Сера. Строение атома, аллотропия, свойства и применение серы
1. Сера. Строение атома, аллотропия, свойства и применение серы.
2. Цель:
Определить положение серы впериодической системе химических
элементов Д.И. Менделеева;
Рассмотреть строение атома серы,
физические и химические свойства,
области применения серы.
3. «В древней магии присутствую при рождении огня, называют серой издавна меня»
4. Сера. Строение атома, аллотропия, свойства и применение серы.
5. Визитка химического элемента.
Химический знак — SПорядковый номер – 16
S
Аr — 32.066
Sulfur
Период — III
32.066
Группа – V I
3s23p4
Подгруппа – главная
Электронная формула атома –
1s22s22p63s23p4
Радиус атома – 0.104 нм.
Электроотрицательность – 2.58
16
2
8
6
ПРИЗНАКИ
СРАВНЕНИЯ
ПОЛОЖЕНИЕ
В ПСХЭ
СТРОЕНИЕ
АТОМА
СТЕПЕНИ
ОКИСЛЕНИЯ
КИСЛОРОД
СЕРА
ПРИЗНАКИ
СРАВНЕНИЯ
КИСЛОРОД
2 период
ПОЛОЖЕНИЕ VI группа
В ПСХЭ
главная (А)
подгруппа
СТРОЕНИЕ
АТОМА
СТЕПЕНИ
ОКИСЛЕНИЯ
СЕРА
3 период
VI группа
главная (А)
подгруппа
О + 8 ) 2) 6
S + 16 )2)8)6
-2, 0
-2, 0, +2, +4, +6
Телур
Te
+52
Поло
ний
Po
+84
2 8 6
))))
4s24p4
2 8 18 6
)))))
2 8 18 18 6
5s25p4
)))))) 6s 6p
2 8 18 32 18 6
2
4
Окислительные свойства
Se
+34
3s23p4
Электроотрицательность
)))
s
Селен
2s22р4
2 6
+16
Сера
))
Неметаллические свойства
О
Радиус атома
Кисло
род
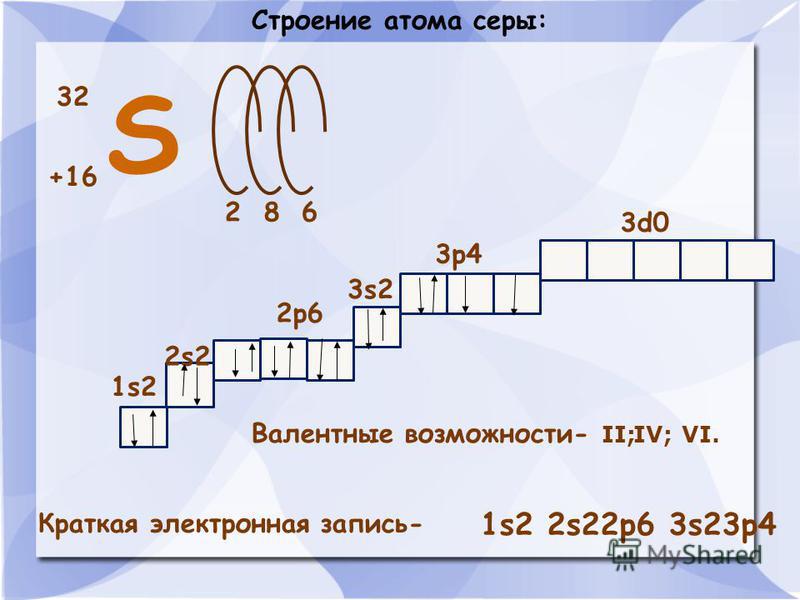
32
+16
2 8 6
1s2
2s2
2p6
3s2
3p4
3d0
Валентные возможности- II (примеры
соединений: SCl2 h3S)
IV (SO2)
VI (SO3)
10.
 Валентные состояния атома серы S Валентность II,
Валентные состояния атома серы S Валентность II,ст. окисления -2
3s
3p
3d
↓
↑
Н2S
Валентность IV,
Ст. окисления +4
Валентность VI,
Ст. окисления +6
SО2
Н2SО4
11. Распространенность серы
Пораспространённости в
земной коре сера
занимает
пятнадцатое место.
Содержание серы в
организме среднего
человека (массой
тела 70 кг.)
составляет 140 г.
Содержание в окружающей среде и в
организме человека ( в % по массе )
12. Нахождение серы в природе.
Сера в природеСамородная
сера -S
Киноварь
HgS
Сульфиды
Пирит –FeS2
Сульфаты
ГипсСаSO4*2h3O
Мирабилит –
Na2SO4*10h3O
Горькая сольMgSO4*7h3O
Халькопирит
CuFeS2
Аллотропные
модификации
серы
Ромбическая
Моноклинная
Пластическая
14. Ромбическая сера
Ромбическая (αсера) — S8, желтогоцвета,
t°пл. = 113°C;
Наиболее
устойчивая
модификация.

15. Физические свойства серы
Твердоекристаллическое
вещество желтого
цвета,
нерастворима в
воде, водой не
смачивается
(порошок серы в
воде не тонет и
плавает на
поверхности воды)
16. Моноклинная сера
Моноклинная (β –сера)- S8, темножелтые иглы,t°пл. =
119°C; устойчивая
при температуре
обычных условиях
превращается в
ромбическую
17. Пластическая сера
Пластическая серакоричневаярезиноподобная
(аморфная) масса.
Она неустойчива и
через некоторое
время становится
хрупкой, приобретёт
желтый цвет, т.е
превращается в
ромбическую серу.
18. Химические свойства серы
S – окислительS + 2е- = S-2
1.Взаимодействие с
металлами
Сu + S = CuS
2Al + 3S = Al2S3
2.Взаимодействие с
водородом
h3 + S = h3S
19. Химические свойства серы.
S – восстановительS – 2e- = S+2
1.
 Взаимодействие
Взаимодействиес кислородом
S + O2= SO2
S — 4e- = S+4
2.Взаимодействие
с галогенами
S+ Cl2= SCl2
S + 3F2= SF6
S — 6e- = S+6
3.Взаимодействие с
кислотами –
окислителями
S+ 2Н2SО4=3SO2+2h3O
Концентрированная.
20. Применение серы
Производство спичекМедицина
Производство резины
Сельское хозяйство
Производство
серной
кислоты
Производство взрывчатых
веществ
Красители
21. ОТВЕТЬТЕ НА ВОПРОСЫ:
Охарактеризуйтеположение серы в
периодической системе
химических элементов
Д.И. Менделеева.
22. Выберите правильный ответ:
Вкаком соединении сера
проявляет степень
окисления +4?
А) h3S
Б) h3SO3
В) h3SO4
23. ОТВЕТЬТЕ НА ВОПРОСЫ:
Вкаком виде сера
находится в природе?
24. ОТВЕТЬТЕ НА ВОПРОСЫ:
Охарактеризуйтефизические свойства
серы.
25. Выберите правильный ответ:
Скаким веществом
реагирует сера образуя
сульфид:
А) водой
Б) водородом
В) натрием
Ответы | 2.
 По приведённому в тексте параграфа плану составьте описание следующих химических элементов: а) сера; б) хлор; в) алюминий; г) натрий. — Химия, 11 класс
По приведённому в тексте параграфа плану составьте описание следующих химических элементов: а) сера; б) хлор; в) алюминий; г) натрий. — Химия, 11 класса) сера
1. Элемент сера имеет химический знак S, атомный номер Z = 16. Сера расположена в третьем периоде, малом, в VI A-группе, главной. Относительная атомная масса Ar(S) = 32.
2. Строение атома:
а) заряд ядра атома серы +16. В состав ядра атома серы входят 16 протонов. Самый распространённый в природе изотоп — это нуклид
б) электронная оболочка атомов серы содержит 16 электронов, которые распределены по трем энергетическим уровням; электронная схема: 16S 2e, 8e, 6e; формула электронной конфигурации: 16S 1s22s22p63s23p4; электронно-графическая схема:
в) конфигурация внешнего электронного слоя: 3s23p4, значит, сера — р-элемент.
3. Степени окисления атомов элемента: высшая +6, так как на внешнем энергетическом уровне атома находится 6 электронов, низшая –2. Электроотрицательность: x(S) = 2.5. megaresheba.ru megareslieba.ru
4. Простое вещество азот является неметаллом, агрегатное состояние при н. у. — твердое, химическая формула S.
5. Формула высшего оксида S +6O3, оксид серы (VI), кислотный; формула гидроксида, соответствующего высшему оксиду, H2S+6O4, гидроксид кислотный, серная кислота; водородное соединение H2S-2, летучее, так как сера является неметаллом.
б) хлор
1. Элемент хлор имеет химический знак Cl, атомный номер Z = 17. Хлор расположен в третьем периоде, малом, в VII A-группе, главной. Относительная атомная масса Ar(Сl) = 35.5.
2. Строение атома:
а) заряд ядра атома хлора +17. В состав ядра атома хлора входят 17 протонов. Самый распространённый в природе изотоп — это нуклид 35Cl. Число нейтронов в ядре этого нуклида равно 35 – 17 = 18.
Число нейтронов в ядре этого нуклида равно 35 – 17 = 18.
б) электронная оболочка атомов содержит 17 электронов, которые распределены по трем энергетическим уровням; электронная схема:
в) конфигурация внешнего электронного слоя: 3s23p5, значит, хлор — р-элемент.
3. Степени окисления атомов элемента: высшая +7, так как на внешнем энергетическом уровне атома находится 7 электронов, низшая –1. Электроотрицательность: х(Сl) = 3.0.
4. Простое вещество хлор является неметаллом, агрегатное состояние при н. у. — газ, химическая формула Cl2.
5. Формула высшего оксида Cl+72O7, оксид серы (VII), кислотный; формула гидроксида, соответствующего высшему оксиду, HCl+7O4, гидроксид кислотный, хлорная кислота; водородное соединение HCl-1, летучее, так как хлор является неметаллом.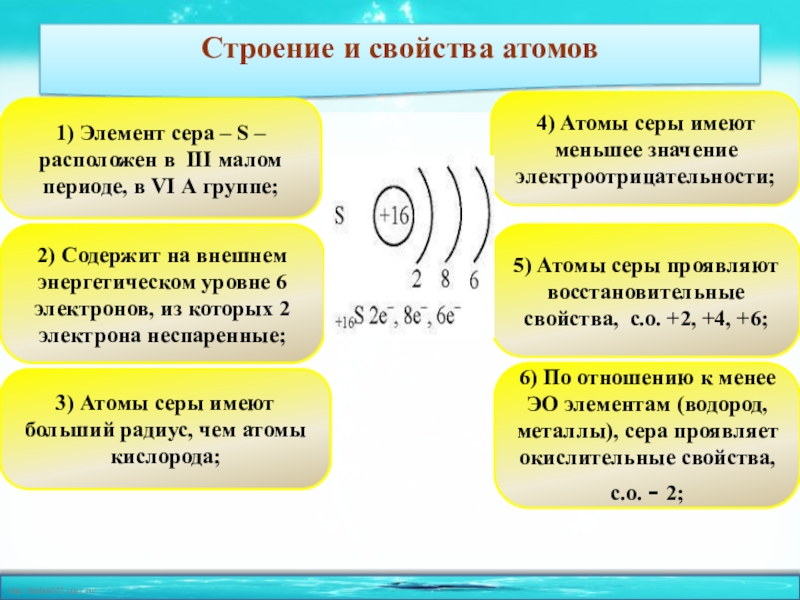
в) алюминий
1. Элемент алюминий имеет химический знак Al, атомный номер Z = 13. Алюминий расположен в третьем периоде, малом, в III A-группе, главной. Относительная атомная масса Ar(Al) = 27.
2. Строение атома:
а) заряд ядра атома алюминия +13. В состав ядра атома входят 13 протонов. Единственный в природе изотоп — это нуклид 27Al. Число нейтронов в ядре этого нуклида равно 27 – 13 = 14.
б) электронная оболочка атомов содержит 13 электронов, которые распределены по трем энергетическим уровням; электронная схема: 13Al 2e, 8e, 3e; формула электронной конфигурации: 13Al 1s22s22p63s23p1; электронно-графическая схема:
в) конфигурация внешнего электронного слоя: 3s23p1, значит, алюминий — р-элемент.
3. Степени окисления атомов элемента: высшая +3, так как на внешнем энергетическом уровне атома находится 3 электронов, низшая 0.
4. Простое вещество алюминий является металлом, агрегатное состояние при н. у. —твердое, химическая формула Al.
5. Формула высшего оксида Al+32O3, оксид алюминия, амфотерный; формула гидроксида, соответствующего высшему оксиду, Al(OH)3, гидроксид алюминия, амфотерный; водородное соединение Al-3H3, нелетучее, так как алюминий является метал.
г) натрий
1. Элемент натрий имеет химический знак Na, атомный номер Z = 11. Натрий расположен в третьем периоде, малом, в I A-группе, главной. Относительная атомная масса Ar(Na) = 23.
2. Строение aтома:
а) заряд ядра атома натрия +11. В состав ядра атома входят 11 протонов. Самый распространённый в природе изотоп — это нуклид 23Na. Число нейтронов в ядре этого нуклида равно 23 – 11 = 12.
б) электронная оболочка атомов содержит 11 электронов, которые распределены по трем энергетическим уровням; электронная схема: 11Na 2e, 8e, 1e; формула электронной конфигурации: 11Na 1s22s22p63s1; электронно-графическая схема:
в) конфигурация внешнего электронного слоя: 3s1, значит, натрий — s-элемент.
3. Степени окисления атомов элемента: высшая +1, так как на внешнем энергетическом уровне атома находится 1 электронов, низшая 0. Электроотрицательность: x(Na) = 0.9.
4. Простое вещество натрий является металлом, агрегатное состояние при н. у. — твердое, химическая формула Na.
5. Формула высшего оксида Na+12O, оксид натрия, основный; формула гидроксида, соответствующего высшему оксиду, NaOH, гидроксид натрия, основный (щелочь), водородное соединение Al
строение атома, аллотропные модификации, физические и химические свойства
I. Посмотрите научно-популярный фильм: “Сера”
Сейчас невозможно установить, когда человек впервые познакомился с серой и её соединениями. Произошло это очень давно. Она помогала нашим предкам получать огонь, вернее, снопы искр при ударе кресалом по обломку пирита.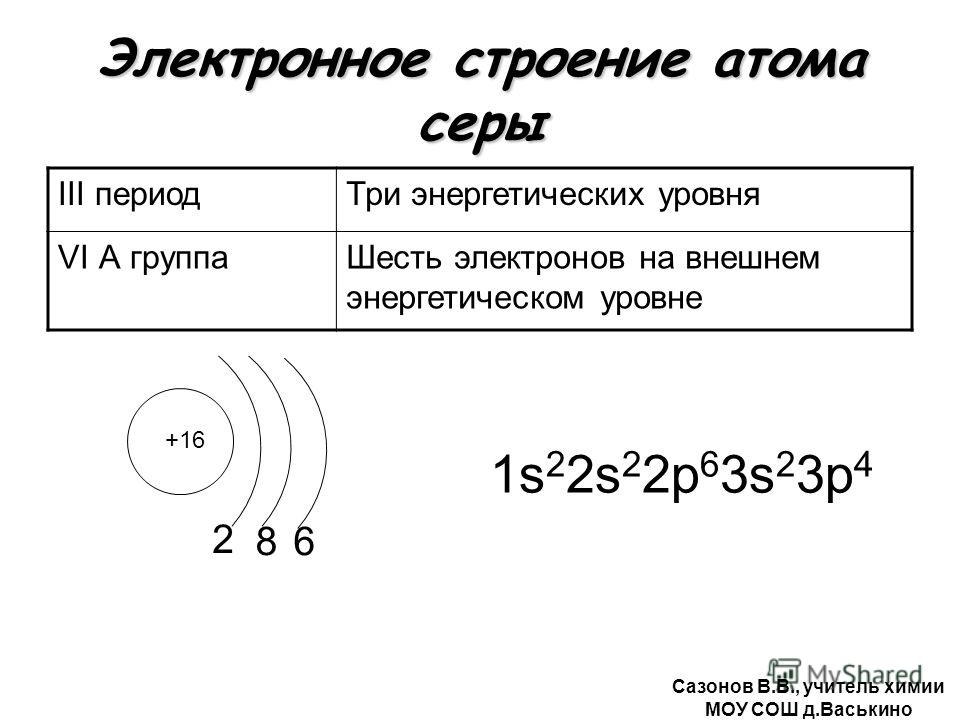 Использовали её для приготовления красок и косметических средств. Знали её и древние индийцы, именно они дали название — «сира» — означает «желтый». Химический символ произошел от латинского слова «сульфур». Древние римляне называли серу «желчью бога Вулкана» (покровителя огня).Картина Карла Брюллова «Гибель Помпеи».
Использовали её для приготовления красок и косметических средств. Знали её и древние индийцы, именно они дали название — «сира» — означает «желтый». Химический символ произошел от латинского слова «сульфур». Древние римляне называли серу «желчью бога Вулкана» (покровителя огня).Картина Карла Брюллова «Гибель Помпеи».
Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников. Около VIII в. китайцы стали использовать её в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что её считали «принципом горючести» и обязательной составной частью металлических руд. Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, ещё в древнем Египте. В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трёх принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси. Впервые в литературе он описан у Агриколы. Таким образом, точное время открытия серы не установлено, но, как сказано выше, этот элемент использовался до нашей эры, а значит, знаком людям с древнейших времён.
Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, ещё в древнем Египте. В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трёх принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси. Впервые в литературе он описан у Агриколы. Таким образом, точное время открытия серы не установлено, но, как сказано выше, этот элемент использовался до нашей эры, а значит, знаком людям с древнейших времён.
II. Положение серы в ПСХЭ, строение атома
В подгруппу кислорода(халькогены) входят элементы: кислород, сера, селен, теллур, полоний.
Химический элемент сера расположен в VIА-группе, 3 периоде ПСХЭ.
На внешнем электронном слое атома серы находится 6 электронов. Относится к р-элементам. Неметалл.
Проявляя свойства окислителя при образовании веществ с металлами и водородом, сера приобретает степень окисления -2 (принимает 2 электрона).
В составе кислородсодержащих соединений сера проявляет степени окисления +4 и +6. Таким образом, для серы характерны степени окисления -2; 0; +4; +6.
|
Размещение электронов по |
Степень |
Валентность |
|
+2, -2 |
В основном состоянии II |
|
|
+4 |
Первое возбуждённое состояние IV |
|
|
+6 |
Второе возбуждённое состояние VI |
III. Сера в природе
Сера в природе
Сера является шестнадцатым по химической распространённости элементом в земной коре. Встречается в свободном (самородном) состоянии и в связанном виде.
Самородная сера:
Украина, Поволжье, Центральная Азия и др.
Важнейшие природные минералы серы:
Кроме того, сера присутствует в нефти, природном угле, природных газах и сланцах.
Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обусловливает «постоянную» жёсткость пресной воды. Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах, ногтях, кожных покровах. При недостатке серы в организме наблюдается хрупкость ногтей и костей, выпадение волос.
Содержание серы в организме человека массой 70 кг — 140 г. В сутки человеку необходимо 1 г серы.
Серой богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго. Соединения серы могут служить лекарственными препаратами.
Соединения серы могут служить лекарственными препаратами.
Тысячелистник обладает повышенной способностью извлекать из почвы серу и стимулировать поглощение этого элемента с соседними растениями.
Чеснок выделяет вещество – альбуцид, едкое соединение серы. Это вещество предотвращает раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
Сульфаты
- CaSO4 x 2H2O — гипс
- MgSO4 x 7H2O – горькая соль (английская)
- Na2SO4 x 10H2O – глауберова соль (мирабилит)
IV. Физические свойства, аллотропия
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип = 445°С
Аллотропия
Для серы характерны несколько аллотропных модификаций:
|
Ромбическая (a — сера) — S8 t°пл. ρ = 2,07 г/см3. Наиболее устойчивая модификация.
|
Моноклинная (b — сера) — S8 темно-желтые иглы, t°пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую. |
Пластическая Sn коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую. |
|
|
|
Опыт: “Получение пластической серы”
|
Взаимопревращение аллотропных модификаций серы
V. Получение серы
В древности и в средние века серу добывали, вкапывая в землю большой глиняный горшок, на который ставили другой, с отверстием в дне. Последний заполняли породой, содержащей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок. В настоящее время серу получают главным образом путём выплавки самородной серы непосредственно в местах её залегания под землёй. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности её самовозгорания.
Последний заполняли породой, содержащей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок. В настоящее время серу получают главным образом путём выплавки самородной серы непосредственно в местах её залегания под землёй. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности её самовозгорания.
1. Промышленный метод — выплавление из руды с помощью водяного пара.
2. Неполное окисление сероводорода (при недостатке кислорода): 2H2S + O2 = 2S + 2H2O
3. Реакция Вакенродера: 2H2S + SO2 = 3S + 2H2O
VI. Химические свойства серы
|
Сера — окислитель S0 + 2ē -> S-2 |
Сера — восстановитель S — 2ē -> S+2; S — 4ē -> S+4; S — 6ē -> S+6 |
|
1) Сера реагирует со щелочными металлами без нагревания: Опыт: “Взаимодействие серы с натрием” 2Na + S -> Na2S c остальными металлами (кроме Au,Pt) — при повышенной t°: 2Al + 3S –t°-> Al2S3 Опыт: “Взаимодействие серы с цинком” Zn + S –t°-> ZnS Опыт: “Взаимодействие меди с серой” Cu + S –t°-> CuS 2) С некоторыми неметаллами сера образует бинарные соединения: H2 + S -> H2S 2P + 3S -> P2S3 C + 2S -> CS2 |
1) С кислородом: S + O2 –t°-> S+4O2 2S + 3O2 –t°;pt-> 2S+6O3 2) С галогенами (кроме йода): S + Cl2 -> S+2Cl2 3) С кислотами — окислителями: S + 2H2SO4(конц) -> 3S+4O2 + 2H2O S + 6HNO3(конц) -> H2S+6O4 + 6NO2 + 2H2O 4) Реакции диспропорционирования: 4) 3S0 + 6KOH -> K2S+4O3 + 2K2S-2 + 3H2O
|
VII.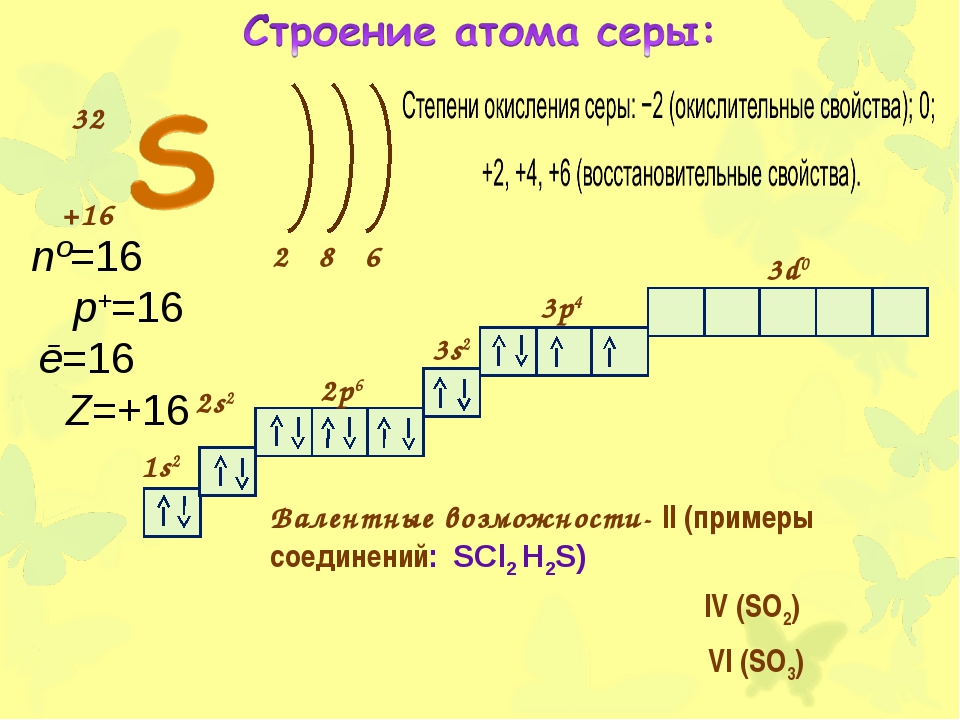 Применение
Применение
Примерно половина производимой серы используется в производстве серной кислоты.
Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Получение эбонита, производство пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний). Сера – основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой. Тиосульфат натрия Na2S2O3 используется для борьбы с нею.
Многие соли серной кислоты содержат кристаллизационную воду: ZnSO4×7H2O и CuSO4×5H2O. Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства.
Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства.
Железный купорос FeSO4×7H2O используют при анемии.
BaSO4 применяют при рентгенографическом исследовании желудка и кишечника.
Алюмокалиевые квасцы KAI(SO4) 2×12H2O — кровоостанавливающее средство при порезах.
Минерал Na2SO4×10H2O носит название «глауберова соль» в честь открывшего его в VIII веке немецкого химика Глаубера И.Р. Глаубер во время своего путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался принимать пищу. Один из местных жителей направил его к источнику. Как только он выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту воду, из нее выкристаллизовалась соль Na2SO4×10H2O. Сейчас ее применяют как слабительное в медицине, при окраске хлопчато- бумажных тканей. Соль также находит применение в производстве стекла.
Соль также находит применение в производстве стекла.
Применение серы и её соединений
VIII. Тренажеры
Тренажёр №1 — Характеристика серы по её положению в периодической системе Д. И. Менделеева
Тренажёр №2 — Химические свойства серы
Тренажёр №3 — Взаимодействие серы с металлами
IX. Задания
№1. Закончите уравнения реакций:
S + O2 =
S + Na =
S + H2 =
Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
№2. Осуществите превращения по схеме:
H2S → S → Al2S3 → Al(OH)3
№3. Закончите уравнения реакций, укажите, какие свойства проявляет сера (окислителя или восстановителя):
Al + S = (при нагревании)
S + H2 = (150-200)
S + O2 = (при нагревании)
S + F2 = (при обычных условиях)
S + H2SO4(к) =
S + KOH =
S + HNO3 =
ЦОРы
Научно-популярный фильм: “Сера”
Видео: Получение пластической серы
Анимацмя: Взаимопревращение аллотропных модификаций серы
Опыт: “Взаимодействие серы с натрием”
Опыт: “Взаимодействие серы с цинком”
Опыт: “Взаимодействие меди с серой”
Применение серы и её соединений
Тема урока «Сера»
Задачи урока:
Образовательные:
- Определить положение серы в Периодической системе Д.
 И.Менделеева.
И.Менделеева. - Познакомить учащихся с нахождением серы в природе
- Рассмотреть строение атома серы.
- Дать характеристику физическим свойствам серы.
- Дать характеристику химическим свойствам серы.
- Познакомить с областями применения серы.
Развивающие:
- Продолжить формирование умений учащихся на основании положения элементов в Периодической системе, определять строение атомов.
- Продолжить формирование умений учащихся на основании электронного строения атомов предполагать химические свойства элементов и оценивать возможность изменения этих свойств.
- Продолжить формирование умений учащихся составлять уравнения окислительно-восстановительных реакций.
Воспитывающие:
- Продолжить формирование у учащихся навыков логического мышления, умений делать выводы, обобщать и сравнивать.

Оборудование:
- Периодическая система химических элементов Д.И.Менделеева,
- Учебник «Химия – 9» И.И Новошинский, Н.С. Новошинская
- компьютер,
- проектор,
- электронная презентация урока Power Point «Сера» (Презентация)
Тип урока: изучение нового учебного материала.
Ход урокаI. Организационный моментТема урока на слайде 1.
II. Вводная часть:Рассмотрев на прошлом уроке общую характеристику элементов VI группы главной подгруппы, мы переходим к подробному изучению серы. (Слайд № 2).
III. Основная часть урока.1. Нахождение в природе.
В природе сера встречается как в свободном (самородном) состоянии, так и в составе соединений. (Слайды № 3,4,5,6).
(Слайды № 3,4,5,6).
2. Физические свойства серы. (Слайды № 7,8,9).
Знакомимся с физическими свойствами серы, её аллотропными модификациями.
(Демонстрационный опыт – физические свойства серы)
3. Положение в Периодической системе и строение атома. (Слайд № 10).
Охарактеризуйте положение серы в периодической системе химических элементов.
Сера находятся в VI группе главной подгруппе и 3 периоде Периодической системы химических элементов.
4. Строение атома
Как определить заряд ядра атома и количество энергетических уровней?
Как определить число электронов на внешнем энергетическом уровне?
Как записать электронную формулу внешнего энергетического уровня атома серы?
5. Строение – свойства. (Слайды № 11,12,13).
Рассматриваем заполнение энергетических уровней атома серы, определяем валентные возможности атома, вероятные степени окисления и примеры веществ с данными степенями окисления.
Проводим сравнение окислительно-восстановительных возможностей серы, определив высшую, низшую и промежуточные степени окисления (Слайд № 14).
6. Химические свойства серы.
Рассматриваем химические свойства серы как окислителя. (Слайд № 15, 16, 17).
- Взаимодействие с металлами
- Взаимодействие с неметаллами (водородом, углеродом, фосфором)
Определяем химические возможности серы как восстановителя. (Слайд № 18).
- Взаимодействие с кислородом, фтором, хлором.
6. Получение серы.
Рассмотрим основные способы получения серы.
- Выплавление из руды с помощью водяного пара (Слайд № 19).
- Неполное окисление сероводорода (Слайд № 20).
В уравнении реакции неполного окисления сероводорода необходимо расставить коэффициенты методом электронного баланса (проверка по слайду).
7. Применение серы. (Слайд № 21).
Рассказ о применении серы в промышленности и быту.
IV. Заключение: (Слайд № 25).Каково положение серы в периодической системе Д.И. Менделеева?
Что такое «аллотропия»?
Какие степени окисления возможны у атома серы?
В чём проявляется окислительно-восстановительная двойственность серы?
V. Домашнее задание:- Учебник «Химия-9» И.И Новошинский, Н.С. Новошинская
§ 22, стр. 104, № 1 – 3. (Слайд № 26).
Сера — урок. Химия, 8–9 класс.
Химический элемент
Сера — химический элемент № \(16\). Она расположена в VIА группе третьем периоде Периодической системы.
S16+16)2e)8e)6e
На внешнем слое атома серы содержатся шесть валентных электронов.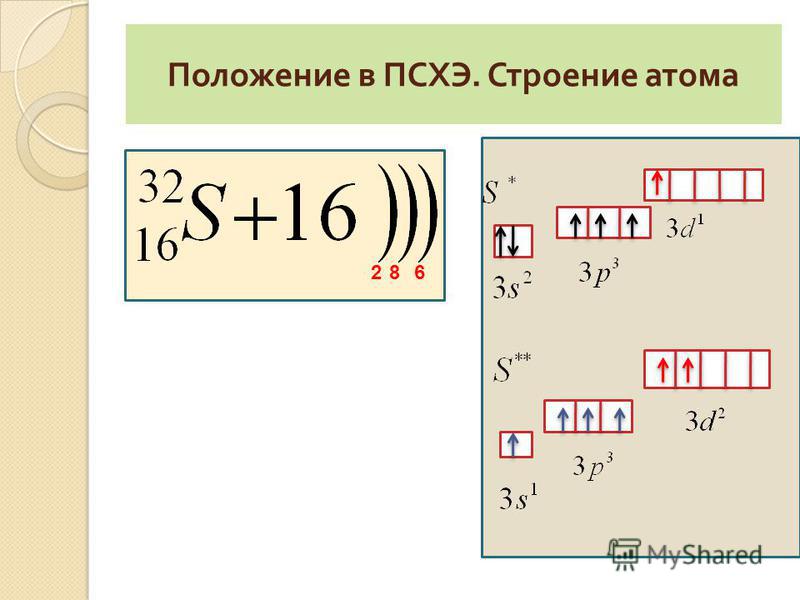 До завершения внешнего слоя не хватает двух электронов. Поэтому в соединениях с металлами и водородом сера проявляет степень окисления \(–2\). При взаимодействии с более электроотрицательными элементами (кислородом, галогенами) сера образует соединения, в которых её степень окисления положительная (\(+4\) или \(+6\)).
До завершения внешнего слоя не хватает двух электронов. Поэтому в соединениях с металлами и водородом сера проявляет степень окисления \(–2\). При взаимодействии с более электроотрицательными элементами (кислородом, галогенами) сера образует соединения, в которых её степень окисления положительная (\(+4\) или \(+6\)).
В земной коре сера встречается в самородном виде или в виде минералов и горных пород: (пирит — FeS2, цинковая обманка — ZnS, свинцовый блеск — PbS, гипс — CaSO4⋅2h3O, глауберова соль — Na2SO4⋅10h3O).
Рис. \(1\). Самородная сера | Рис. \(2\). Пирит |
Сера относится к макроэлементам живых организмов. Она содержится в белках. Больше всего серы в белках, которые образуют шерсть, волосы, рога. Входит она также в состав некоторых витаминов и гормонов.
Простое вещество
Сера образует несколько аллотропных модификаций. Обычно мы имеем дело с кристаллической серой, которая состоит из восьмиатомных циклических молекул.
Обычно мы имеем дело с кристаллической серой, которая состоит из восьмиатомных циклических молекул.
Рис. \(3\). Модель молекулы серы
Молекулы образуют кристаллы разного строения, и поэтому существуют аллотропные видоизменения: ромбическая и моноклинная сера. Обе модификации представляют собой жёлтые легкоплавкие вещества. Температуры плавления их несколько различаются (\(+112,8\) °С и \(+119,3\) °С).
Рис. \(4\). Сера
При нагревании сера плавится, превращается в лёгкую жидкость, а затем начинает темнеть и становится вязкой. Образуется пластическая сера, состоящая из длинных линейных молекул.
В воде сера не растворяется и ею не смачивается. Поэтому порошок серы не тонет в воде, несмотря на более высокую плотность (\(2,07\) г/см³). Такое явление называется флотацией.
Такое явление называется флотацией.
Подожжённая сера реагирует с кислородом, и образуется сернистый газ. Сера в этой реакции — восстановитель.
S0+O20=tS+4O2−2.
Окислительные свойства сера проявляет в реакциях с металлами и водородом.
С активными металлами и ртутью реагирует при комнатной температуре:
Hg0+S0=Hg+2S−2.
При нагревании сера вступает в реакцию с большинством металлов — железом, алюминием, цинком и другими, кроме золота и платины.
2Al0+3S0=tAl+32S−23.
В реакциях с металлами образуются сульфиды.
При повышенной температуре сера реагирует с водородом. Образуется сероводород:
h30+S0=th3+1S−2.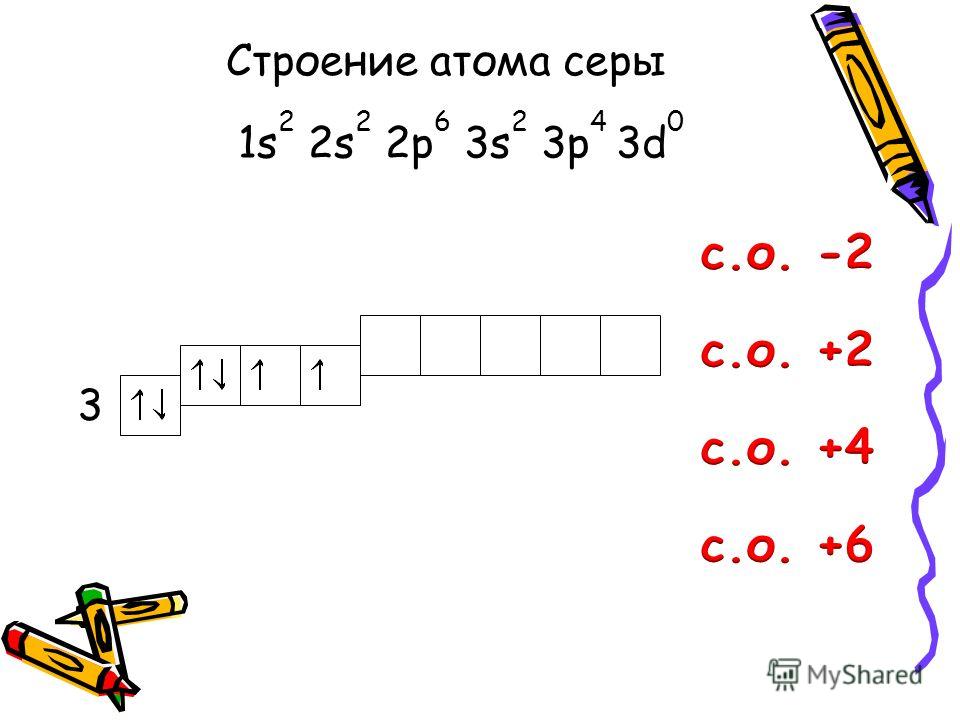
Применение серы
- Используется в химической промышленности для производства серной кислоты;
- находит применение в сельском хозяйстве для обеззараживания помещений;
- входит в состав некоторых мазей;
- используется в производстве спичек и бумаги;
- с её помощью каучук превращают в резину;
- входит в состав взрывчатых веществ.
Источники:
Рис. 1. Самородная сера https://image.shutterstock.com/image-photo/raw-sulphur-sulfur-ore-cutout-600w-1646293537.jpg
Рис. 2. Пирит https://www.shutterstock.com/ru/image-photo/pyrite-mineral-sulfide-group-1734246830
Рис. 3. Модель молекулы серы © ЯКласс
Рис. 4. Сера https://upload.wikimedia.org/wikipedia/commons/thumb/4/44/Sulfur-sample.jpg/1280px-Sulfur-sample.jpg
В основном состоянии | Первое возбуждённое состояние | + 6 | Второе возбуждённое состояние |
Ромбическая (a — сера) — S 8 t° пл. = 113°C; ρ = 2,07 г/см 3 . Наиболее устойчивая модификация. | Моноклинная (b — сера) — S 8 темно-желтые иглы, t° пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую. | Пластическая коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую. |
V. Получение серы
В древности и в средние века серу добывали, вкапывая в землю большой глиняный горшок, на который ставили другой, с отверстием в дне. Последний заполняли породой, содержащей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок. В настоящее время серу получают главным образом путём выплавки самородной серы непосредственно в местах её залегания под землёй. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности её самовозгорания.
Последний заполняли породой, содержащей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок. В настоящее время серу получают главным образом путём выплавки самородной серы непосредственно в местах её залегания под землёй. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности её самовозгорания.
1. Промышленный метод — выплавление из руды с помощью водяного пара.
2. Неполное окисление сероводорода (при недостатке кислорода): 2H 2 S + O 2 = 2S + 2H 2 O
3. Реакция Вакенродера: 2H 2 S + SO 2 = 3S + 2H 2 O
VI. Химические свойства серы
VII. Применение
Примерно половина производимой серы используется в производстве серной кислоты .
Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Получение эбонита, производство пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний). Сера – основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой. Тиосульфат натрия Na 2 S 2 O 3 используется для борьбы с нею.
Многие соли серной кислоты содержат кристаллизационную воду: ZnSO 4 ×7H 2 O и CuSO 4 ×5H 2 O. Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства.
Железный купорос FeSO 4 ×7H 2 O используют при анемии.
BaSO 4 применяют при рентгенографическом исследовании желудка и кишечника.
Алюмокалиевые квасцы KAI(SO 4) 2 ×12H 2 O — кровоостанавливающее средство при порезах.
Минерал Na 2 SO 4 ×10H 2 O носит название «глауберова соль» в честь открывшего его в VIII веке немецкого химика Глаубера И.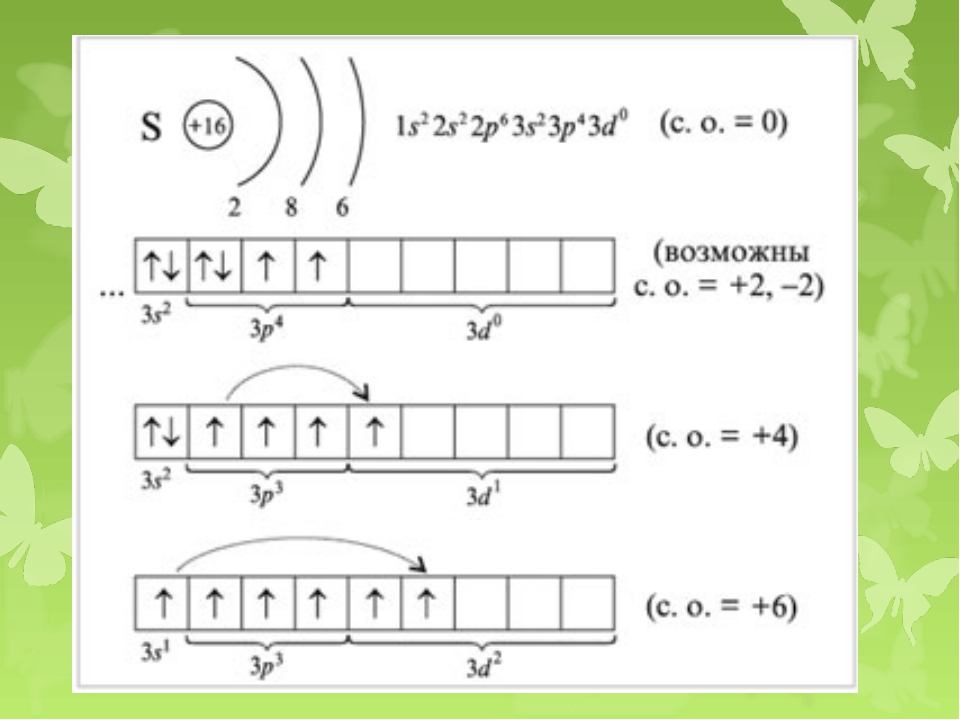 Р. Глаубер во время своего путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался принимать пищу. Один из местных жителей направил его к источнику. Как только он выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту воду, из нее выкристаллизовалась соль Na 2 SO 4 ×10H 2 O. Сейчас ее применяют как слабительное в медицине, при окраске хлопчато- бумажных тканей. Соль также находит применение в производстве стекла.
Р. Глаубер во время своего путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался принимать пищу. Один из местных жителей направил его к источнику. Как только он выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту воду, из нее выкристаллизовалась соль Na 2 SO 4 ×10H 2 O. Сейчас ее применяют как слабительное в медицине, при окраске хлопчато- бумажных тканей. Соль также находит применение в производстве стекла.
VIII. Тренажеры
IX. Задания
№1. Закончите уравнения реакций:
S + O 2 =
S + Na =
S + H 2 =
Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
№2. Осуществите превращения по схеме:
H 2 S → S → Al 2 S 3 → Al(OH) 3
№3. Закончите уравнения реакций, укажите, какие свойства проявляет сера (окислителя или восстановителя).
Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts. google.com
google.com
Подписи к слайдам:
СЕРА. Строение атома, аллотропия, свойства и применение серы Выполнила учитель МОУ «Средняя общеобразовательная школа № 17» Малишевская Светлана Валентиновна
Какие элементы входят в состав VI-А подгруппы, особенности строения атомов? O, S, Se , Te , Po 8 O 1 s 2 2 s 2 2 p 4 16 S ….. 3 s 2 3 p 4 34 Se …. 4 s 2 4 p 4 52 Te …. 5 s 2 5 p 4 84 Po ….. 6 s 2 6 p 4 Что общего и в чем различие в строении атомов элементов VI-А подгруппы? Общее: количество электронов на внешнем энергетическом уровне. Различие: число энергетических уровней.
Каким образом изменяются свойства элементов в группе сверху вниз? Объясните причины
Когда и кем открыт был кислород?
Назовите основные физические свойства кислорода
Назовите основные химические свойства кислорода
Какие аллотропные модификации кислорода вам известны,отличие?
Валентные возможности атома серы
Самородная сера
Сульфидная сера PbS — свинцовый блеск Fe S- медный блеск
Сульфидная сера ZnS — цинковая обманка HgS — киноварь
Сульфатная сера Гипс(CaSO 4 * 2H 2 O) Горькая соль(MgSO 4 * 7H 2 O)
Получение серы 1. Промышленный метод — выплавление из руды с помощью водяного пара. 2. Неполное окисление сероводорода (при недостатке кислорода). 2 H 2 S + O 2 = 2 S + 2 H 2 O 3. Реакция Вакенродера 2 H 2 S + SO 2 = 3 S + 2 H 2 O
Промышленный метод — выплавление из руды с помощью водяного пара. 2. Неполное окисление сероводорода (при недостатке кислорода). 2 H 2 S + O 2 = 2 S + 2 H 2 O 3. Реакция Вакенродера 2 H 2 S + SO 2 = 3 S + 2 H 2 O
Химические свойства серы 1) Взаимодействие серы с простыми веществами: А) с металлами, образуя сульфиды. — Запишите уравнение реакции, составьте уравнение электронного баланса. 2 Na + S -> Na 2 S c остальными металлами (кроме Au , Pt) — при повышенной t °: 2Al + 3S – t° -> Al 2 S 3 Zn + S – t°-> ZnS Cu + S – t °-> CuS
Химические свойства серы Б) Взаимодействие серы с неметаллами. Например: Взаимодействие серы и водорода. H 2 + S -> H 2 S 2 P + 3 S -> P 2 S 3 C + 2 S -> CS 2 В) Взаимодействие серы и кислорода. S + O 2 – t° -> S +4 O 2 2S + 3O 2 – t°;pt -> 2S +6 O 3
По теме: методические разработки, презентации и конспекты
Тема урока: «Фосфор. Строение атома, аллотропия, свойства и применение фосфора».
Цель урока:Определить положение фосфора в периодической системе химических элементов Д. И. Менделеева, рассмотреть строение атома фосфора, физические и химические свойства, области применения фосфора.Т…
И. Менделеева, рассмотреть строение атома фосфора, физические и химические свойства, области применения фосфора.Т…
Сера — одно из немногих веществ, которыми уже несколько тысяч лет назад оперировали первые «химики». Она стала служить человечеству задолго до того, как заняла в таблице Менделеева клетку под №16. Вещества, содержащие серу, могут быть как полезны для человека, так и вредны.
Сера встречается в природе в свободном (самородном) состоянии, поэтому она была известна человеку уже в глубокой древности. Сера привлекала внимание характерной окраской, голубым цветом пламени и специфическим запахом, возникающим при горении (запах сернистого газа). Считалось, что горящая сера отгоняет нечистую силу. В Библии говорится об использовании серы для очищения грешников. У человека средневековья запах «серы» ассоциировался с преисподней. Применение горящей серы для дезинфекции упоминается Гомером. В Древнем Риме с помощью сернистого газа отбеливали ткани. Издавна использовалась сера в медицине — ее пламенем окуривали больных, ее включали в состав различных мазей для лечения кожных заболеваний. В 11 в. Авиценна (Ибн Сина), а затем и европейские алхимики, полагали, что металлы, в том числе золото и серебро, состоят из находящихся в различных соотношениях серы и ртути. Поэтому сера играла важную роль в попытках алхимиков найти «философский камень» и превратить недрагоценные металлы в драгоценные.
В 11 в. Авиценна (Ибн Сина), а затем и европейские алхимики, полагали, что металлы, в том числе золото и серебро, состоят из находящихся в различных соотношениях серы и ртути. Поэтому сера играла важную роль в попытках алхимиков найти «философский камень» и превратить недрагоценные металлы в драгоценные.
Данный элемент обладает сравнительно низкой атомной массой, она равняется тридцати двум граммам на моль. Характеристика элемента сера включает в себя такую особенность данного вещества, как способность обладать разной степенью окисления. То есть, она может проявлять и окислительные, и восстановительные свойства.
Находится в главной подгруппе шестой группы. Так как порядковый номер серы в таблице Менделеева — шестнадцать, то можно сделать вывод, что в ее ядре находится именно такое количество протонов. Исходя из этого, можно сказать, что и электронов, вращающихся вокруг, тоже шестнадцать. Количество же нейтронов можно узнать, отняв от молярной массы порядковый номер химического элемента: 32 — 16 = 16.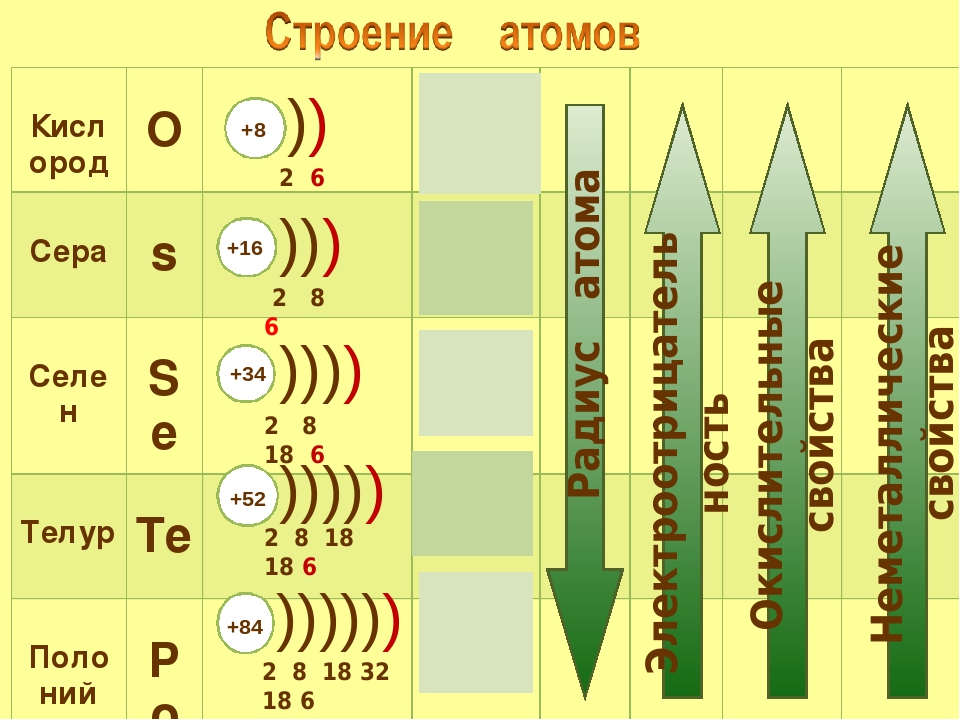 Каждый электрон вращается не хаотично, а по определенной орбите. Так как сера — химический элемент, который относится к третьему периоду таблицы Менделеева, то и орбит вокруг ядра три. На первой из них расположено два электрона, на второй — восемь, на третьей — шесть. Электронная формула атома серы записывается следующим образом: 1s 2 2s 2 2p 6 3s 2 3p 4 .
Каждый электрон вращается не хаотично, а по определенной орбите. Так как сера — химический элемент, который относится к третьему периоду таблицы Менделеева, то и орбит вокруг ядра три. На первой из них расположено два электрона, на второй — восемь, на третьей — шесть. Электронная формула атома серы записывается следующим образом: 1s 2 2s 2 2p 6 3s 2 3p 4 .
Как уже говорилось, сера может проявлять разные степени окисления. Это связано с строением ее атома. Атом серы может принять два электрона и будет иметь заряд -2. Сера может также отдать два электрона и тогда она примет степень окисления +2. Для того чтобы сера имела степень окисления +4 или +6, нужно задействовать d-орбиталь, на которую перейдут электроны. Сера имеет валентности II, IV, VI. Валентности IV соответствует степень окисления +4, валентности VI — +6. При валентности IV перейдет один электрон с p-орбитали на d-орбиталь, при валентности VI — один с p-орбитали и один с s-орбитали на d-орбиталь.
Цель урока. Формирование мышления учащихся
через активизацию представлений о взаимосвязи
строения веществ с их свойствами; обобщение и
систематизация знаний по теме «Соединения серы».
Формирование мышления учащихся
через активизацию представлений о взаимосвязи
строения веществ с их свойствами; обобщение и
систематизация знаний по теме «Соединения серы».
Задачи. Образовательные: повторить строение атома серы, строение молекул, особенности физических и химических свойств важнейших соединений серы; показать учащимся генетическую связь между соединениями серы; рассмотреть экологические проблемы, связанные с переработкой соединений серы.
Воспитательные: продолжить формирование научного мировоззрения учащихся, а также мировоззренческих идей о материальности мира, причинно-следственных связях явлений; воспитание культуры общения.
Развивающие : развитие познавательного интереса школьников, совершенствование умений анализировать и сравнивать, участвовать в проблемном диалоге.
Тип урока. Повторительно-обобщающий.
Методы и методические приемы. Фронтальный
опрос, беседа, дидактические игры,
самостоятельная работа учащихся со
схемами-конспектами, демонстрация средств
наглядности, лабораторный эксперимент.
Оборудование и реактивы. Схема «Семейный портрет серы» (генетическая связь соединений серы), заготовки для дидактических игр «Волшебный цветок» и «Химический поезд», «сульфурики» (дополнительный балл за правильный ответ – символ химического знака «S»), раздаточный материал для учащихся (схема-конспект), электронная презентация урока; шаростержневые модели молекул серы разных аллотропных модификаций;
н а д е м о н с т р а ц и о н н о м с т о л е – образцы серы, штатив с пробирками, растворы разбавленной серной кислоты, хлорида бария, сульфата натрия;
н а с т о л а х у ч а щ и х с я – штатив с пробирками, растворы разбавленной серной кислоты, хлорида бария, сульфата натрия.
ХОД УРОКА
Организационный момент
Вступительное слово учителя , в котором сообщаются цель и план урока, подчеркивается значение материала изученной темы.
Повторение и обобщение изученного материала
Рефлексия учащихся на начальном этапе урока
Учитель. Прошу вас, уважаемые ребята, в
схемах-конспектах отметить свое настроение на
данном этапе урока (рис. 1).
Прошу вас, уважаемые ребята, в
схемах-конспектах отметить свое настроение на
данном этапе урока (рис. 1).
Учитель объясняет условия получения «сульфурика» и правила пользования им («сульфурик» дает право на дополнительный балл при дальнейшем изучении предмета).
Знакомство с семейным портретом серы
На доске – схема «Семейный портрет серы» (рис. 2). Все формулы на портрете закрыты.
Учитель. Сегодня на уроке мы должны назвать ближайших родственников серы. Вспомнить, каковы их имена (т.е. названия веществ), каковы особенности их характера, чем они полезны и где могут быть использованы. Перед вами схема «Семейный портрет серы». По ходу урока мы будем вспоминать соединения серы и к концу урока откроем все имена персонажей фотографии.
Сера
Учитель (рассказ сопровождает показом слайдов). Итак, глава семейства – королева сера.
Сера – это одно из первых веществ, о которых
знало человечество, «начало начал» древнейших
философов и алхимиков; элемент, окутанный
мистикой и тайнами… В древности люди наделяли
серу таинственными сверхъестественными
свойствами. Встречаясь в виде серных жил в
кратерах вулканов, сера издавна считалась
продуктом деятельности подземного бога Вулкана.
Встречаясь в виде серных жил в
кратерах вулканов, сера издавна считалась
продуктом деятельности подземного бога Вулкана.
Сегодня человек достаточно хорошо изучил свойства серы. Давайте же вспомним, каково строение атома серы?
На доске и в схемах-конспектах урока необходимо внести данные по составу атома серы: заряд ядра; число протонов, электронов, нейтронов; распределение электронов по уровням и подуровням (рис. 3).
Рис. 3. Строение атома серы |
Учитель. Назовите значение минимальной степени окисления серы. Какие свойства с точки зрения окислительно-восстановительных процессов будут проявлять соединения с таким значением степени окисления серы? Почему? (Ответы учащихся.)
Назовите значение максимальной степени
окисления серы. Приведите формулы соединений с
максимальным значением степени окисления серы. Какие свойства характерны для них? (Ответы
учащихся.)
Какие свойства характерны для них? (Ответы
учащихся.)
Выполним задание «Волшебный цветок». Запишите формулы веществ, изображенных на лепестках цветка (рис. 4), в соответствующие графы таблицы.
Таблица
Учащиеся выполняют задание.
Учитель. Вы знаете, что одна из причин многообразия химических веществ – это явление аллотропии . Что называется аллотропией? Какие аллотропные модификации серы вам известны? (Слайд 1.) (Ответы учащихся.)
Сероводород, сероводородная кислота и ее соли
Учитель. В одном из стихотворений А.С.Пушкина есть такие строки:
«… Тогда услышал я (о, диво) запах
скверный,
Как будто тухлое разбилося яйцо».
О каком веществе идет речь? (Слайд 2.) (Учитель открывает на схеме «Семейный портрет серы» формулу сероводорода.)
Сероводород не только скверно пахнет, он еще и
ядовит. Но если сероводород использовать
разумно, то можно от него получить пользу.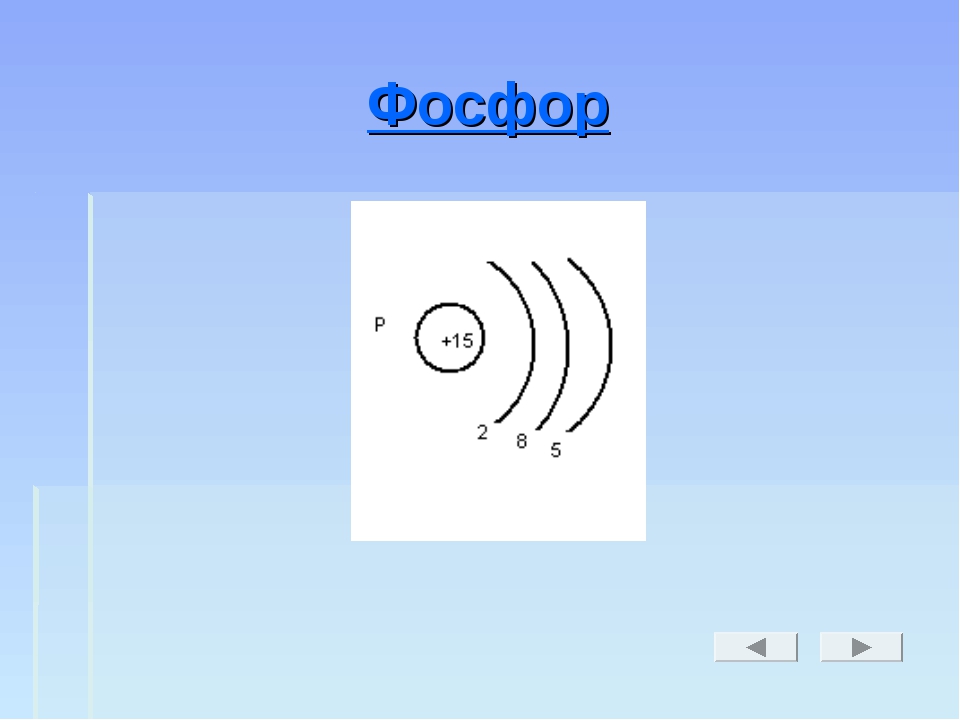 Каково
положительное значение сероводорода? (Ответы
учащихся.)
Каково
положительное значение сероводорода? (Ответы
учащихся.)
Знаете ли вы, что сероводород является реактивом на ионы серебра?
H 2 S + 2Ag + = Ag 2 S + 2H + .
Почему ювелирные изделия из серебра слегка чернеют на воздухе? Подтвердите свой ответ уравнением реакции.
Учащиеся работают у доски и на местах в схемах-конспектах.
Учитель. Как называется водный раствор сероводорода? Какова основность сероводородной кислоты? Какие два ряда солей образует сероводородная кислота? (Слайд 3.)
Назовите формулы гидросульфида калия, сульфида алюминия. (Учитель открывает на схеме формулы НS – и S 2– .)
В молекуле сероводорода сера находится в минимальной степени окисления. Приведите примеры реакций, доказывающих восстановительные свойства сероводорода.
Составьте уравнение
реакции взаимодействия сероводорода с избытком
кислорода. Расставьте коэффициенты методом
электронного баланса.:format(png):watermark(759b8b91892f470.s2.siteapi.org/watermark/6bzb54iyph0cskco0w8s4kkogso4ok,-1,-1,0,15,none)/759b8b91892f470.s2.siteapi.org/img/8uj9r2xojkkcow88c00koggg0kccws)
Оксид серы(IV)
Учитель. При горении сероводорода в избытке кислорода образуется оксид серы(IV) – еще один родственник серы (открывает на схеме-портрете SO 2). Перечислите области применения этого вещества. (Слайд 4.)
Каков характер этого оксида? Назовите классы соединений, с которыми взаимодействует сернистый газ. (Ответы учащихся.)
Известно, что вода есть в воздухе всегда.
И, к сожаленью, дальше что бывает?
С оксидом серы реагирует вода,
На землю дождь кислотный выпадает.
Составьте уравнение реакции взаимодействия оксида серы(IV) с водой и расскажите, в чем проявляется отрицательное действие кислотных дождей.
Работа учащихся у доски и на местах в схемах-конспектах.
Сернистая кислота и ее соли
Учитель. Какое вещество образуется в
результате процесса взаимодействия сернистого
газа с водой? (Слайд 5.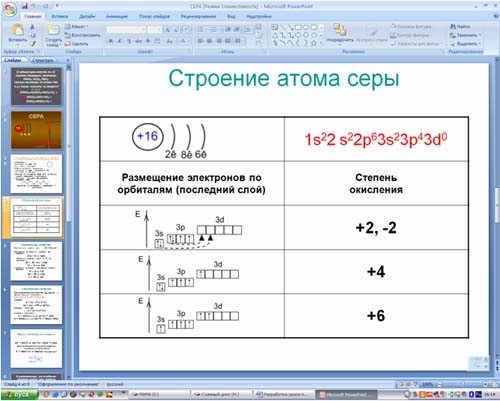 ) Итак, открываем формулу
очередного члена семьи серы H 2 SO 3 .
) Итак, открываем формулу
очередного члена семьи серы H 2 SO 3 .
Для сернистой кислоты также характерны два ряда солей. Назовите их и запишите названия. (Слайд 6.) (Открывает на схеме-портрете HSO 3 – и .)
Оксид серы(VI)
Учитель. Сера образует несколько оксидов. Сернистый газ мы вспомнили. Какой еще оксид серы вам известен? (Открывает на схеме-портрете SO 3 .)
Каков характер этого оксида? Опишите физические свойства оксида серы(VI). С какими классами веществ вступает в реакцию оксид серы(VI)? (Ответы учащихся.)
Серная кислота и ее соли
Учитель. Назовите кислоту, соответствующую оксиду серы(VI). (Открывает на схеме-портрете H 2 SO 4 .) Перечислите некоторые свойства серной кислоты. (Слайд 7.)
Хочу вам напомнить, что,
Если в кислоту попадает вода,
То может случиться большая беда,
Вы не должны забывать,
Что кислоту надо в воду вливать.
Пострадает тот, кто сделает наоборот.
Объясните, почему кислоту льют в воду, а не наоборот? (Ответы учащихся.)
Серная кислота является многотоннажным продуктом. Области ее применения очень широки. Перечислите их. (Слайд 8, см. с. 34. )
Серную кислоту можно получать различными способами. В промышленности широко используется контактный способ производства серной кислоты. Предлагаю немного поиграть.
Игра «Химический поезд». Перед вами вагонное депо (рис. 5, см. с. 34.). Вагоны здесь необычные. Вместо номеров они обозначены формулами веществ.
Прошу вас прицепить вагоны к паровозу таким образом, чтобы последовательность формул на вагонах соответствовала стадиям производства серной кислоты контактным способом.
Учащиеся выполняют задание на местах в схемах-конспектах и у доски.
Учитель. Каковы экологические проблемы, связанные с производством и применением серной кислоты? Как вы считаете, справедливы ли строки, в которых серная кислота заявляет о себе:
Я растворю любой металл,
Меня алхимик получал
В реторте, глиняной, простой,
Слыву я главной кислотой.
(Обсуждение особенностей свойств концентрированной серной кислоты по отношению к металлам. Подведение учащихся к выводу о том, что окислительные свойства концентрированной серной кислоты обусловлены атомом серы, находящимся в максимальной степени окисления.)
Составьте уравнение реакции взаимодействия концентрированной серной кислоты с медью. Расставьте коэффициенты методом электронного баланса.
Учащиеся работают у доски и на местах в схемах-конспектах.
Учитель. Какие соли образует серная кислота? (Открывает на схеме, см. с. 34. и.) Проведем небольшую практическую работу. Пользуясь выданными вам реактивами, экспериментальным путем докажите, что в растворе серной кислоты (1-й в а р и а н т) и в растворе сульфата натрия (2-й в а р и а н т) содержатся сульфат-ионы.
Составьте уравнения реакции в молекулярном, полном и сокращенном ионном видах.
Учащиеся выполняют эксперимент, пишут
уравнения реакций на доске и в схемах-конспектах.
Учитель. Каковы признаки проведенного процесса? Сравните полученные результаты первого и второго вариантов. Есть ли различия? Почему? (Ответы учащихся.)
Учитель. Итак, имена всех членов семьи серы открыты нами на фотографии (см. рис. 2). Вы видите, что между отдельными формулами соединений серы проведены стрелки. Что они означают?
Учитель подводит учащихся к выводу о генетической взаимосвязи между соединениями серы.
Рефлексия учащихся на заключительном этапе урока
Учитель. Прошу вас, уважаемые ребята, в раздаточном материале отметить свое настроение на данном этапе урока (см. рис. 1).
Подведение итогов урока
Л и т е р а т у р а
Аликберова Л.Ю. Занимательная химия. М.:
АСТ-Пресс, 1999; Таубе П.Р., Руденко Е.И. От
водорода до … нобелия? М.: Высшая школа, 1964; Бобров
Л.А. и др. Путешествие в страну элементов. М.:
Молодая гвардия, 1963; Компакт-диск «1С:
Образовательная коллекция. Общая и
неорганическая химия». МарГТУ, 2003; Компакт-диск
«Электронные уроки и тесты. Химия в школе». YDP
Interactive Publishing, 2005.
Общая и
неорганическая химия». МарГТУ, 2003; Компакт-диск
«Электронные уроки и тесты. Химия в школе». YDP
Interactive Publishing, 2005.
Сера, ее физические и химические свойства. – УчМет
учитель химии высшей категории
Овчинникова С.М.
МОУ Обшаровская СОШ № 2
Цель урока: Дать общую характеристику халькогенов. Охарактеризовать серу в свете трех форм существования этого химического элемента: в форме атомов, простых веществ, а следовательно, и аллотропию ее, а также в форме некоторых соединений серы.
Сегодня на уроке мы должны:
Повторить и закрепить положение элементов, строение их атомов на основании их положения в Периодической Системе Д.И. Менделеева.
Познакомиться с месторождениями и соединениями серы. Более полно изучить физические и химические свойства её.
Закрепить навыки окислительно-восстановительных процессов и совершенствовать свои знания в умении делать выводы.
 Т.е. вы
будете думать, решать, обобщать, поэтому
пытайтесь, осмеливайтесь делать то,
чего ещё никто не пытался делать до
вас.
Т.е. вы
будете думать, решать, обобщать, поэтому
пытайтесь, осмеливайтесь делать то,
чего ещё никто не пытался делать до
вас.
А для этого мы с вами немного повторим.
Назовите мне, пожалуйста, современную формулировку Периодического закона.
А каков же физический смысл закона?
Как изменяются неметаллические свойства в главных подгруппах сверху вниз?
Слайд 1. Периодическая система Д.И.М.
Итак, VI группа, главная подгруппа. Давайте дадим характеристику и сравним строения атомов этих элементов на основании положения в Периодической системе Д.И. Менделеева.
Что общего можно выделить в строении атома этих элементов?
Как вы догадались, сегодняшний урок посвящен одному из самых интересных химических элементов, соединения которого известны с глубокой древности.
В
средние века считалось, что это
обязательная составная часть всех
веществ.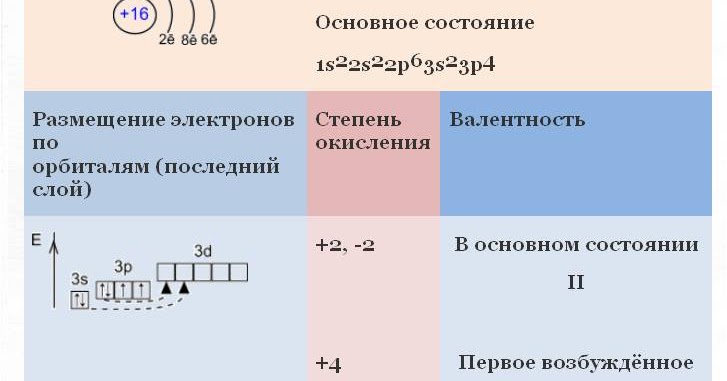
В жизни современного человека, соединения этого элемента играют заметную роль, что нашло отражение в художественной литературе.
Тема нашего урока «Сера и ее свойства»
Слайд №2. Сера и ее свойства.
Свойства серы можно прогнозировать по положению химического элемента.
Слайд №3. Сера в П.С.
Мы выяснили, сера в П.С., находясь в одной подгруппе с О имеет сходное с ним строение внешнего электронного слоя.
Попытаемся узнать, какова же внутренняя структура кристаллической S.
Слайд № 4. Молекулы серы.
Оказывается, что каждый атом S соединяется с 2 другими, а 8 атомов S замыкаясь в кольцо, образуют молекулу S8.
Физические свойства серы.
Исследуем основные физические свойства S;
Опыт
№1.
Прочные на вид кристаллы легко разламываются.
Опыт №2.
Хотя р S больше р воды, сера в воде не тонет, разгадка- в несмачиваемости S. Она хорошо растворима в органических растворителях и практически и практически нерастворима в воде.
Опыт №3.
Удивительно необычные свойства проявляет сера при плавлении.
Сначала разрушаются кристаллы, изменяется цвет вещества, при t=1120С S превращается в легко подвижную жидкость, при дальнейшем нагревании, жидкость начинает терять подвижность.
Слайд № 5. Цепочки.
Кристаллы S построены из 8-членных молекул, при t выше 150 кольцевые молекулы рвутся, отдельные цепочки соединяются друг с другом в цепи.
При 250 0 C длина цепей максимальна.
Вязкость
серы постоянно повышается, что она не
выливается из сосуда, но если продолжить
нагревание, цепи рвутся и S
опять становится жидкой.
Постараемся этот расплав быстро охладить и вылить его в стакан с водой.
Слайд № 6. сера-пластическая.
И вновь неожиданность, получилось вещество по свойствам не похожее на серу. Это аллотропная модификация серы –пластическая сера,
Слайд № 7. График.
но пластическая сера неустойчива и она опять через некоторое время превращается в кристаллическую.
Так вы убедились, что свойства серы связаны с ее строением.
Химические свойства серы.
Слайд № 8.
Строение атома серы доказывает, что она может отдавать или принимать электроны, играя роль восстановителя или окислителя.
Рисунок.
Реакции при которых атом серы принимает электроны, это взаимодействие серы с металлами.
Обычно
они идут с выделением тепла и света.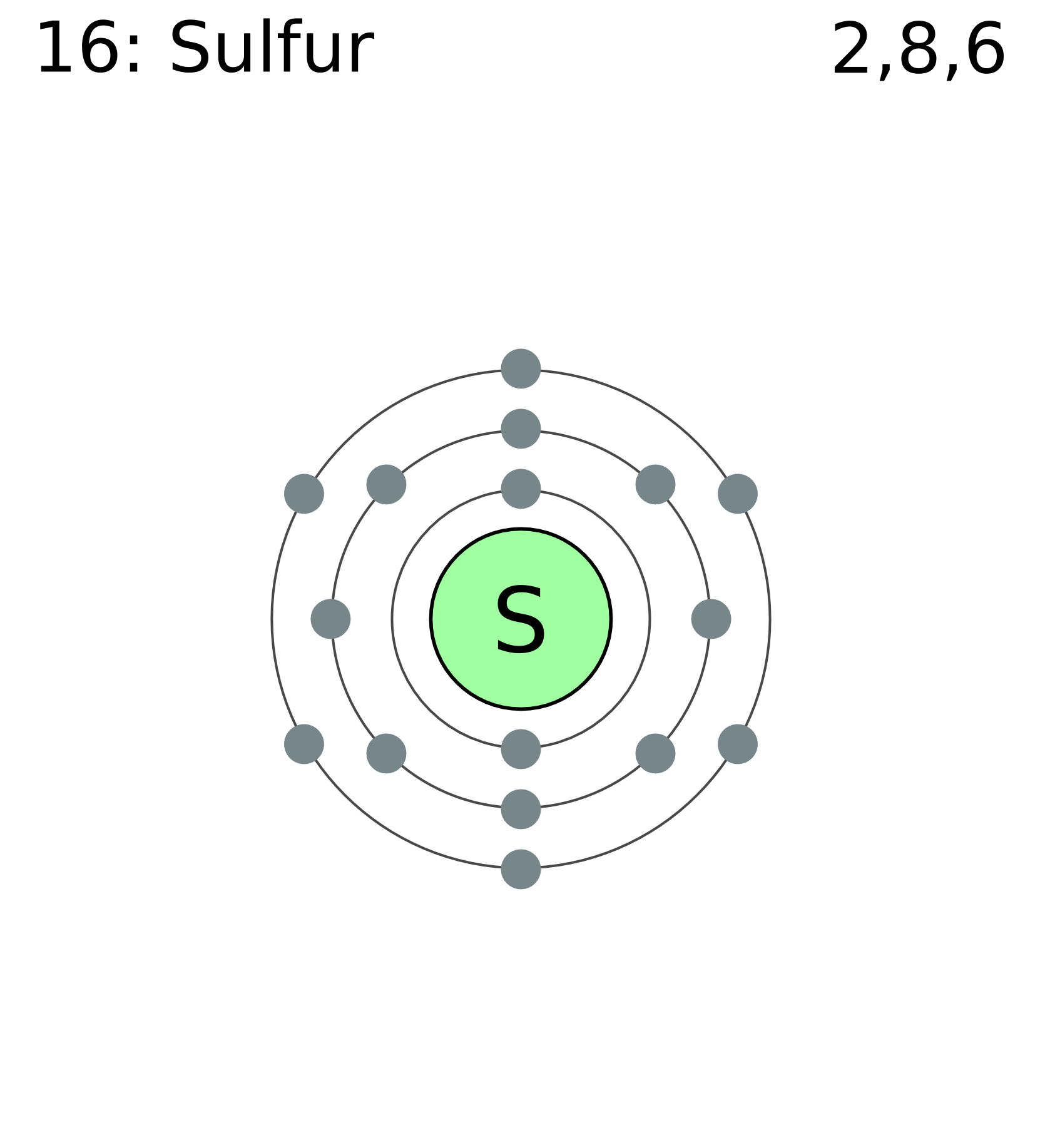
Опыт.
Бурно соединяется сера с натрием.
Опыт.
Обратите внимание на условия реакции взаимодействия S с медью.
Каковы признаки этой реакции.?
Соединения которые образуются при взаимодействии S с металлами называются — сульфиды.
Слайд № 9. Ртуть.
Эта капля ртути принесет нам новую неожиданность, взаимодействие S с Hg проходят при обычных условиях.
Так можно связать в химическое соединение случайно пролитую Hg. Этот процесс лежит в основе удаления в основе удаления и обезвреживания разлитой ртути, например, из разбитого термометра и называется — Демеркуризацией.
В этих реакциях мы наблюдаем окислительные свойства серы, а в каких же случаях сера ведет себя как восстановитель.
Сера сгорает в кислороде с образованием
оксида
серы ( IV), взаимодействует
с F с образованием фторида
серы.
Вывод.
Сера при химических реакциях может быть и окислителем и восстановителем, как ярко выраженный типичный неметалл.
А в каком же виде сера встречается в природе?
Слайд № 10. Сера самородная.
Она встречается в природе как в самородном виде, так и в виде соединений.
В фантастическом романе В.А. Обручева «Плутония» об экспедиции ученых в неведомый мир под земной поверхностью, читаем: «…За площадкой круто поднималась противоположная стена, густо покрытая белыми, желтыми и красными налетами и натеками.
В желтых налетах нетрудно было узнать самородную серу в виде мелких и крупных кристаллов сидевших в пустотах лавы или покрывавших ее поверхность нетолстым слоем».
-У вас на столах образцы разных минералов, найдите среди них серу.
-Помог ли вам только что зачитанный отрывок?.
-По
каким признакам вы ее узнали.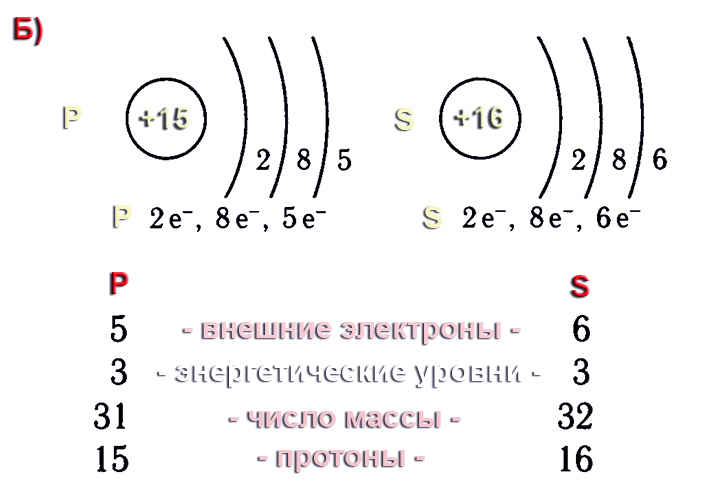 ?
?
Слайд № 11. Таблица минералов.
Еще чаще сера встречается в виде соединений.
Слайд № 12 . Пирит.
Среди них большое значение имеет минерал –пирит.
Пирит -огненный камень, и именно в этой роли он был известен еще на заре человечества.
Кусок пирита выполнял функцию огнива.
Этот достаточно распространенный минерал стал для наших далеких предков ступенькой к цивилизации.
Мы сегодня с вами познакомились со строением атома серы, с ее аллотропными модификациями, и напрашивается вопрос
А зачем, с какой целью мы это изучаем?
Чтобы узнать о применении серы в настоящее время.
Какие области применения серы вам известны?
Кто может назвать?
Откройте учебник стр.
 _____ абзац _____________
_____ абзац _____________
Дополните!
«В полночный час с горящего вулкана возьми немного серы, смерть дарящей, и мелкий порошок её смешав с составом чудотворным, для ран бальзам получишь, краски для картин, а дымом едким нечисть всю убьешь…» -, так писал античный поэт Лукреций Кар об удивительном веществе сере.
Шло время, эти жёлтые кристаллы находили всё новые и новые области применения.
Слад № 13. Области применения.
Их используют для чернения оружия и изготовления пороха. Тысячелетия жизнь людей связана с серой. И каждый из нас связан с этим обычным и необычным веществом – серой.
Д/з §21 стр. 96-99. Задание 1 и 5 для всех, 3 – кто увлекается химией.
Я обращаю ваше внимание, на дополнительную литературу по данной теме.
1-ая
книга для чтения по химии расскажет об
атомах S. Стр.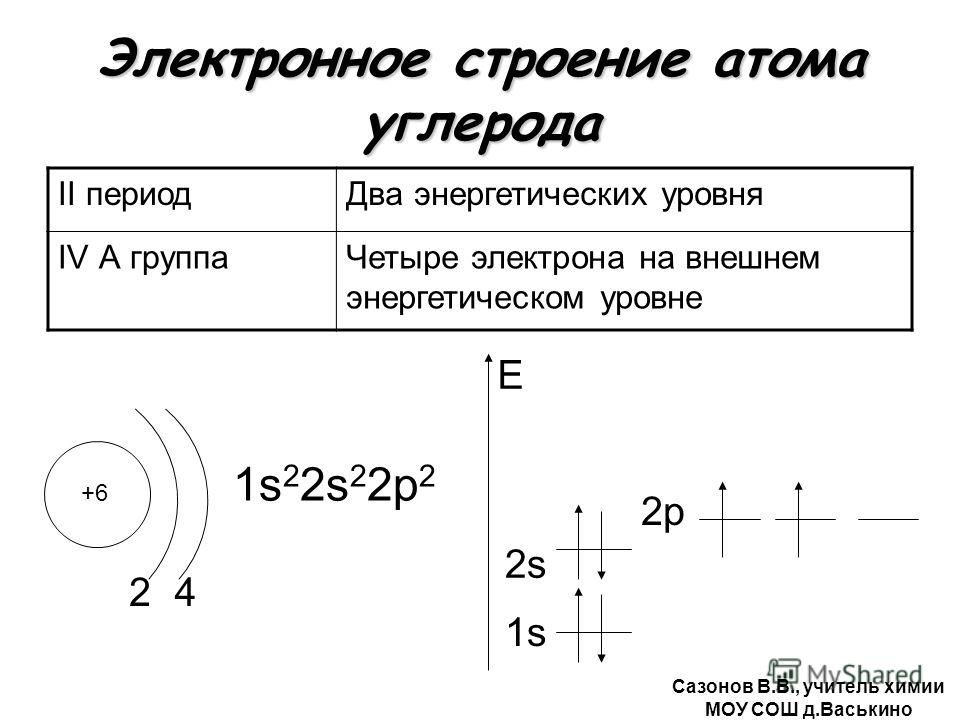 ____
____
2-ая книга «Химия жизни».
В этой книге вы прочитаете о влиянии S на наш организм, потому что она входит в состав белков, и эта книга вам поможет более полно раскрыть функцию белков на уроках биологии. Стр. _______.
У нас осталось с вами время, и мне хотелось бы знать степень усвоения данного материала.
Тесты
Всего вам доброго!
Информация об элементе серы: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементов
История серы
Элемент Сера был обнаружен Древним Китаем в году. 500 г. до н.э. в неизвестном месте . Сера получил свое название от латинского слова «сера», «огонь и сера».
Присутствие серы: изобилие в природе и вокруг нас
В таблице ниже показано содержание серы во Вселенной, Солнце, Метеоритах,
Земная кора, океаны и человеческое тело.
Кристаллическая структура серы
Сера имеет твердую структуру Орторомбическая с центрированной гранью.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| а | b | c |
|---|---|---|
| 1043.7 | 1284,5 | 2436. 9 м. 9 м. |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства серы
Атомы серы имеют 16 электронов и
структура электронной оболочки [2, 8, 6] с символом атомного члена (квантовые числа) 3 P 2 .
Оболочечная структура серы — количество электронов на энергию уровень
| n | с | п. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 4 |
Основная электронная конфигурация серы — нейтральный Атом серы
Электронная конфигурация нейтрального атома серы в основном состоянии
[Ne] 3с2 3п4. Часть конфигурации серы, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ne]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3s2 3p4, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации серы, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ne]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3s2 3p4, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтральной серы
Полная электронная конфигурация в основном состоянии для атома серы, Полная электронная конфигурация
1с2 2с2 2п6 3с2 3п4
Атомная структура серы
Атомный радиус серы 88 пм, а его ковалентный радиус 102 пм.
Атомный спектр серы
Химические свойства серы: Энергии ионизации серы и сродство к электрону
Сродство к электрону серы составляет 200 кДж / моль.
Энергия ионизации серы
Энергия ионизации серы
см. В таблице ниже.| Число энергии ионизации | Энтальпия — кДж / моль |
|---|---|
| 1 | 999.6 |
| 2 | 2252 |
| 3 | 3357 |
| 4 | 4556 |
| 5 | 7004,3 |
| 6 | 8495,8 |
| 7 | 27107 |
| 8 | 31719 |
| 9 | 36621 |
| 10 | 43177 |
Физические свойства серы
Физические свойства серы см.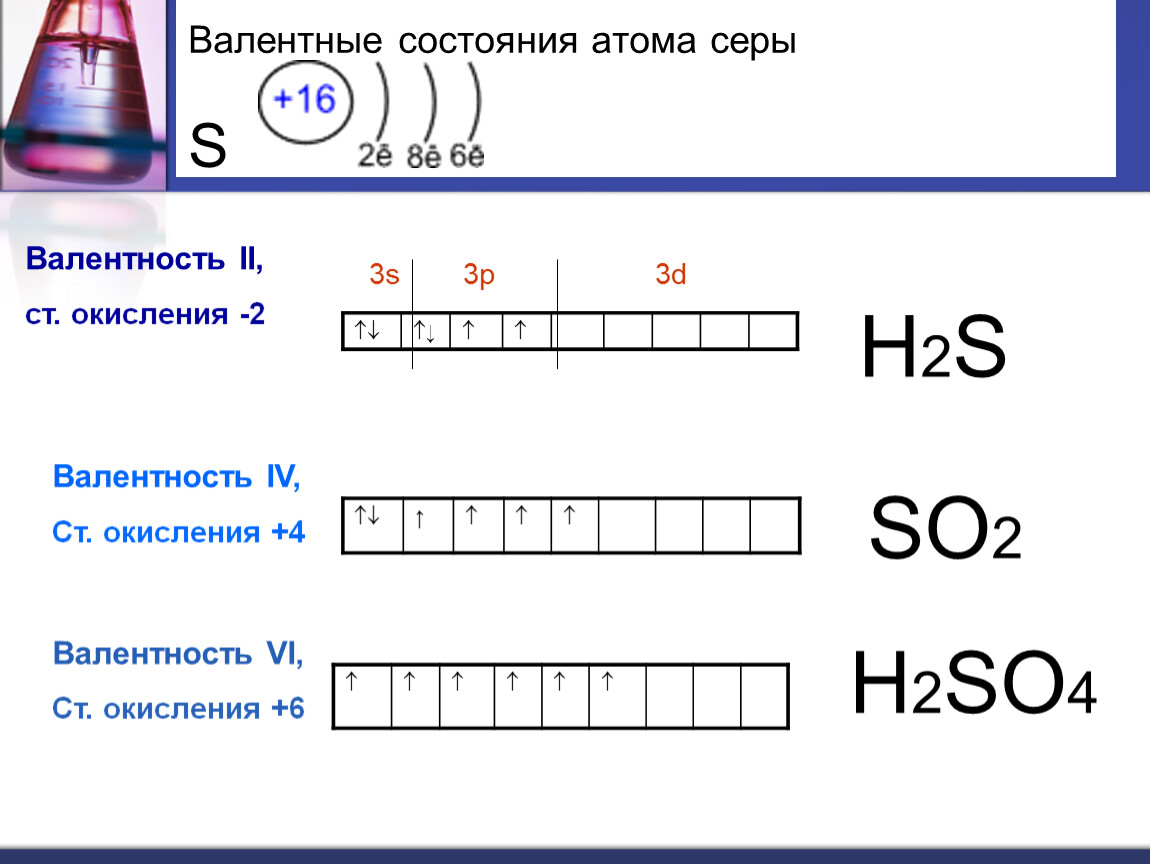 В таблице ниже.
В таблице ниже.
| Плотность | 1.96 г / см3 |
| Молярный объем | 16.3596938776 см3 |
Эластичные свойства
Твердость серы — Испытания для измерения твердости элемента
Электрические свойства серы
Сера — изолятор электричества. Ссылаться на Таблица ниже электрические свойства серы
Теплопроводность и теплопроводность серы
Магнитные свойства серы
Оптические свойства серы
Акустические свойства серы
Термические свойства серы — энтальпии и термодинамика
Термические свойства серы
см. В таблице ниже.
В таблице ниже.Энтальпии серы
Изотопы серы — ядерные свойства серы
Изотопы родия.Встречающаяся в природе сера имеет 4 стабильный изотоп — 32С, 33С, 34С, 36С.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 26S | ||||
| 27S | ||||
| 28S | ||||
| 29S | ||||
| 30S | ||||
| 31S | ||||
| 32S | 94. 93% 93% | Стабильный | Нет данных | |
| 33S | 0. 76% 76% | Стабильный | Нет данных | |
| 34S | 4. 29% 29% | Стабильный | Нет данных | |
| 35S | ||||
| 36S | 0. 02% 02% | Стабильный | Нет данных | |
| 37S | ||||
| 38S | ||||
| 39S | ||||
| 40S | ||||
| 41S | ||||
| 42S | ||||
| 43S | ||||
| 44S | ||||
| 45S | ||||
| 46S | ||||
| 47S | ||||
| 48S | ||||
| 49S |
Нормативно-правовое регулирование и здравоохранение — Параметры и рекомендации по охране здоровья и безопасности
| Количество CAS | CAS7704-34-9 |
| Номер RTECS | {RTECSWS4250000, N / A, N / A, N / A, N / A, N / A} |
| Класс опасности DOT | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Номера DOT | «Н / Д», «Н / Д», «Н / Д», «Н / Д», «Н / Д», «Н / Д» |
| Номер ЕС | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Рейтинг огнестойкости NFPA | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Опасности NFPA | Н / Д, Н / Д, Н / Д, Н / Д, Н / Д, Н / Д |
| Рейтинг здоровья NFPA | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Рейтинг реактивности NFPA | {N / A, N / A, N / A, N / A, N / A, N / A} |
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
| База данных | Идентификационный номер |
|---|---|
| Количество CAS — Химическая служба рефератов ( CAS ) | CAS7704-34-9 |
| Номер CID | {CID5362487, CID5460602, CID139340, CID139602, CID66348, CID66348} |
| Число Гмелина | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Номер НСК | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Номер RTECS | {RTECSWS4250000, N / A, N / A, N / A, N / A, N / A} |
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Информация об элементе серы: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементов
История серы
Элемент Сера был обнаружен Древним Китаем в году.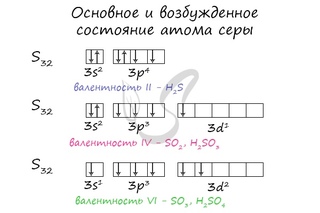 500 г. до н.э. в неизвестном месте
.Сера
получил свое название от латинского слова «сера», «огонь и сера».
500 г. до н.э. в неизвестном месте
.Сера
получил свое название от латинского слова «сера», «огонь и сера».
Присутствие серы: изобилие в природе и вокруг нас
В таблице ниже показано содержание серы во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура серы
Сера имеет твердую структуру Орторомбическая с центрированной гранью.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| а | b | c |
|---|---|---|
1043. 7 7 | 1284,5 | 2436.9 м. |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства серы
Атомы серы имеют 16 электронов и структура электронной оболочки [2, 8, 6] с символом атомного члена (квантовые числа) 3 P 2 .
Оболочечная структура серы — количество электронов на энергию уровень
| n | с | п. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 4 |
Основная электронная конфигурация серы — нейтральный Атом серы
Электронная конфигурация нейтрального атома серы в основном состоянии
[Ne] 3с2 3п4. Часть конфигурации серы, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ne]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3s2 3p4, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации серы, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ne]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3s2 3p4, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтральной серы
Полная электронная конфигурация в основном состоянии для атома серы, Полная электронная конфигурация
1с2 2с2 2п6 3с2 3п4
Атомная структура серы
Атомный радиус серы 88 пм, а его ковалентный радиус 102 пм.
Атомный спектр серы
Химические свойства серы: Энергии ионизации серы и сродство к электрону
Сродство к электрону серы составляет 200 кДж / моль.
Энергия ионизации серы
Энергия ионизации серы
см. В таблице ниже.| Число энергии ионизации | Энтальпия — кДж / моль |
|---|---|
| 1 | 999.6 |
| 2 | 2252 |
| 3 | 3357 |
| 4 | 4556 |
| 5 | 7004,3 |
| 6 | 8495,8 |
| 7 | 27107 |
| 8 | 31719 |
| 9 | 36621 |
| 10 | 43177 |
Физические свойства серы
Физические свойства серы см. В таблице ниже.
В таблице ниже.
| Плотность | 1.96 г / см3 |
| Молярный объем | 16.3596938776 см3 |
Эластичные свойства
Твердость серы — Испытания для измерения твердости элемента
Электрические свойства серы
Сера — изолятор электричества. Ссылаться на Таблица ниже электрические свойства серы
Теплопроводность и теплопроводность серы
Магнитные свойства серы
Оптические свойства серы
Акустические свойства серы
Термические свойства серы — энтальпии и термодинамика
Термические свойства серы
см. В таблице ниже.
В таблице ниже.Энтальпии серы
Изотопы серы — ядерные свойства серы
Изотопы родия.Встречающаяся в природе сера имеет 4 стабильный изотоп — 32С, 33С, 34С, 36С.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 26S | ||||
| 27S | ||||
| 28S | ||||
| 29S | ||||
| 30S | ||||
| 31S | ||||
| 32S | 94. 93% 93% | Стабильный | Нет данных | |
| 33S | 0. 76% 76% | Стабильный | Нет данных | |
| 34S | 4.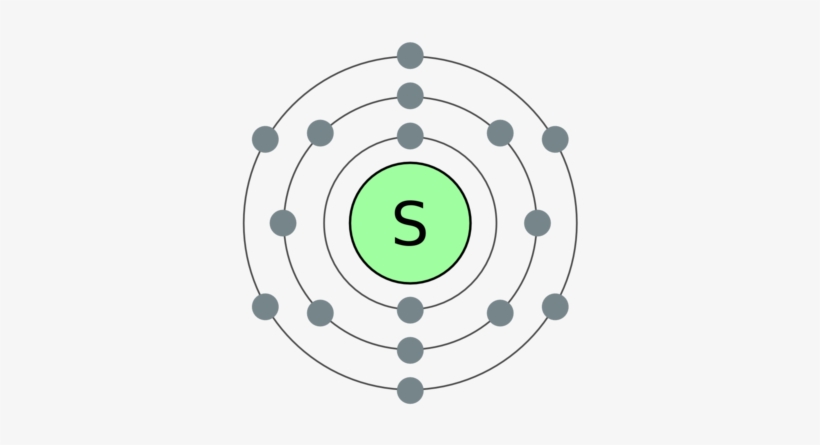 29% 29% | Стабильный | Нет данных | |
| 35S | ||||
| 36S | 0. 02% 02% | Стабильный | Нет данных | |
| 37S | ||||
| 38S | ||||
| 39S | ||||
| 40S | ||||
| 41S | ||||
| 42S | ||||
| 43S | ||||
| 44S | ||||
| 45S | ||||
| 46S | ||||
| 47S | ||||
| 48S | ||||
| 49S |
Нормативно-правовое регулирование и здравоохранение — Параметры и рекомендации по охране здоровья и безопасности
| Количество CAS | CAS7704-34-9 |
| Номер RTECS | {RTECSWS4250000, N / A, N / A, N / A, N / A, N / A} |
| Класс опасности DOT | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Номера DOT | «Н / Д», «Н / Д», «Н / Д», «Н / Д», «Н / Д», «Н / Д» |
| Номер ЕС | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Рейтинг огнестойкости NFPA | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Опасности NFPA | Н / Д, Н / Д, Н / Д, Н / Д, Н / Д, Н / Д |
| Рейтинг здоровья NFPA | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Рейтинг реактивности NFPA | {N / A, N / A, N / A, N / A, N / A, N / A} |
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
| База данных | Идентификационный номер |
|---|---|
| Количество CAS — Химическая служба рефератов ( CAS ) | CAS7704-34-9 |
| Номер CID | {CID5362487, CID5460602, CID139340, CID139602, CID66348, CID66348} |
| Число Гмелина | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Номер НСК | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Номер RTECS | {RTECSWS4250000, N / A, N / A, N / A, N / A, N / A} |
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Информация об элементе серы: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементов
История серы
Элемент Сера был обнаружен Древним Китаем в году. 500 г. до н.э. в неизвестном месте
.Сера
получил свое название от латинского слова «сера», «огонь и сера».
500 г. до н.э. в неизвестном месте
.Сера
получил свое название от латинского слова «сера», «огонь и сера».
Присутствие серы: изобилие в природе и вокруг нас
В таблице ниже показано содержание серы во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура серы
Сера имеет твердую структуру Орторомбическая с центрированной гранью.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| а | b | c |
|---|---|---|
1043. 7 7 | 1284,5 | 2436.9 м. |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства серы
Атомы серы имеют 16 электронов и структура электронной оболочки [2, 8, 6] с символом атомного члена (квантовые числа) 3 P 2 .
Оболочечная структура серы — количество электронов на энергию уровень
| n | с | п. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 4 |
Основная электронная конфигурация серы — нейтральный Атом серы
Электронная конфигурация нейтрального атома серы в основном состоянии
[Ne] 3с2 3п4. Часть конфигурации серы, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ne]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3s2 3p4, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации серы, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ne]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3s2 3p4, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтральной серы
Полная электронная конфигурация в основном состоянии для атома серы, Полная электронная конфигурация
1с2 2с2 2п6 3с2 3п4
Атомная структура серы
Атомный радиус серы 88 пм, а его ковалентный радиус 102 пм.
Атомный спектр серы
Химические свойства серы: Энергии ионизации серы и сродство к электрону
Сродство к электрону серы составляет 200 кДж / моль.
Энергия ионизации серы
Энергия ионизации серы
см. В таблице ниже.| Число энергии ионизации | Энтальпия — кДж / моль |
|---|---|
| 1 | 999.6 |
| 2 | 2252 |
| 3 | 3357 |
| 4 | 4556 |
| 5 | 7004,3 |
| 6 | 8495,8 |
| 7 | 27107 |
| 8 | 31719 |
| 9 | 36621 |
| 10 | 43177 |
Физические свойства серы
Физические свойства серы см. В таблице ниже.
В таблице ниже.
| Плотность | 1.96 г / см3 |
| Молярный объем | 16.3596938776 см3 |
Эластичные свойства
Твердость серы — Испытания для измерения твердости элемента
Электрические свойства серы
Сера — изолятор электричества. Ссылаться на Таблица ниже электрические свойства серы
Теплопроводность и теплопроводность серы
Магнитные свойства серы
Оптические свойства серы
Акустические свойства серы
Термические свойства серы — энтальпии и термодинамика
Термические свойства серы
см. В таблице ниже.
В таблице ниже.Энтальпии серы
Изотопы серы — ядерные свойства серы
Изотопы родия.Встречающаяся в природе сера имеет 4 стабильный изотоп — 32С, 33С, 34С, 36С.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 26S | ||||
| 27S | ||||
| 28S | ||||
| 29S | ||||
| 30S | ||||
| 31S | ||||
| 32S | 94.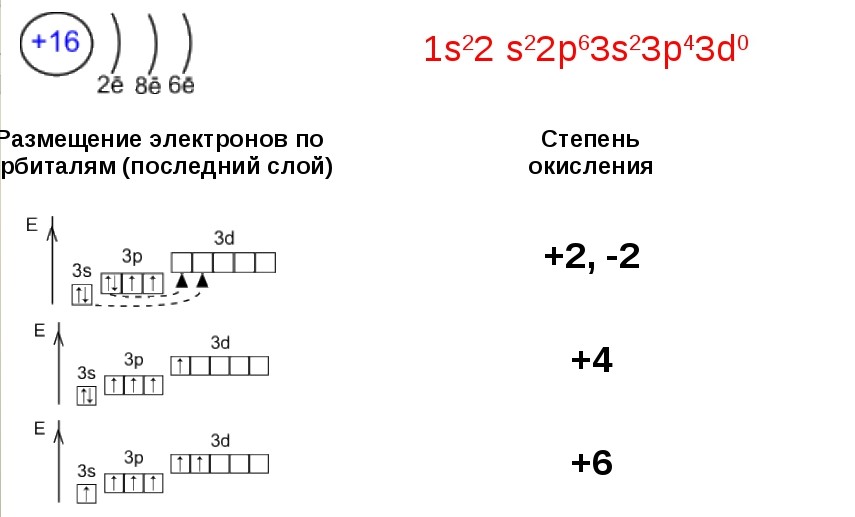 93% 93% | Стабильный | Нет данных | |
| 33S | 0. 76% 76% | Стабильный | Нет данных | |
| 34S | 4.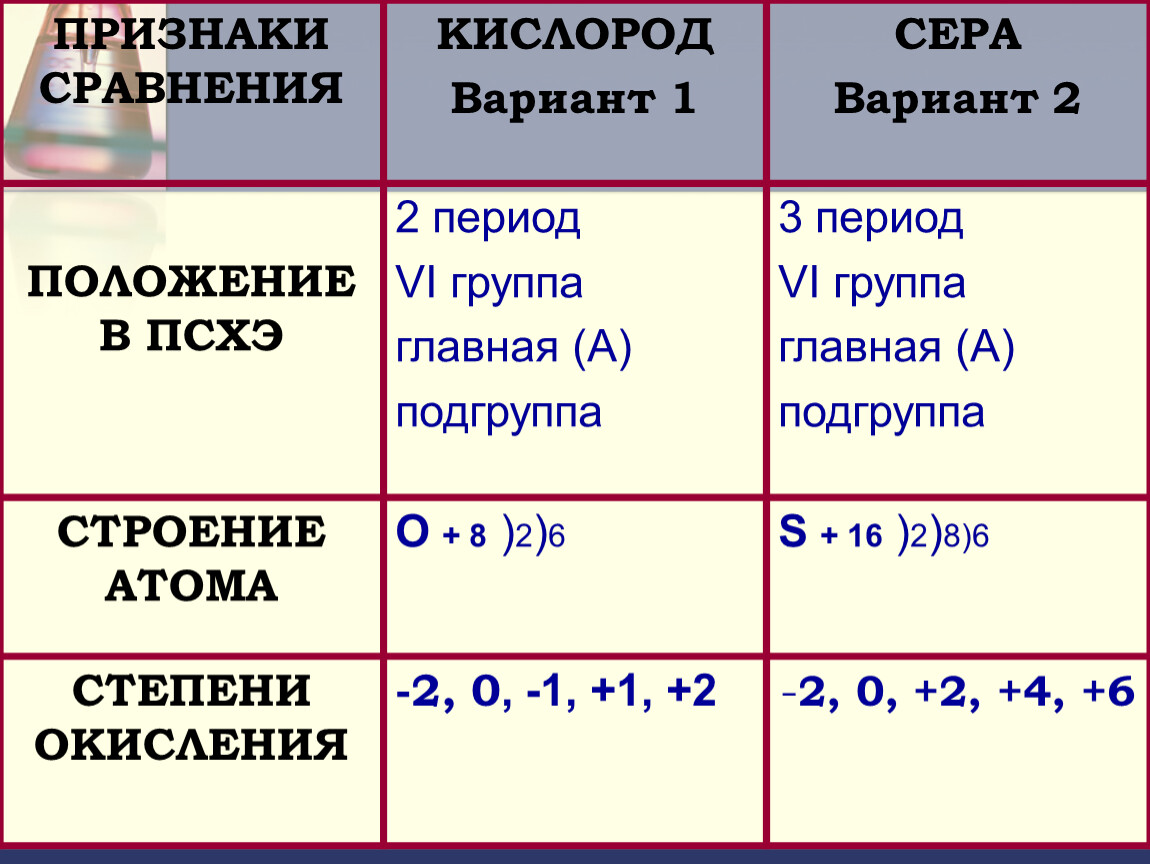 29% 29% | Стабильный | Нет данных | |
| 35S | ||||
| 36S | 0.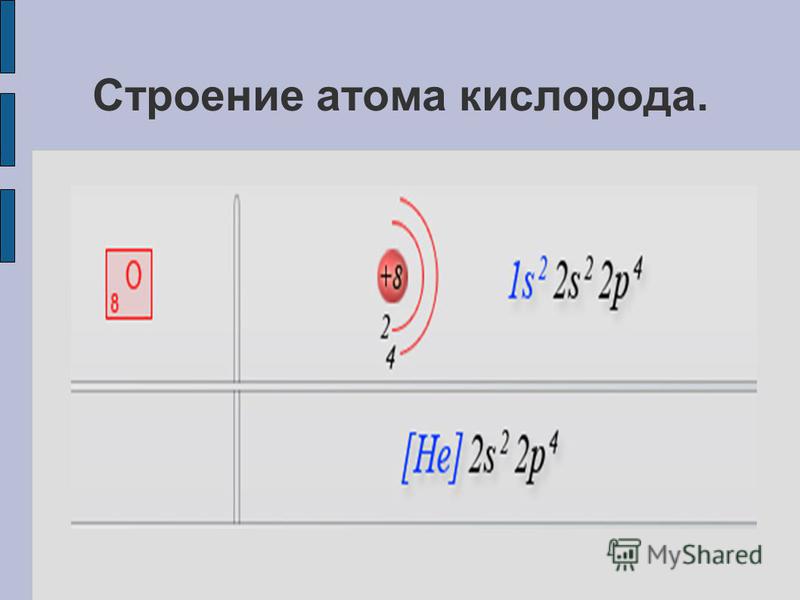 02% 02% | Стабильный | Нет данных | |
| 37S | ||||
| 38S | ||||
| 39S | ||||
| 40S | ||||
| 41S | ||||
| 42S | ||||
| 43S | ||||
| 44S | ||||
| 45S | ||||
| 46S | ||||
| 47S | ||||
| 48S | ||||
| 49S |
Нормативно-правовое регулирование и здравоохранение — Параметры и рекомендации по охране здоровья и безопасности
| Количество CAS | CAS7704-34-9 |
| Номер RTECS | {RTECSWS4250000, N / A, N / A, N / A, N / A, N / A} |
| Класс опасности DOT | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Номера DOT | «Н / Д», «Н / Д», «Н / Д», «Н / Д», «Н / Д», «Н / Д» |
| Номер ЕС | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Рейтинг огнестойкости NFPA | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Опасности NFPA | Н / Д, Н / Д, Н / Д, Н / Д, Н / Д, Н / Д |
| Рейтинг здоровья NFPA | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Рейтинг реактивности NFPA | {N / A, N / A, N / A, N / A, N / A, N / A} |
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
| База данных | Идентификационный номер |
|---|---|
| Количество CAS — Химическая служба рефератов ( CAS ) | CAS7704-34-9 |
| Номер CID | {CID5362487, CID5460602, CID139340, CID139602, CID66348, CID66348} |
| Число Гмелина | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Номер НСК | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Номер RTECS | {RTECSWS4250000, N / A, N / A, N / A, N / A, N / A} |
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Информация об элементе серы: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементов
История серы
Элемент Сера был обнаружен Древним Китаем в году. 500 г. до н.э. в неизвестном месте
.Сера
получил свое название от латинского слова «сера», «огонь и сера».
500 г. до н.э. в неизвестном месте
.Сера
получил свое название от латинского слова «сера», «огонь и сера».
Присутствие серы: изобилие в природе и вокруг нас
В таблице ниже показано содержание серы во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура серы
Сера имеет твердую структуру Орторомбическая с центрированной гранью.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| а | b | c |
|---|---|---|
1043. 7 7 | 1284,5 | 2436.9 м. |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства серы
Атомы серы имеют 16 электронов и структура электронной оболочки [2, 8, 6] с символом атомного члена (квантовые числа) 3 P 2 .
Оболочечная структура серы — количество электронов на энергию уровень
| n | с | п. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 4 |
Основная электронная конфигурация серы — нейтральный Атом серы
Электронная конфигурация нейтрального атома серы в основном состоянии
[Ne] 3с2 3п4.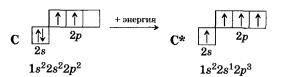 Часть конфигурации серы, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ne]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3s2 3p4, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации серы, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ne]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3s2 3p4, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтральной серы
Полная электронная конфигурация в основном состоянии для атома серы, Полная электронная конфигурация
1с2 2с2 2п6 3с2 3п4
Атомная структура серы
Атомный радиус серы 88 пм, а его ковалентный радиус 102 пм.
Атомный спектр серы
Химические свойства серы: Энергии ионизации серы и сродство к электрону
Сродство к электрону серы составляет 200 кДж / моль.
Энергия ионизации серы
Энергия ионизации серы
см. В таблице ниже.| Число энергии ионизации | Энтальпия — кДж / моль |
|---|---|
| 1 | 999.6 |
| 2 | 2252 |
| 3 | 3357 |
| 4 | 4556 |
| 5 | 7004,3 |
| 6 | 8495,8 |
| 7 | 27107 |
| 8 | 31719 |
| 9 | 36621 |
| 10 | 43177 |
Физические свойства серы
Физические свойства серы см.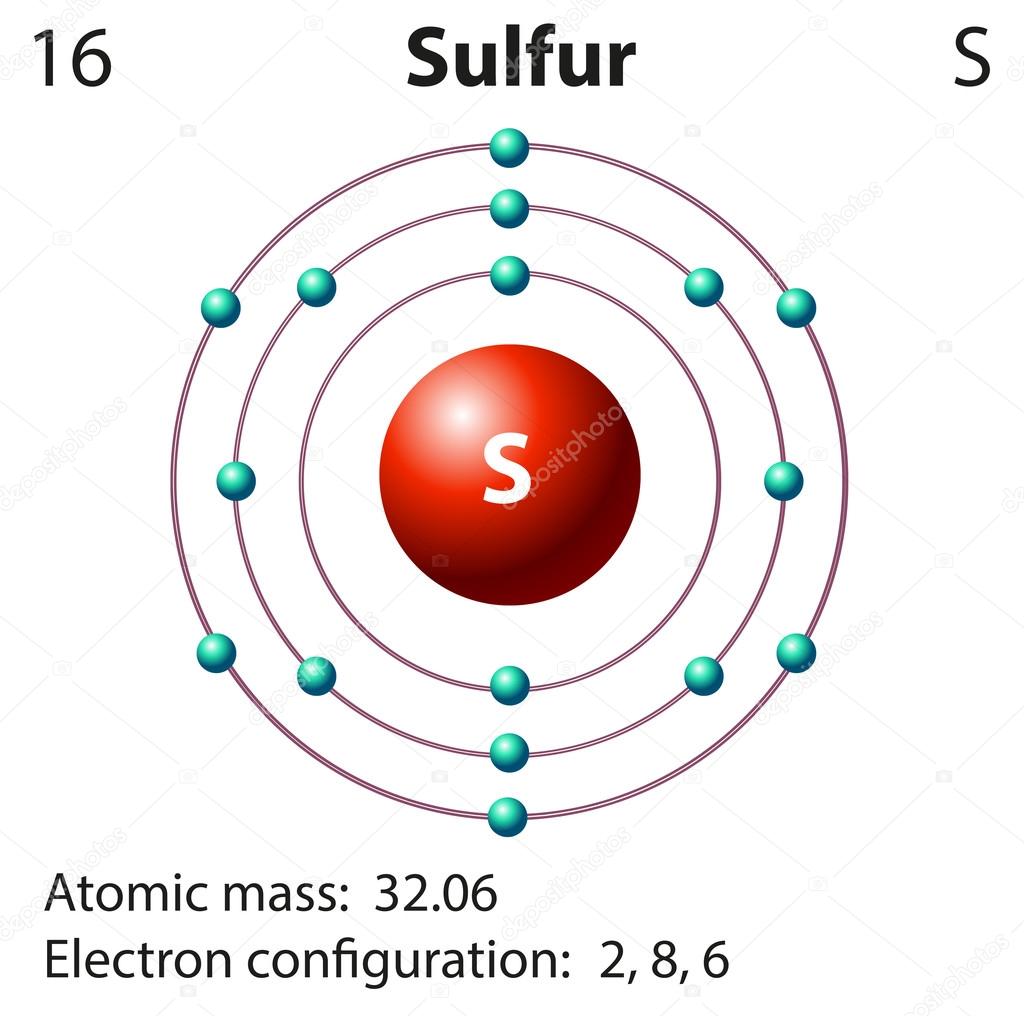 В таблице ниже.
В таблице ниже.
| Плотность | 1.96 г / см3 |
| Молярный объем | 16.3596938776 см3 |
Эластичные свойства
Твердость серы — Испытания для измерения твердости элемента
Электрические свойства серы
Сера — изолятор электричества. Ссылаться на Таблица ниже электрические свойства серы
Теплопроводность и теплопроводность серы
Магнитные свойства серы
Оптические свойства серы
Акустические свойства серы
Термические свойства серы — энтальпии и термодинамика
Термические свойства серы
см. В таблице ниже.
В таблице ниже.Энтальпии серы
Изотопы серы — ядерные свойства серы
Изотопы родия.Встречающаяся в природе сера имеет 4 стабильный изотоп — 32С, 33С, 34С, 36С.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 26S | ||||
| 27S | ||||
| 28S | ||||
| 29S | ||||
| 30S | ||||
| 31S | ||||
| 32S | 94.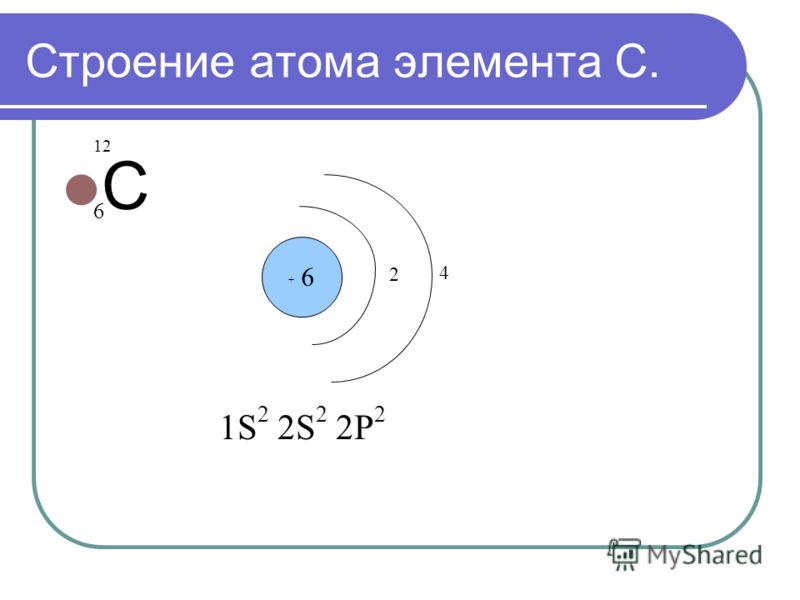 93% 93% | Стабильный | Нет данных | |
| 33S | 0. 76% 76% | Стабильный | Нет данных | |
| 34S | 4. 29% 29% | Стабильный | Нет данных | |
| 35S | ||||
| 36S | 0. 02% 02% | Стабильный | Нет данных | |
| 37S | ||||
| 38S | ||||
| 39S | ||||
| 40S | ||||
| 41S | ||||
| 42S | ||||
| 43S | ||||
| 44S | ||||
| 45S | ||||
| 46S | ||||
| 47S | ||||
| 48S | ||||
| 49S |
Нормативно-правовое регулирование и здравоохранение — Параметры и рекомендации по охране здоровья и безопасности
| Количество CAS | CAS7704-34-9 |
| Номер RTECS | {RTECSWS4250000, N / A, N / A, N / A, N / A, N / A} |
| Класс опасности DOT | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Номера DOT | «Н / Д», «Н / Д», «Н / Д», «Н / Д», «Н / Д», «Н / Д» |
| Номер ЕС | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Рейтинг огнестойкости NFPA | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Опасности NFPA | Н / Д, Н / Д, Н / Д, Н / Д, Н / Д, Н / Д |
| Рейтинг здоровья NFPA | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Рейтинг реактивности NFPA | {N / A, N / A, N / A, N / A, N / A, N / A} |
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
| База данных | Идентификационный номер |
|---|---|
| Количество CAS — Химическая служба рефератов ( CAS ) | CAS7704-34-9 |
| Номер CID | {CID5362487, CID5460602, CID139340, CID139602, CID66348, CID66348} |
| Число Гмелина | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Номер НСК | {N / A, N / A, N / A, N / A, N / A, N / A} |
| Номер RTECS | {RTECSWS4250000, N / A, N / A, N / A, N / A, N / A} |
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Sulfur Atom — обзор
3.
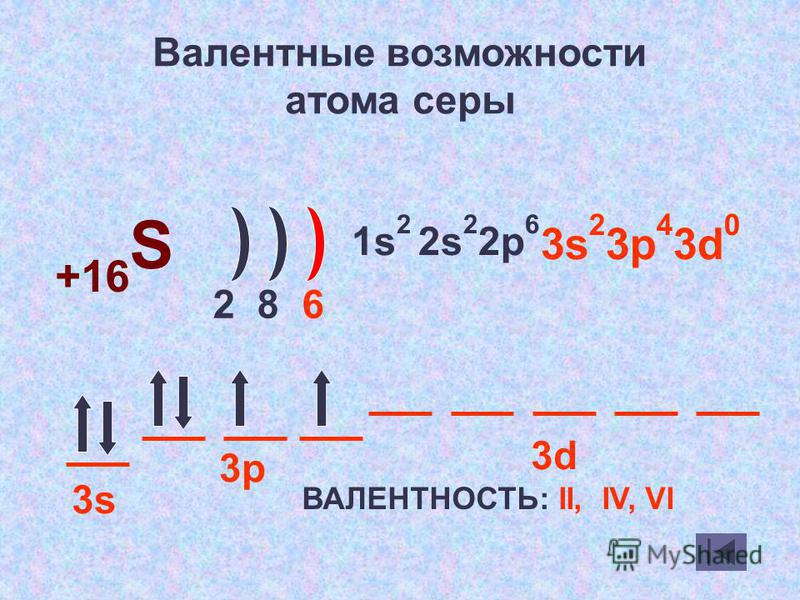 13.2.4 Тиофены, замещенные серой
13.2.4 Тиофены, замещенные серойАтом серы тиофенов является слабонуклеофильным и в некоторых случаях может действовать как место атаки электрофильного реагента. В сильнокислых растворах α-атом углерода протонирован 〈66RTC1072〉; Однако это может быть термодинамически контролируемый продукт. Реакция тиофена с мощными алкилирующими агентами дает соль тиофения ( 56 ), где X — представляет собой ненуклеофильный противоион, такой как BF 4 — или PF 6 — 〈64JA5360, 70JCS (C) 1764〉.Получен и охарактеризован большой ассортимент солей тиофения и бензо [ b ] тиофения.
In ( 56 ) и его производные должна вестись битва между необходимостью планарности атома серы для достижения максимальной резонансной стабилизации и нормальной пирамидальной геометрией вокруг сульфониевой серы. Та же проблема возникает с сульфоксидами тиофена. Для ( 57 ) 〈70JA7610〉, полученного с низким выходом окислением соответствующего тиофена m -хлорпербензойной кислотой, с помощью спектроскопии ЯМР 1 H было установлено, что атом серы является пирамидальным. При температуре ниже 26 ° C метиленовые атомы водорода изооктильных заместителей являются диастереотопными; выше этой температуры происходит коалесценция, и атомы водорода метилена считаются эквивалентными. Это согласуется с пирамидальным атомом серы, который быстро инвертируется по шкале времени ЯМР 1 H выше 26 ° C. Расчетная энергия активации для пирамидальной инверсии составляет 61,9 кДж моль -1 по сравнению с нормальным значением 160-180 кДж моль -1 для алифатических сульфоксидов.Такая же ситуация, а именно пирамидальный атом серы и достаточно низкий пирамидальный барьер инверсии, обнаруживается для солей тиофения. Доступ к сульфоксидам бензо [ b ] тиофена, , т.е. ( 58a ), также может быть достигнут 〈75TL2345〉; они также имеют пирамидальный атом серы.
При температуре ниже 26 ° C метиленовые атомы водорода изооктильных заместителей являются диастереотопными; выше этой температуры происходит коалесценция, и атомы водорода метилена считаются эквивалентными. Это согласуется с пирамидальным атомом серы, который быстро инвертируется по шкале времени ЯМР 1 H выше 26 ° C. Расчетная энергия активации для пирамидальной инверсии составляет 61,9 кДж моль -1 по сравнению с нормальным значением 160-180 кДж моль -1 для алифатических сульфоксидов.Такая же ситуация, а именно пирамидальный атом серы и достаточно низкий пирамидальный барьер инверсии, обнаруживается для солей тиофения. Доступ к сульфоксидам бензо [ b ] тиофена, , т.е. ( 58a ), также может быть достигнут 〈75TL2345〉; они также имеют пирамидальный атом серы.
Как и следовало ожидать, атом серы производного тиофена при алкилировании или окислении может быть вызван реакциями, характерными, соответственно, для солей сульфония или сульфоксидов. Дибензотиофен — особенно полезное соединение для изучения этого типа химии. Алкилирование соответствующего сульфоксида дает соли алкоксисульфония, подобные ( 59 ), а обмен с вторичными аминами обеспечивает доступ к производным азасульфония, подобным ( 60 ) 〈72JCS (P1) 899〉. В некоторых случаях также можно получить илидические структуры, например ( 61 ). Приведены некоторые подходящие длины связи для ( 61 ), полученные с помощью рентгеноструктурного анализа.Обратите внимание на повышенную локализацию связей в тиофеновом кольце, отражающую потерю ароматичности. Как и следовало ожидать, атом серы также неплоский 〈78CC83〉. Илид из 1,2,3,4,5-пентаметилтиофения фторсульфоната также был получен и охарактеризован в растворе с помощью спектроскопии ЯМР 1 H 〈74TL75〉.
Дибензотиофен — особенно полезное соединение для изучения этого типа химии. Алкилирование соответствующего сульфоксида дает соли алкоксисульфония, подобные ( 59 ), а обмен с вторичными аминами обеспечивает доступ к производным азасульфония, подобным ( 60 ) 〈72JCS (P1) 899〉. В некоторых случаях также можно получить илидические структуры, например ( 61 ). Приведены некоторые подходящие длины связи для ( 61 ), полученные с помощью рентгеноструктурного анализа.Обратите внимание на повышенную локализацию связей в тиофеновом кольце, отражающую потерю ароматичности. Как и следовало ожидать, атом серы также неплоский 〈78CC83〉. Илид из 1,2,3,4,5-пентаметилтиофения фторсульфоната также был получен и охарактеризован в растворе с помощью спектроскопии ЯМР 1 H 〈74TL75〉.
Возникает вопрос об ароматичности. Ни соли тиофения, ни сульфоксиды тиофена не являются особенно стабильными, что затрудняет классический тест реакционной способности электрофильного ароматического замещения. Первый деалкилирует легко, а второй, по крайней мере, в случае сульфоксида тиофена, легко подвергается самодимеризации 〈65CCC1158〉 (объемные заместители ( 57 ) препятствуют этой реакции). Ароматичность требует, чтобы неподеленная пара на сере участвовала в ароматическом секстете. Если неподеленная пара из-за гибридизации sp 3 и неправильной симметрии не делокализована в сегмент бутадиена, система будет антиароматической .
Первый деалкилирует легко, а второй, по крайней мере, в случае сульфоксида тиофена, легко подвергается самодимеризации 〈65CCC1158〉 (объемные заместители ( 57 ) препятствуют этой реакции). Ароматичность требует, чтобы неподеленная пара на сере участвовала в ароматическом секстете. Если неподеленная пара из-за гибридизации sp 3 и неправильной симметрии не делокализована в сегмент бутадиена, система будет антиароматической .
На основе рентгеноструктурных определений структур ( 62 ), ( 63 ) и ( 64 ) наиболее подходящим является приближение антиароматического вещества 〈81JA289〉.Как и ожидалось, атом серы во всех случаях пирамидальный, алкильные заместители находятся на 68–69 ° вне плоскости, а кислород ( 64 ) на 59 ° вне плоскости. Во всех случаях длины связи углерод – сера значительно больше, чем у неалкилированных (окисленных) аналогов. Этот момент лучше проиллюстрирован сравнением рассчитанных длин связей (методами MNDO с использованием структурных результатов для 62 , 63 и 64 ) для ( 56 ) с рассчитанными длинами связей для ( 1 ) с использованием тех же вычислительных методов и параметров. Расчетное удлинение связи углерод – сера является следствием введения антиароматического характера.
Расчетное удлинение связи углерод – сера является следствием введения антиароматического характера.
Дополнительная неподеленная пара на сере в тризамещенных производных также может быть использована для образования связи. Различные тиофеновые сульфоны ( 16 , раздел 3.13.2.1) были получены либо прямым окислением соответствующих тиофенов, либо косвенными путями 〈53RTC314, 54JA1932, 54JA1936, 54JA1940, 76SC583〉. Более эзотерические, хотя и вполне разумные структуры, такие как окисленные соли тиофения ( 65 ), насколько известно автору, еще не описаны.Можно было бы ожидать a priori , что тиофенсульфоны ( 16 ) и подобные производные не должны иметь ароматического характера из-за отсутствия неподеленной пары на сере. Хотя производные ( 16 ) не проявляют характерного ароматического характера (наиболее часто наблюдаются реакции Дильса-Альдера с диенофилами), все же существует некоторая степень передачи конъюгативных эффектов через сульфоновую группу 〈74JA280〉.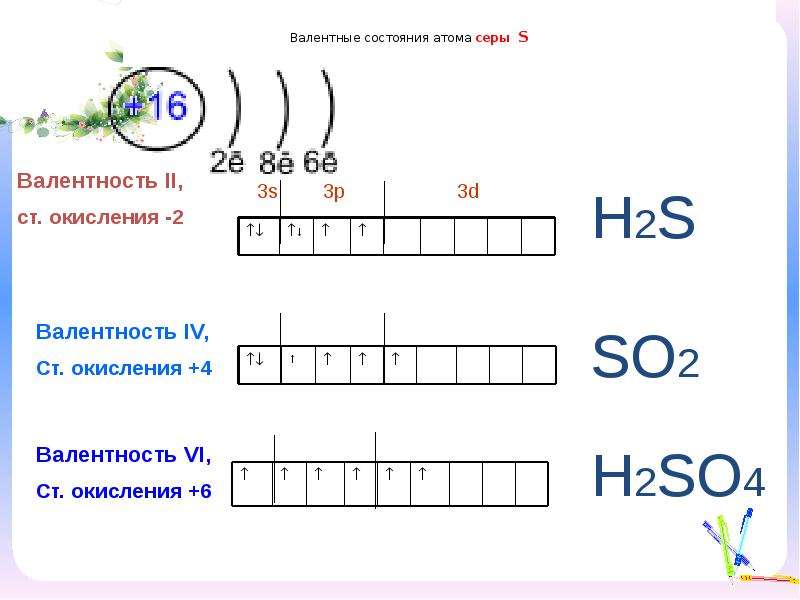 В ( 16 ; R = Bu t ) самая высокая занятая молекулярная орбиталь (полученная из диена) стабилизирована примерно на 0.85 эВ относительно соответствующей орбитали 2,5-ди- t -бутилциклопентадиена. Это указывает на заметную степень сквозного сопряжения.
В ( 16 ; R = Bu t ) самая высокая занятая молекулярная орбиталь (полученная из диена) стабилизирована примерно на 0.85 эВ относительно соответствующей орбитали 2,5-ди- t -бутилциклопентадиена. Это указывает на заметную степень сквозного сопряжения.
Указание на структурные вариации, которые могут быть достигнуты с тиофенами и тиофенсульфонами, дают поликонденсированные тиенотиофенсульфоны ( 66 ) — ( 71 ) 〈71JOC1645, 71JOC1998, 72JCS (P2) 572, 73RTC1073〉. Хотя ограниченная способность сульфоновой группы передавать конъюгативные эффекты, эффект, отмеченный в начале 1950-х годов 〈50MI31300, 51MI31300〉, уже упоминался, это не видно из обширных исследований, проведенных на ( 66 ) — ( 71 ), что для этих соединений сульфоновая группа придает свойства, отличные от качественно ожидаемых для мостиковой и изолирующей функции.
Небольшое удлинение связей углерод – сера также происходит в тиофеновых сульфонах. Рентгеновские кристаллографические структуры ( 72 ) 〈66MI31301〉 и ( 73 ) 〈68AX (B) 981〉 были определены, и некоторые подходящие длины связей приведены в структурах. Наиболее яркая особенность структур видна в ( 72 ), где двойная связь удлинена на 0,1 Å по сравнению с тиофеном.
Рентгеновские кристаллографические структуры ( 72 ) 〈66MI31301〉 и ( 73 ) 〈68AX (B) 981〉 были определены, и некоторые подходящие длины связей приведены в структурах. Наиболее яркая особенность структур видна в ( 72 ), где двойная связь удлинена на 0,1 Å по сравнению с тиофеном.
Имеются значительные доказательства существования другого типа промежуточного тиофена, в котором сера является четырехкоординатной, а именно таких соединений, как ( 75 ), которые, по-видимому, образуются в виде короткоживущих промежуточных продуктов при добавлении ариллития или реактива Гриньяра к дибензотиофенонию. соль, такая как ( 74 ) (уравнение 12).Соли арилтиофения ( 75 ) получают обменом лиганда с соответствующими солями алкоксисульфония, полученными алкилированием сульфоксидов кислородом. Такие соединения, как ( 75 ), не были выделены как таковые, но постулируются как промежуточные соединения на основании большого количества доказательств. Такие соединения будут иметь нечеткое количество электронов вокруг серы, которая, как ожидается, будет иметь тригонально-бипирамидную геометрию 〈73JA5288, 74CPB1711, 74CPB2004, 74CPB2014, 74CPB2020〉. Тригональные бипирамидные соединения серы, конечно, хорошо известны и в других ситуациях.
Такие соединения будут иметь нечеткое количество электронов вокруг серы, которая, как ожидается, будет иметь тригонально-бипирамидную геометрию 〈73JA5288, 74CPB1711, 74CPB2004, 74CPB2014, 74CPB2020〉. Тригональные бипирамидные соединения серы, конечно, хорошо известны и в других ситуациях.
Структурная основа распознавания серы в фосфоротиоатной ДНК
Структура полноразмерного (FL) белка ScoMcrA
Молекулярный механизм распознавания PT-ДНК до сих пор оставался неуловимым. ScoMcrA является первой фосфоротиоатион-зависимой REase, и было постулировано, что она несет домен или мотив, который распознает PT-ДНК с атомом серы в конфигурации R p (дорожка 3 на рис. 1a, дополнительный рис. 27). ), но не PT-ДНК с серой в конфигурации S p (полоса 4 на рис.1а) или ДНК без РТ (дорожка 2 на рис. 1а). Чтобы выяснить молекулярный механизм распознавания РТ-ДНК ScoMcrA, мы определили кристаллическую структуру ScoMcrA Streptomyces coelicolor FL ScoMcrA с разрешением 3,15 Å (регистрационный номер PDB 5ZMM), используя метод одноволновой аномальной дисперсии (SAD) с производное селенометионина (SeMet) (рис. 1b – d, дополнительный рисунок 1, дополнительная таблица 1). В каждой асимметричной единице есть шесть молекул ScoMcrA (дополнительный рис. 2а), которые собраны в три димера (дополнительный рис.2б). Это согласуется с наблюдением, что ScoMcrA ведет себя как димер в растворе (дополнительный рис. 2c).
1b – d, дополнительный рисунок 1, дополнительная таблица 1). В каждой асимметричной единице есть шесть молекул ScoMcrA (дополнительный рис. 2а), которые собраны в три димера (дополнительный рис.2б). Это согласуется с наблюдением, что ScoMcrA ведет себя как димер в растворе (дополнительный рис. 2c).
ScoMcrA использует свой домен SBD для распознавания PT-ДНК. a Streptomyces coelicolor ScoMcrA, специфически связанный с РТ-ДНК и геми ‒ РТ-ДНК, содержащей ядерную последовательность G PS GCC, с атомом серы в R p , но не в S p , конфигурация для стерео.Дорожка 1 служит контролем без добавления белка. b Доменная организация ScoMcrA. c Структура полноразмерного димера ScoMcrA. Помечены четыре домена ScoMcrA, head, SBD, SRA и HNH. d Структура протомера ScoMcrA. e Структура ScoMcrA ‒ SBD-SRA в комплексе с PT-ДНК из 10 пар оснований. Последовательность ДНК показана вверху, а основания, распознаваемые ScoMcrA, выделены пурпурным цветом. f Структура ScoMcrA ‒ SBD в комплексе с РТ-ДНК из восьми пар оснований.Распознающие серу остатки показаны в карандаше, а также на изображениях поверхности. «Петля S 187 RGRR 191 », распознающая основания PT-ДНК, окрашена в оранжевый цвет
f Структура ScoMcrA ‒ SBD в комплексе с РТ-ДНК из восьми пар оснований.Распознающие серу остатки показаны в карандаше, а также на изображениях поверхности. «Петля S 187 RGRR 191 », распознающая основания PT-ДНК, окрашена в оранжевый цвет
Каждый протомер ScoMcrA состоит из головного домена, не охарактеризованного домена, SRA-подобного домена и домена HNH. Эти четыре модульных домена расположены аналогично бусинам на нити (рис. 1d), причем последние три домена все вносят вклад в контакты димеризации (рис. 1c). Головной домен небольшой и с неизвестной функцией (дополнительный рис.3а). Наложение шести протомеров ScoMcrA в асимметричную единицу показывает, что головной домен обнаруживает существенную вариацию положения относительно др. Доменов, указывая тем самым, что он довольно гибко прикреплен к остальной части молекулы (Supplementary Fig. 4). Не охарактеризованный домен специфически связывается с PT-ДНК, атом серы которой находится в конфигурации R p , но не в конфигурации S p (дополнительный рисунок 5), поэтому мы назвали его серосвязывающим доменом (SBD). .Он демонстрирует новую складку, состоящую из 10 α-спиралей в качестве основного тела и трехцепочечного β-листа на периферии (дополнительный рис. 3b). Поиск DALI не выявил значимого структурного гомолога ScoMcrA-SBD, наиболее похожим совпадением является субъединица-2 комплекса распознавания происхождения (код PDB: 1W5S [https://www.rcsb.org/structure/1W5S], Z оценка = 8,7). Оба домена SRA и HNH структурно аналогичны известным доменам SRA 18,19,20,21,22,23,24,25,26,27 и HNH 36 , которые, соответственно, отвечают за распознавание 5-метилцитозинов и выполнение двухцепочечного расщепления ДНК (дополнительный рис.3в, г). В домене HNH две β-цепи и α-спираль несут остатки активного сайта H508, N522 и H531, которые являются критическими для его эндонуклеазной активности 14 . Четыре остатка цистеина, C484, C489, C527 и C530, координируют ион Zn 2+ в структуре, подобной цинковому пальцу (дополнительный рис. 3d).
.Он демонстрирует новую складку, состоящую из 10 α-спиралей в качестве основного тела и трехцепочечного β-листа на периферии (дополнительный рис. 3b). Поиск DALI не выявил значимого структурного гомолога ScoMcrA-SBD, наиболее похожим совпадением является субъединица-2 комплекса распознавания происхождения (код PDB: 1W5S [https://www.rcsb.org/structure/1W5S], Z оценка = 8,7). Оба домена SRA и HNH структурно аналогичны известным доменам SRA 18,19,20,21,22,23,24,25,26,27 и HNH 36 , которые, соответственно, отвечают за распознавание 5-метилцитозинов и выполнение двухцепочечного расщепления ДНК (дополнительный рис.3в, г). В домене HNH две β-цепи и α-спираль несут остатки активного сайта H508, N522 и H531, которые являются критическими для его эндонуклеазной активности 14 . Четыре остатка цистеина, C484, C489, C527 и C530, координируют ион Zn 2+ в структуре, подобной цинковому пальцу (дополнительный рис. 3d).
Структура домена ScoMcrA-SBD в комплексе с PT-ДНК
После многочисленных испытаний по кристаллизации с использованием различных фрагментов ScoMcrA и различной длины и последовательностей олигонуклеотидов PT-ДНК мы успешно определили кристаллические структуры доменов SBD-SRA ScoMcrA. (остатки 91–442) в комплексе с PT-ДНК из 10 пар (п.н.) (5ʹ-CCCG PS GCCGGG-3ʹ) в 3.Разрешение 30 Å (номер доступа PDB 5ZMN; рис. 1e) и SBD-домен ScoMcrA (остатки 91–260) в комплексе с PT-ДНК из 8 пар оснований (5ʹ-CCG PS GCCGG-3ʹ) при 1,70 Å. разрешение (рис. 1f и дополнительная таблица 1). Подобно белку FL ScoMcrA, ScoMcrA SBD-SRA образует димер с доменом SRA, опосредующим димеризацию, но без ассоциации с PT-ДНК (Fig. 1e). Напротив, структура ScoMcrA ‒ SBD существует как мономер (рис. 1f). Хотя атомы серы присутствуют в обеих цепях PT-ДНК, которые содержат палиндромную ядерную последовательность G PS GCC, только один атом серы в PT-ДНК распознается ScoMcrA-SBD в обеих структурах (рис.1д, е). В подтверждение этих структурных наблюдений, как FL ScoMcrA, так и ScoMcrA-SBD взаимодействовали с геми-PT-ДНК, в которой только одна из двух цепей ДНК фосфоротиоэтифицирована, как показано в анализах EMSA (дорожка 5 на рис. 1а и дополнительный рис. 5). ).
(остатки 91–442) в комплексе с PT-ДНК из 10 пар (п.н.) (5ʹ-CCCG PS GCCGGG-3ʹ) в 3.Разрешение 30 Å (номер доступа PDB 5ZMN; рис. 1e) и SBD-домен ScoMcrA (остатки 91–260) в комплексе с PT-ДНК из 8 пар оснований (5ʹ-CCG PS GCCGG-3ʹ) при 1,70 Å. разрешение (рис. 1f и дополнительная таблица 1). Подобно белку FL ScoMcrA, ScoMcrA SBD-SRA образует димер с доменом SRA, опосредующим димеризацию, но без ассоциации с PT-ДНК (Fig. 1e). Напротив, структура ScoMcrA ‒ SBD существует как мономер (рис. 1f). Хотя атомы серы присутствуют в обеих цепях PT-ДНК, которые содержат палиндромную ядерную последовательность G PS GCC, только один атом серы в PT-ДНК распознается ScoMcrA-SBD в обеих структурах (рис.1д, е). В подтверждение этих структурных наблюдений, как FL ScoMcrA, так и ScoMcrA-SBD взаимодействовали с геми-PT-ДНК, в которой только одна из двух цепей ДНК фосфоротиоэтифицирована, как показано в анализах EMSA (дорожка 5 на рис. 1а и дополнительный рис. 5). ).
Признание
R p Атом серы в PT-ДНК с помощью ScoMcrA-SBD Атом серы на PT-ДНК плотно прилегает к полости на поверхности SBD (рис. 1e, f и дополнительный рис. 6). Стенка этой серосвязывающей полости SBD выстлана неполярными функциональными группами, включая β-метиленовые группы Y164 и h216, β-метильную группу A168 и γ-метиленовую группу R117.Гидрофобное пиролидиновое кольцо P165 образует дно этой серосвязывающей полости. Кроме того, полость, связывающая серу, также содержит положительно заряженный элемент, такой как гуанидиновая группа R117 (рис. 2a – c).
1e, f и дополнительный рис. 6). Стенка этой серосвязывающей полости SBD выстлана неполярными функциональными группами, включая β-метиленовые группы Y164 и h216, β-метильную группу A168 и γ-метиленовую группу R117.Гидрофобное пиролидиновое кольцо P165 образует дно этой серосвязывающей полости. Кроме того, полость, связывающая серу, также содержит положительно заряженный элемент, такой как гуанидиновая группа R117 (рис. 2a – c).
Остатки, взаимодействующие с атомом серы. a Увеличенный вид серосвязывающей полости на ScoMcrA-SBD. Атом серы PT-ДНК распознается пиролидиновым кольцом P165, β-метиленовыми группами Y164 и h216, β-метильной группой A168 и γ-метиленовой группой R117 за счет гидрофобных взаимодействий, а также посредством гуанидиновая группа R117 за счет электростатического взаимодействия.Электростатические взаимодействия обозначены пурпурными пунктирными линиями. b Вид в и был повернут на 90 ° влево. c Схематическое резюме взаимодействий между ScoMcrA-SBD и PT-ДНК. d Мутации ключевых распознающих серу или контактирующих с основанием остатков нарушили или уменьшили ассоциацию между ScoMcrA-SBD и PT-ДНК, как было проанализировано с помощью анализа EMSA. Исходные гели EMSA показаны на дополнительном рисунке 9
c Схематическое резюме взаимодействий между ScoMcrA-SBD и PT-ДНК. d Мутации ключевых распознающих серу или контактирующих с основанием остатков нарушили или уменьшили ассоциацию между ScoMcrA-SBD и PT-ДНК, как было проанализировано с помощью анализа EMSA. Исходные гели EMSA показаны на дополнительном рисунке 9
По сравнению с кислородом, электроотрицательность серы значительно ниже и составляет 2.58 по сравнению с 3,44 для кислорода по шкале Полинга 37 . Следовательно, можно ожидать, что фосфоротиоат менее гидрофилен и более гидрофобен, чем фосфат. В структуре ScoMcrA-SBD, связанной с PT-ДНК, атом серы образует гидрофобные взаимодействия с пиролидиновым кольцом P165, β-метиленовыми группами Y164 и h216, β-метильной группой A168 и γ-метиленовой группой R117. (Рис. 2a – c и дополнительный рис. 7). Кроме того, гуанидиниевая группа R117 образует солевой мостик с фосфоротиоатом в PT-ДНК 38 (рис.2а – в). В конфигурации S p атом серы был бы неправильно расположен для размещения в полости для связывания серы (дополнительный рис.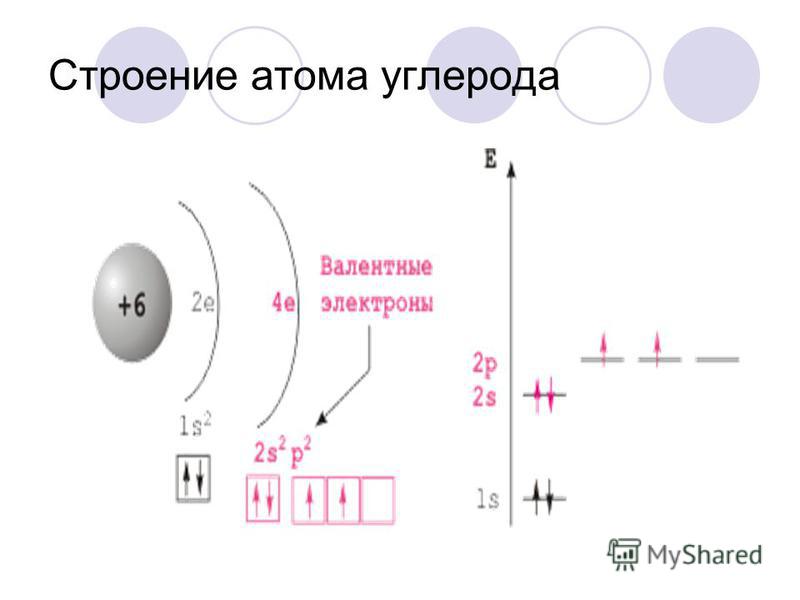 8a, b). Более того, обратная стереохимия фосфоротиоата привела бы к неблагоприятному взаимодействию между катионом гуанидиния и фосфоротиоат-анионом, в частности, из-за низкого заряда атома серы и его большего ван-дер-ваальсового радиуса. Это согласуется с нашими биохимическими результатами, согласно которым ScoMcrA или его домен SBD не ассоциировались с PT-ДНК с атомом серы в конфигурации S p (рис.1а и дополнительный рис. 5). Следовательно, домен SBD ScoMcrA управляет тонким балансом между гидрофобными и электростатическими взаимодействиями для распознавания атома серы в PT-ДНК.
8a, b). Более того, обратная стереохимия фосфоротиоата привела бы к неблагоприятному взаимодействию между катионом гуанидиния и фосфоротиоат-анионом, в частности, из-за низкого заряда атома серы и его большего ван-дер-ваальсового радиуса. Это согласуется с нашими биохимическими результатами, согласно которым ScoMcrA или его домен SBD не ассоциировались с PT-ДНК с атомом серы в конфигурации S p (рис.1а и дополнительный рис. 5). Следовательно, домен SBD ScoMcrA управляет тонким балансом между гидрофобными и электростатическими взаимодействиями для распознавания атома серы в PT-ДНК.
Чтобы проверить наши структурные наблюдения, мы выполнили анализ EMSA, чтобы изучить, как различные мутации распознающих серу остатков ScoMcrA-SBD влияют на связывание PT-ДНК. Замена неполярного P165 в центре серосвязывающей полости на гидрофильные остатки, такие как аспарагин, явно не вызывала сдвига ДНК под действием ScoMcrA-SBD (дополнительный рис.9), что свидетельствует о его критической важности.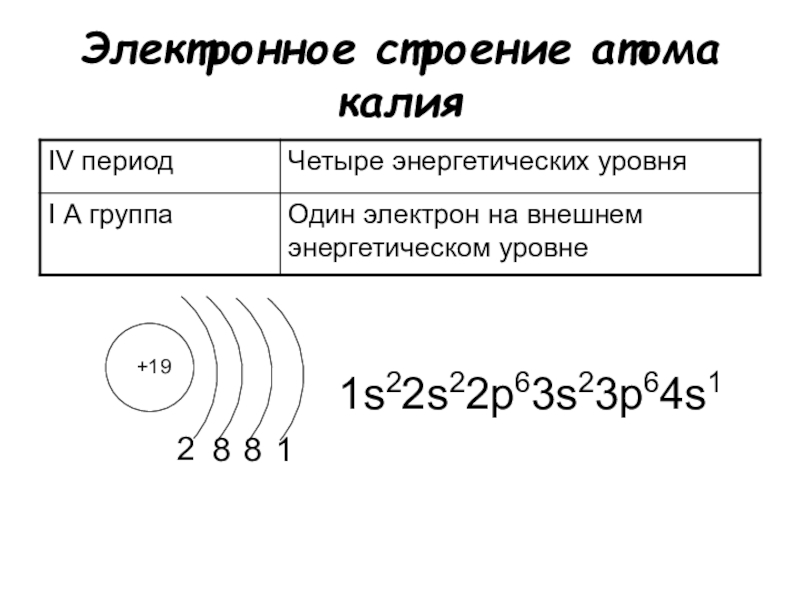 Кроме того, мутация положительно заряженного R117 на нейтральные остатки, такие как аланин или глицин, устраняет его электростатическое взаимодействие с атомом серы в PT-ДНК и приводит к полной потере образования комплекса ScoMcrA-SBD / PT-ДНК. Точечные мутации h216I, Y164I и A168I, которые вводят дополнительные γ-метильные группы в их боковые цепи, создают стерические препятствия между атомом серы PT-ДНК и серосвязывающей полостью SBD и связывания PT-ДНК этих мутантов. снизилось на 94%, 89% и 51% соответственно (рис.2d и дополнительный рис. 9). A168 не так консервативен, как некоторые другие остатки, такие как P165 в гомологах ScoMcrA-SBD (см. Рис. 6a ниже), и он может вносить вклад в связывание PT-ДНК посредством ван-дер-ваальсовых взаимодействий.
Кроме того, мутация положительно заряженного R117 на нейтральные остатки, такие как аланин или глицин, устраняет его электростатическое взаимодействие с атомом серы в PT-ДНК и приводит к полной потере образования комплекса ScoMcrA-SBD / PT-ДНК. Точечные мутации h216I, Y164I и A168I, которые вводят дополнительные γ-метильные группы в их боковые цепи, создают стерические препятствия между атомом серы PT-ДНК и серосвязывающей полостью SBD и связывания PT-ДНК этих мутантов. снизилось на 94%, 89% и 51% соответственно (рис.2d и дополнительный рис. 9). A168 не так консервативен, как некоторые другие остатки, такие как P165 в гомологах ScoMcrA-SBD (см. Рис. 6a ниже), и он может вносить вклад в связывание PT-ДНК посредством ван-дер-ваальсовых взаимодействий.
Аффинности связывания этих мутантов ScoMcrA-SBD и РТ-ДНК также измеряли по поляризации флуоресценции. Было подтверждено, что мутация P165 или R117 существенно нарушила способность ScoMcrA-SBD связывать PT-ДНК, в то время как мутации других остатков, таких как h216, также уменьшали ассоциацию в различной степени (дополнительный рис. 10; поскольку никакая другая аминокислота не имеет такой же связности с основной цепью, как пролин, мутация пролина на другую аминокислоту изменит основу белка SBD и может привести к потере его активности из-за неправильной укладки вместо изменения гидрофобности). Результаты EMSA и флуоресцентного поляризационного анализа показывают, что как гидрофобные, так и электростатические взаимодействия, а также правильная укладка SBD-домена играют решающую роль для серосвязывающей полости ScoMcrA-SBD для распознавания атома серы в PT-ДНК.
10; поскольку никакая другая аминокислота не имеет такой же связности с основной цепью, как пролин, мутация пролина на другую аминокислоту изменит основу белка SBD и может привести к потере его активности из-за неправильной укладки вместо изменения гидрофобности). Результаты EMSA и флуоресцентного поляризационного анализа показывают, что как гидрофобные, так и электростатические взаимодействия, а также правильная укладка SBD-домена играют решающую роль для серосвязывающей полости ScoMcrA-SBD для распознавания атома серы в PT-ДНК.
Петля S
187 RGRR 191 распознает ядерную последовательность G PS GCC ScoMcrA специфически распознает PT-ДНК с основной последовательностью G PS GCC 14 (рис. 1a), которая является одной из четырех известных консенсусных последовательностей PT-ДНК, существующих в бактериях. Наша структура показывает, что кончик петли α9 – α10 ScoMcrA, последовательность которой S 187 RGRR 191 , вставляется в большую бороздку PT-ДНК и обеспечивает специфичные для оснований контакты для ядра G PS GCC. последовательность.В центре этой границы раздела гуанидиновая группа R190 в петле S 187 RGRR 191 образует две водородные связи с атомами O6 G 3 и G 4 G 3 PS G 4 C 5 C 6 / G 6 ‘G 5 ‘ C 4 ‘C 3 ‘ ядерная последовательность (‘обозначает основания на комплементарной цепи). Кроме того, гуанидиниевая группа R191 образует две водородные связи с атомами O6 G 4 и G 5 ‘.Кроме того, гидроксильные группы S187 и Y164 образуют водородные связи с атомом N7 G 5 ‘и атомом N4 C 5 соответственно. Кроме того, атом N4 C 6 образует слабую водородную связь с гидроксильной группой Y164 и электростатическое взаимодействие с карбоксильной группой D160. Наконец, положительно заряженные R109 и R171 образуют электростатические взаимодействия с отрицательно заряженным фосфатом основной цепи PT-ДНК (рис.
последовательность.В центре этой границы раздела гуанидиновая группа R190 в петле S 187 RGRR 191 образует две водородные связи с атомами O6 G 3 и G 4 G 3 PS G 4 C 5 C 6 / G 6 ‘G 5 ‘ C 4 ‘C 3 ‘ ядерная последовательность (‘обозначает основания на комплементарной цепи). Кроме того, гуанидиниевая группа R191 образует две водородные связи с атомами O6 G 4 и G 5 ‘.Кроме того, гидроксильные группы S187 и Y164 образуют водородные связи с атомом N7 G 5 ‘и атомом N4 C 5 соответственно. Кроме того, атом N4 C 6 образует слабую водородную связь с гидроксильной группой Y164 и электростатическое взаимодействие с карбоксильной группой D160. Наконец, положительно заряженные R109 и R171 образуют электростатические взаимодействия с отрицательно заряженным фосфатом основной цепи PT-ДНК (рис. 2c, дополнительные рисунки 11 и 12).Водородные связи Y164 с N4 атомов C 5 и N4 атомов C 6 могут способствовать переворачиванию гидроксифенильной группы Y164 и открытию связывающего серу кармана ScoMcrA-SBD. Важность Y164 для распознавания коровой последовательности G PS GCC согласуется с тем фактом, что он не является хорошо консервативным в гомологах ScoMcrA-SBD, поскольку различные мотивы коровой последовательности PT-ДНК потребуют различных соответствующих остатков для связывания.
2c, дополнительные рисунки 11 и 12).Водородные связи Y164 с N4 атомов C 5 и N4 атомов C 6 могут способствовать переворачиванию гидроксифенильной группы Y164 и открытию связывающего серу кармана ScoMcrA-SBD. Важность Y164 для распознавания коровой последовательности G PS GCC согласуется с тем фактом, что он не является хорошо консервативным в гомологах ScoMcrA-SBD, поскольку различные мотивы коровой последовательности PT-ДНК потребуют различных соответствующих остатков для связывания.
В соответствии с этими структурными наблюдениями, замена R190 или R191 на аланин вызвала уменьшение ассоциации между ScoMcrA-SBD и PT-ДНК на 82% или 72% соответственно, а двойная мутация R190A / R191A полностью исключила образование комплекса между ScoMcrA-SBD и PT-ДНК (рис.2d и дополнительный рисунок 9), которые были подтверждены анализом поляризации флуоресценции (дополнительный рисунок 10). Кроме того, одноточечная мутация Y164 в фенилаланин привела к 65% потере образования комплекса между ScoMcrA-SBD и PT-ДНК, а замена S187 на аланин снизила аффинность связывания ScoMcrA-SBD с PT-ДНК на 38%. (Рис. 2d и Дополнительный Рис. 9).
(Рис. 2d и Дополнительный Рис. 9).
Связывание PT-ДНК вызывает конформационное изменение ScoMcrA-SBD
Сравнение структур ScoMcrA-SBD в свободном и связанном с PT-ДНК состояниях показало, что связывание PT-ДНК индуцирует вращение боковой цепи Y164 в серной -связочная полость ScoMcrA-SBD.Когда Y164 не находится в комплексе с PT-ДНК, он гибок и имеет множество конформаций. Из шести молекул ScoMcrA в асимметричной единице только две имеют четко наблюдаемые концентрации электронов для боковой цепи Y164, и обе находятся в закрытых состояниях (дополнительный рис. 13). В этих двух молекулах гидрофобное фенильное кольцо боковой цепи Y164 закрывает отверстие неполярной серосвязывающей полости (рис. 3а и дополнительный рис. 14а). У остальных четырех молекул ScoMcrA отсутствуют четко наблюдаемые концентрации электронов для боковой цепи Y164 (дополнительный рис.13).
Рис. 3 ScoMcrA-SBD претерпевает конформационные изменения при узнавании PT-ДНК. a В несвязанном PT-ДНК состоянии ScoMcrA-SBD фенильное кольцо боковой цепи ScoMcrA-Y164 покрывает полость для связывания серы. b В состоянии, связанном с PT-ДНК, гидроксифенильная группа Y164 открыта, чтобы позволить атому серы PT-ДНК получить доступ к полости для связывания серы. c Сравнивая состояния РТ-ДНК-связанных и РТ-ДНК-несвязанных ScoMcrA-SBD, гидроксифенильная группа Y164 поворачивается на 98 ° при ассоциации РТ-ДНК. d Ассоциация PT-ДНК также запускает существенное конформационное изменение «петли S 187 RGRR 191 » ScoMcrA-SBD
a В несвязанном PT-ДНК состоянии ScoMcrA-SBD фенильное кольцо боковой цепи ScoMcrA-Y164 покрывает полость для связывания серы. b В состоянии, связанном с PT-ДНК, гидроксифенильная группа Y164 открыта, чтобы позволить атому серы PT-ДНК получить доступ к полости для связывания серы. c Сравнивая состояния РТ-ДНК-связанных и РТ-ДНК-несвязанных ScoMcrA-SBD, гидроксифенильная группа Y164 поворачивается на 98 ° при ассоциации РТ-ДНК. d Ассоциация PT-ДНК также запускает существенное конформационное изменение «петли S 187 RGRR 191 » ScoMcrA-SBD
С другой стороны, при связывании PT-ДНК, гидроксифенильной группы боковая цепь Y164 открыта, позволяя атому серы в PT-ДНК получить доступ к полости ScoMcrA-SBD (рис. 3b и дополнительный рис. 14b). Следовательно, ассоциация с PT-ДНК приводит к повороту гидроксифенильной группы на 98 ° от боковой цепи Y164 (рис. 3c).Это конформационное изменение ScoMcrA-Y164 может быть вызвано либо связыванием ScoMcrA-SBD с атомом серы PT-ДНК, либо связыванием с мотивом GGCC, либо оба могут вносить свой вклад. Петля S 187 RGRR 191 ScoMcrA также претерпевает существенные конформационные изменения, так что она может лучше размещаться в большой бороздке PT-ДНК для распознавания основной последовательности G PS GCC (рис. 3d).
Петля S 187 RGRR 191 ScoMcrA также претерпевает существенные конформационные изменения, так что она может лучше размещаться в большой бороздке PT-ДНК для распознавания основной последовательности G PS GCC (рис. 3d).
Атом серы в PT-ДНК поворачивается на ~ 80 ° при связывании SBD.
Связывание ScoMcrA также приводит к значительному конформационному изменению PT-ДНК.По сравнению с цепью ДНК, которая не контактирует с ScoMcrA-SBD, атом серы в SBD-связанной цепи PT-ДНК повернут вокруг фосфодиэфирного остова на 80 ° наружу, так что он лучше подходит для серы ScoMcrA-SBD. полость переплета (рис. 4а). Это напоминает переворачивание 5-метилцитозина в метилированной ДНК за пределы двойной спирали доменами SRA 18,19,20,21 . Более того, сравнение нашей SBD-связанной структуры PT-ДНК с недавно опубликованной свободной структурой R p PT-ДНК 39 также показывает, что связанный с ScoMcrA-SBD атом серы в PT-ДНК демонстрирует вращение на 83 °. наружу после его распознавания ScoMcrA-SBD (рис.4б).
наружу после его распознавания ScoMcrA-SBD (рис.4б).
Атом серы поворачивается на ~ 80 ° наружу после ассоциации с ScoMcrA-SBD. a Сравнение SBD-связанных и SBD-несвязанных цепей одной и той же молекулы PT-ДНК в структуре ScoMcrA-SBD в комплексе с PT-ДНК. Можно наблюдать вращение атома серы на 80 ° наружу, что делает его более подходящим для размещения серосвязывающей полостью на ScoMcrA-SBD. b Сравнение свободной и связанной SBD РТ-ДНК также показывает, что атом серы поворачивается на 83 ° наружу после его распознавания ScoMcrA-SBD
Гомологи ScoMcrA-SBD широко распространены у прокариот
Поскольку ScoMcrA является единственным идентифицированным белка, который распознает PT-ДНК, мы предположили, могут ли существовать другие ScoMcrA-подобные считыватели PT-ДНК.Интересно, что обширный позиционно-специфический повторный поиск BLAST (PSI-BLAST) с использованием последовательности ScoMcrA-SBD показал, что многие белки, обладающие SBD-гомологичными доменами, широко присутствуют среди прокариот. Было обнаружено, что 1059 секвенированных видов из 14 типов бактерий обладают доменами SBD, включая более распространенные типы, такие как протеобактерии, актинобактерии, бактероиды, фирмикуты и цианобактерии, а также менее известные, включая хлорофлекси, планктомицеты, веррукомикробию и др. acidobacteria, nitrospirae, deinococcus-thermus, rhodothermaeota, balneolaeota и lentisphaerae (рис.5 и дополнительная таблица 2). В некоторых хорошо известных отрядах, таких как streptomycetales, enterobacterales и vibrionales, гомологи ScoMcrA-SBD обнаруживаются даже у более чем 25% секвенированных видов (рис. 5).
Было обнаружено, что 1059 секвенированных видов из 14 типов бактерий обладают доменами SBD, включая более распространенные типы, такие как протеобактерии, актинобактерии, бактероиды, фирмикуты и цианобактерии, а также менее известные, включая хлорофлекси, планктомицеты, веррукомикробию и др. acidobacteria, nitrospirae, deinococcus-thermus, rhodothermaeota, balneolaeota и lentisphaerae (рис.5 и дополнительная таблица 2). В некоторых хорошо известных отрядах, таких как streptomycetales, enterobacterales и vibrionales, гомологи ScoMcrA-SBD обнаруживаются даже у более чем 25% секвенированных видов (рис. 5).
Филогенетическое дерево прокариотических гомологов ScoMcrA-SBD. Два числа после каждого типа / класса / порядка представляют количество видов, обладающих гомологами ScoMcrA-SBD, и тех, чьи геномы были секвенированы. Была указана частота встречаемости гомологов ScoMcrA-SBD, которую рассчитывали путем деления количества видов, обладающих гомологами ScoMcrA-SBD, на количество секвенированных видов для различных типов / классов / порядков в царстве бактерий. Подробности см. В дополнительной таблице 2
Подробности см. В дополнительной таблице 2
Выравнивание последовательностей этих предполагаемых доменов SBD показывает, что некоторые из распознающих серу остатков ScoMcrA-SBD, такие как P165 и h216, являются наиболее консервативными (рис. 6а, дополнительный рис. 15а и дополнительный Таблица 3). R117, положительно заряженный остаток, образующий электростатическое взаимодействие с атомом серы в PT-ДНК, заменен таким же положительно заряженным лизином в большинстве гомологов SBD (дополнительный рис. 15a). Предположительно, эти гомологи SBD используют лизины в этом положении для образования электростатического взаимодействия с серой PT-ДНК.В подтверждение этого наблюдения точечная мутация R117K не оказывала заметного влияния на аффинность связывания между ScoMcrA-SBD и PT-ДНК, как измерено в анализах поляризации флуоресценции (дополнительный рис. 15b). С другой стороны, мутация R117Q уменьшала ассоциацию между ScoMcrA-SBD и PT-ДНК, предположительно потому, что глутамин не так положительно заряжен, как аргинин и лизин (дополнительный рис. 15b).
15b).
Среди остатков в серосвязывающем кармане Y164 уникален тем, что он играет две роли: использование своей β-метиленовой группы для формирования ван-дер-ваальсова взаимодействия с атомом серы и использование своей гидроксильной группы для образования водородных связей с атомом серы. Атом N7 в G 5 ‘и атом N4 в C 5 .Последовательности PT-ДНК у других бактерий обладают консенсусными мотивами, отличными от G PS GCC / G PS GCC, поэтому неудивительно, что Y164 консервативен только в подмножестве гомологов SBD (7 из 23 гомологов SBD на дополнительном рис. 15а). Скорее всего, гомологи SBD у бактерий, содержащих ядерные последовательности G PS AAC / G PS TTC, G PS ATC / G PS ATC и C PS CA, используют остатки, отличные от тирозина в этом положении до распознают эти консенсусные последовательности PT-ДНК.Интересно, что мутация Y164M усилила связывание между ScoMcrA-SBD и PT-ДНК (дополнительный рис. 15b), предположительно потому, что гидрофобность метионина не меньше, чем у тирозина, и метионин также обладает значительной конформационной гибкостью.
15b), предположительно потому, что гидрофобность метионина не меньше, чем у тирозина, и метионин также обладает значительной конформационной гибкостью.
A168 способствует ассоциации с PT-ДНК, используя свою β-метильную группу для гидрофобного взаимодействия с атомом серы PT-ДНК. Другие аминокислоты могут заменять аланин в этом положении, поскольку они содержат β-метиленовые группы, которые могут функционировать таким же образом.Поэтому неудивительно, что A168 не так консервативен, как другие серосвязывающие остатки (дополнительный рис. 15a), и мутации A168 в другие остатки, такие как A168H или A168R в ScoMcrA-SBD, существенно не снижали его аффинность связывания с PT-ДНК (дополнительный рис. 15b).
Помимо этих остатков, существуют другие высококонсервативные остатки ScoMcrA-SBD, включая P118, V119, L120, L121, F166, W167, L169 и W175 (фиг. 6a и дополнительный фиг. 15a). Эти остатки не вносят вклад во взаимодействие между ScoMcrA-SBD и PT-ДНК, но участвуют в формировании гидрофобного ядра домена ScoMcrA-SBD (дополнительный рис. 16). Предположительно, мутации этих остатков могут нарушить укладку домена ScoMcrA-SBD, что может объяснить их высокую консервативность среди гомологов.
16). Предположительно, мутации этих остатков могут нарушить укладку домена ScoMcrA-SBD, что может объяснить их высокую консервативность среди гомологов.
SBD-гомологичные домены могут функционировать для распознавания PT-ДНК. a Множественное выравнивание последовательностей репрезентативных гомологов ScoMcrA-SBD из Streptomyces coelicolor (# 1), Streptomyces gancidicus (# 2), Escherichia coli (# 3) и Morganella morganii) (# 2).Остатки, распознающие серу, выделены желтым цветом. Согласованная последовательность показана внизу. Справа: доменные организации этих гомологов ScoMcrA. b Поверхность ScoMcrA-SBD окрашена в соответствии с оценками консервации, что свидетельствует о высокой сохранности его распознающей серу полости. c Очищенные гомологи домена ScoMcrA-SBD из Streptomyces gancidicus (# 2), Escherichia coli (# 3) и Morganella morganii (# 4), специфически распознающих PT-ДНК с атомом серы в R p , но не в конфигурации S p . d Мутация P482N в гомологе Escherichia coli SBD значительно уменьшилась, в то время как мутация P607N в гомологе SBD Streptomyces gancidicus нарушена, ассоциация с PT-ДНК с основной последовательностью G PS AAC. e Гетерологичная экспрессия гомологов scomcrA из S. gancidicus (№ 2), E. coli (№ 3) и M. morganii (№ 4) ограниченный перенос кластера генов dnd из Salmonella enterica , который содержит гены, кодирующие «писательские» белки фосфоротиоата ДНК.Частоты трансформации пустого вектора pBluescript (PT — ) и вектора, несущего кластер генов dnd (PT + ), в E. coli Dh20B, экспрессирующих различные гомологи scomcrA , показаны
d Мутация P482N в гомологе Escherichia coli SBD значительно уменьшилась, в то время как мутация P607N в гомологе SBD Streptomyces gancidicus нарушена, ассоциация с PT-ДНК с основной последовательностью G PS AAC. e Гетерологичная экспрессия гомологов scomcrA из S. gancidicus (№ 2), E. coli (№ 3) и M. morganii (№ 4) ограниченный перенос кластера генов dnd из Salmonella enterica , который содержит гены, кодирующие «писательские» белки фосфоротиоата ДНК.Частоты трансформации пустого вектора pBluescript (PT — ) и вектора, несущего кластер генов dnd (PT + ), в E. coli Dh20B, экспрессирующих различные гомологи scomcrA , показаны
Напротив, остатки ScoMcrA -SBD-опосредованные специфичные к основанию G PS Контакты ядерной последовательности GCC, такие как S187, R190 и R191, демонстрируют более высокий уровень дисперсии последовательностей. Картирование сохранения последовательности на поверхности структуры ScoMcrA-SBD показывает, что полость, связывающая серу, является наиболее консервативной областью, что также подчеркивает ее функциональную важность.Примечательно, что другие части поверхности ScoMcrA-SBD не обнаруживают сравнимого уровня сохранения (рис. 6b). Следовательно, гомологи ScoMcrA-SBD предположительно также используют серосвязывающую полость, содержащую остатки, эквивалентные P165 / h216 / R117 / Y164, для распознавания атома серы R p в PT-ДНК.
Картирование сохранения последовательности на поверхности структуры ScoMcrA-SBD показывает, что полость, связывающая серу, является наиболее консервативной областью, что также подчеркивает ее функциональную важность.Примечательно, что другие части поверхности ScoMcrA-SBD не обнаруживают сравнимого уровня сохранения (рис. 6b). Следовательно, гомологи ScoMcrA-SBD предположительно также используют серосвязывающую полость, содержащую остатки, эквивалентные P165 / h216 / R117 / Y164, для распознавания атома серы R p в PT-ДНК.
Гомологи SBD связывают PT-ДНК и ограничивают перенос генов
Последовательности гомологов ScoMcrA-SBD, обнаруженные с помощью поиска BLAST, очень похожи на таковые для ScoMcrA-SBD, особенно для распознающих серу остатков P165, Y164, h216, и R117 (рис.6a, дополнительный рисунок 15a и дополнительная таблица 3). Чтобы исследовать, действительно ли эти гомологи ScoMcrA-SBD могут связывать PT-ДНК, мы выбрали три гомолога SBD из Streptomyces gancidicus , E. coli и Morganella morganii . ScoMcrA происходит от S. coelicolor , который принадлежит к филюму актинобактерий. С другой стороны, как E. coli , так и M. morganii принадлежат к типу протеобактерий, который представляет собой отдельный тип, отличный от филума актинобактерий.Более того, гомологи E. coli и M. morganii отдаленно родственны ScoMcrA (дополнительный рис. 17). Эти три гомолога ScoMcrA-SBD были гетерологично экспрессированы в штамме E. coli BL21 (DE3), очищены и исследованы на их способность взаимодействовать с PT-ДНК с помощью EMSA и анализами поляризации флуоресценции in vitro. Действительно, очищенные белки этих гомологов SBD связывают РТ-ДНК с атомом серы в конфигурации R p , но не S p в контексте последовательности G PS GCC / G PS GCC, G PS AAC / G PS TTC или G PS ATC / G PS ATC.Интересно, что гомолог SBD S.
coli и Morganella morganii . ScoMcrA происходит от S. coelicolor , который принадлежит к филюму актинобактерий. С другой стороны, как E. coli , так и M. morganii принадлежат к типу протеобактерий, который представляет собой отдельный тип, отличный от филума актинобактерий.Более того, гомологи E. coli и M. morganii отдаленно родственны ScoMcrA (дополнительный рис. 17). Эти три гомолога ScoMcrA-SBD были гетерологично экспрессированы в штамме E. coli BL21 (DE3), очищены и исследованы на их способность взаимодействовать с PT-ДНК с помощью EMSA и анализами поляризации флуоресценции in vitro. Действительно, очищенные белки этих гомологов SBD связывают РТ-ДНК с атомом серы в конфигурации R p , но не S p в контексте последовательности G PS GCC / G PS GCC, G PS AAC / G PS TTC или G PS ATC / G PS ATC.Интересно, что гомолог SBD S. gancidicus давал только одну сдвинутую полосу с РТ-ДНК на геле, тогда как гомологи E. coli и M. morganii SBD образовывали две сдвинутые полосы с РТ-ДНК. Это указывает на то, что они могут взаимодействовать с палиндромной PT-ДНК с образованием гетеродимерных комплексов один белок плюс одна ДНК или гетеротримерных комплексов два белка плюс одна ДНК (рис. 6c, дополнительный рис. 28). Кроме того, гомологи S. gancidicus и E. coli SBD в равной степени связаны с G PS GCC / G PS GCC, G PS AAC / G PS TTC и G PS ATC / G PS ATC, тогда как M.morganii Гомолог SBD более сильно взаимодействовал с G PS GCC / G PS GCC (фиг. 5d), что позволяет предположить, что разные гомологи SBD обладают различной специфичностью связывания PT-ДНК. Мутация критических остатков пролина, соответствующих ScoMcrA-P165, устраняет или значительно снижает ассоциацию гомологов SBD из E.
gancidicus давал только одну сдвинутую полосу с РТ-ДНК на геле, тогда как гомологи E. coli и M. morganii SBD образовывали две сдвинутые полосы с РТ-ДНК. Это указывает на то, что они могут взаимодействовать с палиндромной PT-ДНК с образованием гетеродимерных комплексов один белок плюс одна ДНК или гетеротримерных комплексов два белка плюс одна ДНК (рис. 6c, дополнительный рис. 28). Кроме того, гомологи S. gancidicus и E. coli SBD в равной степени связаны с G PS GCC / G PS GCC, G PS AAC / G PS TTC и G PS ATC / G PS ATC, тогда как M.morganii Гомолог SBD более сильно взаимодействовал с G PS GCC / G PS GCC (фиг. 5d), что позволяет предположить, что разные гомологи SBD обладают различной специфичностью связывания PT-ДНК. Мутация критических остатков пролина, соответствующих ScoMcrA-P165, устраняет или значительно снижает ассоциацию гомологов SBD из E. coli и S. gancidicus с РТ-ДНК, как показано с помощью флуоресцентных поляризационных анализов (рис. 6d). .
coli и S. gancidicus с РТ-ДНК, как показано с помощью флуоресцентных поляризационных анализов (рис. 6d). .
В качестве дополнительного функционального анализа in vivo мы исследовали способность гетерологически экспрессируемых гомологов SBD ограничивать перенос кластера генов dnd из серовара Cerro 87 Salmonella enterica .Он содержит записывающие гены G PS AAC / G PS TTC фосфоротиоатной модификации в ДНК, dndA через dndE 40,41,42,43 . Эффективность трансформации кластера генов dnd в хозяина, экспрессирующего гомолог SBD из S. gancidicus или E. coli , значительно снизилась в 1000 раз по сравнению с контрольным вектором, в то время как эффективность трансформации в 10 раз снизилась. кластер гена dnd в хозяина, несущего M.morganii SBD гомолог (фиг. 6e). Таким образом, наши исследования in vivo и in vitro подтверждают гипотезу о том, что эти прокариотические гомологи ScoMcrA-SBD специфически распознают PT-ДНК.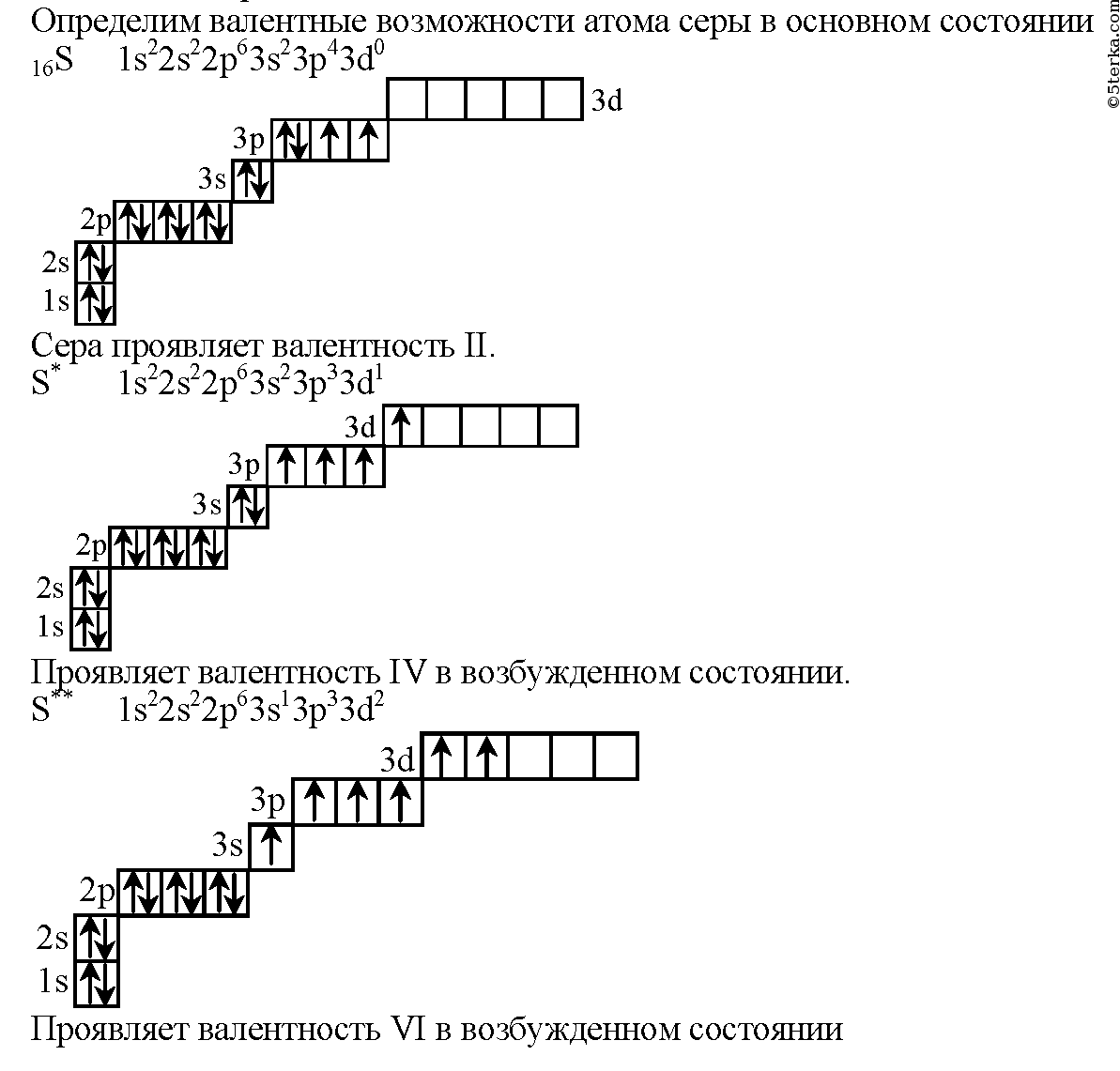
Какие резонансные структуры у СО_2?
Диоксид серы , или # SO_2 #, имеет две резонансные структуры, которые в равной степени вносят вклад в общую гибридную структуру молекулы. Однако для # SO_2 # можно нарисовать третью структуру Льюиса, которая более устойчива в теории, но не совсем соответствует экспериментальным данным.
Нарисуем первые две структуры Льюиса для # SO_2 #. Общее количество валентных электронов, имеющихся в нашем распоряжении, составляет 18 — 6 от серы и по 6 от каждого из двух атомов кислорода.
Первые две структуры Льюиса, которые можно нарисовать для # SO_2 #, будут
.Учитываются все 18 валентных электронов — 6 электронов из 3 связей и 10 электронов, распределенных в виде неподеленных пар на трех атомах. Здесь следует отметить несколько важных моментов.
Эти две резонансные структуры эквивалентны и будут вносить равный вклад в гибридную структуру.Обе структуры имеют формальные заряды — отрицательный формальный заряд помещен на более электроотрицательный атом — кислород, а положительный заряд — на серу, менее электроотрицательную из двух атомов.
В этом случае фактическая структура будет гибридом, который будет выглядеть так
Отрицательный заряд будет разделен на два атома кислорода. Заряды на атомах составляют # «+ 1,4» # для серы и # «- 0,7» # для каждого атома кислорода.
Еще одна структура Льюиса, которую можно нарисовать для # SO_2 #, — это
На этот раз формальных зарядов нет — каждому атому кислорода нужно 6 электронов и он получает 6 электронов, то же самое верно и для серы.Поскольку сера имеет доступ к своим 3d-орбиталям , она вполне способна расширить свой октет, чтобы разместить 10 электронов вместо 8.
Итак, теоретически эта структура была бы более стабильной, чем две предыдущие, на основании того факта, что она имеет больше ковалентных связей и не имеет формальных зарядов ни на одном из атомов.
Однако, как я уже сказал, экспериментальные данные указывают на гибридную модель; частичные заряды на всех атомах будут присутствовать, и двойные связи молекулы также имеют характер одинарной связи.
 = 113°C;
= 113°C;  И.Менделеева.
И.Менделеева.


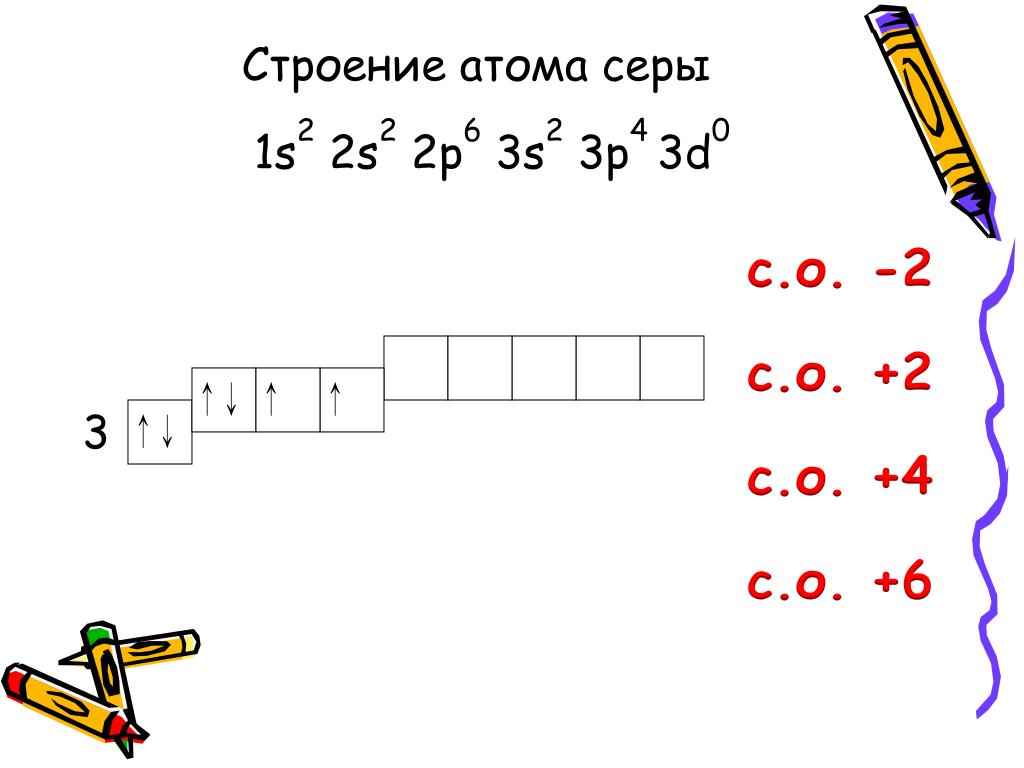 Около VIII в. китайцы стали использовать её в пиротехнических смесях, в частности, в смеси типа пороха . Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что её считали «принципом горючести» и обязательной составной частью металлических руд.Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, ещё в древнем Египте. В период арабской алхимии возникла состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трёх принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона . Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси. Впервые в литературе он описан у Агриколы .
Около VIII в. китайцы стали использовать её в пиротехнических смесях, в частности, в смеси типа пороха . Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что её считали «принципом горючести» и обязательной составной частью металлических руд.Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, ещё в древнем Египте. В период арабской алхимии возникла состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трёх принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона . Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси. Впервые в литературе он описан у Агриколы . Таким образом, точное время открытия серы не установлено, но, как сказано выше, этот элемент использовался до нашей эры, а значит, знаком людям с древнейших времён.
Таким образом, точное время открытия серы не установлено, но, как сказано выше, этот элемент использовался до нашей эры, а значит, знаком людям с древнейших времён.
 Физические свойства, аллотропия
Физические свойства, аллотропия 
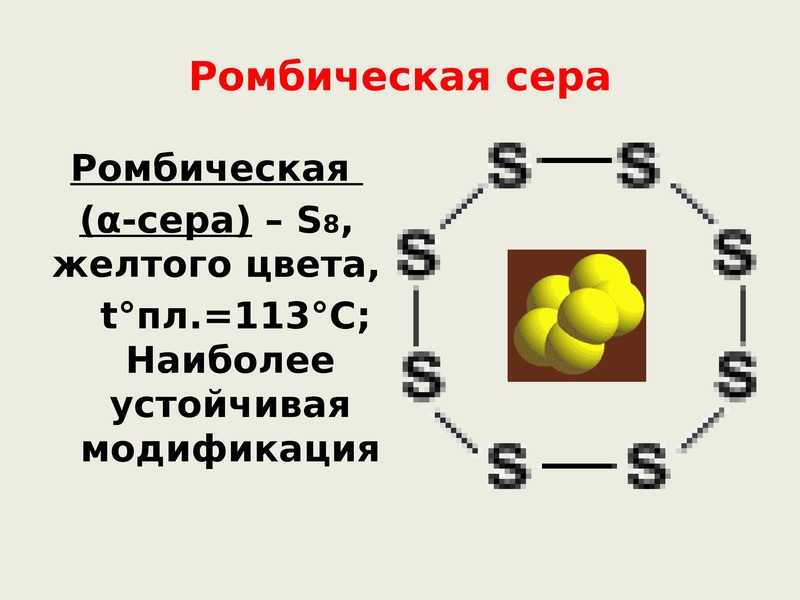
 Т.е. вы
будете думать, решать, обобщать, поэтому
пытайтесь, осмеливайтесь делать то,
чего ещё никто не пытался делать до
вас.
Т.е. вы
будете думать, решать, обобщать, поэтому
пытайтесь, осмеливайтесь делать то,
чего ещё никто не пытался делать до
вас. _____ абзац _____________
_____ абзац _____________