Применение электролитов » Primelab | Производство лабораторного и аналитического оборудования
Основные свойства
Обычная вода и многие другие вещества не способны проводить ток. Растворы становятся токопроводимыми, только если вещества могут распадаться на ионы. В отличие от металлов электролиты называют проводниками второго порядка. Ими могут выступать некоторые кристаллы и расплавы, например иодид серебра, диоксид циркония.
Основным свойством электролитов является возможность электролитической диссоциации, представляющей собой процесс распада молекул при взаимодействии с водой, другими растворителями. В результате распада появляются заряженные ионы.
В зависимости от типа образующихся ионов различают такие электролиты:
- щелочные,
- кислотные,
- солевые.
В щелочных электропроводимость обеспечивается ионами ОН и металлов. В кислотных – ионами Н+, а также остатками оснований кислот. Процесс диссоциации зависит от таких факторов:
- концентрации веществ,
- выбора растворителя,
- температуры.

- растворимые соли,
- сильные кислоты,
- щелочи.
Если говорить об аккумуляторах, то для них важна плотность токопроводящих сред. Она определяет емкость батарей и срок их службы.
Возможности для применения
В основном применение электролитов распространено в промышленности. С их помощью изготавливают источники тока разного назначения. Это могут быть автомобильные аккумуляторы и различные виды батарей. Для них используются щелочные вещества, проводящие ток.
Аналитическая практика предполагает использование ионометров и рН-метров, которые заполнены солевыми веществами, проводящими ток. Приборы применяют для измерения кислотности среды, концентрации определенных веществ.
Если говорить об электрохимической индустрии, то многие растворы для гальванирования металлов создаются на основе веществ, способных к диссоциации. Также они применяются в биологии и медицине. Многие диагностические методы построены на анализе кислотно-щелочного и водно-солевого балансов. Применение электролитов довольно разнообразно, как и их составы.
Многие диагностические методы построены на анализе кислотно-щелочного и водно-солевого балансов. Применение электролитов довольно разнообразно, как и их составы.
К достоинствам аккумуляторов, построенных на щелочных веществах, способных к диссоциации, относят:
- длительный срок службы;
- надежность;
- меньшее количество токсичных веществ, выделяемых в процессе работы;
- возможность использования в широком температурном диапазоне;
- неприхотливость;
- меньшая масса в сравнении с кислотными.
Если говорить об автомобильной индустрии, в ней являются востребованными кислотные аккумуляторы. К их непосредственным преимуществам относятся:
- простое и отработанное обслуживание;
- низкий саморазряд;
- приемлемая стоимость;
- способность давать высокий ток при старте.
Основные меры предосторожности
Все популярные вещества, способные проводить ток, созданы на основе щелочи или серной кислоты. Они могут стать причиной ожога, поэтому при обращении с ними важно предпринимать меры предосторожности. Среди правил обращения с такими опасными веществами главными являются следующие:
Они могут стать причиной ожога, поэтому при обращении с ними важно предпринимать меры предосторожности. Среди правил обращения с такими опасными веществами главными являются следующие:
- наличие в помещении нейтрализующих веществ, воды, аптечки;
- для нейтрализации кислотного ожога необходим раствор соды, используется одна чайная ложка на стакан воды;
- для нейтрализации щелочных ожогов применяется раствор борной кислоты, берется чайная ложка на стакан воды;
- если агрессивное вещество попало в глаза, для его нейтрализации применяются растворы в два раза слабее;
- если произошел ожог, сначала используется нейтрализующее вещество, а потом вода.
Важно при работе соблюдать все правила техники безопасности, чтобы избежать ожогов. Основные из них:
- кислоту необходимо наливать в воду и ни в коем случае не наоборот;
- при работе с твердой щелочью ее необходимо опускать в воду при помощи щипцов;
- хранение в одном помещении или работа одновременно с кислотными и щелочными веществами запрещена.

Если при выполнении работ предполагается кипение вещества, оно будет сопровождаться выделением взрывоопасного и горючего газа – водорода. Соответственно, в помещении необходимо предусмотреть его отвод, взрывобезопасную проводку, защитить все электроприборы.
Хранение опасных веществ организовывают в пластиковых емкостях. Для работы с ними подходит фарфоровая, керамическая и стеклянная посуда.
Электролиты свойства — Справочник химика 21
Равновесие в системе осадок — раствор. Произведение растворимости. Образование осадков и их растворение. Правило Бертолле в свете теории электролитической диссоц иации. Реакции между ионами в растворах. Нейтрализация. Гидролиз и его частные случаи. Амфотерные электролиты. Свойства гидроокисей и величины радиуса и заряда положительного иона. [c.115]Поведение кислот и оснований в некоторых растворителях. Сила кислот и оснований в среде различных растворителей прежде всего определяется природой самого растворенного электролита.
 Свойства и структура электролита определяют величину константы диссоциации данного электролита в избранном растворителе. Относительная сила электролитов одной и той же природной группы (например, карбоновые кислоты) в различных растворителях в большинстве случаев сохраняется, и соотношение рК в данном растворителе к рК в воде или к р/другом растворителе выражается линейной функцией.
Свойства и структура электролита определяют величину константы диссоциации данного электролита в избранном растворителе. Относительная сила электролитов одной и той же природной группы (например, карбоновые кислоты) в различных растворителях в большинстве случаев сохраняется, и соотношение рК в данном растворителе к рК в воде или к р/другом растворителе выражается линейной функцией. В растворах сильных электролитов наблюдается высокая ионная концентрация, из-за чего промежутки между ионами невелики и большое значение приобретают силы межионного взаимодействия. В результате такого взаимодействия движение ионов в большинстве случаев тормозится и тогда создается впечатление о неполной диссоциации электролитов. Свойства растворов сильных электролитов описываются специальной теорией активности. При упрощенном рассмотрении вопроса пользуются иногда представлением о кажущейся степени диссоциации сильных электролитов. [c.115]
Таким образом, при изучении механизма мембранного разделения необходимо учитывать степень сродства разделяемого раствора и материала мембраны например, при разделении водных растворов электролитов — свойства воды в ацетатцеллюлозной мембране.
Сильные и слабые электролиты. Свойства растворов слабых электролитов. По способности к диссоциации электролиты разделяются на сильные и слабые. [c.387]
Другой класс электролитов, называемых сильными, характеризуется тем, что поведение их растворов не подчиняется простым соотношениям, которые были описаны выше и справедливы лишь для слабых электролитов. Как будет показано дальше, по существу сильные электролиты полностью диссоциированы. В случае слабых электролитов свойства растворов определяются равновесием диссоциации молекул, а не взаимодействием ионов друг с другом. Наоборот, в растворах сильных электролитов, где а равна единице, физика явления определяется электростатическим взаимодействием между ионами. [c.147]
ЭЛЕКТРОЛИТЫ. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Электропроводность электролитов (электрическая проводимость электролитов) — свойство водных растворов электролитов или их расплавов проводить электрический ток при приложении электрического напряжения. [c.362]
[c.362]
Обзоры данных об электропроводности растворов электролитов. Свойства кислот и оснований, дифференцирующее действие растворителей на силу солей. [c.583]
Как показали опыты, неравномерность покрытия по толщине зависит от режима осаждения и от состава электролита. Свойство электролита способствовать образованию равномерного по толщине покрытия на различных участках рельефного ка- [c.110]
Если требуется электролитическим способом получать тонкие и равномерные по толщине покрытия, кроющая способность электролита (свойство электролита способствовать отложению на поверхности изделий сплошных металлических осадков) приобретает весьма важное значение. [c.117]
При контакте двух конденсированных фаз (например, металла и раствора электролита) свойства поверхностного слоя каждой фазы под воздействием второй фазы изменяются. Совокупность двух поверхностных слоев три контакте конденсированных фаз называют межфазным слоем. [c.222]
[c.222]
Для изготовления керамических изделий методом литья необходимо точно знать литейные свойства шликера и в первую очередь их подвижность или степень текучести. Текучесть шликера зависит от соотношения между количеством твердых и жидких компонентов массы, количества введенного электролита, свойств глины и ряда других факторов. [c.376]
Для тех электролитов, свойства которых были нами теоретически исследованы, преимущественно галогенидов и нитратов щелочных металлов, не потребовалось привлечения представлений о неполной диссоциации электролитов или об образовании ионных пар и ассоциатов для объяснения свойств водных растворов этих электролитов. В других случаях это может оказаться необходимым, причем аналитически эти явления следует учесть примерно так, как это было показано выше в формулах (2) и (21).
Природа электролита (свойства электролита). Взаимодействие цинка с равными объемами кислот одинаковой молярной концентрации идет с разными скоростями. Реакция взаимодействия цинка с соляной кислотой протекает бурно и значительно быстрее, чем с уксусной кислотой, так как последняя образует гораздо меньше ионов [c.203]
Реакция взаимодействия цинка с соляной кислотой протекает бурно и значительно быстрее, чем с уксусной кислотой, так как последняя образует гораздо меньше ионов [c.203]
Степень равномерности распределения выделяемого металла на поверхности катода зависит в значительной степени от характера электролита. Свойство электролита давать при катодном выделении металла равномерный по толщине осадок зависит от рассеивающейся способности этого электролита, а свойство покрывать имеющиеся на катоде углубления — от его кроющей способности. [c.202]
На основании новой теории представляется целесообразным различать у сильных электролитов свойства первого и второго рода (Эберт, loe. it.). [c.136]
Теория электролитической диссоциации Аррениуса объяснила различие в поведении неэлектролитов и электролитов увеличением числа частиц в последних, вследствие диссоциации растворенного вещества на ионы. Этим, в частности, обусловлены более значительные изменения в электролитах свойств, связанных с понижением давления пара растворителя (понижение температуры замерзания, повышение температуры кипения растворов и др. ), а также ионная электропроводность. На основе теории электролитической диссоциации получили объяснение многие другие свойства электролитов (кислые и основные свойства растворов, цвет растворов электролитов и. др.).
), а также ионная электропроводность. На основе теории электролитической диссоциации получили объяснение многие другие свойства электролитов (кислые и основные свойства растворов, цвет растворов электролитов и. др.).
В различных производственных и биологических процессах большую роль играют растворы электролитов. Свойства этих растворов объясняет теория электролитической диссоциации. Знание теории электролитической диссоциации является основой для изучения свойств неорганических и органических соединений, для глубокого понимания механизмов химических реакций в растворах электролитов. [c.189]
Кислоты, основания и большинство солей являются электролитами. Свойства ионов резко отличаются от свойств атомов соответствующих элементов. Ионы обладают зарядом и поэтому передвигаются в электрическом поле. Растворы электролитов проводят электрический ток благодаря тому, что ионы, разряжаясь на электродах, осуществляют перенос ионов от катода к аноду (рис.
Специфичность ионных расплавов заключается в зависимости выхода по току не только от таких факторов, как природа электролита, свойства выделяющихся на электродах продуктов, плотность тока, расстояние между электродами, перемешивание, температура, но и от анодного эффекта, а также растворимости металлов в электролите. [c.123]
В неводных средах и особенно в инертных растворителях стеклянные электроды даже одного и того же образца могут проявлять разные свойства. Эффективность выбранных электродов не всегда удается регулировать или улучшить, вводя вспомогательные электролиты. Свойства электрода сильно зависят от его предварительной обработки. Но, конечно, невозможно знать предысторию каждого стеклянного электрода. В большинстве случаев, однако, электрод перед употреблением оставляют набухать на 12—48 час в растворителе, в котором предполагается его использовать [894]. Эта процедура также необходима для проведения относительных потенциометрических измерений.
Вытеснение воды с поверхности металла Е2, Ез, Ет Ед, Ец Ещ 1. з>- 1в 2. Ей(Ег, Ет, Ез)>-Ец 3. ( 14— 5, Ею, Еп)>Еи Поверхностное натяжение на границе с водой, краевые углы смачивания, вытеснение электролита Свойства в системе металл — электролит — ПИНС (ФСз), водовытесняющие свойства (ДФС ) быстродействие (ДФС8) [c. 54]
54]
Свойства расгворов электролитов — свойства ионов [c.14]
СВОЙСТВА ИОНОВ. ОВЩИЕ СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ — СВОЙСТВА ИОНОЗ [c.123]
Теория ассоциации ионов была развита главным образом в связи с необходимостью объяснить открытое И. А. Каблуковым явление аномальной электропроводности растворов электролитов. Свойства ионов в теории ионной ассоциащш предполагаются такими же, как и в теорип Дебая—Хюккеля. [c.432]
Полная обменная емкость И. с. определяется общим количеством всех активных групп ионита, вступающих в реакцию ионного обмена. Значение этой величины всегда постоянно для данного образца И. с. Значение обменной емкости по определенным активным группам, как и полной обменной емкости, постоянно для каждого образца И. с. Экспериментально его определяют по перегибу кривых потенциометрич. титрования И. с. (рис. 2). Значение равновесной обменной емкости ионита 1гепостоянно и зависит от pH среды, концентрации р-ра электролита, свойств обменивающихся ионов и др.
Катодные осадки металлов существенно различаются по своей структуре в зависимости от условий элетролиза, свойств электролита, свойств самого металла и т. д. Гладкие и плотные, мелкокристаллические отложения металлов группы железа получаются из растворов их простых солей, для цинка, меди, серебра, кадмия и т. д.—из крмплексных растворов шероховатые, крупнокристаллические осадки обычны для меди, цинка, кадмия и других металлов при электролизе из простых солей иглистые, разветвленные осадки характерны, например, для серебра при электролизе азотнокислых растворов, свинца и олова — при электролизе хлоридов и т. д. Ветвистые, иглистые, так называемые дендритообразные осадки часто растут по краям катодов (где плотность тока повышена), они легко валут к коротким замыканиям между электродами. [c.154]
Как подчеркивает Микулин, для электролитов, свойства которых были им теоретически исследованы, преимущественно галогенидов и нитратов щелочных металлов, не потребовалось привлечения представлений о неполной диссоциациг электролитов или об образовании ионных пар и ассоциатов для объяснения свойств водных растворов этих электролитов (вплоть до самых концентрированных из исследо ванных растворов,— см. выше). Отсутствие ассоциатов в растворах указанных солей подразумевается и в теории Робинсона и Стокса. [c.21]
выше). Отсутствие ассоциатов в растворах указанных солей подразумевается и в теории Робинсона и Стокса. [c.21]
Приборы для определения рассеивающей способности и удельной электропроводимости электролитов. Свойство электролита способствовать равномерному отложению металла на поверхности покрываемых предметов называется рассеивающей способностью. Для измерения рассеивающей способности электролита можно пользоваться электролизером размером 120x100x300 мм. Аноды размером 120Х 100×5 мм устанавливают у торцовых стенок ванны. Катод состоит из десяти латунных или стальных втулок, насаженных на латунный стержень. Крайние втулки и концы стержня имеют резьбу для более плотного соединения торцовых поверхностей втулок. С целью экранирования торцовых поверхностей крайних втулок на концы стержня навинчивают круглые эбонитовые гайки. Для увеличения степени рельефности катода между центральными втулками зажимают латунный диск. [c.264]
Реакции в электролитах протекают мгновенно, и такая большая скорость протекания этих реакций молэлектростатическим притяжением разноименно заряженных ионов, имеющихся в электролитах свойства солей, кислот и щелочей определяются свойствами их ионов, а также тем, что молекулы электролитов диссоциируют в водных растворах только на две части на положительные и отрицательные ионы никаких третьих ионов при электролитической диссоциации не образуется (реакция AgNOa с КСЮз), (опыты 3 и 4). [c.157]
[c.157]
Оксиэтилцеллюлоза некоторых марок растворяется в диметилформамиде, диэтилацетамиде и Ы-ацетилэтаноламине. Окснэтил-целлюлоза обладает хорошей совместимостью в водных растворах с электролитами. Свойства растворов оксиэтилцеллюлозы приведены ниже [c.246]
Наряду с характерными для электролита свойствами и емкостью, в практике имеет также значение изменение объема смолы (называемое также разницей в набухании или дыханием ) при различных состояниях заряжеиности и осмотического давления окружающего раствора. [c.359]
Электролиты и неэлектролиты. Механизм электролитической диссоциации. Свойства растворов электролитов
Модуль состоит из восьми кадров, включающих текст, фотографии, интерактивные схемы классификации и свойств растворов электролитов. В том числе, ученику предлагается просмотреть и прослушать интерактивную схему путем последовательного выбора активных зон для знакомства со свойствами электролитов, просмотреть видеоролик «Свойства растворов электролитов».
Тип: Информационный;
версия: 1.0.0.2 от 24.02.2009
Внимание! Для воспроизведения модуля необходимо установить на компьютере проигрыватель ресурсов.
Категория пользователей
Обучаемый, ПреподавательКласс
11Контактное время
15 минутИнтерактивность
СредняяДисциплины
Химия / Общая химия / Важнейшие понятия и законы химии / Химическая связь / Теория электролитической диссоциации. Свойства растворов электролитов
Свойства растворов электролитов Статус
Завершенный вариант (готовый, окончательный)Тип ИР сферы образования
Информационный модульМесто издания
МоскваЯзык
РусскийКлючевые слова
электролитыАвтор
Издатель
Правообладатель
Морозов Михаил Николаевич
Марийский государственный технический университет
Марийский государственный технический университет ГОУВПО
ГОУВПО «Марийский государственный технический университет»
Россия, 424000, Республика Марий Эл, Йошкар-Ола, Ленина пл. , 3,
, 3,
Сайт — http://www.mmlab.ru
Эл. почта — [email protected]
Федеральное агентство по образованию России
Федеральное агентство по образованию России
Россия, 115998, Москва, Люсиновская ул. , 51
, 51
Характеристики информационного ресурса
Тип используемых данных:
application/xml, image/jpeg, image/png, application/x-shockwave-flash, audio/mpeg, text/htmlОбъем цифрового ИР
6 192 396 байтПроигрыватель
OMS-player версии от 1.0Категория модифицируемости компьютерного ИР
открытыйПризнак платности
бесплатныйНаличие ограничений по использованию
есть ограниченияРубрикация
Ступени образования
Среднее (полное) общее образованиеЦелевое назначение
УчебноеТип ресурса
Открытая образовательная модульная мультимедийная система (ОМС)Классы общеобразовательной школы
11Уровень образовательного стандарта
ФедеральныйХарактер обучения
БазовоеСвойства растворов электролитов
Исследуем
электропроводность уксусной кислоты.
Уксусная кислота – слабый электролит, поэтому электропроводность невысокая. При разбавлении раствора водой электропроводность увеличивается.
Как же изменяется электропроводность раствора при увеличении концентрации? Например, при растворении хлорида натрия в воде ионы двигаются хаотично, при увеличении концентрации раствора ионов становится больше. Движение ионов становится затруднённым, поэтому электропроводность уменьшается.
Свойства электролитов – это свойства образующих их ионов.
А если вещества имеют одни и те же ионы? Сходны ли они по свойствам?
Раствор каждого вещества обладает определёнными свойствами. Обычно, в растворах электролитов преобладают ионы, на которые диссоциируют электролиты, поэтому свойства растворов – это свойства данных ионов.
В растворах кислот всегда присутствуют гидратированные ионы водорода.
Общие свойства
щелочей определяют гидроксид-ионы.
При смешивании щёлочи и кислоты получим соль. Свойства растворов солей обусловлены катионами металлов и анионами кислотных остатков.
Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются только катионы водороды.
Составим уравнение электролитической диссоциации азотной, серной и сернистой кислоты. Азотная и серная кислоты являются сильными электролитами, поэтому они диссоциируют полностью с образованием катионов водорода и анионов кислотных остатков.
Сернистая кислота – двухосновная кислота и является слабым электролитом, поэтому диссоциирует ступенчато.
Число ступеней диссоциации зависит от основности кислоты. У сернистой кислоты будет две ступени диссоциации. Первая ступень диссоциации – отщепление одного иона водорода. На второй ступени диссоциации идёт отщепление иона водорода от сложного гидрокарбоната иона.
Обнаружить ионы
водорода в растворах кислот можно с помощью индикаторов. Лакмус в растворах кислот меняет фиолетовый цвет на красный, метилоранж
оранжевый цвет – на красный.
Лакмус в растворах кислот меняет фиолетовый цвет на красный, метилоранж
оранжевый цвет – на красный.
Кислоты вступают в химические реакции с металлами, стоящими в ряду активности до водорода. Например, в реакции цинка с соляной кислотой образуется соль – хлорид цинка и водород.
Кислоты реагируют с основными оксидами с образованием солей и воды. Так, в реакции серной кислоты с оксидом меди два образуется соль – сульфат меди два и вода.
Кислоты реагируют с основаниями. В реакции соляной кислоты со щёлочью – гидроксидом калия образуется соль – хлорид калия и вода.
В реакции соляной кислоты с гидроксидом меди два образуется соль – хлорид меди два и вода.
Кислоты также реагируют
с солями, образованными более слабыми кислотами. Например, в реакции
соляной кислоты с карбонатом натрия образуется соль – хлорид натрия, углекислый
газ и вода.
Таким образом, свойства кислот обусловлены наличием в их растворах катионов водорода.
Основания – это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Составим уравнение электролитической диссоциации гидроксида калия и гидроксида кальция. Эти вещества являются сильными электролитами и дисоциируют полностью по одной ступени. При диссоциации этих оснований образуются катионы металлов и гидроксид-ионы.
Слабые многокислотные основания диссоциируют ступенчато и число ступеней диссоциации определяется кислотностью слабого основания.
Так, у слабого двухкислотного основания гидроксида железа два две ступени диссоциации. На первой ступени отщепляется один гидроксид-ион, а на второй ступени отщепляется гидроксид-ион от сложного катиона.
Присутствие растворимых оснований – щелочей в растворах обнаруживается при помощи индикаторов.
Фенолфталеин в растворах
щелочей малиновый, лакмус – синий, а метиловый оранжевый – жёлтый.
Щёлочи – активные вещества. Они реагируют с кислотными оксидами. Так, в реакции гидроксида натрия с оксидом углерода четыре образуется соль – карбонат натрия и вода, в реакциях щелочей с кислотами образуется также соль и вода. Например, в реакции гидроксида натрия с соляной кислотой образуется соль – хлорид натрия и вода.
Щёлочи также реагируют с солями. Например, в реакции гидроксида калия с хлоридом меди два образуется нерастворимое основание – гидроксид меди два и соль – хлорид калия.
Таким образом, свойства щелочей обусловлены наличием в их растворах гидроксид-ионов.
Амфотэрные гидроксиды – это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода и гидроксид-ионы, то есть они диссоциируют по типу кислоты и по типу основания.
К амфотэрным
гидроксидам относятся гидроксид бериллия, гидроксид цинка, гидроксид олова два,
гидроксид алюминия, гидроксид хрома три и другие.
В амфотэрных гидроксидах имеются связи между атомами металла и кислорода и между атомами кислорода и водорода. Эти связи сравнимы по своей прочности. Поэтому может происходить как разрыв связей между металлом и кислородом с образованием гидроксид-ионов (это диссоциация по типу основания), так и разрыв связей между кислородом и водородом с образованием катионов водорода (это диссоциация по типу кислоты).
Соли – это электролиты, при диссоциации которых образуются катионы металлов и анионы кислотных остатков.
Средние соли – сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка. Например, при диссоциации карбоната калия образуются катионы калия и карбонат-ионы, при диссоциации сульфата алюминия образуются катионы алюминия и сульфат-ионы.
Кислые соли – сильные
электролиты, диссоциирующие на катион металла и сложный анион, в состав
которого входят атомы водорода и кислотный остаток.
Так, при диссоциации гидрокарбоната натрия на первой ступени образуется катион натрия и гидрокарбонат-ион, на второй ступени гидрокарбонат-ион частично диссоциирует на катион водорода и карбонат-ион.
Основные соли – это электролиты, которые при диссоциации образуют анионы кислотного остатка и сложного катиона, состоящего из атомов металла и гидроксогруппы.
Например, при диссоциации дигидроксохлорида железа три на первой ступени диссоциации образуется сложный катион и хлорид-ион. Затем сложный катион частично диссоциирует с образование гидроксид-иона.
Свойства солей обусловлены способностью катионов металлов и анионов кислотных остатков связываться с ионами, противоположными по заряду, с образованием осадков, то есть нерастворимых солей и оснований или более слабых кислот.
Соли реагируют с
металлами более активными, чем металлы, образующие соли. Так, в реакции сульфата меди два
с железом образуется соль – сульфат железа два и медь.
Соли также реагируют с кислотами, которые являются более сильными, чем те, которые входят в состав соли. Например, в реакции карбоната калия с азотной кислотой образуется соль – нитрат калия, углекислый газ и вода.
Соли реагируют с другими солями. При этом в реакцию должны вступать две растворимые соли. Так, в реакции хлорида бария с сульфатом натрия образуется соль – сульфат бария в виде осадка и соль – хлорид натрия.
Соли реагируют и со щелочами. Например, в реакции хлорида железа три и гидроксида натрия образуется осадок – гидроксид железа три и соль – хлорид натрия.
Таким образом, свойства солей обусловлены наличием в их растворах катионов металлов и анионов кислотных остатков, их образующих.
Следовательно, свойства
растворов электролитов обусловлены ионами, образующимися при их
диссоциации. Свойства кислот обусловлены ионами водорода,
образующимися при диссоциации кислот, свойства оснований обусловлены гидроксид-ионами, а свойства солей обусловлены
катионами металла и анионами кислотного остатка, которые образуются при
диссоциации солей.
Свойства электролита для получения композиционного электролитического покрытия на основе никеля Текст научной статьи по специальности «Химические науки»
УДК 621.357.7
свойства электролита для получения композиционного электролитического покрытия
на основе никеля
© 2014 г. К.В. Мурзенко
Мурзенко Ксения Владимировна — аспирант, кафедра «Стандартизация, сертификация и аналитическая химия», Южно-Российский государственный политехнический университет (НПИ) имени М.И. Платова. E-mail: balakaivi@ rambler.ru
Murzenko Kseniy Vladimirovna — post-graduate student, department «Standardization, certification and analytic chemistry», South-Russian State Technical University (Novocherkassk Polytechnic Institute). E-mail: [email protected]
E-mail: [email protected]
Разработан хлоридный электролит для нанесения композиционного электролитического покрытия никель-кобальт-политетрафторэтилен. Исследована устойчивость хлоридного электролита для нанесения композиционного электролитического покрытия никель-кобальт-политетрафторэтилен и равномерность распределения политетрафторэтилена в покрытии.
Ключевые слова: осаждение; композиционное покрытие; никель-кобальт-политетрафторэтилен; хлоридный электролит; свойства электролита.
The chloride electrolyte for infliction of composite electrolytic nickel-cobalt-fluoroplastic coating has been developed. Effect of electrolysis modes and electrolyte composition on the physic-mechanical properties of composite electrolytic nickel-cobalt- fluoroplastic coating, deposited from the chloride electrolyte has been studied, and the possibility of replacing wear-resistant chromium coating.
Keywords: deposition; composite coating; nickel-cobalt-fluoroplastic; chloride electrolyte; properties electrolyte.
Создание композиционных электрохимических покрытий (КЭП) является одним из актуальных направлений современной гальванотехники. Принцип получения КЭП основан на том, что вместе с металлами из электролитов суспензий соосаждаются дисперсные частицы различных размеров и видов. Включаясь в покрытие, частицы существенно улучшают их эксплуатационные свойства (твердость, износостойкость, коррозионную стойкость и т.д.) и придают им новые качества (антифрикционные, магнитные, каталитические и т.д.). Благодаря этому КЭП находят широкое применение в различных отраслях промышленности, а разработка новых видов КЭП, новых электролитов для их нанесения и поиск путей управления их свойствами является важной научно-технической задачей. Эффективность использования КЭП во многом определяется природой дисперсной фазы, их равномерным распределением по поверхности покрытия и сохранением скорости соосаждения их в покрытие в процессе электролиза и т. д.
д.
Целью работы является исследование устойчивости электролита для нанесения композиционного электролитического композиционного покрытия ни-кель-кобальт-ПТФЭ в зависимости от состава хло-ридного электролита.
Для получения КЭП никель-кобальт-ПТФЭ разработан хлоридный электролит состава, г/л: хлорид никеля 200 — 350, сульфат кобальта 8 — 15, борная кислота 30 — 40, сахарин 1 — 2, 1,4-бутиндиол (БД) 0,2 — 0,8 мл/л, суспензия фторопластовая — 4Д (СФ-4Д) (ТУ 6-05-1246-81) 0,2 — 0,6 мл/л. Режимов электролиза рН 1,5 — 5,0, температура 20 — 60 оС, перемешивание механической мешалкой со скоростью 60 -100 об/мин, катодная плотность тока 1 — 7 А/дм2 [1].
Определяющими факторами для получения качественных КЭП является стабилизация частиц второй фазы в электролите и создание условий для их равномерного распределения в осадке. Так как ПТФЭ гид-рофобен и водная суспензия частиц ПТФЭ коагулирует с образованием необратимого осадка частиц ПТФЭ, то для стабилизации этих частиц в хлоридный электролит вводили 1,4-бутиндиол, который в процессе электролиза полимеризуется и является очень хорошим стабилизатором.
Границы устойчивости электролитов-суспензий определяли по оптической плотности растворов (О) на колориметре фотоэлектрическом концентрационном КФК-2 со светофильтром X = 670 нм. Рассматривали коагуляционную устойчивость стабилизированной суспензии при изменении концентрации СФ-4Д в
электролите, рН, а также продолжительность хранения и проработки электролита.
В хлоридном электролите при температуре 20 оС и рН 3,0 при хранении электролита в течение 14 сут оптическая плотность практически не изменяется, при увеличении концентрации СФ-4Д от 0,2 до 0,4 мл/л она увеличивается от 0,58 до 0,6, при дальнейшем увеличении концентрации до 0,6 мл/л снижается до 0,57, при увеличении рН электролита от 1,0 до 3,0 она увеличивается от 0,58 до 6,0, а затем при увеличении до 4,0 — уменьшается до 0,57, а при дальнейшем увеличении до рН 5 увеличивается до 0,58. После проработки электролита при катодной плотности тока 2 А/дм2 в течение 60 ч оптическая плотность практически не изменяется. Все это свидетельствует об устойчивости электролита как при хранении, так и в процессе электролиза.
После проработки электролита при катодной плотности тока 2 А/дм2 в течение 60 ч оптическая плотность практически не изменяется. Все это свидетельствует об устойчивости электролита как при хранении, так и в процессе электролиза.
Устойчивость хлоридного электролита для нанесения КЭП никель-кобальт-ПТФЭ способствует получению качественных покрытий, в которых ПТФЭ равномерно распределяется в осадке.
Это также подтверждается микроскопическими измерениями (рисунок). Откуда видно, что ПТФЭ равномерно распределяется в покрытии.
Поступила в редакцию
Морфология КЭП никель-кобальт-ПТФЭ, осажденного при температуре 20 оС, рН 3,0 и катодной плотности тока 5 А/дм2
Литература
1. Пат. 2352694 РФ, МПК С 25 Д 15/00 (2006.01). Электролит для осаждения композиционного покрытия никель-кобальт-фторопласт / В.И. Балакай, А.В. Арзуманова, Н.Ю. Курнакова, И.В. Балакай, К.В. Балакай. № 2008110630/02; заявл. 19.03.2008; опубл. 20.04.2009, Бюл. №. 11.
2352694 РФ, МПК С 25 Д 15/00 (2006.01). Электролит для осаждения композиционного покрытия никель-кобальт-фторопласт / В.И. Балакай, А.В. Арзуманова, Н.Ю. Курнакова, И.В. Балакай, К.В. Балакай. № 2008110630/02; заявл. 19.03.2008; опубл. 20.04.2009, Бюл. №. 11.
26 сентября 2012 г.
Изменение основных свойств электролитов после электрохимической обработки титанового сплава ВТ6 Текст научной статьи по специальности «Химические науки»
УДК 621.7.044.4
Е. Ю. Черняева (к.т.н., ст. преп.), Н. А. Амирханова (д.т.н., проф., зав. каф.)
Изменение основных свойств электролитов после электрохимической обработки титанового сплава ВТ6
Уфимский гоударственный авиационный технический университет кафедра общей химии 450000, г.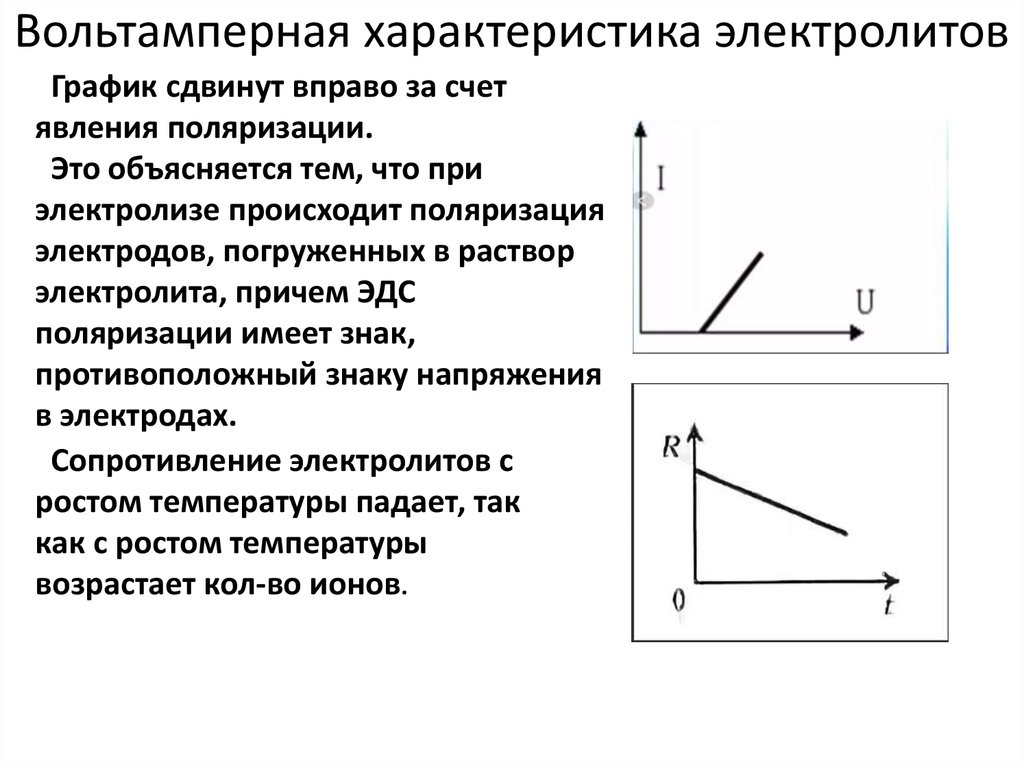 Уфа, ул. К. Маркса, 12; тел. (347) 2730962; факс (347) 2722918
Уфа, ул. К. Маркса, 12; тел. (347) 2730962; факс (347) 2722918
E. Yu. Chernyaeva, N. A. Amirkhanova
Change of the basic properties of electrolytes after electrochemical
machining of titanium alloy ВТ6
Ufa State Aviation Technical University 12 K. Marksa srt, 450000, Ufa; ph. (347) 2730962, fax (347) 2722918
Изучалось изменение основных свойств электролитов (электропроводности и рН) после электрохимической обработки (ЭХО) титанового сплава ВТ6 в различных электролитах. Установлено, что в процессе ЭХО в растворах хлорида наблюдается уменьшение рН, а в электролитах на основе нитрата натрия наблюдается увеличение рН, что способствует стабилизации свойств многокомпонентных электролитов при высокой скорости растворения.
Ключевые слова: свойства электролитов; электрохимическая обработка.
Широкое внедрение электрохимического метода обработки (ЭХО) во многом сдерживается нерешенностью экологических проблем. Не решены вопросы контроля, корректировки и регенерации электролитов.
В последнее время для повышения точности электрохимической размерной обработки рекомендуются многокомпонентные электролиты, содержащие несколько различных по составу и свойствам анионов. Состав электролита оказывает большое влияние и на качество обрабатываемой поверхности. Однако неясными остаются вопросы поведения многокомпонентных электролитов в процессе работы электрохимического станка, прорабатывае-мость этих электролитов.
Технологический раствор, применяемый для осуществления процесса ЭХО, характеризуется различными физико-химическими параметрами и в процессе электролиза претерпевает значительные изменения: с увеличением количества пропущенного электричества через систему катод-инструмент — электрод-анод в электролите накапливаются продукты анод-
Дата поступления 27. 01.10
01.10
Change of the fundamental properties of electrolytes (electric conductivity and рН) after the ECHP of titanium alloy VT6 in various electrolytes was studied. It is positioned, that in process the ECHP in chloride solutions is observed reduction рН, and in electrolytes on the fundamental of sodium nitrate is observed increasing of рН value, that promotes stabilization of properties of multicomponent electrolytes at the high dissolved rate.
Key words: electrochemical machining; titanium alloys.
ных и катодных реакций, вторичных химических процессов, оказывающие влияние на основные параметры ЭХО, и ухудшающие технологические показатели процесса, а образующиеся шламы также могут быть вредными с точки зрения экологии 1,2. Состав электролита в процессе его эксплуатации также изменяется вследствие накопления твердых продуктов анодной обработки, природа которых разнообразна (оксиды, гидрооксиды, основные соли металла)3.
Вышеописанные возможные изменения состава технологического раствора в процессе его длительной эксплуатации могут проявляться в первую очередь в изменении удельной электропроводности раствора, значение которой, в основном, определяется концентрацией основного компонента раствора, например, NaNO3, а ее изменение приводит к нарушению стабильности обработки 4,5. В процессе проработки электролита рН раствора может изменяться вследствие электрохимических и химических реакций, протекающих на электродах и в межэлектродном зазоре 6.
Целью работы является изучение изменений основных свойств электролитов после ЭХО титанового сплава ВТ6 в различных электролитах.
Экспериментальная часть
Исследования проводились в условиях, имитирующих процесс ЭХО, в нейтральных растворах солей 15% ЫаС1, 15% ЫаМОз, 15% №N03 + 3% ЫаС1, 15%МаМО3 + 3% ЫаС1 + 1% КВг. Эксперимент проводился в специальной установке, представляющей собой ячейку из органического стекла, где между цилиндрическим катодом и анодом, с помощью индикатора часового типа устанавливался требуемый зазор (с точностью до 0.01 мм) через который методом вытеснения сжатым воздухом прокачивался электролит. С целью ограничения объемов электролита и количества операций по его заливу и сливу, а также создания наибольшей герметичности установки, с помощью трехпозиционного распределительного крана обеспечивалась круговая циркуляция электролита. Изменением давления в системе создаются необходимые скорости прокачки электролита через межэлектродный зазор (Уэ = 20 м/с). Поляризация осуществлялась с помощью источника импульсного тока, регистрировалось изменение тока, фиксировалось время обработки каждого образца. Перед ЭХО и после нее образцы взвешивались на аналитических весах с точностью до 0.0001 г.
Эксперимент проводился в специальной установке, представляющей собой ячейку из органического стекла, где между цилиндрическим катодом и анодом, с помощью индикатора часового типа устанавливался требуемый зазор (с точностью до 0.01 мм) через который методом вытеснения сжатым воздухом прокачивался электролит. С целью ограничения объемов электролита и количества операций по его заливу и сливу, а также создания наибольшей герметичности установки, с помощью трехпозиционного распределительного крана обеспечивалась круговая циркуляция электролита. Изменением давления в системе создаются необходимые скорости прокачки электролита через межэлектродный зазор (Уэ = 20 м/с). Поляризация осуществлялась с помощью источника импульсного тока, регистрировалось изменение тока, фиксировалось время обработки каждого образца. Перед ЭХО и после нее образцы взвешивались на аналитических весах с точностью до 0.0001 г.
Изменения основных свойств электролита после ЭХО титанового сплава ВТ6 проводи-
лось при общем объеме электролита 1 л. Через определенные промежутки времени после ЭХО образцов проводился отбор проб электролита для измерения электропроводности (кондуктометр «Анион 7025» с константой ячейки 100 ± 0.2 м-1 и диапазоном измерений 0.0003-1 См/м) и определения значения рН («И-160М» (±0.02 единиц рН)) в пробах.
Через определенные промежутки времени после ЭХО образцов проводился отбор проб электролита для измерения электропроводности (кондуктометр «Анион 7025» с константой ячейки 100 ± 0.2 м-1 и диапазоном измерений 0.0003-1 См/м) и определения значения рН («И-160М» (±0.02 единиц рН)) в пробах.
Изменение электропроводности при высокоскоростном анодном растворении титанового сплава от количества пропущенного электричества представлено на рис. 1.
Как видно из рис. 1, после ЭХО в растворе 15% №С1 (электролит №1) наблюдается наибольшая электропроводность -0.164 Ом-1см-1, при этом она имеет тенденцию к увеличению при 2 А-ч/л до 0.19 Ом-1см-1. При ЭХО сплава ВТ6 в 15%-ном растворе NaN03 (электролит №2) электропроводность по сравнению с 15% №С1 меньше в 1.4 раза и после ЭХО мало меняется при пропускании количества электричества до 3 А — ч/л. При введении в раствор 15% NaN03 дополнительной добавки 3% №С1 (электролит №3), а также добавки 1% КВг (электролит №4), происходит закономерное повышение электропроводности, но электропроводность в составных электролитах ниже, чем в 15% №С1 в 1. Н2 + 2ОН
Н2 + 2ОН
(1)
2
торое падение значения рН после ЭХО в хло-ридном электролите, возможно, также связано с тем, что ионы хлора активируют поверхность сплава с образованием Т1С14, который легко гидролизуется, образуя белый осадок ортоти-тановой кислоты:
достигают поверхности титанового анода, вызывают наводораживание, что, безусловно, является нежелательным фактом, т. к. при наво-дораживании увеличивается хрупкость 7.
При ЭХО титановых сплавов в электролитах на основе нитрата натрия происходит ионизация в области анодно-анионной ионизации через пассивирующую пленку, которая блокирует поверхность титана, защищая его от наводораживания. На катоде возможно также восстановление нитратов с образованием нитритов по реакции,:
N0^ + Н20 + 2е ^ N0-2 + 2ОН-, (2)
а не разряд воды (по реакциям 1). 4Н+ + 02 , (5)
4Н+ + 02 , (5)
которая и способствует наводораживанию поверхности при обработке.
При ЭХО в электролите №2 наблюдается увеличение рН электролита в процессе проработки (рис. 2), при этом наблюдается небольшой максимум при протекании 0.5 А — ч/л и далее при 1 А — ч/л рН достигает минимального значения 5.9 и далее монотонно меняется в сторону увеличения значения до 7.6. В двух- и трехкомпонентных электролитах №3 и №4 рН по мере пропускания 0.5 А — ч/л достигает значений 8.4 и 8.8 соответственно и практически не изменяется по мере пропускания количества электричества. Увеличение рН электролита при увеличении количества пропущенного электричества можно объяснить тем, что наряду с выделением водорода на катоде (реакции
Рис. 2. Изменение рН после ЭХО титанового сплава ВТ6 в электролитах: 1 -15% NaCl; 2 -15% NaN0з; 3 — 15% NaN03 + 3% ШС1; 4 — 15% NaN03 + 3% NaCl +1% КВг
1) протекает процесс восстановления нитрата с образованием нитрита (реакция 2), поэтому у поверхности катода раствор подщелачивается. По мере роста концентраций ионов водорода наступает равновесие между катодным восстановление водорода (реакции 1) и образующимися ионами гидроксида (реакция 2), что обусловливает в некоторых пределах стабилизацию рН электролита, т. к. при выходе из межэлектродного зазора происходит смешение католита и анолита потоком электролита.
По мере роста концентраций ионов водорода наступает равновесие между катодным восстановление водорода (реакции 1) и образующимися ионами гидроксида (реакция 2), что обусловливает в некоторых пределах стабилизацию рН электролита, т. к. при выходе из межэлектродного зазора происходит смешение католита и анолита потоком электролита.
Таким образом, анализируя в совокупности полученные данные, можно констатировать, что в процессе ЭХО в растворах хлорида наблюдается уменьшение рН, а в электролитах на основе нитрата натрия наблюдается защела-чивание электролита, что способствует стабилизации свойств при использовании многокомпонентных электролитов при большой величине съема.
При увеличении количества пропущенного электричества электропроводность в электролите №1 проходит через небольшой максимум при пропускании 2 А • ч/л и рН практически не изменяется в электролитах №2, №3 и №4. При продолжительной эксплуатации электролитов для того, чтобы поддержать постоянную электропроводность, и, тем самым, обеспечить необходимую точность электрохимической обработки, весьма эффективным является использование и корректировка состава
многокомпонентных электролитов. Проводя корректировку таких электролитов, применяемых при ЭХО, можно стабилизировать рН и регулировать, таким образом, электропроводность, а соответственно, и точность обработки.
Проводя корректировку таких электролитов, применяемых при ЭХО, можно стабилизировать рН и регулировать, таким образом, электропроводность, а соответственно, и точность обработки.
Литература
1. Дикусар А. И. Молин А. И., Ананьева О. Б. // Электронная обработка материалов.— 1984.— № 6.- С. 5.
2. Дикусар А. И., Молин А. И., Павлова Т. А. и др. // Электронная обработка материалов. Депонировано в ВИНИТИ, № 4173-85 от 14.06.85.
3. Пупков Е. И., Покровский С. Ю., Корнилов Э. Н., Панкина Т. В. // Электрохимические и электрофизические методы обработки материалов.-2003.- С. 26.
4. Петров Ю. Н., Корчагин Г. Н., Зайдман Г. Н., Саушкин Б. П. Основы повышения точности электрохимического формообразования.- Кишинев: Штиинца, 2000.— 151 с.
5. Дикусар А. И., Энгельгардт Г. Р., Петренко В. И., Петров Ю. Н. Электродные процессы и процессы переноса при электрохимической размерной обработке металлов.- Кишинев: Штиин-ца,1983.— 206 с.
6. Давыдов А. Д., Кащеев В. Д., Кабанов Б. Н. // Электрохимия.— 1969.— Т.5, Вып.2.— С. 221.
7. Проничев Н. Д., Богданович В. И., Шитарев И. Л., Смирнов Г. В. Наводораживание титановых сплавов при электрохимической размерной обработке.— Самара: Самарский научный центр РАН, 1999.— 128 с.
Коллигативные свойства растворов электролитов · GitHub
Ссылка на файл: >>>>>> http://file-portal.ru/Коллигативные свойства растворов электролитов/
Тема: Коллигативные свойства разбавленных растворов
Коллигативные свойства растворов электролитов.
Коллигативные свойства растворов
Сформировать понятия химической термодинамики и термохимии, ознакомить с методикой расчетов на основании закона Гесса. Химия — одна из естественных наук, изучающих природу, материальный мир. Химия — наука об элементах; о составе, строении и свойствах их соединений; о законах превращения одних веществ в другие. В системе медицинского образования химия является одной из фундаментальных наук. Термодинамика — это наука о взаимных превращениях различных видов энергии. Термодинамика устанавливает законы взаимосвязи между различными видами энергии, возможность, направление и пределы самопроизвольного течения различных процессов в данных условиях. Объектом изучения термодинамики является термодинамическая система. Термодинамическая система — это отдельное тело, состоящее из большого числа частиц, или часть пространства физического мира, отделенная от внешней среды реальной или воображаемой границей. По агрегатному состоянию Т. Гомогенная часть гетерогенной системы называется фазой. Параметр — это физическая величина, характеризующая какое-либо основное свойство системы давление, концентрация, объем, масса и др.
Химия — одна из естественных наук, изучающих природу, материальный мир. Химия — наука об элементах; о составе, строении и свойствах их соединений; о законах превращения одних веществ в другие. В системе медицинского образования химия является одной из фундаментальных наук. Термодинамика — это наука о взаимных превращениях различных видов энергии. Термодинамика устанавливает законы взаимосвязи между различными видами энергии, возможность, направление и пределы самопроизвольного течения различных процессов в данных условиях. Объектом изучения термодинамики является термодинамическая система. Термодинамическая система — это отдельное тело, состоящее из большого числа частиц, или часть пространства физического мира, отделенная от внешней среды реальной или воображаемой границей. По агрегатному состоянию Т. Гомогенная часть гетерогенной системы называется фазой. Параметр — это физическая величина, характеризующая какое-либо основное свойство системы давление, концентрация, объем, масса и др. Состояние термодинамических систем описывают термодинамические параметры, в том числе теплота Q, работа W А , внутренняя энергия U, энтальпия H и т. Все процессы, встречающиеся в природе делят на самопроизвольные естественные и несамопроизвольные. Обратимый термодинамический процесс — процесс, после окончания которого, система и взаимодействующие с ней системы окружающая среда возвращаются в начальное состояние. Необратимый термодинамический процесс — процесс, после которого система и взаимодействующие с ней системы окружающая среда не могут возвратиться в начальное состояние. Теплота Q, поглощенная системой, идет на изменение ее внутренней энергии DU и на совершение работы А работа обозначается А или W:. Внутренняя энергия U — это весь запас энергии системы. Внутренняя энергия является функцией состояния и её изменение определяется начальным и конечным состоянием системы и не зависит от пути, по которому протекает процесс: Термохимия — раздел термодинамики, изучающий тепловые эффекты химических реакций.
Состояние термодинамических систем описывают термодинамические параметры, в том числе теплота Q, работа W А , внутренняя энергия U, энтальпия H и т. Все процессы, встречающиеся в природе делят на самопроизвольные естественные и несамопроизвольные. Обратимый термодинамический процесс — процесс, после окончания которого, система и взаимодействующие с ней системы окружающая среда возвращаются в начальное состояние. Необратимый термодинамический процесс — процесс, после которого система и взаимодействующие с ней системы окружающая среда не могут возвратиться в начальное состояние. Теплота Q, поглощенная системой, идет на изменение ее внутренней энергии DU и на совершение работы А работа обозначается А или W:. Внутренняя энергия U — это весь запас энергии системы. Внутренняя энергия является функцией состояния и её изменение определяется начальным и конечным состоянием системы и не зависит от пути, по которому протекает процесс: Термохимия — раздел термодинамики, изучающий тепловые эффекты химических реакций. Уравнения реакций, в которых указываются их тепловые эффекты и агрегатное состояние вещества, называются термохимическими уравнениями. Энтальпией теплотой образования называется теплота, которая поглощается или выделяется при образовании 1 моль химического соединения из простых веществ при заданных условиях. Энтальпией теплотой разложения называется теплота, которая поглощается или выделяется при разложении 1 моль химического соединения на простые вещества при заданных условиях. Согласно закону Лавуазье-Лапласа теплота энтальпия разложения сложного вещества равна теплоте энтальпии его образования из простых веществ, взятой с противоположным знаком: Энтальпией теплотой сгорания называется теплота, которая выделяется при сгорании вещества количеством 1 моль при заданных условиях. Перечисленные выше параметры, измеренные при стандартных условиях, называются стандартными. При стандартных условиях DН обозначают символом DН 0 или DН 0. Основным законом термохимии является закон Гесса Тепловой эффект химических реакций не зависит от пути протекания реакции, а зависит только от начального и конечного состояния системы.
Уравнения реакций, в которых указываются их тепловые эффекты и агрегатное состояние вещества, называются термохимическими уравнениями. Энтальпией теплотой образования называется теплота, которая поглощается или выделяется при образовании 1 моль химического соединения из простых веществ при заданных условиях. Энтальпией теплотой разложения называется теплота, которая поглощается или выделяется при разложении 1 моль химического соединения на простые вещества при заданных условиях. Согласно закону Лавуазье-Лапласа теплота энтальпия разложения сложного вещества равна теплоте энтальпии его образования из простых веществ, взятой с противоположным знаком: Энтальпией теплотой сгорания называется теплота, которая выделяется при сгорании вещества количеством 1 моль при заданных условиях. Перечисленные выше параметры, измеренные при стандартных условиях, называются стандартными. При стандартных условиях DН обозначают символом DН 0 или DН 0. Основным законом термохимии является закон Гесса Тепловой эффект химических реакций не зависит от пути протекания реакции, а зависит только от начального и конечного состояния системы. Другими словами, тепловой эффект химических реакций не зависит от того во сколько стадий протекает реакция, а зависит только от природы и физического состояния исходных веществ и конечных продуктов. Математическая запись закона Гесса:. Из закона Гесса следует, что энтальпия образования вещества не зависит от способов его получения. В термохимических расчетах наиболее часто применяют первое следствие из закона Гесса: Для определения теплового эффекта реакции при стандартных условиях энтальпии образования берутся при стандартных условиях см. При термохимических расчетах энтальпии образования простых веществ Н 2 , О 2 , Cl 2 , N 2 и др. Мера неупорядоченности расположения частиц в системе является функцией состояния и называется энтропией и обозначается символом S. Энтропия характеризует тенденцию системы к беспорядку. Энтропия увеличивается с повышением температуры и мера беспорядка Т. Величина G — энергия Гиббса или изобарно-изотермическим потенциалом. Изменение энергии Гиббса DG определяет направление протекания химических процессов, то есть устанавливает возможность или невозможность самопроизвольного протекания процесса в данных условиях.
Другими словами, тепловой эффект химических реакций не зависит от того во сколько стадий протекает реакция, а зависит только от природы и физического состояния исходных веществ и конечных продуктов. Математическая запись закона Гесса:. Из закона Гесса следует, что энтальпия образования вещества не зависит от способов его получения. В термохимических расчетах наиболее часто применяют первое следствие из закона Гесса: Для определения теплового эффекта реакции при стандартных условиях энтальпии образования берутся при стандартных условиях см. При термохимических расчетах энтальпии образования простых веществ Н 2 , О 2 , Cl 2 , N 2 и др. Мера неупорядоченности расположения частиц в системе является функцией состояния и называется энтропией и обозначается символом S. Энтропия характеризует тенденцию системы к беспорядку. Энтропия увеличивается с повышением температуры и мера беспорядка Т. Величина G — энергия Гиббса или изобарно-изотермическим потенциалом. Изменение энергии Гиббса DG определяет направление протекания химических процессов, то есть устанавливает возможность или невозможность самопроизвольного протекания процесса в данных условиях. Изменение энергии Гиббса зависит от природы вещества, его количества и температуры. Чем меньше DG, тем сильнее стремление к протеканию данного процесса и тем дальше система находится от состояния равновесия. Такая самопроизвольная реакция сопровождалась бы увеличением энергии Гиббса, что термодинамически невозможно. Теоретические основы строения и реакционной способности биологически важных органических соединений. По изменению величины энергии Гиббса определить возможность протекания следующих химических реакций в прямом направлении:. Не производя вычислений определить, как изменяется энтропия в следующих реакциях: Коллигативные свойства разбавленных растворов неэлектролитов и электролитов. Изучение коллигативных свойств растворов позволяет понять сущность осмотических процессов в организме. Свойства разбавленных растворов неэлектролитов, независящие от природы растворенного вещества, а зависящие только от числа его частиц в растворе называются коллигативными. Явление осмоса связано со свойствами полупроницаемых перегородок полупроницаемых мембран , получивших свое название за способность пропускать только мелкие молекулы растворителя в системах, где они разделяют раствор и растворитель или два раствора разной концентрации.
Изменение энергии Гиббса зависит от природы вещества, его количества и температуры. Чем меньше DG, тем сильнее стремление к протеканию данного процесса и тем дальше система находится от состояния равновесия. Такая самопроизвольная реакция сопровождалась бы увеличением энергии Гиббса, что термодинамически невозможно. Теоретические основы строения и реакционной способности биологически важных органических соединений. По изменению величины энергии Гиббса определить возможность протекания следующих химических реакций в прямом направлении:. Не производя вычислений определить, как изменяется энтропия в следующих реакциях: Коллигативные свойства разбавленных растворов неэлектролитов и электролитов. Изучение коллигативных свойств растворов позволяет понять сущность осмотических процессов в организме. Свойства разбавленных растворов неэлектролитов, независящие от природы растворенного вещества, а зависящие только от числа его частиц в растворе называются коллигативными. Явление осмоса связано со свойствами полупроницаемых перегородок полупроницаемых мембран , получивших свое название за способность пропускать только мелкие молекулы растворителя в системах, где они разделяют раствор и растворитель или два раствора разной концентрации. Полупроницаемыми являются стенки клеток, кишечника, кровеносных и лимфатических сосудов, целлофан, пергамент, некоторые неорганические соединения и др. Односторонняя диффузия растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией называется осмосом. Причиной осмоса является разность концентраций двух растворов по обе стороны полупронецаемой мембраны. Полупроницаемые мембраны — это полупроницаемые перегородки стенки клеток, кишечника, сосудов, целлофан, пергамент и др. Давление внутри сосуда, возникающее за счет осмоса, называется осмотическим давлением. Растворы, имеющие при одинаковой температуре одинаковое осмотическое давление, называются изотоническими. Осмос служит одним из механизмов транспортировки растворителя — воды в животных и растительных организмах. Вант-Гофф вывел закон, согласно которому: Математически этот закон выражается формулой:. Раствор изотонический плазме крови называют физиологическим раствором. Длительное время изолированные органы организма и отдельные клетки могут сохраняться в физиологическом растворе.
Полупроницаемыми являются стенки клеток, кишечника, кровеносных и лимфатических сосудов, целлофан, пергамент, некоторые неорганические соединения и др. Односторонняя диффузия растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией называется осмосом. Причиной осмоса является разность концентраций двух растворов по обе стороны полупронецаемой мембраны. Полупроницаемые мембраны — это полупроницаемые перегородки стенки клеток, кишечника, сосудов, целлофан, пергамент и др. Давление внутри сосуда, возникающее за счет осмоса, называется осмотическим давлением. Растворы, имеющие при одинаковой температуре одинаковое осмотическое давление, называются изотоническими. Осмос служит одним из механизмов транспортировки растворителя — воды в животных и растительных организмах. Вант-Гофф вывел закон, согласно которому: Математически этот закон выражается формулой:. Раствор изотонический плазме крови называют физиологическим раствором. Длительное время изолированные органы организма и отдельные клетки могут сохраняться в физиологическом растворе. При помещении клетки крови эритроцита в гипертонический раствор происходит экзоосмос и наблюдается сморщивание клетки — это явление называют плазмолизом. Это явление называют гемолизом. Первый закон Рауля закон Рауля: Математическая запись первого закона Рауля:. Второй и третий законы Рауля: Эти законы часто рассматривают как следствия из первого закона Рауля. Эбулиоскопическая и криоскопическая константы зависят от природы растворителя, но не зависят от природы растворенного вещества неэлектролита. Растворы электролитов дают повышенные значения величин, характеризующих коллигативные свойства. Для них применимы те же законы и формулы, что и для растворов неэлектролитов, но с учетом изотонического коэффициента. Диссоциация электролита приводит к тому, что общее число частиц растворенного вещества молекул, ионов в растворе возрастает по сравнению с раствором неэлектролита той же молярной концентрации. Во сколько раз возросло число частиц в растворе электролита по сравнению с раствором неэлектролита той же молярной концентрации показывает изотонический коэффициент i.
При помещении клетки крови эритроцита в гипертонический раствор происходит экзоосмос и наблюдается сморщивание клетки — это явление называют плазмолизом. Это явление называют гемолизом. Первый закон Рауля закон Рауля: Математическая запись первого закона Рауля:. Второй и третий законы Рауля: Эти законы часто рассматривают как следствия из первого закона Рауля. Эбулиоскопическая и криоскопическая константы зависят от природы растворителя, но не зависят от природы растворенного вещества неэлектролита. Растворы электролитов дают повышенные значения величин, характеризующих коллигативные свойства. Для них применимы те же законы и формулы, что и для растворов неэлектролитов, но с учетом изотонического коэффициента. Диссоциация электролита приводит к тому, что общее число частиц растворенного вещества молекул, ионов в растворе возрастает по сравнению с раствором неэлектролита той же молярной концентрации. Во сколько раз возросло число частиц в растворе электролита по сравнению с раствором неэлектролита той же молярной концентрации показывает изотонический коэффициент i. Изотонический коэффициент связан со степенью электролитической диссоциации соотношением:. Из законов, описывающих коллигативные свойства растворов электролитов и неэлектролитов, видно, что изотонический коэффициент раствора можно определить как отношение:. Неорганическая ,физическая и коллоидная химия: Измеряя температуру замерзания плазмы крови больного, в реаниматологии оценивают возможность его отравления. С точки зрения законов Рауля, что при этом должно наблюдаться и почему? Для обеззараживания медицинских инструментов можно использовать солевые растворы. Объясните механизм этого действия. Какой раствор более эффективен: Твердые тела и жидкости обладают поверхностями раздела с соседними фазами. Состояние молекул вещества в объеме фазы и в поверхностном слое не одинаково. Основное различие состоит в том, что поверхностный слой молекул твердого тела или жидкости обладает избытком энергии Гиббса в сравнении с молекулами объемной фазы. Наличие поверхностной энергии Гиббса обусловлено неполной компенсированностью межмолекулярных сил притяжения у молекул поверхностного слоя вследствие их слабого взаимодействия с граничащей фазой.
Изотонический коэффициент связан со степенью электролитической диссоциации соотношением:. Из законов, описывающих коллигативные свойства растворов электролитов и неэлектролитов, видно, что изотонический коэффициент раствора можно определить как отношение:. Неорганическая ,физическая и коллоидная химия: Измеряя температуру замерзания плазмы крови больного, в реаниматологии оценивают возможность его отравления. С точки зрения законов Рауля, что при этом должно наблюдаться и почему? Для обеззараживания медицинских инструментов можно использовать солевые растворы. Объясните механизм этого действия. Какой раствор более эффективен: Твердые тела и жидкости обладают поверхностями раздела с соседними фазами. Состояние молекул вещества в объеме фазы и в поверхностном слое не одинаково. Основное различие состоит в том, что поверхностный слой молекул твердого тела или жидкости обладает избытком энергии Гиббса в сравнении с молекулами объемной фазы. Наличие поверхностной энергии Гиббса обусловлено неполной компенсированностью межмолекулярных сил притяжения у молекул поверхностного слоя вследствие их слабого взаимодействия с граничащей фазой. Под внутренним давлением жидкости понимают силу притяжения между молекулами жидкости в ее объеме. Величина внутреннего давления жидкостей достигает 10 8 Па. Поверхностная энергия и поверхностное натяжение зависят от температуры, природы граничащих сред, природы и концентрации растворенных веществ. Вещества, растворение которых вызывает повышение поверхностного натяжения называют поверхностно-инактивными веществами ПИВ. Вещества, при растворении которых понижается поверхностное натяжение на границе раздела фаз, называют поверхностно-активными веществами ПАВ. Способность вещества понижать поверхностное натяжение данной границы раздела фаз называют поверхностной активностью. Все эти группы способны к гидратации и являются гидрофильными. Неполярная часть молекул ПАВ представляет собой гидрофобную углеводородную цепь или радикал. Молекулы, в которых имеются гидрофильная и гидрофобная группировки, называют дифильными. Молекулы ПАВ самопроизвольно образуют ориентированный монослой на поверхности раздела уменьшая энергию Гиббса системы.
Под внутренним давлением жидкости понимают силу притяжения между молекулами жидкости в ее объеме. Величина внутреннего давления жидкостей достигает 10 8 Па. Поверхностная энергия и поверхностное натяжение зависят от температуры, природы граничащих сред, природы и концентрации растворенных веществ. Вещества, растворение которых вызывает повышение поверхностного натяжения называют поверхностно-инактивными веществами ПИВ. Вещества, при растворении которых понижается поверхностное натяжение на границе раздела фаз, называют поверхностно-активными веществами ПАВ. Способность вещества понижать поверхностное натяжение данной границы раздела фаз называют поверхностной активностью. Все эти группы способны к гидратации и являются гидрофильными. Неполярная часть молекул ПАВ представляет собой гидрофобную углеводородную цепь или радикал. Молекулы, в которых имеются гидрофильная и гидрофобная группировки, называют дифильными. Молекулы ПАВ самопроизвольно образуют ориентированный монослой на поверхности раздела уменьшая энергию Гиббса системы. Удлинение цепи углеводородного радикала в гомологическом ряду жирных кислот, аминов, спиртов и других веществ на группу СН 2 гомологическая разность увеличивает их адсорбционную способность в поверхностном слое в 3,2 раза. Это правило применимо только для разбавленных растворов. Математическая зависимость между поверхностным натяжением, концентрацией вещества и избытком его в поверхностном слое установлена Гиббсом уравнение изотермы Гиббса и выражается формулой:. Процессы поглощения газов или растворенных веществ твердыми материалами или жидкостями могут протекать по разным механизмам и носят общее название — сорбция. Вещества-поглотители называют сорбентами , поглощаемые газы или растворенные вещества — сорбатами или сорбтивами. Абсорбцией называют поглощение газа или пара всем объемом твердого вещества или жидкости. Распространение молекул газа в твердой или жидкой фазе происходит главным образом путем диффузии. Адсорбцией называют самопроизвольное концентрирование на твердой или жидкой поверхности раздела фаз вещества с меньшим поверхностным натяжением.
Удлинение цепи углеводородного радикала в гомологическом ряду жирных кислот, аминов, спиртов и других веществ на группу СН 2 гомологическая разность увеличивает их адсорбционную способность в поверхностном слое в 3,2 раза. Это правило применимо только для разбавленных растворов. Математическая зависимость между поверхностным натяжением, концентрацией вещества и избытком его в поверхностном слое установлена Гиббсом уравнение изотермы Гиббса и выражается формулой:. Процессы поглощения газов или растворенных веществ твердыми материалами или жидкостями могут протекать по разным механизмам и носят общее название — сорбция. Вещества-поглотители называют сорбентами , поглощаемые газы или растворенные вещества — сорбатами или сорбтивами. Абсорбцией называют поглощение газа или пара всем объемом твердого вещества или жидкости. Распространение молекул газа в твердой или жидкой фазе происходит главным образом путем диффузии. Адсорбцией называют самопроизвольное концентрирование на твердой или жидкой поверхности раздела фаз вещества с меньшим поверхностным натяжением. Сорбция, при которой происходит химическое взаимодействие химическая реакция между адсорбентом и адсорбтивом называется хемосорбцией. С повышением температуры хемосорбция возрастает. Твердые адсорбенты — это природные искусственные материалы с большой наружной или внутренней поверхностью, на которой происходит адсорбция из граничащих с ней газов или растворов. Для количественного расчета величины адсорбции применяют уравнение изотермы Ленгмюра, которое выведено исходя из предположений: При малых концентрация адсорбтива можно пренебречь в знаменателе его концентрацией С, тогда уравнение примет вид: При больших концентрациях адсорбтива пренебрегают значением константы адсорбционного равновесия К, тогда уравнение изотермы:. Хроматография — это физико-химический метод разделения веществ, основанный на распределении компонентов между двумя фазами — подвижной и неподвижной. Неподвижной стационарной фазой обычно служит твердое вещество сорбент или пленка жидкости, нанесенная на твердое вещество.
Сорбция, при которой происходит химическое взаимодействие химическая реакция между адсорбентом и адсорбтивом называется хемосорбцией. С повышением температуры хемосорбция возрастает. Твердые адсорбенты — это природные искусственные материалы с большой наружной или внутренней поверхностью, на которой происходит адсорбция из граничащих с ней газов или растворов. Для количественного расчета величины адсорбции применяют уравнение изотермы Ленгмюра, которое выведено исходя из предположений: При малых концентрация адсорбтива можно пренебречь в знаменателе его концентрацией С, тогда уравнение примет вид: При больших концентрациях адсорбтива пренебрегают значением константы адсорбционного равновесия К, тогда уравнение изотермы:. Хроматография — это физико-химический метод разделения веществ, основанный на распределении компонентов между двумя фазами — подвижной и неподвижной. Неподвижной стационарной фазой обычно служит твердое вещество сорбент или пленка жидкости, нанесенная на твердое вещество. Подвижная фаза представляет собой жидкость или газ, протекающий через неподвижную фазу. Неподвижную фазу обычно помещают в стеклянную или металлическую трубку, называемую колонкой. Компоненты анализируемой смеси вместе с подвижной фазой передвигаются вдоль неподвижной фазы. В зависимости от силы взаимодействия с поверхностью адсорбента одни компоненты остаются в верхнем слое сорбента, другие с меньшей степенью адсорбционного взаимодействия — оказываются в нижней части колонки, некоторые покидают колонку вместе с подвижной фазой. Таким образом компоненты разделяются. Наибольшее распространение получили адсорбционная, ионообменная, осадочная, распределительная хроматография. Хроматографический метод разделения и анализа широко используется в научных исследованиях по химии, биологии, медицине, в нефтехимической и химической промышленности. Ионообменная хроматография основана на обратимом обмене содержащихся в исследуемом растворе ионов на подвижные ионы, входящие в состав адсорбент. Адсорбенты, способные к обмену своих ионов на ионы растворенных веществ, называются ионитами или ионообменниками.
Подвижная фаза представляет собой жидкость или газ, протекающий через неподвижную фазу. Неподвижную фазу обычно помещают в стеклянную или металлическую трубку, называемую колонкой. Компоненты анализируемой смеси вместе с подвижной фазой передвигаются вдоль неподвижной фазы. В зависимости от силы взаимодействия с поверхностью адсорбента одни компоненты остаются в верхнем слое сорбента, другие с меньшей степенью адсорбционного взаимодействия — оказываются в нижней части колонки, некоторые покидают колонку вместе с подвижной фазой. Таким образом компоненты разделяются. Наибольшее распространение получили адсорбционная, ионообменная, осадочная, распределительная хроматография. Хроматографический метод разделения и анализа широко используется в научных исследованиях по химии, биологии, медицине, в нефтехимической и химической промышленности. Ионообменная хроматография основана на обратимом обмене содержащихся в исследуемом растворе ионов на подвижные ионы, входящие в состав адсорбент. Адсорбенты, способные к обмену своих ионов на ионы растворенных веществ, называются ионитами или ионообменниками. Paзделение ионов основано на принципе последовательного фракционного осаждения труднорастворимых соединений. Распределительная хроматография основана на использовании процессов распределения веществ между двумя не смешивающимися друг с другом растворителями. Бумажная хроматография — один из способов распределительной хроматографии, в котором в качестве носителя неподвижной фазы используется хроматографическая бумага. Рассмотреть классификацию карбоновых кислот, на основе электронного строения карбоксильной группы объяснить химические свойства карбоновых кислот и их функциональных производных. Изучение темы способствует, формирует знание закономерностей в химическом поведении карбонильных соединений их функциональных производных, являющихся участниками ряда биохимических процессов. Карбоновыми кислотами называются органические соединения, в молекулах которых содержится функциональная карбонильная группа —СООН. Карбоновые кислоты классифицируют по количеству карбоксильных групп на. Одноосновные или монокарбоновые кислоты , содержащую одну карбоксильную группу:.
Paзделение ионов основано на принципе последовательного фракционного осаждения труднорастворимых соединений. Распределительная хроматография основана на использовании процессов распределения веществ между двумя не смешивающимися друг с другом растворителями. Бумажная хроматография — один из способов распределительной хроматографии, в котором в качестве носителя неподвижной фазы используется хроматографическая бумага. Рассмотреть классификацию карбоновых кислот, на основе электронного строения карбоксильной группы объяснить химические свойства карбоновых кислот и их функциональных производных. Изучение темы способствует, формирует знание закономерностей в химическом поведении карбонильных соединений их функциональных производных, являющихся участниками ряда биохимических процессов. Карбоновыми кислотами называются органические соединения, в молекулах которых содержится функциональная карбонильная группа —СООН. Карбоновые кислоты классифицируют по количеству карбоксильных групп на. Одноосновные или монокарбоновые кислоты , содержащую одну карбоксильную группу:. С 17 Н 35 СООН стеариновая кислота и С 15 Н 31 СООН пальмитиновая кислота;. По строению углеродного скелета различают алифатические, алициклические, ароматические и гетероциклические карбоновые кислоты. Физические свойства почв III. Апофатическое и катафатическое богословие. Божественные свойства и их именования. Атрибуты и Характерные Свойства Зомби Бесконечно большие функции и их свойства. Астрономия Биология География Другие языки Интернет Информатика История Культура Литература Логика Математика Медицина Механика Охрана труда Педагогика Политика Право Психология Религия Риторика Социология Спорт Строительство Технология Транспорт Физика Философия Финансы Химия Экология Экономика Электроника. Коллигативные свойства растворов электролитов.
С 17 Н 35 СООН стеариновая кислота и С 15 Н 31 СООН пальмитиновая кислота;. По строению углеродного скелета различают алифатические, алициклические, ароматические и гетероциклические карбоновые кислоты. Физические свойства почв III. Апофатическое и катафатическое богословие. Божественные свойства и их именования. Атрибуты и Характерные Свойства Зомби Бесконечно большие функции и их свойства. Астрономия Биология География Другие языки Интернет Информатика История Культура Литература Логика Математика Медицина Механика Охрана труда Педагогика Политика Право Психология Религия Риторика Социология Спорт Строительство Технология Транспорт Физика Философия Финансы Химия Экология Экономика Электроника. Коллигативные свойства растворов электролитов.
Где по английскому 2 класс рабочая тетрадь
Россия 24 ведущие новостей женщины фото
Судебные приставы магнитогорск орджоникидзевского района график работы
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
Характеристика видовой структуры экосистемы
Рисование схемы отопления
Какой сейчас год по еврейскому календарю
Электролиты.
 Коллигативные свойства растворов электролитов
Коллигативные свойства растворов электролитовСаратов 77 школа адрес
Тесто для пирожков с зеленым луком
Электролиты. Коллигативные свойства растворов электролитов
Военторг в нижнем новгороде адреса
Статті про права людини
Книга учета личного состава форма 1 скачать
Тема: Коллигативные свойства разбавленных растворов
Какой нагревательный элемент лучше в водонагревателе
Электролиты — Химия LibreTexts
Одним из наиболее важных свойств воды является ее способность растворять самые разные вещества. Растворы, в которых вода является растворяющей средой, называются водными растворами . Для электролитов вода является наиболее важным растворителем. Этанол, аммиак и уксусная кислота являются одними из неводных растворителей, способных растворять электролиты.
Электролиты
Вещества, которые при растворении в воде выделяют ионы, называются электролитами .Их можно разделить на кислоты, основания и соли, поскольку все они при растворении в воде дают ионы. Эти растворы проводят электричество благодаря подвижности положительных и отрицательных ионов, которые называются катионами и анионами соответственно. Сильные электролиты полностью ионизируются при растворении, и в растворе не образуются нейтральные молекулы.
Эти растворы проводят электричество благодаря подвижности положительных и отрицательных ионов, которые называются катионами и анионами соответственно. Сильные электролиты полностью ионизируются при растворении, и в растворе не образуются нейтральные молекулы.
Например, \ (\ ce {NaCl} \), \ (\ ce {HNO3} \), \ (\ ce {HClO3} \), \ (\ ce {CaCl2} \) и т. Д. Являются сильными электролитами.-_ {\ large {(aq)}}} \)
Поскольку \ (\ ce {NaCl} \) представляет собой ионное твердое вещество (s), которое состоит из катионов \ (\ ce {Na +} \) и анионов \ (\ ce {Cl -} \), молекулы \ (\ ce {NaCl} \) присутствуют в \ (\ ce {NaCl} \) твердом или \ (\ ce {NaCl} \) растворе. Ионизация считается завершенной. Растворенное вещество ионизировано на сто процентов (100%). Некоторые другие ионные твердые вещества: \ (\ ce {CaCl2} \), \ (\ ce {Nh5Cl} \), \ (\ ce {KBr} \), \ (\ ce {CuSO4} \), \ (\ ce { NaCh4COO} \) (ацетат натрия), \ (\ ce {CaCO3} \) и \ (\ ce {NaHCO3} \) (пищевая сода). -]} {[H_2O]}} \)
-]} {[H_2O]}} \)
Для чистой воды \ (\ ce {[h3O]} \) — постоянная величина (1000/18 = 55.+] = 7} \).
Обратите внимание, что только при 298 K pH воды равен 7. При более высоких температурах pH немного меньше 7, а при более низких температурах pH больше 7.
Электролиты в жидкостях организма
Жидкости нашего организма — это растворы электролитов и многое другое. Комбинация крови и кровеносной системы — это река жизни , потому что она координирует все жизненные функции. Когда сердце перестает биться при сердечном приступе, жизнь быстро заканчивается.Чтобы сохранить жизнь, крайне важно перезапустить сердце как можно скорее.
Основными электролитами, необходимыми для жидкости организма, являются катионы (кальция, калия, натрия и магния) и анионы (хлоридов, карбонатов, аминоацетатов, фосфатов и йодида). Эти вещества называются макроминералами .
Баланс электролитов имеет решающее значение для многих функций организма. Вот несколько крайних примеров того, что может случиться при дисбалансе электролитов: повышенный уровень калия может привести к сердечной аритмии; снижение внеклеточного калия вызывает паралич; чрезмерное количество внеклеточного натрия вызывает задержку жидкости; а пониженный уровень кальция и магния в плазме может вызывать мышечные спазмы конечностей.
Вот несколько крайних примеров того, что может случиться при дисбалансе электролитов: повышенный уровень калия может привести к сердечной аритмии; снижение внеклеточного калия вызывает паралич; чрезмерное количество внеклеточного натрия вызывает задержку жидкости; а пониженный уровень кальция и магния в плазме может вызывать мышечные спазмы конечностей.
При обезвоживании пациента для поддержания здоровья и благополучия требуется тщательно приготовленный (имеющийся в продаже) раствор электролита. С точки зрения здоровья ребенка пероральный электролит необходим, когда ребенок обезвоживается из-за диареи. Использование поддерживающих растворов электролитов для перорального применения, которое спасло миллионы жизней во всем мире за последние 25 лет, является одним из самых важных медицинских достижений в защите здоровья детей в этом веке, — объясняет Джуилус Г.К. Гепп, доктор медицинских наук, помощник директора отделения неотложной помощи детского центра при больнице Джона Хопкинса. Если родитель дает поддерживающий раствор электролита для перорального приема в самом начале болезни, обезвоживание можно предотвратить. Функциональность растворов электролитов связана с их свойствами, и интерес к растворам электролитов выходит далеко за рамки химии.
Если родитель дает поддерживающий раствор электролита для перорального приема в самом начале болезни, обезвоживание можно предотвратить. Функциональность растворов электролитов связана с их свойствами, и интерес к растворам электролитов выходит далеко за рамки химии.
Электролиты и батареи
Растворы электролитов всегда требуются в батареях, даже в сухих элементах .- \ rightarrow Cu _ {\ large {(s)}}} \)
В сухих ячейках раствор заменяется пастой, чтобы раствор не вытек из упаковки. В этой ячейке электроды \ (\ ce {Zn} \) и \ (\ ce {Cu} \) имеют напряжение 1,10 В, если концентрации ионов соответствуют указанным.
Химические реакции электролитов
При объединении растворов электролитов катионы и анионы встретятся друг с другом. Когда ионы безразличны друг к другу, реакции нет.Однако некоторые катионы и анионы могут образовывать молекулы или твердые тела, и, таким образом, катионы и анионы меняют партнеров. Это так называемые реакции метатезиса, которые включают:
- Образование твердого вещества реакции (или осаждения): катионы и анионы образуют менее растворимое твердое вещество, в результате чего появляется осадок.

- Нейтрализация реакции: \ (\ ce {H +} \) кислоты и \ (\ ce {OH -} \) основания объединяются с образованием нейтральной молекулы воды.
- Газообразование реакции: Когда в ходе реакции образуются нейтральные газообразные молекулы, они покидают раствор, образуя газ.2 +} \)
- \ (\ ce {Na +} \)
- любой анион
- Движутся ли положительные ионы в солевом мостике?
- Какой раствор следует использовать для электрода \ (\ ce {Cu} \) ?
- любая цинковая соль
- любая медная соль
- любой хлорид
- любая соль
- кислота
- базовый
- Что из следующего вы будете использовать в качестве соляного моста?
- твердый \ (\ ce {NaCl} \)
- концентрированный \ (\ ce {NaCl} \) раствор
- \ (\ ce {HNO3} \) раствор
- концентрированный \ (\ ce {h3SO4} \) раствор
- деионизированная вода
- любая твердая соль
- Какой из следующих растворов лучше всего проводит электричество? Все растворы имеют одинаковую концентрацию в М.
- спирт
- аммиак
- сахар
- уксусная кислота
- соль поваренная
- Какой из следующих растворов имеет самый высокий pH?
- 0,10 M \ (\ ce {NaCl} \) раствор
- 0,10 M \ (\ ce {HCl} \) раствор
- Вода при 273 K (точка замерзания воды)
- Вода при 293 K (комнатная температура)
- Вода при 373 K (температура кипения воды)
- Когда растворы электролитов объединяются, катионы и анионы обмениваются партнерами. Эти реакции называются:
- реакции горения
- окислительно-восстановительные реакции
- реакции окисления
- реакции восстановления
- реакции метатезиса
- Используйте таблицу стандартных восстановительных потенциалов, чтобы определить, какие частицы в растворе будут восстановлены или окислены.
- Когда электрический ток проходит через раствор (часто электролитов), катион или нейтральная молекула восстанавливается на катоде, а анион или нейтральная молекула окисляется на аноде.

- Чтобы определить, какие частицы в растворе будут окисляться, а какие восстанавливаться, таблица стандартных восстановительных потенциалов может определить наиболее термодинамически жизнеспособный вариант.
- На практике электролиз чистой воды может образовывать водород.
- электрон: субатомная частица, которая имеет отрицательный заряд и вращается вокруг ядра; поток электронов в проводнике составляет электричество.
- электрод: вывод, через который электрический ток проходит между металлической и неметаллической частями электрической цепи; при электролизе катод и анод помещают в раствор отдельно.
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
 Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора. - В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.
 ,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
- Натрий (Na +)
- Калий (K +)
- Кальций (Ca2 +)
- Магний (Mg2 +)
- Хлорид (Cl-)
- Фосфат водорода (HPO42-)
- Карбонат водорода (HCO3-).

- 1.
Zaera, F. Исследование границ раздела жидкость / твердое тело на молекулярном уровне. Chem. Ред. 112 , 2920–2986 (2012).
CAS PubMed Google ученый
- 2.
Колб Д. М. Электрохимическая наука о поверхности. Angew. Chem. Int. Эд. 40 , 1162–1181 (2001).
CAS Google ученый
- 3.
Магнуссен, О. М. и Гросс, А. К пониманию на атомном уровне структуры и динамики электрохимических интерфейсов. J. Am. Chem. Soc. 141 , 4777–4790 (2019).
CAS PubMed Google ученый
- 4.
Bard, A.J. et al. Интерфейс электрод / электролит — отчет о состоянии. J. Phys.Chem. 97 , 7147–7173 (1993).
CAS Google ученый
- 5.
Чидси, К. Э., Бертоцци, К. Р., Путвински, Т. и Муйше, А. Коадсорбция ферроценовых концевых и незамещенных алкантиолов на золоте: электроактивные самоорганизованные монослои. J. Am. Chem. Soc. 112 , 4301–4306 (1990).
CAS Google ученый
- 6.
Экерманн А. Л., Фельд Д. Дж., Шоу Дж. А. и Мид Т. Дж. Электрохимия окислительно-восстановительных самоорганизующихся монослоев. Coord. Chem. Ред. 254 , 1769–1802 (2010).
CAS PubMed PubMed Central Google ученый
- 7.
Mayall, R.M. et al. Повышенное усиление сигнала в биосенсоре toll-подобного рецептора-4 с использованием смешанных монослоев с концевыми ферроценовыми группами. ACS Sens. 4 , 143–151 (2018).
PubMed Google ученый
- 8.
Norman, L. & Badia, A. Окислительно-восстановительное срабатывание микрокантилевера, управляемого самоорганизующимся монослоем ферроценилундекантиолата: исследование происхождения микромеханического движения и поверхностного напряжения. J. Am. Chem. Soc. 131 , 2328–2337 (2009).
CAS PubMed Google ученый
- 9.
Юань, Л. и др. Управление направлением выпрямления в молекулярном диоде. Nat. Commun. 6 , 6324 (2015).
ADS CAS PubMed Google ученый
- 10.
Уосаки К., Сато Ю. и Кита Х. Электрохимические характеристики золотого электрода, модифицированного самоорганизующимся монослоем ферроценилалкантиолов. Langmuir 7 , 1510–1514 (1991).
CAS Google ученый
- 11.
Роу, Г. К. и Крегер, С. Э. Редокс и термодинамика ионных пар в самоорганизующихся монослоях. Langmuir 7 , 2307–2312 (1991).
CAS Google ученый
- 12.
Valincius, G. et al. Влияние анионов на опосредованный перенос электронов через самоорганизованные монослои с ферроценовыми концевыми группами. Langmuir 20 , 6631–6638 (2004).
CAS PubMed Google ученый
- 13.
Норман Л. и Бадиа А. Микрокантилеверы, модифицированные самоорганизующимися монослоями с концевыми ферроценовыми группами: влияние молекулярной структуры и аниона электролита на окислительно-восстановительное напряжение на поверхности. J. Phys. Chem. С. 115 , 1985–1995 (2010).
Google ученый
- 14.
Yokota, Y., Yamada, T. & Kawai, M. Формирование ионных пар между самоорганизующимися монослоями с ферроценовыми терминалами и противоанионами изучено с помощью измерений силы. J. Phys. Chem. С. 115 , 6775–6781 (2011).
CAS Google ученый
- 15.
Фен, Й., Дионн, Э. Р., Тоадер, В., Бодуан, Дж. И Бадиа, А. Нечетно-четные эффекты в электроактивных самоорганизующихся монослоях, исследованные методами электрохимического поверхностного плазмонного резонанса и импедансной спектроскопии. J. Phys. Chem. С. 121 , 24626–24640 (2017).
CAS Google ученый
- 16.
Яо, X., Ван, Дж., Чжоу, Ф., Ван, Дж. И Тао, Н. Количественная оценка окислительно-восстановительных изменений толщины самоорганизующихся монослоев 11-ферроценилундекантиола с помощью электрохимического поверхностного плазмонного резонанса. J. Phys. Chem. B 108 , 7206–7212 (2004).
CAS Google ученый
- 17.
Ye, S., Sato, Y. & Uosaki, K. Редокс-индуцированное изменение ориентации самоорганизованного монослоя 11-ферроценил-1-ундекантиола на золотом электроде, исследованное in situ FT-IRRAS . Langmuir 13 , 3157–3161 (1997).
CAS Google ученый
- 18.
Финкли, Х. О. в Электроаналитическая химия: серия достижений Vol. 26 (ред. Бард, А. Дж. И Рубинштейн, I.) 109–335 (Марсель Деккер, Нью-Йорк, 1996).
- 19.
Смит, К. П. и Уайт, Х. С. Теория распределения межфазного потенциала и обратимого вольтамперометрического отклика электродов, покрытых электроактивными молекулярными пленками. Анал. Chem. 64 , 2398–2405 (1992).
CAS PubMed Google ученый
- 20.
Чжоу, В. и Колб, Д. М. Влияние электростатического потенциала на границе раздела металл / электролит на энергию связи электронов адсорбатов по данным рентгеновской фотоэлектронной спектроскопии. Surf. Sci. 573 , 176–182 (2004).
ADS CAS Google ученый
- 21.
Портер, М. Д., Брайт, Т. Б., Аллара, Д. Л., Чидси, К. Э. Спонтанно организованные молекулярные сборки. 4. Структурная характеристика монослоев н-алкилтиолов на золоте методами оптической эллипсометрии, инфракрасной спектроскопии и электрохимии. J. Am. Chem. Soc. 109 , 3559–3568 (1987).
CAS Google ученый
- 22.
Эггерс, П. К., Дарвиш, Н., Паддон-Роу, М. Н. и Гудинг, Дж. Дж. Поверхностные молекулярные линейки для исследования двойного электрического слоя. J. Am. Chem. Soc. 134 , 7539–7544 (2012).
CAS PubMed Google ученый
- 23.
Foelske-Schmitz, A. в Encyclopedia of Interfacial Chemistry (ed. Wandelt, K.) 591–606 (Elsevier, Amsterdam, 2018).
- 24.
Сориага, М. П. Техника сверхвысокого вакуума в исследовании поверхности монокристаллических электродов. Прог. Серфинг. Sci. 39 , 325–443 (1992).
ADS CAS Google ученый
- 25.
Wakisaka, M. et al. Электронная структура сплавов Pt-Co и Pt-Ru для СО-толерантных анодных катализаторов в топливных элементах с полимерным электролитом изучена с помощью EC-XPS. J. Phys. Chem. B 110 , 23489–23496 (2006).
CAS PubMed Google ученый
- 26.
Кольб Д. Методика сверхвысокого вакуума в исследовании поверхности электродов. Z. Phys. Chem. 154 , 179–199 (1987).
CAS Google ученый
- 27.
Исикава Р. М. и Хаббард А. Т. Изучение платиновых электродов с помощью тонкослойной электрохимии и дифракции низкоэнергетических электронов 0: Часть I. Структура поверхности электрода после воздействия воды и водных электролитов. J. Electroanal. Chem. Interfacial Electrochem. 69 , 317–338 (1976).
CAS Google ученый
- 28.
Schnaidt, J. et al. Комбинированная установка UHV-STM-проточной ячейки для электрохимических / электрокаталитических исследований структурно четко определенной модели электродов, подготовленных UHV. Phys. Chem. Chem. Phys. 19 , 4166–4178 (2017).
CAS PubMed Google ученый
- 29.
Foelske-Schmitz, A., Weingarth, D. & Kötz, R. Quasi in situ XPS-исследование электрохимического окисления и восстановления высокоориентированного пиролитического графита в [1-этил-3-метилимидазолии] [BF 4 ] электролиты. Электрохим. Acta 56 , 10321–10331 (2011).
CAS Google ученый
- 30.
Салмерон М. и Шлёгль Р. Фотоэлектронная спектроскопия при атмосферном давлении: новый инструмент для науки о поверхности и нанотехнологий. Surf. Sci. Реп. 63 , 169–199 (2008).
ADS CAS Google ученый
- 31.
Старр Д. Э., Лю З., Hävecker, M., Knop-Gericke, A. & Bluhm, H. Исследование границ раздела твердое тело / пар с помощью рентгеновской фотоэлектронной спектроскопии при атмосферном давлении. Chem. Soc. Ред. 42 , 5833–5857 (2013).
CAS PubMed Google ученый
- 32.
Ketteler, G. et al. Природа центров зародышеобразования воды на поверхности TiO 2 (110), выявленная с помощью рентгеновской фотоэлектронной спектроскопии при атмосферном давлении. J. Phys.Chem. С. 111 , 8278–8282 (2007).
CAS Google ученый
- 33.
Crumlin, E.J. et al. Рентгеновская спектроскопия энергетических материалов в условиях in situ / operando. J. Electron Spectrosc. Relat. Феном. 200 , 264–273 (2015).
CAS Google ученый
- 34.
Favaro, M. et al. Наука о взаимодействии с использованием жесткой рентгеновской фотоэлектронной спектроскопии при атмосферном давлении. Поверхности 2 , 78–99 (2019).
Google ученый
- 35.
Masuda, T. et al. Рентгеновская фотоэлектронная спектроскопия in situ электрохимических реакций в обычных растворителях. Заявл. Phys. Lett. 103 , 111605 (2013).
ADS Google ученый
- 36.
Casalongue, H. S. et al. Прямое наблюдение кислородсодержащих веществ во время восстановления кислорода на платиновом катоде топливного элемента. Nat. Commun. 4 , 1–6 (2013).
Google ученый
- 37.
Hansen, W. N. Всплывший двойной слой. J. Electroanal. Chem. 150 , 133–140 (1983).
CAS Google ученый
- 38.
Д’Агостино, А. Т. и Хансен, В. Н. Наблюдение систематического электрохимически индуцированного сдвига энергии связи в спектрах XPS образовавшихся двухслойных частиц Cs + . Surf. Sci. 165 , 268–276 (1986).
ADS Google ученый
- 39.
Филиппини, Г., Гужон, Ф., Бонал, К. и Малфрейт, П. Влияние окружающей среды на окислительно-восстановительные свойства самоорганизованных монослоев: теоретическое исследование природы поддерживающего электролита. Soft Matter 7 , 8961–8968 (2011).
ADS CAS Google ученый
- 40.
Руднев А.В. и др. Самоорганизующиеся монослои алкантиола с ферроценовыми концевыми группами: исследование методом электрохимической и in situ спектроскопии инфракрасного поглощения с усилением поверхности. Электрохим. Acta 107 , 33–44 (2013).
CAS Google ученый
- 41.
Ли, Л. Ю., Сазерленд, Т. К., Рукаряну, С. и Леннокс, Р. Б. Ферроценилалкилтиолаты как проба гетерогенности в бинарных самоорганизующихся монослоях золота. Langmuir 22 , 4438–4444 (2006).
CAS PubMed Google ученый
- 42.
Nerngchamnong, N. et al. Неидеальное электрохимическое поведение SAM ферроценила-алкантиолата картирует микросреду окислительно-восстановительного звена. J. Phys. Chem. С. 119 , 21978–21991 (2015).
CAS Google ученый
- 43.
Ue, M. Подвижность и ионная ассоциация солей лития и четвертичного аммония в пропиленкарбонате и γ-бутиролактоне. J. Electrochem. Soc. 141 , 3336–3342 (1994).
ADS CAS Google ученый
- 44.
Asai, T., Kitada, A., Utsunomiya, T., Fukami, K. & Murase, K. Редокс SAM ферроценилтиола в электролитах с бис [(трифторметил) сульфонил] амидом в качестве уникальных анионов: Параллельно между водной и ионной жидкой средами. J. Electroanal. Chem. 795 , 75–80 (2017).
CAS Google ученый
- 45.
Сан, К.-В., Мурас, К., Ичи, Т., Сугимура, Х. Анионное влияние ионных жидкостных электролитов на электрохимическое поведение двойных SAM ферроценилтиол / алкантиол. J. Electroanal. Chem. 643 , 58–66 (2010).
- 46.
Shimazu, K., Yagi, I., Sato, Y. & Uosaki, K. Исследования электрохимического микробаланса кристаллов кварца самоорганизующихся монослоев 11-ферроценил-1-ундекантиола: структурно-зависимое образование пар ионов и поглощение растворителя. J. Electroanal.Chem. 372 , 117–124 (1994).
CAS Google ученый
- 47.
Ye, S., Haba, T., Sato, Y., Shimazu, K. & Uosaki, K. Поведение, зависящее от покрытия, вызванное окислительно-восстановительной реакцией изменения структуры и массопереноса в 11-ферроценил-1- Самоорганизованный монослой ундекантиола на золотом электроде исследовали с помощью комбинированной системы IRRAS – EQCM in situ. Phys. Chem. Chem. Phys. 1 , 3653–3659 (1999).
CAS Google ученый
- 48.
Бокрис, Дж. О. М. и Хан, С. У. М. Электрохимия поверхности: подход на молекулярном уровне (Plenum, США, 1993).
- 49.
Пирсон Р.Г. Твердые и мягкие кислоты и основания, HSAB, часть 1: основные принципы. J. Chem. Educ. 45 , 581 (1968).
CAS Google ученый
- 50.
Yokota, Y. et al. Сравнительные исследования фотоэлектронной спектроскопии и вольтамперометрии самоорганизующихся монослоев с терминированными ферроценами, обладающих различной электронодонорной способностью. J. Phys. Chem. С. 118 , 10936–10943 (2014).
CAS Google ученый
- 51.
Тейлор, A. W. и License, P. Рентгеновская фотоэлектронная спектроскопия ионных жидкостей на основе ферроценила и ферроцения. ChemPhysChem 13 , 1917–1926 (2012).
CAS PubMed Google ученый
- 52.
Мендес Де Лео, Л. П., де ла Ллав, Э., Шерлис, Д. и Уильямс, Ф. Дж. Молекулярная и электронная структура электроактивных самоорганизующихся монослоев. J. Chem. Phys. 138 , 114707 (2013).
ADS PubMed Google ученый
- 53.
Xu, Z.-F., Xie, Y., Feng, W.-L. И Шефер, Х.F. Систематическое исследование электронной и молекулярной структуры металлоценов первой серии переходных металлов M (C 5 H 5 ) 2 (M = V, Cr, Mn, Fe, Co и Ni). J. Phys. Chem. А 107 , 2716–2729 (2003).
CAS Google ученый
- 54.
Yokota, Y. et al. Вычислительные исследования модификаций электронной структуры самоорганизующихся монослоев с концевыми ферроценовыми группами: эффекты электронодонорных / отводящих функциональных групп, присоединенных к ферроценовому фрагменту. Phys. Chem. Chem. Phys. 19 , 32715–32722 (2017).
CAS PubMed Google ученый
- 55.
Yokota, Y. et al. Изменения электронного состояния самоорганизующихся монослоев с концевыми ферроценовыми группами, индуцированные молекулярно тонкими слоями ионной жидкости: исследование комбинированной атомно-силовой микроскопии, рентгеновской фотоэлектронной спектроскопии и ультрафиолетовой фотоэлектронной спектроскопии. J. Phys. Chem. С. 119 , 18467–18480 (2015).
CAS Google ученый
- 56.
Вонг, Р. А., Йокота, Ю., Вакисака, М., Инукай, Дж. И Ким, Ю. Выявление редокс-зависимых электронных и межфазных структур в электроактивных самоорганизующихся монослоях. J. Am. Chem. Soc. 140 , 13672–13679 (2018).
CAS PubMed Google ученый
- 57.
Хирата, Н., Шибута, М., Эгути, Т.И Накадзима, А. Динамика возбужденных электронов в самоорганизующихся монослоях с ферроценовым концом на Au (111): увеличенное время жизни потенциального состояния изображения. Chem. Phys. Lett. 561 , 131–136 (2013).
ADS Google ученый
- 58.
Плетчер, Д. Первый курс по электродным процессам (Королевское химическое общество, Лондон, 2019).
- 59.
Кальвенте, Дж. Дж., Андреу, Р., Молеро, М., Лопес-Перес, Г. и Домингес, М. Влияние пространственного окислительно-восстановительного распределения на электрохимическое поведение электроактивных самоорганизующихся монослоев. J. Phys. Chem. B 105 , 9557–9568 (2001).
CAS Google ученый
- 60.
Borup, R., Sauer, D. & Stuve, E. Исследование ex-situ электроосажденного свинца на платине (111): I. Исследование окислительно-восстановительного поведения поверхности свинца и динамического всплытия. Surf.Sci. 293 , 10–26 (1993).
ADS CAS Google ученый
- 61.
Колб Д. и Михаэлис Р. Влияние поверхностного электрического поля на электронные состояния адсорбата. J. Electroanal. Chem. Межфазный. Электрохим. 284 , 507–510 (1990).
CAS Google ученый
- 62.
Лазареску В. О значении сдвигов энергии связи остовного уровня, наблюдаемых при измерениях XPS на всплывающих электродах. J. Electron. Spectrosc. Relat. Феном. 104 , 41–45 (1999).
CAS Google ученый
- 63.
Mondal, P. C., Chhatwal, M., Jeyachandran, Y. L. & Zharnikov, M. Повышение оптических и электрохимических свойств за счет восходящей сборки бинарной олигомерной системы. J. Phys. Chem. С. 118 , 9578–9587 (2014).
CAS Google ученый
- 64.
Vogel, Y. B. et al. Воспроизводимые дефекты раскрывают электростатические аспекты электрохимии полупроводников. Nat. Commun. 8 , 2066 (2017).
ADS PubMed PubMed Central Google ученый
- 65.
Sano, H. et al. Формирование однородного монослоя с концевыми ферроценильными группами, ковалентно связанного с Si, с использованием реакции поверхности Si (111) с концевыми водородными группами с раствором винилферроцена / н-декана путем возбуждения видимым светом. J. Colloid Interface Sci. 361 , 259–269 (2011).
ADS CAS PubMed Google ученый
- 66.
Ohtake, T. & Tanaka, H. Redox-индуцированное срабатывание в макромолекулярных и самоорганизующихся системах. Polym. J. 48 , 25–37 (2016).
CAS Google ученый
- 67.
Bachman, J. C. et al. Электрохимическая полимеризация производных пирена на функционализированных углеродных нанотрубках для псевдоемкостных электродов. Nat. Commun. 6 , 1–9 (2015).
Google ученый
- 68.
Angerstein-Kozlowska, H., Conway, B., Hamelin, A. & Stoicoviciu, L. Элементарные стадии электрохимического окисления монокристаллических плоскостей Au Часть II. Химическая и структурная основа окисления плоскости (111). J. Electroanal. Chem. Межфазный. Электрохим. 228 , 429–453 (1987).
CAS Google ученый
- 69.
Faisal, F. et al. Электрификация модельных катализаторов для понимания электрокаталитических реакций в жидких электролитах. Nat. Mater. 17 , 592–598 (2018).
ADS CAS PubMed Google ученый
- Posted in Разное
Подсказка: e. любой анион
Навык:
Объяснять движение ионов в растворе электролитов.
Подсказка: да
Ионы двух типов движутся в противоположных направлениях.
Навык:
Объяснять движение ионов в растворе электролитов.
Подсказка: б. любая соль меди
любая соль меди
В качестве \ (\ ce {Zn} \) — электрода можно использовать любую соль. Но для электрода \ (\ ce {Cu} \) обычно используется \ (\ ce {CuSO4} \) или \ (\ ce {CuCl2} \).
Навык:
Применять химические знания при установке батарей.
Подсказка: б.\ (\ ce {NaCl} \) раствор
Обычно используют солевой раствор, но подойдут и растворы кислот и оснований. \ (\ ce {NaCl} \) раствор экономичен и прост в обращении.
Подсказка: e.поваренная соль
Навык:
Различать сильные и слабые электролиты.
Намек: ок. вода низкой температуры
вода низкой температуры
См. PH.
Навык:
Определение и оценка pH.
См. Редокс.
Навык:
Объяснять реакции метатезиса.
Электролитические свойства | Введение в химию
Цель обучения
Ключевые моменты
Условия
Электролитические свойства
Когда электроды помещаются в раствор электролита и подается напряжение, электролит проводит электричество. Одинокие электроны обычно не могут проходить через электролит; вместо этого на катоде происходит химическая реакция, которая поглощает электроны анода. Другая реакция происходит на аноде, производя электроны, которые в конечном итоге переносятся на катод. В результате в электролите вокруг катода образуется облако отрицательного заряда, а вокруг анода — положительный заряд.{-} [/ латекс]
Другая реакция происходит на аноде, производя электроны, которые в конечном итоге переносятся на катод. В результате в электролите вокруг катода образуется облако отрицательного заряда, а вокруг анода — положительный заряд.{-} [/ латекс]
и газообразный хлор будет освобожден. Положительно заряженные ионы натрия Na + будут реагировать на катод, нейтрализуя там отрицательный заряд OH — ; отрицательно заряженные гидроксид-ионы OH — будут реагировать на анод, нейтрализуя там положительный заряд Na + . Без ионов электролита заряды вокруг электрода замедляют непрерывный поток электронов; диффузия H + и OH — через воду к другому электроду занимает больше времени, чем перемещение гораздо более распространенных солевых ионов.
В других системах электродные реакции могут включать электродный металл, а также ионы электролита. Например, в батареях в качестве электродов используются два материала с различным сродством к электрону: вне батареи электроны текут от одного электрода к другому; внутри цепь замыкается ионами электролита. Здесь электродные реакции преобразуют химическую энергию в электрическую.
Здесь электродные реакции преобразуют химическую энергию в электрическую.
Окисление и восстановление на электродах
Окисление ионов или нейтральных молекул происходит на аноде, а восстановление ионов или нейтральных молекул происходит на катоде.{+} \ rightarrow [/ latex]
Гидрохинон Гидрохинон представляет собой восстановитель или донор электронов и органическую молекулу. Пара-бензохинон П-бензохинон является окислителем или акцептором электронов.В последнем примере ионы H + (ионы водорода) также принимают участие в реакции и предоставляются кислотой в растворе или самим растворителем (вода, метанол и т. Д.). Реакции электролиза с участием ионов H + довольно распространены в кислых растворах, тогда как реакции с участием OH- (гидроксид-ионы) обычны в щелочных водных растворах.
Окисленные или восстановленные вещества также могут быть растворителем (обычно водой) или электродами. Возможен электролиз с участием газов.
Чтобы определить, какие частицы в растворе будут окисляться, а какие — восстанавливаться, стандартный электродный потенциал каждого вещества может быть получен из таблицы стандартных потенциалов восстановления, небольшая выборка из которой представлена здесь:
Таблица стандартных электродных потенциалов Это стандартный потенциал восстановления для показанной реакции, измеренный в вольтах.0 (В) [/ латекс] = +1,36 В в таблице. Помните, что более положительный потенциал всегда означает, что эта реакция будет благоприятной; это будет иметь последствия в отношении окислительно-восстановительных реакций. Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Что такое электролит?
Электролит — это медицинский термин, обозначающий соль или ион в крови или другой жидкости организма, несущие заряд.
Растворение некоторых биологических полимеров, таких как ДНК, или синтетических полимеров, таких как полистиролсульфонат, дает раствор электролитов, называемых полиэлектролитами, и они содержат заряженные функциональные группы. Помещение соли в растворитель (например, воду) также приводит к получению раствора электролита, так как компоненты в соли диссоциируют в процессе, называемом сольватацией. Когда, например, в воду добавляют хлорид натрия или поваренную соль, соль растворяется и распадается на входящие в ее состав ионы натрия (Na +) и хлорид (Cl-). Аналогичным образом, когда газообразный диоксид углерода растворяется в воде, он производит ионы карбоната, ионы гидрокарбоната и ионы гидроксония. Расплавленные соли также могут быть электролитами. Например, расплавленный хлорид натрия становится жидкостью, которая может проводить электричество.
Аналогичным образом, когда газообразный диоксид углерода растворяется в воде, он производит ионы карбоната, ионы гидрокарбоната и ионы гидроксония. Расплавленные соли также могут быть электролитами. Например, расплавленный хлорид натрия становится жидкостью, которая может проводить электричество.
Электролит в растворе называется концентрированным, если он имеет большое количество ионов, и разбавленным, если он имеет низкое количество. Следовательно, если большое количество растворенного вещества диссоциирует с образованием свободных ионов, электролит является сильным, тогда как если диссоциирует небольшая часть растворенного вещества, электролит является слабым.Электролиты обладают несколькими свойствами, которые можно использовать в процессе электролиза как средство разделения и извлечения элементов и соединений, присутствующих в растворе.
В биологических системах основными электролитами являются:
Символ «плюс» или «минус» указывает на ионную природу вещества: его положительный или отрицательный заряд в результате диссокации. Эти электролиты необходимы для различных функций организма, и дисбаланс электролитов может быть опасным и даже опасным для жизни, в зависимости от клинического сценария. Таким образом, в организме тщательно поддерживается баланс уровней электролитов, и его можно проверить с помощью крови или мочи как показателя здоровья. Потеря электролитов обычна в случаях чрезмерной рвоты, диареи или потоотделения, но ее можно восполнить с помощью изотонических напитков или, в некоторых случаях, раствора для пероральной регидратации (ПРС).
Дополнительная литература
Термоэлектрические свойства полукристаллического полимера, легированного за пределами перехода изолятор-металл с помощью электролитного стробирования
ВВЕДЕНИЕ
Сбор тепловой энергии от низкотемпературных источников тепла, таких как человеческое тело, является многообещающим методом питания энергии для огромного количества микроустройств и датчиков в технологиях Интернета вещей. В частности, термоэлектрические генераторы, использующие проводящие полимеры, хорошо подходят для этой цели из-за присущей им легкости, гибкости и малотоксичности, а также легкости их изготовления на основе процессов в растворах ( 1 — 3 ).Однако термоэлектрические характеристики проводящих полимеров все еще намного ниже, чем у коммерческих продуктов, и поэтому для разработки высокоэффективных термоэлектрических материалов и устройств требуются руководящие принципы оптимизации.
В частности, термоэлектрические генераторы, использующие проводящие полимеры, хорошо подходят для этой цели из-за присущей им легкости, гибкости и малотоксичности, а также легкости их изготовления на основе процессов в растворах ( 1 — 3 ).Однако термоэлектрические характеристики проводящих полимеров все еще намного ниже, чем у коммерческих продуктов, и поэтому для разработки высокоэффективных термоэлектрических материалов и устройств требуются руководящие принципы оптимизации.
Одним из ключевых рабочих параметров термоэлектрических устройств является коэффициент мощности, P = S 2 σ, где S — коэффициент Зеебека, а σ — электропроводность. Было высказано предположение, что большинство проводящих полимеров, за исключением материалов на основе поли (3,4-этилендиокситиофена), не демонстрируют максимумов P при легировании носителя, т.е.е., P непрерывно увеличивается с увеличением σ для более высоких уровней легирования ( 4 — 11 ). Происхождение этого нетрадиционного поведения лежит в эмпирически известном степенном соотношении S σ -1 / s , где s в большинстве случаев равно 3 или 4. Широко признано, что эта нетрадиционная взаимосвязь возникает из-за неупорядоченной природы полимерных пленок, где на перенос заряда влияют структурные / энергетические нарушения внутри пленки.Отношение S -σ во многих легированных полимерах недавно было феноменологически воспроизведено с помощью модели, учитывающей энергозависимую транспортную функцию ( 7 ). На основе вышеизложенной концепции активное управление эффектами беспорядка на процесс переноса заряда является фундаментальным подходом к управлению P посредством модификации эмпирического соотношения S -σ.
Происхождение этого нетрадиционного поведения лежит в эмпирически известном степенном соотношении S σ -1 / s , где s в большинстве случаев равно 3 или 4. Широко признано, что эта нетрадиционная взаимосвязь возникает из-за неупорядоченной природы полимерных пленок, где на перенос заряда влияют структурные / энергетические нарушения внутри пленки.Отношение S -σ во многих легированных полимерах недавно было феноменологически воспроизведено с помощью модели, учитывающей энергозависимую транспортную функцию ( 7 ). На основе вышеизложенной концепции активное управление эффектами беспорядка на процесс переноса заряда является фундаментальным подходом к управлению P посредством модификации эмпирического соотношения S -σ.
Здесь мы демонстрируем, что эмпирическое соотношение S -σ проводящего полимера действительно может быть изменено посредством контролируемого легирования носителя.Мы ориентируемся на поли [2,5-бис (3-алкилтиофен-2-ил) тиено (3,2-b) тиофен] (PBTTT) в качестве целевого полимера, поскольку он демонстрирует самую высокую проводимость 1300 См / см среди растворов. обрабатываемые полукристаллические полимеры путем легирования химического носителя 4-этилбензолсульфоновой кислотой ( 11 ), что указывает на то, что легированный PBTTT является одним из ключевых материалов, на которые нарушения минимально влияют. Фактически, мы ранее продемонстрировали, что макроскопический переход изолятор-металл индуцируется в тонкой пленке PBTTT за счет увеличения уровня легирования с использованием метода электролитного стробирования ( 12 ).В отличие от обычных транзисторов, использующих изолятор с твердым затвором ( 13 , 14 ), настоящая технология позволяет непрерывно контролировать уровень легирования проводящих полимеров до очень высоких концентраций с помощью электрохимического процесса ( 12 , 15 — 20 ). Таким образом, PBTTT с электролитом обеспечивает подходящую платформу для полного понимания термоэлектрических свойств PBTTT, включая металлическое состояние.
обрабатываемые полукристаллические полимеры путем легирования химического носителя 4-этилбензолсульфоновой кислотой ( 11 ), что указывает на то, что легированный PBTTT является одним из ключевых материалов, на которые нарушения минимально влияют. Фактически, мы ранее продемонстрировали, что макроскопический переход изолятор-металл индуцируется в тонкой пленке PBTTT за счет увеличения уровня легирования с использованием метода электролитного стробирования ( 12 ).В отличие от обычных транзисторов, использующих изолятор с твердым затвором ( 13 , 14 ), настоящая технология позволяет непрерывно контролировать уровень легирования проводящих полимеров до очень высоких концентраций с помощью электрохимического процесса ( 12 , 15 — 20 ). Таким образом, PBTTT с электролитом обеспечивает подходящую платформу для полного понимания термоэлектрических свойств PBTTT, включая металлическое состояние.
В настоящем исследовании мы наблюдали максимум P в PBTTT вокруг перехода изолятор-металл при легировании носителями. Кроме того, мы тщательно исследовали структурный / энергетический беспорядок, вызванный электрохимическим легированием, с помощью измерений дифракции рентгеновских лучей и электронного парамагнитного резонанса (ЭПР). Пленка без беспорядка обеспечивает процесс переноса металлического заряда в сильно легированном состоянии, где соотношение S -σ хорошо описывается уравнением Мотта, обеспечивая максимальное значение P на границе с неметаллической областью, демонстрирующей эмпирическое значение S ∝ σ −1 / с соотношение.
Кроме того, мы тщательно исследовали структурный / энергетический беспорядок, вызванный электрохимическим легированием, с помощью измерений дифракции рентгеновских лучей и электронного парамагнитного резонанса (ЭПР). Пленка без беспорядка обеспечивает процесс переноса металлического заряда в сильно легированном состоянии, где соотношение S -σ хорошо описывается уравнением Мотта, обеспечивая максимальное значение P на границе с неметаллической областью, демонстрирующей эмпирическое значение S ∝ σ −1 / с соотношение.
РЕЗУЛЬТАТЫ
Термоэлектрические свойства тонких пленок PBTTT, легированных электролитным затвором
На рисунке 1 (A и B) схематически показана экспериментальная установка, которая позволяет одновременно измерять S и σ при легировании носителем ( 18 ) и фотография структуры тонкопленочного транзистора (TFT) PBTTT соответственно. Устройство TFT было сформировано на верхней части стеклянной подложки с изолятором затвора из ионной жидкости, как описано в разделе «Материалы и методы». Концентрацию носителей можно непрерывно контролировать, прикладывая напряжение затвора ( В, , г, ) на протяжении всего процесса электрохимического легирования, когда ионы легирующей примеси проникают в объемную пленку. σ определяется из вольт-амперных характеристик, полученных при применении В, , г, , как показано на рис. 1С. S определяется из наклона термоэлектродвижущей силы (Δ V ) в зависимости от разницы температур (Δ T ) между электродами ( S = Δ В / Δ T ) для каждого В г , как показано на рис.1D.
Концентрацию носителей можно непрерывно контролировать, прикладывая напряжение затвора ( В, , г, ) на протяжении всего процесса электрохимического легирования, когда ионы легирующей примеси проникают в объемную пленку. σ определяется из вольт-амперных характеристик, полученных при применении В, , г, , как показано на рис. 1С. S определяется из наклона термоэлектродвижущей силы (Δ V ) в зависимости от разницы температур (Δ T ) между электродами ( S = Δ В / Δ T ) для каждого В г , как показано на рис.1D.
( A ) Схематическое изображение системы измерения термоэлектрических свойств при затворе электролита вместе с химическими структурами PBTTT и ионной жидкости [DEME] [TFSI]. TFT, управляемый ионной жидкостью, устанавливается между двумя устройствами Пельтье, а индуцированная разность температур (Δ T ) между S / D электродами контролируется двумя термопарами.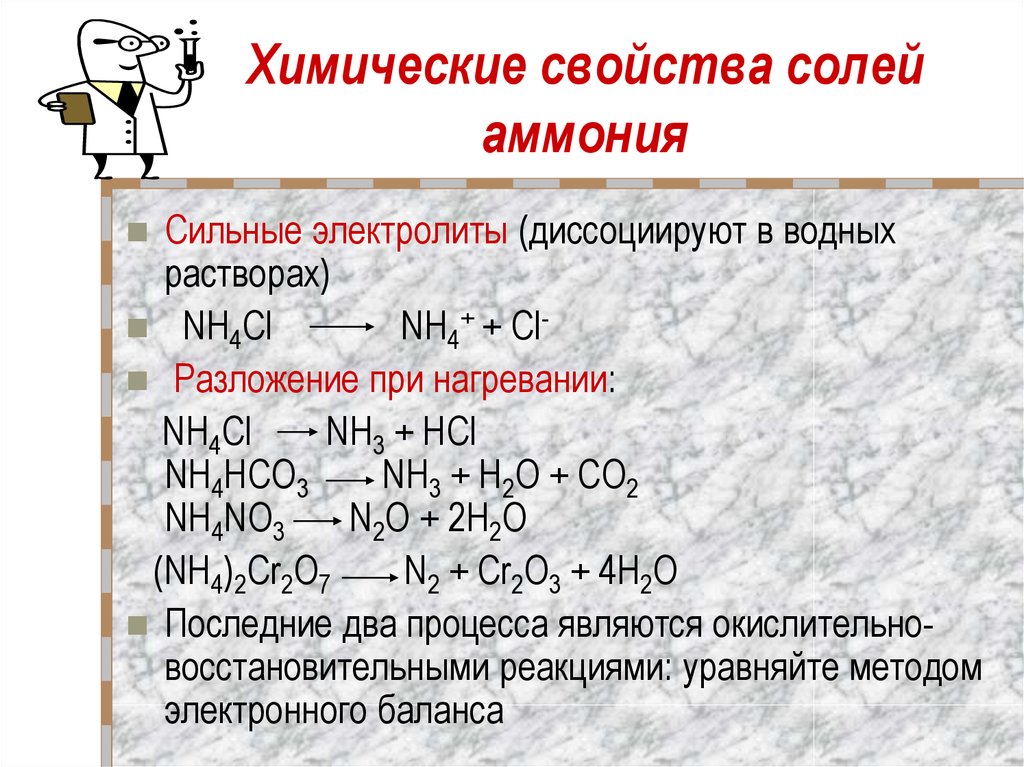 ( B ) Фотография TFT со стробированием с ионной жидкостью. ( C ) Пример характеристик тока стока ( I d ) — напряжения стока ( В d ). ( D ) Пример измерения термоэлектродвижущей силы (Δ В ) относительно Δ T при приложении напряжения затвора ( В г ). ( E ) Зависимость от электрической проводимости (σ) коэффициента Зеебека ( S ) и коэффициента термоэлектрической мощности ( P ), полученные с помощью метода электролитного стробирования.Пунктирные линии представляют отношение S ∝ σ −1/4 и соотношение P ∝ σ 1/2 , ожидаемое из эмпирического соотношения, а также ожидаемое соотношение S ∝ σ −1 . из уравнения Мотта. На вставке показан график S -log σ (Йонкер) с пунктирной линией, соответствующий случаю обычного термически активируемого процесса. Фото: К.
( B ) Фотография TFT со стробированием с ионной жидкостью. ( C ) Пример характеристик тока стока ( I d ) — напряжения стока ( В d ). ( D ) Пример измерения термоэлектродвижущей силы (Δ В ) относительно Δ T при приложении напряжения затвора ( В г ). ( E ) Зависимость от электрической проводимости (σ) коэффициента Зеебека ( S ) и коэффициента термоэлектрической мощности ( P ), полученные с помощью метода электролитного стробирования.Пунктирные линии представляют отношение S ∝ σ −1/4 и соотношение P ∝ σ 1/2 , ожидаемое из эмпирического соотношения, а также ожидаемое соотношение S ∝ σ −1 . из уравнения Мотта. На вставке показан график S -log σ (Йонкер) с пунктирной линией, соответствующий случаю обычного термически активируемого процесса. Фото: К. Канахаши, Университет Васэда.
Канахаши, Университет Васэда.
На рисунке 1E показана зависимость σ S (вверху) и P (внизу), полученная для двух независимых устройств при комнатной температуре.Мы получили данные с высокой воспроизводимостью между двумя устройствами с довольно небольшим разбросом данных из-за непрерывного легирования носителей заряда методом электролитного стробирования. Наблюдаемая форма отношения S -σ обратима, если V g не превышает порог ухудшения работы устройства (рис. S1). Мы сразу же замечаем, что P демонстрирует четкий максимум примерно выше 100 См / см. Хотя было несколько отчетов о легированном PBTTT, показывающем нечеткую сигнатуру максимального значения P , физическая подоплека такого поведения еще не выяснена ( 19 , 20 ).Как правило, образование максимума P ожидается в следующих двух случаях: Первый случай — это обычные невырожденные полупроводники, где соотношение S- σ описывается логарифмическим соотношением S ∝ ln σ ( см. раздел S1) ( 21 , 22 ). В этом случае зависимость σ S- становится линейной на графике S в зависимости от log σ (график Джонкера) с абсолютным наклоном 198 мкВ / К, который показан пунктирной линией на вставке к рис.1E. Однако наблюдаемый наклон графика Йонкера намного меньше ожидаемого значения, как сообщалось ранее для допированного полианилина и полипиррола ( 23 ). Кроме того, мы наблюдаем, что наклон графика Джонкера показывает постепенные изменения около σ ~ 10 и 100 См / см, указывая на то, что обычный термически активированный процесс не может просто объяснить наши экспериментальные данные. Во втором случае было указано, что максимум P имеет тенденцию наблюдаться, если электронное состояние изменяется с невырожденного на вырожденное состояния при легировании носителями ( 24 , 25 ).В этом случае σ-отношение S- (или σ-соотношение P-) может быть разделено на две области на уровне легирования, давая максимум P , отражающий фундаментальное изменение электронных свойств легированных материалов.
раздел S1) ( 21 , 22 ). В этом случае зависимость σ S- становится линейной на графике S в зависимости от log σ (график Джонкера) с абсолютным наклоном 198 мкВ / К, который показан пунктирной линией на вставке к рис.1E. Однако наблюдаемый наклон графика Йонкера намного меньше ожидаемого значения, как сообщалось ранее для допированного полианилина и полипиррола ( 23 ). Кроме того, мы наблюдаем, что наклон графика Джонкера показывает постепенные изменения около σ ~ 10 и 100 См / см, указывая на то, что обычный термически активированный процесс не может просто объяснить наши экспериментальные данные. Во втором случае было указано, что максимум P имеет тенденцию наблюдаться, если электронное состояние изменяется с невырожденного на вырожденное состояния при легировании носителями ( 24 , 25 ).В этом случае σ-отношение S- (или σ-соотношение P-) может быть разделено на две области на уровне легирования, давая максимум P , отражающий фундаментальное изменение электронных свойств легированных материалов. Зависимость S- σ, наблюдаемая на рис. 1E, следует эмпирической тенденции S ∝ σ −1/4 (или P ∝ σ 1/2 ) в области низкой проводимости (σ < 100 См / см), тогда как он отклоняется от этого соотношения с увеличением σ, приближаясь к соотношению S ∝ σ −1 , как показано пунктирными линиями на рис.1E. Обратное соотношение S ∝ σ −1 фактически ожидается из уравнения Мотта, полученного для вырожденных (или металлических) состояний (см. Раздел S1) ( 22 , 26 ).
Зависимость S- σ, наблюдаемая на рис. 1E, следует эмпирической тенденции S ∝ σ −1/4 (или P ∝ σ 1/2 ) в области низкой проводимости (σ < 100 См / см), тогда как он отклоняется от этого соотношения с увеличением σ, приближаясь к соотношению S ∝ σ −1 , как показано пунктирными линиями на рис.1E. Обратное соотношение S ∝ σ −1 фактически ожидается из уравнения Мотта, полученного для вырожденных (или металлических) состояний (см. Раздел S1) ( 22 , 26 ).
Далее мы рассмотрим возможность реализации описанного выше сценария с точки зрения структуры, микроскопических электронных состояний и макроскопических транспортных свойств легированных пленок PBTTT. Поскольку процесс электрохимического легирования включает инфильтрацию ионов легирующей примеси в пленку, мы сначала исследуем возможность структурной модификации расположения молекул во время процесса легирования, которая может повлиять на термоэлектрические свойства. С этой целью мы провели эксперименты по дифракции рентгеновских лучей при скользящем падении (GIXD) на легированной полимерной пленке, как описано ниже.
С этой целью мы провели эксперименты по дифракции рентгеновских лучей при скользящем падении (GIXD) на легированной полимерной пленке, как описано ниже.
Рентгеноструктурный анализ тонких пленок из легированного PBTTT
На рис. 2 представлены результаты экспериментов GIXD, полученные в результате измерений ex situ (см. Материалы и методы). Аналогичные результаты, полученные при натурных измерениях, также показаны на рис. S2. В исходной пленке ( В, , г, = 0 В) наблюдались четкие внеплоскостные ( h 00) пики рассеяния, соответствующие ламеллярной структуре до четвертого порядка, а также плоскостная (010) пик, соответствующий π-π стопке, указывающий на высококристаллический характер тонкой пленки PBTTT ( 27 ).Получение изображений поверхности пленки с помощью атомно-силовой микроскопии (АСМ) также подтверждает высокую кристалличность (рис. S3). После легирования носителями, профили пиков демонстрируют четкие изменения, которые показаны на рис. 2 (B и D) для пика (100) и на рис. 2 (C и E) для пика (010). Вектор рассеяния q z пика (100) непрерывно смещается в сторону меньших значений как | V г | увеличивается из-за расширения межламеллярного расстояния от 23,3 Å при В г = 0 В до 29.4 Å при В г = −1,6 В, как показано на рис. 2D. Это расширение вызвано интеркалированием анионов бис (трифторметансульфонил) имида (TFSI) в пленку, что также было зарегистрировано для 2,3,5,6-тетрафтор-7,7,8,8-тетрацианохинодиметана (F 4 -TCNQ) -допированный PBTTT ( 28 ) или поли (3-гексилтиофен), легированный TFSI (P3HT) ( 29 , 30 ). Однако по сравнению с предыдущими исследованиями, увеличение периода решетки в данном случае намного больше (~ 6 Å), что близко к длине аниона TFSI ~ 8.0 Å (длинная ось) ( 31 ). Этот результат подразумевает, что молекулы TFSI расположены в межламеллярном положении и образуют сквозную конфигурацию с алкильными боковыми цепями, как схематически показано на фиг.
2 (B и D) для пика (100) и на рис. 2 (C и E) для пика (010). Вектор рассеяния q z пика (100) непрерывно смещается в сторону меньших значений как | V г | увеличивается из-за расширения межламеллярного расстояния от 23,3 Å при В г = 0 В до 29.4 Å при В г = −1,6 В, как показано на рис. 2D. Это расширение вызвано интеркалированием анионов бис (трифторметансульфонил) имида (TFSI) в пленку, что также было зарегистрировано для 2,3,5,6-тетрафтор-7,7,8,8-тетрацианохинодиметана (F 4 -TCNQ) -допированный PBTTT ( 28 ) или поли (3-гексилтиофен), легированный TFSI (P3HT) ( 29 , 30 ). Однако по сравнению с предыдущими исследованиями, увеличение периода решетки в данном случае намного больше (~ 6 Å), что близко к длине аниона TFSI ~ 8.0 Å (длинная ось) ( 31 ). Этот результат подразумевает, что молекулы TFSI расположены в межламеллярном положении и образуют сквозную конфигурацию с алкильными боковыми цепями, как схематически показано на фиг. 2F. Обратите внимание, что даже при таком большом расширении решетки мы не наблюдаем уширения линий дифракционных пиков, как показано на рис. 2D, что указывает на то, что кристалличность ламеллярной структуры не ухудшается интеркаляцией анионов. Кроме того, интеркаляция анионов происходит обратимо, о чем свидетельствует тот факт, что шаг решетки восстанавливается близко к исходному значению, когда мы прикладываем положительное напряжение после легирования, что подтверждается измерениями in situ, показанными на рис.S2B. Судя по обратимости данных GIXD, временной масштаб процесса легирования / дедопирования составляет более 20 минут. Этот медленный процесс вызывает большой гистерезис σ по отношению к сканированию вверх и вниз V g , как показано на вставках к рис. S1. Однако, если мы сосредоточимся на соотношении S- σ на рис. S1B, то гистерезиса не наблюдается, что указывает на то, что ионная инфильтрация не вызывает необратимого повреждения пленки.
2F. Обратите внимание, что даже при таком большом расширении решетки мы не наблюдаем уширения линий дифракционных пиков, как показано на рис. 2D, что указывает на то, что кристалличность ламеллярной структуры не ухудшается интеркаляцией анионов. Кроме того, интеркаляция анионов происходит обратимо, о чем свидетельствует тот факт, что шаг решетки восстанавливается близко к исходному значению, когда мы прикладываем положительное напряжение после легирования, что подтверждается измерениями in situ, показанными на рис.S2B. Судя по обратимости данных GIXD, временной масштаб процесса легирования / дедопирования составляет более 20 минут. Этот медленный процесс вызывает большой гистерезис σ по отношению к сканированию вверх и вниз V g , как показано на вставках к рис. S1. Однако, если мы сосредоточимся на соотношении S- σ на рис. S1B, то гистерезиса не наблюдается, что указывает на то, что ионная инфильтрация не вызывает необратимого повреждения пленки.
 2 GIXD измерения тонкой пленки PBTTT при электролитном затворе.
2 GIXD измерения тонкой пленки PBTTT при электролитном затворе.( A ) Узоры GIXD, полученные из чистой пленки PBTTT на стеклянной подложке. ( B ) V г Зависимость пика (100) и ( C ) (010), полученных в результате измерений ex situ, где пленка ионной жидкости удаляется перед измерениями после нанесения V г . ( D ) Зависимость V g межламеллярного расстояния, полученная из положения пика (100) и полной ширины на полувысоте (FWHM) соответствующих пиков.( E ) π-π расстояние суммирования, полученное из положения пика (010). ( F ) Схематическое изображение расположения молекул в легированной пленке, где анионы TFSI расположены в областях алкильной цепи.
Кроме того, мы также наблюдаем явный сдвиг в векторе рассеяния q xy пика (010) в сторону более высоких значений при легировании, что указывает на сокращение расстояния накопления π-π, как показано на рис. (C и E). О подобном сжатии также сообщалось в тонких пленках P3HT с электролитным затвором ( 29 , 30 ).Недавний расчет теории функционала плотности (DFT) предполагает, что делокализация межцепочечных поляронов посредством π-π-укладки может быть возможным источником такого сжатия в легированном P3HT ( 32 ). Настоящие измерения GIXD убедительно свидетельствуют о том, что система не проявляет структурной деградации при легировании, указывая на то, что отклонение отношения σ S- от эмпирического тренда на рис. 1E не происходит из-за модификации кристалличности путем легирования. Затем мы рассматриваем изменение электронного состояния или свойств переноса заряда, вызванное легированием.Во-первых, ниже мы обсудим изменение электронного состояния внутри кристаллических доменов, наблюдаемое с помощью спектроскопии ЭПР.
(C и E). О подобном сжатии также сообщалось в тонких пленках P3HT с электролитным затвором ( 29 , 30 ).Недавний расчет теории функционала плотности (DFT) предполагает, что делокализация межцепочечных поляронов посредством π-π-укладки может быть возможным источником такого сжатия в легированном P3HT ( 32 ). Настоящие измерения GIXD убедительно свидетельствуют о том, что система не проявляет структурной деградации при легировании, указывая на то, что отклонение отношения σ S- от эмпирического тренда на рис. 1E не происходит из-за модификации кристалличности путем легирования. Затем мы рассматриваем изменение электронного состояния или свойств переноса заряда, вызванное легированием.Во-первых, ниже мы обсудим изменение электронного состояния внутри кристаллических доменов, наблюдаемое с помощью спектроскопии ЭПР.
Измерения ESR легированных тонких пленок
На рис. 3A схематически показано устройство TFT, управляемое ионной жидкостью, которое позволяет одновременно измерять ESR и проводимость при В g ( 33 ). Подавая на устройство отрицательный В g , мы наблюдаем четкий сигнал ЭПР положительных носителей (поляронов) на цепи PBTTT, как показано на рис.3B. Сигнал ESR наблюдается со значением g , равным 2,003, независимо от значения V g , когда мы прикладываем внешнее магнитное поле ( H ), перпендикулярное подложке. Этот результат показывает, что носители находятся в области, ориентированной с ребра, как показано на фиг. 3С, что согласуется с результатами GIXD, показывающими отсутствие кристаллической деградации в легированной пленке (см. Также раздел S5).
Подавая на устройство отрицательный В g , мы наблюдаем четкий сигнал ЭПР положительных носителей (поляронов) на цепи PBTTT, как показано на рис.3B. Сигнал ESR наблюдается со значением g , равным 2,003, независимо от значения V g , когда мы прикладываем внешнее магнитное поле ( H ), перпендикулярное подложке. Этот результат показывает, что носители находятся в области, ориентированной с ребра, как показано на фиг. 3С, что согласуется с результатами GIXD, показывающими отсутствие кристаллической деградации в легированной пленке (см. Также раздел S5).
( A ) Схематическое изображение структуры TFT с нижним контактом с верхним затвором, используемой для измерений ESR при электролитном затворе. Две подложки с полимерной пленкой и пленкой ионной жидкости на каждой из них ламинируются, образуя шахматную структуру TFT. ( B ) Сигнал ESR, полученный при приложении V g с магнитным полем ( H ), перпендикулярным подложке. Фоновый сигнал при В g = +1 В был вычтен из всех данных.( C ) Схематическое изображение молекул, ориентированных с ребра. ( D ) σ зависимость спиновой восприимчивости χ, полученная из интегральной интенсивности ЭПР. ( E ) Полная ширина линии ESR (Δ H pp ). Пунктирная линия в (D) показывает руководство к соотношению χ ∝ σ.
( B ) Сигнал ESR, полученный при приложении V g с магнитным полем ( H ), перпендикулярным подложке. Фоновый сигнал при В g = +1 В был вычтен из всех данных.( C ) Схематическое изображение молекул, ориентированных с ребра. ( D ) σ зависимость спиновой восприимчивости χ, полученная из интегральной интенсивности ЭПР. ( E ) Полная ширина линии ESR (Δ H pp ). Пунктирная линия в (D) показывает руководство к соотношению χ ∝ σ.
По интегральной интенсивности сигнала ЭПР определялась спиновая восприимчивость χ легированной пленки. На рисунке 3D показан график зависимости χ от σ, полученный одновременно с измерениями ESR.В области низкой проводимости мы наблюдаем резкое увеличение χ с увеличением σ. В слаболегированных областях, где поляроны магнитно изолированы, спиновая восприимчивость следует закону Кюри χ = Ng 2 μ B 2 S ( S + 1) / 3 k B T , где N — общее количество спинов. В этом случае спиновая восприимчивость пропорциональна концентрации носителей n , и тогда соотношение χ ∝ σ ожидается в предположении постоянной подвижности.Это соотношение действительно наблюдается в области очень низкой проводимости σ <0,01 См / см на рис. 3D, что указывает на то, что изолированные поляроны доминируют в переносе заряда в процессе прыжков. В этом случае хорошо задокументировано, что ширина линии ЭПР определяется сверхтонким взаимодействием с соседними ядрами протонов (см. Также рис. S4A), которое не зависит от n ( 33 , 34 ). Это явление согласуется с тем фактом, что ширина линии ЭПР от пика до пика (Δ H pp ) практически не имеет зависимости σ в области низкой проводимости, как показано на рис.3E.
В этом случае спиновая восприимчивость пропорциональна концентрации носителей n , и тогда соотношение χ ∝ σ ожидается в предположении постоянной подвижности.Это соотношение действительно наблюдается в области очень низкой проводимости σ <0,01 См / см на рис. 3D, что указывает на то, что изолированные поляроны доминируют в переносе заряда в процессе прыжков. В этом случае хорошо задокументировано, что ширина линии ЭПР определяется сверхтонким взаимодействием с соседними ядрами протонов (см. Также рис. S4A), которое не зависит от n ( 33 , 34 ). Это явление согласуется с тем фактом, что ширина линии ЭПР от пика до пика (Δ H pp ) практически не имеет зависимости σ в области низкой проводимости, как показано на рис.3E.
С другой стороны, выше σ ~ 1 См / см мы наблюдаем четкое уширение линий, как показано на рис. 3Е, что указывает на качественно иную динамику спина в этой области. Подобное уширение линий также наблюдалось в наших предыдущих измерениях ЭПР легированного PBTTT ( 33 , 35 ), и происхождение этого поведения обоснованно приписывается механизму электронов проводимости Эллиотта ( 36 ). В этом случае рассеяние электронов проводимости на фононах с переворотом спина определяет время спиновой релаксации, вызывая уширение ширины линии.Поскольку спин-фононное взаимодействие опосредовано спин-орбитальной связью, аналогичной сдвигу g (Δ g ) от значения свободного электрона g (2,0023), ширина линии в этом процессе сильно коррелирует с g согласно соотношению Δ H pp ∝ (Δ g ) 2 / τ, где τ обозначает время рассеяния с переворотом спина ( 37 ). Положительная корреляция между значением g и шириной линии наблюдается в угловой зависимости значения g и ширины линии, как показано на рис.S4, в области σ> 1 См / см, что убедительно свидетельствует о том, что носители начинают делокализоваться. Этот факт указывает на то, что энергетический беспорядок, который имеет тенденцию приводить к ограниченному ловушкой переносу заряда, не доминирует в процессе переноса внутри кристаллической области выше 1 См / см.
В этом случае рассеяние электронов проводимости на фононах с переворотом спина определяет время спиновой релаксации, вызывая уширение ширины линии.Поскольку спин-фононное взаимодействие опосредовано спин-орбитальной связью, аналогичной сдвигу g (Δ g ) от значения свободного электрона g (2,0023), ширина линии в этом процессе сильно коррелирует с g согласно соотношению Δ H pp ∝ (Δ g ) 2 / τ, где τ обозначает время рассеяния с переворотом спина ( 37 ). Положительная корреляция между значением g и шириной линии наблюдается в угловой зависимости значения g и ширины линии, как показано на рис.S4, в области σ> 1 См / см, что убедительно свидетельствует о том, что носители начинают делокализоваться. Этот факт указывает на то, что энергетический беспорядок, который имеет тенденцию приводить к ограниченному ловушкой переносу заряда, не доминирует в процессе переноса внутри кристаллической области выше 1 См / см.
Когда делокализованные носители образуют вырожденное (или металлическое) состояние при легировании, закон Кюри больше не выполняется, и ожидается спиновая восприимчивость Паули. В этом случае χ пропорционален плотности состояний на уровне энергии Ферми, а не n ( 38 ).Мы ранее подтвердили, что не зависящая от температуры спиновая восприимчивость Паули действительно наблюдается в высоколегированном PBTTT с использованием метода электролитного стробирования, хотя σ-зависимость χ отсутствовала ( 33 ). В настоящем исследовании мы наблюдаем, что увеличение χ почти достигает насыщения при увеличении σ выше 1 См / см, что связано с уширением линий из-за делокализации носителей заряда. Это наблюдение является микроскопическим признаком образования вырожденного (или металлического) электронного состояния в доменах, ориентированных с ребра.Текущие параметры ESR не показывают заметных аномалий около σ ~ 100 См / см, где отношение S-σ показывает отклонение от отношения S ∝ σ −1/4 на рис. 1E, хотя уширение линии вызывает относительно большое ошибки в оценке χ в этой области. Это открытие указывает на то, что термоэлектрические свойства изменяются независимо от микроскопического электронного состояния внутри доменов. Затем мы исследуем изменение макроскопических процессов переноса заряда при легировании носителями заряда, как обсуждается ниже.
1E, хотя уширение линии вызывает относительно большое ошибки в оценке χ в этой области. Это открытие указывает на то, что термоэлектрические свойства изменяются независимо от микроскопического электронного состояния внутри доменов. Затем мы исследуем изменение макроскопических процессов переноса заряда при легировании носителями заряда, как обсуждается ниже.
Макроскопические свойства переноса заряда легированных пленок
На рисунке 4А показана температурная зависимость σ, полученная при различных значениях В, , г, . Мы наблюдаем явное увеличение проводимости при комнатной температуре (σ RT ) при | V г | увеличивается. Область с отрицательным температурным градиентом ( d σ / dT <0), указывающая на металлическое состояние, появляется в | V г | область, край.Металлическое поведение наблюдается даже ниже 200 К при | V г | > 1,7 В, что ниже температуры замерзания электролита, что указывает на то, что появление металлических свойств не является искусственным эффектом из-за подвижных ионов. Хотя проводимость проявляет неметаллическое поведение при низких температурах, температура кроссовера смещается в сторону более низких температур как | V г | увеличивается, указывая на то, что металлическое состояние становится более стабильным по мере увеличения уровня легирования.Мы также подтверждаем образование металлического состояния на основе измерений магнитосопротивления при В, , g, = –2,2 В и 150 К. Результат показан на рис. 4B с H , перпендикулярным подложке. Мы наблюдаем небольшое, но конечное положительное магнитосопротивление (Δρ = ρ ( H ) — ρ (0)) в соответствии с простым квадратичным соотношением Δρ ∝ H 2 , характерным для металлического состояния. Никаких признаков слабой локализации или механизмов перескока переменной дальности на рис.4B, в отличие от случая легированного PBTTT, демонстрирующего неметаллическую проводимость ( d σ / dT > 0) ( 28 ). Эти данные убедительно указывают на то, что настоящий PBTTT претерпевает макроскопический металлический переход посредством электролитной вентиляции при высоких температурах.
Хотя проводимость проявляет неметаллическое поведение при низких температурах, температура кроссовера смещается в сторону более низких температур как | V г | увеличивается, указывая на то, что металлическое состояние становится более стабильным по мере увеличения уровня легирования.Мы также подтверждаем образование металлического состояния на основе измерений магнитосопротивления при В, , g, = –2,2 В и 150 К. Результат показан на рис. 4B с H , перпендикулярным подложке. Мы наблюдаем небольшое, но конечное положительное магнитосопротивление (Δρ = ρ ( H ) — ρ (0)) в соответствии с простым квадратичным соотношением Δρ ∝ H 2 , характерным для металлического состояния. Никаких признаков слабой локализации или механизмов перескока переменной дальности на рис.4B, в отличие от случая легированного PBTTT, демонстрирующего неметаллическую проводимость ( d σ / dT > 0) ( 28 ). Эти данные убедительно указывают на то, что настоящий PBTTT претерпевает макроскопический металлический переход посредством электролитной вентиляции при высоких температурах. Дальнейшие детали макроскопических процессов переноса заряда, особенно для низкотемпературного изолирующего состояния, будут опубликованы в другом месте.
Дальнейшие детали макроскопических процессов переноса заряда, особенно для низкотемпературного изолирующего состояния, будут опубликованы в другом месте.
( A ) Температурная зависимость σ, полученная при применении В г . Стрелки и закрашенные точки указывают положение максимума проводимости. ( B ) Зависимость отношения магнитосопротивлений (Δρ / ρ) от магнитного поля, полученная при В г = −2,2 В при 150 К. Магнитное поле прикладывается перпендикулярно плоскости пленки, как показано на рисунке. Сплошная кривая показывает аппроксимацию экспериментальных данных квадратичным соотношением H .
Взаимосвязь между переносом заряда и термоэлектрическими свойствами
На рисунке 5A суммированы зависимости S -σ при комнатной температуре, полученные в настоящем исследовании, вместе с данными других групп с различными методами легирования и легирующими добавками ( 5 , 8 , 9 , 19 , 20 ). Информация об электронном состоянии и процессе переноса заряда, обнаруженная, как описано выше, также включена в рисунок.Сразу отметим, что проводимость, при которой соотношение S -σ отклоняется от эмпирического тренда, достаточно хорошо согласуется с проводимостью, при которой наблюдаются металлические транспортные свойства, то есть σ RT ~ 100 См / см. Это открытие убедительно подтверждает, что соотношение S ∝ σ -1 , наблюдаемое в области высокой проводимости, действительно следует уравнению Мотта, отражая металлическую природу системы. Напротив, σ демонстрирует неметаллическую температурную зависимость в области σ RT <100 См / см, хотя микроскопическое электронное состояние в кристаллической области является металлическим выше 1 См / см.Этот результат показывает, что макроскопический процесс переноса заряда в основном ограничивается структурной неоднородностью, такой как границы доменов, а не захватом заряда внутри кристаллитов.
Информация об электронном состоянии и процессе переноса заряда, обнаруженная, как описано выше, также включена в рисунок.Сразу отметим, что проводимость, при которой соотношение S -σ отклоняется от эмпирического тренда, достаточно хорошо согласуется с проводимостью, при которой наблюдаются металлические транспортные свойства, то есть σ RT ~ 100 См / см. Это открытие убедительно подтверждает, что соотношение S ∝ σ -1 , наблюдаемое в области высокой проводимости, действительно следует уравнению Мотта, отражая металлическую природу системы. Напротив, σ демонстрирует неметаллическую температурную зависимость в области σ RT <100 См / см, хотя микроскопическое электронное состояние в кристаллической области является металлическим выше 1 См / см.Этот результат показывает, что макроскопический процесс переноса заряда в основном ограничивается структурной неоднородностью, такой как границы доменов, а не захватом заряда внутри кристаллитов. Эмпирическое соотношение S ∝ σ −1/4 , по-видимому, в этом случае наблюдается независимо от микроскопических электронных состояний, таких как вырожденное состояние, невырожденное состояние или изолированные поляроны. Подчеркнем, что максимальный коэффициент мощности возникает на границе макроскопически металлического состояния и неметаллического состояния в легированной пленке PBTTT.
Эмпирическое соотношение S ∝ σ −1/4 , по-видимому, в этом случае наблюдается независимо от микроскопических электронных состояний, таких как вырожденное состояние, невырожденное состояние или изолированные поляроны. Подчеркнем, что максимальный коэффициент мощности возникает на границе макроскопически металлического состояния и неметаллического состояния в легированной пленке PBTTT.
( A ) S -σ зависимости, полученные в настоящем исследовании вместе с данными, полученными другими группами, использующими различные методы легирования и легирующие добавки ( 5 , 8 , 9 , 19 , 20 ). Также показана информация о микроскопическом электронном состоянии, полученная из измерений ЭПР, а также макроскопические транспортные свойства, полученные с помощью температурной зависимости σ.Пунктирные линии представляют ту же информацию, что и на фиг. 1E. ( B ) Схематическое изображение упорядоченных (или кристаллических) доменов и границ доменов в тонкой пленке PBTTT. Соседние домены соединены связующими молекулами, показанными красным, которые обеспечивают макроскопический перенос заряда. ( C ) Оптимизация структуры димерного звена в одиночной цепи PBTTT в нейтральном (вверху) и катионном (внизу) состояниях. Цифры представляют собой двугранные углы между соседними субъединицами тиофена (Т) и тиенотиофена (ТТ).
Здесь мы обсуждаем, как макроскопический перенос металла становится возможным за счет электролитного затвора существующей поликристаллической пленки PBTTT. Широко признано, что процесс макроскопического переноса заряда в поликристаллических полимерных пленках опосредуется связующими молекулами между кристаллическими доменами, как схематически показано на рис. 5В ( 39 , 40 ). В этом случае локальная структура связывающих молекул существенно влияет на процесс переноса. Затем мы провели структурную оптимизацию нейтрального и катионного состояний изолированной молекулы PBTTT путем расчета DFT с учетом димерных звеньев.Как и в случае подобной оптимизации, о которой сообщалось ранее ( 41 ), основная цепь PBTTT в нейтральном состоянии имеет тенденцию демонстрировать большое скручивание на тиофен-тиенотиофеновых связях, как показано на рис. 5C (вверху), что должно ограничивать онцепочечный перенос заряда связывающей молекулы и, следовательно, междоменный транспорт. Однако оптимизированная структура в катионном состоянии, показанная на фиг. 5C (внизу), демонстрирует идеальную планарность с симметрией C 2h . Кроме того, структура становится более устойчивой к конформационному беспорядку, чем структура в нейтральном состоянии, как показано на рис.S5. Планарные молекулы обеспечивают высокоэффективное междоменное соединение ( 40 — 44 ), что может объяснить металлический переход, наблюдаемый в настоящем исследовании. Однако соединение доменов связующими молекулами должно быть весьма чувствительным к условиям легирования, предположительно из-за структурного / энергетического беспорядка изолированных связывающих молекул, индуцированного допантом. Металлическое поведение в настоящем исследовании с использованием тонкого ионно-гелевого изолятора наблюдается вплоть до намного более низких температур, чем в нашем предыдущем отчете с использованием толстого и вязкого изолятора из ионной жидкости ( 12 ).Этот результат также согласуется с тем фактом, что металлическая температурная зависимость σ обычно не наблюдается в тонких пленках PBTTT, хотя используются очень сложные методы легирования ( 28 , 45 ). Мы пришли к выводу, что умеренное легирование с помощью существующей технологии электролитного стробирования позволяет эффективно соединять кристаллические домены, что приводит к макроскопическому металлическому переходу, давая максимум P в тонкой пленке PBTTT.
МАТЕРИАЛЫ И МЕТОДЫ
Подготовка образцов
Образцы PBTTT с гексадецильными боковыми цепями ( M w = от 73700 до 82800) были приобретены у Merck Co.Ltd. Структура TFT с электролитным затвором для измерения термоэлектрических свойств была изготовлена на стеклянной подложке (Corning XG) с типичными размерами 1 мм на 1 мм на 0,5 мм, очищенной ультразвуком в деионизированной воде, ацетоне и 2-проперноле для По 5 мин. Затем подложку обрабатывали парами октилтрихлорсилана для образования гидрофобной поверхности. Затем полимерный слой был изготовлен методом центрифугирования или -дихлорбензола (7,5 мг / мл; 2000 об / мин в течение 120 с) с последующим отжигом (180 ° C, 30 мин) на подложке с рисунком из Cr (3 нм). / Au (30 нм) электроды затвора / истока / стока.Наконец, пленка ионной жидкости была изготовлена методом литья по капле [N, N-диэтил-N-метил-N- (2-метоксиметил) аммоний] [бис (трифторметансульфонил) имид] [(DEME) (TFSI)] (Nisshinbo Holdings Inc.) на устройстве, чтобы сформировать структуру TFT с боковым затвором, как показано на рис. 1A. Типичная длина канала ( L ) и ширина канала ( W ) составляли 400 мкм и 2 мм соответственно.
Для измерений ex situ GIXD мы изготовили структуру устройства с боковым затвором, как описано выше, за исключением того, что условия нанесения покрытия методом центрифугирования раствора PBTTT немного отличаются (4000 об / мин в течение 90 с).Для измерений GIXD на месте мы также использовали структуру устройства с боковым затвором, как упомянуто выше, за исключением того, что мы использовали ионно-гелевый изолятор. Раствор [DEME] [TFSI] в ацетоне и поли (винилиденфторид- co -гексафторпропилен) с массовым соотношением 1: 1 наносили центрифугированием (6000 об / мин, 120 с) на стеклянную подложку. После испарения растворителя была получена тонкая пленка ионного геля с типичной толщиной ~ 1 мкм. Пленка ионного геля отслаивалась от подложки, а затем наносилась на полимерную пленку, сформированную на подложке с рисунком электродов, вместо капли ионной жидкости в случае измерений ex situ GIXD.
Для измерений ESR мы использовали конструкцию устройства с нижним контактом (или ступенчатую) с верхним затвором, как показано на рис. 3A и сообщалось ранее ( 33 ). Полимерная пленка была изготовлена на кварцевой подложке размером 3 мм на 30 мм с рисунком электродов истока / стока Cr (5 нм) / Au (30 нм). L и W составляют 100 мкм и 15 мм соответственно. Пленка ионной жидкости была отдельно сформирована на полиэтиленнафталатной подложке с рисунком затворного электрода Cr (3 нм) / Au (30 нм) путем капельного литья этилацетатного раствора [DEME] [TFSI] и поли (метилметакрилата). ( M w = 120000; Aldrich Co.Ltd.) с массовым соотношением 9: 1. Наконец, эти две подложки были ламинированы друг с другом и запечатаны в пробирку для образца ЭПР.
Для определения температурной зависимости измерений проводимости и магнитосопротивления мы изготовили TFT с боковым затвором с тонким ионно-гелевым изолятором, как описано выше. Полимерная пленка была изготовлена методом центрифугирования (4000 об / мин в течение 90 с) с последующим отжигом при 215 ° C в течение 20 минут и последующим медленным охлаждением. L и W составляли 40 мкм и 2 мм соответственно.Использование тонкого ионно-гелевого изолятора с типичной толщиной 1 мкм позволяет минимизировать поверхностное натяжение на границе раздела полимер / ион-гель, вызванное различными коэффициентами теплового расширения, что необходимо для предотвращения растрескивания образца во время низкотемпературных измерений.
Характеристики устройства
Термоэлектрические свойства были измерены при комнатной температуре следующим образом. TFT с электролитом был установлен между двумя элементами Пельтье для создания температурного градиента. Электропроводность определялась из вольт-амперных характеристик, полученных двухзондовым методом при приложении В г .Коэффициент Зеебека определялся из линейного наклона термоэлектродвижущей силы (Δ В ) в зависимости от разности температур (Δ T ), индуцированной между электродами истока и стока для каждого значения В, , г, . Δ T измерялась двумя термопарами (тип K, ϕ = 100 мкм). Обратите внимание, что линейность наклона Δ V -Δ T ухудшалась, когда сопротивление канала было высоким при низком | V г | области, возможно, из-за падения напряжения, вызванного небольшим током утечки.Таким образом, коэффициент Зеебека в области низкой проводимости σ <1 См / см не измерялся в настоящем исследовании.
Измерения GIXD были выполнены с использованием микрофокусной системы генератора рентгеновских лучей высокой интенсивности Rigaku FR-E с источником рентгеновского излучения CuKa (λ = 1,5418 Å) в лаборатории дифракции рентгеновских лучей высокой интенсивности в Университете Нагоя. Дифракция в плоскости и вне плоскости регистрировалась пластиной изображения. Измерения ex situ проводились путем удаления ионной жидкости перед измерениями GIXD после нанесения каждого V g в течение ~ 15 мин.После измерений GIXD ионная жидкость была снова сброшена, и была нанесена следующая V g . Измерения in situ проводились с пленкой ионного геля, сформированной поверх полимерной пленки во время нанесения V g . Падающие рентгеновские лучи облучались на поверхность полимерной пленки через слой ионной жидкости.
Измерения ЭПР выполнены на спектрометре Bruker E-500. Цилиндрический резонатор TE 011 с высоким коэффициентом качества был принят для высокочувствительных измерений.Магнитное поле определялось с точностью ± 0,01 Гс с помощью тесламетра ядерного магнитного резонанса. Спиновую восприимчивость определяли путем двукратного интегрирования сигнала ЭПР первой производной, калиброванного в соответствии с CuSO 4 · 5H 2 O.
Температурную зависимость проводимости и измерения магнитосопротивления выполняли с использованием физического свойства измерительная система (PPMS) (модель 6000, Quantum Design). Напряжение на затворе подавалось при комнатной температуре.После ожидания, пока ток затвора не упадет до стационарного значения (обычно 20 мин), образец охлаждали со скоростью 5 К / мин до 180 К. Электропроводность выше 180 К была измерена методом псевдочетырех зондов в условиях заявка В г . Вольт-амперные характеристики измерялись с помощью полупроводникового параметрического анализатора Agilent B1500A, а падение напряжения между электродами исток-сток контролировалось нановольтметром (Hewlett-Packard 34420A).Ниже 180 К, когда ионный гель заморожен, скорость охлаждения снижалась до 0,3–0,5 К / мин, а проводимость измерялась непосредственно системой PPMS без применения В г , потому что уровень легирования поддерживается в этой системе. кейс. Магнитосопротивление измерялось в магнитном поле, приложенном перпендикулярно пленке.
DFT-расчет
DFT-расчет оптимизированных структур димерных звеньев был выполнен с использованием функционала B3LYP и базиса 6-311G (d, p).Боковые алкильные цепи были заменены метильными звеньями. Расчеты проводились с использованием пакета программ Gaussian 16 ( 48 ).
Благодарности: Мы благодарим T. Hikage за поддержку экспериментов по дифракции рентгеновских лучей. Финансирование: Эта работа была финансово поддержана грантом на научные исследования (JP17H01069 и 19K22127) и грантом на научные исследования в инновационных областях (JP26102012) Японского общества содействия науке (JSPS). ) и JST CREST (JPMJCR17I5).Эта работа была выполнена в рамках программы совместных исследований «Сетевого объединенного исследовательского центра материалов и устройств» компании MEXT. Вклад авторов: H.O. разработал экспериментальную установку для измерений Зеебека. К.К. и Н. измерили коэффициент Зеебека и электропроводность при затворе электролита при комнатной температуре. N.T. провели измерения ESR и AFM. H.M. выполнил GIXD, определил температурную зависимость проводимости и провел измерения магнитосопротивления.Ю.С. провели расчеты DFT. ЗДРАВСТВУЙ. и Х. спроектировал тотальные эксперименты. H.T. написал рукопись при участии всех соавторов. T.T. курировал проект. Все авторы обсудили результаты и одобрили проект рукописи. Конкурирующие интересы: Авторы заявляют об отсутствии конкурирующих интересов. Доступность данных и материалов: Все данные, необходимые для оценки выводов в статье, представлены в статье и / или дополнительных материалах. Дополнительные данные, относящиеся к этой статье, могут быть запрошены у соответствующих авторов.




 Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора. ,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.