Общая характеристика электролитов
Одни электролиты в растворах полностью распадаются на ионы. Они называются сильными.
Другие электролиты только частично распадаются на ионы, т.е. большая часть их молекул остаётся в растворе в недиссоциированном виде. Такие электролиты называются слабыми.
Данное свойство вещества не абсолютно, и зависит не только от его природы, но и от природы растворителя. Чем больше диэлектрическая постоянная растворителя, тем сильнее его ионизирующая слабость. Так, в водных растворах (ε(Н2О) = 80).LiClиNaClведут себя как сильные электролиты. Но если их растворить в уксусной кислоте (ε = 6) или ацетоне (ε = 21), то они начинают проявлять свойства слабых электролитов.
В водных
В то же время многие органические кислоты, некоторые неорганические кислоты (HNO2, HF, H2S, H2SiO3, H3PO4 и т.д.), нерастворимые в Н2 О основания ведут себя как слабые электролиты.
Вещества, в которых частицы связаны различными видами химической связи, распадаются на ионы сперва по ионным связям
KНSO4K++ НSO4–,
а затем – по наиболее полярным ковалентным связям
НSO4–Н++SO42–.
Гетеролитический разрыв малополярных или неполярных ковалентных связей в процессах диссоциации таких веществ, как правило, не происходит.
Количественно процесс распада молекул электролита на ионы оценивается с помощьюстепени электролитической диссоциации α.
Степень диссоциации – это отношение числа распавшихся на ионы молекул вещества к общему числу его молекул в растворе (распавшихся и нераспавшихся):
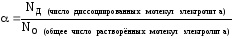
NО=NД+NH (число непродиссоциированных молекул электролита в растворе)
Так как число частиц вещества (N) и их химическое количество (n) связаны между собой соотношениемN=n∙NA, то степень диссоциации можно ещё рассчитать и другим способом:

Для сильных электролитов α близка к единице. Практически все их молекулы в растворе находятся в диссоциированном виде, процесс ассоциации протекает крайне незначительно.
В связи с этим
в уравнениях диссоциации данных веществ
вместо знака обратимости « »
ставят знак «
»
ставят знак «
HCl H+ + Cl–
KOН K+ + OH–
K2SO42K++SO42–
Слабые электролиты
Для слабых электролитов степень диссоциации очень мала (α<<1). Так, для воды при 20оС α ≈ 1 ∙ 10–9. Это означает, что только одна молекула из миллиарда распадается на ионы. В растворах слабых электролитов, наряду с диссоциацией, непрерывно протекает и обратный процесс – ассоциация. С течением времени между ними устанавливается химическое равновесие, которое может быть смещено в ту или иную сторону.
В результате диссоциации электролита происходит увеличение числа его частиц в растворе. Это позволяет экспериментально определить степень диссоциации по измерению тех свойств раствора, которые зависят только от количества содержащихся в нём частиц растворённого вещества, но не от их природы, размеров, массы. К таким свойствам относятся температура кипения и замерзания раствора, осмотическое давление и некоторые другие.
Для растворов слабых электролитов значения α, определённые различными способами, как правило, совпадают и всегда значительно меньше единицы, что хорошо согласуется с теорией Аррениуса.
Как показали экспериментальные исследования, степень диссоциации слабых электролитов зависит от температуры раствора и его концентрации.
Таблица 8.Изменение степени диссоциации уксусной кислоты в зависимости от ее молярной концентрации в растворе
Ссн3соон, моль/дм3 | 0,2 | 0,1 | 0,05 | 0,01 | 0,005 | 0,001 |
α, % | 0,95 | 1,4 | 1,9 | 4,2 | 6,0 | 12,4 |
При повышении температуры раствора степень диссоциации увеличивается, т.к. при этом лучше обеспечивается поляризация и облегчается последующий разрыв ковалентной полярной связи в молекулах электролита. При понижении температуры α уменьшается.
Возрастает α и при уменьшении концентрации растворов, т.е. при их разбавлении (табл. 8), т.к. при этом толщина разделяющей ионы водной прослойки становится больше, поэтому электростатическое взаимодействие между ними, приводящее к ассоциации ионов в молекулы, наблюдается реже.
При бесконечно большом разведении степень диссоциации электролита стремится к своему максимальному значению, т.е. к единице (рис. 30).

Рис. 30. Изменение степени электролитической диссоциации α с разбавлением V(схема)
Таким образом, для слабых электролитов α не является постоянной величиной. Поэтому их способность к распаду на ионы удобнее сравнивать по константе диссоциации, которая представляет собой константу равновесия обратимой реакции электролитического разложения молекул электролита.
Например:
HNO2 H+ +
NO2–
H+ +
NO2–
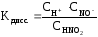
где СН+, СNO2–, CHNO2 – равновесные молярные концентрации ионов H+, NO2– и непродиссоциированных молекул HNO2.
Константа диссоциации слабых электролитов не зависит от их концентрации в растворе даже при значительном разбавлениии и при данной температуре остается постоянной величиной (табл. 9). С увеличением температуры раствора константа диссоциации слабых электролитов во многих случаях изменяется сложным образом (рис. 31).
Таблица 9.Зависимость величиныKдисс.уксусной кислоты в растворе от ее молярной концентрации при Т = 298K
Ссн3соон, моль/дм3 | 0,1 | 0,05 | 0,0012 | 0,0003 |
Kдисс. | 1,845·10–5 | 1,845·10–5 | 1,850·10–5 | 1,855·10–5 |
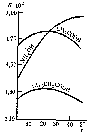
Рис. 31. Зависимость константы диссоциации K некоторых слабых электролитов в водных растворах от температурыt (°С)
Чем меньше Kдисс., тем более слабым является данный электролит. Например, уксусная кислота (Kдисс.= 1,85·10–5) почти в 220 000 раз сильнее циановодороднойHCN(K дисс.= 4,8·10–10) и примерно в 10 раз слабее муравьиной кислоты (Kдисс.= 1,8·10–4).
Существуют слабые электролиты (многоосновные кислоты, многокислотные основания) процесс распада которых на ионы протекает ступенчато, т.е. в несколько стадий. При этом каждая стадия характеризуется своей величиной константы диссоциации.
Например, в 2 стадии осуществляется диссоциация сероводородной кислоты:
1) H2S  H+ +
HS–
H+ +
HS–

2) HS– H+ +
S2–
H+ +
S2–
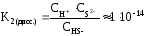
Суммарное уравнение реакции диссоциации H2Sвыглядит следующим образом:
H2S 2H++S2–
2H++S2–

Величина константы диссоциации для суммарного уравнения и значения констант диссоциации отдельных стадий связаны между собой соотношением:
Kсумм.=K1·K2·K3…
При ступенчатой диссоциации распад слабого электролита на каждой последующей стадии происходит в меньшей степени, чем на предыдущей, т.е. K1 > K2 > K3 и т.д. Это объясняется тем, что отрыв иона происходит уже не от нейтральной молекулы (как на первой стадии), а от частицы со все более возрастающим зарядом и требует поэтому больших затрат энергии.
Часто для оценки силы слабого электролита вместо величины константы диссоциации используют ее десятичный логарифм, взятый с обратным знаком (pK)
pK= -lgKдисс.
В этом случае чем больше величина pK, тем более слабым является электролит.
Степень диссоциации слабого электролита уменьшается, если внести в его раствор даже в небольшом количестве сильный электролит, содержащий в своем составе одноименные ионы.
Например, если в раствор СН3СООН добавить ацетат натрияCH3COONa, то за счет диссоциации соли концентрация ацетат-ионов СН3СОО–резко увеличится. В соответствии с принципом Ле Шателье это приведет к смещению равновесия реакции
СН3СООН СН3СОО–+ Н+
СН3СОО–+ Н+
в левую сторону. Аналогичный эффект наблюдается, если в раствор СН3СООН добавить небольшое количество сильной кислоты.
Таким образом, диссоциация слабой кислоты подавляется в присутствии собственной соли или сильной кислоты. То же можно сказать и о слабом основании, диссоциация которого будет подавляться в сильнощелочной среде или в присутствии соли, содержащей одноименный катион.
При добавлении большого количества соответствующего сильного электролита слабый электролит практически не будет диссоциировать.
Существует количественная связь между степенью диссоциации слабого электролита и его концентрацией в растворе, называемая законом разбавления Оствальда.
Для бинарного электролита, молекулы которого распадаются только на 2 иона, можно показать, что
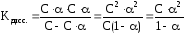
где С – исходная молярная концентрация электролита в растворе; α – степень диссоциации электролита; С ∙ α – концентрация распавшихся молекул электролита и образовавшихся при этом ионов.
Вильгельм
Фридрих Оствальд (1853 – 1932).
Родился в Риге. Учился в Дерптском университете, здесь же в 1878 г. получил степень доктора. С 1882 г. был профессором Рижского университета. С 1887 г. перешел на кафедру физической химии в Лейпциге, где работал до 1928 г.
В. Оствальд изучал электрическую проводимость органических кислот. Познакомившись с работами С. Аррениуса, он стал его сторонником. В. Оствальд внес существенный вклад в теорию электролитической диссоциации. В частности, он предложил свой известный закон разбавления, показал, что аналитические реакции в растворах следует рассматривать как ионные, и объяснил цвет растворов многих веществ специфической окраской ионов. В. Освальду принадлежат также исследования по катализу.
Так как степень
диссоциации слабых электролитов мала,
то можно пренебречь этой величиной в
знаменателе. Тогда K=C·α2,
откуда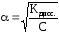 или учитывая, что
или учитывая, что (разведение
или разбавление раствора), то
(разведение
или разбавление раствора), то .
.
Для электролитов, молекулы или формульные единицы которых распадаются на большее число ионов, закон разбавления Оствальда носит более сложный характер.
7.5. Свойства растворов электролитов
Электролитами называют вещества, которые в полярных растворителях или в расплавленном виде распадаются на ионы и проводят электрический ток.
Распад вещества на ионы под влиянием полярных молекул растворителя называется электролитической диссоциацией. Разделение веществ на электролиты и не электролиты понятие условное.
Соли, кислоты,
основания — электролиты в воде, а в
бензоле — неэлектролиты. Это связано с
диэлектрической постоянной растворителя  .
.
f
= 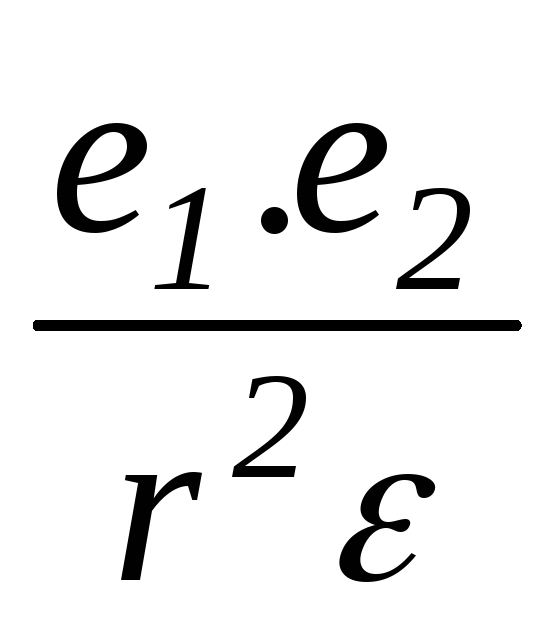 ,
,
где f — связь между ионами; r — расстояние между ионами; e1и e2 — заряды ионов.
Например,  = 80,
это значит, что связь в воде ослабляется
в 80 раз.
= 80,
это значит, что связь в воде ослабляется
в 80 раз.
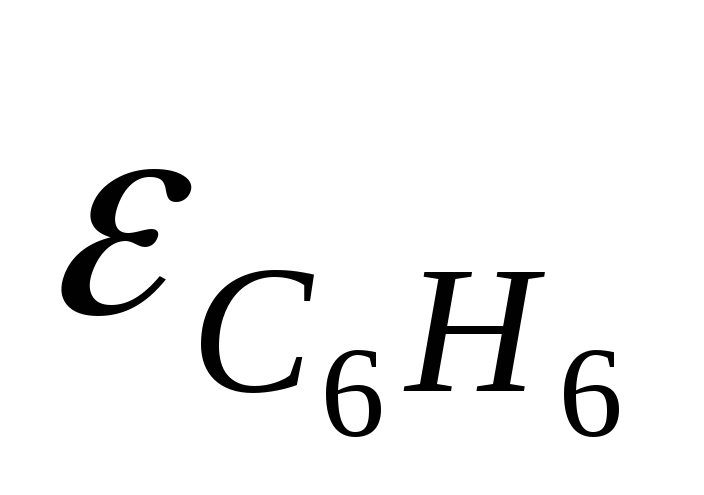 =
2, следовательно,
связь в бензоле ослабляется в 2
раза.
=
2, следовательно,
связь в бензоле ослабляется в 2
раза.
Электролитической диссоциации подвергаются вещества с ионной связью или сильно полярной.
Перенос тока в растворах и расплавах осуществляется ионами, поэтому их в отличие от электронных проводников называют ионными проводниками или проводниками второго рода. Положительно заряженные ионы называют катионами.
Отрицательно заряженные анионами. Ионы в растворе находятся в состоянии неупорядоченного теплового движения. Растворы электронейтральны Σ + = Σ –
Особенности растворов электролитов. Растворы электролитов не подчиняются законам Рауля и Вант — Гоффа.
Опытные величины 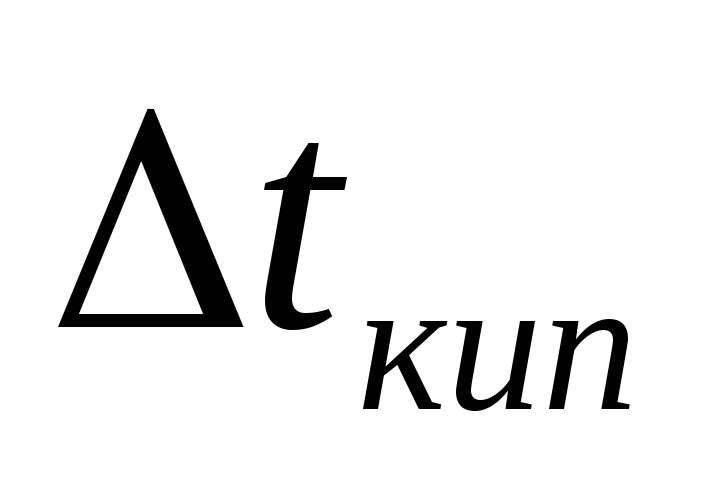 ,
,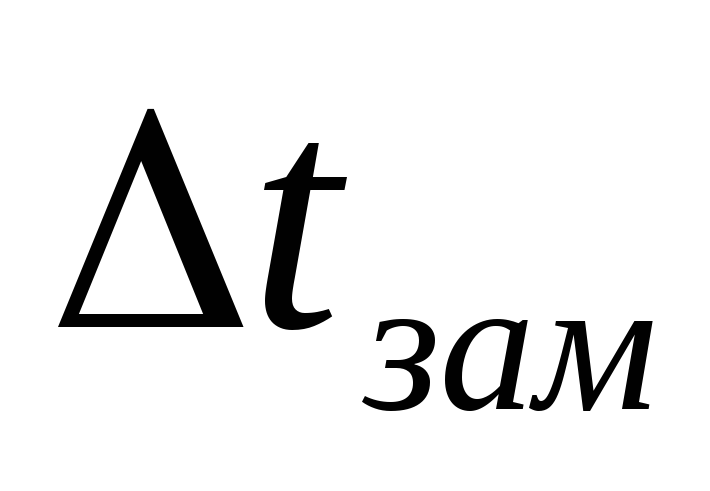 ,
,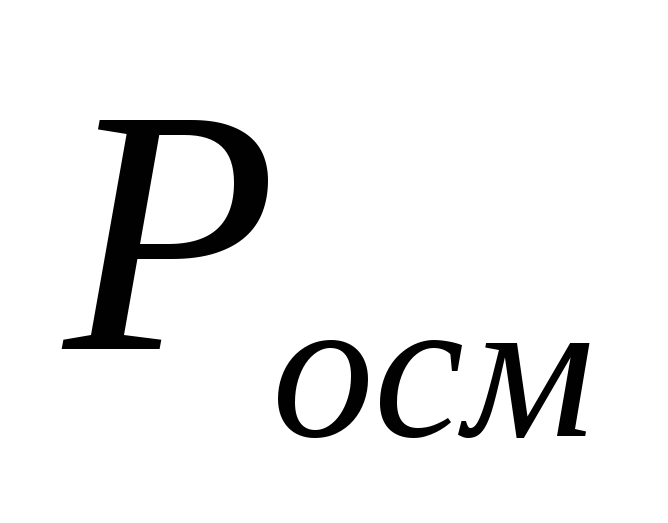 превышают расчетные в одно и тоже число
раз.
превышают расчетные в одно и тоже число
раз.
Объясняется это тем, что в растворах электролитов содержится больше ионов, чем в растворах не электролитов.

Например, в NaCl n = 2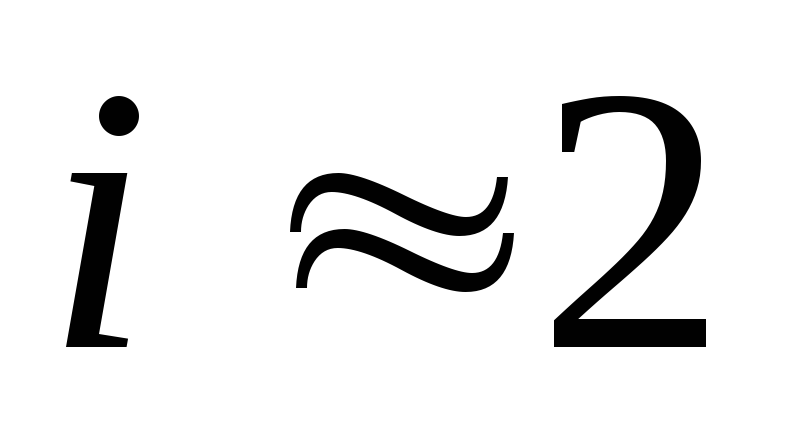 ,
а вMgCl2 n = 3
,
а вMgCl2 n = 3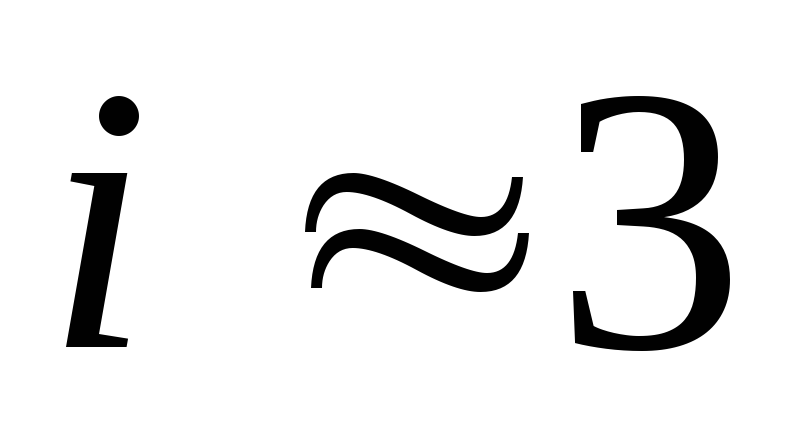
Вант — Гофф ввел поправочный коэффициент i, который называетсяизотоническим коэффициентом.Подстановка этого коэффициента позволяет использовать эти формулы для всех растворов. Физический смысл этого коэффициента был выяснен, когда был установлен механизм электролитической диссоциации.
Как известно теорию электролитической диссоциации предложил шведский химик Аррениус, который, однако, рассматривал растворы как механическую смесь молекул и ионов растворенного вещества с молекулами растворителя. Таким образом, отрицая взаимодействие между ними, теория Аррениуса имела лишь физический смысл. Менделеев развил теорию растворов и предложил свою сольватную теорию растворения (гидратную). И. А. Каблуков объединил эти две теории и развил свою физико-химическую теорию растворения.
По Аррениусу диссоциация уксусной кислоты:
CH3COOH  CH3COO— + H+
CH3COO— + H+
По Менделееву:
CH3COOH
+ (n+m) H2O  CH3COO— ∙ nH2O
+ H+∙ mH2O
CH3COO— ∙ nH2O
+ H+∙ mH2O
Особенностью сольватов как химических соединений является то, что коэффициенты nиmменяются с изменением концентрации, температуры и других параметров раствора.
Слабые и сильные
электролиты. В растворах некоторых
электролитов диссоциирует лишь часть
молекул. Для количественной характеристики
электролитической диссоциации было
введено понятие степени диссоциации  – отношение числа молекул, диссоциированных
на ионы, к общему числу молекул:
– отношение числа молекул, диссоциированных
на ионы, к общему числу молекул: 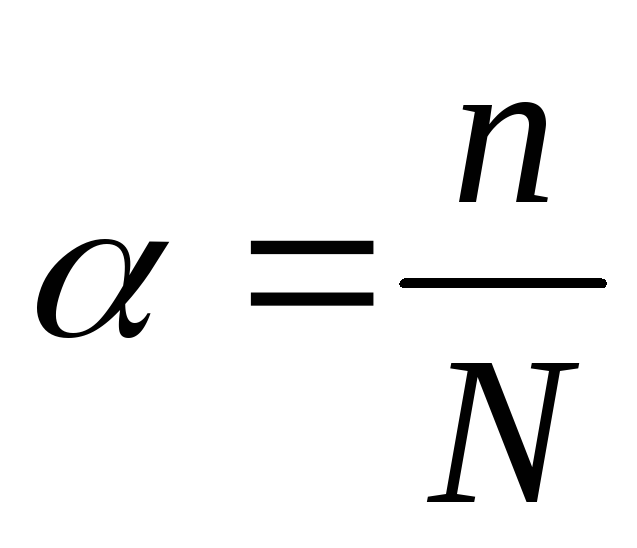 ,
,
 выражается в долях
единицы или в %. Если
выражается в долях
единицы или в %. Если  =20
%, значит из 100 растворенных молекул
20 диссоциирует на ионы.
=20
%, значит из 100 растворенных молекул
20 диссоциирует на ионы.
 зависит от: 1)
природы электролита;
зависит от: 1)
природы электролита;
2) концентрации раствора;
3) температуры раствора;
4) природы растворителя.
Примеры:
1) Для солей  изменяется от35до90 %.
изменяется от35до90 %.
Для кислот HF = 8 %— слабая
= 8 %— слабая
H2SO4 =60 %— сильная
=60 %— сильная
HNO3 , HCl  = 90 — 95 %
= 90 — 95 %
CH3COOH =1,4 %
=1,4 %
H2CO3  =0,17
%первая ступень практически не
диссоциирует.
=0,17
%первая ступень практически не
диссоциирует.
HCN = 0,01 %
= 0,01 %
H2O = 1,8∙ 10-9 %
= 1,8∙ 10-9 %
Вообще говоря,
принято, если  >30 %— это сильные электролиты;
>30 %— это сильные электролиты; от 3 до 30 — средней силы и менее3 %—
слабые электролиты.
от 3 до 30 — средней силы и менее3 %—
слабые электролиты.
2) От концентрации.
HCl1 Hраствор  = 78 %
= 78 %
0,1 Hраствор  = 91 %
= 91 %
CH3COOH0,1Hраствор = 1,4 %
= 1,4 %
0,01 Hраствор =4,2 %
=4,2 %
0,001Hраствор  =12,4 %
=12,4 %
3) Увеличение  с ростом температуры обусловлено
увеличением колебательного движения
молекул и ионов ослабляется связь;
с ростом температуры обусловлено
увеличением колебательного движения
молекул и ионов ослабляется связь;
4) От природы растворителя.
Чем больше  — диэлектрическая постоянная, тем больше
— диэлектрическая постоянная, тем больше .
.
Слабые электролиты. В растворах слабых электролитов процесс диссоциации протекает обратимо, и, следовательно, к нему может быть применен закон действия масс. Так, для процесса диссоциацииCH3COOHконстанта равновесия равна
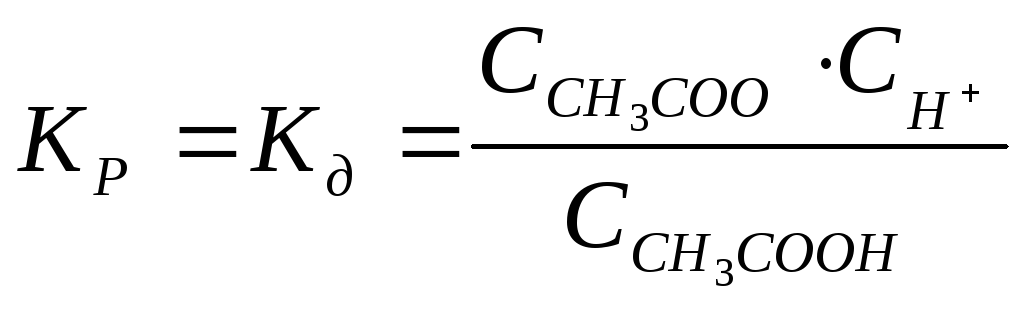
Константу равновесия
для процесса диссоциации называют
константой диссоциации 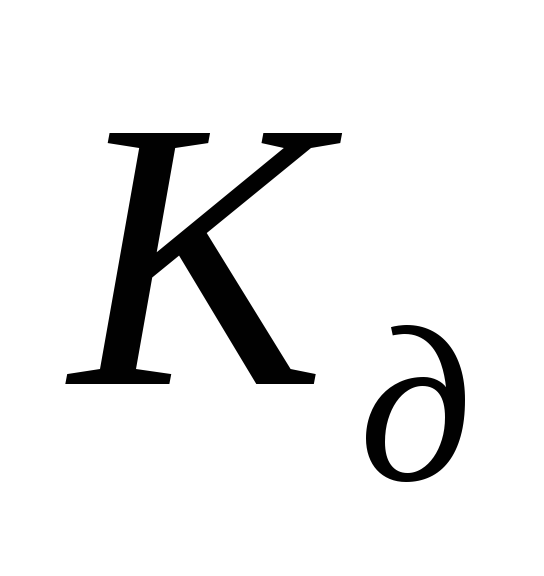 ,
которая зависит от природы диссоциирующего
вещества, природы растворителя,
температуры, и не зависит от концентрации
раствора.
,
которая зависит от природы диссоциирующего
вещества, природы растворителя,
температуры, и не зависит от концентрации
раствора.
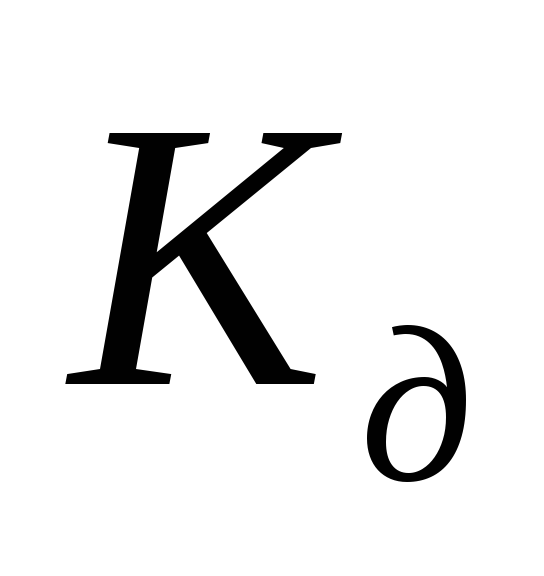 указывает на
прочность молекул в данном растворе.
указывает на
прочность молекул в данном растворе.
Чем меньше 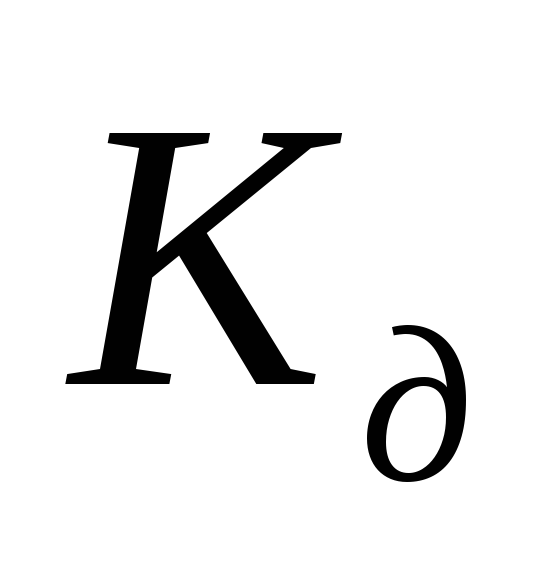 ,
тем слабее диссоциирует электролит и
тем устойчивее его молекула. Учитывая,
что
,
тем слабее диссоциирует электролит и
тем устойчивее его молекула. Учитывая,
что  в отличие от
в отличие от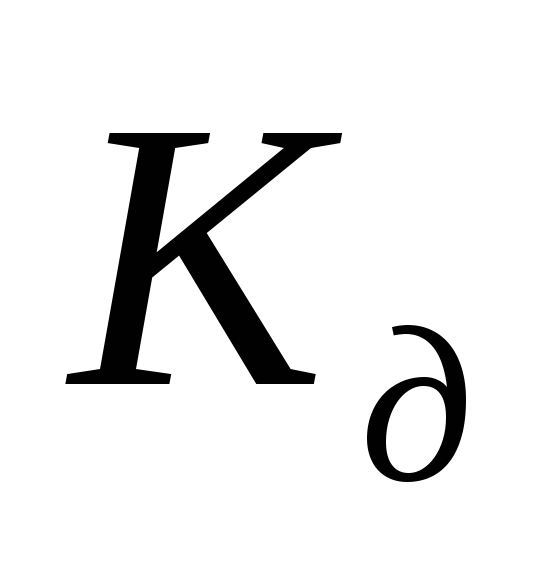 изменяется с концентрацией раствора
необходимо выяснить взаимосвязь между
этими величинами на примере диссоциацииCH3COOH.Если исходную концентрацию раствора
принять равнойС, а степень диссоциации
—
изменяется с концентрацией раствора
необходимо выяснить взаимосвязь между
этими величинами на примере диссоциацииCH3COOH.Если исходную концентрацию раствора
принять равнойС, а степень диссоциации
— ,
то
,
то С— число продиссоциированных молекул,
так как при диссоциации каждая молекула
распадается на один анионCH3COO—и один катионH+, то равновесная концентрация этих
ионов будет совпадать между собой и
равна
С— число продиссоциированных молекул,
так как при диссоциации каждая молекула
распадается на один анионCH3COO—и один катионH+, то равновесная концентрация этих
ионов будет совпадать между собой и
равна С.
С.
Равновесная
концентрация нераспавшихся молекул
будет равна С— Сили(1-
Сили(1- )С, тогда
)С, тогда
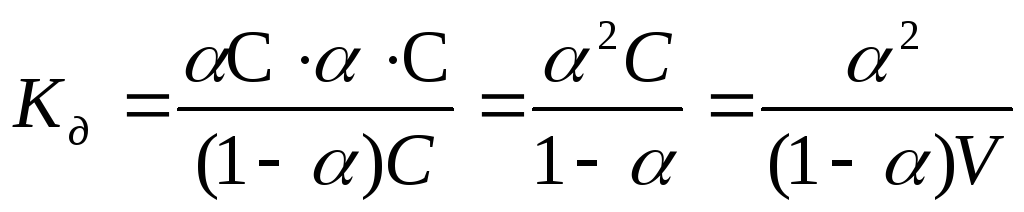 ,
,
где V=1/С— разведение раствора.
Это уравнение называют законом разведения Оствальда.
Для растворов
слабых электролитов, у которых степень
диссоциации меньше единицы это уравнение
можно упростить, считая, что разность (1- )примерно равна единице.
)примерно равна единице.
Тогда 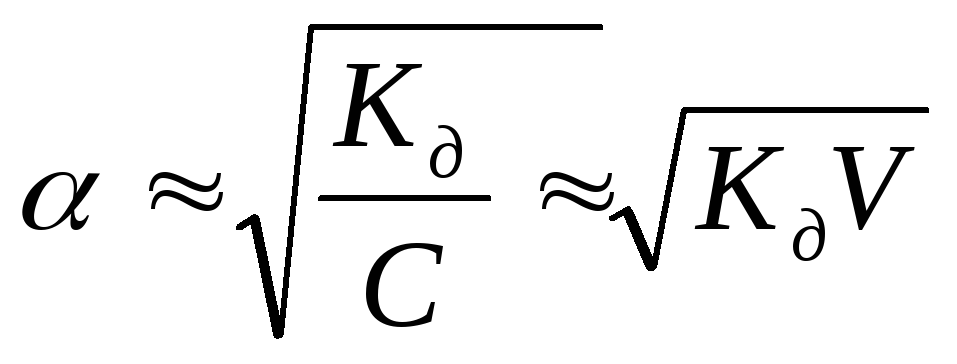
Электролиты
сильные. Сильные электролиты это
вещества, которые в растворах практически
полностью диссоциируют на ионы или100 %.
или100 %.
В растворах сильных электролитов вследствие полной их диссоциации концентрация ионов велика. Поэтому свойства таких растворов будут существенно зависеть от степени взаи-
модействия входящих в их состав ионов как друг с другом, так и с полярными молекулами растворителя. Взаимодействие ионов в растворах сильных электролитов будет приводить к тому, что катионы и анионы будут испытывать взаимное притяжение, анионы одного знака будут отталкиваться друг от друга. Каждый ион будет окружен противоположно заряженными ионами, которые будет располагаться в виде сферы, которая называется ионной атмосферой. Суммарный заряд ионной атмосферы равен по величине заряду центрального атома и противоположен ему по знаку; все ионы в растворе равноправны, поэтому каждый из них является центральным атомом и одновременно входит в состав ионной атмосферы. С увеличением концентрации раствора электролита уменьшается среднее расстояние между противоположно заряженными ионами. В этом случае начинают играть роль близкодействующие силы химической связи.
Поскольку в растворах сильных электролитов существуют сложные взаимодействия ионов и молекул, то для количественного описания свойств растворов электролитов было признано целесообразно сохранить все общие закономерности,
применимые к идеальным растворам, но вместо входящей в них концентрации компонентов ввести новую величину — активную концентрацию или активность, формально заменяющую концентрацию. Активность связана с концентрацией следующим соотношением
а = fc,
где f— коэффициент активности, который
формально учитывает все виды взаимодействия
частиц в данном растворе.fопределяют экспериментально. Для этого
измеряют, например, электропроводность( )и определяютfкак
частное от деления экспериментально
полученной величины на теоретически
рассчитанную по законам идеальных
растворов:
)и определяютfкак
частное от деления экспериментально
полученной величины на теоретически
рассчитанную по законам идеальных
растворов:
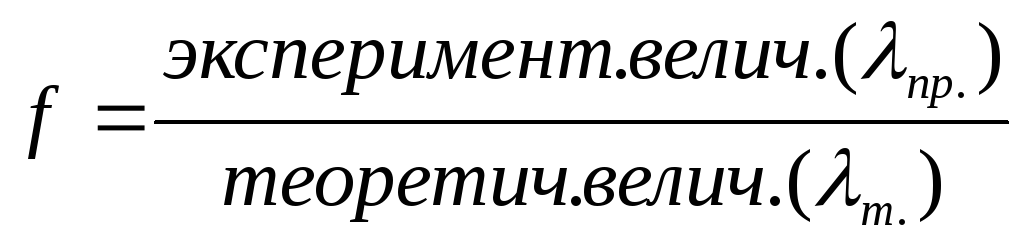
Т.к. f— безразмерная величина, то активность имеет ту же размерность, что и его концентрация. Коэффициент системной зависимости от природы.
f— меняется в широких пределах, в области разбавленных растворов он стремится к единице, а в высококонцентрированных растворах может достигать единицу и даже сотен.
В области разбавленных растворов (ниже 0,1 моль/л) коэффициенты активности зависят главным образом от концентрации и заряда ионов присутствующих в растворе, и мало зависят от природы растворенных веществ. Эта закономерность известна под названием «правила ионной силы».Ионной силойраствора называется полусумма произведений концентраций всех ионов, присутствующих в растворе на квадрат их заряда:
 или
или
Правило ионной
силы позволяет рассчитать коэффициенты
активности отдельных ионов в разбавленных
растворах. fуменьшаются
с увеличением раствора.
раствора.
Так, например, ионная сила раствора, содержащего 0,1 мольHClи0,2 мольCaCl2в1 л, равна

Здесь 0,1– концентрацияН+;0,2– концентрацияCa+2и0,5– концентрацияCl—.
Для НClв0,001 мраствореf=0,965 (~1), т.е.а = с
в 3,0 мраствореf=1,316, т.е.а=1,316∙ 3=3,948.
Общая характеристика электролитов
Одни электролиты в растворах полностью распадаются на ионы. Они называются сильными.
Другие электролиты только частично распадаются на ионы, т.е. большая часть их молекул остаётся в растворе в недиссоциированном виде. Такие электролиты называются слабыми.
Данное свойство вещества не абсолютно, и зависит не только от его природы, но и от природы растворителя. Чем больше диэлектрическая постоянная растворителя, тем сильнее его ионизирующая слабость. Так, в водных растворах (ε(Н2О) = 80).LiClиNaClведут себя как сильные электролиты. Но если их растворить в уксусной кислоте (ε = 6) или ацетоне (ε = 21), то они начинают проявлять свойства слабых электролитов.
В водных растворах сильными электролитами являются соли, растворимые основания (образованные, как правило, щелочными и щелочноземельными металлами), некоторые неорганические или минеральные кислоты (HCl, HBr, HI, H2SO4, HNO3 и др.).
В то же время многие органические кислоты, некоторые неорганические кислоты (HNO2, HF, H2S, H2SiO3, H3PO4 и т.д.), нерастворимые в Н2О основания ведут себя как слабые электролиты.
Вещества, в которых частицы связаны различными видами химической связи, распадаются на ионы сперва по ионным связям
KНSO4®K++ НSO4–,
а затем – по наиболее полярным ковалентным связям
НSO4–®Н++SO42–.
Гетеролитический разрыв малополярных или неполярных ковалентных связей в процессах диссоциации таких веществ, как правило, не происходит.
Количественно процесс распада молекул электролита на ионы оценивается с помощьюстепени электролитической диссоциации α.
Степень диссоциации – это отношение числа распавшихся на ионы молекул вещества к общему числу его молекул в растворе (распавшихся и нераспавшихся):

NО=NД+NH (число непродиссоциированных молекул электролита в растворе)
Так как число частиц вещества (N) и их химическое количество (n) связаны между собой соотношениемN=n∙NA, то степень диссоциации можно ещё рассчитать и другим способом:

Для сильных электролитов α близка к единице. Практически все их молекулы в растворе находятся в диссоциированном виде, процесс ассоциации протекает крайне незначительно.
В связи с этим
в уравнениях диссоциации данных веществ
вместо знака обратимости « »
ставят знак «»
(т.е. используют стрелку только в
направлении распада), например:
»
ставят знак «»
(т.е. используют стрелку только в
направлении распада), например:
HClH++Cl–
KOН®K++OH–
K2SO4®2K++SO42–
Слабые электролиты
Для слабых электролитов степень диссоциации очень мала (α<<1). Так, для воды при 20оС α ≈ 1 ∙ 10–9. Это означает, что только одна молекула из миллиарда распадается на ионы. В растворах слабых электролитов, наряду с диссоциацией, непрерывно протекает и обратный процесс – ассоциация. С течением времени между ними устанавливается химическое равновесие, которое может быть смещено в ту или иную сторону.
В результате диссоциации электролита происходит увеличение числа его частиц в растворе. Это позволяет экспериментально определить степень диссоциации по измерению тех свойств раствора, которые зависят только от количества содержащихся в нём частиц растворённого вещества, но не от их природы, размеров, массы. К таким свойствам относятся температура кипения и замерзания раствора, осмотическое давление и некоторые другие.
Для растворов слабых электролитов значения α, определённые различными способами, как правило, совпадают и всегда значительно меньше единицы, что хорошо согласуется с теорией Аррениуса.
Как показали экспериментальные исследования, степень диссоциации слабых электролитов зависит от температуры раствора и его концентрации.
Таблица 8.Изменение степени диссоциации уксусной кислоты в зависимости от ее молярной концентрации в растворе
Ссн3соон, моль/дм3 | 0,2 | 0,1 | 0,05 | 0,01 | 0,005 | 0,001 |
α, % | 0,95 | 1,4 | 1,9 | 4,2 | 6,0 | 12,4 |
При повышении температуры раствора степень диссоциации увеличивается, т.к. при этом лучше обеспечивается поляризация и облегчается последующий разрыв ковалентной полярной связи в молекулах электролита. При понижении температуры α уменьшается.
Возрастает α и при уменьшении концентрации растворов, т.е. при их разбавлении (табл. 8), т.к. при этом толщина разделяющей ионы водной прослойки становится больше, поэтому электростатическое взаимодействие между ними, приводящее к ассоциации ионов в молекулы, наблюдается реже.
При бесконечно большом разведении степень диссоциации электролита стремится к своему максимальному значению, т.е. к единице (рис. 30).

Рис. 30. Изменение степени электролитической диссоциации α с разбавлением V(схема)
Таким образом, для слабых электролитов α не является постоянной величиной. Поэтому их способность к распаду на ионы удобнее сравнивать по константе диссоциации, которая представляет собой константу равновесия обратимой реакции электролитического разложения молекул электролита.
Например:
HNO2 H+ +
NO2–
H+ +
NO2–
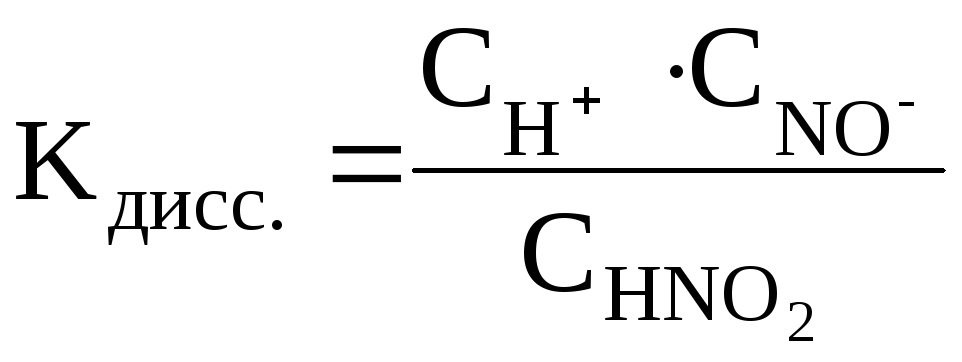
где СН+, СNO2–, CHNO2 – равновесные молярные концентрации ионов H+, NO2– и непродиссоциированных молекул HNO2.
Константа диссоциации слабых электролитов не зависит от их концентрации в растворе даже при значительном разбавлениии и при данной температуре остается постоянной величиной (табл. 9). С увеличением температуры раствора константа диссоциации слабых электролитов во многих случаях изменяется сложным образом (рис. 31).
Таблица 9.Зависимость величиныKдисс.уксусной кислоты в растворе от ее молярной концентрации при Т = 298K
Ссн3соон, моль/дм3 | 0,1 | 0,05 | 0,0012 | 0,0003 |
Kдисс. | 1,845·10–5 | 1,845·10–5 | 1,850·10–5 | 1,855·10–5 |
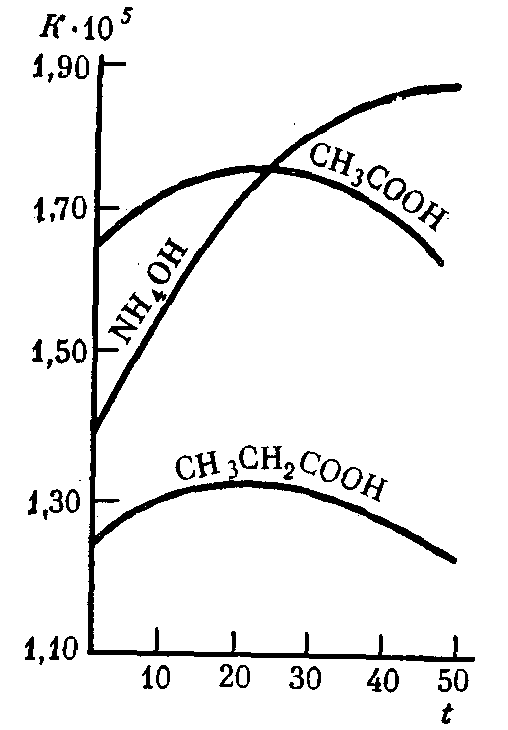
Рис. 31. Зависимость константы диссоциации K некоторых слабых электролитов в водных растворах от температурыt (°С)
Чем меньше Kдисс., тем более слабым является данный электролит. Например, уксусная кислота (Kдисс.= 1,85·10–5) почти в 220 000 раз сильнее циановодороднойHCN(Kдисс.= 4,8·10–10) и примерно в 10 раз слабее муравьиной кислоты (Kдисс.= 1,8·10–4).
Существуют слабые электролиты (многоосновные кислоты, многокислотные основания) процесс распада которых на ионы протекает ступенчато, т.е. в несколько стадий. При этом каждая стадия характеризуется своей величиной константы диссоциации.
Например, в 2 стадии осуществляется диссоциация сероводородной кислоты:
1) H2S  H+ +
HS–
H+ +
HS–
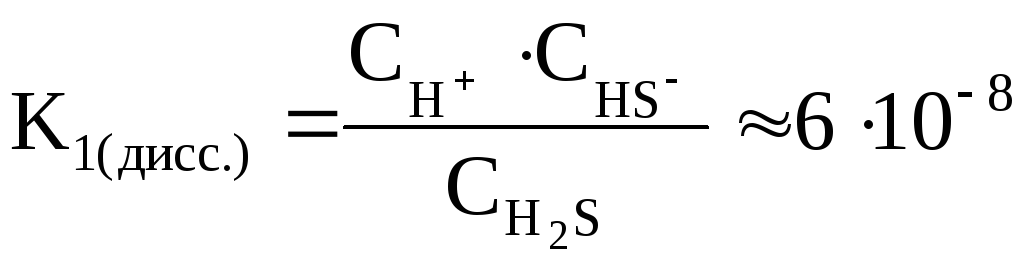
2) HS– H+ +
S2–
H+ +
S2–
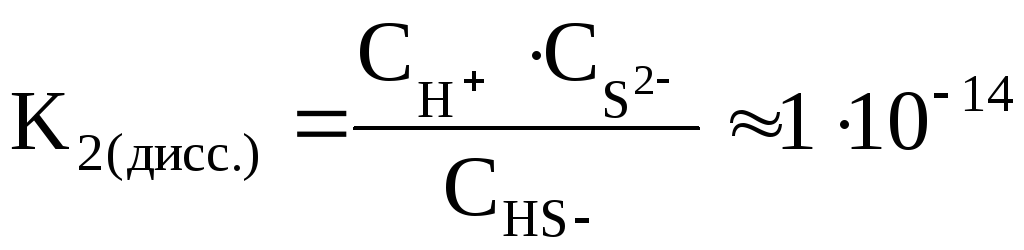
Суммарное уравнение реакции диссоциации H2Sвыглядит следующим образом:
H2S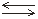 2H++S2–
2H++S2–
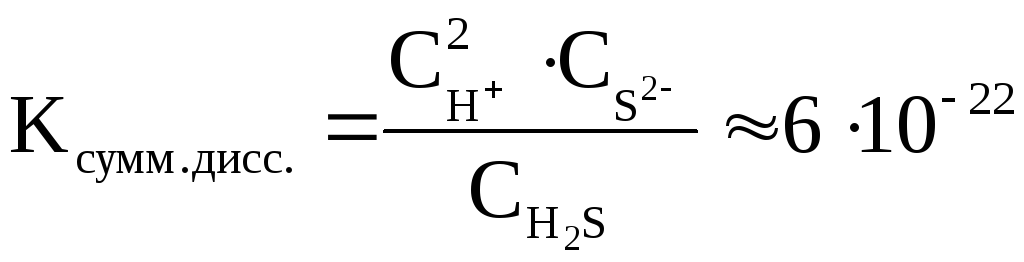
Величина константы диссоциации для суммарного уравнения и значения констант диссоциации отдельных стадий связаны между собой соотношением:
Kсумм.=K1·K2·K3…
При ступенчатой диссоциации распад слабого электролита на каждой последующей стадии происходит в меньшей степени, чем на предыдущей, т.е. K1 > K2 > K3 и т.д. Это объясняется тем, что отрыв иона происходит уже не от нейтральной молекулы (как на первой стадии), а от частицы со все более возрастающим зарядом и требует поэтому больших затрат энергии.
Часто для оценки силы слабого электролита вместо величины константы диссоциации используют ее десятичный логарифм, взятый с обратным знаком (pK)
pK= -lgKдисс.
В этом случае чем больше величина pK, тем более слабым является электролит.
Степень диссоциации слабого электролита уменьшается, если внести в его раствор даже в небольшом количестве сильный электролит, содержащий в своем составе одноименные ионы.
Например, если в раствор СН3СООН добавить ацетат натрияCH3COONa, то за счет диссоциации соли концентрация ацетат-ионов СН3СОО–резко увеличится. В соответствии с принципом Ле Шателье это приведет к смещению равновесия реакции
СН3СООН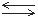 СН3СОО–+ Н+
СН3СОО–+ Н+
в левую сторону. Аналогичный эффект наблюдается, если в раствор СН3СООН добавить небольшое количество сильной кислоты.
Таким образом, диссоциация слабой кислоты подавляется в присутствии собственной соли или сильной кислоты. То же можно сказать и о слабом основании, диссоциация которого будет подавляться в сильнощелочной среде или в присутствии соли, содержащей одноименный катион.
При добавлении большого количества соответствующего сильного электролита слабый электролит практически не будет диссоциировать.
Существует количественная связь между степенью диссоциации слабого электролита и его концентрацией в растворе, называемая законом разбавления Оствальда.
Для бинарного электролита, молекулы которого распадаются только на 2 иона, можно показать, что
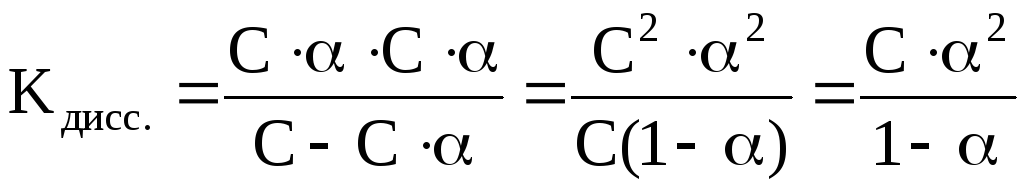
где С – исходная молярная концентрация электролита в растворе; α – степень диссоциации электролита; С ∙ α – концентрация распавшихся молекул электролита и образовавшихся при этом ионов.
В ильгельм
Фридрих Оствальд (1853 – 1932)
ильгельм
Фридрих Оствальд (1853 – 1932)
Родился в Риге. Учился в Дерптском университете, здесь же в 1878 г. получил степень доктора. С 1882 г. был профессором Рижского университета. С 1887 г. перешел на кафедру физической химии в Лейпциге, где работал до 1928 г.
В. Оствальд изучал электрическую проводимость органических кислот. Познакомившись с работами С. Аррениуса, он стал его сторонником. В. Оствальд внес существенный вклад в теорию электролитической диссоциации. В частности, он предложил свой известный закон разбавления, показал, что аналитические реакции в растворах следует рассматривать как ионные, и объяснил цвет растворов многих веществ специфической окраской ионов. В. Освальду принадлежат также исследования по катализу.
Так как степень
диссоциации слабых электролитов мала,
то можно пренебречь этой величиной в
знаменателе. Тогда K=C·α2,
откуда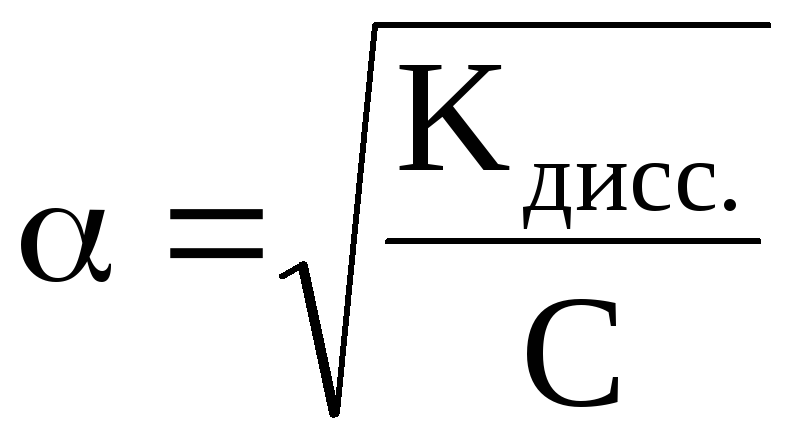 или учитывая, что
или учитывая, что (разведение
или разбавление раствора), то
(разведение
или разбавление раствора), то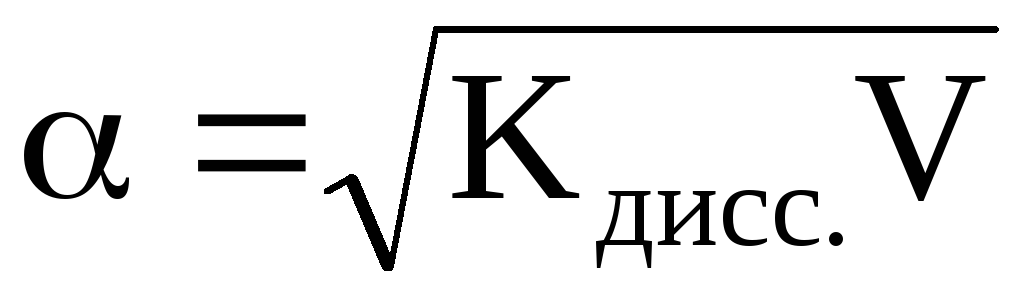 .
.
Для электролитов, молекулы или формульные единицы которых распадаются на большее число ионов, закон разбавления Оствальда носит более сложный характер.
Общая характеристика электролитов
Одни электролиты в растворах полностью распадаются на ионы. Они называются сильными.
Другие электролиты только частично распадаются на ионы, т.е. большая часть их молекул остаётся в растворе в недиссоциированном виде. Такие электролиты называются слабыми.
Данное свойство вещества не абсолютно, и зависит не только от его природы, но и от природы растворителя. Чем больше диэлектрическая постоянная растворителя, тем сильнее его ионизирующая слабость. Так, в водных растворах (ε(Н2О) = 80).LiClиNaClведут себя как сильные электролиты. Но если их растворить в уксусной кислоте (ε = 6) или ацетоне (ε = 21), то они начинают проявлять свойства слабых электролитов.
В водных растворах сильными электролитами являются соли, растворимые основания (образованные, как правило, щелочными и щелочноземельными металлами), некоторые неорганические или минеральные кислоты (HCl, HBr, HI, H2SO4, HNO3 и др.).
В то же время многие органические кислоты, некоторые неорганические кислоты (HNO2, HF, H2S, H2SiO3, H3PO4 и т.д.), нерастворимые в Н2О основания ведут себя как слабые электролиты.
Вещества, в которых частицы связаны различными видами химической связи, распадаются на ионы сперва по ионным связям
KНSO4®K++ НSO4–,
а затем – по наиболее полярным ковалентным связям
НSO4–®Н++SO42–.
Гетеролитический разрыв малополярных или неполярных ковалентных связей в процессах диссоциации таких веществ, как правило, не происходит.
Количественно процесс распада молекул электролита на ионы оценивается с помощьюстепени электролитической диссоциации α.
Степень диссоциации – это отношение числа распавшихся на ионы молекул вещества к общему числу его молекул в растворе (распавшихся и нераспавшихся):
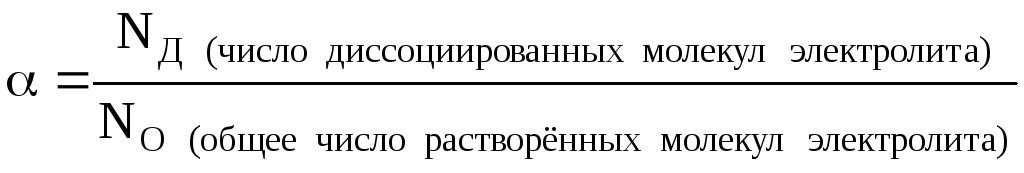
NО=NД+NH (число непродиссоциированных молекул электролита в растворе)
Так как число частиц вещества (N) и их химическое количество (n) связаны между собой соотношениемN=n∙NA, то степень диссоциации можно ещё рассчитать и другим способом:

Для сильных электролитов α близка к единице. Практически все их молекулы в растворе находятся в диссоциированном виде, процесс ассоциации протекает крайне незначительно.
В связи с этим
в уравнениях диссоциации данных веществ
вместо знака обратимости « »
ставят знак «»
(т.е. используют стрелку только в
направлении распада), например:
»
ставят знак «»
(т.е. используют стрелку только в
направлении распада), например:
HClH++Cl–
KOН®K++OH–
K2SO4®2K++SO42–
Слабые электролиты
Для слабых электролитов степень диссоциации очень мала (α<<1). Так, для воды при 20оС α ≈ 1 ∙ 10–9. Это означает, что только одна молекула из миллиарда распадается на ионы. В растворах слабых электролитов, наряду с диссоциацией, непрерывно протекает и обратный процесс – ассоциация. С течением времени между ними устанавливается химическое равновесие, которое может быть смещено в ту или иную сторону.
В результате диссоциации электролита происходит увеличение числа его частиц в растворе. Это позволяет экспериментально определить степень диссоциации по измерению тех свойств раствора, которые зависят только от количества содержащихся в нём частиц растворённого вещества, но не от их природы, размеров, массы. К таким свойствам относятся температура кипения и замерзания раствора, осмотическое давление и некоторые другие.
Для растворов слабых электролитов значения α, определённые различными способами, как правило, совпадают и всегда значительно меньше единицы, что хорошо согласуется с теорией Аррениуса.
Как показали экспериментальные исследования, степень диссоциации слабых электролитов зависит от температуры раствора и его концентрации.
Таблица 8.Изменение степени диссоциации уксусной кислоты в зависимости от ее молярной концентрации в растворе
Ссн3соон, моль/дм3 | 0,2 | 0,1 | 0,05 | 0,01 | 0,005 | 0,001 |
α, % | 0,95 | 1,4 | 1,9 | 4,2 | 6,0 | 12,4 |
При повышении температуры раствора степень диссоциации увеличивается, т.к. при этом лучше обеспечивается поляризация и облегчается последующий разрыв ковалентной полярной связи в молекулах электролита. При понижении температуры α уменьшается.
Возрастает α и при уменьшении концентрации растворов, т.е. при их разбавлении (табл. 8), т.к. при этом толщина разделяющей ионы водной прослойки становится больше, поэтому электростатическое взаимодействие между ними, приводящее к ассоциации ионов в молекулы, наблюдается реже.
При бесконечно большом разведении степень диссоциации электролита стремится к своему максимальному значению, т.е. к единице (рис. 30).
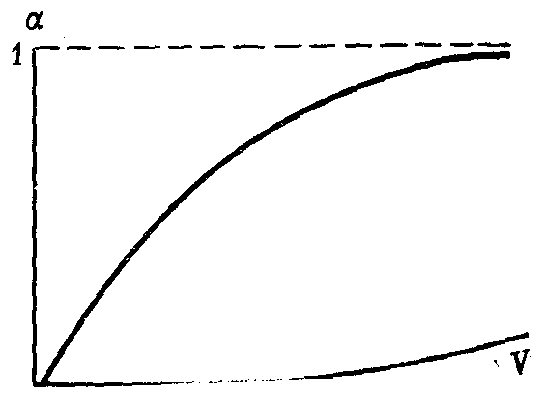
Рис. 30. Изменение степени электролитической диссоциации α с разбавлением V(схема)
Таким образом, для слабых электролитов α не является постоянной величиной. Поэтому их способность к распаду на ионы удобнее сравнивать по константе диссоциации, которая представляет собой константу равновесия обратимой реакции электролитического разложения молекул электролита.
Например:
HNO2 H+ +
NO2–
H+ +
NO2–
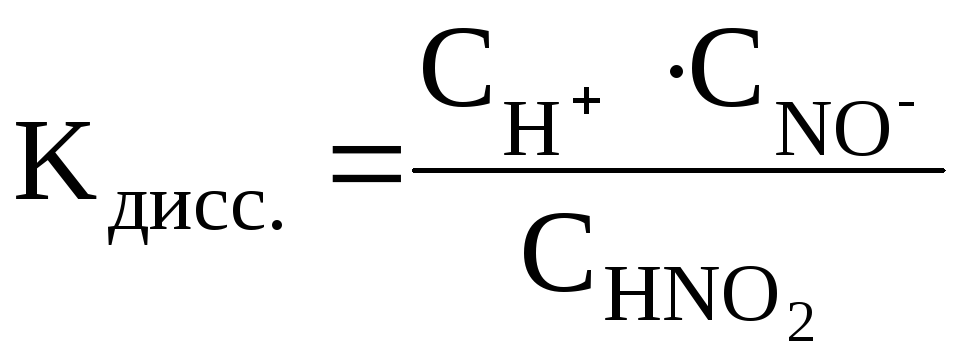
где СН+, СNO2–, CHNO2 – равновесные молярные концентрации ионов H+, NO2– и непродиссоциированных молекул HNO2.
Константа диссоциации слабых электролитов не зависит от их концентрации в растворе даже при значительном разбавлениии и при данной температуре остается постоянной величиной (табл. 9). С увеличением температуры раствора константа диссоциации слабых электролитов во многих случаях изменяется сложным образом (рис. 31).
Таблица 9.Зависимость величиныKдисс.уксусной кислоты в растворе от ее молярной концентрации при Т = 298K
Ссн3соон, моль/дм3 | 0,1 | 0,05 | 0,0012 | 0,0003 |
Kдисс. | 1,845·10–5 | 1,845·10–5 | 1,850·10–5 | 1,855·10–5 |
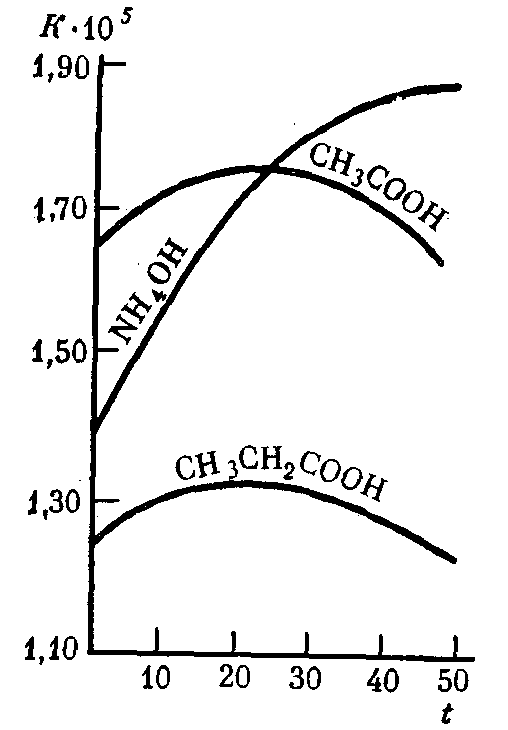
Рис. 31. Зависимость константы диссоциации K некоторых слабых электролитов в водных растворах от температурыt (°С)
Чем меньше Kдисс., тем более слабым является данный электролит. Например, уксусная кислота (Kдисс.= 1,85·10–5) почти в 220 000 раз сильнее циановодороднойHCN(Kдисс.= 4,8·10–10) и примерно в 10 раз слабее муравьиной кислоты (Kдисс.= 1,8·10–4).
Существуют слабые электролиты (многоосновные кислоты, многокислотные основания) процесс распада которых на ионы протекает ступенчато, т.е. в несколько стадий. При этом каждая стадия характеризуется своей величиной константы диссоциации.
Например, в 2 стадии осуществляется диссоциация сероводородной кислоты:
1) H2S  H+ +
HS–
H+ +
HS–

2) HS– H+ +
S2–
H+ +
S2–
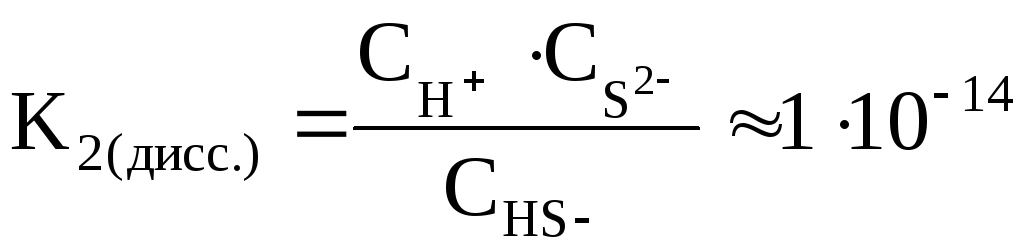
Суммарное уравнение реакции диссоциации H2Sвыглядит следующим образом:
H2S 2H++S2–
2H++S2–

Величина константы диссоциации для суммарного уравнения и значения констант диссоциации отдельных стадий связаны между собой соотношением:
Kсумм.=K1·K2·K3…
При ступенчатой диссоциации распад слабого электролита на каждой последующей стадии происходит в меньшей степени, чем на предыдущей, т.е. K1 > K2 > K3 и т.д. Это объясняется тем, что отрыв иона происходит уже не от нейтральной молекулы (как на первой стадии), а от частицы со все более возрастающим зарядом и требует поэтому больших затрат энергии.
Часто для оценки силы слабого электролита вместо величины константы диссоциации используют ее десятичный логарифм, взятый с обратным знаком (pK)
pK= -lgKдисс.
В этом случае чем больше величина pK, тем более слабым является электролит.
Степень диссоциации слабого электролита уменьшается, если внести в его раствор даже в небольшом количестве сильный электролит, содержащий в своем составе одноименные ионы.
Например, если в раствор СН3СООН добавить ацетат натрияCH3COONa, то за счет диссоциации соли концентрация ацетат-ионов СН3СОО–резко увеличится. В соответствии с принципом Ле Шателье это приведет к смещению равновесия реакции
СН3СООН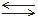 СН3СОО–+ Н+
СН3СОО–+ Н+
в левую сторону. Аналогичный эффект наблюдается, если в раствор СН3СООН добавить небольшое количество сильной кислоты.
Таким образом, диссоциация слабой кислоты подавляется в присутствии собственной соли или сильной кислоты. То же можно сказать и о слабом основании, диссоциация которого будет подавляться в сильнощелочной среде или в присутствии соли, содержащей одноименный катион.
При добавлении большого количества соответствующего сильного электролита слабый электролит практически не будет диссоциировать.
Существует количественная связь между степенью диссоциации слабого электролита и его концентрацией в растворе, называемая законом разбавления Оствальда.
Для бинарного электролита, молекулы которого распадаются только на 2 иона, можно показать, что
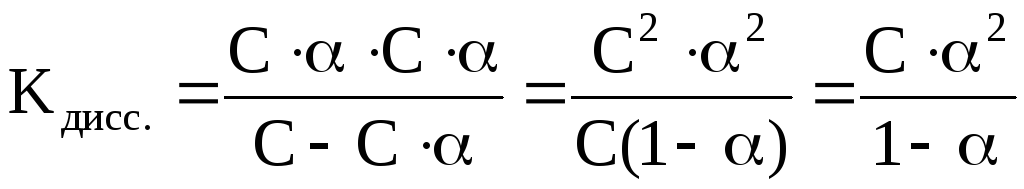
где С – исходная молярная концентрация электролита в растворе; α – степень диссоциации электролита; С ∙ α – концентрация распавшихся молекул электролита и образовавшихся при этом ионов.
В ильгельм
Фридрих Оствальд (1853 – 1932)
ильгельм
Фридрих Оствальд (1853 – 1932)
Родился в Риге. Учился в Дерптском университете, здесь же в 1878 г. получил степень доктора. С 1882 г. был профессором Рижского университета. С 1887 г. перешел на кафедру физической химии в Лейпциге, где работал до 1928 г.
В. Оствальд изучал электрическую проводимость органических кислот. Познакомившись с работами С. Аррениуса, он стал его сторонником. В. Оствальд внес существенный вклад в теорию электролитической диссоциации. В частности, он предложил свой известный закон разбавления, показал, что аналитические реакции в растворах следует рассматривать как ионные, и объяснил цвет растворов многих веществ специфической окраской ионов. В. Освальду принадлежат также исследования по катализу.
Так как степень
диссоциации слабых электролитов мала,
то можно пренебречь этой величиной в
знаменателе. Тогда K=C·α2,
откуда или учитывая, что
или учитывая, что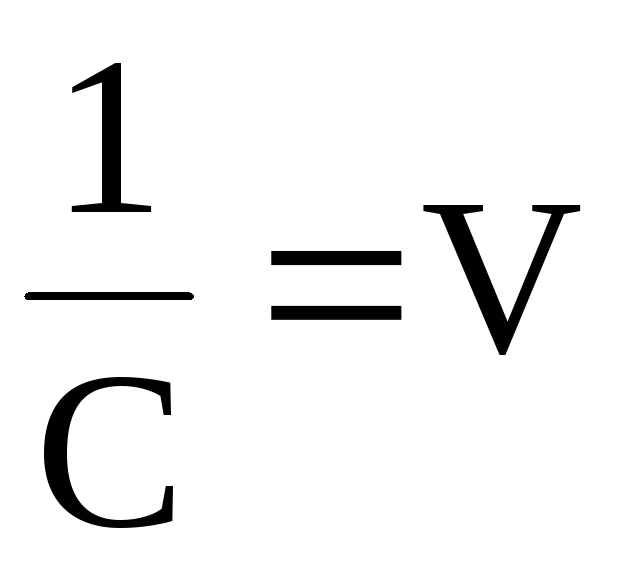 (разведение
или разбавление раствора), то
(разведение
или разбавление раствора), то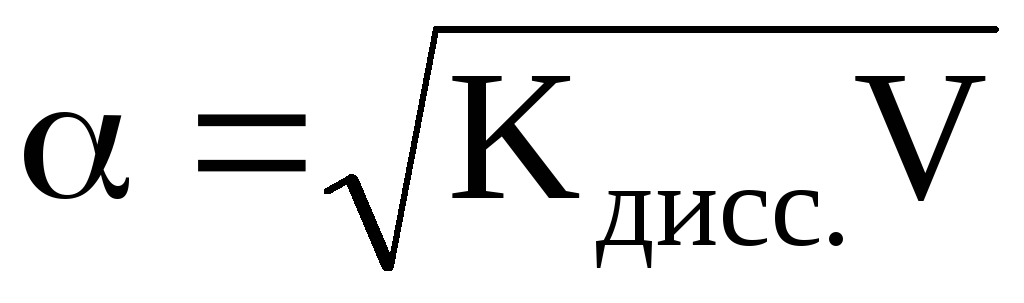 .
.
Для электролитов, молекулы или формульные единицы которых распадаются на большее число ионов, закон разбавления Оствальда носит более сложный характер.
II. Коллигативные свойства растворов неэлектролитов
Раствор неэлектролита состоит из растворителя и растворенного вещества в виде недиссоциированных молекул. Коллигативными свойствами раствора неэлектролита являются свойства, которые зависят от концентрации и практически не зависят от природы неэлектролита. К таким свойствам относятся:
Относительное понижение давления насыщенного пара растворителя над раствором (I закон Рауля)
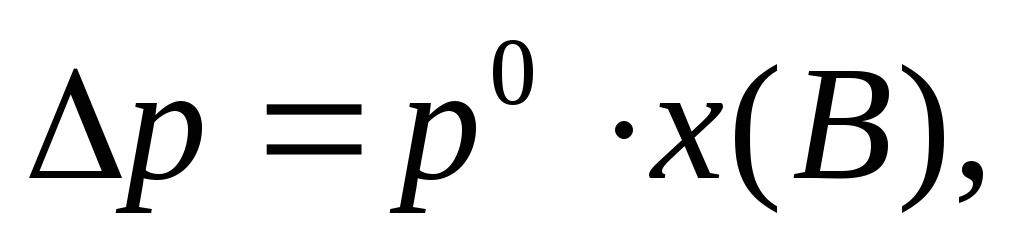 (8)
(8)
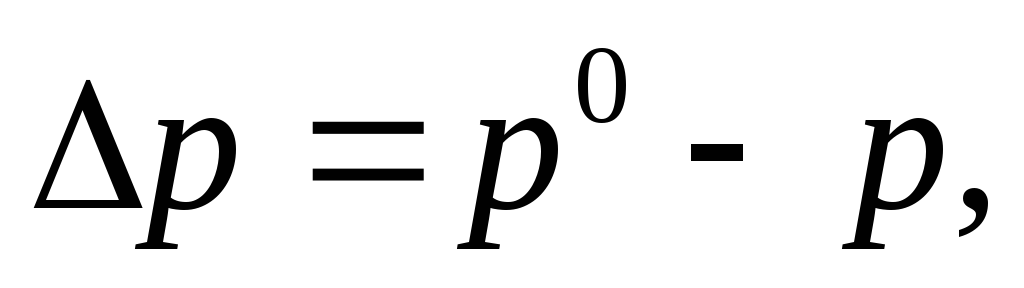 (8а)
(8а)
р0— давление насыщенного пара над чистым растворителем, Па;
р – давление насыщенного пара над раствором неэлектролита, Па;
х(В) – молярная доля неэлектролита в растворе;
Понижение температуры замерзания (II закон Рауля)
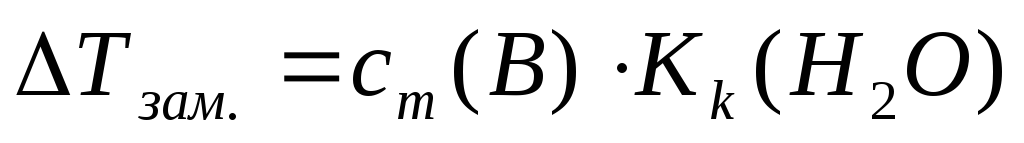 (9)
(9)
 (9а)
(9а)
Кк – криоскопическая константа, Kk(H2O)=1,86 К×кг/моль
сm(B) – моляльная концентрация неэлектролита, моль/кг;
Повышение температуры кипения (II закон Рауля)
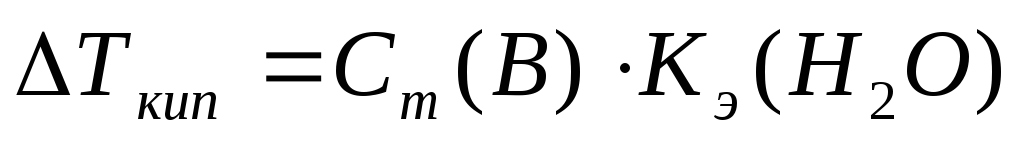 (10)
(10)
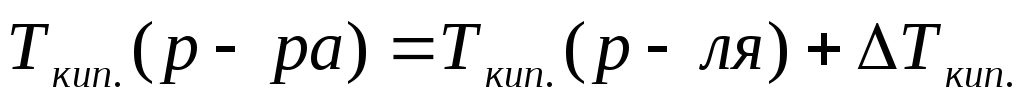 (10а)
(10а)
Кэ–эбуллиоскопическая постоянная, Кэ(Н2О)=0,52 К×кг/моль
Осмотическое давление раствора (закон Вант-Гоффа)
pосм= с(В)×R×T, Па (11)
R= 8,314 л×Па/моль×К, Т – температура, К
с(В) – молярная концентрация неэлектролита, моль/л
Пример 5. Давление насыщенного пара воды при 500С равно 12334 Па. Вычислите давление насыщенного пара воды над раствором, содержащим 50г этиленгликоля C2H4(OH)2 в 900г воды. Определите температуру замерзания этого раствора.
Решение. 1.Рассчитаем молярную долю вещества в растворе по формуле (3):
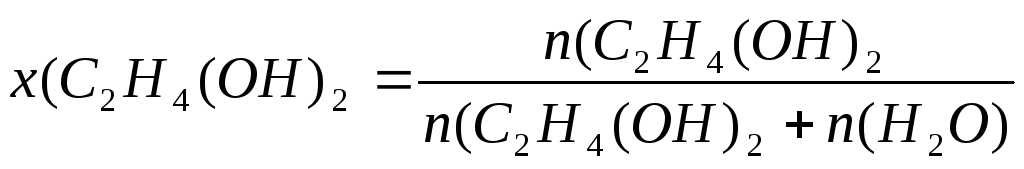
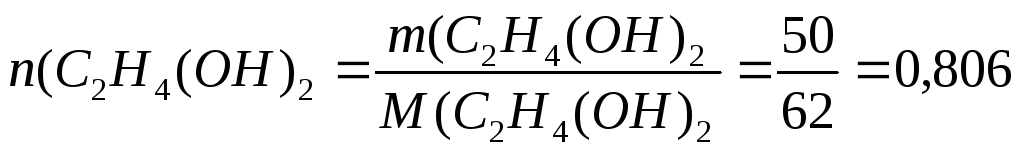 моль;
моль;
M(C2H4(OH)2= 62 г/моль;
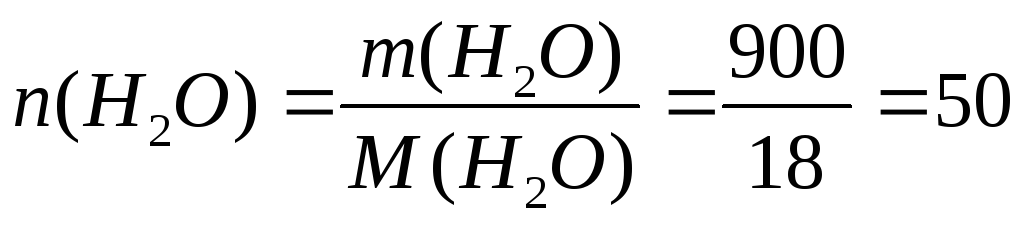 моль, М(Н2О)=
18 г/моль;
моль, М(Н2О)=
18 г/моль;
;
2.Рассчитаем понижение давления насыщенного пара:
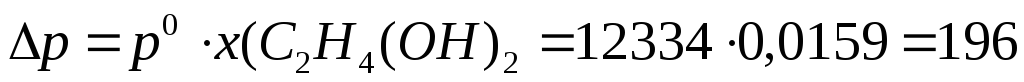 Па;
Па;
3.Рассчитаем давление насыщенного пара над раствором:
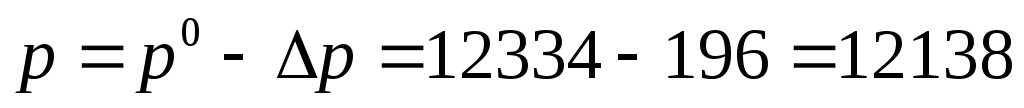 Па;
Па;
4.Определим Тзам по формуле (9):

моль/кг;  0
0
5.Определи Тзам раствора:
Тзам.(р-ра)= 0 – 1,67 = — 1,67 0
Пример 6. Сколько граммов глицерина С3Н8О3 надо растворить в 2 л воды, чтобы получить раствор, закипающий при 100,6 0С?
Решение.
Определим Ткип по формуле (10а):
 0
0
Определим сm(В):
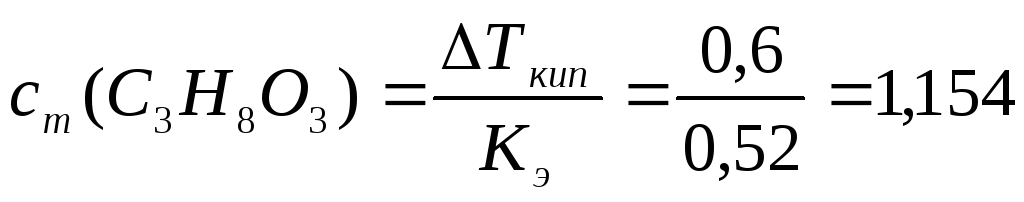 моль/кг
моль/кг
3. Определим n(В) по формуле (6):
n(C3H8O3)
= 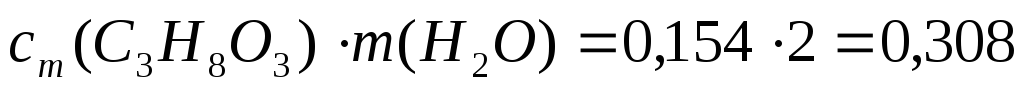 моль;m(H2O)=V∙ρ=2000∙1=2000г=2кг;
моль;m(H2O)=V∙ρ=2000∙1=2000г=2кг;
4.Определим массу глицерина:
m(C3H8O3) = n M(C3H8O3) =0,30892= 28,336 г
M(C3H8O3) =92 г/моль
Пример 7. При 420С давление насыщенного пара воды равно 2,34 кПа. На сколько понизится давление насыщенного пара воды над раствором при указанной температуре, если в 540г воды растворить 36г глюкозы.
Решение. 1. Определим x(В) по формуле (3):
 ;
;
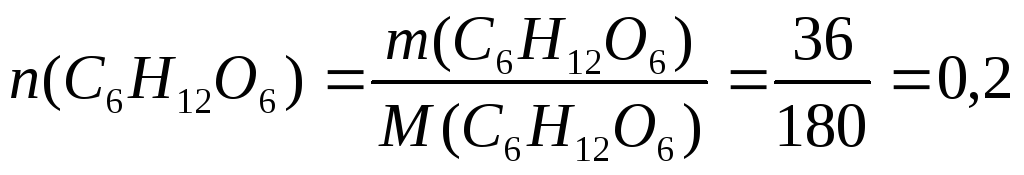 моль
моль
М(С6Н12О6)= 180г/моль;
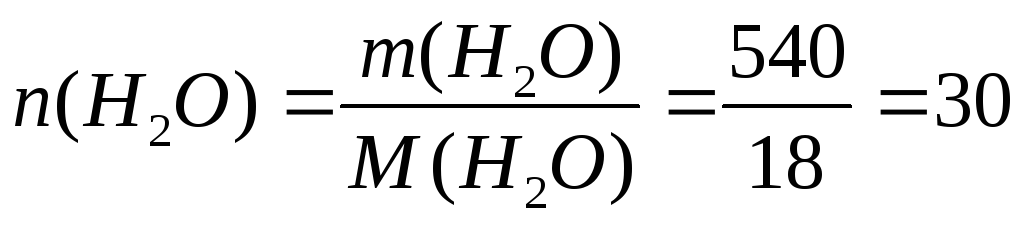 моль
моль
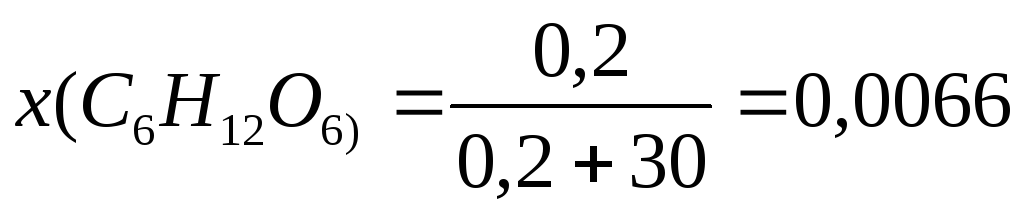
2. Рассчитаем p по формуле (8а):
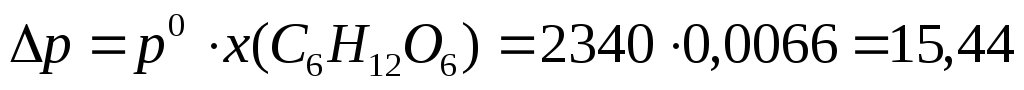 Па
Па
III. Коллигативные свойства растворов электролитов.
Раствор электролита состоит из растворителя и растворенного вещества (электролита), которое частично или полностью диссоциирует на ионы. В растворе число частиц в результате диссоциации увеличивается. Коллигативные свойства растворов электролитов описываются уравнениями с поправочным множителем – изотоническим коэффициентом ( i ), учитывающим процесс диссоциации:
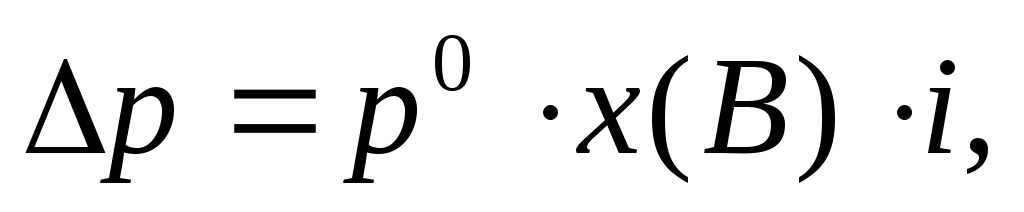 (12)
(12)
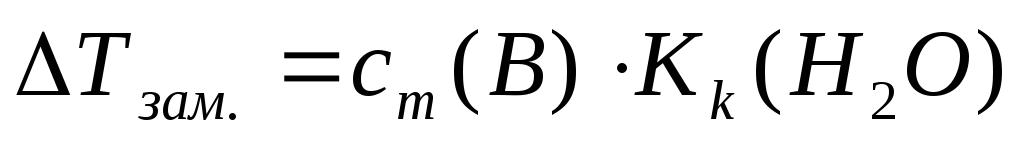 ×i(13)
×i(13)
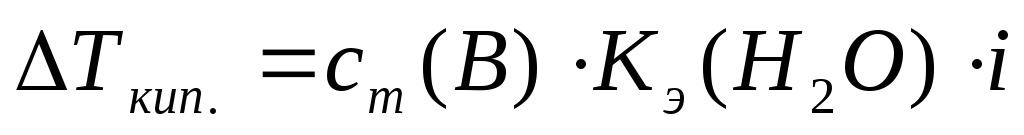 (14)
(14)
pосм= С×R×T×i, (15)
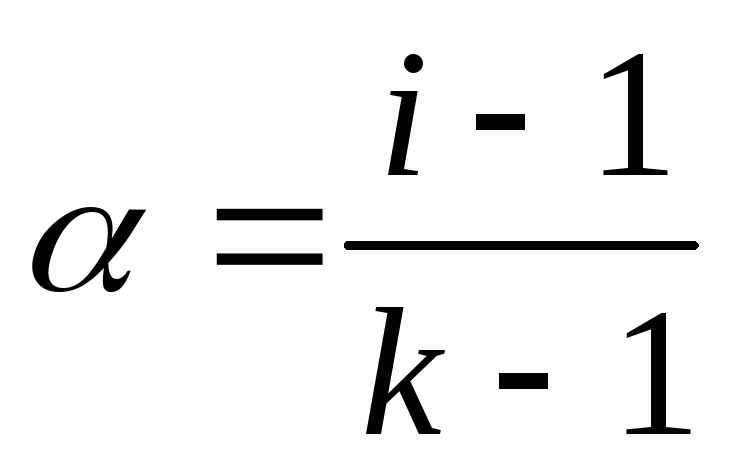 (16)
(16)
α – степень диссоциации электролита;
k – число частиц, образующихся при диссоциации 1молекулы электролита.
Пример 8. Определите температуру кипения раствора AgNO3, если ω(AgNO3)= 2%, α(AgNO3) = 90%, ρ(р-ра) = 1 г/мл.
Решение. 1. Определим сm(AgNO3):
Примем m(р-ра)= 100г, тогда m(AgNO3)= ω(AgNO3)=2г;
m(H2O)= 100- 2= 98г;
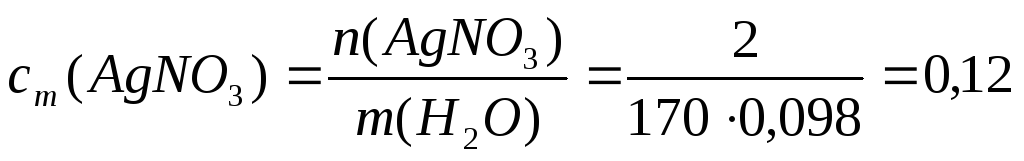 моль/кг;
моль/кг;
M(AgNO3)=170 г/моль;
2.Определим i по формуле (16): AgNO3=Ag+ + NO3–; k =2;
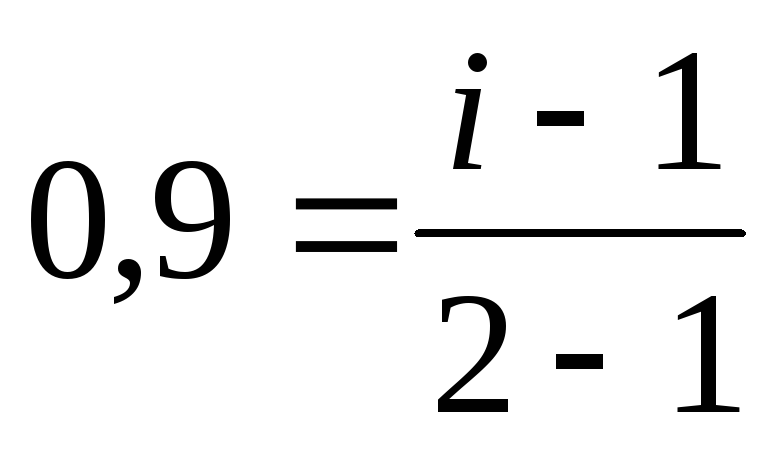 ; i
=1,9
; i
=1,9
Определим Ткип по формуле (10):
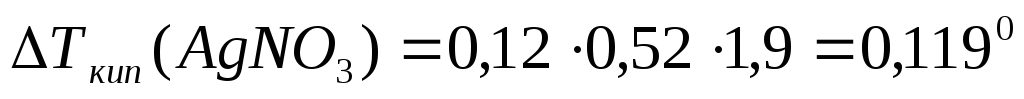
4. Ткип(AgNO3)= 373 + 0,119 = 373,1190
Пример 8а. Определите осмотическое давление раствора AgNO3, при 200С, если ω(AgNO3)= 2%, α(AgNO3) = 90%, ρ(р-ра) = 1 г/мл.
Решение. 1. Определим с(AgNO3) по формуле (4):
Из примера 8 m(р-ра)= 100г, m(AgNO3) =2г
V(р-ра)= 100/ 1= 100 мл = 0,1 л;
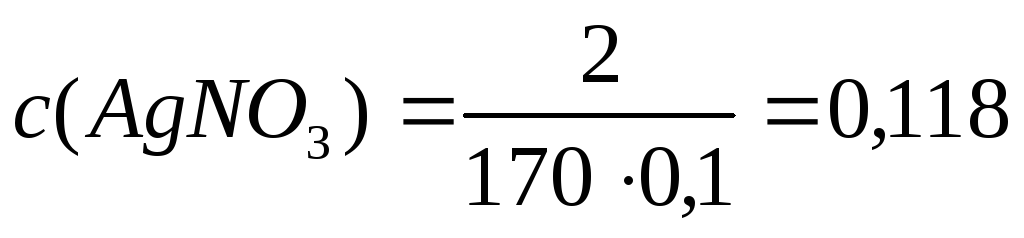 моль/л
моль/л
2. Определим pосм(AgNO3) по формуле (15):
Из примера (8) i=1,9; Т=293К
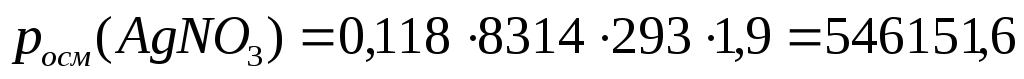 Па
Па
Пример 8б. Определите давление насыщенного пара над раствором AgNO3 при 200С, если р0(Н2О)=2337,8 Па, ω(AgNO3)= 2%, α(AgNO3) = 90%, ρ(р-ра) = 1 г/мл.
Решение. Из примера 8 m(AgNO3)=2г; m(H2O)= 98г;
Определим x(В)
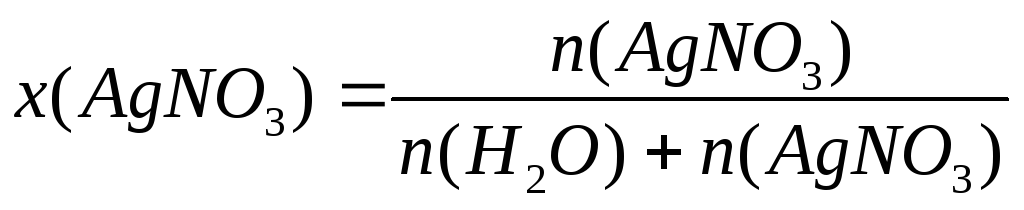 ;
;
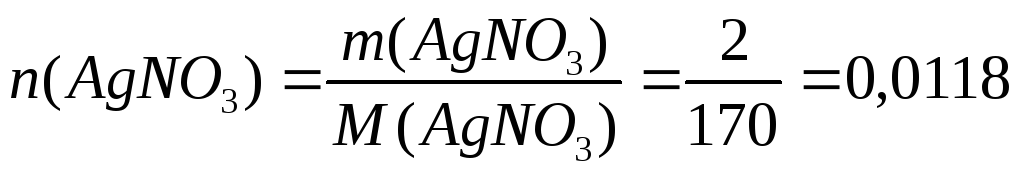 моль
моль
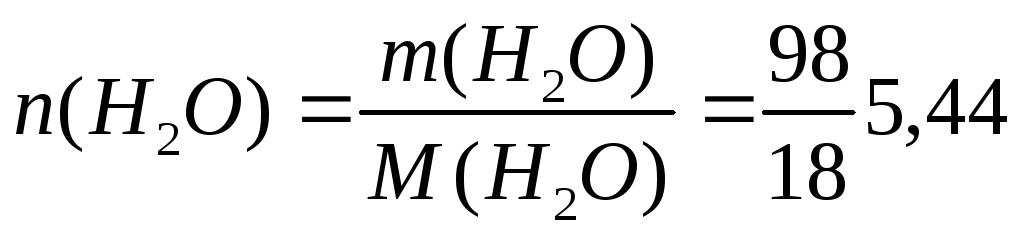 моль;
моль; 
Определим p по формуле (12):
 Па
Па
Определим p по формуле (8а):
 ;
;  Па
Па
Пример 9. При 00С осмотическое давление 0,1н раствора К2СО3 равно 272 кПа. Определите степень диссоциации карбоната калия в этом растворе.
Решение. 1.Рассчитаем c(B) по формуле (4):
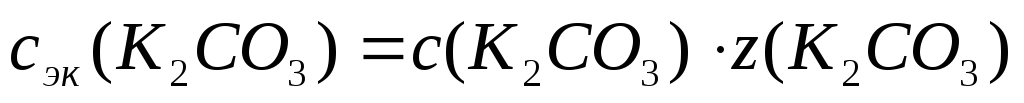 ;
; 
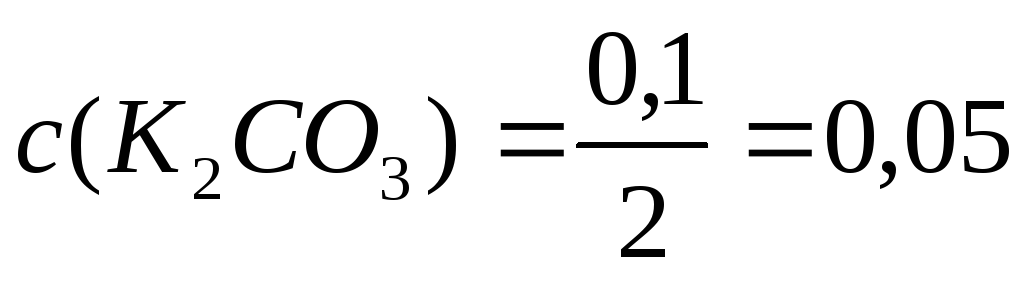 моль/л
моль/л
2. Рассчитаем i по формуле (15):

3.Рассчитаем по формуле (16):
K2CO3= 2K+ + CO32-; k = 3;
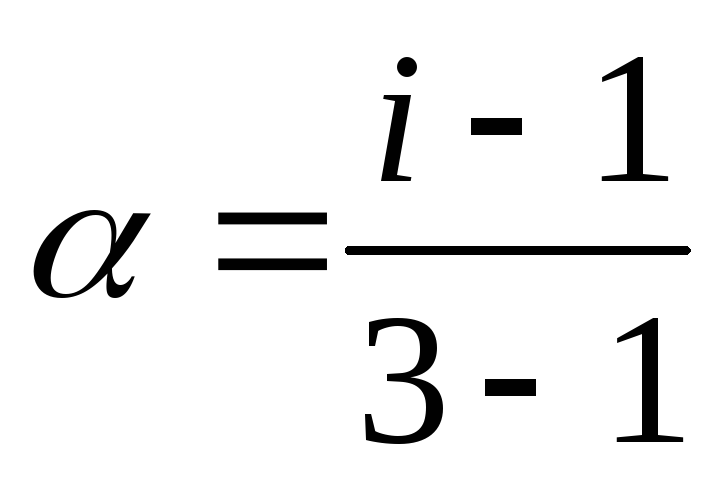 ;
α=
0,699.
;
α=
0,699.
Пример 10. Определите моляльую концентрацию раствора KCl, если его водный раствор замерзает при -0,320C, а α(KCl)=66,5%.
Решение.
1. По формуле (9а) ΔТзам=0,320
2. Рассчитаем i по формуле (16):
KCl = K+ + Cl–;
k =2 ; 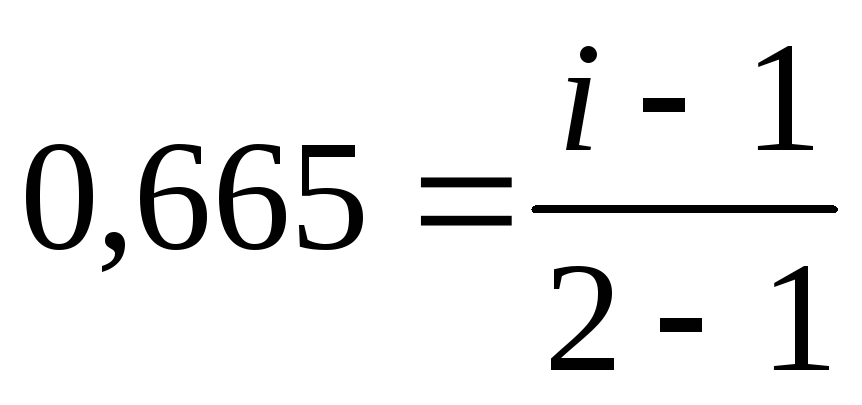 ;
i = 1,665;
;
i = 1,665;
3. Рассчитаем моляльную концентрацию по формуле (13):
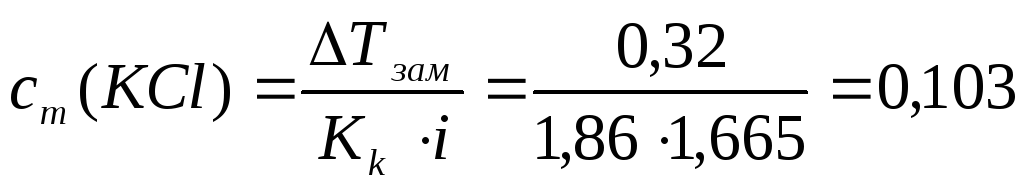 моль/кг;
моль/кг;
Вопрос 13) элементы теории растворов электролитов. Сильные и слабые электролиты. Активность и коэфициент активности электролитов. Электролиты в организме.
Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения электронов
обобщая экспериментальные данные, Я.Г. Вант-Гофф пришел к выводу, что растворы электролитов всегда ведут себя так, будто они содержат больше частиц растворенного вещества, чем следует из аналитической концентрации: повышение температуры кипения, понижение температуры замерзания, осмотическое давление для них всегда больше, чем вычисленные. Для учета этих отклонений Вант-Гофф внес в уравнение (III.16) для растворов электролитов поправку – изотонический коэффициент i:
Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает до некоторого целочисленного значения.
Для объяснения особенностей свойств растворов электролитов С. Аррениус предложил теорию электролитической диссоциации, основывающуюся на следующих постулатах:
1. Электролиты в растворах распадаются на ионы – диссоциируют;
2. Диссоциация является обратимым равновесным процессом;
3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными).
Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность. Для оценки полноты диссоциации в теории электролитической диссоциации вводится понятие степень диссоциации α, которая равна отношению числа молекул n, распавшихся на ионы, к общему числу молекул N:
Величина степени диссоциации зависит от природы растворителя и растворенного вещества, концентрации раствора и температуры. По величине степени диссоциации электролиты подразделяются на три группы: сильные (α ≥ 0.7), средней силы (0.3 < α < 0.7) и слабые (α ≤ 0.3). К сильным электролитам относятся почти все соли (кроме Рb(СН3СОО)2, НgСl2, СdСl2), большинство неорганических кислот и щелочей; к слабым – все органические кислоты, вода, NН4ОН, Н2S и т.д. Электролитами средней силы являются некоторые неорганические кислоты: НF, НСN, Н3PO4.
Электролиты называются вещества, растворы которых проводят электрический ток ионами, образующимися в результате электролитической диссоциации
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
Переносчиками электрического тока в растворах электролитов являются ионы, образующиеся при диссоциации молекул электролитов. Поскольку при диссоциации число частиц в растворе возрастает, растворы электролитов обладают аномальными коллигативными свойствами. Уравнения, описывающие коллигативные свойства неэлектролитов, можно применить и для описания свойств идеальных растворов электролитов, если ввести поправочный изотонический коэффициент Вант-Гоффа, например: i осм. = iCRT или ∆ Tзам. = iKm. Изотонический коэффициент связан со степенью диссоциации электролита: i = 1 + (n — 1),где n — количество ионов, образующихся при диссоциации одной молекулы…Свойства реальных растворов описываются уравнениями, в которых вместо концентраций вводится активность. Активность иона ai выражается в виде произведения концентрации иона mi на его коэффициент активности i: ai = i mi. коэффициенты активности ионов не зависят от конкретного вида ионов, находящихся в растворе, а зависят от ионной силы I раствора :где zi — заряд иона (в единицах заряда протона), mi — его моляльная концентрация. Согласно первому приближению теории Дебая-Хюккеля, можно рассчитать как коэффициент активности i отдельного иона Так и средний ионный коэффициент активности: где z+ и z- заряды катиона и аниона, I — ионная сила раствора, A — константа, зависящая от диэлектрической проницаемости растворителя и температуры. Для водного раствора при 25o C A = 0.509.
вопрос 14) Электрическая проводимость растворов. Жидкости и ткани организма как проводники электричества второго рода. Удельная электрическая проводимость раствора, молярная электрическая проводимость электролита; их изменение с концентрацией раствора. Электрическая подвижность ионов. Предельная молярная электрическая подвижность. Закон Кольрауша.
Электрический ток есть упорядоченное перемещение заряженных частиц. Растворы электролитов обладают ионной проводимостью (являются т.н. проводниками второго рода), т.е. электропроводность растворов электролитов обусловлена перемещением ионов в электрическом поле (в отличие от электронной проводимости проводников первого рода).
Величина преимущественного передвижения иона в направлении одного из электродов при прохождении тока через раствор отнесённая к градиенту потенциала 1 В/см, есть абсолютная скорость движения иона. Абсолютные скорости движения ионов имеют величины порядка 0,0005 – 0,003 см2/(В·с). Абсолютные скорости движения катионов U+ и анионов U–различаются; это приводит к тому, что ионы разных знаков переносят разные количества электричества.
Всякий проводник, по которому течет ток, представляет для него определенное сопротивление R, которое, согласно закону Ома, прямо пропорционально длине проводника l и обратно пропорционально площади сечения S; коэффициентом пропорциональности является удельное сопротивление материала ρ – сопротивление проводника, имеющего длину 1 см и сечение 1 см2:
, Ом
В качестве количественной меры способности раствора электролита проводить электрический ток используют обычно удельную электропроводность κ (каппа) – величину, обратную удельному сопротивлению (т.е. величину, обратную сопротивлению столба раствора между электродами площадью 1 см2, находящимися на расстоянии 1 см):
, Ом-1см-1
Величина удельной электропроводности электролита зависит от ряда факторов: природы электролита, температуры, концентрации раствора. Удельная электропроводность растворов электролитов (в отличие от электропроводности проводников первого рода) с увеличением температуры возрастает, что вызвано увеличением скорости движения ионов за счет понижения вязкости раствора и уменьшения сольватированности ионов. Зависимость удельной электропроводности от концентрации раствора представлена на рис. 3.9.
Рис. 3.9 Зависимость удельной электропроводности электролитов от концентрации (1 – H2SO4, 2 – KOH, 3 – CH3COOH)
Как видно из рисунка, с увеличением концентрации удельная электропроводность растворов сначала возрастает, достигая некоторого максимального значения, затем начинает уменьшаться. Эта зависимость очень чётко выражена для сильных электролитов и значительно хуже для слабых. Наличие максимума на кривых объясняется тем, что в разбавленных растворах сильных электролитов скорость движения ионов мало зависит от концентрации, и κсначала растет почти прямо пропорционально числу ионов; с ростом концентрации усиливается взаимодействие ионов, что уменьшает скорость их движения. Для слабых электролитов наличие максимума на кривой обусловлено тем, что с ростом концентрации уменьшается степень диссоциации, и при достижении определенной концентрации число ионов в растворе начинает увеличиваться медленнее, чем концентрация. Для учета влияния на электрическую проводимость растворов электролитов их концентрации и взаимодействия между ионами введено понятие молярной электропроводности раствора.
Молярная электропроводность раствора λ есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью κ и молярной концентрацией раствора С молярная электропроводность связана следующим соотношением:
, Ом-1см2моль-1 (III.34)
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т.е. увеличением разведения раствора V = 1/С), достигая некоторого предельного значения λo, называемого молярной электропроводностью при бесконечном разведении (рис. 3.10 – 3.11).
Рис. 3.10 Зависимость молярной Рис. 3.11 Зависимость молярной электропроводности от концентрации. электропроводности от разведения
Для слабого электролита такая зависимость молярной электропроводности от концентрации обусловлена в основном увеличением степени диссоциации с разбавлением раствора. В случае сильного электролита с уменьшением концентрации ослабляется взаимодействие ионов между собой, что увеличивает скорость их движения и, следовательно, молярную электропроводность раствора. Последнюю связывает с абсолютными скоростями движения катионов и анионов U+ и U– уравнение Аррениуса (III.35):
(III.35)
Ф. Кольрауш показал, что в молярную электропроводность бесконечно разбавленных растворов электролитов каждый из ионов вносит свой независимый вклад, и λo является суммой молярных электропроводностей катиона и аниона λ+ и λ– (т.н. подвижностей ионов), и сформулировал закон независимости движения ионов:
Молярная электропроводность при бесконечном разведении равна сумме электролитических подвижностей катиона и аниона данного электролита.
(III.36)
Подставив в это выражение уравнение Аррениуса и приняв, что при бесконечном разведении степень диссоциации α равна единице, получим:
Отсюда
; (
Электролитическая подвижность является важнейшей характеристикой иона, отражающей его участие в электропроводности раствора.
Организм в целом, а также его различные ткани представляют собой сложный электролитический раствор. Величина электропроводности зависит от содержания в тканях жидкости.Жидкие среды организма: кровь, лимфа, моча, спинномозговая жидкость — обладают наибольшей электропроводностью.К хорошим проводникам также относятся внутренние органы и мышечная ткань, а к плохим — кость, жировая ткань. Большим сопротивлением проводимости обладает кожа, особенно ее роговой слой. В коже ток проходит в основном через протоки потовых и сальных желез, межклеточные пространства эпидермиса. Прохождение электрического тока через ткани организма связано с переносом вещества. Ионы тканей человека, когда соприкасаются с проводниками I рода (металлические пластины аппарата — электроды), превращаются в нейтральные атомы, так как теряют свой заряд. Происходит процесс электролиза: молекулы, потеряв свой заряд, распались на атомы, и эти атомы вступают в реакцию с другими атомами, в других сочетаниях, образуя совершенно другие вещества — продукты электролиза. Электрический ток характеризуется, прежде всего, количеством зарядов, протекающих через поперечное сечение проводника в единицу времени. Для обозначения этого количества зарядов пользуются понятием силы тока. За единицу силы тока принят ампер. В электролечении чаще приходится иметь дело с тысячными долями ампера — миллиамперами.БИОЭЛЕКТРИ́ЧЕСКИЕ
ПОТЕНЦИА́ЛЫ, электрические потенциалы в тканях и клетках (главным образом в клеточных мембранах) живых организмов. Связаны с процессами возбуждения и торможения у животных и человека и раздражимости у растений. Исследования биоэлектрических потенциалов применяют с диагностическими целями (электрокардиография, электроэнцефалография и др.).
БИОЭЛЕКТРИ́ЧЕСКИЕ ПОТЕНЦИА́ЛЫ (биопотенциалы), электрические потенциалы в тканях и клетках живых организмов. Обусловлены способностью клеток и тканей быть источниками электрического тока и выступать в качестве так называемых электрических проводников второго рода с неоднородной структурой (в отличие от металлов, являющихся электрическими проводниками первого рода с однородной структурой).
степень электролитической диссоциации. Константа диссоциации. Закон разбавления Оствальда.
Растворы электролитов проводят электричество
По величине степени диссоциации все электролиты можно условно разделить на сильные (степень диссоциации которых стремится к единице) и слабые (степень диссоциации которых стремится к нулю).
Сильные электролиты в растворах практически полностью распадаются на ионы, и уравнение диссоциации для таких электролитов принято записывать как необратимый процесс.
К сильным электролитам относят щелочи, все соли, некоторые кислоты (HCl, HNO3, H2S04, НСlO4, HBr, HI, CF3COOH и др.).
Слабые электролиты в растворах диссоциируют очень незначительно, причем этот процесс обратим.
К слабым электролитам относятся многие неорганические (h3S, h3C03, HCN) и почти все органические кислоты. Вода, будучи причиной диссоциации, сама незначительно диссоциирует.

{\displaystyle \alpha ={\frac {n}{N}}\cdot 100\%}
Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как, например, когда комплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы.
Закон разведения Оствальда: степень диссоциации электролита при разбавлении раствора увеличивается
33. Понятие изотонического коэффициента и формулы расчета коллигативных свойств для электролитов. Связь степени электролитической диссоциация и изотонического коэффициента.
Изотонический коэффициент — безразмерный параметр, характеризующий поведение вещества в растворе.
Изотонический коэффициент ί связан со степенью диссоциации электролита αдис соотношением:
ί = 1 + αдис (p — 1) или α = (ί — 1) /( p — 1).
Здесь p — число ионов, на которые распадается молекула электролита (для КСl p= 2, для ВаСl2 и Na2SO4 p = 3 и т.д). Экспериментально найденное значение изотонического коэффициента используют для вычисления степени диссоциации электролита растворе.
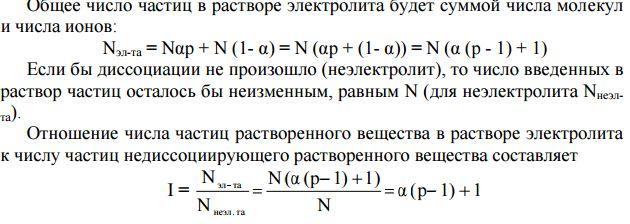

34. Ионно-обменные реакции, полные и сокращенные. Направление протекания ионно-обменных реакций.
Реакциями ионного обмена называют реакции между растворами электролитов, в результате которых они обмениваются своими ионами. Реакции ионного обмена протекают до конца (являются практически необратимыми) в тех случаях, если образуются слабый электролит, осадок (нерастворимое или малорастворимое вещество), газ.
2 Примеры записи реакций ионного обмена
Пример 1– В результате реакции образуется нерастворимое вещество
Молекулярное уравнение реакции взаимодействия растворимой соли со щелочью
CuCl2 + 2KOH → 2KCl + Cu(OH)2↓.
Полное ионное уравнение реакции
Cu2+ + 2Cl– + 2K+ + 2OH– → 2K+ + 2Cl– + Cu(OH)2↓.
Сокращенное ионное уравнение реакции
Cu2+ + 2OH– → Cu(OH)2↓.
35. Электролитическая диссоциация воды, водородный показатель (рН). Расчет водородного показателя.
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах



 ,
Н+ — концентрация ионов водорода
,
Н+ — концентрация ионов водорода