Гидроксид железа (II), характеристика, свойства и получение, химические реакции
Гидроксид железа (II), характеристика, свойства и получение, химические реакции.
Гидроксид железа (II) – неорганическое вещество, имеет химическую формулу Fe(OH)2.
Краткая характеристика гидроксида железа (II)
Физические свойства гидроксида железа (II)
Получение гидроксида железа (II)
Химические свойства гидроксида железа (II)
Химические реакции гидроксида железа (II)
Применение и использование гидроксида железа (II)
Краткая характеристика гидроксида железа (II):
Гидроксид железа (II) – неорганическое вещество белого цвета. Иногда имеет зеленоватый оттенок из-за примесей солей железа. Со временем на воздухе темнеет вследствие окисления, приобретая грязно-бурый цвет (цвет ржавчины).
Химическая формула гидроксида железа (II) Fe(OH)2.
Является одним из промежуточных соединений при ржавлении железа.
Не растворяется в воде и других растворителях. Растворимость в воде 5,2⋅10
Не горит. При нагревании разлагается на оксид железа (II,III) и водород.
Гидроксид железа (II) встречается в природе в виде минерала амакинита. Данный минерал содержит примеси магния и марганца (эмпирическая формула амакинита Fe0,7Mg0,2Mn0,1(OH)2). Цвет минерала амакинита жёлто-зелёный или светло-зелёный, твёрдость по Моосу 3,5-4, плотность 2,925—2,98 г/см³.
Физические свойства гидроксида железа (II):
| Наименование параметра: | Значение: |
| Химическая формула | Fe(OH)2 |
| Синонимы и названия иностранном языке | iron(II) hydroxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | белые или светло-зелёные тригональные кристаллы |
| Цвет | белый (иногда с зеленоватым оттенком), на воздухе со временем темнеет, приобретая грязно-бурый цвет. |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 3400 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 3,4 |
| Температура разложения, °C | 150 |
| Гигроскопичность | отсутствует |
| Молярная масса, г/моль | 89,86 |
* Примечание:
— нет данных.
Получение гидроксида железа (II):
В лаборатории гидроксид железа (II) получается в результате следующих химических реакций:
- 1. в результате взаимодействия сульфата железа (II) с гидроксидом калия:
FeSO4 + 2KOH → Fe(OH)2 + K2SO4.
При этом гидроксид железа (II) выпадает в осадок.
- 2. в результате взаимодействия хлорида железа (II) и гидроксида калия:
FeCl2 + 2KOH → Fe(OH)2 + 2KCl.
При этом гидроксид железа (II) выпадает в осадок.
Гидроксид железа (II) получают при действии растворов щелочей на соли железа (II) без доступа воздуха.
- 3. в результате ржавления железа:
2Fe + 2Н2O + O2 → Fe(OH)2.
Данная реакция образование гидроксида железа (II) является одной из стадий ржавления железа. Реакция протекает медленно.
Химические свойства гидроксида железа (II). Химические реакции гидроксида железа (II):
Гидроксид железа (II) – слабое основание. Проявляет также и слабые амфотерные свойства, реагирует с концентрированными щелочами.
Химические свойства гидроксида железа (II) аналогичны свойствам гидроксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида железа (II) с ортофосфорной кислотой:
Fe(OH)2 + H3PO4 → Fe3(PO4)2 + 6H2O.
В результате реакции образуются фосфат железа (II) и вода. В качестве исходного вещества используется разбавленный раствор ортофосфорной кислоты.
2. реакция гидроксида железа (II) с азотной кислотой:
Fe(OH)2 + 2HNO3 → Fe(NO3)2 + 2H2O.
В результате реакции образуются нитрат железа (II) и вода. В качестве исходного вещества используется разбавленный раствор азотной кислоты.
Аналогично проходят реакции гидроксида железа (II) и с другими кислотами.
3. реакция гидроксида железа (II) с фтороводородом:
Fe(OH)2 + 2HF → FeF2 + 2H2O.
В результате реакции образуются фторид железа (II) и вода.
4. реакция гидроксида железа (II) с бромоводородом:
Fe(OH)2 + 2HBr → FeBr2 + 2H2O.
В результате реакции образуются бромид железа (II) и вода.
5. реакция гидроксида железа (II) с йодоводородом:
Fe(OH)2 + 2HI → FeI2 + 2H2O.
В результате реакции образуются йодид железа (II) и вода.
6. реакция гидроксида железа (II) с гидроксидом натрия:
Fe(OH)2 + 2NaOH → Na2[Fe(OH)4] (to).
В результате реакции образуется тетрагидроксоферрат (II) натрия. При этом в ходе реакции качестве исходного вещества используется гидроксид натрия в виде концентрированного раствора (концентрация более 50 %). Реакция протекает при кипении в атмосфере азота.
7. реакция гидроксида железа (II) с хлоридом аммония:
Fe(OH)2 + 2NH4Cl → FeCl 2 + 2NH3 + 2H2O.
В результате реакции образуются хлорид железа (II), аммиак и вода. При этом в ходе реакции качестве исходного вещества используется концентрированный горячий раствор хлорида аммония.
8. реакция гидроксида железа (II) с бромидом аммония:
Fe(OH)2 + 2NH4Br → FeBr2 + 2NH3 + 2H2O.
В результате реакции образуются бромид железа (II), аммиак и вода. При этом в ходе реакции качестве исходного вещества используется концентрированный горячий раствор бромида аммония.
9. реакция гидроксида железа (II) с йодидом аммония:
Fe(OH)2 + 2NH4I → FeI2 + 2NH3 + 2H2O.
В результате реакции образуются йодид железа (II), аммиак и вода. При этом в ходе реакции качестве исходного вещества используется концентрированный горячий раствор йодида аммония.
10.
4Fe(OH)2 + O2 → 4FeO(OH) + 2H2O (to).
В результате реакции образуются метагидроксид железа и вода. При этом в ходе реакции качестве исходного вещества используется гидроксид железа (II) в виде суспензии. Реакция протекает при кипении. Данная реакция также происходит (медленно) в процессе коррозии железа.
11. реакция гидроксида железа (II) с кислородом и водой:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3.
В результате реакции образуется гидроксида железа (III). Данная реакция также происходит (медленно) в процессе коррозии железа.
12. реакция гидроксида железа (II) с метагидроксидом железа:
2FeO(OH) + Fe(OH)2 → Fe3O4 + 2H2O (t = 600-1000 oС).
В результате реакции образуются оксид железа (II,III) и вода. Данная реакция также происходит (медленно) в процессе коррозии железа.
13. реакция термического разложения гидроксида железа (II):
Fe(OH)2 → FeO + H2O (t = 150-200 oC).
В результате реакции образуются оксид железа (II) и вода. Также образуются примеси: железо Fe, оксид железа (II,III) Fe3O4.
Применение и использование гидроксида железа (II):
Гидроксид железа (II) используется:
– при изготовлении активной массы железо-никелевых аккумуляторов.
Примечание: © Фото https://www.pexels.com, https://pixabay.com




карта сайта
гидроксид железа (II) реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие гидроксида железа (II)
реакции с оксидом натрия
Коэффициент востребованности 751
xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai
Гидроксид железа(II) — это… Что такое Гидроксид железа(II)?
Гидрокси́д желе́за(II) — неорганическое вещество с формулой Fe(OH) 2, соединение железа. Амфотерный гидроксид с преобладанием осно́вных свойств. Кристаллическое вещество белого (иногда с зеленоватым оттенком) цвета, на воздухе со временем темнеет. Является одним из промежуточных соединений при ржавлении железа.
Нахождение в природе
Гидроксид железа(II) встречается в природе в виде минерала амакинита. Данный минерал содержит примеси магния и марганца (эмпирическая формула Fe0,7Mg0,2Mn0,1(OH)2). Цвет минерала жёлто-зелёный или светло-зелёный, твёрдость по Моосу 3,5—4, плотность 2,925—2,98 г/см³.[1]
Физические свойства
Чистый гидроксид железа(II) — кристаллическое вещество белого цвета. Иногда имеет зеленоватый оттенок из-за примесей солей железа. Со временем на воздухе темнеет вследствие окисления. Нерастворим в воде (растворимость 5,8·10−6 моль/л). При нагревании разлагается. Имеет тригональную сингонию кристаллической решётки.[2][3]
Химические свойства
Гидроксид железа(II) вступает в следующие реакции.[2]
Проявляет свойства основания — легко вступает в реакции нейтрализации с разбавленными кислотами, например с соляной (образуется раствор хлорида железа(II)):
В более жёстких условиях проявляет кислотные свойства, например с концентрированным (более 50 %) гидроксидом натрия при кипении в атмосфере азота образует осадок тетрагидроксоферрата(II) натрия:
Не реагирует с гидратом аммиака. При нагревании реагирует с концентрированными растворами солей аммония, например, хлорида аммония:
При нагревании разлагается с образованием оксида железа(II):
- В этой реакции в качестве примесей образуются металлическое железо и оксид дижелеза(III)-железа(II) (Fe3O4).
В виде суспензии, при кипячении в присутствии кислорода воздуха окисляется до метагидроксида железа. При нагревании с последним образует оксид дижелеза(III)-железа(II):
- Эти реакции также происходят (медленно) в процессе ржавления железа.
Получение
Гидроксид железа(II) может быть получен в виде осадка в обменных реакциях растворов солей железа(II) со щёлочью, например:
Образование гидроксида железа(II) является одной из стадий ржавления железа:
Применение
Гидроксид железа(II) находит применение при изготовлении активной массы железо-никелевых аккумуляторов.
Примечания
- ↑ Аманкинит на webmineral.com. Архивировано из первоисточника 21 апреля 2012.
- ↑ 1 2 Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — С. 179. — 637 с. — ISBN 978-5-358-01303-2
- ↑ Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 109, 467, 580, 605. — 685 с. — ISBN 5-7107-8085-5
dic.academic.ru
Гидроксид железа(II) — Википедия. Что такое Гидроксид железа(II)
Гидрокси́д желе́за(II) — неорганическое вещество с формулой Fe(OH)2, соединение железа. Амфотерный гидроксид с преобладанием осно́вных свойств. Кристаллическое вещество белого (иногда с зеленоватым оттенком) цвета, на воздухе со временем темнеет. Является одним из промежуточных соединений при ржавлении железа.
Нахождение в природе
Гидроксид железа(II) встречается в природе в виде минерала амакинита. Данный минерал содержит примеси магния и марганца (эмпирическая формула Fe0,7Mg0,2Mn0,1(OH)2). Цвет минерала жёлто-зелёный или светло-зелёный, твёрдость по Моосу 3,5—4, плотность 2,925—2,98 г/см³.[1]
Физические свойства
Чистый гидроксид железа(II) — кристаллическое вещество белого цвета. Иногда имеет зеленоватый оттенок из-за примесей солей железа. Со временем на воздухе темнеет вследствие окисления. Нерастворим в воде (растворимость 5,8·10−6 моль/л). При нагревании разлагается. Имеет тригональную сингонию кристаллической решётки.[2]
Химические свойства
Гидроксид железа(II) вступает в следующие реакции.[2]
Проявляет свойства основания — легко вступает в реакции нейтрализации с разбавленными кислотами, например с соляной (образуется раствор хлорида железа(II)):
- Fe(OH)2 + 2HCl ⟶ FeCl2 + 2h3O{\displaystyle {\mathsf {Fe(OH)_{2}\ +\ 2HCl\ \longrightarrow \ FeCl_{2}\ +\ 2H_{2}O}}}
В более жёстких условиях проявляет кислотные свойства, например с концентрированным (более 50 %) гидроксидом натрия при кипении в атмосфере азота образует осадок тетрагидроксоферрата(II) натрия:
- Fe(OH)2 + 2NaOH ⟶ Na2[Fe(OH)4]↓{\displaystyle {\mathsf {Fe(OH)_{2}\ +\ 2NaOH\ \longrightarrow \ Na_{2}[Fe(OH)_{4}]\downarrow }}}
Не реагирует с гидратом аммиака. При нагревании реагирует с концентрированными растворами солей аммония, например, хлорида аммония:
- Fe(OH)2 + 2Nh5Cl ⟶ FeCl2 + 2Nh4↑ + 2h3O{\displaystyle {\mathsf {Fe(OH)_{2}\ +\ 2NH_{4}Cl\ \longrightarrow \ FeCl_{2}\ +\ 2NH_{3}\uparrow \ +\ 2H_{2}O}}}
При нагревании разлагается с образованием оксида железа(II):
- Fe(OH)2 →150−200 ∘C FeO + h3O{\displaystyle {\mathsf {Fe(OH)_{2}\ {\xrightarrow {150-200\ ^{\circ }C}}\ FeO\ +\ H_{2}O}}}
- В этой реакции в качестве примесей образуются металлическое железо и оксид дижелеза(III)-железа(II) (Fe3O4).
В виде суспензии, при кипячении в присутствии кислорода воздуха окисляется до метагидроксида железа. При нагревании с последним образует оксид дижелеза(III)-железа(II):
- 4Fe(OH)2 + O2 ⟶ 4FeO(OH) + 2h3O{\displaystyle {\mathsf {4Fe(OH)_{2}\ +\ O_{2}\ \longrightarrow \ 4FeO(OH)\ +\ 2H_{2}O}}}
- Fe(OH)2 + 2FeO(OH) →600−1000 ∘C (FeIIFe2III)O4 + 2h3O{\displaystyle {\mathsf {Fe(OH)_{2}\ +\ 2FeO(OH)\ {\xrightarrow {600-1000\ ^{\circ }C}}\ (Fe^{II}Fe_{2}^{III})O_{4}\ +\ 2H_{2}O}}}
- Эти реакции также происходят (медленно) в процессе коррозии железа.
Получение
Гидроксид железа(II) может быть получен в виде осадка в обменных реакциях растворов солей железа(II) со щёлочью, например:
- FeSO4 + 2KOH ⟶ Fe(OH)2↓ + K2SO4{\displaystyle {\mathsf {FeSO_{4}\ +\ 2KOH\ \longrightarrow \ Fe(OH)_{2}\downarrow \ +\ K_{2}SO_{4}}}}
Образование гидроксида железа(II) является одной из стадий ржавления железа:
- 2Fe + 2h3O + O2 ⟶ 2Fe(OH)2{\displaystyle {\mathsf {2Fe\ +\ 2H_{2}O\ +\ O_{2}\ \longrightarrow \ 2Fe(OH)_{2}}}}
Применение
Гидроксид железа(II) находит применение при изготовлении активной массы железо-никелевых аккумуляторов.
Примечания
- ↑ Аманкинит на webmineral.com. Архивировано 21 апреля 2012 года.
- ↑ 1 2 Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — С. 179. — 685 с. — ISBN 5-7107-8085-5.
wiki.sc
| Химическая формула | Fe(OH)2 |
|---|---|
| Внешний вид | белые или светло-зелёные кристаллы |
| Свойства | |
| Молярная масса | 89,86 г/моль |
| Температура разложения | 150—200 °C |
| Плотность | 3,4 г/см³ |
| Твёрдость по Моосу | 3,5—4 |
| Константа диссоциации pKb | 1,92 |
| Растворимость в воде | 5,2·10−5 г/100 мл |
| Произведение растворимости | 7,9·10−16 |
| Структура | |
| Кристаллическая решётка | тригональная |
| Термодинамические свойства | |
| Стандартная энтальпия образования | −574 кДж/моль |
| Стандартная молярная энтропия | +92 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −493 кДж/моль |
| Классификация | |
| Регистрационный номер CAS | 18624-44-7 |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
| актиния(III) • алюминия • бария • бериллия • железа(II) • железа(III) • кадмия • калия • кальция • лития • магния • марганца(II) • меди(II) • натрия • радия • рубидия • стронция • цезия • цинка Гидрат аммиака • Гидроксиламин • Метагидроксид железа |
Гидроксид железа(II) Информацию О

Гидроксид железа(II) Комментарии
Гидроксид железа(II)
Гидроксид железа(II)
Гидроксид железа(II) Вы просматриваете субъект
Гидроксид железа(II) что, Гидроксид железа(II) кто, Гидроксид железа(II) описание
There are excerpts from wikipedia on this article and video
www.turkaramamotoru.com
Гидроксид железа(III) — это… Что такое Гидроксид железа(III)?
Гидроксид железа(III) — неорганическое соединение, гидроксид металла железа с формулой Fe(OH)3, красновато-коричневые кристаллы, не растворяется в воде.
Получение
- В природе встречается минерал лимнит (разновидность лимонита), по составу совпадает с Fe(OH)3.
- Действие щелочей на растворимые соли железа(III):
Физические свойства
Гидроксид железа(III) образует красновато-коричневые кристаллы кубической сингонии, параметры ячейки a = 0,571 нм.
Трудно растворим в воде, легко образует коллоидные растворы.
Химические свойства
- Разлагается при нагревании:
- Реагирует с кислотами:
Применение
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
dic.academic.ru
Свойства д-элементов(2 часть)+_Ужато
Свойства d-элементов ( 2 часть).
Теоретическая часть
Железо, кобальт, никель составляют «семейство» железа.
Проявляют степень окисления главным образом +2 и +3. Степень окисления +3 более характерна железа, +2 для кобальта и никеля.
Родственные черты этих металлов проявляются в свойственной им ферромагнитности, каталитической активности, способности к образованию окрашенных ионов, комплексообразовании. Однако при схожести свойств, железо по своим магнитным свойствам ярко выделяется в триаде. Восстановительная активность железа значительно больше, чем кобальта и никеля (смотри электродные потенциалы). Все эти металлы со щелочами не взаимодействуют. При растворении в неокисляющих кислотах образуют ионы Fe2+, Co2+, Ni2+

В разбавленной азотной кислоте (сильном окислителе ) образуются ионы Fe3+, Co3+, Ni3+

Сильная окислительная среда: H2SO4 (конц.), HNO3 (конц.) пассивирует железо и оно начинает реагировать лишь при нагревании:

В азотной кислоте, содержащей соли NaNO2 и NaNO3, железо пассивируется с образованием пленки оксида высшей степени окисления FeO3
В ряду гидроксидов: Fe(OH)2 — Co(OH)2 — Ni(OH)2
 восстановительная
способность падает
восстановительная
способность падает
Гидроксид железа (II) легко окисляется кислородом воздуха:

Окисление ионов Co2+ происходит труднее и протекает медленно:

Более интенсивно идет процесс при добавлении в раствор пероксида водорода:

Самопроизвольного окисления Ni(OH)2 кислородом воздуха не происходит, H2O2 является также не достаточно сильным окислителем и процесс окисления Ni(OH)2 становится возможным лишь при использовании более сильного окислителя, например бромной воды:
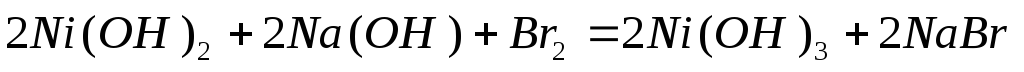
Гидроксиды Fe (III), Co (II), Co (III), Ni (II), Ni (III) носят в обычных условиях основной характер. При растворении в кислотах Co(OH)3 и Ni(OH)3 проявляют сильные окислительные свойства и восстанавливаются до катионов Co2+ и Ni2+.
Гидроксид железа (III) при кипячении с концентрированным раствором щелочи образует ферриты — соли железистой кислоты.
Таким образом гидроксид Fe(OH)3, проявляет амфотерные свойства.
Гидроксиды Fe (II), Fe (III), Co (II), Co (III), Ni (II) нерастворимы
Гидроксиды Fe (II), Fe (III), Co (II), Co (III), Ni (II) являются слабыми основаниями, поэтому их соли в водных растворах гидролизуются.


Эти процессы идут без нагревания.
Однако гидролиз солей не идет до конца вследствие накопления в растворе H+. При сильном разбавлении и нагревании гидролиз идет дальше:
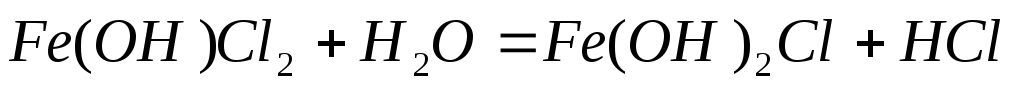
При кипячении раствора FeCl3 процесс гидролиза можно провести необратимо:
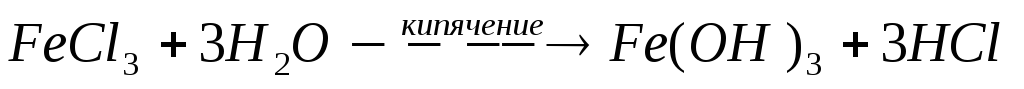
При подкислении растворов солей соответствующими кислотами степень их гидролиза уменьшается, так как равновесие сдвигается в сторону исходных веществ.
При сильном разбавлении степень гидролиза увеличивается. При добавлении растворимых карбонатов — происходит необратимой гидролиз, так как продукты реакции уходят из сферы взаимодействия.
Соли Fe (II) на воздухе постепенно переходят в соли Fe (III).
В комплексных соединениях Fe, Co, Ni являются центральными ионами комплексообразователями с координационными числами 4 или 6.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Опыт № 3 Получение и свойства гидроксида железа (II).
К раствору соли железа (II) подливаем раствор щелочи NaOH до образования осадка, затем осадок разделить на три части:
а) в первую пробирку добавляем избыток щелочи;
б) во вторую — кислоту;
в) осадок из третьей пробирки отфильтровать и дать ему постоять на воздухе.
В присутствии влаги и кислорода воздуха гидроксид железа (II) переходит в гидроксид железа (III).




 (Цвет
не меняется. Реакция не идет)
(Цвет
не меняется. Реакция не идет) (Цвет
изменяется на грязно-зеленый)
(Цвет
изменяется на грязно-зеленый)Ф
 ильтрование
(2) осадок на воздухе окисляется
(ржавеет)
ильтрование
(2) осадок на воздухе окисляется
(ржавеет)
Опыт № 4 Характерная реакция на ион Fe2+.
Наливаем в пробирку немного соли железа (II) и добавляем небольшое количество раствора красной кровяной соли K3[Fe(CN)6]. Эта реакция применяется для открытия ионов железа (II).

Вывод: Красная кровяная соль K3[Fe(CN)6] является реактивом на ион железа (II).
Опыт № 5 Получение и гидролиз карбоната железа (II).
К раствору соли железа (II) добавляем раствор карбоната натрия. Образовавшаяся белая углекислая соль железа (II) мгновенно подвергается гидролизу с образованием гидроксида железа (II).


Вывод: соль, образованная слабой кислотой гидролизуется до конца, т.к. H2CO3 распадается на H2O и CO2 и H2CO3 полностью удаляется из сферы реакции.
Опыт № 6 Получение гидроксида железа (III)
Наливаем в пробирку немного соли железа (II). Добавляем раствор щелочи NaOH до появления осадка.
Добавляем щелочь. Реакция не идет.
Добавляем
кислоту — 
Опыт № 8 Характерные реакции на ион Fe3+
А) К раствору соли железа (III) добавляем несколько капель желтой кровяной соли. Получается синий осадок берлинской лазури.
Б) К раствору соли железа (III) добавляем несколько капель роданида аммония NH4CNS.
Вывод: Выпадает синий осадок.
Вывод: Образовывается красный раствор
Опыт № 12 Исследование прочности цианистых и роданистых комплексов
К раствору красной кровяной соли добавляем концентрированный раствор роданида аммония.
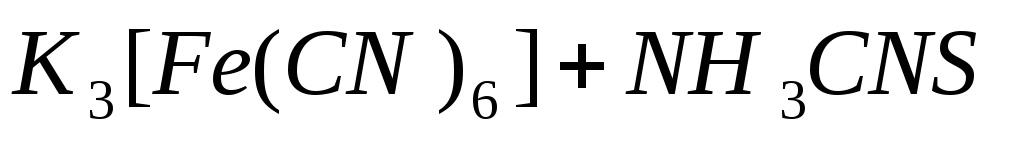 реакция
не идет
реакция
не идет
Вывод: красной окраски Fe3+ не наблюдается.
Опыт № 13 Получение гидроксида кобальта (II) и изучение его свойств
К раствору соли кобальта (II) добавляем немного раствора едкого натра. Образуется плохо растворимая основная соль кобальта. Основная соль переходит в розовый гидроксид кобальта (II). Полученный осадок разделяем на три части: а) в первую пробирку добавляем кислоту; б) во вторую — избыток щелочи; в) в третьей пробирке наблюдаем постепенное побурение, осадка вследствие окисления Co(OH)2 в Co(OH)3 кислородом воздуха. Процесс побурения осадка на воздухе происходит достаточно долго (в течение 10 минут ). Отделим часть осадка Co(OH)2 и подействуем на него раствором перекиси водорода.

Вывод: осадок переходит в розовый гидроксид Со(II)
а) 
б)  Р.Н.И.
Р.Н.И.
в) 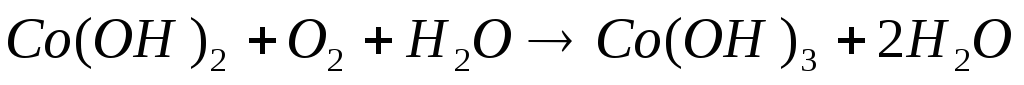
г) 
Вывод: При добавлении перекиси водорода скорость перехода к Co(OH)3 увеличивается.
Опыт № 14 Получение аммиаката кобальта (II)
К раствору соли кобальта (II) добавляем сначала немного раствора аммиака, а затем избыток его.

Вывод: Наблюдается светло-синий коллоидный раствор.
Опыт № 18 Получение аммиаката никеля
К раствору соли никеля (II) добавим несколько капель раствора аммиака, а затем его избыток.

 светло-зеленый
раствор
светло-зеленый
раствор
Опыт № 19 Характерная реакция на ион
К полученному в опыте 18 раствору комплексной соли никеля добавим спиртовой раствор диметилглиоксима, образуется розово-красный осадок никельдиметилглиоксимата по следующему уравнению реакции:
 розово-красный
осадок.
розово-красный
осадок.
Вывод: реакция используется для колич. определения Ni2+ в растворе, полученном при растворении его сплавов.
Контрольные вопросы
Гидроксид Fe (III) получается потому, что Fe2(CO3)3 в дальнейшем гидролизуется.
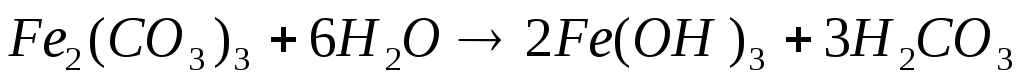
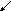

H2O CO2
Происходит необратимый процесс.
8. 
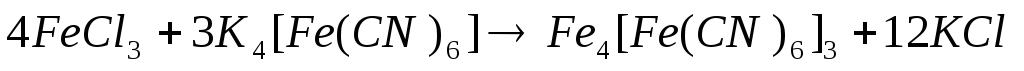
г)

существовать совместно не могут.
д

 )
) 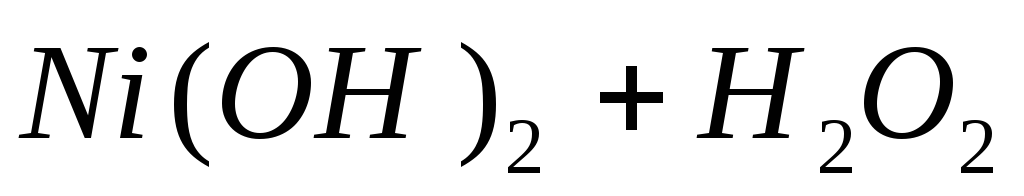
могут существовать совместно, т.к. H2O2 не достаточно сильный окислитель для Ni(OH)2.
e) 
Существовать совместно не могут.
3
studfile.net
Свойства д-элементов(2 часть)+
Свойства d-элементов ( 2 часть).
Теоретическая часть
Железо, кобальт, никель составляют «семейство» железа.
Проявляют степень окисления главным образом +2 и +3. Степень окисления +3 более характерна железа, +2 для кобальта и никеля.
Родственные черты этих металлов проявляются в свойственной им ферромагнитности, каталитической активности, способности к образованию окрашенных ионов, комплексообразовании. Однако при схожести свойств, железо по своим магнитным свойствам ярко выделяется в триаде. Восстановительная активность железа значительно больше, чем кобальта и никеля (смотри электродные потенциалы). Все эти металлы со щелочами не взаимодействуют. При растворении в неокисляющих кислотах образуют ионы Fe2+, Co2+, Ni2+

В разбавленной азотной кислоте (сильном окислителе ) образуются ионы Fe3+, Co3+, Ni3+

Сильная окислительная среда: H2SO4 (конц.), HNO3 (конц.) пассивирует железо и оно начинает реагировать лишь при нагревании:

В азотной кислоте, содержащей соли NaNO2 и NaNO3, железо пассивируется с образованием пленки оксида высшей степени окисления FeO3
В ряду гидроксидов: Fe(OH)2 — Co(OH)2 — Ni(OH)2
 восстановительная
способность падает
восстановительная
способность падает
Гидроксид железа (II) легко окисляется кислородом воздуха:

Окисление ионов Co2+ происходит труднее и протекает медленно:

Более интенсивно идет процесс при добавлении в раствор пероксида водорода:

Самопроизвольного окисления Ni(OH)2 кислородом воздуха не происходит, H2O2 является также не достаточно сильным окислителем и процесс окисления Ni(OH)2 становится возможным лишь при использовании более сильного окислителя, например бромной воды:

Гидроксиды Fe (III), Co (II), Co (III), Ni (II), Ni (III) носят в обычных условиях основной характер. При растворении в кислотах Co(OH)3 и Ni(OH)3 проявляют сильные окислительные свойства и восстанавливаются до катионов Co2+ и Ni2+.
Гидроксид железа (III) при кипячении с концентрированным раствором щелочи образует ферриты — соли железистой кислоты.
Таким образом гидроксид Fe(OH)3, проявляет амфотерные свойства.
Гидроксиды Fe (II), Fe (III), Co (II), Co (III), Ni (II) нерастворимы
Гидроксиды Fe (II), Fe (III), Co (II), Co (III), Ni (II) являются слабыми основаниями, поэтому их соли в водных растворах гидролизуются.


Эти процессы идут без нагревания.
Однако гидролиз солей не идет до конца вследствие накопления в растворе H+. При сильном разбавлении и нагревании гидролиз идет дальше:

При кипячении раствора FeCl3 процесс гидролиза можно провести необратимо:

При подкислении растворов солей соответствующими кислотами степень их гидролиза уменьшается, так как равновесие сдвигается в сторону исходных веществ.
При сильном разбавлении степень гидролиза увеличивается. При добавлении растворимых карбонатов — происходит необратимой гидролиз, так как продукты реакции уходят из сферы взаимодействия.
Соли Fe (II) на воздухе постепенно переходят в соли Fe (III).
В комплексных соединениях Fe, Co, Ni являются центральными ионами комплексообразователями с координационными числами 4 или 6.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Опыт № 3 Получение и свойства гидроксида железа (II).
К раствору соли железа (II) подливаем раствор щелочи NaOH до образования осадка, затем осадок разделить на три части:
а) в первую пробирку добавляем избыток щелочи;
б) во вторую — кислоту;
в) осадок из третьей пробирки отфильтровать и дать ему постоять на воздухе.
В присутствии влаги и кислорода воздуха гидроксид железа (II) переходит в гидроксид железа (III).





 (Цвет
не меняется. Реакция не идет)
(Цвет
не меняется. Реакция не идет) (Цвет
изменяется на грязно-зеленый)
(Цвет
изменяется на грязно-зеленый)Ф
 ильтрование
(2) осадок на воздухе окисляется
(ржавеет)
ильтрование
(2) осадок на воздухе окисляется
(ржавеет)
Опыт № 4 Характерная реакция на ион Fe2+.
Наливаем в пробирку немного соли железа (II) и добавляем небольшое количество раствора красной кровяной соли K3[Fe(CN)6]. Эта реакция применяется для открытия ионов железа (II).

Вывод: Красная кровяная соль K3[Fe(CN)6] является реактивом на ион железа (II).
Опыт № 5 Получение и гидролиз карбоната железа (II).
К раствору соли железа (II) добавляем раствор карбоната натрия. Образовавшаяся белая углекислая соль железа (II) мгновенно подвергается гидролизу с образованием гидроксида железа (II).


Вывод: соль, образованная слабой кислотой гидролизуется до конца, т.к. H2CO3 распадается на H2O и CO2 и H2CO3 полностью удаляется из сферы реакции.
Опыт № 6 Получение гидроксида железа (III)
Наливаем в пробирку немного соли железа (II). Добавляем раствор щелочи NaOH до появления осадка.
Добавляем щелочь. Реакция не идет.
Добавляем кислоту — 
Опыт № 8 Характерные реакции на ион Fe3+
А) К раствору соли железа (III) добавляем несколько капель желтой кровяной соли. Получается синий осадок берлинской лазури.
Б) К раствору соли железа (III) добавляем несколько капель роданида аммония NH4CNS.
Вывод: Выпадает синий осадок.
Вывод: Образовывается красный раствор
Опыт № 12 Исследование прочности цианистых и роданистых комплексов
К раствору красной кровяной соли добавляем концентрированный раствор роданида аммония.
 реакция
не идет
реакция
не идет
Вывод: красной окраски Fe3+ не наблюдается.
Опыт № 13 Получение гидроксида кобальта (II) и изучение его свойств
К раствору соли кобальта (II) добавляем немного раствора едкого натра. Образуется плохо растворимая основная соль кобальта. Основная соль переходит в розовый гидроксид кобальта (II). Полученный осадок разделяем на три части: а) в первую пробирку добавляем кислоту; б) во вторую — избыток щелочи; в) в третьей пробирке наблюдаем постепенное побурение, осадка вследствие окисления Co(OH)2 в Co(OH)3 кислородом воздуха. Процесс побурения осадка на воздухе происходит достаточно долго (в течение 10 минут ). Отделим часть осадка Co(OH)2 и подействуем на него раствором перекиси водорода.

Вывод: осадок переходит в розовый гидроксид Со(II)
а) 
б)  Р.Н.И.
Р.Н.И.
в) 
г) 
Вывод: При добавлении перекиси водорода скорость перехода к Co(OH)3 увеличивается.
Опыт № 14 Получение аммиаката кобальта (II)
К раствору соли кобальта (II) добавляем сначала немного раствора аммиака, а затем избыток его.

Вывод: Наблюдается светло-синий коллоидный раствор.
Опыт № 18 Получение аммиаката никеля
К раствору соли никеля (II) добавим несколько капель раствора аммиака, а затем его избыток.

 светло-зеленый
раствор
светло-зеленый
раствор
Опыт № 19 Характерная реакция на ион
К полученному в опыте 18 раствору комплексной соли никеля добавим спиртовой раствор диметилглиоксима, образуется розово-красный осадок никельдиметилглиоксимата по следующему уравнению реакции:
 розово-красный
осадок.
розово-красный
осадок.
Вывод: реакция используется для колич. определения Ni2+ в растворе, полученном при растворении его сплавов.
Контрольные вопросы
Гидроксид Fe (III) получается потому, что Fe2(CO3)3 в дальнейшем гидролизуется.



H2O CO2
Происходит необратимый процесс.
8. 

г)

существовать совместно не могут.
д

 )
) 
могут существовать совместно, т.к. H2O2 не достаточно сильный окислитель для Ni(OH)2.
e) 
Существовать совместно не могут.
6
studfile.net


 (Цвет
не меняется. Реакция не идет)
(Цвет
не меняется. Реакция не идет)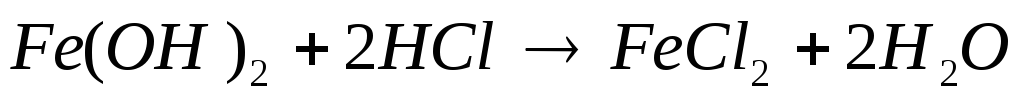 (Цвет
изменяется на грязно-зеленый)
(Цвет
изменяется на грязно-зеленый) ильтрование
(2) осадок на воздухе окисляется
(ржавеет)
ильтрование
(2) осадок на воздухе окисляется
(ржавеет)
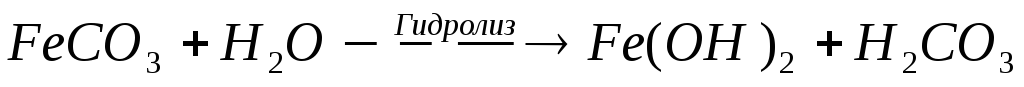










 (Цвет
не меняется. Реакция не идет)
(Цвет
не меняется. Реакция не идет) (Цвет
изменяется на грязно-зеленый)
(Цвет
изменяется на грязно-зеленый) ильтрование
(2) осадок на воздухе окисляется
(ржавеет)
ильтрование
(2) осадок на воздухе окисляется
(ржавеет)








