Физические свойства оксидов — урок. Химия, 8–9 класс.
Агрегатное состояние
Оксиды металлов, например, оксид меди(\(II\)) CuO, оксид железа(\(III\)) Fe2O3, оксид кальция CaO, являются твёрдыми кристаллическими веществами.
Некоторые оксиды неметаллов при обычных условиях также находятся в твёрдом агрегатном состоянии. Например, твёрдыми веществами являются оксид кремния SiO2, оксид фосфора(\(V\)) P2O5 и оксид серы(\(VI\)) SO3.
Жидким веществом является оксид водорода, то есть вода h3O.
Среди оксидов неметаллов при нормальных условиях некоторые являются газообразными веществами. Например, SO2, N2O, NO, NO2, CO и CO2.
Цвет оксидов может быть самым разнообразным.
Отметим, что бесцветным, например, является оксид кремния в виде кварца или горного хрусталя. Из жидких оксидов цвета не имеет вода. Большинство газообразных оксидов также не имеет окраски, но оксид азота(\(IV\)) NO2 — газообразное вещество бурого цвета.
Оксид железа(\(III\)) Fe2O3 — вещество красно-коричневого цвета:
Рис. \(1\). Оксид железа(\(III\))
Оксид меди(\(II\)) CuO чёрного цвета:
Рис. \(2\). Оксид меди(\(II\))
Оксид магния MgO белого цвета:
Рис. \(3\). Оксид магния
Оксид хрома(\(III\)) Cr2O3 тёмно-зелёного цвета:
Рис. \(4\). Оксид хрома(\(III\))
Риски, связанные с воздействием оксидов на организм
Самый ядовитый из оксидов — оксид углерода(\(II\)), или угарный газ CO. Его молекулы связываются гемоглобином крови намного прочнее, чем молекулы кислорода. Поэтому при наличии даже незначительной примеси этого вещества в воздухе человек может погибнуть от удушья.
Ядовитыми также являются диоксид серы SO2 и диоксид азота NO2.
Источники:
Рис. 1. Оксид железа(III) https://upload.wikimedia.org/wikipedia/commons/thumb/e/ee/Iron%28III%29-oxide-sample. jpg/1280px-Iron%28III%29-oxide-sample.jpg
jpg/1280px-Iron%28III%29-oxide-sample.jpg
Рис. 2. Оксид меди(II) https://upload.wikimedia.org/wikipedia/commons/f/fa/CopperIIoxide.jpg
Рис. 3. Оксид магния https://upload.wikimedia.org/wikipedia/commons/1/13/Magnesium_oxide.jpg
Рис. 4. Оксид хрома(III) https://upload.wikimedia.org/wikipedia/commons/0/03/Chromium%28III%29-oxide_pigment.jpg
Общие способы получения оксидов — урок. Химия, 8–9 класс.
1. Оксиды образуются при взаимодействии простых веществ с кислородом.
Например, при сгорании водорода в кислороде образуется оксид водорода (вода):
2h3+O2→2h3O.
При нагревании меди на воздухе она покрывается налётом чёрного цвета, состоящим из оксида меди(\(II\)):
2Cu+O2→2CuO.
2. Оксиды можно получить путём обжига или при сжигании некоторых бинарных соединений.
Например, оксид цинка и оксид серы(\(IV\)) получают обжигом сульфида цинка:
2ZnS+3O2→2ZnO+2SO2.
3. Оксиды образуются при термическом разложении некоторых солей, оснований и кислот.
Например, при обжиге известняка, состоящего из карбоната кальция, образуются оксид кальция и углекислый газ: CaCO3→CaO+CO2.
Оксид меди(\(II\)) образуется при нагревании гидроксида меди(\(II\)): Cu(OH)2→CuO+h3O.
Угольная кислота разлагается даже без нагревания, выделяя оксид углерода(\(IV\)), т. е. углекислый газ: h3CO3→h3O+CO2.
Применение оксидов
Оксиды используются в самых разных отраслях народного хозяйства: в промышленности, в строительстве, при получении других веществ, в медицине, в быту и т. д.
Оксиды используют в промышленности
В промышленности оксиды используются в качестве сырья.
Например, некоторые оксиды используются в качестве пигментов в производстве красок и эмалей. Именно на эти нужды в большом количестве расходуются оксид цинка ZnO, оксид титана(\(IV\)) TiO2 и оксид железа(\(III\)) Fe2O3.
При варке цветных стёкол в качестве пигментов используют оксид кобальта(\(III\)) Co2O3, оксид хрома(\(III\)) Cr2O3 и оксид марганца(\(IV\)) MnO2.
Из оксида серы(\(VI\)) SO3 производят серную кислоту h3SO4, а оксид кальция, или негашёная известь CaO, служит сырьём для получения гидроксида кальция, или гашёной извести Ca(OH)2.
Из оксида кремния SiO2 получают кремний, без которого в наши дни не может обойтись производство солнечных батарей и компьютеров.
Оксиды находят применение в пищевой промышленности и в сельском хозяйстве
В качестве консерванта, а также для дезинфекции теплиц и складских помещений, используют оксид серы(\(IV\)), или сернистый газ SO2. Этот же оксид используют для отбеливания сахара.
Углекислый газ CO2 используют для газирования напитков, а также в производстве сахара.
Оксиды используют для обеспечения безопасности
В качестве надёжного средства для борьбы с огнём используют оксид водорода, т.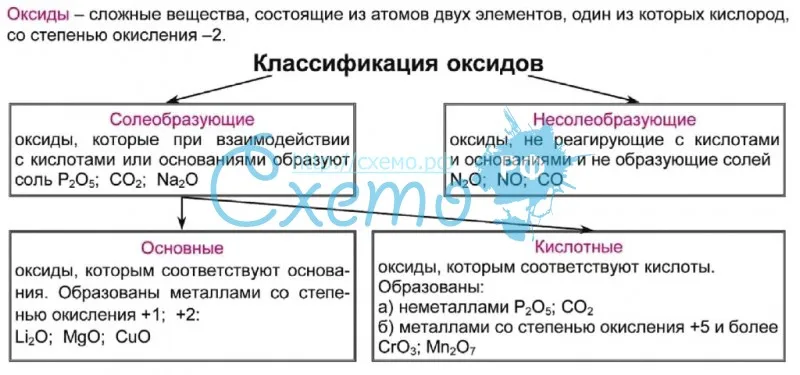 е. воду h3O, а также оксид кремния SiO2 в виде песка.
е. воду h3O, а также оксид кремния SiO2 в виде песка.
Углекислый газ CO2 не поддерживает горения, поэтому им заполняют огнетушители.
Химические свойства оксидов — урок. Химия, 8–9 класс.
1. Основные оксиды, образованные щелочными и щелочноземельными металлами, взаимодействуют с водой, образуя растворимое в воде основание — щёлочи.
Основный оксид + вода → основание.
Например, при взаимодействии оксида кальция с водой образуется гидроксид кальция:
CaO+h3O→Ca(OH)2.
2. Основные оксиды взаимодействуют с кислотами, образуя соль и воду.
Основный оксид + кислота → соль + вода.
Например, при взаимодействии оксида меди с серной кислотой образуются сульфат меди и вода:CuO+h3SO4→CuSO4+h3O.
3. Основные оксиды могут взаимодействовать с оксидами, принадлежащими к другим классам, образуя соли.
Основный оксид + кислотный оксид → соль.
Например, при взаимодействии оксида магния с углекислым газом образуется карбонат магния:
MgO+CO2→MgCO3.
Химические свойства кислотных оксидов
1. Кислотные оксиды могут взаимодействовать с водой, образуя кислоты.
Кислотный оксид + вода → кислота.
Например, при взаимодействии оксида серы(\(VI\)) с водой образуется серная кислота:
SO3+h3O→h3SO4.
Обрати внимание!
Оксид кремния SiO2 с водой не реагирует.
2. Кислотные оксиды взаимодействуют со щелочами, образуя соль и воду.
Кислотный оксид + основание → соль + вода.
Например, при взаимодействии оксида серы(\(IV\)) с гидроксидом натрия образуются сульфит натрия и вода:
SO2+2NaOH→Na2SO3+h3O.
3. Кислотные оксиды могут реагировать с основными оксидами, образуя соли.
Кислотный оксид + основный оксид → соль.
Например, при взаимодействии оксида углерода(\(IV\)) с оксидом кальция образуется карбонат кальция:CO2+CaO→CaCO3.
Химические свойства амфотерных оксидов
1. Амфотерные оксиды при взаимодействии с кислотой или кислотным оксидом проявляют свойства, характерные для основных оксидов. Так же, как основные оксиды, они взаимодействуют с кислотами, образуя соль и воду.
Например, при взаимодействии оксида цинка с соляной кислотой образуется хлорид цинка и вода:
ZnO+2HCl→ZnCl2+h3O.
2. Амфотерные оксиды при взаимодействии со щёлочью или с оксидом щелочного или щелочноземельного металла проявляют кислотные свойства. При сплавлении их со щелочами протекает химическая реакция, в результате которой образуются соль и вода.
Например, при сплавлении оксида цинка с гидроксидом калия образуется цинкат калия и вода:
ZnO+2KOH→K2ZnO2+h3O.
Если же с гидроксидом калия сплавить оксид алюминия, кроме воды образуется алюминат калия: Al2O3+2KOH→2KAlO2+h3O.
Оксиды. Классификация оксидов.
 Названия оксидов
Названия оксидовОксиды — это сложные неорганические соединения, состоящие из двух элементов, один из которых кислород (в степени окисления -2).
Например, Na2O, B2O3, Cl2O7 относятся к оксидам. Все перечисленные вещества содержат кислород и еще один элемент. Вещества Na2O2, H2SO4, HCl не относятся к оксидам: в первом степень окисления кислорода равна -1, в составе второго не два, а три элемента, а третье вообще не содержит кислорода.
Если вы не понимаете смысл термина «степень окисления», ничего страшного. Во-первых, можно обратиться к соответствующей статье на этом сайте. Во-вторых, даже без понимания этого термина можно продолжать чтение. Временно можете забыть про упоминание о степени окисления.
Получены оксиды практически всех известных на сегодняшний день элементов, кроме некоторых благородных газов и «экзотических» трансурановых элементов.
Номенклатура оксидов
Мы должны научиться называть оксиды. Это очень просто.Пример 1. Назовите следующие соединения: Li2O, Al2O3, N2O5, N2O3.
Li2O — оксид лития,
Al2O3 — оксид алюминия,
N2O5 — оксид азота (V),
N2O3 — оксид азота (III).
Обратите внимание на важный момент: если валентность элемента постоянна, мы НЕ упоминаем ее в названии оксида. Если валентность меняется, следует обязательно указать ее в скобках! Литий и алюминий имеют постоянную валентность, у азота валентность переменная; именно по этой причине названия окислов азота дополнены римскими цифрами, символизирующими валентность.
Задание 1. Назовите оксиды: Na2O, P2O3, BaO, V2O5, Fe2O3, GeO2, Rb2O. Не забывайте, что существуют элементы как с постоянной, так и с переменной валентностью.
Не забывайте, что существуют элементы как с постоянной, так и с переменной валентностью.
Еще один важный момент: вещество F2O правильнее называть не «оксид фтора», а «фторид кислорода»!
Физические свойства оксидов
Физические свойства весьма разнообразны. Обусловлено это, в частности, тем, что в оксидах могут проявляться разные типы химической связи. Температуры плавления и кипения варьируются в широких пределах. При нормальных условиях оксиды могут находиться в твердом состоянии (CaO, Fe2O3, SiO2, B2O3), жидком состоянии (N2O3
Разнообразна окраска: MgO и Na2O белого цвета, CuO — черного, N2O3 — синего, CrO3 — красного и т. д.
Расплавы оксидов с ионным типом связи хорошо проводят электрический ток, ковалентные оксиды, как правило, имеют низкую электропроводность.
Классификация оксидов
Все существующие в природе оксиды можно разделить на 4 класса: основные, кислотные, амфотерные и несолеобразующие. Иногда первые три класса объединяют в группу солеобразующих оксидов, но для нас это сейчас несущественно. Химические свойства оксидов из разных классов отличаются весьма сильно, поэтому вопрос классификации очень важен для дальнейшего изучения этой темы!
Начнем с несолеобразующих оксидов. Их нужно запомнить: NO, SiO, CO, N2
O. Просто выучите эти четыре формулы!Для дальнейшего продвижения мы должны вспомнить, что в природе существуют два типа простых веществ — металлы и неметаллы (иногда выделяют еще группу полуметаллов или металлоидов). Если вы четко понимаете, какие элементы относятся к металлам, продолжайте читать эту статью. Если есть малейшие сомнения, обратитесь к материалу «Металлы и неметаллы» на этом сайте.
Итак, сообщаю вам, что все амфотерные оксиды являются оксидами металлов, но не все оксиды металлов относятся к амфотерным. Я перечислю наиболее важные из них: BeO, ZnO, Al2O3, Cr2O3, SnO. Список не является полным, но перечисленные формулы следует обязательно запомнить! В большинстве амфотерных оксидов металл проявляет степень окисления +2 или +3 (но есть исключения).
Я перечислю наиболее важные из них: BeO, ZnO, Al2O3, Cr2O3, SnO. Список не является полным, но перечисленные формулы следует обязательно запомнить! В большинстве амфотерных оксидов металл проявляет степень окисления +2 или +3 (но есть исключения).
В следующей части статьи мы продолжим говорить о классификации; обсудим кислотные и основные оксиды.
Продолжение статьи →
Оксиды,классификация,свойства,применение.
Тема урока. Оксиды, их классификация , свойства и применение.
Цель: Формирование целостного представления об оксидах, как классе неорганических соединений.
Задачи. Образовательная: — обеспечить усвоение понятий « оксиды», « классификация оксидов», «свойства оксидов»; познакомить со значением оксидов в природе и жизни человека.
Развивающая: — продолжить формирование умений определять степень окисления элемента по формуле, составлять формулы сложных веществ по степени окисления, составлять уравнения химических реакций; развитие умений самостоятельно приобретать знания.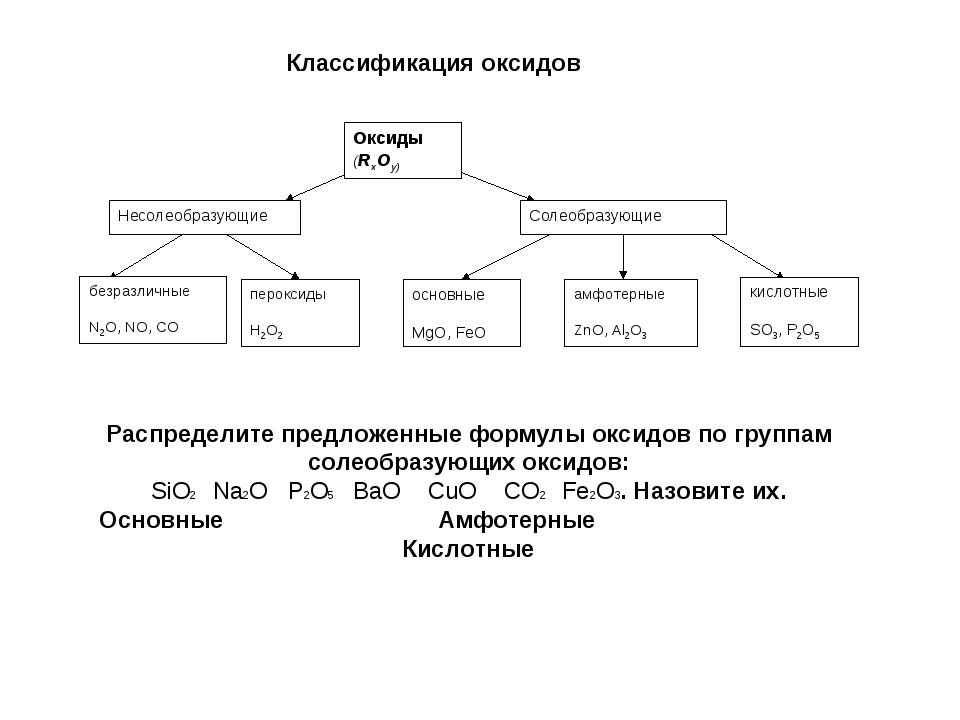
Воспитательная: — воспитание интереса к предмету, к процессу познания, заинтересованность процессами, происходящими вокруг в окружающем мире.
Оборудование: коллекция оксидов, компьютер, проектор, газированная вода.
Ход урока.
1. Организация класса
Добрый день! Я рада видеть вас на сегодняшнем уроке. Надеюсь, что наша совместная работа будет полезной и интересной. Давайте улыбнемся друг другу, настроимся на поиск и начнем урок. Тема нашего урока « Оксиды, их классификация и свойства». Итак, что это за соединения — оксиды. Что мы знаем об оксидах? А что ещё надо знать об оксидах? (классификацию, свойства, применение).
Приведите примеры оксидов и назовите их. Перед вами перечень веществ, выберите оксиды, согласно определению и общей формуле, запишите их .
Перечень веществ: h3S, CaO, HCl, CO2, h3O, Nh4, CuO, h3SO4, NaOH, Fe2O3, P2O5, SiO2, Na2CO3 . По каким признакам вы выписали оксиды?
2.Новый материал.
Учитель. Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные) и несолеобразующие или безразличные.
Что значит несолеобразующие оксиды? (даёт определение, приводит примеры, учащиеся записывают в тетрадь).
Знакомство с некоторыми оксидами.
1ученик: А вы знаете, что…Окись углерода называют угарным газом. Он не имеет ни цвета ни вкуса ни запаха…..Определить наличие СО в воздухе можно с помощью бумажки , смоченной раствором хлорида палладия. Если содержание СО в воздухе превысит допустимое ,бумажка чернеет. И еще интересный факт. Канарейка падает в обморок от присутствия в воздухе СО.Шахтеры брали в шахту клетки с канарейкой для обнаружения СО. Оксид углерода (II)применяется для обработки мяса животных и рыбы, придает им ярко красный цвет и вид свежести, не изменяя вкусовых качеств. Является хорошим восстановителем в металлургическом производстве.
2 ученик. Один из распространенных оксидов – диоксид углерода CO2. Он содержится в составе вулканических газов. Сухой лед – тоже CO2. Горящий бензин можно быстро потушить, бросив в пламя несколько кусочков сухого льда. Главное применение сухого льда — хранение и перевозка продуктов: рыбы, мяса, мороженого.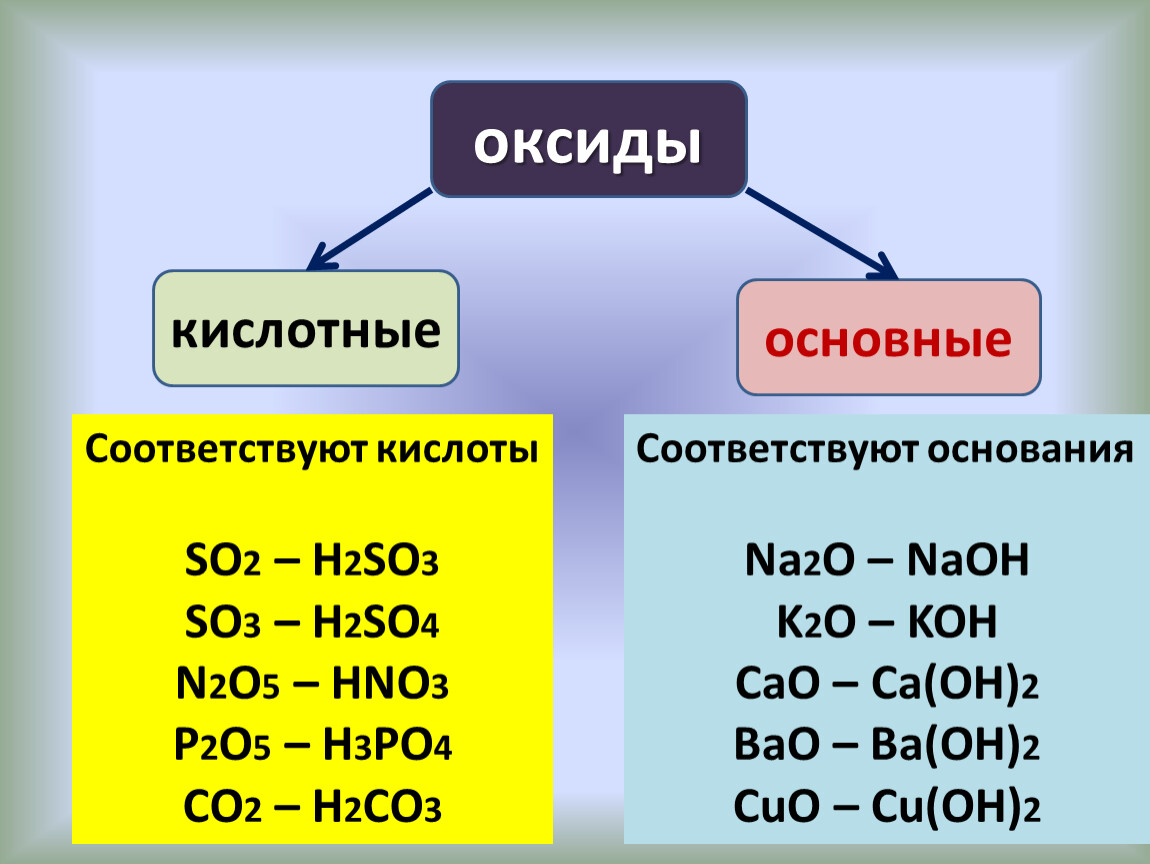 Ценность сухого льда заключается не только в его охлаждающем действии, но и в том, что продукты в углекислом газе не плесневеют, не гниют. Газ, необходимый растениям для фотосинтеза. Растения благодаря фотосинтезу усваивают углекислый газ из атмосферы, превращая минеральные вещества в органические —глюкозу, крахмал.
Ценность сухого льда заключается не только в его охлаждающем действии, но и в том, что продукты в углекислом газе не плесневеют, не гниют. Газ, необходимый растениям для фотосинтеза. Растения благодаря фотосинтезу усваивают углекислый газ из атмосферы, превращая минеральные вещества в органические —глюкозу, крахмал.
3 ученик. Оксид кремния (IV) SiO2 .Кварц, кремень, горный хрусталь, аметист, яшма, опал — все это оксид кремния (IV). Диоксид кремния применяют в производстве стекла, керамики, бетонных изделий, для получения кремния, как наполнитель в производстве резин, в хроматографии и др. В народной медицине и ветеринарии часто обычная роса При анализе ее химического состава было найдено большое количество кремнезема в ней. Именно поэтому так полезно ходить босиком по росе: и закаливаешься и излечиваешь болезни кожи и суставы ног.
Какие оксиды называют солеобразующими? (даёт определение, приводит примеры ,учащиеся повторяют).
Физические свойства оксидов.
Выберите основные оксиды, находящиеся на столах. Обратите внимание на их агрегатное состояние.
Обратите внимание на их агрегатное состояние.
А как вы думаете ,оксиды неметаллов в большинстве своем находятся в каком агрегатном состоянии?
Открываем бутылку газированной воды. Что наблюдаем?
Сделайте выводы о физических свойствах оксидов.
Оксиды металлов МехОу | Оксиды неметаллов неМехОу | |||
Основные | Кислотные | Кислотные | Безразличные | |
I, II Ме | V-VII Me | II неМе | I, II неМе CO, NO, N2O | |
Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксиды металлов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO — оксид цинка и BeO – оксид бериллия.
К основным оксидам относятся оксиды металлов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO — оксид цинка и BeO – оксид бериллия.
Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например, CrO3-оксид хрома (VI), Mn 2O7 — оксид марганца (VII).
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ 1. Основной оксид + Кислотный оксид = Соль (р. соединения) CaO + SO2 = CaSO3 2. Основной оксид + Кислота = Соль + Н2О (р. обмена) 3K2O + 2h4PO4 = 2K3PO4 + 3h3O 3. Основной оксид + Вода = Щёлочь (р. соединения) Na2O + h3O = 2NaOH |
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ 1. СO2 + h3O = h3CO3, SiO2 – не реагирует 2. Кислотный оксид + Основание = Соль + Н2О (р. обмена) P2O5 + 6KOH = 2K3PO4 + 3h3O 3. Основной оксид + Кислотный оксид = Соль (р. соединения) CaO + SO2 = CaSO3 4. Менее летучие вытесняют более летучие из их солей CaCO3 + SiO2 = CaSiO3 +CO2 |
3.Закрепление изученного материала.
Что мы узнали об оксидах? Отвечают на ряд вопросов.
1. Определите лишнее вещество. Ответ мотивируйте.
СаО, СН4, N2О, SiО2, О2, Н2О, КОН, РbО, СО2, Al2О3, ZnО, СО.
2. Найди соответствие. С какими из перечисленных веществ, формулы которых приведены ниже, будет вступать в реакцию оксид серы (VI): НСl, NaOH, h3O, Ca(OH)2, KCl ? Составьте уравнения возможных реакций.
Вот и подошёл к концу наш урок. Посмотрите ваши записи в тетради и поделитесь своими впечатлениями о том, что вы узнали на уроке.
Домашнее задание: пар. 40 ,упр .1 стр .252.
отношение к воде, кислотам и щелочам. на Сёзнайке.ру
ПЛАН ОТВЕТА:
- Определение
- Классификация
- несолеобразующие
- солеобразующие
- основные
- кислотные
- амфотерные
- Химические свойства
- взаимодействие с водой
- взаимодействие с кислотами
- взаимодействие со щелочами
Оксиды – это сложные вещества, молекулы которых состоят из двух элементов, один из которых кислород, причём атомы кислорода не связаны друг с другом.
Все оксиды разделяют на две группы: солеобразующие и несолеобразующие.
Несолеобразующие оксиды не образуют солей в химических реакциях. К ним относятся: оксид азота(I), оксид азота(II), оксид кремния(IV).
Солеобразующие оксиды могут взаимодействовать с кислотами или щелочами с образованием солей
. В зависимости от состава, а следовательно, и свойств они подразделяются на основные, кислотные и амфотерные.
В зависимости от состава, а следовательно, и свойств они подразделяются на основные, кислотные и амфотерные.Основные оксиды – это оксиды, которые при взаимодействии с кислотами образуют соль и воду. Они образованы элементами-металлами с валентностью 1 и 2. в качестве гидроксидов им соответствуют основания. К основным оксидам относятся оксид натрия, оксид кальция, оксид меди(), оксид железа().
Кислотные оксиды реагируют со щелочами с образованием соли и воды. Они образованы элементами-неметаллами, например, оксид серы(IV),оксид серы(VI), оксид фосфора(V) и переходными элементами, проявляющими валентность V, VI, VII, например, оксид хрома(VI), оксид марганца(VII). В качестве гидроксида
Амфотерными оксидами называют оксиды, которые реагируют и с кислотами и со щелочами с образованием соли и воды. Они образованы переходными элементами. Например, оксид алюминия, оксид цинка.
Они образованы переходными элементами. Например, оксид алюминия, оксид цинка.
Химические свойства:
Оксиды взаимодействуют с водой, если соответствующий им гидроксид растворим в воде.
При взаимодействии основного оксида с водой образуется щёлочь, например, при взаимодействии оксида натрия с водой образуется гидроксид натрия (щёлочь), а оксид меди(II) с водой не реагирует, т.к. ему соответствует нерастворимое основание.
При взаимодействии кислотного оксида с водой образуется кислота, например, при взаимодействии оксида серы(VI) с водой образуется серная кислота, а оксид кремния(IV) с водой не реагирует, т.к. кремниевая кислота нерастворима в воде.
Амфотерные оксиды с водой не реагируют, т.к. им соответствуют нерастворимые гидроксиды.
Основные оксиды взаимодействуют с растворимыми кислотами с образованием соли и воды, например, при взаимодействии оксида меди(II) с соляной кислотой образуются хлорид меди(II) и вода.
Все кислотные оксиды взаимодействуют со щелочами с образованием соли и воды, причём образуется соль той кислоты, которая соответствует данному оксиду. Например, при взаимодействии оксида углерода(IV) с гидроксидом кальция образуются карбонат кальция и вода.
Амфотерные оксиды могут реагировать и с кислотами и со щелочами. Например, оксид цинка при взаимодействии с соляной кислотой образует хлорид цинка и воду, а при взаимодействии с гидроксидом натрия – цинкат натрия и воду.
Na2
CuO + H2O ?
SO3 + H2O = H2SO4
SiO2 + H2O ?
CuO + 2HCl = CuCl2 + H2O
CO2 + Ca(OH)2 = CaCO3 + H2O
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH = Na2ZnO2 + H2O
Дополнительно знать:
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
BaO + H2O = Ba(OH)2
CO2 + H2O = H2CO3
SO2 + H2O = H2SO3
P2O5 + 3H2O = 2H3РО4
3NO2 + H2O = 2HNO3 + NO
Оксиды.
 Классификация. Получение. Свойства — презентация онлайн
Классификация. Получение. Свойства — презентация онлайн1. ОКСИДЫ. КЛАССИФИКАЦИЯ. ПОЛУЧЕНИЕ. СВОЙСТВА.
Презентация к урокуВыполнила Войтенкова Н.К.
учитель химии
МБОУ Александровская СОШ
2. Классификация оксидов.
Оксиды — это сложные вещества,состоящие из двух химических
элементов, один из которых кислород,
со степенью окисления -2.
3. Получение оксидов.
Окислениекислородом
простых веществ
2Mg +O2=2MgO
сложных веществ
2h3S+3O2=2h3O+2S
O2
Разложение
нагреванием солей
нагреванием
оснований
СaCO3=CaO+CO2
Cu (OH)2=CuO+h30
нагреванием
h3SO3=h3O+SO2
кислородсодержащих
кислот
нагреванием высших 4CrO3=Cr2O3+3O2
оксидов
Окисление низших
оксидов
4FeO+O2=2Fe2O3
Вытеснение
летучего оксида
менее летучим
Na2CO3+SiO2=Na2SiO3+CO2
4. Химические свойства оксидов.
ОсновныеКислотные
1.Взаимодействие с водой(оксиды
щелочных и щелочноземельных
металлов.
 )
)CaO+h3O=Ca(OH)2
водой
SO3+h3O=h3SO4
2.Все-с кислотами
AI2O3+6HCl=2AlCl3+3h3O
2.Со щелочами
NaOH+SiO2=Na2SiO3+h3O
3.С кислотными оксидами
CaO+CO2=CaCO3
3.С основными оксидами
SiO2+CaO=CaSiO3
4.С амфотерными оксидами
Li2O+Al2O3=2LiAlO2
4.С амфотерными оксидами
Al2O3+3SO3=Al2(SO4)3
5. Применение оксидов
Са(ОН)2 – гашеная известь- основнойстроительный продукт
оксид цинка ZnO – вещество белого цвета,
поэтому используется для приготовления
белой масляной краски (цинковые белила).
оксид титана (IV) – TiO2. Он тоже имеет
красивый белый цвет и применяется
для изготовления титановых белил.
«Зелёная хромовая»
Cr2O3 – пигмент оливково –
зелёной краски.
6. Углекислый газ (CO2) →
Песок (Оксид кремния (IV)SiO2)Fe2O3, SiO2, Al2O3
(смесь) красная охра.
7. Оксид алюминия
Al2O3Оксид алюминия
Боксит (глина), рубин, сапфир, корунд
Cr2О3 как пигмент
используют для
типографской краски
Источник: электронный учебник
по химии
Классификация оксидов.
 Введение, классификация, примеры и реакции
Введение, классификация, примеры и реакцииВы должны хорошо знать соединение, которым является двуокись углерода. Как и в процессе дыхания, мы выдыхаем углекислый газ. Кроме того, он используется и в процессе фотосинтеза. Как следует из названия, углекислый газ является разновидностью оксида. Кислород может реагировать с металлами и неметаллами с образованием соединений, содержащих кислород и другой элемент металла или неметалла. Оксиды можно разделить на четыре типа.
Многие элементы естественным образом окисляются на воздухе или в воде. По этой причине многие оксиды встречаются в природе в виде минералов. Большая часть земной коры состоит из твердых оксидов. Как мы знаем, кислород является сильно электроотрицательным элементом, поэтому он образует связи почти со всеми элементами и, таким образом, образует устойчивые соответствующие оксиды. Хотя эта чрезмерная склонность кислорода к образованию оксидов иногда также вредна. Так как он разъедает металлы и делает изделия из металлов непрочными. В этой статье мы обсудим все четыре типа оксидов с примерами и примерами их использования, однако перед этим мы кратко объясним, что такое оксиды.
В этой статье мы обсудим все четыре типа оксидов с примерами и примерами их использования, однако перед этим мы кратко объясним, что такое оксиды.
Что такое оксиды?
Оксид — это химическое соединение, содержащее по крайней мере один атом кислорода и еще один элемент. Дианион кислорода также называют оксидом, который представлен O-2. Все соединения оксидов содержат по крайней мере один дианион кислорода. Оксиды обычно представляют собой бинарные соединения, состоящие из кислорода и другого элемента.
Примеры оксидов – Al2O3 – оксид алюминия, CO2 – диоксид углерода, SO2 – диоксид серы, CaO – оксид кальция, MgO – оксид магния, Na2O – оксид натрия и т. д.
0 Классификация оксидовОксиды можно разделить на следующие типы на основе валентности другого элемента в оксидах —
Простые оксиды
смешанные оксиды
Простые оксиды — простые оксиды из одного металла или полуметалла и кислорода. Эти оксиды несут только то количество атомов кислорода, которое допускается нормальной валентностью элемента или металла.
Эти оксиды несут только то количество атомов кислорода, которое допускается нормальной валентностью элемента или металла.
Примеры простых оксидов – h3O, MgO, CaO, SiO2 и т. д.
Смешанные оксиды – Смешанные оксиды образуются при соединении простых оксидов. Эти два простых оксида могут быть одного и того же металла (элемента) или разных.
Примеры смешанных оксидов – сурик (Pb3O) представляет собой смешанный оксид двуокиси свинца (PbO2) и монооксида свинца (PbO). Другим примером является оксид железа-железа (Fe3O4), который представляет собой смешанный оксид двух простых оксидов – оксида железа (Fe2O3) и оксида железа (FeO).
Оксиды можно разделить на следующие типы на основе металлического характера другого элемента в оксидах —
металлические оксиды
Базовый оксид
Оксид амфотера
Неметаллический оксид
Кислотный оксид
Нейтральный оксид
Оксиды металлов. Оксиды металлов состоят из металла и кислорода.Обычно они встречаются в природе в виде полезных ископаемых. Они образуются при окислении металлов.
Оксиды металлов состоят из металла и кислорода.Обычно они встречаются в природе в виде полезных ископаемых. Они образуются при окислении металлов.
Примеры металлического оксида — CaO, MgO, Fe3O4, Bao, ZnO и др.
Они могут быть классифицированы в следующие два типа —
Базовый оксид
Оксид амфотера
Базовый оксид — Если оксид реагирует с водой и образует основание, его называют основным оксидом. Таким образом, основной оксид, реагируя с водой, дает основание. Это означает, что если мы приготовим раствор основного оксида и воды и окунем в него красную лакмусовую бумажку, то она станет синей.
Примеры основных оксидов – MgO, CaO, BaO и т. д.
Сжигание магниевой ленты. Когда мы сжигаем магниевую ленту, она вступает в реакцию с атмосферным кислородом и образует соединение серого цвета, которое представляет собой оксид магния. Теперь, когда мы растворяем это серое соединение в воде и опускаем в него красную лакмусовую бумажку, тогда она превращает красную лакмусовую бумагу в синюю, так как при реакции с водой образует гидроксид магния. Участвующие реакции приведены ниже:
Теперь, когда мы растворяем это серое соединение в воде и опускаем в него красную лакмусовую бумажку, тогда она превращает красную лакмусовую бумагу в синюю, так как при реакции с водой образует гидроксид магния. Участвующие реакции приведены ниже:
Амфотерный оксид – Амфотерный оксид представляет собой оксид металла, проявляющий двойное поведение.Он ведет себя как кислотный оксид и основной оксид. Он также реагирует как с основаниями, так и с кислотами.
Примеры амфотерных оксидов – оксид цинка (ZnO)
Когда оксид цинка реагирует с конц. Гидроксид натрия действует как кислотный оксид, а когда он реагирует с HCl, он действует как основной оксид. Реакции приведены ниже –
\[ZnO + 2H_{2}O + 2NaOH \rightarrow Na_{3}ZnOH_{4} + H_{2}\]
Кислый оксид цинка
\[ZnO + 2Hcl \rightarrow Zncl_{2} + H_{2}O\]
Основной оксид цинка
Другим примером амфотерного оксида является Al2O3 – оксид алюминия. Когда он реагирует с серной кислотой, он действует как основание, а когда он реагирует с гидроксидом натрия, он действует как кислота. Реакции приведены ниже –
Когда он реагирует с серной кислотой, он действует как основание, а когда он реагирует с гидроксидом натрия, он действует как кислота. Реакции приведены ниже –
\[Al_{2} + 3H_{2}SO_{4} \rightarrow Al_{2}(SO_{4})_{3} + 3H_{2}O\]
Basic
\ [al_ {2} + 2naoh \ prightarrow 2naalo_ {2} + h_ {2} o \]
Кислый алюминат натрия
Другие примеры амфотерных оксидов представляют собой Беа, Sno и т. Д.
Неметаллический оксид – неметаллический оксид образуется из неметалла и кислорода.Обычно они встречаются в природе в виде газов, таких как углекислый газ. Они образуются при окислении неметаллов.
Примеры металлического оксида — CO2, SO2, P2O5, CO2, SO2, P2O5, COS и т. Д.
Они могут быть классифицированы в следующие два типа —
кислотный оксид
нейтральный оксид
кислотные оксиды — Если оксид реагирует с водой и образует кислоту, его называют кислым оксидом. Таким образом, кислотный оксид, реагируя с водой, дает основание.Это означает, что если мы приготовим раствор кислого оксида и воды и окунем в него синюю лакмусовую бумажку, то она станет красной. В основном кислотные оксиды представляют собой оксиды неметаллов, но некоторые оксиды металлов с высокими степенями окисления также обладают кислотным характером. Таким образом, некоторые оксиды металлов, такие как CrO3, Mn2O7 и т. д., также являются кислотными.
Таким образом, кислотный оксид, реагируя с водой, дает основание.Это означает, что если мы приготовим раствор кислого оксида и воды и окунем в него синюю лакмусовую бумажку, то она станет красной. В основном кислотные оксиды представляют собой оксиды неметаллов, но некоторые оксиды металлов с высокими степенями окисления также обладают кислотным характером. Таким образом, некоторые оксиды металлов, такие как CrO3, Mn2O7 и т. д., также являются кислотными.
Примеры кислых оксидов – SO2, CO2, SO3 и т. д.
Когда триоксид серы реагирует с водой, он образует серную кислоту. Реакция приведена ниже –
\[SO_{3} + H_{2}O \rightarrow H_{2}SO_{4}\]
Нейтральный оксид – Нейтральные оксиды – это те оксиды, которые не обладают ни кислотными свойствами, ни основные свойства.Они не образуют соли при взаимодействии с кислотой или основанием.
Примеры нейтральных оксидов – N2O, NO, CO и т. д.
д.
Это все о классификации оксидов, если вы ищете решения проблем NCERT на основе оксидов, войдите на веб-сайт Vedantu или скачать приложение для обучения Веданту. Таким образом, вы сможете получить доступ к бесплатным PDF-файлам с решениями NCERT, а также к примечаниям к изменениям, пробным тестам и многому другому.
Значение оксидов его классификация, а также примеры и реакции
Химическое соединение, содержащее как минимум один атом кислорода и еще один элемент, называется оксидом.В состоянии окисления оксиды металлов содержат ион кислорода. Твердые оксиды можно найти в большей части земной коры из-за окисления элементов кислородом, присутствующим в воздухе, или кислородом, присутствующим в воде. Материалы, которые обычно считаются чистыми элементами, чаще всего образуют оксидное покрытие.
Из этого короткого обсуждения вы, возможно, поняли, что понимание оксидов и их типов имеет первостепенное значение для учащихся. и поэтому Веданту дал изучающим химию полное объяснение оксидов вместе с их классификацией и типами.
и поэтому Веданту дал изучающим химию полное объяснение оксидов вместе с их классификацией и типами.
Классификация оксидов
Оксиды обычно можно классифицировать на основе их валентности, то есть их способности связываться с другим элементом. Основываясь на этой валентности, оксиды классифицируются между простыми оксидами и смешанными оксидами.
Простые оксиды: Оксиды образованы комбинацией одного металла и кислорода или кислорода полуметалла. Атомы, которые разрешены нормальной валентностью элемента или металла, содержатся в простых оксидах.
Смешанные оксиды: Когда простые оксиды объединяются, получаются смешанные оксиды.Эта комбинация простых оксидов может быть из одного и того же металла или другого металла.
Кроме того, если вы хотите узнать об оксидах азота, вам может быть полезно это: Различные оксиды азота с формулой и примерами решения (vedantu. com)
com)
%PDF-1.3
%
31 0 объект
>
эндообъект
внешняя ссылка
31 135
0000000016 00000 н
0000003049 00000 н
0000003638 00000 н
0000003847 00000 н
0000005450 00000 н
0000005967 00000 н
0000006509 00000 н
0000006731 00000 н
0000006957 00000 н
0000006996 00000 н
0000007018 00000 н
0000008879 00000 н
0000008901 00000 н
0000010435 00000 н
0000010457 00000 н
0000012011 00000 н
0000012033 00000 н
0000013538 00000 н
0000013560 00000 н
0000015142 00000 н
0000015164 00000 н
0000016742 00000 н
0000016764 00000 н
0000018307 00000 н
0000018329 00000 н
0000021254 00000 н
0000044983 00000 н
0000045061 00000 н
0000065069 00000 н
0000067746 00000 н
0000068110 00000 н
0000068365 00000 н
0000068669 00000 н
0000068902 00000 н
0000069251 00000 н
0000069507 00000 н
0000069806 00000 н
0000070043 00000 н
0000070400 00000 н
0000070652 00000 н
0000070950 00000 н
0000071187 00000 н
0000071552 00000 н
0000071812 00000 н
0000072126 00000 н
0000072366 00000 н
0000072730 00000 н
0000073060 00000 н
0000073336 00000 н
0000073690 00000 н
0000073950 00000 н
0000074203 00000 н
0000074517 00000 н
0000074754 00000 н
0000075111 00000 н
0000075363 00000 н
0000075678 00000 н
0000075916 00000 н
0000076280 00000 н
0000076538 00000 н
0000076852 00000 н
0000077093 00000 н
0000077453 00000 н
0000077705 00000 н
0000078025 00000 н
0000078269 00000 н
0000078617 00000 н
0000078869 00000 н
0000079182 00000 н
0000079421 00000 н
0000079778 00000 н
0000080031 00000 н
0000080348 00000 н
0000080588 00000 н
0000080948 00000 н
0000081200 00000 н
0000081520 00000 н
0000081759 00000 н
0000082122 00000 н
0000082378 00000 н
0000082699 00000 н
0000082943 00000 н
0000083297 00000 н
0000083553 00000 н
0000083868 00000 н
0000084111 00000 н
0000084472 00000 н
0000084726 00000 н
0000085039 00000 н
0000085280 00000 н
0000085643 00000 н
0000085899 00000 н
0000086221 00000 н
0000086466 00000 н
0000086827 00000 н
0000087084 00000 н
0000087405 00000 н
0000087649 00000 н
0000087998 00000 н
0000088249 00000 н
0000088565 00000 н
0000088807 00000 н
0000089165 00000 н
0000089424 00000 н
0000089738 00000 н
0000089981 00000 н
00000 00000 н
00000 00000 н
00000 00000 н
00000 00000 н
00000
00000 н
00000
Оксид металла — обзор
6.
 1 Введение
1 Введение До недавнего времени классические методы, такие как сенсорная оценка человека, 1 газовая хроматография, 2 и масс-спектрометрия 3 , были единственными доступными методами для оценки запахов предметов, продуктов и окружающей среды. Хотя методы надежны и точны, практическое использование этих инструментов требует много времени, сложно и дорого. Появление датчиков химических газов и электронного носа (e-nose) в 1990-х годах 4,5 открыло новые возможности для применения во многих невиданных ранее областях, особенно для оперативных, полевых и быстрых измерений.С тех пор датчики химических газов и электронный нос были приняты в качестве стандартных инструментов, которыми можно дополнить или даже заменить традиционные аналитические инструменты во многих областях, начиная от контроля качества пищевых продуктов 6,7 и напитков, 8,9 защита окружающей среды 10 общественной безопасности. 11 В целом датчики химических газов можно разделить на четыре типа 12 на основе их принципов преобразования: оптические, тепловые, электрохимические и гравиметрические. Среди этих методов электрохимическая трансдукция до сих пор доминировала в применении сенсоров химических газов в измерительных системах, потому что настройка интерфейса более проста, чем другие методы трансдукции. 13–16
Среди этих методов электрохимическая трансдукция до сих пор доминировала в применении сенсоров химических газов в измерительных системах, потому что настройка интерфейса более проста, чем другие методы трансдукции. 13–16
В настоящее время эта технология используется в большинстве коммерческих датчиков химических газов, а полупроводники на основе оксидов металлов (МОХ) предлагают наиболее предпочтительную архитектуру датчиков благодаря их низкой стоимости, высокой чувствительности и простоте в работе. 17 В одном устройстве можно легко объединить несколько функциональных элементов, таких как чувствительный слой, преобразователь сигналов и управляющая электроника.Несмотря на простые принципы работы газовых сенсоров МОКС, механизм обнаружения газа на микроскопическом уровне очень сложен и до сих пор недостаточно изучен. 18,19 Датчики газа, изготовленные из одних и тех же МОКС-материалов, могут иметь разные свойства в зависимости от технологии изготовления и условий подготовки. Существует твердое мнение, что каталитическое восстановление/окисление на микроскопической поверхности лежит в основе хеморезистентных свойств МОХ. 20 Эти реакции регулируются электронной структурой, химическим составом, кристаллической структурой и относительной ориентацией поверхности оксида по отношению к молекулам аналита, что позволяет настраивать их газочувствительные свойства путем изменения таких параметров.Наиболее успешный подход к оптимизации газочувствительных свойств МОКСов заключается в изменении микроскопической структуры путем уменьшения размера зерна и модификации различных параметров кристаллитов. 21
Существует твердое мнение, что каталитическое восстановление/окисление на микроскопической поверхности лежит в основе хеморезистентных свойств МОХ. 20 Эти реакции регулируются электронной структурой, химическим составом, кристаллической структурой и относительной ориентацией поверхности оксида по отношению к молекулам аналита, что позволяет настраивать их газочувствительные свойства путем изменения таких параметров.Наиболее успешный подход к оптимизации газочувствительных свойств МОКСов заключается в изменении микроскопической структуры путем уменьшения размера зерна и модификации различных параметров кристаллитов. 21
Среди МОХ-материалов оксиды олова наиболее часто используются в твердотельных газовых сенсорах. Чувствительность и селективность этих материалов можно настроить на основе структурной инженерии. Оксиды олова имеют богатый набор структурных параметров, которые можно модифицировать. Например, нанокристаллы оксида олова, полученные в результате эксперимента по пиролизу распылением, могут иметь множество кристаллографических плоскостей, таких как (110), (111), (200), (101), (011), (-1,-1,2) и т. д. . 22 Такие кристаллографические параметры чувствительны к изменению размера зерна, которое отвечает за различные газочувствительные свойства пленок, приготовленных в разных условиях. 23 МОКСы могут быть легированы небольшим количеством металлов, таких как Sn, Pd, Cu, Nb и т. д., для изменения структурных и электронных свойств. Установлено, что легирование оксида олова Sn, In и Nb приводит к уменьшению размера зерна вплоть до нанометрового диапазона. 24 Кавамура и др. обнаружили, что взаимодействие между различными направлениями роста кристаллов можно контролировать путем добавления примесей. 25 Помимо чистых металлов, МОКСы могут быть легированы или смешаны с органическими материалами, что позволяет создавать так называемые «гибридные» датчики химических газов. Область гибридных датчиков химических газов все еще находится в зачаточном состоянии. 26 Объединение твердых и мягких материалов в одну пленку является довольно сложной задачей из-за сложности процессов подготовки и изготовления.
д. . 22 Такие кристаллографические параметры чувствительны к изменению размера зерна, которое отвечает за различные газочувствительные свойства пленок, приготовленных в разных условиях. 23 МОКСы могут быть легированы небольшим количеством металлов, таких как Sn, Pd, Cu, Nb и т. д., для изменения структурных и электронных свойств. Установлено, что легирование оксида олова Sn, In и Nb приводит к уменьшению размера зерна вплоть до нанометрового диапазона. 24 Кавамура и др. обнаружили, что взаимодействие между различными направлениями роста кристаллов можно контролировать путем добавления примесей. 25 Помимо чистых металлов, МОКСы могут быть легированы или смешаны с органическими материалами, что позволяет создавать так называемые «гибридные» датчики химических газов. Область гибридных датчиков химических газов все еще находится в зачаточном состоянии. 26 Объединение твердых и мягких материалов в одну пленку является довольно сложной задачей из-за сложности процессов подготовки и изготовления. 27 В этой главе нас особенно интересуют гибридные датчики газа МОХ на основе композитов МОХ и углеродных нанотрубок (УНТ). 28,29 Для получения дополнительной информации о модификации МОКСов другими добавками следует обращаться к другим главам этой книги или текущему справочному разделу. 30
27 В этой главе нас особенно интересуют гибридные датчики газа МОХ на основе композитов МОХ и углеродных нанотрубок (УНТ). 28,29 Для получения дополнительной информации о модификации МОКСов другими добавками следует обращаться к другим главам этой книги или текущему справочному разделу. 30
МОКСы — это очень надежная технология, в основном применяемая в коммерческих целях для полупроводниковых датчиков газа. Стабильность и долговечность (средний срок службы 5 лет) были с радостью встречены в различных отраслях, включая охрану окружающей среды, безопасность, нефтехимию и сельское хозяйство. Однако у МОКСов есть определенные недостатки, которые ограничивают их применение во многих областях, например, в мобильных устройствах, где энергопотребление является серьезной проблемой.Снижение рабочей температуры (около 250–400 °C для большинства МОХ-топлив) до комнатной стало предметом научных интересов во всем мире. Поскольку механизм обнаружения МОХ основан на реакции поверхности материалов с поступающими анализируемыми газами, где главную роль будет играть перенос электронов, 31 разработка проводимости поверхности может привести к желаемым сенсорным свойствам. Легирование примесями оказалось успешным методом модификации поверхностей МОКС-топлива. Помимо металлических примесей, как упоминалось в предыдущем разделе, УНТ имеют ряд преимуществ по сравнению с другими композитными материалами. 29 УНТ обладает высокой электропроводностью, и обнаружение газа можно проводить при комнатной температуре. Следовательно, смешивание УНТ с МОКС приведет к увеличению поверхностной проводимости и снижению рабочей температуры. Высокоспецифичная площадь УНТ также увеличивает активную поверхность МОХ, что приводит к повышению чувствительности и селективности. Композитные материалы на основе МОКС- и УНТ можно разделить на две группы в зависимости от того, какого материала больше в составе: УНТ, декорированные МОХ-нанотрубками, и УНТ, легированные УНТ.
Легирование примесями оказалось успешным методом модификации поверхностей МОКС-топлива. Помимо металлических примесей, как упоминалось в предыдущем разделе, УНТ имеют ряд преимуществ по сравнению с другими композитными материалами. 29 УНТ обладает высокой электропроводностью, и обнаружение газа можно проводить при комнатной температуре. Следовательно, смешивание УНТ с МОКС приведет к увеличению поверхностной проводимости и снижению рабочей температуры. Высокоспецифичная площадь УНТ также увеличивает активную поверхность МОХ, что приводит к повышению чувствительности и селективности. Композитные материалы на основе МОКС- и УНТ можно разделить на две группы в зависимости от того, какого материала больше в составе: УНТ, декорированные МОХ-нанотрубками, и УНТ, легированные УНТ.
- 1.
УНТ, декорированные МОХ. В этом случае УНТ функционализируется за счет прикрепления наночастиц МОХ к боковой стенке УНТ за счет связанного или несвязного взаимодействия.
 32,33 Наиболее распространенным методом достижения сильного взаимодействия наночастиц МОХ на УНТ является окисление УНТ сильными кислотами для введения карбоксильных или гидроксильных групп на поверхности УНТ. Такие функциональные группы могут напрямую взаимодействовать с кислородом наночастиц МОХ посредством водородных связей.Возможны также связанные взаимодействия таких функциональных групп с атомами металла через пару электронов на кислороде. Различные нанокристаллы Mox, покрытые на CNT, такие как ZnO, 3 40 TIO 2 , 3 SIO 2 40, 36 SNO 2 , 37 MNO 2 , 38 и Fe 2 O 3 . 39 Такая функционализация создает новые свойства, которые расширяют применимость УНТ во многих новых областях, таких как конденсаторы, фотокатализаторы и батареи.В приложениях для обнаружения газа УНТ, декорированные МОКС-оксидом, показали повышенную чувствительность, улучшенное время отклика и восстановления, а также резкое снижение рабочей температуры.
32,33 Наиболее распространенным методом достижения сильного взаимодействия наночастиц МОХ на УНТ является окисление УНТ сильными кислотами для введения карбоксильных или гидроксильных групп на поверхности УНТ. Такие функциональные группы могут напрямую взаимодействовать с кислородом наночастиц МОХ посредством водородных связей.Возможны также связанные взаимодействия таких функциональных групп с атомами металла через пару электронов на кислороде. Различные нанокристаллы Mox, покрытые на CNT, такие как ZnO, 3 40 TIO 2 , 3 SIO 2 40, 36 SNO 2 , 37 MNO 2 , 38 и Fe 2 O 3 . 39 Такая функционализация создает новые свойства, которые расширяют применимость УНТ во многих новых областях, таких как конденсаторы, фотокатализаторы и батареи.В приложениях для обнаружения газа УНТ, декорированные МОКС-оксидом, показали повышенную чувствительность, улучшенное время отклика и восстановления, а также резкое снижение рабочей температуры. Сообщалось о нескольких окружающих газах, например, CO, NO 2 , NH 3 и этанол (см. ссылку 29 и полный список ссылок в нем).
Сообщалось о нескольких окружающих газах, например, CO, NO 2 , NH 3 и этанол (см. ссылку 29 и полный список ссылок в нем).- 2.
МОКСы, легированные УНТ. В этом случае УНТ встраиваются в матрицу МОХ. В этой главе основное внимание будет уделено этому типу гибридного материала УНТ и МОКС-топлива.Тонкие пленки МОКС/УНТ могут быть получены с использованием различных методов, таких как центрифугирование, капельное покрытие, окунание и электронно-лучевое испарение, подробности которых будут приведены в следующих разделах.
Хотя гибридные материалы MOX активно разрабатывались многими исследователями в течение последних нескольких десятилетий, на самом деле датчики газа MOX имеют определенные ограничения, которые не поддерживают развитие технологий носимых датчиков. Желание преодолеть эти ограничения побудило исследователей сосредоточиться на поиске новых газочувствительных материалов и новых технологий в области сенсоров газа на текстильной основе. Нанокомпозитные материалы УНТ/полимер привлекли особое внимание исследователей во всем мире, поскольку они могут работать при комнатной температуре, требуют низкого энергопотребления и предлагают несколько возможностей дизайна с электронным текстилем. 40 Кроме того, нанокомпозитные материалы УНТ/полимер также исследуются в качестве альтернативных газочувствительных материалов для ряда приложений, таких как здравоохранение, 41 сельское хозяйство, 42 промышленность, 43 и окружающая среда. 44–46 Недавно исследователи разработали носимую смарт-технологию для изменения как дизайна, так и производственного процесса с помощью электронных схем и цифровых компонентов, встроенных в одежду, известную как электронный текстиль или электронный текстиль.Технология электронного текстиля меняет производство волокон и текстиля и обладает особыми свойствами, которые нельзя найти в традиционной ткани, такими как коммуникация, функции восприятия и проведение энергии.
Нанокомпозитные материалы УНТ/полимер привлекли особое внимание исследователей во всем мире, поскольку они могут работать при комнатной температуре, требуют низкого энергопотребления и предлагают несколько возможностей дизайна с электронным текстилем. 40 Кроме того, нанокомпозитные материалы УНТ/полимер также исследуются в качестве альтернативных газочувствительных материалов для ряда приложений, таких как здравоохранение, 41 сельское хозяйство, 42 промышленность, 43 и окружающая среда. 44–46 Недавно исследователи разработали носимую смарт-технологию для изменения как дизайна, так и производственного процесса с помощью электронных схем и цифровых компонентов, встроенных в одежду, известную как электронный текстиль или электронный текстиль.Технология электронного текстиля меняет производство волокон и текстиля и обладает особыми свойствами, которые нельзя найти в традиционной ткани, такими как коммуникация, функции восприятия и проведение энергии.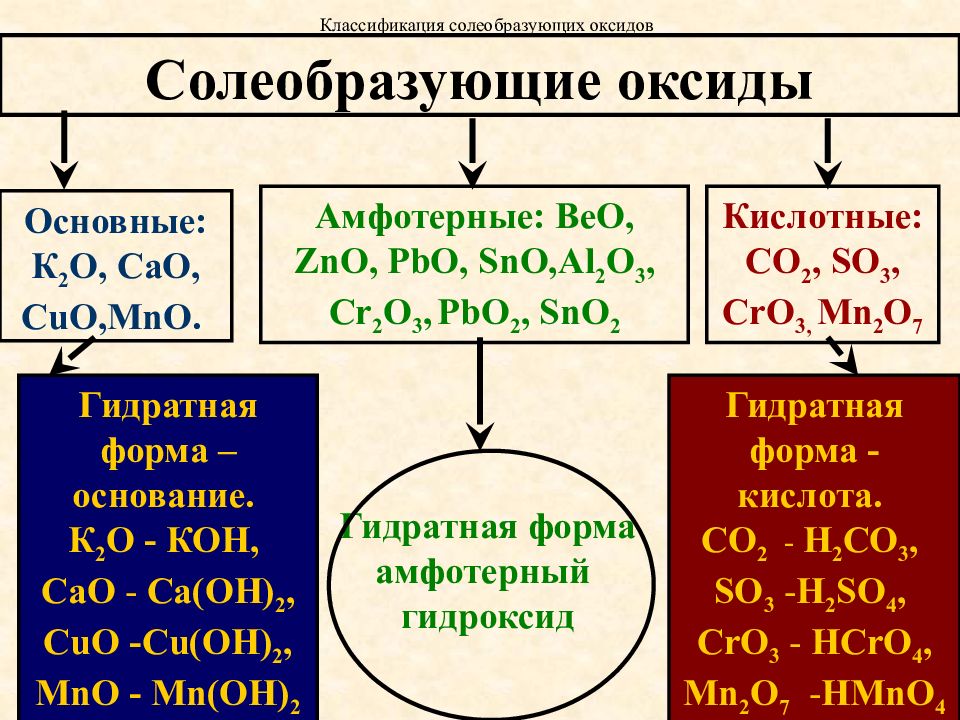 47,48 Примером инноваций в области носимого электронного текстиля, являющихся результатом сочетания текстильных и электронных технологий, обеспечивающих идеальную платформу для носимых медицинских устройств, является биометрическая смарт-рубашка; метрическая система тела, которая отслеживает сердечный ритм, модели дыхания 49 и отслеживает активность тела для положения ребенка во сне с помощью нескольких датчиков, встроенных в ткань. 50 Существуют также интеллектуальные датчики частоты вращения носков, которые могут получать доступ к биометрическим данным в режиме реального времени для выявления аномалий ходьбы, анализа походки и равномерного распределения веса тела вокруг стопы во время ходьбы и бега. 51 Следовательно, мы сможем отслеживать прогресс эффективности упражнений. Тем не менее, возможно, будет возможно интегрировать электронные компоненты в текстиль или ткани на ранних стадиях технологии электронного текстиля, потому что компонент подключения устройств немодный из-за неопрятности электропроводки и негибкости кабелей при вплетении в одежду.
47,48 Примером инноваций в области носимого электронного текстиля, являющихся результатом сочетания текстильных и электронных технологий, обеспечивающих идеальную платформу для носимых медицинских устройств, является биометрическая смарт-рубашка; метрическая система тела, которая отслеживает сердечный ритм, модели дыхания 49 и отслеживает активность тела для положения ребенка во сне с помощью нескольких датчиков, встроенных в ткань. 50 Существуют также интеллектуальные датчики частоты вращения носков, которые могут получать доступ к биометрическим данным в режиме реального времени для выявления аномалий ходьбы, анализа походки и равномерного распределения веса тела вокруг стопы во время ходьбы и бега. 51 Следовательно, мы сможем отслеживать прогресс эффективности упражнений. Тем не менее, возможно, будет возможно интегрировать электронные компоненты в текстиль или ткани на ранних стадиях технологии электронного текстиля, потому что компонент подключения устройств немодный из-за неопрятности электропроводки и негибкости кабелей при вплетении в одежду. Вполне вероятно, что опасность может возникнуть, особенно при ношении громоздкой и неудобной одежды. Затем исследователи пытаются найти подходящий метод объединения электроники с одеждой и украшениями. В результате эти устройства будут безопасны в использовании, а мониторинг приложений в режиме реального времени будет легко построен. Возможно иметь более совершенную форму связи без каких-либо кабелей благодаря беспроводной платформе для новых границ приложений электронного текстиля, таких как мода электронного текстиля, отделка и декорирование, военные приложения и умная одежда. 52
Вполне вероятно, что опасность может возникнуть, особенно при ношении громоздкой и неудобной одежды. Затем исследователи пытаются найти подходящий метод объединения электроники с одеждой и украшениями. В результате эти устройства будут безопасны в использовании, а мониторинг приложений в режиме реального времени будет легко построен. Возможно иметь более совершенную форму связи без каких-либо кабелей благодаря беспроводной платформе для новых границ приложений электронного текстиля, таких как мода электронного текстиля, отделка и декорирование, военные приложения и умная одежда. 52
Кроме того, имеются новые разработки в области электрических свойств текстильных материалов, включая проводящую нить, пряжу с металлической отделкой, серебряную пряжу, полиэфирное порошковое покрытие/металлическую отделку и синтетические ткани, состоящие из волокон с высокой электропроводностью. 53 Инновационные электронные текстильные устройства и текстильные материалы (ткани, пряжа и нити) были разработаны с использованием различных технологий и процессов изготовления, таких как светящаяся ткань и светоизлучающее волокно, которые были разработаны для украшения зданий и автомобильных деталей. . 54 Кроме того, исследовательский центр Philips и Институт текстиля TITV Greiz, Германия, проводят совместные исследования в области разработки технологии электронного текстиля для здоровья и повышения качества жизни, известной под названием фотонный текстиль. Фотонный текстиль был создан путем встраивания светодиодов в пластик или пленку, а затем их вплетения в ткань, чтобы сделать их мягкими и гибкими, позволяющими принимать неограниченные формы, что может увеличить взаимодействие с пользователем за счет объединения функций датчиков и устройств связи. 55 Кроме того, в рамках проекта PLACE-it (Платформа для электроники, согласующейся с большой площадью путем интеграции) была разработана чрезвычайно тонкая и легкая оптоэлектроника, которую можно легко применять в медицине и здравоохранении, а также в некоторых областях, например, для лечения кожи. и измерение циркуляции крови во всех частях тела. Кроме того, его также можно использовать в дизайне продуктов, таких как лампы, шторы, реклама и мода.
. 54 Кроме того, исследовательский центр Philips и Институт текстиля TITV Greiz, Германия, проводят совместные исследования в области разработки технологии электронного текстиля для здоровья и повышения качества жизни, известной под названием фотонный текстиль. Фотонный текстиль был создан путем встраивания светодиодов в пластик или пленку, а затем их вплетения в ткань, чтобы сделать их мягкими и гибкими, позволяющими принимать неограниченные формы, что может увеличить взаимодействие с пользователем за счет объединения функций датчиков и устройств связи. 55 Кроме того, в рамках проекта PLACE-it (Платформа для электроники, согласующейся с большой площадью путем интеграции) была разработана чрезвычайно тонкая и легкая оптоэлектроника, которую можно легко применять в медицине и здравоохранении, а также в некоторых областях, например, для лечения кожи. и измерение циркуляции крови во всех частях тела. Кроме того, его также можно использовать в дизайне продуктов, таких как лампы, шторы, реклама и мода. 56 E-textile может не только интегрировать электронику непосредственно в текстильную основу, но и производить электронные компоненты из волокон и текстиля.Например, исследования Текстильного колледжа NC STATE UNIVERSITY продемонстрировали, что разработка литий-ионного аккумулятора обеспечивает лучшую производительность за счет использования нановолокон MnOx/C вместо графита в аноде аккумулятора, называемого элементами 18650. 57 Интересный проект умного текстиля ProeTEX (PROtection E-TEXtiles) представляет собой исследовательское сотрудничество европейских стран, которое придает большое значение развитию технологии MicroNano на основе электронного текстиля и носимой системы для спасателей и пожарных. 58,59 Недавние исследования в области электронных текстильных технологий показали, что ключевым компонентом этой технологии является часть электронной схемы на ткани для управления и обработки оборудования. Таким образом, новый производственный процесс и материалы при разработке электронного компонента на текстильной основе, обеспечивающие постоянное качество электронного текстиля в каждом производстве, являются основной основой для создания носимой электронной текстильной системы.
56 E-textile может не только интегрировать электронику непосредственно в текстильную основу, но и производить электронные компоненты из волокон и текстиля.Например, исследования Текстильного колледжа NC STATE UNIVERSITY продемонстрировали, что разработка литий-ионного аккумулятора обеспечивает лучшую производительность за счет использования нановолокон MnOx/C вместо графита в аноде аккумулятора, называемого элементами 18650. 57 Интересный проект умного текстиля ProeTEX (PROtection E-TEXtiles) представляет собой исследовательское сотрудничество европейских стран, которое придает большое значение развитию технологии MicroNano на основе электронного текстиля и носимой системы для спасателей и пожарных. 58,59 Недавние исследования в области электронных текстильных технологий показали, что ключевым компонентом этой технологии является часть электронной схемы на ткани для управления и обработки оборудования. Таким образом, новый производственный процесс и материалы при разработке электронного компонента на текстильной основе, обеспечивающие постоянное качество электронного текстиля в каждом производстве, являются основной основой для создания носимой электронной текстильной системы. В настоящее время растет интерес к использованию технологии трафаретной печати в качестве производственного процесса при разработке исследований в области электронной коммерции для создания перпендикулярной структуры проводки на текстильной основе, 60,61 , которая позволяет производить электронные компоненты и схемы на ткани, которые не может быть достигнуто другими методами, такими как влажная химическая или фотолитографическая технология.Электронные печатные платы в секторе промышленной электроники были разработаны с использованием процесса трафаретной печати по той причине, что этот процесс может производить множество изделий за относительно короткий период времени, и их можно воспроизводить с низкими затратами с постоянным качеством заготовки и точным рисунком. контроль.
В настоящее время растет интерес к использованию технологии трафаретной печати в качестве производственного процесса при разработке исследований в области электронной коммерции для создания перпендикулярной структуры проводки на текстильной основе, 60,61 , которая позволяет производить электронные компоненты и схемы на ткани, которые не может быть достигнуто другими методами, такими как влажная химическая или фотолитографическая технология.Электронные печатные платы в секторе промышленной электроники были разработаны с использованием процесса трафаретной печати по той причине, что этот процесс может производить множество изделий за относительно короткий период времени, и их можно воспроизводить с низкими затратами с постоянным качеством заготовки и точным рисунком. контроль.
Хотя электронный текстиль активно разрабатывался многими исследователями в последнее десятилетие, инновационные продукты электронного текстиля были найдены в основном в модной одежде и украшениях.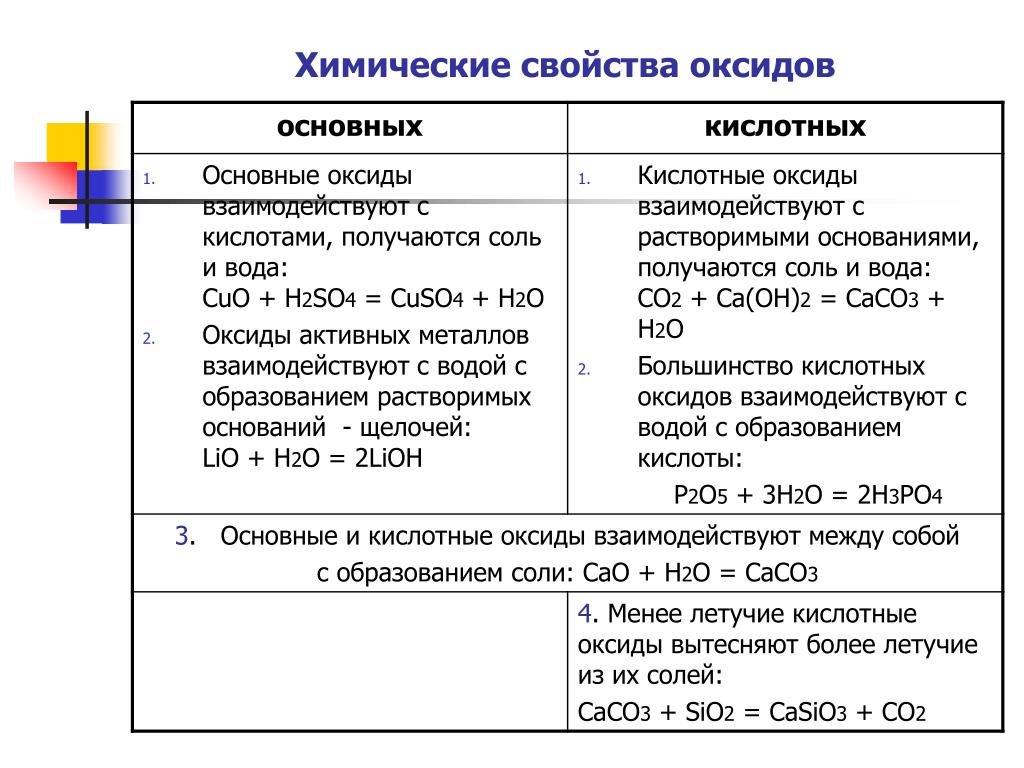 Несмотря на то, что существует множество исследований в поддержку обучения и создания ориентированных на инновации исследований для приложений здравоохранения, большинство из которых являются инновациями, которые могут помочь в интерпретации результатов измерений с точки зрения физиологических параметров и биокинетики, таких как дыхание, движение, прикосновение, мозговые волны, частота сердечных сокращений, дыхание, сердечная деятельность и температура тела. 62 Видно, что среди множества инноваций в области умного текстиля все еще есть место для создания инновационного электронного текстиля для молекулярного обнаружения с использованием наноматериалов и наногибридных материалов. Чтобы сделать технологию электронного текстиля более совершенной, исследователи проводят исследования, связанные с разработкой сенсоров газа на текстильной основе, используемых в качестве носимых электронных носов. 63 В настоящее время ведутся исследования в области разработки электронного текстиля, чтобы получить широкое признание.
Несмотря на то, что существует множество исследований в поддержку обучения и создания ориентированных на инновации исследований для приложений здравоохранения, большинство из которых являются инновациями, которые могут помочь в интерпретации результатов измерений с точки зрения физиологических параметров и биокинетики, таких как дыхание, движение, прикосновение, мозговые волны, частота сердечных сокращений, дыхание, сердечная деятельность и температура тела. 62 Видно, что среди множества инноваций в области умного текстиля все еще есть место для создания инновационного электронного текстиля для молекулярного обнаружения с использованием наноматериалов и наногибридных материалов. Чтобы сделать технологию электронного текстиля более совершенной, исследователи проводят исследования, связанные с разработкой сенсоров газа на текстильной основе, используемых в качестве носимых электронных носов. 63 В настоящее время ведутся исследования в области разработки электронного текстиля, чтобы получить широкое признание. Инновация Sniffing e-textile была разработана, чтобы быть более модной и удобной для использования в повседневной жизни, чтобы владелец мог работать за пределами первоначального предела. Сначала печатная плата была разработана из жесткого материала, а затем ее заменили на мягкий материал, такой как ткань, резина и пластик, чтобы сделать ее гибкой. Кроме того, тканевая основа также безвредна для кожи человека и эстетически приемлема. Для исследователей самой большой проблемой является преодоление этих ограничений. Детали исследования связаны с технологией электронного текстиля, и одежда является первоочередной задачей, на которой мы делаем акцент, потому что это то, что вы можете носить на протяжении всей своей жизни.Более того, одежду можно не только легко приспособить к биологическим функциям, что на самом деле происходит, но и обеспечить комфорт при физической подвижности. В этой главе мы осветим наиболее важный процесс изготовления гибких текстильных датчиков газа на основе УНТ, характеристики нанокомпозитов УНТ/полимер для многофункционального обнаружения и основные достижения в области обнаружения газа.
Инновация Sniffing e-textile была разработана, чтобы быть более модной и удобной для использования в повседневной жизни, чтобы владелец мог работать за пределами первоначального предела. Сначала печатная плата была разработана из жесткого материала, а затем ее заменили на мягкий материал, такой как ткань, резина и пластик, чтобы сделать ее гибкой. Кроме того, тканевая основа также безвредна для кожи человека и эстетически приемлема. Для исследователей самой большой проблемой является преодоление этих ограничений. Детали исследования связаны с технологией электронного текстиля, и одежда является первоочередной задачей, на которой мы делаем акцент, потому что это то, что вы можете носить на протяжении всей своей жизни.Более того, одежду можно не только легко приспособить к биологическим функциям, что на самом деле происходит, но и обеспечить комфорт при физической подвижности. В этой главе мы осветим наиболее важный процесс изготовления гибких текстильных датчиков газа на основе УНТ, характеристики нанокомпозитов УНТ/полимер для многофункционального обнаружения и основные достижения в области обнаружения газа.
Типы оксидов и использование перекиси водорода.
Символ: O
Молекулярная формула: O 2
Атомный номер: 8
Атомный вес: 15.999 а.е.м.
Молекулярный вес: 32
Электронная конфигурация: 1с 2 2с 2 2п 4
Изотопы: 8 O 16 , 8 O 17 , 8 O 18
Обнаружен: Джозеф Пристли
→ Самый распространенный элемент в земной коре, около 41%. → Открыт английским ученым Джозефом Пристли, который получил кислород, сфокусировав солнечные лучи с помощью линзы на оксиде ртути. →Лавуазье подробно исследовал его свойства. → Существовать в двухатомной газообразной молекуле (O 2 )Положение кислорода в периодической таблице
Электронная конфигурация кислорода 1s 2 2s 2 2p 4 . Таким образом, этот элемент помещен в р-блок в группе VIA или группе 16 вместе с серой (S), селеном (Se), теллуром (Te) и полонием (Po). металлы. Таким образом, этот элемент помещен в р-блок в группе VIA или группе 16 вместе с серой (S), селеном (Se), теллуром (Te) и полонием (Po). металлы.
|
Использование кислорода
- Используется для искусственного дыхания в больнице.
- Используется в ракетном топливе. { Смесь топлива и жидкости.Кислород используется для получения высокой скорости в высотных ракетах, реактивных самолетах и ракетах. }
- Используется для приготовления таких соединений, как H 2 SO 4 , HNO 3 , CO 2 и т. д.
- Используется в качестве окислителя в химических реакциях.

Аллотропы кислорода
Аллотропы — это две или более формы одного и того же элемента в одном и том же физическом состоянии (твердом, жидком или газообразном), которые отличаются друг от друга своими физическими, а иногда и химическими свойствами.
Существуют две основные аллотропные формы кислорода:
- Двухатомная молекула, состоящая из 2 атомов кислорода с молекулярной формулой O 2 , обычно называемая молекулярным кислородом или дикислородом.
- Трехатомная молекула, состоящая из 3 атомов кислорода, с молекулярной формулой O 3 , обозначаемая как озон .
Примечание : Другие аллотропы: O 4 , O 8 и т. д.
Оксиды
Оксиды представляют собой бинарные соединения кислорода с другими элементами, которые менее электроотрицательны, чем кислород. например. CO 2 , CO, Fe 2 O 3 , CaO, Na 2 O, H 2 O и т. д.
например. CO 2 , CO, Fe 2 O 3 , CaO, Na 2 O, H 2 O и т. д.
Примечание: Бинарные соединения означают соединения, содержащие только два типа элементов. Бинарные соединения кислорода, такие как OF 2 , O 2 F 2 и т. д., не являются оксидами, они являются фторидами.
Классификация оксидов
A. На основе кислотного и щелочного поведения:
1.Основные оксиды:
Оксиды металлов, которые растворяются в воде с образованием основания (щелочи) и реагируют с кислотами с образованием соли и воды, называются основными оксидами. Например. Na 2 O, H 2 O, MgO, CaO, BaO, Li 2 O, {CuO, MnO, FeO} и т. д.
Обычно оксиды металлов группы IA являются основными. {кроме BeO, который является амфотерным. } Eg.
} Eg.
Оксиды элементов d-блока в низших степенях окисления являются основными. Они не растворяются в воде, но реагируют с кислотой с образованием соли и воды.Например.
2. Кислотные оксиды:
Оксиды неметаллов, которые растворяются в воде с образованием кислот и реагируют с основаниями с образованием соли и воды, называются кислотными оксидами. Например. СО 2 , СО 2 , СО 3 , НО 2 , Н 2 О 3 , Н 2 О 90 90 305 60 90 305 5 0 90.
3. Нейтральные оксиды:
Оксиды, которые не реагируют ни с кислотами, ни с основаниями, называются нейтральными оксидами. Например, H 2 O, CO, NO, N 2 O и т. д.
4. Амфотерные оксиды:
Оксиды, которые реагируют как с кислотами, так и с основаниями с образованием соли и воды, называются амфотерными оксидами. Например. ZnO, SnO, PbO, Al 2 O 3 , {BeO} и т. д.
д.
Тренд в периодической таблице:
При перемещении слева направо в периоде металлический характер уменьшается, а основной характер уменьшается.
| Период 3 | На | мг | Ал | Си | Р | С | Кл |
| Оксид | На 2 О | MgO | Алюминий 2 О 3 | SiO 2 | П 2 П 5 | SO 3 | Класс 2 О 7 |
| Кислотное/основное поведение | Сильно основной | базовый | амфотерный | Слабокислотный | кислый | Сильнокислотный | Очень сильнокислотный |
При движении сверху вниз в группе усиливается металлический характер и усиливается основной характер.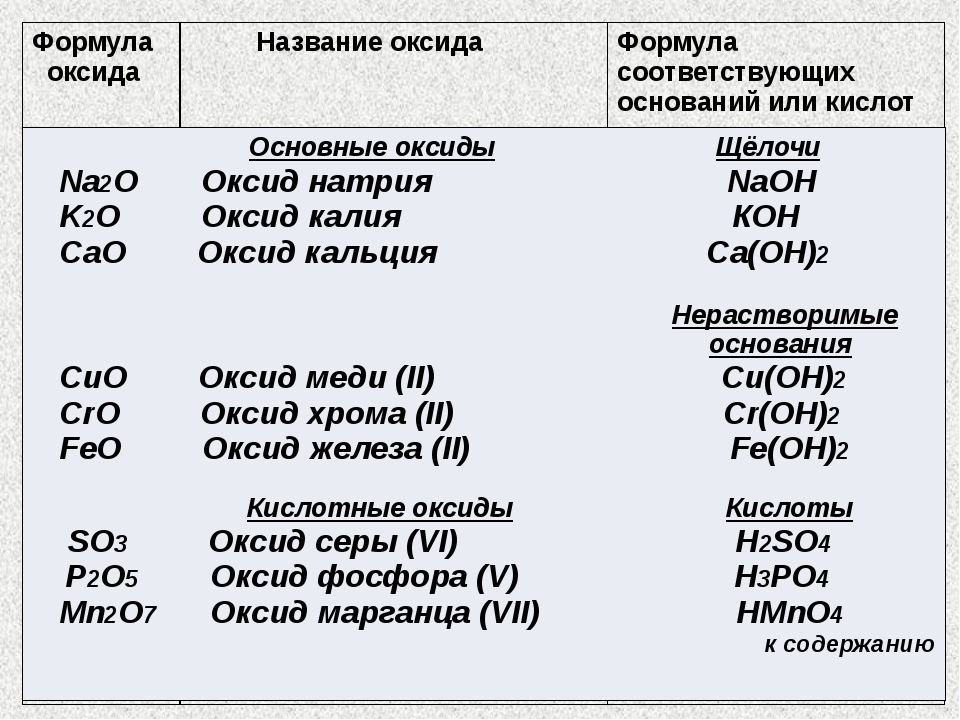 Например. Оксиды элементов 13 группы:
Например. Оксиды элементов 13 группы:
| Группа 13 | оксиды | поведение |
| Б | В 2 О 3 | Слабокислотный |
| Ал | Алюминий 2 О 3 | Амфотерный |
| Га | Га 2 О 3 | Амфотерный |
| В | В 2 О 3 | Базовый |
| Тл | Тл 2 О 3 | Более простой |
В оксидах одного и того же элемента кислотность увеличивается с увеличением степени окисления или числа атомов кислорода.Например.
| Оксиды азота | Н 2 О | НЕТ | Н 2 О 3 | № 2 | Н 2 О 5 |
О. Н. азота Н. азота | +1 | +2 | +3 | +4 | +5 |
| Кислотный характер | нейтральный | нейтральный | кислый | кислый | кислый |
Кислотный порядок: N 2 O < NO < N 2 O 3 < NO 2 < N 2 O 5 6 Оксиды, образованные по правилу нормальной валентности, называются нормальными оксидами. Например. Na 2 O, MgO, ZnO, Al 2 O 3 и т. д., где валентность O = 2. Оксиды, которые содержат пероксид-ион O 2 2- или (O-O) 2-, в которых степень окисления кислорода равна -1 и образуют пероксид водорода с кислотой, называются пероксидами.Например. H 2 O 2 { т. BaO 2 : {т.е. Ба-О-О} Щелочные металлы образуют пероксиды типа M 2 O 2 , а щелочноземельные металлы образуют пероксиды типа MO 2 . Оксиды, содержащие супероксид-ион O 2 – , в которых степень окисления кислорода составляет -1/2, называются супероксидами. Например. KO 2 {супероксид калия}, RbO 2 , CsO 2 и др. , т.е. оксиды, содержащие больше атомов кислорода, чем требуется по правилу нормальной валентности, называются супероксидами. Оксиды, которые содержат меньше атомов кислорода, чем требуется по правилу нормальной валентности, называются субоксидами. Те оксиды, которые представляют собой смесь двух подобных оксидов одного и того же элемента с разной валентностью, называются смешанными оксидами. Например. 1. Что из перечисленного не является оксидом? а. CO 2 c. Н 2 О б. 2. Что из перечисленного является амфотерным оксидом? а.PbO c. О 2 б. N 2 O 3 d. К 2 О 3. Что из перечисленного является перекисью? а. Na 2 O c. MgO б. Al 2 O 3 d. БаО 2 4. Какой из следующих оксидов является наиболее кислотным? а. Na 2 O c. Р 2 О 5 б. Al 2 O 3 d.СО 3 5. Какой из следующих оксидов является наиболее основным? а. Al 2 O 3 c. В 2 О 3 б. Ga 2 O 3 d. Тл 2 О 3 6. Какой из следующих оксидов является наиболее кислым? а. б. Кивать головой. Н 2 О 3 Ответить : 1.- б ; 2.- и ; 3.- д ; 4.- д ; 5.- д ; 6. – в Цели обучения В этой статье автор объяснил, что такое оксиды, типы и классификация оксидов, а также изменения в периодической таблице. Бинарные соединения кислорода с элементами периодической таблицы называются оксидами. Примеры оксидов Na 2 O, CaO, Al 2 O 3 , CO 2 , NO 2 , Cl 2 O 3 , OF 5 оксид 2 6 90 93 , OF 5 Существует три типа оксидов на основе кислотных свойств. Те оксиды, которые образуют основания в воде и в основном состоят из оксидов металлов, известны как основные оксиды. Элементы группы I-А и группы II-А, кроме Be, и элементы группы II-А, кроме Zn, из основных оксидов. Всякий раз, когда они растворяются в воде, они дают основания. С повышением металлического характера элементов вниз по группе оксиды элементов той же группы становятся все более и более основными. CO 2 и SiO 2 являются кислотными оксидами. GeO 2 и SnO 2 являются амфотерными оксидами, тогда как PbO 2 являются основными оксидами. Те оксиды, которые при растворении в воде дают кислый раствор, известны как кислые оксиды. Оксиды углерода, азота и серы имеют кислотную природу. CO 2 , NO 2 , SO 2 являются кислотными оксидами. Те оксиды, которые имеют как кислотный, так и основной характер, называются амфотерными оксидами. Амоготерные оксиды ведут себя как кислоты по отношению к сильному основанию. Например: ZnO реагирует с ионами H+ с образованием иона Zn +2 и ведет себя как основной оксид. ZnO также реагирует с ионами OH – Существует почти систематическая вариация кислотного и основного характера оксидов по группам и периодам периодической таблицы. Следующая таблица дает представление о классификации оксидов на основе кислотно-основного характера. Когда мы движемся слева направо по периоду, оксиды становятся все более и более кислыми по своей природе. Посмотрите на постепенное увеличение изменения характера оксидов третьего периода. Когда мы движемся сверху вниз в группе; наблюдается увеличение оксидов основного характера.Посмотрите на оксиды элементов группы II-А. BeO наименее основный, а BaO максимально основный. Группа II-А Существуют определенные металлы, которые имеют различные степени окисления. Давайте посмотрим на оксиды марганца (Mn) Это пять оксидов азота, и их кислотная сила увеличивается с увеличением степени окисления азота. Точно так же оксиды серы имеют те же тенденции, что и выше. Бинарное соединение элемента с кислородом, в котором атом кислорода электроотрицательный, называется оксидом. например MgO, Al 2 O 3, и т. Классификация оксидов: В зависимости от химического поведения оксиды элементов третьего ряда подразделяются на три типа, а именно i) кислотные оксиды Na 2 O, MgO ii) основные оксиды SiO 2 , SO 3 , Cl 2 O 7, P 2 O 5 и iii) амфотерные оксиды Al 2 O 3 . Основные оксиды: Оксиды, которые реагируют с водой с образованием щелочи и могут нейтрализовать кислоты с образованием соли и воды, называются основными оксидами. Na 2 O натрия и MgO магния третьего ряда являются основными оксидами. Поскольку оба оксида образуют щелочь при обработке водой и могут нейтрализовать кислоту с образованием соли и воды. Na 2 O + H 2 O → 2 NaOH (сильное основание) Na 2 O + 2 HCl → 2 NaCl + h3O MgO + 2 H 2 O → Mg (OH) 2 (основание) MgO + 2 HCl → MgCl 2 + H 2 O Na и Mg имеют больший атомный размер. Амфотерный оксид: Оксид, который действует как кислота и основание и нейтрализует кислоту и основание с образованием соли и воды, называется амфотерным оксидом. Al 2 O 3 алюминия представляет собой амфотерный оксид. Он нейтрализует кислоту, такую как HCl, а также основание, такое как NaOH. Al 2 O 3 имеет кислую природу, поскольку реагирует с основанием с образованием соли и воды. Al 2 O 3 + 2 NaOH → 2 NaAlO 2 (алюминат натрия) + H 2 O Al 2 O 3 имеет кислую природу, поскольку реагирует с основанием с образованием соли и воды. Al 2 O 3 + 6 HCl → 2 AlCl 3 + 3 H 2 O Алюминий имеет более высокий IP. чем натрий, и его электроотрицательность больше, чем у металлов Mg и Na. Кислотные оксиды: Оксиды электроотрицательных элементов, которые дают кислоту при обработке водой и могут нейтрализовать основания с образованием соли и воды, называемые кислотными оксидами. Оксиды фосфора, серы, хлора являются кислыми. SiO 2 + 2 NaOH → Na 2 SIO 3 + H 2 O P 4 O 10 + 6 H 2 O → 4 H 3 PO 4 SO 3 + H 2 O → H 2 SO 4 SO 3 + 2 Na OH → Na 2 SO 4 + H 2 O Cl 2 O 7 + H 2 O → 2 HClO 4 (хлорная кислота) Cl 2 O 7 + 2 Na OH → 2 NaClO 4 + H 2 O Si, P, S и Cl имеют больший потенциал ионизации, электроотрицательность, тенденцию притягивать электроны. Тенденция кислотного и основного характера: Тренд: Как правило, оксиды металлов являются основными по своей природе, а оксиды неметаллов – кислотными. По мере продвижения от Na к Cl по третьему периоду кислотный характер элементов постепенно увеличивается, а основной характер уменьшается. Na 2 O и MgO из Na и Mg соответственно являются высокоосновными по своей природе.При взаимодействии с водой они выделяют щелочи. Они нейтрализуют кислоты. Na и Mg имеют очень низкий потенциал ионизации среди элементов третьего ряда. Na 2 O + H 2 O → 2 NaOH (сильное основание) Na 2 O + 2 HCl → 2 NaCl + h3O MgO + 2 H 2 O → Mg (OH) 2 (основание) MgO + 2 HCl → MgCl 2 + H 2 O Оксиды электроотрицательных элементов, таких как Si, P, S.и Cl имеют кислую природу. Их оксиды дают кислоты, при обработке водой они могут нейтрализовать основания с образованием соли и воды. Элементы Si, P, S и Cl имеют больший потенциал ионизации, больше валентных электронов, большую электроотрицательность. SiO 2 + 2 NaOH → Na 2 SiO 3 + H 2 O P 4 O 10 + 6 H 2 O → 4 H 3 PO 4 SO 3 + H 2 O → H 2 SO 4 SO 3 + 2 Na OH → Na 2 SO 4 + H 2 O Cl 2 O 7 + H 2 O → 2 HClO 4 (хлорная кислота) CL 2 O 7 + 2 NA 7 + 2 NA OH → 2 NaClo 4 + H 2 o Al 2 O 2 алюминия является амфотерным, потому что он нейтрализует кислоту, а также базу, продуцирующую соль и вода. Al 2 O 3 имеет кислую природу, поскольку реагирует с основанием с образованием соли и воды. Al 2 O 3 + 2 NaOH → 2 NaAlO 2 (алюминат натрия) + H 2 O Al 2 O 3 имеет кислую природу, поскольку реагирует с основанием с образованием соли и воды. Al 2 O 3 + 6 HCl → 2 AlCl 3 + 3 H 2 O Оксиды элементов третьего ряда приведены в следующей таблице. Причины: Оксид натрия является более основным, чем оксид магния. Бинарное соединение элемента с кислородом, в котором атом кислорода является электроотрицательным, называется оксидом. Оксиды, которые реагируют с водой с образованием щелочи и могут нейтрализовать кислоты с образованием соли и воды, называются основными оксидами. Na 2 O, MgO – основные оксиды. Эти оксиды образуют щелочь при обработке водой и могут нейтрализовать соль и воду, образующие кислоту. Натрий является более электроположительным элементом, чем магний. Натрий имеет более низкий потенциал ионизации и более низкую электроотрицательность, чем магний. По вышеуказанным причинам натрий очень легко отдает свой электрон кислороду, чем магний, и действует как более щелочной, чем магний. Оксид Определение Оксид представляет собой соединение кислорода и другого радикала а. «Оксид» сам по себе является дианионом кислорода, атомом O 2–. Таким образом, оксиды металлов обычно содержат анион кислорода в степени окисления -2. Большая часть земной коры состоит из твердых оксидов в результате окисления элементов кислородом воздуха или воды. Сгорание углеводородов дает два основных оксида углерода: монооксид углерода и диоксид углерода.Даже материалы, считающиеся чистыми элементами, часто образуют оксидное покрытие. На основании кислотно-основных характеристик оксиды классифицируются как кислотные, основные, амфотерные или нейральные: Существуют различные свойства, которые помогают различать три типа оксидов. Термин ангидрид («без воды») относится к соединениям, которые ассимилируют H 2 O с образованием либо кислоты, либо основания при добавлении воды. Структура и образование оксидов Оксидные материалы представляют большой научный и коммерческий интерес. Среди оксидов встречаются высокотемпературные сверхпроводники, магниторезистивные материалы, пьезоэлектрики, сегнетоэлектрики, мультиферроики.Его можно получить в виде монокристаллов, что позволяет проводить исследования диффузного рассеяния, в которых мы наблюдаем ближний порядок в материалах. Плавное изменение типа связи в оксидах от ионных к ковалентным наблюдается при переходе по таблице Менделеева от металлов слева к неметаллам справа.Такая же вариация наблюдается в реакции оксидов с водой и обусловленном этим кислотно-основном характере продуктов. Ионные оксиды металлов реагируют с водой с образованием гидроксидов (соединений, содержащих ион ОН-) и результирующих основных растворов, тогда как большинство оксидов неметаллов реагируют с водой с образованием кислот и результирующих кислых растворов. В сухом кислороде железо легко образует оксид железа(II), но для образования гидратированных оксидов железа, Fe 2 O 3 −x(OH) 2x , которые в основном содержат ржавчину, обычно требуется кислород и вода. Оксиды металлов представляют собой твердые кристаллические вещества, содержащие катион металла и анион оксида. Обычно они реагируют с водой с образованием оснований или с кислотами с образованием солей. Щелочные и щелочноземельные металлы образуют три различных типа бинарных соединений кислорода: В большинстве случаев окисление происходит в тандеме с процессом, называемым восстановлением. 1. Нормальные оксиды:
2. Пероксиды:
 е. H-O-O-H} , Na 2 O 2 , K 2 O 2 3 , 5 0 9 0 9 0 , 3 0 9 0 9 0
е. H-O-O-H} , Na 2 O 2 , K 2 O 2 3 , 5 0 9 0 9 0 , 3 0 9 0 9 0 Примечание : PbO 2 (перекись свинца) и MnO 2 не являются настоящей перекисью, поскольку они не производят H 2 O 2 с разбав.кислота.
3. Супероксиды:
4. Субоксиды:
 Например. N 2 O(закись азота}, Pb 2 O, C 3 O 2 и др.
Например. N 2 O(закись азота}, Pb 2 O, C 3 O 2 и др. 5. Смешанные оксиды:
Использование перекиси водорода
Вопросы и ответы  OF 2 d. БаО 2
OF 2 d. БаО 2  N 2 O c. № 2
N 2 O c. № 2
Каталожные номера Оксиды – классификация и периодические тренды оксидов

Основные оксиды 
 Они действуют как основания по отношению к сильной кислоте.
Они действуют как основания по отношению к сильной кислоте.
IA II-A III-A III-A VA VI-A VI-A VII-A Оксиды NA 2 O MGO AL 2 48 AL 2 O 3 O 48 SIO 2 P 2 O 5 9 O 5 So 3 9 CL 2 O 7 природа 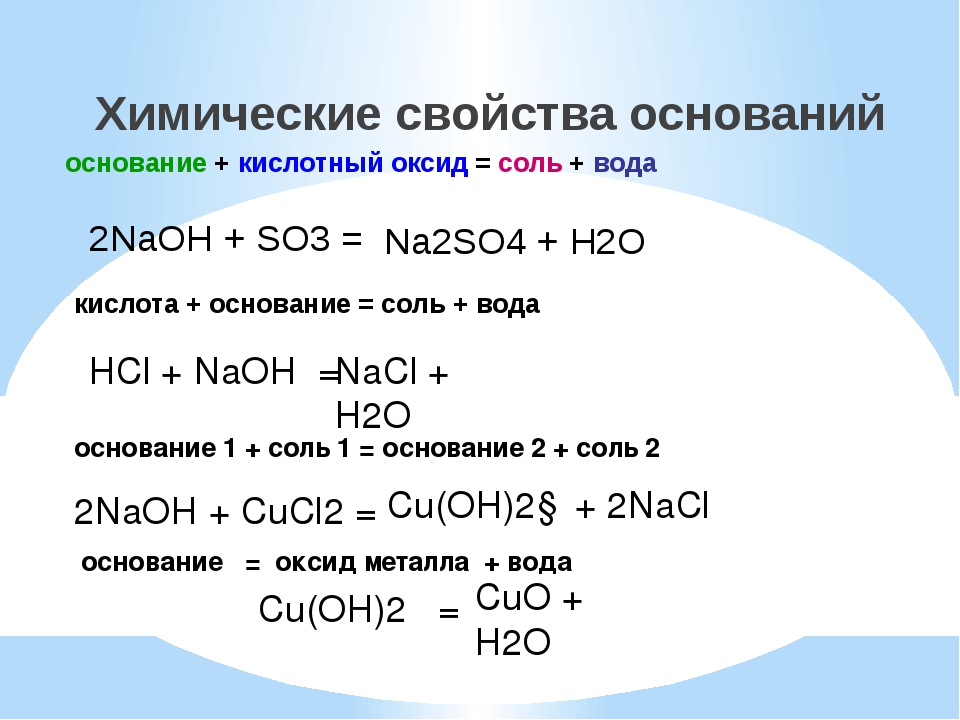 Поэтому эти металлы дают различные оксиды. Это можно объяснить, сказав; чем больше степень окисления металла, тем сильнее кислотный характер оксидов.
Поэтому эти металлы дают различные оксиды. Это можно объяснить, сказав; чем больше степень окисления металла, тем сильнее кислотный характер оксидов. Оксиды элементов третьего ряда и их классификация
Наука > Химия > Элементы третьего ряда > Оксиды элементов третьего ряда  д. Оксид, в котором кислород проявляет нормальную степень окисления -2, называется нормальным оксидом.В этой статье мы будем изучать оксиды элементов третьего ряда.
д. Оксид, в котором кислород проявляет нормальную степень окисления -2, называется нормальным оксидом.В этой статье мы будем изучать оксиды элементов третьего ряда. 1 и 2 валентных электрона соответственно и очень низкое значение потенциала ионизации.
1 и 2 валентных электрона соответственно и очень низкое значение потенциала ионизации. Таким образом, связь Al-O в Al 2 O 3 носит амфотерный характер.
Таким образом, связь Al-O в Al 2 O 3 носит амфотерный характер. Они имеют меньший атомный размер и больше валентных электронов.
Они имеют меньший атомный размер и больше валентных электронов.
Примеры: 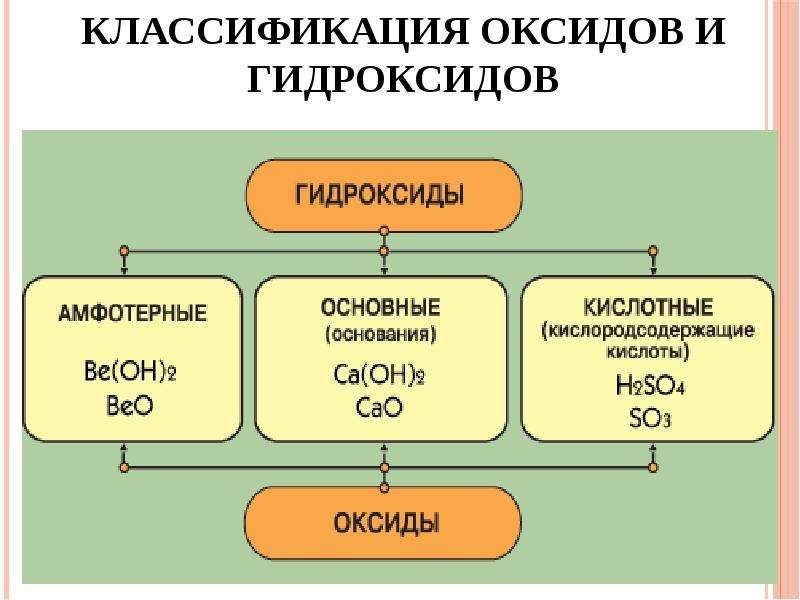
 Из-за своей двойственной природы его называют амфотерным.
Из-за своей двойственной природы его называют амфотерным. Элемент 91 776 На 91 776 Мг 91 776 Ал 91 776 Si 91 776 Р 91 776 S 91 776 Cl 90 464 гидроксисоединения 91 776 NaOH 91 776 MgOH) 2 91 776 Al (OH) 3 SI (OH) 3 PO (OH) 3 Po (OH) 3 Po (OH) 3 So2 (OH) 2 CLO 3 ) CLO 2 (OH) (OH) Очень сильная база прочная база Очень слабокислый Очень слабокислый Слабый кислотный сильно кислый сильно кислый очень сильно кислый 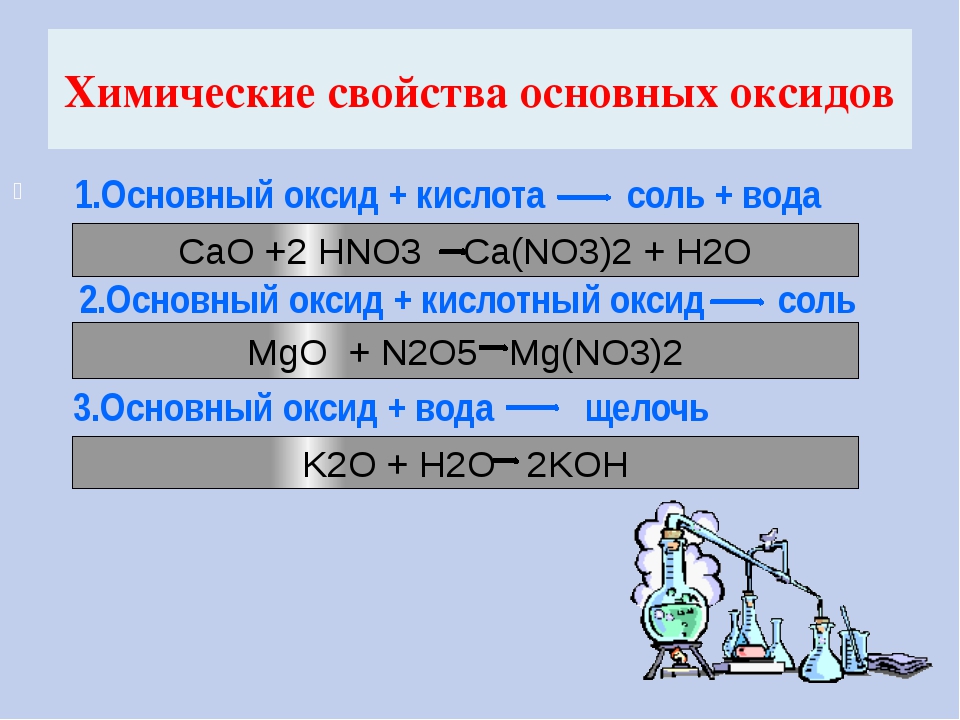
Оксид — точка присвоения
 Вода (H 2 O) представляет собой оксид. Оксиды представляют собой бинарные соединения кислорода с другим элементом, например.например, CO 2 , SO 2 , CaO, CO, ZnO, BaO 2 , H 2 O и т. д. Они называются оксидами, поскольку здесь кислород находится в сочетании только с одним элементом.
Вода (H 2 O) представляет собой оксид. Оксиды представляют собой бинарные соединения кислорода с другим элементом, например.например, CO 2 , SO 2 , CaO, CO, ZnO, BaO 2 , H 2 O и т. д. Они называются оксидами, поскольку здесь кислород находится в сочетании только с одним элементом.
 Это особенно актуально для замещенных и смешанных оксидов, например PZN, PbZn 1/3 Nb 2/3 O 3 ; где ионы на смешанном узле (в данном случае Zn/Nb) не входят упорядоченным образом. Вот презентация о диффузном рассеянии и PZN.
Это особенно актуально для замещенных и смешанных оксидов, например PZN, PbZn 1/3 Nb 2/3 O 3 ; где ионы на смешанном узле (в данном случае Zn/Nb) не входят упорядоченным образом. Вот презентация о диффузном рассеянии и PZN. Производство свободного кислорода фотосинтезирующими бактериями около 3,5 миллиардов лет назад осаждало железо из раствора в океанах в виде Fe 2 O 3 в экономически важной железной руде гематите.
Производство свободного кислорода фотосинтезирующими бактериями около 3,5 миллиардов лет назад осаждало железо из раствора в океанах в виде Fe 2 O 3 в экономически важной железной руде гематите.
 Кислотный оксид + Вода = Кислота (р. соединения)
Кислотный оксид + Вода = Кислота (р. соединения) 32,33 Наиболее распространенным методом достижения сильного взаимодействия наночастиц МОХ на УНТ является окисление УНТ сильными кислотами для введения карбоксильных или гидроксильных групп на поверхности УНТ. Такие функциональные группы могут напрямую взаимодействовать с кислородом наночастиц МОХ посредством водородных связей.Возможны также связанные взаимодействия таких функциональных групп с атомами металла через пару электронов на кислороде. Различные нанокристаллы Mox, покрытые на CNT, такие как ZnO, 3 40 TIO 2 , 3 SIO 2 40, 36 SNO 2 , 37 MNO 2 , 38 и Fe 2 O 3 . 39 Такая функционализация создает новые свойства, которые расширяют применимость УНТ во многих новых областях, таких как конденсаторы, фотокатализаторы и батареи.В приложениях для обнаружения газа УНТ, декорированные МОКС-оксидом, показали повышенную чувствительность, улучшенное время отклика и восстановления, а также резкое снижение рабочей температуры.
32,33 Наиболее распространенным методом достижения сильного взаимодействия наночастиц МОХ на УНТ является окисление УНТ сильными кислотами для введения карбоксильных или гидроксильных групп на поверхности УНТ. Такие функциональные группы могут напрямую взаимодействовать с кислородом наночастиц МОХ посредством водородных связей.Возможны также связанные взаимодействия таких функциональных групп с атомами металла через пару электронов на кислороде. Различные нанокристаллы Mox, покрытые на CNT, такие как ZnO, 3 40 TIO 2 , 3 SIO 2 40, 36 SNO 2 , 37 MNO 2 , 38 и Fe 2 O 3 . 39 Такая функционализация создает новые свойства, которые расширяют применимость УНТ во многих новых областях, таких как конденсаторы, фотокатализаторы и батареи.В приложениях для обнаружения газа УНТ, декорированные МОКС-оксидом, показали повышенную чувствительность, улучшенное время отклика и восстановления, а также резкое снижение рабочей температуры.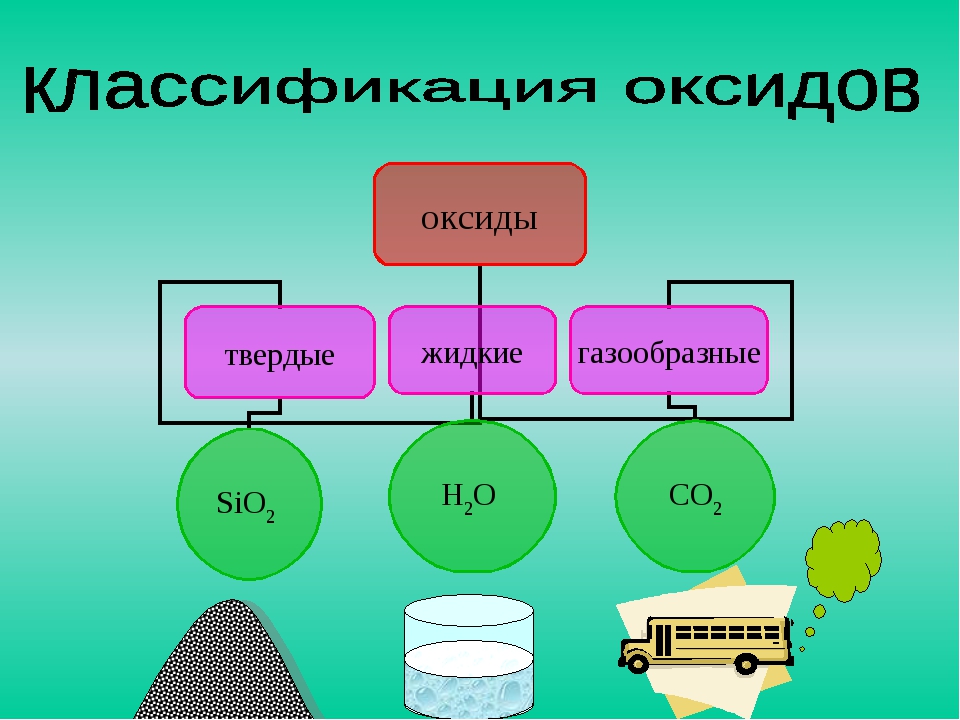 Сообщалось о нескольких окружающих газах, например, CO, NO 2 , NH 3 и этанол (см. ссылку 29 и полный список ссылок в нем).
Сообщалось о нескольких окружающих газах, например, CO, NO 2 , NH 3 и этанол (см. ссылку 29 и полный список ссылок в нем).