Общие свойства металлов. Металлическая связь. Видеоурок. Химия 9 Класс
Тема: Химия металлов
Урок: Общие свойства металлов. Металлическая связь
Для металлов характерны общие физические свойства: они обладают особенным металлическим блеском, высокой тепло- и электропроводностью, пластичностью.
Для металлов также характерны некоторые общие химические свойства. Важно запомнить, что в химических реакциях металлы выступают в качестве восстановителей: отдают электроны и повышают свою степень окисления. Рассмотрим некоторые реакции, в которых участвуют металлы.
ВЗАИМОДЕЙСТВИЕ С КИСЛОРОДОМ
Многие металлы могут вступать в реакцию с кислородом. Обычно продуктами этих реакций являются оксиды, но есть и исключения, о которых вы узнаете на следующем уроке. Рассмотрим взаимодействие магния с кислородом.
Магний горит в кислороде, при этом образуется оксид магния:
0 0 +2 -2
2Mg + O2 = 2MgO

Рис. 1. Горение магния в кислороде
Атомы магния отдают свои внешние электроны атомам кислорода: два атома магния отдают по два электрона двум атомам кислорода. При этом магний выступает в роли восстановителя, а кислород – в роли окислителя.
Для металлов характерна реакция с галогенами. Продуктом такой реакции является галогенид металла, например, хлорид.

Рис. 2. Горение калия в хлоре
Калий сгорает в хлоре образованием хлорида калия:
0 0 +1 -1
2К + Cl2 = 2KCl
Два атома калия отдают молекуле хлора по одному электрону. Калий, повышая степень окисления, играет роль восстановителя, а хлор, понижая степень окисления,- роль окислителя
Многие металлы реагируют с серой с образованием сульфидов. В этих реакциях металлы также выступают в роли восстановителей, тогда как сера будет окислителем. Сера в сульфидах находится в степени окисления -2, т.е. она понижает свою степень окисления с 0 до -2. Например, железо при нагревании реагирует с серой с образованием сульфида железа (II):
0 0 +2 -2
Fe + S = FeS

Рис. 3. Взаимодействие железа с серой
Металлы также могут реагировать с водородом, азотом и другими неметаллами при определенных условиях.
С водой без нагревания реагируют только активные металлы, например, щелочные и щелочноземельные. В ходе этих реакций образуется щелочь и выделяется газообразный водород. Например, кальций реагирует с водой с образованием гидроксида кальция и водорода, при этом выделяется большое количество теплоты:
Ca + 2H2O = Ca(OH)2 + H2
Менее активные металлы, например, железо и цинк, реагируют с водой только при нагревании с образованием оксида металла и водорода. Например:
0 +1 -2 +2 -2 0
Zn + H2O = ZnO + H2
В этих реакциях окислителем является атом водорода, входящий в состав воды.
Металлы, стоящие в ряду напряжении правее водорода, с водой не реагируют.
Вы уже знаете, что с кислотами реагируют металлы, стоящие в ряду напряжений левее водорода. В этих реакциях металлы отдают электроны и выступают в качестве восстановителя. Окислителем являются катионы водорода, образующиеся в растворах кислот. Например, цинк реагирует с соляной кислотой:
0 +1 -1 +2 -1 0
Zn + 2HCl = ZnCl2 + H2
Иначе протекают реакции металлов с азотной и концентрированной серной кислотами. В этих реакциях водород практически не выделяется. Мы погорим о таких взаимодействиях на следующих уроках.
Металл может реагировать с раствором соли, если он активнее, чем металл, входящий в состав соли. Например, железо замещает медь из сульфата меди (II):
0 +2 +2 0
Fe + CuSO4 = FeSO4 + Cu
Железо – восстановитель, катионы меди – окислитель.
Попробуем объяснить, почему металлы обладают общими физическими и химическими свойствами. Для этого рассмотрим модель внутреннего строения металла.
Атомы металлов имеют относительно большие радиусы и малое число внешних электронов. Эти электроны слабо притягиваются к ядру, поэтому в химических реакциях металлы выступают в роли восстановителей, отдавая электроны с внешнего энергетического уровня.
В узлах кристаллической решетки металлов находятся не только нейтральные атомы, но и катионы металла, т.к. внешние электроны свободно перемещаются по кристаллической решетке. При этом атомы, отдавая электроны, становятся катионами, а катионы, принимая электроны, превращаются в электронейтральные атомы.
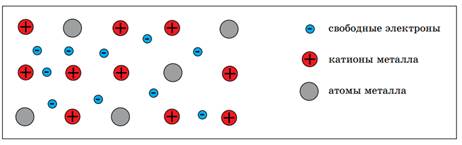
Рис. 4. Модель внутреннего строения металла
Химическую связь, которая образуется в результате притяжения катионов металла к свободно перемещающимся электронам, называют металлической.
Электро– и теплопроводность металлов объясняются наличием свободных электронов, которые могут быть носителями электрического тока и переносчиками теплоты. Пластичность металла объясняется тем, что при механическом воздействии не рвется химическая связь, т.к. химическая связь устанавливается не между конкретными атомами и катионами, а между всеми катионами металла со всеми свободными электронами в кристалле металла.
Список рекомендованной литературы
1. Микитюк А.Д. Сборник задач и упражнений по химии. 8-11 классы / А.Д. Микитюк. – М.: Изд. «Экзамен», 2009.
2. Оржековский П.А. Химия: 9-й класс: учеб. для общеобраз. учрежд. / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. – М.: АСТ: Астрель, 2007. (§23)
3. Оржековский П.А. Химия: 9-ый класс: учеб для общеобр. учрежд. / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013. (§6)
4. Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009.
5. Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008.
6. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник).
2. Электронная версия журнала «Химия и жизнь» (Источник).
Домашнее задание
с.41 №№ А1, А2 из Учебника Оржековского П.А. «Химия: 9-ый класс» (М.: Астрель, 2013).
interneturok.ru
Химические свойства металлов
Московский государственный индустриальный университет
Факультет прикладной математики и технической физики
Кафедра химии
Лабораторная работа
Москва 2012
Цель работы. Изучение свойств s-, p-, d-элементов-металлов (Mg, Al, Fe, Zn) и их соединений.
1. Теоретическая часть
Все металлы по своим химическим свойствам являются восстановителями, т.е. они отдают электроны при протекании химической реакции. Атомы металлов относительно легко отдают валентные электроны и переходят в положительно заряженные ионы.
1.1. Взаимодействие металлов с простыми веществами
При взаимодействии металлов с простыми веществами в качестве окислителей обычно выступают неметаллы. Металлы реагируют с неметаллами с образованием бинарных соединений.
1. При взаимодействии с кислородом металлы образуют оксиды:
2Mg
+ O2 2MgO,
2MgO,
2Cu
+ O2 2CuO.
2CuO.
2. Металлы реагируют с галогенами (F2, Cl2, Br2, I2) с образованием солей галогеноводородных кислот:
2Na + Br2
Ba + Cl2 = BaCl2,
2Fe
+ 3Cl2 2FeCl3.
2FeCl3.
3. При взаимодействии металлов с серой образуются сульфиды (соли сероводородной кислоты H2S):
Hg + S = HgS,
Zn + S = ZnS.
4. С водородом взаимодействуют активные металлы с образованием гидридов металлов, которые являются солеподобными веществами:
2Na
+ H2 2NaH,
2NaH,
Ca
+ H2 CaH2.
CaH2.
В гидридах металлов водород имеет степень окисления (-1).
Металлы могут взаимодействовать и с другими неметаллами: азотом, фосфором, кремнием, углеродом с образованием соответственно нитридов, фосфидов, силицидов, карбидов. Например:
3Mg
+ N2 Mg3N2,
Mg3N2,
3Ca
+ 2P  Ca3P2,
Ca3P2,
2Mg
+ Si  Mg2Si,
Mg2Si,
4Al
+ 3C  Al4C3.
Al4C3.
5. Металлы могут также взаимодействовать между собой с образованием интерметаллических соединений:
2Mg + Cu = Mg2Cu,
2Na + Sb = Na2Sb.
1.2. Взаимодействие металлов с водой
Взаимодействие металлов с водой – это окислительно-восстановительный процесс, в котором металл является восстановителем, а вода выполняет роль окислителя. Реакция протекает по схеме:
Me + nH2O = Me(OH)n + n/2 H2.
С водой при обычных условиях взаимодействуют щелочные и щелочноземельные металлы с образованием растворимых оснований и водорода:
2Na + 2H2O = 2NaOH + H2,
Ca + 2H2O = Ca(OH)2 + H2 .
Магний реагирует с водой при нагревании:
Mg
+ 2H2O  Mg(OH)2 + H2 .
Mg(OH)2 + H2 .
Железо и некоторые другие активные металлы взаимодействуют с горячим водяным паром:
3Fe
+ 4H2O  Fe3O4 + 4H2 .
Fe3O4 + 4H2 .
Металлы, имеющие положительные электродные потенциалы, не взаимодействуют с водой.
Не взаимодействуют с водой 4d-элементы (кроме Cd), 5d-элементы и Cu (3d-элемент).
1.3. Взаимодействие металлов с кислотами
По характеру действия на металлы наиболее распространенные кислоты можно разделить на две группы.
1. Кислоты-неокислители: хлороводородная (соляная, HCl), бромоводородная (HBr), йодоводородная (HI), фтороводородная (HF), уксусная (CH3COOH), разбавленная серная (H2SO4(разб.)), разбавленная ортофосфорная (H3PO4(разб.)).
2. Кислоты-окислители: азотная (HNO3) в любой концентрации, концентрированная серная (H2SO4(конц.)), концентрированная селеновая (H2SeO4(конц.)) .
Взаимодействие металлов с кислотами-неокислителями. Окисление металлов ионами водорода H+ в растворах кислот-неокислителей происходит более энергично, чем в воде.
Все металлы, имеющие отрицательное значение стандартного электродного потенциала, т.е. находящиеся в электрохимическом ряду напряжений до водорода, вытесняют водород из кислот-неокислителей. Реакция протекает по схеме:
Ме + nH + = Men+ + n/2 H2 .
Например:
2Al +6HCl = 2AlCl3 + 3H2 ,
Mg + 2CH3COOH = Mg(CH3COO)2 + H2 ,
2Ti + 6HCl = 2TiCl3 + 3H2 .
Металлы с переменной степенью окисления (Fe, Cо, Ni и др.) образуют ионы в своей низшей степени окисления (Fe2+, Co2+, Ni2+ и другие):
Fe + H2SO4(разб) = FeSO4 + H2.
При взаимодействии некоторых металлов с кислотами-неокислителями: HCl, HF, H2SO4(разб.), HCN образуются нерастворимые продукты, предохраняющие металл от дальнейшего окисления. Так, поверхность свинца в HCl (разб) и H2SO4(разб) пассивируется плохо растворимыми солями PbCl2 и PbSO4 соответственно.
Взаимодействие металлов с кислотами-окислителями. Серная кислота в разбавленном растворе – слабый окислитель, а в концентрированном – очень сильный. Окисляющая способность концентрированной серной кислоты H2SO4(конц.) определяется анионом SO42, окислительный потенциал которого значительно выше, чем иона H+. Концентрированная серная кислота является сильным окислителем за счёт атомов серы в степени окисления (+6). Кроме того, в концентрированном растворе H2SO4 содержится мало ионов H+, так как в концентрированном растворе она слабо ионизирована. Поэтому при взаимодействии металлов с H2SO4(конц.) водород не выделяется.
Реагируя с металлами как окислитель, H2SO4(конц.) переходит чаще всего в оксид серы (IV) (SO2), а при взаимодействии с сильными восстановителями – в S или H2S:
Me + H2SO4(конц) Me2(SO4)n + H2O + SO2 (S, H2S).
Для удобства запоминания рассмотрим электрохимический ряд напряжений, который выглядит так:
Li, Rb, K, Cs, Ba, Sr, Ca, Na, Mg, Be, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au .
В табл. 1. представлены продукты восстановления концентрированной серной кислоты при взаимодействии с металлами различной активности.
Таблица 1.
Продукты взаимодействия металлов с концентрированной
серной кислотой
Тип металла | Продукты восстановления H2SO4(конц.) |
Малоактивные металлы (в ряду напряжений правее Fe) | SO2 |
Металлы, стоящие в ряду напряжений между Al и Cd | Возможно образование трёх продуктов: SO2, S, H2S |
Активные металлы (начало ряда напряжений по Al включительно) | H2S |
Примеры:
Cu + 2H2SO4(конц) = CuSO4 + SO2 + 2H2O,
4Mg + 5H2SO4(конц) = 4MgSO4 + H2S + 4H2O.
Для металлов средней активности (Mn, Cr, Zn, Fe) соотношение продуктов восстановления зависит от концентрации кислоты.
Общая тенденция такова: чем выше концентрация H2SO4 , тем глубже протекает восстановление.
Это означает, что
формально каждый атом серы 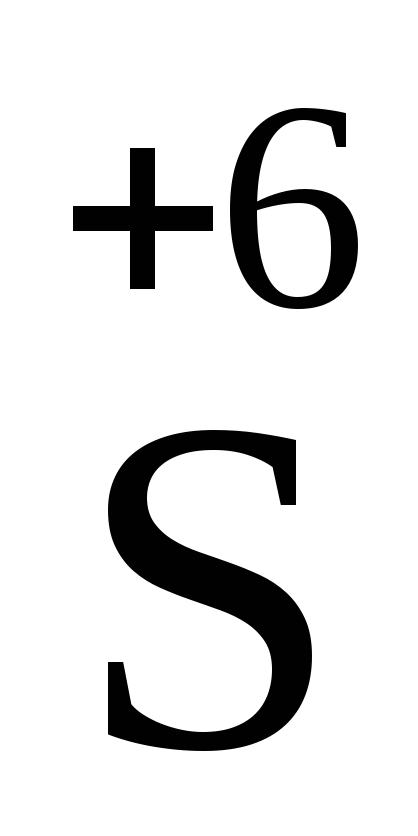 из молекулH2SO4 может
забрать у металла не только два электрона
(и перейти в
из молекулH2SO4 может
забрать у металла не только два электрона
(и перейти в  ),
но и шесть электронов (и перейти в
),
но и шесть электронов (и перейти в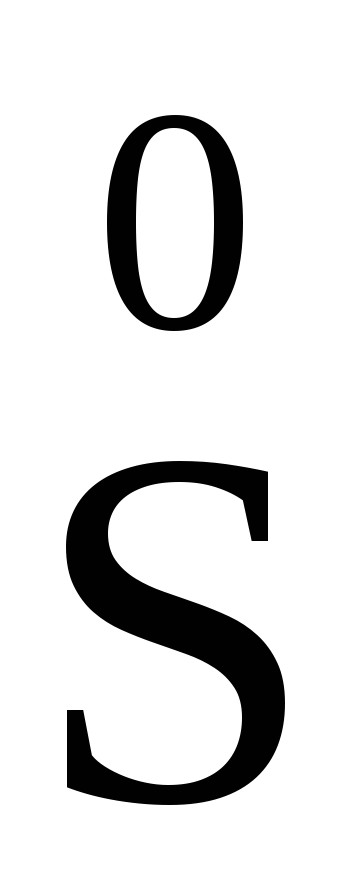 )
и даже восемь (и перейти в
)
и даже восемь (и перейти в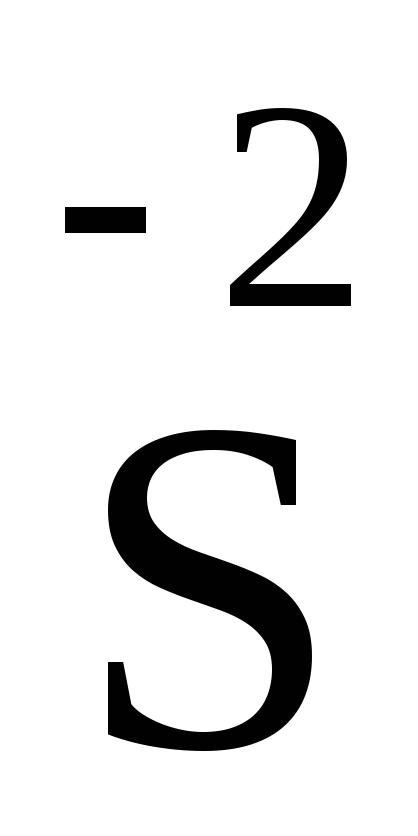 ):
):
Zn + 2H2SO4(конц) = ZnSO4 + SO2 + 2H2O,
3Zn + 4H2SO4(конц) = 3ZnSO4 + S + 4H2O,
4Zn + 5H2SO4(конц) = 4ZnSO4 + H2S + 4H2O.
Свинец с концентрированной серной кислотой взаимодействует с образованием растворимого гидросульфата свинца (II), оксида серы (IV) и воды:
Pb + 3H2SO4 = Pb(HSO4)2 + SO2↑ + 2H2O.
Холодная H2SO4(конц) пассивирует некоторые металлы (например, железо, хром, алюминий), что позволяет перевозить кислоту в стальной таре. При сильном нагревании концентрированная серная кислота взаимодействует и с этими металлами:
2Fe
+ 6H2SO4(конц) Fe2(SO4)3 + 3SO2 + 6H2O.
Fe2(SO4)3 + 3SO2 + 6H2O.
Взаимодействие металлов с азотной кислотой. Окислительная способность азотной кислоты определяется анионом NO3, окислительный потенциал которого значительно выше, чем ионов H+. Поэтому при взаимодействии металлов с HNO3 водород не выделяется. Нитрат-ион NO3 , имеющий в своём составе азот в степени окисления (+ 5), в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) может принимать от одного до восьми электронов. Восстановление аниона NO3 может протекать с образованием различных веществ по следующим схемам:
NO3 + 2H+ + e = NO2 + H2O,
NO3 + 4H+ + 3e = NO + 2H2O,
2NO3 + 10H+ + 8e = N2O + 5H2O,
2NO3+ 12H+ + 10e = N2 + 6H2O,
NO3+ 10H+ + 8e = NH4+ + 3H2O.
Азотная кислота обладает окислительной способностью при любой концентрации. При прочих равных условиях проявляются следующие тенденции: чем активнее металл, реагирующий с кислотой, и чем меньше концентрация раствора азотной кислоты, тем более глубоко она восстанавливается.
Это можно пояснить следующей схемой:
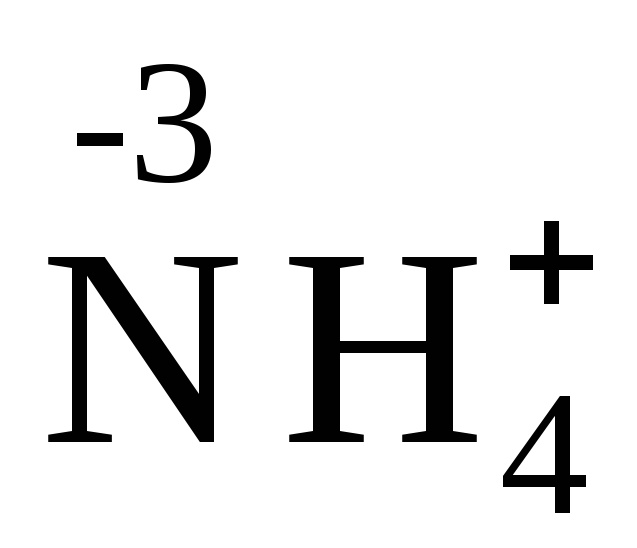 ,
,  ,
, ,
,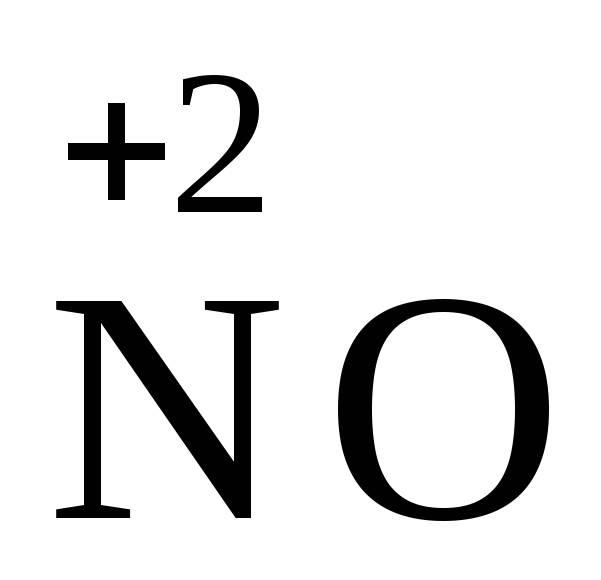 ,
,
Концентрация кислоты
Активность металла


Окисление веществ азотной кислотой сопровождается образованием смеси продуктов её восстановления (NO2, NO, N2O, N2, NH4+), состав которых определяется природой восстановителя, температурой и концентрацией кислоты. Среди продуктов преобладают оксиды NO2 и NO. Причём при взаимодействии с концентрированным раствором HNO3 чаще выделяется NO2, а с разбавленной – NO.
Уравнения окислительно-восстановительных реакций с участием HNO3 составляются условно, с включением только одного продукта восстановления, образующегося в большем количестве:
Me + HNO3 Me (NO3)n + H2O + NO2 (NO, N2O, N2, NH4+).
Например, в газовой
смеси, образующейся при действии на
достаточно активный металл цинк (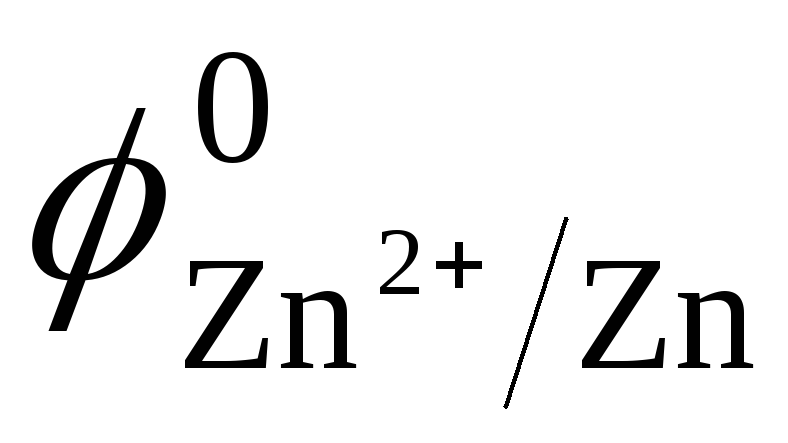 =
— 0,76 B)
концентрированной (68%-й) азотной кислоты,
преобладает – NO2,
40%-й – NO;
20%-й – N2O;
6%-й – N2.
Очень разбавленная (0,5%-я) азотная кислота
восстанавливается до ионов аммония:
=
— 0,76 B)
концентрированной (68%-й) азотной кислоты,
преобладает – NO2,
40%-й – NO;
20%-й – N2O;
6%-й – N2.
Очень разбавленная (0,5%-я) азотная кислота
восстанавливается до ионов аммония:
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2 + 2H2O,
3Zn + 8HNO3(40%) = 3Zn(NO3)2 + 2NO + 4H2O,
4Zn + 10HNO3(20%) = 4Zn(NO3)2 + N2O + 5H2O,
5Zn + 12HNO3(6%) = 5Zn(NO3)2 + N2 + 6H2O,
4Zn + 10HNO3(0,5%) = 4Zn(NO3)2 + NH4NO3 + 3H2O.
С
малоактивными металлом медью (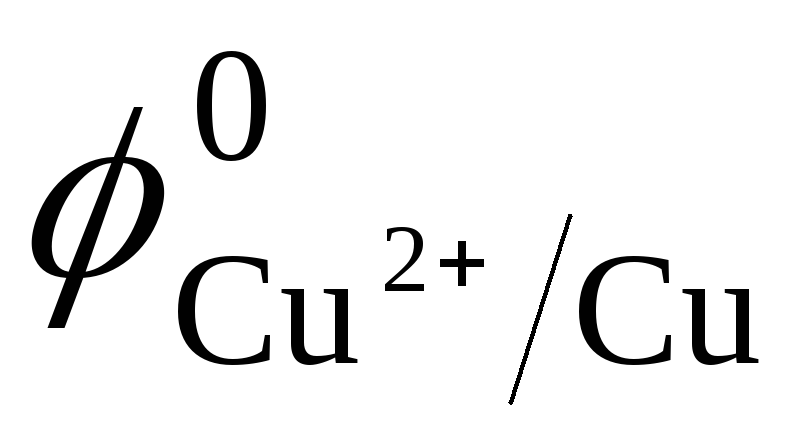 =
+ 0,34B)
реакции идут по следующим схемам:
=
+ 0,34B)
реакции идут по следующим схемам:
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 + 2H2O,
3Cu + 8HNO3 (разб) = 3 Cu(NO3)2 + 2NO + 4H2O.
В концентрированной HNO3 растворяются практически все металлы, кроме Au, Ir, Pt, Rh, Ta, W, Zr. А такие металлы как Al, Be, Bi, Co, Cr, Fe, Nb, Ni, Pb, Th, U, а также нержавеющие стали пассивируются кислотой с образованием устойчивых оксидных плёнок, плотно прилегающих к поверхности металла и защищающих его от дальнейшего окисления. Однако Al и Fe начинают растворяться при нагревании, а Cr устойчив к действию даже горячей HNO3:
Fe
+ 6HNO3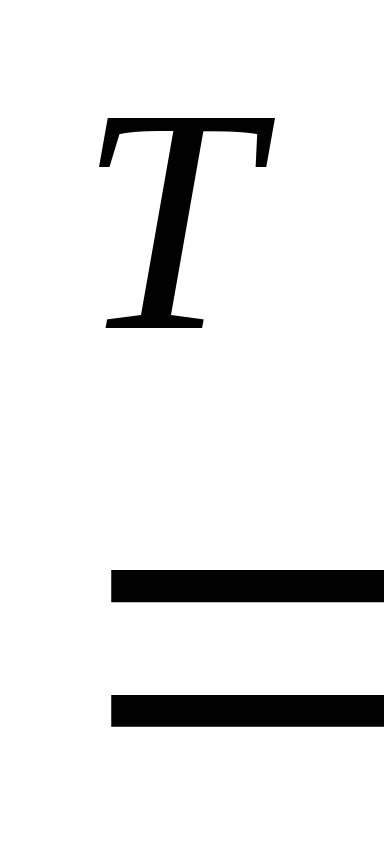 Fe(NO3)3 + 3NO2 + 3H2O.
Fe(NO3)3 + 3NO2 + 3H2O.
Металлы, для которых характерны высокие степени окисления (+6, +7, +8), с концентрированной азотной кислотой образуют кислородсодержащие кислоты. При этом HNO3 восстанавливается до NO, например:
3Re + 7HNO3 (конц) = 3HReO4 + 7NO + 2H2O.
В очень разбавленной HNO3 уже отсутствуют молекулы HNO3, существуют только ионы H+ и NO3. Поэтому очень разбавленная кислота (~ 3-5%) взаимодействует с Al и не переводит в раствор Cu и другие мало активные металлы:
8Al + 30HNO3(оченьразб) = 8Al(NO3)3 + 3NH4NO3 + 9H2O.
Смесь концентрированных азотной и соляной кислот (1:3) называется царской водкой. Она растворяет Au и платиновые металлы (Pd, Pt, Os, Ru). Например:
Au + HNO3(конц.) + 4HCl = H[AuCl4] + NO + 2H2O.
Указанные металлы растворяются в HNO3 и в присутствии других комплексообразователей, но процесс протекает очень медленно.
studfile.net
Химические свойства металлов
Химические свойства металлов
Сегодня мы с вами изучим общие химические свойства металлов.
В реакциях металлы проявляют восстановительные свойства, то есть они отдают электроны и превращаются в положительные ионы, сами при этом окисляются.
Сначала разберём реакции металлов с простыми веществами – неметаллами.
Например, с кислородом взаимодействуют практически все металлы, кроме золота и платины, при этом образуются оксиды.

Щелочные и щелочноземельные металлы при обычной температуре легко окисляются на воздухе, поэтому их обычно хранят в закрытых сосудах или под слоем масла.

Так, в реакции лития с кислородом воздуха образуется оксид лития, при этом литий повышает свою степень окисления с 0 до +1, а кислород понижает свою степень окисления с 0 до -2, литий является восстановителем, а кислород – окислителем, четыре атома лития отдают по одному электрону молекуле кислорода.
В реакции кальция с кислородом, кальций также повышает свою степень окисления с 0 до +2, а кислород понижает свою степень окисления с 0 до -2. Металл кальций выступает в роли восстановителя, а кислород – в роли окислителя, при этом два атома кальция отдают по два электрона молекуле кислорода. В результате реакции образуется оксид кальция.

Такие металлы, как алюминий, цинк, свинец при обычной температуре реагируют с кислородом воздуха, покрываясь тонкой плёнкой оксида, которая защищает их от дальнейшего окисления. Слой оксида, образующегося на поверхности алюминия, настолько тонок, что металл не теряет своего блеска. Так, в реакции алюминия с кислородом, образуется оксид алюминия, алюминий повышает свою степень окисления с 0 до +3, являясь при этом восстановителем, а кислород, наоборот, понижает свою степень окисления с 0 до -2. В этой реакции четыре атома алюминия отдают по три электрона молекуле кислорода.

Многие металлы взаимодействуют с кислородом при нагревании: например, медь при нагревании на воздухе чернеет, так как покрывается плёнкой чёрного оксида меди два.
В этой реакции медь выступает в роли восстановителя и повышает свою степень окисления с 0 до +2, а кислород – окислитель, понижает свою степень окисления с 0 до -2. При этом два атома меди отдают по два электрона молекуле кислорода.
При прокаливании железа образуется железная окалина – это смешанный оксид, который состоит из оксида железа два и оксида железа три.
Железо, в данном случае, является восстановителем, оно повышает свою степень окисления с 0 до +2 и +4, значит, железо – это восстановитель, а кислород – окислитель, он понижает свою степень окисления с 0 до -2. В этой реакции три атома железа отдают восемь электронов молекуле кислорода.

А вот магний при поджигании на воздухе сгорает яркой вспышкой, образуя оксид магния.
Магний также является восстановителем, потому что повышает свою степень окисления с 0 до +2, а кислород понижает свою степень окисления с 0 до -2 и является окислителем. В результате реакции образуется оксид магния, а два атома магния отдают по два электрона молекуле кислорода.

Таким образом, большинство металлов реагируют с кислородом с образованием оксидов, активные металлы вступают во взаимодействие с кислородом при обычных условиях, менее активные при нагревании, а такие, как золото или платина не реагируют с кислородом.
Металлы в этих реакциях являются восстановителями и, соответственно, повышают свою степень окисления, а кислород является окислителем и понижает свою степень окисления.
С серой все металлы, кроме золота, способны взаимодействовать при незначительном нагревании, образуя сульфиды:

В реакции натрия с серой образуется сульфид натрия, натрий повышает свою степень окисления с 0 до +2, он является восстановителем, сера является окислителем и понижает свою степень с 0 до -2. В результате взаимодействия два атома натрия отдают по одному электрону молекуле серы.
В реакции кальция с серой образуется сульфид кальция, кальций также повышает свою степень окисления с 0 до +2, являясь при этом восстановителем, а сера понижает свою степень окисления с 0 до -2 и является окислителем, при этом, каждый атом кальция отдаёт по два электрона молекуле серы.
А в реакции железа с серой образуется сульфид железа два. Здесь также железо является восстановителем, повышает свою степень окисления с 0 до +2, а серя, являясь окислителем, понижает свою степень окисления с 0 до -2. Каждый атом железа здесь отдаёт по два электрона молекуле серы.

Если смешать небольшое количество порошка алюминия с порошком серы и нагреть сверху смесь пламенем лучинки, то в результате бурной реакции образуется сульфид алюминия:
Алюминий выступает в роли восстановителя и повышает свою степень окисления с 0 до +3, а сера понижает свою степень окисления с 0 до -2 и является окислителем. В этой реакции два атома алюминия отдают по три электрона молекуле серы.

Таким образом, с серой при определённых условиях реагируют все металлы кроме золота, в результате этого взаимодействия образуются сульфиды, в которых степень окисления серы равна мину двум. В этих реакциях металлы выступают в роли восстановителей, а сера – в роли окислителя.
C фтором, хлором, бромом и йодом – металлы реагируют с образованием галогенидов.

Так, в реакции алюминия с йодом образуется йодид алюминия, а катализатором в этой реакции является вода.
В этой реакции алюминий также повышает свою степень окисления с 0 до +4, являясь при этом восстановителем, а йод является окислителем и понижает свою степень окисления с 0 до -1. При этом два атома алюминия отдают по три электрона молекуле йода.

Таким образом, в реакциях с галогенами, металлы являются восстановителями и повышают свою степень окисления, а сами галогены являются окислителями и понижают свою степень окисления, при этом металлы окисляются, а галогены восстанавливаются. В результате этих реакций образуются галогениды.
Металлы не только реагируют с неметаллами – простыми веществами, но и вступают в реакции со сложными веществами.
Например, с водой эффективно реагируют щелочные и щелочноземельные металлы. Если натрий поместить в ёмкость с водой, в которую добавили несколько капель фенолфталеина, то он будет двигаться по поверхности воды, бурно реагируя с ней. При этом выделяется водород и образуется гидроксид натрия, окрашивающий фенолфталеин в малиновый цвет.
Металлический натрий выступает в качестве восстановителя, он повышает свою степень окисления с 0 до +1, а ионы водорода выступают в качестве окислителя и водород понижает свою степень окисления с +1 до 0. В этой реакции два атома натрия отдают по одному электрону ионам водорода.

Некоторые металлы взаимодействуют с водой при определённых условиях, например, цинк – при нагревании, железо – в раскалённом виде с парами воды. При этом образуются оксиды металлов и выделяется водород.
Так, в реакции с цинком образуется оксид цинка и водород. Цинк при этом, являясь восстановителем, повышает свою степень окисления с 0 до +2 и отдаёт по два электрона ионам водорода. Катионы водорода выступают в роли окислителя и понижают свою степень окисления с +1 до 0. В реакции с железом, аналогично, железо является восстановителем, повышает свою степень окисления с 0 до +2 и +3, при этом три атома железа отдают по восемь электронов ионам водорода, а ионы водорода понижают свою степень окисления с +1 до 0 и являются окислителями.

Если металл стоит в ряду активности после водорода, то он не вытесняет водород из воды ни при каких условиях.

Таким образом, щелочные и щелочноземельные металлы реагируют с водой с образованием щелочей, при этом выделяется водород, некоторые металлы реагируют с водой только при нагревании, при этом образуются оксиды и выделяется водород, а металлы, стоящие в ряду активности после водорода не реагируют с водой. В этих реакциях металлы выступают в роли восстановителей, а ионы водорода – в роли окислителя.
Металлы реагируют и с кислотами. Активность металлов при взаимодействии с растворами кислот зависит от положения металла в ряду активности. Металлы, стоящие в ряду активности до водорода, способны вытеснять водород из разбавленных растворов кислот.
Следует учитывать и следующее металл реагирует с кислотой:
· металл должен стоять в ряду активности до водорода
· если образуется растворимая соль
· концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами, при этом водород не выделяется
· на щелочные металлы это правило не распространяется, так как они реагируют активно с водой, а речь в данном случае идёт о растворах кислот
Например, в реакции магния с раствором серной кислоты, магний выступает в роли восстановителя, а ионы водорода в качестве окислителя.
При этом магний повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0. Каждый атом магния отдаёт по два электрона ионам водорода.
Металлы, стоящие в ряду активности после водорода, к такому взаимодействию не способны:
Например, медь стоит в ряду активности после водорода, поэтому она не реагирует с раствором соляной кислоты.

Если налить в две пробирки растворы кислот: в первую – раствор соляной кислоты, во вторую – раствор серной кислоты, а затем поместить в каждую по грануле цинка, то в результате у нас появляются пузырьки газа и в первой, и во второй пробирке. Значит, цинк стоит в ряду активности металлов до водорода, поэтому он способен вытеснять водород из раствора кислот.
Цинк в обеих реакциях является восстановителем, он повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0, при этом выступая в роли окислителя. В этих двух реакциях атом цинк отдаёт по два электрона ионам водорода.

Следует помнить, что металлы, стоящие в ряду активности до водорода, реагируют с растворами кислот, но в результате этих реакций должна образоваться растворимая соль, на щелочные металлы эти правила не распространяются, концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами.
Металлы реагируют с растворами солей, при этом нужно также использовать ряд активности металлов: более активный металл способен вытеснять другой металл из раствора соли, однако при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, потому что они реагируют с водой, а реакции эти протекают в растворе.
Если в две пробирки налить раствора сульфата меди (II) и поместить в первую кусочек железа, а во вторую гранулу цинка, то реакция будет у нас идти в двух пробирках. На кусочке железа и грануле цинка оседает медь и раствор сульфата (II) изменяет свою окраску: в первой пробирке – на жёлтую, во второй – с голубой на более светлую.
В этой реакции железо выступает в роли восстановителя, само при этом окисляясь. Атомы железа превращаются в ионы железа. Ионы меди выступают в роли окислителя, они восстанавливаются, превращаясь в атомы меди. В результате окислительно-восстановительной реакции электроны от атомов железа переходят к ионам меди.
Во второй реакции, в роли восстановителя выступает цинк, сам он окисляется, атомы цинка превращаются в ионы цинка, ионы меди выступают в роли окислителя, ионы меди восстанавливаются и превращаются в атомы меди, электроны от атомов цинка переходят к ионам меди.

Следовательно, металлы реагируют и с растворами кислот, но нужно помнить, что каждый металл вытесняет из раствора соли другой металл, стоящий правее него в ряду напряжений металлов, при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, так как они реагируют с водой.
Сделаем вывод:
· металлы реагируют с простыми веществами, такими, как:
· кислород
· сера
· галогены
· со сложными:
· вода
· кислоты
· соли
videouroki.net
|
3. Вода |
Только щелочные и щелочноземельные металлы реагируют с водой с образованием щелочей: Ca + 2H2O → Ca(OH)2 + H2 (комн. темп) Исключение: Mg + 2H2O → Mg(OH)2 + H2 (нагревание) |
Только галогены реагируют с водой, но для ОГЭ этих реакций знать не нужно |
4. Оксиды: 1) Основные
2) Амфотерные
3) Кислотные
|
–
Fe2O3 + 2Al → 2Fe + Al2O3 Cr2O3 + 2Al → 2Cr + Al2O3
CO2 + Mg → MgO + C SiO2 + 2Mg → 2MgO + Si |
CuO + C → Cu + CO CuO + H2 → Cu + H2O
Fe2O3 + 3C → 2Fe + 3CO Fe2O3 + 3H2 → 2Fe + 3H2O
CO2 + C → 2CO В других случаях кислотные оксиды с неметаллами не реагируют. |
5. Основания: 1) Растворимые (щелочи)
2)Нерастворимые |
Только с Al, Be и Zn: 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 Fe и Cr не реагируют с щелочами
|
Только P, S, галогены и Si реагируют с щелочами (водород выделяется только в случае Si)
– |
6. Кислоты: 1) неокислители
2) окислители: H2SO4 (конц). И HNO3 (любой концентрации)
|
Только с металлами до H2 в ряду напряжений металлов: Fe + 2HCl → FeCl2 + H2
Реагируют со всеми металлами кроме Au и Pt Cu + 2H2SO4(к) → CuSO4 + SO2 + 2H2O 3Cu + 8HNO3(р) → 3Сu(NO3)2 + 2NO + 4H2O Cu + 4HNO3(к) → Сu(NO3)2 + 2NO2 + 2H2O
Концентрированные кислоты-окислители при tкомн. пассивируют Al, Cr, Fe, Ni. |
–
Образование оксидов, кислот: 2H2SO4 (к) + C → CO2 + 2SO2 + 2H2O 4HNO3(р) + 3C → 3CO2 + 4NO + 2H2O 4HNO3(к, гор.) + C → CO2 + 4NO2 + 2H2O
|
7. Соли: 1) растворимые
2) нерастворимые |
Если металл (например, Fe) левее металла в составе соли (Cu) в ряду напряжений: CuSO4 + Fe → FeSO4 + Cu – |
–
|
chemrise.ru
Физические и химические свойства металлов
Металлы широко распространены в природе и могут встречаться в различном виде: в самородном состоянии (Ag, Au, Rt, Cu), в виде оксидов (Fe3O4, Fe2O3, (NaK)2O×AlO3), солей (KCl, BaSO4, Ca3(PO4)2), а также сопутствуют различным минералам (Cd – цинковые руды, Nb, Tl – оловянные и т.д.).
Физические свойства металлов
Всем металлам присущи металлический блеск (однако In и Ag отражают свет лучше других металлов), твердость (самый твердый металл – Cr, самые мягкие металлы – щелочные), пластичность (в ряду Au, Ag, Cu, Sn, Pb, Zn, Fe наблюдается уменьшение пластичности), ковкость, плотность (самый легкий металл – Li, самый тяжелый – Os), тепло – и электропроводность, которые уменьшаются в ряду Ag, Cu, Au, Al, W, Fe.
В зависимости от температуры кипения все металлы подразделяют на тугоплавкие (Tкип > 1000С) и легкоплавкие (Tкип < 1000С). Примером тугоплавких металлов может быть – Au, Cu, Ni, W, легкоплавких – Hg, K, Al, Zn.
Среди металлов присутствуют s-, p-, d- и f-элементы. Так, s- элементы – это металлы I и II групп Периодической системы (ns1, ns2), р- элементы – металлы, расположенные в группах III – VI (ns2np1-4). Металлы d-элементы имеют большее число валентных электронов по сравнению с металлами s- и p-элементами. Общая электронная конфигурация валентных электронов металлов d-элементов – (n-1)d1-10ns2. Начиная с 6 периода появляются металлы f-элементы, которые объединены в семейства по 14 элементов (за счет сходных химических свойств) и носят особые названия лантаноидов и актиноидов. Общая электронная конфигурация валентных электронов металлов f-элементов – (n-2)f1-14(n-1)d0-1ns2.
Химические свойства металлов
Металлы способны реагировать с простыми веществами, такими как кислород (реакция горения), галогены, азот, сера, водород, фосфором и углеродом:
2Al + 3/2 O2 = Al2O3 (оксид алюминия)
2Na + Cl2 = 2NaCl (хлорид натрия)
6Li + N2 = 2Li3N (азид лития)
2Li+2C = Li2C2 (карбид лития)
2K +S = K2S (сульфид калия)
2Na + H2 = NaH (гидрид натрия)
3Ca + 2P = Ca3P2 (фосфид кальция)
Металлы взаимодействуют друг с другом, образуя интерметаллические соединения:
3Cu + Au = Cu3Au
Щелочные и некоторые щелочноземельные металлы (Ca, Sr, Ba) взаимодействуют с водой с образованием гидроксидов:
Ba + 2H2O = Ba(OH)2 + H2↑
2Na + 2H2O = 2NaOH + H2↑
В ОВР металлы являются восстановителями – отдают валентные электроны и превращаются в катионы. Восстановительная способность металла — его положение в электрохимическом ряду напряжений металлов. Так, чем левее в ряду напряжений стоит металл, тем более сильные восстановительные свойства он проявляет.
Металлы, стоящие в ряду активности до водорода способны реагировать с кислотами:
2Al + 6HCl = 2AlCl3 + 3 H2↑
Zn + 2HCl = ZnCl2 + 2H2↑
Fe + H2SO4 = FeSO4 + H2↑
Получение металлов
Щелочные, щелочноземельные металлы и алюминий получают электролизом расплавов солей или оксидов этих элементов:
2NaCl = 2Na + Cl2↑
CaCl2 = Ca + Cl2↑
2Al2O3 = 4Al + 3O2↑
Тяжелые металлы получают восстановлением из руд при высоких температурах и в присутствии катализатора (пирометаллургия) (1) или восстановлением из солей в растворе (гидрометаллургия) (2):
Cu2O + C = 2Cu + CO (1)
CuSO4 + Fe = Cu + FeSO4 (2)
Некоторые металлы получают термическим разложением их неустойчивых соединений:
Ni(CO)4 = Ni + 4CO
Примеры решения задач
ru.solverbook.com
Характерные химические свойства щелочных металлов » HimEge.ru
•Восстановительная способность увеличивается в ряду ––Li–Na–K–Rb–Cs.
•Все соединения щелочных металлов имеют ионный характер.
•Практически все соли растворимы в воде.
•Вследствие своей активности щелочные металлы хранят под слоем керосина, чтобы преградить доступ воздуха и влаги. Литий очень легкий и в керосине всплывает на поверхность, поэтому его хранят под слоем вазелином.
1. Щелочные металлы активно взаимодействуют с водой:
2Na + 2H2O → 2NaOH + H2
2Li + 2H2O → 2LiOH + H2
2. Реакция щелочных металлов с кислородом:
4Li + O2 → 2Li2O (оксид лития)
2Na + O2 → Na2O2 ( пероксид натрия)
K + O2 → KO2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
2Li + Cl2 → 2LiCl (галогениды)
2Na + S → Na2S (сульфиды)
2Na + H2 → 2NaH (гидриды)
6Li + N2 → 2Li3N (нитриды)
2Li + 2C → Li2C2 (карбиды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH3 = 2LiNH2 + H2
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2;
2K + 2C6H5OH = 2C6H5OK + H2;
7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
Li+ – карминово-красный
Na+ – желтый
K+, Rb+ и Cs+ – фиолетовый
Получение щелочных металлов
Металлические литий, натрий и калий получают электролизом расплава солей (хлоридов), а рубидий и цезий – восстановлением в вакууме при нагревании их хлоридов кальцием: 2CsCl+Ca=2Cs+CaCl2
В небольших масштабах используется также вакуум-термическое получение натрия и калия:
2NaCl+CaC2=2Na+CaCl2+2C;
4KCl+4CaO+Si=4K+2CaCl2+Ca2SiO4.
Активные щелочные металлы выделяются в вакуум-термических процессах благодаря своей высокой летучести (их пары удаляются из зоны реакции).
Особенности химических свойств s-элементов I группы и их физиологическое действие
Электронная конфигурация атома лития 1s22s1 . У него самый большой во 2-м периоде атомный радиус, что облегчает отрыв валентного электрона и возникновение иона Li+ со стабильной конфигурацией инертного газа (гелия). Следовательно, его соединения образуются с передачей электрона от лития к другому атому и возникновением ионной связи с небольшой долей ковалентности. Литий ‑ типичный металлический элемент. В виде вещества это щелочной металл. От других членов I группы он отличается малыми размерами и наименьшей, по сравнению с ними, активностью. В этом отношении он напоминает расположенный по диагонали от Li элемент II группы ‑ магний. В растворах ион Li+ сильно сольватирован; его окружают несколько десятков молекул воды. Литий по величине энергии сольватации — присоединения молекул растворителя, стоит ближе к протону, чем к катионам щелочных металлов.
Малый размер иона Li+, высокий заряд ядра и всего два электрона создают условия для возникновения вокруг этой частицы довольно значительного поля положительного заряда, поэтому в растворах к нему притягивается значительное число молекул полярных растворителей и его координационное число велико, металл способен образовывать значительное число литийорганических соединений.
Натрием начинается 3-й период, поэтому у него на внешнем уровне всего 1е—, занимающий 3s-орбиталь. Радиус атома Na — наибольший в 3-м периоде. Эти две особенности определяют характер элемента. Его электронная конфигурация 1s22s22p63s1. Единственная степень окисления натрия +1. Электроотрицательность его очень мала, поэтому в соединениях натрий присутствует только в виде положительно заряженного иона и придает химической связи ионный характер. По размеру ион Na+ значительно больше, чем Li+, и сольватация его не так велика. Однако в растворе в свободном виде он не существует.
Физиологическое значение ионов К+ и Na+ связано с их различной адсорбируемостью на поверхности компонентов, входящих в состав земной коры. Соединения натрия лишь незначительно подвержены адсорбции, в то время как соединения калия прочно удерживаются глиной и другими веществами. Мембраны клеток, являясь поверхностью раздела клетка ‑ среда, проницаемы для ионов К+, вследствие чего внутриклеточная концентрация К+ значительно выше, чем ионов Na+ . В то же время в плазме крови концентрация Na+ превышает содержание в ней калия. С этим обстоятельством связывают возникновение мембранного потенциала клеток. Ионы К+ и Na+ ‑ одни из основных компонентов жидкой фазы организма. Их соотношение с ионами Са2+ строго определенно, а его нарушение приводит к патологии. Введение ионов Na+ в организм не оказывает заметного вредного влияния. Повышение же содержания ионов К+ вредно, но в обычных условиях рост его концентрации никогда не достигает опасных величин. Влияние ионов Rb+, Cs+, Li+ еще недостаточно изучено.
Из различных поражений, связанных с применением соединений щелочных металлов, чаще всего встречаются ожоги растворами гидроксидов. Действие щелочей связано с растворением в них белков кожи и образованием щелочных альбуминатов. Щелочь вновь выделяется в результате их гидролиза и действует на более глубокие слои организма, вызывая появление язв. Ногти под влиянием щелочей становятся тусклыми и ломкими. Поражение глаз, даже очень разбавленными растворами щелочей, сопровождается не только поверхностными разрушениями, но нарушениями более глубоких участков глаза (радужной оболочки) и приводит к слепоте. При гидролизе амидов щелочных металлов одновременно образуется щелочь и аммиак, вызывающие трахеобронхит фибринозного типа и воспаление легких.
Калий был получен Г. Дэви практически одновременно с натрием в 1807 г. при электролизе влажного гидроксида калия. От названия этого соединения ‑ «едкое кали» и получил свое наименование элемент. Свойства калия заметно отличаются от свойств натрия, что обусловлено различием величин радиусов их атомов и ионов. В соединениях калия связь более ионная, а в виде иона К+ он обладает меньшим поляризующим действием, чем натрий, из-за больших размеров. Природная смесь состоит из трех изотопов 39К, 40К, 41К. Один из них 40К ‑ радиоактивен и определенная доля радиоактивности минералов и почвы связана с присутствием этого изотопа. Его период полураспада велик ‑ 1,32 млрд. лет. Определить присутствие калия в образце довольно легко: пары металла и его соединения окрашивают пламя в фиолетово-красный цвет. Спектр элемента довольно прост и доказывает наличие 1е— на 4s-орбитали. Изучение его послужило одним из оснований для нахождения общих закономерностей в строении спектров.
В 1861 г. при исследовании соли минеральных источников спектральным анализом Роберт Бунзен обнаружил новый элемент. Его наличие доказывалось темно-красными линиями в спектре, которых не давали другие элементы. По цвету этих линий элемент и был назван рубидием (rubidus—темно-красный). В 1863 г. Р. Бунзен получил этот металл и в чистом виде восстановлением тартрата рубидия (виннокислой соли) сажей. Особенностью элемента является легкая возбудимость его атомов. Электронная эмиссия у него появляется под действием красных лучей видимого спектра. Это связано с небольшой разницей в энергиях атомных 4d и 5s-орбиталей. Из всех щелочных элементов, имеющих стабильные изотопы, рубидию (как и цезию) принадлежит один из самых больших атомных радиусов и маленький потенциал ионизации. Такие параметры определяют характер элемента: высокую электроположительность, чрезвычайную химическую активность, низкую температуру плавления (390C) и малую устойчивость к внешним воздействиям.
Открытие цезия, как и рубидия, связано со спектральным анализом. В 1860 г. Р.Бунзен обнаружил две яркие голубые линии в спектре, не принадлежащие ни одному известному к тому времени элементу. Отсюда произошло и название «цезиус» (caesius), что значит небесно-голубой. Это последний элемент подгруппы щелочных металлов, который ещё встречается в измеримых количествах. Наибольший атомный радиус и наименьшие первые потенциалы ионизации определяют характер и поведение этого элемента. Он обладает ярко выраженной электроположительностью и ярко выраженными металлическими качествами. Стремление отдать внешний 6s-электрон приводит к тому, что все его реакции протекают исключительно бурно. Небольшая разница в энергиях атомных 5d- и 6s-орбиталей обусловливает легкую возбудимость атомов. Электронная эмиссия у цезия наблюдается под действием невидимых инфракрасных лучей (тепловых). Указанная особенность структуры атома определяет хорошую электрическую проводимость тока. Все это делает цезий незаменимым в электронных приборах. В последнее время все больше внимания уделяется цезиевой плазме как топливу будущего и в связи с решением проблемы термоядерного синтеза.
На воздухе литий активно реагирует не только с кислородом, но и с азотом и покрывается пленкой, состоящей из Li3N (до 75%) и Li2O. Остальные щелочные металлы образуют пероксиды (Na2O2) и надпероксиды (K2O4 или KO2).
Перечисленные вещества реагируют с водой:
Li3N + 3 H2O = 3 LiOH + NH3 ;
Na2O2 + 2 H2O = 2 NaOH + H2O2 ;
K2O4 + 2 H2O = 2 KOH + H2O2 + O2 .
Для регенерации воздуха на подводных лодках и космических кораблях, в изолирующих противогазах и дыхательных аппаратах боевых пловцов (подводных диверсантов) использовалась смесь «оксон»:
Na2O2+CO2=Na2CO3+0,5O2 ;
K2O4 + CO2 = K2CO3+ 1,5 O2 .
В настоящее время это стандартная начинка регенерирующих патронов изолирующих противогазов для пожарных.
Щелочные металлы реагируют при нагревании с водородом, образуя гидриды:
2Li+H2=2LiH.
Гидрид лития используется как сильный восстановитель.
Гидроксиды щелочных металлов разъедают стеклянную и фарфоровую посуду, их нельзя нагревать и в кварцевой посуде:
SiO2+2NaOH=Na2SiO3+H2O.
Гидроксиды натрия и калия не отщепляют воду при нагревании вплоть до температур их кипения (более 13000С). Некоторые соединения натрия называют содами:
а) кальцинированная сода, безводная сода, бельевая сода или просто сода – карбонат натрия Na2CO3;
б) кристаллическая сода – кристаллогидрат карбоната натрия Na2CO3.10H2O;
в) двууглекислая или питьевая – гидрокарбонат натрия NaHCO3;
г) гидроксид натрия NaOH называют каустической содой или каустиком.
himege.ru
общая характеристика, строение; свойства и получение — урок. Химия, 8–9 класс.
Щелочноземельными металлами называют \(4\) химических элемента \(I\)\(I\)\(A\) группы Периодической системы Д. И. Менделеева, начиная с кальция:
кальций \(Ca\), стронций \(Sr\), барий \(Ba\), радий \(Ra\).
Электронное строение атомов
На внешнем энергетическом уровне атомы металлов \(IIA\) группы имеют два электрона.
Поэтому для всех щелочноземельных металлов характерна степень окисления \(+2\).
Этим объясняется сходство их свойств.
Для металлов \(I\)\(I\)\(A\) группы (сверху вниз) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Нахождение в природе
Из щелочноземельных металлов кальций наиболее широко распространён в природе, а радиоактивный радий — менее всего.
Все щелочноземельные металлы обладают высокой химической активностью, поэтому встречаются в природе только в виде соединений.
Основными источниками кальция являются его карбонаты CaCO3 (мел, мрамор, известняк).
В свободном виде простые вещества представляют собой типичные металлы от серого до серебристого цвета.
Физические свойства простых веществ
В твёрдом агрегатном состоянии атомы связаны металлической связью. Это обусловливает общие физические свойства простых веществ металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
Тем не менее, металлы \(I\)\(I\)\(A\) группы имеют разные значения температуры плавления, плотности и других физических свойств.
Химические свойства
Щелочноземельные металлы обладают высокой химической активностью, реагируют с кислородом, водородом, другими неметаллами, оксидами, кислотами, солями.
Они являются сильными восстановителями.
Щелочноземельные металлы активно реагируют с:
водой, образуя соответствующие гидроксиды и выделяя водород:
Ba+2h3O=Ba(OH)2+h3↑;
кислотами, легко растворяясь в их растворах с образованием соответствующих солей:
Ba+2HCl=BaCl2+h3↑;
с неметаллами, образуя оксиды или соответствующие соли (гидриды, галогениды, сульфиды и др.):
Bа+Cl2=BаCl2,
Bа+S=BаS.
Щелочноземельные металлы получают в основном электролизом расплавов галогенидов. Чаще используются хлориды металлов.
При этом на катоде восстанавливаются катионы, а на аноде окисляются анионы.
Суммарное уравнение реакции электролиза расплава хлорида кальция:
CaCl2=Ca+Cl2↑.
www.yaklass.ru