Урок по теме «Химические свойства оснований»
Поэтому исходя из темы сразу же 1 вопрос:
? Какой класс веществ называется основания (дать определение).
О.: Основаниями, называют сложные вещества, в состав которых входят атомы металлов, соединенные с одной или несколькими гидромогруппами.
? Исходя из определения класса – оснований выведите общую формулу для этого класса веществ.
О.: Me (OH)n.
Давайте попытаемся расшифровать, что означает это запись
? Сочетание букв Me.
О.: На месте этих букв может находится химический знак любого металла из периодической таблицы. Д.И. Менделеева.
? ОН – это, что за сочетание.
О.: Группе ОН или её второе название гидроксогруппа.
? Какова валентность гидроксогруппы.
О.: Валентность гидроксогруппы постоянная и ровна I.
? Что означает буква n стоящая после гидроксогруппы.
О.: n – это индекс показывающий, число групп ОН входящих в данное соединение, он равен валентности металла образовавшего данный гидроксид.
? Руководствуясь всеми перечисленными правилами и особенностями, составьте и произнесите формулы следующих гидроксидов: гидроксид натрия, гидроксид кальция, гидроксид железа (III), гидроксид калия, гидроксид аммония, гидроксид магния.
.
Раз существует в химии целый класс веществ называемых основание, значит
известно большое количество различных оснований, для которых характерны
свои свойства, обычаев химии вещества с одинаковыми свойствами объединяют
в одну группу, или говоря другими совами классифицируют.
? Есть и такая классификация у оснований
О.: Да есть.
? Перечислите на какие группы можно разделить все основания:
? Какие основания называются амфотерными.
О.: Амфотерные – Это основания, которые могут проявлять в одних случаях свойства характерные для оснований, а в других случаях свойства характерные
для кислот.
? Согласно приведенной классификации приведите примеры оснований, на каждую группу по 2 примера.
О.:Щелочи: NaOH – гидроксид натрия, KOH – гидроксид калия.
Амфотерные:
Нерастворимые:
Обратите внимание на демонстрационном столе представлены некоторые из
представителей класса оснований, все они в твердом виде, а рядом с
растворимыми основаниями – щелочами, представлены и их растворы.
? Давайте вспомним какие же физические свойства характерны для оснований.
О.: Основания в основном твердые вещества с различной растворимостью в воде.
Свойства оснований в свете ТЭД
Прежде, чем изучать свойства оснований, давайте с вами вспомним классификацию оснований по нескольким признакам.
Классификация оснований
По растворимости в воде основания делятся на растворимые в воде, или щёлочи, к ним относятся гидроксиды металлов I A группы главной подгруппы и гидроксиды металлов II A группы главной подгруппы, таких как Ca, Sr, Ba. Все остальные основания являются нерастворимыми в воде.
В
зависимости от степени электролитической диссоциации
различают сильные основания, к ним относятся щёлочи, степень диссоциации
этих оснований стремиться к единице.
По числу гидроксогрупп основания делятся на однокислотные, у которых одна группа ОН—, например, NaOH, KOH, LiOH. Двукислотные, у которых две группы ОН—, например, Ca(OH)2, Mg(OH)2, Cu(OH)2.
Все
основания по агрегатному состоянию являются твёрдыми веществами,
имеющими различную окраску. Исключение составляет только раствор аммиака в
воде, представляющий собой всем известный нашатырный спирт. Это
основание, в отличие от других, содержит не катион металла, а катион аммония
(NH 4+)
и существует только в растворе. Он легко разлагается на аммиак и воду.
NH3 · H2O ↔ NH3↑ + H2O
Такое основание, как гидроксид кальция (Са(ОН)2) имеет белую окраску, Cu(OH)2 – голубую окраску, Ni(OH)2 – зелёную окраску, а Fe(OH)3 – красно-бурую окраску.
Основания
– это электролиты, при диссоциации которых в качестве катионов выступают
катионы металла (или аммония), а в качестве анионов – гидроксид-ионы. Число
групп ОН равно степени окисления металла. Если степень окисления металла
+1, значит, в составе основания будет 1 группа ОН, например NaOH,
1 группа ОН, т.к. степень окисления металла натрия +1, или Ba(OH) к. у металла бария степень окисления
+2.
к. у металла бария степень окисления
+2.
Наличие группы ОН обуславливает ряд общих свойств оснований: мыльность на ощупь, изменение окраски индикаторов и др.
Основания, в частности щёлочи, изменяют окраску индикаторов, т.к. при диссоциации образуют гидроксид-ионы. В присутствии щелочей лакмус изменяет свою окраску на синюю, метиловый оранжевый – на желтую, фенолфталеин – на малиновую.
Диссоциация оснований
NaOH = Na+ + OH—
Основания вступают в реакцию с кислотами.
Эти реакции относятся к реакциям обмена. В результате чего образуется соль и вода. Вспомните, если мы в стакан с гидроксидом натрия добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты, то малиновая окраска исчезает. Окраска исчезает, т.к. в
результате этой реакции образуется соль и вода. Образование соли можно легко
подтвердить: если мы на предметное стекло капнем несколько капель раствора
и выпарим, то на стекле появятся кристаллы соли.
Окраска исчезает, т.к. в
результате этой реакции образуется соль и вода. Образование соли можно легко
подтвердить: если мы на предметное стекло капнем несколько капель раствора
и выпарим, то на стекле появятся кристаллы соли.NaOH + HCl = NaCl + H2O
ОН— + Н+ = Н2О
Аналогично, и нерастворимые основания реагируют с кислотами. Получим, например, нерастворимое основание –

Fe2(SO4)3 + 6КOH = 2Fe(OH)3↓ + 3К2SO4
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Щёлочи реагируют и с оксидами неметаллов.
Каждому оксиду неметалла соответствует своя кислота, так оксиду азота (V) соответствует азотная кислота (N2O5 → HNO3), оксиду серы (IV) – сернистая кислота (SO2 → H2SO3), оксиду серы (VI) соответствует серная кислота (SO3 → H2SO4), оксиду фосфора (V) – фосфорная кислота (P2O5 → H3PO4), оксиду углерода (IV) – угольная кислота (CO2 → H2CO3) и т. д.
д.Поэтому в реакциях щелочей с оксидами неметаллов
Са(ОН)2 + СО2 = СаСО3↓ + Н2О
Са2+ + 2ОН— + СО2 = СаСО3↓ + Н2О
Эта реакция относится к реакциям обмена.
Щёлочи вступают в реакцию обмена с солями, при этом образуется новая соль и новое основание, но при этом, должны выполняться определённые условия, т.е. должен образоваться осадок или слабый электролит.
Проведём
эксперимент, для этого нальём в первую пробирку
гидроксида натрия и хлорида аммония, во вторую – гидроксида калия и сульфата
железа (III), а в третью –
гидроксида натрия и хлорида бария. Содержимое первой пробирки нагреем. В
результате появляется резкий запах аммиака. Во второй пробирке образуется
осадок бурого цвета, а в третьей пробирке изменений не произошло.
Т.о. в двух пробирках реакция прошла, т.к. выполнялись условия:
образуется осадок или слабый электролит.
Содержимое первой пробирки нагреем. В
результате появляется резкий запах аммиака. Во второй пробирке образуется
осадок бурого цвета, а в третьей пробирке изменений не произошло.
Т.о. в двух пробирках реакция прошла, т.к. выполнялись условия:
образуется осадок или слабый электролит.
NaOH + NH4Cl = NaCl + NH3↑ + H2O
OH— + NH4+ = NH3↑ + H2O
6KOH + Fe2(SO4)3 = 3K2SO4 + 2Fe(OH)3↓
6OH— + 2Fe3+ = 2Fe(OH)3↓
NaOH + BaCl2 ≠
Все
нерастворимые основания при нагревании разлагаются на оксид металла и воду.
Щёлочи этой способностью не обладают. Например, гидроксид железа (II)
разлагается на оксид железа (II)
и воду.
Например, гидроксид железа (II)
разлагается на оксид железа (II)
и воду.
Fe(OH)2 = FeO + H2O
Для подтверждения этого свойства получим нерастворимое основание гидроксида меди (II), а затем нагреем его. Для этого, в две пробирки нальём раствора сульфата меди (II), затем сюда же добавим несколько капель гидроксида натрия. У нас образуется осадок голубого цвета. Это гидроксид меди (II).
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Cu2+ + 2OH— = Cu(OH)2↓
Если
в одну из пробирок с осадком гидроксида меди (II)
добавить раствора соляной кислоты, то осадок растворяется. В результате образуется
соль и вода. В этом можно убедиться, если несколько капель раствора капнуть
на предметное стекло и выпарить, то на стекле появляются кристаллы соли.
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
Нагреем пробирку с гидроксидом меди (II). В результате образуется вещество черного цвета – это оксид меди (II). Образуется оксид меди (II), т.к. нерастворимые основания при нагревании разлагаются на оксид металла и воду.
Cu(OH)2 = CuO + H2O
Химические свойства оснований — Справочник химика 21
Важнейшее химическое свойство оснований — способность образовывать соли с кислотами. Наиример, при взаимодействии перечисленных оснований с соляной кислотой получаются хлористые соли соответствующих металлов —. хлориды натрия или меди [c.41] Важнейшее химическое свойство оснований —их способность взаимодействовать с кислотами, кислотными или амфотерными [c. 11]
11]
Они являются твердыми кристаллическими веществами. Основное химическое свойство оснований — способность взаимодействовать с кислотами и кислотными оксидами с образованием солей. Основания щелочных (Li, Na, К, Rb, s) и щелочноземельных металлов (Са, Sr, Ва) растворимы в воде и называются щелочами. Систематические названия этого типа соединений состоят из слова гидроксид и названия элемента в родительном падеже с указанием его степени окисления, если это необходимо [c.33]
Наиболее характерное химическое свойство оснований — их способность взаимодействовать с кислотами (а также с кислотными и амфотерными оксидами) с образованием солей, например [c.32]
Из других химических свойств оснований следует отметить их отношение к нагреванию многие нерастворимые основания при нагревании разлагаются с образованием соответствующего оксида и воды [c.126]
Основания. 1) Наиболее общее химическое свойство оснований все они реагируют с сильными кислотами с образованием соли и воды. Реакции между растворами щелочей и сильных кислот сводятся к соединению уже отщепленных от щелочи ионов гидроксила с отщепленными от кислоты ионами водорода в молекулы воды [c.34]
1) Наиболее общее химическое свойство оснований все они реагируют с сильными кислотами с образованием соли и воды. Реакции между растворами щелочей и сильных кислот сводятся к соединению уже отщепленных от щелочи ионов гидроксила с отщепленными от кислоты ионами водорода в молекулы воды [c.34]
Химические свойства оснований характеризуются отношением их к кислотам, кислотным оксидам и индикаторам. [c.29]
А 1. Перечислите химические свойства оснований. Приведите примеры, напишите уравнения реакций в ионной форме. [c.36]
Важнейшие химические свойства оснований обусловливаются их отношением к кислотам, кислотным оксидам и солям. [c.128]
Химические свойства оснований [c.230]
Приведите уравнения реакций, отражающие основные химические свойства оснований. [c.201]
Химические свойства оснований. I. Действие растворимых оснований на индикаторы (см. главу 4, 8). [c.61]
главу 4, 8). [c.61]
ОСНОВАНИЯ Химические свойства оснований [c.60]
Таутомерия и некоторые другие физико-химические свойства оснований [c.173]
Химические свойства оснований. Все нерастворимые в воде основания при нагревании разлагаются с образованием оксидов [c.169]
Даже чисто качественное рассмотрение роли отдельных атомов в сопряжении позволяет сделать ряд довольно важных выводов о химических свойствах оснований (рис. 3.3). В частности, те атомы, которые вносят в общую л-электронную систему два электрона— типы а и в по обозначениям рис. 3.1, — должны иметь некоторый недостаток электронов или, иными словами, на них должен быть сосредоточен частичный положительный заряд б-f. Атомы, вносящие в систему один р-электрон и имеющие на иесвязывающей орбите два электрона (по обозначениям рис. 3.1, типы б и г), должны обладать частичным отрицательным зарядом б— (рис. 3.3). В соответствии с этим первые атомы должны значи- [c. 148]
148]
Они являются твердыми, кристаллическими веществами. Основное химическое свойство оснований — способность взаимодействовать с кислотами и кислотными оксидами с образованием солей. Основания щелочных (Li, Na, К, Rb, s) и щелочноземельных металлов (Са, 8г, Ва, Ra) растворимы в воде и называются щелочами. [c.24]
Учет а-электронов и суммарное распределение электронной плотности. Многие физические свойства оснований, например ди-польные моменты, зависят и от п-электронных, и от о-электрон-ных характеристик молекулы. Очевидно, это относится также к тем химическим свойствам оснований, которые связаны с разрывами а-связей. Поэтому знание распределения а-электронов в молекуле чрезвычайно важно. На рис. 3.7 приведено распределение электронной плотности в основаниях нуклеиновых кислот для а-электронов и на рис. 3.8 — распределение суммарных зарядов . [c.155]
Установление преобладания той или иной таутомерной формы еще недостаточно для понимания химических свойств оснований. Как правило, все реакции оснований происходят в растворах и во многих из них принимают участие протонированные (катионные) или депротонированные (анионные) формы оснований. В кислой среде основания могут протонироваться путем равновесного превращения [c.177]
Как правило, все реакции оснований происходят в растворах и во многих из них принимают участие протонированные (катионные) или депротонированные (анионные) формы оснований. В кислой среде основания могут протонироваться путем равновесного превращения [c.177]
В водных растворах основания диссоциируют на положительно заряженные ионы металлов (катионы) и отрицательно заряженные ионы — гидроксильные группы (анионы). Химические свойства оснований обусловливаются наличием в них отрицательно заряженных ионов гидроксила ОН . [c.23]
Перечислите важнейшие химические свойства оснований. Приведите примеры соответствующих реакций. [c.64]
Хотя данные об относительных свойствах и реакционной способности металлоорганических соединений, приведенные в предыдущей главе, охватывают лишь немногие из имеющихся фактов, они все же указывают на необходимость обобщенной теории металл-углеродной связи, позволяющей объяснить все наблюдения и предсказать поведение этих соединений. В химии металлоорганических соединений это не менее трудно, чем в неорганической или органической химии, и даже может быть еще труднее вследствие того, что приходится иметь дело с самыми различными элементами. В настоящей главе рассматриваются молекулярные структуры с точки зрения типа образовавшейся связи, а также даются общие предсказания химических свойств, основанные на нашем понимании характера этих связей. [c.28]
В химии металлоорганических соединений это не менее трудно, чем в неорганической или органической химии, и даже может быть еще труднее вследствие того, что приходится иметь дело с самыми различными элементами. В настоящей главе рассматриваются молекулярные структуры с точки зрения типа образовавшейся связи, а также даются общие предсказания химических свойств, основанные на нашем понимании характера этих связей. [c.28]
Химические свойства. Основание умеренной силы, образующее стойкие в растворах соли с минеральными кислотами, мыла — с жирными кислотами. [c.398]
Из химических свойств оснований следует отметить их способность вступать во взаимодействие [c.19]
Химические свойства оснований. Все нерастворимь[е в воде основания, а при сильном нагревании и гидроксиды щелочноземельных металлов разлагаются с образованием оксидов. Гидроксиды щелочных металлов при нагревании не распадаются [c.230]
Детальное изучение химических особенностей самих основании и их поведения в составе нуклеозидов и нуклеотидов требует определения места этих соединений в ряду ближайших аналогов, отличающихся друг от друга какой-либо монотонно меняющейся характеристикой, например наличием разных заместителей, обладающих различными индуктивными эффектами или различным пространственным эффектом. Так, изучая какую-нибудь определенную реакцию ряда l-N-алкилзамещенных пиримидинов с разнообразными алкильными заместителями, можно было бы лучше оценить роль рибозного (или дезоксирибозного) остатка в определении химических свойств основания в составе нуклеозида или нуклеотида. Подобным подходом широко пользуются в органической химии для изучения механизмов реакций, причем оказывается, что свободная энергия активации многих реакций является линейной функцией некоторой характеристики, меняющейся от одного заместителя к другому, но постоянной для данного заместителя в разных соединениях. Данный принцип достаточно хорошо известен и формулируется как правило линейной зависимости свободных энергий. Хорошо известны частные случаи применения этого правила — уравнения Гамметта или уравнение Тафта. Они связывают реакционную способность ряда родственных соединений по отношению к одному и тому же реагенту с электронными характеристиками заместителей в этих соединениях соотношениями типа [c.
Так, изучая какую-нибудь определенную реакцию ряда l-N-алкилзамещенных пиримидинов с разнообразными алкильными заместителями, можно было бы лучше оценить роль рибозного (или дезоксирибозного) остатка в определении химических свойств основания в составе нуклеозида или нуклеотида. Подобным подходом широко пользуются в органической химии для изучения механизмов реакций, причем оказывается, что свободная энергия активации многих реакций является линейной функцией некоторой характеристики, меняющейся от одного заместителя к другому, но постоянной для данного заместителя в разных соединениях. Данный принцип достаточно хорошо известен и формулируется как правило линейной зависимости свободных энергий. Хорошо известны частные случаи применения этого правила — уравнения Гамметта или уравнение Тафта. Они связывают реакционную способность ряда родственных соединений по отношению к одному и тому же реагенту с электронными характеристиками заместителей в этих соединениях соотношениями типа [c. 205]
205]
Химические свойства. Основание, еще более слабое, чем анилин. Соли Д. разлагаются водой. ГОСТ (техн.) 194—41. [c.445]
Физические и химические свойства оснований. Реакция нейтрализации
I. Физические свойства
По своим физическим свойствам щелочи очень схожи: все они твердые, белые вещества. Правда, на воздухе гидроксиды натрия и калия поглощают пары воды и как бы расплываются. Это свойство называется гигроскопичностью. Нерастворимые в воде основания тоже твердые вещества, но могут иметь различную окраску.
Посмотрите рисунки различных оснований:
Гидроксид кальция (известковая вода)
Гидроксид кальция (известковое молоко)
Гидроксид кальция (кристаллический)
Гидроксид натрия (кристаллический)
II. Химические свойства щелочей
1). Изменяют окраску индикаторов
Изменяют окраску индикаторов
Индикаторы — вещества, позволяющие визуально определить тип среды или изменение концентрации какого-либо компонента в растворе.
Наиболее распространенными индикаторами являются:
метилоранжевый (метилоранж), фенолфталеин, лакмус
Чаще всего химики работают с универсальным индикатором, который представляет собой смесь высушенных индикаторов, нанесенных на полоску бумаги.
Сравнивая цвет полоски с эталонным (приведенным на упаковке) можно приблизительно оценить величину водородного показателя.
Стихи для запоминания окраски индикаторов
1) Индикатор лакмус — красный,
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щелочь здесь! Не будь разиней!
2) Лакмус будет в них краснеть,
Растворяться — цинк и медь.
А мелок в них, посмотри,
Вмиг пускает пузыри!
И опасны для работы
Эти жгучие КИСЛОТЫ
3) Я растворчик изучал.
Лакмус в нем синее стал.
Поглощал раствор тотчас
Кислый углекислый газ!
Про такой раствор я знаю,
Что среда в нем ЩЕЛОЧНАЯ
4) Смущает меня щелочная среда;
Краснею… Но если вокруг кислота,
И если в воде растворен я один,
Не видно меня. Я — фенолфталеин.
Ах, что же я поделаю с собой —
Ведь в щелочи я сине-голубой.
А в кислоте быть синим я не смею:
Я — лакмус, и в кислотах я краснею.
Как на прогулке от мороза,
От кислого я стану розов.
Но вид мой в щелочи смешон:
Я сразу желтый, как лимон.
(метилоранж)
|
Название индикатора |
Нейтральная среда (OH=H) |
Щелочная среда (OH>H) |
|
Лакмус |
Фиолетовый |
Синий |
|
Фенолфталеин |
Бесцветный |
Малиновый |
|
Метилоранж |
Оранжевый |
Жёлтый |
|
Универсальная индикаторная бумага |
Оранжевая |
Синяя |
Видео-опыт: “Действие щелочей на индикаторы”
Видео-опыт: “Распознавание растворов щёлочи, воды, кислоты при помощи индикатора”
Виртуальная образовательная лаборатория:“Определение характера среды раствора с помощью универсального индикатора”
Это интересно
Кто придумал индикаторы?
Современные индикаторы — фенолфталеин, метиловый оранжевый, метиловый красный — в основном продукты химического синтеза. А первый индикатор был приготовлен английским учёным Робертом Бойлем (1627 — 1691) из тропического лишайника лакмуса. Фиолетовый настой этого лишайника под действием кислот становился красным, а под действием щелочей — синим. Бойль пропитал фильтровальную бумагу этим настоем и тем самым положил начало применению индикаторной бумаги («реактивные бумажки»). Он также заметил, что и отвары цветков некоторых растений (фиалок, васильков и др.) меняют цвет в растворах кислот и щелочей. Термин «индикатор» также придумал Роберт Бойль.
А первый индикатор был приготовлен английским учёным Робертом Бойлем (1627 — 1691) из тропического лишайника лакмуса. Фиолетовый настой этого лишайника под действием кислот становился красным, а под действием щелочей — синим. Бойль пропитал фильтровальную бумагу этим настоем и тем самым положил начало применению индикаторной бумаги («реактивные бумажки»). Он также заметил, что и отвары цветков некоторых растений (фиалок, васильков и др.) меняют цвет в растворах кислот и щелочей. Термин «индикатор» также придумал Роберт Бойль.
Индикаторы из растений (в виде отваров или соков) можно приготовить и самостоятельно. В качестве сырья можно использовать ягоды черники, чёрной рябины, винограда, столовую свёклу, листья краснокочанной капусты, цветки анютиных глазок, ирисов и т. д.
Чтобы узнать, как изменяется цвет самодельного индикатора в кислой или щелочной среде, нужно взять пипеткой несколько его капель и добавлять их поочерёдно в кислый или щелочной раствор. Кислым раствором может служить столовый уксус, а щелочным — раствор стиральной соды (карбоната натрия). Так, под действием кислоты ярко-синий отвар из цветков ириса станет красным, под действием соды — зелёно-голубым.
Так, под действием кислоты ярко-синий отвар из цветков ириса станет красным, под действием соды — зелёно-голубым.
2) Взаимодействие с кислотными оксидами: Щёлочь + Кислотный оксид = Соль + Вода – реакция обмена
2KOH + CO2 = K2CO3 + H2O
Ca(OH)2 + CO2 = CaCO3 + H2O
3) Взаимодействие с кислотами: Щёлочь + Кислота = Соль + Вода
Тренажёр «Реакция нейтрализации»
Видео «Реакция нейтрализации»
4) С растворами солей, если в результате образуется осадок: Соль (раствор) + Щёлочь = Нерастворимое основание↓ + Новая соль
FeCI3 + 3NaOH = Fe(OH)3↓ + 3NaCl -реакция обмена
III. Химические свойства нерастворимых оснований
1) С кислотами — реакция обмена: Ме(OH)n↓ + Кислота = Соль + вода
2) Разлагаются при нагревании: Ме(OH)n↓ = MxOy + H2O – реакция разложения
Cu(OH)2 = CuO + H2O или 2Fe(OH)3 = Fe2O3 +3H2O
Внимание! Валентность металла в оксиде и соответствующем гидроксиде одинаковая.
IV. Химические свойства амфотерных оснований
1.Реагируют с кислотами: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
2.Реагируют со щелочами: Zn(OH)2 + 2NaOH = Na2[ Zn(OH)4] – тетрагидроксоцинкат(II) натрия
Интерактивное задание №1 LearningApps.org по теме: “Оксиды и основания”
Интерактивное задание №2 LearningApps.org по теме: “Химические свойства оснований”
Выполните тест
ЦОРы
Видео-опыт: “Действие щелочей на индикаторы”
Видео-опыт: “Распознавание растворов щёлочи, воды, кислоты при помощи индикатора”
Виртуальная образовательная лаборатория: “Определение характера среды раствора с помощью универсального индикатора”
Анимация: “Реакция нейтрализации”
Видео: «Реакция нейтрализации»
Видео: «Получение и химические свойства амфотерных гидроксидов»
Видео: «Химические свойства оснований»
Не удается найти страницу | Autodesk Knowledge Network
(* {{l10n_strings. REQUIRED_FIELD}})
REQUIRED_FIELD}})
{{l10n_strings.CREATE_NEW_COLLECTION}}*
{{l10n_strings.ADD_COLLECTION_DESCRIPTION}}
{{l10n_strings.COLLECTION_DESCRIPTION}} {{addToCollection.description.length}}/500 {{l10n_strings.TAGS}} {{$item}} {{l10n_strings.PRODUCTS}} {{l10n_strings.DRAG_TEXT}}{{l10n_strings.DRAG_TEXT_HELP}}
{{l10n_strings. LANGUAGE}}
{{$select.selected.display}}
LANGUAGE}}
{{$select.selected.display}}{{article.content_lang.display}}
{{l10n_strings.AUTHOR}}{{l10n_strings.AUTHOR_TOOLTIP_TEXT}}
{{$select.selected.display}} {{l10n_strings.CREATE_AND_ADD_TO_COLLECTION_MODAL_BUTTON}} {{l10n_strings.CREATE_A_COLLECTION_ERROR}}ГДЗ по химии 9 класс Габриелян, Остроумов, Сладков Просвещение 2020-2021 Задание: § 7 Химические свойства оснований как электролитов
На данной странице представлено детальное решение задания § 7. Химические свойства оснований как электролитов по химии для учеников 9 классa автор(ы) Габриелян, Остроумов, Сладков
Химические свойства оснований как электролитов по химии для учеников 9 классa автор(ы) Габриелян, Остроумов, Сладков
§ 7. Химические свойства оснований как электролитов
1. Характерные свойства для щелочей:
Водные растворы щелочей мылкие на ощупь.
Растворы щелочей изменяют окраску индикаторов.
Щелочи реагируют с оксидами неметаллов с образованием соли и воды.
Щелочи реагируют с солями, если образуется осадок или газ.
Характерные свойства для нерастворимых оснований: при нагревании разлагаются на соответствующих оксид металла и воду.
Для обеих групп характерна реакция с кислотами с образованием соли и воды.
2. Гидроксид-ионами обусловлены: изменение окраски индикаторов, реакция с кислотами, реакция с солями, если образуется осадок.
Катионами металла и аммония обусловлены: растворимость оснований, сильный или слабый электролит (реакция с солями, если образуется газ).
3. Условия протекания реакций между растворами щелочей и солей:
Правило Бертолле: если в результате образуется осадок, газ или вода.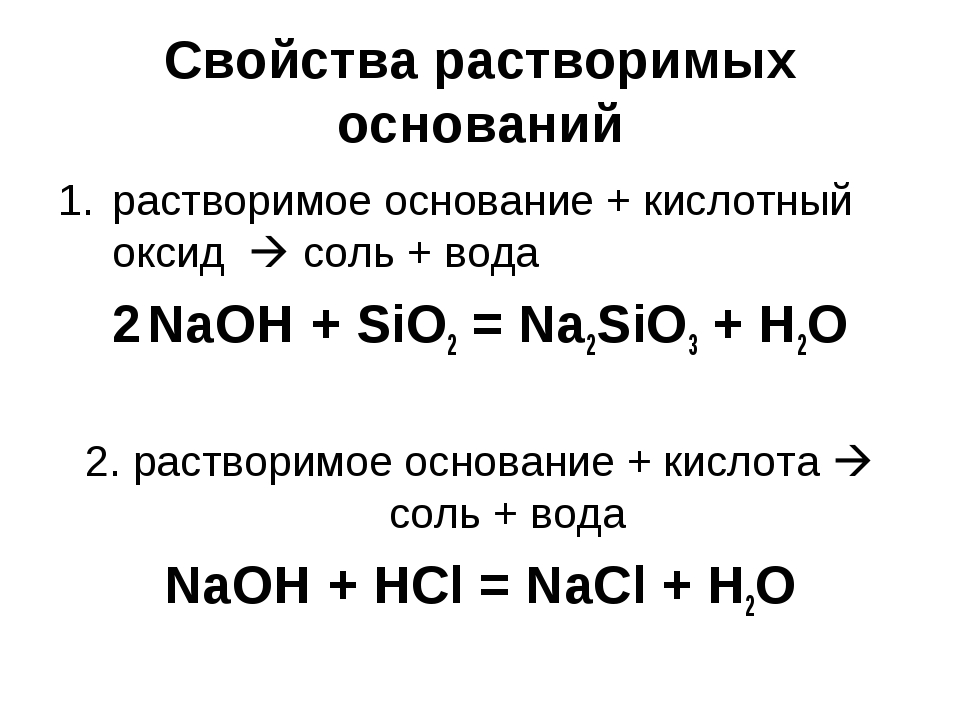
Если основание и соль растворимы.
4.
2NaOH + N2O5 = 2NaNO3 + H2O
2Na+ + 2OH— + N2O5 = 2Na+ + 2NO3— + H2O
2OH— + N2O5 = 2NO3— + H2O
Cr(OH)2 + 2HCl = CrCl2 + 2H2O
Cr(OH)2 + 2H+ + 2Cl— = Cr2+ + 2Cl— + 2H2O
Cr(OH)2 + 2H+ = Cr2+ + 2H2O
(NH4)2SO4 + 2NaOH = Na2SO4 + 2NH3↑ + 2H2O
2NH4+ + SO42- + 2Na+ + 2OH— = 2Na+ + SO42- + 2NH3↑ + 2H2O
NH4+ + OH— = NH3↑ + H2O
5.
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
CO2 + 2NaOH = Na2CO3 + H2O
2HCl + Cu(OH)2 = CuCl2 + 2H2O
6. Задача
Найти: |
|---|
7. Задача
Найти: |
|---|
Рис. 1. ГДЗ по химии 9 класс Габриелян, Остроумов, Сладков Просвещение 2020-2021 Задание: § 7 Химические свойства оснований как электролитов
Основания, их классификация. Химические свойства. Взаимодействие с оксидами неметаллов и кислотами.
ПЛАН ОТВЕТА:
1) Определение оснований.
a) Исходя из состава,
b) Как электролита.
2) Классификация оснований.
a) По растворимости в воде,
b) По силе электролита
c) По числу гидроксильных групп,
3) Химические свойства оснований.
a) Действие на индикаторы,
b) Взаимодействие с кислотными оксидами,
c) Взаимодействие с кислотами,
d) Разложение при нагревании,
e) Взаимодействие с солями.
Основания – это сложные вещества, в молекулах которых атомы металла соединены с одной или несколькими гидроксильными группами.
Основания – это электролиты, которые при диссоциации образуют в качестве анионов только гидроксид-ионы.
NaOH ® Na+ + OH—
Ca(OH)2 ® CaOH+ + OH— ® Ca2+ + 2OH——
Существует несколько признаков классификации оснований:
- В зависимости от растворимости в воде основания делят на щёлочи и нерастворимые. Щелочами являются гидроксиды щелочных металлов ( Li, Na, K, Rb, Cs) и щелочноземельных металлов ( Ca, Sr, Ba ).
 Все остальные основания являются нерастворимыми.
Все остальные основания являются нерастворимыми. - В зависимости от степени диссоциации основания делятся на сильные электролиты ( все щёлочи ) и слабые электролиты ( нерастворимые основания ).
- В зависимости от числа гидроксильных групп в молекуле основания делятся на однокислотные ( 1 группа ОН ), например, гидроксид натрия, гидроксид калия, двухкислотные ( 2 группы ОН ), например, гидроксид кальция, гидроксид меди(2), и многокислотные.
Химические свойства.
Ионы ОН— в растворе определяют щелочную среду.
- Растворы щелочей изменяют окраску индикаторов:
Фенолфталеин: бесцветный ® малиновый,
Лакмус: фиолетовый ® синий,
Метилоранж : оранжевый ® жёлтый.
- Растворы щелочей взаимодействуют с кислотными оксидами с образованием солей тех кислот, которые соответствуют реагирующим кислотным оксидам.
 В зависимости от количества щёлочи образуются средние или кислые соли. Например, при взаимодействии гидроксида кальция с оксидом углерода(IV) образуются карбонат кальция и вода:
В зависимости от количества щёлочи образуются средние или кислые соли. Например, при взаимодействии гидроксида кальция с оксидом углерода(IV) образуются карбонат кальция и вода:
Ca(OH)2 + CO2 = CaCO3? + H2O
Ca2+ + 2OH— + CO2 = CaCO3 + H2O
А при взаимодействии гидроксида кальция с избытком оксида углерода(IV) образуется гидрокарбонат кальция:
Ca(OH)2 + CO2 = Ca(HCO3)2
Ca2+ + 2OH— + CO2 = Ca2+ + 2HCO32-
- Все основания взаимодействуют с кислотами с образованием соли и воды, например: при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода:
NaOH + HCl = NaCl + H2O
Na+ + OH—+ H+ + Cl— = Na+ + Cl— + H2O
OH— + H+ = H2O.
Гидроксид меди(II) растворяется в соляной кислоте с образованием хлорида меди(II) и воды:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ + 2Cl— = Cu2+ + 2Cl— + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2О.
Реакция между кислотой и основанием называется реакцией нейтрализации.
- Нерастворимые основания при нагревании разлагаются на воду и соответствующий основанию оксид металла, например:
t0 t0
Cu(OH)2 = CuO + H2 2Fe(OH)3 = Fe2O3 + 3H2O
- Щёлочи вступают во взаимодействие с растворами солей, если выполняется одно из условий протекания реакции ионного обмена до конца ( выпадает осадок), например: при взаимодействии гидроксида натрия с раствором сульфата меди(II) образуется осадок гидроксида меди(II).

2NaOH + CuSO4 = Cu(OH)2? + Na2SO4
2OH— + Cu2+ = Cu(OH)2
Реакция протекает за счёт связывания катионов меди с гидроксид-ионами.
При взаимодействии гидроксида бария с раствором сульфата натрия образуется осадок сульфата бария.
Ba(OH)2 + Na2SO4 = BaSO4? + 2NaOH
Ba2+ + SO42- = BaSO4
Реакция протекает за счёт связывания катионов бария и и сульфат-анионов.
14.3: Основания — свойства и примеры
Цели обучения
- Изучение свойств оснований.
Возможно, вы съели слишком много пиццы и через несколько часов почувствовали себя очень некомфортно. Это чувство возникает из-за того, что вырабатывается избыток желудочной кислоты. С дискомфортом можно справиться, приняв антацид. Основание антацида вступает в реакцию с \(\ce{HCl}\) в желудке и нейтрализует его, избавляя от неприятного ощущения.
Основание антацида вступает в реакцию с \(\ce{HCl}\) в желудке и нейтрализует его, избавляя от неприятного ощущения.
Основания
Основания обладают свойствами, которые в основном контрастируют со свойствами кислот.
- Водные растворы оснований также являются электролитами. Основания могут быть как сильными, так и слабыми, как и кислоты.
- Основания часто имеют горький вкус и встречаются в пищевых продуктах реже, чем кислоты. Многие основы, такие как мыло, скользкие на ощупь.
- Базы также меняют цвет индикаторов. Лакмус в присутствии основания становится синим, а фенолфталеин — розовым.
- Основания не реагируют с металлами так, как это делают кислоты.
- Основания реагируют с кислотами с образованием соли и воды.
Внимание!
Пробовать химикаты и прикасаться к ним НЕ рекомендуется в лаборатории, и этого следует избегать, другими словами, не делайте этого дома.
Основания менее распространены в качестве пищевых продуктов, но, тем не менее, они присутствуют во многих продуктах для дома. Многие чистящие средства содержат аммиак, основание. Гидроксид натрия содержится в очистителе канализации. Антациды , которые борются с избытком желудочной кислоты, состоят из таких оснований, как гидроксид магния или гидрокарбонат натрия.Различные общие основания и соответствующие варианты использования приведены в таблице \(\PageIndex{2}\).
Некоторые общие основания | Использование |
|---|---|
| гидроксид натрия, NaOH (щелок или едкий натр) | Используется в производстве мыла и моющих средств, а также в качестве основного ингредиента в чистящих средствах для духовок и канализации. |
| гидроксид калия, KOH (щелок или едкий кали) | Используется в производстве жидкого мыла и мягкого мыла. Используется в щелочных батареях. |
| магния гидроксид, Mg(OH) 2 (магнезиальное молоко) | Используется в качестве ингредиента в слабительных, антацидах и дезодорантах. Также используется при нейтрализации кислых сточных вод. |
| гидроксид кальция, Ca(OH) 2 (гашеная известь) | Используется в производстве цемента и известковой воды.Также добавляют для нейтрализации кислой почвы. |
| гидроксид алюминия | Используется для очистки воды и в качестве компонента антацидов. |
| аммиак, NH 3 | Используется в качестве строительного блока для синтеза многих фармацевтических продуктов и во многих коммерческих чистящих средствах.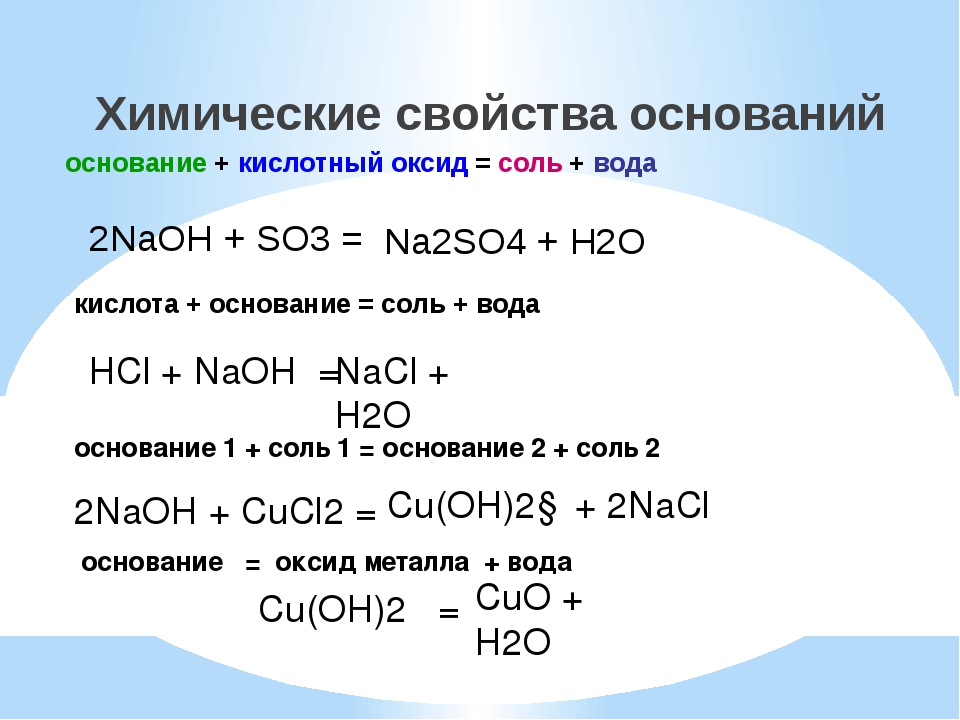 Используется в производстве удобрений. Используется в производстве удобрений. |
Гидроксид натрия
Гидроксид натрия, также известный как щелочь и каустическая сода, представляет собой неорганическое соединение с формулой \(\ce{NaOH}\).{-} (водн.)}\]
Полученный раствор обычно не имеет цвета и запаха и кажется скользким при контакте с кожей.
Гидроксид калия
Гидроксид калия представляет собой неорганическое соединение с формулой \(\ce{KOH}\), обычно называемое едким калием. Наряду с гидроксидом натрия (NaOH) это бесцветное твердое вещество является прототипом сильного основания. Он имеет множество промышленных и нишевых применений, в большинстве из которых используется его коррозионная природа и реакционная способность по отношению к кислотам.{-} (водн.)}\]
Концентрированные водные растворы иногда называют калиевыми щелочами .
Гидроксид магния
Гидроксид магния представляет собой неорганическое соединение с химической формулой \(\ce{Mg(OH)2}\). Гидроксид магния является распространенным компонентом антацидов, таких как магнезиальное молоко, а также слабительных средств.
Гидроксид магния является распространенным компонентом антацидов, таких как магнезиальное молоко, а также слабительных средств.
Это белое твердое вещество с низкой растворимостью в воде. Объединение раствора многих солей магния с щелочной водой вызывает осаждение твердого вещества \(\ce{Mg(OH)2}\).{−}(водн.) }\]
Гидроксид кальция
Гидроксид кальция (традиционно называемый гашеной известью) представляет собой неорганическое соединение с химической формулой \(\ce{Ca(OH)2}\). Это бесцветный кристалл или белый порошок. У него много названий, включая гашеную известь, едкую известь, строительную известь, гашеную известь, кальций или травильную известь. Гидроксид кальция используется во многих областях, включая приготовление пищи. Известковая вода — это общее название насыщенного раствора гидроксида кальция.
Гидроксид кальция относительно нерастворим в воде, но достаточно велик, чтобы его растворы были основными в соответствии со следующей реакцией:
\[\ce{Ca(OH)2 (т) <=> Ca^{2+}(водн. {-} (водн.)}\]
{-} (водн.)}\]
Аммиак также является строительным материалом для синтеза многих фармацевтических продуктов и используется во многих коммерческих чистящих средствах.
Резюме
- Дано краткое описание свойств оснований.
- Свойства оснований в основном контрастируют со свойствами кислот.
- Базы имеют множество различных применений.
Взносы и ссылки
Эта страница была создана на основе контента следующих авторов и отредактирована (тематически или подробно) командой разработчиков LibreTexts в соответствии со стилем, презентацией и качеством платформы:
Что такое БАЗА? — ВЕРСИЯ ДАННЫХ
BASE описывает обработку базы данных, относящуюся к базе данных NoSQL, такой как озеро данных.Согласно DAMA DMBoK, рост объемов данных и их изменчивость стимулировали философию BASE. Его популярность возросла в 2008 году. BASE обеспечивает меньшую надежность, чем ACID, но очень хорошо масштабируется и хорошо реагирует на быстрые изменения данных. БАЗОВАЯ конструкция имеет три свойства:
БАЗОВАЯ конструкция имеет три свойства:
- B базовый A доступный: система гарантированно доступна в случае сбоя.
- S часто Состояние: состояние данных может измениться без взаимодействия с приложением из-за до конечной согласованности.
- E вентуал Непротиворечивость: система в конечном итоге будет согласованной после применения. Вход. Данные будут реплицированы на разные узлы и в конечном итоге достигнут последовательное состояние. Но согласованность не гарантируется при транзакции уровень.
- «Система, обеспечивающая горизонтальное масштабирование, отказоустойчивость и высокую доступность за счет согласованности», (Akshay Pore)
- Альтернатива модели обработки данных ACID.(Дэн Притчетт)
- Модель согласованности, которая оценивает доступность с менее строгой гарантией согласованности, чем в модели базы данных ACID.
 (Neo4j)
(Neo4j) - Акроним, используемый для описания свойств определенных баз данных, обычно NoSql. (Переполнение стека)
- Создание основанной на ценности модели для организации здравоохранения из разрозненных информационных источников
- Использование приложений корзины покупок на веб-сайте
- Выявление мошеннических сетей и мошенничества
- Мониторинг безопасности сети и ИТ-инфраструктуры
- Управление и повторное использование содержимого документов
- Использование объектно-ориентированной архитектуры, встроенной в облако
- Очень быстрая обработка больших объемов неструктурированных данных
- Поддержка исследования данных
- Поиск закономерностей, например мошенничества
- Получение бизнес-понимания
- Управление данными из Интернета вещей ( IoT)
Изображение использовано по лицензии
Шаттерсток. ком
ком
Кислотные и основные свойства — Концепция
Определение кислот и оснований по Аррениусу применимо только к водным растворам. Кислота — это вещество, которое ионизируется в водных растворах с образованием ионов водорода, а основание — это вещество, которое принимает ионы водорода в водных растворах с образованием гидроксид-ионов. Определения Бренстеда-Лоури утверждают, что кислоты отдают протоны, а основания принимают протоны. Кислотные и основные свойства важны, независимо от того, какое определение мы используем.
Привет ребята. Итак, давайте обсудим кислоты и основания и начнем с основных свойств того, что такое кислота и что такое основание, поэтому кислота — это вещество, которое ионизируется в водных растворах с образованием ионов водорода, которые мы записываем как H+ и, таким образом, увеличивает концентрацию протонов в растворе.
С другой стороны, основание — это вещество, которое принимает протоны или реагирует с ними в водном растворе и поэтому образует гидроксид-ионы, поэтому вы заметите здесь, что протоны имеют заряд плюс 1, а гидроксид-ионы имеют заряд -1, поэтому два разных типа кислот и оснований.Мы можем говорить о некоторых из них, называемых аррениусами, или мы можем говорить об определениях кислотных оснований Бронстеда-Лоури, поэтому давайте сначала рассмотрим аррениус, так что это своего рода определение старой школы, и оно ограничено, потому что оно применимо только в водных растворах, что делает его применимо ко всем ситуациям, поэтому аррениусовая кислота — это вещество, которое при растворении в воде увеличивает концентрацию протонов в растворе, и наоборот, основание — это вещество, которое при растворении в воде увеличивает концентрацию гидроксид-ионов в растворе. хорошо, поэтому, когда помните, что с аррениусом это относится только к водным растворам и касается для кислоты увеличения концентрации протонов и для основания увеличения концентрации гидроксид-ионов.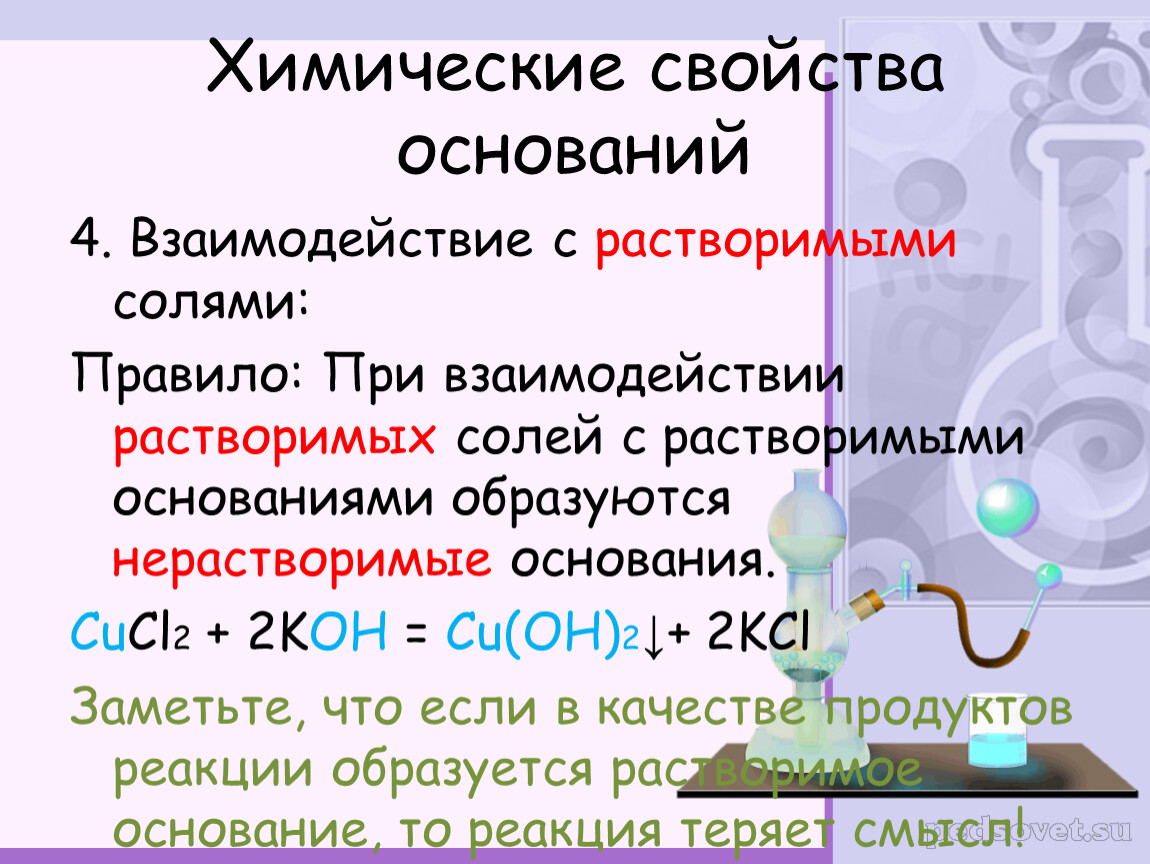
Итак, теперь давайте перейдем к разговору о бронстед-лоури, который немного более применим к большинству ситуаций, поэтому кислота бронстеда-лоури — это вещество, которое может отдавать протон другому веществу, поэтому мы называем это донором протона. Основание — это вещество, которое может принимать протон, поэтому мы называем его акцептором протона. Таким образом, бронстед-лоури применим к гораздо большему количеству реальных ситуаций, и он определяется тем, является ли кислота донором протонов, а основание — акцептором протонов, аналогично тому, когда мы говорим о реакциях окисления-восстановления, эти вещи происходят вместе, у вас есть донор протонов должен иметь акцептор протонов.
Итак, молекулы разных кислот могут ионизироваться с образованием разного количества ионов протонов, помните, что когда я говорю, что что-то ионизируется, я говорю, что оно распадается на соответствующие плюс- и минус-ионы, поэтому, например, у нас есть HCl и HNO3, так что соляная кислота и азотная кислота — две очень распространенные сильные кислоты, и вы видите, что у каждой из них есть один протон, поэтому мы называем эти монопротонные кислоты моно, что означает один протон, который может быть передан раствору, поэтому эти ребята удерживают один протон на молекулу кислоты. С другой стороны, у вас может быть двухосновная кислота, так что вот серная кислота, которая представляет собой h3SO4, что означает, что у нее есть два протона, которые нужно отдать раствору, поэтому двуосновная кислота равна двум, и она дает два протона на молекулу кислоты. Вы можете идти вверх и вверх, там есть h4PO4 различных типов кислот, но просто чтобы вы знали, что это два наиболее распространенных, с которыми вы, вероятно, соприкоснетесь в первые дни химии, и это в значительной степени основные свойства кислот и оснований. .
С другой стороны, у вас может быть двухосновная кислота, так что вот серная кислота, которая представляет собой h3SO4, что означает, что у нее есть два протона, которые нужно отдать раствору, поэтому двуосновная кислота равна двум, и она дает два протона на молекулу кислоты. Вы можете идти вверх и вверх, там есть h4PO4 различных типов кислот, но просто чтобы вы знали, что это два наиболее распространенных, с которыми вы, вероятно, соприкоснетесь в первые дни химии, и это в значительной степени основные свойства кислот и оснований. .
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Значение кислотно-основных свойств при открытии лекарств
Chem Soc Rev.Авторская рукопись; доступен в PMC 2014 Jan 21.
Опубликовано в окончательной редакции как:
PMCID: PMC3641858
NIHMSID: NIHMS421298
Факультет фармации и фармацевтических наук, Monash 381 Royal Parade, Parkville, VIC 3052, Австралия
Медицинский факультет Университета Нью-Мексико, кафедра внутренних болезней, отдел трансляционной информатики, комплекс инновационных открытий и обучения, MSC10 5550, Альбукерке, NM 87131, США
Окончательное решение издателя отредактированная версия этой статьи доступна на сайте Chem Soc Rev См. другие статьи в PMC, в которых цитируется опубликованная статья.
другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
В то время как ученые, занимающиеся открытием новых лекарств, обращают внимание на различные руководства, касающиеся свойств лекарств, влияние кислотно-щелочных свойств часто остается недостаточно изученным. Константы ионизации (значения pK и ) имеют основополагающее значение для изменчивости биофармацевтических характеристик лекарств и для основных параметров, таких как logD и растворимость. p K a значения влияют на физико-химические свойства, такие как растворимость в воде, что, в свою очередь, влияет на подходы к составлению лекарственных препаратов.Что еще более важно, абсорбция, распределение, метаболизм, экскреция и токсичность (ADMET) сильно зависят от состояния заряда соединений при различных условиях pH. Рассмотрение значений p K a в сочетании с другими молекулярными свойствами имеет большое значение и может быть использовано для дальнейшего повышения эффективности открытия лекарств. Учитывая недавний низкий ежегодный выпуск новых лекарств фармацевтическими компаниями, этот обзор будет своевременным напоминанием о важном молекулярном свойстве, влияющем на клинический успех.
Учитывая недавний низкий ежегодный выпуск новых лекарств фармацевтическими компаниями, этот обзор будет своевременным напоминанием о важном молекулярном свойстве, влияющем на клинический успех.
Введение
С экономической точки зрения стало совершенно ясно, что фармацевтические компании испытывают трудности, несмотря на увеличение расходов на исследования и разработки. К счастью, обширное доклиническое профилирование помогло снизить количество отказов от лекарств из-за плохой фармакокинетики у человека. Однако в последнее время причины выпадения лекарств из клинической разработки были основаны на коммерческих решениях, а также на проблемах с рецептурой и токсичностью.Другие факторы, такие как более строгий контроль со стороны регулирующих органов и нехватка простых (и поддающихся лечению) целей, также способствовали снижению производительности отрасли. 1 Некоторые комментаторы даже ставят под сомнение долгосрочную жизнеспособность фармацевтической промышленности.
Чтобы решить проблему высоких показателей текучести кадров и в соответствии с передовой практикой управления, анализ всего процесса разработки лекарств был необходим, чтобы помочь компаниям конкурировать в текущих условиях.Медицинские химики также принимали активное участие в изучении неэффективности лекарств, исследуя и определяя физико-химические свойства соединений, которые предсказывают успешные результаты. 1 Целью этих анализов является улучшение качества соединений, которые проходят клинические испытания, и все же есть некоторые споры о том, насколько соблюдаются эти рекомендации. 2 Оптимизация, основанная на свойствах, имеет чрезвычайно важное значение для отрасли, поскольку имеются четкие доказательства того, что работа с крупными и липофильными молекулами связана с проблемами, касающимися распущенности, метаболизма, биодоступности, оттока, растворимости и связывания с белками плазмы. 3-5
Ключевое значение для поведения лекарств имеет их кислотно-щелочной характер, который влияет на их биофармацевтические свойства и состав. При открытии лекарств часто анализируются многие физико-химические свойства, и вновь возникает интерес к профилям ионизации. 1, 4-8 В этом обзоре будет представлен обзор свойств, связанных с клиническим успехом, и их связь с кислотно-основными свойствами. В частности, мы рассмотрим, как состояние заряда влияет на взаимодействие лекарство-рецептор, фармакокинетические параметры и биофармацевтические свойства кандидатов в лекарства.
При открытии лекарств часто анализируются многие физико-химические свойства, и вновь возникает интерес к профилям ионизации. 1, 4-8 В этом обзоре будет представлен обзор свойств, связанных с клиническим успехом, и их связь с кислотно-основными свойствами. В частности, мы рассмотрим, как состояние заряда влияет на взаимодействие лекарство-рецептор, фармакокинетические параметры и биофармацевтические свойства кандидатов в лекарства.
Поиск лекарств
Имея в виду конкретное болезненное состояние, процесс поиска лекарств обычно начинается с идентификации и проверки конкретной макромолекулярной мишени. Разработка экранов позволяет тестировать соединения для выявления совпадений и потенциальных клиентов, которые соответствуют набору заранее определенных критериев, касающихся таких атрибутов, как эффективность, функциональная активность и физико-химические свойства. Если требуется пероральная биодоступность, то тестирование на этом этапе может помочь определить качество этих лигандов. Последующий процесс превращения ведущего соединения в лекарство включает многофакторную оптимизацию эффективности, селективности и биофармацевтических свойств, таких как абсорбция, распределение, метаболизм, экскреция и токсичность 1, 4 (ADMET) ().
Последующий процесс превращения ведущего соединения в лекарство включает многофакторную оптимизацию эффективности, селективности и биофармацевтических свойств, таких как абсорбция, распределение, метаболизм, экскреция и токсичность 1, 4 (ADMET) ().
Процесс открытия лекарств.
Важно отметить, что кислотно-щелочной профиль соединения оказывает прямое влияние на липофильность вещества, определяемую константами ионизации (значения p K a ) ключевых функциональных групп.Таким образом, абсолютно необходимы дальнейшие исследования и знание кислотно-щелочных профилей для исследовательских соединений, клинических кандидатов и лекарств, если мы хотим понять и контролировать липофильность. иллюстрирует четыре важных аспекта разработки лекарств, на которые влияет кислотно-основное равновесие лекарства. Действительно, кислотно-щелочной характер влияет на активность и селективность лекарственного средства и оказывает большое влияние как на фармакокинетические, так и на биофармацевтические свойства.
Диаграмма, иллюстрирующая основные свойства, на которые влияет кислотно-щелочной характер наркотиков.Каждый узел подчеркивает важный аспект открытия и разработки лекарств.
Биофармацевтические свойства
Усилия по определению физико-химических свойств, которые относятся к долгосрочной жизнеспособности соединения, были предприняты совместно со сбором биологических данных по таким атрибутам, как: клеточная токсичность, склонность к оттоку, метаболическая стабильность или ингибирование, клеточная проницаемость, биодоступность, Проницаемость ЦНС, связывание с белками, связывание с тканями головного мозга, распущенность, клиренс и объемы распределения.Вооружившись этими данными, были проведены поиски взаимосвязей с рядом простых физико-химических свойств. Большая часть этого внимания была уделена легко вычисляемым параметрам, таким как молекулярная масса (MW), ClogP, площадь полярной поверхности (PSA), количество доноров/акцепторов водородных связей, ароматический характер и количество вращающихся связей.
Одним из первых появившихся общих исследований является хорошо известная работа Lipinski et al. 9 , в которой подчеркивалось, что проблемы с пероральным всасыванием могут возникнуть, если соединение отвечает двум или более из следующих критериев: молекулярный масса > 500, ClogP > 5, доноры Н-связи > 5 и акцепторы Н-связи > 10.Более поздняя работа позволила уточнить эти рекомендации, и в этом обзоре будет освещена только часть этого исследования. Для всестороннего анализа этой темы мы отсылаем читателя к обзору Meanwell. 1
Простые расчеты ClogP можно улучшить, рассматривая состояние заряда в порядке биологически значимых значений pH. Обычно это принимает форму оценки коэффициента распределения октанол/вода при физиологическом pH (7,4), известного как ClogD 7,4 . Например, компания Pfizer также использовала большое количество внутренних данных о проницаемости клеток и клиренсе in vitro , чтобы получить полезную связь с физико-химическими свойствами. 10 Это включало нанесение биологических данных на график зависимости logD от MW, чтобы продемонстрировать, что соединения, имеющие приемлемые значения, попадают в область, называемую «золотым треугольником». Примечательно, что по мере увеличения молекулярной массы полоса липофильности становится гораздо более узкой, что может удовлетворять атрибутам приемлемой проницаемости и клиренса.
10 Это включало нанесение биологических данных на график зависимости logD от MW, чтобы продемонстрировать, что соединения, имеющие приемлемые значения, попадают в область, называемую «золотым треугольником». Примечательно, что по мере увеличения молекулярной массы полоса липофильности становится гораздо более узкой, что может удовлетворять атрибутам приемлемой проницаемости и клиренса.
Дальнейший анализ Wager et al. на препараты для ЦНС привели к методу оценки, который учитывал следующие свойства: MW, ClogP, ClogD 7.4 , количество доноров водородных связей, PSA и наиболее основных p K a . 11 Метод оценки многопараметрической оптимизации центральной нервной системы (CNSMPO) показал вероятность успешного применения соединения в клинике. Это было в первую очередь нацелено на препараты для ЦНС, но существовала общая (подобная лекарствам) взаимосвязь между оценкой и ключевыми атрибутами in vitro , такими как метаболическая стабильность, проницаемость, токсичность и отток. При исследовании особое внимание уделялось основности соединений и основным значениям p K a выше 8.4 не повлияло на общий балл CNSMPO. Важно отметить, что для определения значений ClogD 7,4 для каждого вещества требовались оценки значений p K a . Было показано, что основные молекулы с высокими значениями p K a имеют два потенциальных недостатка в качестве лекарственных средств для ЦНС. Во-первых, заряженные катионные препараты имеют пониженное проникновение через гематоэнцефалический барьер (ГЭБ). Кроме того, эти основные соединения имеют более высокую вероятность блокирования каналов hERG. В этом исследовании Вейгер и его коллеги 11 , ClogD 7.4 значений получили оптимальный диапазон от 2,0 до 4,0 для сходства с наркотиками ЦНС.
При исследовании особое внимание уделялось основности соединений и основным значениям p K a выше 8.4 не повлияло на общий балл CNSMPO. Важно отметить, что для определения значений ClogD 7,4 для каждого вещества требовались оценки значений p K a . Было показано, что основные молекулы с высокими значениями p K a имеют два потенциальных недостатка в качестве лекарственных средств для ЦНС. Во-первых, заряженные катионные препараты имеют пониженное проникновение через гематоэнцефалический барьер (ГЭБ). Кроме того, эти основные соединения имеют более высокую вероятность блокирования каналов hERG. В этом исследовании Вейгер и его коллеги 11 , ClogD 7.4 значений получили оптимальный диапазон от 2,0 до 4,0 для сходства с наркотиками ЦНС.
Руководящие принципы и наблюдения, изложенные выше, охватывают широкие характеристики лекарственных препаратов, и большинство фармацевтических компаний применяют вариации этих правил для оценки своих соединений. Этот подход направлен на повышение вероятности успеха за счет работы в областях с низким уровнем риска и раннего выявления потенциальных проблемных соединений. Опасность предоставления правил заключается в том, что им можно бездумно следовать, не полностью понимая, как их следует применять или их ограничения.Ясно, что кислотно-щелочные характеристики соединений при открытии лекарств рассматривались, однако константы ионизации, по-видимому, в значительной степени не изучались. В разделах ниже специально рассматриваются доказательства того, что кислотно-щелочные свойства влияют на определенные атрибуты поведения соединения.
Этот подход направлен на повышение вероятности успеха за счет работы в областях с низким уровнем риска и раннего выявления потенциальных проблемных соединений. Опасность предоставления правил заключается в том, что им можно бездумно следовать, не полностью понимая, как их следует применять или их ограничения.Ясно, что кислотно-щелочные характеристики соединений при открытии лекарств рассматривались, однако константы ионизации, по-видимому, в значительной степени не изучались. В разделах ниже специально рассматриваются доказательства того, что кислотно-щелочные свойства влияют на определенные атрибуты поведения соединения.
Состояние заряда
Для адекватного обсуждения состояния заряда и значений p K a необходимо указать, что подразумевается под кислотным, основным и нейтральным.Большинство исследований, обсуждаемых в этом обзоре, в которых изучались свойства состояния заряда лекарств, классифицируют соединения как кислоты, основания, нейтральные или цвиттерионные. Обычно этого достаточно, чтобы обобщить поведение соединений по отношению к их физико-химическим свойствам. 4-6, 8, 12, 13 В то время как в этой предыдущей работе для классификации каждого соединения использовались значения p K a , 4-6, 8, 12, 13 основное внимание уделялось природе соединений на физиологический рН. Что касается термина «нейтральный», соединение может иметь нейтральный заряд в своей изоэлектрической точке, даже если молекула содержит кислотную или основную функциональную группу.Напротив, соединение классифицируется здесь как нейтральное, если оно не имеет (физиологически) релевантной ионизируемой группы (кислой или основной). Поэтому основное внимание уделяется наличию кислотных и основных групп в молекуле и обсуждаемому рН. Кислота была просто классифицирована как разновидность HA, которая при pH выше p K a будет диссоциировать на анионную A-форму и протон (для простого монопротонного случая). Точно так же основное вещество можно изобразить как вид B, который будет принимать протон ниже значения p K a для образования катионных видов.
Обычно этого достаточно, чтобы обобщить поведение соединений по отношению к их физико-химическим свойствам. 4-6, 8, 12, 13 В то время как в этой предыдущей работе для классификации каждого соединения использовались значения p K a , 4-6, 8, 12, 13 основное внимание уделялось природе соединений на физиологический рН. Что касается термина «нейтральный», соединение может иметь нейтральный заряд в своей изоэлектрической точке, даже если молекула содержит кислотную или основную функциональную группу.Напротив, соединение классифицируется здесь как нейтральное, если оно не имеет (физиологически) релевантной ионизируемой группы (кислой или основной). Поэтому основное внимание уделяется наличию кислотных и основных групп в молекуле и обсуждаемому рН. Кислота была просто классифицирована как разновидность HA, которая при pH выше p K a будет диссоциировать на анионную A-форму и протон (для простого монопротонного случая). Точно так же основное вещество можно изобразить как вид B, который будет принимать протон ниже значения p K a для образования катионных видов.
Кислотная диссоциация.HA+h3O⇄A+h4O+Основная диссоциация.B+h3O⇄BH++OH
Для наших собственных исследований зарядовых состояний и p K a распределения 7 мы также определили различные ионизации категории с использованием значений p K a . Предполагалось, что наши определения будут более широкими, чтобы охватить состояния заряда в пределах диапазона значений pH, наблюдаемых как физиологически, так и тех, которые встречаются при составлении лекарственных препаратов. В дополнение к категориям, указанным выше, мы классифицировали определенные соединения как «всегда ионизированные», такие как четвертичные основания и кислоты со значениями p K a ниже 0.0 или основания со значениями pK a выше 12,0. Амфолиты также классифицировали на группы по количеству кислотных и основных групп. Простые амфолиты содержат одну кислоту и одно основание, а сложные амфолиты содержат другие комбинации кислот и оснований.
Общие кислотные группы включают: карбоксилаты, фенолы, сульфаниламиды, гетероциклические атомы азота, гидроксаматы и реже карбоновые кислоты, фосфаты, тетразолы, тиолы, спирты, кислые амиды, кислые анилины, карбаматы, гидразиды, имиды и сульфаты.С другой стороны, основания включают гетероциклические атомы азота, алифатические амины, гуанидины, амидины, анилины и основные амиды. Дополнительная информация, содержащая определение p K a , приведена в рамке 1. ), мы можем выразить константу ионизации кислоты ( K a ), используя уравнение (2). Чаще используется отрицательная логарифмическая форма константы ионизации кислоты (3).Преобразование уравнения (3) дает уравнение Хендерсона-Хассельбаха (4). Аналогичным образом мы можем использовать эти уравнения для сопряженных кислотных форм основных функциональных групп (5).
га + H 2 O ⇌ 4 + H 3 O +
(1)
BH + + H 2 O ⇌ B + H 3 O +
(5)
График, показывающий % протонированных частиц в зависимости от pH для соединения с одной кислотной группой (p K a 4. 0).
0).
График, показывающий % протонированных соединений в зависимости от pH для соединения с одной основной группой (p K a 9,0).
Всасывание, проницаемость и биодоступность
Значительные исследования были направлены на понимание факторов, влияющих на всасывание лекарств через кишечные мембраны. Ранние исследования Brodie, Hogben и соавт. 14 детализировали их «гипотезу разделения pH», которая ясно продемонстрировала влияние состояния ионизации на скорость всасывания лекарств из тонкого кишечника.В этой новаторской работе они показали, что кислоты со значениями p K a ниже 3 и основания со значениями p K a выше 8 плохо усваиваются. После этого исследования были предприняты другие исследования, в которых упоминались p K a и поведение ADME. Например, Палм и др. 15 расширил вышеприведенную работу, показав, что транспорт молекул через мембраны более быстрый для незаряженных частиц.
Пример, демонстрирующий этот принцип, был показан с серией из трех структурно родственных антагонистов рецепторов AT 1 , обладающих небольшими различиями в состоянии ионизации при pH 6.0 и 7.4. 16 При pH 7,4 все молекулы были ионизированы, что приводило к плохой проницаемости в модельных системах с использованием камер Ussing, перфузии петли тощей кишки или исследований переноса Caco-2. Наоборот, при рН 6,0 только одна молекула была в значительной степени незаряженной, и одно это соединение значительно абсорбировалось. Помимо подчеркивания осторожности, необходимой при использовании этих модельных систем, в этой работе также предлагалось уделить пристальное внимание профилям ионизации исследуемых соединений. 16
В другом примере Кастро и его коллеги 17 создали ряд соединений для решения проблемы плохого перорального всасывания соединения свинца. Свинец имел хороший профиль in vitro , однако менее 5% абсорбировалось пероральным путем. Считалось, что проблемой является основная аминогруппа со значением p K a , близким к 9,7. Были синтезированы фторированные аналоги, которые снизили значения p K a амина до 8.0 и 8.8. Последующие испытания показали значительное улучшение пероральной абсорбции фторированных производных. Увеличение всасывания было связано с более высокой долей нейтральных частиц в кишечнике.
Считалось, что проблемой является основная аминогруппа со значением p K a , близким к 9,7. Были синтезированы фторированные аналоги, которые снизили значения p K a амина до 8.0 и 8.8. Последующие испытания показали значительное улучшение пероральной абсорбции фторированных производных. Увеличение всасывания было связано с более высокой долей нейтральных частиц в кишечнике.
Уровень заряда также был отмечен Мартином как важный фактор в прогнозировании биодоступности у крыс. 12 В более крупном исследовании компания Gleeson 4 исследовала как проницаемость с использованием анализа искусственной мембраны (PAMPA), так и биодоступность большого количества соединений собственной разработки GSK.Было обнаружено, что ранговый порядок проницаемости: нейтральные > основания > цвиттер-ионы > кислоты. Это объяснялось анионной природой используемых мембран и, таким образом, объяснялось электростатическими соображениями. Исследование Глисона также показало, что биодоступность было труднее интерпретировать, чем проницаемость, поскольку в первой присутствуют компоненты как абсорбции, так и клиренса. Состояние ионизации оказывало лишь незначительное влияние на биодоступность, однако было обнаружено, что кислоты в среднем более биодоступны, что контрастировало с данными о проницаемости кислот в целом.Его исследование интересно совпало с предыдущими исследованиями, показавшими, что кислоты имеют более высокую пероральную биодоступность и, вероятно, являются результатом лучшей растворимости и более низкого клиренса. 4 Основания, как правило, протонируются в желудочно-кишечном тракте и, следовательно, имеют более высокую полярность и пониженную липофильность, что ограничивает пассивное всасывание через биомембраны.
Состояние ионизации оказывало лишь незначительное влияние на биодоступность, однако было обнаружено, что кислоты в среднем более биодоступны, что контрастировало с данными о проницаемости кислот в целом.Его исследование интересно совпало с предыдущими исследованиями, показавшими, что кислоты имеют более высокую пероральную биодоступность и, вероятно, являются результатом лучшей растворимости и более низкого клиренса. 4 Основания, как правило, протонируются в желудочно-кишечном тракте и, следовательно, имеют более высокую полярность и пониженную липофильность, что ограничивает пассивное всасывание через биомембраны.
Простая классификация соединений на кислоты и основания не принимает во внимание степень ионизации, которая рассматривалась предыдущими исследователями с использованием значений p K a . 14-16 Kubinyi 18 обобщил эту концепцию следующим заявлением:
«медицинские химики, которые не заботились о значениях pK a своих кислот или оснований, теперь хорошо осведомлены о рисках, которые возникают из-за того, что эти значения слишком далеки от 7, нейтрального значения pH».
Ясно, что когда мы рассматриваем природу мембран и их липофильный характер, приведенные выше обобщения относительно неионизированных состояний и проницаемости становятся полностью понятными.Нейтральные молекулы легче проникают через неполярную липидную среду мембраны, в отличие от заряженных соединений, где этот процесс энергетически невыгоден.
Несмотря на эти исследования и общую догму о том, что нейтральные частицы обладают большим преимуществом при пассивном переносе через мембраны, существуют данные, свидетельствующие о том, что часть заряженных молекул способна поглощаться. В одном исследовании использовали монослои клеток Caco-2, чтобы предположить, что ионные частицы могут способствовать общему транспорту лекарств. 19 Хотя Palm и др. . также показали отчетливое увеличение коэффициентов проницаемости с увеличением доли неионизированного (f(u)) лекарственного средства, они также подчеркнули, что в случаях, когда f(u) было ниже 0,1, вклад ионизированной формы был значительным. 15 Совершенно очевидно, что всасывание включает ряд процессов и усложняет нашу способность обобщать свойства лекарств. Кислотный/основной характер и значения p K a являются важными детерминантами абсорбции и проникновения, однако необходимо принимать во внимание и другие факторы, такие как: липофильность, размер, метаболическая лабильность, механизмы оттока и гидрофильность, которые были рассмотрены ранее. . 9, 20
15 Совершенно очевидно, что всасывание включает ряд процессов и усложняет нашу способность обобщать свойства лекарств. Кислотный/основной характер и значения p K a являются важными детерминантами абсорбции и проникновения, однако необходимо принимать во внимание и другие факторы, такие как: липофильность, размер, метаболическая лабильность, механизмы оттока и гидрофильность, которые были рассмотрены ранее. . 9, 20
Объем распределения, связывание с белками плазмы
Хотя лекарство может всасываться адекватно, другие свойства могут приводить к тому, что оно плохо распределяется или быстро выводится, так что оно не может вызвать адекватный фармакологический ответ. Параметр, объем распределения (V d ), является теоретическим свойством, где большие значения указывают на то, что лекарство широко распространено, в то время как малые значения (например, от 0,1 до 0,2 л/кг) предполагают, что соединение находится в основном в большом круге кровообращения. .Объем распределения является ключевым фактором, определяющим фармакокинетические свойства, и вместе с информацией о клиренсе можно определить биологический период полувыведения лекарственного средства (период полувыведения = 0,693 × V дней /клиренс). Соединения с более высокой липофильностью обычно имеют более высокие значения V d . Что еще более важно, связывание с белками плазмы крови оказывает значительное влияние на объем распределения. Плазма человека содержит более 60 белков, однако только на три из них приходится большая часть связывания лекарств: альбумин (переносит в основном анионные препараты, некоторые катионные и нейтральные препараты), α 1 -кислый гликопротеин (AAG) (катионные и нейтральные препараты) и липопротеины (катионные и нейтральные препараты). 21 Большинство вычислительных исследований, связывающих связывание белков плазмы с кислотно-основными характеристиками, были ограничены моделированием соединений с использованием следующих широких категорий при физиологическом рН: кислые, основные, нейтральные или цвиттерионные.
.Объем распределения является ключевым фактором, определяющим фармакокинетические свойства, и вместе с информацией о клиренсе можно определить биологический период полувыведения лекарственного средства (период полувыведения = 0,693 × V дней /клиренс). Соединения с более высокой липофильностью обычно имеют более высокие значения V d . Что еще более важно, связывание с белками плазмы крови оказывает значительное влияние на объем распределения. Плазма человека содержит более 60 белков, однако только на три из них приходится большая часть связывания лекарств: альбумин (переносит в основном анионные препараты, некоторые катионные и нейтральные препараты), α 1 -кислый гликопротеин (AAG) (катионные и нейтральные препараты) и липопротеины (катионные и нейтральные препараты). 21 Большинство вычислительных исследований, связывающих связывание белков плазмы с кислотно-основными характеристиками, были ограничены моделированием соединений с использованием следующих широких категорий при физиологическом рН: кислые, основные, нейтральные или цвиттерионные. 22, 23 Как правило, основные соединения имеют большие значения V d , в то время как кислотные соединения имеют меньшие значения. Таким образом, количество препарата, попадающего в печень и почки, значительно различается между кислотами и основаниями. Связанные с тканями соединения, такие как основания, склонны к взаимодействию с кислыми головными группами (фосфо)липидов, тогда как кислоты легко связываются с остатками лизина в белках плазмы крови.Недавнее исследование, проведенное в GlaxoSmithKline 4 , согласуется с этими установленными выводами, демонстрируя, что основные соединения более широко распределяются по всему телу. 23 Это исследование также показало, что кислоты имеют более низкие значения V d , чем нейтральные или цвиттерионные соединения. Опять же, другие факторы играют роль в степени связывания лекарств с белками, в частности, липофильность, и вместе с кислотно-основными свойствами они сильно влияют на клиренс и воздействие на органы-мишени.
22, 23 Как правило, основные соединения имеют большие значения V d , в то время как кислотные соединения имеют меньшие значения. Таким образом, количество препарата, попадающего в печень и почки, значительно различается между кислотами и основаниями. Связанные с тканями соединения, такие как основания, склонны к взаимодействию с кислыми головными группами (фосфо)липидов, тогда как кислоты легко связываются с остатками лизина в белках плазмы крови.Недавнее исследование, проведенное в GlaxoSmithKline 4 , согласуется с этими установленными выводами, демонстрируя, что основные соединения более широко распределяются по всему телу. 23 Это исследование также показало, что кислоты имеют более низкие значения V d , чем нейтральные или цвиттерионные соединения. Опять же, другие факторы играют роль в степени связывания лекарств с белками, в частности, липофильность, и вместе с кислотно-основными свойствами они сильно влияют на клиренс и воздействие на органы-мишени.
Связывание тканей головного мозга, проницаемость гематоэнцефалического барьера
Компании, занимающиеся исследованиями новых лекарств, заинтересованы в проницаемости исследуемых соединений для ЦНС и в том, насколько хорошо они связываются с тканью головного мозга. Компании, разрабатывающие лекарства, нацеленные на мишени в ЦНС, знают, что фармакологический ответ соединения напрямую связан со свободной фракцией в ЦНС, доступной для связывания с необходимой макромолекулой. 24 Если соединение сильно связано с белком, то оно должно обладать достаточной эффективностью, чтобы компенсировать небольшую долю свободно доступного лекарства.Что касается связывания с тканями головного мозга, были обнаружены незначительные различия между связыванием кислых, основных, нейтральных и цвиттер-ионных веществ, в отличие от отчетливого паттерна, наблюдаемого для связывания с белками плазмы. Вместо этого было обнаружено, что на связывание с тканями головного мозга в основном влияют неспецифические явления, особенно липофильность. 4
4
Еще один широко изучаемый аспект исследований лекарственных средств для ЦНС касается способности лекарств проходить через ГЭБ. С физиологической точки зрения ГЭБ представляет собой существенное препятствие для поступления лекарств в ЦНС.Между эпителиальными клетками ГЭБ существуют плотные контакты, и имеются значительные популяции насосов оттока для противодействия проникновению лекарств. Простые модели, которые оценивают степень проникновения лекарств в ЦНС, ограничены качеством данных, и, как указано выше, в большинстве исследований для исследовательских целей соединения разделяют на различные состояния заряда. 25 Хотя молекулярная масса, липофильность и способность донора водородных связей являются важными факторами, влияющими на проникновение ГЭБ 26 , состояние ионизации также играет ключевую роль.Fischer и соавт. 27 подчеркнули отсутствие препаратов для ЦНС с кислой p K a < 4 или основных групп с p K a > 10. Fan et al . 25 показали, что кислые препараты обладают наименьшей пенетрантностью (среднее значение logBB -2,0), в то время как основные и нейтральные соединения показали аналогичные средние значения ca . -0,5. (обратите внимание, logBB = log([мозг]/[кровь])). Броккателли и др. . 28 также обнаружили, что кислотные соединения со значениями p K a ниже 5.5, согласно нашим выводам, с меньшей вероятностью были проникающими в ЦНС. 7 Их работа по моделированию, которая была направлена на прогнозирование проникновения в ЦНС, была способна работать с состояниями ионизации с использованием молекулярных дескрипторов VolSurf (http://www.moldiscovery.com/soft_volsurf.php). В совокупности приведенная выше информация может быть использована для разработки лигандов, где требуется проникновение в ЦНС, или в случаях, когда необходимо исключение ЦНС для минимизации побочных эффектов.
Fan et al . 25 показали, что кислые препараты обладают наименьшей пенетрантностью (среднее значение logBB -2,0), в то время как основные и нейтральные соединения показали аналогичные средние значения ca . -0,5. (обратите внимание, logBB = log([мозг]/[кровь])). Броккателли и др. . 28 также обнаружили, что кислотные соединения со значениями p K a ниже 5.5, согласно нашим выводам, с меньшей вероятностью были проникающими в ЦНС. 7 Их работа по моделированию, которая была направлена на прогнозирование проникновения в ЦНС, была способна работать с состояниями ионизации с использованием молекулярных дескрипторов VolSurf (http://www.moldiscovery.com/soft_volsurf.php). В совокупности приведенная выше информация может быть использована для разработки лигандов, где требуется проникновение в ЦНС, или в случаях, когда необходимо исключение ЦНС для минимизации побочных эффектов.
Механизмы оттока
Существует множество систем оттока для защиты организма от вредных веществ. Ключевым примером является P-гликопротеин (P-gp), который представляет собой связанный с мембраной белок, находящийся на апикальной поверхности кишечного эпителия и мембран астроцитов ГЭБ. Фармацевтическая промышленность проявляет значительный интерес к переносчикам, таким как P-gp, поскольку этот насос для оттока может серьезно ограничивать пероральное всасывание соединений или препятствовать доступу к ЦНС. Полезная прогностическая модель сродства ингибитора P-gp была создана с использованием полей молекулярного взаимодействия 29 , и существуют четкие отношения между сродством к P-gp и размером молекулы 4, 30 , а также числом доноров водородных связей. 31 Напоминая многие ферменты метаболизма, P-gp не различает субстраты для этого белка. В кишечнике как P-gp, так и ферменты метаболизма в значительной степени расположены вместе, выполняя одну и ту же функцию, которая заключается в предотвращении воздействия нежелательных и потенциально вредных веществ.
Ключевым примером является P-гликопротеин (P-gp), который представляет собой связанный с мембраной белок, находящийся на апикальной поверхности кишечного эпителия и мембран астроцитов ГЭБ. Фармацевтическая промышленность проявляет значительный интерес к переносчикам, таким как P-gp, поскольку этот насос для оттока может серьезно ограничивать пероральное всасывание соединений или препятствовать доступу к ЦНС. Полезная прогностическая модель сродства ингибитора P-gp была создана с использованием полей молекулярного взаимодействия 29 , и существуют четкие отношения между сродством к P-gp и размером молекулы 4, 30 , а также числом доноров водородных связей. 31 Напоминая многие ферменты метаболизма, P-gp не различает субстраты для этого белка. В кишечнике как P-gp, так и ферменты метаболизма в значительной степени расположены вместе, выполняя одну и ту же функцию, которая заключается в предотвращении воздействия нежелательных и потенциально вредных веществ. 32
32
Состояния ионизации также играют роль: кислоты имеют более низкие коэффициенты истечения, чем нейтральные и основные соединения, в то время как цвиттер-ионы имеют более высокие коэффициенты истечения. 4 В целях упрощения классификации соединений было разработано «правило 4» для приблизительного описания субстратной специфичности P-gp. 33 Это правило использует свойства; MW, p K a значений и сумма числа атомов азота и кислорода (N+O). Короче говоря, было обнаружено, что соединение с параметрами (N+O) ≥ 8, MW > 400 и кислотой p K a > 4, вероятно, является субстратом P-gp, в то время как соединения с параметрами (N +O) ≤ 4, MW < 400 и основание p K a < 8 с меньшей вероятностью является субстратом. 33 Эти рекомендации полезны и позволяют исследователям отслеживать конкретные физико-химические свойства, а также состояния заряда для измерения чувствительности P-gp. Хотя эти результаты важны, сродство P-gp для каждого структурного класса будет различаться, и на ранней стадии требуется лабораторное тестирование для установления каких-либо ограничений.
Хотя эти результаты важны, сродство P-gp для каждого структурного класса будет различаться, и на ранней стадии требуется лабораторное тестирование для установления каких-либо ограничений.
Связывание hERG
Большое значение для фармацевтической промышленности при разработке лекарств имеет необходимость избегать соединений, которые блокируют калиевый канал hERG. Ингибирование каналов hERG может вызвать серьезные побочные эффекты, такие как удлинение интервала QT, что в тяжелых случаях может привести к сердечной аритмии и смерти.Недавно были разработаны улучшенные модели канала hERG, что привело к более точному прогнозированию сродства каналов. 34 Многие из моделей, которые были разработаны для прогнозирования сродства hERG, описывают взаимосвязь между присутствием основной группы и блокадой канала. 34 Действительно, наличие основного алифатического азота является для химиков-медиков поводом для раннего тестирования сродства к hERG. 35 Исследование 35 200 молекул, протестированных на ингибирование hERG, показало, что основные соединения обладают более высоким сродством к каналам hERG, чем цвиттер-ионные соединения, в то время как кислые и нейтральные соединения показали самое слабое сродство. 4
4
Электрофизиологические исследования обеспечивают более точную оценку, чем связывание радиолиганда, и компания AstraZeneca протестировала 7685 соединений, сосредоточив внимание как на состоянии заряда, так и на липофильности, чтобы разработать рекомендации по предотвращению ингибирования hERG. 36 Молекулы были классифицированы как кислые, основные, нейтральные или цвиттер-ионные на основании их состояния заряда при физиологических значениях pH, тогда как значения logD были либо оценены in silico , либо измерены экспериментально. В соответствии с выводами GSK 4 было обнаружено, что основные соединения с большей вероятностью ингибируют hERG, и это ингибирование также сильно обусловлено липофильностью. 36 Waring and Johnstone 36 определили верхний предел липофильности для прогнозирования 70% вероятности образования соединения с hERG IC 50 более 10 мкМ (). Еще 5748 соединений были протестированы на этой модели, демонстрируя, что предложенные пределы logP/logD 7,4 могут быть успешно предсказаны на уровне 70%. 36 Исследования, специально использующие значения p K a для оценки риска ингибирования каналов hERG, еще не появились, и, хотя не было продемонстрировано никакой конкретной связи с p K a , Wager и соавт. 11 проанализировали внутренние данные, чтобы сделать вывод, что риск блокады канала hERG был выше, когда молекула имела основной центр с ap K a выше 8.4.
36 Исследования, специально использующие значения p K a для оценки риска ингибирования каналов hERG, еще не появились, и, хотя не было продемонстрировано никакой конкретной связи с p K a , Wager и соавт. 11 проанализировали внутренние данные, чтобы сделать вывод, что риск блокады канала hERG был выше, когда молекула имела основной центр с ap K a выше 8.4.
Таблица 1
Взаимосвязь между состоянием заряда, липофильностью и ингибированием hERG мкМ
 4
4 8 CLOGP
Фосфолипидоз
Фосфолипидоз характеризуется избыточными фосфолипидами в клетках, дающих им пенистый внешний вид и известен индуцироваться определенными соединениями, которые являются катионными амфифилами. Хотя это управляемый побочный эффект некоторых лекарств, он создает проблемы во время разработки лекарств, поскольку необходимы дальнейшие исследования, чтобы показать, что эффекты обратимы.Плоемен и его коллеги 37 разработали модель для прогнозирования способности катионных соединений вызывать фосфолипидоз. Позднее эта модель была обновлена 38 до следующего простого расчета, ориентированного как на липофильность, так и на p K a основной группы. Соединение потенциально может вызывать фосфолипидоз, если (ClogP) 2 + (расчетное основное p K a ) 2 ≥ 50, пока ClogP > 2 и p K a > 69
Позднее эта модель была обновлена 38 до следующего простого расчета, ориентированного как на липофильность, так и на p K a основной группы. Соединение потенциально может вызывать фосфолипидоз, если (ClogP) 2 + (расчетное основное p K a ) 2 ≥ 50, пока ClogP > 2 и p K a > 69
Другие исследователи также искали простые алгоритмы для прогнозирования фосфолипидоза. Используя модель in vitro , Tomizawa et al . показал связь для основных соединений между ClogP, p K a и фосфолипидозом. 39 Чтобы распространить это на другие классы соединений, они построили график суммарного заряда (NC) при pH 4,0 в зависимости от ClogP и разработали прогностическую схему для фосфолипидоза (). Для более сложных случаев разработки лекарств, когда доступна информация об объеме распределения, Ханумеговда и его коллеги разработали модель, которая лучше, чем использование только значений p K a и ClogP. 40 Индукторы фосфолипидоза были предсказаны с точностью 82%, если самые основные значения p K a * V d * ClogP превышали 180. Эти простые модели используют значения p K a для прогнозирования соединения токсичность и может быть легко применена при поиске новых лекарств.
40 Индукторы фосфолипидоза были предсказаны с точностью 82%, если самые основные значения p K a * V d * ClogP превышали 180. Эти простые модели используют значения p K a для прогнозирования соединения токсичность и может быть легко применена при поиске новых лекарств.
Таблица 2
вероятность фосфолипидоза
| CLOGP | Net Charge | ||
|---|---|---|---|
| <1 | 1 | 1 | |
| < 1.61 | Отсутствует | Низких | Высокого |
| 1,61 ≤ ClogP <2,75 | Отсутствует | Среднего | Высокого |
| ≥ 2,75 | Отсутствует | Высокого | высокого |
митохондриальная дисфункция
Нарушение митохондриальных процессов недавно было признано причиной нецелевой лекарственной токсичности и привело к изъятию нескольких соединений из клиники. В частности, два соединения, троглитазон и церивастатин, были исключены из списка из-за их влияния на митохондриальное окислительное фосфорилирование. 41 Основной функцией митохондрий является производство энергии для клетки в форме аденозинтрифосфата (АТФ). Соединения, которые резко снижают выработку АТФ, вызывают ряд симптомов, таких как лактоацидоз, который клинически проявляется тошнотой, рвотой и болью в животе. Чтобы предотвратить попадание этих соединений в тесты на животных или людях, были разработаны методы доклинического скрининга для выявления молекул, которые мешают функции митохондрий. 42 Исследование более 2000 соединений, проведенное Naven et al . показал, что кислые препараты представляют наибольшие проблемы. 43 Они также показали более высокую склонность к разобщающей активности при повышенной липофильности. Ряд кислотных функциональных групп был отмечен как особенно проблемный, например, антраниловые кислоты, тиазолиндионы, фторметилсульфонанилиды, салицилаты и ациклиндолоны.
В частности, два соединения, троглитазон и церивастатин, были исключены из списка из-за их влияния на митохондриальное окислительное фосфорилирование. 41 Основной функцией митохондрий является производство энергии для клетки в форме аденозинтрифосфата (АТФ). Соединения, которые резко снижают выработку АТФ, вызывают ряд симптомов, таких как лактоацидоз, который клинически проявляется тошнотой, рвотой и болью в животе. Чтобы предотвратить попадание этих соединений в тесты на животных или людях, были разработаны методы доклинического скрининга для выявления молекул, которые мешают функции митохондрий. 42 Исследование более 2000 соединений, проведенное Naven et al . показал, что кислые препараты представляют наибольшие проблемы. 43 Они также показали более высокую склонность к разобщающей активности при повышенной липофильности. Ряд кислотных функциональных групп был отмечен как особенно проблемный, например, антраниловые кислоты, тиазолиндионы, фторметилсульфонанилиды, салицилаты и ациклиндолоны.
Клиренс, метаболизм и ферменты цитохрома Р450
Рассмотрение клиренса лекарственного средства должно охватывать как почечный, так и печеночный пути.Также необходимо включить билиарные системы, и в совокупности эти пути влияют на фармакокинетические параметры, такие как период полувыведения. Липофильность является доминирующим фактором клиренса, так как она определяет проницаемость лекарственного средства через мембраны, особенно в почечной системе. Водный компонент крови фильтруется почками, и реабсорбция соединений зависит от их logD. Положительные значения logD 7,4 предсказывают реабсорбцию соединения, в то время как значения со значениями ниже 0.0 очищаются легче. Состояние ионизации играет роль в клиренсе и особенно зависит от связывания с белками. Поскольку анионная форма кислот может сильно связываться с белками плазмы, они с меньшей вероятностью выводятся, тогда как основания, как правило, демонстрируют более высокие скорости выведения. 4
Следует также учитывать вторичный метаболизм, поскольку начальный метаболизм часто может генерировать ионизируемые функциональные группы. Например, соединения, содержащие карбоновые кислоты, подвержены ацилглюкуронированию, что влияет на их химическую реакционную способность и профиль побочных эффектов. 44 Несмотря на это, около 19% лекарств содержат карбоксилат (неопубликованные наблюдения за лекарствами, одобренными FDA), и он остается важной функциональной группой для медицинских химиков.
Например, соединения, содержащие карбоновые кислоты, подвержены ацилглюкуронированию, что влияет на их химическую реакционную способность и профиль побочных эффектов. 44 Несмотря на это, около 19% лекарств содержат карбоксилат (неопубликованные наблюдения за лекарствами, одобренными FDA), и он остается важной функциональной группой для медицинских химиков.
Поскольку липофильные соединения реабсорбируются в почках, необходим метаболизм, чтобы сделать их более растворимыми в воде. Лекарства и другие экзогенные химические вещества часто метаболизируются ферментами цитохрома Р450, при этом большинство лекарств метаболизируются изоформами цитохрома Р450 1А2, 2С9, 2С19, 2D6 и 3А4. 45 В области разработки лекарств часто предпринимаются усилия по снижению метаболизма лекарств с помощью ферментов P450. Причины этого связаны с уменьшением производства потенциально токсичных метаболитов и с целью избежать вмешательства в метаболизм других лекарств, что может привести к лекарственным взаимодействиям. Уменьшение метаболизма лекарственного средства также позволяет увеличить период полувыведения и менее частые режимы дозирования. Изоформы P450, на которые больше всего влияет состояние заряда, включают 2C9 и 2D6, в то время как для остальных изоформ было показано, что состояние ионизации играет меньшую роль. 4 Другие факторы играют роль в предпочтении изоформ цитохрома P450 для органических соединений и включают MW и logP. Ферменты цитохрома Р450 и другие ферменты, метаболизирующие лекарственные средства, могут давать биологически активные метаболиты, процесс, известный как биоактивация. К счастью, трехмерная структурная информация о белках начинает помогать нам оценивать предпочтения субстрата, хотя эти ферменты, как известно, неразборчивы в связях. Это понятно, если вспомнить об их широкой роли в метаболизме как эндогенных, так и экзогенных соединений. 46, 47
Уменьшение метаболизма лекарственного средства также позволяет увеличить период полувыведения и менее частые режимы дозирования. Изоформы P450, на которые больше всего влияет состояние заряда, включают 2C9 и 2D6, в то время как для остальных изоформ было показано, что состояние ионизации играет меньшую роль. 4 Другие факторы играют роль в предпочтении изоформ цитохрома P450 для органических соединений и включают MW и logP. Ферменты цитохрома Р450 и другие ферменты, метаболизирующие лекарственные средства, могут давать биологически активные метаболиты, процесс, известный как биоактивация. К счастью, трехмерная структурная информация о белках начинает помогать нам оценивать предпочтения субстрата, хотя эти ферменты, как известно, неразборчивы в связях. Это понятно, если вспомнить об их широкой роли в метаболизме как эндогенных, так и экзогенных соединений. 46, 47
Кислотно-щелочной профиль пероральных препаратов
Наш анализ кислотно-щелочного профиля малых органических веществ специально исследовал p K a каждой функциональной группы, чтобы классифицировать каждое соединение. В первом из наших исследований рассматривался набор опубликованных значений p K a для ряда старых препаратов (см. ссылку 7 ). Хотя это было информативно, впоследствии был исследован более широкий набор соединений, включающих соединения, используемые в настоящее время в клинической практике. 7 Это последнее исследование предоставило несколько уровней анализа, охватывающих долю классов состояния заряда в распределениях кислот и оснований p K a . Кроме того, соединения были разделены на пероральные препараты и препараты, воздействующие на ЦНС, чтобы можно было провести сравнение между этими группами. Опросы такого рода дают представление о наркотиках в целом, и наблюдения могут быть применены на ранней стадии исследовательской работы.
В первом из наших исследований рассматривался набор опубликованных значений p K a для ряда старых препаратов (см. ссылку 7 ). Хотя это было информативно, впоследствии был исследован более широкий набор соединений, включающих соединения, используемые в настоящее время в клинической практике. 7 Это последнее исследование предоставило несколько уровней анализа, охватывающих долю классов состояния заряда в распределениях кислот и оснований p K a . Кроме того, соединения были разделены на пероральные препараты и препараты, воздействующие на ЦНС, чтобы можно было провести сравнение между этими группами. Опросы такого рода дают представление о наркотиках в целом, и наблюдения могут быть применены на ранней стадии исследовательской работы.
Сосредоточение внимания на пероральных препаратах показало, что 78.6% соединений содержали ионизируемую группу, 11,9% были нейтральными, 4,3% всегда ионизированными, а остальные (5,2%) состояли из солей, различных соединений (например, смесей) и высокомолекулярных веществ. 7 показывает, что ионизируемые соединения преимущественно состоят из молекул с одной кислотной или основной группой, а также из простых амфолитов, содержащих одну кислоту и одно основание. Большая доля ионизируемых соединений была интересной статистикой, которая является отражением процесса оптимизации, который обеспечивает необходимые свойства, подходящие для взаимодействия с сайтом связывания, и биофармацевтические свойства.
7 показывает, что ионизируемые соединения преимущественно состоят из молекул с одной кислотной или основной группой, а также из простых амфолитов, содержащих одну кислоту и одно основание. Большая доля ионизируемых соединений была интересной статистикой, которая является отражением процесса оптимизации, который обеспечивает необходимые свойства, подходящие для взаимодействия с сайтом связывания, и биофармацевтические свойства.
(A), Доля категорий соединений для ионизируемых пероральных препаратов. 7 (B), p K a дистрибутивов пероральных препаратов, содержащих одну кислотную функциональную группу или (C) одну основную функциональную группу. Соединения со следующими критериями классифицировались как всегда ионизированные: кислоты со значениями p K a < 0 и основания со значениями p K a > 12, а также соединения с постоянно заряженными группами (например, четвертичными атомами азота). .Кислоты со значениями p K a выше 10 или основания со значениями p K a ниже 0,0 считались нейтральными. Остальные ионизируемые соединения (кислота p K a в диапазоне 0-10 и основание p K a в диапазоне 0-12) были разделены на следующие группы: вещества, содержащие отдельные кислоты, вещества, содержащие отдельные основания, соединения с двумя кислотными группами, соединения с двумя основными группами, простые амфолиты (одна кислотная и одна основная группа) и другие сложные сочетания кислотных и основных групп (сложные амфолиты).p K a значений были объединены в диапазоны единичных логарифмических единиц (т. е. 0,0 < X ≤ 1,0, 1,0 < X ≤ 2,0 и т. д.). Высота столбца гистограммы выражается в процентах.
Остальные ионизируемые соединения (кислота p K a в диапазоне 0-10 и основание p K a в диапазоне 0-12) были разделены на следующие группы: вещества, содержащие отдельные кислоты, вещества, содержащие отдельные основания, соединения с двумя кислотными группами, соединения с двумя основными группами, простые амфолиты (одна кислотная и одна основная группа) и другие сложные сочетания кислотных и основных групп (сложные амфолиты).p K a значений были объединены в диапазоны единичных логарифмических единиц (т. е. 0,0 < X ≤ 1,0, 1,0 < X ≤ 2,0 и т. д.). Высота столбца гистограммы выражается в процентах.
Графики распределения p K a веществ, содержащих одну кислоту и одно основание, показаны на . Интересно, что для кислот существует двухфазное распределение, показывающее малое количество кислот со значениями p K a между 6 и 7. Это можно объяснить преобладанием карбоксилатных и фенольных веществ в этом наборе и диапазоном значений p . K a значения, обычно встречающиеся для этих групп.С другой стороны, основания имеют распределение, показывающее, что большинство этих веществ имеют значения p K a выше 6,0. Опять же, это можно объяснить большим количеством алифатических аминов в этом наборе, которые в основном нацелены на GPCR. На общий состав классов соединений и их распределения влияют многочисленные факторы. 7 Учитывая, что это признанные препараты, свойства ADMET являются доминирующими факторами, а также необходимостью соблюдения необходимых взаимодействий сайтов связывания.Ценность этой работы заключалась в том, чтобы предоставить дополнительную информацию помимо стандартных физико-химических свойств, которые могут повлиять на выбор скрининговых коллекций и разнообразие ионизируемых функциональных групп в этих соединениях. Наш анализ скрининга соединений и наборов данных хемогеномики дополняет эту работу по наркотикам, и рукопись по этой теме находится в стадии подготовки.
K a значения, обычно встречающиеся для этих групп.С другой стороны, основания имеют распределение, показывающее, что большинство этих веществ имеют значения p K a выше 6,0. Опять же, это можно объяснить большим количеством алифатических аминов в этом наборе, которые в основном нацелены на GPCR. На общий состав классов соединений и их распределения влияют многочисленные факторы. 7 Учитывая, что это признанные препараты, свойства ADMET являются доминирующими факторами, а также необходимостью соблюдения необходимых взаимодействий сайтов связывания.Ценность этой работы заключалась в том, чтобы предоставить дополнительную информацию помимо стандартных физико-химических свойств, которые могут повлиять на выбор скрининговых коллекций и разнообразие ионизируемых функциональных групп в этих соединениях. Наш анализ скрининга соединений и наборов данных хемогеномики дополняет эту работу по наркотикам, и рукопись по этой теме находится в стадии подготовки.
Другие группы также рассматривали состояние заряда лекарств, которое было включено в их общий анализ физико-химических свойств. 6, 13 Бокер и др. . особое внимание уделялось карбоксилатам, но также давало сравнение стандартных физико-химических свойств, разделяя лекарства на кислоты, основания, нейтралы и цвиттер-ионы. 13 Между группами наблюдались незначительные различия, однако было обнаружено, что нейтральные препараты имеют меньше вращающихся связей, а основные препараты имеют значительно меньшее количество акцепторов водородных связей. Их исследование завершилось рядом наблюдений, которые могли предсказать, будет ли соединение, содержащее карбоновую кислоту, демонстрировать приемлемые свойства ADME. 13 Следующий список обеспечивает желаемые свойства, и в этом случае не должно быть нарушено более одного порогового значения: -Ондующие акцепторы ≤ 6
# Rotatable Bonds ≤
#
CLOGP <3
-1,5
60
P K a (COOH) > 3
Более обширный анализ молекулярных свойств и состояний заряда был проведен Лисоном и его коллегами 6 , которые также изучили изменения этих параметров за последние несколько десятилетий.Соединения снова были разделены на кислоты, основания, нейтралы и цвиттер-ионы, однако для четвертичных аминов был включен дополнительный класс «катионов». Был сравнен широкий спектр свойств в поисках тенденций, чтобы определить, достигли ли определенные характеристики консенсуса с течением времени. Например, было показано, что липофильность нейтральных и кислых пероральных препаратов со временем увеличивается, в то время как основные препараты уже достигли диапазона липофильности, характерного для других классов. Другие выводы показали, что 6 :
MW увеличивается во всех классах со временем
# доноры H-связи стабильны
# H-связи акцепторы увеличиваются со временем
ароматический атом count – sp 3 количество атомов (Ar-sp 3 ) постоянно со временем.
 (Ar-sp 3 описывает форму или ароматический/алифатический баланс)
(Ar-sp 3 описывает форму или ароматический/алифатический баланс)
Эта форма анализа очень полезна для выявления тенденций в том, как проводится медицинская химия и открытие лекарств, и может применяться для изучения тенденций между отдельными организациями. Было высказано предположение, что в случае кислот и нейтральных лекарственных средств существует потенциальная устойчивость к большей липофильности. Похоже, что отслеживание липофильности, количества доноров Н-связей и молекулярной формы жизненно важно для разработки перорально активных соединений, которые могут выдержать суровые условия разработки лекарств.
Взаимодействия лекарство-рецептор
Сайты связывания лекарства в макромолекулярных мишенях состоят из гидрофобных и гидрофильных участков, где последние могут участвовать в связывании с лигандами посредством электростатических взаимодействий, включая ионное связывание, водородное связывание, диполь-дипольные взаимодействия, ион-дипольные взаимодействия взаимодействия и взаимодействия катион-π. Исследования этих взаимодействий позволили глубже понять геометрию и силу этих связей, чтобы помочь разработчикам лекарств. 48 Ионизируемые группы в лекарствах могут взаимодействовать с комплементарными группами в макромолекулах, образуя сильные взаимодействия, однако сила может быть снижена из-за конкурирующих явлений гидратации и энтропии.Медицинские химики могут улучшить активность свинца, влияя либо на энтальпийные, либо на энтропийные термодинамические компоненты. Самый простой способ — добавить липофильности или увеличить количество взаимодействующих групп. Этот подход получил название «молекулярное ожирение» и ведет исследователя в направлении, которое, вероятно, приведет к будущим проблемам ADMET или растворимости. 3 Поиск более специфических взаимодействий, например, посредством Н-связей, требует оптимального размещения функциональной группы в сайте связывания с учетом того, что десольватация может привести к энтропийным штрафам.С точки зрения энергии, десольватация неполярной группы требует в 10 раз меньше энергии, поэтому медицинские химики добавляют гидрофобные группы в своих усилиях по повышению эффективности.
Исследования этих взаимодействий позволили глубже понять геометрию и силу этих связей, чтобы помочь разработчикам лекарств. 48 Ионизируемые группы в лекарствах могут взаимодействовать с комплементарными группами в макромолекулах, образуя сильные взаимодействия, однако сила может быть снижена из-за конкурирующих явлений гидратации и энтропии.Медицинские химики могут улучшить активность свинца, влияя либо на энтальпийные, либо на энтропийные термодинамические компоненты. Самый простой способ — добавить липофильности или увеличить количество взаимодействующих групп. Этот подход получил название «молекулярное ожирение» и ведет исследователя в направлении, которое, вероятно, приведет к будущим проблемам ADMET или растворимости. 3 Поиск более специфических взаимодействий, например, посредством Н-связей, требует оптимального размещения функциональной группы в сайте связывания с учетом того, что десольватация может привести к энтропийным штрафам.С точки зрения энергии, десольватация неполярной группы требует в 10 раз меньше энергии, поэтому медицинские химики добавляют гидрофобные группы в своих усилиях по повышению эффективности. Рабский поиск потенции в таких ситуациях означает, что химик часто идет по ложному пути.
Рабский поиск потенции в таких ситуациях означает, что химик часто идет по ложному пути.
Чтобы избежать проблем молекулярного ожирения и специально контролировать качество соединений свинца, был разработан ряд параметров. Например, во время оптимизации свинца мерой потенциала разработки соединения является мониторинг эффективности лиганда (LE). 49 Этот параметр учитывает как активность, так и молекулярную массу соединения, чтобы дать свободную энергию связи на тяжелый (т. е. неводородный) атом. Было описано несколько показателей эффективности лиганда, и в настоящее время они популярны в сообществе медицинской химии. 1 В соответствии с энергиями связи Эндрюса 50 , на эффективность лиганда в соединениях с очень малой молекулярной массой влияют заряженные группы, которые могут обеспечить значительное увеличение LE. 51 В качестве альтернативы эффективность лиганда можно обменять на включение заряженной функциональной группы, которая может потребоваться для улучшения биофармацевтических характеристик или растворимости лиганда.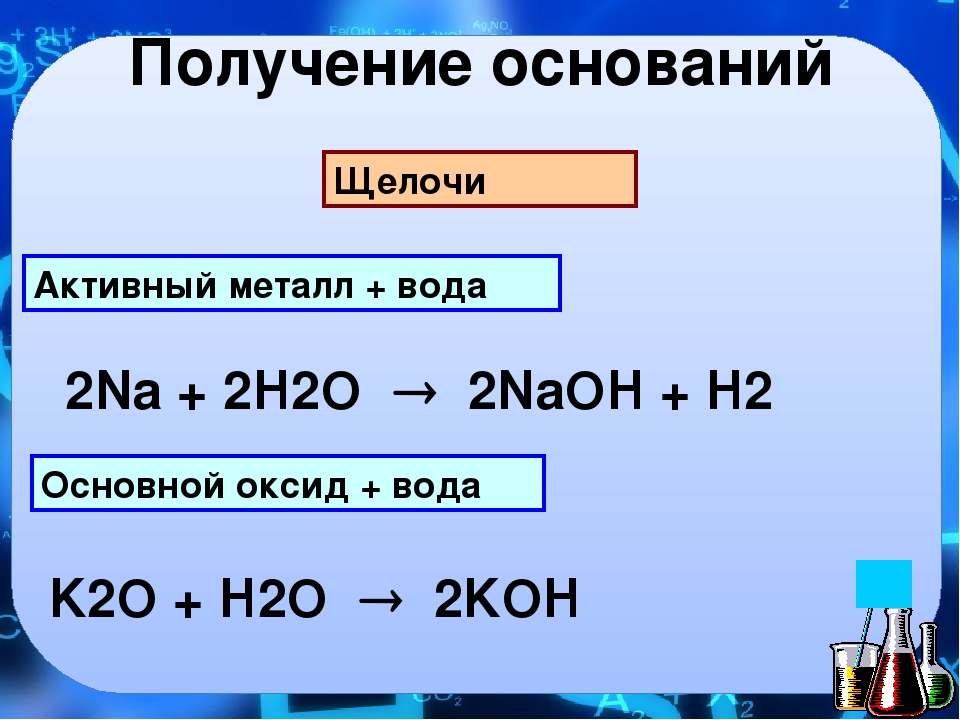 51
51
Нецелевая активность
Главной задачей ученого, разрабатывающего новое лекарство, является обеспечение селективности в отношении намеченной цели. Хотя в некоторых случаях требуется взаимодействие с более чем одной макромолекулой, нецелевая активность может привести к токсичности и побочным эффектам. Ряд исследований рассматривал эту проблему, пытаясь найти взаимосвязь с простыми физико-химическими свойствами. 5, 8, 11, 52, 53 Основные соединения ясно показали, что они часто взаимодействуют с более чем одной мишенью 8, 53 , в то время как кислоты, нейтралы и цвиттер-ионы показали пониженную склонность к нецелевой активности. 8 Хотя некоторые из этих исследований предполагают связь между MW, ClogP и беспорядочными половыми связями 8, 11, 54 , необходимо соблюдать осторожность со статистикой. Повышенная сложность соединения с более высоким ClogP и MW предполагает, что может быть повышенная вероятность взаимодействия с другими мишенями. 3 Нецелевая активность является еще одной причиной для тщательного изучения размера и липофильности, а когда задействованы ионизируемые группы, необходимо контролировать значения logD 7,4 .
3 Нецелевая активность является еще одной причиной для тщательного изучения размера и липофильности, а когда задействованы ионизируемые группы, необходимо контролировать значения logD 7,4 .
Состав
Значения p K a лекарства могут критически повлиять на аспекты его состава, особенно для лекарств, которые необходимо вводить в растворе. В частности, значения p K a оказывают большое влияние на растворимость лекарственного средства в воде, и в целом ионизированная форма лекарственного средства значительно более растворима в воде. Растворимость является чрезвычайно важным физико-химическим параметром, который обычно исследуется в фармацевтической промышленности.Полярность из-за влияния, которое она оказывает на взаимодействие растворенного вещества с растворителем, является одним из двух основных факторов, влияющих на растворимость лекарственного средства в воде. Другой — энергетическая природа твердого тела, в частности энергия кристаллической решетки, которая варьируется от одной структуры лекарства к другой, а также между полиморфными формами одной и той же структуры. Как правило, лекарствам необходима подходящая степень липофильности, чтобы: (а) достичь места действия, начиная с абсорбции из желудочно-кишечного тракта, и (б) взаимодействовать с соответствующим рецептором.Следовательно, растворимость в воде часто в некоторой степени снижается из-за желаемой липофильности. Кислотно-щелочной характер лекарственного средства играет важную роль в определении растворимости, но она часто в значительной степени зависит от рН состава в виде раствора, вызывая переменную полярность в водном растворе. Существует множество информации о растворимости лекарств, и читатель отсылается к двум важным текстам. 55, 56
Как правило, лекарствам необходима подходящая степень липофильности, чтобы: (а) достичь места действия, начиная с абсорбции из желудочно-кишечного тракта, и (б) взаимодействовать с соответствующим рецептором.Следовательно, растворимость в воде часто в некоторой степени снижается из-за желаемой липофильности. Кислотно-щелочной характер лекарственного средства играет важную роль в определении растворимости, но она часто в значительной степени зависит от рН состава в виде раствора, вызывая переменную полярность в водном растворе. Существует множество информации о растворимости лекарств, и читатель отсылается к двум важным текстам. 55, 56
Поскольку растворы для инъекций предпочтительно являются водными, ключевым требованием для преодоления ограничений, связанных с липофильностью при разработке лекарств, является наличие одной или нескольких ионизируемых групп, для которых полярность, основанная на степени ионизации, может контролироваться с помощью рН среды, будь то в биологической среде или в приготовленном растворе. Однако необходимо обеспечить, чтобы ключевая роль кислотно-основных функциональных групп во взаимодействиях с рецепторами не была поставлена под угрозу за счет корректировки кислотно-основного поведения с целью изменения растворимости, что также может быть достигнуто с помощью неионизируемых полярных групп.
Однако необходимо обеспечить, чтобы ключевая роль кислотно-основных функциональных групп во взаимодействиях с рецепторами не была поставлена под угрозу за счет корректировки кислотно-основного поведения с целью изменения растворимости, что также может быть достигнуто с помощью неионизируемых полярных групп.
Давно принято, что рН растворов для инъекций не должен выходить за пределы диапазона 4–9, в основном по причинам, связанным с болью или повреждением тканей при инъекции. Для приготовления ионизируемого плохо растворимого в воде лекарственного средства может потребоваться крайнее значение pH, чтобы получить достаточную растворимость.Разумный выбор ионизируемой группы или групп (на этапе проектирования) может значительно помочь в решении этой проблемы растворимости. Чтобы быть эффективной, введенная группа должна быть значительно ионизирована в носителе состава, а в идеале также в физиологических условиях. Хотя это трудно обобщить, эффективные значения p K a для повышения растворимости должны находиться в диапазоне 4-9, чтобы обеспечить достаточную долю ионизированного лекарственного средства для достижения адекватной растворимости в воде. Для оснований значения p K a должны быть ближе к верхнему пределу этого диапазона, тогда как значения для кислот должны быть ближе к нижнему пределу. Конечно, относительно растворимое в воде лекарство будет легче приготовить, чем лекарство с предельной растворимостью. Еще одна проблема, связанная с инъекционными и офтальмологическими препаратами, заключается в осмотическом эффекте, который контролируется лекарственным веществом p K a и рН раствора. Это важно, когда концентрация лекарства высока, так что само лекарство является основной осмотической детерминантой.
Для оснований значения p K a должны быть ближе к верхнему пределу этого диапазона, тогда как значения для кислот должны быть ближе к нижнему пределу. Конечно, относительно растворимое в воде лекарство будет легче приготовить, чем лекарство с предельной растворимостью. Еще одна проблема, связанная с инъекционными и офтальмологическими препаратами, заключается в осмотическом эффекте, который контролируется лекарственным веществом p K a и рН раствора. Это важно, когда концентрация лекарства высока, так что само лекарство является основной осмотической детерминантой.
Другим аспектом влияния p K a на рецептуру является потенциальное влияние состояния ионизации на стабильность лекарственного средства. Например, при pH > 6 морфин разлагается по двум путям окисления, один из которых включает форму свободного основания алициклического азота 3°, а другой — анионную форму фенольной группы 3-ОН. 57 В обоих случаях скорость окисления увеличивается при депротонировании каждой функциональной группы. Для обоих типов пути деградации, если соображения дизайна лекарственного средства приводят к окисляемым группам со значениями p K a , близкими к физиологически значимому диапазону, то окислительная деградация может быть ускорена.
Для обоих типов пути деградации, если соображения дизайна лекарственного средства приводят к окисляемым группам со значениями p K a , близкими к физиологически значимому диапазону, то окислительная деградация может быть ускорена.
p
K a Методы прогнозирования Важно отметить, что основной интерес к кислотно-основным равновесиям лекарственных средств относится к водным биологическим системам. Механизм, с помощью которого кислотно-щелочное поведение влияет на эти системы, заключается в изменениях, происходящих в свойствах водных растворов лекарственных средств, когда полярность молекулы изменяется в результате измененной ионизации (реакций протонирования-депротонирования) одной или нескольких функциональных групп. Другим важным аспектом при рассмотрении кислотно-основного характера является обоснованное предсказание или точное измерение значений p K a , что также влияет на оценку значений logD.Доступен ряд пакетов программного обеспечения для оценки значений p K a в водной среде, и они различаются как по точности, так и по применяемому алгоритму. Учитывая широту этой темы, мы отсылаем читателя к Lee и Crippen 58 , которые обсуждают различные методы и доступное программное обеспечение.
Учитывая широту этой темы, мы отсылаем читателя к Lee и Crippen 58 , которые обсуждают различные методы и доступное программное обеспечение.
Коммерческий p K a Пакеты программного обеспечения для прогнозирования:
ACD Labs/pKa (ACD Labs, http://www.acdlabs.com/home/)
ADME Boxes (Pharma) ://фарма-алгоритмы.com/)
ADMET Predictor (Simulations Plus, http://www.simulations-plus.com/)
CSpKa (ChemSilico, http://www.chemsilico.com/)
Marvin (ChemAxon, http://www.chemaxon.com/)
MoKa (Molecular Discovery, http://www.moldiscovery.com/)
Пилотный проект (Accelrys, http://accelrys.com) /)
pKalc (CompuDrug, http://www.compudrug.com/)
QikProp и Epik (Schrödinger, http://www.schrodinger.com/)
Quacpac (OpenEye, http://www.eyesopen.com/)
SPARC (ARChem, http://archemcalc.
 com/sparc/)
com/sparc/)
Выводы
В любой отрасли требуется постоянная оценка ключевых процессов для поддержания эффективности и конкурентоспособности. Некоторые идеи могут иметь длительное и существенное влияние, например, наблюдения Липински и его коллег. 9 С тех пор, как появилась их публикация, возникли дополнительные рекомендации относительно природы химического пространства, имеющего отношение к открытию лекарств. 1 Фармацевтические компании часто проводили это исследование, пытаясь понять и снизить скорость истощения соединений при разработке лекарств. 1, 4, 5, 8, 9, 11, 52 Этот обзор и наши последние кислотно-щелочные анализы 7 призваны своевременно напомнить о важности кислотно-основных профилей и p K a ценности. Учитывая, что они влияют на все аспекты открытия лекарств, полезно еще раз проанализировать кислотно-основные свойства, чтобы добавить это к нашим знаниям о химическом пространстве. Таким образом, рассмотрение кислотно-основных свойств представляет собой еще одну возможность улучшить процессы поиска лекарств.
Некоторые идеи могут иметь длительное и существенное влияние, например, наблюдения Липински и его коллег. 9 С тех пор, как появилась их публикация, возникли дополнительные рекомендации относительно природы химического пространства, имеющего отношение к открытию лекарств. 1 Фармацевтические компании часто проводили это исследование, пытаясь понять и снизить скорость истощения соединений при разработке лекарств. 1, 4, 5, 8, 9, 11, 52 Этот обзор и наши последние кислотно-щелочные анализы 7 призваны своевременно напомнить о важности кислотно-основных профилей и p K a ценности. Учитывая, что они влияют на все аспекты открытия лекарств, полезно еще раз проанализировать кислотно-основные свойства, чтобы добавить это к нашим знаниям о химическом пространстве. Таким образом, рассмотрение кислотно-основных свойств представляет собой еще одну возможность улучшить процессы поиска лекарств.
Благодарности
Мы признательны за ряд первоисточников, которые не могут быть включены явно из-за нехватки места, но цитируются косвенно. Эта работа была частично поддержана грантами NIH GM-095952 и MH-084690 (TIO).
Эта работа была частично поддержана грантами NIH GM-095952 и MH-084690 (TIO).
Ссылки
6. Leeson PD, St-Gallay SA, Wenlock MC. Медхимком. 2011;2:91–105. [Google Академия]9. Липински К.А., Ломбардо Ф., Домини Б.В., Фини П.Дж. Adv Drug Del Rev. 1997; 46:3–26. [PubMed] [Google Scholar] 10. Джонсон Т.В., Платье К.Р., Эдвардс М. Bioorg Med Chem Lett. 2009;19:5560–5564. [PubMed] [Google Scholar] 13. Бокер А., Бонно П.Р., Хьюк О., Джакалян А., Эдвардс П.Дж. ХимМедХим. 2010;5:2102–2113. [PubMed] [Google Scholar] 14.Schanker LS, Tocco DJ, Brodie BB, Hogben CA. J Pharmacol Exp Ther. 1958; 123: 81–88. [PubMed] [Google Scholar] 15. Palm K, Luthman K, Ros J, Grasjo J, Artursson P. J Pharmacol Exp Ther. 1999; 291:435–443. [PubMed] [Google Scholar] 16. Буассе М., Ботам Р.П., Хегеле К.Д., Ленфант Б., Пахот Д.И. Eur J Pharm Sci. 2000; 10: 215–224. [PubMed] [Google Scholar] 17. Кастро Дж.Л., Коллинз И., Рассел М.Г., Ватт А.П., Сохал Б., Рэтбоун Д., Бир М.С., Стэнтон Дж.А. J Med Chem. 1998;41:2667–2670. [PubMed] [Google Scholar] 18. Кубинский Х.В: Вычислительные подходы к разработке лекарств на основе структуры. Страуд Р.М., редактор. Королевское химическое общество; Лондон: 2007. С. 24–45. [Google Академия] 19. Pagliara A, Reist M, Geinoz S, Carrupt PA, Testa B. J Pharm Pharmacol. 1999;51:1339–1357. [PubMed] [Google Scholar] 20. Вит М., Сигел М.Г., Хиггс Р.Е., Уотсон И.А., Робертсон Д.Х., Савин К.А., Дерст Г.Л., Хипскинд П.А. J Med Chem. 2004; 47: 224–232. [PubMed] [Google Scholar] 23. Глисон М.П., Уотерс, Нью-Джерси, Пейн С.В., Дэвис А.М. J Med Chem. 2006; 49:1953–1963. [PubMed] [Google Scholar] 25.Fan Y, Unwalla R, Denny RA, Di L, Kerns EH, Diller DJ, Humblet C. J Chem Inf Model. 2010;50:1123–1133. [PubMed] [Google Scholar] 30. Гомбар В.К., Полли Дж.В., Хамфрис Дж.Е., Ринг С.А., Серабжит-Сингх С.С. Дж. Фарм. 2004; 93: 957–968. [PubMed] [Google Scholar] 33. Дидзиапетрис Р., Япертас П., Авдеев А., Петраускас А. Дж. Лекарственная мишень. 2003; 11: 391–406. [PubMed] [Google Scholar] 34.
[PubMed] [Google Scholar] 18. Кубинский Х.В: Вычислительные подходы к разработке лекарств на основе структуры. Страуд Р.М., редактор. Королевское химическое общество; Лондон: 2007. С. 24–45. [Google Академия] 19. Pagliara A, Reist M, Geinoz S, Carrupt PA, Testa B. J Pharm Pharmacol. 1999;51:1339–1357. [PubMed] [Google Scholar] 20. Вит М., Сигел М.Г., Хиггс Р.Е., Уотсон И.А., Робертсон Д.Х., Савин К.А., Дерст Г.Л., Хипскинд П.А. J Med Chem. 2004; 47: 224–232. [PubMed] [Google Scholar] 23. Глисон М.П., Уотерс, Нью-Джерси, Пейн С.В., Дэвис А.М. J Med Chem. 2006; 49:1953–1963. [PubMed] [Google Scholar] 25.Fan Y, Unwalla R, Denny RA, Di L, Kerns EH, Diller DJ, Humblet C. J Chem Inf Model. 2010;50:1123–1133. [PubMed] [Google Scholar] 30. Гомбар В.К., Полли Дж.В., Хамфрис Дж.Е., Ринг С.А., Серабжит-Сингх С.С. Дж. Фарм. 2004; 93: 957–968. [PubMed] [Google Scholar] 33. Дидзиапетрис Р., Япертас П., Авдеев А., Петраускас А. Дж. Лекарственная мишень. 2003; 11: 391–406. [PubMed] [Google Scholar] 34. Raschi E, Ceccarini L, De Ponti F, Recanatini M. Экспертное мнение о наркотиках Metab Toxicol. 2009;5:1005–1021. [PubMed] [Google Scholar] 37. Пломен Дж.П., Келдер Дж., Хафманс Т., ван де Сандт Х., ван Бургстеден Дж.А., Салеминки П.Дж., ван Эш Э.Опыт Токсикол Патол. 2004; 55: 347–355. [PubMed] [Google Scholar] 38. Pelletier DJ, Gehlhaar D, Tilloy-Ellul A, Johnson TO, Greene N. J Chem Inf Model. 2007;47:1196–1205. [PubMed] [Google Scholar] 39. Tomizawa K, Sugano K, Yamada H, Horii I. J Toxicol Sci. 2006; 31: 315–324. [PubMed] [Google Scholar]40. Ханумеговда У.М., Венке Г., Регейро-Рен А., Йорданова Р., Корради Д.П., Адамс С.П. Хим. Рез. Токсикол. 2010; 23:749–755. [PubMed] [Google Scholar]42. Nadanaciva S, Dykens JA, Bernal A, Capaldi RA, Will Y. Toxicol Appl Pharmacol.2007; 223: 277–287. [PubMed] [Google Scholar]43. Naven RT, Swiss R, McLeod JK, Will Y, Greene N. Toxicol Sci. 2012 [Google Scholar]44. Сконберг С., Олсен Дж., Мэдсен К.Г., Хансен С.Х., Грилло М.П. Мнение эксперта Препарат Метаб Токсикол.
Raschi E, Ceccarini L, De Ponti F, Recanatini M. Экспертное мнение о наркотиках Metab Toxicol. 2009;5:1005–1021. [PubMed] [Google Scholar] 37. Пломен Дж.П., Келдер Дж., Хафманс Т., ван де Сандт Х., ван Бургстеден Дж.А., Салеминки П.Дж., ван Эш Э.Опыт Токсикол Патол. 2004; 55: 347–355. [PubMed] [Google Scholar] 38. Pelletier DJ, Gehlhaar D, Tilloy-Ellul A, Johnson TO, Greene N. J Chem Inf Model. 2007;47:1196–1205. [PubMed] [Google Scholar] 39. Tomizawa K, Sugano K, Yamada H, Horii I. J Toxicol Sci. 2006; 31: 315–324. [PubMed] [Google Scholar]40. Ханумеговда У.М., Венке Г., Регейро-Рен А., Йорданова Р., Корради Д.П., Адамс С.П. Хим. Рез. Токсикол. 2010; 23:749–755. [PubMed] [Google Scholar]42. Nadanaciva S, Dykens JA, Bernal A, Capaldi RA, Will Y. Toxicol Appl Pharmacol.2007; 223: 277–287. [PubMed] [Google Scholar]43. Naven RT, Swiss R, McLeod JK, Will Y, Greene N. Toxicol Sci. 2012 [Google Scholar]44. Сконберг С., Олсен Дж., Мэдсен К.Г., Хансен С.Х., Грилло М.П. Мнение эксперта Препарат Метаб Токсикол. 2008; 4: 425–438. [PubMed] [Google Scholar]45. Денисов И.Г., Макрис Т.М., Слигар С.Г., Schlichting I. Chem Rev. 2005;105:2253–2277. [PubMed] [Google Scholar]47. Уильямс П.А., Косме Дж., Уорд А., Ангов Х.К., Матак Винкович Д., Джоти Х. Природа. 2003; 424:464–468. [PubMed] [Google Scholar]52. Хьюз Д.Д., Блэгг Дж., Прайс Д.А., Бейли С., Декрещенцо Г.А., Деврадж Р.В., Эллсворт Э., Фобиан Ю.М., Гиббс М.Е., Жиль Р.В., Грин Н., Хуанг Э., Кригер-Берк Т., Лозель Дж., Уэйджер Т., Уайтли Л., Чжан Ю.Bioorg Med Chem Lett. 2008; 18:4872–4875. [PubMed] [Google Scholar]53. Peters JU, Schnider P, Mattei P, Kansy M. ChemMedChem. 2009; 4: 680–686. [PubMed] [Google Scholar]54. Хопкинс А.Л., Мейсон Дж.С., Оверингтон Дж.П. Curr Opin Struct Biol. 2006; 16: 127–136. [PubMed] [Google Scholar]55. Грант DJW, Хигучи Т. Растворимость органических соединений. Уайли; Нью-Йорк: 1990. [Google Scholar]56. Авдеев А, редактор. Поглощение и разработка лекарств: растворимость, проницаемость и состояние заряда. Уайли; Хобокен: 2003.
2008; 4: 425–438. [PubMed] [Google Scholar]45. Денисов И.Г., Макрис Т.М., Слигар С.Г., Schlichting I. Chem Rev. 2005;105:2253–2277. [PubMed] [Google Scholar]47. Уильямс П.А., Косме Дж., Уорд А., Ангов Х.К., Матак Винкович Д., Джоти Х. Природа. 2003; 424:464–468. [PubMed] [Google Scholar]52. Хьюз Д.Д., Блэгг Дж., Прайс Д.А., Бейли С., Декрещенцо Г.А., Деврадж Р.В., Эллсворт Э., Фобиан Ю.М., Гиббс М.Е., Жиль Р.В., Грин Н., Хуанг Э., Кригер-Берк Т., Лозель Дж., Уэйджер Т., Уайтли Л., Чжан Ю.Bioorg Med Chem Lett. 2008; 18:4872–4875. [PubMed] [Google Scholar]53. Peters JU, Schnider P, Mattei P, Kansy M. ChemMedChem. 2009; 4: 680–686. [PubMed] [Google Scholar]54. Хопкинс А.Л., Мейсон Дж.С., Оверингтон Дж.П. Curr Opin Struct Biol. 2006; 16: 127–136. [PubMed] [Google Scholar]55. Грант DJW, Хигучи Т. Растворимость органических соединений. Уайли; Нью-Йорк: 1990. [Google Scholar]56. Авдеев А, редактор. Поглощение и разработка лекарств: растворимость, проницаемость и состояние заряда. Уайли; Хобокен: 2003. [Google Академия] 57. Коннорс К.А., Амидон Г.Л., Стелла В.Дж. Химическая стабильность лекарственных средств. 2. Wiley-Interscience; Нью-Йорк: 1986. [Google Scholar]59. Manchester J, Walkup G, Rivin O, You Z. J Chem Inf Model. 2010; 50: 565–571. [PubMed] [Google Scholar]61. Пракерд Р.Дж. Критическая подборка значений pKa для фармацевтических субстанций. Академическая пресса Эльзевира; Амстердам: 2007. [Google Scholar]62. Комер JEA. В: Комплексная медицинская химия. Triggle DJ, редактор. Том. 5. Эльзевир; 2007. с.357–397. [Google Scholar]
[Google Академия] 57. Коннорс К.А., Амидон Г.Л., Стелла В.Дж. Химическая стабильность лекарственных средств. 2. Wiley-Interscience; Нью-Йорк: 1986. [Google Scholar]59. Manchester J, Walkup G, Rivin O, You Z. J Chem Inf Model. 2010; 50: 565–571. [PubMed] [Google Scholar]61. Пракерд Р.Дж. Критическая подборка значений pKa для фармацевтических субстанций. Академическая пресса Эльзевира; Амстердам: 2007. [Google Scholar]62. Комер JEA. В: Комплексная медицинская химия. Triggle DJ, редактор. Том. 5. Эльзевир; 2007. с.357–397. [Google Scholar]Кислотно-основные свойства модели нуклеиновой кислоты 2′-дезоксигуанилил(5’→3′)-2′-дезокси-5′-гуанилат, d(pGpG)3- и родственных производных гуанина
Динуклеотид d(pGpG) является часто используемой моделью ДНК для изучения различных видов взаимодействий между ДНК и ионами металлов, но его кислотно-основные свойства еще не были подробно описаны. В этом исследовании проводится количественная оценка шести реакций депротонирования H 4 [d(pGpG)] + . Константы кислотности выхода первого протона концевой группы P(O)(OH) 2 (p K a = 0,65) и одного из (N7)H + сайтов (p K a = 2,4). Константы кислотности оставшихся четырех реакций депротонирования измеряли потенциометрическим титрованием рН в водном растворе (25 °С; I = 0,1 М, NaNO 3 ): депротонирование второго (N7)H + , P(O) 2 (OH) — , а два сайта (N1)H равны 2.98, 6,56, 9,54 и 10,11 соответственно. Основываясь на этих результатах, мы показываем, как оценить константы кислотности для родственных систем, которые не были изучены, т.е. pGpG, который участвует в стадии инициации РНК-полимеразы ротавируса. Кратко указывается актуальность наших результатов для нуклеиновых кислот в целом.
Константы кислотности выхода первого протона концевой группы P(O)(OH) 2 (p K a = 0,65) и одного из (N7)H + сайтов (p K a = 2,4). Константы кислотности оставшихся четырех реакций депротонирования измеряли потенциометрическим титрованием рН в водном растворе (25 °С; I = 0,1 М, NaNO 3 ): депротонирование второго (N7)H + , P(O) 2 (OH) — , а два сайта (N1)H равны 2.98, 6,56, 9,54 и 10,11 соответственно. Основываясь на этих результатах, мы показываем, как оценить константы кислотности для родственных систем, которые не были изучены, т.е. pGpG, который участвует в стадии инициации РНК-полимеразы ротавируса. Кратко указывается актуальность наших результатов для нуклеиновых кислот в целом.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент. ..
Что-то пошло не так. Попробуй снова?
..
Что-то пошло не так. Попробуй снова?Сравнение баз данных ACID и BASE
Когда дело доходит до баз данных NoSQL, модели согласованности данных иногда могут разительно отличаться от моделей, используемых реляционными базами данных (а также сильно отличаться от других хранилищ NoSQL).Две наиболее распространенные модели согласованности известны под аббревиатурами ACID и BASE. Несмотря на то, что они часто соревнуются друг с другом в битве за окончательную победу (пожалуйста, сделайте видео об этом), обе модели согласованности и имеют как преимущества, так и недостатки, и ни одна из них не всегда идеально подходит.
Давайте подробнее рассмотрим компромиссы обеих моделей согласованности баз данных.
В этой серии блогов Базы данных графов для начинающих я познакомлю вас с основами технологии графов, предполагая, что у вас мало (или нет) знаний в этой области.За последние недели мы рассмотрели, почему технология графов — это будущее, почему взаимосвязанные данные важны, основы (и подводные камни) моделирования данных, почему важен язык запросов к базе данных, различия между императивными и декларативными языками запросов, прогнозное моделирование с использованием графа. теория, основы алгоритмов поиска графов и зачем нужны базы данных NoSQL.
На этой неделе мы более подробно рассмотрим ключевые различия между моделями согласованности баз данных ACID и BASE и их компромиссы для транзакций данных.
Модель консистенции ACID
Многие разработчики знакомы с транзакциями ACID по работе с реляционными базами данных. Таким образом, модель согласованности ACID некоторое время была нормой.
Основная гарантия ACID заключается в том, что она обеспечивает безопасную среду для работы с вашими данными. Акроним ACID расшифровывается как:
Акроним ACID расшифровывается как:
Atomic
- Все операции в транзакции завершаются успешно или выполняется откат каждой операции.
- По завершении транзакции база данных структурно стабильна.
- Транзакции не конкурируют друг с другом. Состязательный доступ к данным контролируется базой данных, поэтому транзакции выполняются последовательно.
- Результаты применения транзакции неизменны даже при наличии сбоев.
Согласованность записи — замечательная вещь для разработчиков приложений, но она также требует сложной блокировки, которая обычно является тяжеловесным шаблоном для большинства случаев использования.
Что касается технологий NoSQL, то большинство графовых баз данных (включая Neo4j) используют модель согласованности ACID для обеспечения безопасности и последовательного хранения данных.
Базовая модель согласованности
Для многих доменов и вариантов использования ACID-транзакции гораздо более пессимистичны (т. е. они больше беспокоятся о безопасности данных), чем на самом деле требует домен.
В мире баз данных NoSQL транзакции ACID менее популярны, поскольку некоторые базы данных ослабили требования к немедленной согласованности, свежести и точности данных, чтобы получить другие преимущества, такие как масштабируемость и отказоустойчивость.
(Примечательно, что RavenDB на основе .NET изменил тенденцию среди хранилищ агрегатов в поддержке транзакций ACID.)
Вот как расшифровывается аббревиатура BASE:
Basic Availability
- База данных работает большую часть времени.
- Хранилища не обязательно должны быть согласованными по записи, а разные реплики не должны быть все время взаимно согласованными.

- Хранилища демонстрируют согласованность в какой-то более поздний момент (например,г., лениво во время чтения).
Хранилище данных BASE ценит доступность (поскольку это важно для масштабирования), но оно не обеспечивает гарантированной согласованности реплицированных данных во время записи. В целом, модель согласованности BASE обеспечивает менее строгую гарантию, чем ACID: данные будут непротиворечивыми в будущем либо во время чтения (т.например, Riak) или всегда будет непротиворечивым, но только для определенных обработанных прошлых снимков (например, Datomic).
Модель согласованности BASE в основном используется совокупными хранилищами, включая семейства столбцов, хранилища ключей и документов.
Выбор компромиссов между ACID и BASE
Нет правильного ответа на вопрос, нужна ли вашему приложению модель согласованности ACID или BASE. Разработчики и архитекторы данных должны выбирать компромиссы для обеспечения согласованности данных в каждом конкретном случае, а не только на основе тенденций или модели, которая использовалась ранее.
Учитывая нечеткую согласованность BASE, разработчикам необходимо быть более осведомленными и тщательными в отношении непротиворечивых данных, если они выбирают хранилище BASE для своего приложения. Очень важно быть знакомым с БАЗОВЫМ поведением выбранного вами хранилища агрегатов и работать в рамках этих ограничений.
С другой стороны, планирование с учетом ограничений BASE иногда может быть серьезным недостатком по сравнению с простотой транзакций ACID. Полная база данных ACID идеально подходит для случаев, когда важны надежность и согласованность данных (банковское дело, кто-нибудь?).
В ближайшие недели мы углубимся в дополнительные сведения о ACID/BASE, когда речь идет о хранилищах агрегатов и других графовых технологиях.
 Все остальные основания являются нерастворимыми.
Все остальные основания являются нерастворимыми. В зависимости от количества щёлочи образуются средние или кислые соли. Например, при взаимодействии гидроксида кальция с оксидом углерода(IV) образуются карбонат кальция и вода:
В зависимости от количества щёлочи образуются средние или кислые соли. Например, при взаимодействии гидроксида кальция с оксидом углерода(IV) образуются карбонат кальция и вода:
 (Neo4j)
(Neo4j) Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
 (Ar-sp 3 описывает форму или ароматический/алифатический баланс)
(Ar-sp 3 описывает форму или ароматический/алифатический баланс)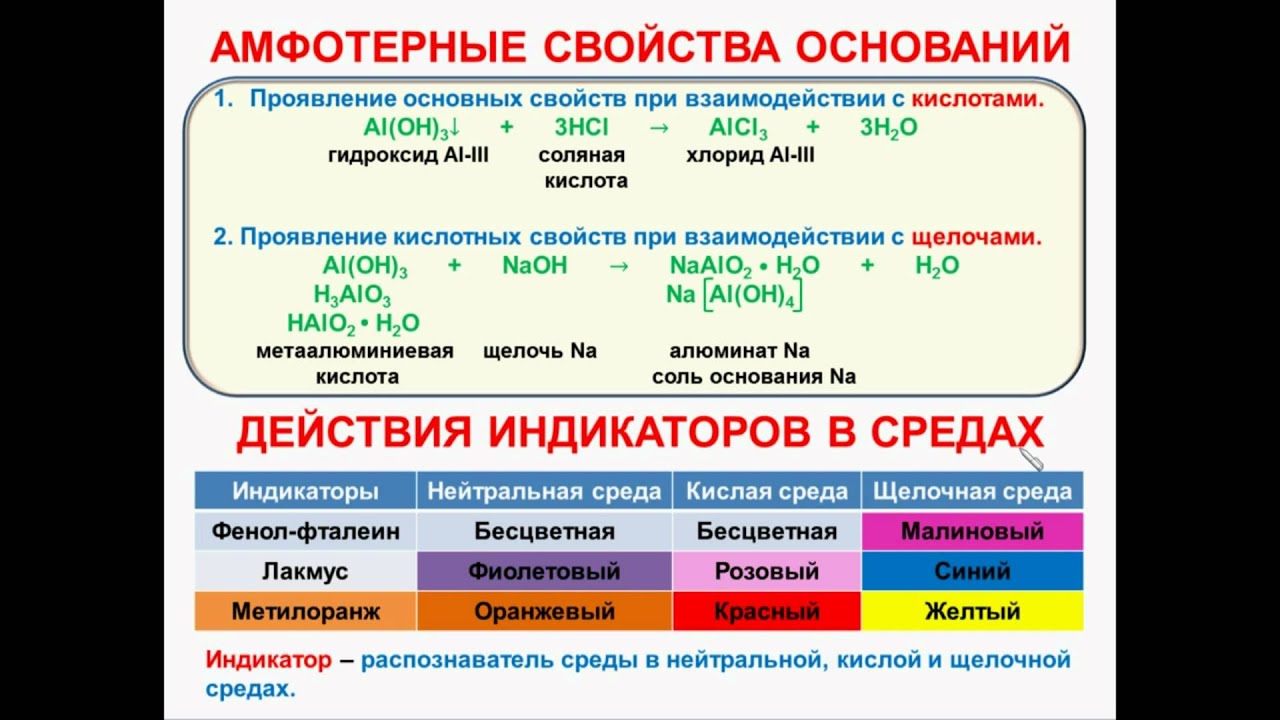 com/sparc/)
com/sparc/)