Химические свойства простых веществ металлов и неметаллов
Урок посвящен обобщению и систематизации знаний о свойствах простых веществ — металлов и неметаллов. Эти два класса веществ отличаются не только физическими, но и химическими свойствами.
Рассмотрим реакции металлов и неметаллов с кислородом. При взаимодействии простых веществ с кислородом образуются, как правило, оксиды. Причем металлы с кислородом обычно образуют основные оксиды, а неметаллы – кислотные.
|
Металлы |
Неметаллы |
|
1. Взаимодействие с кислородом |
|
|
Как правило, образуются основные оксиды: 2Mg + O2 = 2MgO 3Fe + 2O2 = Fe3O4 |
Как правило, образуются кислотные оксиды: S + O2 = SO2 4P + 5O2 = 2P2O5 |
Вы уже знаете, что вещества могут гореть не только в атмосфере кислорода. Некоторые вещества горят при взаимодействии с хлором. Реакции металлов и неметаллов с хлором приводят к образованию хлоридов.
Металл с хлором образует соединение, относящееся к классу солей.
Хлорид неметалла же солью не является.
|
Металлы |
Неметаллы |
|
2. Взаимодействие с хлором |
|
|
Образуются соли: 2К + Cl2 = 2КCl2Fe + 3Cl2 = 2FeCl3
|
Образуются вещества, не являющиеся солями: 2P + 3Cl2 = 2PCl3 2P + 5Cl2 = 2PCl5 |
При взаимодействии активных металлов с водородом образуются твердые нелетучие гидриды, а при взаимодействии неметаллов с водородом – летучие водородные соединения.
|
Металлы |
Неметаллы |
|
3. Взаимодействие с водородом |
|
|
Образуются твердые нелетучие гидриды: 2Na + H2 = 2NaH |
Образуются летучие водородные соединения: Cl2 + H2 = 2HCl С + 2Н2 = СН4 |
Реакции с водой для неметаллов не характерны. Из металлов с водой взаимодействуют только те, которые стоят в ряду активности левее водорода. Причем, самые активные из них (щелочные и щелочноземельные) образуют щелочь и водород. Например, при взаимодействии натрия с водой образуется щелочь (гидроксид натрия) и выделяется водород. Такие реакции сопровождаются выделением большого количества теплоты.
Некоторые металлы взаимодействуют с парами воды с образованием оксида и водорода.
|
Металлы |
Неметаллы |
|
4. Взаимодействие с водой |
|
|
Щелочные и щелочноземельные металлы образуют щелочь и водород: 2Na + 2H2O = 2NaOH + H2 Ba + 2H2O = Ba(OH)2 + H2 Некоторые металлы взаимодействуют с парами воды при высокой температуре 3Fe + 4H2O = Fe3O4 + 4H2 Zn + H2O = ZnO + H2 |
Многие неметаллы не реагируют с водой
|
Для неметаллов не характерны реакции с кислотами. А вот металлы, стоящие в ряду активности левее водорода, вступают в реакцию замещения с кислотами (кроме азотной кислоты любой концентрации и концентрированной серной кислоты). В результате образуются соль и водород.
|
Металлы |
Неметаллы |
|
5. Взаимодействие с кислотами |
|
|
В реакцию вступают металлы, стоящие в ряду активности левее водорода. Fe + 2HCl = FeCl2 + H2 2Al + 3H2SO4 = Al2(SO4)3 + 3H2 |
Не характерно
|

Рис. 1. Растворение железного гвоздя в соляной кислоте
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П.А. Оржековского и др. «Химия. 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с.117-119)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под.ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.122-123)
3. Химия. 8 класс. Учеб.для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.:Астрель, 2013. (§36)
4. Химия: 8-й класс: учеб.для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§43)
5. Энциклопедия для детей. Том 17. Химия / Глав.ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные рекомендованные ссылки на ресурсы Интернет
1. Химическая информационная сеть (Источник).
2. Химия и жизнь (Источник).
Домашнее задание
с. 123 №№ 5,6 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под.ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
interneturok.ru
Хим. свойства простых веществ — Подготовка к ЕГЭ по химии
Все химические элементы разделяют на металлы и неметаллы в зависимости от строения и свойств их атомов. Также на металлы и неметаллы классифицируют образуемые элементами простые вещества, исходя из их физических и химических свойств.
В Периодической системе химических элементов Д.И. Менделеева неметаллы расположены по диагонали: бор – астат и над ней в главных подгруппах.
Для атомов металлов характерны сравнительно большие радиусы и небольшое число электронов на внешнем уровне от 1 до 3 (исключение: германий, олово свинец – 4; сурьма и висмут — 5; полоний — 6 электронов).
Атомам неметаллов, наоборот, свойственны небольшие радиусы атомов и число электронов на внешнем уровне от 4 до 8 (исключение бор, у него таких электронов – три).
Отсюда стремление атомов металлов к отдаче внешних электронов, т.е. восстановительные свойства, а для атомов неметаллов – стремление к приему недостающих до устойчивого восьмиэлектронного уровня электронов, т.е. окислительные свойства.
В металлах – металлическая связь и металлическая кристаллическая решетка. В узлах решетки находятся положительно заряженные ионы металлов, связанные посредством обобществленных внешних электронов, принадлежащих всему кристаллу.
Это обуславливает все важнейшие физические свойства металлов: металлический блеск, электро- и теплопроводность, пластичность (способность изменять форму под внешним воздействием) и некоторые другие, характерные для этого класса простых веществ.
Металлы I группы главной подгруппы называют щелочными металлами.
Металлы II группы: кальций, стронций, барий – щелочноземельными.
В химических реакциях металлы проявляют только восстановительные свойства, т.е. их атомы отдают электроны, образуя в результате положительные ионы.
1. Взаимодействуют с неметаллами:
а) кислородом (с образованием оксидов)
Щелочные и щелочноземельные металлы окисляются легко при обычных условиях, поэтому их хранят под слоем вазелинового масла или керосина.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO
Обратите внимание: при взаимодействии натрия – образуется пероксид, калия — надпероксид
2Na + O2 = Na2O2, К + О2 = КО2
а оксиды получают прокаливанием пероксида с соответствующими металлом:
2Na + Na2O2 = 2Na2O
Железо, цинк, медь и другие менее активные металлы медленно окисляются на воздухе и активно при нагревании.
3Fe + 2O2 = Fe3O4
2Zn + O2 = 2ZnO
2Cu + O2 = 2CuO
Золото и платиновые металлы не окисляются кислородом воздуха ни при каких условиях.
б) водородом (с образованием гидридов)
2Na + H2 = 2NaH
Ca + H2 = CaH2
в) хлором (с образованием хлоридов)
2K + Cl2 = 2KCl
Mg + Cl2 = MgCl2
2Al + 3Cl2 =2AlCl3
Обратите внимание: при взаимодействии железа образуется хлорид железа (III):
2Fe + 3Cl2 = 2FeCl3
г) серой (с образованием сульфидов)
2Na + S = Na2S
Hg + S = HgS
2Al + 3S = Al2S3
Обратите внимание: при взаимодействии железа образуется сульфид железа (II):
Fe + S = FeS
д) азотом (с образованием нитридов)
6K + N2 = 2K3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2. Взаимодействуют со сложными веществами:
Необходимо помнить, что по восстановительной способности металлы расположены в ряд, который называют электрохимическим рядом напряжений или активности металлов (вытеснительный ряд Бекетова Н.Н.):
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au, Pt
а) водой
Металлы, расположенные в ряду до магния, при обычных условиях вытесняют водород из воды, образуя растворимые основания – щелочи.
2Na + 2H2O = 2NaOH + H2↑
Ba + H2O = Ba(OH) 2 + H2↑
Магний взаимодействует с водой при кипячении.
Mg + 2H2O = Mg(OH) 2 + H2↑
Алюминий при удалении оксидной пленки бурно реагирует с водой.
2Al + 6H2O = 2Al(OH) 3 + 3H2↑
Остальные металлы, стоящие в ряду до водорода, при определенных условиях тоже могут вступать в реакцию с водой с выделением водорода и образованием оксидов.
3Fe + 4H2O = Fe3O4 + 4H2↑
б) растворами кислот
(Кроме концентрированной серной кислоты и азотной кислоты любой концентрации. См. раздел «Окислительно-восстановительные реакции».)
Обратите внимание: не используют для проведения реакций нерастворимую кремниевую кислоту
Металлы, стоящие в ряду до магния и активно реагирующие с водой, не используют для проведения таких реакций.
Металлы, стоящие в ряду от магния до водорода, вытесняют водород из кислот.
Mg + 2HCl = MgCl2 + H2↑
Обратите внимание: образуются соли двухвалентного железа.
Fe + H2SO4(разб.) = FeSO4 + H2↑
Образование нерастворимой соли препятствует протеканию реакции. Например, свинец практически не реагирует с раствором серной кислоты из-за образования на поверхности нерастворимого сульфата свинца.
Металлы, стоящие в ряду после водорода, НЕ вытесняют водород.
в) растворами солей
Металлы, стоящие в ряду до магния и активно реагирующие с водой, не используют для проведения таких реакций.
Для остальных металлов выполняется правило:
Каждый металл вытесняет из растворов солей другие металлы, расположенные в ряду правее него, и сам может быть вытеснен металлами, расположенными левее него.
Cu + HgCl2 = Hg + CuCl2
Fe + CuSO4 = FeSO4 + Cu
Как и в случае с растворами кислот, образование нерастворимой соли препятствует протеканию реакции.
г) растворами щелочей
Взаимодействуют металлы, гидроксиды которых амфотерны.
Zn + 2NaOH + 2H2O = Na2 [Zn(OH) 4] + H2↑
2Al + 2KOH + 6H2O = 2K[Al(OH) 4] + 3H2↑
д) с органическими веществами
Щелочные металлы со спиртами и фенолом.
2C2H5OH + 2Na = 2C2H5ONa + H2↑
2C6H5OH + 2Na = 2C6H5ONa + H2↑
Металлы участвуют в реакциях с галогеналканами, которые используют для получения низших циклоалканов и для синтезов, в ходе которых происходит усложнение углеродного скелета молекулы (реакция А.Вюрца):
CH2Cl-CH2-CH2Cl + Zn = C3H6(циклопропан) + ZnCl2
2CH2Cl + 2Na = C2H6(этан) + 2NaCl
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. При этом образуются одинарные (в молекулах H2, F2, Cl2, Br2, I2), двойные (в молекулах О2), тройные (в молекулах N2) ковалентные связи.
1. молекулярное
При обычных условиях большинство таких веществ представляют собой газы (Н2, N2, O2, O3, F2, Cl2) или твердые вещества (I2, P4, S8) и лишь единственный бром (Br2) является жидкостью. Все эти вещества молекулярного строения, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
2. атомное
Эти вещества образованы кристаллами, в узлах которых находятся атомы: (Bn, Сn, Sin, Gen, Sen, Ten). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением
ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма
мала.
Многие элементы – неметаллы образуют несколько простых веществ – аллотропных модификаций. Аллотропия может быть связана с разным составом молекул: кислород О2 и озон О3 и с разным строением кристаллов: аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен. Элементы – неметаллы, имеющие аллотропные модификации: углерод, кремний, фосфор, мышьяк, кислород, сера, селен, теллур.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. Эту способность характеризует значение электроотрицательности. В ряду неметаллов
At, B, Te, H, As, I, Si, P, Se, C, S, Br, Cl, N, O, F
электроотрицательность возрастает и усиливаются окислительные свойства.
Отсюда следует, что для простых веществ – неметаллов будут характерны как окислительные, так и восстановительные свойства, за исключением фтора – самого сильного окислителя.
1. Окислительные свойства
а) в реакциях с металлами (металлы всегда восстановители)
2Na + S = Na2S (сульфид натрия)
3Mg + N2 = Mg3N2 (нитрид магния)
б) в реакциях с неметаллами, расположенными левее данного, то есть с меньшим значением электроотрицательности. Например, при взаимодействии фосфора и серы окислителем будет сера, так как фосфор имеет меньшее значение электроотрицательности:
2P + 5S = P2S5 (сульфид фосфора V)
Большинство неметаллов будут окислителями в реакциях с водородом:
H2 + S = H2S
H2 + Cl2 = 2HCl
3H2 + N2 = 2NH3
в) в реакциях с некоторыми сложными веществами
Окислитель – кислород, реакции горения
CH4 + 2O2 = CO2 + 2H2O
2SO2 + O2 = 2SO3
Окислитель – хлор
2FeCl2 + Cl2 = 2FeCl3
2KI + Cl2 = 2KCl + I2
CH4 + Cl2 = CH3Cl + HCl
Ch2=CH2 + Br2 = CH2Br-CH2Br
2. Восстановительные свойства
а) в реакциях с фтором
S + 3F2 = SF6
H2 + F2 = 2HF
Si + 2F2 = SiF4
б) в реакциях с кислородом (кроме фтора)
S + O2 = SO2
N2 + O2 = 2NO
4P + 5O2 = 2P2O5
C + O2 = CO2
в) в реакциях со сложными веществами – окислителями
H2 + CuO = Cu + H2O
6P + 5KClO3 = 5KCl + 3P2O5
C + 4HNO3 = CO2 + 4NO2 + 2H2O
H2C=O + H2 = CH3OH
3. Реакции диспропорционирования: один и тот же неметалл является и окислителем и восстановителем
Cl2 + H2O = HCl + HClO
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
school4eg.jimdo.com
ЕГЭ. Химические свойства металлов
Химические свойства металлов
1. Щелочные (Li-Fr), щелочно-земельные (Ca-Ra) металлы, Mg
1) Реагируют с кислородом (подробнее)
Все Щ металлы, кроме Li, образуют не оксиды, а пероксиды:
2Li + O2 → 2Li2O
2Na + O2 → Na2O2
Оксиды получают взаимодействием пероксидов с металлом:
Na2O2 + 2Na → 2Na2O
2) Реагируют с водородом (подробнее)
3) Реагируют с водой (подробнее)
4) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
3Mg + 2P → Mg3P2 (t)
2Na + Cl2 → 2NaCl
Ca + 2C → CaC2 (t)
5) Реагируют с некоторыми кислотными оксидами:
CO2 + 2Mg → 2MgO + C
SiO2 + 2Mg → 2MgO + Si
SiO2 + 2Ca → 2CaO + Si
SiO2 + 2Ba → 2BaO + Si
6) Магний как восстановитель используется в производстве кремния и некоторых металлов:
2Mg + TiCl4 → 2MgCl2 + Ti (t)
7) Реакции Щ и ЩЗ металлов с растворами солей или кислот не рассматриваются, так как эти металлы очень бурно взаимодействуют с водой, и суммарная реакция изменится.
2. Алюминий
1) Реагирует с кислородом: 4Al + 3O2 → 2Al2O3
2) Не реагирует с водородом (из металлов только Щ и ЩЗ металлы взаимодействуют с водородом)
3) Реагирует с водой, если удалить оксидную пленку:
2Al + 6H2O → 2Al(OH)3 + 3H2
4) Реагирует с щелочами с выделением водорода (также Be и Zn):
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
5) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
2Al + 3Cl2 → 2AlCl3
4Al + 3C → Al4C3
2Al + N2 → 2AlN (t)
6) Используется для восстановления менее активных металлов (алюмотермия):
3FeO + 2Al → 3Fe + Al2O3
Cr2O3 + 2Al → 2Cr + Al2O3
7) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Al + H2SO4 (р) → Al2(SO4)3 + H2
8) Вытесняет менее активные металлы из их солей:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
9) На холоде пассивируется концентрированными растворами серной и азотной кислот. При нагревании реагирует без выделения водорода.
3. Железо
1) Реагирует с кислородом:
3Fe + 2O2 → Fe3O4 (железная окалина)
В присутствии воды образуется ржавчина:
4Fe + 3O2 + 6H2O  → 4Fe(OH)3
2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Fe + H2 → реакция не идет
3) Реагирует с парами воды с образованием оксида:
3Fe + 4H2O → Fe3O4 + 4H2 (t)
4) Не реагирует с щелочами
Fe + NaOH → реакция не идет
5) Реагирует с кислородом, серой, галогенами при нагревании:
2Fe + 3F2 → 2FeF3 (образуется соль Fe+3)
2Fe + 3Cl2 → 2FeCl3 (образуется соль Fe+3)
2Fe + 3Br2 → 2FeBr3 (образуется соль Fe+3)
Fe + I2 → FeI2 (образуется соль Fe+2)
Fe + S → FeS
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Fe + H2SO4 (р) → FeSO4 + H2 (образуется соль Fe+2)
Fe + 2HCl → FeCl2 + H2
7) Вытесняет менее активные металлы из их солей:
Fe + CuSO4 → FeSO4 + Cu (образуется соль Fe+2)
8) На холодe пассивируется концентрированными растворами серной и азотной кислот (т.е. реакция не протекает). При нагревании реагирует без выделения водорода:
Fe + 6HNO3(к) → Fe(NO3)3 + 3NO2 + 3H2O (образуется соль Fe+3)
2Fe + 6H2SO4(к) → Fe2(SO4)3 + 3SO2 + 6H2O (образуется соль Fe+3)
9) Соединения Fe+3 реагируют с железом, медью, восстанавливаясь до Fe+2:
2FeCl3 + Fe → 3FeCl2
Fe3O4 + Fe → 4FeO
Fe2O3 + Fe  → 3FeO
4. Хром
1) Реагирует с кислородом:
4Cr + 3O2 → 2Cr2O3
2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Cr + H2 → реакция не идет
3) Реагирует с парами воды с образованием оксида:
2Cr + 3H2O → Cr2O3 + 3H2 (t)
4) Не реагирует с щелочами
Cr + NaOH → реакция не идет
5) Реагирует с кислородом, серой, галогенами при нагревании:
2Cr + 3Cl2 → 2CrCl3 (образуется соль Fe+3)
2Cr + 3Br2 → 2CrBr3 (образуется соль Fe+3)
Cr + S → Cr2S3 (образуется соль Fe+3)
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Cr + H2SO4 (р) → CrSO4 + H2 (образуется соль Cr+2)
Cr + 2HCl → CrCl2 + H2 (образуется соль Cr+2)
7) Пассивируется концентрированным и разбавленным растворами азотной кислоты (т.е. реакция не протекает).
5. Медь
1) Реагирует с кислородом:
2Cu + O2 → 2CuO
2) Реагирует с соединениями Cu+2 с образованием промежуточной степени окисления +1:
CuO + Cu → Cu2O
CuCl2
chemrise.ru
Общая характеристика элементов металлов — урок. Химия, 8–9 класс.
Металлы в природе
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами.
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Ряд активности металлов
| \(Li, K, Ba, Ca, Na, \) | \(Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb\) | h3 | \(Cu, Hg, Ag, Pt, Au\) |
активные металлы | металлы средней активности | неактивные металлы |
Металлические элементы, образующие химически активные металлы (Li–Mg), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.
 |  | |
Сильвин — хлорид калия KCl с примесями | Минерал галит состоит из хлорида натрия NaCl | Минерал кальцит состоит из карбоната кальция CaCO_3 |
В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca3(PO4)2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности (Al–Pb), в природе чаще всего встречаются в виде оксидов и сульфидов.
 |  | |
Минерал корунд состоит из оксида алюминия Al_2O_3 | Оксид железа(\(III\)) Fe_2O_3 образует минерал гематит | Минерал галенит cостоит из сульфида свинца(\(II\)) PbS |
Металлические элементы, образующие химически неактивные металлы (Cu–Au), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Самородное золото Au | Самородное серебро Ag | Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.
 |  |  |
Минерал медный блеск состоит из сульфида меди \(I\)) Cu_2S | Гидроксокарбонат меди(\(II\)) (CuOH)_2CO_3 малахит | Минерал киноварь состоит из сульфида ртути(\(II\)) HgS |
Положение элементов металлов в Периодической системе, особенности строения и свойств их атомов
В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Положение металлов в Периодической системе. Знаки металлических химических элементов выделены красным цветом
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны (электроны внешнего энергетического уровня).

Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов (выделены красным цветом) уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей.
www.yaklass.ru
2. Химические свойства Металлов и Неметаллов
1. Металлы реагируют с неметаллами.
2 Me + n Hal2 → 2 MeHaln
4Li + O2 = 2Li2O
Щелочные металлы, за исключением лития, образуют пероксиды:
2Na + O2 = Na2O2
2. Металлы, стоящие до водорода, реагируют с кислотами (кроме азотной и серной конц.) с выделением водорода
Me + HCl → соль + h3↑
2 Al + 6 HCl → 2 AlCl3 + 3 h3↑
Pb + 2 HCl → PbCl2↓ + h3↑
3. Активные металлы реагируют с водой с образованием щелочи и выделением водорода.
2Me + 2nH2O → 2Me(OH)n + nH2
Продуктом окисления металла является его гидроксид – Me(OH)n (где n-степень окисления металла).
Например:
Ca + 2H2O → Ca(OH)2 + H2↑
4. Металлы средней активности реагируют с водой при нагревании, образуя оксид металла и водород.
2Me + nH2O → Me2On + nH2
Продукт окисления в таких реакциях – оксид металла Me2On (где n-степень окисления металла).
3Fe + 4H2O → Fe2O3·FeO + 4H2
5. Металлы, стоящие после водорода, с водой и растворами кислот (кроме азотной и серной конц.) не реагируют
6. Более активные металлы вытесняют менее активные из растворов их солей.
CuSO4 + Zn = Zn SO4 + Cu
CuSO4 + Fe = Fe SO4 + Cu
Активные металлы ‑ цинк и железо заместили медь в сульфате и образовали соли. Цинк и железо окислились, а медь восстановилась.
7. Галогены реагируют с водой и раствором щелочи.
Фтор в отличие от других галогенов воду окисляет:
2H2O + 2F2 = 4HF + O2.
на холоде: Cl2+2KOH=KClO+KCl+h3OCl2+2KOH=KClO+KCl+h3O образуется хлорид и гипохлорит
при нагревании: 3Cl2+6KOH−→KClO3+5KCl+3h3O3Cl2+6KOH→t,∘CKClO3+5KCl+3h3O образуется лорид и хлорат
8 Активные галогены (кроме фтора) вытесняют менее активные галогены из растворов их солей.
HBr HF HCl HI
9. Галогены не реагируют с кислородом.
10. Амфотерные металлы (Al, Be, Zn) реагируют с растворами щелочей и кислот.
3Zn+4h3SO4=3ZnSO4+S+4h3O
11. Магний реагирует с углекислым газом и оксидом кремния.
2Мg + CO2 = C + 2MgO
SiO2+2Mg=Si+2MgO
12. Щелочные металлы (кроме лития) с кислородом образуют пероксиды.
2Na + O2 = Na2O2
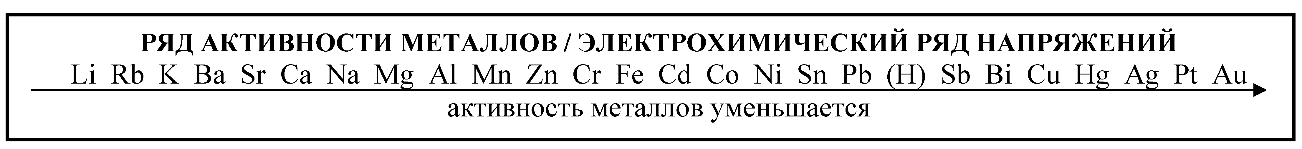
3. Классификация неорганических соединений
Простые вещества – вещества, молекулы которых состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения) – вещества, молекулы которых состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
Простые вещества разбиваются на две большие группы: металлы и неметаллы.
Металлы – группа элементов, обладающая характерными металлическими свойствами: твёрдые вещества (исключение составляет ртуть) имеют металлический блеск, являются хорошими проводниками теплоты и электричества, ковкие (железо (Fe), медь (Cu), алюминий (Al), ртуть (Hg), золото (Au), серебро (Ag) и др.).
Неметаллы – группа элементов: твёрдые, жидкие (бром) и газообразные веществ, которые не обладают металлическим блеском, являются изоляторы, хрупкие.
А сложные вещества в свою очередь подразделятся на четыре группы, или класса: оксиды, основания, кислоты и соли.
Оксиды – это сложные вещества, в состав молекул которых входят атомы кислорода и какого – нибудь другого вещества.
Основания – это сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами.
С точки зрения теории электролитической диссоциации, основания – сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или Nh5+) и гидроксид – анионы OH-.
Кислоты – это сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на атомы металла.
Соли – это сложные вещества, молекулы которых состоят из атомов металлов и кислотных остатков. Соль представляет собой продукт частичного или полного замещения атомов водорода кислоты металлом.
studfile.net
Химия металлов :: Основы химии металлов :: Металлы. Простые вещества :: Химические свойства металлов
Щелочные металлы образуют катион типа Ме+, s-металлы второй группы образуют катионы Ме2+.Металлы р-блока при растворении в кислотах образуют катионы, указанные в таблице.
Металлы Pb и Bi растворяют только в азотной кислоте.
| Me | Al | Ga | In | Tl | Sn | Pb | Bi |
| Mez+ | Al3+ | Ga3+ | In3+ | Tl+ | Sn2+ | Pb2+ | Bi3+ |
| Eo,B | –1,68 | –0,55 | –0,34 | –0,34 | –0,14 | –0,13 | +0,317 |
Все d-металлы 4 периода, кроме Cu, могут быть окислены ионами Н+ в кислых растворах.
Типы катионов, образуемых d-металлами 4 периода:
- Ме 2+ (образуют d-металлы начиная от Mn до Cu)
- Ме 3+ (образуют Sc, Ti , V , Cr и Fe в азотной кислоте).
- Ti и V образуют также катионы МеО 2+
В кислых растворах Н+ может окислить: Y, La, Сd.
В HNO3 могут растворяться: Cd, Hg, Ag. В горячей HNO3 растворяются Pd, Tc, Re.
В горячей H2SO4 растворяются: Ti, Zr, V, Nb, Tc, Re, Rh, Ag, Hg.
Металлы: Ti, Zr, Hf, Nb, Ta, Mo, W обычно растворяют в смеси HNO3 + HF.
В царской водке (смеси HNO3 + HCl) можно растворить Zr, Hf, Mo, Tc, Rh, Ir, Pt, Au и Os с трудом). Причиной растворения металлов в царской водке или в смеси HNO3 + HF является образование комплексных соединений.
Пример. Растворение золота в царской водке становится возможным из-за образования комплекса [AuCl4]—
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
media.ls.urfu.ru
ЕГЭ. Химические свойства неметаллов
Химические свойства неметаллов
1. Галогены
1) С кислородом из галогенов реагирует только фтор:
F2 + O2 → O2F2 (или OF2)
Cl2 + O2 → реакция не идет.
2) С водой реагируют все галогены, но по-разному: фтор окисляет воду, другие галогены диспропорционируют в ней:
2F2 + 2H2O → 4HF + O2
Cl2 + H2O → HCl + HClO
3) Все галогены взаимодействуют с водородом:
H2 + F2 → 2HF
H2 + Cl2 → 2HCl
H2 + Br2 → 2HBr
4) Из солей галогены реагируют: 1) с галогенидами (если галоген в простом веществе является более сильным окислителем, чем галоген в соли) и 2) с сульфидами:
Cl2 + CaBr2 → CaCl2 + Br2
Cl2 + CaF2 → реакция не идет, так как Cl2 обладает менее выраженными окислительными свойствами, чем F2.
С сульфидами:
Br2 + Na2S → 2NaBr + S.
Если можем окислить металл:
Cl2 + 2FeCl2 → 2FeCl3
5) Все галогены реагируют с металлами:
3F2 + 2Fe → 2FeF3
3Br2 + 2Fe → 2FeBr3
Cl2 + Cu → CuCl2
Окислительный свойства йода выражены слабее, чем у других галогенов, поэтому с такими металлами, как Fe и Cu, он взаимодействует по-другому:
I2 + Fe → FeI2
I2 + 2Cu — > 2CuI
6) Галогены — сильные окислители, окисляют такие сложные вещества, как H2S, H2O2, NH3, SO2 и др:
Br2 + H2S → S + 2HBr
H2O2 + Cl2 → 2HCl + O2
3Cl2 + 8NH3 → N2 + 6NH4Cl
Cl2 + 2FeCl2 → 2FeCl3
7) Не реагируют с оксидами
8) Не реагируют с кислотами за исключением одной реакции (только I2 и только с концентрированной азотной кислотой):
10HNO3(конц.) + I2 → 2HIO3 + 10NO2 + 4H2O (t)
9) Диспропорционируют в растворах щелочей:
2F2 + 2NaOH → OF2 + 2NaF + H2O (продукты этой реакции на ЕГЭ не проверяются, но необходимо знать, что реакция протекает)
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2).
2. Сера (желтое вещество, плавает на поверхности воды, не смачиваясь ею)
1) реагирует с кислородом:
S + O2 → SO2
2) Реагирует с водородом:
S + H2 <=> H2S
3) Реагирует с металлами
S + Fe → FeS (t)
2Na + S → Na2S
4) Реагирует со всеми неметаллами, кроме N2, I2 и благородных газов:
S + N2 → реакция не идет
S + I2 → реакция не идет
5S + 2P → P2S5
2S + C → CS2
S + 3F2 → SF6
S + Br2 → SBr2
5) Реагирует с кислотами-окислителями:
S + 6HNO3(конц.)  → H2SO4 + 6NO2 + 2H2O
S + 2HNO3(разб.) → H2SO4 + 2NO
S + H2SO4(конц.) → 3SO2 + 2H2O (t)
3. Азот (прочная тройная связь)
Реагирует только с O2, H2, F2 (со фтором реакции на ЕГЭ не встречаются) и металлами.
1) Реагирует с кислородом (электрический разряд или 2000ºС)
N2 + O2 → 2NO
2) Реагирует с водородом (обратимая, экзотермическая реакция):
N2 + 3H2 <=> 2NH3
3) Реагирует с металлами с образованием нитридов (с Li без нагревания, с остальными — только при нагревании):
N2 + 2Al → 2AlN (t)
N2 + 3Mg → Mg3N2 (t)
4) Не реагирует с H2O, кислотами, оксидами, солями.
4. Фосфор
Основные аллотропные модификации: красный (атомная кристаллическая решетка) и белый (P4, молекулярная кристаллическая решетка). Белый фосфор — ядовитое вещество, самовоспламеняется на воздухе. Красный фосфор стабилен и ядовитым не является.
1) Реагирует с кислородом:
4P + 3O2 → 2P2O3 (недостаток O2)
4P + 5O2 → 2P2O5 (избыток O2)
2) Не реагирует с водородом:
P + H2 → реакция не идет.
3) Диспропорционирует в растворах щелочей:
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 (t°, гипофосфит натрия)
4) Реагирует с кислотами-окислителями:
2P + 5H2SO4(конц.) → 2H3PO4 + 5SO2 + 2H2O (t)
5HNO3(конц.) + P → H3PO4 + 5NO2 + H2O
5HNO3(разб.) + 3P +2H2O → 3H3PO4 + 5NO
5) Окисляется сильными окислителями:
6P + 5KClO3 → 3P2O5 + 5KCl
6) Реагирует с металлами с образованием фосфидов:
P + Na → Na3P
2P + 3Ca → Ca3P2
7) Реагирует с серой, галогенами:
2P + 3Cl2  → 2PCl3 (недостаток Cl2)
2P + 5Cl2 → 2PCl5 (избыток Cl2)
2P + 3I2 → 2PI3 (с I2 возможно только образованием PI3, PI5 не образуется)
8) Реагирует с соединениями P+5:
3PCl5 + 2P → 5PCl3
5. Углерод
1) Реагирует с кислородом:
C + O2 → CO2
2) Реагирует с водородом:
С + 2H2 → CH4
3) Реагирует с кислотами-окислителями:
C + H2SO4(конц.) → CO2 + 2SO2 + 2H2O (t)
C + 4HNO3(конц.)  → CO
chemrise.ru