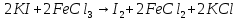| |||
соединения | разложения | замещения | обмена |
Из нескольких простых или сложных веществ образуется одно сложное вещество
| Из одного сложного вещества образуется несколько простых или сложных веществ
| Это реакция между простым и сложным веществами, при которой атомы простого вещества замещают атомы одного из элементов сложного вещества
| Реакция между двумя сложными веществами, при которой вещества обмениваются своими составными частями
|
Классификация по тепловому эффекту | |||
Эндотермичекая | Экзотермическая | ||
|
| ||
Классификация реакций по изменению степени окисления | |||
С изменением степени окисления элементов | Без изменения степени окисления элементов | ||
|
| ||
Классификация по агрегатному состоянию реагирующих веществ | |||
Гомогенные | Гетерогенные | ||
Реагирующие вещества взяты в одном агрегатном состоянии | Реагирующие вещества взяты в разных агрегатных состояниях | ||
Классификация по числу и составу исходных веществ | |||
соединения | разложения | замещения | обмена |
Из нескольких простых или сложных веществ образуется одно сложное вещество
| Из одного сложного вещества образуется несколько простых или сложных веществ
| Это реакция между простым и сложным веществами, при которой атомы простого вещества замещают атомы одного из элементов сложного вещества
| Реакция между двумя сложными веществами, при которой вещества обмениваются своими составными частями
|
Классификация по тепловому эффекту | |||
Эндотермичекая | Экзотермическая | ||
|
| ||
Классификация реакций по изменению степени окисления | |||
С изменением степени окисления элементов | Без изменения степени окисления элементов | ||
|
| ||
Классификация по агрегатному состоянию реагирующих веществ | |||
Гомогенные | Гетерогенные | ||
Реагирующие вещества взяты в одном агрегатном состоянии | Реагирующие вещества взяты в разных агрегатных состояниях | ||
| Этап урока | Учитель | Ученики |
| 1. Организационный момент |
Сообщение темы и цели урока (слайд 2, 3) |
Записывают в тетради |
| 2. Актуализация знаний | Ведет фронтальный опрос: физические и химические явления 2. www.fcior.edu.ru/ |
1. Отвечают на вопросы учителя; 2. Работает один ученик с модулем, |
| 3. Изучение нового материала | Недавно, перелистывая старые журналы, мне на глаза попалась старая химическая сказка, которую я решила прочитать вам. Но вы должны будете выполнить некоторое задание… Читает химическую сказку (Приложение 1) |
Выполняют задание в тетрадях : 1. Выписать все физические явления, о которых идет речь в сказке 2. Выписать все вещества, о которых идет речь в сказке 3. Выписать химические явления, о которых идет речь в сказке |
| Проверка выполненного задания (слайд 4) |
Проверяют задание | |
| Формирование понятия реакция соединения: (слайд 5) А теперь и мы давайте мысленно перенесемся в королевство Марьи Ивановны – химическую лабораторию — и поближе познакомимся с ее подданными. А знакомство начнем с аммиака и соляной кислоты… Вопросы учителя (эти вопросы одинаковы для всех типов реакций) План: 1.Какие вещества вступают в реакцию? 2. Каковы условия возникновения химической реакции 3.Назовите признаки протекания химической реакции 4.Запишите уравнение химической реакции 5.Что общего между записанными реакциями? (наводящий вопрос: сколько и какие вещества вступают в реакцию?) 6.Какое название вы дали бы реакциям такого вида? 7. Попробуйте дать определение таким реакциям. В случае если произвести демонстрацию любого опыта не возможно — можно заменить их видеороликами, взятыми: Единая коллекция цифровых образовательных ресурсов school-collection.edu.ru/catalog/teacher/ |
Отвечают на вопросы и записывают в тетрадь основные моменты по мере появления их в презентации (план работы со слайдом одинаков для всех типов реакций) 1. Взаимодействующие вещества 2. Условия возникновения химической реакции 3. Признаки протекания химической реакции 4. Уравнение химической реакции 5. Общая схема реакций 6. Тип реакции 7. Определение реакции соединения |
|
| Формирование понятия реакция разложения: (слайд 6) Продолжаем наше путешествие: сейчас мы находимся на острове солей, где извергается знаменитый вулкан «бихромат аммония» и я предлагаю посмотреть это. |
Отвечают на вопросы учителя, подобные тем, что были заданы при рассмотрении реакции соединения и самостоятельно в ходе беседы выводят общую схему реакции разложения, дают определение. Записывают в тетрадь основные моменты по мере появления их в презентации |
|
| Формирование понятия реакция замещения: (слайд 7) Ну а теперь милости прошу, гости дорогие. Знакомьтесь: вода-невеста и жених-натрий. Демонстрация реакции Взаимодействия натрия с водой |
Отвечают на вопросы учителя, подобные тем, что были заданы при рассмотрении реакции соединения, разложения и самостоятельно в ходе беседы выводят общую схему реакции замещения, дают определение. Записывают в тетрадь основные моменты по мере появления их в презентации | |
| Формирование понятия реакция обмена: (слайд 8-11) У нас осталось два вещества, с которыми мы еще не успели познакомиться: сульфата меди (II) с гидроксидом натрия Лабораторный опыт: Взаимодействие сульфата меди (II) с гидроксидом натрия В случае если произвести лабораторный опыт не возможно — можно заменить их видеороликами. ( тогда слайд №8-10 можно опустить) |
Учащиеся слушают 1. Инструкцию по выполнению работы 2. инструктаж по технике безопасности 3. выполняют лабораторный опыт 4. обсуждаем и записываем результаты проведенной работы по вышеописанному плану |
|
| Учитель задает вопросы, обобщающие полученные знания учащихся о классификации реакций: 1. По числу и составу исходных и образующихся веществ 2. По тепловому эффекту (слайд 12) |
Учащиеся отвечают на поставленные вопросы и фиксируют в тетради общую схему классификации | |
| Учитель дает Задание №1: Укажите тип химической реакции Проверяет по ходу выполнения упражнения (слайд 13) |
Один ученик работает у компьютера, остальные учащиеся работают устно. | |
| Учитель объясняет правила выполнения Задание №2: Химическое лото (приложение 2) разложить карточки цветной стороной вверх, правильно совмещая уравнение химической реакции и его тип. Проверяет после выполнения задания каждой парой (слайд 14) |
Учащиеся работают в парах, по мере выполнения учащимся выдается новый вариант лото |
|
| Учитель объясняет правила выполнения Задание №3: Химическая атака Проверяет правильность выполнения задания: фиксирует правильные /неправильные ответы, выставляет баллы (слайд 15, 16) |
Класс делится на 4 группы. Учащиеся работают в группах, определяя реакции определенного вида ( реакции соединения, разложения, обмена, замещения) Учащийся от каждой группы выходят и по очереди открывают свой тип реакции, стараясь как можно быстрее открыть все свои реакции |
|
Расставить коэффициенты в записанных схемах химических реакций |
Выполняют задание в тетради, проводят взаимопроверку, сдают учителю. |
|
| 5. Подведение итогов урока | Учитель подводит итоги урока, выставляет оценки |
|
| 6. Домашнее задание | Учитель дает домашнее задание | Учащиеся записывают домашнее задание |
Обобщение и систематизация знаний по теме «Типы химических реакций»
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Тип урока: обобщение и систематизация знаний и умений.
Дидактическая цель: обобщить и систематизировать знания учащихся, полученные при изучении темы.
Задачи:
- Образовательные:
- повторить и закрепить знания о типах химических реакций по количеству и составу исходных и образующих веществ в стандартных и нестандартных ситуациях, признаки, характеризующие протекания химических реакций, умение применять закон сохранения массы веществ.
- развивать умения сравнивать, классифицировать, обобщать факты и понятия.
- Развивающие:
- развивать общеучебные умения и навыки (планирование ответа, логически рассуждать, применять свои знания на практике).
- Воспитательные:
- воспитывать коллективизм, умение работать в парах, проводить рефлексию собственной деятельности.
Психологическая цель: создание комфортного микроклимата для каждого обучающегося.
Методы обучения: репродуктивный, объяснительно-иллюстративный, частично-поисковый.
Формы обучения: фронтальная, индивидуальная, парная, индивидуализированная.
Оборудование и реактивы: кусочек мела в ступке, медная проволока, спиртовка, держатель, пробирки, штатив для пробирок, растворы: NаOH, СuСl2, Fe, таблицы: “Растворимость гидроксидов и солей в воде”, “Периодическая система химических элементов Д. И. Менделеева”, “Классификация химических реакций в неорганической химии”, тесты, опорные схемы, дидактические карточки.
План урока
- Оргмомент.
- Целеполагание и мотивация.
- Актуализация.
- Систематизация.
- Применение учебного материала в знакомой и новой учебных ситуациях.
- Проверка уровня обученности.
- Информация о домашнем задании.
- Рефлексия.
- Завершение урока с выставлением и комментарием оценок.
ХОД УРОКА
I. Оргмомент
II. Целеполагание и мотивация
Перед учащимися в доступной форме ставится цель урока, мотивируется значимость данной темы при дальнейшем изучении курса химии.
Учитель: Вот мы и научились писать
химические предложения в виде химических
уравнений. Как в русском языке предложения
бывают восклицательные, вопросительные и
побудительные, химические реакции бывают
соединения, разложения, замещения, обмена.
Сегодня на уроке мы еще раз повторим и приведем в
систему знания, о типах химических реакций
опираясь на основные понятия.
Для чего они вам пригодятся?
Для изучения химических свойств веществ, которые
характеризуем химическими уравнениями.
Решать расчетные задачи по уравнениям, ведь вы
уже убедились, что если неверно составлено
уравнение, не правильно расставлены
коэффициенты задача будет решена неверно.
III. Актуализация
Учитель: Для начала давайте вспомним основные понятия и проведем химическую разминку.
Работа с классом путем фронтальной беседы по вопросам химической разминки (На каждом ученическом столе находится дидактический материал.
I. Химическая разминка
1. Что такое химическое явление, чем оно
отличается от физического?
2. Укажите известные вам признаки химических
реакций?
3. Дайте определение химической реакции.
4. Каковы условия течения химических реакций?
5. Какие реакции относятся к:
а) реакциям соединения,
б) реакциям разложения,
в) реакциям обмена,
г) реакциям замещения.
IV. Систематизация
Учитель: Продолжаем нашу разминку.
II. Дифференцированная работа по типам химических реакций и подбору коэффициентов.
Учитель: А теперь проверим, как вы
умеете отличать химические реакции друг от
друга. В задании №2 у вас записаны схемы
химических реакций. Из предложенного перечня
выберите реакции, и расставить коэффициенты:
первый вариант – в реакциях соединения, второй –
разложения, третий – замещения, четвертый –
обмена.
Ученики работают самостоятельно в течение 3
минут. Правильность выполнения проверяется
через запись на компьютере. На данном этапе
закрепляется умения читать уравнения.
Критерии оценки: ошибок нет – оценка «5»;
одна ошибка – оценка «4»; две ошибки – оценка
«3»; более трех ошибок – незачет.
III. Работа с химическими уравнениями
Из приведенного перечня схем химических реакций выберите:
1 вариант – реакции соединения,
2 вариант – реакции разложения,
3 вариант – реакции обмена,
4 вариант – реакции замещения.
1. HgO ––> Hg + O2 2. Сu(OH)2 + HCl ––> H2O + CuCl2
3. Al + O2 ––> Al2O3 4. KBr + Cl2 ––> KCl + Br2
5. Zn + HCl ––> ZnCl2 + H2 6. Ca + O2 ––> CaO
7. СuCl2 + NaOH ––> Cu(OH)2 + NaCl 8. H2O ––> H2 + O2
1. По какому признаку определили тип реакции?
2. Почему приведенную запись мы называем схемой?
3. Что уравниваем в уравнении реакции?
4. На основании, какого закона расставляем
коэффициенты?
5. Расставьте коэффициенты в приведенных выше
схемах реакций.
Учитель: Всем вам известно выражение: “Теория проверяется практикой”.
Ученический эксперимент
Цель: закрепить знания о физических и химических явлениях.
Задачи:
- Развить умения сравнивать классифицировать явления природы.
- Развить умения и навыки логически рассуждать, планировать ответ.
№1. Растереть в ступке мел. Объяснить какое это явление и почему вы так считаете.
(Ученик у доски растирает в ступке мел и делает вывод, что произошло физическое явление, т. к. нового вещества не образовалось).
№2. Прокалить медную проволоку
Прокомментировать свои наблюдения, и
определить вид явления.
Перед экспериментом повторяются правила по
технике безопасности при работе со спиртовкой.
(2-й ученик прокаливает медную проволоку над пламенем спиртовки, наблюдает образование налета и делает заключение, что произошла химическая реакция, т. к. образовалось новое вещество).
Так как это химическое явление, то запишите
уравнение реакции горения меди. Помните! При
горении медь, проявляет высшую степень
окисления. Определите тип и продукты химической
реакции. Расставьте коэффициенты.
На основании опытов делается вывод: Теперь
мы с вами на практике убедились и увидели чем
отличается физическое явление от химического.
Здесь же мы пронаблюдали один из типов
химической реакции – реакции соединения.
V. Применение учебного материала в знакомой и новой учебных ситуациях
Экспериментальная работа:
Цель: закрепить знания о химических реакциях.
Задачи:
- Повторить и закрепить знания о типах химических реакций по количеству и составу исходных веществ и продуктов реакции;
- Развить самостоятельность, логическое мышление;
- Воспитать коллективизм, умение работать в парах.
1. Реакция обмена между хлоридом меди (II) и гидроксидом натрия.
На экране записана схема: NaOH + CuCl2 ––>
Перед учащимися ставится задача определить
продукты взаимодействия между гидроксидом
натрия и хлоридом меди (II).
Учитель: Запишите по схеме уравнение
реакции взаимодействия между гидроксидом натрия
и хлоридом меди (II). (Ученики записывают
уравнения реакции).
– Какие вещества вступают в реакцию? (Сложные)
– Какой тип реакции? (Обмена)
– Какие продукты будут образовываться? (Гидроксид
меди (II) и хлорид натрия).
Найдите в таблице растворимости эти вещества,
что можно сказать о них? (Гидроксид меди (II) –
нерастворимое основание, следовательно,
выпадает в осадок, в уравнении около этой формулы
ставим )
Спрогнозированный результат сравнивают с
реальным при выполнении лабораторного опыта.
– Мы с вами спрогнозировали результат данной
реакции. Давайте, убедимся, на практике проведя
эксперимент.
Проводится лабораторная работа учениками под
руководством учителя.
На основании всего этого делается вывод о типе
проведенной реакции и признаке ее протекания.
2. Разложение гидроксида меди (II).
Учитель: Теперь возьмите пробирку, в которой получен гидроксид меди (II), закрепите в пробиркодержатель, проведите нагревание. Не забывая про технику безопасности:
1. Сначала прогреваем всю пробирку, а затем
нагреваем раствор.
2. Нагревание проводим в верхней части пламени, т.
к. именно оно обладает самой высокой
температурой.
Учащиеся проводят опыт “разложение гидроксида меди (II)”, наблюдают за происходящими изменениями.
– Какие изменения вы наблюдаете? (Появление черного осадка, а на стенках пробирки капли воды)
Один ученик на доске, а остальные в тетрадях записывают уравнение реакции
Cu(OH)2 ––> CuO + H2O
Вывод: Таким образом, произошла
реакция разложения, т. к. из одного сложного
вещества образовалось два новых сложных
вещества.
3. Взаимодействие хлорида меди (II) с железом
Учитель: Нам осталось рассмотреть еще
один тип химической реакции. Давайте заложим
опыт. В пробирку со стальным гвоздем прильем
раствор хлорида меди (II). Какие изменения
происходят, мы увидим позже, а пока запишем
уравнение реакции.
Пока протекает реакция, ученики записывают
уравнение в дидактическую тетрадь.
CuCl2 + Fe ––> Fe Cl2 + Cu, определяется
ее тип.
А теперь посмотрите, произошли или изменения в
пробирке в заложенным нами опытом? (Стальной
гвоздь покрывается красным налетом – медью, а
раствор изменился с голубого на зеленый).
– Какой вывод можно сделать?
Ученики на основании наблюдений делают
соответствующий вывод.
Учащиеся делают общий вывод о
классификации химических реакций по числу
исходных и образующихся веществ. Для
затрудняющихся самостоятельно сделать вывод
предлагается опорная схема
Классификация химических реакций по числу и составу исходных и образующих веществ
| Разложения Реакция, в которой из одного сложного вещества получается несколько простых или сложных веществ: АВ––>А + В |
Обмена Реакция, протекающая между двумя сложными веществами при которых они обмениваются составными частями: АВ + СД ––> АД + СВ |
| Замещения Реакция, протекающая между простым и сложным веществами, при которой атомы простого вещества замещают атомы одного из элементов А + ВС ––> АС + В |
СоединенияР Реакция, в результате которой из двух или нескольких простых или сложных веществ образуется одно более сложное вещество: А + В ––> АВ |
VI. Проверка уровня обученности
Задание 1. Работа по вариантам I, II
Определить тип каждой химической реакции.
Из букв, которыми обозначены правильные ответы,
вы получите:
I вариант – фамилию французского химика,
сформулировавшего в 1789 году независимо от
Ломоносова, закон сохранения массы веществ.
II вариант – фамилию ученого, одного из
основоположников атомно-молекулярного учения.
I вариант.
Определите тип каждой химической реакции.
И
Конспект урока химии «Основные типы химических реакций»
Урок.
Тема урока : «Основные типы химических реакций ».
— сформировать представление о типах химических реакций ,
научить распознавать тип химической реакции, отработать навыки
расстановки коэффициентов в схемах реакций;
— развивать общеучебные умения и навыки(работа с учебником),
умения использовать свои знания для решения практических задач,
умение работать в коллективе, где развиваются чувства
доброжелательности и товарищества;
— воспитательные : формировать условия для развития материалистического
мировоззрения, взаимопомощь, самооценка и самоконтроль.
Планируемые результаты:
предметные: классификация химических реакций по числу и составу исходных веществ и продуктов реакции- реакции горения, соединения, замещения, разложения. Сущность этих реакций анализировать, делать выводы, обобщать полученные знания;самостоятельно использовать материалы учебника и справочные таблицы, применять ранее полученные знания
метапредметные:
—регулятивные: следовать определенному алгоритму при характеристике веществ, при составлении уравнений химических реакций ; проводить рефлексию своих действий по выполнению заданий самостоятельно и при помощи одноклассников, вносить необходимые изменения в свои действия на основе принятых правил;
—познавательные: выделять информацию из текста учебника; высказывать суждения, обосновывать и доказывать свой выбор, приводя факты, взятые из материалов учебника; использовать знаки, символы, схемы для выполнения заданий; находить закономерности, устанавливать причинно- следственные связи между реальными объектами и явлениями; осуществлять поиск информации в соответствии с поставленной задачей, используя различные ресурсы информационной среды;
—коммуникативные: уметь слушать собеседника, понимать и /или принимать его точку зрения; оценивать высказывания и действия партнера, сравнивать их со своими высказываниями; формулировать высказывания, задавать вопросы, адекватные ситуации и учебной задаче; проявлять инициативу в ситуации общения;
Ресурсы и оборудование:
источники информации: учебник И.И.Новошинский, Н.С.Новошинская, Химия 8 класс, М.,Русское слово, 2009; рабочая программа, технологическая карта урока, презентация к уроку; модуль ФЦИОР «Типы химических реакций» Запишите уравнения, характеризующие типы химических реакций»
оборудование: компьютер, проектор, микролаборатория
дидактическое сопровождение: ПСХЭ, презентация к уроку,
материалы для познавательной деятельности учеников: инструктивная карта, карточки для индивидуальной работы
Ход урока
1.Организационный момент
Здравствуйте! Сегодня у нас необычный урок. У нас сегодня урок – исследование. Для исследования нам необходимо следующее оборудование: микролаборатория, инструктивные карты, карточки с индивидуальными заданиями, презентация.
2.Актуализация знаний. Проверка домашнего задания.
Что мы изучали на прошлом уроке? Вспомним основные понятия.
Фронтальный опрос.
1. Какие явления называются физическими, приведите примеры?
2. Какие явления называются химическими, приведите примеры?
3.Что такое соли, номенклатура и классификация?
4. Что такое кислоты , номенклатура и классификация?
5. Что такое основания, номенклатура и классификация?
3. Самоопределение к деятельности
Демонстрации.
Реакция соединения — горение магния , угля.
Реакция разложения — разложение гидроксида меди(II).
Реакция замещения — раствор гидроксида меди(II) и железный гвоздь.
Работа по теме урока
Беседа.
Во время урока учащиеся заполняют индивидуальные листы опроса, после урока листы собираются и проверятся.
Химических реакций, как и веществ, очень много. Чтобы легче было изучать химические реакции, их, как и вещества классифицируют по определенным признакам.
1. Классификация химических реакций по числу и составу исходных
веществ и продуктов реакции (показ слайдов)
2.Реакции соединения — это реакции , в результате которых из двух или
несколько простых веществ образуется одно сложное вещество. (показ
слайдов)
3.Реакции разложения – это реакции , при которых из одного сложного
вещества образуются два или несколько простых веществ. (показ
слайдов). Работа с заданиями.
4.Реакции между простым и сложным веществом, при протекании которых
атомы простого вещества замещают атомы одного из элементов сложного
вещества (показ слайдов).
5.Реакции обмена – это реакции между двумя сложными веществами, при
протекании которых они обмениваются своими составными частями, с
образованием новых сложных веществ. (показ слайдов)
Работа в парах. Теперь поработаем самостоятельно, на доске задание – закончить уравнения возможных реакций: Слайд 8-11
6. Работа с учебником в группах Работа с карточками.
7. Рефлексия.
Вспомните, какую цель мы поставили перед собой в начале урока. Сделайте вывод, выполнена ли она. Давайте посмотрим, выполнили ли мы задачи, которые поставили перед собой в начале урока. Для этого у вас на столах лежат задания (Приложение №2)
Выполнив задания, определите, насколько вы достигли поставленную цель?
8. Подведение итогов урока
Какие трудности вы испытывали при выполнении заданий?(Обоснование отдельных учащихся оценки своей деятельности.)
Попробуйте составить уравнения реакции соединения, разложения, замещения и обмена
Поставьте себе общую оценку за работу на уроке.
9.Домашнее задание: учебник §30, выучить определения.
Вы сегодня хорошо потрудились. Молодцы!
План-конспект урока по химии на тему «Типы химических реакций»
Химия 8 класс
Тема урока: «Типы химических реакций»
Цель урока – ознакомление с классификацией химических реакций по составу исходных веществ и продуктов реакций, с типами химических реакций.
Задачи урока:
Обучающие:
— сформировать представление о понятии «классификация химических реакций»;
— познакомить с реакциями соединения, разложения, замещения, обмена;
Развивающие:
— сформировать умение классифицировать химические реакции;
— закрепить знания, умения и навыки учащихся по составлению уравнений реакций;
— развивать у учащихся навыки наблюдения, логического мышления, умения
обобщать, делать выводы, проводить самопроверку.
Воспитательные:
— совершенствование навыков выполнения лабораторных опытов;
— воспитывать умение работать самостоятельно и в группе, в атмосфере поиска,
прививать чувство ответственности за выполненную работу.
Ожидаемые результаты: знать сущность реакций разложения, соединения, замещения; уметь составлять уравнения реакций и определять тип реакций.
Тип урока – комбинированный.
Ход урока:
1. Организационный момент.
2. Актуализация знаний учащихся.
1.Проверка домашнего задания( работа у доски) – упражнения 3,5; тестовые задания стр.67-68
2.Фронтальный опрос.
— Что такое химическое уравнение?
— Что показывает в формуле индекс, коэффициент?
— Сформулируйте закон, на основании которого составляются уравнения химических реакций.
3. Работа в группах
Дописать cхемы реакций, где необходимо расставить коэффициенты:
1 группа:
А) Al + O2 = Б) K + O2 = В) Ca + N2 = Г) Al + S =
2 группа:
А) H2O = H2 + O2 Б) Ag2O = ? + O2 В) Al(OH)3 = Al2O3 + H2O Г) KClO3 = KCL + ?
3 группа
А) CuO + H2 = Cu + ? Б) Fe2O3 + Mg = MgO + ? В) CuSO4 + Zn = ZnSO4 + ? Г) AlCl3 + Mg = MgCl2 + ?
3. Мотивация к учебной деятельности
После самопроверки правильности написания УХР и расстановки коэффициентов (слайд), предлагаем учащимся найти общие признаки в уравнениях каждой группы реакций.
4. Формулирование темы урока, постановка цели
Учитель подводит учащихся к формулировке темы урока, ставит цели (проблему)
С какой целью в науке используют классификацию?
5. Изучение новой темы
1.Вводное слово учителя:
Классификаций реакций существует много, их мы будем рассматривать в ходе дальнейшего изучения химии. Сегодня на уроке мы познакомимся с одной из таких классификаций.
2.Фронтальная беседа, работа в группах:
— По какому признаку подобраны реакции в ваших группах? (число веществ вступивших в реакцию и образующихся).
-Выразите запись каждой группы реакций с помощью буквенного уравнения в общем виде
-Давайте попробуем сформулировать определения типов химических реакций, с которыми вы работали в группах
3.Лабораторный опыты. ТБ!!!
Опыт 1: Реакция замещения меди железом.
Задание: в пробирку с раствором сульфата меди (II) –CuSO4 очищенный железный гвоздь.
Опыт 2: Окисление меди
Задание: внесите в пламя спиртовки медную проволоку.
— Запишите в тетрадь наблюдения, составьте уравнение реакций
— Проверьте правильность составления уравнений реакций (слайд)
4. Сделаем вывод на основании проведённой работы (Работа с учебником)
— используя схему 2 стр. 69 расскажите о классификации химических реакций по числу участвующих и образующихся частиц
6. Закрепление и первичный контроль:
Распределительный цифровой диктант (индивидуальная работа)
Задание: запишите номера типов реакций
1 вариант – соединения
2 вариант — замещения
3 вариант — разложения
1) СaO + CO2 = CaCO3
2) 2Mg + O2 = 2MgO
3) 2Al + 3S = Al2S3
4) 2H2O = 2H2 + O2
5) CuO + H2 = H2O + Cu
6) Cu(OH)2 = CuO + H2O
7) Mg +2HCl = MgCl2 + H2
8) 2SO2 + O2 = 2SO3
7. Домашнее задание:
Проработать материал параграфа 21, выучить определения
Выполните упражнение 3 стр.71
8. Рефлексия.
Я узнал……… Я научился………..
Мне понравилось… Я затруднялся…..
Всем спасибо за активную работу на уроке.
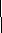

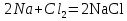
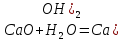
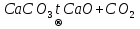
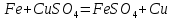
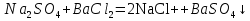
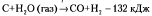 с поглощением тепла
с поглощением тепла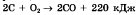 с выделением тепла
с выделением тепла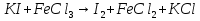
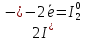 1 восстановитель (окисление)
1 восстановитель (окисление)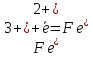 2 окислитель (восстановление)
2 окислитель (восстановление)