Для учащихся 8 класса — Сайт lysakovaen!

«Единственный путь, ведущий к знаниям, — это деятельность».
(Бернард Шоу)

Пусть зимний день с метелями
Мне навевает грусть.
Таблицу Менделеева
Я знаю наизусть!

Динамическая таблица Менделеева

Игра «Таблица Менделеева» — жми на картинку и играй!
Таблица с русскими и латинскими названиями химических элементов
ХЭ таблица.png
Portable Network Image Format 9.3 KB
Естественные семейства элементов
Зависимость свойств элементов от атомног
JPG Image 135.2 KB
Примеры составления молекулярных и структурных формул
Составление структурных формул 8 кл.gif
Graphic Interchange format 12.5 KB
Правила определения валентности
РАЗДАТОЧНЫЙ валентность 8 класс.doc
Microsoft Word Document 35.5 KB
Изменение цвета индикаторов в различных средах
Изменение окраски кислотно-основных инди
Microsoft Word Document 39.5 KB
Таблица растворимости
Таблица растворимости солей, кислот и ос
Microsoft Word Document 43.0 KB
Важнейшие классы неорганических соединений
Опорный конспект Классы неорган соед.doc
Microsoft Word Document 92.5 KB
Таблица с названиями кислот и их кислотных остатков
кислоты и остатки.doc
Microsoft Word Document 59.0 KB
Оксиды и соответствующие им гидроксиды
Раздаточный ОКСИДЫ 8 класс.doc
Microsoft Word Document 87.0 KB
Опорная схема Генетическая связь между классами неорганических соединений
Генетическая связь.jpg
JPG Image 110.5 KB
Опорная схема «Оксиды»
ОС Оксиды 8 кл.docx
Microsoft Word Document 88.0 KB
Опорная схема «Основания»
ОС Основания 8 кл.docx
Microsoft Word Document 76.5 KB
Опорная схема «Кислоты»
ОС Кислоты 8 кл.docx
Microsoft Word Document 60.1 KB
Определение степеней окисления
1.png
Portable Network Image Format 431.7 KB
2.png
Portable Network Image Format 383.1 KB
Опорная схема «П/гр Азота»
ОС пгр Азота.docx
Microsoft Word Document 81.8 KB
Опорная схема «Азот»
Microsoft Word Document 62.9 KB
Опорная схема «Аммиак»
ОС Аммиак.docx
Microsoft Word Document 51.2 KB
ЭХ ряд активности металлов, таблица и закономерности
ПАМЯТКА ЭХ ряд Ме.docMicrosoft Word Document 74.0 KB
ОЭО
Относительные электроотрицательности эле
Microsoft Word Document 43.5 KB
Металлы
доп мат-л по Ме.doc
Microsoft Word Document 2.0 MB
Тривиальные названия некоторых веществ

Кислоты и их кислотные остатки









Экзамен по химии за 10 класс
Экзамен ХИМИЯ за 10 класс.doc
Microsoft Word Document 58.5 KB
ВАЖНЕЙШИЕ альфа АМИНОКИСЛОТЫ.doc
Microsoft Word Document 44.0 KB
Онлайн тест для учащихся 10 и 11 класса

Интерактивный мультимедиа учебник по органической химии
Химия в таблицах и схемах 1
Хим в табл и сх1.zip
Compressed Archive in ZIP Format 1.3 MB
Химия в таблицах и схемах 2
Хим в табл и сх2.zip
Compressed Archive in ZIP Format 1.5 MB
Химия в таблицах и схемах
Хим в табл и сх1.zip
Compressed Archive in ZIP Format 1.3 MB

Краткая характеристика самостоятельных работ учащихся
Виды самостоятельных работ.docx
Microsoft Word Document 13.0 KB
Требования к оформлению реферата
Требования к оформлению реферата.doc
Microsoft Word Document 40.5 KB
Требования к оформлению презентаций
Требования к презентациям.doc
Microsoft Word Document 235.0 KB
lysakovaen.jimdo.com
Шпаргалки по химии для учащихся 8 класса
Химические свойства веществ
Химические свойства кислорода. Кислород взаимодействует
1.1 с металлами 2Cu + O2 = CuO
1.2 с неметаллами S + O2 = SO2
1.3 со сложными веществами 2С2Н2 + 5О2 = 4СО2 + 2Н2О
2. Химические свойства водорода. Водород взаимодействует
2.1 с большинством металлов при повышенной температуре или освещении; с очень активными металлами – при обычных температурах Са + Н2 = СаН2
2.2 с большинством неметаллов при повышенной температуре или освещении; со фтором – при обычных условиях F2 + H2 = 2HF
2.3 Водород проявляет восстановительные свойства, т.е. «отнимает» кислород от некоторых оксидов, сам при этом окисляясь CuO + H2 = Cu + H2O
3. Химические свойства воды. Вода взаимодействует
3.1 с очень активными металлами (Li – Аl) при обычных условиях с образованием гидроксидов и выделением водорода 2Na +2H2O = 2NaOH + H2↑
3.2 с менее активными металлами (Be – Pb) при повышенной температуре с образованием оксидов и выделением водорода Fe + H2O = FeO + H2↑
3.3 с некоторыми неметаллами при нагревании С + 2Н2О = СО2 + 2Н2↑
3.4 с основными оксидами с образованием оснований Na2O + H2O = 2NaOH
3.5 с кислотными оксидами с образованием кислоты SO3 + H2O = H2SO4
3.6 с кислотами с образованием кристаллогидратов nH2O + H2SO4 = H2SO4 · nH2O
3.7 с солями с образованием кристаллогидратов FeSO4 + 7H2O = FeSO4 · 7H2O
4. Химические свойства кислот. Кислоты взаимодействуют
4.1 с металлами, стоящими в ряду активности левее водорода, с образованием соли и выделением водорода Zn + 2HCl = ZnCl2 + H2↑
4.2 с основными оксидами с образованием соли и воды ZnO+2HCl=ZnCl2+H2O
4.3 с основаниями с образованием соли и воды Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
4.4 с солями (если образуется осадок или выделяется газ)
Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O
4.5 с водой с образованием кристаллогидратов nH2O + H2SO4 = H2SO4 · nН2О
5. Химические свойства солей. Соли взаимодействуют
5.1 с металлами, стоящими в ряду активности левее солеобразующего металла
Fe + CuSO4 = FeSO4 + Cu
5.2 с неметаллами 2NaBr + Cl2 = 2NaCl + Br2
5.3 с кислотными оксидами при температуре CaCO3 + SiO2 = СaSiO3 + CO2↑
5.4 с кислотами (см. пункт 4.4)
5.5 со щелочами (если образуется осадок) 2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
5.6 с другими солями (если образуется осадок или выделяется газ)
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
5.7 с водой (см. пункт 3.7)
6. Химические свойства оснований. Щёлочи взаимодействуют
6.1 с неметаллами 2KOH + Cl2 = KClO + KCl + H2O
6.2 с кислотными оксидами Са(ОН)2 + СО2 = СаСО3↓ + Н2О
6.3 с кислотами NaOH + HCl = NaCl + H2O
6.4 с солями (см. пункт 5.5)
6.5 с водой с образованием кристаллогидратов с различным содержанием воды
Нерастворимые в воде основания
6.6 взаимодействуют с кислотами (см. пункт 4.3)
6.7 разлагаются при нагревании на оксид металла и воду Cu(OH)2↓ = CuO + H2O
infourok.ru
Кислоты. Химия, 8–9 класс: уроки, тесты, задания.
| 1. |
Меры предосторожности при работе с кислотами
Сложность: лёгкое |
1 |
| 2. |
Классификация кислот
Сложность: лёгкое |
1 |
| 3. |
Расчёт массовой доли элемента в кислоте
Сложность: лёгкое |
1 |
| 4. |
Массовая доля растворённого вещества в растворе
Сложность: среднее |
2 |
| 5. |
Взаимодействие кислот с металлами
Сложность: среднее |
2 |
| 6. |
Взаимодействие кислот с основаниями
Сложность: среднее |
2 |
| 7. |
Взаимодействие кислот с солями
Сложность: сложное |
3 |
| 8. |
Взаимодействие кислот со смесью металлов
Сложность: сложное |
3 |
| 9. |
Вычисления, связанные со сливанием двух растворов
Сложность: сложное |
3 |
| 10. |
Получение кислот
Сложность: среднее |
2 |
| 11. |
Свойства кислот
Сложность: среднее |
2 |
www.yaklass.ru
Онлайн урок: Основные классы неорганических соединений по предмету Химия 8 класс
Кислота – это сложное вещество, в молекуле которого имеется атом водорода и кислотный остаток.
Пример: серная кислота H2SO4
Ее состав можно написать так H+(HSO4)—
Видим, что она состоит из атома водорода H+ и кислотного остатка (HSO4)— . Значит, это соединение — кислота!
Кислоты могут образовываться реакцией кислотных оксидов с водой.
SO3 + H2O → H2SO4
Так образуется серная кислота H2SO4
Иначе H2SO4 можно записать в виде гидроксида SO2(OH)2
Кроме этих веществ кислотами в химии также называют множество органических кислот.
Органические кислоты – это те, которые образуются в живых организмах (например, муравьиная, уксусная, лимонная, щавелевая, яблочная, винная).
Их подробно изучает отдельная область химии – органическая химия.
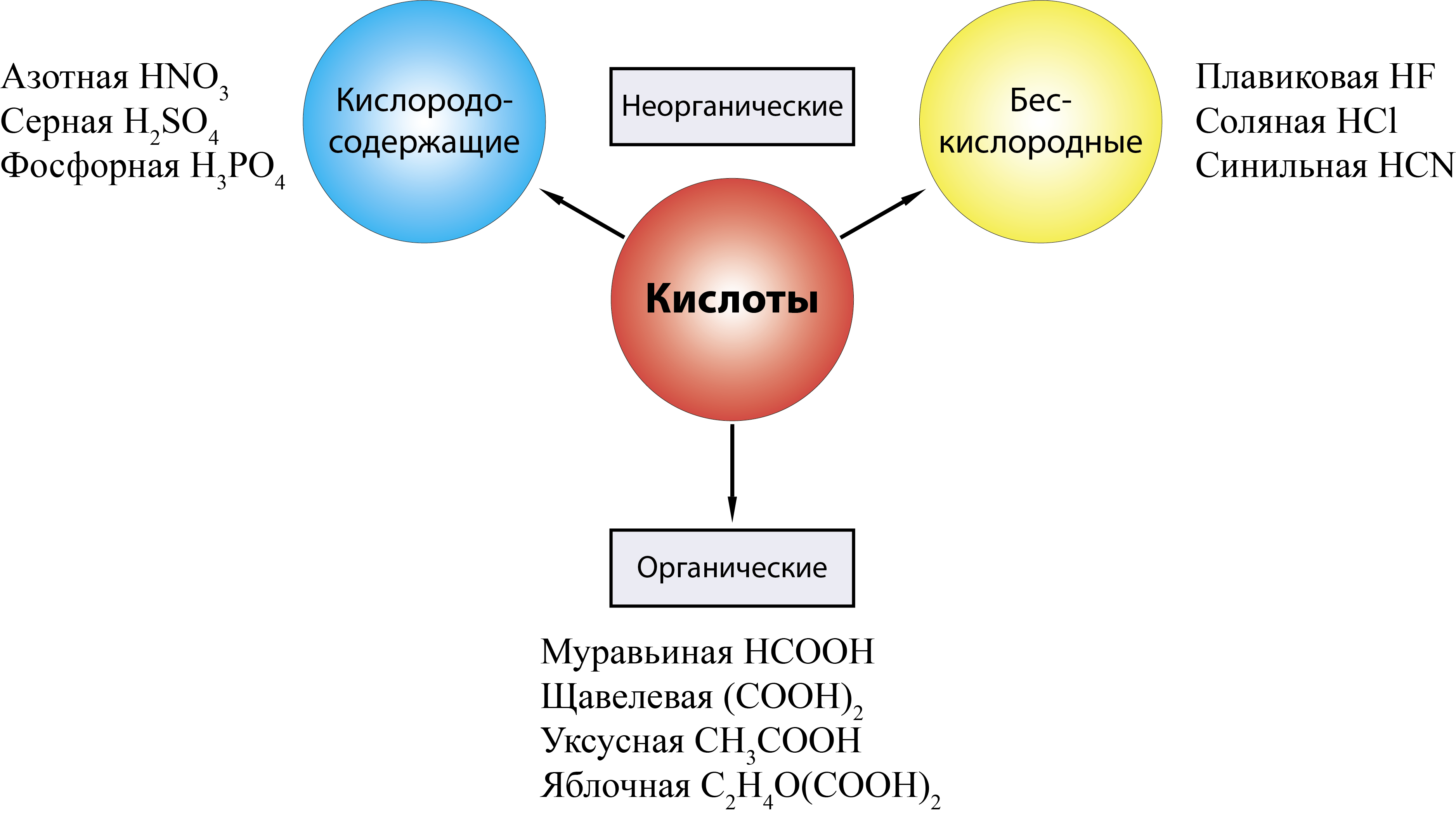
Общие признаки кислот- это сложные вещества, а в их составе всегда есть водород.
Все кислоты в разной степени — это едкие вещества.
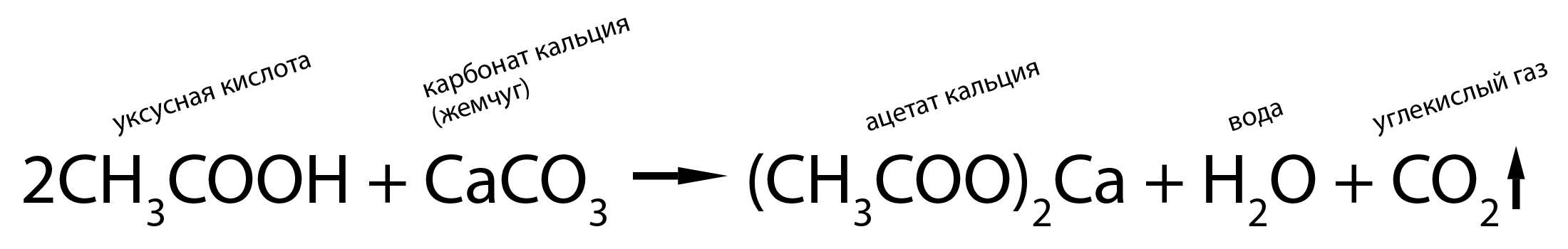
Карбонаты являются очень неустойчивыми в кислотах – разлагаются с выделением углекислого газа:
У меня есть дополнительная информация к этой части урока!
 Закрыть
ЗакрытьСвоё название кислоты получили из-за их кислого вкуса, который мы ощущаем из-за раздражающего воздействия кислот на вкусовые рецепторы.
А английское название acid произошло скорее всего от латинского названия уксусной кислоты – acetum, поскольку уксусная кислота была первой выделенной человеком кислотой.
Ещё алхимики, когда им нужна была кислая среда, использовали именно уксус.
Существует легенда о том, как падишах потребовал от своего придворного алхимика испытать принесённый ему жемчуг.
На что алхимик посоветовал опустить жемчуг в крепкий уксус, и если жемчуг в нём растворится, то он настоящий.
Поговаривают, что после такого совета падишах опустил в крепкий уксус не жемчуг, а алхимика.
На самом деле всё просто: жемчуг – это карбонат кальция (продукт реакции извести с углекислым газом).
Современные ученые доказали, что царица Египта Клеопатра удивляла своих гостей тем, что с легкостью выпивала уксус, в который перед этим бросала жемчуг.
Причина в том же: жемчуг, растворяясь, нейтрализовал большую часть уксуса.
Алхимики часто использовали «царскую водку» – смесь азотной и соляной кислот.
При их смешивании происходит химическая реакция:
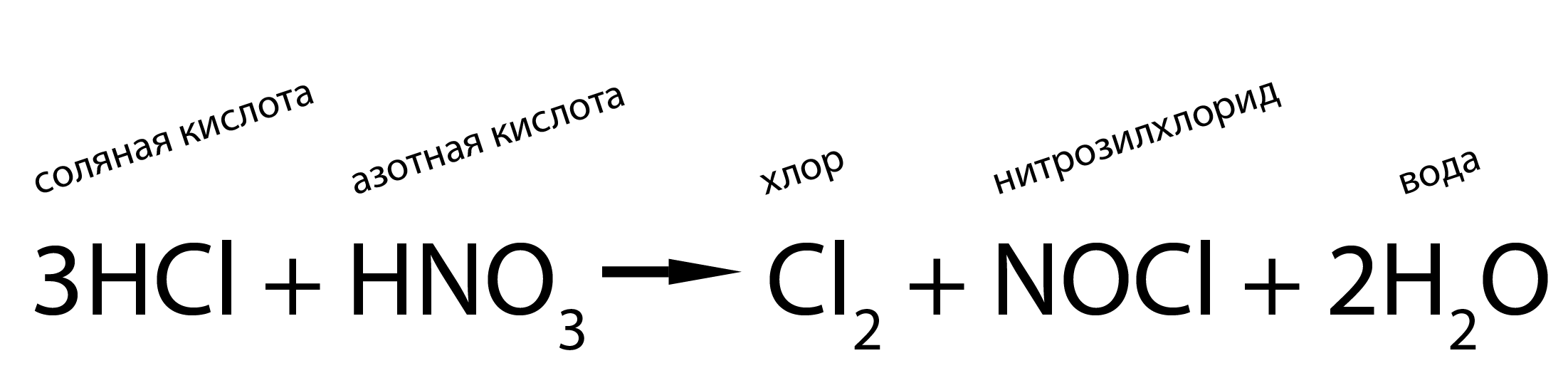
Образующийся нитрозилхлорид – очень агрессивное вещество, оно даже реагирует с металлами, не растворяющимися в чистых кислотах: золотом, платиной и палладием.
Поэтому «царская водка» – одно из самых агрессивных химических веществ.
В лаборатории её обычно используют для очистки химической посуды от сильных загрязнений.
Кислота внутри нас.
Газ хлороводород, растворенный в воде, называют соляной кислотой.
Желудочный сок животных и человека содержит соляную кислоту HCl.
Вы могли встретиться уже с этим названием, поскольку соляная кислота свободно продаётся в хозяйственных магазинах.
Она используется в быту как чистящее средство.
Кислоты применяются:
- в быту
- в лаборатории
- в технике
- в промышленности в качестве исходных веществ для получения каких-либо других или в качестве промежуточных в ходе химических производств, также они могут являться конечным результатом производства.
Внимание! Сaution! Achtung! Attenzione! 注意力
При работе с кислотами следует помнить, что это едкие вещества, и соблюдать осторожность!
Не допускать попадания кислот на кожу, а особенно на слизистые оболочки – глаза, рот!
При попадании кислоты на кожу или в глаза следует промыть большим количеством проточной воды!
ladle.ru
Урок химии по теме «Состав кислот. Соли.» (8 класс)
Урок химии
по теме «Состав кислот. Соли»
Образовательные задачи:
Знать состав кислот, солей;
Определение кислоты и соли.
Уметь составлять химические формулы солей, давать им название, сравнивать по составу кислоты и соли.
Воспитательные задачи:
Продолжить формирование диалектико-материалистического мировоззрения учащихся.
Содействовать трудовому и эстетическому воспитанию учеников.
Формировать умение работать в коллективе, где развиваются чувства товарищества, доброжелательности и требовательности к себе и своему товарищу.
Развивающие задачи:
Развивать познавательный интерес и эмоции школьников, уметь выделять главное, сравнивать, обобщать, логически излагать мысли.
Тип урока:
Урок усвоения новых знаний.
Оборудование:
Образцы кислот и солей.
Ход урока:
1. Учитель знакомит учащихся с темой урока и его задачами, с порядком проведения урока.
2. Изучение новой темы.
I. Состав кислот.
Кислоты – это одни из важнейших продуктов химической технологии, которые находят широкое применение. Чтобы разумно использовать вещества, прежде всего необходимо знать их состав, строение и свойства.
Составьте уравнения химических реакций железа с соляной кислотой и серной кислотой. Вспомним один из способов получения водорода в лаборатории.
К доске выходит ученик и составляет уравнения химических реакций. Класс помогает ему в ответах.
Кроме соляной и серной кислот существуют еще большое количество различных кислот (смотрим и работаем с таблицей № 1)
Учитель демонстрирует на столе кислоты,
Таблица № 1
Формулы некоторых кислот и кислотных остатков.
Название кислоты
Формула кислоты
Кислотный остаток и его валентность
Название соли
Соляная кислота
НСl
С1 —
Хлориды
Серная кислота
H2SO4
SO4 =
Сульфаты
Сернистая кислота
Н2SО3
SO3=
Сульфиты
Азотная кислота
НNО3
NO3 —
Нитраты
Ортофосфорная кислота
Н3РO4
РO4=
Ортофосфаты
Сероводородная кислота
H2S
S =
Сульфиды
Угольная кислота
Н2СО3
СOз=
Карбонаты
Кремниевая кислота
Н2SiO3
SiO3 =
Силикаты
Бромоводородная кислота
НВr
Br —
Бромиды
Фтороводородная кислота
HF
F —
Фториды
Иодоводородная кислота
HI
I —
Иодиды
Фронтальная беседа с классом:
Теперь посмотрите на формулы кислот.
Из чего состоят кислоты?
Дайте определение — что такое кислоты?
Теперь посмотрим на уравнения химических реакций железа с соляной и серной кислотами. И даем полное определение кислотам.
Как узнать валентность кислотного остатка?
Посмотрим на уравнение химической реакции взаимодействия железа с кислотами и ответим на следующий вопрос: Разрушаются кислотные остатки в ходе химических реакций?
II. Классификация кислот.
По составу кислоты делят на кислородосодержащие и бескислородные, а по числу содержащихся в них атомов водорода, способных замещаться на металл, — на одноосновные, двухосновные и трехосновные” Ученики работают с таблицей № 2.
Таблица № 2
Кислоты
Бескислородные
Кислородсодержащие
HCl, HBr, HY (одноосновные)
H2S (двухосновная)
HNO3 (одноосновная),
H2SO4 (двухосновная),
H3PO4 (трехосновные)
III. Закрепление изученного материала.
1. Выполним работу №1 по группам: 1 ряд – 1 группа, 2 ряд – 2 группа, 3 ряд – 3 группа.
Цель:
Сформировать умение определять валентность кислотного остатка по формуле кислоты.
1. В приведенных формулах кислот подчеркните кислотный остаток, обозначьте римской цифрой величину его валентности:
Задание 1 группы
азотная кислота – НNО3
серная кислота – H2SО4
ортофосфорная кислота – НзРО4
метафосфорная кислота – НРО3
Задание 2 группы
сероводородная кислота – H2S
хлорная кислота – НClO4
соляная кислота – НС1
мышьяковая кислота – Н3АsO4
Задание 3 группы
сернистая кислота – Н2SО3
бромоводородная кислота – НВr
кремниевая кислота – Нг8Юз
пирофосфорная кислота – Н4Р2О7
2. Проверьте правильность ответов внутри группы.
3. Проверяем правильность ответов каждой из групп.
IV. Изучение новой темы.
1. Соли, состав, название.
А) Состав солей.
В результате взаимодействия металлов с кислотами образуются соли. Вспомним реакцию железа с кислотами.
FeCl2, FeSO4.
Дайте определение соли?
Демонстрируем образцы солей.
Б) Название солей.
Класс работает с таблицей № 1.
В) Составление формул солей.
2. Что такое валентность химических элементов?
V. Закрепление изученного материала.
Работа 2 (по группам)
1 ряд – 1 группа,
2 ряд – 2 группа,
3 ряд – 3 группа.
Цель: Выработать умение составлять формулы солей по валентности металла и кислотного остатка.
1. Заполнить клетки таблицы формулами солей, образованных указанными кислотами и металлами.
2. Под формулами солей укажите их названия.
Задание № 2 для первой группы
А)
Формула металла
Формула кислоты
HCl
H2SO4
HNO3
H3PO4
K (I)
Al (III)
Б) по названию составьте формулы солей: сульфид натрия, карбонат кальция, силикат калия, нитрат хрома (II)
Задание № 2 для второй группы
А)
Формула металла
Формула кислоты
HCl
H2SO4
HNO3
H3PO4
Ag (I)
Cu (II)
Б) по названию составьте формулы солей: иодид кальция, сльфит калия, силикат лития, сульфат хрома (III).
Задание 2 для третьей группы
А)
Формула металла
Формула кислоты
HCl
H2SO4
HNO3
H3PO4
Fe (II)
Fe (III)
Б) по названию составьте формулы солей: карбонат натрия, бромид магния, сульфид калия, сульфат марганца (II).
3. Проверьте правильность ответов внутри группы.
4. Проверяем правильность ответов каждой из групп.
VI. Домашнее задание: п.21, в. 2 с.112
§ 32. Состав и классификация кислот.
§ 33. Состав, название солей.
Учебник: Габриелян О.С. Химия. 8 класс. М.: Дрофа. 2007.
VIII. Подведение итогов урока.
Учитель объявляет оценки классу и отдельным ученикам.
infourok.ru