Вода как растворитель 💧 свойства и особенности, какие вещества растворяются и не растворяются в воде, значение и роль воды в качестве растворителя в природе
Вода как растворитель играет предельно важную роль далеко не только в плане нашего быта. Исследователи давно говорят, что данное волшебное соединение является основой для образования жизни вообще. И именно поэтому его наличие выступает обязательным условием для существования чего-то более сложного, нежели неживая природа.
Растворимость тех или иных химических элементов напрямую связана с существованием воды, так как она чаще всего выступает той средой, которая преобразует все вокруг себя и создает новые формы органической и неорганической материи.

Человек примерно на 70% состоит из воды (имеется ввиду кровь, межклеточная жидкость, плазма крови и прочие вещества), у большинства других существ этот показатель колеблется от 50 до 95%. Очевидно, что свойства данного соединения оказывают решающую роль на происходящие вокруг нас и внутри нас процессы синтеза, регенерации и многие другие.
Это универсальный растворитель, который буквально формирует окружающий мир, постоянно преображает и обновляет его!
Свойства воды как растворителя
Вода – сложное вещество, отличающееся многими уникальными характеристиками, которые нельзя встретить больше нигде.
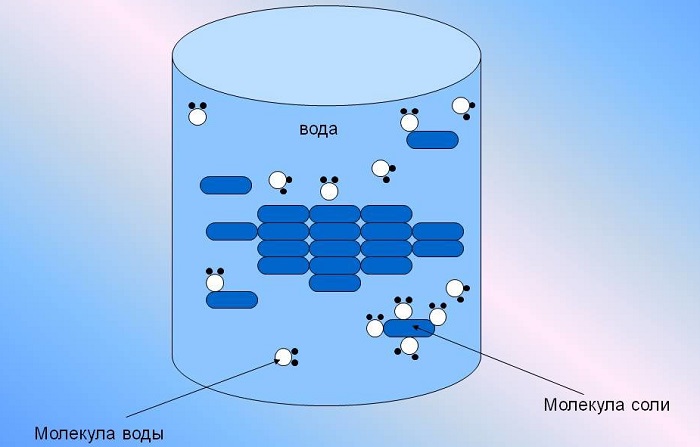
Она способна растворить большую часть существующих в природе комплексных соединений, содержащих в своей структуре молекулы как с положительными, так и отрицательными ионами одновременно.
При проведении так называемых кинетических исследований все растворы также изготавливаются на основе H2O.
Яркий пример особенности воды – при схожести по своей структуре с метаном CH
4, она имеет температуру кипения выше на целых 2500С!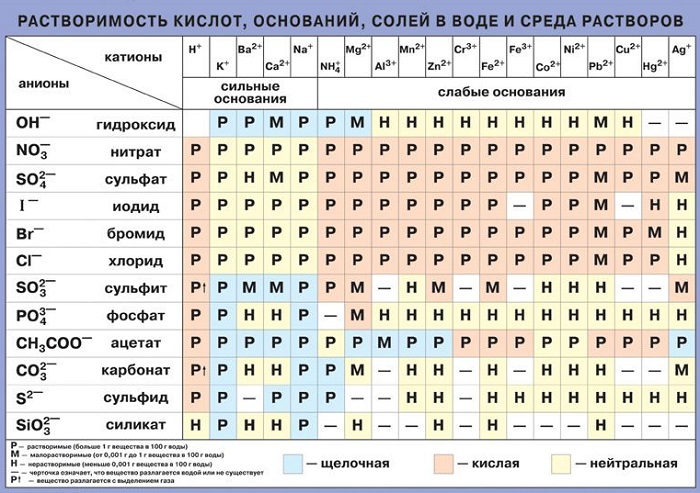
Важную роль играет также ее способность выступать одновременно либо донором, либо акцептором частиц водорода, благодаря чему проходят многие химические процессы. Химия говорит нам еще и о том, что вода выступает идеальным растворителем для диссоциирующих соединений.
Интересно отметить, что по причине высокого уровня диэлектрической проницаемости, вода отлично экранирует электрические поля ионов друг от друга. Благодаря этому притяжение противоположно заряженных частиц в воде снижается примерно в 80 раз.
Какие вещества растворяются в воде
Даже если школьник ходит только в 3 класс, он наверняка может привести примеры материалов, которые боятся контакта с водой, или, другими словами, растворяются в ней и теряют свои свойства.

Вот перечень только некоторых веществ такого типа:
-
К хорошо растворимым относятся: соль, сахар, сода, хлориды, щелочные металлы и нитраты, а также бромиды. Воздух также претерпевает изменения при контакте с жидкой средой. Крахмал полностью растворим, спирт тоже.
-
К средней степени взаимодействия относятся: бертолетова соль, метан, гипс, кислород, азот, другие химические элементы, например, сульфаты, некоторые газообразные вещества.
-
Есть и такие материалы, которые являются нерастворимыми: сульфид меди, стекло, золото, керосин, серебро, растительный жир и многие другие. Правда, при некоторых условиях даже они не способны устоять от такого мощного воздействия.
В организме человека есть целая группа витаминов (С, В1, 2, 3(РР), В12 и другие), которые способны оказывать свое положительное воздействие на здоровье только в контакте с H2O. Это касается также и фолиевой кислоты, биотина и т. д.
Что не растворяется в воде
Существуют такие химические образования, которые не воспринимают воздействия воды в качестве растворителя совсем.

Хороший пример: углерод С, который находится в простом карандаше, многие металлы и сплавы, типа алюминия, а также золото, серебро, медь.
Такая ситуация складывается благодаря тому, что между молекулами и атомами нерастворимых веществ действуют сильные связи, которые водород разрушить не в состоянии. Полярное состояние молекулы также способствует большей прочности материала, который состоит из таких частиц.
Многие вещи, которые мы видим вокруг себя в быту, также являются нерастворимыми. Очень популярный пример – пластик.

В мировом океане плавает огромное пятно из пластикового мусора, которое ежегодно растет, и количество пластмассы там совершенно не желает уменьшаться естественным путем. Его не могут никак переработать, что очень плохо для всей экосистемы.
Именно поэтому экологи бьют тревогу и в ЕС уже сейчас планируется отказ от целлофановых пакетов, пластиковых стаканчиков и трубочек и тому подобные меры.
Значение воды как растворителя
Как уже упоминалось в начале статьи, рассматриваемые свойства воды являются ключевыми для всей живой и неживой природы нашей планеты.

Если бы она не обладала этими характеристиками, то большинство химических процессов на Земле, в живых организмах, в органической природе бы просто остановилось. Картинка такого мира была бы очень неутешительна – темная пустыня без признаков жизни.
Роль воды настолько огромна, что именно ее определение в далеких планетах и галактиках является для астрономов основным занятием в надежде когда-то отыскать там если не разумное существование, то хотя бы зачатки жизни.
nauka.club
Доклад-сообщение Вода растворитель 3 класс
Вода представляет собой жидкость, у которой не имеется запаха, цвета и ярко выраженного вкуса. Если вода очищенная, то она соответственно прозрачная. Через воду можно смотреть, например, налив ее в прозрачный можно разглядеть практически все через неё. Благодаря своему свойству текучести, вода может проникать даже в самые труднодоступные и проходимые места.
Находясь в состоянии жидкости, вода является составляющей рек, морей и океанов. Благодаря воде, растения не засыхают, так как она питает землю. Кроме этого вода является оставляющей растений и млекопитающих.
Уникальность воды в том, что она умеет растворять абсолютно все. Конечно, есть исключения, с которыми вода не может справиться, но это редкость и их очень мало. Как же происходит растворение?
Вещество или предмет, после того как оно растворилось, уже является с водой одним целым, все это называется раствором. Например, кофе, так как в него кинули сахар, и он растворился, соответственно кофе в данной ситуации – раствор. Вода умеет достаточно хорошо растворять вещества, но только не пластик, камень и другие. Например, пластиковая бутылка никогда не раствориться, ровно так же и камень, будет продолжать лежать на дне сосуда в первичном состоянии.
Под микроскопом можно увидеть то, что человеческий глаз не в состоянии увидеть, например, молекулы воды. Уникальность молекул воды в том, что они электронейтральные, то есть они совместимы с большим спектром веществ. Это и дает возможность растворять многие вещества. Когда молекулы воды встречаются с молекулами других веществ, происходит их притяжение. Выходит, что вещество полностью растворяется в воде. Но, когда такого притяжения не происходит, то соответственно никакого растворения нет.
Вода не может быть на 100 % чистой, такого просто в природе нет. Абсолютно все жидкости, которые можно встретить в природе – растворы. Даже вода, бегущая в дома из крана, также растворитель так как в ней содержится железо. Кстати не только лишь твердые вещества способны растворяться в воде, а также жидкости и вещества в газообразном состоянии. Следует запомнить, что в любой воде всегда есть некая примесь.
На планете можно увидеть много разных веществ и предметов, которые могут находится в разном состоянии, то есть в жидком, газообразном или в твердом. Есть те, что вода без труда растворит, а есть такие вещества, которые не поддаются растворению. Поэтому ученые разделили вещества на определенные типы исходя из их растворимости.
Вещества водоотталкивающие, не могут вообще быть растворенными или данный процесс проходит настолько слабо, что его и не заметить. Вещества, которые притягивают воду, напротив очень хорошо могут растворятся в воде, например, соль, сахар, щёлочь.
После того, как произошло растворение, вода перенимает у другого вещества цвет, запах, может поменяться в консистенции.
Доклад №2
Вода — это неотъемлемая и незаменимая часть всего живого. Характерный цвет прозрачный, не имеющий вкуса и запаха. В жидком состоянии проникает во все щели и изъяны.
Главным свойством воды является, то что она может растворить почти все вокруг, но есть предметы которые не видоизменяются при соединение с ней.
Приведем пример:
- Железо,
- Камень,
Если растворитель попадет на газету или журнал, он раскиснет, но не соединится с ней.
Что называют раствором?
Раствором называется соединенное вещество с водой в одно целое.
Приведем несколько примеров:
- Сахар,
- Соль,
- Сода,
- Йод,
- Мед и так далее.
Данные примеры называются водным раствором. Потому что вещество, которое при соединение с жидкостью в ней растворяется.
Вода состоит из мельчайших частиц молекул. Которые, невозможно рассмотреть обычным взглядом, а только можно увидеть под микроскопом.
Молекулы электронейтральны, то есть взаимосвязаны не только между собой, но и с другими веществами могут соединятся, образуя раствор. Но при этом должен быть положительный заряд.
В природе нет абсолютно чистой воды. Даже в повседневной жизни вся встречающаяся на пути жидкости являются растворами.
Приведем пример:
- В море вода смешена с солью,
- В пруду и озерах, также имеется примесь,
- Даже вода из под крана является раствором, в состав которого входят примеси железа, хлора и т.д.
Вода может растворять не только твердые, но и газообразные, а также жидкие вещества.
Она при соединение с пищей, забирает питательные вещества, питая клетки живого организма. А также способна очищать организм от токсинов и шлаков.
На всей земле мало таких веществ, которые не соединялись бы с водой. Так как даже металл, со временем в ней расщепляется частично.
Приведем пример полезного соединения воды.
Если соединить воду с серебром. Полученный раствор способен убивать вредные микробы негативно влияющие на организм человека. Вода становится очищенной без тяжелых примесей, пригодной для употребления.
Заключение.
Вода может быть как полезной, так и вредной для организма. Зависит только от того, какая примесь в ней присутствует. Вода абсолютно вся встречающаяся в повседневной жизни, является соединением. Если бы не было воды на Земле, то не была бы планета живая. Так как без воды не могут существовать не только люди, животные и даже растения.
Вода – самое ценное, что есть на планете.
Вода растворитель доклад
Практически вся биологическая обработка и многие промышленные процессы происходят в водной среде.
Когда вещества растворяются в воде, частицы свободно перемещаются, поэтому взаимодействия между реагентами очень эффективны. Раствор представляет собой равномерно распределенную смесь атомов, молекул или ионов. Наша атмосфера — это раствор газов. Поваренная соль и вода — раствор соли в воде. Когда твердое вещество, жидкость или газ растворяется в воде, образуется водный раствор. Растворенное твердое вещество / жидкость
называется «растворенное вещество» и вода является растворителем.
Расторителя имеют следующие важные характеристики:
- Они однородны; растворенное вещество и растворитель нельзя отличить друг от друга
- Растворенные частицы, слишком малы, чтобы их увидеть
- Пропорция ион растворенного растворяемого вещества варьируется от одного раствора к другому
Вода является таким превосходным растворителем, что редко встречается в природе. Не все вещества растворяются в воде. Большинство газов имеют очень низкую растворимость в воде.
Когда одно вещество растворяется в другое, происходит следующее:
- Частицы растворенного вещества отделяются друг от друга
- Частицы растворителя отделены друг от друга
- Частицы растворенного вещества и растворителя притягивают друг друга
Растворитель растворяется, если притяжение между s-частицами масла и растворитель, достаточно сильны, чтобы конкурировать с растворенным веществом, растворенное вещество и растворитель, растворительные силы притяжения.
Вещества, которые легко растворяются в воде, имеют ионную или полярную ковалентную связь.
Они попадают в одну из следующих трех групп:
- группа ковалентных соединений, которые могут образовывать водородные связи с водой
- Полярные ковалентные молекулярные соединения, которые могут ионизировать
- Ионные соединения.
3 класс, 8 класс окружающий мир
Вода растворитель

Популярные доклады
- Доклад Морской транспорт 9 класс сообщение
Морской транспорт это отдельное направление во всем мировом транспорте. Морским транспортом перевозят, как и грузы так и людей. К морскому транспорту относят любое средство передвижение, которого может держаться на воде.
- Большой Кремлевский дворец описание для детей
Большой Кремлевский дворец находится в столице нашей Родины в городе Москве. Он входит в состав дворцов Московского Кремля. Строительство Дворца началось в 1838 г, по приказу Всероссийского императора Николая 1
- Доклад Суздаль: Город золотого кольца России
Россия одна из самых больших и богатейших стран Европы, имеющая свою многовековую историю и культуру. Самым сердцем России принято считать Золотое кольцо. Это плеяда старинных крупнейших исторических городов. Среди таких городов следует отметить
more-dokladov.ru
Вода — 100% растворитель!
Что может быть  проще воды? Мы ее пьем, купаемся в ней, готовим с ее помощью. Наша жизнь была бы совершенно невозможна без нее. И в то же время эта «знакомая» вода – самое таинственное химическое вещество на планете.
проще воды? Мы ее пьем, купаемся в ней, готовим с ее помощью. Наша жизнь была бы совершенно невозможна без нее. И в то же время эта «знакомая» вода – самое таинственное химическое вещество на планете.
«Живая» и «мертвая» вода, ее происхождение, причины перехода в другие агрегатные состояния – эти вопросы издавна интересовали людей. Одним из самых «чудесных» свойств воды является ее способность растворять вещества.
Фантастиче-
ская сила
Мы смотрим на горный источник и думаем: «Вот по-настоящему чистая вода!» Однако это не так: идеально чистой воды в природе не бывает.  Дело в том, что вода является практически универсальным растворителем. В ней растворены газы: азот, кислород, аргон, углекислота – и другие примеси, находящиеся в воздухе. Особенно ярко свойства растворителя проявляются в морской воде, в которой растворяются практически все вещества. Принято считать, что в водах Мирового океана могут быть растворены практически все элементы таблицы периодической системы элементов. По крайней мере, на сегодня их обнаружено более 80, в том числе редкие и радиоактивные элементы. В наибольшем количестве в морской воде содержатся хлор, натрий, магний, сера, кальций, калий, бром, углерод, стронций, бор. Одного только золота растворено в Мировом океане по 3 кг на душу населения Земли!
Дело в том, что вода является практически универсальным растворителем. В ней растворены газы: азот, кислород, аргон, углекислота – и другие примеси, находящиеся в воздухе. Особенно ярко свойства растворителя проявляются в морской воде, в которой растворяются практически все вещества. Принято считать, что в водах Мирового океана могут быть растворены практически все элементы таблицы периодической системы элементов. По крайней мере, на сегодня их обнаружено более 80, в том числе редкие и радиоактивные элементы. В наибольшем количестве в морской воде содержатся хлор, натрий, магний, сера, кальций, калий, бром, углерод, стронций, бор. Одного только золота растворено в Мировом океане по 3 кг на душу населения Земли!
В земной воде также всегда что-то растворено. Наиболее чистой считается дождевая вода,  но и она растворяет в себе примеси, находящиеся в воздухе. Не думайте, что вода растворяет только легко растворимые вещества. К примеру, химики-аналитики утверждают, что вода немного растворяет даже стекло. Если растереть в ступке порошок стекла с водой, то в присутствии индикатора (фенолфталеина) появится розовая окраска – признак щелочной среды. Следовательно, вода частично растворила стекло и щелочь попала в раствор (недаром химики называют этот процесс выщелачиванием стекла).
но и она растворяет в себе примеси, находящиеся в воздухе. Не думайте, что вода растворяет только легко растворимые вещества. К примеру, химики-аналитики утверждают, что вода немного растворяет даже стекло. Если растереть в ступке порошок стекла с водой, то в присутствии индикатора (фенолфталеина) появится розовая окраска – признак щелочной среды. Следовательно, вода частично растворила стекло и щелочь попала в раствор (недаром химики называют этот процесс выщелачиванием стекла).
Заниматель-
ная химия
Почему же вода может растворять столь различные вещества? Из курса химии мы знаем, что молекула воды электронейтральна.  Но электрический заряд внутри молекулы распределен неравномерно: в области атомов водорода преобладает положительный заряд, в области, где расположен кислород, выше плотность отрицательного заряда. Следовательно, частица воды – это диполь. Этим свойством молекулы воды объясняется ее способность ориентироваться в электрическом поле и присоединяться к другим молекулам, несущим заряд. Если энергия притяжения молекул воды к молекулам какого-либо вещества больше, чем энергия притяжения между молекулами воды, то вещество растворяется. В зависимости от этого различают гидрофильные (хорошо растворимые в воде: соли, щелочи, кислоты) и гидрофобные (вещества, трудно или вовсе не растворимые в воде: жиры, каучук и др.). Таким образом, «вакциной» против растворения в воде является содержание в веществе жира. Неслучайно клетки человеческого тела имеют мембраны, содержащие жировые компоненты. Благодаря этому вода не растворяет тело человека, а способствует его жизнедеятельности.
Но электрический заряд внутри молекулы распределен неравномерно: в области атомов водорода преобладает положительный заряд, в области, где расположен кислород, выше плотность отрицательного заряда. Следовательно, частица воды – это диполь. Этим свойством молекулы воды объясняется ее способность ориентироваться в электрическом поле и присоединяться к другим молекулам, несущим заряд. Если энергия притяжения молекул воды к молекулам какого-либо вещества больше, чем энергия притяжения между молекулами воды, то вещество растворяется. В зависимости от этого различают гидрофильные (хорошо растворимые в воде: соли, щелочи, кислоты) и гидрофобные (вещества, трудно или вовсе не растворимые в воде: жиры, каучук и др.). Таким образом, «вакциной» против растворения в воде является содержание в веществе жира. Неслучайно клетки человеческого тела имеют мембраны, содержащие жировые компоненты. Благодаря этому вода не растворяет тело человека, а способствует его жизнедеятельности.
Бетон и композит –
что прочнее?
Какое отношение эта информация имеет к бассейнам? Дело в том, что способность воды растворять многие вещества отрицательно влияет на бетонные бассейны. Вода необходима для гидратирования цемента.  Однако после ее испарения в структуре бетона появляются пустоты и поры. Это приводит к увеличению проница- емости бетона для газов, пара и жидкости. В результате в поры бетонного бассейна попадает вода, он подвергается выщелачиванию и впоследствии попросту трескается.
Однако после ее испарения в структуре бетона появляются пустоты и поры. Это приводит к увеличению проница- емости бетона для газов, пара и жидкости. В результате в поры бетонного бассейна попадает вода, он подвергается выщелачиванию и впоследствии попросту трескается.
Большим преимуществом по отношению к бетонным собратьям пользуются композитные бассейны. Композит – это неоднородный сплошной материал, состоящий из двух и более компонентов. Основную прочность изделиям из композита придает стекловолокно, то есть волокно из тонких стеклянных нитей. В такой форме стекло демонстрирует неожиданные свойства:  не бьется, не ломается, а гнется без разрушения. В качестве связующего наполнителя в изготовлении композита применяются полимерные органические смолы, которые препятствую проникновению воды в поры вещества. Благодаря этому композитные бассейны практически не подвержены старению и устойчивы к воздействию всем необходимого, но столь разрушительного вещества – воды.
не бьется, не ломается, а гнется без разрушения. В качестве связующего наполнителя в изготовлении композита применяются полимерные органические смолы, которые препятствую проникновению воды в поры вещества. Благодаря этому композитные бассейны практически не подвержены старению и устойчивы к воздействию всем необходимого, но столь разрушительного вещества – воды.
Похоже, что для всемогущей воды практически не существует препятствий.  Со временем ей поддается абсолютно любой материал.
Со временем ей поддается абсолютно любой материал.
Но если необходимо выбрать материал для бассейна, то совершенно очевидно, какой из них: бетон или композит – будет Вашим надежным помощником в борьбе с разрушительной силой воды.
www.franmer.ru
Вода — растворитель растворы — параграф 33 ГДЗ химия 8 Рудзитис
1. Что такое растворы и чем они отличаются от взвесей?
Раствор — однородная смесь, состоящая из растворителя, растворенного в нем вещества и продуктов их взаимодействия. В растворах даже при помощи микроскопа невозможно разглядеть частицы составляющих их веществ.
Взвесь представляет собой гетерогенную (разнородную) смесь жидкого вещества и нерастворимых частиц. Такие смеси мутные, в них можно разглядеть наличие частиц.
2. Какие смеси называют суспензиями и эмульсиями? Приведите примеры эмульсий и суспензий.
Суспензиями называют взвеси (смесь жидкости и нерастворимых частиц), в которых частицы твердого вещества равномерно распределены между молекулами воды. Примеры: смесь глины и воды.
Эмульсиями называют взвеси, в которых капельки какой-либо жидкости равномерно распределены между молекулами воды. Примеры: молоко; смеси бензина и воды, керосина и воды, растительного масла и воды.
3. Что такое растворимость? Какая существует зависимость между изменением температуры и растворимостью твердых и газообразных веществ?
Растворимость — максимальная масса вещества, которая может раствориться в 100 г растворителя (например, воды) при данной температуре (по умолчанию 20° С).
Для твердых веществ — растворимость повышается по мере увеличения температуры. Для газов наоборот, падает с увеличением температуры.
4. При открытии бутылки с лимонадом наблюдается бурное выделение газа. Чем это можно объяснить?
В закупоренной бутылке лимонада газ находится под давлением (при повышении давления растворимость газов увеличивается). Когда мы открываем бутылку, то давление становится равным атмосферному и растворимость газа уменьшается, вследствие чего начинается его выделение из раствора (лимонада).
5. В 500 г раствора, насыщенного при 20° С, содержится 120 г нитрата калия. Определите растворимость этой соли.
Напомним, растворимость — максимальная масса вещества, которая может раствориться в 100 г например, воды при данной температуре.
500 г раствора содержит 120 г нитрата калия, значит масса воды:
m (H2O) = mраствора — mсоли
m (H2O) = 500 — 120 = 380 г
Далее составляем пропорцию. 380 г воды растворяет 120 г нитрата калия, значит 100 г воды растворяет 100 * 120 / 380 = 31,58 г
Ответ: растворимость нитрата калия при 20° С составляет 31,58 г
Тестовые задания
Укажите верное утверждение.
1) Раствор, в котором данное вещество при данной температуре больше не растворяется, называют насыщенным.
2) Раствор, в котором данное вещество при данной температуре больше не растворяется, называют ненасыщенным.
Ответ: 1.
Морская вода — это
1) раствор
2) суспензия
3) эмульсия
Ответ: 1.
Смесь растительного масла с водой называют __________
Ответ: эмульсией.
himgdz.ru
Растворы
73
Леккия №17
РАСТВОРЫ
План
Общая характеристика растворов.
Способы выражения концентрации растворов.
Термодинамика и механизм процесса растворения.
Растворимость.
Вода как растворитель. Значение растворов в жизнедеятельности организмов
1. Общая характеристика растворов.
Растворы – это гомогенные системы переменного состава, включающие два и более компонентов. Частицы компонентов раствора распределены по его объему в виде атомов, молекул или ионов (размер частиц 0,1 – 0,5 нм).
Образование растворов, в отличие от механических смесей, сопровождается изменением энтальпии, энтропии и объема системы.
По агрегатному состоянию различают газовые, жидкие и твердые растворы. Но обычно термин растворы относится к жидким системам.
2. Способы выражения концентрации растворов.
Относительное содержание компонентов в растворе определяется его концентрацией.
М олярная
концентрация – это количество
вещества, содержащееся в одном литре
раствора (моль/л):
олярная
концентрация – это количество
вещества, содержащееся в одном литре
раствора (моль/л):
Э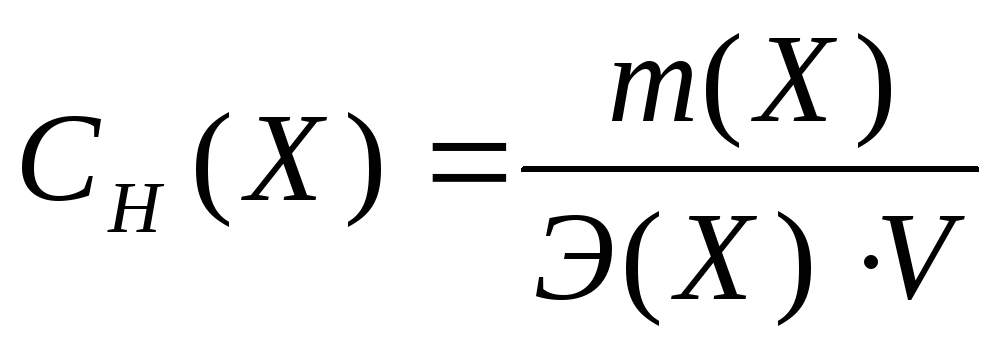 квивалентная
концентрация – это число молей
эквивалентов вещества, содержащихся в
одном литре раствора (моль/л):
квивалентная
концентрация – это число молей
эквивалентов вещества, содержащихся в
одном литре раствора (моль/л):
Эквивалент – это реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна одному иону водорода, а в окислительно-восстановительной эквивалентна одному электрону.
Масса одного моля эквивалентов называется молярной массой эквивалента вещества (Э). В разных реакциях одно и то же вещество может иметь разные эквиваленты.
Моляльная концентрация – это количество вещества, содержащееся в одном килограмме растворителя (моль/кг):
М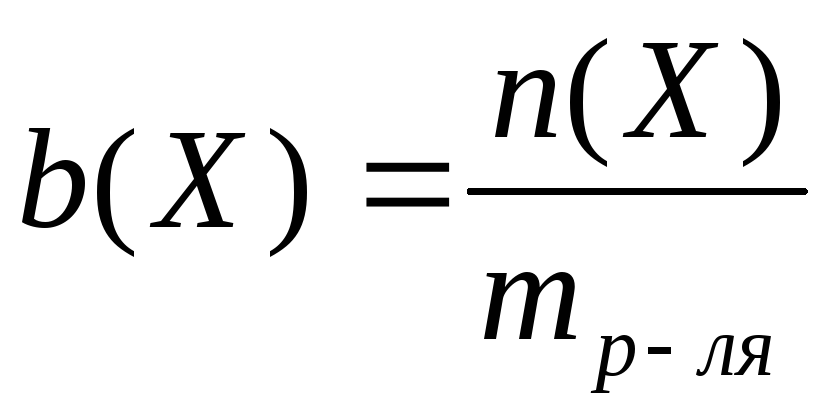 ассовая
доля равна отношению массы растворенного
вещества к массе раствора:
ассовая
доля равна отношению массы растворенного
вещества к массе раствора:
М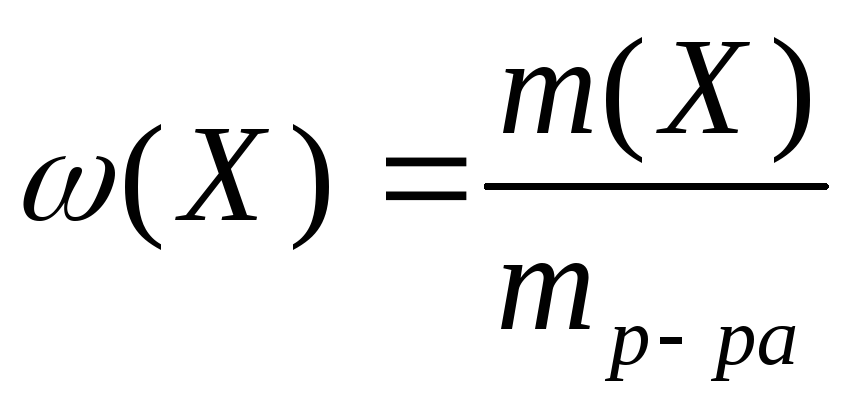 олярная
доля равна отношению количества
растворенного вещества в общему
количеству веществ в растворе:
олярная
доля равна отношению количества
растворенного вещества в общему
количеству веществ в растворе:
К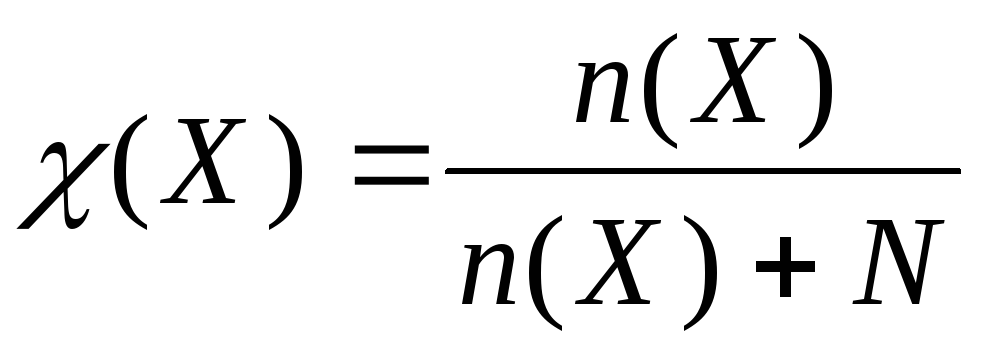 ак
правило, вещество обладает определенной
растворимостью в данном растворителе.
Под растворимостью понимают
концентрацию вещества в насыщенном
растворе.
ак
правило, вещество обладает определенной
растворимостью в данном растворителе.
Под растворимостью понимают
концентрацию вещества в насыщенном
растворе.
3. Термодинамика и механизм процесса растворения
Растворение – сложный физико-химический процесс, включающий три основные стадии, каждая из которых характеризуется изменениями термодинамических функций Н и S:
разрушение химических и межмолекулярных связей в растворяемом веществе (например, разрушение кристаллической решетки): Н1>0, S1>0
химическое взаимодействие частиц растворенного вещества с растворителем (сольватация): Н2<0, S2<0
равномерное распределение частиц растворенного вещества в среде растворителя путем диффузии: Н3>0, S3>0
Согласно 2-му закону термодинамики условием самопроизвольности процесса растворения является убыль энергии Гиббса:
G = H — TS < 0,
которая складывается из энтальпийного Н и энтропийного TS факторов.
Растворение газов в жидкостях приводит к упорядочению системы и, следовательно, сопровождается уменьшением энтропии: Sр-ния<0. Движущей силой процесса растворения в этом случае является энтальпийный фактор и растворение большинства газов является процессом экзотермическим: Нр-ния<0. Таким образом, самопроизвольное растворение газов возможно при низких температурах (|Н| > |TS|)
Растворение жидких и твердых веществ в жидкостях приводит к увеличению беспорядка в системе и увеличению энтропии: Sр-ния>0. Суммарный тепловой эффект процесса растворения определяется в основном слагаемыми Н1 и Н2 и в зависимости от их соотношения может и быть и положительным (NaCl), и отрицательным (NaOH). Растворение большинства кристаллических веществ – процесс эндотермический Нр-ния>0, так как энергия, затрачиваемая на разрушение кристаллической решетки не компенсируется энергией, выделяемой за счет сольватации. Таким образом, самопроизвольному растворению большинства твердых веществ способствуют высокие тепмературы (|Н| < |TS|).
Растворы, образование которых не сопровождается изменениями объема системы и тепловыми эффектами (V=0, Н=0), называют идеальными. Движущей силой образования идеального раствора является увеличение энтропии системы. Идеальный раствор – понятие абстрактное. Реальные системы могут лишь приближаться к идеальным. Наиболее близки к модели идеального раствора системы, в которых компоненты близки по свойствам и практически не взаимодействуют друг с другом (например, раствор толуола в бензоле). Приближаются по свойствам к идеальным бесконечно разбавленные растворы, в которых взаимодействиях сводятся к минимуму за счет низкой концентрации растворенного вещества.
4. Растворимость
Под растворимостью понимают концентрацию растворенного вещества в насыщенном растворе.
Растворимость выражают в тех же единицах, что и концентрацию. Часто используют коэффициент растворимости s, равный массе растворенного вещества (г) в насыщенном растворе, содержащем 100 г растворителя.
Насыщенным называют раствор, который находится в равновесии с избытком растворяемого вещества (Gр-ния=0). Насыщенный раствор имеет максимально возможную в данных условиях концентрацию.
Растворимость зависит:
от природы растворенного вещества и растворителя;
от температуры;
от давления;
от присутствия третьих компонентов.
Влияние природы компонентов на растворимость определяется принципом: подобное растворяется в подобном. Полярные растворители, например, вода, хорошо растворяют вещества с ионной связью (неорганические соли, кислоты и основания). Хорошей растворимостью в воде обладают полярные органические соединения, образующие с молекулами растворителя водородные связи (спирты, карбоновые кислоты, амины). Неполярные растворители, например, углеводороды, растворяют неполярные и малополярные соединения (жиры).
Влияние температуры на растворимость зависит от теплового эффекта растворения и определяется принципом Ле Шателье. Повышению растворимости газов способствует понижение температуры, так как растворение газов – процесс экзотермический. Растворимость большинства твердых веществ и жидкостей — процесс эндотермический и возрастает при повышении температуры.
Влияние давления существенно только в том случае, если при растворении происходит значительное изменение объема системы, что наблюдается при растворении газов в жидкостях. Растворимость газов растет с увеличением давления, так как сопровождается уменьшением объема системы.
Закон Генри:
Количество газа, растворенного в определенном объеме жидкости при постоянной температуре прямо пропорционально давлению газа.
c(X) = Kгp(X)
где c(X) – молярная концентрация газа,моль/л
Kг — константа Генри, моль/лПа
p(X) – давление газа над раствором, Па
Влияние присутствия третьих компонентов.
Растворимость газов в жидкостях значительно снижается в присутствии электролитов (солей) Этот процесс называют высаливанием.
Закон Сеченова:
Растворимость газов в жидкостях в присутствии электролитов понижается.
С(X) = С0(X)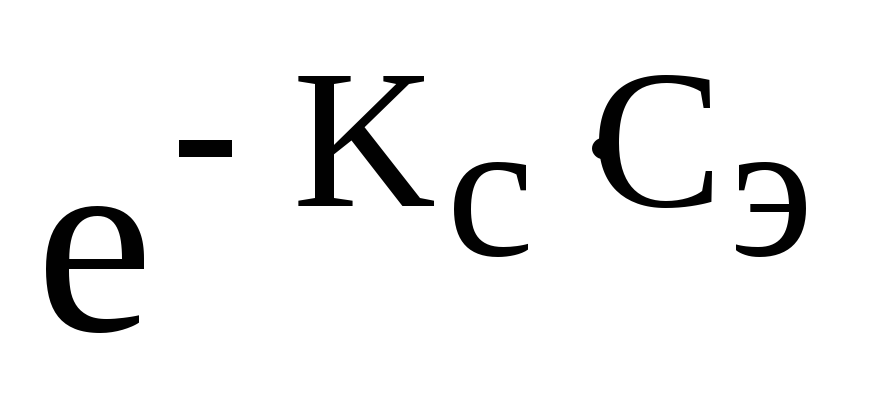
где С(X) – растворимость газа в присутствии электролита
С0(X) – растворимость газа в чистом растворителе
КС — константа Сеченова
Сэ — концентрация электролита
Биологическое значение законов Генри и Сеченова.
Изменение растворимости газов в крови при изменении давления может привести к тяжелым заболеванием. Кесонная болезнь у водолазов – проявление закона Генри. В соответствии с законом Сеченова растворимость кислорода и углекислого газа в крови зависит от концентрации электролитов, а также белков, липидов и других веществ.
5. Вода как растворитель. Значение растворов в жизнедеятельности организмов
Самым распространенным растворителем на нашей планете является вода. У животных и растительных организмов содержание воды составляет обычно более 50%, а в ряде случаев достигает 90-95%.
Вода хорошо растворяет многие ионные и полярные соединения. Такое свойство воды связано с ее высокой диэлектрической проницаемостью (= 78,5). В результате многие ионные соединения диссоциируют и отличаются высокой растворимостью в воде. Другой класс веществ, хорошо растворимых в воде, составляют полярные органические соединения (спирты, альдегиды, кетоны). Их растворимость обусловлена образованием водородных связей с молекулами воды.
Важны и другие аномальные свойства воды: высокое поверхностное натяжение, низкая вязкость, высокие температуры плавления и кипения, более высокая плотность в жидком состоянии, чем в твердом.
Вследствие высокой полярности вода вызывает гидролиз веществ (эфиров, амидов и др.). Так как вода составляет основную часть внутренней среды организма, то она обеспечивает процессы всасывания, передвижения питательных веществ и продуктов обмена в организме.
Важнейшие биологические жидкости – кровь, лимфа, моча, слюна, пот являются растворами солей, белков, углеводов, липидов в воде. Биохимические процессы в живых организмах протекает в водных растворах.
В жидких средах организма поддерживается постоянство рН, концентрации солей и органических веществ, постоянство осмотического давления. Такое постоянство называется гомеостазом. Приведенные примеры показывают, что учение о растворах представляет особый интерес для медиков.
73
studfile.net
Разработка урока по теме Вода.Растворы.
Урок Каморной Ирины Михайловны МБОУ СОШ№15 г. Заринска, Алтайского края
Каморная И.М. учитель химии и биологии
МБОУ СОШ №15 с УИОП города Заринска, Алтайского края
Номинация «Урок с использованием современного учебного оборудования» (6.4.)
Технологическая карта урока химии в 8 классе
Цель:создание условий:
— для изучения воды и её растворов;
— для развития умения делать выводы по работе;
— для развития учебно-познавательного интереса к новому учебному материалу и способам решения новой частной задачи
Дидактические задачи урока:
Обучающие — обеспечить в ходе урока усвоение (изучение, закрепление, повторение…) основных химических понятий
Развивающие — развивать у учащихся умения выделять главное, существенное в изучаемом материале; сравнивать, составлять, обобщать, систематизировать, компактно и логически последовательно излагать свои мысли
Воспитательные — содействовать в ходе урока формированию следующих мировоззренческих идей:
а) объективность и реальность окружающего мира;
б) причинно-следственные и другие связи между явлениями;
в) непрерывность изменений и развития в природе и обществе;
г) обусловленность развития химической науки потребностями производства, жизни и быта;
Планируемый результат
Предметные: в процессе групповой работы уметь распознавать и называть основные качества воды, знать определения понятий
Метапредметные: развивать умения определять понятия, классифицировать, устанавливать причино- следственные связи, в процессе групповой работы уметь пользоваться инструктивной картой при выполнении работы, оформлять результаты работы в тетрадь, делать выводы о значении растворов; формировать развивать компетентности в области использования информационно- коммуникационных технологий.
Личностные: проявление учебно-познавательного интереса к новому учебному материалу и способам решения новой частной задачи, формировать ответственное отношение к учению
Основные понятия
раствор, растворимость, суспензия, эмульсия, насыщенный раствор, ненасыщенный раствор
Мыслительные операции на этапе проектирования:
анализ, синтез, сравнение, обобщение, классификация
Ресурсы:
— основные
— дополнительные
цифровой микроскоп
компьютер
проектор
презентация
раздаточный материал для работы группе
энциклопедия и научная литература
таблицы
модели молекул
наглядные предметы быта
химическое оборудование
Демонстрации
растворение в воде сахара, солей, глины, песка, кислот
Формы организации учебно-познавательной деятельности:
работа фронтальная, индивидуальная, самостоятельная и в парах
Методы:
словесный, наглядный, деятельностный, исследовательский
Технологии обучения:
здоровьесберегающая технология, обучение развитию критического мышления, проблемное обучение, метод эвристического обучения, обучение в сотрудничестве
Учебник:
Рудзитис Г.Е., Фельдман Ф.Г. Химия: учебник для 8 класса общеобразовательных учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – 12-е изд. – М.: Просвещение, ОАО «Московские учебники», 2009. – 176 с
Структура и ход урока
I. Организационный этап урока.Цель этапа:
настроить учащихся на учебный процесс.
7,15
1,2
16
— Здравствуйте, ребята! Садитесь!
1. Для организации работы на уроке,
всем классом, давайте уточним, какое качество необходимо Вам как ученику, чтобы достичь желаемого результата.
2.Опыт№1«Тайное письмо» Единство! Приложение 1 (слайд2)
Учитель: Да, действительно, у каждого из вас есть возможность на этом уроке не только изучить химию, но и работать над собой, развивать в себе те качества, которые, на ваш взгляд, вам необходимы. Мы осуществим взаимосвязь всех ваших качеств во едино, для изучения материала.
3. В течение урока прошу вас оценивать свою работу на листах самооценки. Познакомьтесь с ними. Лист, включает в себя: перечень видов работ на уроке, место для самооценки для каждой работы. Посмотрите критерии оценки. У кого есть вопросы? Не забывайте после каждого задания оценивать свою работу. Приложение 2
Фронтальная работа:
Высказывания учащихся о качествах, необходимых каждому для достижения поставленных целей.
Наблюдают за опытом проявления надписи- нагревание над спиртовкой заранее написанной надписи молоком.
Самостоятельная работа:
Знакомство с листом самооценки (инструктивной картой)
1-2 минуты
II.Актуализация знаний через повторение
Цель этапа:
обобщение материала, проверка домашнего задания
1,2
14,16
1,2
16
Ребята, скажите, пожалуйста, какую тему мы изучили?
— Верно! Водород. (слайд№3)
Я предлагаю обобщить материал прошлой темы по вашему тесту. Приложение 3
Проверьте свои ответы:(слайд №4)
Ответ: 1А -2А, В -3Б -4А -5В
(оцените свою работу на этапе актуализация знаний через повторение и отметьте баллом)
Учащиеся отвечают на вопрос:
Учащиеся повторяют пройденный материал.
Систематизируют знания. Готовятся к тесту.
Самопроверка
Учащиеся обмениваются работами и проверяют результат.
0 ошибок=5,1-2=4,3=3,4=2
5 минуты
III. Целеполагание
Цель этапа:
формирование познавательных мотивов учебной деятельности, определение учебной цели
1,2
11
8
1,2
— Чтобы определить тему и цель сегодняшнего урока, я предлагаю рассмотреть данный слайд и, работая в паре, попытаться ответить на вопрос: «О каком понятии сегодня пойдёт речь? Сформулируйте тему урока». (слайд №5)
ИТАК, тема урока: Вода-растворитель. Растворимость веществ в воде.
— А что вы уже знаете о воде? (слайд №6)
— Работая в парах, обсудите: «Что ещё вы не знаете и хотели бы узнать о воде?»
— Постарайтесь сформулировать цель урока исходя из темы урока.
Итак, наша ЦЕЛЬ: (слайд №7)
— изучить особенности воды как растворителя
— научиться распознавать эти растворы
— научиться решать задачи по теме
(оцените свою работу на этапе постановки цели и отметьте баллом на листах самооценки)
Обсуждение в паре темы урока.
Высказывание одной пары (ученики класса выражают своё согласие или нет с помощью условных знаков – поднятая или опущенная рука)
Ответы учащихся: формула, агрегатное состояние, состав, свойства и значение формулирование темы урока. Запись темы урока в рабочей тетради.
Информацию о растворах
Работа в парах и оглашение цели урока
1-2 минуты
2 минуты
IV. Планирование предстоящей деятельности
Цель этапа:
организация планирования своей деятельности
Цель этапа:
снять напряжения с глаз
1,2
Что нам необходимо, чтобы достичь цели урока?
—Работая в парах, обсудите, какие пункты могут быть в плане достижения поставленной цели.
План достижения цели:
1)объяснить новые понятия;
2)научиться их применять
Разминка для глаз («ВВЕРХ И ВНИЗ», «СМОТРИМ ПО СТОРОНАМ»,«ПО ДИАГОНАЛИ», «РИСУЕМ ПРЯМОУГОЛЬНИК» «ЗМЕЙКА»)
Работа в парах
Обсуждают, высказывают своё мнение в паре. Варианты ответов ребят (устно)
Выполняют упражнения за учителем
1-2 минуты
30-40сек
V. Реализация плана
Цель этапа:
формирование способности анализировать, строить высказывания
Цель этапа:
Формирование основ теоретического мышления, развитие умений высказывать свою точку зрения
Цель этапа:
снять усталость
Цель этапа:
развитие умения осуществлять анализ предъявляемой информации для поиска ответа на вопрос
Цель этапа:
развитие умения пользоваться инструкцией для выполнения практической работы (рассмотрено на первых уроках химии)
13,14
1,2,3,7
15
9,10,11
1,2
9
1,2
16
13
4,5,6,11,12,13
1,2, 13
5,6,11
1. Основным понятием урока является понятие вода. А видел ли кто-нибудь из вас воду? Где и какую?
Почему капля воды всегда получается с бугорком? Строение молекулы- модель
2.Чистая и грязная вода 2 разных понятия, чем отличаются? Капли под микроскопом.
3.Строение льда под электронным микроскопом.
4. Мы действительно знаем много уже про воду и нам необходимо определить новые понятия, вставить ключевые слова в тексте, для этого прочитаем письмо-загадку от Шерлока Холмса… Ответ: раствор(ы) Приложение 4
Пояснение новых понятий учителем (слайды №8-13)
5.Сценка№1 На приёме у врача.
Внимание вопрос. Что предложил в качестве лечения врач. Говоря на языке химии? Приложение5
Суспензия
6.ФИЗКУЛЬТИНУТКА (слайд №14)
7.Сценка№2 «В гостях у друга» Приложение 6 Внимание вопрос: переведите на язык химии разговор ребят, что хотел Вадим?
Раствор насышенный и ненасыщенный.
8.Интересный факт слайд №15
Первые итоги: выполнили мы первую задачу, которую поставили в начале урока?
— Какой следующий этап работы?
таблица растворимости
Картинки слайда берёзовый сок, обсудите в парах выскажите своё мнение, что это с точки зрения по химии. (слайд№16)
Ответ: насышенный раствор сахаром, а когда берёза распустится ненасыщенный. Концентрированный и разбавленный раствор
Опыт№2. (слайд№17) Пробирки с песком, глиной, землёй, соли, оксида калия, растительное масло. Какие это растворы?
Косметика с блеском-спрей для тела, а водо эмульсионная краска?
3.Расчёт коэффициента. (слайд№18-19)
— Что нам на данном этапе удалось изучить?
По 3 стакана с растворами солей NaCl (прозрачный, полупрозрачный и соль с кристаллами) и CuSO4
Молодцы, тема Вами усвоена!!! Ваши ответы верны.
Рассказывают про воду
Рассматривают на экране изображение с микроскопа, объясняют почему в чистой воде микроорганизмов нет и так много в грязной
Рассматривают слоистость льда и переход в другое агрегатное состояние
Являясь слушателями
учащиеся выражают на химическом языке о чём шла речь у героев. По учебнику сверяют формулировки и записывают определения новых понятий.
Фронтальная работа.
Работа с учебником
Запись в тетрадь
Повторяют движения за физруком класса
Учащиеся выполняют физические упражнения на расслабление мышц рук, туловища
Высказывания по этапу урока
Записать в тетради
Высказывают мнение
Ведут обсуждение
Выходят заранее и смешивают содержимое пробирок
Высказывание по каждой пробирке и реакция класса
Наблюдают за работой учащегося
Высказывание учеников
Самостоятельная работа учащихся
Высказывают свои суждения о типах растворах
вновь оцените свою работу н этом этапе
5-7 мин.
1-3мин
1 мин
2-4мин
5 мин.
2-3 мин.
.
VI. Этап проверки понимания нового. Закрепление материала
Цель этапа:
организовать закрепление изученного на уроке
развитие умений в оценочной деятельности
VII.Рефлексия
Цель этапа:
узнать эмоциональное настроение
16
-Вспомните цели, стоявшую перед вами.
-Смогли ли мы достичь их?
Что Вы узнали нового на уроке?
Оцените свою работу на уроке, подсчитав общий балл в листе самооценки.
-Кто доволен своей работой на уроке?
-Кто не доволен?
-Как поступить тем, кто не доволен своей работой?
Поставьте галочку на смайлике настроения в тетради (слайд №20)
Фронтальная и самостоятельная работа учащихся.
Индивидуальная проверка:
Оценивают работу на уроке
Перевод баллов в отметку:
0-3баллов – отметка «2»
4-5 баллов –отметка «3»
6-7 баллов– отметка «4»
8 баллов – отметка «5»
Сдают тесты и листы самооценки
Личные мнения учащихся
2-3 мин.
Домашнее задание
Цель этапа:
пояснить методику выполнения задания,
самообразование
Для закрепления полученных знаний предлагаю выполнить домашнее задание (слайд №21)
1. Работа с учебником § 28, ответы на вопросы после параграфа, подготовка к пр. раб №4 стр. 88
2. Отработать понятия, встречаемые в тексте параграфа. Выписать формулировки определений. Составьте свою задачу. печатная тетрадь, в сетевом городе будут выставлены темы дополнительных сообщений для желающих.
Всем спасибо за работу на уроке! Удачного дня! (слайд 22)
Вносят задания в дневник
1-2 мин
infourok.ru
Уроки 27-29. Вода — растворитель. Растворы. Насыщенные и ненасыщенные растворы. Растворимость веществ в воде. Массовая доля растворенного вещества. Практическая работа ‘Приготовление раствора солей с определенной массовой долей вещества’ (Страницы 78,79,80,81)
Главная › 8 класс › Химия › Рабочая тетрадь по химии Боровских 8 класс 1. Заполните пропуски:Вода — универсальный растворитель. В ней растворяются многие твердые вещества (например: соль, сахар), жидкие вещества (например, кислоты (азотная, серная) и газообразные вещества (например, углекислый газ, сероводород). Именно поэтому в природе нельзя обнаружить чистую воду.
2. Растворами называют однородные системы, состоящие из молекул растворителя и частиц растворенного вещества, между которыми происходят физические и химические взаимодействия.
3. Суспензия это смесь, в которой мелкие частицы твердого вещества равномерно распределены между молекулами воды.
4. Эмульсия — это смесь, в которой мелкие капельки какой-либо жидкости равномерно распределены между молекулами воды (другой жидкости).
5. Растворимость — это макисмально возможное число граммов вещества, которое может раствориться в 100 г растворителя при данной температуре.
Для большинства твердных веществ с повышением температуры растворимость увеличивается. Для газов растворимость увеличивается при понижении температуры.
6. Насыщенный раствор — это раствор, в котором данное вещество больше не растворяется при данной температуре.
Концентрированный растор — это раствор, в котором содержится много растворенного вещества.
Ненасыщенный раствор — это раствор, в котором данное вещество еще может настворяться.
Разбавленный раствор — это раствор, в котором содержится мало растворенного вещества.
7. Массовая доля вещества в растворе — это отношение массы растворенного вещества в массе раствора.
Формула:

8. Задача. Вычислите массу соли и воды для приготовления 250 г 5%-го раствора.

9. Задача. Вычислите массу кислоты и вода в 500 г 25%-го раствора.

10. Задача. Сколько (мл) воды надо взять, чтобы растворить 15 г хлорида меди (2) и получить 15%-ный раствор?

11*. Задача. Определите массу хлорида калия, содержащегося в 100 мл расвтора с массовой долей расвторенного вещества 20% (р=1,133 г/см3).

12*. Задача. Определите массу гидроксида натрия, содержащегося в 300 мл его 15%-ного раствора (р=1,165 г/мл).

Уроки 24-26. Водород, его общая характеристика и нахождение в природе. Получение водорода и его свойства. Применение водорода — стр. 72-77Практическая работа «Приготовление раствора солей с определенной массовой долей вещества» — стр. 82
Сохраните или поделитесь с одноклассниками:
dourokov.ru