Классификация углеводородов
И природный газ, и нефтяные газы представляют собой сложные смеси органических и неорганических соединений. Промышленные же газы получают путем переработки вышеупомянутых газов. Однако в основе всех промышленных газов лежат углеводороды, которые в соединении с галогенами (фтор, хлор, бром, йод), кислородом, азотом и т. п. дают весь спектр промышленных газов.
Органическая химия — это наука, изучающая соединения углерода. Углеводороды — простейшие по составу органические соединения, в которых содержатся атомы лишь двух элементов — углерода и водорода.
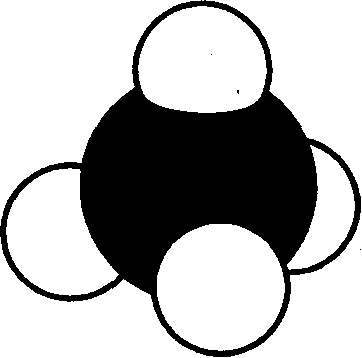
Сырая нефть, например, представляет собой смесь огромного числа углеводородов. Простейшая форма углеводородов — это метан, состоящий из одного атома углерода и четырех атомов водорода (рис. 3).
Во всех органических соединениях атом углерода является четырехвалентным.
Общая формула углеводородов Сm, Нn, где m и n — целые числа.
В настоящее время насчитывается около 5 миллионов органических соединений, тем не менее ежегодно открывают или синтезируют примерно 200 тысяч новых органических соединений. И каждое соединение должно быть Рис 3. Молекула метана
названо таким образом, чтобы в его названии отражалось строение вещества.
Поэтому уже в 1892 году в Женеве на Международном конгрессе были заложены основы номенклатуры органических соединений. Сейчас действуют Правила Международного союза чистой и прикладной химии (UIPAC). В соответствии с этими Правилами можно составлять специализированные коды перевозимых газов, которыми пользуются в настоящее время все перевозчики.
Для классификации углеводородов по типам в молекуле органического соединения выделяют углеродный скелет, т. е. тип взаимодействия атомов углерода между собой, в функциональные группы, т. е. группы элементов, определяющие основные физические и химические свойства веществ.
Ряд сходных по строению органических соединений, обладающих близкими химическими свойствами, в которых отдельные члены ряда отличаются друг от друга лишь количеством в них групп —СН2—, называется гомологическим. Свойства органического соединения в основном определяются составом его функциональной группы (наиболее легко изменяющейся и вступающей в реакции частью молекулы). Это и дает возможность классифицировать органические соединения по гомологическим рядам или же классам органических соединений. Для любого гомологического ряда может быть выведена формула, отображающая соотношение атомов углерода и водорода у членов этого ряда.
Для того чтобы легче разобраться с разновидностями углеводородов, рассмотрим классы углеводородов в зависимости от сложности их состава. Такими классами (гомологическими рядами) являются:
• алканы (парафины) — ряд метана,
• алкены (олефины) — ряд этилена,
• алкадиены (диеновые углеводороды),
• алкины — ряд ацетилена,
• циклоалканы (циклопарафины),
• ароматические углеводороды ряда бензола (арены).
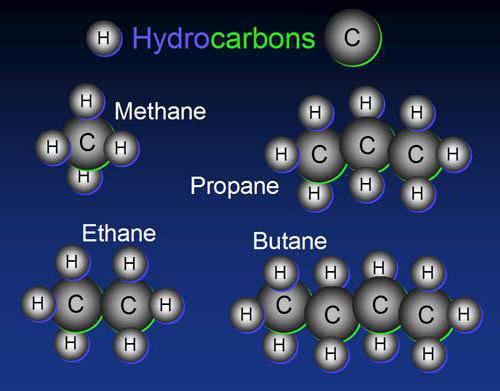
Алканы — предельные углеводороды ряда метана. Все названия предельных углеводородов оканчиваются суффиксом aн. Простейшими представителями таких органических соединений являются:
• метан
• этан
• пропан
• бутан
• изобутан
С увеличением числа атомов углерода в молекуле значительно меняются плотность вещества и его свойства. Если, например, молекулы, содержащие от 1 до 4 атомов углерода, являются газами, то вещества, молекулы которых содержат от 5 до 17 атомов углерода, — уже жидкости, а молекулы, в которых содержание углерода более 17 атомов, представляют собой твердые вещества.
Начиная с молекул углеводородов, в которых содержится 4 атома углерода и более, меняется пространственная структура молекул, т. е. взаимное расположение атомов углерода. При этом изменяются все свойства веществ.
| Вещества, имеющие одинаковый состав (одинаковую молекулярную формулу), но разное пространственное строение молекул, называются ИЗОМЕРАМИ.
Бутан, состоящий из 4 атомов углерода и 10 атомов водорода, имеет 2 изомера, а октан, состоящий из 8 атомов углерода и 18 атомов водорода, имеет уже 18 изомеров. Изомеры отличаются друг от друга температурой кипения, плавления, температурой воспламенения, вязкостью и пр., т. е. физическими свойствами.
Отличительная особенность алканов — это то, что все четыре валентные связи углерода одинарные, следствием этого является инертность таких углеводородов в обычных условиях.
Углеводороды только с одинарными связями между атомами углерода называются насыщенными, или предельными.
Общая химическая формула алканов имеет вид
СnН2n+2 , где n — Целое число.
Алканы не взаимодействуют между собой и не растворяются в воде. При высокой температуре и под действием ультрафиолетового излучения они вступают в реакцию с хлором и бромом с образованием галогенных углеводородов.
Хлоропроизводные метана широко используются в промышленности. Хлорметан — газ, который легко сжижается и при последующем испарении поглощает значительное количество теплоты. Этот газ получил широкое применение в холодильных установках.
Алкены. Следующей важной группой углеводородов, которые не встречаются в природе в свободном состоянии, но могут быть получены из нефти в процессе крекинга, являются алкены. Все названия непредельных углеводородов ряда этилена оканчиваются суффиксом ен.
|Алкенами называют непредельные углеводороды, которые содержат одну двойную связь меяду атомами углерода, т. е. количество атомов водорода в составе непредельных углеводородов всегда меньше, чем в предельных.
Общая формула алкенов СnН2n, где n — целое число. Простейший из алкенов — этилен (этен):
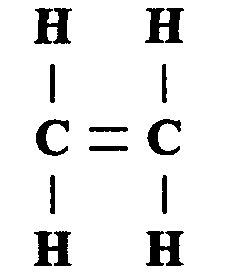
Двойная связь между атомами углерода непрочная, поэтому алкены химически более активны, чем алканы. Как и алканы, алкены образуют целый ряд изомеров, причем такие изомеры отличаются как структурой молекулы, так и расположением двойной связи между атомами углерода, а также пространственным расположением атомов элементов. Из-за наличия двойных связей алкены могут присоединять еще один атом водорода и поэтому могут вступать в реакцию с алканами.
| Углеводороды, содержащие одну или несколько двойных или тройных связей между б атомами углерода, называются непредельными, или ненасыщенными.
Алкадиеиы также являются ненасыщенными углеводородами и содержат в составе молекулы две двойные связи между атомами углерода. Названия диеновых углеводородов образуются от соответствующих названий предельных углеводородов с суффиксом диен. Общая формула диеновых углеводородов СnHn+2.
Так же как и все остальные углеводороды, алкадиены образуют изомеры, начиная с 5-го атома углерода. Изомеры, образующиеся при этом, различаются по скелетному расположению атомов углерода, расположению двойных связей и ориентации элементов молекулы в пространстве. Простейшим представителем диеновых углеводородов является бутадиен: С4Н6, структура которого имеет вид
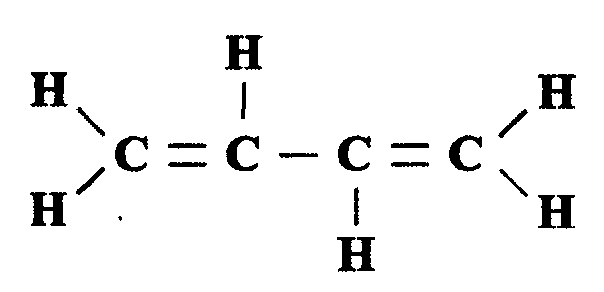
Большинство алкадиенов используются как сырье для получения синтетических пластмасс, в частности, бутадиен — для получения синтетического каучука.
Алкины, или, как их еще называют, ацетиленовые углеводороды также являются непредельными углеводородами и содержат в структурной формуле молекул одну тройную связь между атомами углерода.
Все названия непредельных углеводородов ряда ацетилена оканчиваются суффиксом ин. Общая формула для алкинов СnН2n-2, т. е. точно такая же, как и для алкадиенов.
Простейшими представителями этой группы являются
а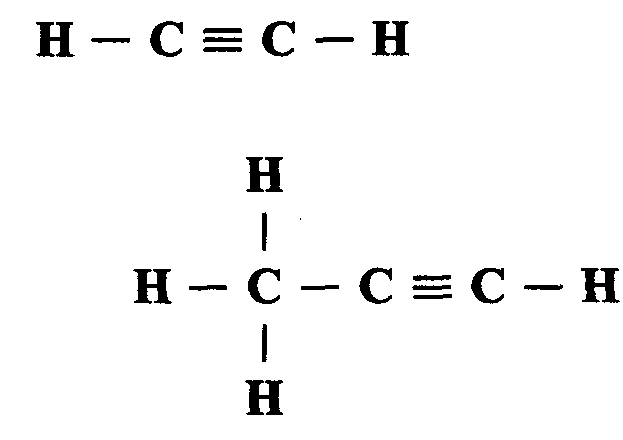 цетилен
(этан) СН ≡ СН и
цетилен
(этан) СН ≡ СН и
пропин СНз – С ≡ СН
Характерными реакциями являются реакции присоединения, окисления и полимеризации. При взаимодействии ацетилена с соляной кислотой (НСl) образуется винилхлоридмономер (VCM), который может полимеризовываться в поливинилхлорид. Данный продукт широко используется для получения пластмасс.
 Винилхлорид
(хлорвинил, хлорэтилен) используется
при изготовлении диэлектрических
пластмасс, искусственной кожи и т. д.
Винилхлорид
(хлорвинил, хлорэтилен) используется
при изготовлении диэлектрических
пластмасс, искусственной кожи и т. д.
Циклоалканы. Некоторые молекулы предельных углеводородов могут соединяться таким образом, что каждый из атомов углерода в молекуле будет иметь по две свободные валентные связи. В таком случае молекулы углеводородов имеют цикличную (замкнутую) форму.
Названия циклопарафинов образуются от соответствующих названий предельных углеводородов с добавлением префикса цикло-. Простейшие представители циклопарафинов — циклопропан и циклобутан, однако наиболее часто встречаются циклопарафины более высокого порядка, например циклопентан или циклогексан. Общая химическая формула циклоалканов выглядит следующим образом: Сnh3n.
Структурное строение молекулы можно представить на примере циклопропана:

В подавляющем большинстве циклопарафины нашли применение как растворители в химической промышленности и в медицине. Чаще всего используются галогенопроизводные циклопарафинов.
Ароматические углеводороды. Если молекула углеводорода содержит более трех атомов углерода, то они могут объединяться, образуя соединения ‘ в форме бензольного кольца. Углеводороды, молекулы которых содержат бен-зольные кольца, называются цикличными, или ароматическими, углеводородами. Общая формула для этих углеводородов Сnh3n-6
.
Простейшие
представители этой группы: 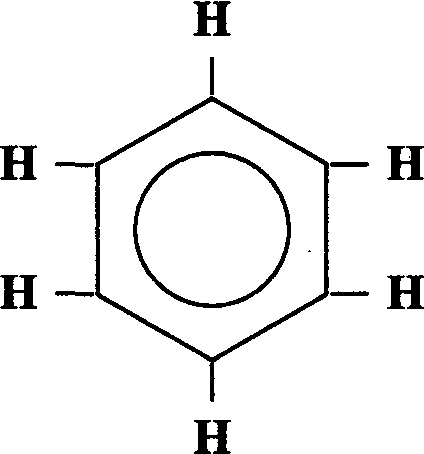 бензол
C
6H6
и толуол С6H5
-СНз.
бензол
C
6H6
и толуол С6H5
-СНз.
Изомерия в ряду бензола обусловлена взаимным расположением органических радикалов в ядре (метильной группы СНз). При этом образуются 3 изомера, расположение заместителей в которых указывается приставками орто-, мета- и пара-.
Шесть атомов углерода образуют правильный шестиугольник. Бензольные кольца обычно очень устойчивы и являются составной частью больших молекул. Характерными реакциями для аренов являются реакции замещения.
studfile.net
Углеводороды, виды и их классификация
Углеводороды, виды и их классификация.
Углеводороды – это органические соединения, состоящие из атомов углерода и водорода. Они служат фундаментальной основой органической химии
Углеводороды
Классификация и виды углеводородов
Предельные (насыщенные) ациклические углеводороды
Непредельные (ненасыщенные) ациклические углеводороды
Алициклические углеводороды
Ароматические углеводороды
Углеводороды:
Углеводороды – это органические соединения, состоящие из атомов углерода и водорода. Углеводороды служат фундаментальной основой органической химии – молекулы любых других органических соединений рассматривают как их производные.
Если в углеводороде один или несколько атомов водорода замещён на другой атом или группу атомов, называемую функциональной группой, то данное соединение называется производным углеводорода.
Атом углерода имеет 4 электрона на внешней оболочке, а потому способен образовывать четыре химические связи с другими атомами. Поэтому атом углерода является стабильным только в том случае, если все из этих связей – все четыре связи используются.
Существует огромное количество совершенно различных соединений углеводородов, которые различаются количеством атомов углерода и водорода, строением углеродного скелета и типом связей между атомами.
Большинство углеводородов в природе Земли встречаются в сырой нефти. Кроме того, основными источниками углеводородов являются природный газ, сланцевый газ, попутный нефтяной газ, горючие сланцы, уголь, торф.
Классификация и виды углеводородов:
При систематизации (классификации) углеводородов принимают во внимание строение углеродного скелета и тип связей, соединяющих атомы углерода.
В зависимости от строения углеродного скелета углеводороды подразделяют на ациклические и карбоциклические.
Ациклические соединения (ациклические углеводороды) – класс органических соединений, в молекулах которых отсутствуют циклы (кольца), и все атомы углерода соединены между собой в прямые или разветвлённые (открытые) цепи.
Ациклические соединения также в литературе называются алифатическими соединениями.
Карбоциклические соединения (карбоциклические углеводороды) – класс органических соединений, характеризующихся наличием колец (циклов) из атомов углерода. Карбоциклические соединения отличаются от гетероциклических соединений отсутствием в кольцах каких-либо других атомов, помимо атомов углерода.
В зависимости от кратности углерод-углеродных связей ациклические углеводороды подразделяют на предельные (алканы) и непредельные (алкены, алкины, диены) углеводороды. Предельные ациклические углеводороды также называются насыщенными, а непредельные – ненасыщенными.
В свою очередь циклические углеводороды в зависимости от кратности углерод-углеродных связей подразделяются на алициклические (циклоалканы, циклоалкены, циклоалкины) и ароматические (арены) углеводороды.
Предельные (насыщенные) ациклические углеводороды:
Алканы (также именуемые насыщенные углеводороды, предельные углеводороды, парафины) – ациклические углеводороды линейного или разветвлённого строения, содержащие только простые (одиночные) связи между атомами углерода и образующие гомологический ряд с общей формулой CnH2n+2.Насыщенными алканы называются потому, что они содержат максимально возможное число атомов водорода для заданного числа атомов углерода.
Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации – все 4 гибридные орбитали атома углерода идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28′. Связи C-C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C-C составляет 0,154 нм, длина связи C-H – 0,1087 нм.
Алканы образуют гомологический ряд, также называемый рядом метана. К алканам относятся: метан CH4, этан C2H6, пропан C3H8, бутан C4H10, пентан C5H12, гексан C6H14, гептан C7H16, октан C8H18, нонан C9H20, декан C10H22 и т.д., которые имеют формулу CnH2n+2. Алкан с самой длинной цепью – нонаконтатриктан C390H782.
Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии – изомерией углеродного скелета, а начиная с гептана – также оптической изомерией. С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Непредельные (ненасыщенные) ациклические углеводороды:
Алкены (также именуемые олефины, этиленовые углеводороды) – ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n.
Атомы углерода при двойной связи находятся в состоянии sp² гибридизации и имеют валентный угол 120°. Связи C=C представляют собой π-связи. Длина связи C=C составляет 0,134 нм.
По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Алкены образуют гомологический ряд, также называемый рядом этилена. К алкенам относятся: этен (этилен) C2H4, пропен (пропилен) C3H6, бутен (бутилен) C4H8, пентен C5H10, гексен C6H12, гептен C7h24, октен C8H16, нонен C9H18, децен C10H20 и т.д., которые имеют формулу CnH2n.
Алкены, число атомов углерода в которых больше двух (т.е. кроме этилена), имеют изомеры. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и геометрическая (пространственная). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Алкины (также именуемые ацетиленовые углеводороды) – ациклические непредельные углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
Атомы углерода при тройной связи находятся в состоянии sp-гибридизации и имеют валентный плоский угол 180°. Таким образом у алкинов связь С≡С линейна (угол 180°) и находится в одной плоскости. Связи C≡C образованы одной σ-связью и двумя π-связями. Длина связи C≡C составляет 0,121 нм.
По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами.
Алкины образуют гомологический ряд, также называемый рядом ацетилена. К алкинам относятся: этин (ацетилен) C2H2, пропин C3H4, бутин C4H6, пентин C5H8, гексин C6H10, гептин C7H12, октин C8H14, нонин C9H16, децин C10H18 и т.д., которые имеют формулу CnH2n-2.
Алкины, число атомов углерода в которых больше трех (т.е. кроме ацетилена и пропина), имеют изомеры. Для алкинов характерны изомерия углеродного скелета, положения тройной связи и межклассовая. С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Диены (именуемые также алкадиены) – ациклические непредельные углеводороды, содержащие две двойных связи между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
В зависимости от взаимного расположения кратных связей, диены подразделяются на три группы:
– сопряжённые диены, в которых двойные связи разделены одинарной (1,3-диены)
– аллены с кумулированными двойными связями (1,2-диены)
– диены с изолированными двойными связями, в которых двойные связи разделены несколькими одинарными.
По номенклатуре IUPAC названия диенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-диен»; положение двух двойных связей указывается двумя арабскими цифрами.
Атомы углерода при двойной связи находятся в состоянии sp² гибридизации. Связи C=C представляют собой π-связи. В сопряженных диенах длина связи C=C составляет 0,137 нм, а C-C – 0,146 нм.
Диены образуют гомологический ряд. К диенам относятся: пропадиен (С3Н4), бутадиен (С4Н6), пентадиен (С5Н8), гексадиен (С6Н10), гептадиен (С7Н12), октадиен (С8Н14), нонадиен (С9Н16), декадиен (С10Н18) и т.д., которые имеют формулу CnH2n-2.
Диены, число атомов углерода в которых больше четырех (т.е. кроме пропадиена и бутадиена), имеют изомеры. Для диенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и геометрическая (пространственная, цис-транс-изомерия). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Алициклические углеводороды:
Алициклические углеводороды – циклические углеводороды, молекулы которых содержат замкнутые кольца из атомов углерода (но не имеющие ароматического кольца), которые являются частично или полностью насыщенными. Алициклические соединения классифицируют по числу атомов в кольце, по числу колец, по наличию или отсутствию кратных связей.
К алициклическим углеводородам относятся циклоалканы, циклоалкены, циклоалкины.
Алициклические углеводороды имеют изомеры. Для них характерны изомерия углеродного скелета (кольца и боковых цепей), положения заместителей в цепи, положения двойной или тройной связи, межклассовая и геометрическая (пространственная, оптическая, цис-транс-изомерия, конформационная). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Циклоалканы (именуемые также полиметиленовые углеводороды, нафтены, цикланы, циклопарафины) – насыщенные алициклические углеводороды, имеющие циклическое строение (т.е. имеющие замкнутое кольцо атомов углерода), содержащие только простые (одиночные) связи между атомами углерода и образующие гомологический ряд с общей формулой CnH2n (n⩾3).
По номенклатуре IUPAC названия циклоалканов образуются от названий соответствующих алканов добавлением приставки «цикло-».
Атомы углерода при С-С связи находятся в состоянии sp3 гибридизации.
Циклоалканы образуют гомологический ряд. К циклоалканам относятся: циклопропан C3H6, циклобутан C4H8, циклопентан C5H10, циклогексан C6H12, циклогептан C7H14, циклооктан C8H16, циклононан C9H18, циклодекан C10H20 и т.д., которые имеют формулу CnH2n.
Циклоалкены (также именуемые циклоолефины) – ненасыщенные алициклические углеводороды, имеющие циклическое строение (т.е. имеющие замкнутое кольцо атомов углерода), содержащие одну двойную связь между атомами углерода и образующие гомологический ряд с общей формулой CnH2n-2 (n⩾3).
По номенклатуре IUPAC названия циклоалкенов образуются от названий соответствующих алкенов добавлением приставки «цикло-».
Циклоалкены образуют гомологический ряд. К циклоалкенам относятся: циклопропен C3H4, циклобутен C4H6, циклопентен C5H8, циклогексен C6H10, циклогептен C7H12 и т.д., которые имеют формулу CnH2n-2.
Циклоалкины – ненасыщенные алициклические углеводороды, имеющие циклическое строение (т.е. имеющие замкнутое кольцо атомов углерода), содержащие одну тройную связь между атомами углерода и образующие гомологический ряд с общей формулой CnH2n-4 (n⩾5).
По номенклатуре IUPAC названия циклоалкинов образуются от названий соответствующих алкинов добавлением приставки «цикло-».
Циклоалкины образуют гомологический ряд. К циклоалкинам относятся: циклопентин C5H6, циклогексин C6H8, циклогептин C7H10 и т.д., которые имеют формулу CnH2n-4.
Ароматические углеводороды:
Ароматические углеводороды (арены) – циклические углеводороды, которые имеют в своём составе ароматическую систему.
Ароматическая система – это электронная система молекулы, содержащая (в кольце), в соответствии с правилом Хюккеля, 4n+2 электронов (где n = 0, 1, 2, …).
Различают бензоидные (арены и структурные производные аренов, которые содержат бензольные ядра) и небензоидные (все остальные) ароматические углеводороды.
Состав аренов с одним бензольным кольцом отвечает общей формуле CnH2n-6 (n⩾6).
Атомы углерода в бензольном кольце находятся в состоянии sp2 гибридизации и имеют валентный угол 120°. Каждый атом углерода образует 3 σ-связи. Бензольное кольцо имеет плоскую форму и образуют шестигранник. У каждого атома есть негибридная р-обиталь, на которой находится неспаренный электрон. Эта орбиталь перпендикулярна плоскости и поэтому все 6 π-электронов образует единую π-электронную систему. Длина связи между атомами углерода в бензольном кольце составляет 0,139 нм.
Ароматические углеводороды имеют множество изомеров.
Примечание: © Фото https://www.pexels.com, https://pixabay.com




карта сайта
Коэффициент востребованности 690
xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai
Классификация углеводородов
И природный газ, и нефтяные газы представляют собой сложные смеси органических и неорганических соединений. Промышленные же газы получают путем переработки вышеупомянутых газов. Однако в основе всех промышленных газов лежат углеводороды, которые в соединении с галогенами (фтор, хлор, бром, йод), кислородом, азотом и т. п. дают весь спектр промышленных газов.
Органическая химия — это наука, изучающая соединения углерода. Углеводороды — простейшие по составу органические соединения, в которых содержатся атомы лишь двух элементов — углерода и водорода.
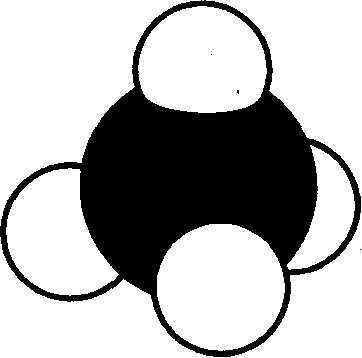
Сырая нефть, например, представляет собой смесь огромного числа углеводородов. Простейшая форма углеводородов — это метан, состоящий из одного атома углерода и четырех атомов водорода (рис. 3).
Во всех органических соединениях атом углерода является четырехвалентным.
Общая формула углеводородов Сm, Нn, где m и n — целые числа.
В настоящее время насчитывается около 5 миллионов органических соединений, тем не менее ежегодно открывают или синтезируют примерно 200 тысяч новых органических соединений. И каждое соединение должно быть Рис 3. Молекула метана
названо таким образом, чтобы в его названии отражалось строение вещества.
Поэтому уже в 1892 году в Женеве на Международном конгрессе были заложены основы номенклатуры органических соединений. Сейчас действуют Правила Международного союза чистой и прикладной химии (UIPAC). В соответствии с этими Правилами можно составлять специализированные коды перевозимых газов, которыми пользуются в настоящее время все перевозчики.
Для классификации углеводородов по типам в молекуле органического соединения выделяют углеродный скелет, т. е. тип взаимодействия атомов углерода между собой, в функциональные группы, т. е. группы элементов, определяющие основные физические и химические свойства веществ.
Ряд сходных по строению органических соединений, обладающих близкими химическими свойствами, в которых отдельные члены ряда отличаются друг от друга лишь количеством в них групп —СН2—, называется гомологическим. Свойства органического соединения в основном определяются составом его функциональной группы (наиболее легко изменяющейся и вступающей в реакции частью молекулы). Это и дает возможность классифицировать органические соединения по гомологическим рядам или же классам органических соединений. Для любого гомологического ряда может быть выведена формула, отображающая соотношение атомов углерода и водорода у членов этого ряда.
Для того чтобы легче разобраться с разновидностями углеводородов, рассмотрим классы углеводородов в зависимости от сложности их состава. Такими классами (гомологическими рядами) являются:
• алканы (парафины) — ряд метана,
• алкены (олефины) — ряд этилена,
• алкадиены (диеновые углеводороды),
• алкины — ряд ацетилена,
• циклоалканы (циклопарафины),
• ароматические углеводороды ряда бензола (арены).
Алканы — предельные углеводороды ряда метана. Все названия предельных углеводородов оканчиваются суффиксом aн. Простейшими представителями таких органических соединений являются:
• метан
• этан
• пропан
• бутан
• изобутан
С увеличением числа атомов углерода в молекуле значительно меняются плотность вещества и его свойства. Если, например, молекулы, содержащие от 1 до 4 атомов углерода, являются газами, то вещества, молекулы которых содержат от 5 до 17 атомов углерода, — уже жидкости, а молекулы, в которых содержание углерода более 17 атомов, представляют собой твердые вещества.
Начиная с молекул углеводородов, в которых содержится 4 атома углерода и более, меняется пространственная структура молекул, т. е. взаимное расположение атомов углерода. При этом изменяются все свойства веществ.
| Вещества, имеющие одинаковый состав (одинаковую молекулярную формулу), но разное пространственное строение молекул, называются ИЗОМЕРАМИ.
Бутан, состоящий из 4 атомов углерода и 10 атомов водорода, имеет 2 изомера, а октан, состоящий из 8 атомов углерода и 18 атомов водорода, имеет уже 18 изомеров. Изомеры отличаются друг от друга температурой кипения, плавления, температурой воспламенения, вязкостью и пр., т. е. физическими свойствами.
Отличительная особенность алканов — это то, что все четыре валентные связи углерода одинарные, следствием этого является инертность таких углеводородов в обычных условиях.
Углеводороды только с одинарными связями между атомами углерода называются насыщенными, или предельными.
Общая химическая формула алканов имеет вид
СnН2n+2 , где n — Целое число.
Алканы не взаимодействуют между собой и не растворяются в воде. При высокой температуре и под действием ультрафиолетового излучения они вступают в реакцию с хлором и бромом с образованием галогенных углеводородов.
Хлоропроизводные метана широко используются в промышленности. Хлорметан — газ, который легко сжижается и при последующем испарении поглощает значительное количество теплоты. Этот газ получил широкое применение в холодильных установках.
Алкены. Следующей важной группой углеводородов, которые не встречаются в природе в свободном состоянии, но могут быть получены из нефти в процессе крекинга, являются алкены. Все названия непредельных углеводородов ряда этилена оканчиваются суффиксом ен.
|Алкенами называют непредельные углеводороды, которые содержат одну двойную связь меяду атомами углерода, т. е. количество атомов водорода в составе непредельных углеводородов всегда меньше, чем в предельных.
Общая формула алкенов СnН2n, где n — целое число. Простейший из алкенов — этилен (этен):
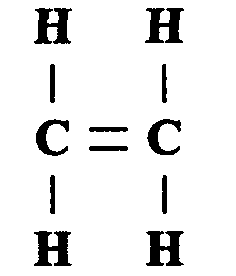
Двойная связь между атомами углерода непрочная, поэтому алкены химически более активны, чем алканы. Как и алканы, алкены образуют целый ряд изомеров, причем такие изомеры отличаются как структурой молекулы, так и расположением двойной связи между атомами углерода, а также пространственным расположением атомов элементов. Из-за наличия двойных связей алкены могут присоединять еще один атом водорода и поэтому могут вступать в реакцию с алканами.
| Углеводороды, содержащие одну или несколько двойных или тройных связей между б атомами углерода, называются непредельными, или ненасыщенными.
Алкадиеиы также являются ненасыщенными углеводородами и содержат в составе молекулы две двойные связи между атомами углерода. Названия диеновых углеводородов образуются от соответствующих названий предельных углеводородов с суффиксом диен. Общая формула диеновых углеводородов СnHn+2.
Так же как и все остальные углеводороды, алкадиены образуют изомеры, начиная с 5-го атома углерода. Изомеры, образующиеся при этом, различаются по скелетному расположению атомов углерода, расположению двойных связей и ориентации элементов молекулы в пространстве. Простейшим представителем диеновых углеводородов является бутадиен: С4Н6, структура которого имеет вид
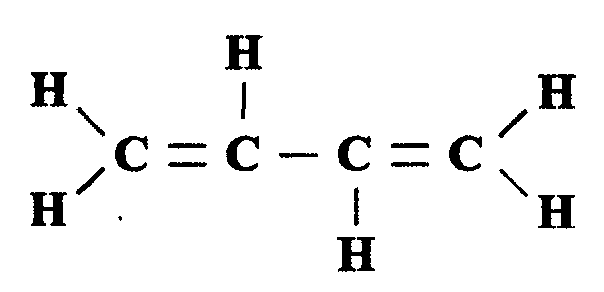
Большинство алкадиенов используются как сырье для получения синтетических пластмасс, в частности, бутадиен — для получения синтетического каучука.
Алкины, или, как их еще называют, ацетиленовые углеводороды также являются непредельными углеводородами и содержат в структурной формуле молекул одну тройную связь между атомами углерода.
Все названия непредельных углеводородов ряда ацетилена оканчиваются суффиксом ин. Общая формула для алкинов СnН2n-2, т. е. точно такая же, как и для алкадиенов.
Простейшими представителями этой группы являются
а цетилен
(этан) СН ≡ СН и
цетилен
(этан) СН ≡ СН и
пропин СНз – С ≡ СН
Характерными реакциями являются реакции присоединения, окисления и полимеризации. При взаимодействии ацетилена с соляной кислотой (НСl) образуется винилхлоридмономер (VCM), который может полимеризовываться в поливинилхлорид. Данный продукт широко используется для получения пластмасс.
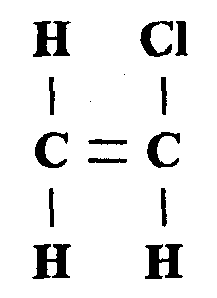 Винилхлорид
(хлорвинил, хлорэтилен) используется
при изготовлении диэлектрических
пластмасс, искусственной кожи и т. д.
Винилхлорид
(хлорвинил, хлорэтилен) используется
при изготовлении диэлектрических
пластмасс, искусственной кожи и т. д.
Циклоалканы. Некоторые молекулы предельных углеводородов могут соединяться таким образом, что каждый из атомов углерода в молекуле будет иметь по две свободные валентные связи. В таком случае молекулы углеводородов имеют цикличную (замкнутую) форму.
Названия циклопарафинов образуются от соответствующих названий предельных углеводородов с добавлением префикса цикло-. Простейшие представители циклопарафинов — циклопропан и циклобутан, однако наиболее часто встречаются циклопарафины более высокого порядка, например циклопентан или циклогексан. Общая химическая формула циклоалканов выглядит следующим образом: Сnh3n.
Структурное строение молекулы можно представить на примере циклопропана:
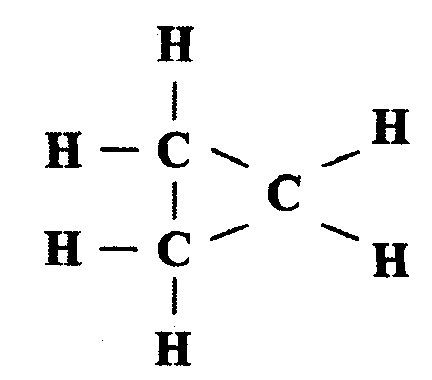
В подавляющем большинстве циклопарафины нашли применение как растворители в химической промышленности и в медицине. Чаще всего используются галогенопроизводные циклопарафинов.
Ароматические углеводороды. Если молекула углеводорода содержит более трех атомов углерода, то они могут объединяться, образуя соединения ‘ в форме бензольного кольца. Углеводороды, молекулы которых содержат бен-зольные кольца, называются цикличными, или ароматическими, углеводородами. Общая формула для этих углеводородов Сnh3n-6
.
Простейшие
представители этой группы:  бензолC
6H6
и толуол С6H5
-СНз.
бензолC
6H6
и толуол С6H5
-СНз.
Изомерия в ряду бензола обусловлена взаимным расположением органических радикалов в ядре (метильной группы СНз). При этом образуются 3 изомера, расположение заместителей в которых указывается приставками орто-, мета- и пара-.
Шесть атомов углерода образуют правильный шестиугольник. Бензольные кольца обычно очень устойчивы и являются составной частью больших молекул. Характерными реакциями для аренов являются реакции замещения.
studfile.net
Классы углеводородов
Алифатические углеводороды в зависимости от характера углерод-углеродных связей в их молекулах делятся на гомологические ряды: алканы. алкены, алкины и алкадиены ( табл. 15).
Гомологический ряд — это ряд родственных органических соединений с однотипными химическим строением н свойствами, молекулы которых отличаются между собой на одну или несколько метиленовых групп (-СН2-) в составе углеводородных радикалов.
Класс ациклических углеводородов делится на гомологические ряды циклоалканов, циклоалкенов, циклоалкинов и циклодиенов, являющихся циклическими аналогами соответствующих алифатических углеводородов (табл. 15).
Класс ароматических углеводородов делится на гомологические ряды бензола, нафталина, антрацена и других. Общим признаком ароматических углеводородов является их «ароматичность».
Ароматичность – это совокупность особенностей электронного строения и свойств соединения: наличие в молекуле циклического сопряжения р-электронных облаков и, вследствие этого, высокая термодинамическая и химическая устойчивость ароматического цикла, склонность не к присоединению, а к реакциям замещения в этом цикле. Ученый Хюккель установил следующее правило, позволяющее выявлять ароматичность соединения: условием ароматичности является существование в молекуле циклической системы сопряжения, в которой р-электронное облако содержит (4n+2) электронов (n-целое число). Например, в цикле бензола имеется шесть сопряженных р-электронных облаков, а в молекуле нафталина — их десять и т.д.
Таблица 2
Классы (гомологические ряды) углеводородов
Классы углеводородов | Брутто-формула | Основоположник ряда |
Алканы | СnH2n+2 | метан СН4 |
Алкены | СnH2n | этен (этилен) СН2=СН2 |
Алкины | СnH2n–2 | этин (ацетилен) СН=СН |
Арены | СnH2n–6 (дляn > 6) | бензол С6Н6
|
Классы производных углеводородов
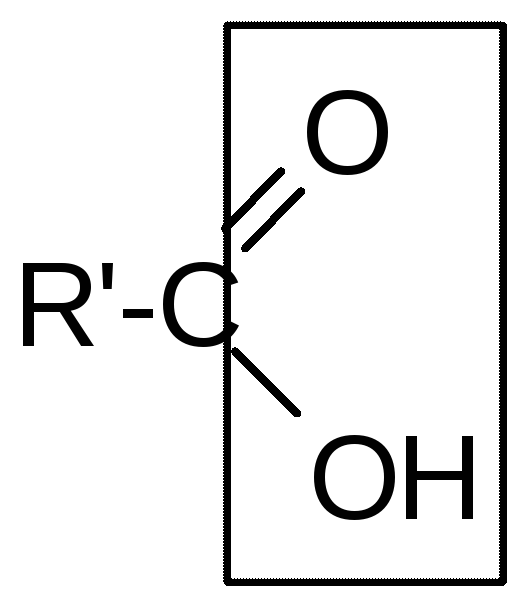
Производные углеводородов – это органические соединения, молекулы которых кроме атомов углерода и водорода содержат одну или несколько функциональных (характеристических) групп. Их можно рассматривать как продукты замещения одного или нескольких атомов водорода в молекулах углеводородов на одинаковые или разные характеристические группы.
Функциональные группы обусловливают специфические химические свойства веществ, поэтому производные углеводородов разделены на классы в зависимости от строения этих групп (табл. 3). Внутри каждого класса имеются соединения, принадлежащие, в зависимости от строения углеводородного радикала, к различным рядам.
Таблица 3
Основные функциональные группы производных углеводородов
и их названия
Класс | Функциональная группа | Обозначение | |
в приставке | в окончании | ||
1 | 2 | 3 | 4 |
Галогенпроизводные углеводородов | Галогены (Hal): -F, -Cl, -Br, -J | фторо-, хлоро-, бромо-, иодо- | – |
Амины | Аминогруппа: -NH2, -NHR, -NR2 | амино- | -амин |
Нитросоединения | Нитрогруппа: -NO2 | нитро- | – |
Простые эфиры | Эфирная группа: -OR (-С-О-С-) | алкокси- (R = алкил) арокси- (R = арил) | – |
Гидроксипроизводные углеводородов: а) спирты (R = алкил) б) фенолы (R = арил) | Гидроксигруппа: -ОН (R-OH) | гидрокси- | -ол |
Оксосоединения (карбонильные соединения): а) альдегиды (R = Н) б) кетоны (R = алкил, арил) | Оксогруппа (карбонильная) группа:
| а) оксо- б) оксо- | а) –аль б) –он |
1 | 2 | 3 | 4 |
Карбоновые кислоты | Карбоксильная группа:
| карбокси- | -овая кислота |
Сложные эфиры | Сложноэфирная группа:
| R-оат | |
Амиды |
| — амид | |
Нитрилы | Нитрильная группа: –(С)≡N | -нитрил | |
Сульфоновые кислоты | Сульфогруппа: -SO3H | сульфо- | -суль-фоновая кислота |
* Атом углерода, заключенный в скобки, включается в название главной углеводородной цепи и не входит в название соответствующей функциональной группы.
Химическое поведение вещества каждого класса определяется строением характеристической группы (реакции по этой группе) и связанного с ней углеводородного радикала (реакции по радикалу).
Эти структурные фрагменты влияют друг на друга. При наличии в молекуле нескольких близко расположенных функциональных групп они также оказывают друг на друга существенное влияние, вызывающее изменение их реакционной способности.
studfile.net
| Характеристика | Алканы | Алкены | Алкины | Алкадиены | Циклоалканы | Арены |
|---|---|---|---|---|---|---|
| Общая формула | Cnh3n+2 | Cnh3n | Cnh3n-2 | Cnh3n-2 | Cnh3n | Cnh3n-6 |
| Строение | sp³-гибридизация — 4 электронных облака направлены в вершины тетраэдра под углами 109°28′. Тип углеродной связи — σ-связи | sp²-гибридизация, валентный угол 120°.Тип углеродной связи — π-связи. lc-c — 0,134 нм. | sp-гибридизациия, молекула плоская (180°), тройная связь, lc-c — 0,120 нм. | lc-c — 0,132 нм – 0,148 нм, 2 или более π-связей. У каждого атома три гибридные sp²-орбитали. | sp³-гибридизация, валентный угол около 100° lc-c — 0,154 нм. | Строение молекулы бензола (6 р-электронов, n = 1), Валентный угол 120° lc-c — 0,140 нм, молекула плоская (6 π | σ) |
| Изомерия | Изомерия углеродного скелета, возможна оптическая изомерия | Изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная | Изомерия углеродного скелета, положения тройной связи, межклассовая | Изомерия углеродного скелета, положения двойной связи, межклассовая и цис-транс-изомерия | Изомерия углеродного скелета, положения двойной связи, межклассовая и цис-транс-изомерия | Изомерия боковых цепей, а также их взаимного положения в бензольном ядре |
| Химические свойства | реакции замещения (галогенирование, нитрирование), окисления, радикальное галогенирование Ch5 + Cl2 → Ch4Cl + HCl (хлорметан), горения, отщепления (дегидрирование) | Реакции присоединения (гидрирование, галогенирование, гидрогалогенирование, гидратация), горения | Реакции присоединения (гидрирование, галогенирование, гидрогалогенирование, гидратация), горения | Реакции присоединения | Для колец из 3-4 атомов углерода — раскрытие кольца | Реакции электрофильного замещения |
| Физические свойства | С Ch5 до C4h20 — газы; с C5h22 до C16h44 — жидкости; после C16h44 — твёрдые тела. | С C2h5 до C4H8 — газы; с C5h20 до C17h44 — жидкости, после C18h46 — твёрдые тела. | Алкины по своим физическим свойствам напоминают соответствующие алкены | Бутадиен — газ (t кип −4,5 °C), изопрен — жидкость, кипящая при 36 °C, диметилбутадиен — жидкость, кипящая при 70 °C. Изопрен и другие диеновые углеводороды способны полимеризоваться в каучук | С C3H6 до C4H8 — газы; с C5h20 до C16h42 — жидкости; после C17h44 — твёрдые тела. | Все ароматические соединения — твердые или жидкие вещества. Отличаются от алифатических и алициклических аналогов высокими показателями преломления и поглощения в близкой УФ и видимой области спектра |
| Получение | Восстановление галогенпроизводных алканов, восстановление спиртов, восстановление карбонильных соединений, гидрирование непредельных углеводородов, Реакция Вюрца. | Каталитический и высокотемпературный крекинг углеводородов нефти и природного газа, реакции дегидратации соответствующих спиртов, дегидрогалогенирование и дегалогенирование соответствующих галогенпроизводных | Основным промышленным способом получения ацетилена является электро- или термокрекинг метана. Пиролиз природного газа и карбидный метод. | Постадийное дегидрирование алканов, дегидрирование спиртов. | Гидрирование ароматических углеводородов, отщепление двух атомов галогена от дигалогеналканов | Дегидрирование циклогексана, тримеризация ацетилена, выделение из нефти |
dic.academic.ru
|
Периодическое изменение свойств химических элементов и их соединений при увеличении заряда ядра атома объясняется тем, что периодически повторяется строение внешнего электронного слоя в атомах элементов. |
||
|
||
Важнейшие классы органических соединений, содержащие функциональные группы (R-углеводородный радикал, Ar-ароматический радикал): |
||
| Функциональная группа: | Класс соединений: | |
Изомерия и гомология органических соединений |
||
|
||
Изометрия: |
||
| Структурная изомерия: это различный порядок связи структурных элементов: | ||
dpva.ru
это соединения углерода с водородом, не содержащие других элементов. Классификация углеводородов :: SYL.ru
Что такое углеводороды? Как они классифицируются? Какими особенностями обладают? Попробуем вместе найти ответы на поставленные вопросы.
Углеводороды — это органические соединения, которые в своем составе имеют водород и углерод. Их в органической химии считают базовыми соединениями.
Классификация
В зависимости от состояния связи между углеродами основной цепи, все СхНу принято подразделять на несколько видов. Одинарные соединения углерода с водородом характерны для предельных углеводородов.
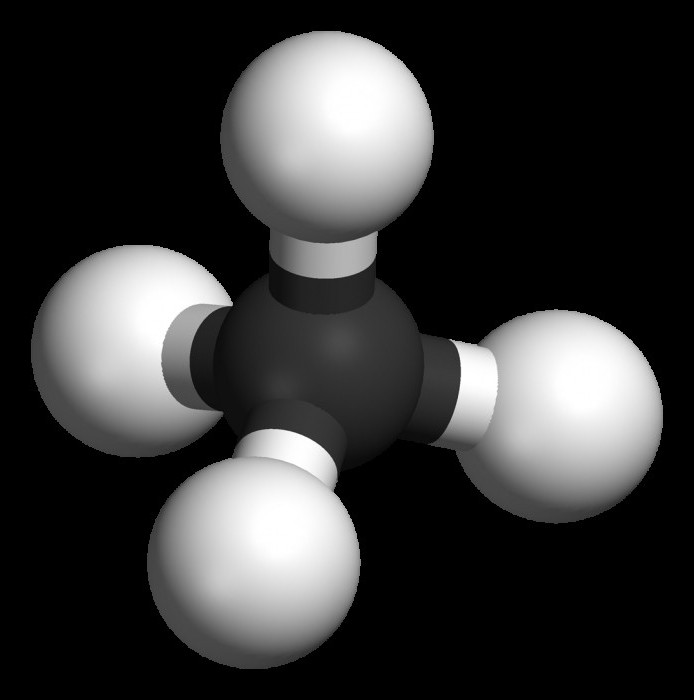
Алканы
Предельные углеводороды — это соединения, имеющие общую формулу СпН2п+2. Среди их особенностей можно упомянуть отсутствие замкнутой структуры, а также одинарные (простые) связи. Их в органической химии называют ациклическими соединениями.
Типичным представителем данного класса является метан – СН4. Именно он начинает гомологический ряд алканов, обладает всеми свойствами, присущими остальным представителям парафинов.
Первые представители данного класса углеводородов являются газообразными веществами, обладающими малой растворимостью в воде, специфическим запахом.
Среди основных химических свойств, которыми обладают представители гомологического ряда алканов, выделим радикальное замещение.
Галогенирование протекает при повышенной температуре либо наличии ультрафиолетового облучения. Реакция протекает в несколько стадий, характеризуется постепенным замещением атомов водорода галогеном. Свойства углеводородов ряда метана объясняются насыщенностью связи между углеродными атомами. Они не способны вступать в реакции присоединения, при этом отлично горят в кислороде воздуха с образованием углекислого газа, водяного пара, выделением достаточного количества тепловой энергии.
Среди основных отраслей применения представителей данного класса углеводородов выделим использование в качестве топлива, а также вариант исходного сырья для производства множества иных органических соединений.
Алкены
Ненасыщенные углеводороды — это соединения, которые имеют одну либо несколько кратных (ненасыщенных) связей между углеродными атомами. Алкены имеют общую формулу СпН2п. Типичным представителем данного класса является этилен.
Эти природные углеводороды входят в состав нефти. Учитывая, что в молекуле содержится двойная связь, для алкенов характерны реакции присоединения. Например, они могут вступать в галогенирование, гидратацию.
Если двойная связь располагается в первом положении, например в бутене-1, присоединение галогеноводорода и гидратация (реакция с водой) протекают по правилу Марковникова. Суть его состоит в том, что при гидрогалогенировании и гидратации водород присоединяется к тому атому углерода, который им максимально насыщен.
Гидроксильная группа или атом галогена присоединяется к атому С, который не насыщен водородом. Качественной реакцией на непредельную (двойную) связь является обесцвечивание бромной воды или перманганата калия.

Циклоалканы
Такие углеводороды — это циклические соединения, являющиеся межклассовыми изомерами для алкенов. Они имеют общую формулу СпН2п, одинарные связи. Учитывая, что данный класс характеризуется замкнутой структурой, они вступают в реакции присоединения, сопровождающиеся разрушением замкнутого цикла, превращением в насыщенные алканы. Основными источниками таких соединений выступают природный и попутный газ, нефть. Несмотря на циклическое строение, в молекулах sp3-гибридизация, валентный угол составляет 109°28′.
Алкадиены
Чем еще характеризуется органическая химия? Углеводороды этого класса имеют общую формулу СпН2п-2. У всех представителей диеновых углеводородов присутствуют две двойные связи. Ненасыщенность диенов определяет их основные химические свойства. По аналогии с алкенами, диеновые соединения вступают в реакции присоединения.
В качестве тех химических реакций, которые характерны для данных соединений, отметим полимеризацию. Исходным мономером в процессе выступает представитель диенов, а продуктом взаимодействия будет синтетический каучук. При добавлении в получаемый полимер серы, происходит вулканизация, сопровождающаяся образованием резины.
Алкины
Для этих ненасыщенных органических соединений, характеризующихся общей формулой СпН2п-2, можно отметить наличие тройной связи между углеродными атомами. Если она располагается после первого углеродного атома, качественной реакцией на ее присутствие выступает замещение с комплексным соединением серебра.
Так же как и для алкенов, диенов, алкины легко вступают в присоединение по тройной связи. Для них свойственны реакции гидрирования, гидрогалогенирования, галогенирования, гидратации.

Ароматические соединения
Бензол является первым представителем данного класса. Он имеет общую формулу СпН2п-6. В отличие от всех остальных углеводородов, данное соединение имеет ароматическое кольцо. В его образовании принимают участие свободные электроны каждого углеродного атома. Три электрона С образуют гибридные облака, а четвертый электрон не повергается гибридизации. Именно он формирует ароматическое кольцо, которое равномерно распределяется по всей молекуле. Равномерное распределение кольца по структуре объясняет его химическую стабильность. Сам бензол вступает в замещение и присоединение только при жестких условиях.
Толуол, являющийся его гомологом, характеризуется некоторым смещением электронной плотности, поэтому у него выше способность к замещению. Углеводородный радикал является ориентантом 1 рода, входящие заместители (галоген, нитрогруппа) занимают орто-, параположения.
Заключение
Независимо от того, какие особенности структуры имеют различные представители углеводородов, они в своем составе имеют определенное количество атомов углеродов и водородов. Существует определенная тенденция в изменении физических свойств представителей СхНу. Первые представители любого класса имеют газообразное состояние, по мере увеличения относительной молекулярной массы наблюдается планомерный переход в жидкости, затем в твердый вид.
www.syl.ru