Радиоактивные ряды — Википедия
Материал из Википедии — свободной энциклопедии
Радиоактивные ряды (семейства) — цепочки радиоактивных превращений.
Выделяют три естественных радиоактивных ряда и один искусственный.
Естественные ряды:
- ряд тория (4n) — начинается с нуклида Th-232;
- ряд радия (4n+2) — начинается с U-238;
- ряд актиния (4n+3) — начинается с U-235.
Искусственный ряд:
- ряд нептуния (4n+1) — начинается с Np-237.
После альфа- и бета-радиоактивных превращений ряды заканчиваются образованием стабильных изотопов.
Активности тех членов ряда, путь к которым от родительского изотопа не проходит через ветвления, при наступлении векового равновесия равны. Так, активность радия-224 в ториевых образцах через несколько десятков лет после изготовления становится практически равной активности тория-232, тогда как активность таллия-208 (образующегося в этом же ряду при α-распаде висмута-212 с коэффициентом ветвления 0,3594) стремится к 35,94 % от активности тория-232. Характерное время прихода к вековому равновесию в ряде равно нескольким периодам полураспада наиболее долгоживущего (среди дочерних) члена семейства. Вековое равновесие в ряду тория наступает достаточно быстро, за десятки лет, так как периоды полураспадов всех членов ряда (кроме родительского нуклида) не превышают нескольких лет (максимальный период полураспада
Тремя наиболее распространёнными видами радиоактивного распада являются α-распад, β±-распад и изомерный переход. В результате альфа-распада массовое число ядер всегда уменьшается на четыре, тогда как в результате бета-распадов и изомерных переходов массовое число ядра не меняется. Это приводит к тому, что все нуклиды делятся на четыре группы (ряда) в зависимости от остатка целочисленного деления массового числа нуклида на четыре (то есть родительский нуклид и его дочерний нуклид, образовавшийся в результате альфа-распада, будут принадлежать к одной группе). Во всех рядах происходит образование гелия (из альфа-частиц).
Три основных радиоактивных ряда, наблюдающихся в природе, обычно называются рядом тория, рядом радия и рядом актиния. Каждый из этих рядов заканчивается образованием различных стабильных изотопов свинца. Массовый номер каждого из нуклидов в этих рядах может быть представлен в виде A=4n, A=4n+2 и A=4n+3, соответственно.
Радиоактивный ряд нуклидов с массовым числом, представимым в виде 4n, называется рядом тория. Ряд начинается с встречающегося в природе тория-232 и завершается образованием стабильного свинца-208.
| Нуклид | Историческое обозначение | Историческое название | Вид распада | Период полураспада | Выделяемая энергия, МэВ | Продукт распада |
|---|---|---|---|---|---|---|
| 252Cf | α | 2,645 года | 6,1181 | 248Cm | ||
| 248Cm | α | 3,4⋅105 лет | 6,260 | 244Pu | ||
| 244Pu | α | 8⋅107 лет | 4,589 | 240U | ||
| 240U | β− | 14,1 ч | 0,39 | 240Np | ||
| 240Np | β− | 1,032 ч | 2,2 | 240Pu | ||
| 240Pu | α | 6561 год | 5,1683 | 236U | ||
| 236U | α | 2,3⋅107 лет | 4,494 | 232Th | ||
| 232Th | Th | Торий | α | 1,405⋅1010 лет | 4,081 | 228Ra |
| 228Ra | MsTh1 | Мезоторий 1 | β− | 5,75 лет | 0,046 | 228Ac |
| 228Ac | MsTh2 | Мезоторий 2 | β− | 6,15 ч | 2,124 | 228Th |
| 228Th | RdTh | Радиоторий | α | 1,9116 года | 5,520 | 224Ra |
| 224Ra | ThX | Торий X | α | 3,66 дня | 5,789 | 220Rn |
| 220 | Tn (ThEm) | Торон (эманация тория) | α | 55,6 с | 6,404 | 216Po |
| 216Po | ThA | Торий A | α | 0,145 с | 6,906 | 212Pb |
| 212Pb | ThB | Торий B | β− | 10,64 ч | 0,570 | 212Bi |
| 212Bi | ThC | Торий C | β− 64,06 % α 35,94 % | 60,55 мин | 2,252 6,208 | 212Po 208Tl |
| 212Po | ThC’ | Торий C’ | α | 299 нс | 8,955 | 208Pb |
| 208Tl | ThC» | Торий C» | β− | 3,053 мин | 4,999 | 208Pb |
| 208Pb | ThD | Торий D, ториевый свинец | стабильный |
Радиоактивный ряд нуклидов с массовым числом, представимым в виде 4n+1, называется рядом нептуния. Ряд начинается с нептуния-237 и завершается образованием стабильного таллия-205. В этой серии только два нуклида встречаются в природе — висмут-209 и таллий-205. Однако с развитием ядерных технологий в результате ядерных испытаний и радиационных аварий в окружающую среду попали радионуклиды, такие как плутоний-241 и америций-241, которые также могут быть отнесены по массовому числу к началу ряда нептуния. Так как этот ряд был изучен недавно, его изотопы не имеют исторических названий. Слабая альфа-активность висмута-209 была обнаружена лишь в 2003 году, поэтому в более ранних работах он называется конечным (и единственным сохранившимся в природе) нуклидом ряда.
| Нуклид | Вид распада | Период полураспада | Выделяемая энергия, МэВ | Продукт распада |
|---|---|---|---|---|
| 249Cf | α | 351 год | 5,813 + 0,388 | 245Cm |
| 245Cm | α | 8500 лет | 5,362 + 0,175 | 241Pu |
| 241Pu | β− | 14,4 года | 0,021 | 241Am |
| 241Am | α | 432,7 года | 5,638 | 237Np |
| 237Np | α | 2,14⋅106 лет | 4,959 | 233Pa |
| 233Pa | β− | 27,0 д | 0,571 | 233U |
| 233U | α | 1,592⋅105 лет | 4,909 | 229Th |
| 229Th | α | 7340 лет | 5,168 | 225Ra |
| 225Ra | β − | 14,9 д | 0,36 | 225Ac |
| 225Ac | α | 10,0 д | 5,935 | 221Fr |
| 221Fr | α | 4,8 мин | 6,3 | 217At |
| 217At | α | 32 мс | 7,0 | 213Bi |
| 213Bi | β− 97,80 % α 2,20 % | 46,5 мин | 1,423 5,87 | 213Po 209Tl |
| 213Po | α | 3,72 мкс | 8,536 | 209Pb |
| 209Tl | β− | 2,2 мин | 3,99 | 209Pb |
| 209Pb | β− | 3,25 ч | 0,644 | 209Bi |
| 209Bi | α | 1,9⋅1019 лет | 3,14 | 205Tl |
| 205Tl | стабильный |
Радиоактивный ряд нуклидов с массовым числом, представимым в виде 4n+2, называется рядом радия (иногда называют рядом урана или урана-радия). Ряд начинается с урана-238 (встречается в природе) и завершается образованием стабильного свинца-206.
| Нуклид | Историческое обозначение | Историческое название | Вид распада | Период полураспада | Выделяемая энергия, МэВ | Продукт распада |
|---|---|---|---|---|---|---|
| 238U | UI | Уран I | α | 4,468⋅109лет | 4,270 | 234Th |
| 234Th | UX1 | Уран X1 | β− | 24,10 сут | 0,273 | 234Pam |
| 234Pam | UX 2 | Уран X2, бревий | β− 99,84 % изомерный переход 0,16 % | 1,16 мин | 2,271 0,074 | 234U 234Pa |
| 234Pa | UZ | Уран Z | β− | 6,70 ч | 2,197 | 234U |
| 234U | UII | Уран II | α | 245500 лет | 4,859 | 230Th |
| 230Th | Io | Ионий | α | 75380 лет | 4,770 | 226Ra |
| 226Ra | Ra | Радий | α | 1602 года | 4,871 | 222Rn |
| 222Rn | Rn (RaEm) | Радон (эманация радия) | α | 3,8235 д | 5,590 | 218Po |
| 218Po | RaA | Радий A | α 99,98 % β− 0,02 % | 3,10 мин | 6,115 0,265 | 214Pb 218At |
| 218At | RaAt | Астат | α 99,90 % β− 0,10 % | 1,5 с | 6,874 2,883 | 214Bi 218Rn |
| 218Rn | AtEm | эманация астата | α | 35 мс | 7,263 | 214Po |
| 214Pb | RaB | Радий B | β− | 26,8 мин | 1,024 | 214Bi |
| 214Bi | RaC | Радий C | β− 99,98 % α 0,02 % | 19,9 мин | 3,272 5,617 | 214Po 210Tl |
| 214Po | RaC’ | Радий C’ | α | 0,1643 мс | 7,883 | 210Pb |
| 210Tl | RaC» | Радий C» | β− | 1,30 мин | 5,484 | 210Pb |
| 210Pb | RaD | Радий D | β− | 22,3 года | 0,064 | 210Bi |
| 210Bi | RaE | Радий E | β− 99,99987 % α 0,00013 % | 5,013 сут | 1,426 5,982 | 210Po 206Tl |
| 210Po | RaF | Радий F, полоний | α | 138,376 сут | 5,407 | 206Pb |
| 206Tl | RaE» | Радий E» | β− | 4,199 мин | 1,533 | 206Pb |
| 206Pb | RaG | Радий G, урановый свинец | — | стабильный | — | — |
Радиоактивный ряд нуклидов с массовым числом, представимым в виде 4n+3, называется рядом актиния или урана-актиния. Ряд начинается с урана-235 и завершается образованием стабильного свинца-207.
| Нуклид | Историческое обозначение | Историческое название | Вид распада | Период полураспада | Выделяемая энергия, МэВ | Продукт распада |
|---|---|---|---|---|---|---|
| 239Pu | α | 2,41⋅104 лет | 5,244 | 235U | ||
| 235U | AcU | Актиноуран | α | 7,04⋅108 лет | 4,678 | 231Th |
| 231Th | UY | Уран Y | β− | 25,52 ч | 0,391 | 231Pa |
| 231Pa | Pa | Протактиний | α | 32760 лет | 5,150 | 227Ac |
| 227Ac | Ac | Актиний | β− 98,62 % α 1,38 % | 21,772 года | 0,045 5,042 | 227Th 223Fr |
| 227Th | RdAc | Радиоактиний | α | 18,68 сут | 6,147 | 223Ra |
| 223Fr | AcK | Актиний K | β− 99,994 % α 0,006 % | 22,00 мин | 1,149 5,340 | 223Ra 219At |
| 223Ra | AcX | Актиний X | α | 11,43 сут | 5,979 | 219Rn |
| 219At | AcAtI | Актиноастат I | α 97,00 % β− 3,00 % | 56 с | 6,275 1,700 | 215Bi 219Rn |
| 219Rn | An (AcEm) | Актинон (эманация актиния) | α | 3,96 с | 6,946 | 215Po |
| 215Bi | β− | 7,6 мин | 2,250 | 215Po | ||
| 215Po | AcA | Актиний A | α 99,99977 % β− 0,00023 % | 1,781 мс | 7,527 0,715 | 211Pb 215At |
| 215At | AcAtII | Актиноастат II | α | 0,1 мс | 8,178 | 211Bi |
| 211Pb | AcB | Актиний B | β− | 36,1 мин | 1,367 | 211Bi |
| 211Bi | AcC | Актиний C | α 99,724 % β− 0,276 % | 2,14 мин | 6,751 0,575 | 207Tl 211Po |
| 211Po | AcC’ | Актиний C’ | α | 516 мс | 7,595 | 207Pb |
| 207Tl | AcC» | Актиний C» | β− | 4,77 мин | 1,418 | 207Pb |
| 207Pb | AcD | Актиний D, актиниевый свинец | стабильный |
Период полураспада радиоактивных элементов и их излучение (Таблица)
Период полураспада – это промежуток времени (Т½), за который распадается 1/2 начального количества радиоактивных ядер. Для каждого радиоизотопа эта величина является строго индивидуальной. У одних и тех же элементов могут быть изотопы с разными периодами полураспада. Есть изотопы у которых период полураспада менее секунды до миллиардов лет.
Радиоактивный элемент (Символ) | Порядковый номер | Массовое число изотопа | Период полураспада (Т½) | Излучение |
Актиний (Ас) | 89 | 227 | 22 года | α, β |
Америций (Аm) | 95 | 243 | 7,8·103 лет | α |
Астат (At) | 85 | 210 | 8,3 часа | Эл. захв. |
Азот (N) | 7 | 13 | 10 минут | α |
Бериллий (Bi) | 4 | 8 | 8,2·10-17 секунды | α |
Берклий (Вк) | 97 | 247 | 104 лет | α |
Висмут (Bi) | 83 | 208 | 368 тыс. лет | α, β |
209 | 1,9·1019 лет | α, β | ||
210 | 5,012 суток | α, β | ||
Водород (H) — тритий | 1 | 3 | 12,3 года | β |
Железо (Fe) | 26 | 59 | 44,495 суток | β |
Иридий (Ir) | 77 | 192 | 74 дня | |
Йод (I) | 53 | 131 | 8,02070 дня | β |
Калий (K) | 19 | 40 | 1,248·109 лет | β |
Калифорний (Cf) | 98 | 249 | 360 лет | α |
Кадмий (Cd) | 48 | 113 | 7,7·1015 лет | β |
Кобальт (Co) | 27 | 60 | 5,2713 года | β |
Кюрий (Cm) | 96 | 247 | 4·107 лет | α |
Эйнштейний (Es) | 99 | 254 | 480 дней | α |
Фермий (Fm) | 100 | 253 | 3 дня | Эл. захв., α |
Фосфор (P) | 15 | 32 | 14,26 суток | |
Франций (Fr) | 87 | 223 | 22 минуты | α, β |
Фтор (F) | 9 | 18 | 109,771 минут | β |
21 | 4,158 секунды | β, γ | ||
Лоуренсий (Lr) | 103 | 257 | 8 секунд | α |
Менделевий (Md) | 101 | 256 | 1,5 часа | Эл. захв. |
Натрий (Na) | 11 | 22 | 2,6 года | |
24 | 14,959 часов | |||
Нептуний (Np) | 93 | 237 | 2,1·108 лет | α |
Нобелий (No) | 102 | 256 | 8 секунд | α |
Протактиний (Pa) | 91 | 231 | 3,2·104 лет | α |
Прометий (Pm) | 61 | 147 | 2,5 года | β |
Полоний (Po) | 84 | 210 | 138,4 дня | α |
214 | 0,16 секунды | α | ||
Плутоний (Pu) | 94 | 238 | 87,74 лет | α |
239 | 24100 лет | α | ||
241 | 14,4 лет | β | ||
242 | 3,3·105 лет | α | ||
Радий (Ra) | 88 | 226 | 1622 года | α |
Радон (Rn) | 86 | 222 | 3,83 дня | α |
Рубидий (Rb) | 37 | 82 | 76 секунд | Эл. захв., позитр. расп. |
87 | 49,7·109 лет | β | ||
Сера (S) | 16 | 35 | 87,51 дней | |
Технеций (Tc) | 43 | 99 | 2,1·105 лет | β |
Торий (Th) | 90 | 232 | 1,4·1010 лет | α |
Уран (U) | 92 | 233 | 1,59⋅105 лет | α |
234 | 2,45⋅105 лет | α | ||
235 | 7,13⋅108 лет | α | ||
238 | 4,5·109 лет | α | ||
240 | 14 часов | β | ||
Углерод (C) | 6 | 14 | 5700 лет | β |
Цезий (Cs) | 55 | 137 | 30 лет | β |
примеры, применение, опасность :: BusinessMan.ru
Радиация, радиоактивность и радиоизлучение — понятия, которые даже звучат достаточно опасно. В этой статье вы узнаете, почему некоторые вещества радиоактивные, и что это значит. Почему все так боятся радиации и насколько она опасна? Где мы можем встретить радиоактивные вещества и чем нам это грозит?
Понятие радиоактивности
Радиоактивностью называю «умение» атомов некоторых изотопов расщепляться и создавать этим излучения. Термин «радиоактивность» появился не сразу. Изначально такое излучение называли лучами Беккереля, в честь ученого, открывшего его в работе с изотопом урана. Уже теперь мы называем этот процесс термином «радиоактивное излучение».

В этом достаточно сложном процессе изначальный атом превращается в атом совсем другого химического элемента. За счет выбрасывания альфа- или бета-частиц, массовое число атома изменяется и, соответственно, это перемещает его по таблице Д. И. Менделеева. Стоит заметить, что массовое число изменяется, но сама масса остается практически такой же.
Опираясь на данную информацию, можем немного перефразировать определение понятия. Итак, радиоактивность — это также способность неустойчивых ядер атомов самостоятельно превращаться в другие, более стабильные и устойчивые ядра.
Вещества — что это такое?
Перед тем как говорить о том, что такое вещества радиоактивные, давайте вообще определим, что называется веществом. Итак, в первую очередь, это разновидность материи. Логичным есть и тот факт, что эта материя состоит из частиц, и в нашем случае это чаще всего электроны, протоны и нейтроны. Здесь уже можно говорить об атомах, которые состоят из протонов и нейтронов. Ну а из атомов получаются молекулы, ионы, кристаллы и так далее.
Понятие химического вещества основывается на этих же принципах. Если в материи невозможно выделить ядро, то ее нельзя причислить к химическим веществам.
О радиоактивных веществах
Как уже говорилось выше, чтобы проявлять радиоактивность, атом должен самопроизвольно распадаться и превращаться в атом совсем другого химического элемента. Если все атомы вещества нестабильны до такой степени, чтобы распасться таким образом, значит перед вами радиоактивное вещество. Более техническим языком определение прозвучало бы так: вещества радиоактивные, если они содержат радионуклиды, причем в высокой концентрации.
Где в таблице Д. И. Менделеева находятся радиоактивные вещества?
Довольно простой и легкий способ узнать, относиться ли вещество к радиоактивным, это посмотреть в таблицу Д. И. Менделеева. Все, что находится после элемента свинец — это радиоактивные элементы, а также еще прометий и технеций. Важно помнить, какие вещества радиоактивные, ведь это может спасти вам жизнь.

Существует также ряд элементов, которые имеют хотя бы один радиоактивный изотоп в своих природных смесях. Вот их неполный список, где указаны одни из самых распространенных элементов:
- Калий.
- Кальций.
- Ванадий.
- Германий.
- Селен.
- Рубидий.
- Цирконий.
- Молибден.
- Кадмий.
- Индий.
К радиоактивным веществам относятся те, которые содержат любые радиоактивные изотопы.
Виды радиоактивного излучения
Радиоактивное излучение бывает нескольких типов, о которых сейчас и пойдет речь. Уже упоминалось альфа- и бета-излучение, но это не весь список.
Альфа-излучение — это самое слабое излучение, которое представляет опасность в том случае, если частицы попадают непосредственно в тело человека. Такое излучение реализуется тяжелыми частицами, и именно поэтому легко останавливается даже листом бумаги. По этой же причини альфа-лучи не пролетают больше 5 см.

Бета-излучение более сильное, чем предыдущее. Это излучение электронами, которые намного легче альфа-частиц, поэтому могут проникать на несколько сантиметров в кожу человека.
Гамма-излучение реализуется фотонами, которые достаточно легко проникают еще дальше к внутренним органам человека.
Самое мощное по проникновению излучение — это нейтронное. От него спрятаться достаточно сложно, но в природе его, по сути, и не существует, разве что в непосредственной близости к ядерным реакторам.
Воздействие радиации на человека
Радиоактивно опасные вещества часто могут быть смертельными для человека. К тому же радиационное облучение имеет необратимый эффект. Если вы подверглись облучению, значит, вы обречены. В зависимости от масштабов повреждения, человек погибает в течение нескольких часов или на протяжении многих месяцев.

Вместе с этим нужно сказать, что люди непрерывно подвергаются радиоактивному излучению. Слава Богу, оно достаточно слабое, чтобы иметь летальный исход. Например, посмотрев футбольный матч по телевиденью, вы получаете 1 микрорад радиации. До 0,2 рад в год — это вообще естественный радиационный фон нашей планеты. 3 дар — ваша порция радиации при рентгене зубов. Ну а облучение свыше 100 рад уже является потенциально опасным.
Вредные радиоактивные вещества, примеры и предостережения
Самое опасное радиоактивное вещество — это Полоний-210. Из-за излучения вокруг него даже видно своеобразную светящуюся «ауру» голубого цвета. Стоит сказать о том, что существует стереотип, будто все радиоактивные вещества светятся. Это совсем не так, хотя и встречаются такие варианты, как Полоний-210. Большинство радиоактивных веществ внешне совсем не подозрительные.
Самым радиоактивным металлом на данный момент считают ливерморий. Его изотопу Ливерморию-293 достаточно 61 миллисекунды, чтобы распасться. Это выяснили еще в 2000 году. Немного уступает ему унунпентий. Время распада Унунпентия-289 составляет 87 миллисекунды.

Также интересный факт состоит в том, что одно и то же вещество может быть как безвредным (если его изотоп стабильный), так и радиоактивным (если ядра его изотопа вот-вот разрушатся).
Ученные, которые изучали радиоактивность
Вещества радиоактивные долгое время не считались опасными, и потому из свободно изучали. К сожалению, печальные смерти научили нас тому, что с такими веществами нужна осторожность и повышенный уровень безопасности.
Одним их первых, как уже упоминалось, был Антуан Беккерель. Это великий французский физик, которому и принадлежит слава первооткрывателя радиоактивности. За свои заслуги он удостоился членства в Лондонском королевском обществе. Из-за своего вклада и эту сферу он скончался достаточно молодым, в возрасте 55 лет. Но его труд помнят по сей день. В его честь были названа сама единица радиоактивности, а также кратеры на Луне и Марсе.

Не менее великим человеком была Мария Склодовская-Кюри, которая работала с радиоактивными веществами вместе со своим мужем Пьером Кюри. Мария также была француженкой, хоть и с польскими корнями. Кроме физики она занималась преподаванием и даже активной общественной деятельностью. Мария Кюри — первая женщина лауреат Нобелевской премии сразу в двух дисциплинах: физика и химия. Открытие таких радиоактивных элементов, как Радий и Полоний, — это заслуга Марии и Пьера Кюри.
Заключение
Как мы видим, радиоактивность — достаточно сложный процесс, который не всегда остается подконтрольным человеку. Это один из тех случаев, когда люди могут оказаться абсолютно бессильными перед лицом опасности. Именно поэтому важно помнить, что действительно опасные вещи могут быть внешне очень обманчивыми.
Узнать вещество радиоактивное или нет, чаще всего можно уже попав под его воздействие. Поэтому будьте осторожны и внимательны. Радиоактивные реакции во многом нам помогают, но также не стоит забывать, что это практически не подконтрольная нам сила.
К тому же стоит помнить вклад великих ученных в изучение радиоактивности. Они передали нам невероятно много полезных знаний, которые теперь спасают жизни, обеспечивают целые страны энергией и помогаю лечить страшные заболевания. Радиоактивные химические вещества — это опасность и благословение для человечества.
Закон радиоактивного распада — Википедия
Зако́н радиоакти́вного распа́да — физический закон, описывающий зависимость интенсивности радиоактивного распада от времени и от количества радиоактивных атомов в образце. Открыт Фредериком Содди и Эрнестом Резерфордом, каждый из которых впоследствии был награждён Нобелевской премией. Они обнаружили его экспериментальным путём и опубликовали в 1903 году в работах «Сравнительное изучение радиоактивности радия и тория»[1] и «Радиоактивное превращение»[2], сформулировав следующим образом[3]:
Во всех случаях, когда отделяли один из радиоактивных продуктов и исследовали его активность независимо от радиоактивности вещества, из которого он образовался, было обнаружено, что активность при всех исследованиях уменьшается со временем по закону геометрической прогрессии.
из чего с помощью теоремы Бернулли учёные сделали вывод[4]:
Скорость превращения всё время пропорциональна количеству систем, ещё не подвергнувшихся превращению.
Существует несколько формулировок закона, например, в виде дифференциального уравнения:
- dNdt=−λN,{\displaystyle {\frac {dN}{dt}}=-\lambda N,}
которое означает, что число распадов −dN, произошедшее за короткий интервал времени dt, пропорционально числу атомов N в образце.
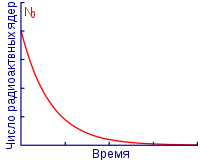 Экспоненциальная кривая радиоактивного распада: по оси абсцисс («оси x») — время, по оси ординат («оси y») — количество ещё нераспавшихся ядер или скорость распада в единицу времени
Экспоненциальная кривая радиоактивного распада: по оси абсцисс («оси x») — время, по оси ординат («оси y») — количество ещё нераспавшихся ядер или скорость распада в единицу времениВ указанном выше математическом выражении неотрицательная константа λ{\displaystyle \lambda } — постоянная распада, которая характеризует вероятность радиоактивного распада за единицу времени и имеющая размерность с−1. Знак минус указывает на убыль числа радиоактивных ядер со временем.
Решение этого дифференциального уравнения имеет вид:
- N(t)=N0e−λt,{\displaystyle N(t)=N_{0}e^{-\lambda t},}
где N0{\displaystyle N_{0}} — начальное число атомов, то есть число атомов для t=0.{\displaystyle t=0.}
Таким образом, число радиоактивных атомов уменьшается со временем по экспоненциальному закону. Скорость распада, то есть число распадов в единицу времени
- I(t)=−dNdt,{\displaystyle \mathrm {I} (t)=-{\frac {dN}{dt}},}
также падает экспоненциально. Дифференцируя выражение для зависимости числа атомов от времени, получаем:
- I(t)=−ddt(N0e−λt)=λN0e−λt=I0e−λt,{\displaystyle \mathrm {I} (t)=-{\frac {d}{dt}}(N_{0}e^{-\lambda t})=\lambda N_{0}e^{-\lambda t}=\mathrm {I} _{0}e^{-\lambda t},}
где I0{\displaystyle \mathrm {I} _{0}} — скорость распада в начальный момент времени t=0.{\displaystyle t=0.}
Таким образом, зависимость от времени числа нераспавшихся радиоактивных атомов и скорости распада описывается одной и той же постоянной λ{\displaystyle \lambda }[4][5][6][7].
 Наглядная демонстрация закона.
Наглядная демонстрация закона.Кроме константы распада λ,{\displaystyle \lambda ,} радиоактивный распад характеризуют ещё двумя производными от неё константами, рассмотренными ниже.
Среднее время жизни[править | править код]
Из закона радиоактивного распада можно получить выражение для среднего времени жизни радиоактивного атома. Число атомов, в момент времени t{\displaystyle t} претерпевших распад в пределах интервала dt{\displaystyle dt} равно −dN,{\displaystyle -dN,} их время жизни равно −tdN.{\displaystyle -tdN.} Среднее время жизни получаем интегрированием по всему периоду распада:
- τ=−1N0∫N00tdN=λ∫0∞te−λtdt=1λ.{\displaystyle \tau =-{\frac {1}{N_{0}}}\int _{N_{0}}^{0}tdN=\lambda \int _{0}^{\infty }te^{-\lambda t}dt={\frac {1}{\lambda }}.}
Подставляя эту величину в экспоненциальные временные зависимости для N(t){\displaystyle N(t)} и I(t),{\displaystyle \mathrm {I} (t),} легко видеть, что за время τ{\displaystyle \tau } число радиоактивных атомов и активность образца (количество распадов в секунду) уменьшаются в e раз[4].
Период полураспада[править | править код]
На практике получила большее распространение другая временная характеристика — период полураспада T1/2,{\displaystyle T_{1/2},} равная времени, в течение которого число радиоактивных атомов или активность образца уменьшаются в 2 раза[4].
Связь этой величины с постоянной распада можно вывести из соотношения N(T1/2)N0=e−λT1/2=1/2,{\displaystyle {\frac {N(T_{1/2})}{N_{0}}}=e^{-\lambda T_{1/2}}=1/2,} откуда:
- T1/2=ln2λ=τln2≈0,693τ.{\displaystyle T_{1/2}={\frac {\ln 2}{\lambda }}=\tau \ln 2\approx 0,693\tau .}
Существующие в природе радиоактивные изотопы в основном возникают в сложных цепочках распадов урана и тория и имеют периоды полураспада в очень широкой области значений: от 3⋅10−7 секунды для 212Po до 1,4⋅1010 лет для 232Th. Наибольший экспериментально измеренный период полураспада имеет изотоп теллура 128Te — 2,2⋅1024 лет. Само существование в настоящее время многих естественных радиоактивных элементов несмотря на то, что с момента образования этих элементов при звёздном нуклеосинтезе прошло более 4,5 млрд лет, является следствием очень больших периодов полураспада 235U, 238U, 232Th и других природных радионуклидов. К примеру, изотоп 238U стоит в начале длинной цепочки (так называемый ряд радия), состоящей из 20 изотопов, каждый из которых возникает при α-распаде или β-распаде предыдущего элемента. Период полураспада 238U (4,5⋅109 лет) много больше, чем период полураспада любого из последующих элементов радиоактивного ряда, поэтому распад в целом всей цепочки происходит за то же время, что и распад 238U, её родоначальника, в таких случаях говорят, что цепочка находится в состоянии секулярного (или векового) равновесия[7]. Примеры характеристик распада некоторых веществ[8]:
| Вещество | 238U | 235U | 234U | 210Bi | 210Tl |
|---|---|---|---|---|---|
| Период полураспада, T1/2{\displaystyle T_{1/2}} | 4,5⋅109 лет | 7,13⋅108 лет | 2,48⋅105 лет | 4,97 дня | 1,32 минуты |
| Постоянная распада, λ{\displaystyle \lambda } | 4,84⋅10−18 с−1 | 8,17⋅10−14 с−1 | 1,61⋅10−6с−1 | 8,75⋅10−3 с−1 | |
| Частица | α | α | α | β | β |
| Полная энергия распада, МэВ[9][10] | 4,2699 | 4,6780 | 4,8575 | 1,1612 | 5,482 |
Один из открывших закон, Фредерик Содди, в своей научно-популярной книге «The story of atomic energy», изданной в 1949 году, видимо из скромности, ничего не пишет о своём (но и чьём-либо ещё тоже) вкладе в создание этой теории, зато довольно оригинально отзывается о ней[11][12]:
Следует отметить, что закон превращений одинаков для всех радиоэлементов, являясь самым простым и в то же время практически необъяснимым. Этот закон имеет вероятностную природу. Его можно представить в виде духа разрушения, который в каждый данный момент наугад расщепляет определённое количество существующих атомов, не заботясь об отборе тех из них, которые близки к своему распаду.
- ↑ Rutherford E. and Soddy F. A comparative study of the radioactivity of radium and thorium (англ.) // Philosophical Magazine Series 6 : journal. — 1903. — Vol. 5, no. 28. — P. 445—457. — DOI:10.1080/14786440309462943.
- ↑ Rutherford E. and Soddy F. Radioactive change (неопр.) // Philosophical Magazine Series 6. — 1903. — Т. 5, № 29. — С. 576—591. — DOI:10.1080/14786440309462960.
- ↑ Кудрявцев П. С. Открытие радиоактивных преврещений. Идея атомной энергии // Курс истории физики. — 1982.
- ↑ 1 2 3 4 Климов А. Н. Ядерная физика и ядерные реакторы. — М.: Энергоатомиздат, 1985. — С. 74-75. — 352 с.
- ↑ Бартоломей Г. Г., Байбаков В. Д., Алхутов М. С., Бать Г. А. Основы теории и методы расчета ядерных энергетических реакторов. — М.: Энергоатомиздат, 1982.
- ↑ Cameron I. R. Nuclear fission reactors. — Canada, New Brunswick: Plenum Press, 1982.
- ↑ 1 2 Камерон И. Ядерные реакторы. — М.: Энергоатомиздат, 1987. — С. 320.
- ↑ Пособие по физике реактора ВВЭР-1000. — БАЭС, ЦПП, 2003.
- ↑ Wang M., Audi G., Kondev F. G., Huang W. J., Naimi S., Xu X. The Ame2016 atomic mass evaluation (I). Evaluation of input data; and adjustment procedures (англ.) // Chinese Physics C. — 2016. — Vol. 41, iss. 3. — P. 030002-1—030002-344. — DOI:10.1088/1674-1137/41/3/030002.
- ↑ Wang M., Audi G., Kondev F. G., Huang W. J., Naimi S., Xu X. The Ame2016 atomic mass evaluation (II). Tables, graphs, and references (англ.) // Chinese Physics C. — 2016. — Vol. 41, iss. 3. — P. 030003-1—030003-442. — DOI:10.1088/1674-1137/41/3/030003.
- ↑ Frederick Soddy, F.R.S. The story of atomic energy. — London: Nova Atlantis, 1949.
- ↑ Содди Ф. История атомной энергии. — М.: Атомиздат, 1979. — С. 288.
Наведённая радиоактивность — Википедия
Наведённая радиоактивность — это радиоактивность веществ, возникающая под действием облучения их ионизирующим излучением, особенно нейтронами.
При облучении частицами (нейтронами, протонами, гамма-квантами) стабильные ядра могут превращаться в радиоактивные ядра с различным периодом полураспада, которые продолжают излучать длительное время после прекращения облучения. Особенно сильна радиоактивность, наведённая нейтронным облучением. Это объясняется следующими свойствами этих частиц: для того, чтобы вызвать ядерную реакцию с образованием радиоактивных ядер, гамма-кванты и заряженные частицы должны иметь большую энергию (не меньше нескольких МэВ). Однако они взаимодействуют с электронными оболочками атомов намного интенсивнее, чем с ядрами, и быстро теряют при этом энергию. Кроме того, положительно заряженные частицы (протоны, альфа-частицы) быстро теряют энергию, упруго рассеиваясь на ядрах. Поэтому вероятность гамма-кванта или заряженной частицы вызвать ядерную реакцию ничтожно мала. Например, при бомбардировке бериллия альфа-частицами лишь одна из нескольких тысяч или десятков тысяч (в зависимости от энергии альфа-частиц) вызывает (α, n)-реакцию, а для других веществ эта вероятность ещё меньше.
Нейтроны же, наоборот, захватываются ядрами при любой энергии, более того, максимальна вероятность захвата именно нейтронов с низкой энергией. Поэтому, распространяясь в веществе, нейтрон может попадать в множество ядер последовательно, пока не будет захвачен очередным ядром, и вероятность захвата нейтрона практически равна единице.
Следует заметить, что поглощение нейтронов не обязательно ведёт к появлению наведённой радиоактивности. Многие ядра могут захватывать нейтрон с образованием стабильных ядер, например бор-10 может превратиться в стабильный бор-11 (если захват нейтрона ядром не приведёт к образованию лития и альфа-частицы), лёгкий водород (протий) — в стабильный дейтерий. В таких случаях наведённая радиоактивность не возникает.
Процесс превращения нерадиоактивных ядер в радиоактивные и образования в веществе радиоактивных изотопов под действием облучения называется активацией.
На эффекте наведённой радиоактивности основан мощный метод определения состава вещества, называемый активационным анализом. Образец облучается потоком нейтронов (нейтронно-активационный анализ) или гамма-квантов (гамма-активационный анализ). При этом в образце наводится радиоактивность, характер которой, при одинаковом характере облучения, полностью определяется изотопным составом образца. Изучая гамма-спектр излучения образца, можно с очень высокой точностью определить его состав. Предел обнаружения различных элементов зависит от интенсивности облучения и составляет до 10−4−10−7 % для гамма-активационного анализа и до 10−5−10−10 % для нейтронно-активационного анализа.[1]
Наведённая радиоактивность при ядерных взрывах[править | править код]
 Изменение атмосферной концентрации радиоуглерода 14C, вызванное ядерными испытаниями. Синим показана естественная концентрация
Изменение атмосферной концентрации радиоуглерода 14C, вызванное ядерными испытаниями. Синим показана естественная концентрацияОдним из поражающих факторов ядерного взрыва является радиоактивное загрязнение. Основной вклад в радиоактивное загрязнение вносят осколки деления ядер урана или плутония, но частично радиоактивное загрязнение обеспечивается наведённой радиоактивностью. Особенно сильна наведённая радиоактивность при взрыве термоядерных (в том числе и нейтронных) зарядов, так как выход нейтронов на единицу энергии в них в несколько раз выше, чем у ядерных зарядов, и средняя энергия нейтронов тоже выше, что делает возможными пороговые реакции. Утверждается[2], например, что взрыв нейтронной бомбы мощностью в 1 кт в 700 метрах от танка не только убивает экипаж нейтронным излучением, но и создает в броне наведённую радиоактивность, достаточную для получения новым экипажем смертельной дозы в течение суток.
При атмосферных ядерных испытаниях особенно большое значение имеет реакция нейтронов с атмосферным азотом-14 01n+ 714N→ 614C+ 11H,{\displaystyle \mathrm {~_{0}^{1}n} +\mathrm {~_{7}^{14}N} \rightarrow \mathrm {~_{6}^{14}C} +\mathrm {~_{1}^{1}H} ,} обладающая довольно высоким сечением (1,75 барн). Общее количество углерода-14, выброшенное в атмосферу во время ядерных испытаний, весьма велико и сравнимо с общим содержанием природного радиоуглерода в атмосфере.
Принцип наведённой радиоактивности положен в основу идеи т. н. кобальтовой бомбы. Это вид ядерного оружия, в котором основным поражающим фактором является радиоактивное загрязнение. Она представляет собой термоядерную бомбу с оболочкой из кобальта, в которой под действием нейтронного излучения взрыва создается изотоп кобальт-60 — сильнейший источник гамма-излучения с периодом полураспада 5,27 лет. Будучи распылённым ядерным взрывом по большой территории, кобальт-60 сделал бы их надолго непригодными для проживания.
Активация конструкционных материалов ядерных реакторов[править | править код]
Ядерные реакторы длительное время (десятки лет) работают в условиях сильнейшего нейтронного облучения (интенсивность потока нейтронов в некоторых энергетических реакторах достигает 1016 см−2·c−1, а в некоторых экспериментальных реакторах — даже 1019 см−2·c−1), а полный флюенс за все время — 1023 см−2. Ещё интенсивнее будут нейтронные потоки в проектируемых термоядерных реакторах. Это создает проблемы с утилизацией конструкций реакторов, отработавших свой срок, так как интенсивность наведённой радиоактивности в конструкциях реактора заставляет отнести их к радиоактивным отходам, причём масса этих отходов сравнима или даже больше массы отработанного ядерного топлива (ОЯТ). Например, реактор ВВЭР-1000 весит 324,4 т. (без воды и топлива) и даёт за 30 лет службы около 750 т ОЯТ — всего вдвое больше массы самого реактора. Ещё больше весят конструкции реактора РБМК — 1850 т.
Для решения проблемы с утилизацией элементов конструкции реакторов проводятся исследования по созданию материалов и сплавов, в которых наведённая радиоактивность спадает относительно быстро. Это достигается подбором материалов, которые при облучении нейтронами не дают долгоживущих изотопов (с T½ от десятков до миллионов лет). Характер спада радиоактивности определяется изотопным составом облучаемого вещества, а также спектром нейтронов.
Например, нежелательно содержание в таких сплавах никеля, молибдена, ниобия, серебра, висмута: они при облучении нейтронами дают изотопы с длительным временем жизни, например 59Ni (T½ = 100 тыс. лет), 94Nb (T½=20 тыс. лет), 91Nb (T½=680 лет), 93Mo (T½=4 тыс. лет). В термоядерных реакторах нежелательным материалом является также алюминий, в котором под действием быстрых нейтронов нарабатывается долгоживущий изотоп 26Al (T½=700 тыс. лет). В то же время такие материалы, как ванадий, хром, марганец, титан, вольфрам не создают изотопов с длительным временем жизни, поэтому после выдержки в течение нескольких десятков лет активность их падает до уровня, допускающего работу с ними персонала без специальной защиты. Например, сплав 79 % ванадия и 21 % титана, облучённый нейтронами спектра термоядерного реактора DEMO с флюенсом 2·1023 см−2, за 30 лет выдержки уменьшает активность до безопасного уровня (25 мкЗв/ч), а малоактивируемая сталь марки Fe12Cr20MnW только за 100 лет. Однако даже небольшая примесь никеля, ниобия или молибдена может увеличить это время до десятков тысяч лет.
Ещё одним способом уменьшения наведённой радиоактивности является изотопное обогащение. Например, при облучении железа нейтронами основной вклад в наведённую радиоактивность вносит изотоп 55Fe с периодом полураспада 2,7 лет в 55Mn (К-захват с излучением гамма-квантов с энергией 0,0065 МэВ), он образуется из лёгкого изотопа 54Fe, поэтому обогащение природного железа тяжёлыми изотопами может существенно снизить наведённую радиоактивность. Аналогично, существенно снижает наведённую радиоактивность молибдена обогащение тяжёлыми изотопами, а циркония или свинца — напротив, лёгкими. Однако изотопное разделение обходится очень дорого, поэтому экономическая целесообразность его под вопросом.