Урок по химии 11 класс «Типы кристаллических решёток»
. Мирошниченко В.И. – учитель химии высшей категории, учитель-методист «Свердловского лицея № 1»; г. Свердловск
В содержании курса химии темы «Химическая связь» и «Типы кристаллических решёток» относятся к основополагающим химическим теоретическим знаниям, включающие изучение состава и строения веществ, зависимости их свойств от строения, прогнозирование свойств веществ, что дает возможность правильно применять вещества.
Тема. Кристаллические решётки
Цель: обобщить и систематизировать знания учащихся о химической связи; создать условия для изучения понятия «кристаллические решётки» и их типы; учить выделять главную и избыточную информацию, выполнять смысловое свертывание выделенных фактов, представлять информацию в сжатой наглядно-символической форме (в виде таблицы) ;
вырабатывать умение устанавливать причинно-следственные связи между типом химической связи, типом кристаллической решётки и свойствами веществ, формировать логику химического мышления.
Ожидаемые результаты.
После этого урока учащиеся смогут:
называть типы кристаллических решеток
определять типы кристаллических решёток веществ
устанавливать взаимосвязь между строением кристаллической решётки и физическими свойствами вещества
Структура урока и методы работы
мотивация учебной деятельности (постановка проблемы)
представление теми и ожидаемых учебных результатов
активизация познавательной деятельности (взаимоконтроль учащихся по типам химической связи)
предоставление необходимой информации по изучаемой теме (критическое чтение текста параграфа)
интерактивное упражнение (работа в парах)
подведение итогов и оценивание результатов.
Ход урока
Мотивация учебной деятельности учащихся
(2 мин.)Постановка проблемы. С детства вы помните сказку о том, как у зайца была избушка лубяная, а у лисицы ледяная; пришла весна и ледяная избушка лисицы растаяла. Почему так случилось?. Сегодня на уроке вы сможете дать научное объяснение этому сказочному сюжету
Представление теми и ожидаемых учебных результатов (3 мин.)
Активизация познавательной деятельности (взаимоконтроль учащихся по типам химической связи) (5 мин.)
Дать определение понятиям, привести примеры:
ковалентная связь
ковалентная неполярная связь
ковалентная полярная связь
ионная связь
металлическая связь
Предоставление необходимой информации по изучаемой теме (критическое чтение текста параграфа)
Учащиеся самостоятельно прорабатывают материал параграфа 10, используя прием КРИТИЧЕСКОГО ЧТЕНИЯ. Во время чтения учащиеся должны на полях учебника делать карандашом пометки
+ (плюс) узнал о новом
— (минус) не понял
? (знак вопроса) хотел бы уточнить
Интерактивное упражнение (работа в парах) (15мин.)
Заполнение таблицы
Примерывеществ
Атомная
Молекулярная
Ионная
Металлическая
Учитель. Возвращаемся к вопросу, прозвучавшему в начале урока. Почему ледяная избушка лисицы растаяла?
Вывод: тип кристаллической решётки определяется частичками, которые находятся в узлах; тип кристаллических решёток определяет тип химической связи; тип химической связи определяет физические химические свойства веществ.
Подведение итогов, оценивание результатов урока (10 мин.)
Самостоятельная работа
Установить логические пары
Красный фосфор А.Молекулярная
Йод Б.Ионная
Магний бромид В.Атомная
Кварц
Белый фосфор (Р4)
Кальций оксид
Алюминий
Домашнее задание Г.Е. Рудзитис, Ф.Г Фельдман, издательство «Просвещение» Химия 11 класс параграф 10 выучить, упражнение 3
Типы кристаллических решёток 11 класс Рудзитис Типы
 Типы кристаллических решёток 11 класс Рудзитис
Типы кристаллических решёток 11 класс Рудзитис


 Молекулярная кристаллическая решётка
Молекулярная кристаллическая решётка
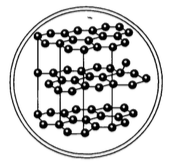
 Типы кристаллических решёток Тип решётки Молекуляр ная Определе ние — такая, в узлах которой находятся молекулы Свойства веществ -Легкоплав кие -Хрупкие Примеры веществ Вода H 2 O Сера S 8 Углекислый газ – сухой лёд
Типы кристаллических решёток Тип решётки Молекуляр ная Определе ние — такая, в узлах которой находятся молекулы Свойства веществ -Легкоплав кие -Хрупкие Примеры веществ Вода H 2 O Сера S 8 Углекислый газ – сухой лёд
 Атомная кристаллическая решётка
Атомная кристаллическая решётка
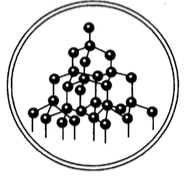
 Типы кристаллических решёток Тип решётки Атомная Определе ние — такая, в узлах которой находятся атомы Свойства веществ -Тугоплавкие -Прочные Примеры веществ Алмаз(C) Графит(C) Кремнезём (Si. O 2) Горный хрусталь (Si. O 2)
Типы кристаллических решёток Тип решётки Атомная Определе ние — такая, в узлах которой находятся атомы Свойства веществ -Тугоплавкие -Прочные Примеры веществ Алмаз(C) Графит(C) Кремнезём (Si. O 2) Горный хрусталь (Si. O 2)

 Типы кристаллических решёток Тип решётки Ионная Определе ние — такая, в узлах которой находятся ионы Свойства веществ -Хрупкие -Тугоплавкие -Растворы проводят эл. ток Примеры веществ Поваренная соль (Na. Cl) Медный купорос (Cu. SO 4 • 5 H 2 O)
Типы кристаллических решёток Тип решётки Ионная Определе ние — такая, в узлах которой находятся ионы Свойства веществ -Хрупкие -Тугоплавкие -Растворы проводят эл. ток Примеры веществ Поваренная соль (Na. Cl) Медный купорос (Cu. SO 4 • 5 H 2 O)
 Металлическая кристаллическая решётка
Металлическая кристаллическая решётка
 Типы кристаллических решёток Тип решётки Металлическая Определени е — в узлах которой находятся атомы и ионы металлов, и свободно движутся электроны. Свойства веществ -металлический блеск -электропроводность -пластичность -ковкость Примеры веществ Металлы Сплавы
Типы кристаллических решёток Тип решётки Металлическая Определени е — в узлах которой находятся атомы и ионы металлов, и свободно движутся электроны. Свойства веществ -металлический блеск -электропроводность -пластичность -ковкость Примеры веществ Металлы Сплавы

 1. Какой тип кристаллической решётки у бромида калия: 1) 2) 3) 4) Атомная Металлическая Молекулярная Ионная
1. Какой тип кристаллической решётки у бромида калия: 1) 2) 3) 4) Атомная Металлическая Молекулярная Ионная
 2. Сахароза – легкоплавкое, хрупкое вещество, тип решётки: 1) 2) 3) 4) Атомная Металлическая Молекулярная Ионная
2. Сахароза – легкоплавкое, хрупкое вещество, тип решётки: 1) 2) 3) 4) Атомная Металлическая Молекулярная Ионная

 4. Атомную кристаллическую решётку имеет вещество: 1) 2) 3) 4) графит вода хлорид натрия магний
4. Атомную кристаллическую решётку имеет вещество: 1) 2) 3) 4) графит вода хлорид натрия магний
 5. Ионную кристаллическую решётку имеет вещество: 1) 2) 3) 4) Mg Mg. F 2 HF
5. Ионную кристаллическую решётку имеет вещество: 1) 2) 3) 4) Mg Mg. F 2 HF
 6. Кислород имеет кристаллическую решётку: 1) 2) 3) 4) Атомную Металлическую Молекулярную Ионную
6. Кислород имеет кристаллическую решётку: 1) 2) 3) 4) Атомную Металлическую Молекулярную Ионную
 7. Хрупкое вещество, при растворении в воде проводит электрический ток. Тип решётки: 1) 2) 3) 4) Атомная Металлическая Молекулярная Ионная
7. Хрупкое вещество, при растворении в воде проводит электрический ток. Тип решётки: 1) 2) 3) 4) Атомная Металлическая Молекулярная Ионная
 8. Йод – твёрдое, легкоплавкое вещество. При нагревании подвергается возгонке. Тип решётки: 1) 2) 3) 4) Атомная Металлическая Молекулярная Ионная
8. Йод – твёрдое, легкоплавкое вещество. При нагревании подвергается возгонке. Тип решётки: 1) 2) 3) 4) Атомная Металлическая Молекулярная Ионная
 9. Твёрдое, пластичное вещество, имеет металлический блеск. Тип решётки: 1) 2) 3) 4) Атомная Металлическая Молекулярная Ионная
9. Твёрдое, пластичное вещество, имеет металлический блеск. Тип решётки: 1) 2) 3) 4) Атомная Металлическая Молекулярная Ионная
 10. Карборунд – твёрдое, прочное, тугоплавкое вещество. Тип решётки: 1) 2) 3) 4) Атомная Металлическая Молекулярная Ионная
10. Карборунд – твёрдое, прочное, тугоплавкое вещество. Тип решётки: 1) 2) 3) 4) Атомная Металлическая Молекулярная Ионная
КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ Конспект урока по химии для учащихся 11 классов.
КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ
Конспект урока
по химии для учащихся 11 классов.
Составлен учителем химии Семидетовой Е.Ю.
Конспект урока
Тема урока: Кристаллические решетки.
Форма урока: коллективное изучение и закрепление нового материала с использованием элементов проектной деятельности.
Цель урока: расширить и закрепить знания учащихся о строе-
нии вещества: видах химической связи и кристаллических решетках.
Задачи урока:
образовательные – закрепить знания учащихся о видах химических
связей; сформировать представление о кристаллических веществах, разновид-
ностях кристаллических решеток, их строении и свойствах.
развивающие – отрабатывать навыки выявления закономерностей,
зависимости одного от другого, развивать познавательный интерес учащихся, тре-
нировать умение четко выражать свою мысль при ответе.
воспитательные – воспитывать навыки творческого подхода к
осмыслению заданной проблемы , логического мышления, умения работать в коллективе.
здоровьесберегающие – сохранять здоровье учащихся с разным
типом восприятия информации путем смены видов деятельности.
Оборудование:
Периодическая система химических элементов Д.И.Менделеева; модели кри-
сталлических решеток; мини-презентации учащихся по темам «Виды химической
связи», « Кристаллические решетки», «Шкала твердости веществ» в электронном
виде (с использованием ИКТ).
Ход урока
1.Организационный момент: объявление плана урока.
а) проверка знаний
б) изучение нового материала
в) закрепление новых знаний
2.Проверка знаний
Ученик демонстрирует домашнее задание: показывает с помощью ИКТ
свою презентацию на тему « Виды химической связи».
.
Класс делится на группы по 4-6 человек, которые отвечают на вопросы:
1.Почему атомы соединяются друг с другом?
(стремятся завершить внешний энергетический уровень)
2.Какие электроны участвуют в образовании связей?
(неспаренные электроны)
3.Как располагается общая пара электронов между атомами одного элемента или между атомами с одинаковой электроотрицательностью?
(ровно посередине, никуда не смещена)
4.Как называется такой тип связи?(ковалентная неполярная)
5.Приведите примеры. (h3, CL2, F2, N2, O2)
6.Как еще можно назвать общую пару электронов?
(связующая пара электронов, общая электронная плотность)
7.Как располагается связующая пара электронов между атомами неметаллов
с небольшой разницей электроотрицательностей?
(общая пара е сдвинута к атому с большей Э.О.)
8.Как называется такой тип связи?
(ковалентная полярная)
9.Приведите примеры. (h3O, Ph4, h3S) – укажите, к какому атому сдвинута общая электронная плотность.
10.Что происходит при образовании ионной связи?
(один атом отдает свои валентные электроны другому атому полностью, превращаясь в
ионы)
11.Какие атомы участвуют в образовании такой связи?
(атомы с большой разницей в Э.О.,т.е. типичный металл и неметалл)
12.Приведите примеры. (NaCl, KNO3, CaSO4)
Члены группы, давшей наибольшее количество правильных ответов, получают «5».
Остальные ученики, отвечавшие на вопросы – «4»
3.Подготовка к активной деятельности на основном этапе урока.
Учитель задает проблемный вопрос: что вы знаете о кристаллах, их строении
и свойствах? Встречались ли вам вещества, представляющие своим строением
кристаллическую решетку?
4.Основной этап урока. Объяснение нового материала.
4.1.Записать тему урока. «Кристаллические решетки.»
Определение: Кристаллические решетки это упорядоченное, периодическое расположение частиц в пространстве.
Точки, в которых расположены частицы, называют узлами кристаллических
решеток.
4.2.На доске начерчена таблица. Учащиеся должны перечертить ее в тетрадь и заполнять в течение урока.
Атомнаякр. решетка
Ионная
кр. решетка
Молекулярная
кр. решетка
Металлическая
кр. решетка
Частицы, кото-
рые находятся
в узлах.
Виды связи
между частицами
Свойства
веществ
Примеры
веществ
4.3.Ученик демонстрирует с помощью ИКТ свою презентацию на тему
«Кристаллические решетки».
. По мере ознакомления с презентацией класс заполняет таблицу.
В случае отсутствия презентации таблица заполняется в ходе коллективного обсуждения.
4.4.Обсуждение изученного.
Вещества с ионной решеткой можно отличить легко – по ионной связи. В моле-
куле присутствует атом металла. Они легко растворяются в воде, диссоциируют.
Металлическая кристаллическая решетка присуща любому металлу.
В некоторых случаях трудно различить по химической формуле атомную и мо-
лекулярную кристаллические решетки, так как в обоих случаях связь между атомами ковалентная.
Вещества с данными решетками различаются по температурам плавления и
кипения. Те, у которых очень высокая температура плавления, имеют атомную
решетку.
Вещества с молекулярной решеткой чаще при обычных условиях газообразны,
жидкие – легкокипящие, а твердые даже обладают способностью возгоняться.
Проверка заполненной таблицы:
Атомнаякристаллич.
решетка
Ионная
кристалл. решетка
Молекулярная
кристаллич.
решетка
Металлическая
кристаллич.
решетка
Частицы, кото-
рые находятся
в узлах.
Атомы
Ионы
Молекулы
Атомы
металла
Виды связи
между частицами
ковалентные
полярные и
неполярные
ионные
(весь кристалл-
гигантская
молекула)
слабые
межмолеку-
лярные,
водородные
катионы металла связаны
воедино валент-
ными электро-
нами
Свойства
веществ
самые проч-
ные, твердые, малолетучие,
нераствори-
мые в воде,
тугоплавкие
обладают
высокой
твердостью,
тугоплавки.
малолетучи,
растворимы
в воде, электролиты
непрочные, малотвердые,
плохо раствори-
мые в воде,
растворы полохо
проводят эл. ток,
низкие темпера-
туры плавления и кипения
обладают метал-
лическим блеском, сереб-
ристым цветом,
высокой тепло- и
электропровод-
ностью, пластичны
Примеры
веществ
C (графит, алмаз), B,Si,Ge,SiO2
(хрусталь и др. кристаллы)
NaCl, KBr
и т.д.
h3O(лед), тв.CO2
(сухой лед), S8
(сера), Р4(фосфор), F2,
Cl2, Br2, I2,N2,O2
все металлы,
кроме Hg, сплавы
5. Подведение итогов и закрепление знаний.
Учащиеся записывают формулы веществ. Определяют вид связи и тип кри-
сталлической решетки.
Cu, C, N2O3, O2, P, Mg, Al2O3, Br2, CaCl2, N2, BaO, B.
Задание выполняется с помощью учителя.
6. Информация о домашнем задании.
Типы кристаллических решёток
Для определения типа кристаллической решётки поступают следующим образом. Если связь в соединении ионная, то кристаллическая решётка всегда ионного типа: хлорид калия, нитрат калия, нитрид кальция, карбид кальция, оксид алюминия.

Если связь металлическая, то и кристаллическая решётка всегда металлическая: латунь, железо, медь, натрий.

Если связь ковалентная, то решётка может быть, как атомной, так и молекулярной. Веществами с атомной кристаллической решёткой являются: карборунд, оксид кремния четыре, бор, кремний, алмаз, графит, чёрный и красный фосфор.

У веществ с молекулярной кристаллической решёткой в узлах кристаллической решётки расположены молекулы, прочность данной связи слабая.

Для веществ с молекулярной кристаллической решёткой характерны низкие температуры плавления, то есть они легкоплавки и летучи, значительная сжимаемость, иногда запах, а также явление сублимации, или возгонки, как для йода и твёрдого углекислого газа.
Для веществ с молекулярной кристаллической решёткой характерна небольшая твёрдость, большинство этих веществ хорошо растворимы в воде. Молекулярную кристаллическую решётку имеют газы и жидкости в твёрдом агрегатном состоянии. Например, кристаллический йод, сера, белый фосфор, углекислый газ, большинство органических соединений.

У веществ с атомной кристаллической решёткой в узлах расположены атомы. Связь между атомами в кристаллические решётки – ковалентная, очень прочная. Для этих веществ характерны высокие температуры кипения и плавления, то есть они тугоплавки и нелетучий, очень твёрдые, практически не растворимы в воде и не имеют запаха.
Примером веществ с таким типом кристаллических решёток являются алмаз и графит.

Как известно, твёрдость алмаза оценивается по шкале Мооса самым высоким значением – 10. Благодаря высокой твёрдости алмаз используют для изготовления буров, свёрл, шлифовальных инструментов, стеклорезов. Алмаз является камнем ювелиров, они используют отшлифованные алмазы – бриллианты.
Графит также является веществом с атомной кристаллической решёткой, но несмотря на это, он мягкий, так как имеет слоистую структуру. В кристаллической решётке графита атомы углерода, лежащие в одной плоскости, связаны в правильные шестиугольники. Связи между слоями непрочные, за счёт этого графит мягкий. Графит, как и алмаз, тугоплавкий. Из него изготавливают электроды, твёрдые смазки, стержни для карандашей, замедлители нейтронов в ядерных реакторах.
Атомные кристаллические решётки имеют не только простые, но и сложные вещества. Например, все разновидности оксида алюминия. Такие, как наждак, корунд, рубин, сапфир.

Наиболее распространённое соединение кремния – это оксид кремния четыре, который также имеет атомную кристаллическую решётку. Почти чистым оксидом кремния четыре является минерал кварц.

У веществ с ионным типом связи в узлах кристаллической решётки расположены ионы, связь между частицами – ионная, она прочная.

Для веществ с ионным типом связи характерны следующие свойства: высокие температуры плавления и кипения, они тугоплавки и нелетучи, они твёрдые, хрупкие, многие растворимы в воде. Их хрупкость объясняется тем, что если попробовать деформировать такую кристаллическую решётку, то один из её слоёв будет двигаться относительно другого слоя до тех пор, пока одинаково заряженные ионы не будут друг против друга. Эти ионы начнут отталкиваться друг от друга, и кристаллическая решётка разрушиться.
Вещества с ионным типом связи плохо проводят электрический ток и тепло. Но их растворы и расплавы проводят электрический ток. Вещества с ионным типом связи не имеют запаха.
Ионное соединение представляет собой гигантскую ассоциацию ионов, расположенных в пространстве благодаря равновесию сил притяжения и отталкивания.

Например, кристалл хлорида натрия состоит из катионов натрия и анионов хлора. Каждый катион натрия окружён шестью анионами хлора, а каждый анион хлора – шестью катионами натрия. Наименьшей структурной единицей кристалла является элементарная ячейка. Строение элементарной ячейки зависит от соотношения размеров катиона и аниона.
У веществ с металлическим типом связи в узлах кристаллической решётки расположены атом-ионы, связь между ними металлическая. Связь может быть различной по прочности.

Металлическая кристаллическая решётка определяет свойства металлов: ковкость, пластичность, электро-и теплопроводность, металлический блеск, способность образовывать сплавы.
Пластичность выражается в способности металлов деформироваться под действием механической нагрузки. Это свойство лежит в основе ковки, прокатки металлов, их способности вытягиваться в проволоку. Пластичность объясняется тем, что под воздействием силы слои перемещаются относительно друг друга без разрыва связи между ними.

Например, если двумя плоскими стеклянными пластинками поместить несколько капель воды, то пластинки будут свободно скользить относительно друг друга, но вот разъединить их будет достаточно сложно. Таким образом, в данном опыте вода играла роль свободных электронов, которые находятся в металлической кристаллической решётке.
Наиболее пластичными металлами являются золото, серебро и медь. Именно из золота можно сделать самую тонкую фольгу толщиной три тысячных миллиметра. Такую тонкую фольгу использую для золочения. Примером может служить Янтарная комната в Большом Екатерининском дворце.
Высокая электропроводность металлов обусловлена наличием свободных электронов, которые под действием электрического тока приобретают направленное движение.

Лучшими проводниками электрического ока являются серебро и медь, немного худшим – алюминий. Однако в большинстве случаев в качестве электропроводов используют алюминий, а не медь.
Теплопроводность металлов также объясняется движением свободных электронов, которые сталкиваются с атом-ионами в узлах кристаллической решётки и обмениваются с ними энергией. Благодаря этому свойству металлическая посуда равномерно нагревается.
Вещества с металлическим типом кристаллической решётки имеют металлический блеск из-за отражения световых лучей.

Высокой светоотражающей способностью обладают ртуть, серебро, палладий и алюминий. Из серебра, палладия и алюминия изготавливают зеркала, прожектора и фары. В порошкообразном состоянии металлы теряют свой блеск, только магний и алюминий сохраняют его.

Большинство металлов имеет серебристо-белый цвет. Только золото окрашено в жёлтый цвет, а медь в красный.
Металлическая кристаллическая решётка характерна не только для металлов, но и для сплавов. Это отличает металлические сплавы от других сплавов: стекла, фарфора, керамики, базальтов, гранитов, гнейсов.
Конспект и задания «Типы кристаллических решеток»
Тест «Гибридизация атомных орбиталей и геометрия молекул»
http://files.school-collection.edu.ru/dlrstore/3c96a8ac-aae9-11db-abbd-0800200c9a66/ch21_07_24.swf
 7. ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК
7. ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК
Кристаллическая решетка
При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку.
Кристаллическая решетка – это структура с геометрически правильным расположением частиц в пространстве.
В самой кристаллической решетке различают узлы и межузловое пространство.
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК
ИОННАЯ
МЕТАЛЛИЧЕСКАЯ
АТОМНАЯ
МОЛЕКУЛЯРНАЯ
НЕМОЛЕКУЛЯРНОЕ
СТРОЕНИЕ
МОЛЕКУЛЯРНОЕ СТРОЕНИЕ
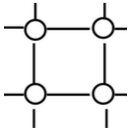
Частицы, находящиеся в узлах кристаллической решетки.
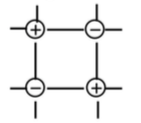
Ионы
Атомы и катионы
Атомы
http://files.school-collection.edu.ru/dlrstore/0ab743c4-4185-11db-b0de-0800200c9a66/ch08_22_03.swf
Ковалентные неполярные или полярные молекулы 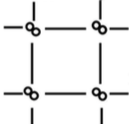
http://files.school-collection.edu.ru/dlrstore/0ab743c5-4185-11db-b0de-0800200c9a66/ch08_22_04.swf
Тип химической связи между частицами узла
Ионная
Металлическая
Ковалентная
Силы взаимодействия между частицами кристалла.
Электростатические
Силы притяжения между ионами велики.
Прочность связи высокая.
Электростатические
Силы взаимодействия велики.
Прочность связи высокая.
Ковалентные
Ковалентная связь между атомами прочная.
Прочность связи высокая.
Межмолекулярные
Силы межмолекулярного взаимодействия невелики.
Прочность связи невысокая.
Физические свойства, обусловленные кристаллической решёткой
— Тпл.↑ (тугоплавкие),
— легко растворяются в воде,
— расплав и раствор проводит электрический ток,
— нелетучие (не имеют запаха)
— Тпл.↑,
— высокие тепло- и электропроводность,
— пластичны,
— Тпл. и Tкип очень↑,
— в воде не растворяются,
— расплав не проводит электрический ток
— Тпл.↓,
— некоторые растворяются в воде,
— обладают запахом,
— летучи (летучесть уменьшается с увеличением размеров молекул).
Агрегатное состояние вещества при обычных условиях
Твёрдое
Твёрдое,
жидкое (Нg)
Твёрдое
Твёрдое,
газообразное,
жидкое
Примеры
Вещества с ионной связью:
большинство солей, щелочей, оксиды типичных металлов.
Металлы, сплавы
С (алмаз, графит), Si, Ge, B,
SiO2, CaC2, SiC (карборунд), BN, Fe3C, TaC(tпл.=38000С)
Красный и чёрный фосфор. Оксиды некоторых металлов.
Все газы, жидкости, большинство неметаллов: инертные газы, галогены, H2, N2, O2, O3, P4 (белый), S8, С (фуллерен).
Водородные соединения неметаллов,
оксиды неметаллов: H2O,
CO2 «сухой лёд» и др.. Большинство органических соединений.

Одно и то же вещество в зависимости от условий (p, t,…) существует в различных кристаллических формах (т.е. имеют разные кристаллические решетки) – аллотропных модификациях, которые отличаются по свойствам.
Например, известно четыре модификации углерода – алмаз, графит, карбин и лонсдейлит.
sp3 формаsp2 форма
sp2 форма
sp форма
Атомная
Атомная
Молекулярная
Атомная
Все связи очень прочные.
Слоистое строение. В плоскости слоя – связи прочные. Между слоями связи слабые.
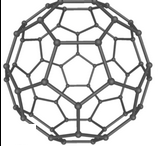
Молекулярное соединение, представляющее собой выпуклые замкнутые многогранники.
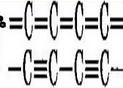
Состоит из углеродных фрагментов с тройной –С≡С–С≡С–, или двойной кумулированной =С=С=С=С= связью. Может быть линейным или образовывать циклические структуры.
Твердый, тугоплавокий, не проводит электрический ток, плохо проводит теплоту.
Мягкий, хрупкий, тугоплавкий, хорошо проводит ток и тепло, обладает металлическим блеском.
Полупроводники
Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9÷2 г/см³), обладает полупроводниковыми свойствами.
Алмаз
1) Тест “Кристаллические решетки”
http://files.school-collection.edu.ru/dlrstore/0ab743c8-4185-11db-b0de-0800200c9a66/index_mht.htm
2) Вопросы.
Урок 4. строение кристаллов. кристаллические решётки. причины многообразия веществ — Химия — 11 класс
Химия, 11 класс
Урок № 4. Строение кристаллов. Кристаллические решётки. Причина многообразия веществ
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению кристаллического состояния вещества, зависимости свойств веществ от типов кристаллических решеток. Объясняются причины многообразия веществ, такие как изотопия элементов, аллотропия, изомерия, гомология. Дается понятие химического синтеза.
Глоссарий
Аллотропия – существование нескольких простых веществ, образованных одним и тем же химическим элементом.
Атомная кристаллическая решётка – регулярная структура твёрдого вещества, в узловых точках которой находятся атомы химического элемента.
Гомология – явление наличия в природе органических соединений, имеющих одинаковое строение и химические свойства, но отличающихся на некоторое целое число групп СН2— состав.
Изомерия – явления наличия нескольких веществ, имеющих один и тот же состав, но отличающихся по порядку соединения атомов.
Ионная кристаллическая решетка – регулярная структура твёрдого вещества, в узлах которой расположены положительно и отрицательно заряженные ионы.
Кристаллическая решетка – особая структура твёрдого вещества, в которой частицы вещества расположены в строго определенном порядке.
Кристаллы – твёрдые вещества, имеющие форму правильных многогранников, образованных в результате многократного регулярного повторения расположения составляющих вещество частиц.
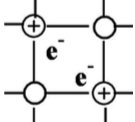
Металлическая кристаллическая решетка – регулярная структура твёрдого вещества, в узлах которой расположены ионы металла.
Молекулярная кристаллическая решетка – регулярная структура твёрдого вещества, в узлах которой находятся молекулы вещества.
Полиморфизм – способность твёрдого вещества образовывать различные кристаллические структуры, состоящие из одних и тех же частиц.
Полиморфные модификации – разные кристаллические структуры, которые образованы частицами одного и того же вещества.
Химический синтез – процесс искусственного создания новых веществ физическими и химическими методами.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Строение кристаллов и типы кристаллических решеток
Кристаллами называются твёрдые вещества, частицы которых образуют трёхмерную периодическую пространственную структуру, называемую кристаллической решёткой. Грани кристаллов представляют собой правильные многоугольники. Свойства кристаллических тел различны. Например, алмаз обладает максимальной твёрдостью, а графит можно сломать руками, хотя эти вещества состоят атомов углерода. Свойства веществ зависят от типа кристаллической решетки. Различают четыре типа кристаллических решёток: атомную, ионную, молекулярную и металлическую.

Зависимость свойств веществ от типа кристаллической решетки
В узлах атомной кристаллической решётки расположены атомы, соединённые ковалентной связью. Примерами веществ, имеющих атомную кристаллическую решетку, являются алмаз, кремний, германий, бор. Вещества, имеющие атомную кристаллическую решетку, характеризуются высокой температурой плавления, большой твёрдостью.
В узлах ионной кристаллической решётки находятся положительные и отрицательные ионы, связь между ними ионная. Ионную кристаллическую решетку имеют соли, щёлочи и оксиды типичных металлов. Для веществ с ионной кристаллической решеткой характерны высокие температуры плавления, твёрдость, плотность, хорошая электропроводность.
В узлах молекулярной кристаллической решетки находятся молекулы, которые удерживаются за счет межмолекулярных вандервальсовых сил. Примером веществ с молекулярной кристаллической решеткой являются лёд, йод, нафталин, углекислый газ. Межмолекулярные связи значительно слабее ковалентных и ионных, поэтому для веществ с молекулярной кристаллической решёткой характерны низкие температуры плавления, невысокая твёрдость, возможность возгонки (переход из твёрдого состояния в газообразное, минуя жидкое).
Для металлов характерна металлическая кристаллическая решётка, в узлах которой расположены положительно заряженные ионы металлов, а между ними свободно перемещаются валентные электроны (так называемый электронный газ). Для веществ с металлической кристаллической решеткой характерны механическая прочность, плавкость, ковкость, хорошая тепло- и электропроводность, металлический блеск.
Свойства кристаллических тел определяются не только характером связи между частицами, но и их взаимным расположением относительно друг друга. В кристаллах алмаза все атомы углерода связаны ковалентными неполярными связями и находятся на одинаковом расстоянии друг от друга, образуя тетраэдры. В кристаллах графита каждые шесть атомов углерода связаны ковалентными неполярными связями, а между собой такие плоские шестиугольники связаны слабыми межмолекулярными связями.
Причины многообразия веществ
Не только углерод может образовывать разные вещества в зависимости от типа кристаллической решётки. Известно несколько веществ, образованных фосфором (белый, красный, чёрный и металлический фосфор). Сера может существовать в виде трёх модификаций (ромбическая, моноклинная и пластическая). Явление существования нескольких простых веществ, образованных одним и тем же элементом, называется аллотропией (полиморфизмом), а сами простые вещества – аллотропными (полиморфными) модификациями.
Существование изотопов – атомов одного и того же химического элемента, имеющих разные массовые числа — ещё одна причина огромного многообразия веществ.
Изучая органическую химию, вы узнали о существовании изомеров – молекул, имеющих одинаковый состав, но разную последовательность атомов и их расположение в пространстве. Изомеры встречаются не только среди органических соединений, например, изомером карбамида является цианат аммония.
Причиной разнообразия органических соединений является и гомология – существование ряда соединений, имеющих одинаковое строение и химические свойства, но отличающихся друг от друга на целое число групп СН2-.
118 известных на сегодняшний день химических элементов образуют миллионы различных веществ, но человек искусственным путём создает новые вещества с нужными ему свойствами. Создание человеком новых веществ получило название химического синтеза.
Таким образом, явления аллотропии (полиморфизма), изомерии, изотопии, гомологии, химический синтез новых соединений являются причинами многообразия веществ.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Расчет количества молекул в кристалле
Условие задачи: Молекула белого фосфора состоит из четырех атомов этого элемента. Сколько молекул белого фосфора содержится в кристалле фосфора массой 2,48 г? Ответ запишите в виде числа, приведенного к стандартному виду.
Шаг первый: найдём молярную массу молекулы белого фосфора Р4. Относительная атомная масса фосфора равна 31 а.е.м., молярная масса Р4 равна 4·31 = 124 (г/моль).
Шаг второй: найдём количество молей белого фосфора в кристалле массой 2,48 г. Для этого разделим массу кристалла на молярную массу Р4:
2,48 : 124 = 0,02 (моль).
Шаг третий: найдём количество молекул, содержащееся в 0,02 моль белого фосфора. Для этого число моль умножим на число Авогадро:
0,02·6,02·1023 = 1,2·1022 (молекул).
Ответ: 1,2·1022.
2. Расчёт числа атомов в молекуле фуллерена
Условие задачи: Одной из аллотропных модификаций углерода, применяемых в электронике, является фуллерен. 0,5 моль фуллерена имеют массу 360 г. Сколько атомов углерода входит в состав одной молекулы фуллерена?
Шаг первый: найдём молярную массу фуллерена.
Для этого массу имеющегося образца разделим на количество молей:
360 : 0,5 = 720 (г/моль).
Шаг второй: найдём количество атомов углерода в 1 моль фуллерена. Для этого молярную массу фуллерена разделим на массу 1 моль атомов углерода. 1 моль атомов углерода имеет массу 12 г.
720 : 12 = 60 (атомов).
Ответ: 60.
Презентация к уроку в 11 классе на тему: «Кристаллические решетки»

Типы кристаллических решеток
(урок 11 класс, базовый уровень)
Преподаватель Казановская Е.Б.

«Познать сущее нельзя извне, можно только изнутри»
(Н.Бердяев)

Ответьте на вопросы:
1. Какое вещество на Земле находится сразу в трех агрегатных состояниях?
2. Вспомните физику и обсудите, от чего зависит агрегатное состояние воды?

Вывод
Агрегатное состояние воды
( и других веществ) зависит от температуры, при которой находится вещество. Агрегатное состояние вещества зависит также от характера его частиц (атомов, молекул или ионов), их взаимного расположения.

Классификация веществ
- Твердые вещества делятся:
1)аморфные ( не имеющие упорядоченной структуры — стекло, резина, шоколад и др.)
2)кристаллические (имеющие упорядоченное расположение структурных частиц — лед, кварц, железо и др.)

Кристаллы серы

- Кристалл – _______вещество, имеющее _______________________строение.
- Разные по форме кристаллы имеют различные кристаллические решетки. Кристаллическая решетка –________________частиц в кристалле.

Вид решетки
Строение
Свойства веществ
Примеры в-в, их использование
Выполнить упр. 4-8 с. 37 письменно

Лабораторный опыт
- Исследуйте тип кристаллической решетки выданного вам вещества. Прочитайте текст из учебника §4. Заполните таблицу «Кристаллические вещества».
Вещество
Тип решетки
Физ. свойства
Применение

Типы кристаллических решеток



Выводы
- В кристаллических веществах атомы, молекулы или ионы располагаются _____________________.
- В зависимости от природы частиц в узлах решетки различают _________________________кристаллические решетки. Физические свойства твердых веществ определяются _________.

Закон постоянства состава веществ:
«Молекулярные химические соединения независимо от способа их получения имеют постоянный состав и свойства»

Диктант
1.Нафталин – легкоплавкое, кристаллическое вещество, потому что имеет молекулярную кристаллическую решетку.
2.Слово «кристалл» пишется с одной буквой «л».
3. Вещества с атомной кристаллической решеткой – твердые, тугоплавкие, нелетучие.
4. Для веществ с металлической кристаллической решеткой характерным свойством является хрупкость.
5. Кристаллическая решетка графита состоит из атомов углерода.

Шкала оценок:
- 5 верных ответов – «5»
- 4 верных ответов – «4»
- 3 верных ответов – «3»
- 2-0 верных ответов – «2».

1. Вещества с атомной кристаллической решеткой
1)очень твердые и тугоплавкие
2)хрупкие и легкоплавкие
3)проводят электрический ток в растворах
4)проводят электрический ток в расплавах
2. Молекулярное строение имеет
1) алмаз
2) азот
3) кремний
4) поваренная соль

3. У веществ с низкой температурой плавления кристаллическая решетка
1) атомная
2) ионная
3) молекулярная
4) металлическая
4. Молекулярный тип кристаллической решетки реализуется в строении:
1) NaCI
2) SiO2
3) h3O
4) Ba(NO)2