Кислоти, їх склад, назви. Класифiкація кислот
Кислоти, їх склад, назви. Класифiкація кислот
Кислотами називають складні речовини, які складаються з атомів Гідрогену, здатних заміщуватися на атоми металів, і кислотних залишків. Кислотний залишок може містити окремі атоми чи групи атомів. Валентність кислотного залишку та основність кислоти визначається числом атомів Гідрогену, здатних заміщуватися на атоми металів.
За сучасною українською науковою номенклатурою при побудові назви кислоти спочатку називають катіон (Гідроген), а потім додають назву аніона. Наприклад, гідроген хлорид HCl, гідроген нітрат HNO3. Оскільки гідроген-катіон вказує на приналежність сполуки до кислоти, назву кислоти можна побудувати, використовуючи назву аніона із закінченням —на замість прикметника, додаючи до нього іменник кислота. Наприклад, хлоридна кислота HCl, нітратна кислота HNO
Необхідно запам’ятати назви та формули найважливіших неорганічних кислот:
· хлоридна кислота HCl;
· сульфатна кислота H2SO4;
· сульфітна кислота H2SO3;
· сульфідна кислота H2S;
· нітратна кислота HNO3;
· ортофосфатна кислота H3PO4;
· карбонатна кислота H2CO3;
· силікатна кислота H2SiO3.
Кислоти можна прокласифікувати за такими основними ознаками, як наявність атомів Оксигену та основність (кількість атомів Гідрогену). За наявністю атомів Оксигену кислоти поділяють на оксигеновмісні (H2SO3, H2SiO3) та безоксигенові (HCl, H2S). За основністю кислоти поділяють на одноосновні (HCl, HNO
3), двоосновні (H2SO4, H2CO3) та триосновні (H3PO4).shkolyar.in.ua
4.5. Кислоти | 8 клас
Кислоти – це сполуки, до складу яких входить один або кілька атомів Гідрогену (здатних заміщуватися на атоми металічних елементів) та кислотний залишок.
Загальна формула кислот – HnR, де R – кислотний залишок.
Кислотний залишок – це атом чи група атомів, що входить до складу молекули кислоти.
Завдання для самоконтролю■ 367. З переліку речовин виберіть кислоти: ZnS, H3PO4, Na2CO3, P2O5, H2SO3, KCl, SiO2, CuO, HI, NaBr, HNO3, CuCl2, H2SiO3, HF, CO2, HNO3
368. Вкажіть кислоти, які належать до безоксигенових: карбонатна, сульфідна, бромідна, силікатна, хлоридна, сульфатна.
369. Вкажіть кислоти, які належать до оксигеновмісних: фторидна, нітратна, сульфідна, сульфітна, плавикова, соляна.
▲● 370. Яка формула сульфатної кислоти: а) H2SO4; б) H2S; в) H2SO3.
371. Позначте відповідність:
| 1) HNO3; | а) сульфатна кислота; |
| 2) HCl; | б) орторфосфатна кислота; |
| 3) H2SO4; | в) сульфідна кислота; |
| 4) H3PO4; | г) нітратна кислота; |
| 5) H2S; | д) хлоридна кислота. |
372. Напишіть формули таких кислот: плавикової, сульфітної, йодидної, карбонатної, бромідної.
373. В присутності кислоти лакмус змінює свій колір на: а) червоний; б) синій; в) жовтий.
●● 374. Які з цих кислот належать до безоксигенових: сульфідна, сульфатна, нітратна, силікатна, хлоридна, фторидна.
375. З переліку ознак випишіть ті, які характерні для хлоридної кислоти: а) рідина; б) добре розчинна у воді; в) погано розчинена у воді; г) має запах; ґ) без запаху.
376. З переліку ознак випишіть ті, які характерні для сульфатної кислоти: а) важка масляниста рідина; б) добре розчиняється у воді з виділенням теплоти; в) погано розчиняється у воді; г) має різкий запах; ґ) без запаху; д) обвуглює органічні речовини; е) тверда речовина.
377. Вкажіть спосіб приготування розчину сульфатної кислоти: а) кислоту наливають у воду, постійно перемішуючи; б) воду наливають у кислоту, постійно перемішуючи.
378. Серед наведених формул випишіть формули одноосновних кислот: H2S, HI, НBr, HNO3, H2SO3, H2SiO3, HF, HNO3.
●●● 379. Валентність кислотного залишку кислоти відповідає: а) кількості атомів Гідрогену в її молекулі; б) кількості атомів Оксигену в її молекулі; в) валентності атомів Гідрогену.
380. У якій з кислот масова частка Гідрогену більша: H2S, H2SO3, H2SO4?
381. Складіть формули кислот, які містять такі кислотні залишки: а) –ClO4, б) =SO3, в) ≡PO4, г) =SiO3, ґ) =SO4, д) =S, е) –Cl, є) –NO3. Назвіть ці кислоти.
382. Якій кількості речовини відповідає нітратна кислота масою 12,6 г?
383. Яка маса 0,5 моль силікатної кислоти?
●●●● 384. Скільки атомів і молекул міститься в ортофосфатній кислоті масою 9,8 г?
385. Виведіть формулу кислоти, масові частки елементів в якій становлять: а) H – 2,04%, S – 32,66% і O – 65,3%; б) H – 3,06%, P – 31,6% і O – 65,34%.
www.chemistry.in.ua
Кислоти: приклади, таблиця. властивості кислот
Кислоти — це такі хімічні сполуки,які здатні віддавати електрично заряджений іон (катіон) водню, а також приймати два взаімодействущіх електрона, внаслідок чого утворюється ковалентний зв’язок.
У даній статті ми розглянемо основні кислоти, які вивчають в середніх класах загальноосвітніх шкіл, а також дізнаємося багато цікавих фактів про самих різних кислотах. Приступимо.
Кислоти: види
У хімії існує безліч найрізноманітнішихкислот, які мають найрізноманітніші властивості. Хіміки розрізняють кислоти за змістом в складі кисню, по летючості, по розчинності у воді, силі, стійкості, приналежності до органічного або неорганічного класу хімічних сполук. У даній статті ми розглянемо таблицю, в якій представлені найвідоміші кислоти. Таблиця допоможе запам’ятати назву кислоти і її хімічну формулу.
| Хімічна формула | Назва кислоти |
| H2S | сірководнева |
| H2SO4 | сірчана |
| HNO3 | азотна |
| HNO2 | азотистая |
| HF | плавикова |
| HCl | соляна |
| H3PO4 | фосфорна |
| H2CO3 | вугільна |
Отже, все наочно видно. В даній таблиці представлені найвідоміші в хімічній промисловості кислоти. Таблиця допоможе набагато швидше запам’ятати назви і формули.
сірководнева кислота
H2S — це сірководнева кислота. Її особливість полягає в тому, що вона ще й є газом. Сірководень дуже погано растоворяется в воді, а також взаємодіє з дуже багатьма металами. Сірководнева кислота відноситься до групи «слабкі кислоти», приклади яких ми розглянемо в даній статті.
H2S має трохи солодкуватий смак, а також дуже різкий запах тухлих яєць. У природі її можна зустріти в природному або вулканічному газах, а також вона виділяється при гнитті білка.
Властивості кислот дуже різноманітні, навіть якщокислота незамінна в промисловості, то може бути дуже некорисна для здоров’я людини. Дана кислота дуже токсична для людини. При вдиханні невеликої кількості сірководню у людини прокидається головний біль, починається сильна нудота і запаморочення. Якщо ж людина вдихне велику кількість H2S, то це може призвести до судом, коми або навіть миттєвої смерті.
Сірчана кислота
H2SO4 — це сильна сірчана кислота, з якою діти знайомляться на уроках хімії ще в 8-му класі. Хімічні кислоти, такі як сірчана, є дуже сильними окислювачами. H2SO4 діє як окислювач на дуже багато металів, а також основні оксиди.
H2SO4 при попаданні на шкіру або одяг викликає хімічні опіки, проте вона не так токсична, як сірководень.
Азотна кислота
У нашому світі дуже важливі сильні кислоти. Приклади таких кислот: HCl, H2SO4, HBr, HNO3. HNO3 — це всім відома азотна кислота. Вона знайшла широке застосування в промисловості, а також в сільському господарстві. Її використовують для виготовлення різних добрив, в ювелірній справі, при друку фотографій, у виробництві лікарських препаратів і барвників, а також у військовій промисловості.
Такі хімічні кислоти, як азотна, є дуже шкідливими для організму. пари HNO3 залишають виразки, викликають гострі запалення і подразнення дихальних шляхів.
азотистая кислота
Азотної кислоти дуже часто плутають з азотної, але різниця між ними є. Справа в тому, що азотистая кислота набагато слабкіше азотної, у неї зовсім інші властивості і дію на організм людини.
HNO2 знайшла широке застосування в хімічній промисловості.
плавикова кислота
Плавикова кислота (або фтороводород) — це розчи
uk.ruarrijoseph.com
Таблица «Названия кислот и кислотных остатков»
Таблица “Формулы, названия кислот и кислотных остатков”
К | Кислотный остаток | ||
н | формула | название | формула |
С | HCl | Хлорид | Cl – |
Плавиковая (фтороводородная) | HF | Фторид | F – |
Б | HBr | Бромид | Br – |
И | HI | Иодид | I – |
Х | HClO | Гипохлорит | ClO – |
Х | HClO3 | Хлорат | ClO3 – |
Х Хлористая | HClO4 HClO2 | Перхлорат Хлорит | ClO4 – ClO2 – |
А | HNO2 | Нитрит | NO2 – |
Азотная | HNO3 | Нитрат | NO3 – |
С | H | Сульфид Гидросульфид | S2 – HS – |
С | H2SO3 | Сульфит Гидросульфит | SO3 2 – HSO3 – |
С | H2SO4 | Сульфат Гидросульфат | SO4 2 – HSO4 – |
Угольная | H2CO3 | Карбонат Гидрокарбонат | СО3 2 – НСО3 – |
К Ортофосфорная | H2SiO3 H3PO4 | Силикат Ортофосфат Гидроортофосфат | SiO3 2 – РО4 3 – НРО4 2 – |
multiurok.ru
Класифікація кислот
Безоксигенові | Основ- ність | Назва кислотного залишку | Оксигено- вмісні | Основ- ність | Назва кислотного залишку |
HCl хлоридна | хлорид | H2CO3 карбонатна | ІІ | карбонат | |
HBr бромідна | І | бромід | H2SiО3 силікатна | ІІ | силікат |
H2S сульфідна | ІІ | сульфід | H2SO3 сульфітна | ІІ | сульфіт |
HI йодидна | І | йодид | H2SO4 сульфатна | ІІ | сульфат |
HF флуоридна | І | флуорид | H3PO4 ортофосфатна | ІІІ | ортофосфат |
H2Sе селенідна | ІІ | селенід | HNO3 нітратна | І | нітрат |
Одержання кислот
1. Взаємодія кислотного оксиду з водою (для оксигеновмісних кислот):
SO3 + H2O = H2SO4; P2O5 + 3H2O = 2H3PO4.
2. Взаємодія водню з неметалом і наступним розчиненням отриманого продукту у воді (для безоксигенових кислот):
H2 + Cl2 = 2HCl; H2 + S = H2S.
3. Реакціями обміну солей із кислотами:
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3;
2NaCl(т)
+ H2SO4 (конц.) 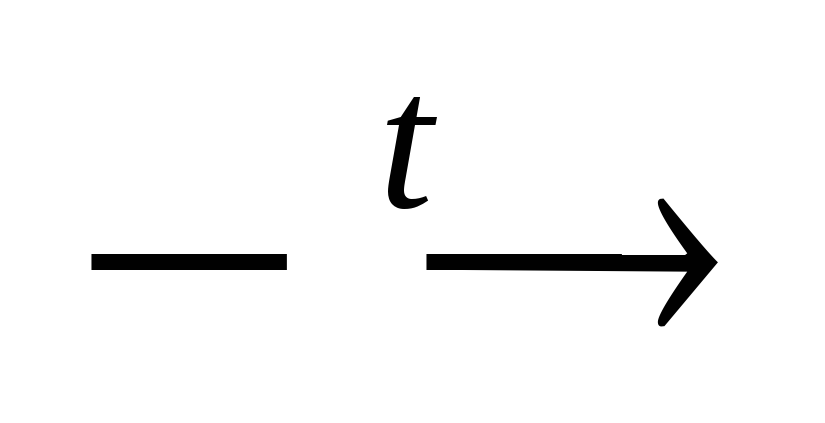
Якщо оксид відповідної кислоти з водою не взаємодіє, то таку кислоту одержують при дії сильної кислоти на відповідну сіль даної кислоти: Na2SiО3 + 2HCl = H2SiО3↓ + 2NaCl.
Хімічні властивості кислот
1. Взаємодія з основами (реакція нейтралізації):
H2SO4 + 2KOH = K2SO4 + 2H2O.
2. Взаємодія з основними оксидами:
CuO
+ 2HNO3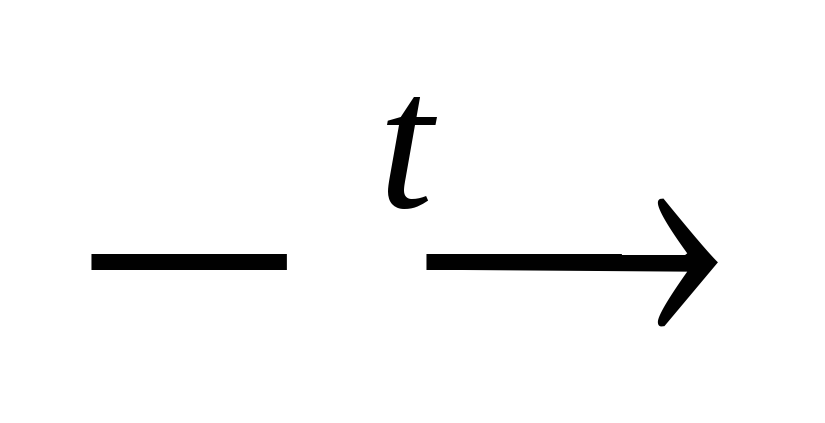 Cu(NO3)2 + H2O.
Cu(NO3)2 + H2O.
3. Взаємодія з металами по механізму окисно-відновних реакцій:
2Al + 6HCl = 2AlCl3 + 3H2↑;
3Cu + 8HNO3 (розведена) = 3Cu(NO3
4. Взаємодія із солями з утворенням газу чи осаду:
H2SO4 + BaCl2 = BaSO4↓ +2HCl;
2HCl + K2CO3 = 2KCl + H2O + CO2↑.
Основи – складні речовини, у яких атоми металів з’єднані з однією чи декількома гідроксидними групами. Кількість гідроксидних груп у молекулі основи означає її кислотність. Класифікація основ представлена в табл. 1.3, а їх хімічні властивості у табл. 1.4.
Таблиця 1.3
Класифікація основ
За розчинністю у воді | |||
Розчинні (луги): LiOH, CsOH, NaOH, KOH, RbOH, Ba(OH)2 | Нерозчинні: Fe(OH)3, Сu(OH)2, Аl(OH)3 | ||
За кислотністю | |||
Однокислотні: LiOH, NaOH, KOH, RbOH, CsOH, | Двокислотні: Ca(OH)2, Ba(OH)2, Cu(OH)2 | Трикислотні: Аl(OH)3, Fe(OH)3 | |
Одержання нерозчинних основ
Взаємодія розчинів солей і лугів:
Al2(SO4)3 + 6NaOH = 2Al(OH)3↓ + 3Na2SO4.
Одержання розчинних основ
1. Взаємодія активних металів (лужних і лужноземельних) з водою: 2Na + 2H2O = 2NaOH + H2↑;
Ca + 2H2O = Ca(OH)2 + H2↑.
2. Взаємодія оксидів активних металів з водою:
BaO + H2O = Ba(OH)2.
3. Електроліз водних розчинів солей:
2NaCl + 2H2O = 2NaOH + H2↑ + Cl2↑.
Таблиця 1.4
Хімічні властивості основ
Розчинні основи | Нерозчинні основи |
| |
2KOH + CO2 = K2CO3+ H2O; KOH + CO2 = KHCO3 | –– |
| |
NaOH + HNO3 = NaNO3 + H2O | Cu(OH)2+2HCl = CuCl2 + 2H2O |
| |
Ba(OH)2 + K2SO4 = 2KOH + BaSO4↓; 3KOH + Fe(NO3)3 = Fe(OH)3↓+3KNO3 | –– |
| |
–– | Cu(OH)2 |
Існують гідроксиди, які здатні вступати у взаємодію, і утворювати солі не тільки з кислотами, але й з основами. Такі гідроксиди називаються амфотерні. Прикладом можуть бути Al(OH)3, Zn(OH)2, Cr(OH)3, Be(OH)2, Ge(OH)2, Рb(OH)2. Хімічні властивості амфотерних гідроксидів представлені у табл. 1.5. Явище амфотерності пояснюється тим, що в молекулах амфотерних електролітів (ROH) міцність зв’язку між металом і Оксигеном незначно відрізняється від міцності зв’язку між Оксигеном і Гідрогеном. Дисоціація таких молекул можлива за місцем обох зв’язків:
R+ + OH– ⇄ ROH ⇄ H+ + RO–, де R – метал.
основа кислота
Таблиця 1.5
studfile.net
Кислоти: приклади, таблиця. властивості кислот
Кислоти — це такі хімічні сполуки,які здатні віддавати електрично заряджений іон (катіон) водню, а також приймати два взаімодействущіх електрона, внаслідок чого утворюється ковалентний зв’язок.
У даній статті ми розглянемо основні кислоти, які вивчають в середніх класах загальноосвітніх шкіл, а також дізнаємося багато цікавих фактів про самих різних кислотах. Приступимо.
Кислоти: види
У хімії існує безліч найрізноманітнішихкислот, які мають найрізноманітніші властивості. Хіміки розрізняють кислоти за змістом в складі кисню, по летючості, по розчинності у воді, силі, стійкості, приналежності до органічного або неорганічного класу хімічних сполук. У даній статті ми розглянемо таблицю, в якій представлені найвідоміші кислоти. Таблиця допоможе запам’ятати назву кислоти і її хімічну формулу.
| Хімічна формула | Назва кислоти |
| H2S | сірководнева |
| H2SO4 | сірчана |
| HNO3 | азотна |
| HNO2 | азотистая |
| HF | плавикова |
| HCl | соляна |
| H3PO4 | фосфорна |
| H2CO3 | вугільна |
Отже, все наочно видно. В даній таблиці представлені найвідоміші в хімічній промисловості кислоти. Таблиця допоможе набагато швидше запам’ятати назви і формули.
сірководнева кислота
H2S — це сірководнева кислота. Її особливість полягає в тому, що вона ще й є газом. Сірководень дуже погано растоворяется в воді, а також взаємодіє з дуже багатьма металами. Сірководнева кислота відноситься до групи «слабкі кислоти», приклади яких ми розглянемо в даній статті.
H2S має трохи солодкуватий смак, а також дуже різкий запах тухлих яєць. У природі її можна зустріти в природному або вулканічному газах, а також вона виділяється при гнитті білка.
Властивості кислот дуже різноманітні, навіть якщокислота незамінна в промисловості, то може бути дуже некорисна для здоров’я людини. Дана кислота дуже токсична для людини. При вдиханні невеликої кількості сірководню у людини прокидається головний біль, починається сильна нудота і запаморочення. Якщо ж людина вдихне велику кількість H2S, то це може призвести до судом, коми або навіть миттєвої смерті.
Сірчана кислота
H2SO4 — це сильна сірчана кислота, з якою діти знайомляться на уроках хімії ще в 8-му класі. Хімічні кислоти, такі як сірчана, є дуже сильними окислювачами. H2SO4 діє як окислювач на дуже багато металів, а також основні оксиди.
H2SO4 при попаданні на шкіру або одяг викликає хімічні опіки, проте вона не так токсична, як сірководень.
Азотна кислота
У нашому світі дуже важливі сильні кислоти. Приклади таких кислот: HCl, H2SO4, HBr, HNO3. HNO3 — це всім відома азотна кислота. Вона знайшла широке застосування в промисловості, а також в сільському господарстві. Її використовують для виготовлення різних добрив, в ювелірній справі, при друку фотографій, у виробництві лікарських препаратів і барвників, а також у військовій промисловості.
Такі хімічні кислоти, як азотна, є дуже шкідливими для організму. пари HNO3 залишають виразки, викликають гострі запалення і подразнення дихальних шляхів.
азотистая кислота
Азотної кислоти дуже часто плутають з азотної, але різниця між ними є. Справа в тому, що азотистая кислота набагато слабкіше азотної, у неї зовсім інші властивості і дію на організм людини.
HNO2 знайшла широке застосування в хімічній промисловості.
плавикова кислота
Плавикова кислота (або фтороводород) — це розчин H2O c HF. Формула кислоти — HF. Плавикова кислота дуже активно використовується в алюмінієвій промисловості. Нею розчиняють силікати, труять кремній, силікатне скло.
Фтороводород є дуже шкідливим для організмулюдини, в залежності від його концентрації може бути легким наркотиком. При попаданні на шкіру спочатку ніяких змін, але вже через кілька хвилин може з’явитися різкий біль і хімічний опік. Плавикова кислота дуже шкідлива для навколишнього світу.
Соляна кислота
HCl — це хлористий водень, є сильноюкислотою. Хлористий водень зберігає властивості кислот, що відносяться до групи сильних. На вигляд кислота прозора і безбарвна, а на повітрі димить. Хлористий водень широко застосовується в металургійній і харчовій промисловостях.
Дана кислота викликає хімічні опіки, але особливо небезпечно її потрапляння в очі.
Фосфорна кислота
Фосфорна кислота (H3PO4) — це по своїх властивостях слабка кислота. Але навіть слабкі кислоти можуть мати властивості сильних. Наприклад, H3PO4 використовують в промисловості для відновленнязаліза з іржі. Крім цього, форсфорная (або ортофосфорна) кислота широко використовується в сільському господарстві — з неї виготовляють безліч різноманітних добрив.
Властивості кислот дуже схожі — практично кожна з них дуже шкідлива для організму людини, H
uk.trendexmexico.com
Кислоты
Кислоты бывают:
бескислородные: хлороводородная (соляная) HCl, сероводородная H2S
кислородосодержащие: азотная HNO3, серная H2SO4 и т.д.
• По числу атомов водорода: одноосновные (HNO3), двухосновные (H2SO4) трехосновные (H3PO4).
• По растворимости: растворимые, нерстворимые (см. таблицу растворимости)
На рисунке слева представлена небольшая часть уже знакомой тебе таблицы растворимости. Под общим названием анионы расположены различные отрицательно заряженные ионы, кроме гидроксид иона ОН— все остальные – это ионы кислотных остатков.
При пересечении, например столбца иона водорода Н+ с ионом хлора Cl— мы видим ячейку в которой находится буква Р (растворяется). Это значит, что соляная кислота HCl растворяется в воде. Так определяют растворимость кислот.
Запомни: Оксид, которому соответствует кислота называется кислотный оксид: S > SO3 > H2SO4 . Кслотный оксид SO3, ему соотвествует серная кислота.
Вопрос: Как составить формулу оксида соответствующего данной кислоте?
Пример: Для серной кислоты составим соответствующий оксид. Для этого:
1. Определим степень окисления элементов в кислоте.
H2SO4 — формула серной кислоты
Степени окисления водорода и кислорода нам известны: водорода +1, кислорода -2. Неизвестна только степень окисления у серы. Обозначим её х. Подставим все степени окисления в формулу серной кислоты.
H2+1SхO4-2 т.к. для химического соединения в сумме все степени окисления равны 0, можно составить уравнение:
+1 • 2 + х + (-2) • 4 = 0
решим его:
2 + х – 8 = 0
Х = +6
все степени окисления известны: H2+1S+6O4-2
2. Степень окисления серы в серной кислоте +6. Составим оксид соответствующий серной кислоте: S+6O3-2или SO3.
Таблица кислот и оксидов
Табл.1
В таблице представленны формулы кислот, их названия и оксиды, соответствующие данной кислоте.
* * *
.
osievskaja.narod.ru
 ислота
ислота азвание
азвание оляная (хлороводородная)
оляная (хлороводородная)
 одоводородная
одоводородная лорноватая
лорноватая 2S
2S ерная
ерная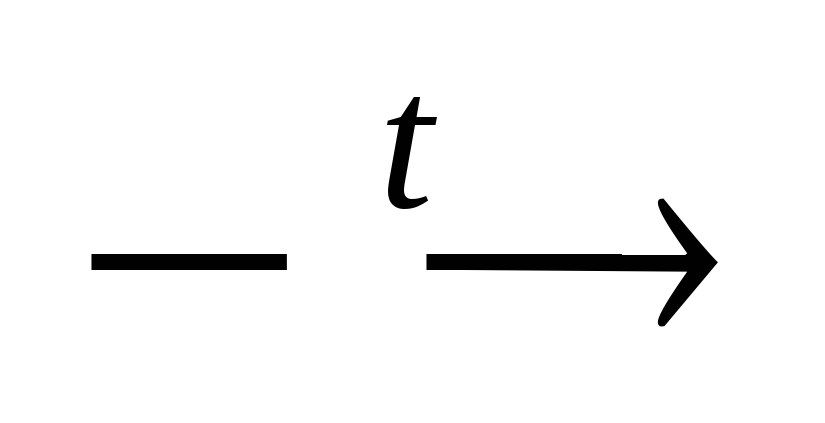 CuO + H2O
CuO + H2O