Углеводороды — Что такое Углеводороды?
Углеводороды (hydrocarbon) – это органические соединения, состоящие из углерода и водорода.Углеводороды служат фундаментальной основой органической химии: молекулы любых других органических соединений рассматривают как их производные.
Соотношения между углеродом и водородом в углеводородах колеблются в широких пределах (10-90 %).
Соединения углеводородов отличаются друг от друга количеством атомов углерода и водорода, строением углеродного скелета и типом связей между атомами.
Большинство углеводородов в природе встречаются в сырой нефти.
Кроме того, основными источниками углеводородов являются природный газ, сланцевый газ, попутный нефтяной газ, горючие сланцы, уголь, торф.
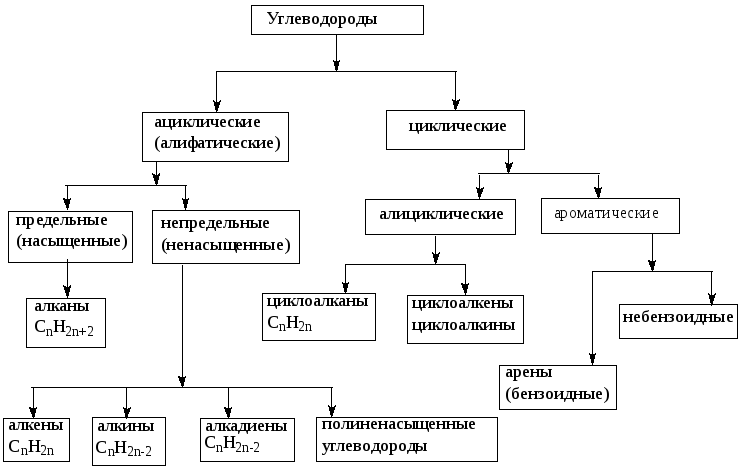
Классификация углеводородов
Алканы (парафины) – углеводороды общей формулы CnH2n+2, в молекулах которых атомы углерода связаны между собой σ-связью, а остальные их валентности предельно насыщены атомами водорода.
Отсюда другое название алканов – предельные углеводороды.
Первым представителем данного гомологического ряда является метан СН4.
Алкены (олефины) относятся к непредельным углеводородам общей формулы CnH2n.
В молекуле алкена кроме σ-связей содержится одна π-связь.
Первый представитель гомологического ряда – этилен С2Н4, поэтому алкены называют также «этиленовыми углеводородами».
Диеновые углеводороды содержат в молекуле 2 двойные связи.
Общая формула СnН2n-2.
Первым представителем ряда является бутадиен СН2=СН–СН=СН2.
Алкинами называются углеводороды общей формулы CnH2n-2, молекулы которых содержат тройную связь.
Первый представитель гомологического ряда – ацетилен С

Молекулы циклоалканов содержат циклы разной величины, атомы углерода в которых связаны между собой только σ-связью.
Общая формула СnH2n.
Циклоалкены содержат одну двойную связь и имеют общую формулу СnН2n-2.
Углеводороды, имеющие кратные связи, легко вступают в реакции присоединения по месту разрыва π-связей.
Ароматические углеводороды (арены) – углеводороды общей формулы CnH2n-6.
Первые представители ароматических углеводородов были выделены из природных источников и обладали своеобразным запахом, поэтому и получили название «ароматические».
Важнейшим представителем ароматических углеводородов является бензол С6Н6.
В молекуле бензола 6 атомов углерода, соединяясь σ-связями, образуют правильный шестиугольник.

Природные источники углеводородов
Каменный уголь – плотная осадочная порода черного, иногда сepo-черного цвета, дающая на фарфоровой пластинке черную черту.
Каменный уголь представляет собой продукт глубокого разложения остатков растений, погибших миллионы лет назад (древовидных папоротников, хвощей и плаунов, а также первых голосеменных растений).
В органическом веществе угля содержится 75-92 % углерода, 2,5-5,7 % водорода, 1,5-15 % кислорода.
Международное название элемента углерода происходит от лат. carbō («уголь»).
Природный газ – полезное ископаемое, основным компонентом которого является метан СН4
(75-98 %).В природном газе содержатся также его ближайшие гомологи: этан С2Н6, пропан С3Н8, бутан С4Н10 и следовые количества более тяжелых легкокипящих углеводородов.
Существует следующая закономерность: чем выше относительная молекулярная масса углеводорода, тем меньше его количество в природном газе.

Содержание сероводорода и его органических производных (тиолов) в природном газе в сумме может достигать 5-25 %.
Попутные нефтяные газы – газы, которые находятся в природе над нефтью или растворены в ней под давлением.
Их состав может быть выражен примерным соотношением компонентов: метан – 31 %, этан – 7,5 %, пропан – 21,5 %,
бутан – 20 %, пентан и гексан (легкокипящие жидкости) – 20 %.
С каждой тонной добытой нефти выделяется около 50 м
Первым предприятием в России, на котором стали использовать попутные нефтяные газы, стала Сургутская ГРЭС.
6 основных энергоблоков, работающих на попутном газе, были введены в строй в 1985-1988 гг.
В настоящее время попутные нефтяные газы улавливают и используют как топливо (в том числе и автомобильное) и ценное химическое сырье.
Нефть – смесь углеводородов от светло-бурого до черного цвета с характерным запахом.
Нефть намного легче воды и в ней не растворяется.
В зависимости от происхождения нефть может содержать большое количество алифатических, циклических или ароматических углеводородов.
Так, например, бакинская нефть богата циклоалканами и содержит сравнительно небольшое количество алифатических предельных углеводородов.
Пермская нефть содержит ароматические углеводороды.
В небольших количествах в состав нефти могут входить также кислородсодержащие соединения, как, например, альдегиды, кетоны, эфиры и карбоновые кислоты.
Классификация органических соединений. Углеводороды. Производные углеводородов. Изомерия и гомология органических соединений
facebook.com/groups/DPVA.ru»>Таблицы DPVA.ru — Инженерный Справочник | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Химия для самых маленьких. Шпаргалки. Детский сад, Школа. Поделиться:
 Введите свой запрос: Введите свой запрос: | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. Вложите в письмо ссылку на страницу с ошибкой, пожалуйста. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Коды баннеров проекта DPVA.ru Начинка: KJR Publisiers Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | |||||||||||||||||||||||||||||||||||||||||||||||||||||
Углеводороды. Полимеры. Химия, 8–9 класс: уроки, тесты, задания.
1.
|
Общие формулы
Сложность: лёгкое |
1 |
| 2. |
Названия углеводородов
Сложность: лёгкое |
1 |
3.
|
Определения понятий
Сложность: лёгкое |
1 |
| 4. |
Реакции углеводородов
Сложность: среднее |
1 |
5.
|
Химические свойства
Сложность: среднее |
2 |
| 6. |
Расставь коэффициенты
Сложность: среднее |
2 |
7.
|
Выбери формулу
Сложность: среднее |
2 |
| 8. |
Число атомов водорода
Сложность: сложное |
3 |
9.
|
Выбери гомологи
Сложность: сложное |
4 |
Таблица 7. Классификация опасности веществ / КонсультантПлюс
Таблица 7
(Извлечения из ГОСТ 12.1.007)
КЛАССИФИКАЦИЯ ОПАСНОСТИ ВЕЩЕСТВ
Наименование показателя | Нормы для класса опасности | |||
1-го | 2-го | 3-го | 4-го | |
Предельно допустимая концентрация (ПДК) вредных веществ в воздухе рабочей зоны, мг/куб. | Менее 0,1 | 0,1 — 1,0 | 1,1 — 10,0 | Более 10,0 |
Средняя смертельная доза при введении в желудок, мг/кг | Менее 15 | 15 — 150 | 151 — 5000 | Более 5000 |
Средняя смертельная доза при нанесении на кожу, мг/кг | Менее 100 | 100 — 500 | 501 — 2500 | Более 2500 |
Средняя смертельная концентрация в воздухе, мг/куб. м | Менее 500 | 500 — 5000 | 5001 — 50000 | Более 50000 |
Коэффициент возможности ингаляционного отравления (КВИО) | Более 300 | 300 — 3 | 29 — 3 | Менее 3 |
Зона острого действия | Менее 6,0 | 6,0 — 18,0 | 18,1 — 54 | Более 54,0 |
Зона хронического действия | Более 10,0 | 10,0 — 5,0 | 4,9 — 2,5 | Менее 2,5 |
Примечания. 1. К 1-му классу опасности относятся: тетраэтилсвинец, пары ртути, хромовый ангидрид, хроматы, бихроматы и др.
1. К 1-му классу опасности относятся: тетраэтилсвинец, пары ртути, хромовый ангидрид, хроматы, бихроматы и др.
2. Ко 2-му классу опасности относятся: анилин, формальдегид, фосфористый водород, цианистый водород и др.
3. К 3-му классу опасности относятся: сероводород в смеси с углеводородами, окиси азота, пыль, содержащая от 10 до 90% свободных SiO2, метиловый спирт и др.
4. К 4-му классу опасности относятся: нафталин, оксид углерода, нитросоединения метана, этана, пропана, бутана, этиловый спирт, этиловый (диэтиловый) эфир, бензин, керосин и др.
13.1.8. Производственная пыль-витающие в воздухе и медленно оседающие твердые частицы веществ размерами от нескольких десятков до долей микрометра (мкм).
13.1.9. При попадании в организм человека пыль может вызвать различные заболевания (поражаются органы дыхания, воздействует раздражающе на кожный покров, вызывая заболевания кожи, на глаза, раздражая слизистые оболочки и вызывая заболевания глаз, и др.).
13. 1.10. Вредное действие пыли зависит от многих факторов (физико-химических свойств пыли, размеров и формы пылинок, концентрации пыли в воздухе, продолжительности действия на организм и др.).
1.10. Вредное действие пыли зависит от многих факторов (физико-химических свойств пыли, размеров и формы пылинок, концентрации пыли в воздухе, продолжительности действия на организм и др.).
13.1.11. Наиболее вредны пыли таких веществ, как диоксиды кремния, угля, силикатов, свинца, меди, хрома, бериллия и др.
13.1.12. Наиболее распространенное заболевание при воздействии пыли-пневмокониоз. В зависимости от вида пыли, вызвавшей заболевание, различают силикоз (при воздействии пыли, содержащей диоксид кремния), асбестоз (от пыли асбеста), антракоз (от угольной пыли) и т.д.
13.1.13. При вдыхании запыленного воздуха часть пылевых частиц проникает вглубь легочных тканей и оседает на альвеолах легких, вызывая разрастание соединительных тканей, т.е. развивается пневмокониоз. Наиболее сильное вредное действие проявляют токсичные пыли, оказывающие физико-химическое воздействие на ткани верхних дыхательных путей и легких (пыли ядохимикатов, аэрозоли металлов и др.).
13.1. 14. Основное по борьбе с пылью — предупреждение ее образования, что достигается заменой пылящих материалов влажными или пастообразными, подавлением пыли водяным орошением, герметизацией. При невозможности полностью предотвратить пылевыделение применяют местную приточно-вытяжную вентиляцию и индивидуальные защитные средства.
14. Основное по борьбе с пылью — предупреждение ее образования, что достигается заменой пылящих материалов влажными или пастообразными, подавлением пыли водяным орошением, герметизацией. При невозможности полностью предотвратить пылевыделение применяют местную приточно-вытяжную вентиляцию и индивидуальные защитные средства.
13.1.15. Все работники организации, применяющей опасные химические вещества, должны быть обучены приемам оказания первой доврачебной помощи. В каждом цехе и на каждом обособленном производственном участке должна быть аптечка с набором медикаментов, составленным по указанию работников здравпункта.
13.1.16. При отравлениях или воздействии агрессивных веществ пострадавшему должна быть оказана первая доврачебная помощь.
13.1.16.1. Наиболее распространенным является поступление отравляющих веществ через верхние дыхательные пути. При этом виде отравления необходимо, прежде всего, прекратить дальнейшее поступление яда в организм, необходимо вывести пострадавшего из загрязненной среды в теплое, проветриваемое, чистое помещение или на свежий воздух. Затем необходимо освободить пострадавшего от стесняющей дыхание одежды — расстегнуть воротник, пояс; снять одежду, адсорбировавшую газ или облитую ядовитым веществом, так как во многих случаях такая одежда является дополнительным источником поступления яда в организм через кожу.
Затем необходимо освободить пострадавшего от стесняющей дыхание одежды — расстегнуть воротник, пояс; снять одежду, адсорбировавшую газ или облитую ядовитым веществом, так как во многих случаях такая одежда является дополнительным источником поступления яда в организм через кожу.
13.1.16.2. При попадании ядовитого вещества на кожу необходимо обмыть загрязненный участок теплой (не горячей) водой с мылом. При этом необходимо предохранять пострадавшего от охлаждения и, если необходимо, согреть (грелкой, одеялом).
13.1.16.3. При остановке или глубоких нарушениях дыхания длительно, до прибытия врача, необходимо проводить искусственное дыхание.
13.1.16.4. Следует помнить, что при отравлении некоторыми веществами, при резком раздражении слизистых оболочек верхних дыхательных путей и спазме голосовой щели, искусственное дыхание недопустимо. Такие случаи должны быть специально оговорены в инструкциях по охране труда. Технике искусственного дыхания должен быть обучен каждый работающий с СДЯВ.
13.1.16.5. При попадании на кожный покров ядовитых веществ (жидких или твердых) необходимо осторожно их удалить влажным тампоном, фильтровальной бумагой или смыть водой.
13.1.16.6. При химических ожогах кислотами и щелочами необходимо длительно промыть пораженный участок большим количеством воды. Для этого вблизи рабочих зон, где возможны химические ожоги, должны быть специальные краны-гидранты. Для промывки глаз должны быть установлены фонтанчики, а там, где водопровод отсутствует, должны быть предусмотрены емкости с чистой, регулярно сменяемой водой.
13.1.17. Для защиты органов дыхания должны применяться фильтрующие (при ограниченном содержании вредных веществ) и изолирующие (при неограниченном содержании вредных веществ в воздухе) противогазы.
Фильтрующая коробка для противогаза с соответствующим поглотителем должна подбираться в зависимости от газов и паров, от воздействия которых необходимо обеспечить защиту органов дыхания (табл. 8).
Классификация углеводородов (ациклические, циклические).
 Предельные углеводороды (алканы), общая формула состава, гомологический ряд, гомологическая разность.Физические свойства.
Предельные углеводороды (алканы), общая формула состава, гомологический ряд, гомологическая разность.Физические свойства.Конспект урока химии в 10 классе
Тема урока:Классификация углеводородов (ациклические, циклические). Предельные углеводороды (алканы), общая формула состава, гомологический ряд, гомологическая разность.Физические свойства.
Лабораторный опыт №1.Моделирование молекул углеводородов
Задачи:
Познакомить учащихся с понятиями «гомологический ряд», «гомология», «общая формула» на примере алканов.
Развить понятие об «изомерии» для этого класса углеводородов и научить учащихся давать названия алканам по международной номенклатуре
Рассказать о применении предельных углеводородов в жизни человека
Оборудование:
Мультимедийный комплекс
Шаростержневые модели атомов: по одному атому углерода и четырем атомам водорода
Бензин, парафиновая свеча
Ход урока
Организационный этап
Актуализация опорных знаний и мотивация учебной деятельности
Постановка целей урока
Изучение нового материала
ПОНЯТИЕ: Алканы (парафины, предельные или насыщенные углеводороды) – это углеводороды, в молекулах которых между атомами углерода присутствуют только одинарные связи, т.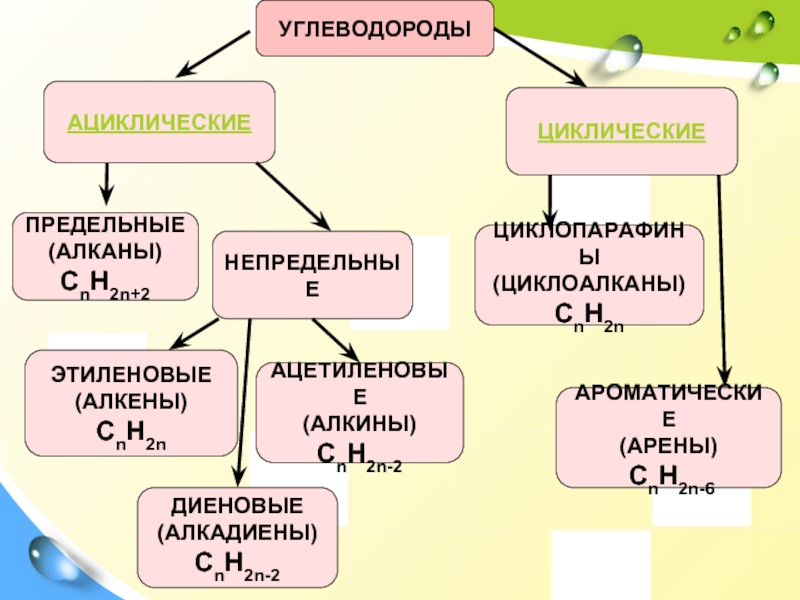 е. атомы углерода до предела заполнены атомами водорода.
е. атомы углерода до предела заполнены атомами водорода.
ОБЩАЯ ФОРМУЛА: СnН2n+2, где nmin = 1.
НОМЕНКЛАТУРА: у всех суффикс -АН
ГОМОЛОГИЧЕСКИЙ РЯД:
СН4 – метан
С2Н6 – этан
С3Н8 – пропан
С4Н10 – бутан
С5Н12 – пентан
С6Н14 – гексан
С7Н16 – гептан
С8Н18 – октан
С9Н20 – нонан
С10Н22– декан
СТРОЕНИЕ:
Валентный угол: 109°28′. Все связи – σ (сигма). Длина связи
С–С равна 0,154 нм. Тип гибридизации в молекулах алканов: sp3.
ИЗОМЕРИЯ: Для алканов характерен только один вид изомерии: изомерия цепи (углеродного скелета). СН3
СН3
Например, три изомера для С5Н12: |
Формулы:
а) СН3–СН2–СН2–СН2–СН3 б) СН3–СН–СН2–СН3 в) СН3– С–СН3.
| |
СН3 СН3
Названия: н-пентан 2-метилбутан 2,2-диметилпропан
НАХОЖДЕНИЕ В ПРИРОДЕ: В природе алканы очень распространены. Главными источниками являются природный газ (содержит 85–98 % метана, 3–12 % этана и другие алканы), попутный нефтяной газ (содержит до 45 % метана, до 25 % этана и другие алканы), нефть (содержит смесь различныхалканов от С5 до С30 и выше), каменный уголь.
ПОЛУЧЕНИЕ:
Особые методы получения метана:
1. Прямым синтезом: C+ 2H2CH4↑
2. *Из карбида алюминия: Al4C3 + 12H2O→ 3CH4↑+ 4Al(OH)3↓
ФИЗИЧЕСКИЕ СВОЙСТВА: При обычных условиях (t° = 20°C) алканы с С1 по С4 – газы, с С5 по С15 – жидкости, а начиная с С17 – твердые вещества. *Температуры кипения и плавления, а также вязкость и плотность алканов постепенно увеличиваются (в связи с увеличением молекулярной массы). При одинаковой массе разветвлённые алканы имеют более низкие температуры кипения и боле высокие температуры плавления, чем неразветвлённые. Плотности всех алканов меньше единицы, т.е. они легче воды. В воде алканы не растворимы, но хорошо растворимы в органических неполярных растворителях (бензоле, толуоле, эфире и др.).
*Температуры кипения и плавления, а также вязкость и плотность алканов постепенно увеличиваются (в связи с увеличением молекулярной массы). При одинаковой массе разветвлённые алканы имеют более низкие температуры кипения и боле высокие температуры плавления, чем неразветвлённые. Плотности всех алканов меньше единицы, т.е. они легче воды. В воде алканы не растворимы, но хорошо растворимы в органических неполярных растворителях (бензоле, толуоле, эфире и др.).
Лабораторный опыт №1.
Моделирование молекул углеводородов
Цель: изготовить шаростержневые модели молекул метана, пропана, цис- и транс-изомеров молекулы бутена-2; развивать представления о существовании различных способов моделирования молекул органических соединений.
Оборудование: набор для построения шаростержневых моделей молекул органических соединений.
Выполнение опыта
1. Запишите в таблицу соответствующие формулы метана, пропана, цис- и транс-изомеров молекулы бутена-2.
Укажите длину связей С—С, С=С и величины валентных углов Н—С—Н и Н—С—С в третьем столбце таблицы.
2. Составьте шаростержневую модель молекулы метана:
— возьмите из набора шарик черного цвета, который будет символизировать атом углерода, и необходимое число шариков белого цвета, которые будут символизировать атомы водорода;
— используя детали набора, необходимые для соединения шариков, составьте шаростержневую модель молекулы метана.
3. Составьте шаростержневую модель молекулы пропана:
— исходя из модели молекулы метана, составьте модель молекулы пропана;
— отнимите от модели молекулы метана шарик белого цвета (символ атома водорода) и на его место прикрепите черный шарик (символ атома углерода), к которому добавьте еще один шарик — символ другого атома углерода;
— далее, используя детали набора, необходимые для построения модели молекулы, дополните ее до модели молекулы пропана;
— проверьте возможность вращения атомов углерода вокруг одинарной связи С—С.
4. Зарисуйте модель молекулы пропана, отражающую пространственное изображение связей, используя обозначения: темный клин — это связи, выступающие над плоскостью рисунка, пунктирная линия — связи, уходящие за плоскость рисунка, сплошная линия — связи, лежащие в плоскости рисунка.
5. Составьте шаростержневые модели цис- и транс-изомеров молекулы бутена-2:
— используйте тот же способ построения модели, что и для пропана;
— проверьте возможность совмещения моделей изомеров друг с другом и вращения атомов вокруг связи С=С с переходом на модели любого изомера.
6. Выводы:
а) (Какие существуют способы моделирования молекул органических соединений?):
Плоскостные (полные структурные и скелетные структурные) и объемное (шаростержневые)
б) (Какие положения теории химического строения органических соединений учитывались при составлении моделей молекул углеводородов?):
Атомы соединяются в молекулах согласно валентности; атомы и группы атомов взаимно влияют друг на друга.
Первичное закрепление знаний
ТЕСТЫ С ОДНИМ ПРАВИЛЬНЫМ ОТВЕТОМ по теме «АЛКАНЫ»
1. Общая формула алканов …
А CnH2n; Б CnH2n-4; В CnH2n-2; Г CnH2n+2; Д CnH2n-6.
2. Какой ряд веществ состоит только из алканов …
А С2Н4; С5Н8; С6Н12; Б С3Н8; С5Н12; С10Н22; В С6Н12; С8Н16; С9Н18;
Г С6Н6; С7Н8; С8Н10; Д правильного ответа нет.
3. Изомерия цепи для алканов возможна с …
А пропана; Б пентана; В этана; Г бутана; Д метана.
4. Метан, этан, пропан и бутан являются …
А твёрдыми веществами; Б жидкостями; В бесцветными газами;
Г веществами, хорошо растворимыми в воде; Д правильного ответа нет.
5. Этан в одну стадию можно получить из …
А пропана; Б метана; В этилена; Г угля; Д правильного ответа нет.
6. Число изомеров пентана равно …
А 4; Б 3; В 5; Г 2; Д правильного ответа нет.
7. Для алканов наиболее характерными реакциями являются …
А замещения; Б присоединения; В полимеризации;
Г отщепления; Д правильного ответа нет.
Каталитический риформинг бензинов, установка и гидроочистка бензиновых фракций
(cправочная информация)
Процесс каталитического риформинга бензиновых фракций (риформинга бензинов) является одним из важнейших процессов современной нефтеперерабатывающей и нефтехимической промышленности. Процесс риформинга предназначен для производства высокооктановых компонентов автомобильных бензинов и для производства легких ароматических углеводородов – бензола, толуола и ксилолов. Весьма важным продуктом процесса риформинга является водородсодержащий газ с высоким содержанием водорода, который используется для гидроочистки широкого ассортимента нефтяных фракций, для процесса гидрокрекинга тяжелых нефтяных фракций и других гидрогенизационных процессов.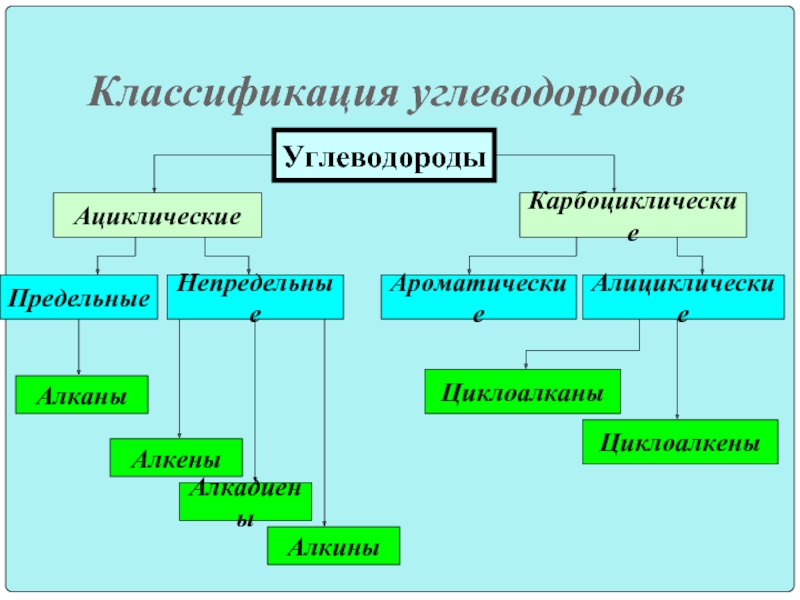
Процесс каталитического риформинга является сложным химическим процессом. Это обусловлено, прежде всего, химическим составом исходного сырья процесса – разнообразных бензиновых фракций. В состав так называемой широкой фракции бензина входит более 150 углеводородов. Это углеводороды трех основных групп: парафиновые углеводороды нормального и изостроения, нафтеновые углеводороды с пятичленными и шестичленными циклами с одной или несколькими замещающими алкильными группами и ароматические углеводороды, которые обычно представлены бензолом, толуолом, ксилолами и незначительным количеством более тяжелых алкилбензолов. Среди парафинов преобладают углеводороды нормального строения и монометилзамещенные структуры. Нафтены представлены гомологами циклопентана и циклогексана.
Научные основы процесса каталитического риформинга были подготовлены работами русских учёных. Так ещё в 1911г. Н.Д. Зелинским была показана возможность дегидрогенизации шестичленных нафтеновых углеводородов при температуре выше 300°С над платиновым и палладиевым катализаторами количественно, практически без побочных реакций. В том же году дегидрогенизацию нафтеновых углеводородов при контакте их с оксидом металлов осуществили В.Н. Ипатьев и Н. Довгелевич. В 1936г. в СССР одновременно в трёх лабораториях была открыта реакция непосредственной дегидроциклизации парафиновых углеводородов в ароматические. Б.Л. Молдавский и Г.Д. Камушер в ГИВДс осуществили дегидроциклизацию парафинов на оксиде хрома при температуре 450-470°С. В.И. Каржёв, М.Г. Северьянова и А.Н. Сиова во ВНИГИ наблюдали реакции дегидроциклизации парафинов на меднохромовом катализаторе при температуре 500-550°С. Б.А. Казанский и А.Ф. Платэ в МГУ показали возможность дегидроциклизаци парафиновых углеводородов в присутствии платинированного угля при температуре 300-310°С.
В том же году дегидрогенизацию нафтеновых углеводородов при контакте их с оксидом металлов осуществили В.Н. Ипатьев и Н. Довгелевич. В 1936г. в СССР одновременно в трёх лабораториях была открыта реакция непосредственной дегидроциклизации парафиновых углеводородов в ароматические. Б.Л. Молдавский и Г.Д. Камушер в ГИВДс осуществили дегидроциклизацию парафинов на оксиде хрома при температуре 450-470°С. В.И. Каржёв, М.Г. Северьянова и А.Н. Сиова во ВНИГИ наблюдали реакции дегидроциклизации парафинов на меднохромовом катализаторе при температуре 500-550°С. Б.А. Казанский и А.Ф. Платэ в МГУ показали возможность дегидроциклизаци парафиновых углеводородов в присутствии платинированного угля при температуре 300-310°С.
Основой процесса каталитического риформинга бензинов являются реакции, приводящие к образованию ароматических углеводородов. Это реакции дегидрирования шестичленных и дегидроизомеризации пятичленных нафтеновых углеводородов, дегидроциклизация парафиновых углеводородов. Кроме того, второй по значимости в процессе каталитического риформинга является реакция изомеризации углеводородов.
Кроме того, второй по значимости в процессе каталитического риформинга является реакция изомеризации углеводородов.
Наряду с изомеризацией пятичленных и шестичленных нафтенов изомеризации подвергаются парафиновые и ароматические углеводороды. Существенную роль в процессе играют реакции гидрокрекинга парафинов, сопровождающиеся газообразованием. При каталитическом риформинге протекают также реакции раскрытия пятичленного кольца нафтенов с образованием соответствующих парафиновых углеводородов.
Типы установок риформинга бензиновых фракций
В настоящее время трудно найти завод, технология переработки нефти на котором не предусматривала бы каталитического риформирования. Развитие процесса каталитического риформинга было обусловлено длительной тенденцией роста октановых чисел товарных бензинов на фоне постепенного отказа от использования тетраэтилсвинца, как октаноповышающей добавки, а также ростом спроса на ароматические углеводороды. Таким образом, каталитический риформинг прочно занял место базового процесса современной нефтепереработки.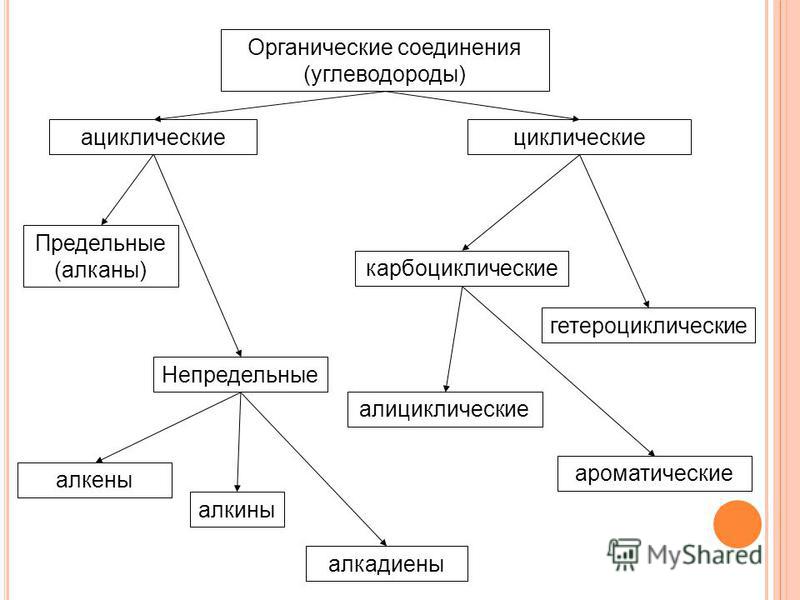
Эволюция процесса состояла в увеличении глубины превращения сырья, селективности ароматизации углеводородов и стабильности работы катализаторов. За весь период использования процесса выход ароматических углеводородов и водорода (целевые продукты) увеличился более чем в 1,5 раза, а межрегенерационный цикл работы катализатора — в 4 раза. Эти результаты достигнуты, прежде всего, за счет разработки новых катализаторов, повлекших за собой совершенствование технологии процесса. Сменилось, по меньшей мере, три поколения катализаторов, непременным компонентом которых всегда оставалась платина. Прогресс в технологии процесса выразился в снижении рабочего давления более чем в 10 раз (с 4,0 до 0,35 МПа) и разработке нового типа реакторных устройств непрерывного риформинга (системы CCR).
Технологическое оформление процесса каталитического риформинга определяется по способу проведения регенерации катализатора. Подавляющее большинство установок риформинга описывают тремя разновидностями технологий: полурегенеративный, циклический и процесс с непрерывной регенерацией катализатора. Наибольшее количество установок работает по полурегенеративному варианту. Например, платформинг фирмы ЮОП лицензирован примерно на 600 установках, магнаформинг фирмы Энгельгард осуществляется более чем на 150 установках, процесс ренийформинг фирмы Шеврон используется более чем на 70 установках, наконец, технология Французского института нефти лицензирована более чем на 60 установках мира. В России практически все установки каталитического риформинга (за исключением трех – в Уфе, Нижнем Новгороде и Омске) работают в полурегенеративном варианте.
Наибольшее количество установок работает по полурегенеративному варианту. Например, платформинг фирмы ЮОП лицензирован примерно на 600 установках, магнаформинг фирмы Энгельгард осуществляется более чем на 150 установках, процесс ренийформинг фирмы Шеврон используется более чем на 70 установках, наконец, технология Французского института нефти лицензирована более чем на 60 установках мира. В России практически все установки каталитического риформинга (за исключением трех – в Уфе, Нижнем Новгороде и Омске) работают в полурегенеративном варианте.
Технологические параметры работы установок риформинга по полурегенеративному варианту: давление- от 1.3 до 3.0 МПа, температура- от 480 до 530?С, октановое число (ИОЧ) колеблется от 94 до 100, выход риформата от 80 до 88% мас. Межрегенерационный цикл работы катализатора составляет от года до трех лет.
Второй тип технологии – циклический – применяется в основном на заводах США и характеризуется более жесткими условиями проведения процесса (давление 0. 9-2.1 МПа, температура 505-550?С) и, как следствие, небольшими межрегенерационными циклами (от 40 до 5 суток). Октановое число риформата (ИОЧ) – от 95 до 103. Катализатор до полной отработки может выдерживать до 600 регенераций. К циклическому варианту относится процесс пауэрформинг фирмы Эксон (около 100 установок) и ультраформинг фирмы Амоко Ойл Ко (~150 установок).
9-2.1 МПа, температура 505-550?С) и, как следствие, небольшими межрегенерационными циклами (от 40 до 5 суток). Октановое число риформата (ИОЧ) – от 95 до 103. Катализатор до полной отработки может выдерживать до 600 регенераций. К циклическому варианту относится процесс пауэрформинг фирмы Эксон (около 100 установок) и ультраформинг фирмы Амоко Ойл Ко (~150 установок).
Наконец, третий тип технологии каталитического риформинга представляет собой процесс с непрерывной регенерацией катализатора. Данная технология наиболее прогрессивна, так как позволяет работать в лучших термодинамических условиях (давление – 0.35-0.9 МПа, температура –до 550?С) без остановки на регенерацию (межремонтный пробег установок риформинга достигает 3-х лет и более) и достигнуть максимального октанового числа риформата (ИОЧ=102-104).
Первая установка запущена по лицензии фирмы ЮОП в 1971 году, в 1983году эксплуатировалось 35 установок, а в настоящее время работает 163 установки (в том числе 40 с давлением 0,35 МПа) по лицензии ЮОП и 56 установок по лицензии Французского института нефти.
Классификация промышленных установок риформинга
В России подавляющее большинство установок каталитического риформинга относится к классу полурегенеративного типа. Установки каталитического риформинга состоят из двух блоков. На первой стадии исходное сырье подвергается предварительной гидроочистке бензиновых фракций с целью практически полного удаления присутствующих в нем примесей органических соединений серы, азота, кислорода, хлора и др., являющихся ядами для катализаторов, используемых в процессе каталитического риформинга. На второй стадии гидроочищенное сырье подвергается непосредственно каталитическому риформингу.
Упрощенная принципиальная схема блока каталитического риформинга представлена на рис. 1.
Сырье – стабильный гидрогенизат с блока, где происходит гидроочистка бензиновых фракций поступает на прием сырьевого насоса Н-1, который подает его в тройник смешения на смешение с циркулирующим водородсодержащим газом (ВСГ), поступающим с выкида циркуляционного компрессора ЦК-1.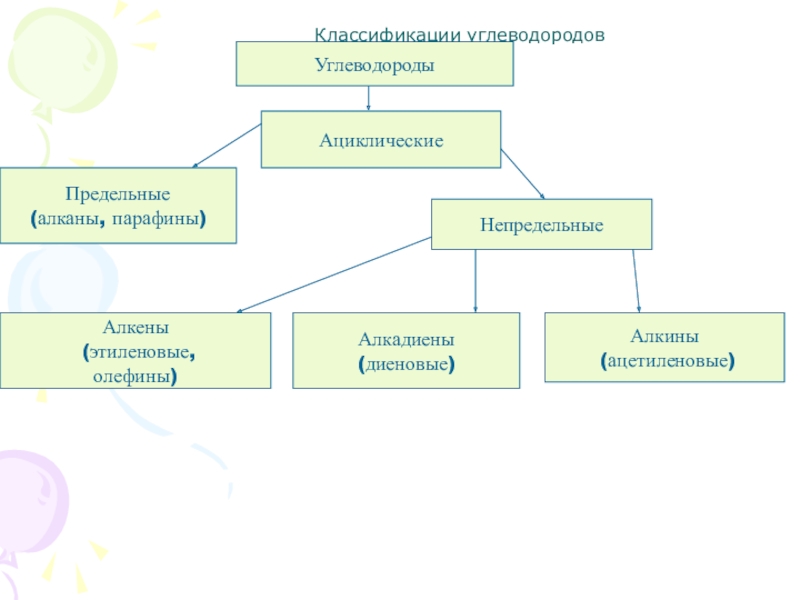 Смесь сырья и ВСГ в теплообменнике Т-1 подогревается газопродуктовым потоком, выходящим из реактора Р-3, подогревается в первой секции печи П-1 и поступает в реактор Р-1, затем подогревается во второй секции П-1, проходит реактор Р-2, затем проходит третью секцию печи П-1 и проходит в реактор Р-3. Газопродуктовая смесь после реактора Р-3 отдает часть своего тепла газосырьевому потоку в теплообменнике Т-1, охлаждается в воздушном холодильнике ВХ-1, в водяном холодильнике Х-1 и поступает в газосепаратор С-1. Здесь происходит отделение водородсодержащего газа от жидкого продукта – нестабильного катализата. Водородсодержащий газ из сепаратора С-1 направляется на удаление избыточной влаги в адсорбер А-1 (или минует его по байпасу) и поступает на прием циркуляционного компрессора ЦК-1, который вновь подает его на смешение с сырьем.
Смесь сырья и ВСГ в теплообменнике Т-1 подогревается газопродуктовым потоком, выходящим из реактора Р-3, подогревается в первой секции печи П-1 и поступает в реактор Р-1, затем подогревается во второй секции П-1, проходит реактор Р-2, затем проходит третью секцию печи П-1 и проходит в реактор Р-3. Газопродуктовая смесь после реактора Р-3 отдает часть своего тепла газосырьевому потоку в теплообменнике Т-1, охлаждается в воздушном холодильнике ВХ-1, в водяном холодильнике Х-1 и поступает в газосепаратор С-1. Здесь происходит отделение водородсодержащего газа от жидкого продукта – нестабильного катализата. Водородсодержащий газ из сепаратора С-1 направляется на удаление избыточной влаги в адсорбер А-1 (или минует его по байпасу) и поступает на прием циркуляционного компрессора ЦК-1, который вновь подает его на смешение с сырьем.
Избыток ВСГ направляется на блок гидроочистки бензиновых фракций или в водородное кольцо завода. Нестабильный катализат из сепаратора С-1 подогревается в теплообменнике Т-2 потоком стабильного катализата и поступает в среднюю часть колонны К-1 на стабилизацию – отделение растворенных в нем газообразных углеводородов. Верхом колонны К-1 выводятся легкие углеводороды до бутанов включительно. Пары охлаждаются и конденсируются в воздушном холодильнике ВХ-2 и водяном холодильнике Х-2 и поступает в емкость орошения Е-1. Жидкий продукт из Е-1 поступает на прием насоса Н-2, который подает его в качестве холодного орошения на верхнюю тарелку колонны К-1. Балансовый избыток выводится на ГФУ или в парк в виде жидкого газа. Несконденсировавшиеся газы из емкости Е-1 сбрасываются в топливную сеть.
Верхом колонны К-1 выводятся легкие углеводороды до бутанов включительно. Пары охлаждаются и конденсируются в воздушном холодильнике ВХ-2 и водяном холодильнике Х-2 и поступает в емкость орошения Е-1. Жидкий продукт из Е-1 поступает на прием насоса Н-2, который подает его в качестве холодного орошения на верхнюю тарелку колонны К-1. Балансовый избыток выводится на ГФУ или в парк в виде жидкого газа. Несконденсировавшиеся газы из емкости Е-1 сбрасываются в топливную сеть.
Стабильный катализат риформинга выводится снизу колонны К-1, проходит теплообменник Т-2, охлаждается в воздушном холодильнике ВХ-3, водяном холодильнике Х-3 и направляется в парк в качестве готового продукта. Подвод тепла в низ колонны К-1 осуществляется циркуляцией части стабильного катализата через печь П-2 под нижнюю тарелку колонны. Для компенсации уноса части хлора с поверхности катализатора схемой предусмотрена дозированная подача раствора хлорорганического соединения на вход первого либо в каждый из реакторов.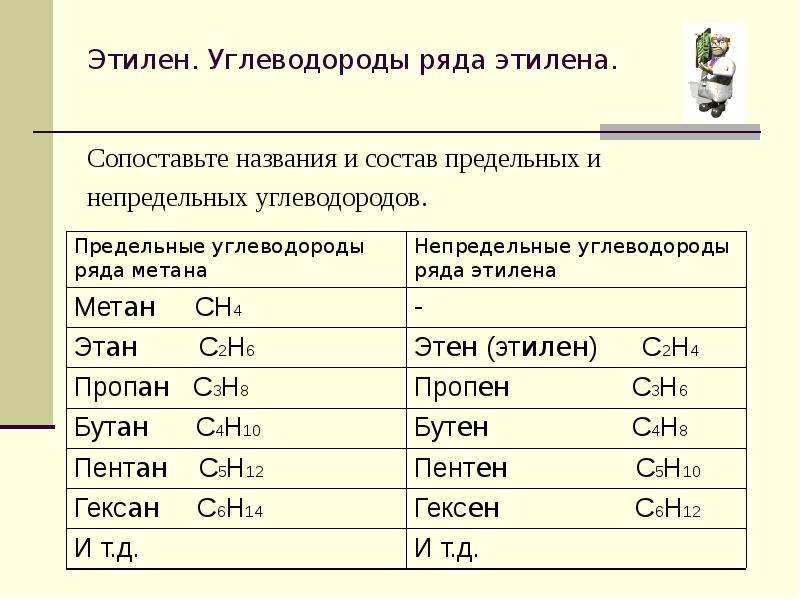 Для поддержания водно-хлорного баланса в зоне катализа предусматривается дозированная подача воды в реакторный блок, включая возможность подачи отдельно в каждый реактор.
Для поддержания водно-хлорного баланса в зоне катализа предусматривается дозированная подача воды в реакторный блок, включая возможность подачи отдельно в каждый реактор.
Для выполнения операции осернения катализатора в пусковой период схемой предусматривается дозированная подача в реакторный блок раствора сероорганического соединения. Схемой предусмотрена также подача в каждый реактор хлорорганического соединения для выполнения операции реактивации катализатора риформинга.
Таблица 2. Установки риформинга для производства бензина (по типовым проектам)
Установки каталитического риформинга, предназначенные для производства компонента автомобильного бензина, состоят из двух основных блоков – блока, где происходит гидроочистка бензиновых фракций и блока риформинга. Исключением является установка Л-35-5/300, которая, являясь первенцем промышленных установок риформинга, первоначально была спроектирована в виде самостоятельного блока каталитического риформинга. Эта установка работает в комплексе с отдельно стоящей типовой установкой гидроочистки Л-24-300.
Эта установка работает в комплексе с отдельно стоящей типовой установкой гидроочистки Л-24-300.
Таблица 3. Установки каталитического риформинга для производства ароматических углеводородов (по типовым проектам)
Значительно более сложный технологический комплекс представляет собой установка каталитического риформинга, предназначенная для производства ароматических углеводородов. В этот комплекс кроме блока гидроочистки и блока риформинга входит также блок экстракции ароматических углеводородов из катализата риформинга и блок четкой ректификации для разделения ароматического экстракта с получением ароматических углеводородов товарного качества. В табл. 2. представлена краткая характеристика основных типов установок риформинга, предназначенных для производства компонента автомобильного бензина. В табл. 3. представлена краткая характеристика типовых установок риформинга, предназначенных для производства ароматических углеводородов. Представленные данные характеризуют установки по материалам типовых проектов.
Таблица 4. Объем системы установок риформинга
В табл. 4 даны объемы систем блоков гидроочистки и риформинга. Эти данные необходимы для расчетов расхода водородсодержащего газа и технического азота на период пуска установок и регенерации катализатора. Принципиальные технологические схемы блока, где происходит гидроочистка бензиновых фракций и риформинга практически идентичны. Но имеются некоторые отличия, которые заключаются в основном в аппаратурном оформлении отдельных узлов установок, прежде всего, узлов стабилизации нестабильного катализата риформинга. Для установок, предназначенных для производства высокооктанового компонента автобензина характерно увеличение производственной мощности по перерабатываемому сырью с 300 тыс. т/год до 600 тыс. т/год и до 1000 тыс. т/год, что диктовалось необходимостью увеличения производства высокооктановых автомобильных бензинов. Все установки, предназначенные для производства ароматических углеводородов, имели одинаковую производительность – 300 тыс. т/год по сырью. Установки, рассчитанные на переработку высоконафтенистого сырья, имели реакторные узлы, состоящие из четырех реакторов – четырех ступеней реакции. Это установки типа Л-35-12/300, Л-35-12/300А и Л-35-13/300А. Остальные установки этого рода имели реакторные узлы из трех ступеней реакции.
т/год по сырью. Установки, рассчитанные на переработку высоконафтенистого сырья, имели реакторные узлы, состоящие из четырех реакторов – четырех ступеней реакции. Это установки типа Л-35-12/300, Л-35-12/300А и Л-35-13/300А. Остальные установки этого рода имели реакторные узлы из трех ступеней реакции.
Катализаторы риформинга
В процессе каталитического риформинга используются катализаторы, основой которых является платина, равномерно распределенная на носителе – оксиде алюминия, промотированном хлором (в редких случаях фтором). Природа активной поверхности катализаторов риформинга базируется на модели бифункционального их действия, предложенной в 1953г. Маилсом. Диспергированная на поверхности носителя платина является катализатором реакций гидрирования-дегидрирования, а носитель – галоидированный оксид алюминия – катализатором реакций кислотно-основного типа – изомеризации, циклизации, крекинга.
Новейшими исследованиями, выполненными в последнее время, было обнаружено, что часть высокодисперсной нанесенной на носитель платины по своим физическим, адсорбционным и химическим характеристикам не соответствует характеристикам металлической платины.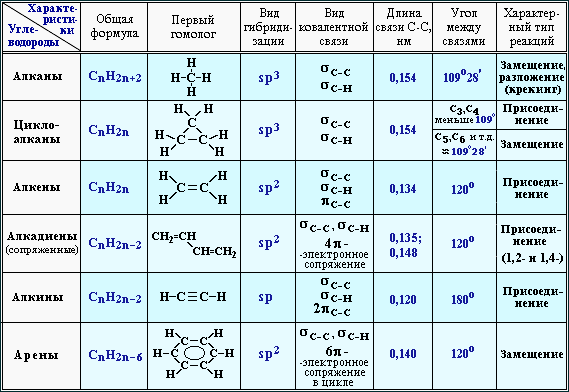 Эта платина получила название электронодефицитной и обозначается символом Ptσ в отличие от металлической платины, которая обозначается символом Pt?. Характерной особенностью электронодефицитной платины является ее способность образовывать прочную хемосорбционную связь с молекулами воды. По этому признаку все поверхностные атомы платины на катализаторе различаются на два состояния: Pt? и Ptσ. Эта же характерная особенность электронодефицитной платины позволяет оценивать ее количество на поверхности катализатора.
Эта платина получила название электронодефицитной и обозначается символом Ptσ в отличие от металлической платины, которая обозначается символом Pt?. Характерной особенностью электронодефицитной платины является ее способность образовывать прочную хемосорбционную связь с молекулами воды. По этому признаку все поверхностные атомы платины на катализаторе различаются на два состояния: Pt? и Ptσ. Эта же характерная особенность электронодефицитной платины позволяет оценивать ее количество на поверхности катализатора.
Главной характерной особенностью электронодефицитной платины Ptσ является ее высокая активность в реакции дегидроциклизации парафиновых углеводородов – основополагающей реакции процесса каталитического риформинга бензиновых фракций. Скорость реакции дегидроциклизации парафиновых углеводородов с участием платины Ptσ в десять-пятнадцать раз выше скорости с участием металлической платины Pt?. Электронодефицитная платина Ptσ входит в состав поверхностных комплексов PtClxOyLz, являющихся продуктами сильного взаимодействия предшественника платины с поверхностными группами и дефектами γ- или η-оксидов алюминия,являющегося основным носителем катализаторов риформинга. Характерными признаками состояния Ptσ являются предельная дисперсность, ионные состояния платины, наличие лигандов L, связанных с носителем, отсутствие связи Pt-Pt,высокая устойчивость к спеканию. Установлена линейная зависимость между константой скорости дегидроциклизации парафинового углеводорода и содержанием платины Ptσ в катализаторе, что дает основание отнести Ptσ к активным центрам ароматизации парафинов, обладающих комплексом свойств, обуславливающих высокую активность и селективность действия в сложной реакции дегидроциклизации парафиновых углеводородов.
Характерными признаками состояния Ptσ являются предельная дисперсность, ионные состояния платины, наличие лигандов L, связанных с носителем, отсутствие связи Pt-Pt,высокая устойчивость к спеканию. Установлена линейная зависимость между константой скорости дегидроциклизации парафинового углеводорода и содержанием платины Ptσ в катализаторе, что дает основание отнести Ptσ к активным центрам ароматизации парафинов, обладающих комплексом свойств, обуславливающих высокую активность и селективность действия в сложной реакции дегидроциклизации парафиновых углеводородов.
Разработанные технологии приготовления современных катализаторов риформинга направлены на получение катализаторов с максимальным содержанием электронодефицитной платины Ptσ. Наиболее активные и стабильные современные промышленные катализаторы содержат в своем составе до 55 % Ptσ от общего содержания платины в катализаторе.
Большинство промышленных катализаторов риформинга приготовлено с использованием в качестве носителя γ-Al2O3, обладающей большей термической стабильностью.
Для усиления и регулирования кислотной функции оксид алюминия промотируют галоидом – фтором или хлором. Фторсодержащие катализаторы используются весьма ограниченно, в случаях, когда процесс риформинга осуществляют без предварительной гидроочистки сырья или при высокой влажности. Абсолютное большинство катализаторов риформинга приготовлены на основе хлорированного оксида алюминия. Преимуществом катализаторов, приготовленных на хлорированном оксиде алюминия, является возможность регулирования содержания хлора на поверхности катализаторов, а, следовательно, и уровень их кислотности, непосредственно в условиях эксплуатации. Это объясняется тем, что хлор является подвижным промотором, он слабо связан с поверхностью носителя и легко замещается гидроксилами воды.
Количество хлора на поверхности оксида алюминия определяется равновесием реакции:
Это обстоятельство привело к необходимости во время эксплуатации поддерживать над поверхностью катализатора вполне определенную концентрацию паров воды, при которой в катализаторе содержится оптимальное количество хлора, и которое, как правило, находится в пределах 0,9-1,2 масс. %. Содержание хлора на поверхности катализатора является функцией мольного отношения вода: хлор в зоне реакции, удельной поверхности Al2О3 и прочности удерживания хлора на катализаторе.
%. Содержание хлора на поверхности катализатора является функцией мольного отношения вода: хлор в зоне реакции, удельной поверхности Al2О3 и прочности удерживания хлора на катализаторе.
Высока роль хлора в создании активной поверхности катализатора, в создании поверхностных комплексов, обеспечивающих стабильную работу катализаторов в жестких условиях процесса. Поверхностные комплексы имеют примерный состав PtσnClxOyLz, где σ=2; n≥1; x+y+z≤4; в качестве лигандов L могут быть ионы S, углеводородные радикалы (влияние реакционной среды).
Наконец, без хлора невозможно восстановление высокой дисперсности платины на носителе в период реактивации платиновых катализаторов.
В настоящее время в промышленной практике используются модифицированные би- и полиметаллические катализаторы риформинга, приготовленные на хлорированном оксиде алюминия, в которых наряду с платиной содержатся другие элементы периодической системы. Модификаторами для катализаторов риформинга являются рений, олово, титан, германий, иридий, свинец, цирконий, марганец.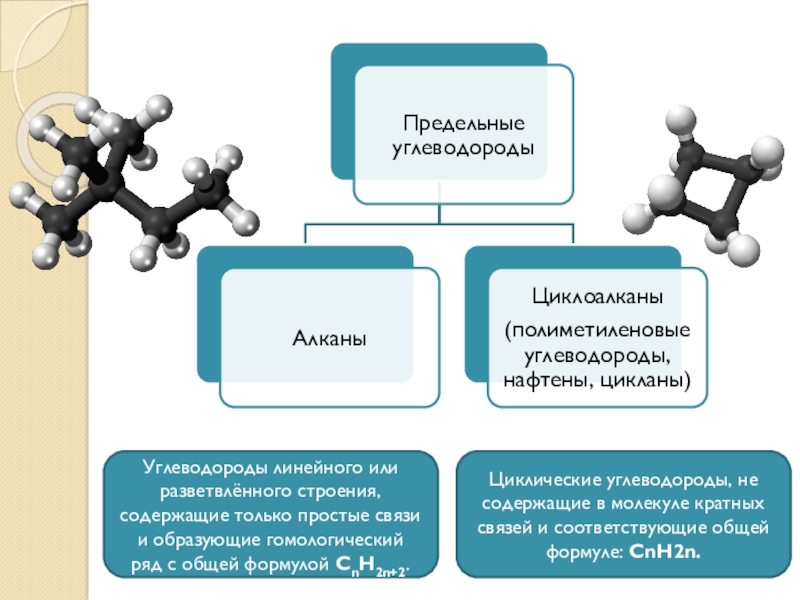
Основным преимуществом модифицированных полиметаллических катализаторов риформинга является их высокая стабильность, выражающаяся в том, что снижение активности в условиях процесса происходит значительно медленнее, чем у монометаллических платиновых катализаторов.
Поскольку основной причиной дезактивации катализаторов риформинга в цикле реакции является их закоксовывание, повышение стабильности при введении модифицирующих металлов связано с воздействием на процесс коксоотложения. Характер этого воздействия, его механизм зависит от природы применяемого модификатора.
В промышленной практике процесса риформинга наибольшее распространение получили алюмоплатиновые катализаторы, модифицированные рением – платинорениевые катализаторы, в отдельных случаях с добавками третьего компонента.
Информация данного раздела приведена исключительно в справочных целях. Информацию о продукции и услугах ООО «НПП Нефтехим» Вы найдете в разделах Главное меню/Разработки и Услуги.
Углеводород — определение, типы, классификация, примеры
Что такое углеводород?
Углеводороды , такие как алифатические, ароматические или полиядерные ароматические углеводороды, представляют собой типы органических соединений, перерабатывающих водород и углерод во всей молекулярной формуле, по крайней мере, с одной одинарной, двойной или тройной связью в двух соседних атомах углерода. Когда органические соединения, образованные двумя или более атомами углерода одной химической связью, называются насыщенными углеводородами. Если соединение, содержащее хотя бы одну пару соседних атомов углерода, нравится несколько химических связей, называется ненасыщенными углеводородами в органической химии.
Состав углеводородов
Электронная конфигурация валентной оболочки углерода в молекуле углеводородов, 2s 2 2p x 1 2p y 1 2p z . Когда электрон с 2s-орбитали продвигается к вакантной 2p z -орбитали и гибридизуется с образованием четырех эквивалентных гибридных орбиталей sp 3 . Эти четыре гибридизированных орбитали атомов углерода смешиваются с атомом водорода с образованием насыщенных органических соединений.Но для sp 2 и sp-гибридизации атом углерода не насыщается валентностью четыре.
Эти четыре гибридизированных орбитали атомов углерода смешиваются с атомом водорода с образованием насыщенных органических соединений.Но для sp 2 и sp-гибридизации атом углерода не насыщается валентностью четыре.
Химические свойства углеводорода
Растворимость углеводородов показывает, что молекула углеводорода почти не растворяется в воде, но быстро растворяется в спирте или растворе эфира. Когда мы говорим об алканах, силы притяжения — это лишь слабые силы Ван-дер-Ваальса. Дипольный момент углеводорода, как и всех алканов с прямой или разветвленной цепью, будет равен нулю. Нулевая полярность этих углеводородов связана с уравновешиванием ковалентной связи C-H оставшейся алкильной функциональной группой.
Положение области электромагнитного спектра группы C-H зависит от атома углерода. Следовательно, диапазон частот растяжения углеводородов следующий: первичный углерод> вторичный углерод> третичный углерод.
Классификация углеводородов
По реакционной способности углеводороды подразделяются на два основных класса, такие как насыщенные и ненасыщенные углеводороды. Термин насыщенный углеводород означает углерод, насыщенный по четвертой валентности, но ненасыщенный углерод не насыщен по четвертой валентности.В соответствии со структурой в химии углеводороды подразделяются на два типа: открытые, циклические или замкнутые, насыщенные и ненасыщенные органические соединения, присутствующие в окружающей среде.
Термин насыщенный углеводород означает углерод, насыщенный по четвертой валентности, но ненасыщенный углерод не насыщен по четвертой валентности.В соответствии со структурой в химии углеводороды подразделяются на два типа: открытые, циклические или замкнутые, насыщенные и ненасыщенные органические соединения, присутствующие в окружающей среде.
Насыщенные углеводороды
Список органических соединений, содержащих два или более атомов углерода, связанных только одной химической связью, называется термином насыщенные соединения или углеводороды. Метан, этан, пропан, бутан, пентан являются примерами насыщенных углеводородов с открытой цепью, поскольку эти соединения образуются углеродными и водородными связями.Циклоалканы (циклопропан, циклобутан, циклопентан, циклогексан) являются примерами циклических насыщенных углеводородов.
Ненасыщенный углеводород
Соединение, которое содержит по крайней мере одну кратную связь в соседних атомах углерода, называется ненасыщенным углеводородом. Если органические соединения имеют хотя бы одну двойную связь, они называются алкенами или олефинами. Если в органических соединениях есть хотя бы одна тройная связь, они соответственно называются алкинами (ацетиленами). Но в ацетальдегиде кратные связи между соседним углеродом и атомом кислорода не считаются ненасыщенными.
Если органические соединения имеют хотя бы одну двойную связь, они называются алкенами или олефинами. Если в органических соединениях есть хотя бы одна тройная связь, они соответственно называются алкинами (ацетиленами). Но в ацетальдегиде кратные связи между соседним углеродом и атомом кислорода не считаются ненасыщенными.
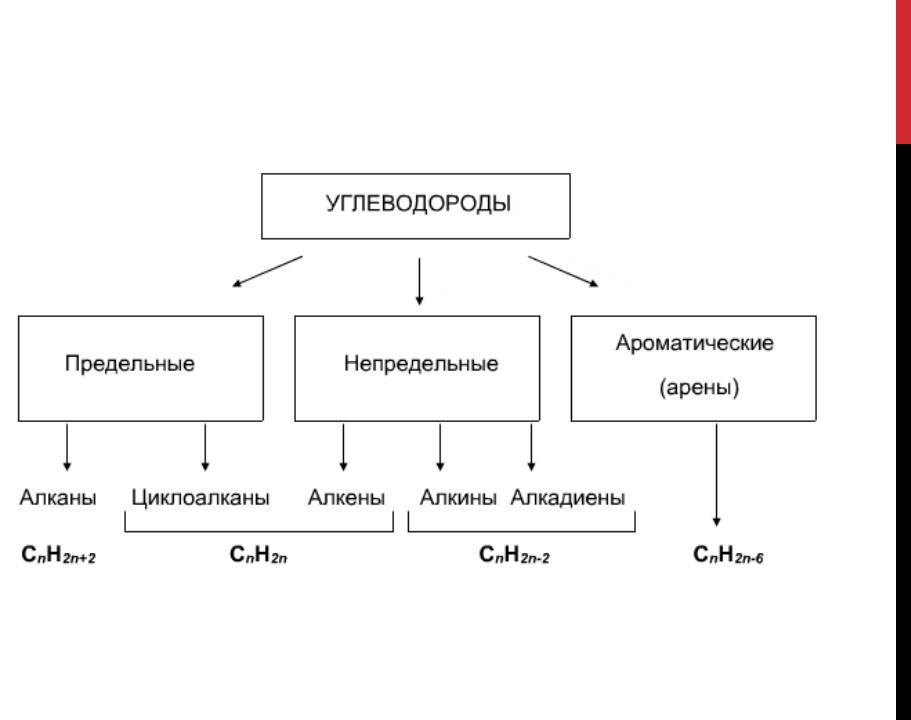
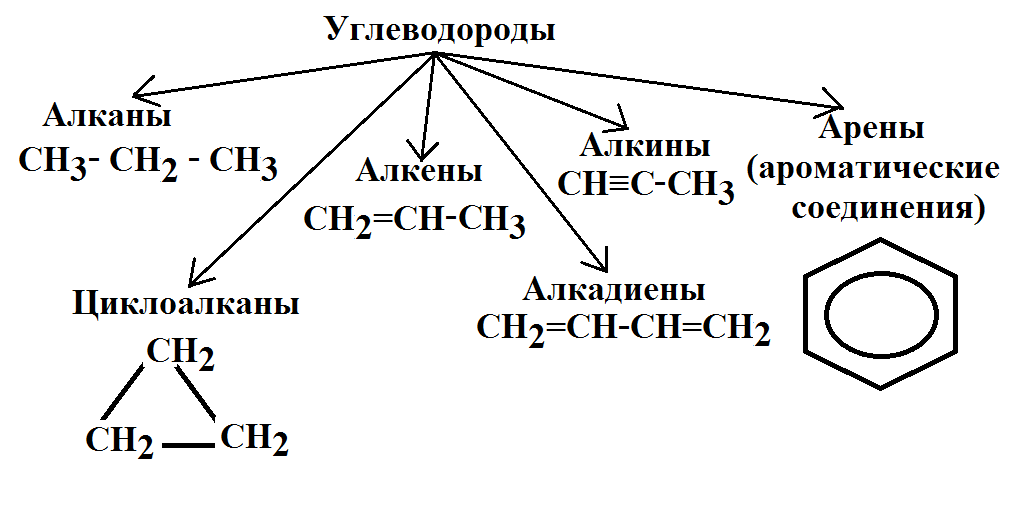
Алканы, алкены и алкины
- Алканы или парафин — это насыщенный тип углеводородов, которые содержат одинарные связи на соседних атомах углерода, полученные из природных источников, таких как сырая нефть. Общая молекулярная формула алканов: C n H 2n + 2 .
- Алкен или олефин — это ненасыщенный углеводород, который содержит по крайней мере одну двойную связь или олефиновую химическую связь на двух соседних атомах углерода. Общая молекулярная формула алкенов: C n H 2n .
- Алкин представляет собой органический углеводород, который содержит по крайней мере одну тройную связь или ацетиленовую связь на двух соседних атомах углерода с общей молекулярной формулой C n H n .

Углеводород циклический
Когда атомы углерода и водорода образуют замкнутую кольцевую структуру, это называется карбоциклическими или гомоциклическими соединениями. Циклические соединения проявляют алифатические характеристики, называемые алициклическими углеводородами. Насыщенные типы циклических углеводородов берут название соответствующих углеводородов с открытой цепью, продолжается суффиксами цикло.Эти соединения вместе называются циклопарафинами или циклоалканами. Если циклический углеводород ненасыщенный, то этот углеводород называют циклоалкенами.
Соединения алифатические и ароматические
С развитием химии органические соединения делятся в основном на два типа, которые произносятся как алифатические и ароматические углеводороды.
Углеводороды алифатические
Алифатические названия углеводородов даны от жирных кислот, но сегодня эти соединения известны как соединения с открытой цепью.Поэтому несколько примеров насыщенных или ненасыщенных углеводородов из природных источников называют алифатическими углеводородами.
Углеводороды ароматические
Название ароматического типа углеводорода происходит от греческой приставки aroma, означающей ароматный запах. Подробные характеристики показывают, что ароматическое углеводородное соединение содержит кольцо с ароматическим свойством. Большинство молекул углеводородов связано с бензольным кольцом или производным бензола. Циклическое бензоидное соединение имеет ароматические свойства, но свойства этих соединений полностью отличаются от свойств молекул алициклических углеводородов.
Источники углеводородов
Природная сырая нефть или минеральные масла являются основными источниками алифатических, ароматических и циклических углеводородов, таких как метан, этан, пропан, циклоалкен и т. Д.
Природный газ — это еще один источник углеводородов, который определяет большие количества газообразных веществ с недиссоциированным жидким нефтяным топливом, используемым в качестве ежедневного источника энергии. Когда природный газ не содержит углеводородов, выше этана называют обедненным или сухим газом. Если он содержит более высокий член углеводородов, они называются богатыми или влажными газами.
Если он содержит более высокий член углеводородов, они называются богатыми или влажными газами.
Что входит в состав сырой нефти?
Сырая нефть в окружающей среде нашей Земли содержит в основном газы с встречающимися в природе углеводородами в сжиженной форме или в твердой форме, растворенной в жидких растворителях. Плотность и состав сырой нефти варьируются в зависимости от места нахождения, но все насыщенные органические соединения в основном представляют собой жидкие углеводороды. Следовательно, сырая нефть содержит список изопарафиновых алканов, циклоалкенов или нафтенов, а также ароматических или полиядерных ароматических углеводородов.Помимо углеводорода, существуют также известные производные углеводородов, содержащие кислород, азот, серу и твердый кристаллический атом металла.
Углеводороды в нефти
Естественно, сырая нефть подразделяется на два типа, например, парафиновая и асфальтовая, которая содержит углеводородные соединения, такие как алкан и нафталин. Согласно этой классификации сырая нефть из Пенсильвании, Ирана и Румынии содержит парафин, но из Баку, Венесуэла — это асфальтовый углеводород.Также из Техаса, Мексика, Оклахома представляет собой промежуточный тип углеводородов.
Согласно этой классификации сырая нефть из Пенсильвании, Ирана и Румынии содержит парафин, но из Баку, Венесуэла — это асфальтовый углеводород.Также из Техаса, Мексика, Оклахома представляет собой промежуточный тип углеводородов.
Состав природного газа
Термин «природный газ» означает общее количество газообразных углеводородов, содержащихся в отработанных сжиженных газах. Следовательно, основной компонент природного газа варьируется в зависимости от источника. Следовательно, природный газ состоит в основном из первых шести алканов или углеводородов, и процент присутствия уменьшается с увеличением молекулярной массы.
Фракционная перегонка природного газа
Углеводород, отделенный от природного газа путем фракционной перегонки под давлением, используется в нашей повседневной жизни для различных целей производства энергии.Окисление природного газа в контролируемых условиях дает смесь органического альдегида, кислоты, ацетона и спирта, которую мы используем в различных отраслях химической промышленности. Такие углеводороды, как метан, этан, пропан, бутан, пентан и гексан, получаются при сжигании природного газа при температуре около 200-300 ° C при давлении 1-200 атм в присутствии химического катализатора.
Такие углеводороды, как метан, этан, пропан, бутан, пентан и гексан, получаются при сжигании природного газа при температуре около 200-300 ° C при давлении 1-200 атм в присутствии химического катализатора.
Крекинг углеводородов
Диссоциация термической связи органических молекул, таких как углеводород, известна как пиролиз.Термический скрип дает список углеводородов или классов алканов из высшего члена семейства алканов. Следовательно, алкан разлагается до низших алканов за счет удельной теплоемкости от 500 ° C до 600 ° C. Продукт, полученный из данного алкана, зависит от структуры, приложенного давления и используемого катализатора.
- Термическое разложение списка углеводородов, таких как декан, с получением низшего октана алкана и этилена.
- При использовании подходящих катализаторов происходит циклизация алканов, содержащих шесть или более атомов углерода.Следовательно, в присутствии химического элемента платины в качестве катализатора углеводородный декан подвергается циклизации с образованием бензола.

Крекинг нефти
Органическое топливо, такое как скрип нефтяного масла, используется для добычи наиболее распространенных жидких углеводородов, таких как алифатические, ароматические, полиароматические углеводороды. Например, наиболее важный список углеводородов, таких как метан, этан, этан, пропан, бутан и изобутен, получают из органических топлив, которые содержат до четырех атомов углерода в своей молекулярной формуле.
Углеводородов
16.1 Углеводороды
Цели обучения
- Укажите алканы, алкены, алкины и ароматические соединения.
- Перечислить некоторые свойства углеводородов.
Простейшие органические соединения состоят всего из двух элементов: углерода и водорода. Эти соединения называются углеводородами. Органическое соединение, состоящее из углерода и водорода. Сами углеводороды делятся на два типа: алифатические углеводороды и ароматические углеводороды. Алифатические углеводороды Углеводород на основе цепочек атомов C. представляют собой углеводороды на основе цепочек атомов C. Есть три типа алифатических углеводородов. Алканы — алифатический углеводород с одинарными ковалентными связями. представляют собой алифатические углеводороды только с одинарными ковалентными связями. Алкены — алифатический углеводород, содержащий двойную связь C – C. представляют собой углеводороды, содержащие по крайней мере одну двойную связь C – C, и алкины — алифатический углеводород, содержащий тройную связь C – C. углеводороды, содержащие тройную связь C – C.Иногда мы находим алифатический углеводород с кольцом из атомов углерода; эти углеводороды называют циклоалканов (или циклоалкенов или циклоалкинов ).
Алифатические углеводороды Углеводород на основе цепочек атомов C. представляют собой углеводороды на основе цепочек атомов C. Есть три типа алифатических углеводородов. Алканы — алифатический углеводород с одинарными ковалентными связями. представляют собой алифатические углеводороды только с одинарными ковалентными связями. Алкены — алифатический углеводород, содержащий двойную связь C – C. представляют собой углеводороды, содержащие по крайней мере одну двойную связь C – C, и алкины — алифатический углеводород, содержащий тройную связь C – C. углеводороды, содержащие тройную связь C – C.Иногда мы находим алифатический углеводород с кольцом из атомов углерода; эти углеводороды называют циклоалканов (или циклоалкенов или циклоалкинов ).
Ароматические углеводороды Углеводород, содержащий бензольное кольцо. имеют специальное шестиуглеродное кольцо, называемое бензольным кольцом . Электроны в бензольном кольце обладают особыми энергетическими свойствами, которые придают бензолу физические и химические свойства, заметно отличающиеся от алканов. Первоначально термин ароматический использовался для описания этого класса соединений, потому что они были особенно ароматными.Однако в современной химии термин ароматический означает наличие шестичленного кольца, которое придает молекуле различные уникальные свойства.
Первоначально термин ароматический использовался для описания этого класса соединений, потому что они были особенно ароматными.Однако в современной химии термин ароматический означает наличие шестичленного кольца, которое придает молекуле различные уникальные свойства.
У простейших алканов атомы C связаны в прямую цепь; они называются нормальными алканами. Они названы в соответствии с количеством атомов углерода в цепи. Самый мелкий алкан — метан:
Чтобы образовать четыре ковалентные связи, атом C соединяется с четырьмя атомами H, образуя молекулярную формулу метана CH 4 .Однако диаграмма для метана вводит в заблуждение; четыре ковалентные связи, образующиеся атомом C, ориентированы в трех измерениях по направлению к углам тетраэдра. Лучшее представление молекулы метана показано на рисунке 16.1 «Трехмерное представление метана».
Следующий по величине алкан имеет два атома углерода, ковалентно связанные друг с другом. Чтобы каждый атом C образовал четыре ковалентные связи, каждый атом C должен быть связан с тремя атомами H. Полученная молекула, формула которой C 2 H 6 , представляет собой этан:
Чтобы каждый атом C образовал четыре ковалентные связи, каждый атом C должен быть связан с тремя атомами H. Полученная молекула, формула которой C 2 H 6 , представляет собой этан:
Пропан имеет основу из трех атомов C, окруженных атомами H.Вы должны убедиться, что молекулярная формула пропана: C 3 H 8 :
Диаграммы, представляющие алканы, называются структурными формулами. Диаграмма, которая показывает, как атомы в молекуле связаны. потому что они показывают структуру молекулы. По мере того как молекулы становятся больше, структурные формулы становятся все более и более сложными. Один из способов обойти это — использовать сжатую структурную формулу — список атомов, связанных с каждым атомом углерода в цепи., в котором перечислены формулы каждого атома углерода в основной цепи молекулы. Например, конденсированная структурная формула для этана — CH 3 CH 3 , а для пропана — CH 3 CH 2 CH 3 . Таблица 16.1 «Первые 10 алканов» дает молекулярные формулы, сжатые структурные формулы и названия первых 10 алканов.
Таблица 16.1 «Первые 10 алканов» дает молекулярные формулы, сжатые структурные формулы и названия первых 10 алканов.
Таблица 16.1 Первые 10 алканов
Октановое число| Молекулярная формула | Концентрированная структурная формула | Имя |
|---|---|---|
| Канал 4 | CH 4 | метан |
| C 2 H 6 | Канал 3 Канал 3 | этан |
| C 3 H 8 | Канал 3 Канал 2 Канал 3 | пропан |
| C 4 H 10 | Канал 3 Канал 2 Канал 2 Канал 3 | бутан |
| C 5 H 12 | Канал 3 Канал 2 Канал 2 Канал 2 Канал 3 | пентан |
| C 6 H 14 | Канал 3 (Канал 2 ) 4 Канал 3 | гексан |
| C 7 H 16 | Канал 3 (Канал 2 ) 5 Канал 3 | гептан |
| C 8 H 18 | Канал 3 (Канал 2 ) 6 Канал 3 | |
| C 9 H 20 | Канал 3 (Канал 2 ) 7 Канал 3 | нонан |
| C 10 H 22 | Канал 3 (Канал 2 ) 8 Канал 3 | декан |
Поскольку алканы имеют максимально возможное количество атомов H в соответствии с правилами ковалентных связей, алканы также называют насыщенными углеводородами — углеродным соединением с максимально возможным числом атомов H в своей формуле. .
.
Алкены имеют двойную связь C – C. Поскольку они содержат меньше максимально возможного количества атомов H, их называют ненасыщенными углеводородами. Углеродное соединение с меньшим, чем максимально возможное количество атомов H в его формуле. Наименьший алкен — этен — имеет два атома углерода и также известен как его общее название этилен:
Следующий по величине алкен — пропен — имеет три атома углерода с двойной связью между двумя атомами углерода. Он также известен как пропилен:
.Что вы заметили в названиях алканов и алкенов? Названия алкенов такие же, как и соответствующие им алканы, за исключением того, что окончание — ene , а не — ane .Как мы увидим, использование стержня для обозначения количества атомов C в молекуле и окончания для обозначения типа органического соединения является обычным явлением в органической химии.
С появлением следующего алкена, бутена, мы начинаем видеть главную проблему с органическими молекулами: выбор. С четырьмя атомами C двойная связь C – C может проходить между первым и вторым атомами C или между вторым и третьим атомами C:
С четырьмя атомами C двойная связь C – C может проходить между первым и вторым атомами C или между вторым и третьим атомами C:
(Двойная связь между третьим и четвертым атомами углерода такая же, как между первым и вторым атомами углерода, только перевернутая.) Правила наименования в органической химии требуют, чтобы эти два вещества имели разные названия. Первая молекула называется 1-бутен , а вторая молекула — 2-бутен . Число в начале названия указывает на происхождение двойной связи. Наименьшее возможное число используется для нумерации функции в молекуле; следовательно, называть вторую молекулу 3-бутеном было бы неправильно. Числа — общие части названий органических химических веществ, потому что они указывают, какой атом углерода в цепи содержит отличительную особенность.
Соединения 1-бутен и 2-бутен имеют разные физические и химические свойства, даже несмотря на то, что они имеют одинаковую молекулярную формулу — C 4 H 8 . Различные молекулы с одинаковой молекулярной формулой называются изомерами. Молекула с той же молекулярной формулой, что и другая молекула, но с другой структурой. Изомеры распространены в органической химии и способствуют ее сложности.
Различные молекулы с одинаковой молекулярной формулой называются изомерами. Молекула с той же молекулярной формулой, что и другая молекула, но с другой структурой. Изомеры распространены в органической химии и способствуют ее сложности.
Пример 1
На основании названий молекул бутена предложите название для этой молекулы.
Решение
С пятью атомами C мы будем использовать стержень pent -, а с двойной связью C – C это алкен, поэтому эта молекула является пентеном. При нумерации атомов C мы используем номер 2 , потому что это нижняя возможная метка. Итак, эта молекула называется 2-пентеном.
Проверьте себя
На основании названий молекул бутена предложите название для этой молекулы.
Ответ
3-гексен
Алкины с тройной связью C – C названы аналогично алкенам, за исключением того, что их названия заканчиваются на — yne . Самый мелкий алкин — этин, также известный как ацетилен:
Самый мелкий алкин — этин, также известный как ацетилен:
Пропин имеет структуру
С бутином нам нужно начать нумерацию позиции тройной связи, как мы это делали с алкенами:
Ароматические соединения содержат бензольное звено.Сам бензол состоит из шести атомов углерода в кольце с чередующимися одинарными и двойными связями C – C:
Чередующиеся одинарные и двойные связи C – C придают бензольному кольцу особую стабильность, и оно не реагирует как алкен, как можно было бы предположить. Бензол имеет молекулярную формулу C 6 H 6 ; в более крупных ароматических соединениях другой атом заменяет один или несколько атомов H.
Какими бы фундаментальными ни были углеводороды для органической химии, их свойства и химические реакции довольно банальны.Большинство углеводородов неполярны из-за близкой электроотрицательности атомов C и H. По существу, они очень мало растворяются в H 2 O и других полярных растворителях. Небольшие углеводороды, такие как метан и этан, являются газами при комнатной температуре, тогда как более крупные углеводороды, такие как гексан и октан, являются жидкостями. Даже более крупные углеводороды являются твердыми веществами при комнатной температуре и имеют мягкую воскообразную консистенцию.
Небольшие углеводороды, такие как метан и этан, являются газами при комнатной температуре, тогда как более крупные углеводороды, такие как гексан и октан, являются жидкостями. Даже более крупные углеводороды являются твердыми веществами при комнатной температуре и имеют мягкую воскообразную консистенцию.
Углеводороды довольно инертны, но они участвуют в некоторых классических химических реакциях.Одной из распространенных реакций является замещение атомом галогена путем объединения углеводорода с элементарным галогеном. Иногда для ускорения реакции используют свет, например, между метаном и хлором:
Ch5 + Cl2 → легкий Ch4Cl + HClГалогены также могут реагировать с алкенами и алкинами, но реакция другая. В этих случаях галоген реагирует с двойной или тройной связью C – C и внедряется на каждый атом C, участвующий в кратных связях. Эта реакция называется реакцией присоединения. Реакция молекулы галогена через двойную или тройную связь C – C.. Один из примеров —
.
Условия реакции обычно мягкие; во многих случаях галоген самопроизвольно реагирует с алкеном или алкином.
Водород также может быть добавлен через кратную связь; эта реакция называется реакцией гидрирования. Реакция водорода через двойную или тройную связь C – C, обычно в присутствии катализатора. Однако в этом случае условия реакции могут быть не мягкими; может потребоваться высокое давление газа H 2 .Платиновый или палладиевый катализатор обычно используется для ускорения реакции:
Ч3 = Ч3 + х3 → металлический катализатор Ч4Ч4Наиболее распространенной реакцией углеводородов является горение, которое представляет собой комбинацию углеводорода с O 2 с образованием CO 2 и H 2 O. Сжигание углеводородов сопровождается выделением энергии и первичный источник производства энергии в нашем обществе (Рисунок 16.2 «Горение»). Например, реакция горения бензина, которую можно представить как C 8 H 18 , выглядит следующим образом:
2C 8 H 18 + 25O 2 → 16CO 2 + 18H 2 O + ~ 5060 кДжОсновные выводы
- Простейшие органические соединения — это углеводороды, они состоят из углерода и водорода.

- Углеводороды могут быть алифатическими или ароматическими; алифатические углеводороды делятся на алканы, алкены и алкины.
- Сжигание углеводородов — основной источник энергии для нашего общества.
Упражнения
Определите углеводород . Каковы два основных типа углеводородов?
Какие три различных типа алифатических углеводородов? Как они определены?
Укажите, является ли каждая молекула алифатическим или ароматическим углеводородом; если алифатический, идентифицируйте молекулу как алкан, алкен или алкин.
Укажите, является ли каждая молекула алифатическим или ароматическим углеводородом; если алифатический, идентифицируйте молекулу как алкан, алкен или алкин.

Укажите, является ли каждая молекула алифатическим или ароматическим углеводородом; если алифатический, идентифицируйте молекулу как алкан, алкен или алкин.
Укажите, является ли каждая молекула алифатическим или ароматическим углеводородом; если алифатический, идентифицируйте молекулу как алкан, алкен или алкин.

Назовите и нарисуйте структурные формулы четырех мельчайших алканов.
Назовите и нарисуйте структурные формулы для четырех наименьших алкенов.
Что означает термин ароматический в отношении органической молекулы?
Что означает термин нормальный , когда он используется для алканов?
Объясните, почему название 1-пропен неверно.
 Какое собственное название этой молекулы?
Какое собственное название этой молекулы?Объясните, почему название 3-бутен неверно. Какое собственное название этой молекулы?
Назовите и нарисуйте структурную формулу каждого изомера пентена.
Назовите и нарисуйте структурную формулу каждого изомера гексина.
Напишите химическое уравнение реакции метана и брома.
Напишите химическое уравнение реакции этана и хлора.
Изобразите структуру продукта реакции брома с пропеном.

Изобразите структуру продукта реакции хлора с 2-бутеном.
Изобразите структуру продукта реакции водорода с 1-бутеном.
Изобразите структуру продукта реакции водорода с 2-пентеном.
Напишите вычисленное химическое уравнение горения гептана.
Напишите вычисленное химическое уравнение горения нонана.
ответы
органическое соединение, состоящее только из углерода и водорода; углеводороды алифатические и ароматические углеводороды
- алифатический; алкан
- ароматический
- алифатический; алкен
- алифатический; алкан
- алифатический; алкен
- ароматический
Ароматический означает, что в молекуле есть бензольное кольцо.

1 не требуется. Название соединения просто пропен .
CH 4 + Br 2 → CH 3 Br + HBr
C 7 H 16 + 11O 2 → 7CO 2 + 8H 2 O
Углеводороды
КЛАССИФИКАЦИЯ УГЛЕВОДОРОДОВ
| ||||||||||||
Классификация углеводородов — A Plus Topper
Классификация углеводородов Соединения, содержащие в молекулах только углерод и водород, называются углеводородами .
Углеводороды подразделяются на две категории, известные как углеводороды с открытой цепью, углеводороды, и углеводороды с замкнутой цепью. Углеводороды с открытой цепью также называют алифатическими углеводородами или ациклическими углеводородами.
Углеводороды с открытой и замкнутой цепью
Рассмотрим следующие структурные формулы различных углеводородов.
1) CH 3 –CH 2 –CH 2 –CH 2 –CH 3 н-пентан, соединение с прямой цепью.
2) Изопентан, соединение с разветвленной цепью
3) циклопентан, циклическое соединение или кольцевое соединение
В первом примере вы заметите, что все атомы углерода связаны друг с другом, что дает линейную структуру, где как и во втором примере, четыре атома углерода связаны линейным образом, а пятый атом углерода связан с родительской цепью, в результате чего образуется разветвление. В третьем примере мы обнаруживаем, что углеродная цепь замкнута, образуя кольцо. Итак, это углеводород с замкнутой цепью или углеводородное кольцо.
Все углеводороды (как алифатические, так и циклические углеводороды) снова классифицируются как алканы, алкены и алкины:
1) Углеводороды, содержащие только одинарные связи между атомами углерода, называются алканами .
2) Углеводороды, содержащие хотя бы одну двойную связь между атомами углерода, называются алкенами, и
3) Углеводороды, содержащие хотя бы одну тройку между атомами углерода, называются алкинами .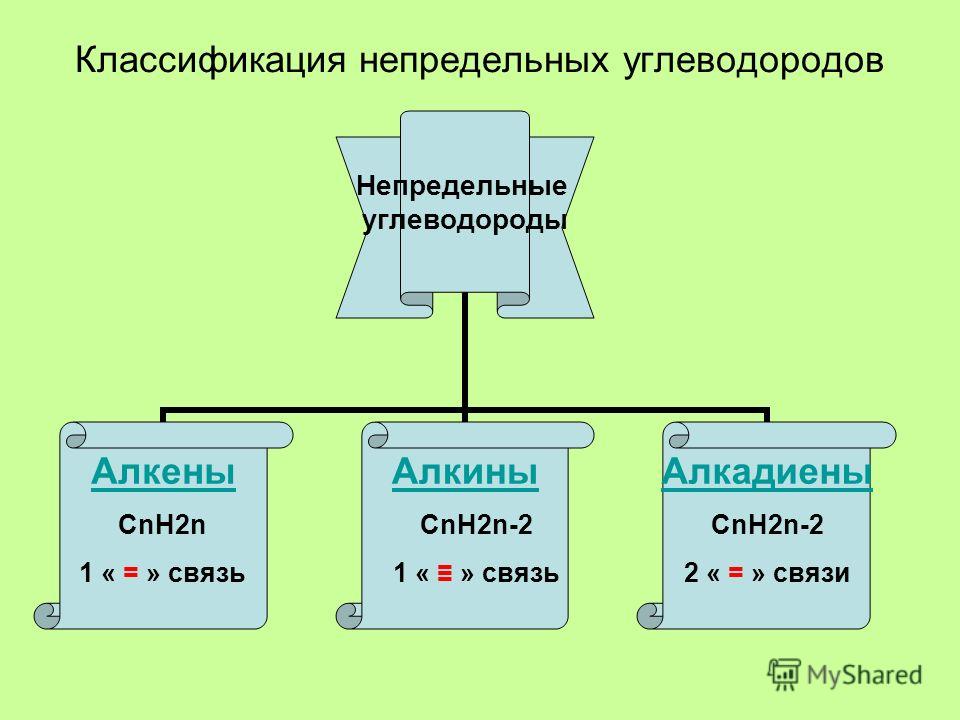
Насыщенные и ненасыщенные углеводороды
Углеводороды, содержащие только одинарные связи C — C, известны как насыщенные углеводороды. Все алканы — предельные углеводороды. Углеводороды, которые содержат по крайней мере одну двойную связь (C = C) или содержат по крайней мере одну тройную связь (C ≡ C) между двумя атомами углерода, называются ненасыщенными углеводородами . Алкены и алкины являются примерами ненасыщенных углеводородов.
Углеводородные соединения с прямой, разветвленной и замкнутой цепью могут быть насыщенными или ненасыщенными. См. Следующие примеры.
Подробнее:
Люди также спрашивают
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Идентификация молекулярной структурной ароматичности углеводородов Классификация
САУ Омега.2018 30 ноя; 3 (11): 16035–16039.
, * † , ‡ #, § , ∥ и ⊥Райан К. Фортенберри
† Отдел химии и биохимии, университет Миссисипи, Университет, Миссисипи 38655-1848, США
Карли М. Новак
‡ Департамент химии и биохимии, Грузия Южный университет, Стейтсборо, Джорджия 30460, США
Тимоти Дж.Ли
§ MS 245-3 NASA Ames Research Center, Moffett Field, California 94035-1000, United States
Partha P. Bera
∥ Bay Районный институт экологических исследований, Петалума, Калифорния 94952, США
Джулия Э. Райс
⊥ IBM Исследовательский центр Альмадена, IBM Research, 650 Harry Road, San Jose, California 95120, United States
† Department химии и биохимии, университет Миссисипи, Университет, Миссисипи 38655-1848, США
‡ Департамент химии и биохимии, Грузия Южный университет, Стейтсборо, Джорджия 30460, США
§ MS 245-3 NASA Ames Research Center, Moffett Field, California 94035-1000, United States
∥ Bay Районный институт экологических исследований, Петалума, Калифорния 94952, США
⊥ IBM Almaden Research Center, IBM Research, 650 Harry Road, San Jose, California 95120, United States
Автор, отвечающий за переписку.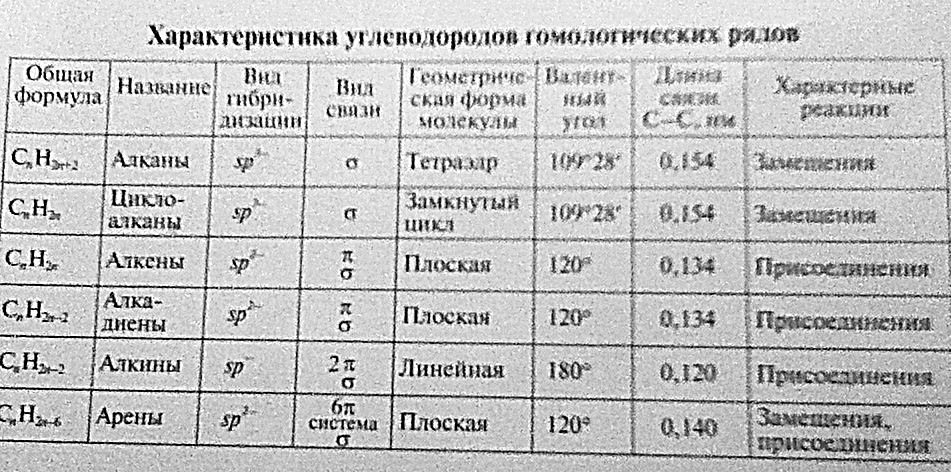
Поступило 09.10.2018 г .; Принято 15 ноября 2018 г.
Это статья в открытом доступе, опубликованная под лицензией ACS AuthorChoice License, которая разрешает копирование и распространение статьи или любые изменения в некоммерческих целях. Эта статья цитируется в других статьях в PMC.Реферат
Определение ароматичности углеводородов.
может быть так же просто, как
определение средней длины связи для интересующей молекулы.
Это очень поможет в классификации природы углеводородов.
химия, особенно для больших молекул, таких как полициклические ароматические
углеводороды (ПАУ), в которых современные методы классификации ароматических
непомерно дороги.Средние длины связей C – C для
набор для тестирования известных ароматических, антиароматических и алифатических циклических углеводородов
вычисляются здесь, и они показывают сильные разграничивающие модели для
структурное различение этих классификаций ароматичности. Ароматный
молекулы имеют среднюю длину связи C – C 1,41 Å или меньше.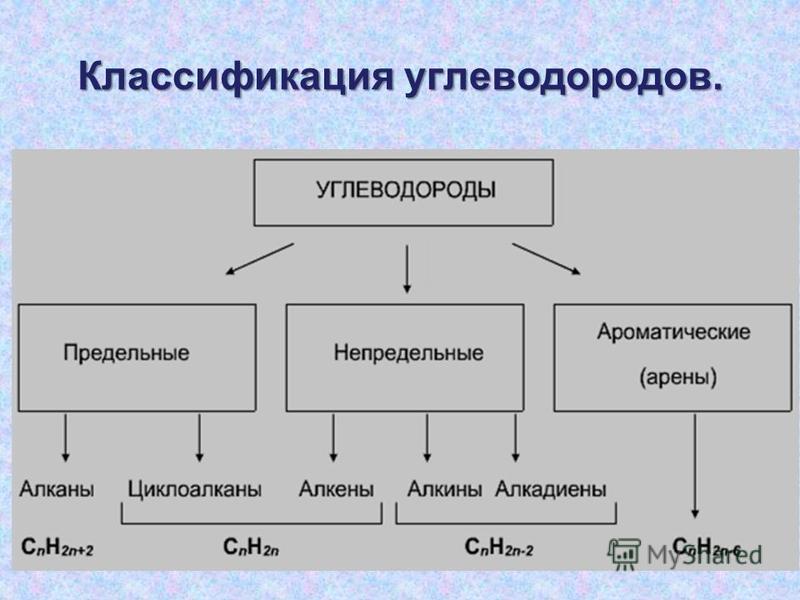 с самыми крупными молекулами, ПАУ, имеющими наибольшую среднюю длину C – C
длины облигаций; алифатические разновидности имеют такую длину 1,50 Å или
более; и антиароматические виды попадают между ними. Следовательно,
может просто возникнуть предположение первого порядка об ароматичности системы
от его геометрии.Хотя у этого прогноза, скорее всего, будут исключения,
такой простой скрининг позволяет легко классифицировать большинство случаев, а более сложные
методы могут быть применены к случаям, которые лежат в границах.
Здесь представлены эталоны для углеводородов, но другие классы
молекулярную структурную ароматичность, вероятно, придется определять на
на специальной основе.
с самыми крупными молекулами, ПАУ, имеющими наибольшую среднюю длину C – C
длины облигаций; алифатические разновидности имеют такую длину 1,50 Å или
более; и антиароматические виды попадают между ними. Следовательно,
может просто возникнуть предположение первого порядка об ароматичности системы
от его геометрии.Хотя у этого прогноза, скорее всего, будут исключения,
такой простой скрининг позволяет легко классифицировать большинство случаев, а более сложные
методы могут быть применены к случаям, которые лежат в границах.
Здесь представлены эталоны для углеводородов, но другие классы
молекулярную структурную ароматичность, вероятно, придется определять на
на специальной основе.
Введение
Простая средняя длина связи C – C
в циклической плоской молекуле
продвигается в этой работе как коррелирующий предсказатель ароматичности
или антиароматичность, но не делается попыток дать определение ни одному из этих терминов.Определение ароматичности варьировалось в различных формах с тех пор, как
возникновение этого химического термина в середине 19 века. Современный
определения ароматичности включают делокализацию электронов, ведущих
к стабилизации энергии связи. Так далеко от простого
обращение к носу аптекаря, чтобы уловить какой-то запах. Один из
наиболее успешные и, безусловно, самые продолжительные определения ароматичности
это правило Хюккеля 4 n + 2 для числа
электронов в плоских, циклических молекулах.Хотя это уравнение применяется
к π электронам в sp 2 гибридизированных системах, σ
и δ ароматичности также обычно легко определить, используя
тот же подход. H 3 + — классический пример
σ ароматичности с n = 0. 1-3
Современный
определения ароматичности включают делокализацию электронов, ведущих
к стабилизации энергии связи. Так далеко от простого
обращение к носу аптекаря, чтобы уловить какой-то запах. Один из
наиболее успешные и, безусловно, самые продолжительные определения ароматичности
это правило Хюккеля 4 n + 2 для числа
электронов в плоских, циклических молекулах.Хотя это уравнение применяется
к π электронам в sp 2 гибридизированных системах, σ
и δ ароматичности также обычно легко определить, используя
тот же подход. H 3 + — классический пример
σ ароматичности с n = 0. 1-3
Хотя
правило 4 n + 2 хорошо работает в моноциклических
системы, он начинает разрушаться по мере увеличения размера кольца. 4 Следовательно, более конкретные определения ароматичности,
особенно π ароматичность, были основным направлением исследований
за последние десятилетия. 5 Некоторые включают различные
методы, предложенные покойным Полом против Р. Шлейера, такие как блочно-локализованные
волновая функция — дополнительная энергия циклического резонанса (BLW-ECRE), разложение по энергии
анализ-ароматическая стабилизация энергии и ядерно-независимая химическая
сдвиг. 6,7 Другие включают многоцентровый индекс (MCI),
индекс пара-делокализации и индекс ароматических флуктуаций
(FLU), 8,9 и многие другие. 5 Каждый из этих методов включает вычисление энергии для разных
части молекулы и построение схемы для физической интерпретации
результаты как ароматичность и ее последующая стабилизация молекулярной энергии.Эти мощные методы позволяют лучше понять
геометрия циклических систем даже за пределами углеводородов. 10
Шлейера, такие как блочно-локализованные
волновая функция — дополнительная энергия циклического резонанса (BLW-ECRE), разложение по энергии
анализ-ароматическая стабилизация энергии и ядерно-независимая химическая
сдвиг. 6,7 Другие включают многоцентровый индекс (MCI),
индекс пара-делокализации и индекс ароматических флуктуаций
(FLU), 8,9 и многие другие. 5 Каждый из этих методов включает вычисление энергии для разных
части молекулы и построение схемы для физической интерпретации
результаты как ароматичность и ее последующая стабилизация молекулярной энергии.Эти мощные методы позволяют лучше понять
геометрия циклических систем даже за пределами углеводородов. 10
Однако более простые метрики, такие как среднее значение C – C
длина облигации
могут быть доступны для прогнозирования ароматичности даже без определения или явного
количественная оценка. Хотя эта молекулярная наблюдаемая используется как одна
условных ограничений в некоторых количественных оценках ароматичности, 16 , таких как стабилизация гармонического осциллятора
метод энергии (HOSE), 5,17 этот более простой подход к усреднению
длины связей C – C могут быть полезны для грубой аппроксимации
ароматичность в циклических углеводородах с заметным применением к полициклическим
ароматические углеводороды (ПАУ).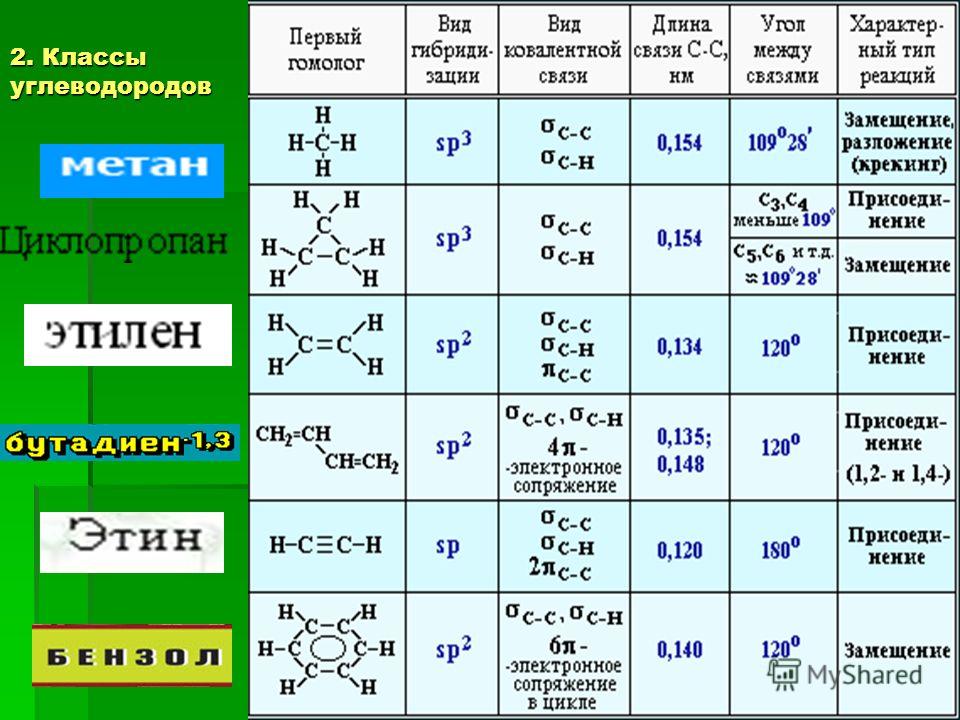 Полагают, что ПАУ составляют столько же
как 20% углерода во Вселенной и может вырасти до огромных размеров
включая сотни атомов. 18,19 Небольшие изменения в
Геометрия ПАУ также обычна: внутренний углерод легко удаляется.
из системы из-за столкновений с энергичными частицами и космическими
лучи. В результате ароматичность таких систем может измениться, что приведет к
к новой химии, поскольку ПАУ пытается вернуться к ароматической планарности
или даже антиароматические (в определении 4 n + 2) сферы
создание таких видов, как бакиболлы. 20−23 Расчеты FLU, MCI, ECRE и HOSE
ПАУ и бакиболлы трудноизлечимы с практической точки зрения. Определенный
Представляющие интерес ПАУ можно вычислить, но количество ПАУ и близко
связанных углеводородных производных может стать огромным, особенно для
исследования динамики и химических реакций. Результатов могут быть сотни
виды, лечение которых точными, но дорогостоящими методами невозможно.
каждая интересующая система. Структура может помочь в прогнозировании ароматичности
и может быть достаточно надежно вычислен даже простыми методами.
Полагают, что ПАУ составляют столько же
как 20% углерода во Вселенной и может вырасти до огромных размеров
включая сотни атомов. 18,19 Небольшие изменения в
Геометрия ПАУ также обычна: внутренний углерод легко удаляется.
из системы из-за столкновений с энергичными частицами и космическими
лучи. В результате ароматичность таких систем может измениться, что приведет к
к новой химии, поскольку ПАУ пытается вернуться к ароматической планарности
или даже антиароматические (в определении 4 n + 2) сферы
создание таких видов, как бакиболлы. 20−23 Расчеты FLU, MCI, ECRE и HOSE
ПАУ и бакиболлы трудноизлечимы с практической точки зрения. Определенный
Представляющие интерес ПАУ можно вычислить, но количество ПАУ и близко
связанных углеводородных производных может стать огромным, особенно для
исследования динамики и химических реакций. Результатов могут быть сотни
виды, лечение которых точными, но дорогостоящими методами невозможно.
каждая интересующая система. Структура может помочь в прогнозировании ароматичности
и может быть достаточно надежно вычислен даже простыми методами. Несмотря на то что
ароматичность была использована для прогнозирования средней длины связи в ПАУ, 24 эта работа предлагает обратное: длины связи
прогнозировать ароматичность.
Несмотря на то что
ароматичность была использована для прогнозирования средней длины связи в ПАУ, 24 эта работа предлагает обратное: длины связи
прогнозировать ароматичность.
Геометрия большинства π ароматических углеводородов иметь длину облигаций которые находятся между одинарной связью C – C (1,54 Å от этана) и двойной связи C = C (1,34 Å от этилена) в результате «частичной» связи в электронном делокализация. Например, бензол, как известно, имеет длину связи около 1,40 Å, что ближе к двойной связи, но отличается достаточно, чтобы классифицировать однозначно.Истинная геометрия Кекуле чередовать одинарные и двойные связи, давая среднюю длину связи между ними, как показывает бензол. Следовательно, средняя длина связи может быть полезным в качестве простого предсказания ароматичности первого порядка.
На самом деле все связи будут одинаковой длины, правда D 6 h бензол, но не все ароматические углеводороды
настолько симметричны. Самый простой ароматический углеводород — циклопропенилиден,
с-С 3 Н 2 .Он следует правилу Hückel 4 n + 2 с n = 0 для количества
π электронов, но имеет неподеленную пару на апикальном углероде.
Таким образом, существует две длины связи C – C 1,4262 Å и одна
Длина связи 1,3295 Å из квантово-химических расчетов. 25 Более короткая длина скрепления находится между двумя CH
группы, потому что они разделяют как σ-, так и π-связь, создавая
двойная связь из определения молекулярной структуры Льюиса. Следовательно,
средняя длина связи c-C 3 H 2 составляет 1.3940
Å, довольно близкий к бензолу, что указывает на ароматичность.
Самый простой ароматический углеводород — циклопропенилиден,
с-С 3 Н 2 .Он следует правилу Hückel 4 n + 2 с n = 0 для количества
π электронов, но имеет неподеленную пару на апикальном углероде.
Таким образом, существует две длины связи C – C 1,4262 Å и одна
Длина связи 1,3295 Å из квантово-химических расчетов. 25 Более короткая длина скрепления находится между двумя CH
группы, потому что они разделяют как σ-, так и π-связь, создавая
двойная связь из определения молекулярной структуры Льюиса. Следовательно,
средняя длина связи c-C 3 H 2 составляет 1.3940
Å, довольно близкий к бензолу, что указывает на ароматичность.
Результаты и Обсуждение
Для дальнейшего расширения идеи средней облигации
длина как предсказатель
ароматичности, квантово-химические вычисления используются для вычисления
геометрии ряда известных ароматических, антиароматических и алифатических
разновидность. Теория связанных кластеров 26,27 на одиночном, двойном,
и пертурбативный тройной уровень [CCSD (T)] 28 с базисным набором aug-cc-pVTZ, 29,30 , а также
явно коррелировал MP2-F12 31,32 с aug-cc-pVDZ
базовый набор, используется для обработки более крупных систем, таких как ПАУ, для этого
оценка. Методы выбраны потому, что CCSD (T) считается
быть «золотым стандартом» квантовой химии 33 , но иногда это слишком дорого. Снижение вниз
в MP2 может предоставить надежную геометрическую информацию для более крупных систем,
а явная корреляция еще больше повысит точность.
Методы выбраны потому, что CCSD (T) считается
быть «золотым стандартом» квантовой химии 33 , но иногда это слишком дорого. Снижение вниз
в MP2 может предоставить надежную геометрическую информацию для более крупных систем,
а явная корреляция еще больше повысит точность.
В таблице 1 представлены средняя длина облигаций для анализируемых систем, а также средняя Энергии связи C – C и изодесмические энергии. Средняя облигация энергии вычисляются путем разбиения каждой из молекул на его фрагменты 3 P C, 2 ∑ + CH и 1 A 1 CH 2 .Например, средняя энергия связи для c-C 3 H 2 определяется как
1
, где n b представляет
количество связей C – C, присутствующих в молекуле. Для c-C 3 H 2 , n b = 3. CCSD (T) / apVTZ
(используя сокращение для aug-cc-pVTZ) дает значение 110,0
ккал / моль с MP2-F12 / apVDZ аналогично 126,3 ккал / моль.
Таблица 1
Средняя длина связи C – C (Å), Средняя энергия связи C – C (ккал / моль) и изодесмическая энергия (ккал / моль)
корон 911 911 9119 (планарный)| CCSD (T) / apVTZ | MP2-F12 / apVDZ | экспериментальный | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| длина связи | энергия связи | энергия | длина связи | энергия связи | изодесмическая энергия | длина связи | ||||||||||||||
| c-C 3 H 2 | 1. 385 385 | 110,0 | –0,8 | 1,388 | 126,3 | –6,3 | 1,390 b | |||||||||||||
| cC 3 H 3 + | 911 911 911 911 | 1,363 | 150,3 | 29,9 | ||||||||||||||||
| cC 5 H 5 — | 1,418 | 138,6 | –85,6 | 1,414 | 150. 9 9 | –96,6 | ||||||||||||||
| бензол | 1,398 | 140,5 | –59,6 | 1,393 | 151,9 | –69,3 | 1,397 | –69,3 | 1,397 | 1 | 1 | 1 | –110,9 | 1,402 | 145,4 | –128,8 | 1,400 d | |||
| антрацен | 1. 405 405 | 142,7 | ||||||||||||||||||
| пирен | 1,407 | 141,0 | ||||||||||||||||||
| 9119 9119 | ||||||||||||||||||||
| cC 4 H 4 | 1,460 | 117,5 | 52,4 | 1,453 | 127. 3 3 | 52,4 | ||||||||||||||
| CC 5 H 5 + | 1,450 | 139,9 | 19,1 | 1,423 | 147,4 | 4 | 34,51997 | 1 | 1 | 1,419 | 135,9 | –33,7 | ||||||||
| cC 3 H 6 | 1,511 | 101,3 | 24.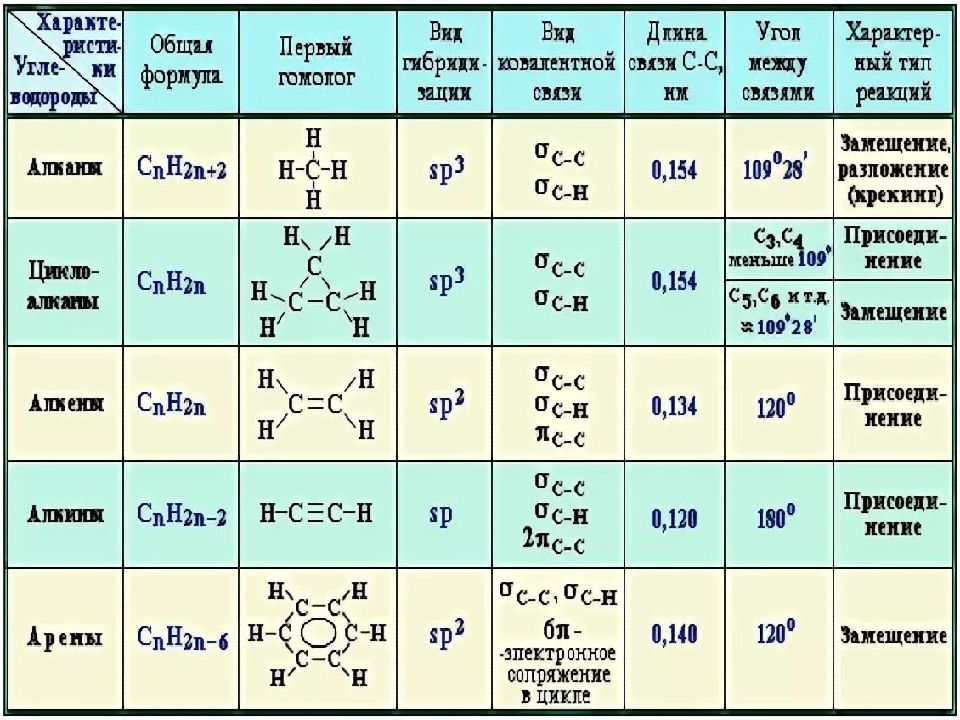 6 6 | 1,502 | 110,4 | 23,6 | 1,501 e | |||||||||||||
| куб. | ||||||||||||||||||||
| куб. | 1.535 | 119,0 | –3,5 | 1,546 г | ||||||||||||||||
| куб. 8 H 8 | 1.404 | 145,4 | –40,5 | 1,404 h | ||||||||||||||||
| cC 8 H 4 | 1. 407 407 | 143,6 | –26,1 | |||||||||||||||||
| куб.см 10 H 10 (плоский) | 1,398 | 143,8 | 143,8 | 143,8 | ) C 3 H 2 | 1,424 | 101,1 | 43,5 | 1,418 | 108,0 | 41,8 | |||||||||
Изодесмическая энергия часто используется для вычисления
напряжение кольца в
циклическая система и определяется как схема энергии реакции, где
количество и тип связей сохранены. 34 Используются состояния спина с наименьшей энергией для каждой системы, что делает
большая часть рассчитанных фрагментов закрытых синглетов. Изодесмический
схема для c-C 3 H 2 определяется как
34 Используются состояния спина с наименьшей энергией для каждой системы, что делает
большая часть рассчитанных фрагментов закрытых синглетов. Изодесмический
схема для c-C 3 H 2 определяется как
2
Изодесмический энергии равны -0,8 и -6,3 ккал / моль для CCSD (T) / apVTZ и MP2-F12 / apVDZ соответственно, для c-C 3 H 2 . Приведены изодесмические энергии. здесь, чтобы избежать интерпретации дестабилизации средней облигации энергия, возникающая в результате деформации кольца.
На первый взгляд Таблица 1, одна интерпретация
будет то, что c-C 3 H 2 не сильно напрягается.
Однако известны похожие циклические геометрии.
быть очень напряженным. Циклопропан — яркий тому пример. Настоящее
расчеты показывают, что энергия деформации этой системы равна 24,6 и
23,6 ккал / моль снова для CCSD (T) и MP2-F12 соответственно. Эти
довольно близко к общепринятому штамму кольца 27 ккал / моль c-C 3 H 6 .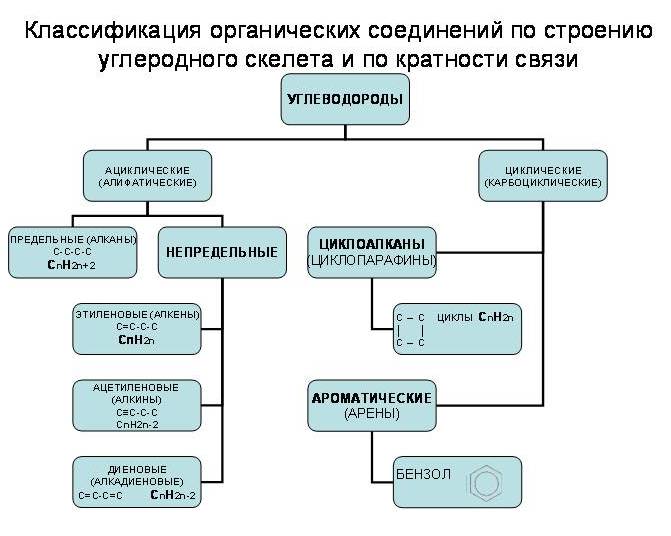 Удаление двух атомов водорода, чтобы создать одинокий
пара на новом концевом углероде в циклопропилидене (c-C 3 H 4 ), менее стабильном изомере аллена, 35 фактически увеличивает энергию деформации примерно на 2 ккал / моль.Следовательно, разница в изодесмических энергиях между
c-C 3 H 2 π молекулы и любой из несвязанных π
системы могут быть мерой ароматичности.
Удаление двух атомов водорода, чтобы создать одинокий
пара на новом концевом углероде в циклопропилидене (c-C 3 H 4 ), менее стабильном изомере аллена, 35 фактически увеличивает энергию деформации примерно на 2 ккал / моль.Следовательно, разница в изодесмических энергиях между
c-C 3 H 2 π молекулы и любой из несвязанных π
системы могут быть мерой ароматичности.
Дополнительно
средние энергии связи заметно различаются между
c-C 3 H 2 и другие циклические пропилалканы.
Диссоциация циклопропенилидена посредством уравнения 1 снова требует 110,0 ккал / моль от CCSD (T).
Подобные реакции для циклопропана и циклопропилидена требуют меньше
в 101.3 и 86,8 ккал / моль соответственно. Значения MP2-F12 выше
но представляют те же качественные относительные энергии. В любом случае
энергии имеют четкую яркую грань между традиционно интерпретируемыми
ароматическая система и традиционно интерпретируемые алифатические системы. Этот
коррелирует со средней длиной связи: 1,385 Å для c-C 3 H 2 по сравнению с 1,511 и 1,502 Å для c-C 3 H 6 и c-C 3 H 4 соответственно.
Следовательно, средняя длина связи соответствует ароматичности в данном
первый пример.
Этот
коррелирует со средней длиной связи: 1,385 Å для c-C 3 H 2 по сравнению с 1,511 и 1,502 Å для c-C 3 H 6 и c-C 3 H 4 соответственно.
Следовательно, средняя длина связи соответствует ароматичности в данном
первый пример.
Принимая значения таблицы 1 в целом, традиционные ароматические геометрии
есть MP2-F12 / apVDZ
длина связи примерно 1,41 Å и меньше. Это похоже на
CCSD (T) / apVTZ для тех систем, которые подходят для изучения с этим более дорогостоящим
уровень теории. Поскольку ароматичность — это циклическое свойство, в среднем
длина связи, приближающаяся к длине двойной связи, не имеет значения (или эзотерически
в худшем случае) для настоящего анализа как непрерывные двойные связи в циклических
молекулы чаще всего сильно напряжены и нестабильны.Алифатические геометрии
имеют длину связи 1,50 Å и более. Это не удивительно
потому что одинарные связи C – C обычно находятся в том же диапазоне.
Сравнение экспериментальных длин связей с расчетными значениями составляет
в пределах 0,01 Å для обоих уровней используемой здесь теории. c-C 5 H 5 — немного выходит за пределы
тренд на ароматические виды; однако дополнительный электрон делокализует
систему немного, тем самым увеличивая длину скрепления.
c-C 5 H 5 — немного выходит за пределы
тренд на ароматические виды; однако дополнительный электрон делокализует
систему немного, тем самым увеличивая длину скрепления.
Все геометрии C 3 H x для c-C 3 H 3 + имеют заметные суммы деформации в них, о чем свидетельствуют как средние энергии связи, так и изодесмические энергии в таблице 1.c-C 3 H, как известно, нестабилен и работает на c-C 3 H показало, что даже добавление одиночного водорода недостаточно для стабилизации кольца, так что большая амплитуда движение присутствует в кольцевых деформационных колебательных модах. 36−38 Выброс в c-C 3 H 3 + резонансный стабилизируется, понижая изодесмическую энергию ниже другого циклопропенила члены семьи.
Интересный результат: традиционно
интерпретированный антиароматический
геометрии, эти циклические системы с четным числом π-электронов
которые не соответствуют Hückel’s 4 n + 2
правило, имеют среднюю длину связи и среднюю энергию связи, которая падает
между ароматическими и алифатическими группами. Несмотря на то что
любое количество ордеров на облигации, превышающее 1,0, приведет к уменьшению среднего
длина связи, тот факт, что антиароматические частицы более стабильны, чем
чистая алифатика изначально не очевидна, особенно для студентов.
Два типичных антиароматических соединения включают C 2 h циклобутадиен (cC 4 H 4 ) и D 5 h циклопентадиенильный катион (cC 5 H 512 900 ). Как показано в середине таблицы 1, они показывают среднюю длину связи от 1.50 и
1,41 Å со средними энергиями связи, которые также попадают в эту середину.
диапазон для CCSD (T) и MP2-F12. Циклопентадиенильный катион имеет
средняя энергия связи почти в диапазоне ожидаемых для ароматических
геометрии, но пустая p-орбиталь на одном из атомов углерода в
кольцо приводит к этой стабилизации. Кроме того, геометрия бициклического пенталена c-C 8 H 6 также является антиароматической для n = 8 со средней длиной связи 1,419 Å и
средняя энергия связи 135.
Несмотря на то что
любое количество ордеров на облигации, превышающее 1,0, приведет к уменьшению среднего
длина связи, тот факт, что антиароматические частицы более стабильны, чем
чистая алифатика изначально не очевидна, особенно для студентов.
Два типичных антиароматических соединения включают C 2 h циклобутадиен (cC 4 H 4 ) и D 5 h циклопентадиенильный катион (cC 5 H 512 900 ). Как показано в середине таблицы 1, они показывают среднюю длину связи от 1.50 и
1,41 Å со средними энергиями связи, которые также попадают в эту середину.
диапазон для CCSD (T) и MP2-F12. Циклопентадиенильный катион имеет
средняя энергия связи почти в диапазоне ожидаемых для ароматических
геометрии, но пустая p-орбиталь на одном из атомов углерода в
кольцо приводит к этой стабилизации. Кроме того, геометрия бициклического пенталена c-C 8 H 6 также является антиароматической для n = 8 со средней длиной связи 1,419 Å и
средняя энергия связи 135. 9 ккал / моль, оба попадают в эту середину
область. В каждом случае связи C – C разделяют дополнительные электроны,
создание связей, которые короче одинарных связей C – C, но длиннее
чем в среднем связи C – C в ароматической геометрии. В виде
в результате антиароматическое связывание находится между ароматическим и
алифатический.
9 ккал / моль, оба попадают в эту середину
область. В каждом случае связи C – C разделяют дополнительные электроны,
создание связей, которые короче одинарных связей C – C, но длиннее
чем в среднем связи C – C в ароматической геометрии. В виде
в результате антиароматическое связывание находится между ароматическим и
алифатический.
ПАУ большей геометрии демонстрируют сходящееся поведение
для обеих облигаций
длины и средние энергии связи. Исключая коронен, который требовал
использование cc-pVDZ вместо aug-cc-pVDZ, средняя связь MP2-F12 / apVDZ
длина приближается к 1.410 Å и среднее значение MP2-F12 / apVDZ
энергия связи до 140,0 ккал / моль. Такое сходящееся поведение было показано
для различных свойств ПАУ в зависимости от увеличения количества бензола
кольца. 39,40 Быстрые вычисления AM1 41 определяют средние длины связей C – C в наших четырех PAH.
сходится к немного более длинным значениям на 1,413 Å по сравнению с
длина связи MP2-F12 / apVDZ. Следовательно, общие и большие ПАУ
будет иметь длину связи, которая немного больше, чем у бензола
(1,397 Å) и будет близка к 1. 410 Å. Включая коронен
в анализе дает качественное свидетельство того, что тенденция сохраняется. В виде
примечание, в частности пирен, но также и многие другие ПАУ на самом деле
не прошли тест 4 n + 2. Однако каждое из колец
принимается индивидуально в каждом ПАУ, проходит тест. Опять же, это было
известен более полувека. 4 Дополнительно,
пирен экспериментально ароматичен по поведению, и тенденция к ароматичности
основанный на длине связи и энергии, также присутствует в наших расчетах.
410 Å. Включая коронен
в анализе дает качественное свидетельство того, что тенденция сохраняется. В виде
примечание, в частности пирен, но также и многие другие ПАУ на самом деле
не прошли тест 4 n + 2. Однако каждое из колец
принимается индивидуально в каждом ПАУ, проходит тест. Опять же, это было
известен более полувека. 4 Дополнительно,
пирен экспериментально ароматичен по поведению, и тенденция к ароматичности
основанный на длине связи и энергии, также присутствует в наших расчетах.
Чтобы проверить, неароматическое или антиароматическое поведение в молекулах
планарности сил, которые оптимизируются как неплоские, также можно предсказать
по этому методу циклооктатетраен (C 8 H 8 )
исследованы. Эта молекула, как экспериментально известно, имеет симметрию D 2 d и имеет два класса
из четырех длин связи, 1,470 и 1,337 Å, 15,42 , что дает в среднем 1,404 Å, и это именно то, что MP2-F12 / apVDZ
результаты предсказывают. Циклооктатетраен непланарен, что означает, что он будет
быть алифатическим, даже если он циклический. Стабилизация привела к
изгибами вне плоскости оказывает любое предсказание ароматичности от
спорный вопрос о средней длине облигаций. Однако принудительная планарность в геометрии D 4 h является антиароматической.
по правилу Хюккеля, но наши расчеты положили
длина связи планарной C 8 H 8 при 1,407 Å с
средняя энергия связи 143,6 ккал / моль. Это на внешнем крае
антиароматического диапазона и посягает на средний уровень ПАУ
диапазон длин связи.Однако энергия деформации для этой молекулы равна
отрицательный, что указывает на то, что, хотя он предпочитает изгибаться вне плоскости,
уменьшенного внутреннего угла восьмиугольника достаточно для обеспечения устойчивости
в системе. Кроме того, C 8 H 8 достаточно большой
делокализовать, не переходя в истинную антиароматичность, как указано
длиной связи 1,407 Å, существующей на границе между ароматичностью
и антиароматичность.
Циклооктатетраен непланарен, что означает, что он будет
быть алифатическим, даже если он циклический. Стабилизация привела к
изгибами вне плоскости оказывает любое предсказание ароматичности от
спорный вопрос о средней длине облигаций. Однако принудительная планарность в геометрии D 4 h является антиароматической.
по правилу Хюккеля, но наши расчеты положили
длина связи планарной C 8 H 8 при 1,407 Å с
средняя энергия связи 143,6 ккал / моль. Это на внешнем крае
антиароматического диапазона и посягает на средний уровень ПАУ
диапазон длин связи.Однако энергия деформации для этой молекулы равна
отрицательный, что указывает на то, что, хотя он предпочитает изгибаться вне плоскости,
уменьшенного внутреннего угла восьмиугольника достаточно для обеспечения устойчивости
в системе. Кроме того, C 8 H 8 достаточно большой
делокализовать, не переходя в истинную антиароматичность, как указано
длиной связи 1,407 Å, существующей на границе между ароматичностью
и антиароматичность.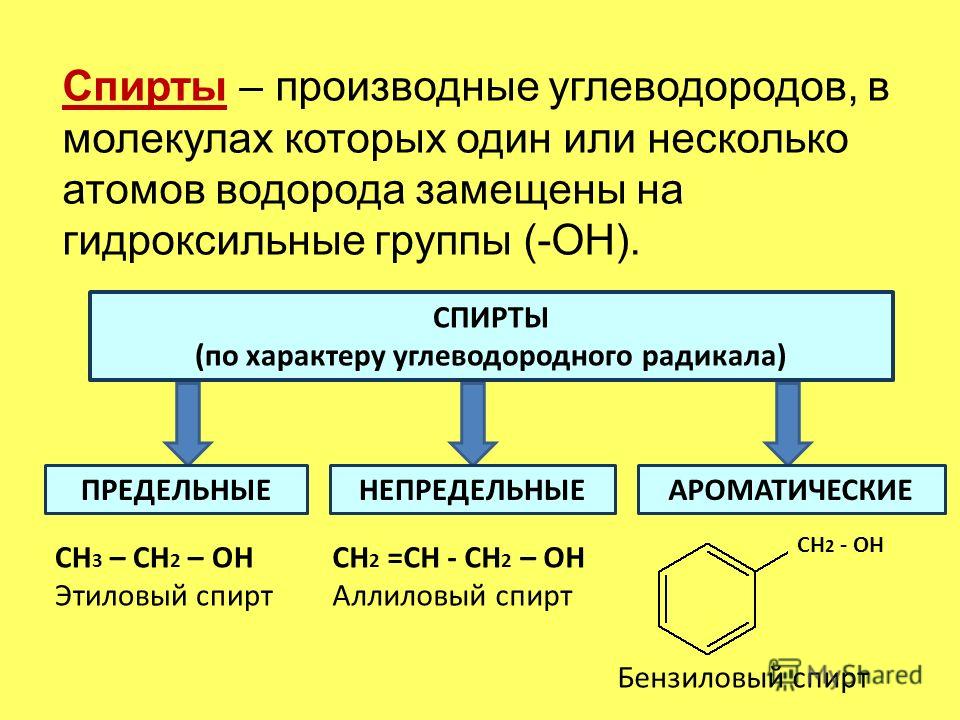 Об этом дополнительно свидетельствует C 10 H 10 в таблице 1, которая, если она плоская, удовлетворяет требованию 4 n + 2.Его средняя длина связи 1,398 Å хорошо вписывается в ароматический
критерий, но он также отклоняется от плоскости в своей самой низкой энергетической форме,
рендеринг комментариев по ароматичности для C 2 также спор с минимальной геометрией.
Об этом дополнительно свидетельствует C 10 H 10 в таблице 1, которая, если она плоская, удовлетворяет требованию 4 n + 2.Его средняя длина связи 1,398 Å хорошо вписывается в ароматический
критерий, но он также отклоняется от плоскости в своей самой низкой энергетической форме,
рендеринг комментариев по ароматичности для C 2 также спор с минимальной геометрией.
В целях прогнозирования
циклический c- (C) C 3 H 2 , циклопропенилиден с
дополнительный атом углерода, связанный с
апикальный углерод, представленный на фиг., можно классифицировать двумя способами. Полагаясь только на
связей в кольце (без учета апикальной связи C = C), среднее
длина связи для n b = 3 попадает в
антиароматический диапазон, как показано в таблице 1.Правило 4 n + 2 здесь не работает, потому что
в кольце четыре электрона, если предположить, что центральный углерод
в данный момент обладает обоими π-электронами. Даже в этом случае
1,424 CCSD (T) средняя длина связи приближается к ароматической области.
континуума. Следовательно, удаление атома углерода из c- (C) C 3 H 2 для создания c-C 3 H 2 четко
заметно влияет на ароматичность. Такие результаты подтверждают
выводы из работы (6) о том, что заместители могут сильно влиять на ароматичность в
циклопропенильная геометрия даже при простой замене атома углерода
с карбидной группой.
Даже в этом случае
1,424 CCSD (T) средняя длина связи приближается к ароматической области.
континуума. Следовательно, удаление атома углерода из c- (C) C 3 H 2 для создания c-C 3 H 2 четко
заметно влияет на ароматичность. Такие результаты подтверждают
выводы из работы (6) о том, что заместители могут сильно влиять на ароматичность в
циклопропенильная геометрия даже при простой замене атома углерода
с карбидной группой.
Выводы
В заключении планарные,
ароматические молекулы, определенные в традиционных
смысл имеют среднюю длину связи C – C 1,41 Å или меньше.
ПАУ, очевидно крупные ПАУ, представляют собой верхнюю границу этого среднего значения.
длина облигации. Плоские, циклические антиароматические частицы имеют среднюю связь
длиной от 1,41 до 1,50 Å. Циклические геометрии со связкой
длины более 1,50 Å соответствуют одинарным C – C
определения связи ∼1,54 Å. Следовательно, средний
Длина связи C – C может быть хорошим предиктором первого порядка относительно того,
Циклический углеводород является ароматическим или антиароматическим.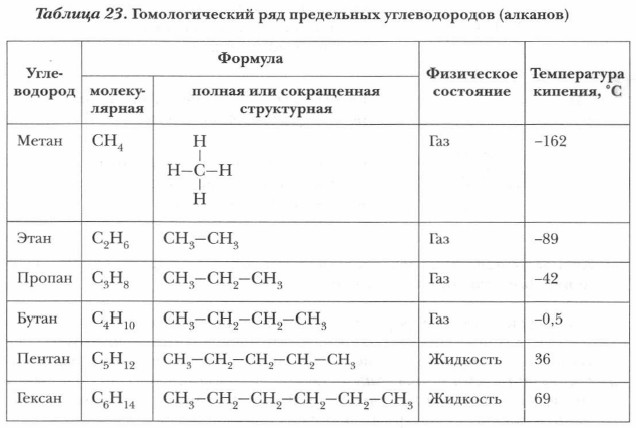 Мы не пропагандируем
надежный прогноз для ароматической классификации, но этот простой
метрика, кажется, хорошо коррелирует в качестве первоначального предположения. Хотя большинство
квантово-химические определения ароматичности слишком дороги
для молекул, имеющих астрофизическое значение, таких как ПАУ, эффективно определяя
природа химического вещества может быть легко достигнута с помощью
структурный ароматический показатель, описанный здесь.
Мы не пропагандируем
надежный прогноз для ароматической классификации, но этот простой
метрика, кажется, хорошо коррелирует в качестве первоначального предположения. Хотя большинство
квантово-химические определения ароматичности слишком дороги
для молекул, имеющих астрофизическое значение, таких как ПАУ, эффективно определяя
природа химического вещества может быть легко достигнута с помощью
структурный ароматический показатель, описанный здесь.
Еще нет
чтобы увидеть, как боковые группы и другие заместители влияют на
средняя длина связи для ароматичности (см., например, c- (C) C 3 H 2 ).Однако такой анализ оставим на будущее.
Работа. Подобный подход, вероятно, можно использовать для других классов.
молекул помимо углеводородов, таких как азотированные молекулы ПАУ
(PANH) и трехмерные геометрии, такие как фуллерены. Тем не мение,
ориентиры средней длины облигаций в таких системах, считающихся ароматическими
или антиароматические должны быть установлены в первую очередь.
Детали вычислений
Вычисления CCSD (T) / apVTZ используют программу PSI4; 43,44 вычисления MP2-F12 / apVDZ взяты из MOLPRO 2015.1, 45,46 и вычисления AM1 взяты из Gaussian09. 47 Два прежних вычислительных подхода используют замороженный приближение остовных электронов. Энергия колебаний нулевой точки (ZPVEs) не включены в вычисления энергии из-за сложности в их вычислении для ПАУ с помощью существующих стандартных подходов. Однако сами абсолютные связывающие и изодесмические энергии не так важны для этого исследования, как относительные значения, и ZPVE как известно, включения незначительно влияют на относительную энергию ПАУ. из-за их регулярности. 40
Благодарности
R.C.F. благодарит за поддержку гранта НАСА NNX17Ah25G
изданный
через Управление научной миссии. Авторы выражают благодарность
Профессор Джошуа П. Лэйфилд из Университета Сент-Томас (Миннесота) для
полезные обсуждения, связанные с этой рукописью.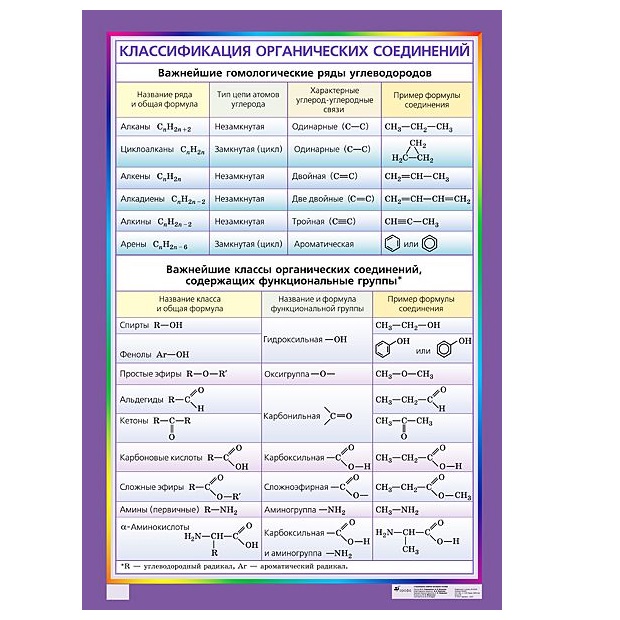
Настоящий адрес автора
# Школа химии и биохимии Технологического института Джорджии, Атланта, Джорджия, 30332-0400, США (C.M.N.).
Примечания
Авторы заявляют, что нет конкурирующий финансовый интерес.
Литература
- Ока Т. Инфракрасный Спектр H 3 + в лабораторной и космической плазме. Ред. Мод. Phys. 1992, 64, 1141–1149. 10.1103 / RevModPhys.64.1141. [CrossRef] [Google Scholar]
- МакКолл Б. Дж. Диссоциативный Рекомбинация холода H 3 + и его межзвездного Подразумеваемое. Филос. Пер. R. Soc., А 2006, 364, 2953–2963. 10.1098 / rsta.2006.1876. [PubMed] [CrossRef] [Google Scholar]
- Полянский О.Л .; Алия А.; Зобов Н. Ф .; Mizus I. I .; Овсянников Р. И .; Теннисон Дж .; Lodi L .; Сидаровски Т .; Часар А. Г.
Спектроскопия H 3 + на основе новой высокоточной поверхности глобальной потенциальной энергии. Филос. Пер. R. Soc., А
2012, 370, 5014–5027.
 10.1098 / rsta.2012.0014. [PubMed] [CrossRef] [Google Scholar]
10.1098 / rsta.2012.0014. [PubMed] [CrossRef] [Google Scholar] - Робертс Дж. Д .; Streitwieser A. Jr; Риган С. М. Соединения с малым кольцом. X. Молекулярно-орбитальные расчеты свойств некоторых малых колец. Углеводороды и свободные радикалы. Дж.Являюсь. Chem. Soc. 1952, 74, 4579–4582. 10.1021 / ja01138a038. [CrossRef] [Google Scholar]
- Krygowski T. M .; Szatylowicz H .; Стасюк О. А .; Dominikowska J .; Палусяк М. Ароматичность от Точка зрения молекулярной геометрии: Приложение к планарным системам. Chem. Ред. 2014, 114, 6383–6422. 10.1021 / cr400252h. [PubMed] [CrossRef] [Google Scholar]
- Wang Y .; Фернандес I .; Duvall M .; Wu J. I.-C .; Li Q .; Frenking G .; фон Раге Шлейер П. Последовательные оценки ароматичности аналогов метиленциклопропена.J. Org. Chem. 2010, 75, 8252–8257. 10.1021 / jo1020097. [PubMed] [CrossRef] [Google Scholar]
- Fernández I .; Duvall M .; Wu J. I.-C .; von Rague Schleyer P .; Френкинг Г.
Ароматичность в группе
14 Гомологи Cyclopropenylium
Катион.
 Chem. — Евро. Дж.
2011, 17, 2215–2224. 10.1002 / chem.201001392. [PubMed] [CrossRef] [Google Scholar]
Chem. — Евро. Дж.
2011, 17, 2215–2224. 10.1002 / chem.201001392. [PubMed] [CrossRef] [Google Scholar] - Feixas F .; Solà M .; Barroso J.M .; Ugalde J.M .; Матито Э. Новое приближение плотности третьего порядка: приложение к вычислению коррелированных Многоцентровые индексы.J. Chem. Теория вычисл. 2014, 10, 3055–3065. 10.1021 / ct5002736. [PubMed] [CrossRef] [Google Scholar]
- Feixas F .; Matito E .; Poater J .; Сола М. Количественная оценка Ароматичность с помощью мер делокализации электронов. Chem. Soc. Ред. 2015, 44, 6434–6451. 10.1039 / C5CS00066A. [PubMed] [CrossRef] [Google Scholar]
- Попов И.А .; Пан Ф.-Х .; Вы X.-R .; Ли Л.-Дж .; Matito E .; Liu C .; Zhai H.-J .; Вс З.-М .; Болдырев А.И. Своеобразный цельнометаллический σ-Ароматичность аниона [Au 2 Sb 16 4–] в твердом состоянии.Энгью. Chem., Int. Эд. 2016, 55, 15344–15346. 10.1002 / anie.201609497. [PubMed] [CrossRef] [Google Scholar]
- Thaddeus P .; Vrtilek J.
 M .; Готтлиб К. А.
Лаборатория
и астрономическое обнаружение
Циклопропанилидена, C 3 H 2 . Astrophys. Дж.
1985, 299, L63 – L66. 10.1086 / 184581. [CrossRef] [Google Scholar]
M .; Готтлиб К. А.
Лаборатория
и астрономическое обнаружение
Циклопропанилидена, C 3 H 2 . Astrophys. Дж.
1985, 299, L63 – L66. 10.1086 / 184581. [CrossRef] [Google Scholar] - Герцберг Г. Электронные спектры и Электронное строение многоатомных молекул; Ван Ностранд: Нью-Йорк, 1966. [Google Scholar]
- Hellwege K.-ЧАС.; Hellwege A.M .. Структурные данные Свободные многоатомные молекулы; Springer: Berlin, 1976. [Google Scholar]
- Kuchitsu K. Структура свободного многоатомного атома. Молекулы; Springer: Berlin, 1998. [Google Scholar]
- Kummli D. S .; Lobsiger S .; Frey H.-M .; Leutwyler S .; Стэнтон Дж. Точное определение структуры циклооктатетраена. с помощью фемтосекундной спектроскопии вращательной когерентности и расчетов ab Initio . J. Phys. Chem. А 2008, 112, 9134–9143. 10.1021 / jp803523y. [PubMed] [CrossRef] [Google Scholar]
- фон
Шлейер П.Р.; Цзяо Х.
Что такое ароматичность ?. Pure Appl. Chem.
1996, 68, 209–218.
 10.1351 / pac199668020209. [CrossRef] [Google Scholar]
10.1351 / pac199668020209. [CrossRef] [Google Scholar] - Крыговски Т. М. Структура и реакционная способность; Либман Дж. Л .; Гринберг А., ред .; VCH: Weinheim, 1988. [Google Scholar]
- Тиленс А. Физика и химия. межзвездной среды; Кембриджский университет Press: Cambridge, UK, 2005. [Google Scholar]
- Allamandola L.J. In PAHs и Вселенная: Симпозиум, посвященный 25-летию гипотеза ПАУ; Джоблин К., Tielens A. G. G. M., Eds .; Серия публикаций EAS: Кембридж, Великобритания, 2011. [Google Scholar]
- Cami J .; Bernard-Salas J .; Peeters E .; Малек С. Э. Обнаружение C 60 и C 70 в молодой планетарной туманности. Наука 2010, 329, 1180–1192. 10.1126 / science.11. [PubMed] [CrossRef] [Google Scholar]
- Chen Z .; Wu J. I .; Corminboeuf C .; Bohmann J .; Lu X .; Hirsch A .; фон Раге Шлейер П. Is C 60 Бакминстерфуллерен Ароматный ?. Phys. Chem. Chem. Phys.2012, 14, 14886–14891. 10.1039 / c2cp42146a. [PubMed] [CrossRef] [Google Scholar]
- Zhen J .
 ; Castellanos P .; Паардекупер Д. М .; Linnartz H .; Тиленс А.Г.Г.М.
Лаборатория
Образование фуллеренов из ПАУ: межзвездная химия сверху вниз. Astrophys. Дж.
2014, 797, L30.10.1088 / 2041-8205 / 797/2 / L30. [CrossRef] [Google Scholar]
; Castellanos P .; Паардекупер Д. М .; Linnartz H .; Тиленс А.Г.Г.М.
Лаборатория
Образование фуллеренов из ПАУ: межзвездная химия сверху вниз. Astrophys. Дж.
2014, 797, L30.10.1088 / 2041-8205 / 797/2 / L30. [CrossRef] [Google Scholar] - Кэмпбелл Э. К .; Holz M .; Герлих Д .; Майер Дж. П. Лабораторное подтверждение C 60 + как носитель двух диффузных межзвездных группы.Природа 2015, 523, 322–324. 10.1038 / природа14566. [PubMed] [CrossRef] [Google Scholar]
- Kiralj R .; Феррейра М. М. С. Прогнозирование длин связей в плоском бензоидном полициклическом соединении Ароматические углеводороды: хемометрический подход. J. Chem. Инф. Comput. Sci. 2002, 42, 508–523. 10.1021 / ci010063g. [PubMed] [CrossRef] [Google Scholar]
- Ли Т. Дж .; Хуанг X .; Датео К. Э.
Эффект
приближения некоторых
Молекулярные интегралы в расчетах связанных кластеров: основные частоты
и Ровибрационные спектроскопические константы для изотопологов циклопропенилидена.Мол.
 Phys.
2009, 107, 1139–1152. 10.1080 / 002689709455. [CrossRef] [Google Scholar]
Phys.
2009, 107, 1139–1152. 10.1080 / 002689709455. [CrossRef] [Google Scholar] - Shavitt I .; Бартлетт Р. Дж. Многотельные методы в области химии и физики: MBPT и теория связанных кластеров; Cambridge University Press: Cambridge, 2009. [Google Scholar]
- Crawford T. D .; Шефер Х. Ф. III в обзорах по вычислительной химии; Липковиц К. Б .; Boyd D. B., Eds .; Wiley: Нью-Йорк, 2000; Vol. 14. С. 33–136. [Google Scholar]
- Raghavachari K .; Грузовики G.W .; Попл Дж.А .; Хед-Гордон М. Пятый порядок Сравнение возмущений теории корреляции электронов. Chem. Phys. Lett. 1989, 157, 479–483. 10.1016 / S0009-2614 (89) 87395-6. [CrossRef] [Google Scholar]
- Даннинг Т. Х. Гауссовский Базовые наборы для использования в коррелированных молекулярных расчетах. I. Атомы Бор через неон и водород. J. Chem. Phys. 1989, 90, 1007–1023. 10.1063 / 1.456153. [CrossRef] [Google Scholar]
- Петерсон К. А .; Даннинг Т. Х.
Сравнительные расчеты с коррелированной молекулярной волной
Функции.
 VII. Энергия связи и структура димера HF. J. Chem. Phys.
1995, 102, 2032–2041. 10.1063 / 1.468725. [CrossRef] [Google Scholar]
VII. Энергия связи и структура димера HF. J. Chem. Phys.
1995, 102, 2032–2041. 10.1063 / 1.468725. [CrossRef] [Google Scholar] - Møller C .; Плессет М.С. Обратите внимание на Аппроксимация для многих электронов Системы. Phys. Ред. 1934, 46, 618–622. 10.1103 / PhysRev.46.618. [CrossRef] [Google Scholar]
- Werner H.-J .; Адлер Т. Б .; Манби Ф. Р. Общий орбитальный инвариант MP2-F12 Теория. J. Chem. Phys. 2007, 126, 16410210.1063 / 1.2712434. [PubMed] [CrossRef] [Google Scholar]
- Хельгакер Т.; Руден Т. А .; Jørgensen P .; Olsen J .; Клоппер В. А Priori Расчет молекулярных свойств с химической точностью. J. Phys. Орг. Chem. 2004, 17, 913–933. 10.1002 / poc.841. [CrossRef] [Google Scholar]
- Smith S. A .; Рука К. Э .; Любовь М.Л .; Hill G .; Магерс Д. Х. Общепринятый Деформационная энергия азетидина и фосфетана: функциональная плотность Can Density Теория дает надежные результаты ?. J. Comput. Chem. 2013, 34, 558–565. 10.1002 / jcc.23165. [PubMed] [CrossRef] [Google Scholar]
- Валтазанос П.
 ; Эльберт С. Т .; Xantheas S .; Рюденберг К.
Открытие кольца
Циклопропилиден в аллен: глобальные особенности реакционной поверхности. Теор. Chem. В соотв.
1991, 78, 287–326. 10.1007 / BF01112344. [CrossRef] [Google Scholar]
; Эльберт С. Т .; Xantheas S .; Рюденберг К.
Открытие кольца
Циклопропилиден в аллен: глобальные особенности реакционной поверхности. Теор. Chem. В соотв.
1991, 78, 287–326. 10.1007 / BF01112344. [CrossRef] [Google Scholar] - Aoki K .; Икута С .; Мураками А. Равновесие Геометрия и устойчивость из C 3 H Radical: ab initio MO Study. Теор. Chem. В соотв. 1996, 365, 103–110. 10.1016 / 0166-1280 (96) 04513-7. [CrossRef] [Google Scholar]
- Стэнтон Дж. Ф. Сильный Псевдо-эффект Яна-Теллера в циклическом радикале C 3 H.Chem. Phys. Lett. 1995, 237, 20–26. 10.1016 / 0009-2614 (95) 00270-Е. [CrossRef] [Google Scholar]
- Bassett M. K .; Фортенберри Р. К. Симметрия Разрывные и спектральные соображения Удивительно гибкий c-C 3 H-радикал и связанная с ним дипольная связь Возбужденное состояние c -C 3 H — . J. Chem. Phys. 2017, 146, 22430310.1063 / 1.4985095. [PubMed] [CrossRef] [Google Scholar]
- Fortenberry R.
 C .; Мур М. М .; Ли Т. Дж.
Тенденции возбужденного состояния в двунаправленном направлении
Расширенные анионы ПАУ и ПАНГ с закрытой оболочкой.Дж.
Phys. Chem. А
2016, 120, 7327–7334. 10.1021 / acs.jpca.6b06654. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
C .; Мур М. М .; Ли Т. Дж.
Тенденции возбужденного состояния в двунаправленном направлении
Расширенные анионы ПАУ и ПАНГ с закрытой оболочкой.Дж.
Phys. Chem. А
2016, 120, 7327–7334. 10.1021 / acs.jpca.6b06654. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Филипек Г. Т. II; Фортенберри Р. К. Формация потенциальных межзвездных Молекулы благородных газов в газовой и адсорбированной фазах. САУ Омега 2016, 1, 765–772. 10.1021 / acsomega.6b00249. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Dewar M. J. S .; Зоебиш Э. Г .; Хили Э. Ф .; Стюарт Дж. Дж. П. AM1: новый универсальный Квантовая механическая модель молекулы.Варенье. Chem. Soc. 1985, 107, 3902–3909. 10.1021 / ja00299a024. [CrossRef] [Google Scholar]
- Bastiansen O .; Hedeberg L .; Хедеберг К. Повторное расследование молекулярной Структура 1,3,5,7-Циклооктатетраена по данным электронной дифракции. J. Chem. Phys. 1957, 27, 1311–1317. 10.1063 / 1.1743999. [CrossRef] [Google Scholar]
- Терни Дж.
 М .; Simmonett A.C .; Пэрриш Р. М .; Hohenstein E. G .; Евангелиста Ф. А .; Fermann J. T .; Минц Б. Дж .; Бернс Л. А .; Wilke J. J .; Abrams M. L .; Русс Н. Дж .; и другие.PSI4:
Программа электронной структуры Ab Initio с открытым исходным кодом. Wiley Interdiscip. Реверс: Comput. Мол. Sci.
2012, 2, 556–565. 10.1002 / wcms.93. [CrossRef] [Google Scholar]
М .; Simmonett A.C .; Пэрриш Р. М .; Hohenstein E. G .; Евангелиста Ф. А .; Fermann J. T .; Минц Б. Дж .; Бернс Л. А .; Wilke J. J .; Abrams M. L .; Русс Н. Дж .; и другие.PSI4:
Программа электронной структуры Ab Initio с открытым исходным кодом. Wiley Interdiscip. Реверс: Comput. Мол. Sci.
2012, 2, 556–565. 10.1002 / wcms.93. [CrossRef] [Google Scholar] - Пэрриш Р. М .; Бернс Л. А .; Смит Д. Г. А .; Simmonett A.C .; ДеПринс А. Э. III; Hohenstein E. G .; Бозкая У .; Соколов А.Ю .; Ремихио Р. Д .; Ричард Р. М .; Gonthier J. F .; и другие. Psi4 1.1: Электронная структура с открытым исходным кодом Программа с упором на автоматизацию, расширенные библиотеки и взаимодействие. J. Chem.Теория вычисл. 2017, 13, 3185–3197. 10.1021 / acs.jctc.7b00174. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Werner H.-J .; Ноулз П. Дж .; Knizia G .; Манби Ф.
Р.; Schütz M .; Celani P .; Györffy W .; Кац Д .; Корона Т .; Lindh R .; Митрушенков А. и др. МОЛПРО, пакет ab Initio
Программы, версия 2015.
 1, 2015, см. Http://www.molpro.net.
1, 2015, см. Http://www.molpro.net. - Werner H.-J .; Ноулз П. Дж .; Knizia G .; Manby F. R .; Шютц М. Молпро: А Пакет программ общего назначения по квантовой химии. ПРОВОДА Comput.Мол. Sci. 2012, 2, 242–253. 10.1002 / wcms.82. [CrossRef] [Google Scholar]
- Frisch M. J .; Грузовики G.W .; Schlegel H. B .; Scuseria G.E .; Робб М. А .; Cheeseman J. R .; Scalmani G .; Barone V .; Mennucci B .; Петерссон Г. А .; Накацудзи Х .. и др., Гауссиан 09, редакция D.01; Gaussian Inc .: Wallingford, CT, 2009.
Технический обзор летучих органических соединений
На этой странице:
Обзор
Органические химические соединения1 присутствуют повсюду как в помещении, так и на открытом воздухе, поскольку они стали важными ингредиентами во многих продуктах и материалах.
- На открытом воздухе ЛОС улетучиваются или выбрасываются в воздух в основном при производстве или использовании повседневных товаров и материалов.

- Внутри помещений ЛОС в основном выбрасываются в воздух в результате использования продуктов и материалов, содержащих ЛОС.
ЛОС вызывают озабоченность как загрязнители воздуха внутри помещений, так и как загрязнители наружного воздуха. Однако акцент этой заботы на открытом воздухе отличается от акцента в помещении. Основная проблема в помещении — это возможность ЛОС негативно повлиять на здоровье людей, подвергшихся их воздействию.Хотя летучие органические соединения также могут представлять опасность для здоровья на открытом воздухе, EPA регулирует выбросы летучих органических соединений на открытом воздухе в основном из-за их способности создавать фотохимический смог при определенных условиях.
Хотя один и тот же термин «ЛОС» используется для обозначения качества воздуха как в помещении, так и на улице, этот термин определяется по-разному, чтобы отразить его преобладающую озабоченность в каждом контексте. Это вызвало недоразумение на рынке и в экологическом сообществе. Кроме того, измеренное количество и состав ЛОС в воздухе могут значительно различаться в зависимости от используемых методов измерения, что вызывает дополнительную путаницу.
Кроме того, измеренное количество и состав ЛОС в воздухе могут значительно различаться в зависимости от используемых методов измерения, что вызывает дополнительную путаницу.
Общее определение и классификации
Летучие органические соединения (ЛОС) означает любое соединение углерода, за исключением монооксида углерода, диоксида углерода, угольной кислоты, карбидов или карбонатов металлов и карбоната аммония, которое участвует в фотохимических реакциях в атмосфере, за исключением обозначенных EPA как обладающий незначительной фотохимической реакционной способностью 2 .
Летучие органические соединения или ЛОС — это органические химические соединения, состав которых позволяет им испаряться при нормальных атмосферных условиях температуры и давления в помещении 3 .Это общее определение ЛОС, которое используется в научной литературе и согласуется с определением качества воздуха в помещениях. Поскольку летучесть 4 соединения обычно тем выше, чем ниже его температура кипения, летучесть органических соединений иногда определяют и классифицируют по их температурам кипения.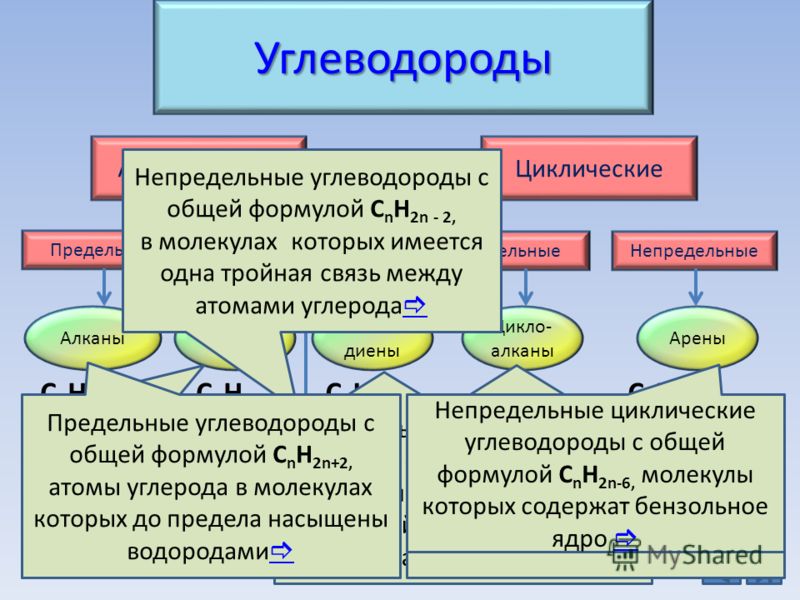
Например, Европейский Союз использует точку кипения, а не его волатильность в своем определении ЛОС.
ЛОС — это любое органическое соединение, начальная точка кипения которого меньше или равна 250 ° C, измеренная при стандартном атмосферном давлении 101.3 кПа. 5, 6, 7
ЛОС иногда классифицируют по легкости их выделения. Например, Всемирная организация здравоохранения (ВОЗ) классифицирует органические загрязнители помещений следующим образом:
- Очень летучие органические соединения (ЛОС)
- Летучие органические соединения (ЛОС)
- Полулетучие органические соединения (SVOC)
Чем выше летучесть (ниже точка кипения), тем больше вероятность того, что соединение будет выброшено из продукта или поверхности в воздух.Очень летучие органические соединения настолько летучие, что их трудно измерить, и они почти полностью обнаруживаются в виде газов в воздухе, а не в материалах или на поверхностях. Наименее летучие соединения, содержащиеся в воздухе, составляют гораздо меньшую часть от общего количества, присутствующего в помещении, в то время как большинство из них находится в твердых или жидких веществах, которые их содержат, или на поверхностях, включая пыль, мебель и строительные материалы.
Классификация неорганических органических загрязнителей (адаптировано из ВОЗ 8 )
| Описание | Аббревиатура | Диапазон температур кипения (° C) | Соединения примера |
|---|---|---|---|
| Очень летучие (газообразные) органические соединения | VVOC | <0 до 50-100 | Пропан, бутан, метилхлорид |
| Летучие органические соединения | VOC | от 50-100 до 240-260 | Формальдегид, d-лимонен, толуол, ацетон, этанол (этиловый спирт) 2-пропанол (изопропиловый спирт), гексаналь |
| Полулетучие органические соединения | SVOC | 240-260 до 380-400 | Пестициды (ДДТ, хлордан, пластификаторы (фталаты), антипирены (ПХД, ПБД)) |
Нормативное определение EPA для ЛОС, влияющих на фотохимическое окисление в наружном воздухе
Общие сведения
В США выбросы ЛОС в окружающую среду регулируются EPA в основном для предотвращения образования озона, составляющего фотохимический смог. Многие ЛОС образуют приземный озон, «вступая в реакцию» с такими источниками молекул кислорода, как оксиды азота (NOx) и монооксид углерода (CO) в атмосфере в присутствии солнечного света. Однако только некоторые ЛОС считаются достаточно «реактивными», чтобы вызывать беспокойство. ЛОС, которые не вступают в реакцию или обладают незначительной реакционной способностью с образованием озона в этих условиях, не подпадают под определение ЛОС, используемое Агентством по охране окружающей среды в своем регламенте. С момента первого создания списка исключенных соединений в 1977 году Агентство по охране окружающей среды добавило несколько к этому списку и часто имеет несколько петиций о дополнительных соединениях, находящихся на рассмотрении.Кроме того, в некоторых штатах есть свои определения и списки исключенных соединений. Таким образом, для целей регулирования конкретное определение ЛОС вне помещений может изменяться в зависимости от того, что исключено из этого определения.
Многие ЛОС образуют приземный озон, «вступая в реакцию» с такими источниками молекул кислорода, как оксиды азота (NOx) и монооксид углерода (CO) в атмосфере в присутствии солнечного света. Однако только некоторые ЛОС считаются достаточно «реактивными», чтобы вызывать беспокойство. ЛОС, которые не вступают в реакцию или обладают незначительной реакционной способностью с образованием озона в этих условиях, не подпадают под определение ЛОС, используемое Агентством по охране окружающей среды в своем регламенте. С момента первого создания списка исключенных соединений в 1977 году Агентство по охране окружающей среды добавило несколько к этому списку и часто имеет несколько петиций о дополнительных соединениях, находящихся на рассмотрении.Кроме того, в некоторых штатах есть свои определения и списки исключенных соединений. Таким образом, для целей регулирования конкретное определение ЛОС вне помещений может изменяться в зависимости от того, что исключено из этого определения.
Непонимание и путаница в отношении ЛОС
EPA ранее определяло регулируемые органические соединения в наружном воздухе как «реактивные органические газы» (ROG). Эта терминология пояснила, что ее значение ограничивается реактивными химическими веществами. Однако позже EPA изменило эту терминологию на «ЛОС».К сожалению, использование термина «ЛОС», а не «ROG», вызвало недоразумение применительно к качеству воздуха в помещении. Многие люди и организации, в том числе производители строительных материалов и продукции, а также сторонние организации по сертификации, стали думать о летучих органических соединениях как о «только тех, которые регулируются EPA для наружного воздуха», и применяют то же определение для воздуха внутри помещений.
Эта терминология пояснила, что ее значение ограничивается реактивными химическими веществами. Однако позже EPA изменило эту терминологию на «ЛОС».К сожалению, использование термина «ЛОС», а не «ROG», вызвало недоразумение применительно к качеству воздуха в помещении. Многие люди и организации, в том числе производители строительных материалов и продукции, а также сторонние организации по сертификации, стали думать о летучих органических соединениях как о «только тех, которые регулируются EPA для наружного воздуха», и применяют то же определение для воздуха внутри помещений.
В той степени, в которой некоторые исключенные соединения влияют на здоровье людей, подвергшихся воздействию, в помещении, определение ЛОС, регулируемых для наружного воздуха, может создать серьезные неправильные представления о качестве воздуха в помещении, поэтому такие ЛОС не следует исключать из рассмотрения для воздуха в помещении. .Например, метиленхлорид (средство для снятия краски) и перхлорэтилен (жидкость для химической чистки) являются соединениями, не подпадающими под действие правил на открытом воздухе, но они могут представлять серьезную опасность для здоровья людей, подвергшихся воздействию, если находятся в помещении.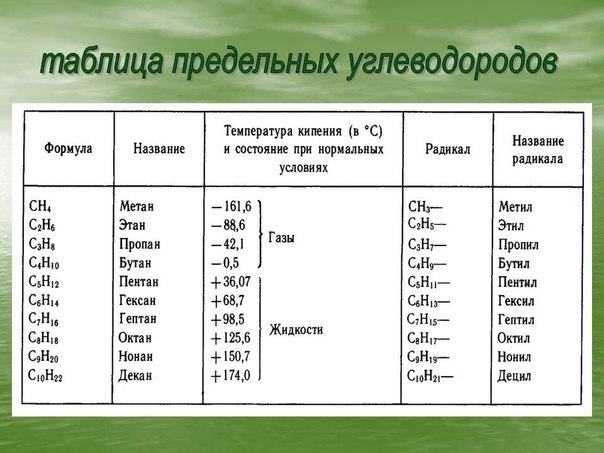 Первый указан Международным агентством по изучению рака (IARC) как потенциальный канцероген для человека, а второй — как вероятный канцероген для человека. ЛОС внутри помещений вступают в реакцию с озоном внутри помещений 9 даже при концентрациях ниже норм общественного здравоохранения.В результате химических реакций образуются частицы субмикронного размера и вредные побочные продукты, которые могут быть связаны с неблагоприятными последствиями для здоровья некоторых уязвимых групп населения.
Первый указан Международным агентством по изучению рака (IARC) как потенциальный канцероген для человека, а второй — как вероятный канцероген для человека. ЛОС внутри помещений вступают в реакцию с озоном внутри помещений 9 даже при концентрациях ниже норм общественного здравоохранения.В результате химических реакций образуются частицы субмикронного размера и вредные побочные продукты, которые могут быть связаны с неблагоприятными последствиями для здоровья некоторых уязвимых групп населения.
Классификация ЛОС
При обсуждении условий внутри помещений все органические химические соединения, которые могут улетучиваться при нормальных условиях температуры и давления в помещении, являются ЛОС. Хотя демаркационная линия между классификациями очень летучих органических соединений (VVOC), летучих органических соединений (VOC) и полулетучих органических соединений (SVOC) (см. Таблицу выше) несколько условна, она показывает широкий диапазон летучести среди органических соединений.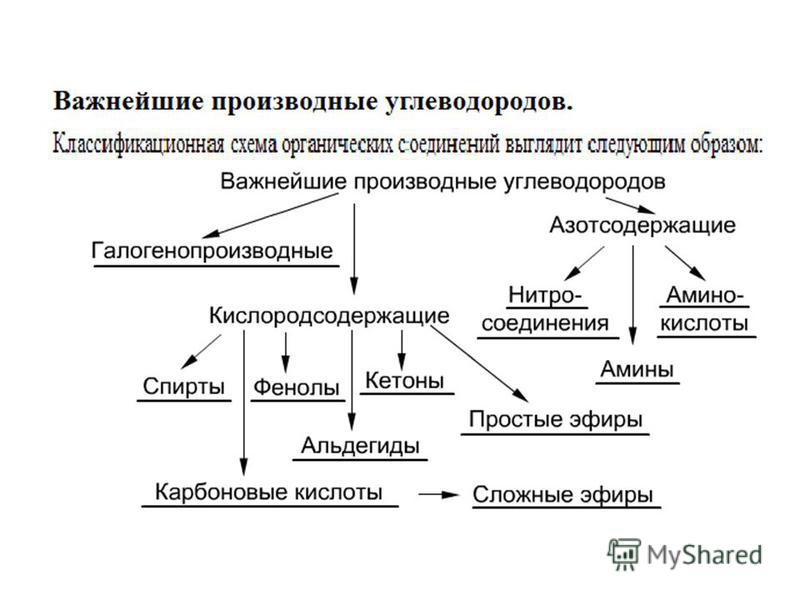 Все три классификации важны для воздуха в помещениях и считаются подпадающими под широкое определение летучих органических соединений в помещениях. Никакие другие критерии, кроме летучести (или точки кипения), не используются для определения ЛОС в помещении.
Все три классификации важны для воздуха в помещениях и считаются подпадающими под широкое определение летучих органических соединений в помещениях. Никакие другие критерии, кроме летучести (или точки кипения), не используются для определения ЛОС в помещении.
Измерение ЛОС в воздухе помещений
Знание о ЛОС, которые присутствуют в низких концентрациях, обычно присутствующих в воздухе помещений. в любой конкретной ситуации сильно зависит от того, как они измеряются. Все доступные методы измерения избирательны в том, что они могут точно измерить и количественно определить, и ни один из них не способен измерить все присутствующие ЛОС.Например, бензол и толуол измеряются другим методом, чем формальдегид и другие подобные соединения. Диапазон методов измерения и аналитических инструментов велик и будет определять чувствительность измерений, а также их избирательность или погрешности. Вот почему любое заявление о ЛОС, присутствующих в данной среде, должно сопровождаться описанием того, как были измерены ЛОС, чтобы профессионал мог правильно интерпретировать результаты.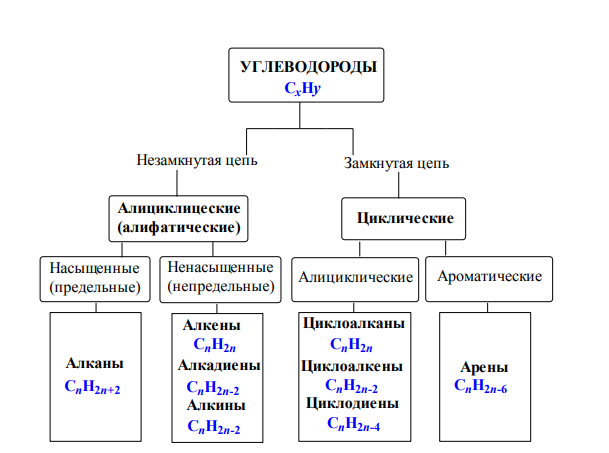 В отсутствие такого описания заявление имело бы ограниченное практическое значение.
В отсутствие такого описания заявление имело бы ограниченное практическое значение.
Маркировка продуктов
Для потребителей важно понимать, что информация на этикетках или другой документации о продуктах с широкими заявлениями о воздействии на окружающую среду с использованием таких терминов, как «зеленый» или «экологически чистый», может включать или не включать некоторые из Летучие органические соединения выделяются из продукта, поэтому их вредное воздействие на здоровье не учитывается.
Тем не менее, существуют национальные и международные программы, которые сертифицируют и маркируют продукты и материалы на основе их воздействия на качество воздуха в помещении, такого как различные эффекты для здоровья и комфорта человека, включая запах, раздражение, хроническую токсичность или канцерогенность.Такие программы, вероятно, будут включать рассмотрение по крайней мере некоторых ЛОС, вызывающих озабоченность в отношении воздуха внутри помещений. Однако нормы и требования, используемые в настоящее время в индустрии маркировки и сертификации продукции для помещений, не стандартизированы. Правительство или сторонняя организация еще не установили основные правила для разработки последовательных, защитных стандартных методов тестирования для оценки и сравнения продуктов и материалов. Отсутствие стандартизации в большинстве случаев затрудняет для потребителя полное понимание того, что означают этикетки и сертификаты.
Правительство или сторонняя организация еще не установили основные правила для разработки последовательных, защитных стандартных методов тестирования для оценки и сравнения продуктов и материалов. Отсутствие стандартизации в большинстве случаев затрудняет для потребителя полное понимание того, что означают этикетки и сертификаты.
Некоторые маркировки ЛОС или программы сертификации основаны на ЛОС, выделяемых продуктом во внутреннюю среду, и возможных связанных с этим воздействиях на здоровье. Однако некоторые из них основаны на содержании ЛОС, которые регулируются для контроля образования фотохимического смога на открытом воздухе. Поэтому маркировка ЛОС и программы сертификации могут не дать должной оценки всех ЛОС, выделяемых продуктом, включая некоторые химические соединения, которые могут иметь отношение к качеству воздуха в помещении. Это особенно верно в отношении большинства влажных продуктов, таких как краски или клеи, которые могут иметь маркировку «с низким содержанием летучих органических соединений» или «без летучих органических соединений».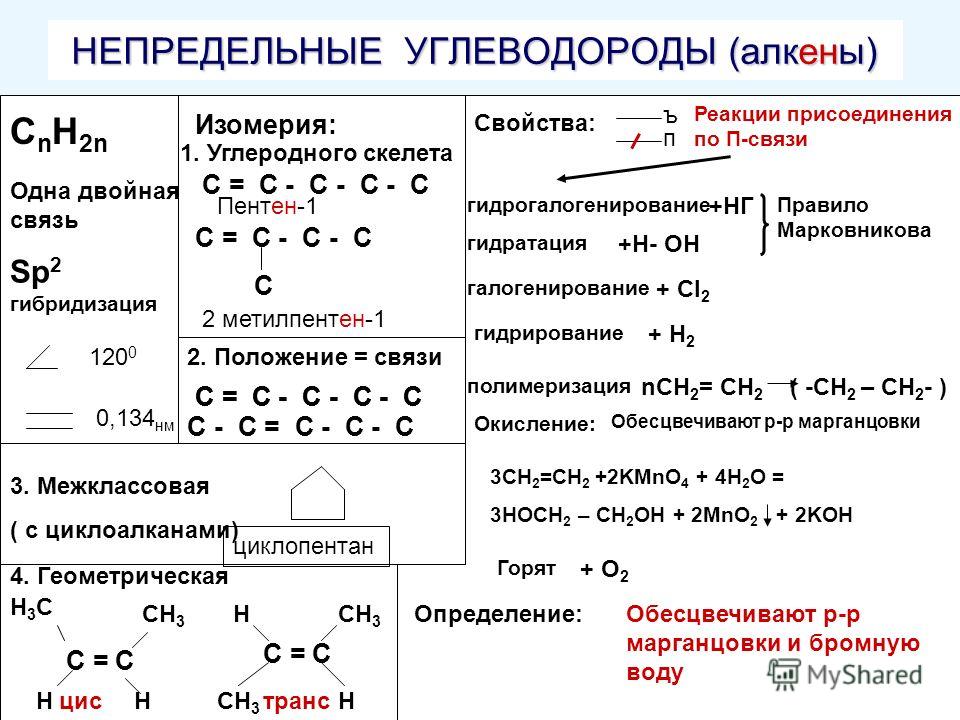
Заключение
Снижение концентрации ЛОС в помещении и на открытом воздухе является важной задачей для здоровья и окружающей среды. Однако важно понимать, что существуют опасные ЛОС внутри и снаружи помещений, которые не влияют на фотохимическое окисление и, следовательно, не регулируются EPA (42 U.S.C. §7401 et seq. (1970)). Важно понимать и понимать это различие, пропагандируя или используя стратегии улучшения качества воздуха в помещениях. Что касается качества воздуха в помещении, ВСЕ органические химические соединения, состав которых дает им возможность испаряться при нормальных атмосферных условиях, считаются ЛОС и должны учитываться при любой оценке воздействия на качество воздуха в помещении.
Ссылки
- Органическое соединение — это любое из большого класса химических соединений, молекулы которых содержат углерод. По историческим причинам некоторые типы соединений, такие как карбонаты, простые оксиды углерода и цианиды, а также аллотропы углерода, считаются неорганическими.
 Разделение на «органические» и «неорганические» углеродные соединения полезно, но может считаться несколько произвольным.
Разделение на «органические» и «неорганические» углеродные соединения полезно, но может считаться несколько произвольным. - Свод федеральных правил, 40: Глава 1, подраздел C, часть 51, подраздел F, 51100.по состоянию на 8 февраля 2009 г. и Глоссарию терминов по окружающей среде EPA, сокращениям и акронимам.
- Нормальные атмосферные условия температуры и давления в помещении, используемые здесь, относятся к диапазону условий, обычно встречающихся в зданиях, где живут люди. Таким образом, в зависимости от типа здания и его географического положения, температура может быть от середины 30 (в градусах Фаренгейта) до 90 ° F, а давление может быть от уровня моря до возвышенности гор, где могут находиться здания. расположена.Это не следует путать со «Стандартной температурой и давлением», которые часто используются при анализе и представлении научных исследований, но по-разному определяются разными авторитетными источниками. Наиболее часто используемые, хотя и не общепринятые, определения — это определения Международного союза теоретической и прикладной химии (IUPAC) и Национального института стандартов и технологий (NIST).
 Стандарт IUPAC — это температура 0 ° C (273, 15 K, 32 ° F) и абсолютное давление 100 кПа (14,504 psi), определение NIST — это температура 20 ° C (293, 15 K, 68 ° F). и абсолютное давление 101.325 кПа (14,696 фунтов на кв. Дюйм).
Стандарт IUPAC — это температура 0 ° C (273, 15 K, 32 ° F) и абсолютное давление 100 кПа (14,504 psi), определение NIST — это температура 20 ° C (293, 15 K, 68 ° F). и абсолютное давление 101.325 кПа (14,696 фунтов на кв. Дюйм). - Летучесть определяется давлением паров вещества. Это тенденция вещества к испарению или скорость, с которой оно испаряется. Вещества с более высоким давлением пара будут испаряться легче при данной температуре, чем вещества с более низким давлением пара.
- «Директива 2004/42 / CE Европейского парламента и Совета» EUR-Lex. Офис публикаций Европейского Союза. Проверено 27 сентября 2007.
- 101,3 кПа = 1 атмосфера, нормальное давление на уровне моря.
- 250 ° С = 482 ° F
- Всемирная организация здравоохранения, 1989. «Качество воздуха в помещениях: органические загрязнители». Отчет о совещании ВОЗ, Берлин, 23-27 августа 1987 г. Отчеты и исследования ЕВРО 111. Копенгаген, Европейское региональное бюро Всемирной организации здравоохранения.


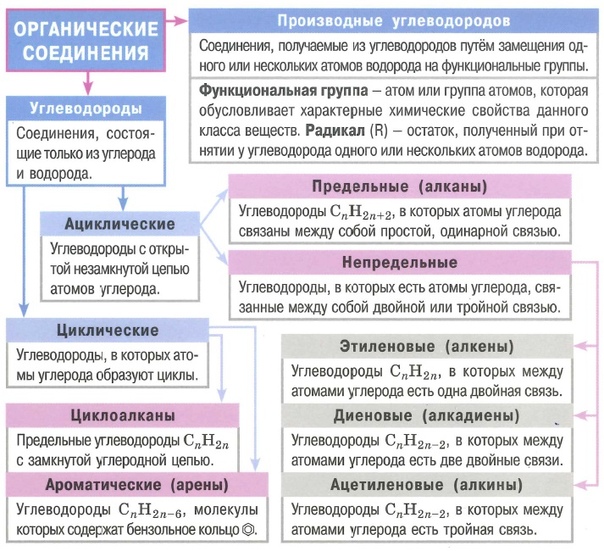
 м
м

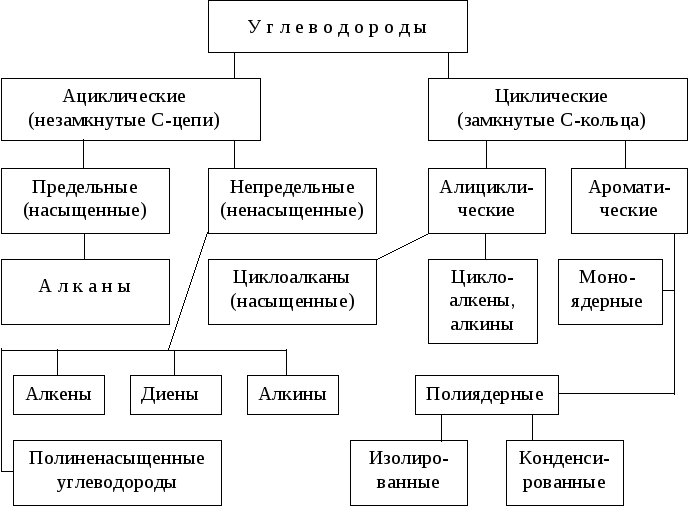


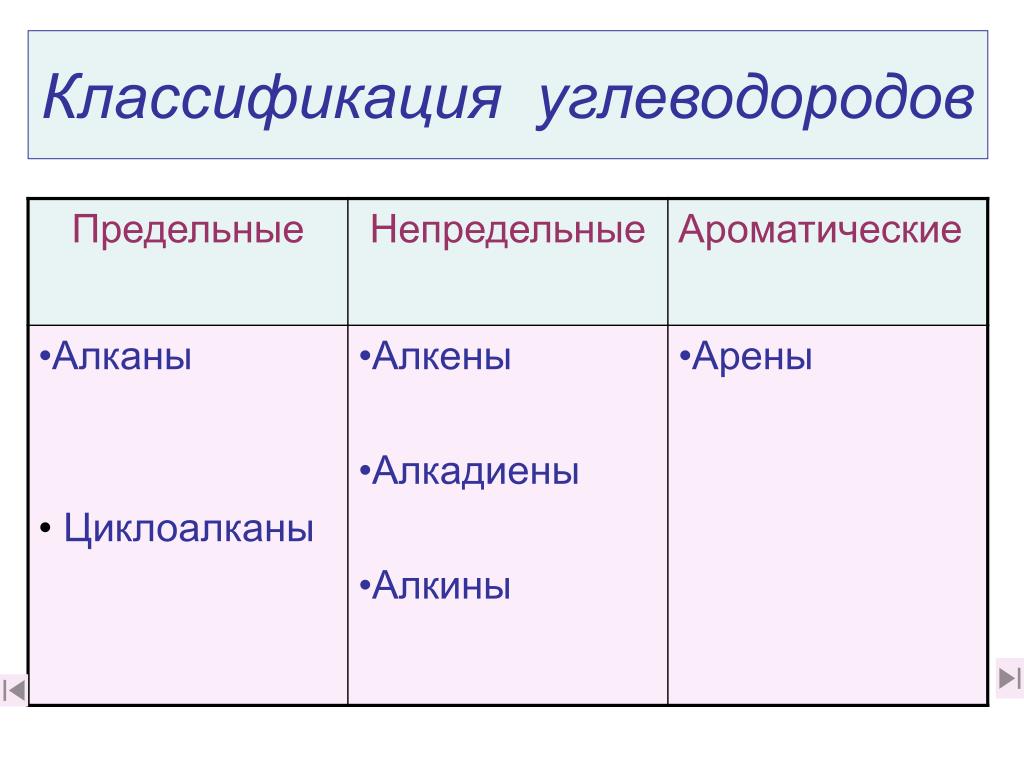 Какое собственное название этой молекулы?
Какое собственное название этой молекулы?

 Используя это определение, четыре класса
углеводороды включены: алканы, алкены, алкины и ароматические.
Используя это определение, четыре класса
углеводороды включены: алканы, алкены, алкины и ароматические.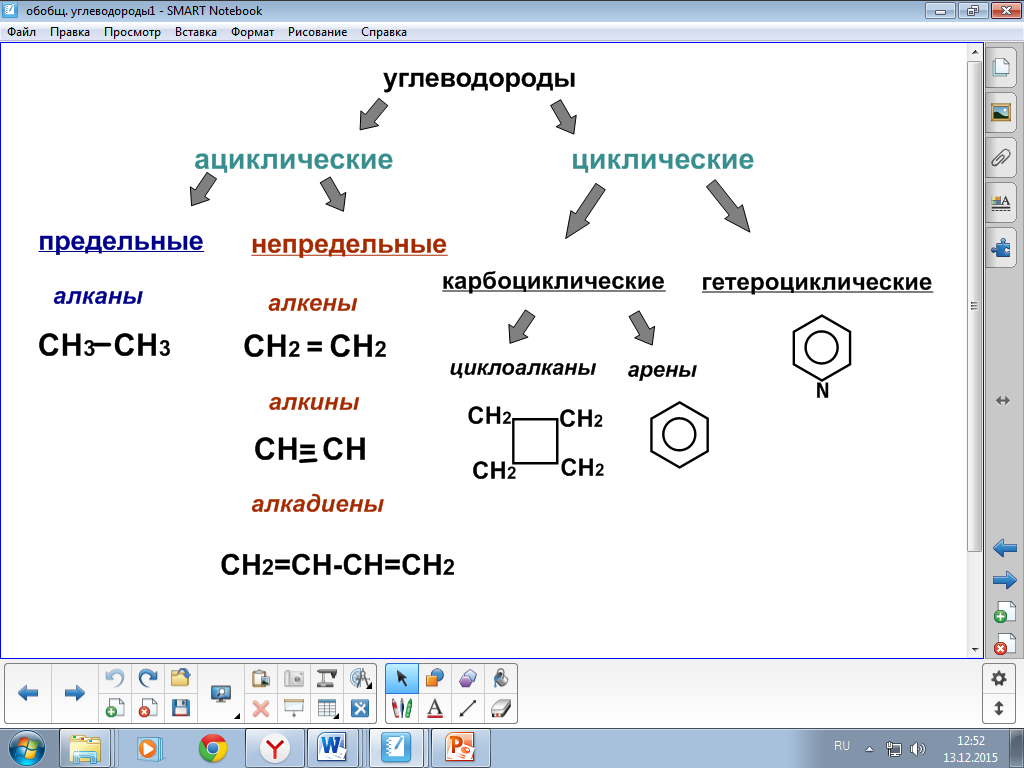
 Эта структура
придает бензолу уникальные свойства, отличные от
другие кольцевые соединения.
Эта структура
придает бензолу уникальные свойства, отличные от
другие кольцевые соединения.
 10.1098 / rsta.2012.0014. [PubMed] [CrossRef] [Google Scholar]
10.1098 / rsta.2012.0014. [PubMed] [CrossRef] [Google Scholar]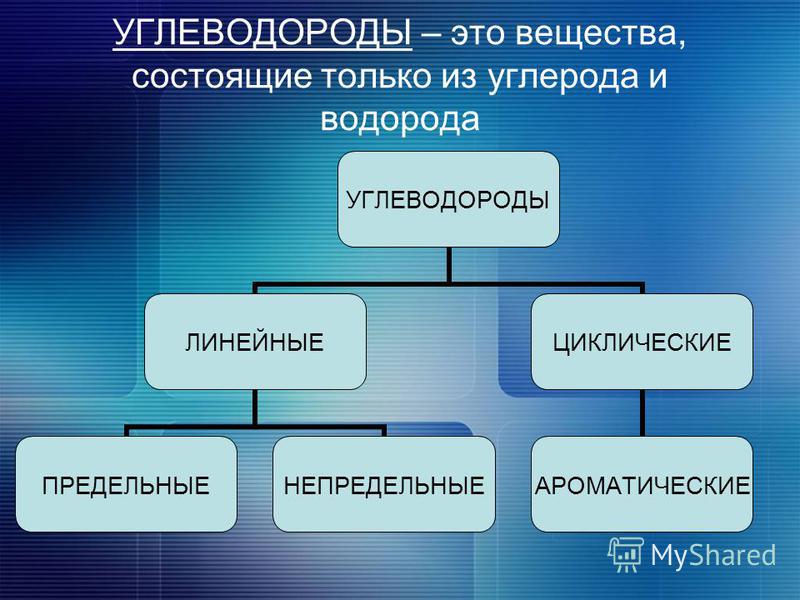 Chem. — Евро. Дж.
2011, 17, 2215–2224. 10.1002 / chem.201001392. [PubMed] [CrossRef] [Google Scholar]
Chem. — Евро. Дж.
2011, 17, 2215–2224. 10.1002 / chem.201001392. [PubMed] [CrossRef] [Google Scholar] M .; Готтлиб К. А.
Лаборатория
и астрономическое обнаружение
Циклопропанилидена, C 3 H 2 . Astrophys. Дж.
1985, 299, L63 – L66. 10.1086 / 184581. [CrossRef] [Google Scholar]
M .; Готтлиб К. А.
Лаборатория
и астрономическое обнаружение
Циклопропанилидена, C 3 H 2 . Astrophys. Дж.
1985, 299, L63 – L66. 10.1086 / 184581. [CrossRef] [Google Scholar] 10.1351 / pac199668020209. [CrossRef] [Google Scholar]
10.1351 / pac199668020209. [CrossRef] [Google Scholar]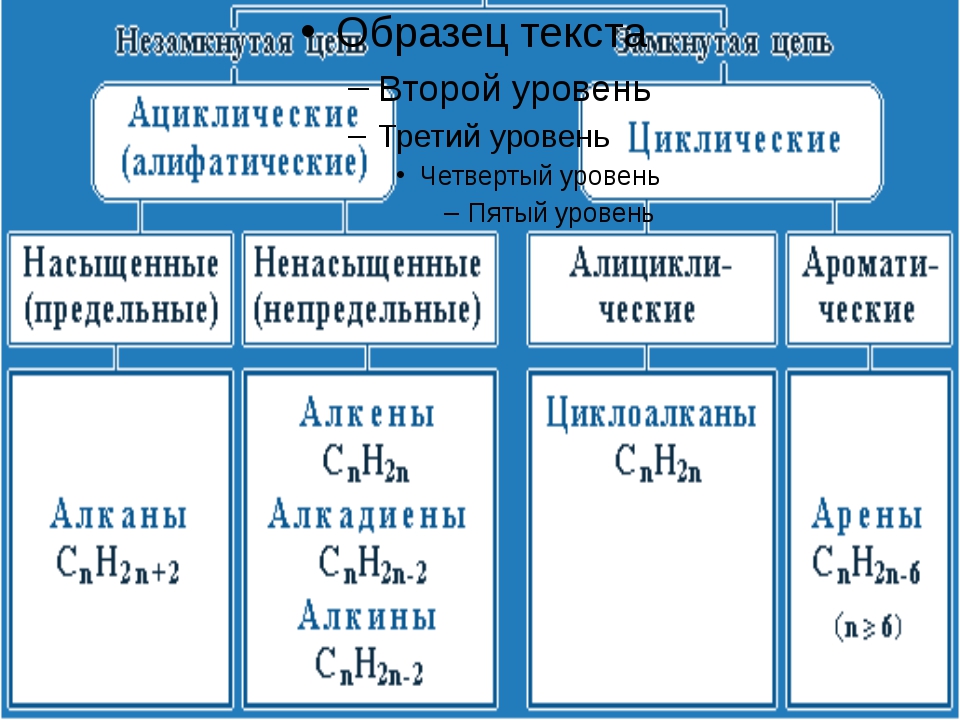 ; Castellanos P .; Паардекупер Д. М .; Linnartz H .; Тиленс А.Г.Г.М.
Лаборатория
Образование фуллеренов из ПАУ: межзвездная химия сверху вниз. Astrophys. Дж.
2014, 797, L30.10.1088 / 2041-8205 / 797/2 / L30. [CrossRef] [Google Scholar]
; Castellanos P .; Паардекупер Д. М .; Linnartz H .; Тиленс А.Г.Г.М.
Лаборатория
Образование фуллеренов из ПАУ: межзвездная химия сверху вниз. Astrophys. Дж.
2014, 797, L30.10.1088 / 2041-8205 / 797/2 / L30. [CrossRef] [Google Scholar] Phys.
2009, 107, 1139–1152. 10.1080 / 002689709455. [CrossRef] [Google Scholar]
Phys.
2009, 107, 1139–1152. 10.1080 / 002689709455. [CrossRef] [Google Scholar] VII. Энергия связи и структура димера HF. J. Chem. Phys.
1995, 102, 2032–2041. 10.1063 / 1.468725. [CrossRef] [Google Scholar]
VII. Энергия связи и структура димера HF. J. Chem. Phys.
1995, 102, 2032–2041. 10.1063 / 1.468725. [CrossRef] [Google Scholar] ; Эльберт С. Т .; Xantheas S .; Рюденберг К.
Открытие кольца
Циклопропилиден в аллен: глобальные особенности реакционной поверхности. Теор. Chem. В соотв.
1991, 78, 287–326. 10.1007 / BF01112344. [CrossRef] [Google Scholar]
; Эльберт С. Т .; Xantheas S .; Рюденберг К.
Открытие кольца
Циклопропилиден в аллен: глобальные особенности реакционной поверхности. Теор. Chem. В соотв.
1991, 78, 287–326. 10.1007 / BF01112344. [CrossRef] [Google Scholar] C .; Мур М. М .; Ли Т. Дж.
Тенденции возбужденного состояния в двунаправленном направлении
Расширенные анионы ПАУ и ПАНГ с закрытой оболочкой.Дж.
Phys. Chem. А
2016, 120, 7327–7334. 10.1021 / acs.jpca.6b06654. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
C .; Мур М. М .; Ли Т. Дж.
Тенденции возбужденного состояния в двунаправленном направлении
Расширенные анионы ПАУ и ПАНГ с закрытой оболочкой.Дж.
Phys. Chem. А
2016, 120, 7327–7334. 10.1021 / acs.jpca.6b06654. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]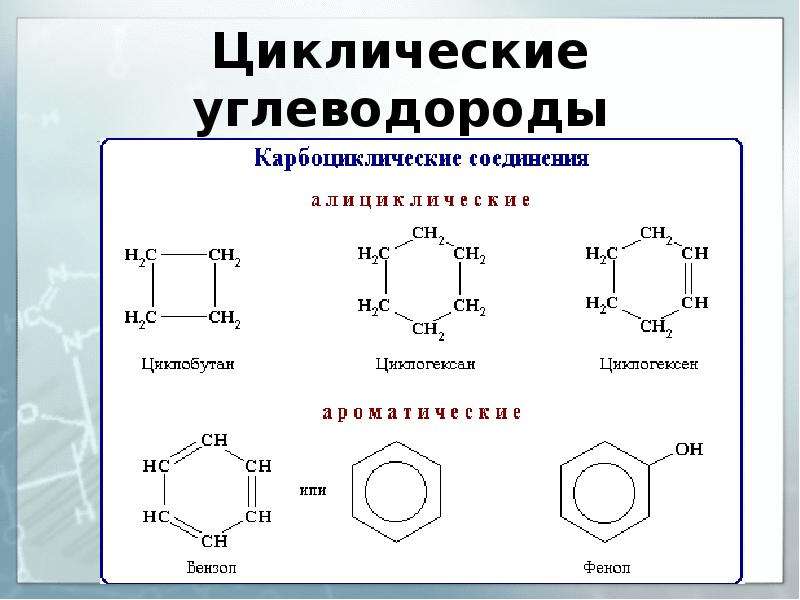 М .; Simmonett A.C .; Пэрриш Р. М .; Hohenstein E. G .; Евангелиста Ф. А .; Fermann J. T .; Минц Б. Дж .; Бернс Л. А .; Wilke J. J .; Abrams M. L .; Русс Н. Дж .; и другие.PSI4:
Программа электронной структуры Ab Initio с открытым исходным кодом. Wiley Interdiscip. Реверс: Comput. Мол. Sci.
2012, 2, 556–565. 10.1002 / wcms.93. [CrossRef] [Google Scholar]
М .; Simmonett A.C .; Пэрриш Р. М .; Hohenstein E. G .; Евангелиста Ф. А .; Fermann J. T .; Минц Б. Дж .; Бернс Л. А .; Wilke J. J .; Abrams M. L .; Русс Н. Дж .; и другие.PSI4:
Программа электронной структуры Ab Initio с открытым исходным кодом. Wiley Interdiscip. Реверс: Comput. Мол. Sci.
2012, 2, 556–565. 10.1002 / wcms.93. [CrossRef] [Google Scholar] 1, 2015, см. Http://www.molpro.net.
1, 2015, см. Http://www.molpro.net.
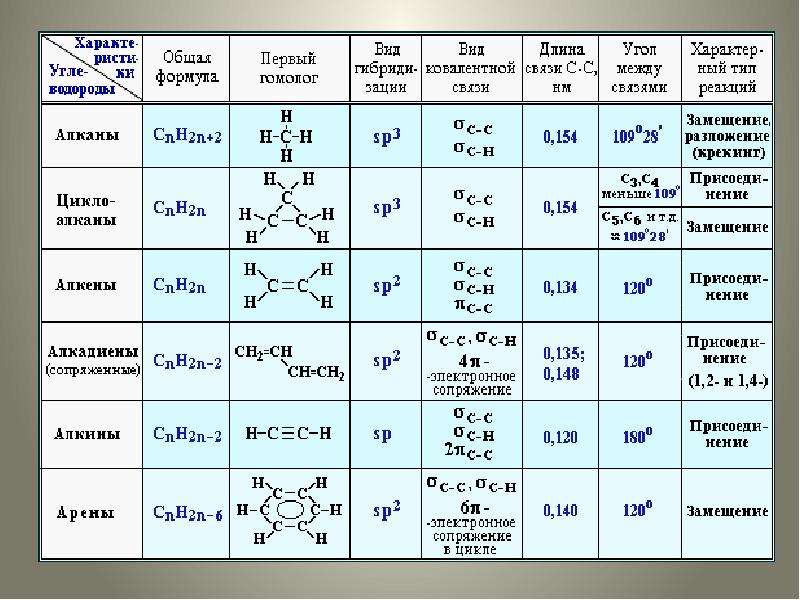 Разделение на «органические» и «неорганические» углеродные соединения полезно, но может считаться несколько произвольным.
Разделение на «органические» и «неорганические» углеродные соединения полезно, но может считаться несколько произвольным.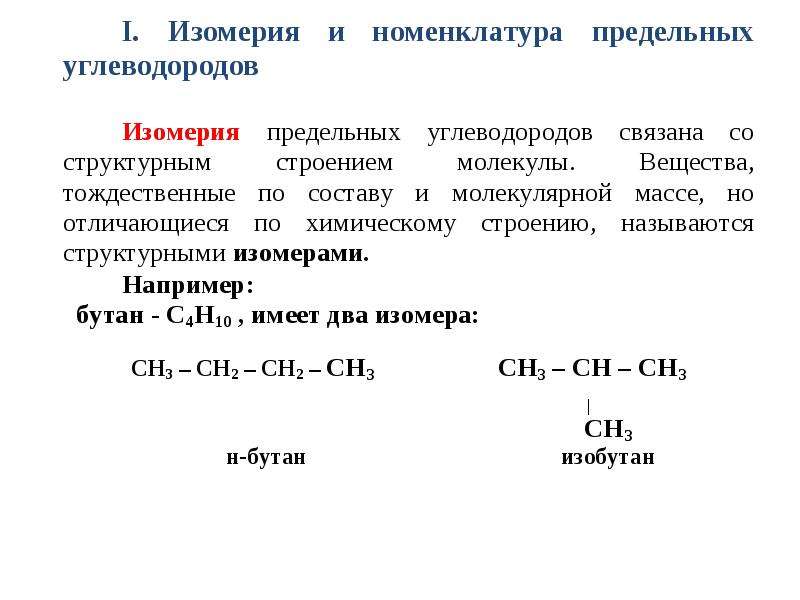 Стандарт IUPAC — это температура 0 ° C (273, 15 K, 32 ° F) и абсолютное давление 100 кПа (14,504 psi), определение NIST — это температура 20 ° C (293, 15 K, 68 ° F). и абсолютное давление 101.325 кПа (14,696 фунтов на кв. Дюйм).
Стандарт IUPAC — это температура 0 ° C (273, 15 K, 32 ° F) и абсолютное давление 100 кПа (14,504 psi), определение NIST — это температура 20 ° C (293, 15 K, 68 ° F). и абсолютное давление 101.325 кПа (14,696 фунтов на кв. Дюйм).