Благородные газы молекулярные кристаллы — Справочник химика 21
Молекулярные кристаллические вещества характеризуются значительной летучестью, твердость их невелика, они легкоплавки. Особенно низки температуры плавления и кипения у тех веществ-, молекулы которых неполярны. Кристаллы, образуемые благородными газами, также следует отнести к молекулярным, состоящим из одноатомных молекул, поскольку валентные силы в образовании этих кристаллов роли не играют, и связи между частицами имеют тот же характер, что и в других молекулярных кристаллах. [c.145]Узлы молекулярной кристаллической решетки образованы молекулами. Молекулярную решетку имеют, например, кристаллы водорода, кислорода, азота, благородных газов, диоксида углерода, органических веш,еств. Структуру кристаллов веществ с не- [c.102]
Твердые тела, построенные из индивидуальных молекул, удерживаемых вместе силами слабого притяжения, называют молекулярными кристаллами.
Узлы молекулярной решетки образованы молекулами. Молекулярную решетку имеют, например, твердый водород, кислород, азот, галогены, благородные газы, диоксид углерода, а также многие органические вещества. Структуру молекулярных кристаллов, образованных [c.136]
Вандерваальсовы связи в молекулярных кристаллах и жидкостях обычно тем сильнее, чем больше размеры атомов и молекул. Например, при переходе к благородным газам с большими порядковыми номерами прочность вандерваальсовой связи также возрастает это видно из сопоставления кривых потенциальной энергии для систем Не—Не и Аг—Аг, которое проводится на рис.
По природе входящих в состав кристалла частиц и по типу химической связи кристаллические решетки подразделяются на молекулярные, ионные, атомные (ковалентные) и металлические. В узлах молекулярных решеток располагаются молекулы вещества. Вещества, имеющие молекулярные решетки, обычно имеют низкие температуры плавления и кипения, высокое давление насыщенного пара. К такого типа веществам относятся, например, твердые Нг, О2, N2, галогены, СО2, все благородные газы (хотя они одноатомны) и многие органические вещества. Кристаллические Аг и Ь имеют одинаковые решетки (рис.
Уже отмечалось, что молекулярные силы, или силы Ван-дер-Ваальса, очень слабы по сравнению с силами ионной и ковалентной связи. Поэтому твердые тела, в которых силы сцепления имеют молекулярную природу, всегда являются мягкими, плавящимися при низких температурах и легко летучими. К такого типа кристаллам относятся, например, благородные газы, азот, Нг, СН4, бензол и другие газы и жидкости, охлажденные ниже температур затвердевания. [c.163]
Следовательно, удельная поверхностная энергия в этом приближении пропорциональна теплоте испарения (сублимации) и обратно пропорциональна молярному объему в степени 2/3. Подобную связь величин а Ж обычно называют правилом Стефана. Приведенные в табл. 2 данные свидетельствуют о приближенной выполнимости правила Стефана изменениям теплоты испарения на три порядка величины при переходе от благородных газов и молекулярных кристаллов к ионным и ковалентным соединениям и металлам отвечает примерно такое же возрастание удельной поверхностной энергии. Для твердых тел, для которых определить величину а трудно (см. подробнее 4 данной главы), соотношение (I—15) позволяет оценить возможные значения поверхностной энергии. [c.22]
Для твердых тел, для которых определить величину а трудно (см. подробнее 4 данной главы), соотношение (I—15) позволяет оценить возможные значения поверхностной энергии. [c.22]
Взаимодействия типа индуцированный диполь — индуцированный диполь. Связи, образуемые за счет таких сил,—наиболее слабые из числа межмолекулярных взаимодействий и встречаются в твердых веществах молекулярного типа, состоящих из симметричных молекул. Например, молекулы твердого иода способны взаимодействовать друг с другом в результате взаимно индуцируемых слабых флуктуирующих диполь-дипольных связей. Упаковка молекул иода 12 в решетке кристалла показана на рис. 8.23, где изображено одно из возможных расположений положительных и отрицательных индуцированных зарядов. Самым лучшим примером проявления взаимодействия типа индуцированный диполь — индуцированный диполь являются благородные газы в жидком или твердом состоянии. Чрезвычайно низкие температуры, необходимые для конденсации или отвердевания этих веществ (температура плавления неона приблизительно  144]
144]
Кристаллы, содержащие бесконечные трехмерные комплексы. Простейшие структуры, относящиеся к этой группе,— это структуры а) благородных газов, б) металлических и интерметаллических соединений и в) многих простых ионных и ковалентных кристаллов, т. е. к этой группе относятся все те кристаллы, в которых нельзя выявить группировки меньшей размерности. Не очень существенно, следует ли включать сюда или относить к молекулярным кристаллы, содержащие такие небольшие молекулы, как Н2, N2 и h3S. Типично ковалентные кристаллы этого класса включают алмаз (и изоструктурные ему Si, BN и т. д.) и родственные соединения, такие, как различные формы Si . Некоторые простейшие структурные типы бинарных соединений, в которых бесконечные трехмерные комплексы распространяются по всему кристаллу, представлены в табл. 1.2. [c.42]
В молекулярных кристаллических решетках в узлах решетки находятся молекулы. Большинство веществ с ковалентной связью образуют кристаллы такого типа.
 [c.260]
[c.260] В узлах молекулярных кристаллических решеток находятся молекулы, которые связаны друг с другом слабыми межмолеку-лярными силами. Такие кристаллы образуют вещества с ковалентной связью в молекулах. Веществ с молекулярной кристаллической решеткой известно очень много. Это твердые водород, хлор, диоксид углерода и другие вещества, которые при обычной температуре газообразны. Кристаллы большинства органических веществ также относятся к этому типу. Молекулярные кристаллические вещества характеризуются значительной летучестью, твердость их невелика, они легкоплавки. Особенно низкие температуры плавления и кипения у тех веществ, молекулы которых неполярны. Кристаллы, образуемые благородными газами, также следует отнести к молекулярным, состоящим из одноатомных молекул, поскольку валентные силы в образовании этих кристаллов роли не играют, и связи между частицами имеют тот же характер, что и в других молекулярных кристаллах.
Примерами структур с однотипной химической связью могут служить жристаллы благородных газов (молекулярная связь), алмаза (ковалентная связь), хлорида натрия (иоиная связь), золота (металлическая связь) Кристаллы графита могут служить примером стр5етуры, характеризующейся связью, промежуточной между ковалентной и металлической Структуры еорганических пигментов, обычно являющихся солями или оксидами, чаще всего характеризуются ковалентной или ионио-ковалентной связями Молекулярная связь присуща кристаллической структуре органических пигментов [c.
 237]
237] Таким образом, можно считать доказанным, что благородные газы образуют смешанные кристаллы со многими летучими гидридами даже в тех случаях, когда молекулы последних имеют большой дипольный момент. Необходимо выяснить, образуют ли благородные газы смешанные кристаллы только с летучими гидридами, или они могут образовать их с какими-либо другими веществами. Молекулы летучих гидридов являются, как мы уже говорили, псевдоатомами, они занимают, так же как и благородные газы, только один узел в кристаллической решетке. Возникает вопрос, действительно ли для изоморфного замещения в молекулярных решетках необходимо, чтобы замещающие друг друга молекулы состояли из одинакового числа атомов. Атомы в молекуле связаны между собой гораздо более сильно, чем отдельные молекулы в решетке. В первом случае мы имеем атомную (гомеополярную) связь, во втором — ван-дер-ваальсову связь. Расстояния между атомами в молекуле поэтому в несколько раз меньше, чем расстояние между центрами тяжести молекул в кристаллической решетке.
Молекулярная кристаллическая решетка содержит в своих узлах молекулы веществ ковалентной природы, т. е. состоящих из атомов, соединенных друге другом ковалентными связями. Эти узловые молекулы связаны друг с другом слабыми ван-дер-ваальсовымн силами. Молекулярная кристаллическая решетма присуща самым разнообразным веществам элементарным окислителям, благородным газам, водородным, галогенным, кислородным соединениям неметаллов, всевозможным кислотам и. наконец, многочисленным органическим веществам. Молекулярным кристаллам свойственны малая механическая прочность, сравнительно большая летучесть и низкие температуры плавления. [c.70]
Вещества с молекулярными кристаллическими решетками. Их свойства. Энергия решеток. Молекулярные кристаллы состоят из индивидуальных молекул ( I2, 12. I4, СО2, СдНв, Sg и т. д.). В большинстве органических веществ молекулярные решетки. Межмолекулярные силы в таких решетках малы (дисперсионные, междипольные, индукционные и иногда силы водородных связей). Дисперсионные силы обладают шаровой симметрией воздействия. Поэтому, когда действуют только они, образуется плотнейшая упаковка молекул в кристалле. Так, кристаллы, образованные из одноатомных молекул благородных газов, имеют гранецентрированную кубическую элементарную ячейку, не искаженную каким-либо взаимодействием направленного характера. Другие вещества с более сложными молекулами, в которых атомы связаны ковалентными связями, образуют кристаллы более [c.130]
Энергия решеток. Молекулярные кристаллы состоят из индивидуальных молекул ( I2, 12. I4, СО2, СдНв, Sg и т. д.). В большинстве органических веществ молекулярные решетки. Межмолекулярные силы в таких решетках малы (дисперсионные, междипольные, индукционные и иногда силы водородных связей). Дисперсионные силы обладают шаровой симметрией воздействия. Поэтому, когда действуют только они, образуется плотнейшая упаковка молекул в кристалле. Так, кристаллы, образованные из одноатомных молекул благородных газов, имеют гранецентрированную кубическую элементарную ячейку, не искаженную каким-либо взаимодействием направленного характера. Другие вещества с более сложными молекулами, в которых атомы связаны ковалентными связями, образуют кристаллы более [c.130]
Радиусы атомов благородных газов Не, Ке, Аг, Кг и Хе равны соответственно 122, 160, 191, 201 и 220 пм. Приведенные значения получены из межатомных расстояний в кристаллах данных веществ, которые существуют при низких температурах. Для атомов этих элементов также наблюдается рост г, с увеличением порядкового номера. Радиусы атомов благородных газов значительно больше радиусов атомов неметаллов соответствующих периодов, поскольку в кристаллах благородных газов межатомное взаимодействие очень слабое (силы Ван-дер-Ваальса), а для молекул других неметаллов характерна прочная ковалентная связь. Можно считать, что атомные радиусы благородных газов — это радиусы валентно не связанных атомов, т. е. ван-дер-ваальСовы радиусы (которые находят из межатомных расстояний в молекулярных кристаллах). [c.51]
Для атомов этих элементов также наблюдается рост г, с увеличением порядкового номера. Радиусы атомов благородных газов значительно больше радиусов атомов неметаллов соответствующих периодов, поскольку в кристаллах благородных газов межатомное взаимодействие очень слабое (силы Ван-дер-Ваальса), а для молекул других неметаллов характерна прочная ковалентная связь. Можно считать, что атомные радиусы благородных газов — это радиусы валентно не связанных атомов, т. е. ван-дер-ваальСовы радиусы (которые находят из межатомных расстояний в молекулярных кристаллах). [c.51]
При образовании молекулярного кристалла, в котором взаимодействия сводятся к вандерваальсовым, перераспределения электронов между молекулами не происходит. Так как вандерваальсовы взаимодействия много слабее кулоновских и ковалентных, молекулярные кристаллы имеют заметно более низкие энергии связи и температуры плавления. Для них характерна плотнейшая упаковка частиц. Наиболее распространены молекулярные кристаллы, образованные органическими веществами (например, углеводородами). Примером неорганических молекулярных кристаллов является затвердевшие благородные газы, [c.176]
Примером неорганических молекулярных кристаллов является затвердевшие благородные газы, [c.176]
Элементы УПА-групны (галогены) в соответствии с правилом 8—N должны иметь координационное число в кристаллах простых веществ, равное единице, т. е. каждый атом может иметь лишь одного ближайшего соседа. Действительно, все галогены (иод при обычных условиях, а остальные при низких температурах) образуют молекулярные кристаллические структуры , в которых расстояния между атомами в гантелеобразных молекулах значительно меньше, чем расстояния между молекулами в кристалле. Так, для хлора длина связи в молекуле 0,202 нм, а расстояние между молекулами в кристалле составляет 0,334 нм. Наконец, правило Юм-Розерп мож но применить и к элементам УП1А-группы (благородные газы) В соответствии с этим правилом при образовании кристаллов про стых веществ координационное число должно быть равно нулю Действительно, кристаллы благородных газов состоят из одноатом ных молекул, связанных силами Ван-дер-Ваальса. [c.30]
[c.30]
Все благородные газы и многие молекулярные вещества с простыми симметричными молекулами кристаллизуются в молекулярных решетках с плотнейшей упаковкой. Это указывает на то, что для межмолекулярпых связей характерны ненасыщенность и нена-правленность. В молекулярных кристаллах из несимметричных молекул структура может быть более рыхлой (приспособленной к асимметрии молекул), но все же определяющим здесь выступает геометрический фактор, а не природа составляющих частиц. Структуры молекулярных кристаллов относятся к гетеродеслшческим в них сосуществуют два типа связи — внутри молекул и между молекулами. Связи, действующие между молекулами, намного слабее, чем межатомные внутри молекул. Поэтому именно мелфизические свойства веществ (температуры плавления, твердость, плотность, тепловое расширение и др.). Низкие температуры плавления, высокая летучесть, малая твердость, незначительная плотность и высокий коэффициент теплового расширения — все это свидетельствует о слабости ван-дер-ваальсовой связи. Оценку величины энергии межмолекулярного взаимодействия можно получить, исходя пз экспериментальных данных по теплотам сублимации молекулярных [c.136]
Оценку величины энергии межмолекулярного взаимодействия можно получить, исходя пз экспериментальных данных по теплотам сублимации молекулярных [c.136]
М. к. образуют орг., металлоорг., мн. комплексные соед., а также бинарные соединения типа HjO, СО , НС1 и др. В форме М. к. могут находиться нек-рые твердые простые в-ва (напр., Hj, галогены, N , О , Sg). Кристаллы благородных газов также молекулярные, построены из одноатомных молекул. М. к. делятся на гомомолекулярные и гетеро-молекулярные. Первые состоят из одинаковых молекул, вторые-из разных. К числу гетеромол. кристаллов относятся, напр., кристаллогидраты орг. соединений, мол. комплексы типа нафталин-тетрацнаноэтнлен, твердые р-ры орг. в-в. [c.117]
Структурные изменения при плавлении. Структурные изменения, происходящие при плавлении, простираются от простого преодоления вандерваальсовых сил, связывающих атомы (благородные газы) и молекулы (молекулярные кристаллы, построенные из неполярных молекул), до полного распада бесконечных группировок атомов в случае кристаллов, содержащих цепи, слои и трехмерные каркасы. При температурах слегка ниже и выше точки плавления плотно упакованного металла в непосредственном окружении атома металла, как правило, существует лишь небольшое различие, хотя дальний порядок сразу исчезает. С другой стороны, при плавлении металлического висмута происходит более значительная перестройка структуры. Вместо обычного уменьшения плотности при плавлении, которое может быть проиллюстрировано поведением такого металла, как свинец, имеет место увеличение ее на 2,5% из-за перехода весьма открытой структуры твердого тела в более плотно упакованную жидкость [c.37]
При температурах слегка ниже и выше точки плавления плотно упакованного металла в непосредственном окружении атома металла, как правило, существует лишь небольшое различие, хотя дальний порядок сразу исчезает. С другой стороны, при плавлении металлического висмута происходит более значительная перестройка структуры. Вместо обычного уменьшения плотности при плавлении, которое может быть проиллюстрировано поведением такого металла, как свинец, имеет место увеличение ее на 2,5% из-за перехода весьма открытой структуры твердого тела в более плотно упакованную жидкость [c.37]
В ряче случаев и более сложных последовательностей (напри-меп гк La, Рг, Nd, Am кгг Sm). Кплотноупаковацным молекулярным кристаллам относятся благородные газы, водород, НС1, HoS п СН4. [c.195]
Молекулярные веса благородных газов также можно рассчитать из данных измерений плотности газа при низких давлениях, как это показано на рис. 6.13. При этом, однако, возникает вопрос о том, сколько атомов находится в молекуле газа. Мы уже знаем, что благородные газы одноатомны, но это было известно не всегда. После открытия благородных газов возникло затруднение, в какое место периодической системы следует их поместить (см. гл. И). К этим газам не удавалось применить закон Дюлонга н Пти, так как их нелегко сконденсировать в кристаллы с помощью методики, доступной в то время. Правда, благородные газы невозможно разложить на газы, состоящие из меньших молекул, что подтверждало догадку об их одноатом-ности, но этот довод все же не является достаточно убедительным. Более определенные сведения о порядковых номерах этих элементов могли бы дать метод рассеяния Резерфорда или рентгеновский метод Мозли, но ко времени открытия благородных газов этих методов еще не существовало. (Правда, если бы они уже были известны, в то время их все равно было бы очень сложно применить к благородным газам. Чем это объясняется Определите температуры плавления и кипения благородных газов по табл. 5.5 и постарайтесь дать ответ на этот вопрос.
Мы уже знаем, что благородные газы одноатомны, но это было известно не всегда. После открытия благородных газов возникло затруднение, в какое место периодической системы следует их поместить (см. гл. И). К этим газам не удавалось применить закон Дюлонга н Пти, так как их нелегко сконденсировать в кристаллы с помощью методики, доступной в то время. Правда, благородные газы невозможно разложить на газы, состоящие из меньших молекул, что подтверждало догадку об их одноатом-ности, но этот довод все же не является достаточно убедительным. Более определенные сведения о порядковых номерах этих элементов могли бы дать метод рассеяния Резерфорда или рентгеновский метод Мозли, но ко времени открытия благородных газов этих методов еще не существовало. (Правда, если бы они уже были известны, в то время их все равно было бы очень сложно применить к благородным газам. Чем это объясняется Определите температуры плавления и кипения благородных газов по табл. 5.5 и постарайтесь дать ответ на этот вопрос.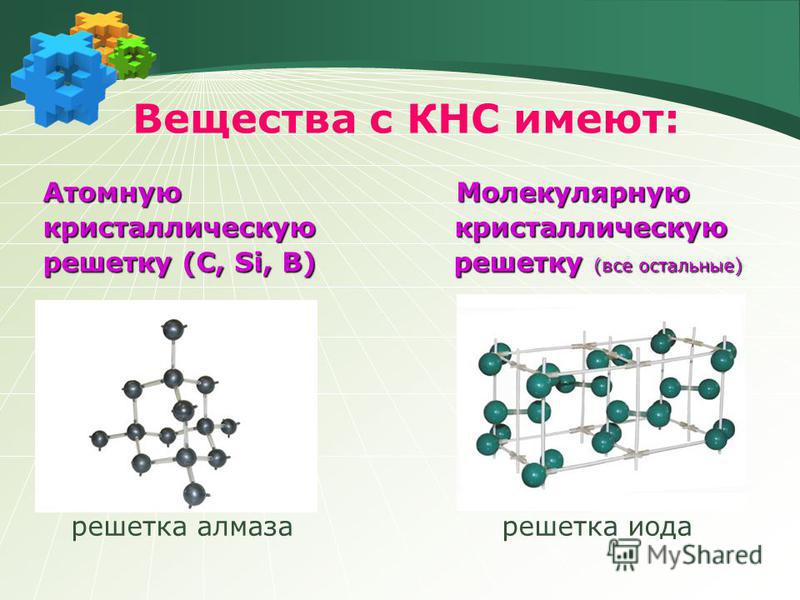 ) [c.245]
) [c.245]
Дисперсионные силы. Взаимодействие валентно насыщенных электронных оболочек атомов и молекул. Это силы, не зависящие от наличия зарядов, дипольных моментов, квадрупольных моментов и т. д. Таковы, например, силы, действующие между молекулами N2, Ог, СО2, благородных газов в их смеси (воздух) и порознь. Эти силы определяют неидеальное поведение безди-польных газов, их сжижение. Дисперсионные силы ответственны 88 существование молекулярных кристаллов, в частности, кристаллов углеводородов. Дисперсионные силы имеют квантовоме- [c.56]
Соединения благородных газов. Со времени открытия благородных газов (гл. 1, разд. 4) их считали химически неактивными и не образующими соединений элементами. Позже появился ряд соединений , в которых молекулы инертных газов были захвачены молекулярными кристаллами типа бензохино-на (так называемые клатраты), но их соединения в строгом смысле этого слова не были известны. В 1962 г. Бартлетт при реакции кислорода с гексафторидом платины получил ионное соединение [02]+[Р1Рб] . Исходя из близости первых потенциалов ионизации 1 Ог (12,70 эВ) и Хе (12,13 эВ), он предположил возможность осуществления такой же реакции для Хе и впервые получил соединение благородного газа Хе(Р1Рв) (, где X = , 2. В дальнейшем было синтезировано много подобных соединений, которые состояли в основном из ксенона, фтора и кислорода, а из соединений других инертных газов досто-рерно обнаружен только бесцветный кристаллический фторид [c.265]
Исходя из близости первых потенциалов ионизации 1 Ог (12,70 эВ) и Хе (12,13 эВ), он предположил возможность осуществления такой же реакции для Хе и впервые получил соединение благородного газа Хе(Р1Рв) (, где X = , 2. В дальнейшем было синтезировано много подобных соединений, которые состояли в основном из ксенона, фтора и кислорода, а из соединений других инертных газов досто-рерно обнаружен только бесцветный кристаллический фторид [c.265]
Адсорбенты по той же классификации, т. е. в зависимости от химического строения их поверхности, определяющего способность к тому или иному виду межмолекулярных взаимодействий, делятся на три типа. К первому типу относятся неспецифические адсорбенты, не несущие на своей поверхности ни ионов, ни каких-либо функциональных групп, связей или центров с локально сосредоточенными на периферии зарядами и не обладающие электронодонорными или электроноакцепторными центрами. На таких адсорбентах любые молекулы адсорбируются неспецифически. К адсорбентам этого типа можно отнести графитированные сажи, в особенности графити-рованную около 3000 °С термическую сажу, поверхность которой состоит в основном из базисных граней графита. Кроме графитированной сажи к неспецифическим адсорбентам относится чистый нитрид бора, молекулярные кристаллы благородных газов и насыщенных углеводородов, а также пленки из таких углеводородов и пористые углеводородные полимеры. Адсорбция на таких адсорбентах мало зависит от локального распределения в адсорбируемых молекулах электронной плотности, в частности, от наличия я-связей и неподеленных электронных пар. Различие в валентных состояниях атомов углерода в таких адсорбентах, как, например, графит, с одной стороны, и насыщенные углеводороды — с другой, сказывается на адсорбции незначительно, хотя и может быть выявлено в некоторых системах (подробнее см. разд. 1 гл. П и рис. 11,12) [90, 91]. [c.22]
К адсорбентам этого типа можно отнести графитированные сажи, в особенности графити-рованную около 3000 °С термическую сажу, поверхность которой состоит в основном из базисных граней графита. Кроме графитированной сажи к неспецифическим адсорбентам относится чистый нитрид бора, молекулярные кристаллы благородных газов и насыщенных углеводородов, а также пленки из таких углеводородов и пористые углеводородные полимеры. Адсорбция на таких адсорбентах мало зависит от локального распределения в адсорбируемых молекулах электронной плотности, в частности, от наличия я-связей и неподеленных электронных пар. Различие в валентных состояниях атомов углерода в таких адсорбентах, как, например, графит, с одной стороны, и насыщенные углеводороды — с другой, сказывается на адсорбции незначительно, хотя и может быть выявлено в некоторых системах (подробнее см. разд. 1 гл. П и рис. 11,12) [90, 91]. [c.22]
Молекулярно-статистическая теория адсорбции при нулевом и конечных (небольших) заполнениях поверхности была развита в ряде хорошо известных работ (литературу см. в обзорах [4, 22]). Однако полученные в этих работах молекулярно-ста-тистические выражения для термодинамических характеристик адсорбции (ТХА) применялись лишь для нахождения этих характеристик путем обработки экспериментальных данных. Расчеты ТХА из свойств адсорбата и адсорбента, взятых в отдельности, проводили лишь для простейших молекул адсорбатов, главным образом, одноатомных. Необходимые для расчетов ТХА значения потенциальной энергии адсорбции находили долгое время также только для простейших систем благородные газы — графит [23] или неполярные и полярные молекулы — ионный кристалл [4, 24]. В последуюших работах были рассчитаны потенциальные энергии адсорбции более сложных молекул углеводородов на графите [4] и более простых молекул в цеолитах (обзор [25, 26]). В дальнейшем развитии количественных молекулярно-статистических расчетов ТХА сложных молекул большую роль сыграли следующие два достижения [c.188]
в обзорах [4, 22]). Однако полученные в этих работах молекулярно-ста-тистические выражения для термодинамических характеристик адсорбции (ТХА) применялись лишь для нахождения этих характеристик путем обработки экспериментальных данных. Расчеты ТХА из свойств адсорбата и адсорбента, взятых в отдельности, проводили лишь для простейших молекул адсорбатов, главным образом, одноатомных. Необходимые для расчетов ТХА значения потенциальной энергии адсорбции находили долгое время также только для простейших систем благородные газы — графит [23] или неполярные и полярные молекулы — ионный кристалл [4, 24]. В последуюших работах были рассчитаны потенциальные энергии адсорбции более сложных молекул углеводородов на графите [4] и более простых молекул в цеолитах (обзор [25, 26]). В дальнейшем развитии количественных молекулярно-статистических расчетов ТХА сложных молекул большую роль сыграли следующие два достижения [c.188]
Ван-дер-ваальсова связь (например, в аргоне) характерна для молекулярных кристаллов. Это рыхлые структуры с малыми координационными числами, с низкой температурой плавления, с малыми тенлотами плавления и испарения, с большой сжимаемостью. По электрическим свойствам молекулярные кристаллы — диэлектрики. Обычно они прозрачны для электромагнитных волн вплоть до дальней ультрафиолетовой области. К молекулярным кристаллам относятся благородные газы в твердом состоянии, кристаллы из насыщенных молекул, такие как Oj, Hj, H l, СН4, и органические кристаллы. [c.144]
Это рыхлые структуры с малыми координационными числами, с низкой температурой плавления, с малыми тенлотами плавления и испарения, с большой сжимаемостью. По электрическим свойствам молекулярные кристаллы — диэлектрики. Обычно они прозрачны для электромагнитных волн вплоть до дальней ультрафиолетовой области. К молекулярным кристаллам относятся благородные газы в твердом состоянии, кристаллы из насыщенных молекул, такие как Oj, Hj, H l, СН4, и органические кристаллы. [c.144]
Молекулярные кристаллы. К этому классу относятся затвердевшие благородные газы, а также твердые тела, образованные насышенными молекулами, в частности, органических ве-шеств [14]. Связь в молекулярных кристаллах обусловлена так называемыми ван-дер-ваальсовыми силами. Природу этих сил проще всего понять, рассматривая атом в модели Бора. Совокупность положительного ядра и отрицательных электронов в каждый момент времени можно рассматривать как электрический диполь, непрерывно изменяющий свою ориентацию в результате движения электронов вокруг ядра. Такой диполь в каждый момент времени индуцирует диполи на окружающих атомах, в результате чего между ними возникают электрические силы притяжения несмотря на непрерывное изменение ориентации диполей, среднее по времени значение этих сил оказывается отличным от нуля. [c.19]
Такой диполь в каждый момент времени индуцирует диполи на окружающих атомах, в результате чего между ними возникают электрические силы притяжения несмотря на непрерывное изменение ориентации диполей, среднее по времени значение этих сил оказывается отличным от нуля. [c.19]
Перейдем теперь к рассмотрению 2ис ерсионные Рироды химической связи в молеку-лярных кристаллах. Природа сил, заставляющих молекулы собираться в огромные ансамбли (жидкости и твердые тела), носит тройственный характер. С дисперсионным взаимодействием мы уже познакомились при рассмотрении кристаллов благородных газов. И здесь, в молекулярных кристаллах, этот вид взаимодействия также имеет значение, часто преобладающее. В кристаллах водорода, как и в кристаллах благородных газов, только оно удерживает хмолекулы в кристаллической структуре. То же относится к молекулам N2, О2, F2, СЬ, Р4, S и т. д. Эти силы чрезвычайно слабы по сравнению с обычными силами химического взаимодействия, например, теплота сублимации кристаллического водорода составляет всего 0,5 ккал/моль, в то время как теплота диссоциации молекулы водорода порядка 100 ккал/моль. Именно поэтому температура плавления водорода лежит всего на 16 град выше абсолютного нуля. [c.85]
Именно поэтому температура плавления водорода лежит всего на 16 град выше абсолютного нуля. [c.85]
Какие соединения имеют ионную кристаллическую решетку. Кристаллическая решетка и ее основные типы
Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой .
Точки, в которых размещены частицы, называются узлами кристаллической решетки . В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные , атомные , молекулярные и металлические .
Кристаллические решетки, состоящие из ионов, называются ионными
. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион — шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле. Очень часто кристаллические решетки изображают, как показано на рис , где указывается только взаимное расположение частиц, но не их размеры.
Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион — шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле. Очень часто кристаллические решетки изображают, как показано на рис , где указывается только взаимное расположение частиц, но не их размеры.
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом .
В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na + и Cl — , Na n Cl n , где n — большое число. Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Они тугоплавки и малолетучи.
Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными . Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число углерода в алмазе 4 . В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными
.
Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико.
Примерами их являются лед, твердый оксид углерода (IV) («сухой лед»), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F 2 , Сl 2 , Br 2 , I 2 , Н 2 , О 2 , N 2), трех- (О 3), четырех- (Р 4), восьми- (S 8) атомными молекулами. Молекулярная кристаллическая решетка йода показана на рис . Большинство кристаллических органических соединений имеют молекулярную решетку.
При осуществлении многих физических и химических реакций вещество переходит в твердое агрегатное состояние. При этом молекулы и атомы стремятся расположиться в таком пространственном порядке, при котором силы взаимодействия между частицами вещества были бы максимально сбалансированы. Этим и достигается прочность твердого вещества. Атомы, однажды заняв определенное положение, совершают небольшие колебательные движения, амплитуда которых зависит от температуры, но положение их в пространстве остается фиксированным. Силы притяжения и отталкивания уравновешивают друг друга на определенном расстоянии.
Этим и достигается прочность твердого вещества. Атомы, однажды заняв определенное положение, совершают небольшие колебательные движения, амплитуда которых зависит от температуры, но положение их в пространстве остается фиксированным. Силы притяжения и отталкивания уравновешивают друг друга на определенном расстоянии.
Современные представления о строении вещества
Современная наука утверждает, что атом состоит из заряженного ядра, несущего положительный заряд, и электронов, несущих заряды отрицательные. Со скоростью несколько тысяч триллионов оборотов в секунду электроны вращаются по своим орбитам, создавая вокруг ядра электронное облако. Положительный заряд ядра численно равен отрицательному заряду электронов. Таким образом, атом вещества остается электрически нейтральным. Возможные взаимодействия с другими атомами происходят тогда, когда электроны отсоединяются от родного атома, тем самым нарушая электрический баланс. В одном случае атомы выстраиваются в определенном порядке, который и называется кристаллической решеткой.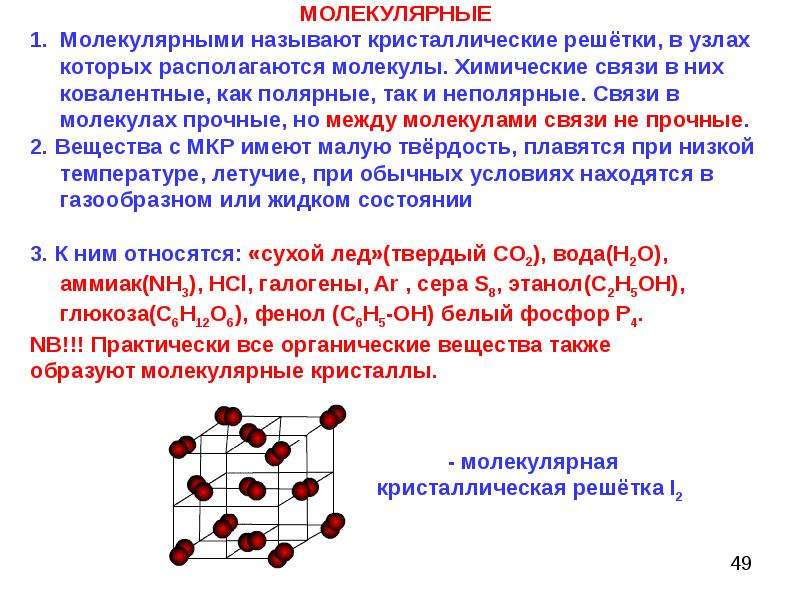 В другом — за счет сложного взаимодействия ядер и электронов соединяются в молекулы различного вида и сложности.
В другом — за счет сложного взаимодействия ядер и электронов соединяются в молекулы различного вида и сложности.
Определение кристаллической решетки
В совокупности различные типы кристаллических решеток веществ представляют собой сетки с различной пространственной ориентацией, в узлах которых располагаются ионы, молекулы или атомы. Это стабильное геометрическое пространственное положение и называется кристаллической решеткой вещества. Расстояние между узлами одной кристаллической ячейки называется периодом идентичности. Пространственные углы, под которыми расположены узлы ячейки, называются параметрами. По способу построения связей кристаллические решетки могу быть простыми, базоцентрированными, гранецентрированными и объемно-центрированными. Если частицы вещества расположены лишь в углах параллелепипеда, такая решетка называется простой. Пример такой решетки показан ниже:
Если, кроме узлов, частицы вещества расположены и в середине пространственных диагоналей, то такое построение частиц в веществе имеет название объемно-центрированной кристаллической решетки. На рисунке этот тип показан наглядно.
На рисунке этот тип показан наглядно.
Если кроме узлов в вершинах решетки имеется узел и в месте, где пересекаются воображаемые диагонали параллелепипеда, то перед вами — гранецентрированный тип решетки.
Виды кристаллических решеток
Различные микрочастицы, из которых состоит вещество, определяют различные типы кристаллических решеток. Они могут определять принцип построения связи между микрочастицами внутри кристалла. Физические типы кристаллических решеток — ионные, атомные и молекулярные. Сюда же относятся различные типы кристаллических решеток металлов. Изучением принципов внутреннего строения элементов занимается химия. Типы кристаллических решеток подробнее представлены ниже.
Ионные кристаллические решетки
Данные типы кристаллических решеток присутствуют в соединениях с ионным типом связи. В этом случае узлы решетки содержат ионы, обладающие противоположным электрическим зарядом. Благодаря электромагнитному полю, силы межионного взаимодействия оказываются достаточно сильными, и это обуславливает физические свойства вещества.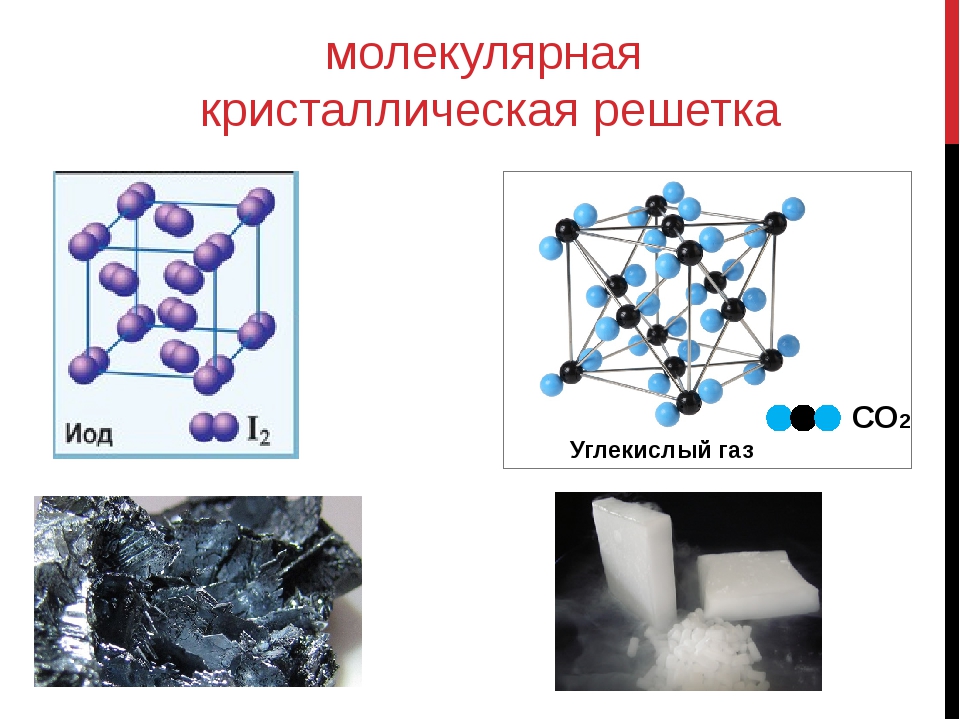 Обычными характеристиками являются тугоплавкость, плотность, твердость и возможность проводить электрический ток. Ионные типы кристаллических решеток имеются у таких веществ, как поваренная соль, нитрат калия и прочие.
Обычными характеристиками являются тугоплавкость, плотность, твердость и возможность проводить электрический ток. Ионные типы кристаллических решеток имеются у таких веществ, как поваренная соль, нитрат калия и прочие.
Атомные кристаллические решетки
Этот тип строения вещества присущ элементам, структуру которых определяет ковалентная химическая связь. Типы кристаллических решеток подобного рода содержат в узлах отдельные атомы, связанные между собой крепкими ковалентными связями. Подобный тип связи возникает тогда, когда два одинаковых атома «делятся» электронами, тем самым образуют общую пару электронов для соседних атомов. Благодаря такому взаимодействию ковалентные связи равномерно и сильно связывают атомы в определенном порядке. Химические элементы, которые содержат атомные типы кристаллических решеток, обладают твердостью, высокой температурой плавления, плохо проводят электрический ток и химически неактивны. Классическими примерами элементов с подобным внутренним строением можно назвать алмаз, кремний, германий, бор.
Молекулярные кристаллические решетки
Вещества, имеющие молекулярный тип кристаллической решетки, представляют собой систему устойчивых, взаимодействующих, плотноупакованных между собой молекул, которые расположены в узлах кристаллической решетки. В подобных соединениях молекулы сохраняют свое пространственное положение в газообразной, жидкой и твердой фазе. В узлах кристалла молекулы удерживаются слабыми ван-дер-ваальсовыми силами, которые в десятки раз слабее сил ионного взаимодействия.
Образующие кристалл молекулы могут быть как полярными, так и неполярными. Из-за спонтанного движения электронов и колебания ядер в молекулах электрическое равновесие может смещаться — так возникает мгновенный электрический момент диполя. Соответствующим образом ориентированные диполи создают силы притяжения в решетке. Двуокись углерода и парафин являются типичными примерами элементов с молекуляной кристаллической решеткой.
Металлические кристаллические решетки
Металлическая связь гибче и пластичней ионной, хотя может показаться, что обе они базируются на одном и том же принципе. Типы кристаллических решеток металлов объясняют их типичные свойства — такие, например, как механическая прочность, тепло- и электропроводность, плавкость.
Типы кристаллических решеток металлов объясняют их типичные свойства — такие, например, как механическая прочность, тепло- и электропроводность, плавкость.
Отличительной особенностью металлической кристаллической решетки является наличие положительно заряженных ионов металла (катионов) в узлах этой решетки. Между узлами находятся электроны, которые непосредственно участвуют в создании электрического поля вокруг решетки. Количество электронов, перемещающихся внутри этой кристаллической решетки, называется электронным газом.
При отсутствии электрического поля свободные электроны совершают хаотическое движение, беспорядочно взаимодействуя с ионами решетки. Каждое такое взаимодействие меняет импульс и направление движения отрицательно заряженной частицы. Своим электрическим полем электроны притягивают к себе катионы, уравновешивая их взаимное отталкивание. Хотя электроны считаются свободными, их энергии не хватает для того, чтобы покинуть кристаллическую решетку, поэтому эти заряженные частицы постоянно находятся в ее пределах.
Присутствие электрического поля придает электронному газу дополнительную энергию. Соединение с ионами в кристаллической решетке металлов не является прочным, поэтому электроны легко покидают ее пределы. Электроны двигаются по силовым линиям, оставляя позади положительно заряженные ионы.
Выводы
Огромное значение изучению внутреннего строения вещества уделяет химия. Типы кристаллических решеток различных элементов определяют практически весь спектр их свойств. Воздействуя на кристаллы и меняя их внутренне строение, можно добиться усиления нужных свойств вещества и удалить нежелательные, преобразовывать химические элементы. Таким образом, изучение внутренней структуры окружающего мира может помочь познать суть и принципы устройства мироздания.
Согласно атомно-молекулярной теории Бойля, все вещества состоят из молекул, которые находятся в постоянном движении. Но существует ли какая-то определённая структура в веществах? Или они просто состоят из хаотично движущихся молекул?
В действительности чёткую структуру имеют все вещества, пребывающие в твёрдом состоянии. Атомы и молекулы движутся, но силы притяжения и отталкивания между частицами сбалансированы, поэтому атомы и молекулы располагаются в определённой точке пространства (но продолжают совершать небольшие колебания, зависящие от температуры). Такие структуры называются кристаллическими решётками . Места, в которых находятся сами молекулы, ионы или атомы, называют узлами . А расстояния между узлами получили название – периоды идентичности . В зависимости от положения частиц в пространстве, различают несколько типов:
Атомы и молекулы движутся, но силы притяжения и отталкивания между частицами сбалансированы, поэтому атомы и молекулы располагаются в определённой точке пространства (но продолжают совершать небольшие колебания, зависящие от температуры). Такие структуры называются кристаллическими решётками . Места, в которых находятся сами молекулы, ионы или атомы, называют узлами . А расстояния между узлами получили название – периоды идентичности . В зависимости от положения частиц в пространстве, различают несколько типов:
- атомная;
- ионная;
- молекулярная;
- металлическая.
В жидком и газообразном состоянии вещества не имеют чёткой решётки, их молекулы движутся хаотично, именно поэтому они не имеют формы. Например, кислород, находясь в газообразном состоянии, представляет собой бесцветный газ без запаха, в жидком (при -194 градусов) – раствор голубоватого цвета. Когда температура опускается до -219 градусов, кислород переходит в твёрдое состояние и приобретает кр. решётку, при этом он превращается в снегообразную массу синего цвета.
решётку, при этом он превращается в снегообразную массу синего цвета.
Интересно, что у аморфных веществ нет чёткой структуры, поэтому у них и нет строгой температуры плавления и кипения. Смола и пластилин при нагревании постепенно размягчаются и становятся жидкими, у них нет чёткой фазы перехода.
Атомная кристаллическая решётка
В узлах находятся атомы, о чём и говорит название. Эти вещества очень крепкие и прочные , так как между частицами образуется ковалентная связь. Соседние атомы образуют между собой общую пару электронов (а, точнее, их электронные облака наслаиваются друг на друга), и поэтому они очень хорошо связаны друг с другом. Самый наглядные пример – алмаз, который по шкале Мооса обладит наибольшей твёрдостью. Интересно, что алмаз, как и графит, состоит из углевода. Графит является очень хрупким веществом (твёрдость по шкале Мооса – 1), что является наглядным примером того, как много зависит от вида.
Атомная кр. решётка плохо распространена в природе, к ней относятся: кварц, бор, песок, кремний, оксид кремния (IV), германий, горный хрусталь. Для этих веществ характерна высокая температура плавления, прочность, а также эти соединения очень твёрдые и нерастворимые в воде. Из-за очень сильной связи между атомами, эти химические соединения почти не взаимодействуют с другими и очень плохо проводят ток.
Для этих веществ характерна высокая температура плавления, прочность, а также эти соединения очень твёрдые и нерастворимые в воде. Из-за очень сильной связи между атомами, эти химические соединения почти не взаимодействуют с другими и очень плохо проводят ток.
Ионная кристаллическая решётка
В этом типе ионы располагаются в каждом узле. Соответственно, этот вид характерен для веществ с ионной связью, например: хлорид калия, сульфат кальция, хлорид меди, фосфат серебра, гидроксид меди и так далее. К веществам с такой схемой соединения частиц относятся ;
- соли;
- гидроксиды металлов;
- оксиды металлов.
Хлорид натрия имеет чередование положительных (Na +) и отрицательных (Cl —) ионов. Один ион хлора, находящийся в узле, притягивает к себе два иона натрия (благодаря электромагнитному полю), которые находятся в соседних узлах. Таким образом, образуется куб, в котором частицы связаны между собой.
Для ионной решётки характерна прочность, тугоплавкость, устойчивость, твёрдость и нелетучесть. Некоторые вещества могут проводить электрический ток.
Некоторые вещества могут проводить электрический ток.
Молекулярная кристаллическая решётка
В узлах этой структуры находятся молекулы, которые плотно упакованы между собой. Для таких веществ характерна ковалентная полярная и неполярная связь. Интересно, что независимо от ковалентной связи, между частицами образуете очень слабое притяжение (из-за слабых ван-дер-вальсовых сил). Именно поэтому такие вещества очень хрупкие, обладают низкой температурой кипения и плавления, а также они летучие. К таким веществам относятся: вода, органические вещества (сахар, нафталин), оксид углерода (IV), сероводород, благородные газы, двух– (водород, кислород, хлор, азот, йод), трёх- (озон), четырёх- (фосфор), восьмиатомные (сера) вещества и так далее.
Одна из отличительных черт — это то, что структурная и пространственная модель сохраняется во всех фазах (как в твёрдых, так в жидких и газообразных).
Металлическая кристаллическая решётка
Из-за наличия в узлах ионов, может показаться, что металлическая решетка похожа на ионную. На самом деле, это две совершенно разные модели, с разными свойствами.
На самом деле, это две совершенно разные модели, с разными свойствами.
Металлическая гораздо гибче и пластичнее ионной, для неё характерна прочность, высокая электро- и теплопроводность, эти вещества хорошо плавятся и отлично проводят электрический ток. Это объясняется тем, что в узлах находятся положительно заряженные ионы металлов (катионы), которые могут перемещаться по всей структуре, тем самым обеспечивают течение электронов. Частицы хаотично движутся около своего узла (они не имеют достаточной энергии, чтобы выйти за пределы), но как только появляется электрическое поле, электроны образуют поток и устремляются из положительной в отрицательную область.
Металлическая кристаллическая решётка характерна для металлов, например: свинец, натрий, калий, кальций, серебро, железо, цинк, платина и так далее. Помимо прочего, она подразделяется ещё на несколько типов упаковок: гексагональная, объёмно центрированная (наименее плотная) и гранецентрированная. Первая упаковка характерна для цинка, кобальта, магния, вторая для бария, железа, натрия, третья для меди, алюминия и кальция.
Таким образом, от типа решётки зависят многие свойства, а также строение вещества. Зная тип, можно предсказать, к примеру, какой будет тугоплавкость или прочность объекта.
Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное.
Чтобы рассматривать данную тему необходимо знать:
Электроотрицательность — это способность атома смещать к себе общую электронную пару. (Самый электроотрицательный элемент — фтор.)
Кристаллическая решетка — трехмерное упорядоченное расположение частиц.
Различают три основных типа химических связей: ковалентную, ионную и металлическую.
Металлическая связь характерна для
металлов, которые содержат небольшое количество электронов на внешнем энергетическом уровне (1 или 2, реже 3). Эти электроны легко теряют связь с ядром и свободно перемещаются по всему куску
металла, образуя «электронное облако» и обеспечивая связь с положительно заряженными ионами, образовавшимися после отрыва электронов. Кристаллическая решетка — металлическая. Это обуславливает
физические свойства металлов: высокую тепло- и электропроводность, ковкость и пластичность, металлический блеск.
Кристаллическая решетка — металлическая. Это обуславливает
физические свойства металлов: высокую тепло- и электропроводность, ковкость и пластичность, металлический блеск.
Ковалентная связь образуется за счет общей электронной пары атомов неметаллов, при этом каждый из них достигает устойчивой конфигурации атома инертного элемента.
Если связь образуют атомы с одинаковой электроотрицательностью, то есть разница электроотрицательности двух атомов равна нулю, электронная пара располагается симметрично между двумя атомами и связь называется ковалентной неполярной.
Если связь образуют атомы с разной электроотрицательностью, причем разница в электроотрицательности двух атомов лежит в
интервале от нуля примерно до двух (чаще всего это разные неметаллы), то общая электронная пара смещается к более электроотрицательному элементу. На нем возникает частично отрицательный заряд
(отрицательный полюс молекулы), а на другом атоме — частично положительный заряд (положительный полюс молекулы). Такая связь называется ковалентной полярной.
Такая связь называется ковалентной полярной.
Если связь образуют атомы с разной электроотрицательностью, причем разница в электроотрицательности двух атомов больше двух (чаще всего это неметалл и металл), то считают, что электрон полностью переходит к атому неметалла. В результате этот атом становится отрицательно заряженным ионом. Атом, отдавший электрон, — положительно заряженным ионом. Связь между ионами называется ионной связью.
Соединения с ковалентной связью имеют два типа кристаллических решеток: атомные и молекулярные.
В атомной кристаллической решетке в узлах находятся атомы, соединенные прочной ковалентной связью. Вещества с такой кристаллической решеткой имеют высокие температуры плавления, прочны и тверды, практически нерастворимы в жидкостях. например, алмаз, твердый бор, кремний, германий и соединения некоторых элементов с углеродом и кремнием.
В молекулярной кристаллической решетке в узлах находятся молекулы, соединенные слабым межмолекулярным взаимодействием. Вещества с такой решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, из растворы практически не проводят электрический ток. Например, лед,
твердый оксид углерода (IV) твердые галогеноводороды, твердые простые вещества, образованные одно-(благородные газы), двух- (F 2 , Cl 2 , Br 2 ,
I 2 , H 2 , O 2 , N 2), трех-(О 3), четырех- (Р 4), восьми- (S 8) атомными молекулами. Большинство
кристаллических органических соединений имеют молекулярную решетку.
Вещества с такой решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, из растворы практически не проводят электрический ток. Например, лед,
твердый оксид углерода (IV) твердые галогеноводороды, твердые простые вещества, образованные одно-(благородные газы), двух- (F 2 , Cl 2 , Br 2 ,
I 2 , H 2 , O 2 , N 2), трех-(О 3), четырех- (Р 4), восьми- (S 8) атомными молекулами. Большинство
кристаллических органических соединений имеют молекулярную решетку.
Соединения с ионной связью имеют ионную кристаллическую решетку, в узлах которой чередуются положительно и отрицательно заряженные ионы. Вещества с ионной решеткой тугоплавки и малолетучи, имеют сравнительно высокую твердость, но хрупки. Расплавы и водные растворы солей и щелочей проводят электрический ток.
Примеры заданий
1. В какой молекуле ковалентная связь «элемент — кислород» наиболее полярна?
1) SO 2 2) NO 3) Cl 2 O 4) H 2 O
Решение:
Полярность связи определяется разностью электроотрицательности двух атомов (в данном случае элемента и кислорода).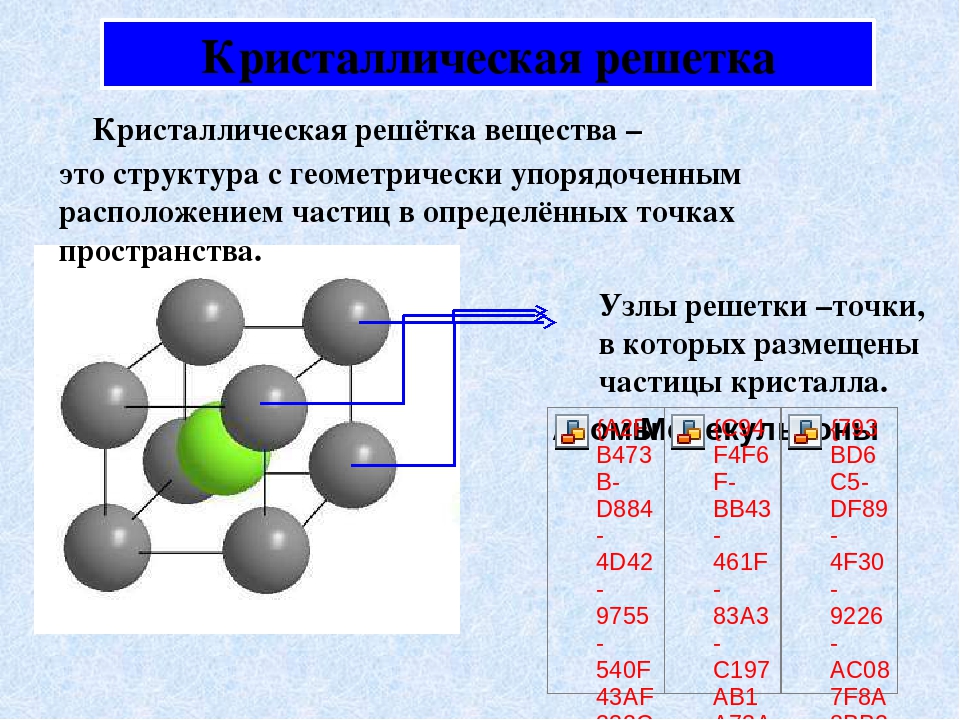 Сера,
азот и хлор находятся рядом с кислородом, следовательно их электроотрицательности отличаются незначительно. И только водород находится на отдалении от кислорода, значит разница в
электроотрицательности будет большая, и связь будет наиболее полярна.
Сера,
азот и хлор находятся рядом с кислородом, следовательно их электроотрицательности отличаются незначительно. И только водород находится на отдалении от кислорода, значит разница в
электроотрицательности будет большая, и связь будет наиболее полярна.
Ответ: 4)
2. Водородные связи образуются между молекулами
1) метанола 2) метаналь 3) ацетилена 4) метилформиата
Решение:
В составе ацетилена вообще нет сильноэлектроотрицательных элементов. Метаналь Н 2 СО и метилформиат НСООСН 3 не содержат водорода, соединенного с сильноэлектроотрицательным элементом. Водород в них соединен с углеродом. А вот в метаноле СН 3 ОН между атомом водорода одной гидроксогруппы и атомом кислорода другой молекулы возможно образование водородной связи.
Ответ: 1)
Самая прочная кристаллическая решетка. Школьная энциклопедия
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. По типу связи различают вещества молекулярного и немолекулярного строения.
По типу связи различают вещества молекулярного и немолекулярного строения.
Это вещества, состоящие из молекул. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (С, Si, Li, Na, К, Си, Fe, W), среди них есть металлы и неметаллы.
Немолекулярное строение веществК веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли (NaCl, K 2 S0 4), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, КОН). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Твердые вещества: кристаллические и аморфныеАморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой . Точки, в которых размещены частицы кристалла, называют узлами решетки .
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические .
Ионные кристаллические решеткиИонными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na + , Сl — , так и сложные S0 4 2- , ОН — . Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na + и отрицательных Сl — , образующих решетку в форме куба.
Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na + и отрицательных Сl — , образующих решетку в форме куба.
Ионная кристаллическая решетка поваренной соли
Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Атомные кристаллические решеткиАтомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.
Атомная кристаллическая решетка алмаза
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С), они прочны и тверды, практически нерастворимы.
Молекулярные кристаллические решеткиМолекулярными называют кристаллические решетки, в узлах которых располагаются молекулы.
Молекулярная кристаллическая решетка йода
Химические связи в этих молекулах могут быть и полярными (НСl, Н 2 O), и неполярными (N 2 , О 2). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Металлические кристаллические решеткиВещества с металлической связью имеют металлические кристаллические решетки.
В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.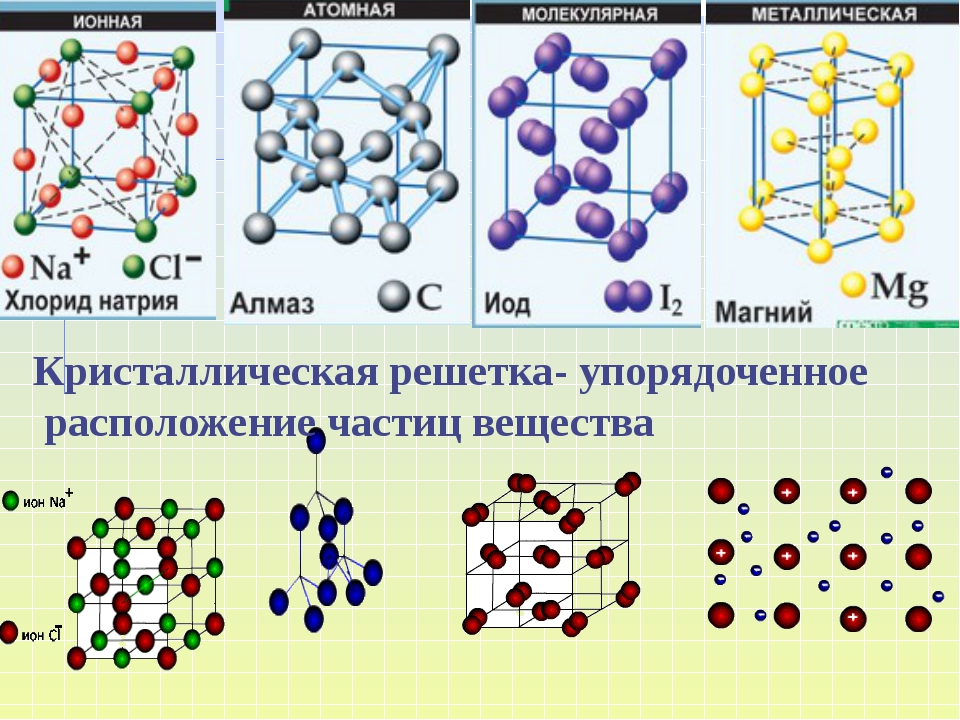
При осуществлении многих физических и химических реакций вещество переходит в твердое агрегатное состояние. При этом молекулы и атомы стремятся расположиться в таком пространственном порядке, при котором силы взаимодействия между частицами вещества были бы максимально сбалансированы. Этим и достигается прочность твердого вещества. Атомы, однажды заняв определенное положение, совершают небольшие колебательные движения, амплитуда которых зависит от температуры, но положение их в пространстве остается фиксированным. Силы притяжения и отталкивания уравновешивают друг друга на определенном расстоянии.
Современные представления о строении вещества
Современная наука утверждает, что атом состоит из заряженного ядра, несущего положительный заряд, и электронов, несущих заряды отрицательные. Со скоростью несколько тысяч триллионов оборотов в секунду электроны вращаются по своим орбитам, создавая вокруг ядра электронное облако. Положительный заряд ядра численно равен отрицательному заряду электронов. Таким образом, атом вещества остается электрически нейтральным. Возможные взаимодействия с другими атомами происходят тогда, когда электроны отсоединяются от родного атома, тем самым нарушая электрический баланс. В одном случае атомы выстраиваются в определенном порядке, который и называется кристаллической решеткой. В другом — за счет сложного взаимодействия ядер и электронов соединяются в молекулы различного вида и сложности.
Таким образом, атом вещества остается электрически нейтральным. Возможные взаимодействия с другими атомами происходят тогда, когда электроны отсоединяются от родного атома, тем самым нарушая электрический баланс. В одном случае атомы выстраиваются в определенном порядке, который и называется кристаллической решеткой. В другом — за счет сложного взаимодействия ядер и электронов соединяются в молекулы различного вида и сложности.
Определение кристаллической решетки
В совокупности различные типы кристаллических решеток веществ представляют собой сетки с различной пространственной ориентацией, в узлах которых располагаются ионы, молекулы или атомы. Это стабильное геометрическое пространственное положение и называется кристаллической решеткой вещества. Расстояние между узлами одной кристаллической ячейки называется периодом идентичности. Пространственные углы, под которыми расположены узлы ячейки, называются параметрами. По способу построения связей кристаллические решетки могу быть простыми, базоцентрированными, гранецентрированными и объемно-центрированными. Если частицы вещества расположены лишь в углах параллелепипеда, такая решетка называется простой. Пример такой решетки показан ниже:
Если частицы вещества расположены лишь в углах параллелепипеда, такая решетка называется простой. Пример такой решетки показан ниже:
Если, кроме узлов, частицы вещества расположены и в середине пространственных диагоналей, то такое построение частиц в веществе имеет название объемно-центрированной кристаллической решетки. На рисунке этот тип показан наглядно.
Если кроме узлов в вершинах решетки имеется узел и в месте, где пересекаются воображаемые диагонали параллелепипеда, то перед вами — гранецентрированный тип решетки.
Виды кристаллических решеток
Различные микрочастицы, из которых состоит вещество, определяют различные типы кристаллических решеток. Они могут определять принцип построения связи между микрочастицами внутри кристалла. Физические типы кристаллических решеток — ионные, атомные и молекулярные. Сюда же относятся различные типы кристаллических решеток металлов. Изучением принципов внутреннего строения элементов занимается химия. Типы кристаллических решеток подробнее представлены ниже.
Типы кристаллических решеток подробнее представлены ниже.
Ионные кристаллические решетки
Данные типы кристаллических решеток присутствуют в соединениях с ионным типом связи. В этом случае узлы решетки содержат ионы, обладающие противоположным электрическим зарядом. Благодаря электромагнитному полю, силы межионного взаимодействия оказываются достаточно сильными, и это обуславливает физические свойства вещества. Обычными характеристиками являются тугоплавкость, плотность, твердость и возможность проводить электрический ток. Ионные типы кристаллических решеток имеются у таких веществ, как поваренная соль, нитрат калия и прочие.
Атомные кристаллические решетки
Этот тип строения вещества присущ элементам, структуру которых определяет ковалентная химическая связь. Типы кристаллических решеток подобного рода содержат в узлах отдельные атомы, связанные между собой крепкими ковалентными связями. Подобный тип связи возникает тогда, когда два одинаковых атома «делятся» электронами, тем самым образуют общую пару электронов для соседних атомов. Благодаря такому взаимодействию ковалентные связи равномерно и сильно связывают атомы в определенном порядке. Химические элементы, которые содержат атомные типы кристаллических решеток, обладают твердостью, высокой температурой плавления, плохо проводят электрический ток и химически неактивны. Классическими примерами элементов с подобным внутренним строением можно назвать алмаз, кремний, германий, бор.
Благодаря такому взаимодействию ковалентные связи равномерно и сильно связывают атомы в определенном порядке. Химические элементы, которые содержат атомные типы кристаллических решеток, обладают твердостью, высокой температурой плавления, плохо проводят электрический ток и химически неактивны. Классическими примерами элементов с подобным внутренним строением можно назвать алмаз, кремний, германий, бор.
Молекулярные кристаллические решетки
Вещества, имеющие молекулярный тип кристаллической решетки, представляют собой систему устойчивых, взаимодействующих, плотноупакованных между собой молекул, которые расположены в узлах кристаллической решетки. В подобных соединениях молекулы сохраняют свое пространственное положение в газообразной, жидкой и твердой фазе. В узлах кристалла молекулы удерживаются слабыми ван-дер-ваальсовыми силами, которые в десятки раз слабее сил ионного взаимодействия.
Образующие кристалл молекулы могут быть как полярными, так и неполярными. Из-за спонтанного движения электронов и колебания ядер в молекулах электрическое равновесие может смещаться — так возникает мгновенный электрический момент диполя.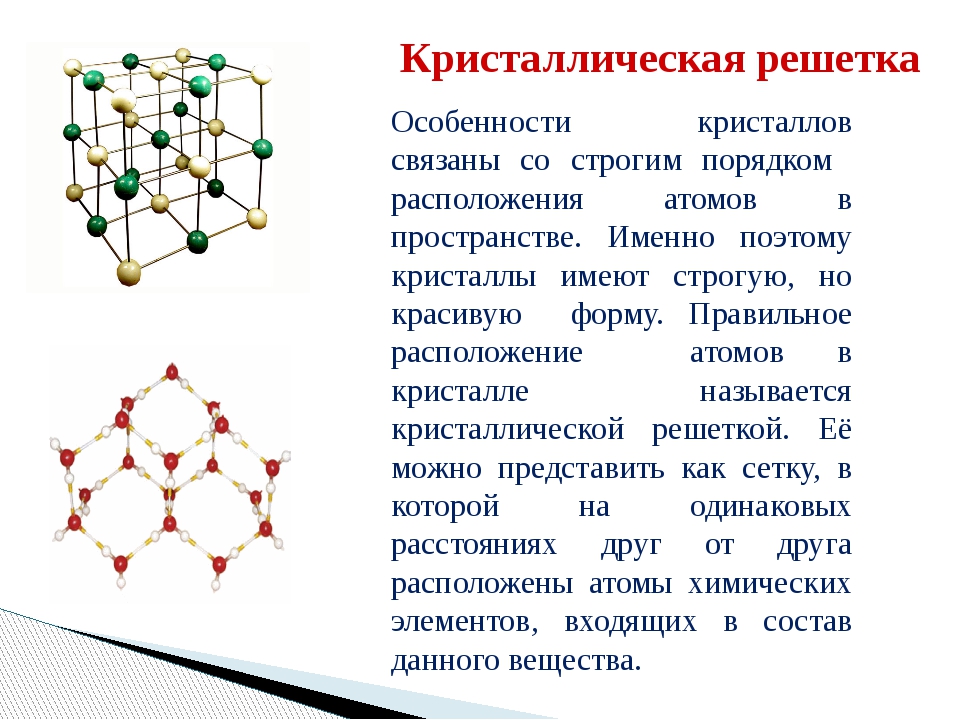 Соответствующим образом ориентированные диполи создают силы притяжения в решетке. Двуокись углерода и парафин являются типичными примерами элементов с молекуляной кристаллической решеткой.
Соответствующим образом ориентированные диполи создают силы притяжения в решетке. Двуокись углерода и парафин являются типичными примерами элементов с молекуляной кристаллической решеткой.
Металлические кристаллические решетки
Металлическая связь гибче и пластичней ионной, хотя может показаться, что обе они базируются на одном и том же принципе. Типы кристаллических решеток металлов объясняют их типичные свойства — такие, например, как механическая прочность, тепло- и электропроводность, плавкость.
Отличительной особенностью металлической кристаллической решетки является наличие положительно заряженных ионов металла (катионов) в узлах этой решетки. Между узлами находятся электроны, которые непосредственно участвуют в создании электрического поля вокруг решетки. Количество электронов, перемещающихся внутри этой кристаллической решетки, называется электронным газом.
При отсутствии электрического поля свободные электроны совершают хаотическое движение, беспорядочно взаимодействуя с ионами решетки. Каждое такое взаимодействие меняет импульс и направление движения отрицательно заряженной частицы. Своим электрическим полем электроны притягивают к себе катионы, уравновешивая их взаимное отталкивание. Хотя электроны считаются свободными, их энергии не хватает для того, чтобы покинуть кристаллическую решетку, поэтому эти заряженные частицы постоянно находятся в ее пределах.
Каждое такое взаимодействие меняет импульс и направление движения отрицательно заряженной частицы. Своим электрическим полем электроны притягивают к себе катионы, уравновешивая их взаимное отталкивание. Хотя электроны считаются свободными, их энергии не хватает для того, чтобы покинуть кристаллическую решетку, поэтому эти заряженные частицы постоянно находятся в ее пределах.
Присутствие электрического поля придает электронному газу дополнительную энергию. Соединение с ионами в кристаллической решетке металлов не является прочным, поэтому электроны легко покидают ее пределы. Электроны двигаются по силовым линиям, оставляя позади положительно заряженные ионы.
Выводы
Огромное значение изучению внутреннего строения вещества уделяет химия. Типы кристаллических решеток различных элементов определяют практически весь спектр их свойств. Воздействуя на кристаллы и меняя их внутренне строение, можно добиться усиления нужных свойств вещества и удалить нежелательные, преобразовывать химические элементы. Таким образом, изучение внутренней структуры окружающего мира может помочь познать суть и принципы устройства мироздания.
Таким образом, изучение внутренней структуры окружающего мира может помочь познать суть и принципы устройства мироздания.
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.

- Молекулярная кристаллическая решетка.
- кристаллическая решетка.
Ионная кристаллическая решетка
Главной особенностью строения кристаллической решетки ионов являются противоположные электрические заряды, собственно, ионов, вследствие чего образуется электромагнитное поле, определяющее свойства веществ, имеющих ионную кристаллическую решетку. А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные . Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки.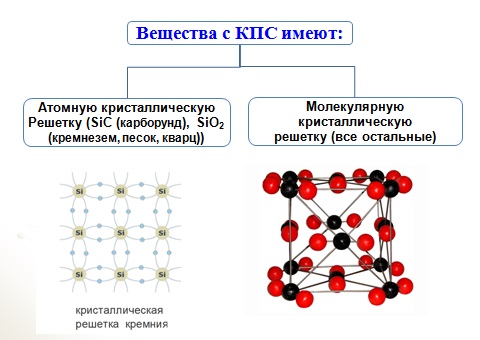 Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Молекулярная кристаллическая решетка
Молекулярный тип кристаллической решетки характеризуется наличием устойчивых и плотноупакованных молекул. Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки.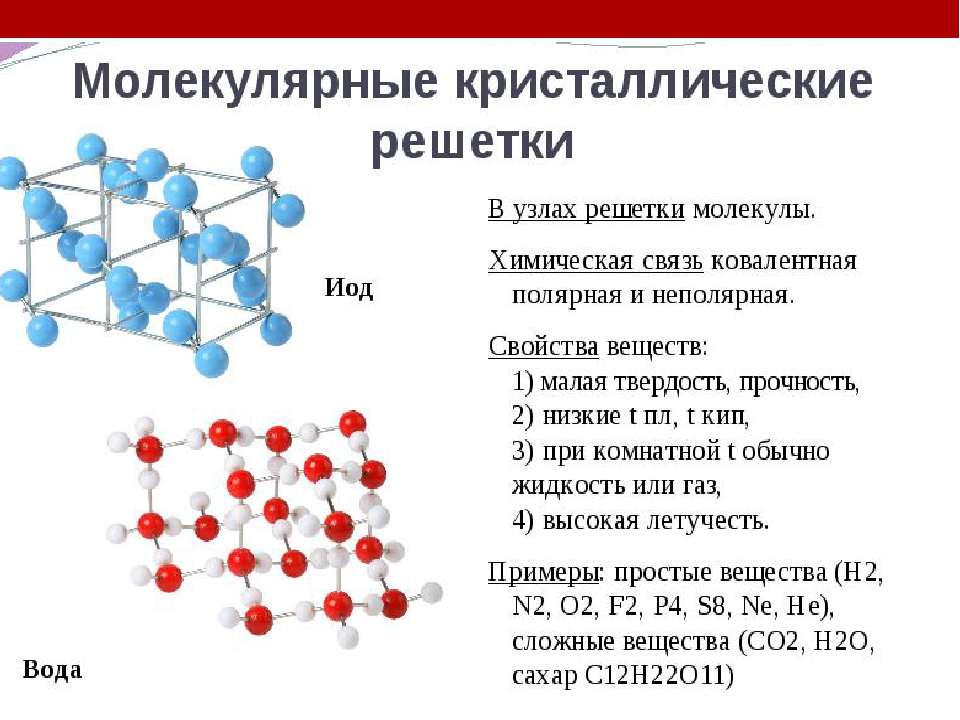 Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
Согласно атомно-молекулярной теории Бойля, все вещества состоят из молекул, которые находятся в постоянном движении. Но существует ли какая-то определённая структура в веществах? Или они просто состоят из хаотично движущихся молекул?
В действительности чёткую структуру имеют все вещества, пребывающие в твёрдом состоянии. Атомы и молекулы движутся, но силы притяжения и отталкивания между частицами сбалансированы, поэтому атомы и молекулы располагаются в определённой точке пространства (но продолжают совершать небольшие колебания, зависящие от температуры). Такие структуры называются кристаллическими решётками . Места, в которых находятся сами молекулы, ионы или атомы, называют узлами . А расстояния между узлами получили название – периоды идентичности . В зависимости от положения частиц в пространстве, различают несколько типов:
Места, в которых находятся сами молекулы, ионы или атомы, называют узлами . А расстояния между узлами получили название – периоды идентичности . В зависимости от положения частиц в пространстве, различают несколько типов:
- атомная;
- ионная;
- молекулярная;
- металлическая.
В жидком и газообразном состоянии вещества не имеют чёткой решётки, их молекулы движутся хаотично, именно поэтому они не имеют формы. Например, кислород, находясь в газообразном состоянии, представляет собой бесцветный газ без запаха, в жидком (при -194 градусов) – раствор голубоватого цвета. Когда температура опускается до -219 градусов, кислород переходит в твёрдое состояние и приобретает кр. решётку, при этом он превращается в снегообразную массу синего цвета.
Интересно, что у аморфных веществ нет чёткой структуры, поэтому у них и нет строгой температуры плавления и кипения. Смола и пластилин при нагревании постепенно размягчаются и становятся жидкими, у них нет чёткой фазы перехода.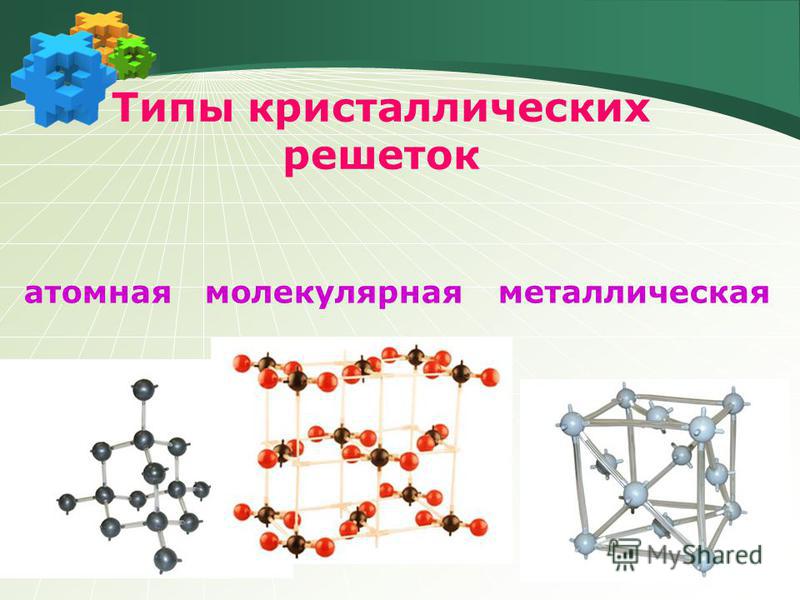
Атомная кристаллическая решётка
В узлах находятся атомы, о чём и говорит название. Эти вещества очень крепкие и прочные , так как между частицами образуется ковалентная связь. Соседние атомы образуют между собой общую пару электронов (а, точнее, их электронные облака наслаиваются друг на друга), и поэтому они очень хорошо связаны друг с другом. Самый наглядные пример – алмаз, который по шкале Мооса обладит наибольшей твёрдостью. Интересно, что алмаз, как и графит, состоит из углевода. Графит является очень хрупким веществом (твёрдость по шкале Мооса – 1), что является наглядным примером того, как много зависит от вида.
Атомная кр. решётка плохо распространена в природе, к ней относятся: кварц, бор, песок, кремний, оксид кремния (IV), германий, горный хрусталь. Для этих веществ характерна высокая температура плавления, прочность, а также эти соединения очень твёрдые и нерастворимые в воде. Из-за очень сильной связи между атомами, эти химические соединения почти не взаимодействуют с другими и очень плохо проводят ток.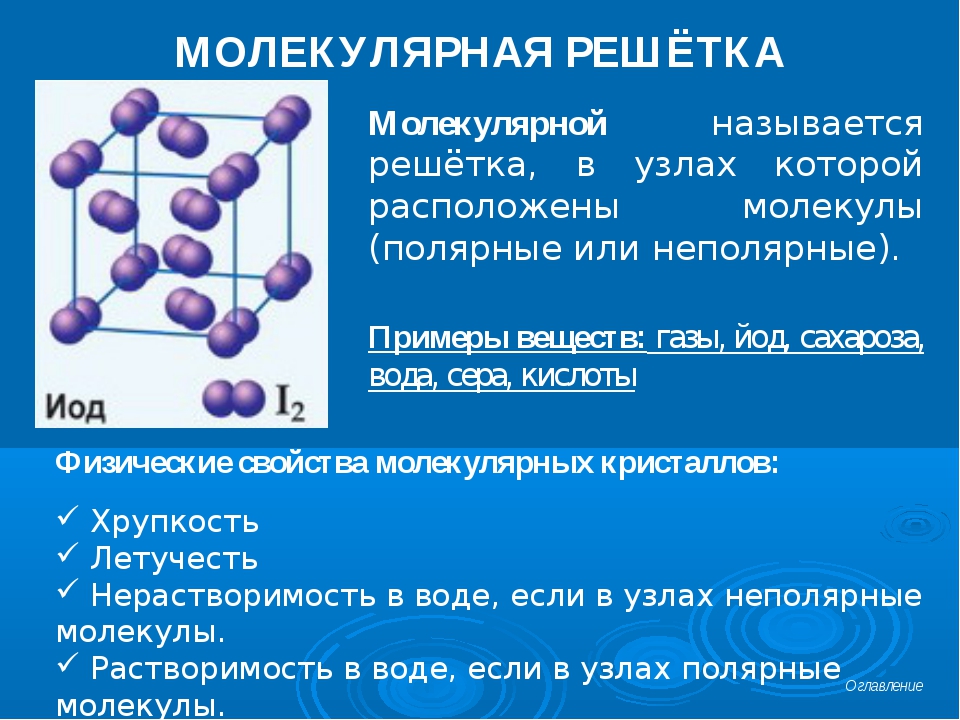
Ионная кристаллическая решётка
В этом типе ионы располагаются в каждом узле. Соответственно, этот вид характерен для веществ с ионной связью, например: хлорид калия, сульфат кальция, хлорид меди, фосфат серебра, гидроксид меди и так далее. К веществам с такой схемой соединения частиц относятся ;
- соли;
- гидроксиды металлов;
- оксиды металлов.
Хлорид натрия имеет чередование положительных (Na +) и отрицательных (Cl —) ионов. Один ион хлора, находящийся в узле, притягивает к себе два иона натрия (благодаря электромагнитному полю), которые находятся в соседних узлах. Таким образом, образуется куб, в котором частицы связаны между собой.
Для ионной решётки характерна прочность, тугоплавкость, устойчивость, твёрдость и нелетучесть. Некоторые вещества могут проводить электрический ток.
Молекулярная кристаллическая решётка
В узлах этой структуры находятся молекулы, которые плотно упакованы между собой. Для таких веществ характерна ковалентная полярная и неполярная связь. Интересно, что независимо от ковалентной связи, между частицами образуете очень слабое притяжение (из-за слабых ван-дер-вальсовых сил). Именно поэтому такие вещества очень хрупкие, обладают низкой температурой кипения и плавления, а также они летучие. К таким веществам относятся: вода, органические вещества (сахар, нафталин), оксид углерода (IV), сероводород, благородные газы, двух– (водород, кислород, хлор, азот, йод), трёх- (озон), четырёх- (фосфор), восьмиатомные (сера) вещества и так далее.
Для таких веществ характерна ковалентная полярная и неполярная связь. Интересно, что независимо от ковалентной связи, между частицами образуете очень слабое притяжение (из-за слабых ван-дер-вальсовых сил). Именно поэтому такие вещества очень хрупкие, обладают низкой температурой кипения и плавления, а также они летучие. К таким веществам относятся: вода, органические вещества (сахар, нафталин), оксид углерода (IV), сероводород, благородные газы, двух– (водород, кислород, хлор, азот, йод), трёх- (озон), четырёх- (фосфор), восьмиатомные (сера) вещества и так далее.
Одна из отличительных черт — это то, что структурная и пространственная модель сохраняется во всех фазах (как в твёрдых, так в жидких и газообразных).
Металлическая кристаллическая решётка
Из-за наличия в узлах ионов, может показаться, что металлическая решетка похожа на ионную. На самом деле, это две совершенно разные модели, с разными свойствами.
Металлическая гораздо гибче и пластичнее ионной, для неё характерна прочность, высокая электро- и теплопроводность, эти вещества хорошо плавятся и отлично проводят электрический ток. Это объясняется тем, что в узлах находятся положительно заряженные ионы металлов (катионы), которые могут перемещаться по всей структуре, тем самым обеспечивают течение электронов. Частицы хаотично движутся около своего узла (они не имеют достаточной энергии, чтобы выйти за пределы), но как только появляется электрическое поле, электроны образуют поток и устремляются из положительной в отрицательную область.
Это объясняется тем, что в узлах находятся положительно заряженные ионы металлов (катионы), которые могут перемещаться по всей структуре, тем самым обеспечивают течение электронов. Частицы хаотично движутся около своего узла (они не имеют достаточной энергии, чтобы выйти за пределы), но как только появляется электрическое поле, электроны образуют поток и устремляются из положительной в отрицательную область.
Металлическая кристаллическая решётка характерна для металлов, например: свинец, натрий, калий, кальций, серебро, железо, цинк, платина и так далее. Помимо прочего, она подразделяется ещё на несколько типов упаковок: гексагональная, объёмно центрированная (наименее плотная) и гранецентрированная. Первая упаковка характерна для цинка, кобальта, магния, вторая для бария, железа, натрия, третья для меди, алюминия и кальция.
Таким образом, от типа решётки зависят многие свойства, а также строение вещества. Зная тип, можно предсказать, к примеру, какой будет тугоплавкость или прочность объекта.
Строение вещества.
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества.
Наша задача познакомиться со строением вещества.
При низких температурах для веществ устойчиво твёрдое состояние.
☼ Самым твёрдым веществом в природе является алмаз. Он считается царём всех самоцветов и драгоценных камней. Да и само его название означает по-гречески «несокрушимый». На алмазы с давних пор смотрели как на чудодейственные камни. Считалось, что человек, носящий алмазы, не знает болезней желудка, на него не действует яд, он сохраняет до глубокой старости память и весёлое расположение духа, пользуется царской милостью.
☼ Алмаз, подвергнутый ювелирной обработке – огранке, шлифовке, называют бриллиантом.
При плавлении в результате тепловых колебаний порядок частиц нарушается, они становятся подвижными, при этом характер химической связи не нарушается. Таким образом, между твёрдым и жидким состояниями принципиальных различий нет.
У жидкости появляется текучесть (т. е. способность принимать форму сосуда).
Жидкие кристаллы.
Жидкие кристаллы открыты в конце XIX века, но изучены в последние 20-25 лет. Многие показывающие устройства современной техники, например некоторые электронные часы, мини-ЭВМ, работают на жидких кристаллах.
В общем-то слова «жидкие кристаллы» звучат не менее необычно, чем «горячий лёд» . Однако на самом деле и лёд может быть горячим, т.к. при давлении более 10000 атм. водяной лёд плавится при температуре выше 2000 С. Необычность сочетания «жидкие кристаллы» состоит в том, что жидкое состояние указывает на подвижность структуры, а кристалл предполагает строгую упорядоченность.
Если вещество состоит из многоатомных молекул вытянутой или пластинчатой формы и имеющих несимметричное строение, то при его плавлении эти молекулы ориентируются определённым образом друг относительно друга (их длинные оси располагаются параллельно). При этом молекулы могут свободно перемещаться параллельно самим себе, т. е. система приобретает свойство текучести, характерное для жидкости. В то же время система сохраняет упорядоченную структуру, обусловливающую свойства, характерное для кристаллов.
е. система приобретает свойство текучести, характерное для жидкости. В то же время система сохраняет упорядоченную структуру, обусловливающую свойства, характерное для кристаллов.
Высокая подвижность такой структуры даёт возможность управлять ею путём очень слабых воздействий (тепловых, электрических и др.), т.е. целенаправленно изменять свойства вещества, в том числе оптические, с очень малыми затратами энергии, что и используется в современной технике.
Типы кристаллических решёток.
Любое химическое вещество образованно большим числом одинаковых частиц, которые связаны между собою.
При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку.
Кристаллическая решетка – это структура с геометрически правильным расположением частиц в пространстве.
В самой кристаллической решетке различают узлы и межузловое пространство.
Одно и то же вещество в зависимости от условий (p, t,…) существует в различных кристаллических формах (т. е. имеют разные кристаллические решетки) – аллотропных модификациях, которые отличаются по свойствам.
е. имеют разные кристаллические решетки) – аллотропных модификациях, которые отличаются по свойствам.
Например, известно четыре модификации углерода – графит, алмаз, карбин и лонсдейлит.
☼ Четвёртая разновидность кристаллического углерода «лонсдейлит» мало кому известна. Он обнаружен в метеоритах и получен искусственно, а строение его ещё изучается.
☼ Сажу, кокс, древесный уголь относили к аморфным полимерам углерода. Однако теперь стало известно, что это тоже кристаллические вещества.
☼ Кстати, в саже обнаружили блестящие чёрные частицы, которые назвали «зеркальным углеродом». Зеркальный углерод химически инертен, термостоек, непроницаем для газов и жидкостей, обладает гладкой поверхностью и абсолютной совместимостью с живыми тканями.
☼ Название графита происходит от итальянского «граффитто» — пишу, рисую. Графит представляет собой тёмно – серые кристаллы со слабым металлическим блеском, имеет слоистую решётку. Отдельные слои атомов в кристалле графита, связанные между собой сравнительно слабо, легко отделяются друг от друга.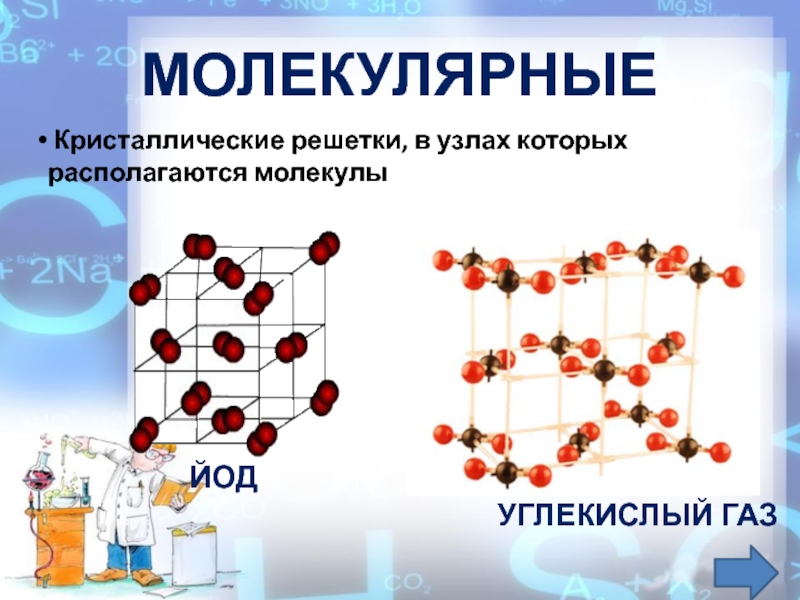
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК
Свойства веществ с различной кристаллической решёткой (таблица)
Если скорость роста кристаллов мала при охлаждении – образуется стеклообразное состояние (аморфное).
Взаимосвязь между положением элемента в Периодической системе и кристаллической решёткой его простого вещества.
Между положением элемента в периодической системе и кристаллической решёткой его соответствующего простого вещества существует тесная взаимосвязь.
Простые вещества остальных элементов имеют металлическую кристаллическую решётку.
ЗАКРЕПЛЕНИЕ
Изучите материал лекции, ответьте на следующие вопросы письменно в тетради:
— Что такое кристаллическая решётка?
— Какие виды кристаллических решёток существуют?
— Охарактеризуйте каждый вид кристаллической решётки по плану:
Что в узлах кристаллической решётки, структурная единица → Тип химической связи между частицами узла → Силы взаимодействия между частицами кристалла → Физические свойства, обусловленные кристаллической решёткой → Агрегатное состояние вещества при обычных условиях → Примеры
Выполните задания по данной теме:
— Какой тип кристаллической решётки у следующих широко используемых в быту веществ: вода, уксусная кислота (Ch4
COOH), сахар (C12
h32
O11
), калийное удобрение (KCl), речной песок (SiO2
) – температура плавления 1710 0C, аммиак (Nh4
), поваренная соль? Сделайте обобщённый вывод: по каким свойствам вещества можно определить тип его кристаллической решётки?
По формулам приведённых веществ: SiC, CS2
, NaBr, C2
h3
— определите тип кристаллической решётки (ионная, молекулярная) каждого соединения и на основе этого опишите физические свойства каждого из четырёх веществ.
Тренажёр №1. «Кристаллические решётки»
Тренажёр №2. «Тестовые задания»
Тест (самоконтроль):
1) Вещества, имеющие молекулярную кристаллическую решётку, как правило:
a). тугоплавки и хорошо растворимы в воде
б). легкоплавки и летучи
в). Тверды и электропроводны
г). Теплопроводны и пластичны
2) Понятия «молекула» не применимо по отношению к структурной единице вещества:
б). кислород
в). алмаз
3) Атомная кристаллическая решётка характерна для:
a). алюминия и графита
б). серы и йода
в). оксида кремния и хлорида натрия
г). алмаза и бора
4) Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, электропроводно, то его кристаллическая решётка:
А). молекулярная
б). атомная
в). ионная
г). металлическая
Твердые вещества — презентация онлайн
Твердые веществаКристаллические вещества
Истинно же твердые тела – это кристаллы, одной из
характерных особенностей которых является правильность
их внешнего вида.

Кристаллические вещества
Общие свойства:
Сохранение формы и объема.
Наличие постоянной температуры плавления.
Упорядоченное внутреннее строение.
только из
неметаллов
ионная
кр. реш.
Атомная кр. реш.
(SiO2; SiO2
nh3O)
неметаллы
молекулярная
кр. реш.
простые
Атомная кр. реш.
(B,C,Si,Ge,As, Se,
Te)
металлы
молекулярная
кр. реш.
металлическая
кр. реш.
Кристаллические вещества
ВЕЩЕСТВА
сложные
металл +
неметалл
Кристаллические вещества
алюминий
ковкость
пластичность
электропроводность
теплопроводность
металлический блеск
ВЕЩЕСТВА С МЕТАЛЛИЧЕСКОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ
Кристаллические вещества
NaCl
ВЕЩЕСТВА С ИОННОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ
Кристаллические вещества
сера
нафталин
сахар
малая твердость
низкая t плавления
летучесть
ВЕЩЕСТВА С МОЛЕКУЛЯРНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ
Кристаллические вещества
C
алмаз
SiO2
горный
хрусталь
твердые
прочные
тугоплавкие
практически
нерастворимые
ВЕЩЕСТВА С АТОМНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ
Кристаллические вещества
Полиморфизм-существование различных кристаллических
структур у одного и того же вещества.

Схемы строения различных
модификаций углерода:
a: алмаз;
b: графит;
c: лонсдейлит;
d: фуллерен — бакибол C60;
e: фуллерен C540;
f: фуллерен C70
g: аморфный углерод,;
h: углеродная нанотрубка
Кристаллические вещества
топаз
горный хрусталь
МОНОКРИСТАЛЛЫ
Кристаллические вещества
обработанный
алмаз
хризолит
необработанный
хризолит
обработанный
МОНОКРИСТАЛЛЫ
исландский шпат
Кристаллические вещества
ПОЛИКРИСТАЛЛЫ
магнетит
пирит
гематит
Широко распространённые минералы железа, главнейшие
железные руды.
Кристаллические вещества
аскорбиновая кислота и сахароза
витамин А
сплав титана и алюминия
булатная сталь
Фотографии сделаны с помощью электронного микроскопа
и нанотехнологий.
Кристаллические вещества
МЕГАКРИСТАЛЛЫ
Эта удивительная пещера огромных кристаллов находится в
Мексике, в штате Чивава.
Кристаллические вещества
МЕГАКРИСТАЛЛЫ
Селенит — разновидность гипса.
 Эти кристаллы – самые большие в мире.
Эти кристаллы – самые большие в мире.Самые крупные из них достигают в длину 15 м и весят 50-60 тонн.
Проверь себя!
1. Атомную кристаллическую решетку имеет каждое из двух
веществ:
1) оксид кремния (IV) и оксид углерода (IV)
2) графит и кремний
3) хлорид калия и фторид натрия
4) хлор и йод
2. Кристаллическую структуру, подобную структуре алмаза,
имеет:
1) кремнезем SiO2
2) оксид углерода (II) СО
3) оксид натрия Nа2О
4) белый фосфор Р4
Проверь себя!
3. Кристаллическая решетка графита:
1) ионная
2) атомная
3) металлическая
4) молекулярная
4. Вещества твердые, прочные, с высокой температурой
плавления, расплавы которых проводят электрический
ток, имеют кристаллическую решетку:
1) металлическую
2) атомную
3) молекулярную
4) ионную
Проверь себя!
5. Молекулярную кристаллическую решетку имеет:
1) СаF2
2) СO2
3) SiO2
4) А1F3
6. К веществам с атомной кристаллической решеткой
относятся:
1) натрий, фтор, оксид серы (IV)
2) свинец, азотная кислота, оксид магния
3) бор, алмаз, карбид кремния
4) хлорид калия, белый фосфор, йод
Проверь себя!
7.
 Вещества, обладающие твердостью, тугоплавкостью,
Вещества, обладающие твердостью, тугоплавкостью,хорошей растворимостью в воде, как правило, имеют
кристаллическую решетку:
1) молекулярную
2) ионную
3) атомную
4) металлическую
8. Атом является структурной частицей в кристаллической
решетке:
1) метана
2) водорода
3) кислорода
4) кремния
Проверь себя!
9. Для веществ с молекулярной кристаллической решеткой
характерна:
1) высокая растворимость в спирте
2) летучесть и твердость
3) высокая температура плавления
4) низкая температура плавления
10. Молекулярная кристаллическая решетка характерна
для каждого из веществ, расположенных в ряду:
1) хлорид калия, азот, метан
2) йод, диоксид углерода, гелий
3) алюминий, бром, алмаз
4) водород, сульфат магния, оксид железа (III)
Проверь себя!
11. Верные утверждения из приведенных:
А. Вещества с молекулярной решеткой имеют низкие
температуры плавления и низкую электропроводность.

Б. Вещества с атомной решеткой пластичны и обладают
высокой электрической проводимостью.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
Проверь себя!
12.Установите соответствие между названием вещества
и типом его кристаллической решетки.
НАЗВАНИЕ ВЕЩЕСТВА:
А) бром
Б) цезий
В) графит
Г) нитрид алюминия
ТИП КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ:
1) металлическая
2) молекулярная
3) ионная
4) атомная
Проверь себя!
13. Установите соответствие между типом кристаллической
решетки и свойствами веществ.
ТИП КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ:
А) ионная
Б) металлическая
В) атомная
Г) молекулярная
СВОЙСТВА:
1) твердые, тугоплавкие, не растворяются в воде
2) хрупкие, легкоплавкие, не проводят электрический ток
3) пластичные, имеют различные tпл., проводят электрический
ток 4) твердые, тугоплавкие, хорошо растворяются в воде
Аморфные вещества
Аморфные вещества (от греческого amorphos – бесформенный,
a – отрицательная частица и morphe – форма) – внешне могут
быть твердыми, а по строению относиться к жидкостям.

Аморфные вещества
Молекулы в аморфных телах расположены беспорядочно.
Нет постоянной температуры плавления, по мере повышения
температуры – размягчаются.
При низких температурах они ведут себя подобно кристаллическим телам, а при высоких – подобны жидкостям.
кристаллическое строение
аморфное строение
Аморфные вещества
Аморфные вещества
Аморфные вещества
Аморфные вещества
Аморфные вещества
Аморфные вещества
халцедон
янтарь
опал
Аморфные вещества
Переход аморфных тел в кристаллические
сера пластическая
сера кристаллическая
Аморфное состояние веществ неустойчиво, и рано или поздно
они из такого состояния переходят в кристаллическое.
Аморфные вещества
Переход аморфных тел в кристаллические
жвачка новая
использованная
жвачка
Время перехода аморфного состояния в кристаллическое может
быть разным. Для некоторых веществ оно составляет несколько
лет.
Аморфные вещества
Переход аморфных тел в кристаллические
=
Застывший твердый мед засахаривается так же, как
засахаривается при длительном хранении стекловидная
карамель.

Аморфные вещества
Аморфные тела
по структуре
по свойствам
вязкие
жидкости
твердые
тела
Проверь себя!
Установите соответствие между веществом и его
структурой.
ВЕЩЕСТВО: А) крупинка соли
Б) капелька воска
В) крупинка сахара
Г) кусочек сахара-рафинада
Д) кусочек пластилина
Е) капелька смолы
Ж) кристалл медного купороса
СТРУКТУРА: 1) аморфная структура
2) поликристаллическая структура
3) монокристаллическая структура
полимеры
Полимеры– это соединения с высокой молекулярной массой,
молекулы которых состоят из большого числа регулярно и
нерегулярно повторяющихся одинаковых или различных
звеньев.
поливинилхлорид
полимеры
В зависимости от строения макромолекул различают линейные,
разветвленные (или привитые) и пространственные полимеры.
пространственная
структура
линейная
структура
разветвленная
структура
полимеры
Полимеры
Аморфные
Кристаллические
(кристаллических
участков менее 25%)
(кристаллических
участков более 75%)
Аморфно-кристаллические
(кристаллических участков
25-75%)
полимеры
ПОЛИМЕРЫ АМОРФНОЙ СТРУКТУРЫ:
с беспорядочным взаимным расположением макромолекул;
обладают одинаковыми физико-механическими свойствами во
всех направлениях;
характеризуются низкой усадкой при литье, прозрачностью (как
правило), средней хемостойкостью и износостойкостью и
высоким поверхностным трением;
большинство распространенных в промышленности полимеров
аморфные;
имеют РАЗВЕТВЛЕННУЮ структуру молекул.
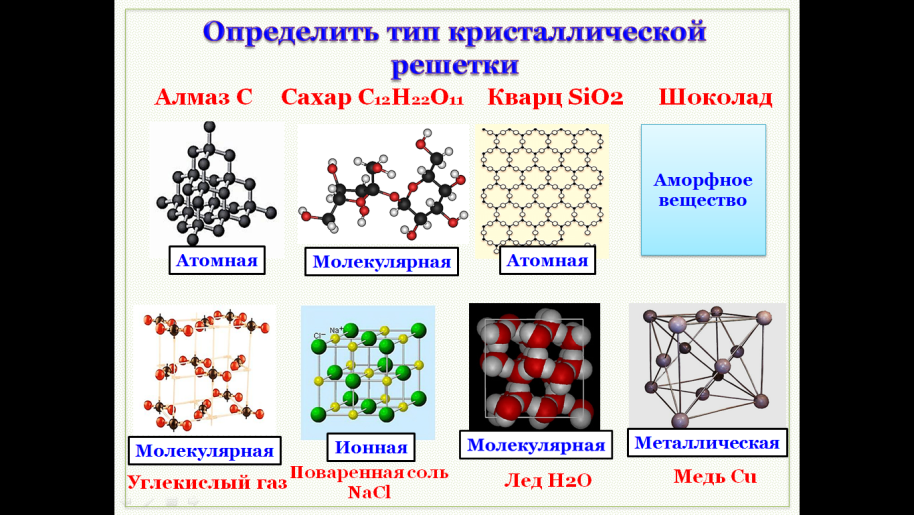
полимеры
ПОЛИМЕТИЛМЕТАКРИЛАТ (ОРГСТЕКЛО)
полимеры
ПОЛИКАРБОНАТ
полимеры
ПОЛИСТИРОЛ
полимеры
ПОЛИМЕРЫ КРИСТАЛЛИЧЕСКОЙ
СТРУКТУРЫ:
имеют упорядоченное расположение макромолекул, плотность
их упаковки;
обладают повышенной теплостойкостью, высокой прочностью,
жесткостью и плотностью, низкой эластичностью;
способны к деформациям, имеют низкое поверхностное трение,
повышенную хемостойкость и высокую усадку;
имеют ЛИНЕЙНУЮ структуру молекул.
полимеры
ПОЛИМЕРЫ АМОРФНО-КРИСТАЛЛИЧЕСКОЙ
СТРУКТУРЫ (МЕЗОФАЗНЫЕ):
полимеры с разветвленным строением макромолекул или с
затрудненной подвижностью линейных макроцепей;
содержание кристаллической фазы составляет 25-70%;
и кристаллические, и аморфно-кристаллические полимеры
могут быть только термопластичными.
полимеры
АМОРФНОСТЬ – ценное качество полимеров, так как
оно обуславливает такое их технологическое свойство
как термопластичность.
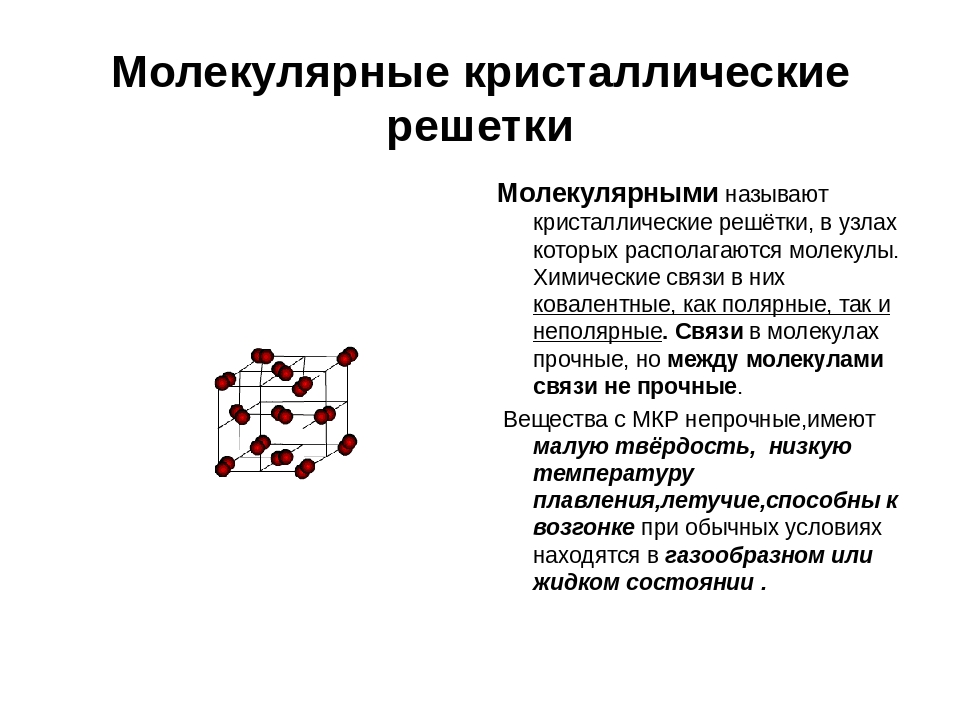
Благодаря аморфности полимер можно вытянуть в тончайшую
нить, превратить в прозрачную пленку или отлить из него
изделие самой замысловатой формы.
Основные термины
1. Твердые тела – это кристаллические вещества, одной из характерных
особенностей которых является правильность их внешнего вида.
2. Аморфные тела – тела, которые внешне могут быть твердыми, а по строению
относиться к жидкостям.
3. Монокристаллы – одиночные кристаллы.
4. Поликристаллы – это твёрдые тела, состоящие из большого числа маленьких
кристалликов.
5. Полимеры– это соединения с высокой молекулярной массой, молекулы
которых состоят из большого числа регулярно и нерегулярно повторяющихся
одинаковых или различных звеньев.
6. Аморфные – полимеры, имеющие кристаллических участков менее 25%.
7. Кристаллические – полимеры, имеющие кристаллических участков более
75%.
8. Аморфно-кристаллические – полимеры, имеющие кристаллических
участков 25-75%.

9. Термопластичность – свойство полимеров обратимо твердеть и размягчаться.
10. Анизотропия – это зависимость физических свойств от направления внутри
кристалла.
11. Изотропи́я – одинаковость физических свойств во всех направлениях.
Одинаковый тип кристаллической решетки. Кристаллическая решетка и ее основные типы
Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называюткристаллической решеткой . Точки, в которых размещены частицы, называются узлами кристаллической решетки . В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
В
зависимости от вида частиц и характера
связи между ними различают 4 вида
кристаллических решеток: ионные (NaCl,
KCl),
атомные, молекулярные и металлические.
Кристаллические решетки, состоящие из ионов, называются ионными . Их образуют вещества с ионной связью. Примером может служить кристалл хлорида натрия, в котором каждый ион натрия окружен 6 хлорид-ионами, а каждый хлорид-ион 6 ионами-натрия.
Кристаллическая решетка NaCl
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или отдельной молекуле называется координационным число .
В решетке NaCl координационные числа обоих ионов равны 6. И так, в кристалле NaCl нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na + и Cl — , Na n Cl n – где n большое число. Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Плавление
ионных кристаллов приводит к нарушению
геометрически правильной ориентации
ионов относительно друг друга и уменьшению
прочности связи между ними. Поэтому
расплавы их проводят электрический
ток. Ионные соединения, как правило,
легко растворяются в жидкостях, состоящих
из полярных молекул, например, воде.
Поэтому
расплавы их проводят электрический
ток. Ионные соединения, как правило,
легко растворяются в жидкостях, состоящих
из полярных молекул, например, воде.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными . Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с 4 соседними атомами. Координационное число углерода в алмазе равно 4. Вещества с атомной кристаллической решеткой имеют высокую температуру плавления (у алмаза свыше 3500 о С), прочны и тверды, практически не растворимы в воде.
Кристаллические
решетки, состоящие из молекул (полярных
и неполярных), называются молекулярными .
Молекулы в таких решетках соединены
между собой сравнительно слабыми
межмолекулярными силами. Поэтому
вещества с молекулярной решеткой имеют
малую твердость и низкую температуру
плавления, нерастворимы или малорастворимы
в воде, их растворы почти не проводят
электрический ток. Примерами их являются
лед, твердый СО 2
(«сухой лед»), галогены, кристаллы
водорода, кислорода, азота, благородных
газов и др.
Примерами их являются
лед, твердый СО 2
(«сухой лед»), галогены, кристаллы
водорода, кислорода, азота, благородных
газов и др.
Валентность
Важной количественной характеристикой, показывающей число взаимодействующих между собой атомов в образовавшейся молекуле, является валентность – свойство атомов одного элемента присоединять определенное число атомов других элементов.
Количественно валентность определяется числом атомов водорода, которое данный элемент может присоединять или замещать. Так, например, в плавиковой кислоте (HF) фтор одновалентен, в аммиаке (NH 3) азот трехвалентен, в кремневодороде (SiH 4 – силан) кремний четырехвалентен и т.д.
Позже,
с развитием представлений о строении
атомов, валентность элементов стали
связывать с числом неспаренных электронов
(валентных), благодаря которым
осуществляется связь между атомами.
Таким образом, валентностьопределяется
числом неспаренных электронов в атоме,
принимающих участие в образовании
химической связи (в основном или
возбужденном состоянии). В общем случае
валентность
равна числу электронных
пар, связывающих
данный атом с атомами других элементов.
В общем случае
валентность
равна числу электронных
пар, связывающих
данный атом с атомами других элементов.
Молекулярное строение имеет
1) оксид кремния(IV)
2) нитрат бария
3) хлорид натрия
4) оксид углерода(II)
Пояснение.
Под строением вещества понимают, из каких частиц молекул, ионов, атомов построена его кристаллическая решетка. Немолекулярное строение имеют вещества с ионными и металлическими связями. Вещества, в молекулах которых атомы соединены ковалентными связями могут иметь молекулярные и атомные кристаллические решетки. Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO 2 , SiC (карборунд), BN, Fe 3 C, TaC, красный и чёрный фосфор. В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
Оксид кремния (IV) — связи ковалентные, вещество твердое, тугоплавкое, кристаллическая решетка атомная. Нитрат бария и хлорид натрия вещества с ионными связями — кристаллическая решетка ионная. Оксид углерода (II) это газ в молекуле ковалентные связи, значит, это правильный ответ, кристаллическая решетка молекулярная.
Ответ: 4
Источник: Демонстрационная версия ЕГЭ-2012 по химии.
В твердом виде молекулярное строение имеет
1) оксид кремния(IV)
2) хлорид кальция
3) сульфат меди (II)
Пояснение.
Под строением вещества понимают, из каких частиц молекул, ионов, атомов построена его кристаллическая решетка. Немолекулярное строение имеют вещества с ионными и металлическими связями. Вещества, в молекулах которых атомы соединены ковалентными связями, могут иметь молекулярные и атомные кристаллические решетки. Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO 2 , SiC (карборунд), BN, Fe 3 C, TaC, красный и чёрный фосфор. В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
Вещества с молекулярной кристаллической решеткой имеет более низкие температуры кипения, чем все остальные вещества. По формуле необходимо определить тип связи в веществе, а затем определить тип кристаллической решетки. Оксид кремния (IV) — связи ковалентные, вещество твердое, тугоплавкое, кристаллическая решетка атомная. Хлорид кальция и сульфат меди — вещества с ионными связями — кристаллическая решетка ионная. В молекуле йода ковалентные связи, и он легко возгоняется, значит это правильный ответ, кристаллическая решетка молекулярная.
Оксид кремния (IV) — связи ковалентные, вещество твердое, тугоплавкое, кристаллическая решетка атомная. Хлорид кальция и сульфат меди — вещества с ионными связями — кристаллическая решетка ионная. В молекуле йода ковалентные связи, и он легко возгоняется, значит это правильный ответ, кристаллическая решетка молекулярная.
Ответ: 4
Источник: Демонстрационная версия ЕГЭ-2013 по химии.
1) оксид углерода(II)
3) бромид магния
Пояснение.
Немолекулярное строение имеют вещества с ионными и металлическими связями. Вещества, в молекулах которых атомы соединены ковалентными связями могут иметь молекулярные и атомные кристаллические решетки. Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO2, SiC (карборунд), BN, Fe3 C, TaC, красный и чёрный фосфор. В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
Ответ: 3
Источник: ЕГЭ по химии 10. 06.2013. Основная волна. Дальний Восток. Вариант 1.
06.2013. Основная волна. Дальний Восток. Вариант 1.
Ионную кристаллическую решётку имеет
2) оксид углерода(II)
4) бромид магния
Пояснение.
Немолекулярное строение имеют вещества с ионными и металлическими связями. Вещества, в молекулах которых атомы соединены ковалентными связями могут иметь молекулярные и атомные кристаллические решетки. Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO2 , CaC2 , SiC (карборунд), BN, Fe3 C, TaC, красный и чёрный фосфор. В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
Вещества с молекулярной кристаллической решеткой имеет более низкие температуры кипения, чем все остальные вещества. По формуле необходимо определить тип связи в веществе, а затем определить тип кристаллической решетки.
Ионную кристаллическую решетку имеет бромид магния.
Ответ: 4
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2.
Дальний Восток. Вариант 2.
Сульфат натрия имеет кристаллическую решётку
1) металлическую
3) молекулярную
4) атомную
Пояснение.
Вещества с молекулярной кристаллической решеткой имеет более низкие температуры кипения, чем все остальные вещества. По формуле необходимо определить тип связи в веществе, а затем определить тип кристаллической решетки.
Сульфат натрия — это соль, имеющая ионную кристаллическую решетку.
Ответ: 2
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 3.
Немолекулярное строение имеет каждое из двух веществ:
1) азот и алмаз
2) калий и медь
3) вода и гидроксид натрия
4) хлор и бром
Пояснение.
Немолекулярное строение имеют вещества с ионными и металлическими связями. Вещества, в молекулах которых атомы соединены ковалентными связями могут иметь молекулярные и атомные кристаллические решетки. Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO2, SiC (карборунд), BN, красный и чёрный фосфор. В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
Вещества с молекулярной кристаллической решеткой имеет более низкие температуры кипения, чем все остальные вещества. По формуле необходимо определить тип связи в веществе, а затем определить тип кристаллической решетки.
Из приведенных веществ только алмаз, калий, медь и гидроксид натрия имеют немолекулярное строение.
Ответ: 2
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 4.
Веществом с ионным типом кристаллической решётки является
3) уксусная кислота
4) сульфат натрия
Пояснение.
Немолекулярное строение имеют вещества с ионными и металлическими связями. Вещества, в молекулах которых атомы соединены ковалентными связями могут иметь молекулярные и атомные кристаллические решетки. Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO2 , CaC2 , SiC (карборунд), BN, Fe3 C, TaC, красный и чёрный фосфор.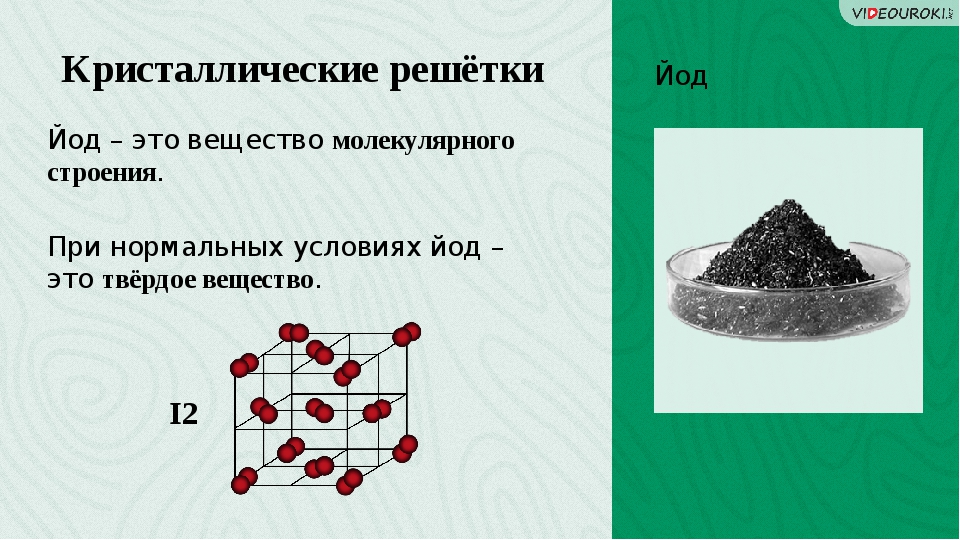 В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
Вещества с молекулярной кристаллической решеткой имеет более низкие температуры кипения, чем все остальные вещества. По формуле необходимо определить тип связи в веществе, а затем определить тип кристаллической решетки.
Ионную кристаллическую решетку имеет сульфат натрия.
Ответ: 4
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 1.
Металлическая кристаллическая решётка характерна для
2) белого фосфора
3) оксида алюминия
4) кальция
Пояснение.
Металлическая кристаллическая решетка характерна для металлов, например, кальция.
Ответ: 4
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 1.
Максим Аврамчук 22.04.2015 16:53
Все металлы кроме ртути имеют металлическую кристаллическую решетку. Не подскажите какая кристаллическая решетка у ртути и амальгамы?
Александр Иванов
Ртуть в твердом состоянии тоже имеет металлическую кристаллическую решетку
·2) оксид кальция
4) алюминий
Пояснение.
Немолекулярное строение имеют вещества с ионными и металлическими связями. Вещества, в молекулах которых атомы соединены ковалентными связями могут иметь молекулярные и атомные кристаллические решетки. Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO2 , CaC2 , SiC (карборунд), BN, Fe3 C, TaC, красный и чёрный фосфор. В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
Вещества с молекулярной кристаллической решеткой имеет более низкие температуры кипения, чем все остальные вещества. По формуле необходимо определить тип связи в веществе, а затем определить тип кристаллической решетки.
Ионную кристаллическую решетку имеет оксид кальция.
Ответ: 2
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 2.
Молекулярную кристаллическую решётку в твёрдом состоянии имеет
1) иодид натрия
2) оксид серы(IV)
3) оксид натрия
4) хлорид железа(III)
Пояснение.
Немолекулярное строение имеют вещества с ионными и металлическими связями. Вещества, в молекулах которых атомы соединены ковалентными связями могут иметь молекулярные и атомные кристаллические решетки. Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO2 , CaC2 , SiC (карборунд), BN, Fe3 C, TaC, красный и чёрный фосфор. В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
Вещества, в молекулах которых атомы соединены ковалентными связями могут иметь молекулярные и атомные кристаллические решетки. Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO2 , CaC2 , SiC (карборунд), BN, Fe3 C, TaC, красный и чёрный фосфор. В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
Вещества с молекулярной кристаллической решеткой имеет более низкие температуры кипения, чем все остальные вещества. По формуле необходимо определить тип связи в веществе, а затем определить тип кристаллической решетки.
Среди приведенных веществ все кроме оксида серы(IV) имеют ионную кристаллическую решетку, а он — молекулярную.
Ответ: 2
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 4.
Ионную кристаллическую решётку имеет
3) гидрид натрия
4) оксид азота(II)
Пояснение.
Немолекулярное строение имеют вещества с ионными и металлическими связями. Вещества, в молекулах которых атомы соединены ковалентными связями могут иметь молекулярные и атомные кристаллические решетки. Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO2 , CaC2 , SiC (карборунд), BN, Fe3 C, TaC, красный и чёрный фосфор. В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO2 , CaC2 , SiC (карборунд), BN, Fe3 C, TaC, красный и чёрный фосфор. В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
Вещества с молекулярной кристаллической решеткой имеет более низкие температуры кипения, чем все остальные вещества. По формуле необходимо определить тип связи в веществе, а затем определить тип кристаллической решетки.
Гидрид натрия имеет ионную кристаллическую решетку.
Ответ: 3
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 5.
Для веществ с молекулярной кристаллической решёткой характерным свойством является
1) тугоплавкость
2) низкая температура кипения
3) высокая температура плавления
4) электропроводность
Пояснение.
Вещества с молекулярной кристаллической решеткой имеет более низкие температуры кипения, чем все остальные вещества. Ответ: 2
Ответ: 2
Источник: ЕГЭ по химии 10. 06.2013. Основная волна. Центр. Вариант 1.
06.2013. Основная волна. Центр. Вариант 1.
Для веществ с молекулярной кристаллической решёткой характерным свойством является
1) тугоплавкость
2) высокая температура кипения
3) низкая температура плавления
4) электропроводность
Пояснение.
Вещества с молекулярной кристаллической решеткой имеет более низкие температуры плавления и кипения, чем все остальные вещества.
Ответ: 3
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 2.
Молекулярное строение имеет
1) хлороводород
2) сульфид калия
3) оксид бария
4) оксид кальция
Пояснение.
Немолекулярное строение имеют вещества с ионными и металлическими связями. Вещества, в молекулах которых атомы соединены ковалентными связями могут иметь молекулярные и атомные кристаллические решетки. Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO2 , CaC2 , SiC (карборунд), BN, Fe3 C, TaC, красный и чёрный фосфор.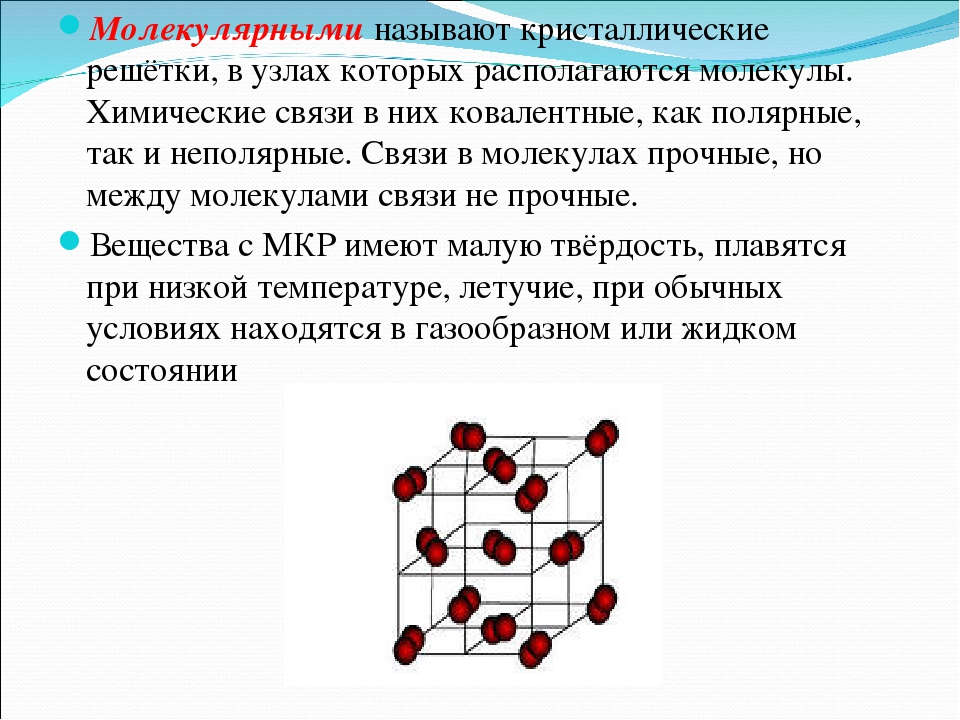 В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
Вещества с молекулярной кристаллической решеткой имеет более низкие температуры кипения, чем все остальные вещества. По формуле необходимо определить тип связи в веществе, а затем определить тип кристаллической решетки.
Из приведенных веществ все имеют ионную кристаллическую решетку кроме хлороводорода.
Ответ: 1
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 5.
Mолекулярное строение имеет
1) оксид кремния(IV)
2) нитрат бария
3) хлорид натрия
4) оксид углерода(II)
Пояснение.
Немолекулярное строение имеют вещества с ионными и металлическими связями. Вещества, в молекулах которых атомы соединены ковалентными связями могут иметь молекулярные и атомные кристаллические решетки. Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO2 , CaC2 , SiC (карборунд), BN, Fe3 C, TaC, красный и чёрный фосфор. В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
Вещества с молекулярной кристаллической решеткой имеет более низкие температуры кипения, чем все остальные вещества. По формуле необходимо определить тип связи в веществе, а затем определить тип кристаллической решетки.
Среди приведенных веществ молекулярное строение имеет угарный газ.
Ответ: 4
Источник: Демонстрационная версия ЕГЭ-2014 по химии.
Веществом молекулярного строения является
1) хлорид аммония
2) хлорид цезия
3) хлорид железа(III)
4) хлороводород
Пояснение.
Под строением вещества понимают, из каких частиц молекул, ионов, атомов построена его кристаллическая решетка. Немолекулярное строение имеют вещества с ионными и металлическими связями. Вещества, в молекулах которых атомы соединены ковалентными связями могут иметь молекулярные и атомные кристаллические решетки. Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO2, SiC (карборунд), BN, Fe3C, TaC, красный и чёрный фосфор. В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
Вещества с молекулярной кристаллической решеткой имеет более низкие температуры кипения, чем все остальные вещества. По формуле необходимо определить тип связи в веществе, а затем определить тип кристаллической решетки.
1) хлорид аммония — ионное строение
2) хлорид цезия — ионное строение
3) хлорид железа(III) — ионное строение
4) хлороводород — молекулярное строение
Ответ: 4
Какое из соединений хлора имеет наибольшую температуру плавления?
Ответ: 3
Какое из соединений кислорода имеет наибольшую температуру плавления?
Ответ: 3
Александр Иванов
Нет. Это атомная кристаллическая решётка
Игорь Сраго 22.05.2016 14:37
Поскольку в рамках ЕГЭ учат, что связь между атомами металлов и неметаллов является ионной, постольку оксид алюминия должен образовывать ионный кристалл.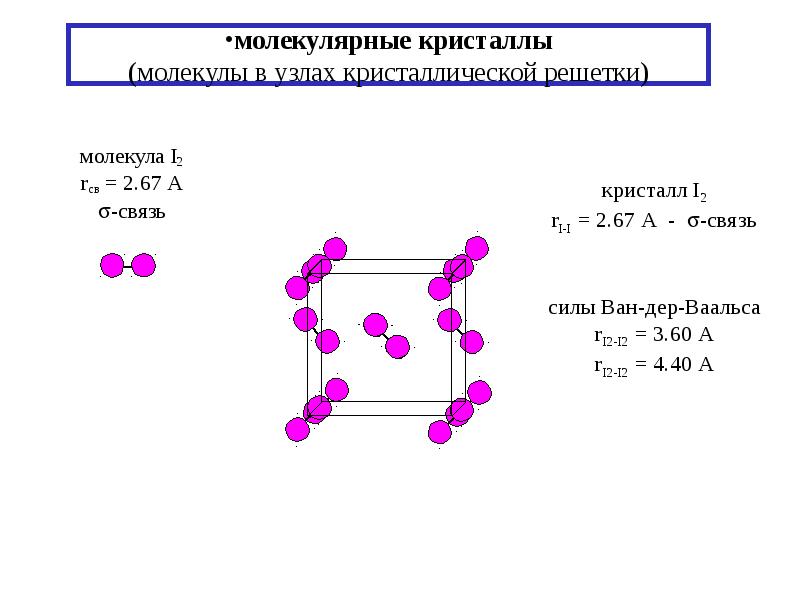 А вещества ионного строения тоже (как и атомного) имеют температуру плавления выше, чем вещества молекулярного.
А вещества ионного строения тоже (как и атомного) имеют температуру плавления выше, чем вещества молекулярного.
Антон Голышев
Вещества с атомной кристаллической решеткой лучше просто выучить.
·Для веществ с металлической кристаллической решёткой нехарактерна
1) хрупкость
2) пластичность
3) высокая электропроводность
4) высокая теплопроводность
Пояснение.
Для металлов характерна пластичность, высокая электро- и теплопроводность, а вот хрупкость для них нехарактерна.
Ответ: 1
Источник: ЕГЭ 05.05.2015. Досрочная волна.
Пояснение.
Вещества, в молекулах которых атомы соединены ковалентными связями могут иметь молекулярные и атомные кристаллические решетки. Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO2, SiC (карборунд), BN, Fe3C, TaC, красный и чёрный фосфор. В эту группу входят вещества, как правило, твердые и тугоплавкие вещества.
Ответ: 1
Молекулярную кристаллическую решётку имеет
Пояснение.
Вещества с ионными (BaSO 4) и металлическими связями имеют немолекулярное строение.
Вещества, атомы которых соединены ковалентными связями могут иметь молекулярные и атомные кристаллические решетки.
Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO 2 , SiC (карборунд), B 2 O 3 , Al 2 O 3 .
Вещества, газообразные при обычных условиях (O 2 , H 2 , NH 3 , H 2 S, CO 2), а также жидкие (H 2 O, H 2 SO 4) и твердые, но легкоплавкие (S, глюкоза), имеют молекулярное строение
Поэтому молекулярную кристаллическую решётку имеет — углекислый газ.
Ответ: 2
Атомную кристаллическую решётку имеет
1) хлорид аммония
2) оксид цезия
3) оксид кремния(IV)
4) сера кристаллическая
Пояснение.
Вещества с ионными и металлическими связями имеют немолекулярное строение.
Вещества, в молекулах которых атомы соединены ковалентными связями могут иметь молекулярные и атомные кристаллические решетки. Атомные кристаллические решетки: С (алмаз, графит), Si, Ge, B, SiO2, SiC (карборунд), BN, Fe3C, TaC, красный и чёрный фосфор. Остальные относятся к веществам с молекулярной кристаллической решеткой.
Поэтому атомную кристаллическую решётку имеет оксид кремния(IV).
Ответ: 3
Твёрдое хрупкое вещество с высокой температурой плавления, раствор которого проводит электрический ток, имеет кристаллическую решётку
2) металлическую
3) атомную
4) молекулярную
Пояснение.
Такие свойства характерны для веществ с ионной кристаллической решеткой.
Ответ: 1
Какое соединение кремния имеет в твёрдом состоянии молекулярную кристаллическую решётку?
Дата публикации 07.01.2013 17:01
Абсолютно любое химическое вещество, существующее в природе, образовано большим числом одинаковых частиц, которые связаны между собою. Все вещества существуют в трёх агрегатных состояниях: газообразном, жидком и твёрдом. Когда затруднено тепловое движение (при низких температурах), а также в твердых веществах частицы строго ориентированы в пространстве, что проявляется в их точной структурной организации.
Все вещества существуют в трёх агрегатных состояниях: газообразном, жидком и твёрдом. Когда затруднено тепловое движение (при низких температурах), а также в твердых веществах частицы строго ориентированы в пространстве, что проявляется в их точной структурной организации.
Кристаллическая решётка вещества – это структура с геометрически упорядоченным расположением частиц (атомы, молекулы либо ионы) в определённых точках пространства. В различных решетках различают межузловое пространство и непосредственно узлы – точки, в которых расположены сами частицы.
Кристаллическая решётка бывает четырех типов: металлическая, молекулярная, атомная, ионная. Типы решеток определяются в соответствии с видом частиц, расположенных в их узлах, а также характером связей между ними.
Кристаллическая решётка называется молекулярной в том случае, если в ее узлах располагаются молекулы. Они связаны между собой межмолекулярными сравнительно слабыми силами, называемые ван-дер-ваальсовыми, однако сами атомы внутри молекулы соединяются существенно более сильной ковалентной связью (полярной либо неполярной). Молекулярная кристаллическая решетка свойственна хлору, твердому водороду, двуокиси углерода и другим веществам, являющимся газообразными при обычной температуре.
Молекулярная кристаллическая решетка свойственна хлору, твердому водороду, двуокиси углерода и другим веществам, являющимся газообразными при обычной температуре.
Кристаллы, которые образуют благородные газы, также имеют молекулярные решетки, состоящие из одноатомных молекул. Большинство твердых органических веществ имеют именно такую структуру. Число же неорганических веществ, которым свойственна молекулярная структура, весьма невелико. Это, например, твердые галогеноводороды, природная сера, лед, твердые простые вещества и некоторые другие.
При нагревании относительно слабые межмолекулярные связи разрушаются довольно легко, поэтому вещества с такими решетками имеют очень низкие температуры плавления и малую твердость, они нерастворимы либо малорастворимы в воде, растворы их практически не проводят электрический ток, характеризуются значительной летучестью. Минимальные температуры кипения и плавления – у веществ из неполярных молекул.
Металлической называется такая кристаллическая решетка, узлы которой сформированы атомами и положительными ионами (катионами) металла со свободными валентными электронами (отцепившимися от атомов при образовании ионов), беспорядочно движущимися в объеме кристалла. Однако эти электроны по существу являются полусвободными, так как могут беспрепятственно перемещаться только в рамках, которые ограничивает данная кристаллическая решетка.
Однако эти электроны по существу являются полусвободными, так как могут беспрепятственно перемещаться только в рамках, которые ограничивает данная кристаллическая решетка.
Электростатические электроны и положительные ионы металлов взаимно притягиваются, чем объясняется стабильность металлической кристаллической решетки. Совокупность свободных движущихся электронов называют электронным газом – он обеспечивает хорошую электро- и теплопроводность металлов. При появлении электрического напряжения электроны устремляются к положительной частице, участвуя в создании электрического тока и взаимодействуя с ионами.
Металлическая кристаллическая решетка характерна, главным образом, для элементарных металлов, а также для соединений различных металлов друг с другом. Основные свойства, которые присущи металлическим кристаллам(механическая прочность, летучесть, температура плавления), достаточно сильно колеблются. Однако такие физические свойства, как пластичность, ковкость, высокая электро- и теплопроводность, характерный металлический блеск свойственны лишь исключительно кристаллам с металлической решеткой.
Cтраница 1
Молекулярные кристаллические решетки и соответствующие им молекулярные связи образуются преимущественно в кристал-дах тех веществ, в молекулах которых связи являются ковалент-ными. При нагревании связи между молекулами легко разрушаются, поэтому вещества с молекулярными решетками обладают низкими температурами плавления.
Молекулярные кристаллические решетки образуются из полярных молекул, между которыми возникают силы взаимодействия, так называемые ван-дер-ваальсовы силы, имеющие электрическую природу. В молекулярной решетке они осуществляют довольно слабую связь. Молекулярную кристаллическую решетку имеют лед, природная сера и многие органические соединения.
Молекулярная кристаллическая решетка иода показана на рис. 3.17. Большинство кристаллических органических соединений имеют молекулярную решетку.
Узлы молекулярной кристаллической решетки образованы молекулами. Молекулярную решетку имеют, например, кристаллы водорода, кислорода, азота, благородных газов, диоксида углерода, органических веществ.
Наличие молекулярной кристаллической решетки твердой фазы является здесь причиной незначительной адсорбции ионов из маточного раствора, а следовательно, и гораздо более высокой чистоты осадков по сравнению с осадками, для которых характерна ионная кристал. Поскольку осаждение в этом случае происходит в оптимальной области кислотности, различной для ионов, осаждаемых этим реактивом, оно находится в зависимости от значения соответствующих констант устойчивости комплексов. Этот факт позволяет, регулируя кислотность раствора, достигать селективного, а иногда даже специфического осаждения определенных ионов. Подобные результаты часто могут быть получены путем подходящего изменения доноркых групп в органических реактивах с учетом особенностей катионов-ком-плексообразователей, которые осаждаются.
В молекулярных кристаллических решетках наблюдается локальная анизотропия связей, а именно: внутримолекулярные силы очень велики по сравнению с межмолекулярными.
В молекулярных кристаллических решетках в узлах решетки находятся молекулы. Большинство веществ с ковалентной связью образуют кристаллы такого типа. Молекулярные решетки образуют твердые водород, хлор, двуокись углерода и другие вещества, которые при обычной температуре газообразны. Кристаллы большинства органических веществ также относятся к этому типу. Таким образом, веществ с молекулярно кристаллической решеткой известно очень много.
Большинство веществ с ковалентной связью образуют кристаллы такого типа. Молекулярные решетки образуют твердые водород, хлор, двуокись углерода и другие вещества, которые при обычной температуре газообразны. Кристаллы большинства органических веществ также относятся к этому типу. Таким образом, веществ с молекулярно кристаллической решеткой известно очень много.
В молекулярных кристаллических решетках составляющие их молекулы связаны между собой при помощи относительно слабых ван-дер-ваальсовых сил, тогда как атомы внутри молекулы связаны значительно более сильной ковалентной связью. Поэтому в таких решетках молекулы сохраняют свою индивидуальность и занимают один узел кристаллической решетки. Замещение здесь возможно в том случае, если молекулы сходны между собой по форме и по размерам. Поскольку силы, связывающие молекулы, относительно слабы, то и границы замещения здесь значительно шире. Как показал Никитин , атомы благородных газов могут изоморфно замещать молекулы СО2, SO2, Ch4COCh4 и другие в решетках этих веществ. Сходство химической формулы здесь оказывается не обязательным.
Сходство химической формулы здесь оказывается не обязательным.
В молекулярных кристаллических решетках в узлах решетки находятся молекулы. Большинство веществ с ковалентной связью образуют кристаллы такого типа. Молекулярные решетки образуют твердые водород, хлор, двуокись углерода и другие вещества, которые при обычной температуре газообразны. Кристаллы большинства органических веществ также относятся к этому типу. Таким образом, веществ с молекулярной кристаллической решеткой известно очень много. Молекулы, находящиеся в узлах решетки, связаны друг с другом межмолекулярными силами (природа этих сил была рассмотрена выше; см. стр. Так как межмолекулярные силы значительно слабее сил химической связи, то молекулярные кристаллы легкоплавки, характеризуются значительной летучестью, твердость их невелика. Особенно низки температуры плавления и кипения у тех веществ, молекулы которых неполярны. Так, например, кристаллы парафина очень мягки, хотя ковалентные связи С-С в углеводородных молекулах, из которых состоят эти кристаллы, столь же прочны, как связи в алмазе. Кристаллы, образуемые благородными газами, также следует отнести к молекулярным, состоящим из одноатомных молекул, поскольку валентные силы в образовании этих кристаллов роли не играют, и связи между частицами здесь имеют тот же характер, что и в других молекулярных кристаллах; это обусловливает сравнительно большую величину межатомных расстояний в этих кристаллах.
Кристаллы, образуемые благородными газами, также следует отнести к молекулярным, состоящим из одноатомных молекул, поскольку валентные силы в образовании этих кристаллов роли не играют, и связи между частицами здесь имеют тот же характер, что и в других молекулярных кристаллах; это обусловливает сравнительно большую величину межатомных расстояний в этих кристаллах.
| Схема регистрации дебаеграммм. |
В узлах молекулярных кристаллических решеток находятся молекулы, которые связаны друг с другом слабыми межмолекулярными силами. Такие кристаллы образуют вещества с ковалент-ной связью в молекулах. Веществ с молекулярной кристаллической решеткой известно очень много. Молекулярные решетки имеют твердые водород, хлор, диоксид углерода и другие вещества, которые при обычной температуре газообразны. Кристаллы большинства органических веществ также относятся к этому типу.
В природе есть два вида твердых тел, которые заметно различаются своими свойствами. Это аморфные и кристаллические тела. И аморфные тела не имеют точной температуры плавления, они во время нагревания постепенно размягчаются, а затем переходят в текучее состояния. Примером таких веществ может служить смола или обычный пластилин. Но совсем по-другому дело обстоит с кристаллическими веществами. Они остаются в твердом состоянии до какой-то определенной температуры, и только достигнув ее, эти вещества расплавляются.
Это аморфные и кристаллические тела. И аморфные тела не имеют точной температуры плавления, они во время нагревания постепенно размягчаются, а затем переходят в текучее состояния. Примером таких веществ может служить смола или обычный пластилин. Но совсем по-другому дело обстоит с кристаллическими веществами. Они остаются в твердом состоянии до какой-то определенной температуры, и только достигнув ее, эти вещества расплавляются.
Здесь все дело в строении таких веществ. В кристаллических телах частицы, из которых они состоят, расположены в определенных точках. И если их соединить прямыми линиями, то получится некий воображаемый каркас, который так и называется — кристаллическая решетка. А типы кристаллических решеток могут быть самые разные. И по виду частиц, из которых они «построены», решетки делятся на четыре типа. Это ионная, атомная, молекулярная и
И в узлах соответственно, расположены ионы, и между ними существует ионная связь. могут быть как простыми (Cl-, Na+), так и сложными (OH-, SO2-). И такие типы кристаллических решеток могут содержать некоторые гидроксиды и оксиды металлов, соли и другие подобные вещества. Возьмем, к примеру, обычный хлорид натрия. В нем чередуются отрицательные ионы хлора и положительные ионы натрия, которые образуют кубическую кристаллическую решетку. Ионные связи в такой решетке весьма устойчивы и вещества, «построенные» по такому принципу, имеют достаточно высокую прочность и твердость.
И такие типы кристаллических решеток могут содержать некоторые гидроксиды и оксиды металлов, соли и другие подобные вещества. Возьмем, к примеру, обычный хлорид натрия. В нем чередуются отрицательные ионы хлора и положительные ионы натрия, которые образуют кубическую кристаллическую решетку. Ионные связи в такой решетке весьма устойчивы и вещества, «построенные» по такому принципу, имеют достаточно высокую прочность и твердость.
Есть также типы кристаллических решеток, называемых атомными. Здесь в узлах расположены атомы, между которыми существует сильная ковалентная связь. Атомную решетку имеют не очень много веществ. К ним относится алмаз, а также кристаллический германий, кремний и бор. Есть еще некоторые сложные вещества, которые содержат и имеют, соответственно, атомную кристаллическую решетку. Это горный хрусталь и кремнезем. И в большинстве случаев такие вещества очень прочные, твердые и тугоплавкие. Также они практически нерастворимы.
А молекулярные типы кристаллических решеток имеют самые разные вещества. К ним относится замерзшая вода, то есть обычный лед, «сухой лед» — затвердевший оксид углерода, а также твердый сероводород и хлороводород. Еще молекулярные решетки имеют много твердых органических соединений. К ним относится сахар, глюкоза, нафталин и прочие подобные вещества. А молекулы, находящиеся в узлах такой решетки, связаны между собой полярными и неполярными химическими связями. И несмотря на то, что внутри молекул между атомами существуют прочные ковалентные связи, сами эти молекулы держатся в решетке за счет очень слабых межмолекулярных связей. Поэтому такие вещества достаточно летучи, легко плавятся и не обладают большой твердостью.
К ним относится замерзшая вода, то есть обычный лед, «сухой лед» — затвердевший оксид углерода, а также твердый сероводород и хлороводород. Еще молекулярные решетки имеют много твердых органических соединений. К ним относится сахар, глюкоза, нафталин и прочие подобные вещества. А молекулы, находящиеся в узлах такой решетки, связаны между собой полярными и неполярными химическими связями. И несмотря на то, что внутри молекул между атомами существуют прочные ковалентные связи, сами эти молекулы держатся в решетке за счет очень слабых межмолекулярных связей. Поэтому такие вещества достаточно летучи, легко плавятся и не обладают большой твердостью.
Ну а металлы имеют самые разные виды кристаллических решеток. И в их узлах могут находиться как атомы, так и ионы. При этом атомы могут легко превращаться в ионы, отдавая свои электроны в «общее пользование». Таким же образом ионы, «захватив» свободный электрон, могут становиться атомами. И такое решетки определяет такие свойства металлов, как пластичность, ковкость, тепло- и электропроводимость.
Также типы кристаллических решеток металлов, да и других веществ, делятся на семь основных систем по форме элементарных ячеек решетки. Самой простой является кубическая ячейка. Есть также ромбические, тетрагональные, гексагональные, ромбоэдрические, моноклинные и триклинные элементарные ячейки, которые определяют форму всей кристаллической решетки. Но в большинстве случаев кристаллические решетки являются более сложными, чем те, что перечислены выше. Это связано с тем, что элементарные частицы могут находиться не только в самих узлах решетки, а и в ее центре или на ее гранях. И среди металлов наиболее распространены такие три сложные кристаллические решетки: гранецентрированная кубическая, объемно-центрированная кубическая и гексагональная плотноупакованная. Еще физические характеристики металлов зависят не только от формы их кристаллической решетки, а и от межатомного расстояния и от других параметров.
Молекулярную кристаллическую решетку имеет соединение. Типы кристаллических решеток
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- кристаллическая решетка.
Ионная кристаллическая решетка
Главной особенностью строения кристаллической решетки ионов являются противоположные электрические заряды, собственно, ионов, вследствие чего образуется электромагнитное поле, определяющее свойства веществ, имеющих ионную кристаллическую решетку. А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные . Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Молекулярная кристаллическая решетка
Молекулярный тип кристаллической решетки характеризуется наличием устойчивых и плотноупакованных молекул.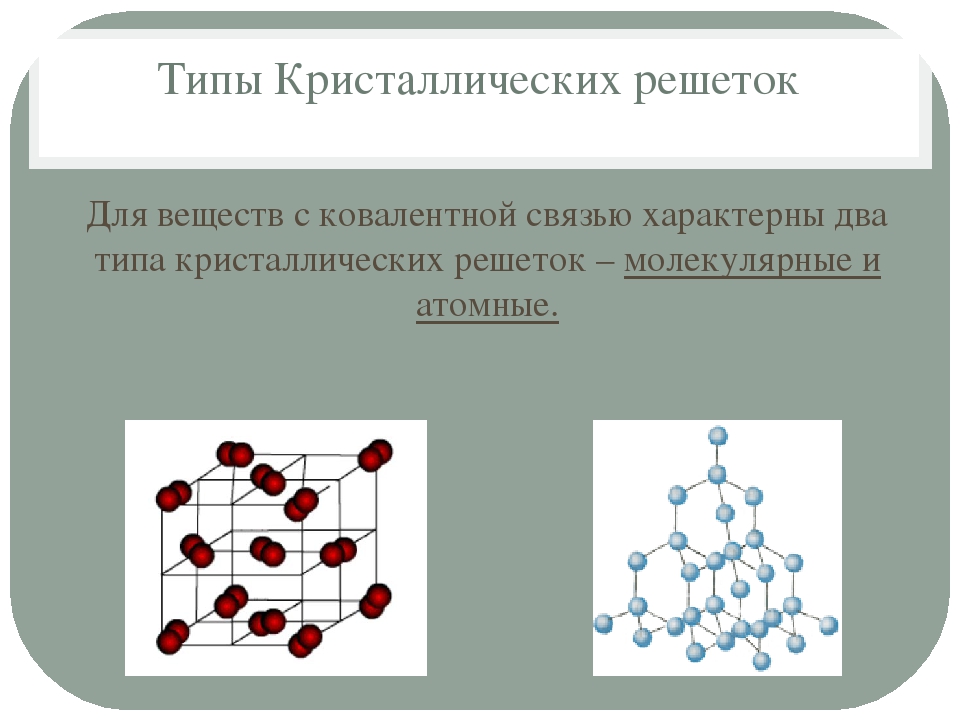 Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
Большинство твердых веществ имеют кристаллическую структуру , в которой частицы, из которых она «построена» находятся в определенном порядке, создавая тем самым кристаллическую решетку . Она строится из повторяющихся одинаковых структурных единиц — элементарных ячеек , которая связывается с соседними ячейками, образуя дополнительные узлы. В результате существует 14 различных кристаллических решеток.
Типы кристаллических решеток.
В зависимости от частиц, которые стоят в узлах решетки, различают:
- металлическую кристаллическую решетку;
- ионную кристаллическую решетку;
- молекулярную кристаллическую решетку;
- макромолекулярную (атомную) кристаллическую решетку.
Металлическая связь в кристаллических решетках.
Ионные кристаллы обладают повышенной хрупкостью, т.к. сдвиг в решетке кристалла (даже незначительный) приводит к тому, что одноименно заряженные ионы начинают отталкиваться друг от друга, и связи рвутся, образуются трещины и расколы.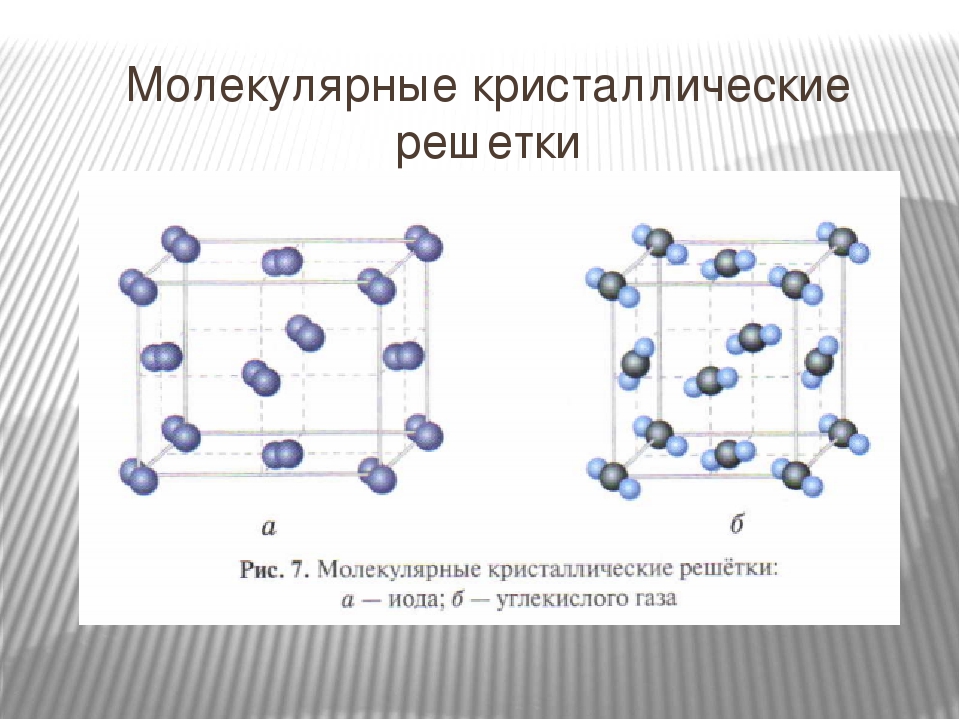
Молекулярная связь кристаллических решеток.
Основная особенность межмолекулярной связи заключается в ее «слабости» (ван-дер-ваальсовые, водородные).
Это структура льда. Каждая молекула воды связана водородными связями с 4-мя окружающими ее молекулами, в результате структура имеет тетраэдрический характер.
Водородная связь объясняет высокую температуру кипения, плавления и малую плотность;
Макромолекулярная связь кристаллических решеток.
В узлах кристаллической решетки находятся атомы. Эти кристаллы разделяются на 3 вида:
- каркасные;
- цепочечные;
- слоистые структуры.
Каркасной структурой обладает алмаз — одно их самых твердых веществ в природе. Атом углерода образует 4 одинаковые ковалентные связи, что говорит о форме правильного тетраэдра (sp 3 — гибридизация). Каждый атом имеет неподеленную пару электронов, которые также могут связываться с соседними атомами. В результате чего образуется трехмерная решетка, в узлах которой только атомы углерода.
Энергии для разрушения такой структуры требуется очень много, температура плавления таких соединений высока (у алмаза она составляет 3500°С).
Слоистые структуры говорят о наличии ковалентных связях внутри каждого слоя и слабых ван-дер-ваальсовых — между слоями.
Рассмотрим пример: графит. Каждый атом углерода находится в sp 2 — гибридизации. 4-ый неспаренный электрон образует ван-дер-ваальсовую связь между слоями. Поэтому 4ый слой очень подвижен:
Связи слабые, поэтому их легко разорвать, что можно наблюдать у карандаша — «пишущее свойство» — 4ый слой остается на бумаге.
Графит — отличный проводник электрического тока (электроны способны перемещаться вдоль плоскости слоя).
Цепочечными структурами обладают оксиды (например, SO 3 ), который кристаллизуется в виде блестящих иголок, полимеры, некоторые аморфные вещества, силикаты (асбест).
Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой
.
Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой
.
Точки, в которых размещены частицы, называются узлами кристаллической решетки . В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные , атомные , молекулярные и металлические .
Кристаллические решетки, состоящие из ионов, называются ионными
. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион — шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле. Очень часто кристаллические решетки изображают, как показано на рис , где указывается только взаимное расположение частиц, но не их размеры.
Очень часто кристаллические решетки изображают, как показано на рис , где указывается только взаимное расположение частиц, но не их размеры.
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом .
В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na + и Cl — , Na n Cl n , где n — большое число. Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными . Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число углерода в алмазе 4 . В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными .
Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико.
Число неорганических веществ с молекулярной решеткой невелико.
Примерами их являются лед, твердый оксид углерода (IV) («сухой лед»), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F 2 , Сl 2 , Br 2 , I 2 , Н 2 , О 2 , N 2), трех- (О 3), четырех- (Р 4), восьми- (S 8) атомными молекулами. Молекулярная кристаллическая решетка йода показана на рис . Большинство кристаллических органических соединений имеют молекулярную решетку.
Любое вещество в природе, как известно, состоит из более мелких частиц. Они, в свою очередь, связаны и образуют определенную структуру, которая определяет свойства конкретного вещества.
Атомная свойственна и возникает при низких температурах и высоком давлении. Собственно, именно благодаря такому , металлы и ряд других материалов приобретают характерную прочность.
Строение таких веществ на молекулярном уровне выглядит, как кристаллическая решетка, каждый атом в которой связан со своим соседом самым прочным соединением, существующим в природе — ковалентной связью. Все мельчайшие элементы, образующие структуры, расположены упорядоченно и с определенной периодичностью. Представляя собой сетку, в углах которой расположены атомы, окруженные всегда одинаковым числом спутников, атомная кристаллическая решетка практически не меняет своего строения. Общеизвестно, что изменить структуру чистого металла или сплава можно лишь нагревая его. При этом температура тем выше, чем более прочные связи в решетке.
Все мельчайшие элементы, образующие структуры, расположены упорядоченно и с определенной периодичностью. Представляя собой сетку, в углах которой расположены атомы, окруженные всегда одинаковым числом спутников, атомная кристаллическая решетка практически не меняет своего строения. Общеизвестно, что изменить структуру чистого металла или сплава можно лишь нагревая его. При этом температура тем выше, чем более прочные связи в решетке.
Иными словами, атомная кристаллическая решетка является залогом прочности и твердости материалов. При этом, однако, стоит учитывать, что расположение атомов в различных веществах также может отличаться, что, в свою очередь, влияет на степень прочности. Так, например, алмаз и графит, имеющие в составе один и тот же атом углерода, в высшей мере отличаются друг от друга по показателям прочности: алмаз — на Земле, графит же может слоиться и ломаться. Дело в том, что в кристаллической решетке графита атомы расположены слоями. Каждый слой напоминает пчелиную соту, в которой атомы углерода сочленены достаточно слабо.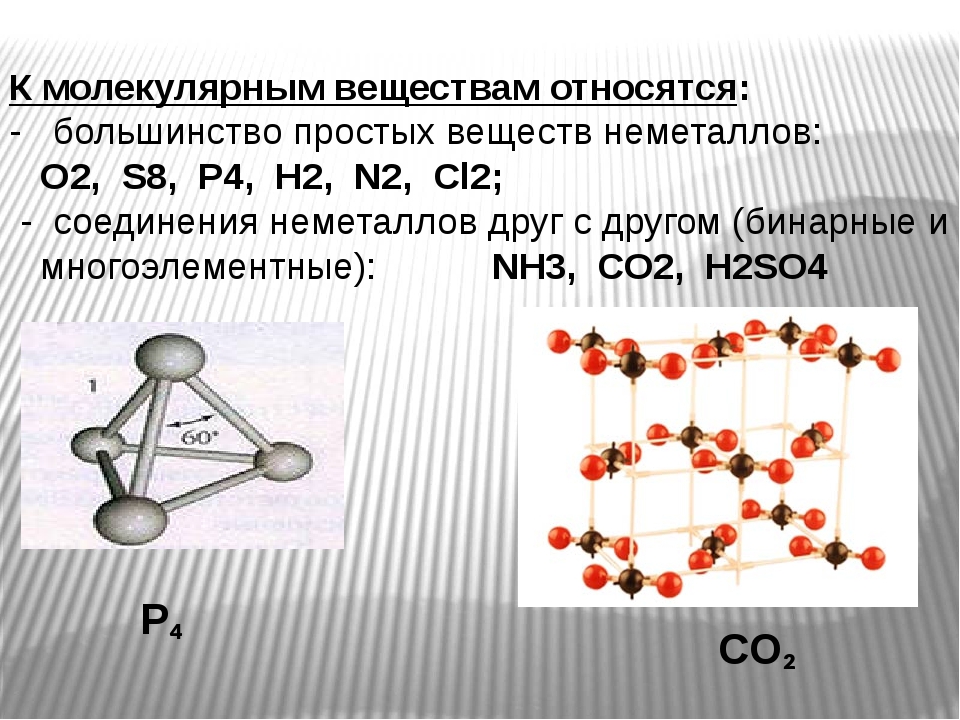 Подобное строение обуславливает слоистое крошение грифелей карандаша: при поломке части графита попросту отслаиваются. Другое дело — алмаз, кристаллическая решетка которого состоит из возбужденных атомов углерода, то есть тех, что способны образовывать 4 прочных связи. Разрушить такое сочленение попросту невозможно.
Подобное строение обуславливает слоистое крошение грифелей карандаша: при поломке части графита попросту отслаиваются. Другое дело — алмаз, кристаллическая решетка которого состоит из возбужденных атомов углерода, то есть тех, что способны образовывать 4 прочных связи. Разрушить такое сочленение попросту невозможно.
Кристаллические решетки металлов, кроме того, обладают определенными характеристиками:
1. Период решетки — величина, определяющая расстояние между центрами двух рядом расположенных атомов, измеряемая по ребру решетки. Общепринятое обозначение не отличается от оного в математике: a, b, c — длина, ширина, высота решетки соответственно. Очевидно, что размеры фигуры столь малы, что расстояние измеряется в наименьших единицах измерения — десятой доли нанометра или ангстремах .
2. К — координационное число . Показатель, определяющий плотность упаковки атомов в рамках одной решетки. Соответственно, плотность ее тем больше, чем выше число К. По факту же данная цифра являет собой количество атомов, находящихся как можно ближе и на равном расстоянии от изучаемого атома.
3. Базис решетки . Также величина, характеризующая плотность решетки. Представляет собой общее число атомов, которые принадлежат конкретной изучаемой ячейке.
4. Коэффициент компактности измеряется путем подсчета общего объема решетки, поделенного на тот объем, что занимают все атомы в ней. Как и предыдущие две, эта величина отражает плотность изучаемой решетки.
Мы рассмотрели всего несколько веществ, которым свойственна атомная кристаллическая решетка. Меж тем, их великое множество. Несмотря на большое разнообразие, кристаллическая атомная решетка включает в себя единицы, всегда соединенные при помощи (полярной или неполярной). Кроме того, подобные вещества практически не растворяются в воде и характеризуются низкой теплопроводностью.
В природе существует три вида кристаллических решеток: кубическая объемно-центрированная, кубическая гранецентрированная, плотноупакованная гексагональная.
Молекулярное и немолекулярное строение веществ.
 Строение вещества
Строение веществаВ химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. По типу связи различают вещества молекулярного и немолекулярного строения . Вещества, состоящие из молекул, называются молекулярными веществами . Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (C, Si, Li, Na, K, Cu, Fe, W), среди них есть металлы и неметаллы. К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли (NaCl, K 2 SO 4), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, KOH). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Твердые вещества: аморфные и кристаллические
Твердые вещества делятся на кристаллические и аморфные .
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки. В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионными называют кристаллические решетки , в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl — , так и сложные SO 4 2- , OH — . Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na + и отрицательных Cl — , образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Кристаллическая решетка — а) и аморфная решетка — б).
Кристаллическая решетка — а) и аморфная решетка — б).
Атомные кристаллические решетки
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями . Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода. Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С), они прочны и тверды, практически нерастворимы.
Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода. Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С), они прочны и тверды, практически нерастворимы.
Молекулярные кристаллические решетки
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными (HCl, H 2 O), и неполярными (N 2 , O 2). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения . Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Молекулярная кристаллическая решетка(углекислый газ)
Металлические кристаллические решетки
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Шпаргалки
Molecular Crystal — обзор
1 КОНТРАСТ МЕЖДУ МОЛЕКУЛЯРНЫМИ И ИОННЫМИ ТВЕРДЫМИ моделирование. Однако эти противоположные методы необходимо объединить для моделирования многих неорганических систем, которые включают как ковалентные, так и ионные связи. Актуальный пример — био-неорганические поверхности раздела, где ковалентно связанные органические соединения взаимодействуют с ионными твердыми веществами.
Структуры ионных твердых тел можно понять с точки зрения упаковки сфер, тогда как молекулярные кристаллы являются результатом упаковки различных форм. Лишь несколько простых многоатомных молекул имеют даже приблизительно сферическую форму; больше молекул пластинчато, но большинство органических молекул имеют очень неправильную форму. Эти формы кристаллизуются в плотноупакованные структуры, причем отношение молекулярного объема к объему элементарной ячейки составляет 0,7 ± 0,05 для подавляющего большинства структур органических кристаллов (Перцин, Китайгородский, 1987), что приближается к эффективности упаковки твердых сфер (0 .74). Этот принцип плотной упаковки может почти определять кристаллическую структуру многих органических соединений неправильной формы. Действительно, основополагающий принцип молекулярной кристаллографии, выдвинутый Китайгородским (1973), заключается в том, что «выступы одной молекулы вставляются в полости других». Он добился значительного прогресса в рационализации кристаллических структур, используя этот принцип «ласточкин хвост» и искателя механической структуры, который использовал модели, заполняющие пространство. Эквивалент для ионных твердых тел, правила отношения радиусов, заведомо неэффективны даже для простых бинарных соединений.
Эти формы кристаллизуются в плотноупакованные структуры, причем отношение молекулярного объема к объему элементарной ячейки составляет 0,7 ± 0,05 для подавляющего большинства структур органических кристаллов (Перцин, Китайгородский, 1987), что приближается к эффективности упаковки твердых сфер (0 .74). Этот принцип плотной упаковки может почти определять кристаллическую структуру многих органических соединений неправильной формы. Действительно, основополагающий принцип молекулярной кристаллографии, выдвинутый Китайгородским (1973), заключается в том, что «выступы одной молекулы вставляются в полости других». Он добился значительного прогресса в рационализации кристаллических структур, используя этот принцип «ласточкин хвост» и искателя механической структуры, который использовал модели, заполняющие пространство. Эквивалент для ионных твердых тел, правила отношения радиусов, заведомо неэффективны даже для простых бинарных соединений.
Различия в форме приводят к значительным различиям в диапазонах принятых структур, и это меняет вопросы, которые пытается решить компьютерное моделирование. Уже определены многие молекулярные кристаллические структуры; Кембриджская структурная база данных (Аллен и др. , 1991; Аллен и Кеннард, 1993) содержит 140 268 кристаллических структур органических и металлоорганических соединений (выпуск от апреля 1995 года). Различные статистические анализы показывают, что более 90% этих структур содержат только одну независимую молекулу в элементарной ячейке (Belsky, Zorkii, 1977) и что 75% органических структур принадлежат только пяти пространственным группам (Mighell et al., 1983). Таким образом, структуры с более чем восемью молекулами в элементарной ячейке встречаются редко, и большинство молекул кристаллизуются с одной, двумя или четырьмя молекулами в элементарной ячейке. Следовательно, обычно нетрудно найти молекулярную упаковку, соответствующую заданному набору размеров ячеек. Целью моделирования молекулярной кристаллической структуры является предсказание размеров элементарной ячейки и упаковки молекулы до ее синтеза.
Уже определены многие молекулярные кристаллические структуры; Кембриджская структурная база данных (Аллен и др. , 1991; Аллен и Кеннард, 1993) содержит 140 268 кристаллических структур органических и металлоорганических соединений (выпуск от апреля 1995 года). Различные статистические анализы показывают, что более 90% этих структур содержат только одну независимую молекулу в элементарной ячейке (Belsky, Zorkii, 1977) и что 75% органических структур принадлежат только пяти пространственным группам (Mighell et al., 1983). Таким образом, структуры с более чем восемью молекулами в элементарной ячейке встречаются редко, и большинство молекул кристаллизуются с одной, двумя или четырьмя молекулами в элементарной ячейке. Следовательно, обычно нетрудно найти молекулярную упаковку, соответствующую заданному набору размеров ячеек. Целью моделирования молекулярной кристаллической структуры является предсказание размеров элементарной ячейки и упаковки молекулы до ее синтеза.
Предсказание молекулярных кристаллических структур — фундаментальная проблема в физической химии, которая проверяет как модель сил между молекулами, так и модель кинетических и термодинамических эффектов, контролирующих кристаллизацию. Это имеет практическое значение при разработке новых материалов. Например, молекула с высоким нелинейным оптическим коэффициентом будет поддерживать это желаемое свойство в кристалле только в том случае, если она упаковывается в нецентросимметричной пространственной группе. Многие органические молекулы могут кристаллизоваться в более чем одной форме, и разные полиморфы обладают разными физическими свойствами, такими как растворимость или легкость таблетирования. Полиморфизм может принимать разные формы; это может быть результатом различных конформаций молекулы в кристалле или включения различных молекул растворителя в кристаллическую структуру, а также просто различных упаковок идентичных молекул, относительная стабильность которых зависит от условий температуры и давления.Полиморфизм плохо изучен, поскольку часто кажется, что количество известных полиморфов в основном зависит от затраченных экспериментальных усилий. Действительно, часто требуется так много усилий, чтобы убедить новое соединение образовать четко определенные кристаллы, что у немногих химиков-органиков есть мотивация экспериментировать с дальнейшими условиями кристаллизации, чтобы найти новые структуры.
Это имеет практическое значение при разработке новых материалов. Например, молекула с высоким нелинейным оптическим коэффициентом будет поддерживать это желаемое свойство в кристалле только в том случае, если она упаковывается в нецентросимметричной пространственной группе. Многие органические молекулы могут кристаллизоваться в более чем одной форме, и разные полиморфы обладают разными физическими свойствами, такими как растворимость или легкость таблетирования. Полиморфизм может принимать разные формы; это может быть результатом различных конформаций молекулы в кристалле или включения различных молекул растворителя в кристаллическую структуру, а также просто различных упаковок идентичных молекул, относительная стабильность которых зависит от условий температуры и давления.Полиморфизм плохо изучен, поскольку часто кажется, что количество известных полиморфов в основном зависит от затраченных экспериментальных усилий. Действительно, часто требуется так много усилий, чтобы убедить новое соединение образовать четко определенные кристаллы, что у немногих химиков-органиков есть мотивация экспериментировать с дальнейшими условиями кристаллизации, чтобы найти новые структуры. Убедительные компьютерные предсказания новых полиморфов могут стать катализатором их открытия. Возникающий патентный закон о различных кристаллических формах лекарств, таких как ранитидин, также будет способствовать систематическому поиску полиморфных кристаллических структур.
Убедительные компьютерные предсказания новых полиморфов могут стать катализатором их открытия. Возникающий патентный закон о различных кристаллических формах лекарств, таких как ранитидин, также будет способствовать систематическому поиску полиморфных кристаллических структур.
Прежде чем теоретики и экспериментаторы смогут понять полиморфизм, мы должны уметь предсказывать известные молекулярные кристаллические структуры. Как и в изучении полярных материалов, описанном в главах 9 и 10, такие исследования состоят из двух компонентов: во-первых, нам нужна реалистичная модель сил между молекулами, а во-вторых, метод моделирования, который найдет все возможные кристаллические структуры. Прогресс наблюдается по обоим направлениям. Модельные потенциалы, которые являются достаточно реалистичными, поскольку минимум энергии решетки находится достаточно близко к экспериментальной структуре, в настоящее время разрабатываются для полярных органических молекул.Эти потенциалы теоретически обоснованы, что дает большую уверенность в оценках энергии решетки для гипотетических структур. Точно так же недавно были предложены различные систематические методы создания гипотетических кристаллических структур в качестве отправных точек для минимизации. Степень, в которой эти методы распространяются на различные типы молекул, неясна, и не было подробных сравнений с методами моделирования отжига, но сочетание этих методов с реалистичными потенциалами должно позволить нам предсказать молекулярные кристаллические структуры к началу века.
Точно так же недавно были предложены различные систематические методы создания гипотетических кристаллических структур в качестве отправных точек для минимизации. Степень, в которой эти методы распространяются на различные типы молекул, неясна, и не было подробных сравнений с методами моделирования отжига, но сочетание этих методов с реалистичными потенциалами должно позволить нам предсказать молекулярные кристаллические структуры к началу века.
Дополнительные темы
Межмолекулярные силы
Молекула представляет собой наименьшую наблюдаемую группу атомов с уникальными связями, которые представляют состав, конфигурацию и характеристики чистого соединения. До этого момента мы в основном фокусировались на обнаружении и описании способов, которыми атомы связываются вместе, образуя молекулы. Поскольку все наблюдаемые образцы соединений и смесей содержат очень большое количество молекул ( около ! 0 20 ), мы должны также позаботиться о взаимодействиях между молекулами, а также об их индивидуальных структурах. Действительно, многие физические характеристики соединений, которые используются для их идентификации (например, точки кипения, точки плавления и растворимость), обусловлены межмолекулярными взаимодействиями.
Действительно, многие физические характеристики соединений, которые используются для их идентификации (например, точки кипения, точки плавления и растворимость), обусловлены межмолекулярными взаимодействиями.
Все атомы и молекулы имеют слабое притяжение друг к другу, известное как притяжение Ван-дер-Ваальса . Эта сила притяжения происходит из электростатического притяжения электронов одной молекулы или атома к ядрам другой. Если бы не было сил Ван-дер-Ваальса, вся материя существовала бы в газообразном состоянии, и жизнь в том виде, в каком мы ее знаем, была бы невозможна.Следует отметить, что между молекулами также действуют меньшие силы отталкивания, которые быстро увеличиваются при очень малых межмолекулярных расстояниях.
Точки кипения
Для общих целей полезно рассматривать температуру как меру кинетической энергии всех атомов и молекул в данной системе. С повышением температуры происходит соответствующее увеличение силы поступательных и вращательных движений всех молекул, а также колебаний атомов и групп атомов внутри молекул. Опыт показывает, что многие соединения обычно существуют в виде жидкостей и твердых тел; и что даже газы с низкой плотностью, такие как водород и гелий, можно сжижать при достаточно низкой температуре и высоком давлении. Из этого факта следует сделать четкий вывод, что силы межмолекулярного притяжения значительно различаются, и что точка кипения соединения является мерой силы этих сил. Таким образом, чтобы разрушить межмолекулярные притяжения, которые удерживают молекулы соединения в конденсированном жидком состоянии, необходимо увеличить их кинетическую энергию за счет повышения температуры образца до характерной точки кипения соединения.
Опыт показывает, что многие соединения обычно существуют в виде жидкостей и твердых тел; и что даже газы с низкой плотностью, такие как водород и гелий, можно сжижать при достаточно низкой температуре и высоком давлении. Из этого факта следует сделать четкий вывод, что силы межмолекулярного притяжения значительно различаются, и что точка кипения соединения является мерой силы этих сил. Таким образом, чтобы разрушить межмолекулярные притяжения, которые удерживают молекулы соединения в конденсированном жидком состоянии, необходимо увеличить их кинетическую энергию за счет повышения температуры образца до характерной точки кипения соединения.
В следующей таблице показаны некоторые факторы, влияющие на силу межмолекулярного притяжения. После формулы каждой записи в скобках указывается ее вес по формуле и температура кипения в градусах Цельсия. Во-первых, размер молекул. У больших молекул больше электронов и ядер, которые создают силы притяжения Ван-дер-Ваальса, поэтому их соединения обычно имеют более высокие температуры кипения, чем подобных соединений, состоящих из более мелких молекул. Очень важно применять это правило только к подобным соединениям.Примеры, приведенные в первых двух строках, похожи в том, что молекулы или атомы имеют сферическую форму и не имеют постоянных диполей. Форма молекулы также важна, как показывает вторая группа соединений. Верхний ряд состоит из молекул примерно сферической формы, тогда как изомеры в нижнем ряду имеют молекулы цилиндрической или линейной формы. Силы притяжения между последней группой обычно больше. Наконец, постоянные молекулярные диполи, генерируемые полярными ковалентными связями, приводят к еще большим силам притяжения между молекулами, при условии, что они обладают подвижностью, чтобы выстраиваться в соответствующие ориентации.Последние записи в таблице сравнивают неполярные углеводороды с соединениями равного размера, имеющими полярные связи с кислородом и азотом. Галогены также образуют полярные связи с углеродом, но они также увеличивают молекулярную массу, что затрудняет различение этих факторов.
Очень важно применять это правило только к подобным соединениям.Примеры, приведенные в первых двух строках, похожи в том, что молекулы или атомы имеют сферическую форму и не имеют постоянных диполей. Форма молекулы также важна, как показывает вторая группа соединений. Верхний ряд состоит из молекул примерно сферической формы, тогда как изомеры в нижнем ряду имеют молекулы цилиндрической или линейной формы. Силы притяжения между последней группой обычно больше. Наконец, постоянные молекулярные диполи, генерируемые полярными ковалентными связями, приводят к еще большим силам притяжения между молекулами, при условии, что они обладают подвижностью, чтобы выстраиваться в соответствующие ориентации.Последние записи в таблице сравнивают неполярные углеводороды с соединениями равного размера, имеющими полярные связи с кислородом и азотом. Галогены также образуют полярные связи с углеродом, но они также увеличивают молекулярную массу, что затрудняет различение этих факторов.
Точки кипения (ºC) отдельных элементов и соединений | ||||
|---|---|---|---|---|
Увеличивающийся размер | ||||
| Атомный | Ar (40) -186 | Kr (83) -153 | Xe (131) -109 | |
| Молекулярный | Канал 4 (16) -161 | (Канал 3 ) 4 С (72) 9.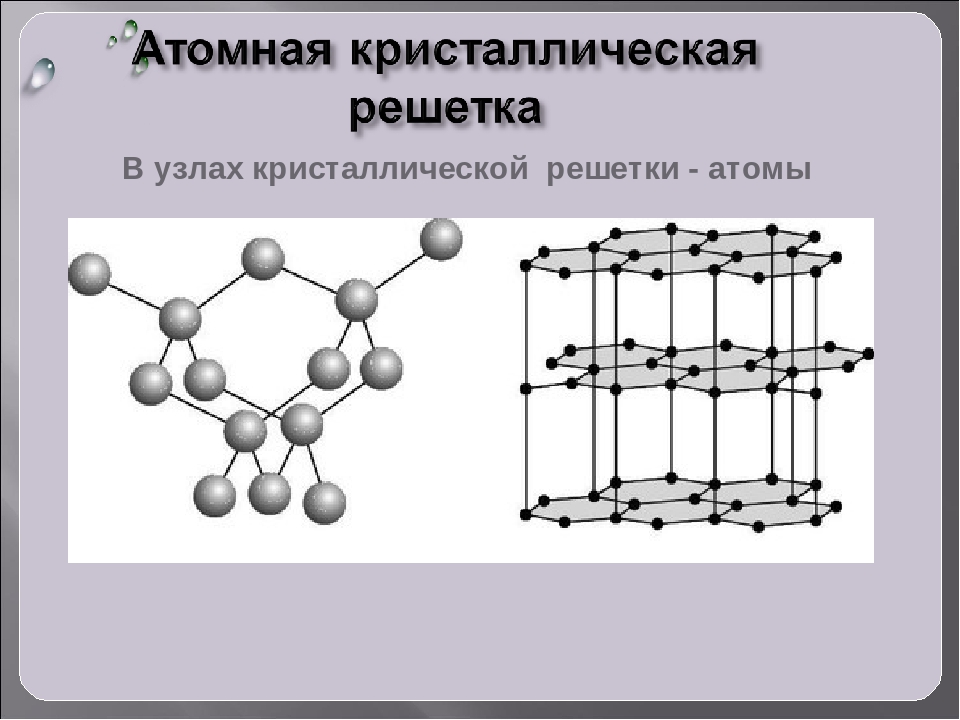 5 5 | (CH 3 ) 4 Si (88) 27 | CCl 4 (154) 77 |
Молекулярная форма | ||||
| Сферическая: | (CH 3 ) 4 C (72) 9,5 | (CH 3 ) 2 CCl 2 (113) 69 | (CH 3 ) 3 CC (CH 3 ) 3 (114) 106 | |
| Линейный: | CH 3 (CH 2 ) 3 CH 3 (72) 36 | Cl (CH 2 ) 3 Cl (113) 121 | CH 3 (CH 2 ) 6 CH 3 (114) 126 | |
Молекулярная полярность | ||||
| Неполярный: | H 2 C = CH 2 (28) -104 | F 2 (38) -188 | CH 3 C≡CCH 3 (54) -32 | CF 4 (88) -130 |
| Полярный: | H 2 C = O (30) -21 | CH 3 CH = O (44) 20 | (CH 3 ) 3 N (59) 3. 5 5 | (CH 3 ) 2 C = O (58) 56 |
| HC≡N (27) 26 | CH 3 C≡N (41) 82 | (CH 2 ) 3 O (58) 50 | CH 3 NO 2 (61) 101 | |
Точки плавления кристаллических твердых веществ нельзя классифицировать так же просто, как точки кипения. Расстояние между молекулами в кристаллической решетке невелико и регулярно, а межмолекулярные силы сдерживают движение молекул сильнее, чем в жидком состоянии.Размер молекулы важен, но форма также имеет решающее значение, поскольку отдельные молекулы должны согласовываться вместе, чтобы силы притяжения решетки были большими. Молекулы сферической формы обычно имеют относительно высокие температуры плавления, которые в некоторых случаях приближаются к температуре кипения. Это отражает тот факт, что сферы могут упаковываться вместе более плотно, чем другие формы. Эта чувствительность к структуре или форме является одной из причин того, что точки плавления широко используются для идентификации конкретных соединений.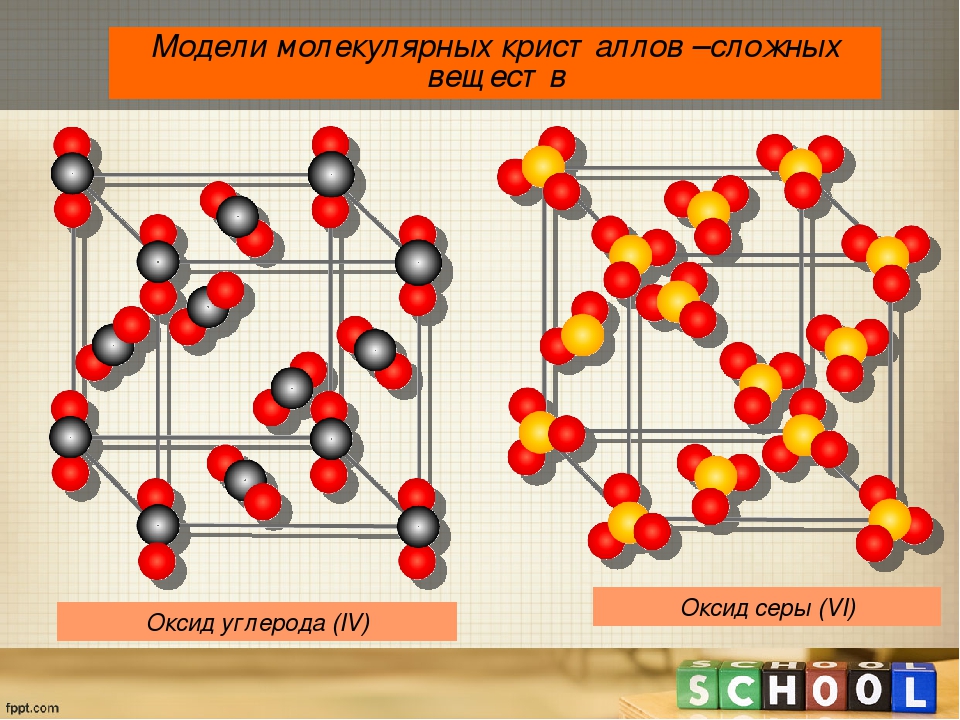 Данные в следующей таблице служат для иллюстрации этих моментов.
Данные в следующей таблице служат для иллюстрации этих моментов.
| Соединение | Формула | Точка кипения | Точка плавления |
|---|---|---|---|
| пентан | CH 3 (CH 2 ) 3 CH 3 | 36ºC | –130ºC3 | гексан | CH 3 (CH 2 ) 4 CH 3 | 69ºC | –95ºC |
| гептан | CH 3 (CH 2 ) 5 CH 3 | 98ºC | –91ºC |
| октан | CH 3 (CH 2 ) 6 CH 3 | 126ºC | –57ºC |
| нонан | CH 3 (CH 2 ) 7 CH 3 | 151ºC | –54ºC |
| декан | CH 3 (CH 2 ) 8 CH 3 | 900 61 174ºC–30ºC | |
| тетраметилбутан | (CH 3 ) 3 C-C (CH 3 ) 3 | 106ºC | + 100ºC |
Обратите внимание, что температуры кипения неразветвленных алканов (от пентана до декана) увеличиваются довольно плавно с увеличением молекулярной массы, но точки плавления цепей с четным углеродом увеличиваются больше, чем температуры плавления цепей с нечетным углеродом. Четные цепи упаковываются вместе более компактно, чем нечетные. Последнее соединение, изомер октана, имеет почти сферическую форму и исключительно высокую температуру плавления (всего на 6 ° ниже точки кипения).
Четные цепи упаковываются вместе более компактно, чем нечетные. Последнее соединение, изомер октана, имеет почти сферическую форму и исключительно высокую температуру плавления (всего на 6 ° ниже точки кипения).
Водородная связь
Самая мощная межмолекулярная сила, влияющая на нейтральные (незаряженные) молекулы, — это водородная связь . Если мы сравним точки кипения метана (CH 4 ) -161ºC, аммиака (NH 3 ) -33ºC, воды (H 2 O) 100ºC и фтороводорода (HF) 19ºC, мы увидим большее изменение для эти молекулы аналогичного размера, чем ожидалось из данных, представленных выше для полярных соединений.Это показано графически на следующей диаграмме. Большинство простых гидридов элементов IV, V, VI и VII групп демонстрируют ожидаемое повышение температуры кипения с увеличением молекулярной массы, но гидриды наиболее электроотрицательных элементов (азота, кислорода и фтора) имеют аномально высокие температуры кипения для своей массы.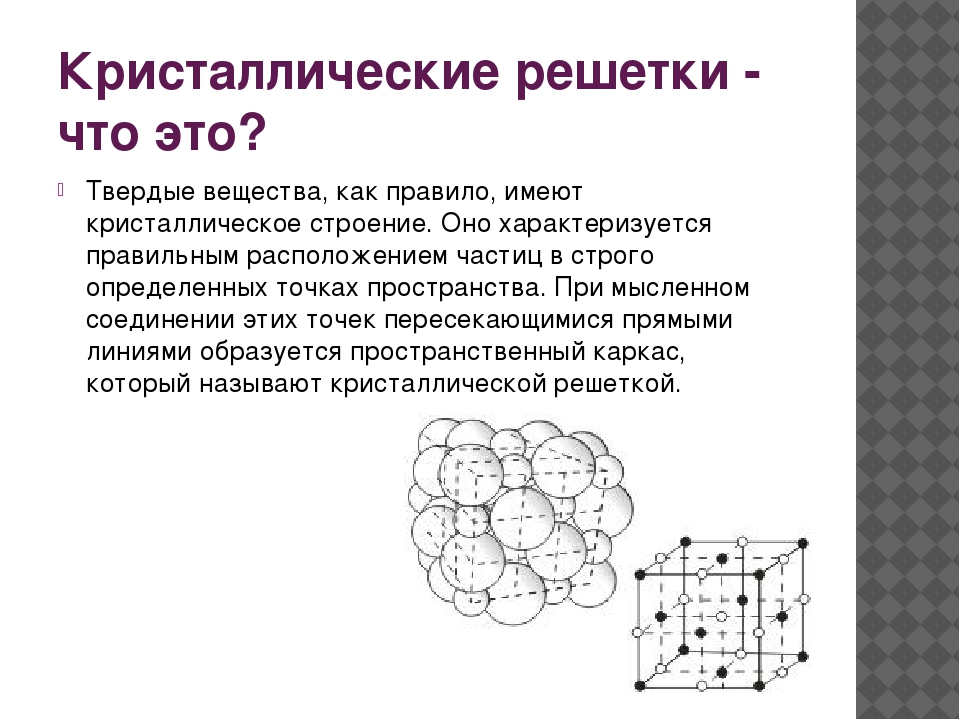
Исключительно сильное диполь-дипольное притяжение, вызывающее такое поведение, называется водородной связью . Водород образует полярные ковалентные связи с большим количеством электроотрицательных атомов, таких как кислород, и, поскольку атом водорода довольно мал, положительный конец диполя связи (водород) может приближаться к соседним нуклеофильным или основным участкам ближе, чем другие полярные связи.Кулоновские силы обратно пропорциональны шестой степени расстояния между диполями, что делает эти взаимодействия относительно сильными, хотя они все еще слабые ( около от 4 до 5 ккал на моль) по сравнению с большинством ковалентных связей. Уникальные свойства воды во многом связаны с сильной водородной связью, которая возникает между ее молекулами. На следующей диаграмме водородные связи изображены пурпурными пунктирными линиями.
Молекула, обеспечивающая полярный водород для водородной связи, называется донором . Молекула, которая обеспечивает богатый электронами участок, к которому притягивается водород, называется акцептором . Вода и спирты могут служить как донорами, так и акцепторами, тогда как простые эфиры, альдегиды, кетоны и сложные эфиры могут действовать только как акцепторы. Точно так же первичные и вторичные амины одновременно являются донорами и акцепторами, но третичные амины действуют только как акцепторы. Как только вы сможете распознать соединения, которые могут проявлять межмолекулярные водородные связи, их относительно высокие температуры кипения станут понятны.Данные в следующей таблице служат иллюстрацией этого положения.
Молекула, которая обеспечивает богатый электронами участок, к которому притягивается водород, называется акцептором . Вода и спирты могут служить как донорами, так и акцепторами, тогда как простые эфиры, альдегиды, кетоны и сложные эфиры могут действовать только как акцепторы. Точно так же первичные и вторичные амины одновременно являются донорами и акцепторами, но третичные амины действуют только как акцепторы. Как только вы сможете распознать соединения, которые могут проявлять межмолекулярные водородные связи, их относительно высокие температуры кипения станут понятны.Данные в следующей таблице служат иллюстрацией этого положения.
| Соединение | Формула | Мол. Вес. | Точка кипения | Точка плавления |
|---|---|---|---|---|
| диметиловый эфир | CH 3 OCH 3 | 46 | –24ºC | –138ºC |
| этанол | CH 3 CH 2 OH | 46 | 78ºC | -130ºC |
| пропанол | CH 3 (CH 2 ) 2 OH | 60 | 98ºC | –127ºC |
| диэтиловый эфир | (CH 3 CH 2 ) 2 O | 74 | 34ºC | –116ºC |
| пропиламин | CH 3 (CH 2 ) 2 NH 2 | 59 | 48ºC | –83ºC |
| метиламиноэтан | CH 3 CH 2 NHCH 3 | 59 | 37ºC | |
| триметиламин | (CH 3 ) 3 N | 59 | 3ºC | –117ºC |
| этиленгликоль | HOCH 2 CH 2 OH | 62 | 197ºC | –13ºC |
| уксусная кислота | CH 3 CO 2 H | 60 | 118ºC | 17ºC |
| этилендиамин | H 2 NCH 2 CH 2 NH 2 | 60 | 118ºC | 8. 5ºC 5ºC |
Спирты имеют значительно более высокую температуру кипения, чем простые эфиры сопоставимого размера (первые две записи), и изомерные 1º, 2º и 3º -амины, соответственно, показывают снижение температуры кипения, причем два изомера с водородными связями имеют значительно более высокую температуру кипения, чем 3º-амин (записи 5 к 7). Кроме того, водородные связи O – H — O явно сильнее, чем водородные связи N – H — N, как мы видим, сравнивая пропанол с аминами.
Как и ожидалось, наличие двух водородных связей в соединении еще больше повышает температуру кипения.Уксусная кислота (девятая запись) — интересный случай. Димерные частицы, показанные справа, удерживаемые двумя водородными связями, являются основным компонентом жидкого состояния. Если это точное представление о составе этого соединения, то мы ожидаем, что его точка кипения будет эквивалентна температуре кипения соединения C 4 H 8 O 4 (вес формулы = 120). Подходящее приближение такого соединения находится в тетраметоксиметане, (CH 3 O) 4 C, который на самом деле немного больше (вес формулы = 136) и имеет температуру кипения 114 ° C. Таким образом, димерная водородно-связанная структура, по-видимому, хорошо представляет уксусную кислоту в конденсированном состоянии.
Таким образом, димерная водородно-связанная структура, по-видимому, хорошо представляет уксусную кислоту в конденсированном состоянии.
Здесь стоит отметить родственный принцип. Хотя водородная связь относительно слабая ( около от 4 до 5 ккал на моль), когда существует несколько таких связей, результирующая структура может быть довольно прочной. Водородные связи между целлюлозными волокнами придают большую прочность дереву и родственным материалам.
| Для получения дополнительной информации по этому вопросу щелкните здесь. |
|---|
Свойства кристаллических твердых тел |
|---|
Точки плавления
Большинство органических соединений имеют температуру плавления ниже 200 ºC. Некоторые из них разлагаются перед плавлением, некоторые — возвышаются, но большинство претерпевает повторное плавление и кристаллизацию без каких-либо изменений в молекулярной структуре. Теперь хорошо известно, что точка замерзания растворителя понижается растворенным растворенным веществом, например рассол по сравнению с водой. | |
Интересная, но менее распространенная смешанная система включает молекулярные компоненты, которые образуют плотный комплекс или молекулярное соединение , способное существовать как отдельные частицы в равновесии с жидкостью того же состава. Такая разновидность обычно имеет четкую , совпадающую точку плавления и дает фазовую диаграмму, имеющую вид двух соседних эвтектических диаграмм.Пример такой системы показан справа, молекулярное соединение представлено как A: B или C . Одна такая смесь состоит из -нафтола, т. |
Полиморфизм
Полиморфы соединения — это различные кристаллические формы, в которых структура решетки молекул различается. Эти различные твердые вещества обычно имеют разные точки плавления, растворимость, плотность и оптические свойства. Многие полиморфные соединения имеют гибкие молекулы, которые могут принимать различные конформации, и рентгеновское исследование этих твердых тел показывает, что их кристаллические решетки накладывают определенные конформационные ограничения. В расплавленном состоянии или в растворе различные полиморфные кристаллы этого типа образуют одну и ту же быстро уравновешивающуюся смесь молекулярных частиц. Полиморфизм подобен гидратированным или сольватированным кристаллическим формам, но отличается от них. Было подсчитано, что более 50% известных органических соединений могут быть способны к полиморфизму.
В расплавленном состоянии или в растворе различные полиморфные кристаллы этого типа образуют одну и ту же быстро уравновешивающуюся смесь молекулярных частиц. Полиморфизм подобен гидратированным или сольватированным кристаллическим формам, но отличается от них. Было подсчитано, что более 50% известных органических соединений могут быть способны к полиморфизму.
Тетраацетат рибофуранозы, показанный вверху слева внизу, был источником ранней загадки, связанной с полиморфизмом. Соединение было впервые получено в Англии в 1946 году, и его температура плавления составляла 58 ºC.Несколько лет спустя тот же материал с такой же температурой плавления был независимо получен в Германии и США. Затем американские химики обнаружили, что точки плавления их ранних препаратов поднялись до 85 ºC. В конце концов, стало очевидно, что ни одна лаборатория, в которую была введена форма с более высокой температурой плавления, больше не могла производить форму с более высокой температурой плавления. Микроскопические зародыши стабильного полиморфа в окружающей среде неизбежно направляют кристаллизацию с этой целью. Данные дифракции рентгеновских лучей показали, что полиморф с более низкой температурой плавления является моноклинным, пространственная группа P2. Форма с более высокой температурой плавления была орторомбической, пространственная группа P2 1 2 1 2 1 .
Данные дифракции рентгеновских лучей показали, что полиморф с более низкой температурой плавления является моноклинным, пространственная группа P2. Форма с более высокой температурой плавления была орторомбической, пространственная группа P2 1 2 1 2 1 .
Полиморфизм оказался решающим фактором в фармацевтике, производстве твердых пигментов и полимеров. Некоторые примеры описаны ниже.
Ацетаминофен — распространенный анальгетик (например, тайленол). Обычно его получают в виде моноклинных призм (верхний рисунок) при кристаллизации из воды.Менее стабильный ромбический полиморф, имеющий лучшие физические свойства для прессования в таблетки, показан под первым. Хинакридон — важный пигмент, используемый в красках и чернилах. Он имеет жесткую плоскую молекулярную структуру, а в разбавленном растворе имеет светло-желтый цвет. Идентифицировано три полиморфа. Противоязвенный препарат ранитидин (Зантак) был впервые запатентован компанией Glaxo-Wellcome в 1978 году.Семь лет спустя та же компания запатентовала второй полиморф ранитидина. Это расширило лицензионное покрытие до 2002 года, и усилия по продвижению на рынок генерической формы были сорваны, потому что было невозможно приготовить первый полиморф, не загрязненный вторым. Относительно простой арилтиофен, обозначенный как EL1, был получен и изучен химиками компании Eli Lilly. На нем были представлены шесть форм полиморфных кристаллов, изображения которых показаны слева.
| ||||||||||||||||||||||||||||||||||
Типичный пример изменения полиморфизма показан шоколадом, который подвергался нагреванию и / или длительному хранению. Со временем или когда он сбрасывается после размягчения, на нем могут появиться белые пятна, которые больше не тают во рту и не имеют такого приятного вкуса, как должны. Это потому, что у шоколада более шести полиморфов, и только один идеален в качестве кондитерского изделия. Он создается в тщательно контролируемых заводских условиях. Неправильные условия хранения или транспортировки вызывают превращение шоколада в другие полиморфы.
Со временем или когда он сбрасывается после размягчения, на нем могут появиться белые пятна, которые больше не тают во рту и не имеют такого приятного вкуса, как должны. Это потому, что у шоколада более шести полиморфов, и только один идеален в качестве кондитерского изделия. Он создается в тщательно контролируемых заводских условиях. Неправильные условия хранения или транспортировки вызывают превращение шоколада в другие полиморфы.
Шоколад по сути представляет собой тертое какао и частицы сахара, взвешенные в матрице какао-масла.Масло какао представляет собой смесь триглицеридов, в которой преобладают стеароильная, олеоильная и пальмитоильная группы. Именно полиморфы этой матрицы влияют на качество шоколада.
Полиморфы с низкой температурой плавления кажутся слишком липкими или густыми во рту. Форма V, полиморф какао-масла с лучшим вкусом, имеет температуру плавления от 34 до 36 ºC, что немного ниже, чем внутри человеческого тела, что является одной из причин, по которой оно тает во рту.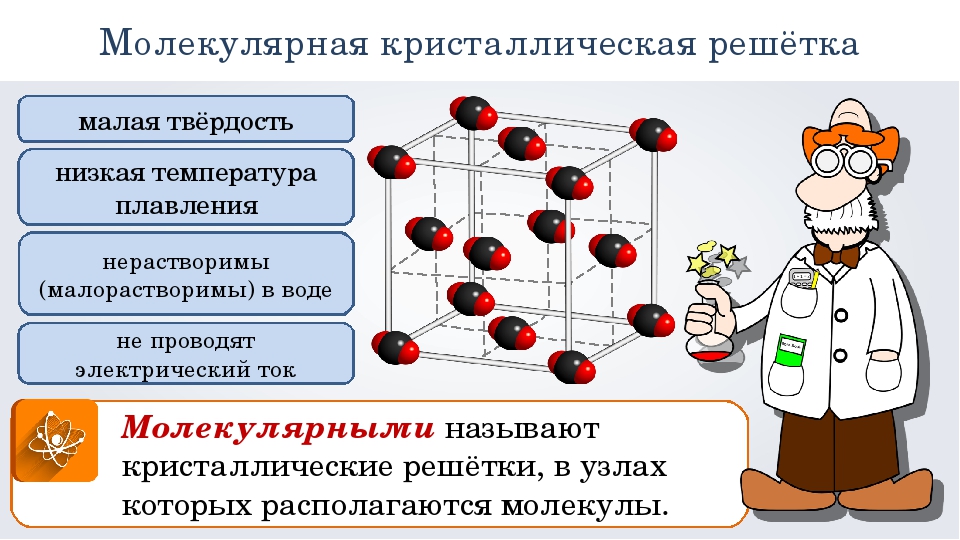 К сожалению, форма VI с более высокой температурой плавления более стабильна и образуется с течением времени.
К сожалению, форма VI с более высокой температурой плавления более стабильна и образуется с течением времени.
| Полиморф | Точка плавления | Комментарии |
|---|---|---|
| I | 17,4 ºC | Получается путем быстрого охлаждения расплава. |
| II | 23,4 ºC | Производится путем охлаждения расплава со скоростью 2 ºC / мин. |
| III | 26 ºC | Получен преобразованием формы II при 5-10 ºC. |
| IV | 27 ºC | Получается преобразованием формы III при хранении при 16-21 ºC. |
| V | 34 ºC | Производится темперированием (охлаждение с последующим небольшим повторным нагревом при перемешивании). |
| VI | 36-37 ºC | Произведено из V после 4 месяцев пребывания при комнатной температуре. |
Растворимость в воде
Воду называют «универсальным растворителем», и ее широкое распространение на этой планете и существенная роль в жизни делают ее эталоном для дискуссий о растворимости.Вода растворяет многие ионные соли благодаря своей высокой диэлектрической проницаемости и способности сольватировать ионы. Первый уменьшает притяжение между противоположно заряженными ионами, а второй стабилизирует ионы, связываясь с ними и делокализуя плотность заряда. Многие органические соединения, особенно алканы и другие углеводороды, почти не растворяются в воде. Органические соединения, растворимые в воде, такие как большинство из перечисленных в приведенной выше таблице, обычно имеют акцепторные и донорные группы водородной связи. Наименее растворимым из перечисленных соединений является диэтиловый эфир, который может служить только акцептором водородной связи и на 75% состоит из углеводородов.Даже в этом случае диэтиловый эфир примерно в двести раз более растворим в воде, чем пентан.
Основной характеристикой воды, которая влияет на эту растворимость, является обширная ассоциация ее молекул друг с другом с водородными связями. Эта сеть с водородными связями стабилизируется суммой всех энергий водородных связей, и если бы неполярные молекулы, такие как гексан, были вставлены в сеть, они разрушили бы локальную структуру, не создавая собственных водородных связей.Конечно, молекулы гексана испытывают значительное притяжение Ван-дер-Ваальса к соседним молекулам, но эти силы притяжения намного слабее, чем водородная связь. Следовательно, когда гексан или другие неполярные соединения смешиваются с водой, сильные силы ассоциации водной сетки исключают неполярные молекулы, которые должны тогда существовать в отдельной фазе. Это показано на следующем рисунке, и поскольку гексан менее плотен, чем вода, гексановая фаза плавает на водной фазе.
Важно помнить об этой тенденции воды исключать неполярные молекулы и группы, поскольку это фактор в структуре и поведении многих сложных молекулярных систем. Общая номенклатура, используемая для описания молекул и областей внутри молекул, — это гидрофильных, для полярных, связывающих водород фрагментов и гидрофобных для неполярных частиц.
Общая номенклатура, используемая для описания молекул и областей внутри молекул, — это гидрофильных, для полярных, связывающих водород фрагментов и гидрофобных для неполярных частиц.
| Для получения дополнительной информации по этому вопросу щелкните здесь. |
|---|
Выберите проблему Точки кипения Водородная связь Растворимость воды
Эта страница является собственностью Уильяма Ройша.
Комментарии, вопросы и ошибки следует
быть отправленным на [email protected].
Эти страницы предоставляются IOCD для оказания помощи в наращивании потенциала в области химического образования. 05.05.2013
Конец этой дополнительной темы
Подробнее о межмолекулярных силах |
|---|
Межмолекулярные силы и физические свойства
Силы притяжения, существующие между молекулами, ответственны за многие объемные физические свойства, проявляемые веществами.Некоторые соединения представляют собой газы, некоторые — жидкости, а другие — твердые вещества. Точки плавления и кипения чистых веществ отражают эти межмолекулярные силы и обычно используются для идентификации. Из этих двух точка кипения считается наиболее репрезентативной мерой общего межмолекулярного притяжения. Таким образом, точка плавления отражает тепловую энергию, необходимую для преобразования высокоупорядоченного массива молекул в кристаллической решетке в хаотичность жидкости. Расстояние между молекулами в кристаллической решетке невелико и регулярно, а межмолекулярные силы сдерживают движение молекул сильнее, чем в жидком состоянии.Размер молекулы важен, но форма также имеет решающее значение, поскольку отдельные молекулы должны согласовываться вместе, чтобы силы притяжения решетки были большими. Молекулы сферической формы обычно имеют относительно высокие температуры плавления, которые в некоторых случаях приближаются к точке кипения, что отражает тот факт, что сферы могут упаковываться вместе более плотно, чем другие формы. Эта чувствительность к структуре или форме является одной из причин того, что точки плавления широко используются для идентификации конкретных соединений.
Точки кипения, с другой стороны, по существу отражают кинетическую энергию, необходимую для высвобождения молекулы из кооперативного притяжения жидкого состояния, так что она становится свободным и относительно независимым видом газообразного состояния.Все атомы и молекулы имеют слабое притяжение друг к другу, известное как притяжение Ван-дер-Ваальса . Эта сила притяжения берет свое начало в электростатическом притяжении электронов одной молекулы или атома к ядрам другой и получила название силы дисперсии Лондона .
Следующая анимация показывает, как близкое сближение двух неоновых атомов может нарушить их распределение электронов таким образом, чтобы вызвать дипольное притяжение. Индуцированные диполи являются кратковременными, но их достаточно для разжижения неона при низкой температуре и высоком давлении.
В общем, более крупные молекулы имеют более высокие температуры кипения, чем более мелкие молекулы того же типа, что указывает на то, что дисперсионные силы увеличиваются с массой, числом электронов, числом атомов или некоторой их комбинацией. В следующей таблице перечислены точки кипения ряда элементов и ковалентных соединений, состоящих из молекул, лишенных постоянного диполя. Число электронов в каждой разновидности указано в первом столбце, а масса каждого дается в виде верхнего индекса перед формулой.
| # Электроны | Молекулы и точки кипения ºC |
|---|---|
| 10 | 20 Ne –246; 16 CH 4 –162 |
| 18 | 40 Ar –186; 32 SiH 4 –112; 30 C 2 H 6 –89; 38 Ф. 2 –187 |
| 34-44 | 84 Kr –152; 58 C 4 H 10 –0.5; 72 (CH 3 ) 4 C 10; 71 Класс 2 –35; 88 CF 4 -130 |
| 66-76 | 114 [(CH 3 ) 3 C] 2 106; 126 (CH 2 ) 9 174; 160 Br 2 59; 154 CCl 4 77; 138 С 2 Ф 6 –78 |
В первой строке показаны две десятиэлектронные молекулы.Неон тяжелее метана, но кипит на 84 градуса ниже. Метан состоит из пяти атомов, и дополнительные ядра могут предоставить больше возможностей для индуцированного образования диполей по мере приближения других молекул. Легкость, с которой электроны молекулы, атома или иона замещаются соседним зарядом, называется поляризуемостью , поэтому мы можем сделать вывод, что метан более поляризуем, чем неон.
Во второй строке перечислено четыре восемнадцать электронных молекул. Большинство их точек кипения выше, чем у десятиэлектронных соединений неона и метана, но фтор является исключением, он кипит на 25º ниже метана.Остальные примеры в таблице соответствуют корреляции точки кипения с полным числом электронов и числом ядер, но фторсодержащие молекулы остаются исключением.
Аномальное поведение фтора можно объяснить его очень высокой электроотрицательностью. Ядро фтора настолько сильно притягивает свои электроны, что они гораздо менее поляризуемы, чем электроны большинства других атомов.
Конечно, отношения точек кипения могут определяться даже более сильными силами притяжения, такими как электростатическое притяжение между противоположно заряженными ионными частицами и между частичным разделением зарядов молекулярных диполей.Следовательно, молекулы, обладающие постоянным дипольным моментом, должны иметь более высокие температуры кипения, чем эквивалентные неполярные соединения, как показано данными в следующей таблице.
| # Электроны | Молекулы и точки кипения ºC |
|---|---|
| 14-18 | 30 C 2 H 6 –89; 28 H 2 C = CH 2 –104; 26 HC≡CH –84; 30 H 2 C = O –21; 27 HC≡N 26; 34 CH 3 -F –78 |
| 22-26 | 42 CH 3 CH = CH 2 –48; 40 CH 3 C≡CH –23; 44 CH 3 CH = O 21; 41 CH 3 C≡N 81; 46 (CH 3 ) 2 O –24; 50.5 CH 3 -Cl –24; 52 CH 2 F 2 –52 |
| 32-44 | 58 (CH 3 ) 3 CH –12; 56 (CH 3 ) 2 C = CH 2 –7; 58 (CH 3 ) 2 C = O 56; 59 (CH 3 ) 3 N 3; 95 СН 3 -Br 45; 85 CH 2 Класс 2 40; 70 CHF 3 –84 |
В первом ряду соединений этан, этен и этин не имеют молекулярного диполя и служат полезными справочными материалами для производных с одинарными, двойными и тройными связями, которые имеют.Формальдегид и цианистый водород ясно показывают усиленное межмолекулярное притяжение, возникающее в результате постоянного диполя. Метилфторид аномален, как и большинство фторорганических соединений. Во втором и третьем рядах все соединения имеют постоянные диполи, но те, которые связаны с углеводородами (первые два соединения в каждом случае), очень малы. Большие молекулярные диполи происходят в основном от связей с высокоэлектроотрицательными атомами (по сравнению с углеродом и водородом), особенно если они являются двойными или тройными связями.Таким образом, альдегиды, кетоны и нитрилы имеют тенденцию к более высокой температуре кипения, чем углеводороды и алкилгалогениды того же размера. Нетипичное поведение соединений фтора неожиданно ввиду большой разницы в электроотрицательности углерода и фтора.
Водородная связь
Большинство простых гидридов групп IV, V, VI и VII элементы отображают ожидаемое повышение температуры кипения с количеством электронов и молекулярной массы, но гидриды наиболее электроотрицательные элементы (азот, кислород и фтор) имеют аномально высокие температуры кипения, обозначенные ранее как график, также перечисленный справа.
| Группа | Молекулы и точки кипения ºC |
|---|---|
| VII | HF 19; HCl –85; HBr –67; HI –36 |
| VI | H 2 O 100; H 2 S –60; H 2 Se –41; H 2 Te –2 |
| V | NH 3 –33; РН 3 –88; AsH 3 –62; SbH 3 –18 |
Органические соединения, содержащие связи O-H и N-H, также будут демонстрировать усиленное межмолекулярное притяжение за счет водородных связей. Немного примеры приведены ниже.
| Класс | Молекулы и точки кипения ºC | |
|---|---|---|
| Кислород Соединения | C 2 H 5 OH 78; (CH 3 ) 2 O –24; (CH 2 ) 2 O 11 этанол диметиловый эфир этиленоксид | (CH 2 ) 3 CHOH 124 и (CH 2 ) 4 O 66 тетрагидрофуран циклобутанола |
| Азот Соединения | C 3 H 7 NH 2 50; C 2 H 5 NH (CH 3 ) 37; (CH 3 ) 3 N 3 пропиламин этилметиламин триметиламин | (CH 2 ) 4 CHNH 2 107 & (CH 2 ) 4 NCH 3 80 Циклопентиламин N-метилпирролидин |
| Комплекс Функции | C 2 H 5 CO 2 H 141 и CH 3 CO 2 CH 3 57 метилацетат пропановой кислоты | C 3 H 7 CONH 2 218 & CH 3 CON (CH 3 ) 2 165 бутирамид N, N-диметилацетамид |
Растворимость в воде
Вода — самая распространенная и важная жидкость на этой планете.При выделении и очистке соединений необходимо учитывать смешиваемость других жидкостей с водой и растворимость твердых веществ в воде. С этой целью в следующей таблице приведена смешиваемость с водой (или растворимость) ряда низкомолекулярных органических соединений. Сразу видно влияние важных атомов водорода, связывающих атомы водорода, кислорода и азота. В первой строке перечислены несколько углеводородных и хлорированных растворителей. Все они без исключения не смешиваются с водой, хотя интересно отметить, что π-электроны бензола и несвязывающие валентные электроны хлора действуют, слегка увеличивая их растворимость по сравнению с насыщенными углеводородами.По сравнению с углеводородами соединения кислорода и азота, перечисленные во втором, третьем и четвертом рядах, более чем в сто раз более растворимы в воде, и многие из них полностью смешиваются с водой.
| Тип соединения | Особые соединения | Грамм / 100 мл | Молей / литр | Особые соединения | грамм / 100 мл | молей / литр | |
|---|---|---|---|---|---|---|---|
| Углеводороды и алкилгалогениды | бутан гексан циклогексан | 0.007 0,0009 0,006 | 0,0012 0,0001 0,0007 | бензол хлористый метилен хлороформ | 0,07 1,50 0,8 | 0,009 0,180 0,07 | |
| Соединения , содержащие Один кислород | 1-бутанол трет -бутанол циклогексанол фенол | 9,0 в комплекте 3,6 8,7 | 1,2 в комплекте 0,36 0.90 | этиловый эфир ТГФ фуран анизол | 6,0 полный 1,0 1,0 | 0,80 полный 0,15 0,09 | |
| Соединения , содержащие два кислорода | 1,3-пропандиол 2-бутоксиэтанол бутановый кислота бензойная кислота | завершено завершено завершено завершено | завершено завершено завершено завершено | 1,2-диметоксиэтан 1,4-диоксан этилацетат γ-бутиролактон | полный полный 8.0 полный | полный полный 0,91 полный | |
| Азот Содержит Соединения | 1-аминобутан циклогексиламин анилин пирролидин пиррол | полное полное 3,4 полное 6,0 | полное полное 0,37 полное 0,9 | триэтиламин пиридин пропионитрил 1-нитропропан ДМФ | 5.5 в комплекте 10,3 1,5 в комплекте | 0,54 в комплекте 2,0 0,17 в комплекте |
Из приведенных выше данных стоит отметить некоторые общие тенденции. Во-первых, спирты (вторая строка слева) обычно более растворимы, чем простые эфиры того же размера (вторая строка справа). Это отражает тот факт, что гидроксильная группа может функционировать как донор, так и акцептор водородной связи; тогда как эфирный кислород может служить только акцептором. Повышенная растворимость фенола по сравнению с циклогексанолом может быть связана с его большей кислотностью, а также с эффектом пи-электронов, отмеченным в первой строке.
Циклический эфир ТГФ (тетрагидрофуран) более растворим, чем его аналог с открытой цепью, возможно, потому, что атом кислорода более доступен для связывания водорода с молекулами воды. Из-за пониженной основности кислорода в ароматическом соединении фуране он гораздо менее растворим. Атом кислорода в анизоле также дезактивируется путем сопряжения с бензольным кольцом (обратите внимание, он активирует кольцо в реакциях электрофильного замещения).
Второй атом кислорода резко увеличивает растворимость в воде, о чем свидетельствуют соединения, перечисленные в третьей строке.Снова слева перечислены гидроксильные соединения.
Азот оказывает солюбилизирующее влияние, подобное кислороду, как показано соединениями в четвертом ряду. Первичные и вторичные амины, перечисленные в левом столбце, могут действовать как доноры, так и акцепторы водородных связей. Ароматичность снижает основность пиррола, но увеличивает его кислотность. Соединения в правом столбце могут выполнять только акцепторную роль. Удивительна низкая растворимость нитросоединения.
Эта страница является собственностью Уильяма Ройша.
Комментарии, вопросы и ошибки следует
быть отправленным на [email protected].
Эти страницы предоставляются IOCD для оказания помощи в наращивании потенциала в области химического образования. 05.05.2013
Конец этой дополнительной темы
молекулярных и ионных твердых тел | Протокол
11.16: Молекулярные и ионные Твердые вещества
Кристаллические твердые вещества делятся на четыре типа: молекулярные, ионные, металлические и ковалентные сети в зависимости от типа составляющих единиц и их взаимодействия между частицами.
Молекулярные вещества
Молекулярные кристаллические твердые вещества, такие как лед, сахароза (столовый сахар) и йод, представляют собой твердые вещества, состоящие из нейтральных молекул в качестве составляющих единиц. Эти молекулы удерживаются вместе слабыми межмолекулярными силами, такими как дисперсионные силы Лондона, диполь-дипольные взаимодействия или водородные связи, которые определяют их свойства (Таблица 1).
Сила сил притяжения между элементами, присутствующими в разных кристаллах, сильно различается, что отражается на температурах плавления таких кристаллов.
• Небольшие симметричные неполярные молекулы, такие как H 2 , N 2 , O 2 и F 2 , обладают слабыми дисперсионными силами и образуют молекулярные твердые вещества с очень низкими температурами плавления (ниже −200 ° C ). Вещества, состоящие из более крупных неполярных молекул, обладают большей силой притяжения и плавятся при более высоких температурах.
• Молекулярные твердые тела, состоящие из полярных молекул с постоянными дипольными моментами, плавятся при еще более высоких температурах. Примеры включают твердый SO 2 и столовый сахар.Межмолекулярная водородная связь в основном отвечает за поддержание трехмерной решетки таких молекулярных твердых тел, как это видно в замороженной воде или льду.
Свойства молекулярных твердых тел зависят от эффективной упаковки составляющих их единиц, молекул, в трех измерениях. Поскольку межмолекулярные силы зависят от контакта, более высокая симметрия составляющих молекул обеспечивает плотную и компактную упаковку внутри кристаллической структуры с высоким межмолекулярным притяжением. Это увеличивает температуру плавления.Более низкая симметрия молекул препятствует их эффективной упаковке. Таким образом, межмолекулярные силы не столь эффективны, а температура плавления ниже.
Ионные твердые вещества
Ионные кристаллические твердые вещества, такие как хлорид натрия, состоят из положительных и отрицательных ионов, которые удерживаются вместе за счет сильного электростатического притяжения.
Ионные твердые тела имеют высокие температуры плавления из-за сильного ионного притяжения. Сила ионного взаимодействия между катионами и анионами в ионном твердом теле может быть аппроксимирована электростатической силой, определяемой законом Кулона:
Здесь K — константа пропорциональности, r — расстояние между зарядами, а q a и q c — заряды на анионах и катионах соответственно.Чем выше заряд катионов и анионов, тем сильнее сила ионного притяжения. Точно так же плотная упаковка анионов и катионов в кристаллической решетке уменьшает расстояние между зарядами, что приводит к более сильным силам ионного притяжения.
Ионные твердые тела твердые, они также имеют тенденцию быть хрупкими и скорее разрушаются, чем изгибаются. Их хрупкость объясняется наличием в кристаллической решетке как притягивающих (катион-анион), так и отталкивающих (катион-катион и анион-анион) взаимодействий.Поскольку ионы не могут свободно перемещаться из-за сильных кулоновских сил, ионные твердые тела не проводят электричество. Однако в расплавленном состоянии или при растворении в воде ионы могут свободно перемещаться и проводить электричество.
Таблица 1. Характеристики молекулярных и ионных твердых тел.
| Тип кристаллического твердого вещества | Тип составляющей частицы | Тип аттракционов | Недвижимость | Примеры |
| Молекулярные вещества | Молекулы | Межмолекулярные силы (ММП): дисперсионные силы, диполь-дипольные силы, водородные связи | переменная твердость, переменная хрупкость, низкие температуры плавления, плохой проводник тепла и электричества | Ar, H 2 O (лед), CO 2 (сухой лед), I 2 , C 12 H 22 O 11 (сахароза) |
| Ионные твердые тела | Ионы | электростатический | твердый, хрупкий, с высокой до очень высокой температурой плавления, проводник электричества в расплавленном и растворенном состоянии | NaCl (поваренная соль), MgO (оксид магния), Al 2 O 3 (оксид алюминия) |
Часть этого текста была адаптирована из Openstax, Chemistry 2e, Section 10.5: Твердое состояние вещества.
Твердые вещества, жидкости и газы — Твердые тела
Твердые тела
Твердые тела имеют фиксированный объем и форму. Частицы остаются заблокированными на месте, лишь слегка перемещаясь вокруг своих позиций. Фактически, твердые вещества (и жидкости) часто называют конденсированными фазами , , потому что частицы расположены так близко друг к другу. Есть много типов взаимодействий между частицами в твердых телах, и эти взаимодействия обычно сильны, мы говорим о сильном Чаке Норрисе.Сжимаемость (или мера того, насколько объем вещества изменяется с давлением) твердых тел близка к нулю. Не верите нам? Попробуйте сжать пенни в меньшую форму. Мы рассчитаем время. На старт, внимание, марш.
Обычно существует два типа твердых веществ: аморфных твердых веществ и кристаллических твердых веществ . В структуре аморфного твердого тела нет расширенного порядка; они настоящие нарушители правил, как Майли Сайрус. Эту девушку просто невозможно приручить. Представьте себе кусок стекла.На наш взгляд, структура выглядит однородной, но внешний вид обманчив. В структуре стекла микроскопического уровня нет регулярного рисунка. Если вы попытаетесь расплавить аморфное твердое вещество, вы не получите резкую температуру плавления , , потому что взаимодействия между отдельными частицами имеют разную силу.
Кристаллические твердые тела (или кристаллов ), с другой стороны, являются образцом для подражания твердому телу, потому что они строго следуют правилам.Они имеют расширенный порядок в своей структуре, что означает, что под микроскопом каждый кусок кристалла выглядит одинаково. Из-за этого порядка кристаллы имеют особую трехмерную геометрическую структуру, часто наблюдаемую невооруженным глазом. Подумайте о леденцах.
Химия такая вкусная. Изображение отсюда.
Точки плавления кристаллических твердых тел чрезвычайно высоки, потому что взаимодействия между частицами одинаковы. Другими словами, нагревание до точки плавления разрывает все связи одновременно, как по волшебству.Кристаллы обычно прочнее, чем их аморфные аналоги, потому что они работают. Нет, не совсем. Это потому, что однородность их структуры делает их более жесткими и, следовательно, более прочными.
Кристаллы состоят из регулярных повторяющихся узоров, называемых кристаллической решеткой . Это похоже на твердотельную версию Groundhog Day , она просто продолжается и продолжается. Самая основная повторяющаяся единица называется элементарной ячейкой . точек решетки кристалла соединяют элементарные ячейки вместе, образуя всю структуру.Эти точки также являются позициями, где мы находим атомы, ионы или молекулы. Как нам повторить элементарную ячейку, чтобы сформировать общую решетку? Мы делаем это с помощью процесса, называемого переводом , , который представляет собой простой сдвиг или перемещение единицы в другое положение.
Ниже представлена элементарная ячейка сульфида магния MgS. Мы знаем, что это элементарная ячейка, потому что нет других повторяющихся единиц меньшего размера. Сферы представляют, где находятся атомы Mg и S. Соединение группы этих единиц вместе дает кристалл MgS.
Пример кристаллической элементарной ячейки.
Существует четыре типа кристаллических твердых тел: ковалентных кристаллов , ионных кристаллов , молекулярных кристаллов и металлических кристаллов . Ого, это много кристаллов. Ковалентный кристалл, как следует из названия, — это кристалл, в котором ковалентная связь существует между всеми атомами в кристалле. Благодаря сильным ковалентным связям эти кристаллы имеют чрезвычайно высокие температуры плавления. Алмазы и графит, которые состоят исключительно из атомов углерода, являются наиболее известными примерами ковалентных кристаллов.Хотя мы должны признать, что бриллианты — безусловно, наши фавориты.
Вы голодны? Вот немного пищи для размышлений. Углерод твердый или мягкий? И алмазы, и графит состоят из углерода и только углерода. Алмазы — одно из самых твердых веществ, известных человеку, но графит очень легко ломается. Скажите честно, сколько раз вы ломали графит в своем любимом карандаше № 2? Так что же дает? Посмотрите на кристаллическую структуру алмаза и графита выше.
Алмаз имеет гораздо более сложную структуру, чем графит.Структура алмаза — это связка этих сложных кубиков, соединенных вместе, причем каждый куб имеет одну сторону с другим кубом. Это образует огромную сеть прочных ковалентных связей. С другой стороны, графит имеет очень рыхлую структуру, состоящую из множества ячеистых слоев графита, соединенных всего несколькими ковалентными связями. Меньше ковалентных связей означает более слабую структуру. Итак, чтобы ответить на вопрос, углерод бывает одновременно твердым и мягким.
Частицы в ионных кристаллах удерживаются вместе электростатическими силами (силы притяжения и отталкивания между заряженными частицами).Эти силы обычно очень сильны. Мы говорим о сильном Халке, который делает ионные кристаллы твердыми, тугоплавкими и хрупкими. Обычный кристалл этого типа, с которым мы все знакомы, — это хлорид натрия (NaCl) или поваренная соль. Каждый атом Na и Cl занимает точку решетки, и между всеми атомами существуют ионные связи.
Двух- и трехмерное представление кристаллической структуры NaCl.
Молекулярный кристалл — это кристалл, в структуре которого есть узнаваемые молекулы, которые удерживаются вместе за счет нековалентных взаимодействий.Чего-чего? Короче говоря, эти кристаллы представляют собой просто большие собрания действительно организованных молекул. Взаимодействия, удерживающие кристалл вместе, довольно слабые, поэтому кристаллы мягкие и легкоплавкие. Сахар (сахароза) и снежинки, вероятно, являются наиболее распространенными молекулярными кристаллами.
Устали от твердой фазы? Подожди, мы почти закончили. Последний пример — металлические кристаллы. В этих твердых телах отдельные атомы металла сидят на узлах решетки, и валентные электроны атома свободно перемещаются по решетке.Эти валентные электроны действуют как клей, который скрепляет положительно заряженные ионные ядра атомов металла. Металлические кристаллы обычно имеют высокие температуры плавления и плотность.
Brain Snack
Во время Манхэттенского проекта в 1944 году 26 человек случайно проглотили большую часть мировых запасов плутония. Плутоний, как и другие тяжелые металлы, проходит прямо через пищеварительный тракт. Не спрашивайте, как они извлекли весь этот плутоний. 1
Общее введение | SpringerLink
11.
(a) Li FF, Zhang L, Gong LL, Yan CS, Gao HY, Luo F (2017) Обратимая фото / термовыключаемая двухцветная флуоресценция посредством преобразования монокристалла в монокристалл. Дальтон Транс 46: 338–341. (b) Лим Ш., Олмстед М.М., Балч А.Л. (2013) Неорганическая топохимия. Парообразные твердотельные превращения люминесцентных трехкоординированных комплексов золота (I). Chem Sci 4: 311–318. (c) Zeng MH, Tan YX, He YP, Yin Z, Chen Q, Kurmoo M (2013) Пористая 4-кратно взаимопроникающая хиральная структура, демонстрирующая вапохромизм, обмен растворителя между монокристаллами, сорбция газа, и эффект отравления.Inorg Chem 52: 2353–2360. (d) Huang R-W, Wei Y-S, Dong X-Y, Wu X-H, Du C-X, Zang S-Q, Mak TCW (2017) Сверхчувствительное переключение двойной функции люминесценции металлоорганического каркаса на основе кластера серебра и халькогенолата. Nat Chem 9: 689–697. (e) Лим С.Х., Олмстед М.М., Балч А.Л. (2011) Молекулярный аккордеон: ваполюминесценция и молекулярная гибкость в оранжевых и зеленых люминесцентных кристаллах димера Au2 (μ-бис- (дифенилфосфино) этан) 2 Br 2 . J Am Chem Soc 133: 10229–10238.(f) Liu G, Liu J, Liu Y, Tao X (2014) Ориентированный фазовый переход от монокристалла к монокристаллу с резкими изменениями размеров кристаллов. J Am Chem Soc 136: 590–593. (g) Лю Дж, Лю Джи, Лю И, Чжэн Х, Хан Q, Йе Х, Тао Х (2016) Роль слабых взаимодействий в механоиндуцированном фазовом переходе из монокристалла в монокристалл 8-гидроксихинолина на основе сокристаллов. Chem Asian J 11: 1682–1687. (h) Кароту Д.П., Вестон Дж., Деста И.Т., Наумов П. (2016) Эффекты памяти формы и самовосстановления в механоактивных молекулярных кристаллах.J Am Chem Soc 138: 13298-13306. (i) Лю Г.Ф., Лю Дж., Йе Х, Ни Л.Н., Гу ПЙ, Тао ХТ, Чжан К.К. (2017) Самовосстановление в термомеханически чувствительном сокристалле во время обратимого фазового перехода. Angew Chem Int Ed. 56: 198–202. (j) Такамидзава С., Миямото Ю. (2014) Сверхупругие органические кристаллы. Angew Chem Int Ed 53: 6970-6973. (k) Takasaki Y, Takamizawa S (2015) Обратимая кристаллическая деформация монокристаллической матрицы 1-нафтоат-пиразин меди (II) посредством фазового перехода кристалла, вызванного сорбцией паров метанола.Chem Commun 51: 5024-5027. (Л) Takamizawa S, Takasaki, Y (2015) суперэластик восстановление формы механически двойниковых кристаллов кислоты 3,5-дифторбензойной. Angew Chem Int Ed 54: 4815-4817. (М) Наумов Р, Бхарадваж ПК (2015) Монокристаллический к монокристаллическим преобразованиям. CrystEngComm 17: 8775. (П) Чаудхари А, Мохаммад А, Mobin S M (2017) Последние достижения в монокристалле-к-монокристаллического преобразования в дискретной молекулярном уровне. Крист Рост Дес 17: 2893-2910Google ученый
Глава 12: хрустальные Типы и межмолекулярные силы
Раздел 12-1: хрустальные Типы
Раздел 12-2: межмолекулярные силы
Раздел 12-3: «Как растворяет Как» и растворимость
Глава 12 Практические упражнения и тесты Обзор
Раздел 12-1: хрустальные Типы
Много различных веществ в Твердотельный можно разделить на один из следующих типов кристаллических:
I.Сеть Covalent
В сетчатом ковалентном кристалле атомы удерживаются вместе в непрерывном трехмерном массиве ковалентных облигации. Например, углерод атомы в сети ковалентного C (алмаз) каждый тетраэдрически связаны с четырьмя соседними атомами углерода следующим образом:
Вещества сетчатые ковалентные прочие включают SiC и SiO 2 . Сетевые ковалентные кристаллы в целом иметь следующие свойства:
1.Высокая температура плавления.
2. Физически тяжело.
3. Плохой проводник электричества. Чтобы вещество проводило электричество, заряженные частицы должен иметь возможность свободно перемещаться по выборке. В случае C (ромб), SiC, а SiO 2 , отрицательно заряженные электроны в ковалентных связях локализованы между двумя конкретными атомами и, следовательно, не имеют возможности свободно перемещаться по кристаллу. Таким образом, C (ромб), SiC и SiO 2 являются плохими проводниками электричество.
C (графит) также считается сетчато-ковалентным, потому что атомы углерода ковалентно соединены непрерывным тригональным плоским узором с слоев формы:
В отличие от физически твердых C (алмаз), SiC и SiO 2 , слои в образце C (графит) будут легче отслаиваться. Каждый атом углерода в C (графит) будет использовать 3 из 4 имеющихся валентных электронов для образования ковалентных связей с 3 соседние атомы углерода.Тем не мение, все лишние валентные электроны будут делокализованы между слоями углерод и, таким образом, может свободно перемещаться по кристаллу. Таким образом, C (графит) будет хорошим проводником электричества.
II. Ионный
Ионные кристаллы содержат непрерывный трехмерный массив положительно заряженных катионов металлов или многоатомных катионов такие как аммоний (NH 4 + ) и отрицательно заряженные неметаллические анионы или многоатомные анионы.Твердый ионные кристаллы обычно обладают следующими свойствами:
1. Высокая температура плавления.
2. Физически хрупкий.
3. Плохой проводник электричества. потому что заряженные катионы и анионы удерживаются прочно на месте и не может свободно перемещаться по кристаллу (катионы и анионы неподвижны).
Несмотря на то, что все еще близко контакт, заряженные катионы и анионы в жидкости (расплавленные) ионные соединения могут свободно перемещаться по образцу (катионы и анионы подвижны).Следовательно, жидкое ионное соединение представляет собой хороший проводник электричества. В водное ионное соединение, отдельные катионы и анионы окружены молекулами воды и полностью отделены от каждого разное. Поскольку эти заряженные ионы могут свободно перемещаться по раствору, водное ионное соединение также хороший проводник электричества.
Один аспект закона Кулона по существу предполагает, что притяжение между двумя противоположно заряженными частиц будет больше, когда величина зарядов частиц будет больше.Более сильное кулоновское притяжение между катионами и анионами в ионном твердом теле приведет к более высокая температура плавления. Когда сравнение температур плавления ионных твердых тел, соединения с большей суммой заряда одного катиона + величины заряда одного аниона часто будет иметь более высокую температуру плавления (хотя ионные радиусы также могут значительно повлиять на температуру плавления), как показано ниже. проблема:
Пример упражнения 12A:
Ранжируйте соединения CsBr, MgO и SrCl 2 от самой низкой до самой высокой точки плавления и обоснуйте свой ответ.
Решение:
Сначала мы определяем сумму заряда одного катиона + величина заряда одного аниона для каждого сложный:
CsBr = Cs + и Br — , сумма начисления величины = 1 + 1 = 2
MgO = Mg 2+ и O 2-, сумма заряда величины = 2 + 2 = 4
SrCl 2 = Sr 2+ и Cl — , сумма заряда величины = 2 + 1 = 3
CsBr имеет
самая низкая сумма и, следовательно, самая низкая температура плавления.MgO имеет наибольшую сумму и,
следовательно, самая высокая температура плавления.
Таким образом, рейтинг от самой низкой до самой высокой точки плавления: CsBr III. Металлик
Металлические кристаллы часто описывается как трехмерный массив катионов металлов в море делокализованных электронов. Металлические кристаллы обычно обладают следующими свойствами:
1.Широкий диапазон температур плавления, но все металлы, кроме ртути (Hg), являются твердые вещества при комнатной температуре.
2. Физически блестящий, податливый и пластичный.
3. Хороший проводник электричества. потому что некоторые электроны от каждого атома делокализованы и могут свободно перемещаться по всему кристаллу.
Жидкие металлы также делокализованы электроны и, следовательно, являются хорошими проводниками электричества.
IV.Молекулярный
Многие вещества, не входящие в сетчатая ковалентная, ионная или металлическая форма молекулярных кристаллов в твердом теле государство. Молекулярные кристаллы обычно имеют следующие свойства:
1. Низкие температуры плавления, поскольку межмолекулярные силы между молекулами относительно слабы. Обычно более низкие температуры плавления, чем сетчатые ковалентные, ионные или металлические кристаллы.
2. Физически не тяжело.
3.Плохой проводник электричества потому что электроны внутри молекул локализованы и не могут двигаться свободно по всему кристаллу.
Молекулярные вещества в жидкости государства являются плохими проводниками электричества, потому что электроны в молекулах локализованы и не могут свободно перемещаться по образцу. Молекулярные вещества в жидкости состояния также обычно имеют более низкие температуры кипения, чем ионные или металлические вещества.
Пример упражнения 12B:
Классифицируйте каждое вещество ниже как ковалентная, ионная, металлическая или молекулярная сеть:
(а) (NH 4 ) 2 CO 3
(б) Ni
(в) SiC
(г) (NH 2 ) 2 CO
Решение:
(а) NH 4 + и CO 3 2- = ионный
(б) никель = металлик
(в) SiC = сеть ковалентная
(г) молекулярный, Структура Льюиса:
Пример упражнения 12C:
Что из следующего имеет самая низкая точка плавления?
(а) CCl 4 (б) Cu (в) NaBr (г) SiO 2
Решение:
CCl 4 = молекулярный = низкий точка плавления
Cu = металлический = обычно выше точка плавления, чем молекулярная
NaBr = Na + и Br — = ионный = высокая температура плавления
SiO 2 = сеть ковалентная = высокая температура плавления
Следовательно, (a) CCl 4 имеет самая низкая точка плавления.
Пример упражнения 12D:
Укажите, каждое из следующих хороший или плохой проводник электричества в твердом состоянии:
(а) BaCl 2
(б) С (графит)
(в)
кр.(г) Mn
Решение:
(a) Ba 2+ и Cl — = ионный = плохой проводник в твердом состоянии, поскольку катионы и анионы неподвижны (но хороший проводник в жидком или водном состоянии, потому что катионы и анионы подвижны)
(б) сеть ковалентный, но, в отличие от других сетчатых ковалентных кристаллов, имеет делокализованные электроны между плоскими слоями = хороший проводник в твердом состоянии
(в) неметалл = молекулярный = плохой проводник в твердом состоянии, потому что электроны локализованы (а также плохой проводник в жидком состоянии, потому что электроны локализованы)
(г) марганец = металлический = хороший проводник в твердом состоянии, потому что электроны делокализованы (а также хороший проводник в жидком состоянии, потому что электроны делокализованы)
Раздел 12-2: Межмолекулярные силы
Молекулярные вещества с более сильными межмолекулярными силами (ММП) будут имеют более высокие температуры кипения, потому что молекулы будут более прочно удерживаться вместе.Три разных типы МВФ описаны ниже:
I. Водородная связь
Водородная связь возникает только между молекулами, содержащими водород связанные атомы НАПРЯМУЮ с атомами азота, кислорода или фтора. Например, HF способен образовывать водородные связи, тогда как дифторметан, CH 2 F 2 , не может образовывать водородные связи. способны к водородной связи, потому что атомы H не связаны непосредственно с Атомы F, как показано в следующей структуре Льюиса:
Пример упражнения 12E:
Что из перечисленного не является способен к водородной связи?
(а) C 2 H 5 OH (б) CH 3 CN (в) H 2 O 2 (г) N 2 H 4
Решение:
(b) CH 3 CN (H не связан прямо к N)
В образце HF ковалентный связь в каждой молекуле сильно полярна из-за большая разница в электроотрицательности между H (EN = 2.1) и F (EN = 4.0), что приводит к частичному отрицательному заряду (δ — ) на F конец молекулы и частичный положительный заряд (δ + ) на H конец молекулы. Сильный притяжение между концом F одной молекулы и концом H соседнего молекула известна как водородная связь и представлена пунктирной линией ниже:
Молекулярные вещества, которые способные образовывать водородные связи, как правило, имеют более высокие температуры кипения, чем молекулярные вещества, не способные к образованию водородных связей.
Для большинства веществ плотность твердого тела выше, чем плотность жидкости, потому что молекулы в твердом теле плотно упакованы и затем слегка перемещаются дальше друг от друга в жидкости. Однако уникальное сочетание небольших размеров, изогнутой формы и способности к водородной связи для молекул H 2 O позволяет льду получить кристалл структура, в которой молекулы воды разделены значительным расстоянием водородными связями, как показано ниже (красный = атомы кислорода, белый = атомы водорода):
Значительное пустое пространство между молекул во льду приводит к более низкой плотности льда, чем жидкая вода, когда два сравниваются при температуре замерзания 0 ° C.
II. Лондон (Рассеивание) Сил
В то время как только ограниченное количество молекулярных веществ способно образовывать водородные связи, все молекулярные вещества удерживаются вместе лондонскими (дисперсионными) силами . Когда на одной стороне молекулы оказывается больше электронов чем другой в конкретный момент времени, мгновенный диполь создается с частичным отрицательным зарядом на стороне с большим количеством электронов и частичный положительный заряд на стороне с меньшим количеством электронов.Если вторая молекула приближается близость к отрицательному концу мгновенного диполя, электронное облако во второй молекуле будет отталкиваться от отрицательного конца мгновенный диполь. Это создает индуцированный диполь во второй молекуле с ближайшим частичным положительным зарядом к первой молекуле и частичный отрицательный заряд, наиболее удаленный от первой молекула. Лондонская сила — это притяжение между мгновенным диполем и индуцированным диполем и равно представлен двухсторонней стрелкой ниже:
Поляризуемость по сути, легкость, с которой электронное облако может быть перемещено в молекуле для создания диполей, необходимых для лондонской силы.Молекулы со значительно большим общим электроны, как правило, будут более поляризуемыми и, следовательно, имейте более сильные лондонские силы. Молекулярные вещества с более сильными лондонскими силами обычно будут иметь более высокие температуры кипения. Скорее, чем подсчет полного количества электронов для сравнения лондонских сил в различных молекулярных веществ, мы обычно можем получить те же результаты, сравнивая вместо этого молярные массы. Следовательно, молекулярная вещества со значительно большей молярной массой, как правило, будут иметь более сильные Лондонские силы и более высокие точки кипения.
Пример упражнения 12F:
Объясните, почему Br 2 является жидкость при комнатной температуре, тогда как Cl 2 — газ.
Решение:
И Br 2 , и Cl 2 представляют собой молекулярные вещества, удерживаемые вместе только силами Лондона. Так как Br 2 имеет значительно большее общее количество электронов (2 x 35 = 70), чем Cl 2 (2 x 17 = 34), Br 2 имеет силы Лондона, достаточно сильные, чтобы удерживать молекулы вместе как жидкость, тогда как силы Лондона в Cl 2 не так сильный, поэтому молекулы Cl 2 разделяются в газ.
III. Диполь-дипольные силы
Молекулярные вещества, содержащие полярные молекулы будут иметь диполь-дипольные силы, где частичный отрицательный конец одной полярной молекулы будет притягиваться к частичному положительному концу другой полярная молекула. Это похоже на водородная связь, но более слабая по прочности. Два молекулярных вещества, не способных образовывать водородные связи, и которые имеют примерно равные силы Лондона (как следует из их одинакового общего числа электронов) могут иметь значительно разные точки кипения, если одна полярная и, следовательно, он также удерживается вместе диполь-дипольными силами, в то время как другой является неполярным и, следовательно, не имеет дополнительного притяжения. за счет диполь-дипольных сил.
Пример упражнения 12G:
Который будет иметь более высокую температуру кипения точка, CO или N 2 ?
Решение:
Оба CO и N 2 являются молекулярные вещества с одинаковым общим числом электронов (CO = 6 + 8 = 14, N 2 = 2 x 7 = 14). Следовательно, CO и N 2 являются Ожидается, что в Лондоне будут примерно равные силы.Однако CO полярен и, следовательно, имеет диполь-дипольные силы, чтобы поднять точку кипения выше точки кипения неполярный N 2 , в котором отсутствует дополнительная притяжение диполь-дипольных сил.
Раздел 12-3: «Подобное растворяется, подобное» и растворимость
Обычное практическое правило, используемое для предсказать, будет ли растворенное вещество растворяться в растворителе, «как растворяется как «:
а.Неполярный растворенные вещества имеют тенденцию растворяться в неполярных растворителях. Обратите внимание, что электроотрицательность разница между водородом и углеродом настолько мала, что мы будем рассматривать связи между водородом и углеродом быть неполярным. Поэтому рассмотрим все соединения, содержащие только водород и углерод (углеводороды), быть неполярными. Масла, жиры и бензин имеют общие значительные доли углеводородов. что делает их фактически неполярными. Таким образом, масла, жиры и бензин будут не растворяться и не смешиваться с полярной водой в любой значительной степени.
г. Полярные растворенные вещества имеют свойство растворяться в полярных растворителях.
г. Растворы, способные к водородные связи имеют тенденцию растворяться в растворителях, способных выделять водород склеивание.
г. Ионные растворенные вещества имеют свойство растворяться в полярных растворителях. Несмотря на то что для разделения катионов требуется значительная энергия и анионы в растворенном веществе во время процесса растворения, значительная энергия восстанавливается через ионно-дипольные взаимодействия, при которых частичные отрицательные концы молекулы полярного растворителя притягиваются к катионам а частичные положительные концы молекул полярного растворителя притягиваются к анионы:
Пример упражнения 12H:
Предсказать, будет ли каждое из растворенных веществ ниже в большей степени растворяется в сероуглероде или воде:
(а) HOCl
(б) Я 2
(в) KBr
(г) NH 2 OH
Решение:
H 2 O полярен и способен образовывать водородные связи.В Структура Льюиса CS 2 не показывает неподеленной пары на углероде, что указывает на линейная и неполярная молекула:
(а) Полярный HOCl в большей степени растворяется в полярной воде.
(б) Неполярный I 2 будет в большей степени растворяться в неполярных сероуглерод.
(в) KBr = K + и Br — = ионные, поэтому растворятся в большей степени в полярной воде (за счет ионно-дипольного притяжения).
(d) NH 2 OH способен к водородные связи, поэтому будет в большей степени растворяться в воде, которая может водородная связь.
Глава 12 Практические упражнения и контрольные тесты:
12-1) Ранжируйте соединения CaO, K 2 S, RbI и SCl 2 от самой низкой до самой высокой точки плавления и объясните.
12-1) SCl 2 = молекулярный = самая низкая точка плавления
Три других соединения ионные, поэтому большая сумма заряда одного катиона + величина заряда одного аниона = более высокая температура плавления:
CaO = Ca 2+ и O 2-, сумма зарядов = 2 + 2 = 4
K 2 S = K + и S 2-, сумма зарядов = 1 + 2 = 3
RbI = Rb + и I — , сумма зарядов = 1 + 1 = 2
Следовательно, порядок плавки
баллов = SCl 2
12-2) Укажите, каждый из Следующее — хороший или плохой проводник электричества в твердом состоянии и объясните:
(а) C (ромб)
(б) К
(в) MgBr 2
(г) № 2
12-2)
(а) сеть ковалентный с локализованными электронами = плохой проводник в твердом состоянии
(б) калий = металлический = хороший проводник в твердом состоянии, потому что электроны делокализованы (а также хороший проводник в жидком состоянии, потому что электроны делокализованы)
(в) Mg 2+ и Br — = ionic = плохой проводник в твердом состоянии, потому что катионы и анионы неподвижны (но хороший проводник в жидком состоянии или водное состояние, потому что катионы и анионы подвижны)
(г) неметалл = молекулярный = плохой проводник в твердом состоянии, потому что электроны локализованы (а также плохой проводник в жидком состоянии, потому что электроны локализованы)
12-3) Оцените каждое из следующих группы от самой высокой до самой низкой точки кипения и объясните:
(а) CO 2 , CH 3 OH, CH 3 OCH 3 , LiF
(б) Al, Br 2 , O 2 , ICl
12-3)
(а) LiF = Li + и F — = ионный = температура кипения выше, чем у других три, которые все являются молекулярными веществами.
CH 3 OH будет иметь второе место по температуре кипения точка, потому что он способен образовывать водородные связи. Обратите внимание, что CH 3 OCH 3 не может водородная связь, потому что H не связан напрямую с O.
Общее количество электронов в CH 3 OCH 3 (2 x 6 + 6 x 1 + 8 = 26) и CO 2 (6 + 2 x 8 = 22) похожи, поэтому эти два ожидается, что в Лондоне будут примерно равные силы.Однако CH 3 OCH 3 полярный и, следовательно, также удерживается вместе диполь-дипольными силами, которые придают ему третья по высоте точка кипения. Мы определили, что CH 3 OCH 3 полярный из структуры Льюиса, которая показывает неподеленные пары на атоме кислорода, которые приводят в изогнутую форму в этом районе:
С другой стороны, CO 2 неполярен и, следовательно, лишен дополнительных диполь-дипольное притяжение, поэтому CO 2 будет иметь самую низкую точку кипения в группе.Мы определили что CO 2 неполярен от Льюиса структура, которая не показывает неподеленных пар на центральном атоме углерода, что указывает на линейный форма для молекулы:
Следовательно, порядок кипячения точки = LiF> CH 3 OH> CH 3 OCH 3 > СО 2 .
(b) Al = металлический = высококипящий точки, чем остальные три, которые все являются молекулярными веществами.
Общее количество электронов в Br 2 (2 x 35 = 70) и ICl (53 + 17 = 70) одинаковы, поэтому ожидается, что эти два имеют примерно равные лондонские силы. Однако ICl полярна и, следовательно, имеет диполь-дипольные силы, чтобы поднимите температуру кипения выше, чем у неполярного Br 2 , в котором отсутствуют дополнительные диполь-дипольные притяжения. Неполярный O 2 имеет значительно меньше полных электронов (2 x 8 = 16), чем Br 2 , Таким образом, силы Лондона в O 2 будут слабее, чем в Br 2 и, следовательно, O 2 будет иметь самую низкую точку кипения в группе.
Следовательно, порядок кипячения точки = Al> ICl> Br 2 > O 2 .
12-4) Предскажите, будет ли каждое растворенное вещество ниже будет растворяться в большей степени в воде или бензоле, C 6 H 6 , и поясняет:
(а) C 10 H 8
(б) H 2 CO
(в) NH 3
(г) SrI 2
12-4) Вода полярна и способна образовывать водородные связи.Бензол — это углеводород и, поэтому считается неполярным.
(а) Неполярный углеводород C 10 H 8 будет в большей степени растворяться в неполярный бензол.
(б) Полярный H 2 CO в большей степени растворяется в полярной воде.
(c) NH 3 может образовывать водородные связи, поэтому будет в большей степени растворяются в воде, которая также может образовывать водородные связи.
(г) SrI 2 = Sr 2+ и I — = ионный, поэтому будет растворяться в большей степени в полярных вода (за счет ионно-дипольного притяжения).
Нажмите, чтобы просмотреть викторину 1
Нажмите для обзора викторины 1 ответов
(PDF) Водородная связь в молекулярных кристаллах
48. Cavallari, C.; Сантос, Б. П.-А .; Fini, A. J. Pharm. Sci. 2013, 102 (11), 4046–4056.
49. Bhardwaj, R.M .; Цена, Л. С .; Цена, с.л .; Reutzel-Edens, S.M .; Miller, G.J .; Освальд, И. Д. Х; Johnston, B. F .; Florence, A. J. Cryst. Рост Des. 2013, 13 (4), 1602–1617.
50. Clarke, H.D .; Hickey, M. B .; Moulton, B .; Perman, J. A .; Peterson, M. L .; Войтас, Ł .; Almarsson, Ö .; Zaworotko, M. J. Cryst. Рост Des. 2012, 12 (8), 4194–4201.
51. Ravikumar, K .; Swamy, G. Y. S. K .; Шридхар, Б.; Roopa, S. Acta Crystallogr. Разд. E 2005, 61 (8), o2720 – o2723.
52. Sridhar, B .; Ravikumar, K. J. Struct. Chem. 2007, 48 (1), 198–202.
53. Kavitha, C. N .; Jasinski, J. P .; Keeley, A.C .; Yathirajan, H. S .; Даянанда, А.С. Acta Crystallogr. Разд. E 2013, 69 (2), o232 – o233.
54. Sarmah, K. K .; Сарма, А .; Рой, К .; Rao, D. R .; Такурия, Р. Крист. Рост Des. 2016, 16 (2), 1047–1055.
55. Achari, A .; Neidle, S. Acta Crystallogr. Разд. В 1976, 32 (2), 600–602.
56. Huber, C.P .; Sake Gowda, D. S .; Равиндра Ачарья, К. Акта Кристаллогр. Разд. В 1980, 36 (2), 497–499.
57. Gangavaram, S .; Raghavender, S .; Sanphui, P .; Pal, S .; Manjunatha, S.G .; Nambiar, S .; Nangia, A. Cryst. Рост Des. 2012, 12 (10), 4963–4971.
58. Grecu, T .; Adams, H .; Хантер, К. А .; McCabe, J. F .; Portell, A .; Prohens, R. Cryst. Рост Des. 2014, 14 (4), 1749–1755.
59. Epelbaum, R .; Schaffer, M .; Визель, Б .; Бадмаев, В .; Бар-Села, Г. Нутр.Cancer 2010, 62 (8), 1137–1141.
60. Kunnumakkara, A. B.; Guha, S.; Krishnan, S.; Diagaradjane, P.; Gelovani, J.; Aggarwal, B. B. Cancer Res. 2007, 67 (8), 3853–3861.
61. Kanai, M.; Yoshimura, K.; Asada, M.; Imaizumi, A.; Suzuki, C.; Matsumoto, S.; Nishimura, T.; Mori, Y.; Masui, T.; Kawaguchi, Y.; Yanagihara, K.; Yazumi, S.; Chiba, T.;
Guha, S.; Aggarwal, B. Cancer Chemother. Pharmacol. 2011, 68 (1), 157–164.
62. Salem, M.; Rohani, S.; Gillies, E.R. RSC Adv. 2014, 4 (21), 10815–10829.
63. Sanphui, P .; Goud, N.R .; Хандавилли, У. Б. Р.; Bhanoth, S .; Nangia, A. Chem. Commun. 2011, 47 (17), 5013–5015.
64. Sanphui, P .; Goud, N.R .; Хандавилли, У. Б. Р.; Nangia, A. Cryst. Рост Des. 2011, 11 (9), 4135–4145.
65. Goud, N. R .; Суреш, К .; Sanphui, P .; Nangia, A. Int. J. Pharm. 2012, 439 (1–2), 63–72.
66. Pienaar, E. W .; Caira, M. R .; Lötter, A.P.J. Crystallogr. Spectrosc. Res. 1993, 23 (9), 739–744.
67. Pienaar, E. W .; Caira, M. R .; Lötter, A.P.J. Crystallogr. Spectrosc. Res. 1993, 23 (10), 785–790.
68. Caira, M. R .; Pienaar, E.W .; Lötter, A. P. Mol. Cryst. Liq. Cryst. Sci. Technol. Разд. А 1996, 279 (1), 241–264.
69. Vangala, V. R .; Чоу, П. С .; Тан, Р. Б. CrystEngComm 2011, 13 (3), 759–762.
70. Alhalaweh, A .; Джордж, S .; Basavoju, S .; Чайлдс, S. L .; Ризви, С. А. А .; Велага, С. П. CrystEngComm 2012, 14 (15), 5078–5088.
71.Вангала, В. Р .; Чоу, П. С .; Тан, Р. Б. Х. Кристалл. Рост Des. 2012, 12 (12), 5925–5938.
72. Tutughamiarso, M .; Bolte, M .; Вагнер, Г .; Egert, E. Acta Crystallogr. Разд. C 2011, 67 (1), o18 – o25.
73. Cherukuvada, S .; Бабу, Н. Дж .; Nangia, A.J. Pharm. Sci. 2011, 100 (8), 3233–3244.
74. Kalman, A .; Parkanyi, L .; Argay, G. Acta Crystallogr. Разд. В 1993, 49 (6), 1039–1049.
75. Fabian, L .; Kalman, A. Acta Кристаллография. Разд. В 2004, 60 (5), 547–558.
76.Энтони, А .; Nangia, A .; Desiraju, G. R .; Jaskolski, M. Chem. Commun. 1998, 22, 2537–2538.
77. Nath, N.K .; Saha, B.K .; Nangia, A. New J. Chem. 2008, 32 (10), 1693–1701.
78. Fabian, L .; Kalman, A. Acta Кристаллография. Разд. В 1999, 55 (6), 1099–1108.
79. Гельбрих, Т .; Херстхаус, М. Б. CrystEngComm 2005, 7 (53), 324–336.
80. Гельбрих, Т .; Херстхаус, М. Б. CrystEngComm 2006, 8 (6), 448–460.
81. Cincic, D .; Friscic, T .; Джонс, В. Нью Дж.Chem. 2008, 32 (10), 1776–1781.
82. Thakuria, R .; Nath, N.K .; Рой, С .; Нангиа, А. CrystEngComm 2014, 16 (22), 4681–4690.
83. Panini, P .; Mohan, T. P .; Gangwar, U .; Санколли, Р .; Чопра, Д. CrystEngComm 2013, 15 (22), 4549–4564.
84. Chopra, D .; Гуру Роу, Т. Н. CrystEngComm 2008, 10 (1), 54–67.
85. Caira, M. R. Mol. Pharm. 2007, 4 (3), 310–316.
86. Reddy, C.M .; Киршнер, М. Т .; Gundakaram, R.C .; Padmanabhan, K. A .; Desiraju, G.R. Chem.Евро. J. 2006, 12 (8), 2222–2234.
87. Anthony, A .; Jaskólski, M .; Nangia, A. Acta Crystallogr. Разд. В 2000, 56 (3), 512–525.
88. Nath, N.K .; Nangia, A. Cryst. Рост Des. 2012, 12 (11), 5411–5425.
89. Askeland, D. R .; Фулай, П. П. Основы материаловедения и инженерии, 2-е изд .; Cengage Learning: USA, 2009.
90. Smith, W. F .; Хашеми, Дж. Основы материаловедения и инженерии, 4-е изд .; Макгроу-Хилл: Бостон, 2006.
91.Stahly, G.P. Cryst. Рост Des. 2009, 9 (10), 4212–4229.
92. Schultheiss, N .; Newman, A. Cryst. Рост Des. 2009, 9 (6), 2950–2967.
93. Oliveira, M.A .; Peterson, M. L .; Klein, D. Cryst. Рост Des. 2008, 8 (12), 4487–4493.
94. Dabros, M .; Emery, P. R .; Таллади, В. Р. Энгью. Chem. Int. Эд. 2007, 46 (22), 4132–4135.
95. Cherukuvada, S .; Нангиа, А. CrystEngComm 2012, 14 (7), 2579–2588.
96. Huang, N .; Родригес-Хорнедо, Н. CrystEngComm 2011, 13 (17), 5409–5422.
97. Good, D. J .; Родригес-Хорнедо, Н. Кристалл. Рост Des. 2010, 10 (3), 1028–1032.
98. Стори, Р. А .; Имен, И. Характеристики фармацевтических препаратов в твердом состоянии, 1-е изд .; John Wiley & Sons Ltd: UK, 2011.
99. Davis, R.E .; Lorimer, K. A .; Wilkowski, M. A .; Rivers, J. H .; Уиллер, К. А .; Bowers, J. ACA Trans. 2004, 39, 41–61.
100. Reddy, L. S .; Nangia, A .; Линч, В. М. Кристалл. Рост Des. 2004, 4 (1), 89–94.
101. Yamamoto, N .; Тага, Т.; Мачида, К. Acta Crystallogr. Разд. В 1989, 45 (2), 162–167.
102. Brittain, H. G. Cryst. Рост Des. 2009, 9 (5), 2492–2499.
103. Childs, S. L .; Stahly, G.P .; Парк, А. Мол. Pharm. 2007, 4 (3), 323–338.
104. Lu, J .; Рохани, С. Курр. Med. Chem. 2009, 16 (7), 884–905.
105. Li, Z. J .; Абрамов, Ю .; Bordner, J .; Леонард, Дж .; Medek, A .; Trask, A. V. J. Am. Chem. Soc. 2006, 128 (25), 8199–8210.
106. Mukherjee, A .; Tothadi, S .; Чакраборти, С.; Ganguly, S .; Десираджу, Г. Р. CrystEngComm 2013, 15 (23), 4640–4654.
107. Егами, Т .; Биллиндж, С. Дж. Л. Под пиками Брэгга: структурный анализ сложных материалов; Pergamon, Elsevier: Oxford, 2003.
108. Juhas, P .; Granlund, L .; Gujarathi, S. R .; Duxbury, P.M .; Биллинге, С. Дж. Л. Дж. Прил. Кристаллогр. 2010, 43 (3), 623–629.
109. Биллинге, С. Дж. Л .; Kanatzidis, M. G. Chem. Commun. 2004, 7, 749–760.
110. Proffen, T .; Пейдж, К. Л .; Маклейн, С.E .; Clausen, B .; Darling, T. W .; TenCate, J. A .; Lee, S.-Y .; Устундаг, Э.З. Крист. 2005, 220, 1002–1008.
111. Петков В .; Гатешки, М .; Choi, J .; Gillan, E. G .; Ren, Y. J. Mater. Chem. 2005, 15 (43), 4654–4659.
112. Moore, M .; Steinbach, A .; Бакнер, I .; Wildfong, P. D. Pharm. Res. 2009, 26 (11), 2429–2437.
113. Boetker, J. P .; Корадиа, В .; Радес, Т .; Rantanen, J .; Саволайнен, М. Фармацевтика 2012, 4 (1), 93–103.
114. Billinge, S. J. L .; Дыхне, Т.; Juhas, P .; Бозин, Е .; Taylor, R .; Florence, A.J .; Шенкленд, К. CrystEngComm 2010, 12 (5), 1366–1368.
115. Di Martino, P .; Guyot-Hermann, A.M .; Con fl ant, P .; Drache, M .; Guyot, J. C. Int. J. Pharm. 1996, 128 (1–2), 1–8.

 Когда чистое кристаллическое соединение нагревается или охлаждается жидкостью, изменение температуры образца со временем примерно равномерное.Однако, если твердое вещество плавится или жидкость замерзает, возникает разрыв, и температура образца остается постоянной до тех пор, пока фазовый переход не завершится. Такое поведение показано на диаграмме справа, где зеленый сегмент представляет твердую фазу, голубой — жидкость, а красный — неизменное по температуре равновесие жидкость / твердое тело. Для данного соединения эта температура представляет собой его точку плавления (или точку замерзания) и является воспроизводимой константой до тех пор, пока внешнее давление не изменяется.Длина горизонтальной части зависит от размера образца, поскольку количество тепла, пропорциональное теплоте плавления, должно быть добавлено (или удалено) до завершения фазового перехода.
Когда чистое кристаллическое соединение нагревается или охлаждается жидкостью, изменение температуры образца со временем примерно равномерное.Однако, если твердое вещество плавится или жидкость замерзает, возникает разрыв, и температура образца остается постоянной до тех пор, пока фазовый переход не завершится. Такое поведение показано на диаграмме справа, где зеленый сегмент представляет твердую фазу, голубой — жидкость, а красный — неизменное по температуре равновесие жидкость / твердое тело. Для данного соединения эта температура представляет собой его точку плавления (или точку замерзания) и является воспроизводимой константой до тех пор, пока внешнее давление не изменяется.Длина горизонтальной части зависит от размера образца, поскольку количество тепла, пропорциональное теплоте плавления, должно быть добавлено (или удалено) до завершения фазового перехода.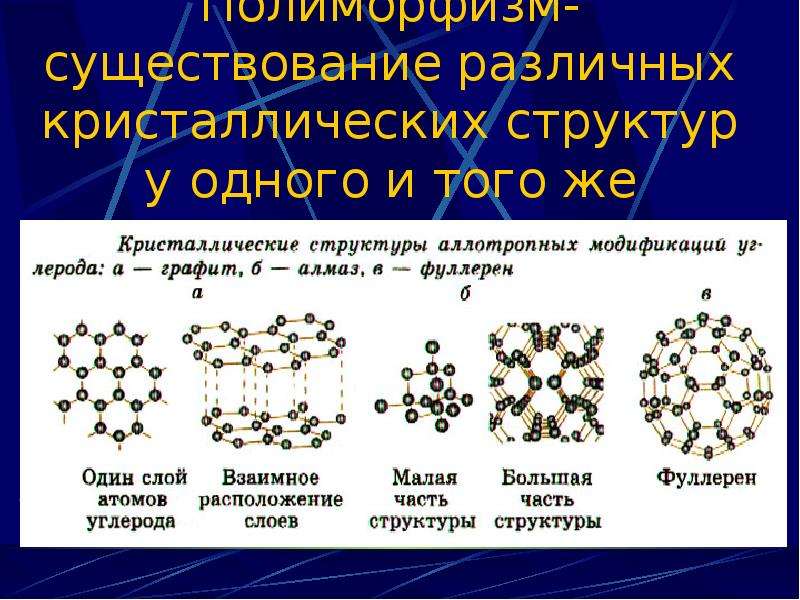 Если два кристаллических соединения (A и B) тщательно смешиваются, температура плавления этой смеси обычно понижается и расширяется по сравнению с характерной острой точкой плавления каждого чистого компонента.Это обеспечивает полезные средства для установления идентичности или неидентичности двух или более соединений, поскольку точки плавления множества твердых органических соединений документируются и обычно используются в качестве теста на чистоту.
Если два кристаллических соединения (A и B) тщательно смешиваются, температура плавления этой смеси обычно понижается и расширяется по сравнению с характерной острой точкой плавления каждого чистого компонента.Это обеспечивает полезные средства для установления идентичности или неидентичности двух или более соединений, поскольку точки плавления множества твердых органических соединений документируются и обычно используются в качестве теста на чистоту.  Выше этой температуры смесь представляет собой жидкую или жидкую твердую смесь, состав которой меняется. В некоторых редких случаях неполярных соединений аналогичного размера и кристаллической структуры образуется настоящий твердый раствор одного в другом, а не конгломерат.Плавление или замерзание происходит в широком диапазоне температур, и истинной точки эвтектики не существует.
Выше этой температуры смесь представляет собой жидкую или жидкую твердую смесь, состав которой меняется. В некоторых редких случаях неполярных соединений аналогичного размера и кристаллической структуры образуется настоящий твердый раствор одного в другом, а не конгломерат.Плавление или замерзание происходит в широком диапазоне температур, и истинной точки эвтектики не существует. пл. 94 ° C, и п-толуидин, т.пл. 43 ºC. Комплекс A: B имеет точку плавления 54 ºC, а на фазовой диаграмме показаны две эвтектические точки, первая при 50 ºC, вторая при 30 ºC. Молекулярные комплексы этого типа обычно имеют стехиометрию 50:50, как показано, но известны другие интегральные отношения.
пл. 94 ° C, и п-толуидин, т.пл. 43 ºC. Комплекс A: B имеет точку плавления 54 ºC, а на фазовой диаграмме показаны две эвтектические точки, первая при 50 ºC, вторая при 30 ºC. Молекулярные комплексы этого типа обычно имеют стехиометрию 50:50, как показано, но известны другие интегральные отношения.  Межмолекулярные водородные связи являются важной особенностью во всем этом. Цвета кристаллов варьируются от ярко-красного до фиолетового.
Межмолекулярные водородные связи являются важной особенностью во всем этом. Цвета кристаллов варьируются от ярко-красного до фиолетового.