Классификация органических веществ — урок. Химия, 8–9 класс.
Органических веществ известно более двадцати пяти миллионов. Для того чтобы разобраться во всём их многообразии, используют классификацию.
В основу современной классификации органических соединений положены два признака:
- строение углеродного скелета молекулы;
- наличие в молекуле функциональных групп.
По строению углеродной цепи все соединения делят на алифатические (с незамкнутой цепью атомов углерода) и циклические (с замкнутым в цикл углеродным скелетом).
Алифатические соединения могут иметь разное строение углеродной цепи.
Алифатические соединения с линейной цепью | Алифатические соединения с разветвлённой цепью |
Среди циклических веществ выделяют карбоциклические (в цикле только атомы углерода) и гетероциклические (кроме углерода содержат в цикле атомы кислорода или азота).
Карбоциклические соединения | Гетероциклические соединения |
Атомы кислорода и азота в состав органических веществ входят в виде функциональных групп.
Функциональная группа — это группа атомов, которая определяет свойства вещества.
По наличию функциональной группы выделяют углеводороды (состоят из атомов углерода и водорода) и их производные .
С учётом связей между атомами углерода органические вещества делятся на насыщенные (с одинарными связями между атомами углерода) и ненасыщенные (с двойными и тройными связями).
Насыщенные углеводороды | Ненасыщенные углеводороды |
Среди производных углеводородов можно выделить кислородсодержащие и азотсодержащие (содержат в молекулах третий элемент).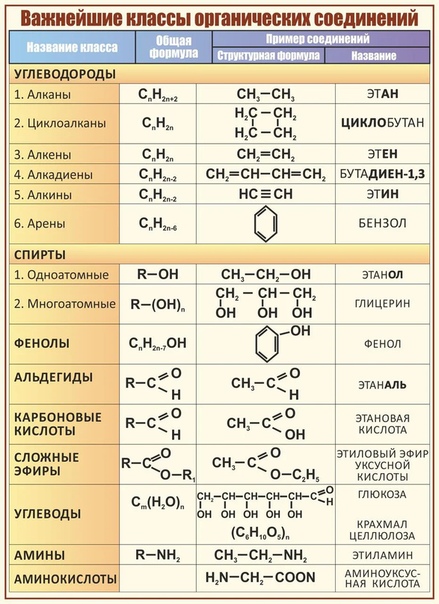
Кислородсодержащие соединения | Азотсодержащие соединения |
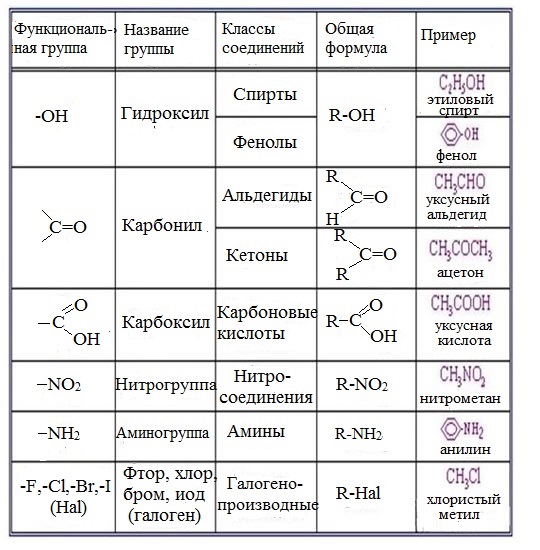
В зависимости от состава функциональной группы среди производных выделяют спирты R—OH,
МЦКО
Химия – предмет, не относящийся к обязательным для сдачи ЕГЭ, и выбирают его выпускники, которые хорошо в нем разбираются. Но и у них даже, казалось бы, самые легкие задания могут вызвать затруднения. На каких моментах часто спотыкаются участники экзамена и как можно избежать ошибок, рассказывает Наталия Покровская, эксперт Московского центра качества образования, ответственный секретарь предметной комиссии ЕГЭ по химии.
Вариант контрольно-измерительных материалов единого государственного экзамена по химии состоит из 35 заданий: 29 в первой части – с выбором ответа или кратким ответом, и 6 во второй – высокого уровня сложности с развернутым ответом.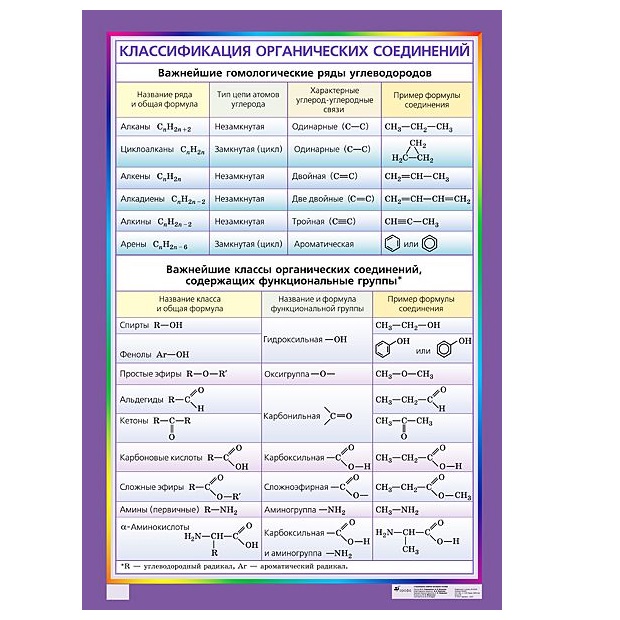
Задания 1–3
– Первые три задания не относятся к разряду трудных, но и в них выпускники могут допустить ошибки: иногда ребят сбивает с толку простое изменение формулировки вопроса, – рассказывает Наталия Покровская. – Например, если в задании 3 написано «Выберите элементы, проявляющие высшую степень окисления +5», всем ясно, о чем идет речь. А нестандартная формулировка вроде «Выберите элементы, которые имеют одинаковую разность между значениями их высшей и низшей степеней окисления» вызывает непонимание, хотя суть задания не изменилась! Таким образом, старшеклассники должны быть готовы к тому, что вопрос может звучать по-разному.
Задание 7
Это задание также нельзя назвать трудным. Главное при его выполнении быть внимательными. Например, в условии может быть сказано: «Добавили раствор вещества Х». Значит, выбирая из предложенного списка вещество Х, сразу нужно исключить все нерастворимые вещества. Поскольку задание чаще всего направлено на проверку знаний о реакциях, протекающих в растворах, следует вспомнить, в каких случаях выделяются газы: разложение получившихся непрочных кислот (сернистой, угольной) или гидрата аммиака, появление в продуктах сероводорода, совместный полный гидролиз, вытеснение водорода из кислоты металлом.
Задания 8, 30, 31 и 32
Задания 8, 30, 31 и 32 направлены на проверку знаний свойств неорганических веществ. Изменившийся формат заданий 30 и 31 ограничивает экзаменуемых в выборе веществ, между которыми идет реакция. Теперь уравнение должно соответствовать указанным в условии признакам: меняется ли цвет раствора, образуется или не образуется осадок либо газ. Поэтому не любое правильно написанное уравнение будет считаться верным: оценивается уравнение только той реакции, которая полностью соответствует условию. Для выполнения задания 30 нужно хорошо знать, какие конкретно вещества являются окислителями и восстановителями, а для задания 31 – вспомнить формулы малодиссоциирующих веществ (их нельзя записывать в виде ионов).
Важно помнить: если в исходных веществах есть кислота, то в продуктах не может получиться основание или основная соль, и наоборот. Следует проверять, чтобы получившиеся продукты реакции не реагировали между собой и с реагентами. Если есть возможность дальнейшего протекания реакции, значит, уравнение неверно. Больше информации о выполнении этих заданий можно найти на сайте Московского образовательного телеканала в видеоролике «Учимся вместе. Я сдам ЕГЭ!».
Следует проверять, чтобы получившиеся продукты реакции не реагировали между собой и с реагентами. Если есть возможность дальнейшего протекания реакции, значит, уравнение неверно. Больше информации о выполнении этих заданий можно найти на сайте Московского образовательного телеканала в видеоролике «Учимся вместе. Я сдам ЕГЭ!».
Задания 8 и 32 различаются тем, что первое предполагает только выбор возможных реакций, а во втором требуется написание уравнений (при этом даются подсказки в виде признаков протекания реакций). Приступая к выполнению задания 8, нужно рассмотреть предложенные формулы веществ с двух позиций: их кислотно-основных и окислительно-восстановительных свойств. Это позволит сразу понять, от какого списка реагентов можно отказаться: например, кислота не реагирует с кислотой, а восстановитель – с восстановителем. Для выполнения задания 32 особенно важно знать цвета осадков и растворов – это может быть хорошей подсказкой для определения продуктов реакции. Выучить палитру довольно просто, если раскрасить таблицу растворимости, отмечая все известные цветовые признаки соединений.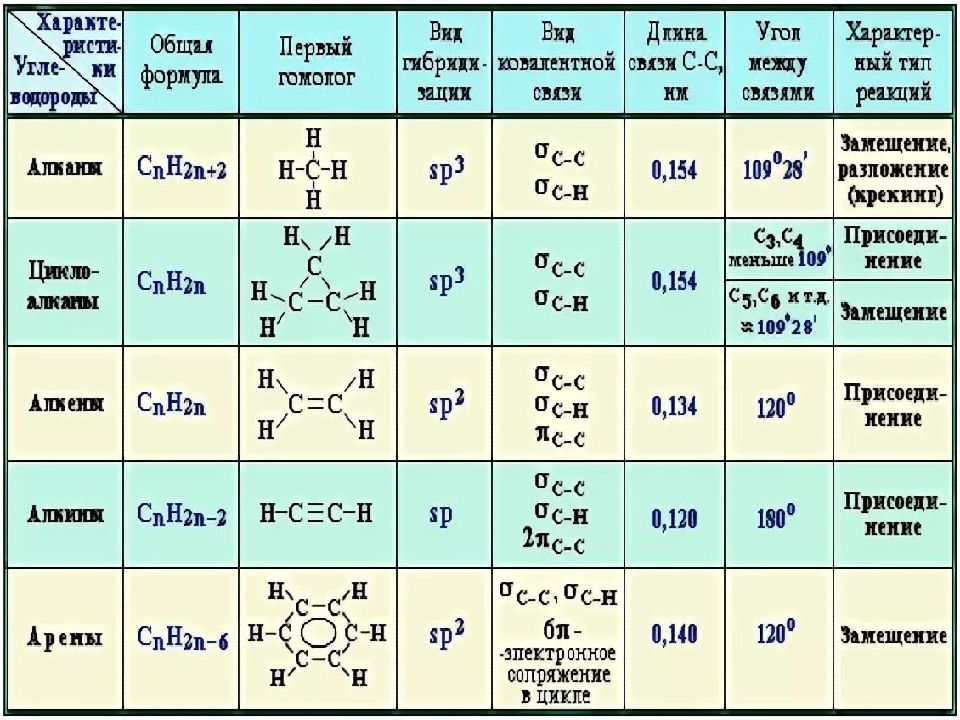
Задание 13
Очень много ошибок выпускники делают в задании 13 (свойства углеводородов), особенно если вопрос заключается в определении механизма реакции. Рекомендую обратить внимание на то, что ионный механизм всегда связан с присутствием ионов, то есть разноименно заряженных частиц. Но есть вещества, которые при разных условиях могут образовывать и частицы-ионы, и частицы-радикалы. Например, молекула хлора при облучении распадается на радикалы, а вот катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи, и получаются ионы.
Гораздо легче запомнить свойства углеводородов, если учитывать возможность веществ с определенным типом связи вступать в соответствующие реакции: кратная связь – реакции присоединения, одинарная связь – реакции замещения. Но не следует забывать также, что при изменении условий могут быть исключения даже в основных законах: с перекисью водорода в качестве катализатора реакция присоединения идет вопреки правилу Марковникова, а если хлорирование алкена проводить при температуре 600 0С, то вместо реакции присоединения пойдет замещение у атома углерода в sp3-гибридизации.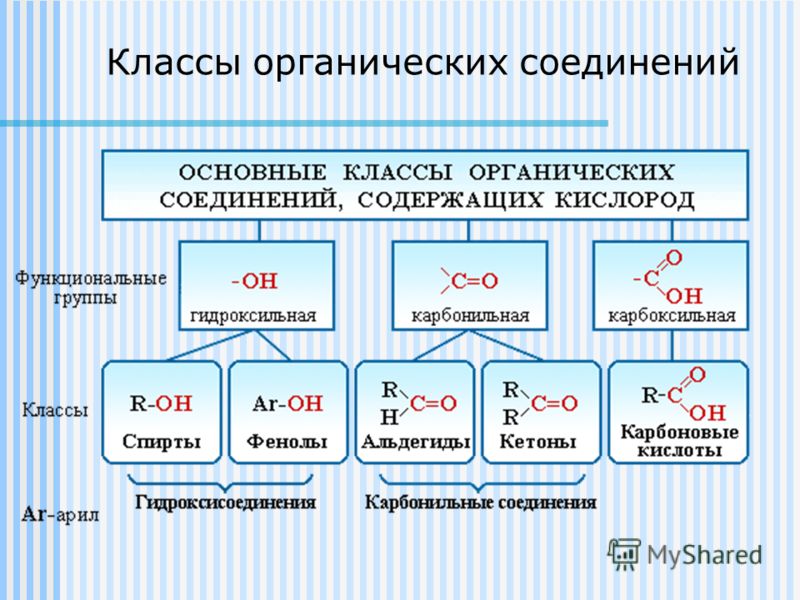
Задания 15 и 17
Не менее сложны задания 15 (азотсодержащие органические вещества и углеводы) и 17 (кислородсодержащие органические вещества). При изучении свойств этих соединений нужно обратить внимание, что реакции могут идти как по функциональной группе, так и по радикалу. Чтобы выучить как можно больше свойств органических соединений, можно составить конспект, выписать побольше уравнений для каждого класса. И конечно же, нужно выполнять цепочки на взаимосвязь органических веществ. Рекомендую посмотреть видеоролики по этим заданиям на Московском образовательном телеканале – «Химия, ЕГЭ. Задание № 15» и «Химия, ЕГЭ. Задание № 17», а также видео «Химия, 10 класс. Взаимосвязь классов органических веществ».
Затруднения вызывают и вопросы по окислительно-восстановительным реакциям в органической химии, особенно если нужно расставить коэффициенты. Справиться с такими заданиями поможет консультация эксперта: «Химия, 11 класс. Окислительно-восстановительные реакции в органической химии».
Задания 34 и 35
Самыми трудными для выполнения являются задания 34 и 35 – это расчетные задачи с химическим содержанием.
Ошибки в задании 35 чаще всего случаются из-за неправильного определения структурной формулы. Обычно это связано с недостаточным знанием химических свойств органических веществ. Поэтому здесь только один совет: стараться каждый день выполнять хотя бы одну цепочку превращений, писать уравнения реакций.
Задание 34 сложно тем, что для него нет единого алгоритма решения. Есть задачи на электролиз, смеси, атомистику, а бывает, что в условии переплетается несколько типов задач. Я бы советовала сначала отработать какой-то один тип задач, разобраться в его логике. Потом подключить задачи другого типа и понять, в чем отличие, определить последовательность действий.
При решении этих задач требуется повышенное внимание: лучше прочитать условие несколько раз, возвращаться к нему по мере выполнения задания, отмечать массы веществ, которые уходят из раствора, чтобы исключить их при нахождении массы конечного раствора.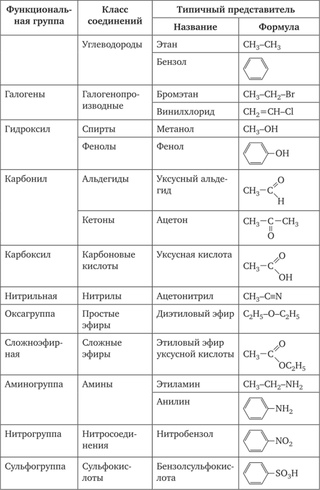 Формулы, применяемые для решения задачи 34, простые и хорошо известные, например: массовая доля равна массе растворенного вещества, деленной на массу раствора. Сложности – в деталях: при вычислении массы раствора нужно не забыть сложить все массы добавляемых веществ, вычесть массы осадков и выделившихся газов. Важно помнить, что амфотерные гидроксиды в избытке щелочи растворяются, и если в начале задачи трудно определить избыток или недостаток щелочи, можно написать два возможных уравнения – образования гидроксида и образования комплексной соли.
Формулы, применяемые для решения задачи 34, простые и хорошо известные, например: массовая доля равна массе растворенного вещества, деленной на массу раствора. Сложности – в деталях: при вычислении массы раствора нужно не забыть сложить все массы добавляемых веществ, вычесть массы осадков и выделившихся газов. Важно помнить, что амфотерные гидроксиды в избытке щелочи растворяются, и если в начале задачи трудно определить избыток или недостаток щелочи, можно написать два возможных уравнения – образования гидроксида и образования комплексной соли.
Полезные ссылки
Для успешной сдачи экзамена по химии нужно готовиться, повторять теорию и выполнять упражнения. Найти их можно в открытом банке заданий на сайте Федерального института педагогических измерений.
Также я рекомендую посмотреть видеоролики Московского образовательного телеканала, где в рубриках «Субботы московского выпускника» (совместный проект с Московским центром качества образования), «Спроси эксперта», «Учимся вместе. Я сдам ЕГЭ!» ведущие эксперты предметных комиссий разбирают задания ЕГЭ и дают рекомендации, как лучше подготовиться. А все новости, касающиеся ЕГЭ, можно найти на сайте Московского центра качества образования.
Я сдам ЕГЭ!» ведущие эксперты предметных комиссий разбирают задания ЕГЭ и дают рекомендации, как лучше подготовиться. А все новости, касающиеся ЕГЭ, можно найти на сайте Московского центра качества образования.
Источник: Activityedu.ru
Классификация органических соединений функциональным группам таблица. Классификация по строению углеродной цепи
Органические соединения наиболее часто классифицируются по двум критериям — по строению углеродного скелета молекулы или по наличию в молекуле органического соединения функциональной группы.
Классификацию органических молекул по строению углеродного скелета можно представить в виде схемы:
Ациклические
соединения – это соединения с незамкнутой
углеродной цепью. Их основу составляют
алифатические соединения (от греческого aleiphatos – масло,
жир, смола)
– углеводороды
и их производные, углеродные атомы
которых связаны между собой в открытые
неразветвленные или разветвленные
цепи.
Циклические соединения – это соединения, содержащие замкнутую цепь. Карбоциклические соединения в составе цикла содержат только атомы углерода, гетероциклические в составе цикла, кроме атомов углерода, содержат один или несколько гетероатомов (атомы N,O,S и др.).
В зависимости от природы функциональной группы производные углеводородов делят на классы органических соединений. Функциональная группа – это атом или группа атомов, как правило, неуглеводородного характера, которые определяют типичные химические свойства соединения и его принадлежность к определенному классу органических соединений. В качестве функциональной группы у ненасыщенных молекул выступают двойные или тройные связи.
Название функциональной группы | Название класса соединений | Общая формула класса |
Карбоксильная -COOH | Карбоновые кислоты | |
Сульфоновая -SO 3 H | Сульфокислоты | |
Оксогруппа (карбонильная) | Альдегиды | |
Оксогруппа (карбонильная) | ||
Гидроксильная -OH | ||
Тиольная (меркапто) -SH | Тиолы (меркаптаны) | |
F, -Cl, -Br, -I | Галогенпроизводные | |
Алкоксильная — OR | Простые эфиры | |
Алкилтиольная -SR | Тиоэфиры | |
Нитросоединения | ||
Алкосикарбонильная | Сложные эфиры | |
Амино -NH 2 | RNH 2 ,R 1 NHR 2, R 1 R 2 R 3 N | |
Карбоксамидная |
2.
 2 Принципы химической номенклатуры – систематическая номенклатура июпак. Заместительная и радикально-функциональная номенклатура
2 Принципы химической номенклатуры – систематическая номенклатура июпак. Заместительная и радикально-функциональная номенклатураНоменклатура – это система правил, позволяющая дать однозначное название соединению. В основе заместительной номенклатуры лежит выбор родоначальной структуры. Название строится как сложное слово, состоящее из корня (название родоначальной структуры), суффиксов, отражающих степень ненасыщенности, приставок и окончаний, указывающих характер, число и положение заместителей.
Родоначальная структура (родовой гидрид) – это неразветвленное ациклическое или циклическое соединение, в структуре которого к атомам углерода или других элементов присоединены только атомы водорода.
Заместитель – это функциональная (характеристическая) группа или углеводородный радикал, связанный с родоначальной структурой.
Характеристическая группа – это функциональная группа, связанная с родоначальной структурой или частично входящая в ее состав.
Главная
группа –
характеристическая группа, вводимая
при формировании названий в виде
окончания в конце названия при образовании
названий с помощью функциональных
групп.
Заместители, связанные с родоначальной структурой, делятся на два типа. Заместители 1-го типа — углеводородные радикалы и неуглеводородные характеристические группы, указываемые в названии только в приставках.
Заместители 2-го типа — характеристические группы, указываемые в названии в зависимости от старшинства либо в приставке, либо в окончании. В приведенной ниже таблице старшинство заместителей убывает сверху вниз.
Функциональная группа | Окончание | ||
Карбоновая кислота | карбокси | Карбоновая кислота | |
овая кислота | |||
Сульфоновые кислоты | сульфокислота | ||
карбонитрил | |||
Альдегиды | карбальдегид | ||
Гидрокси | |||
Меркапто | |||
*- Атом углерода
функциональной группы входит в состав
родоначальной структуры.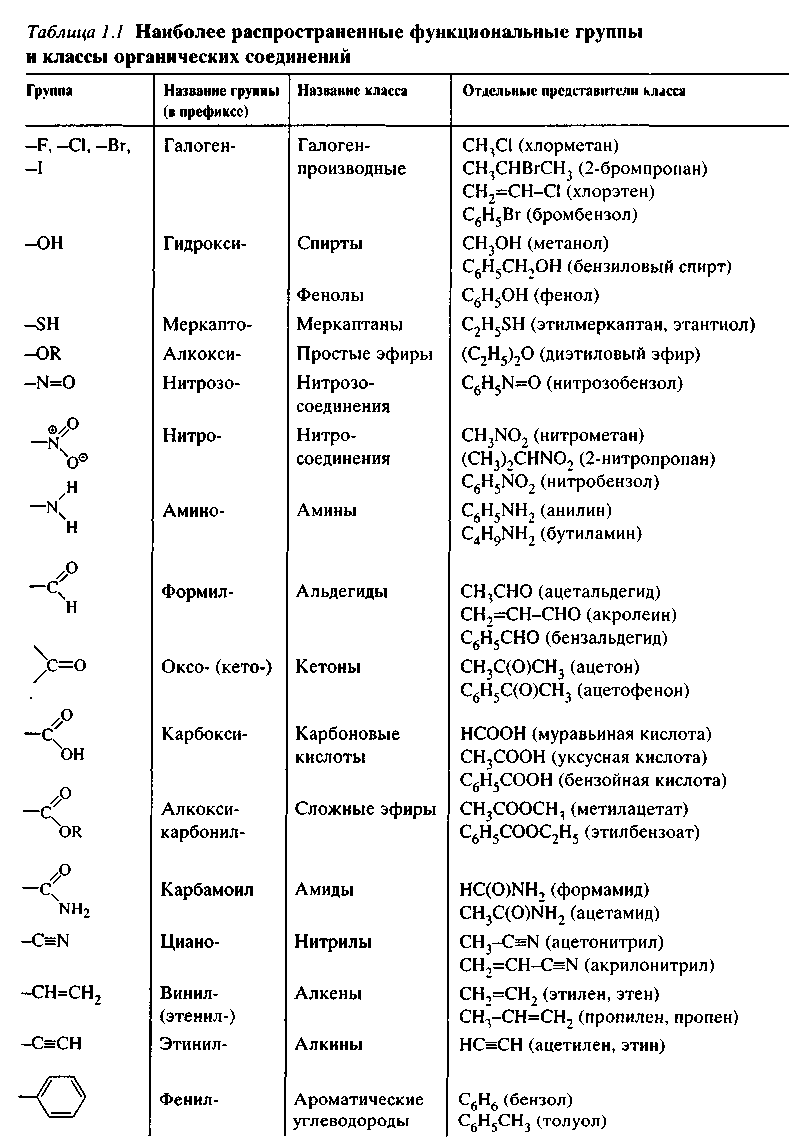
Составление названия органического соединения производится в определенной последовательности.
Определяют главную характеристическую группу, если она присутствует. Главная группа вводится в виде окончания в название соединения.
Определяют родоначальную структуру соединения. За родоначальную структуру принимают, как правило, цикл в карбоциклических и гетероциклических соединениях или главную углеродную цепь в ациклических соединениях. Главную углеродную цепь выбирают с учетом следующих критериев: 1) максимальное число характеристических групп 2-го типа, обозначаемых как префиксами, так и суффиксами; 2) максимальное число кратных связей; 3) максимальная длина цепи; 4) максимальное число характеристических групп 1-го типа, обозначаемых только префиксами. Каждый последующий критерий используют, если предыдущий критерий не приводит к однозначному выбору родоначальной структуры.
Проводят нумерацию
родоначальной структуры таким образом,
чтобы наименьший номер получила старшая
характеристическая группа.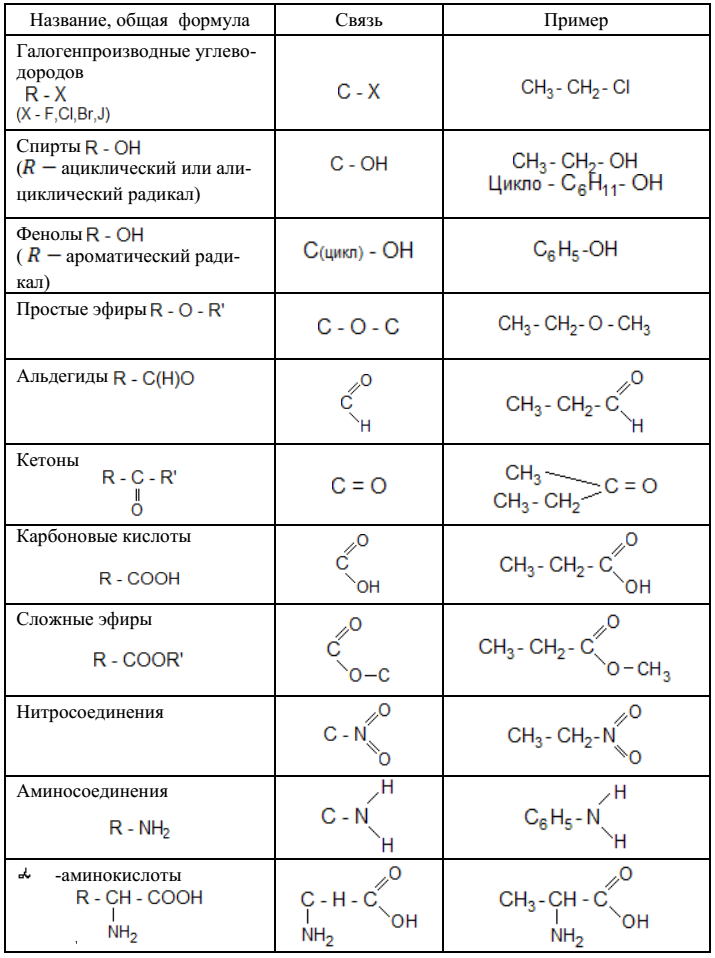 При наличии
нескольких одинаковых старших
функциональных групп родоначальную
структуру нумеруют таким образом, чтобы
заместители получили наименьшие номера.
При наличии
нескольких одинаковых старших
функциональных групп родоначальную
структуру нумеруют таким образом, чтобы
заместители получили наименьшие номера.
Называют родоначальную структуру, в названии которой старшая характеристическая группа отражается окончанием. Насыщенность или ненасыщенность родоначальной структуры отражается суффиксами –ан,-ен,-ин , которые указываются перед окончанием, которое дает старшая характеристическая группа.
Дают названия
заместителям, которые в названии
соединения отражаются в виде префиксов
и перечисляются в едином алфавитном
порядке. Множительные префиксы в едином
алфавитном порядке не учитываются.
Положение каждого заместителя и каждой
кратной связи указывают цифрами,
соответствующими номеру атома углерода,
с которым связан заместитель (для
кратной связи указывают меньший номер
атома углерода). Цифры ставят перед
приставками и после суффиксов или
окончания. Количество одинаковых
заместителей отражают в названии с
помощью множительных префиксов ди,
три, тетра, пента и т.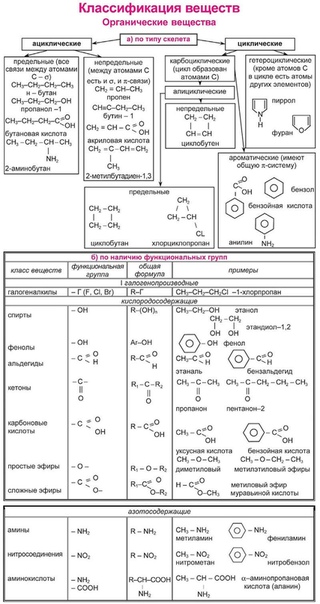 д.
д.
Название соединения формируется по схеме:
Примеры названий по заместительной номенклатуре ИЮПАК:
Радикально-функциональная номенклатура имеет ограниченное использование. Главным образом она используется при названии простых моно- и бифункциональных соединений.
Если в молекуле содержится одна функциональная группа, то название соединения формируется из названий углеводородного радикала и характеристической группы:
В случае более сложных соединений выбирают родоначальную структуру, имеющую тривиальное название. Расположение заместителей, которые указываются в приставках, производится с помощью цифр, греческих букв или приставок орто-, мета-, пара-.
2.3 Конформации соединений с открытой цепью
Соединения,
имеющие одинаковый качественный и
количественный состав, одинаковое
химическое строение, но отличающиеся
расположением в пространстве атомов и
групп атомов, называются стереоизомерами.
Конформация
– это пространственное расположение
атомов в молекуле в результате вращения
атомов или групп атомов вокруг одной
или нескольких ординарных связей.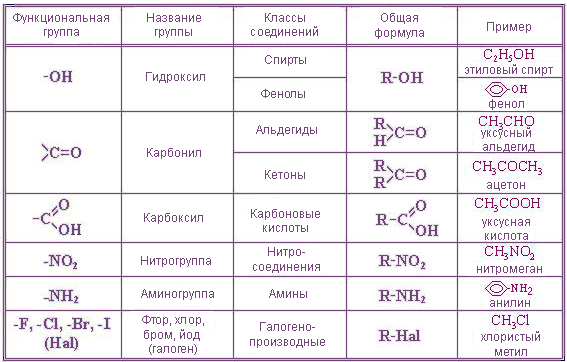 Стереоизомеры, превращающиеся друг в
друга в результате вращения вокруг
ординарной связи, называются
конформационными
изомерами.
Для их изображения на плоскости чаще
всего используют стереохимические
формулы или проекционные формулы
Ньюмена.
Стереоизомеры, превращающиеся друг в
друга в результате вращения вокруг
ординарной связи, называются
конформационными
изомерами.
Для их изображения на плоскости чаще
всего используют стереохимические
формулы или проекционные формулы
Ньюмена.
В стереохимических формулах связи, лежащие в плоскости бумаги, изображают черточкой; связи, направленные к наблюдателю, обозначают жирным клином; связи, расположенные за плоскостью (уходящие от наблюдателя), обозначают заштрихованным клином. Стереохимические формулы метана и этана могут быть представлены следующим образом:
Для получения проекционных формул Ньюмена в молекуле выбирают связь С-С, дальний от наблюдателя атом углерода обозначается окружностью, ближайший к наблюдателю атом углерода и связь С-С – точкой. Три другие связи атомов углерода на плоскости отображаются под углом 120 друг относительно друга. Стереохимические формулы этана можно представить в виде проекционных формул Ньюмена следующим образом:
Вращение относительно
ординарных связей в молекуле метана не
приводит к изменению пространственного
положения атомов в молекуле. Но в молекуле
этана в результате вращения вокруг
ординарной связи С-С изменяется
расположение в пространстве атомов,
т.е. возникают конформационные изомеры.
За минимальный угол поворота (торсионный
угол) принято считать угол 60.
Для этана, таким образом, возникают две
конформации, переходящие друг в друга
при последовательных поворотах на 60.
Эти конформации различаются по энергии.
Конформация, в которой атомы (заместители)
находятся в наиболее близком положении,
так как связи заслоняют друг друга,
называется заслоненной .
Конформация, в которой атомы (заместители)
максимально удалены друг от друга,
называется заторможенной (анти -конформация).
Для этана разница в энергиях конформаций
невелика и равна 11,7 кДж/моль, что
сопоставимо с энергией теплового
движения молекул этана. Такая небольшая
разница в энергиях конформационных
изомеров этана не позволяет их выделить
и идентифицировать при обычной
температуре. Более высокой энергией
обладает заслоненная конформация, что
обусловлено возникновением торсионных
напряжений (напряжения Питцера) —
в заимодействий,
вызванных отталкиванием противостоящих
связей.
Но в молекуле
этана в результате вращения вокруг
ординарной связи С-С изменяется
расположение в пространстве атомов,
т.е. возникают конформационные изомеры.
За минимальный угол поворота (торсионный
угол) принято считать угол 60.
Для этана, таким образом, возникают две
конформации, переходящие друг в друга
при последовательных поворотах на 60.
Эти конформации различаются по энергии.
Конформация, в которой атомы (заместители)
находятся в наиболее близком положении,
так как связи заслоняют друг друга,
называется заслоненной .
Конформация, в которой атомы (заместители)
максимально удалены друг от друга,
называется заторможенной (анти -конформация).
Для этана разница в энергиях конформаций
невелика и равна 11,7 кДж/моль, что
сопоставимо с энергией теплового
движения молекул этана. Такая небольшая
разница в энергиях конформационных
изомеров этана не позволяет их выделить
и идентифицировать при обычной
температуре. Более высокой энергией
обладает заслоненная конформация, что
обусловлено возникновением торсионных
напряжений (напряжения Питцера) —
в заимодействий,
вызванных отталкиванием противостоящих
связей. В заторможенной конформации
связи максимально удалены и взаимодействия
между ними минимальны, что и обуславливает
минимальную энергию конформации.
В заторможенной конформации
связи максимально удалены и взаимодействия
между ними минимальны, что и обуславливает
минимальную энергию конформации.
У бутана при повороте относительно связи между вторым и третьим атомами углерода возникает дополнительно скошенная конформация (гош -конформация). Кроме этого, заслоненные конформации бутана отличаются энергетически.
Заслоненная
(исходная) конформация бутана
характеризуется максимальной энергией,
что обусловлено наличием торсионных и ван-дер-ваальсовых напряжений.
Ван-дер-ваальсовы напряжения в этой
конформации возникают из-за взаимного
отталкивания объемных (в сравнении с
атомом Н) метильных групп, оказавшихся
сближенными. Такое взаимодействие
увеличивает энергию конформации, делая
ее энергетически невыгодной. При повороте
на 60
возникает скошенная конформация, в которой нет торсионных
напряжений (связи не заслоняют друг
друга), а ван-дер-ваальсовы напряжения
существенно уменьшаются за счет отдаления
метильных групп друг от друга, поэтому
энергия гош-конформации меньше на 22
кДж/моль энергии заслоненной конформации. При очередном повороте на 60
возникает заслоненная конформация, в
которой, однако, имеют место только
торсионные напряжения. Между атомом Н
и группой СН 3
не возникают ван-дер-ваальсовы напряжения
вследствии незначительного размера
атома Н. Энергия такой конформации
меньше энергии исходной заслоненной
конформации на 7,5 кДж/моль. Очередной
поворот на 60
приводит к возникновению заторможенной
конформации, в которой нет торсионных
и ван-дер-ваальсовых напряжений, так
как связи не заслоняют друг друга, а
объемные метильные группы максимально
удалены друг от друга. Энергия заторможенной
конформации минимальна, меньше энергии
исходной заслоненой конформации на
25,5 кДж/моль, а по сравнению с энергией
скошенной конформации меньше на 3,5
кДж/моль. Последующие повороты приводят
в возникновению заслоненной, скошенной
и исходной заслоненной конформаций.
При обычных условиях большинство молекул
бутана находятся в виде смеси гош- и
анти-конформеров.
При очередном повороте на 60
возникает заслоненная конформация, в
которой, однако, имеют место только
торсионные напряжения. Между атомом Н
и группой СН 3
не возникают ван-дер-ваальсовы напряжения
вследствии незначительного размера
атома Н. Энергия такой конформации
меньше энергии исходной заслоненной
конформации на 7,5 кДж/моль. Очередной
поворот на 60
приводит к возникновению заторможенной
конформации, в которой нет торсионных
и ван-дер-ваальсовых напряжений, так
как связи не заслоняют друг друга, а
объемные метильные группы максимально
удалены друг от друга. Энергия заторможенной
конформации минимальна, меньше энергии
исходной заслоненой конформации на
25,5 кДж/моль, а по сравнению с энергией
скошенной конформации меньше на 3,5
кДж/моль. Последующие повороты приводят
в возникновению заслоненной, скошенной
и исходной заслоненной конформаций.
При обычных условиях большинство молекул
бутана находятся в виде смеси гош- и
анти-конформеров.
Цель лекции: знакомство с классификацией и номенклатурой органических соединений
План:
1. Предмет и задачи органической химии. Значение её для фармации.
Предмет и задачи органической химии. Значение её для фармации.
2. Классификация органических соединений.
3. Принципы тривиальной и рациональной номенклатуры.
4. Принципы номенклатуры ИЮПАК.
Предмет и задачи органической химии.Органическая химия — это раздел химии, посвященный изучению строения, способов синтеза и химических превращений углеводородов и их функциональных производных.
Термин «органическая химия » впервые ввел шведский химик Йенс Якоб Берцеллиус в 1807 г.
Благодаря особенностям своего строения органические вещества очень многочисленны. Сегодня их число достигает 10 млн.
В настоящее время состояние органической химии таково, что позволяет научно спланировать и осуществить синтез любых сложных молекул (белков, витаминов, ферментов, лекарственных препаратов и т. д.).
Органическая химия тесно связана с фармацией. Она позволяет осуществлять выделение индивидуальных лекарственных веществ из растительного и животного сырья, синтезирует и проводит очистку лекарственного сырья, определяет структуру вещества и механизм химического действия, позволяет определять подлинность того или иного лекарственного препарата. Достаточно сказать, что 95 % лекарственных средств имеют органическую природу.
Достаточно сказать, что 95 % лекарственных средств имеют органическую природу.
В классификации принимаются за основу два важнейших признака: строение углеродного скелета и наличие в молекуле функциональных групп.
По строению углеродного скелета органические. соединения делятся на три большие группы.
I Ациклические (алифатические) соединения, имеющие открытую углеродную цепь как неразветвлённую, так и разветвлённую.
Родоначальными соединениями в органической химии признаны углеводороды , состоящие только из атомов углерода и водорода. Разнообразные органические соединения можно рассматривать как производные углеводородов, полученные введением в них функциональных групп.
Функциональной группой называют структурный фрагмент молекулы, характерный для данного класса органических соединений и определяющий его химические свойства.
Например, свойства спиртов определяются наличием гидроксогруппы (— ОН ), свойства аминов — аминогруппы (— NH 2 ), карбоновых кислот наличием в молекуле карбоксильной группы (- СООН ) и так далее.
Таблица 1 . Основные классы органических соединений
Такая классификация важна потому, что функциональные группы во многом определяют химические свойства данного класса соединений.
Если соединения содержат несколько функциональных групп и они одинаковые, то такие соединения называют полифункциональными (СН 2 ОН — СНОН — СН 2 ОН — глицерин), если молекула содержит разные функциональные группы, то это гетерофункциональное соединение (СН 3 — СН(ОН) — СООН — молочная кислота). Гетерофункциональные соединения можно сразу отнести к нескольким классам соединений.
Органических соединений много, но среди них имеются соединения с общими и сходными свойствами. Поэтому все они по общим признакам классифицированы, объединены в отдельные классы и группы. В основе классификации лежат углеводороды – соединения, которые состоят только из атомов углерода и водорода. Остальные органические вещества относятся к «Другим классам органических соединений».
Углеводороды делятся на два больших класса: ациклические и циклические соединения.
Ациклические соединения (жирные или алифатические) – соединения, молекулы которых содержат открытую (незамкнутую в кольцо) неразветвленную или разветвленную углеродную цепь с простыми или кратными связями. Ациклические соединения подразделяются на две основные группы:
насыщенные (предельные) углеводороды (алканы), у которых все атомы углерода связаны между собой только простыми связями;
ненасыщенные (непредельные) углеводороды, у которых между атомами углерода кроме одинарных простых связей, имеются также и двойные, и тройные связи.
Ненасыщенные (непредельные) углеводороды делятся на три группы: алкены, алкины и алкадиены.
Алкены (олефины, этиленовые углеводороды) – ациклические непредельные углеводороды, которые содержат одну двойную связь между атомами углерода, образуют гомологический ряд с общей формулой C n H 2n . Названия алкенов образуются от названий соответствующих алканов с заменой суффикса «-ан» на суффикс «-ен». Например, пропен, бутен, изобутилен или метилпропен.
Названия алкенов образуются от названий соответствующих алканов с заменой суффикса «-ан» на суффикс «-ен». Например, пропен, бутен, изобутилен или метилпропен.
Алкины (ацетиленовые углеводороды) – углеводороды, которые содержат тройную связь между атомами углерода, образуют гомологический ряд с общей формулой C n H 2n-2 . Названия алкенов образуются от названий соответствующих алканов с заменой суффикса «-ан» на суффикс «-ин». Например, этин (ацителен), бутин, пептин.
Алкадиены – органические соединения, которые содержат две двойные связи углерод-углерод. В зависимости от того, как располагаются двойные связи относительно друг друга диены делятся на три группы: сопряженные диены, аллены и диены с изолированными двойными связями. Обычно к диенам относят ациклические и циклические 1,3-диены, образующие с общими формулами C n H 2n-2 и C n H 2n-4 . Ациклические диены являются структурными изомерами алкинов.
Циклические соединения в свою очередь делятся на две большие группы:
- карбоциклические соединения – соединения, циклы которых состоят только из атомов углерода; Карбоциклические соединения подразделяются на алициклические – насыщенные (циклопарафины) и ароматические;
- гетероциклические соединения – соединения, циклы которых состоят не только из атомов углерода, но атомов других элементов: азота, кислорода, серы и др.

В молекулах как ациклических, так и циклических соединений атомы водорода можно замещать на другие атомы или группы атомов, таким образом, с помощью введения функциональных групп можно получать производные углеводородов. Это свойство ещё больше расширяет возможности получения различных органических соединений и объясняет их многообразие.
Наличие тех или иных групп в молекулах органических соединений обуславливает общность их свойств. На этом основана классификация производных углеводородов.
К «Другим классам органических соединений» относятся следующие:
Спирты получаются замещением одного или нескольких атомов водорода гидроксильными группами – OH. Это соединение с общей формулой R – (OH) х, где х – число гидроксильных групп.
Альдегиды содержат альдегидную группу (С = О), которая всегда находится в конце углеводородной цепи.
Карбоновые кислоты содержат в своём составе одну или несколько карбоксильных групп – COOH.
Сложные эфиры – производные кислородосодержащих кислот, которые формально являются продуктами замещения атомов водорода гидроокислов – OH кислотной функции на углеводородный остаток; рассматриваются также как ацилпроизводные спиртов.
Жиры (триглицериды) – природные органические соединения, полные сложные эфиры глицерина и односоставных жирных кислот; входят в класс липидов. Природные жиры содержат в своём составе три кислотных радикала с неразветвлённой структурой и, обычно, чётное число атомов углерода.
Углеводы – органические вещества, которые содержат содержащими неразветвленную цепь из нескольких атомов углерода, карбоксильную группу и несколько гидроксильных групп.
Амины содержат в своём составе аминогруппу – NH 2
Аминокислоты – органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Белки – высокомолекулярные органические вещества, которые состоят состоящие из альфа – аминокислот, соединённых в цепочку пептидной связью.
Нуклеиновые кислоты – высокомолекулярные органические соединения, биополимеры, образованные остатками нуклеотидов.
Остались вопросы? Хотите знать больше о классификации органических соединений?
Чтобы получить помощь репетитора – зарегистрируйтесь .
Первый урок – бесплатно!
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Видеоурок:
Лекция: Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
Классификация органических веществ
В основе классификации органических веществ лежит теория А.М. Бутлерова. В таблице показана классификация органических веществ в зависимости от типа строения углеродной цепи, т.е. по типу углеродного скелета:
Ациклические соединения — это органические вещества, в молекулах которых атомы углерода соединены друг с другом в прямые, а так же разветвленные открытые цепи.
К ациклическим, например, относится этан:
или ацетилен:
Иначе подобные соединения называются алифатическими или соединениями жирного ряда, потому что первые соединения данного ряда органических веществ были получены из растительных или животных жиров. Из ациклических соединений выделяются:
Предельные (или насыщенные) — данные соединения содержат в углеродном скелете одинарные ковалентные неполярные углерод-углеродные С-С и слабополярные С-Н связи, это алканы .
Общая молекулярная формула алканов — C n H 2n+2 , где n — количество атомов углерода в молекуле углеводорода. К ним относятся открытые цепи, а также замкнутые (циклические) углеводороды. Все атомы углерода в алканах имеют sp 3 — гибридизацию . Запомните следующие алканы:
Метан — СH 4
Этан — C 2 H 6: CH 3 -CH 3
Пропан — C 3 H 8: CH 3 -CH 2 -CH 3
Бутан — C 4 H 10: CH 3 -(CH 2) 2 -CH 3
Пентан — C 5 H 12: CH 3 -(CH 2) 3 -CH 3
Гексан — C 6 H 14: CH 3 -(CH 2) 4 -CH 3
Гептан — C 7 H 16: CH 3 -(CH 2) 5 -CH 3
Октан — C 8 H 18: CH 3 -(CH 2) 6 -CH 3
Нонан — C 9 H 20: CH 3 -(CH 2) 7 -CH 3
Декан — C 10 H 22: CH 3 -(CH 2) 8 -CH 3
Непредельные (или ненасыщенные) — содержат кратные — двойные (С=С) или тройные (С≡С) связи, это алкены, алкины и алкадиены:
1) А лкены — содержат одну углерод-углеродную связь, которая является двойной C=C. Общая формула — C n H 2n . Атомы углерода в данных соединениях имеют sp 2 — гибридизацию . Связь C=C имеет π-связь и σ-связь, поэтому алкены более химически активны, чем алканы. Запомните следующие алкены:
Общая формула — C n H 2n . Атомы углерода в данных соединениях имеют sp 2 — гибридизацию . Связь C=C имеет π-связь и σ-связь, поэтому алкены более химически активны, чем алканы. Запомните следующие алкены:
Этен (этилен) — C 2 H 4: CH 2 =CH 2
Пропен (пропилен) — C 3 H 6: СН 2 =СН-СН 3
Бутен — С 4 Н 8: бутен-1 СН 3 -СН 2 -СН=СН, бутен-2 СН 3 -СН=СН-СН 3 , изобутен [СН 3 ] 2 С=СН 2
Пентен — C 5 H 10: 1-пентен CH 3 -CH 2 -CH 2 -CH=CH 2 , 2-пентен C 2 H 5 CH=CHCH 3
Гексен — C 6 H 12: 1-гексен CH 2 =CH-CH 2 -CH 2 -CH 2 -CH 3 , цис— гексен-2 CH 3 -CH=CH-CH 2 -CH 2 -CH 3 и другие изомеры.
Гептен — C 7 H 14: 1-гептен СН 2 =СН-СН 2 -СН-СН 2 -СН 2 -СН 3 , 2-гептен СН 3 -СН=СН-СН 2 -СН 2 -СН 2 -СН 3 и др.
Октен — C 8 H 16: 1-октен СН 2 =СН-СН 2 -СН 2 -СН 2 -СН 2 -СН 2 -СН 3 , 2-октен СН 3 -СН=СН-СН 2 -СН 2 -СН 2 -СН 2 -СН 3 и др.
Нонен — C 9 H 18: 3-нонен CH 3 -CH 2 -CH=CH-CH 2 -CH 2 -CH 2 -CH 2 -CH 3 , 5-нонен CH 3 -CH 2 -CH 2 -CH 2 -CH=CH-CH 2 -CH 2 -CH 3 и др.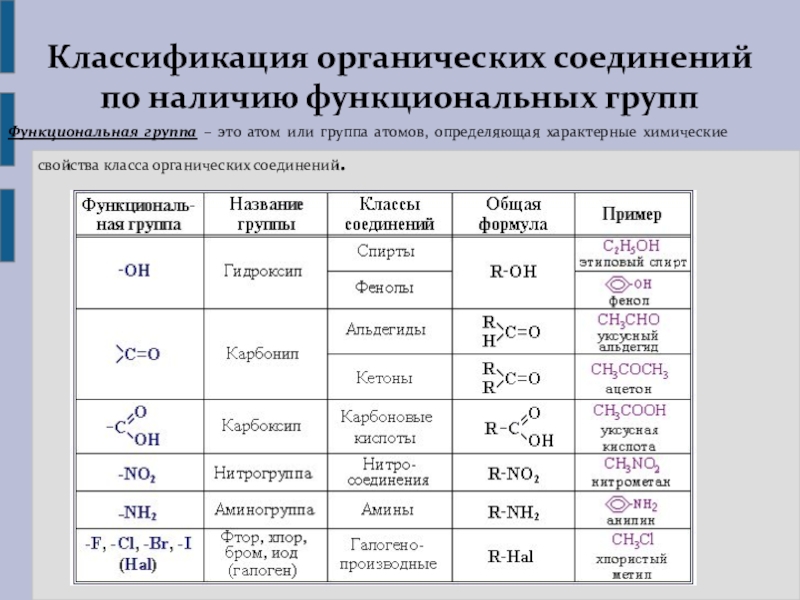
Децен — C 10 H 20: 2-децен СН 3 -СН 2 -СН 2 -СН 2 -СН 2 -СН 2 -СН 2 -СН=СН-СН 3 и др.
Как вы заметили, названия алкенов схожи с названиями алканов, с разницей суффикса. Названия алканов имеют суффикс -ан , а алкенов суффикс -ен . Кроме того среди перечисленных алкенов отсутствует метен. Запомните, метена не существует, потому что метан имеет только один углерод. А для образования алкенов, обязательно образование двойных связей.
Местоположение двойной связи обозначается цифрой, например, 1-бутен: СН 2 =СН–СН 2 –СН 3 или 1-гексен: СН 3 –СН 2 –СН 2 –СН 2 –СН=СН 2 . Обратите внимание на данное правило: нумерация углеводородных цепей должна производиться так, чтобы двойные связи находились под наименьшим номером, например, 2-гексен:
2) А лкины – в молекулах присутствует одна тройная С≡С связь. Общая формула — C n H 2n-2 . В названиях алкинов
суффикс -ан
заменен на
-ин.
Например, 3-гептин: СН 3 –СН 2 –СН 2 –С≡С–СН 2 –СН 3 .
Для этина НС≡СН возможно и тривиальное название ацетилен. Указание положения тройной связи производится также как в предыдущем случае с алкенами. Если в соединении тройных связей больше одной, то к названию прибавляется суффикс -диин
или -триин
. Если же в соединении присутствуют и двойные, и тройные связи, то их нумерацию определяет двойная связь, следовательно, называют сначала двойную, затем тройную связи. Например, гексадиен-1,3-ин-5: СН 2 =СН–СН 2 =СН 2 –С≡СН.
Указание положения тройной связи производится также как в предыдущем случае с алкенами. Если в соединении тройных связей больше одной, то к названию прибавляется суффикс -диин
или -триин
. Если же в соединении присутствуют и двойные, и тройные связи, то их нумерацию определяет двойная связь, следовательно, называют сначала двойную, затем тройную связи. Например, гексадиен-1,3-ин-5: СН 2 =СН–СН 2 =СН 2 –С≡СН.
3) А л кадиены – в молекулах присутствуют две двойные С=С связи. Общая формула — C n H 2n-2, такая же, как и у алкинов. Алкины и алкадиены относятся к межклассовым изомерам. К примеру, 1,3-бутадиен или дивинил C 4 H 6: СН 2 =СН-СН=СН 2 .
Циклические соединения — это органические вещества , в молекулах которых содержится три или более связанных в замкнутое кольцо атомов, образующих циклы.
Предельные циклические углеводороды называются циклоалканами. Их о
бщая формула — C n H 2n . В молекулах имеется замкнутая цепь или кольца. К примеру, циклопропан (C 3 H 6):
К примеру, циклопропан (C 3 H 6):
и циклобутан (C 4 H 8):
В зависимости от того, какими атомами были образованы циклы, данный вид соединений подразделяется на карбоциклические и гетероциклические.
Карбоциклические , которые иначе называются гомоциклическими, содержат в циклах только атомы углерода. В свою очередь, они делятся на алифатические и ароматические.
Алициклические (алифатические) соединения отличаются тем, что атомы углерода могут соединяться между собой в прямые, разветвлённые цепочки или кольца одинарными, двойными или тройными связями.
Типичным алифатическим соединением является циклогексен:
Ароматические соединения получили свое название благодаря ароматному запаху вещества. Иначе называются аренами. Они отличаются наличием в соединении бензольного кольца:
Таких колец в составе может быть несколько. Например, нафталин:
Также данная группа соединений имеет в составе ароматическую систему, что характеризует высокую устойчивость и стабильность соединения. Ароматичная система, содержит в кольце 4n+2 электронов (где n = 0, 1, 2, …). Данной группе органических веществ свойственно вступать в реакции замещения, а не присоединения.
Ароматичная система, содержит в кольце 4n+2 электронов (где n = 0, 1, 2, …). Данной группе органических веществ свойственно вступать в реакции замещения, а не присоединения.
Ароматические соединения могут иметь функциональную группу, прикрепленную непосредственно к кольцу. Например, толуол:
Гетероциклические соединения всегда содержат в составе углеводородного цикла один или несколько гетероатомов, которыми являются атомы кислорода, азота или серы. Если гетероатомов пять, то соединения называются пятичленными, если шесть, соответственно шестичленными. Примером гетероциклического соединения является пиридин:
Классификация производных углеводорода
Другие органические вещества рассматривают исключительно как производные углеводородов, которые образуются при введении в молекулы углеводородов функциональных групп, включающих в себя другие химические элементы. Формулу соединений, имеющих одну функциональную группу, можно записать как R — X . Где R – углеводородный радикал (фрагмент молекулы углеводорода без одного или нескольких атомов водорода; Х – функциональная группа. По наличию функциональных групп углеводороды подразделяются на:
Где R – углеводородный радикал (фрагмент молекулы углеводорода без одного или нескольких атомов водорода; Х – функциональная группа. По наличию функциональных групп углеводороды подразделяются на:
Галогенпроизводные — судя из названия ясно, что в данных соединениях атомы водорода замещены на атомы какого-либо галогена.
Спирты и фенолы. В спиртах атомы водорода замещены на гидроксильную группу -OH. По количеству таких групп, спирты подразделяются на одноатомные и многоатомные, среди которых двухатомные, трехатомные и т.д.
Формула одноатомных спиртов: C n H 2n +1OH или C n H 2n +2O .
Формула многоатомных спиртов: C n H 2n +2O x ; x – атомность спирта.
Спирты могут быть и ароматическими. Формула одноатомных ароматических спиртов: C n H 2n -6O .
Следует помнить, что производные ароматических углеводородов, в которых на гидроксильные группы заменены один/несколько атомов водорода не относятся к спиртам. Данный тип относят к классу фенолов. Причина, по которой фенолы не относят к спиртам, содержится в их специфических химических свойствах. Одноатомные фенолы изомерны одноатомным ароматическим спиртам. То есть они так же имеют общую молекулярную формулу C n H 2n -6O .
Данный тип относят к классу фенолов. Причина, по которой фенолы не относят к спиртам, содержится в их специфических химических свойствах. Одноатомные фенолы изомерны одноатомным ароматическим спиртам. То есть они так же имеют общую молекулярную формулу C n H 2n -6O .
Амины — производные аммиака, в которых один, два или три атома водорода заменены на углеводородный радикал. Амины, в которых только один атом водорода замещен на углеводородный радикал, то есть имеющие общую формулу R-NH 2 , именуют первичными аминами. Амины, в которых, два атома водорода заменены на углеводородные радикалы, именуют вторичными. Их формула — R-NH-R’ . Следует помнить, что радикалы R и R’ могут быть как одинаковые, так и разные. Если все три атома водорода молекулы аммиака замещены на углеводородный радикал, то амины являются третичными. При этом R, R’, R’’ могут быть как полностью одинаковыми, так и разными. Общая формула первичных, вторичных и третичных предельных аминов — C n H 2n +3N .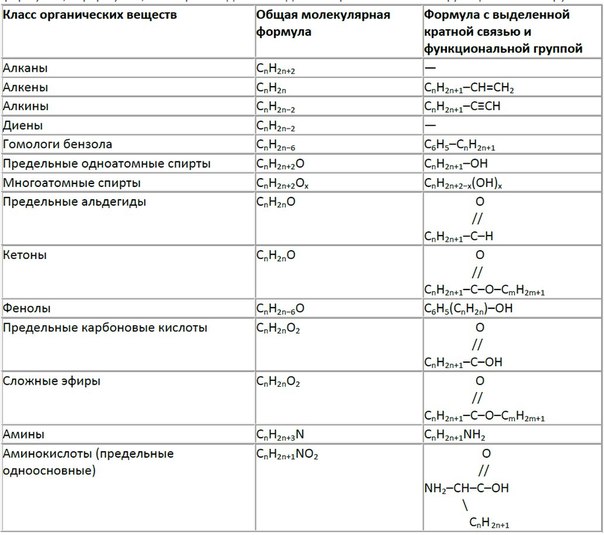 Ароматические амины с одним непредельным заместителем имеют формулу C n H 2n -5N.
Ароматические амины с одним непредельным заместителем имеют формулу C n H 2n -5N.
Альдегиды и кетоны. У альдегидов при первичном атоме углерода два атома водорода замещены на один атом кислорода. То есть в их структуре имеется альдегидная группа – СН=О. Общая формула — R-CH=O . У кетонов при вторичном атоме углерода два атома водорода замещены на атом кислорода. То есть это соединения, в структуре которых есть карбонильная группа –C(O)-. Общая формула кетонов: R-C(O)-R ’. При этом радикалы R, R’ могут быть как одинаковыми, так и разными. Альдегиды и кетоны достаточно схожи по строению, но их все-таки различают как классы, так как они имеют существенные различия в химических свойствах. Общая формула предельных кетонов и альдегидов имеет вид: C n H 2n O .
Карбоновые кислоты содержат карбоксильную группу –COOH. В случае, когда кислота содержит две карбоксильные группы, такую кислоту именуют дикарбоновой кислотой. Предельные монокарбоновые кислоты (с одной группой -COOH) имеют общую формулу — C n H 2n O 2 . Ароматические монокарбоновые кислоты имеют общую формулу C n H 2n -8O 2 .
Предельные монокарбоновые кислоты (с одной группой -COOH) имеют общую формулу — C n H 2n O 2 . Ароматические монокарбоновые кислоты имеют общую формулу C n H 2n -8O 2 .
Простые эфиры – органические соединения, в которых два углеводородных радикала опосредованно соединены через атом кислорода. То есть, имеют формулу вида: R-O-R’ . При этом радикалы R и R’ способны быть как одинаковыми, так и разными. Формула предельных простых эфиров — C n H 2n +1OH или C n H 2n +2О .
Сложные эфиры – класс соединений на основе органических карбоновых кислот, у которых атом водорода в гидроксильной группе заменен на углеводородный радикал R.
Нитросоединения – производные углеводородов, в которых один или несколько атомов водорода замещены на нитрогруппу –NO 2 . Предельные нитросоединения с одной нитрогруппой имеют формулу C n H 2n +1NO 2 .
Аминокислоты имеют в структуре одновременно две функциональные группы – амино NH 2 и карбоксильную – COOH. Например: NH 2 -CH 2 -COOH. Предельные аминокислоты, имеющие одну карбоксильную и одну аминогруппу изомерны соответствующим предельными нитросоединениям то есть, имеют общую формулу C n H 2n +1NO 2 .
Например: NH 2 -CH 2 -COOH. Предельные аминокислоты, имеющие одну карбоксильную и одну аминогруппу изомерны соответствующим предельными нитросоединениям то есть, имеют общую формулу C n H 2n +1NO 2 .
Номенклатура органических соединений
Номенклатура соединения делится на 2 типа:
тривиальную и
систематическую.
Тривиальная — это исторически первая номенклатура, возникшая в самом начале развития органической химии. Названия веществ носили ассоциативный характер, например, щавелевая кислота, мочевина, индиго.
Создание систематической, т.е. международной номенклатуры началось с 1892 года. Тогда была начата Женевская номенклатура, которую с 1947 и по сегодняшний день продолжает ИЮПАК (IUPAC — международная единая химическая номенклатура). Согласно систематической номенклатуре названия органических соединений составляются из корня, обозначающего длину основной цепи, т.е. соединенных в неразветвленную цепь атомов углеродов, а также приставок и суффиксов, обозначающих наличие и расположение заместителей, функциональных групп и кратных связей.
Систематическая номенклатура алкенов
Органические соединения классифицируют по двум основным признакам: строению углеродного скелета и функциональным группам.
По строению углеродного скелета различают ациклические, карбоциклические и гетероциклические соединения.
Ациклические соединения – содержат открытую цепь атомов углерода.
Карбоциклические соединения – содержат замкнутую цепь углеродных атомов и подразделяются на алициклические и ароматические. К алициклическим относятся все карбоциклические соединения, кроме ароматических. Ароматические соединения содержат циклогексатриеновый фрагмент (бензольное ядро).
Гетероциклические соединения — содержат циклы, включающие наряду с атомами углерода один или несколько гетероатомов.
По природе функциональных групп органические соединения делят на классы .
Таблица 2.1. Основные классы органических соединений.
Функциональная группа | Класс соединений | Общая формула |
Отсутствует | Углеводороды | |
Галоген F, -Cl, -Br, -I (–Hal) | Галогенпроизводные | R-Hal |
Гидроксильная | Спирты и фенолы | R-OH |
Алкоксильная | Простые эфиры | R-OR |
Амино NH 2 , >NH, >N- | Амины | RNH 2 , R 2 NH, R 3 N |
Нитро | Нитросоединения | RNO 2 |
Карбонильная | Альдегиды и кетоны | |
Карбоксильная | Карбоновые кислоты | |
Алкоксикарбонильная | Сложные эфиры | |
Карбоксамидная | Амиды карбоновых кислот | |
Тиольная | Тиолы | R-SH |
Сульфо | Сульфокислоты | R-SO 3 H |
2. Номенклатура органических соединений.
Номенклатура органических соединений.
В настоящее время в органической химии общепринятой является систематическая номенклатура, разработанная Международным союзом чистой и прикладной химии (IUPAC ). Наряду с ней сохранились и используются тривиальная и рациональная номенклатуры.
Тривиальная номенклатура состоит из исторически сложившихся названий, которые не отражают состава и строения вещества. Они являются случайными и отражают природный источник вещества (молочная кислота, мочевина, кофеин), характерные свойства (глицерин, гремучая кислота), способ получения (пировиноградная кислота, серный эфир), имя первооткрывателя (кетон Михлера, углеводород Чичибабина), область применения (аскорбиновая кислота). Преимуществом тривиальных названий являетсяих лаконичность, поэтому употребление некоторых из них разрешено правилами IUPAC.
Систематическая номенклатура является научной и отражает
состав, химическое и пространственное строение соединения. Название соединения
выражается при помощи сложного слова, составные части которого отражают
определенные элементы строения молекулы вещества. В основе правил номенклатуры
IUPAC лежат принципы заместительной номенклатуры , согласно которой
молекулы соединений рассматриваются как производные углеводородов, в которых
атомы водорода замещены на другие атомы или группы атомов. При построении
названия в молекуле соединения выделяют следующие структурные элементы.
Название соединения
выражается при помощи сложного слова, составные части которого отражают
определенные элементы строения молекулы вещества. В основе правил номенклатуры
IUPAC лежат принципы заместительной номенклатуры , согласно которой
молекулы соединений рассматриваются как производные углеводородов, в которых
атомы водорода замещены на другие атомы или группы атомов. При построении
названия в молекуле соединения выделяют следующие структурные элементы.
Родоначальная структура – главная цепь углеродная цепь или циклическая структура в карбо- и гетероциклах.
Углеводородный радикал – остаток формульного обозначения углеводорода со свободными валентностями (см. таблицу 2.2).
Характеристическая группа – функциональная группа, связанная с родоначальной структурой или входящая в ее состав (см. таблицу 2.3).
При составлении названия последовательно выполняют следующие правила.
- Определяют старшую
характеристическую группу и указывают ее обозначение в суффиксе (см.
 таблицу 2.3).
таблицу 2.3). - Определяют родоначальную структуру по следующим критериям в порядке падения старшинства: а) содержит старшую характеристическую группу; б) содержит максимальное число характеристических групп; в) содержит максимальное число кратных связей; г) имеет максимальную длину. Родоначальную структуру обозначают в корне названия в соответствии с длиной цепи или размером цикла: С 1 – “мет”, С 2 – “эт”, С 3 – “проп”, С 4 – “бут”, С 5 и далее – корни греческих числительных.
- Определяют степень насыщенности и отражают ее в суффиксе: “ан” – нет кратных связей, “ен” – двойная связь, “ин” – тройная связь.
- Устанавливают остальные заместители (углеводородные радикалы и младшие характеристические группы) и перечисляют их названия в префиксе в алфавитном порядке.
- Устанавливают
умножающие префиксы – “ди”, “три”, “тетра”, указывающие число одинаковых
структурных элементов (при перечислении заместителей в алфавитном порядке
не учитываются).

- Проводят нумерацию родоначальной структуры так, чтобы старшая характеристическая группа имела наименьший порядковый номер. Локанты (цифры) ставят перед названием родоначальной структуры, перед префиксами и перед суффиксами.
Таблица 2.2. Названия алканов и алкильных радикалов, принятые
систематической номенклатурой IUPAC.
Алкан | Название | Алкильный радикал | Название |
CH 4 | Метан | СН 3 — | Метил |
CH 3 CH 3 | Этан | CH 3 CH 2 — | Этил |
Пропан | CH 3 CH 2 CH 2 — | Пропил | |
Изопропил | |||
CH 3 CH 2 СН 2 CH 3 | н-Бутан | CH 3 CH 2 СН 2 CH 2 — | н- Бутил |
втор- Бутил | |||
Изобутан | Изобутил | ||
трет- Бутил | |||
CH 3 CH 2 СН 2 CH 2 СН 3 | н-Пентан | CH 3 CH 2 СН 2 CH 2 СН 2 — | н- Пентил |
Изопентан | Изопентил | ||
Неопентан | Неопентил |
Таблица 2.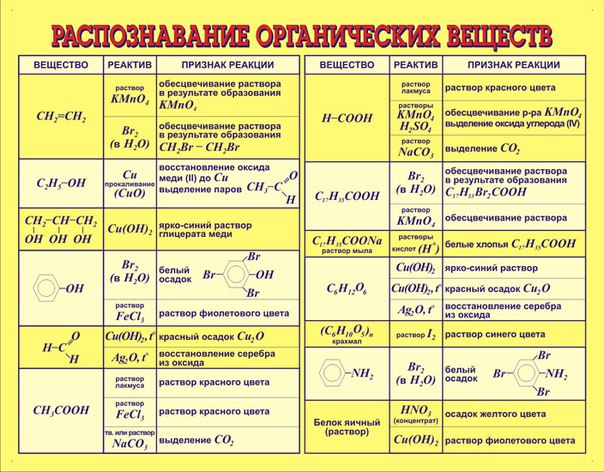 3. Названия характеристических групп (перечислены в порядке
убывания старшинства).
3. Названия характеристических групп (перечислены в порядке
убывания старшинства).
Группа | Название | |
в префиксе | в суффиксе | |
-(C)OOH * | овая кислота | |
COOH | карбокси | карбоновая кислота |
SO 3 H | сульфо | сульфоновая кислота |
-(C)HO | оксо | аль |
формил | карбальдегид | |
>(C)=O | оксо- | он |
ОН | гидрокси | ол |
меркапто | тиол | |
NH 2 | амино | амин |
OR ** | алкокси, арокси | |
F, -Cl, -Br, -I | фтор, хлор, бром, иод | |
NO 2 | нитро | |
*
Атом углерода, заключенный в скобки, входит в состав родоначальной
структуры.
** Алкокси-группы и все следующие за ними перечисляются в префиксе по алфавиту и не имеют порядка старшинства.
Рациональная (радикально-функциональная) номенклатура и спользуется для названий простых моно- и бифункциональных соединений и некоторых классов природных соединений. Основу названия составляет название данного класса соединений или одного из членов гомологического ряда с указанием заместителей. В качестве локантов, как правило, используются греческие буквы.
Шпаргалки по химии. — Инженерный справочник DPVA.ru / Технический справочник ДПВА / Таблицы для инженеров (ex DPVA-info)
| Оксиды. Соли. Кислоты. Классификация, свойства, получение. Ряд напряжений металлов. Гидролиз. | Основания. Классификация, свойства, получение. Электролитическая диссоциация. Таблица растворимости кислот, оснований и солей. | Строение атома, периодическая система Менделлева, таблица Менделеева. | Химическая связь. Ионная, ковалентная, металлическая, водородная химические связи. Классификация химических реакций. Реакции — ионного обмена, окислительно-восстановительные, термохимические, обратимые и необратимые. Ионная, ковалентная, металлическая, водородная химические связи. Классификация химических реакций. Реакции — ионного обмена, окислительно-восстановительные, термохимические, обратимые и необратимые. |
| Органическая химия. Гибридизация. Химические связи в органических веществах, их характеристики. Типы химических реакций — замещение, присоединение, отщепление (элиминирование), перегруппировка (изомеризация), окисления и восстановления. | Теория Бутлерова. Виды изомерии. Пространственная изомерия, Структурная изомерия, основные классы органических веществ — углеводороды, кислородосодержащие, серосодержащие, азотосодержащие. | ||
Растворимость оснований, кислот и солей в воде. Относительные молекулярные массы неорганических солей, оснований, кислот, оксидов. Относительные молекулярные массы органических веществ. Ряд электроотрицательностей. Ряд анионов Относительные молекулярные массы органических веществ. Ряд электроотрицательностей. Ряд анионов |
Классификация химических реакций по типам и видам | Периодический закон в современной формулировке. Периодическая система. Физический смысл периодического закона. Структура. | |
| Строение вещества. Ядерная модель строения атома. Состояние электрона в атоме. Заполнение электронами орбиталей, принцип наименьшей энергии, правило Клечковского, принцип Паули, правило Хунда | Важнейшие классы неорганических веществ. Оксиды. Гидроксиды. Соли. Кислоты, основания, амфотерные вещества. Важнейшие кислоты и их соли. Генетическая связь важнейших классов неорганических веществ. | ||
| Химия металлов. Щелочные металлы. Элементы IIА группы. Алюминий. Железо | Химия неметаллов. Галогены. Сера. Азот. Углерод. Инертные газы Галогены. Сера. Азот. Углерод. Инертные газы |
Закономерности течения химических реакций | — — — — — — — — — |
| — — — — — — — — — | |||
| Химическая связь. Понятия.Правило октета. Металлы и неметаллы. Гибридизация электронных орбиталей. Валентные электроны, понятие валентности, понятие электроотрицательности. | Виды химической связи. Ковалентная связь (механизмы образования, характеристики, полярная, неполярная. Ионная связь. Степень окисления. Металлическая связь. Водородная связь | ||
|
Растворы. Электролитическая диссоциация. Понятия, растворимость, электролитическая диссоциация, теория электролитическoй диссоциации, степень диссоциации, диссоциация кислот, оснований и солей, нейтральная, щелочная и кислая среда |
Реакции в растворах электролитов + Окислительно-восстановительные реакции. (Реакции ионного обмена. Образование малорастворимого вещества. Образование газообразного вещества. Образование малодиссоциирующего вещества. Гидролиз водных растворов солей. Окислитель. Восстановитель.) (Реакции ионного обмена. Образование малорастворимого вещества. Образование газообразного вещества. Образование малодиссоциирующего вещества. Гидролиз водных растворов солей. Окислитель. Восстановитель.) |
||
|
Важнейшие производные углеводородов: спирты, фенолы, карбонильные соединения, карбоновые кислоты, амины, аминокислоты |
— — — — — — — — — | ||
| — — — — — — — — — | |||
Молекулярный состав клеток — Клетка
Клетки состоят из воды, неорганических ионов и углеродсодержащих (органических) молекул. Вода — самая распространенная молекула в клетках, составляющая 70% или более от общей клеточной массы. Следовательно, взаимодействие между водой и другими составляющими клетки имеет центральное значение в биологической химии. Важнейшим свойством воды в этом отношении является то, что это полярная молекула, в которой атомы водорода имеют небольшой положительный заряд, а кислород — небольшой отрицательный заряд ().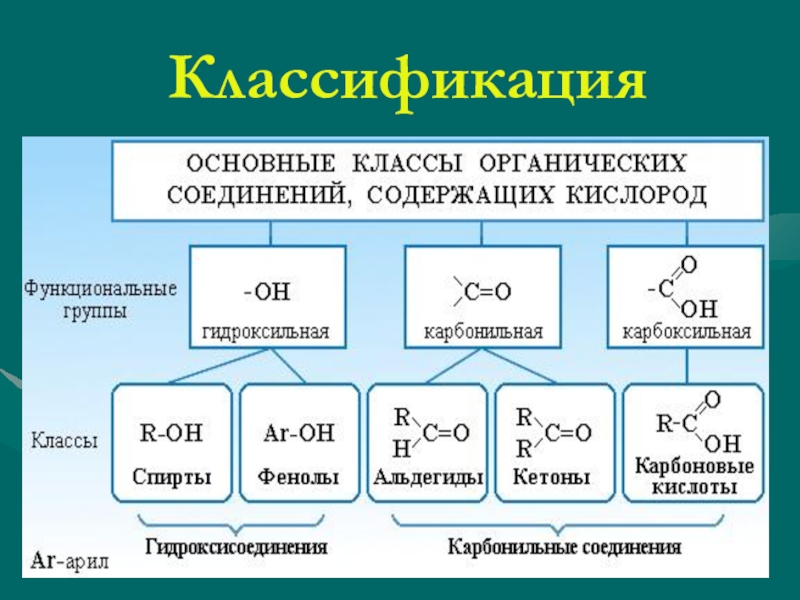 Из-за своей полярной природы молекулы воды могут образовывать водородные связи друг с другом или с другими полярными молекулами, а также взаимодействовать с положительно или отрицательно заряженными ионами. В результате этих взаимодействий ионы и полярные молекулы легко растворяются в воде (гидрофильные). Напротив, неполярные молекулы, которые не могут взаимодействовать с водой, плохо растворимы в водной среде (гидрофобны). Следовательно, неполярные молекулы стремятся минимизировать свой контакт с водой, вместо этого тесно связываясь друг с другом.Как обсуждается далее в этой главе, такие взаимодействия полярных и неполярных молекул с водой и друг с другом играют решающую роль в формировании биологических структур, таких как клеточные мембраны.
Из-за своей полярной природы молекулы воды могут образовывать водородные связи друг с другом или с другими полярными молекулами, а также взаимодействовать с положительно или отрицательно заряженными ионами. В результате этих взаимодействий ионы и полярные молекулы легко растворяются в воде (гидрофильные). Напротив, неполярные молекулы, которые не могут взаимодействовать с водой, плохо растворимы в водной среде (гидрофобны). Следовательно, неполярные молекулы стремятся минимизировать свой контакт с водой, вместо этого тесно связываясь друг с другом.Как обсуждается далее в этой главе, такие взаимодействия полярных и неполярных молекул с водой и друг с другом играют решающую роль в формировании биологических структур, таких как клеточные мембраны.
Рисунок 2.1
Характеристики воды. (A) Вода — полярная молекула с небольшим отрицательным зарядом (δ — ) на атоме кислорода и небольшим положительным зарядом (δ + ) на атомах водорода. Из-за этой полярности молекулы воды могут образовывать водородные связи (пунктир (подробнее. ..)
..)
Неорганические ионы клетки, включая натрий (Na + ), калий (K + ), магний (Mg 2+ ), кальций (Ca 2+ ), фосфат (HPO 4 2–), хлорид (Cl –) и бикарбонат (HCO 3 –) составляют 1% или менее от клеточной массы. Эти ионы участвуют во многих аспектах клеточного метаболизма и, таким образом, играют решающую роль в функционировании клетки.
Однако именно органические молекулы являются уникальными составляющими клеток.Большинство этих органических соединений относятся к одному из четырех классов молекул: углеводов, липидов, белков и нуклеиновых кислот. Белки, нуклеиновые кислоты и большинство углеводов (полисахариды) представляют собой макромолекулы, образованные путем объединения (полимеризации) сотен или тысяч низкомолекулярных предшественников: аминокислот, нуклеотидов и простых сахаров соответственно. Такие макромолекулы составляют от 80 до 90% сухой массы большинства клеток. Липиды — еще одна важная составляющая клеток. Остальная часть клеточной массы состоит из множества небольших органических молекул, в том числе макромолекулярных предшественников.Таким образом, основную химию клеток можно понять с точки зрения структур и функций четырех основных классов органических молекул.
Липиды — еще одна важная составляющая клеток. Остальная часть клеточной массы состоит из множества небольших органических молекул, в том числе макромолекулярных предшественников.Таким образом, основную химию клеток можно понять с точки зрения структур и функций четырех основных классов органических молекул.
Углеводы
Углеводы включают простые сахара, а также полисахариды. Эти простые сахара, такие как глюкоза, являются основными питательными веществами клеток. Как обсуждается далее в этой главе, их распад обеспечивает как источник клеточной энергии, так и исходный материал для синтеза других компонентов клетки. Полисахариды являются формами хранения сахаров и образуют структурные компоненты клетки.Кроме того, полисахариды и более короткие полимеры сахаров действуют как маркеры для множества процессов распознавания клеток, включая адгезию клеток к своим соседям и транспорт белков в соответствующие внутриклеточные пункты назначения.
Структуры типичных простых сахаров (моносахаридов) проиллюстрированы на. Основная формула этих молекул: (CH 2 O) n , от которой происходит название углевод (C = «углевод» и H 2 O = «гидрат»).Шестиуглеродная ( n = 6) сахарная глюкоза (C 6 H 12 O 6 ) особенно важна для клеток, поскольку она обеспечивает основной источник клеточной энергии. Другие простые сахара содержат от трех до семи атомов углерода, из которых наиболее распространены трех- и пятиуглеродные сахара. Сахара, содержащие пять или более атомов углерода, могут циклизоваться с образованием кольцевых структур, которые являются преобладающими формами этих молекул в клетках. Как показано на рисунке, циклизованные сахара существуют в двух альтернативных формах (называемых α или β), в зависимости от конфигурации углерода 1.
Основная формула этих молекул: (CH 2 O) n , от которой происходит название углевод (C = «углевод» и H 2 O = «гидрат»).Шестиуглеродная ( n = 6) сахарная глюкоза (C 6 H 12 O 6 ) особенно важна для клеток, поскольку она обеспечивает основной источник клеточной энергии. Другие простые сахара содержат от трех до семи атомов углерода, из которых наиболее распространены трех- и пятиуглеродные сахара. Сахара, содержащие пять или более атомов углерода, могут циклизоваться с образованием кольцевых структур, которые являются преобладающими формами этих молекул в клетках. Как показано на рисунке, циклизованные сахара существуют в двух альтернативных формах (называемых α или β), в зависимости от конфигурации углерода 1.
Рисунок 2.2
Структура простых сахаров. Проиллюстрированы типичные сахара, содержащие три, пять и шесть атомов углерода (триоза, пентоза и гексоза, соответственно). Сахара с пятью или более атомами углерода могут циклизоваться с образованием колец, которые существуют в двух альтернативных формах (подробнее . ..)
..)
Моносахариды могут быть соединены вместе реакциями дегидратации, в которых удаляется H 2 O, а сахара связываются посредством гликозидная связь между двумя их атомами углерода (). Если вместе соединить только несколько сахаров, полученный полимер называется олигосахаридом.Если задействовано большое количество (сотни или тысячи) сахаров, полученные полимеры представляют собой макромолекулы, называемые полисахаридами.
Рисунок 2.3
Образование гликозидной связи. Два простых сахара соединяются в результате реакции дегидратации (реакции, при которой удаляется вода). В показанном примере две молекулы глюкозы в α-конфигурации соединены связью между атомами углерода 1 и 4, которая (подробнее …)
Два обычных полисахарида — гликоген и крахмал — являются формами хранения углеводов у животных и растений. ячеек соответственно.И гликоген, и крахмал полностью состоят из молекул глюкозы в α-конфигурации (). Основная связь — между углеродом 1 одной глюкозы и углеродом 4 второй. Кроме того, как гликоген, так и одна из форм крахмала (амилопектин) содержат случайные α (1 → 6) связи, в которых углерод 1 одной глюкозы соединен с углеродом 6 второй. Как показано в, эти связи приводят к образованию разветвлений в результате соединения двух отдельных α (1 → 4) связанных цепей. Такие ответвления присутствуют в гликогене и амилопектине, хотя другая форма крахмала (амилоза) представляет собой неразветвленную молекулу.
Кроме того, как гликоген, так и одна из форм крахмала (амилопектин) содержат случайные α (1 → 6) связи, в которых углерод 1 одной глюкозы соединен с углеродом 6 второй. Как показано в, эти связи приводят к образованию разветвлений в результате соединения двух отдельных α (1 → 4) связанных цепей. Такие ответвления присутствуют в гликогене и амилопектине, хотя другая форма крахмала (амилоза) представляет собой неразветвленную молекулу.
Рисунок 2.4
Структура полисахаридов. Полисахариды — это макромолекулы, состоящие из сотен или тысяч простых сахаров. Гликоген, крахмал и целлюлоза полностью состоят из остатков глюкозы, которые соединены α (1 → 4) гликозидом (подробнее …)
Таким образом, структуры гликогена и крахмала в основном похожи, как и их функция: хранить глюкозу. Целлюлоза, напротив, выполняет совершенно отчетливую функцию в качестве основного структурного компонента стенки растительной клетки.Возможно, удивительно, что целлюлоза также полностью состоит из молекул глюкозы. Однако остатки глюкозы в целлюлозе имеют β, а не α конфигурацию, а целлюлоза является неразветвленным полисахаридом (см.). Связывание остатков глюкозы связями β (1 → 4), а не α (1 → 4) заставляет целлюлозу образовывать длинные вытянутые цепи, которые упаковываются бок о бок, образуя волокна с большой механической прочностью.
Однако остатки глюкозы в целлюлозе имеют β, а не α конфигурацию, а целлюлоза является неразветвленным полисахаридом (см.). Связывание остатков глюкозы связями β (1 → 4), а не α (1 → 4) заставляет целлюлозу образовывать длинные вытянутые цепи, которые упаковываются бок о бок, образуя волокна с большой механической прочностью.
Помимо своей роли в хранении энергии и структуре клетки, олигосахариды и полисахариды играют важную роль в различных процессах передачи сигналов в клетке.Например, олигосахариды часто связаны с белками, где они служат маркерами белков-мишеней для транспорта на поверхность клетки или включения в различные субклеточные органеллы. Олигосахариды и полисахариды также служат маркерами на поверхности клеток, играя важную роль в распознавании клеток и взаимодействии между клетками в тканях многоклеточных организмов.
Липиды
Липиды играют в клетках три основных роли. Во-первых, они обеспечивают важную форму хранения энергии.Во-вторых, что имеет большое значение для клеточной биологии, липиды являются основными компонентами клеточных мембран. В-третьих, липиды играют важную роль в передаче сигналов клетками как стероидные гормоны (например, эстроген и тестостерон), так и как молекулы-посредники, которые передают сигналы от рецепторов клеточной поверхности к мишеням внутри клетки.
В-третьих, липиды играют важную роль в передаче сигналов клетками как стероидные гормоны (например, эстроген и тестостерон), так и как молекулы-посредники, которые передают сигналы от рецепторов клеточной поверхности к мишеням внутри клетки.
Самыми простыми липидами являются жирные кислоты, которые состоят из длинных углеводородных цепей, чаще всего содержащих 16 или 18 атомов углерода, с карбоксильной группой (COO — ) на одном конце ().Ненасыщенные жирные кислоты содержат одну или несколько двойных связей между атомами углерода; в насыщенных жирных кислотах все атомы углерода связаны с максимальным числом атомов водорода. Длинные углеводородные цепи жирных кислот содержат только неполярные связи C — H, которые не могут взаимодействовать с водой. Гидрофобная природа этих цепей жирных кислот во многом определяет поведение сложных липидов, особенно при формировании биологических мембран.
Рисунок 2.5
Структура жирных кислот.Жирные кислоты состоят из длинных углеводородных цепей, оканчивающихся карбоксильной группой (COO — ). Пальмитат и стеарат — насыщенные жирные кислоты, состоящие из 16 и 18 атомов углерода соответственно. Олеат — ненасыщенная 18-углеродная жирная кислота (подробнее …)
Пальмитат и стеарат — насыщенные жирные кислоты, состоящие из 16 и 18 атомов углерода соответственно. Олеат — ненасыщенная 18-углеродная жирная кислота (подробнее …)
Жирные кислоты хранятся в форме триацилглицеринов или жиров, которые состоят из трех жирных кислот, связанных с молекулой глицерина (). Триацилглицерины нерастворимы в воде и поэтому накапливаются в цитоплазме в виде капелек жира. При необходимости их можно разделить для использования в реакциях выделения энергии, которые обсуждаются далее в этой главе.Примечательно, что жиры являются более эффективной формой хранения энергии, чем углеводы, давая более чем в два раза больше энергии на вес расщепленного материала. Таким образом, жиры позволяют накапливать энергию, составляющую менее половины массы тела, которая потребовалась бы для хранения такого же количества энергии в углеводах — что особенно важно для животных из-за их подвижности.
Рисунок 2.6
Структура триацилглицеринов. Триацилглицерины (жиры) содержат три жирные кислоты, присоединенные к глицерину. В этом примере все три жирные кислоты представляют собой пальмитат, но триацилглицерины часто содержат смесь различных жирных кислот.
В этом примере все три жирные кислоты представляют собой пальмитат, но триацилглицерины часто содержат смесь различных жирных кислот.
Фосфолипиды, основные компоненты клеточных мембран, состоят из двух жирных кислот, связанных с полярной головной группой (). В фосфолипидах глицерина две жирные кислоты связаны с атомами углерода в глицерине, как в триацилглицеринах. Однако третий углерод глицерина связан с фосфатной группой, которая, в свою очередь, часто присоединяется к другой небольшой полярной молекуле, такой как холин, серин, инозитол или этаноламин.Сфингомиелин, единственный неглицериновый фосфолипид в клеточных мембранах, содержит две углеводородные цепи, связанные с полярной головной группой, образованной из серина, а не из глицерина. Все фосфолипиды имеют гидрофобные хвосты, состоящие из двух углеводородных цепей, и гидрофильные головные группы, состоящие из фосфатной группы и ее полярных присоединений. Следовательно, фосфолипиды представляют собой амфипатические молекулы, частично растворимые в воде и частично нерастворимые в воде.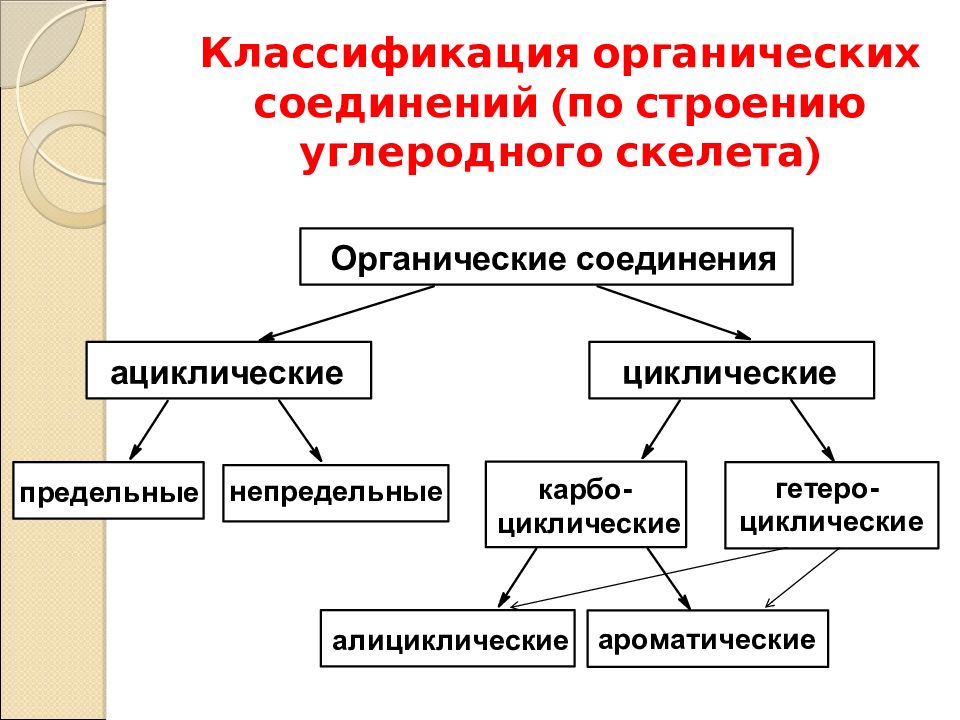 Это свойство фосфолипидов является основой для образования биологических мембран, как обсуждается далее в этой главе.
Это свойство фосфолипидов является основой для образования биологических мембран, как обсуждается далее в этой главе.
Рисунок 2.7
Структура фосфолипидов. Фосфолипиды глицерина содержат две жирные кислоты, присоединенные к глицерину. Жирные кислоты могут отличаться друг от друга и обозначаются R1 и R2. Третий углерод глицерина присоединен к фосфатной группе (образуя фосфатидную (подробнее …)
Помимо фосфолипидов, многие клеточные мембраны содержат гликолипиды и холестерин. Гликолипиды состоят из двух углеводородных цепей, связанных с полярными головными группами, которые содержат углеводы ( ).Таким образом, они похожи на фосфолипиды в их общей организации как амфипатические молекулы. Холестерин, напротив, состоит из четырех углеводородных колец, а не из линейных углеводородных цепей (). Углеводородные кольца сильно гидрофобны, но гидроксильная (ОН) группа, присоединенная к одному концу холестерина, слабо гидрофильна, поэтому холестерин также является амфипатическим.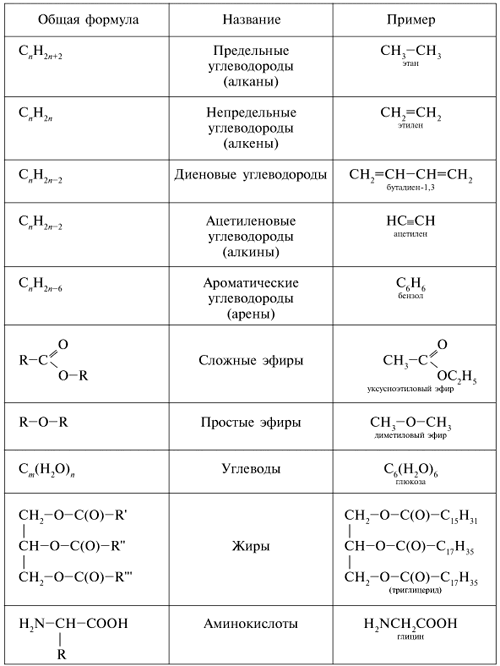
Рисунок 2.8
Структура гликолипидов. Две углеводородные цепи присоединены к полярной головной группе, образованной из серина и содержащей углеводы (например,г., глюкоза).
Рисунок 2.9
Холестерин и стероидные гормоны. Холестерин, важный компонент клеточных мембран, является амфипатической молекулой из-за его полярной гидроксильной группы. Холестерин также является предшественником стероидных гормонов, таких как тестостерон и эстрадиол (форма (подробнее …)
Помимо своей роли компонентов клеточных мембран, липиды действуют как сигнальные молекулы как внутри, так и между клетками. стероидные гормоны (например, эстрогены и тестостерон) являются производными холестерина (см.).Эти гормоны представляют собой разнообразную группу химических посредников, каждая из которых содержит четыре углеводородных кольца, к которым присоединены различные функциональные группы. Производные фосфолипидов также служат в качестве молекул-посредников внутри клеток, передавая сигналы от рецепторов клеточной поверхности к внутриклеточным мишеням (см. Главу 13).
Главу 13).
Нуклеиновые кислоты
Нуклеиновые кислоты — ДНК и РНК — являются основными информационными молекулами клетки. Дезоксирибонуклеиновая кислота (ДНК) играет уникальную роль в качестве генетического материала, который в эукариотических клетках располагается в ядре.Различные типы рибонуклеиновой кислоты (РНК) участвуют в ряде клеточных активностей. Информационная РНК (мРНК) несет информацию от ДНК к рибосомам, где она служит матрицей для синтеза белка. Два других типа РНК (рибосомная РНК и транспортная РНК) участвуют в синтезе белка. Еще другие виды РНК участвуют в процессинге и транспорте как РНК, так и белков. Помимо того, что РНК действует как информационная молекула, она также способна катализировать ряд химических реакций.В современных клетках они включают реакции, участвующие как в синтезе белка, так и в процессинге РНК.
ДНК и РНК представляют собой полимеры нуклеотидов, которые состоят из пуриновых и пиримидиновых оснований, связанных с фосфорилированными сахарами ().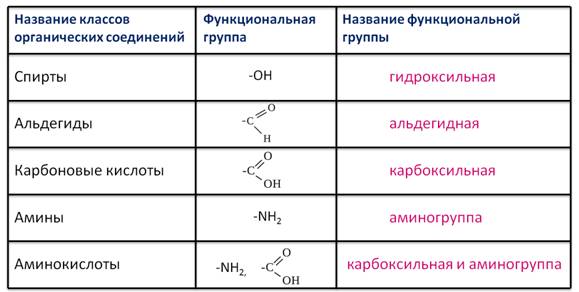 ДНК содержит два пурина (аденин и гуанин) и два пиримидина (цитозин и тимин). Аденин, гуанин и цитозин также присутствуют в РНК, но РНК содержит урацил вместо тимина. Основания связаны с сахарами ( 2 ‘-дезоксирибоза в ДНК или рибоза в РНК) с образованием нуклеозидов.Нуклеотиды дополнительно содержат одну или несколько фосфатных групп, связанных с 5′-атомом углерода нуклеозидных сахаров.
ДНК содержит два пурина (аденин и гуанин) и два пиримидина (цитозин и тимин). Аденин, гуанин и цитозин также присутствуют в РНК, но РНК содержит урацил вместо тимина. Основания связаны с сахарами ( 2 ‘-дезоксирибоза в ДНК или рибоза в РНК) с образованием нуклеозидов.Нуклеотиды дополнительно содержат одну или несколько фосфатных групп, связанных с 5′-атомом углерода нуклеозидных сахаров.
Рисунок 2.10
Компоненты нуклеиновых кислот. Нуклеиновые кислоты содержат пуриновые и пиримидиновые основания, связанные с фосфорилированными сахарами. Основание нуклеиновой кислоты, связанное только с сахаром, является нуклеозидом. Нуклеотиды дополнительно содержат одну или несколько фосфатных групп.
Полимеризация нуклеотидов с образованием нуклеиновых кислот включает образование фосфодиэфирных связей между 5′-фосфатом одного нуклеотида и 3′-гидроксилом другого ().Олигонуклеотиды — это небольшие полимеры, содержащие всего несколько нуклеотидов; большие полинуклеотиды, из которых состоят клеточные РНК и ДНК, могут содержать тысячи или миллионы нуклеотидов соответственно. Важно отметить, что полинуклеотидная цепь имеет определенное направление, причем один конец цепи заканчивается 5′-фосфатной группой, а другой — 3′-гидроксильной группой. Полинуклеотиды всегда синтезируются в направлении от 5 ‘к 3’, причем свободный нуклеотид добавляется к 3 ‘ОН-группе растущей цепи.По соглашению, последовательность оснований в ДНК или РНК также записывается в направлении от 5 ‘к 3’.
Важно отметить, что полинуклеотидная цепь имеет определенное направление, причем один конец цепи заканчивается 5′-фосфатной группой, а другой — 3′-гидроксильной группой. Полинуклеотиды всегда синтезируются в направлении от 5 ‘к 3’, причем свободный нуклеотид добавляется к 3 ‘ОН-группе растущей цепи.По соглашению, последовательность оснований в ДНК или РНК также записывается в направлении от 5 ‘к 3’.
Рисунок 2.11
Полимеризация нуклеотидов. Фосфодиэфирная связь образуется между 3′-гидроксильной группой одного нуклеотида и 5′-фосфатной группой другого. У полинуклеотидной цепи есть чувство направления, один конец заканчивается 5 ‘(подробнее …)
Информация в ДНК и РНК передается в порядке оснований в полинуклеотидной цепи. ДНК — это двухцепочечная молекула, состоящая из двух полинуклеотидных цепей, идущих в противоположных направлениях (см. Главу 3).Основания находятся внутри молекулы, и две цепи соединены водородными связями между комплементарными парами оснований — аденин в паре с тимином и гуанин с цитозином ().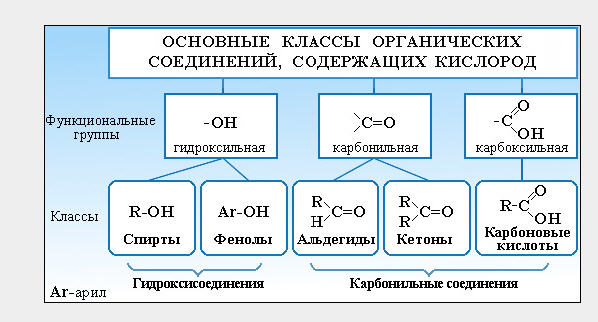 Важным следствием такого комплементарного спаривания оснований является то, что одна цепь ДНК (или РНК) может действовать как матрица для управления синтезом комплементарной цепи. Таким образом, нуклеиновые кислоты обладают уникальной способностью управлять собственной саморепликацией, что позволяет им функционировать в качестве основных информационных молекул клетки.Информация, переносимая ДНК и РНК, направляет синтез определенных белков, которые контролируют большую часть клеточной активности.
Важным следствием такого комплементарного спаривания оснований является то, что одна цепь ДНК (или РНК) может действовать как матрица для управления синтезом комплементарной цепи. Таким образом, нуклеиновые кислоты обладают уникальной способностью управлять собственной саморепликацией, что позволяет им функционировать в качестве основных информационных молекул клетки.Информация, переносимая ДНК и РНК, направляет синтез определенных белков, которые контролируют большую часть клеточной активности.
Рисунок 2.12
Комплементарное спаривание между основаниями нуклеиновых кислот. Образование водородных связей между основаниями на противоположных цепях ДНК приводит к специфическому спариванию гуанина (G) с цитозином (C) и аденина (A) с тимином (T).
Нуклеотиды важны не только как строительные блоки нуклеиновых кислот; они также играют важную роль в других клеточных процессах.Возможно, наиболее ярким примером является аденозин-5′-трифосфат (АТФ), который является основной формой химической энергии в клетках. Другие нуклеотиды аналогичным образом действуют как переносчики энергии или реактивных химических групп в широком спектре метаболических реакций. Кроме того, некоторые нуклеотиды (например, циклический АМФ) являются важными сигнальными молекулами внутри клеток (см. Главу 13).
Другие нуклеотиды аналогичным образом действуют как переносчики энергии или реактивных химических групп в широком спектре метаболических реакций. Кроме того, некоторые нуклеотиды (например, циклический АМФ) являются важными сигнальными молекулами внутри клеток (см. Главу 13).
Белки
Хотя нуклеиновые кислоты несут генетическую информацию клетки, основная ответственность белков заключается в выполнении задач, управляемых этой информацией.Белки — самые разнообразные из всех макромолекул, и каждая клетка содержит несколько тысяч различных белков, которые выполняют самые разные функции. Роли белков включают в себя выполнение функций структурных компонентов клеток и тканей, действие в транспорте и хранении малых молекул (например, перенос кислорода гемоглобином), передачу информации между клетками (например, белковых гормонов) и обеспечение защиты от инфекция (например, антитела). Однако наиболее фундаментальным свойством белков является их способность действовать как ферменты, которые, как обсуждается в следующем разделе, катализируют почти все химические реакции в биологических системах. Таким образом, белки управляют практически всей деятельностью клетки. На центральное значение белков в биологической химии указывает их название, которое происходит от греческого слова proteios , что означает «первого ранга».
Таким образом, белки управляют практически всей деятельностью клетки. На центральное значение белков в биологической химии указывает их название, которое происходит от греческого слова proteios , что означает «первого ранга».
Белки представляют собой полимеры 20 различных аминокислот. Каждая аминокислота состоит из атома углерода (называемого α-углеродом), связанного с карбоксильной группой (COO — ), аминогруппы (NH 3 + ), атома водорода и характерной боковой цепи () .Конкретные химические свойства различных боковых цепей аминокислот определяют роль каждой аминокислоты в структуре и функции белка.
Рисунок 2.13
Структура аминокислот. Каждая аминокислота состоит из центрального атома углерода (α-углерода), связанного с атомом водорода, карбоксильной группы, аминогруппы и определенной боковой цепи (обозначенной R). При физиологическом pH как карбоксил, так и амино (подробнее …)
Аминокислоты можно разделить на четыре широкие категории в соответствии со свойствами их боковых цепей (). Десять аминокислот имеют неполярные боковые цепи, которые не взаимодействуют с водой. Глицин — простейшая аминокислота, боковая цепь которой состоит только из атома водорода. Аланин, валин, лейцин и изолейцин имеют боковые углеводородные цепи, содержащие до четырех атомов углерода. Боковые цепи этих аминокислот гидрофобны и поэтому обычно располагаются внутри белков, где они не контактируют с водой. У пролина также есть углеводородная боковая цепь, но он уникален тем, что его боковая цепь связана с азотом аминогруппы, а также с α-углеродом, образуя циклическую структуру.Боковые цепи двух аминокислот, цистеина и метионина, содержат атомы серы. Метионин довольно гидрофобен, но цистеин менее гидрофобен из-за его сульфгидрильной (SH) группы. Как обсуждается ниже, сульфгидрильная группа цистеина играет важную роль в структуре белка, поскольку дисульфидные связи могут образовываться между боковыми цепями различных остатков цистеина. Наконец, две неполярные аминокислоты, фенилаланин и триптофан, имеют боковые цепи, содержащие очень гидрофобные ароматические кольца.
Десять аминокислот имеют неполярные боковые цепи, которые не взаимодействуют с водой. Глицин — простейшая аминокислота, боковая цепь которой состоит только из атома водорода. Аланин, валин, лейцин и изолейцин имеют боковые углеводородные цепи, содержащие до четырех атомов углерода. Боковые цепи этих аминокислот гидрофобны и поэтому обычно располагаются внутри белков, где они не контактируют с водой. У пролина также есть углеводородная боковая цепь, но он уникален тем, что его боковая цепь связана с азотом аминогруппы, а также с α-углеродом, образуя циклическую структуру.Боковые цепи двух аминокислот, цистеина и метионина, содержат атомы серы. Метионин довольно гидрофобен, но цистеин менее гидрофобен из-за его сульфгидрильной (SH) группы. Как обсуждается ниже, сульфгидрильная группа цистеина играет важную роль в структуре белка, поскольку дисульфидные связи могут образовываться между боковыми цепями различных остатков цистеина. Наконец, две неполярные аминокислоты, фенилаланин и триптофан, имеют боковые цепи, содержащие очень гидрофобные ароматические кольца.
Рисунок 2.14
Аминокислоты. Для каждой аминокислоты указаны трехбуквенные и однобуквенные сокращения. Аминокислоты сгруппированы в четыре категории в соответствии со свойствами их боковых цепей: неполярные, полярные, основные и кислотные.
Пять аминокислот имеют незаряженные, но полярные боковые цепи. К ним относятся серин, треонин и тирозин, которые имеют гидроксильные группы на их боковых цепях, а также аспарагин и глутамин, которые имеют полярные амидные (O = C-NH 2 ) группы.Поскольку полярные боковые цепи этих аминокислот могут образовывать водородные связи с водой, эти аминокислоты являются гидрофильными и имеют тенденцию располагаться снаружи белков.
Аминокислоты лизин, аргинин и гистидин имеют боковые цепи с заряженными основными группами. Лизин и аргинин являются очень основными аминокислотами, и их боковые цепи имеют положительный заряд в клетке. Следовательно, они очень гидрофильны и находятся в контакте с водой на поверхности белков. Гистидин может быть незаряженным или положительно заряженным при физиологическом pH, поэтому он часто играет активную роль в ферментативных реакциях, включающих обмен ионами водорода, как показано на примере ферментативного катализа, обсуждаемом в следующем разделе.
Гистидин может быть незаряженным или положительно заряженным при физиологическом pH, поэтому он часто играет активную роль в ферментативных реакциях, включающих обмен ионами водорода, как показано на примере ферментативного катализа, обсуждаемом в следующем разделе.
Наконец, две аминокислоты, аспарагиновая кислота и глутаминовая кислота, имеют кислотные боковые цепи, оканчивающиеся карбоксильными группами. Эти аминокислоты имеют отрицательный заряд внутри клетки и поэтому часто называются аспартатом и глутаматом. Как и основные аминокислоты, эти кислые аминокислоты очень гидрофильны и обычно расположены на поверхности белков.
Аминокислоты соединены пептидными связями между α-аминогруппой одной аминокислоты и α-карбоксильной группой второй ().Полипептиды представляют собой линейные цепи аминокислот, обычно длиной в сотни или тысячи аминокислот. Каждая полипептидная цепь имеет два различных конца, один из которых заканчивается α-аминогруппой (амино- или N-конец), а другой — α-карбоксильной группой (карбокси или C-конец). Полипептиды синтезируются от амино до карбокси-конца, и последовательность аминокислот в полипептиде записывается (по соглашению) в том же порядке.
Полипептиды синтезируются от амино до карбокси-конца, и последовательность аминокислот в полипептиде записывается (по соглашению) в том же порядке.
Рисунок 2.15
Образование пептидной связи.Карбоксильная группа одной аминокислоты связана с аминогруппой второй.
Определяющей характеристикой белков является то, что они представляют собой полипептиды с определенными аминокислотными последовательностями. В 1953 году Фредерик Сэнджер первым определил полную аминокислотную последовательность белка, гормона инсулина. Было обнаружено, что инсулин состоит из двух полипептидных цепей, соединенных дисульфидными связями между остатками цистеина (). Самое главное, эксперимент Сэнгера показал, что каждый белок состоит из определенной аминокислотной последовательности.В настоящее время белки секвенируются с использованием автоматизированных методов, и теперь известны полные аминокислотные последовательности более 100 000 белков. Каждый состоит из уникальной последовательности аминокислот, определяемой порядком нуклеотидов в гене (см.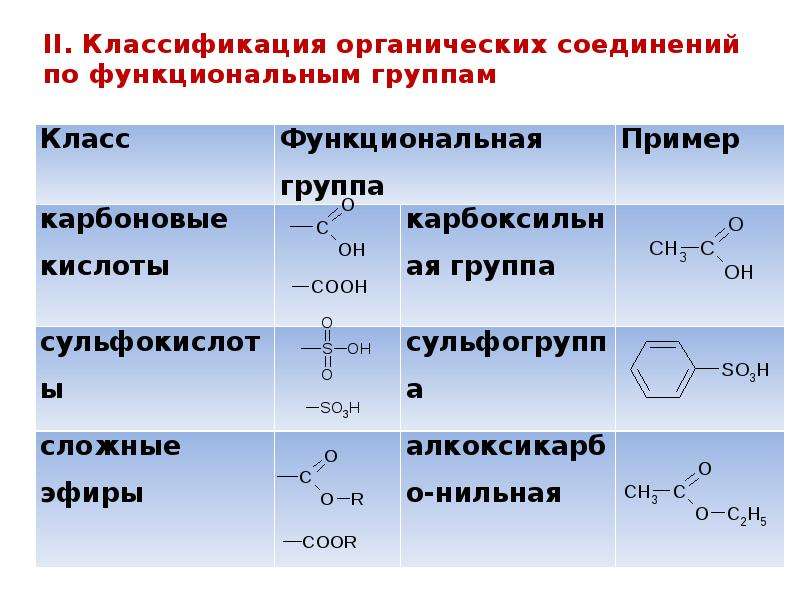 Главу 3).
Главу 3).
Рисунок 2.16
Аминокислотная последовательность инсулина. Инсулин состоит из двух полипептидных цепей, одна из 21, а другая из 30 аминокислот (обозначенных здесь их однобуквенными кодами). Боковые цепи трех пар остатков цистеина соединены дисульфидными связями, две из которых (больше…)
Аминокислотная последовательность белка — это только первый элемент его структуры. Вместо того, чтобы быть расширенными цепочками аминокислот, белки принимают различные трехмерные конформации, которые имеют решающее значение для их функции. Эти трехмерные конформации белков являются результатом взаимодействий между составляющими их аминокислотами, поэтому формы белков определяются их аминокислотными последовательностями. Впервые это было продемонстрировано в экспериментах Кристиана Анфинсена, в которых он разрушил трехмерные структуры белков с помощью таких обработок, как нагрев, которые разрывают нековалентные связи — процесс, называемый денатурацией ().После инкубации в более мягких условиях такие денатурированные белки часто спонтанно возвращались к своим природным конформациям, что указывает на то, что эти конформации непосредственно определялись аминокислотной последовательностью.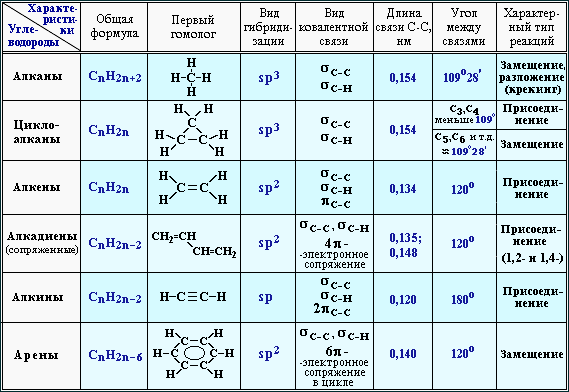
Рисунок 2.17
Денатурация и рефолдинг белка. Рибонуклеаза (РНКаза) — это белок, состоящий из 124 аминокислот (обозначенных цифрами). Белок обычно свернут в свою нативную конформацию, которая содержит четыре дисульфидные связи (обозначены парными кружками, представляющими (больше…)
Трехмерная структура белков наиболее часто анализируется с помощью рентгеновской кристаллографии, метода высокого разрешения, который может определять расположение отдельных атомов в молекуле. Луч рентгеновских лучей направляется на кристаллы белка, подлежащего анализу, и картина рентгеновских лучей, которые проходят через кристалл белка, регистрируется на рентгеновской пленке. Когда рентгеновские лучи попадают на кристалл, они рассеиваются по характерным узорам, определяемым расположением атомов в молекуле.Таким образом, структура молекулы может быть выведена из картины рассеянных рентгеновских лучей (картины дифракции).
В 1958 году Джон Кендрю первым определил трехмерную структуру белка миоглобина — относительно простого белка из 153 аминокислот ().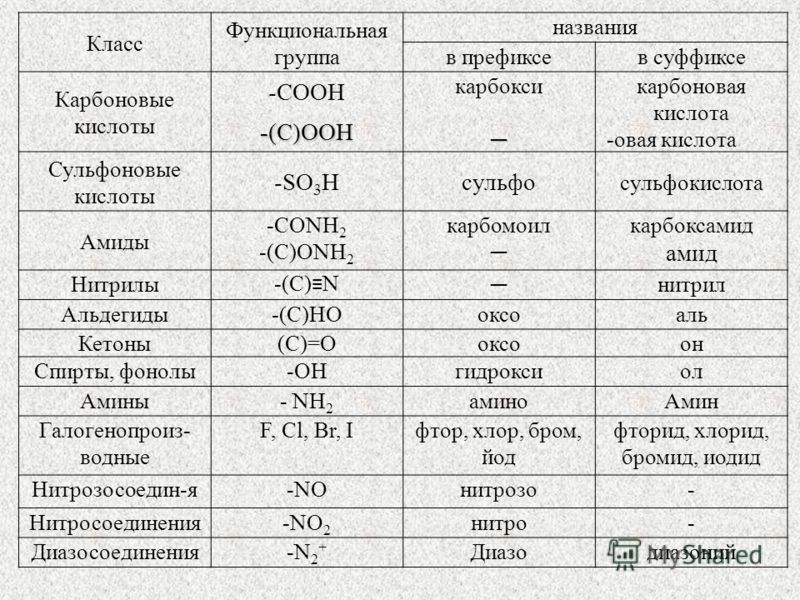 С тех пор были проанализированы трехмерные структуры нескольких тысяч белков. Большинство из них, как и миоглобин, представляют собой глобулярные белки с полипептидными цепями, сложенными в компактные структуры, хотя некоторые (например, структурные белки соединительной ткани) представляют собой длинные волокнистые молекулы.Анализ трехмерных структур этих белков выявил несколько основных принципов, которые управляют сворачиванием белка, хотя структура белка настолько сложна, что предсказать трехмерную структуру белка непосредственно по его аминокислотной последовательности невозможно.
С тех пор были проанализированы трехмерные структуры нескольких тысяч белков. Большинство из них, как и миоглобин, представляют собой глобулярные белки с полипептидными цепями, сложенными в компактные структуры, хотя некоторые (например, структурные белки соединительной ткани) представляют собой длинные волокнистые молекулы.Анализ трехмерных структур этих белков выявил несколько основных принципов, которые управляют сворачиванием белка, хотя структура белка настолько сложна, что предсказать трехмерную структуру белка непосредственно по его аминокислотной последовательности невозможно.
Рисунок 2.18
Трехмерная структура миоглобина. Миоглобин — это белок из 153 аминокислот, который участвует в транспорте кислорода. Полипептидная цепь свернута вокруг гемовой группы, которая служит сайтом связывания кислорода.
Белковая структура обычно описывается как имеющая четыре уровня. Первичная структура белка — это последовательность аминокислот в его полипептидной цепи. Вторичная структура — это регулярное расположение аминокислот в локализованных областях полипептида. Особенно распространены два типа вторичной структуры, которые впервые были предложены Линусом Полингом и Робертом Кори в 1951 году: α-спираль и β-лист. Обе эти вторичные структуры удерживаются вместе водородными связями между группами CO и NH пептидных связей.Спираль α образуется, когда участок полипептидной цепи наматывается вокруг себя, причем группа CO одной пептидной связи образует водородную связь с группой NH пептидной связи, расположенной на четыре остатка ниже по ходу линейной полипептидной цепи (). Напротив, β-лист образуется, когда две части полипептидной цепи лежат бок о бок с водородными связями между ними. Такие β-листы могут быть образованы между несколькими полипептидными цепями, которые могут быть ориентированы либо параллельно, либо антипараллельно друг другу.
Особенно распространены два типа вторичной структуры, которые впервые были предложены Линусом Полингом и Робертом Кори в 1951 году: α-спираль и β-лист. Обе эти вторичные структуры удерживаются вместе водородными связями между группами CO и NH пептидных связей.Спираль α образуется, когда участок полипептидной цепи наматывается вокруг себя, причем группа CO одной пептидной связи образует водородную связь с группой NH пептидной связи, расположенной на четыре остатка ниже по ходу линейной полипептидной цепи (). Напротив, β-лист образуется, когда две части полипептидной цепи лежат бок о бок с водородными связями между ними. Такие β-листы могут быть образованы между несколькими полипептидными цепями, которые могут быть ориентированы либо параллельно, либо антипараллельно друг другу.
Рисунок 2.19
Вторичная структура белков. Наиболее распространенными типами вторичной структуры являются α-спираль и β-лист. В α-спирали водородные связи образуются между группами CO и NH пептидных связей, разделенными четырьмя аминокислотными остатками. (подробнее …)
(подробнее …)
Третичная структура — это сворачивание полипептидной цепи в результате взаимодействий между боковыми цепями аминокислот, которые лежат в разных областях первичной последовательности (). В большинстве белков комбинации α-спиралей и β-листов, соединенных петлевыми участками полипептидной цепи, складываются в компактные глобулярные структуры, называемые доменами, которые являются основными единицами третичной структуры.Маленькие белки, такие как рибонуклеаза или миоглобин, содержат только один домен; более крупные белки могут содержать несколько разных доменов, которые часто связаны с разными функциями.
Рисунок 2.20
Третичная структура рибонуклеазы. Участки вторичных структур α-спирали и β-листка, соединенные участками петель, складываются в нативную конформацию белка. В этом схематическом представлении полипептидной цепи (подробнее …)
Критическим детерминантом третичной структуры является локализация гидрофобных аминокислот внутри белка и гидрофильных аминокислот на поверхности, где они взаимодействуют с вода.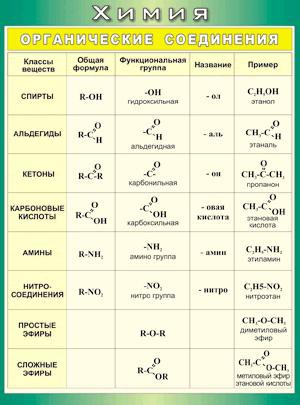 Таким образом, внутренняя часть свернутых белков состоит в основном из гидрофобных аминокислот, расположенных в α-спиралях и β-листах; эти вторичные структуры обнаруживаются в гидрофобных сердцевинах белков, поскольку водородные связи нейтрализуют полярный характер групп CO и NH основной цепи полипептида. Участки петель, соединяющие элементы вторичной структуры, находятся на поверхности свернутых белков, где полярные компоненты пептидных связей образуют водородные связи с водой или с полярными боковыми цепями гидрофильных аминокислот.Взаимодействия между полярными боковыми цепями аминокислот (водородными связями и ионными связями) на поверхности белка также являются важными детерминантами третичной структуры. Кроме того, ковалентные дисульфидные связи между сульфгидрильными группами остатков цистеина стабилизируют складчатые структуры многих белков клеточной поверхности или секретируемых белков.
Таким образом, внутренняя часть свернутых белков состоит в основном из гидрофобных аминокислот, расположенных в α-спиралях и β-листах; эти вторичные структуры обнаруживаются в гидрофобных сердцевинах белков, поскольку водородные связи нейтрализуют полярный характер групп CO и NH основной цепи полипептида. Участки петель, соединяющие элементы вторичной структуры, находятся на поверхности свернутых белков, где полярные компоненты пептидных связей образуют водородные связи с водой или с полярными боковыми цепями гидрофильных аминокислот.Взаимодействия между полярными боковыми цепями аминокислот (водородными связями и ионными связями) на поверхности белка также являются важными детерминантами третичной структуры. Кроме того, ковалентные дисульфидные связи между сульфгидрильными группами остатков цистеина стабилизируют складчатые структуры многих белков клеточной поверхности или секретируемых белков.
Четвертый уровень структуры белка, четвертичная структура, состоит из взаимодействий между различными полипептидными цепями в белках, состоящих из более чем одного полипептида. Гемоглобин, например, состоит из четырех полипептидных цепей, удерживаемых вместе одними и теми же типами взаимодействий, которые поддерживают третичную структуру ().
Гемоглобин, например, состоит из четырех полипептидных цепей, удерживаемых вместе одними и теми же типами взаимодействий, которые поддерживают третичную структуру ().
Рисунок 2.21
Четвертичная структура гемоглобина. Гемоглобин состоит из четырех полипептидных цепей, каждая из которых связана с гемовой группой. Две α-цепи и две β-цепи идентичны.
Таким образом, различные химические характеристики 20 различных аминокислот приводят к значительным вариациям в трехмерных конформациях свернутых белков.Следовательно, белки представляют собой чрезвычайно сложную и разнообразную группу макромолекул, подходящих для широкого круга задач, которые они выполняют в клеточной биологии.
Box
Ключевой эксперимент: сворачивание полипептидных цепей.
Органическое соединение — классификация, определение, типы, примеры
Что такое органическое соединение?
Органическое соединение в химии — это класс химических соединений, содержащих химические связи углерод-водород. Углерод имеет свойство соединяться с другими атомами углерода с образованием длинной цепи.Таким образом, он образует более 3 миллионов химических соединений. Согласно общему определению, органическая химия — это химия соединений или молекул углерода. Это определение включает такие соединения, как монооксид углерода, диоксид углерода, карбонаты и сероуглерод и т. Д. Это царство неорганических рядов. При изучении химии определение или классификация химических соединений, таких как органические и неорганические соединения, очень сложна. Углеводороды (алканы, алкены, ацетилен), альдегид, кетон, спирт, эфир, карбоновая кислота являются наиболее распространенным классом органических соединений.
Углерод имеет свойство соединяться с другими атомами углерода с образованием длинной цепи.Таким образом, он образует более 3 миллионов химических соединений. Согласно общему определению, органическая химия — это химия соединений или молекул углерода. Это определение включает такие соединения, как монооксид углерода, диоксид углерода, карбонаты и сероуглерод и т. Д. Это царство неорганических рядов. При изучении химии определение или классификация химических соединений, таких как органические и неорганические соединения, очень сложна. Углеводороды (алканы, алкены, ацетилен), альдегид, кетон, спирт, эфир, карбоновая кислота являются наиболее распространенным классом органических соединений.
Виды органических соединений
Чтобы различать различные типы органических и неорганических молекул, вещества классифицируются на две группы.
- Вещества, полученные из зеленых растений или животных (живой мир).
- Вещества, не полученные из живого мира.

Чистые органические соединения, такие как сахар, крахмал, аминокислоты, ферменты, спирт, смолы, индиго и метан, известны с самого начала, но химическая формула или реакции этих молекул до сих пор неизвестны.С прогрессом в химии, примерно в начале восемнадцатого века, Лемери (1675) опубликовал известный научный журнал Cours de Chemie. Он разделил химические вещества из природных источников на три класса:
- Вещества происходят из минералов.
- Вещества поступают из зеленых растений.
- Вещества происходят от животных.
История органической химии
Вклад Лавуазье в органическую химию
Определение органических соединений Лемери принимается, но очень быстро Лавуазье (1784) предоставляет новую информацию для классификации органических соединений или молекул на основе их источников.Все соединения, полученные из зеленых растений и животных источников, всегда содержат атом углерода и водорода, а часто и азот, кислород и фосфор. Лавуазье также показывает тесную связь между зелеными растениями и продуктами животного происхождения. С улучшением аналитической химии органические вещества переклассифицируются на два класса:
Лавуазье также показывает тесную связь между зелеными растениями и продуктами животного происхождения. С улучшением аналитической химии органические вещества переклассифицируются на два класса:
- Вещества происходят от живых организмов. Белки, аминокислоты, ферменты, сахар, крахмал являются примерами таких типов органических соединений.
- Вещества сделаны из неживых миров.
Вклад Фридриха Велера в органическую химию
Химическая наука идет шаг за шагом в объеме новой информации, изменении определений или классификаций и получении нового вещества или молекулы в химии.
В 1828 году Фридрих Велер преобразовал цианат аммония в мочевину, вещество, полученное из животных источников. Это меняет определение и классификацию органических химикатов.
Предыдущее определение органической молекулы полностью закончилось синтезом уксусной кислоты из составляющих ее химических элементов Кольбе в 1845 году. Следовательно, органическая химия — это изучение структуры, свойств, синтеза и реакций углеводорода или производных углеводорода.
органических соединений | BioNinja
Понимание:
• Атомы углерода могут образовывать четыре ковалентные связи, позволяя существовать разнообразным стабильным соединениям
Органические соединения
Органическое соединение — это соединение, которое содержит углерода и содержится в живых организмах
- Исключения включают карбиды (например, карбиды).г. CaC 2 ), карбонаты (CO 3 2–), оксиды углерода (CO, CO 2 ) и цианиды (CN –)
Углерод
Углерод составляет основу органическая жизнь благодаря своей способности образовывать большие и сложные молекулы посредством ковалентной связи
Атомы углерода могут образовывать четыре ковалентных связей, причем связи между атомами углерода особенно стабильны (катенация)
- Эти свойства позволяют углероду образовывать самые разные органических соединений, которые являются химически стабильными
Схема атома углерода
Понимание:
• Жизнь основана на углеродных соединениях, включая углеводы, липиды, белки и нуклеиновые кислоты
Основные классы соединений углерода
Существуют четыре основные группы органических соединений, которые во многом определяют структуру и функции клетки
Углеводы
- Наиболее распространенные органические соединения, встречающиеся в природе, состоит в основном из атомов C, H и O в общем соотношении — (CH 2 O) n
- Принципиально функционирует как источник энергии (и как вариант краткосрочного накопления энергии)
- Также важен как молекула узнавания (например,г.
 гликопротеины) и как структурный компонент (часть ДНК / РНК)
гликопротеины) и как структурный компонент (часть ДНК / РНК)
Липиды
- Неполярные гидрофобные молекулы, которые могут иметь различные формы (простые, сложные или производные)
- Липиды служат основным компонентом клеточных мембран (фосфолипиды и холестерин)
- Они могут использоваться в качестве молекулы длительного хранения энергии (жиры и масла)
- Также могут функционировать как сигнальная молекула (стероиды)
Нуклеиновые кислоты
- Генетический материал всех клеток и определяет унаследованные особенности организма
- ДНК функционирует как главный код для сборки белка, в то время как РНК играет активную роль в производстве белков
Белки
- Составляет более 50% сухой массы клеток; состоят из атомов C, H, O и N (некоторые могут включать S)
- Основные регуляторные молекулы, участвующие в катализе (все ферменты являются белками)
- Могут также функционировать как структурные молекулы или играть роль в передаче сигналов в клетках (пути трансдукции)
Основные классы органических соединений в клетках
органических соединений | Протокол
3.
 7: Органические соединения
7: Органические соединенияВсе живые существа состоят в основном из углеродных соединений, называемых органическими соединениями. В категорию органических соединений входят как природные, так и синтетические соединения, содержащие углерод. Хотя единого точного определения химическому сообществу еще предстоит найти, большинство согласны с тем, что определяющей чертой органических молекул является присутствие углерода в качестве основного элемента, связанного с водородом и другими атомами углерода. Однако некоторые углеродсодержащие соединения, такие как карбонаты, цианиды и простые оксиды (CO и CO 2 ), не классифицируются как органические соединения.
Органические соединения являются ключевыми компонентами пластмасс, мыла, парфюмерии, подсластителей, тканей, фармацевтических препаратов и многих других веществ, используемых ежедневно. Органические соединения включают соединения, происходящие из живых организмов, и соединения, синтезированные химиками. Существование широкого спектра органических молекул является следствием способности атомов углерода образовывать до четырех прочных связей с другими атомами углерода, в результате чего образуются цепочки и кольца самых разных размеров, форм и сложности.
Углеводороды
Простейшие органические соединения содержат только элементы углерод и водород и называются углеводородами.Углеводороды могут различаться типами углерод-углеродных связей, присутствующих в их молекулах. Алканы, содержащие только одинарные связи, называются алканами, а те, которые содержат двойные или тройные связи, — алкенами и алкинами соответственно. Хотя все углеводороды состоят только из двух типов атомов (углерода и водорода), существует большое разнообразие углеводородов, поскольку они могут состоять из цепей различной длины, разветвленных цепей и колец из атомов углерода или комбинации этих структур.
| Бутан (C 4 H 10 ) | Изобутан (C 4 H 10 ) | Циклобутан (C 4 H 8 ) |
Углеводороды используются каждый день, в основном в качестве топлива, такого как природный газ, ацетилен, пропан, бутан, а также основные компоненты бензина, дизельного топлива и топочного мазута. Алканы или насыщенные углеводороды содержат только одинарные ковалентные связи между своими атомами углерода. Такие свойства, как точка плавления и точка кипения, обычно изменяются предсказуемо, поскольку количество атомов углерода и водорода в молекулах изменяется.
Алканы или насыщенные углеводороды содержат только одинарные ковалентные связи между своими атомами углерода. Такие свойства, как точка плавления и точка кипения, обычно изменяются предсказуемо, поскольку количество атомов углерода и водорода в молекулах изменяется.
Чтобы назвать простой алкан, сначала укажите имя основания в зависимости от количества атомов углерода в цепи (meth = 1, eth = 2, prop = 3, but = 4, pent = 5, hex = 6, hept = 7 , oct = 8, non = 9 и dec = 10). За именем основания следует суффикс — определяется тем, является ли углеводород алканом (-ан), алкеном (-ен) или алкином (-ин).Например, двухуглеродный алкан называется этаном; трехуглеродный алкан называется пропаном; а четырехуглеродный алкан называется бутаном. Более длинные цепи называются следующим образом: пентан (5-углеродная цепь), гексан (6), гептан (7), октан (8), нонан (9) и декан (10).
Алкены и алкины представляют собой ненасыщенные углеводороды, содержащие двойные и тройные связи, соответственно, по крайней мере между двумя атомами углерода. Их номенклатура повторяет те же шаги, что и у алкана: название основания + суффикс. Например, двухуглеродная алкеновая цепь называется этеном, а двухуглеродный алкин — этином; трехуглеродный алкен называется пропеном, трехуглеродный алкин называется пропином и так далее.
Их номенклатура повторяет те же шаги, что и у алкана: название основания + суффикс. Например, двухуглеродная алкеновая цепь называется этеном, а двухуглеродный алкин — этином; трехуглеродный алкен называется пропеном, трехуглеродный алкин называется пропином и так далее.
| Этан (C 2 H 6 ) | Этен (C 2 H 4 ) | Ethyne (C 2 H 2 ) |
Функционализированные углеводороды
Включение функциональной группы в углерод- и водородсодержащие молекулы приводит к новым семействам соединений, называемых функционализированными углеводородами.Функциональная группа — это характерный атом или группа атомов, которые в первую очередь определяют свойства производных углеводородов.
Одним из типов функциональных групп является группа –ОН. Соединения, содержащие функциональную группу –ОН, являются спиртами. Название спирта происходит от углеводорода, из которого он был получен. По соглашению углеводородная часть молекулы обозначается как «R»; Итак, общая формула спирта — R – OH. Конечный «–e» в названии углеводорода заменяется на «–ol».В случае разветвленного спирта атом углерода, с которым связана группа –ОН, обозначается числом перед названием. Другие общие функциональные группы перечислены ниже. Группа соединений, содержащих одну и ту же функциональную группу, образует семейство.
Название спирта происходит от углеводорода, из которого он был получен. По соглашению углеводородная часть молекулы обозначается как «R»; Итак, общая формула спирта — R – OH. Конечный «–e» в названии углеводорода заменяется на «–ol».В случае разветвленного спирта атом углерода, с которым связана группа –ОН, обозначается числом перед названием. Другие общие функциональные группы перечислены ниже. Группа соединений, содержащих одну и ту же функциональную группу, образует семейство.
Простые эфиры — это соединения, содержащие функциональную группу –O– с общей формулой R – O – R ’.
Другой класс органических молекул содержит атом углерода, соединенный с атомом кислорода двойной связью, обычно называемой карбонильной группой.Углерод в карбонильной группе может присоединяться к двум другим заместителям, что приводит к нескольким подсемействам (альдегиды, кетоны, карбоновые кислоты и сложные эфиры).
Функциональные группы, относящиеся к карбонильной группе, включают группу –CHO альдегида, группу –CO– кетона, группу –CO 2 H карбоновой кислоты и группу –CO 2 R сложный эфир. Карбонильная группа, двойная связь углерод-кислород, является ключевой структурой в этих классах органических молекул. Альдегиды содержат по крайней мере один атом водорода, присоединенный к карбонильному атому углерода, кетоны содержат две углеродные группы, присоединенные к карбонильному атому углерода, карбоновые кислоты содержат гидроксильную группу, присоединенную к карбонильному атому углерода, а сложные эфиры содержат атом кислорода, присоединенный к другой углеродной группе. соединен с карбонильным атомом углерода.Все эти соединения содержат окисленные атомы углерода относительно атома углерода спиртовой группы.
Карбонильная группа, двойная связь углерод-кислород, является ключевой структурой в этих классах органических молекул. Альдегиды содержат по крайней мере один атом водорода, присоединенный к карбонильному атому углерода, кетоны содержат две углеродные группы, присоединенные к карбонильному атому углерода, карбоновые кислоты содержат гидроксильную группу, присоединенную к карбонильному атому углерода, а сложные эфиры содержат атом кислорода, присоединенный к другой углеродной группе. соединен с карбонильным атомом углерода.Все эти соединения содержат окисленные атомы углерода относительно атома углерода спиртовой группы.
Добавление азота в органический каркас приводит к двум семействам молекул, а именно аминам и амидам. Соединения, содержащие атом азота, связанный в углеводородный каркас, классифицируются как амины. Соединения, у которых атом азота связан с одной стороной карбонильной группы, классифицируются как амиды. Амины — основная функциональная группа. Амины и карбоновые кислоты могут объединяться в реакции конденсации с образованием амидов.
Этот текст адаптирован из Openstax, Chemistry 2e, Раздел 20: Введение, Openstax, Chemistry 2e, Раздел 20.1: Углеводороды, Openstax, Химия 2e, Раздел 20.2: Спирты и эфиры, Openstax, Химия 2e, Раздел 20.2: Альдегиды, Кетоны , Карбоновые кислоты и сложные эфиры, и Openstax, Chemistry 2e, раздел 20.2: Амины и амиды.
Органическая химия — Энциклопедия Нового Света
Органическая химия — это научное исследование структур, свойств и методов синтеза химических соединений на основе углерода.Эта область находится в дополнительных отношениях с неорганической химией, которая охватывает изучение соединений всех других элементов, а также самих элементов. [1] Эти две дисциплины обычно рассматриваются по отдельности, но они во многом пересекаются, например, в субдисциплине металлоорганической химии.
Органические соединения в основном состоят из углерода и водорода и могут содержать любое количество других элементов, наиболее распространенными из которых являются азот и кислород. Каждый атом углерода с его образцом четырех ковалентных связей может соединяться с другими атомами углерода множеством способов, давая огромное разнообразие обнаруженных органических соединений. Каждая молекула часто описывается как имеющая «скелет» из атомов углерода. Существенное указание на существование и взаимосвязь, присущее четырехосновным структурам, подходит для углерода, поскольку он является одной из основ самой жизни.
Каждый атом углерода с его образцом четырех ковалентных связей может соединяться с другими атомами углерода множеством способов, давая огромное разнообразие обнаруженных органических соединений. Каждая молекула часто описывается как имеющая «скелет» из атомов углерода. Существенное указание на существование и взаимосвязь, присущее четырехосновным структурам, подходит для углерода, поскольку он является одной из основ самой жизни.
Важные классы органических соединений включают алканы, алкены, алкины, ароматические соединения, спирты, альдегиды, кетоны, карбоновые кислоты, сложные эфиры, простые эфиры, амины и амиды.Многие органические соединения, такие как углеводы, аминокислоты, белки, липиды, нуклеотиды и нуклеиновые кислоты, находятся в живых системах. Изучение органической химии принесло огромные преимущества в практическом плане, например, в производстве текстиля, красок, пластмасс, топлива и фармацевтических препаратов.
История
Когда-то считалось, что определенные соединения, называемые «органическими соединениями», производятся только живыми организмами.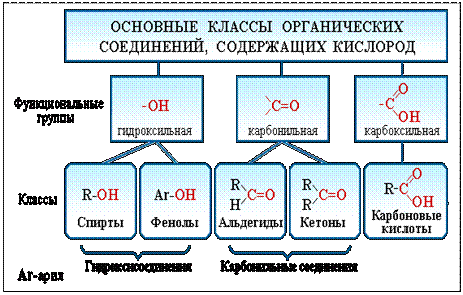 Поэтому исследование таких соединений было названо органической химии .Однако определяющее понятие органических соединений оказалось ложным в 1828 году, когда Фридрих Вёлер случайно синтезировал биологически значимое соединение мочевину путем испарения водного раствора цианата аммония (NH 4 OCN). Позже термин «органическая химия» был переопределен, чтобы обозначать химию соединений углерода.
Поэтому исследование таких соединений было названо органической химии .Однако определяющее понятие органических соединений оказалось ложным в 1828 году, когда Фридрих Вёлер случайно синтезировал биологически значимое соединение мочевину путем испарения водного раствора цианата аммония (NH 4 OCN). Позже термин «органическая химия» был переопределен, чтобы обозначать химию соединений углерода.
Характеристики органических веществ
Органические соединения связаны ковалентными связями и, следовательно, их связи являются направленными. Это позволяет создавать уникальные структуры, такие как длинные углеродные цепи и кольца.Причина, по которой углерод превосходно формирует уникальные структуры и так много углеродных соединений, заключается в том, что атомы углерода образуют очень стабильные ковалентные связи друг с другом (катенация). В отличие от неорганических материалов, органические соединения обычно плавятся, возгоняются или разлагаются при температуре ниже 300 ° C.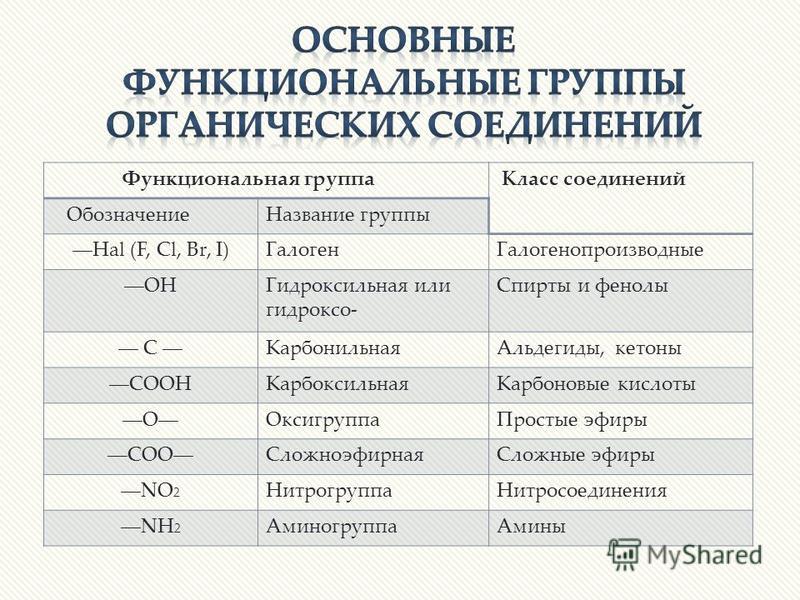 Нейтральные органические соединения, как правило, менее растворимы в воде по сравнению со многими неорганическими солями, за исключением некоторых соединений, таких как ионные органические соединения и низкомолекулярные спирты и карбоновые кислоты, в которых присутствует водородная связь.Органические соединения, как правило, намного более растворимы в органических растворителях, таких как эфир или спирт, но растворимость в каждом растворенном веществе зависит от присутствующих функциональных групп и общей структуры.
Нейтральные органические соединения, как правило, менее растворимы в воде по сравнению со многими неорганическими солями, за исключением некоторых соединений, таких как ионные органические соединения и низкомолекулярные спирты и карбоновые кислоты, в которых присутствует водородная связь.Органические соединения, как правило, намного более растворимы в органических растворителях, таких как эфир или спирт, но растворимость в каждом растворенном веществе зависит от присутствующих функциональных групп и общей структуры.
Органическая номенклатура
Органическая номенклатура — это система, установленная для обозначения и группировки органических соединений.
Соединения алифатические
Алифатические соединения — это органические молекулы, не содержащие ароматических систем. Обычно они содержат углеводородные цепи.
Углеводороды — Алканы — Алкены — Диены или Алкадиены — Алкины — Галоалканы
Соединения ароматические
Ароматические соединения — это органические молекулы, содержащие одну или несколько ароматических кольцевых систем. Обычно это означает, но не ограничивается ими, те соединения, которые содержат бензольное кольцо.
Обычно это означает, но не ограничивается ими, те соединения, которые содержат бензольное кольцо.
Бензол — Толуол — Стирол — Ксилол — Анилин — Фенол — Ацетофенон — Бензонитрил — Галоарены — Нафталин — Антрацен — Фенантрен — Бензопирен — Коронен — Азулен — Бифенил
Соединения гетероциклические
Гетероциклические соединения — это циклические органические молекулы, кольцо (а) которых (а) содержат по крайней мере один гетероатом.Эти гетероатомы могут включать кислород, азот, фосфор и серу.
Имидазол — Индол — Пиридин — Пиррол — Тиофен — Фуран — Пурины
Функциональные группы
Это части органической молекулы, характеризующиеся определенным составом и связанной структурой составляющих атомов. Каждая функциональная группа имеет определенный набор свойств и реакций, характеризующих соединение. Некоторые общие функциональные группы: спирты, альдегиды, амиды, амины, карбоновые кислоты, сложные эфиры, простые эфиры, кетоны, нитрилы.
Полимеры
Полимеры образуют особую группу молекул. Обычно считается «большими» молекулами, полимеры получили свою репутацию в отношении размера, потому что они представляют собой молекулы, которые состоят из множества более мелких сегментов. Сегменты могут быть химически идентичными, что сделало бы такую молекулу гомополимером. Или сегменты могут различаться по химической структуре, что делает эту молекулу гетерополимером. Полимеры — это подмножество «макромолекул», которое представляет собой классификацию всех молекул, которые считаются большими.
Обычно считается «большими» молекулами, полимеры получили свою репутацию в отношении размера, потому что они представляют собой молекулы, которые состоят из множества более мелких сегментов. Сегменты могут быть химически идентичными, что сделало бы такую молекулу гомополимером. Или сегменты могут различаться по химической структуре, что делает эту молекулу гетерополимером. Полимеры — это подмножество «макромолекул», которое представляет собой классификацию всех молекул, которые считаются большими.
Полимеры могут быть органическими или неорганическими. Обычно встречающиеся полимеры обычно являются органическими (такими как полиэтилен, полипропилен или оргстекло). Но неорганические полимеры (например, силикон) также являются частью привычных предметов.
Важные биологические молекулы, такие как белки, нуклеиновые кислоты и полисахариды, также являются полимерами (биополимерами).
Определение молекулярной структуры органического соединения
В настоящее время существует несколько методов определения характеристик органических соединений. Обычно используется (в алфавитном порядке):
Обычно используется (в алфавитном порядке):
- Кристаллография: это наиболее точный метод; однако очень трудно вырастить кристаллы достаточного размера и высокого качества, чтобы получить четкую картину, поэтому это остается вторичной формой анализа.
- Элементный анализ: разрушающий метод, используемый для определения элементного состава молекулы.
- Инфракрасная спектроскопия: в основном используется для определения наличия (или отсутствия) определенных функциональных групп.
- Масс-спектрометрия: используется для определения молекулярной массы соединения и характера фрагментации.
- Спектрометрия ядерного магнитного резонанса (ЯМР)
- УФ / видимая спектроскопия: используется для определения степени конъюгации в системе
Органические реакции
Из-за огромного количества возможных органических соединений важной частью органической химии является понимание синтеза и реакций органических соединений. Существуют различные модели, основанные на функциональной группе и структуре углерода, которые могут быть применены к классам соединений, см. «Органические реакции».Многие типы реакций носят имя человека, открывшего их, например, реакции Гриньяра или синтез эфиров Вильямсона. Современная органическая химия также пытается понять механизм или процесс на молекулярном уровне для каждого типа реакции.
«Органические реакции».Многие типы реакций носят имя человека, открывшего их, например, реакции Гриньяра или синтез эфиров Вильямсона. Современная органическая химия также пытается понять механизм или процесс на молекулярном уровне для каждого типа реакции.
См. Также
Банкноты
- ↑ Изучение некоторых соединений углерода, таких как диоксид углерода, карбонаты и цианиды, считается частью неорганической химии.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Макмерри, Джон.2004. Органическая химия, 6-е изд. Бельмонт, Калифорния: Брукс / Коул. ISBN 0534420052.
- Моррисон, Роберт Т. и Роберт Н. Бойд. 1992. Органическая химия, 6-е изд. Энглвуд Клиффс, Нью-Джерси: Prentice Hall. ISBN 0136436692.
- Solomons, T.W. Грэхем и Крейг Б. Фрайл 2004. Organic Chemistry, 8-е изд. Хобокен, Нью-Джерси: Джон Вили. ISBN 0471417998.
Внешние ссылки
Все ссылки получены 3 января 2019 г.
Кредиты
Энциклопедия Нового Света писателей и редакторов переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Испытания летучих органических соединений человека как инструмент классификации пленок по возрасту
Abstract
Люди выделяют множество летучих органических соединений (ЛОС) через дыхание и кожу. На характер и скорость этих выбросов влияют различные факторы, в том числе эмоциональное состояние. Предыдущие измерения ЛОС и CO 2 в кинотеатре показали, что определенные химические вещества воспроизводимо выделяются зрителями, реагирующими на события в конкретном фильме.Используя данные фильмов с различной возрастной классификацией, мы изучили взаимосвязь между выбросами нескольких ЛОС и CO 2 и возрастным классификатором (0, 6, 12 и 16) с целью разработки нового химически обоснованного и объективного метод классификации фильмов. Мы применяем модель случайного леса, построенную с использованием не зависящих от времени характеристик, извлеченных из временных рядов каждого измеренного соединения, и тестируем возможность прогнозирования на подмножествах всех данных. Было обнаружено, что большинство соединений не могут надежно предсказать все возрастные классификаторы, что, вероятно, отражает тот факт, что текущая классификация основана на воспринимаемой чувствительности ко многим факторам (например,г.
На характер и скорость этих выбросов влияют различные факторы, в том числе эмоциональное состояние. Предыдущие измерения ЛОС и CO 2 в кинотеатре показали, что определенные химические вещества воспроизводимо выделяются зрителями, реагирующими на события в конкретном фильме.Используя данные фильмов с различной возрастной классификацией, мы изучили взаимосвязь между выбросами нескольких ЛОС и CO 2 и возрастным классификатором (0, 6, 12 и 16) с целью разработки нового химически обоснованного и объективного метод классификации фильмов. Мы применяем модель случайного леса, построенную с использованием не зависящих от времени характеристик, извлеченных из временных рядов каждого измеренного соединения, и тестируем возможность прогнозирования на подмножествах всех данных. Было обнаружено, что большинство соединений не могут надежно предсказать все возрастные классификаторы, что, вероятно, отражает тот факт, что текущая классификация основана на воспринимаемой чувствительности ко многим факторам (например,г.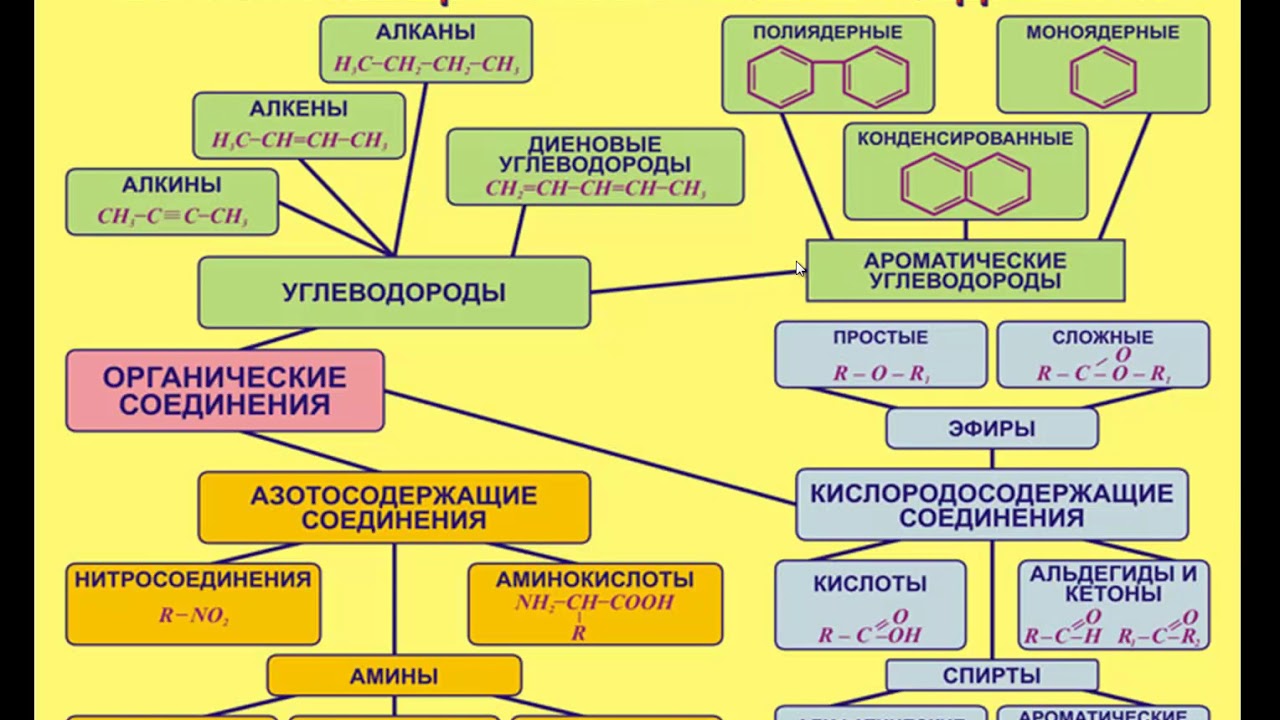 случаи насилия, секса, антисоциального поведения, употребления наркотиков и ненормативной лексики), а не внутренние биологические реакции, выраженные в данных. Однако многообещающие результаты были получены для изопрена, который надежно предсказал возрастные классификаторы 0, 6 и 12 для различных жанров фильмов и возрастных групп аудитории. Следовательно, выброс изопрена на человека в будущем может стать ценным подспорьем для национальных классификационных комиссий или даже предложить альтернативный, объективный показатель для оценки фильмов, основанный на реакции больших групп людей.
случаи насилия, секса, антисоциального поведения, употребления наркотиков и ненормативной лексики), а не внутренние биологические реакции, выраженные в данных. Однако многообещающие результаты были получены для изопрена, который надежно предсказал возрастные классификаторы 0, 6 и 12 для различных жанров фильмов и возрастных групп аудитории. Следовательно, выброс изопрена на человека в будущем может стать ценным подспорьем для национальных классификационных комиссий или даже предложить альтернативный, объективный показатель для оценки фильмов, основанный на реакции больших групп людей.
Образец цитирования: Stönner C, Edtbauer A, Derstroff B, Bourtsoukidis E, Klüpfel T, Wicker J, et al. (2018) Доказательство концепции исследования: Тестирование летучих органических соединений человека в качестве инструментов для классификации пленок по возрасту. PLoS ONE 13 (10): e0203044. https://doi.org/10.1371/journal.pone.0203044
Редактор: Шама Ахмад, Университет Алабамы в Бирмингеме, США
Поступила: 21 октября 2017 г .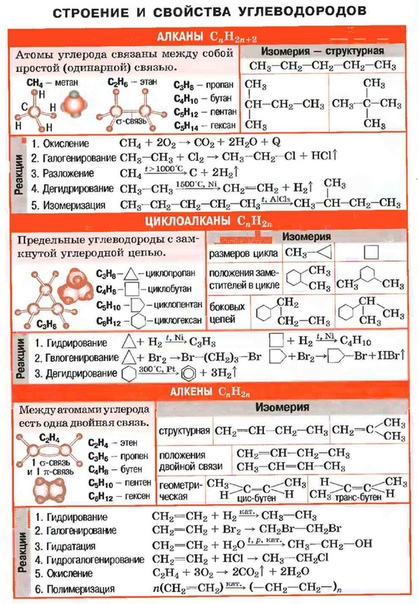 ; Одобрена: 14 августа 2018 г .; Опубликовано: 11 октября 2018 г.
; Одобрена: 14 августа 2018 г .; Опубликовано: 11 октября 2018 г.
Авторские права: © 2018 Stönner et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные, включая данные о продаже билетов и измеренные соединения, находятся в файлах вспомогательной информации.
Финансирование: Авторы не получали специального финансирования на эту работу.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Мировые кассовые сборы оцениваются примерно в 40 миллиардов долларов США [1], поэтому мировая киноиндустрия является важным элементом многих национальных экономик.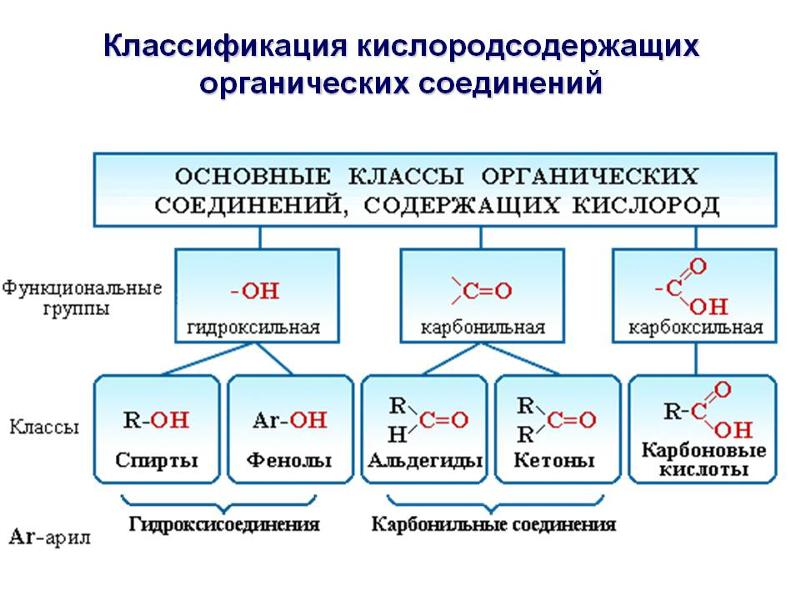 После того, как фильм записан и отредактирован, он должен быть классифицирован до распространения в кинотеатрах. Классификация фильмов служит для защиты детей от неподходящего медиа-контента и для информирования потребителей, особенно родителей, о тематическом материале фильма. Эта классификация производится на национальном уровне независимым регулирующим органом в соответствии с руководящими принципами, основанными на законодательной базе отдельной страны.Регулирующий орган присваивает фильму рейтинг, который отражает восприимчивость публики к содержанию фильма, от неограниченного (подходит для всех) до только для взрослых (обычно 18 лет). Разделение системы классификации на возрастные группы сильно различается от страны к стране. Например, в Германии используются 0, 6, 12, 16, 18, [2], в то время как в Соединенных Штатах есть G (общая аудитория), PG (рекомендуется родительский контроль), PG-13 (родители строго предупреждены), R (ограничено) и NC-17 (никто 17 и младше не допускался).[3] Индия, самый плодовитый производитель фильмов в мире, использует U (от 0 до 11), UA (до 17) и A для взрослых.
После того, как фильм записан и отредактирован, он должен быть классифицирован до распространения в кинотеатрах. Классификация фильмов служит для защиты детей от неподходящего медиа-контента и для информирования потребителей, особенно родителей, о тематическом материале фильма. Эта классификация производится на национальном уровне независимым регулирующим органом в соответствии с руководящими принципами, основанными на законодательной базе отдельной страны.Регулирующий орган присваивает фильму рейтинг, который отражает восприимчивость публики к содержанию фильма, от неограниченного (подходит для всех) до только для взрослых (обычно 18 лет). Разделение системы классификации на возрастные группы сильно различается от страны к стране. Например, в Германии используются 0, 6, 12, 16, 18, [2], в то время как в Соединенных Штатах есть G (общая аудитория), PG (рекомендуется родительский контроль), PG-13 (родители строго предупреждены), R (ограничено) и NC-17 (никто 17 и младше не допускался).[3] Индия, самый плодовитый производитель фильмов в мире, использует U (от 0 до 11), UA (до 17) и A для взрослых.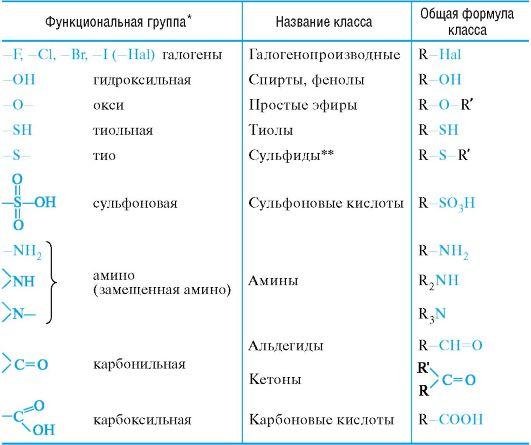 [4] Процесс классификации осложняется многочисленными влияющими факторами, которые необходимо учитывать вместе, прежде чем можно будет назначить возрастной классификатор, например степенью насилия, пола, антисоциального поведения и ненормативной лексики. [5] Более того, общественное мнение по определенным аспектам руководящих принципов классификации может со временем измениться, что потребует от регулирующего органа регулярно пересматривать свои руководящие принципы. В конечном итоге классифицирующий орган выражает субъективную оценку от имени общественности в форме возрастного ограничения.[6] В некоторых случаях это может быть спорным решением, поскольку создатель фильма, стремящийся к более широкому рынку для своего фильма, может счесть свою работу подходящей для более широкой аудитории, чем классифицирующее агентство.
[4] Процесс классификации осложняется многочисленными влияющими факторами, которые необходимо учитывать вместе, прежде чем можно будет назначить возрастной классификатор, например степенью насилия, пола, антисоциального поведения и ненормативной лексики. [5] Более того, общественное мнение по определенным аспектам руководящих принципов классификации может со временем измениться, что потребует от регулирующего органа регулярно пересматривать свои руководящие принципы. В конечном итоге классифицирующий орган выражает субъективную оценку от имени общественности в форме возрастного ограничения.[6] В некоторых случаях это может быть спорным решением, поскольку создатель фильма, стремящийся к более широкому рынку для своего фильма, может счесть свою работу подходящей для более широкой аудитории, чем классифицирующее агентство.
Ясно, что классификационным органам было бы полезно, если бы для обоснования решения можно было использовать методы, основанные на объективных данных. Недавно было показано, что кинозрители излучают химические сигналы в окружающий воздух в ответ на определенные сцены в фильме. Более того, последовательность сигналов во времени воспроизводилась при многократных показах одного и того же фильма.[7,8] Эффект легче всего понять с точки зрения углекислого газа (CO 2 ), который составляет около 4% выдыхаемого человеком дыхания. Кинотеатры постоянно вентилируются наружным воздухом, содержащим около 0,0004% CO 2 , так что, когда аудитория присутствует, уровень CO 2 плавно повышается до тех пор, пока не будет достигнуто равновесие. Однако, когда пульс аудитории и частота дыхания на мгновение увеличиваются в унисон, в ответ на особенно захватывающую сцену, генерируется пик CO 2 , который можно обнаружить в воздухе, выходящем из кинотеатра.Современная технология измерения воздуха позволяет, помимо CO 2 , измерять несколько сотен летучих органических соединений с высокой частотой (каждые 30 секунд). В вышеупомянутом исследовании было обнаружено, что определенные химические вещества соответствуют определенным типам сцен, причем лучше всего охарактеризованы сцены саспенса и комедии.
Более того, последовательность сигналов во времени воспроизводилась при многократных показах одного и того же фильма.[7,8] Эффект легче всего понять с точки зрения углекислого газа (CO 2 ), который составляет около 4% выдыхаемого человеком дыхания. Кинотеатры постоянно вентилируются наружным воздухом, содержащим около 0,0004% CO 2 , так что, когда аудитория присутствует, уровень CO 2 плавно повышается до тех пор, пока не будет достигнуто равновесие. Однако, когда пульс аудитории и частота дыхания на мгновение увеличиваются в унисон, в ответ на особенно захватывающую сцену, генерируется пик CO 2 , который можно обнаружить в воздухе, выходящем из кинотеатра.Современная технология измерения воздуха позволяет, помимо CO 2 , измерять несколько сотен летучих органических соединений с высокой частотой (каждые 30 секунд). В вышеупомянутом исследовании было обнаружено, что определенные химические вещества соответствуют определенным типам сцен, причем лучше всего охарактеризованы сцены саспенса и комедии. Химическая реакция, измеренная с помощью «дыхания толпы», представляет собой реакцию большой группы людей на показанные сцены. [7,8] Эта информация может быть потенциально очень полезной при классификации фильмов, поскольку химическая информация является прямой, неинвазивной мера того, как большая группа людей реагирует на отдельные сцены и на фильм в целом.Легко представить, что изменчивость следа CO 2 , количество пиков в отдельных ЛОС или абсолютные количества химических веществ, выделяемых на человека, — все это возможные индикаторы групповой реакции.
Химическая реакция, измеренная с помощью «дыхания толпы», представляет собой реакцию большой группы людей на показанные сцены. [7,8] Эта информация может быть потенциально очень полезной при классификации фильмов, поскольку химическая информация является прямой, неинвазивной мера того, как большая группа людей реагирует на отдельные сцены и на фильм в целом.Легко представить, что изменчивость следа CO 2 , количество пиков в отдельных ЛОС или абсолютные количества химических веществ, выделяемых на человека, — все это возможные индикаторы групповой реакции.
Недавно были разработаны компьютеризированные системы для поддержки принятия комитетом решения о возрастном рейтинге фильма. Большинство этих методов используют язык (использование нецензурных слов) и свойства изображения (изменение цвета, продолжительность кадра) для классификации фильмов [9,10], но не принимают во внимание реакцию человека на фильм.
В этом исследовании мы систематически изучаем возможность использования CO 2 и более 60 летучих органических соединений, измеренных в воздухе, выходящем из кинотеатра, для классификации фильмов.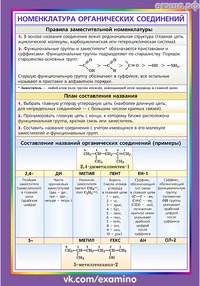 Оценка основана на 135 показах 11 различных фильмов, собранных за 8 недель в двух разных кинотеатрах с участием более 13000 человек. Наш подход включает случайную модель леса, построенную с независимыми от времени характеристиками, извлеченными из временных рядов каждого измеренного соединения для каждого фильма. Эти характеристики включают, например, высоту пика, ширину пика и количество пиков в пленке, нормированное на ее длину.[11,12] Наконец, был проведен тест перестановки, чтобы проверить полученные показатели производительности (площадь под кривой ROC) исходной модели по сравнению с показателями, рассчитанными на основе рандомизированных меток классов. [13]
Оценка основана на 135 показах 11 различных фильмов, собранных за 8 недель в двух разных кинотеатрах с участием более 13000 человек. Наш подход включает случайную модель леса, построенную с независимыми от времени характеристиками, извлеченными из временных рядов каждого измеренного соединения для каждого фильма. Эти характеристики включают, например, высоту пика, ширину пика и количество пиков в пленке, нормированное на ее длину.[11,12] Наконец, был проведен тест перестановки, чтобы проверить полученные показатели производительности (площадь под кривой ROC) исходной модели по сравнению с показателями, рассчитанными на основе рандомизированных меток классов. [13]
Материалы и методы
Кинематографические измерения
Мы очень благодарны компании Cinestar за разрешение использовать свои помещения. Никакого специального разрешения не требовалось. Отдельные члены аудитории не пострадали или не были идентифицированы в газовой смеси, и поэтому измерения не подлежали этическому одобрению.
Измерения проводились в мультиплексном кинотеатре Cinestar в Майнце, Германия (расположенный на 49 ° 59 ‘37,511 «N 8 ° 16’ 45,548» E) в двух разных кинозалах в течение примерно четырех недель зимой 2013/2014 года и зимой 2015 года. / 2016. За 8 недель измерений 11 различных фильмов были показаны несколько раз, в результате чего было проведено 135 отдельных просмотров. В таблице 1 представлены измеренные фильмы, классифицированные в соответствии с рекомендациями немецкой системы классификации фильмов по возрасту «FSK» («Freiwillige Selbstkontrolle der Filmwirtschaft», что означает добровольное саморегулирование), а также количество просмотров.Среднее количество людей, присутствующих на каждом скрининге, приведено в дополнительной таблице S1. Видно, что каждый класс рекомендаций по возрасту посетило примерно одинаковое количество человек.
Для этого исследования использовалась немецкая система рейтинга кинофильмов, в которой фильмы были разделены на 5 категорий. Фильмы без ограничений классифицируются как «FSK 0», фильмы, выпущенные до 6 лет и старше, как «FSK 6», фильмы, выпущенные до 12 лет и старше, как фильмы, выпущенные до 16 лет и старше, фильмы, выпущенные до 16 лет и старше. более «ФСК 16» и фильмы разрешены только взрослым «ФСК 18».За период проведения измерений фильм с возрастным рейтингом «FSK 18» не демонстрировался. Поскольку на билеты для детей до 12 лет действует скидка, доля зрителей определенного фильма до 12 лет может быть взята из продаж билетов.
более «ФСК 16» и фильмы разрешены только взрослым «ФСК 18».За период проведения измерений фильм с возрастным рейтингом «FSK 18» не демонстрировался. Поскольку на билеты для детей до 12 лет действует скидка, доля зрителей определенного фильма до 12 лет может быть взята из продаж билетов.
Два разных кинозала были примерно одинакового размера и вмещали 237 и 227 зрителей соответственно. Размер сортировочных залов составлял 6500 м 3 , и помещения непрерывно продувались свежим воздухом на 1300 м 3 / ч.Внутренний приток потребляемого воздуха из кинотеатра не смешивался со свежим наружным воздухом. Весь отработанный воздух из комнаты для просмотра проходил через вентиляционную шахту из нержавеющей стали размером 75×75 см. Воздух из вытяжной шахты измерялся в отдельном техническом помещении с помощью PTR-TOF-MS и CO 2 -анализатора.
Времяпролетный масс-спектрометр реакции переноса протона
Вытяжной воздух из кинотеатра измерялся с помощью PTR-TOF-MS 8000 (Ionicon Analytik GmbH, Инсбрук, Австрия).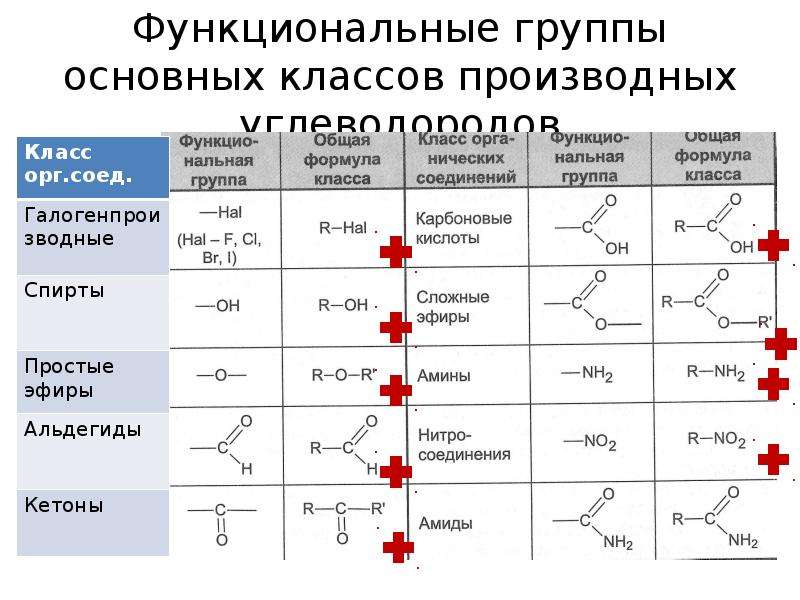 Ионизация каждого аналита происходит через ионы гидроксония (H 3 O + ), в результате чего образуются протонированные положительно заряженные ионы. Эта реакция передачи протекает только к молекулам с более высоким сродством к протонам, чем вода (691 кДж / моль). Таким образом, система не видит основных компонентов воздуха, таких как азот, кислород и аргон. Низкая энергия, вовлеченная в реакцию протонирования, приводит к небольшой фрагментации аналита, облегчающей идентификацию.
Ионизация каждого аналита происходит через ионы гидроксония (H 3 O + ), в результате чего образуются протонированные положительно заряженные ионы. Эта реакция передачи протекает только к молекулам с более высоким сродством к протонам, чем вода (691 кДж / моль). Таким образом, система не видит основных компонентов воздуха, таких как азот, кислород и аргон. Низкая энергия, вовлеченная в реакцию протонирования, приводит к небольшой фрагментации аналита, облегчающей идентификацию.
Подробное описание настройки и калибровки можно найти в другом месте.[14]
Анализ данных
В целом, 20% отснятых пленок пришлось выбросить из-за проблем, связанных с проверками системы вентиляции около полуночи (только зимой 2013/2014 гг.) И высокими выбросами ЛОС от чистящих средств по утрам, что маскирует некоторые выбросы человека (только для предварительной -полуденные просмотры).
Анализ данных был разделен на этап предварительной обработки и этап построения модели. Последний включает в себя генерацию экземпляров и разбиение на обучающие и тестовые наборы.Наконец, полученные показатели производительности сравнивались с результатами, полученными в результате перестановочного теста.
Последний включает в себя генерацию экземпляров и разбиение на обучающие и тестовые наборы.Наконец, полученные показатели производительности сравнивались с результатами, полученными в результате перестановочного теста.
Предварительная обработка.
Измеренные временные ряды для соотношения смешивания изопрена для одной пленки («Я отключусь», «FSK 0») показаны в виде черной кривой в левой части рис. 1. Когда аудитория входит в кинотеатр, соотношение изопрена в смеси сначала быстро увеличивается, а затем постепенно во время фильма, а затем резко снижается в конце, когда аудитория покидает зал для просмотра.В случае изопрена пик, который можно увидеть в конце каждого фильма, вызван усиленным высвобождением изопрена из-за мышечных сокращений, связанных с вставанием и ходьбой. [15,16] Этот пик был исключен для анализа удаление последних 5 минут каждого фильма на этапе предварительной обработки данных.
Рис. 1. Временной ряд изопрена.
На верхней панели показано соотношение изопрена в смеси (в частях на миллиард) во время фильма «Тогда я выхожу».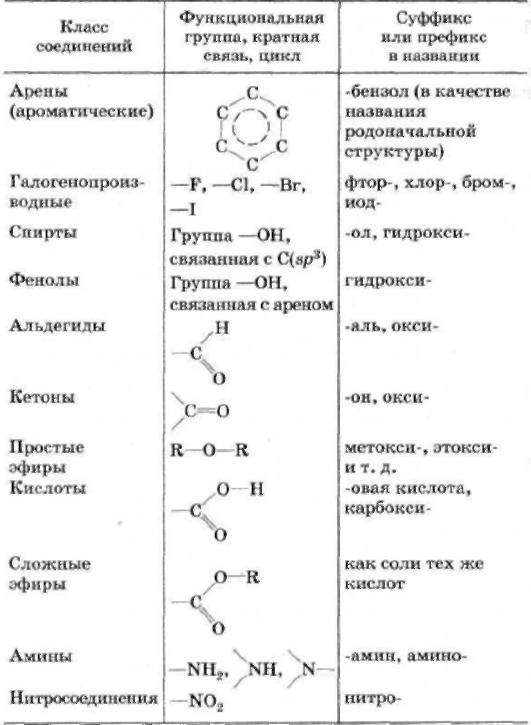 Этот временной ряд был уже разделен по количеству зрителей.Черная линия показывает измеренные значения, а красная — смоделированное соотношение смеси, предполагающее постоянную скорость выделения изопрена. На нижней панели показаны остатки, полученные вычитанием измеренного временного ряда из смоделированного.
Этот временной ряд был уже разделен по количеству зрителей.Черная линия показывает измеренные значения, а красная — смоделированное соотношение смеси, предполагающее постоянную скорость выделения изопрена. На нижней панели показаны остатки, полученные вычитанием измеренного временного ряда из смоделированного.
https://doi.org/10.1371/journal.pone.0203044.g001
При увеличении можно увидеть несколько пиков и спадов, которые повторяются одновременно при каждом просмотре одного и того же фильма. [7] Максимальный коэффициент смешивания ЛОС, измеренный для каждого фильма, положительно коррелирует с количеством зрителей, посещающих кинозал.Таким образом, временные ряды отдельных фильмов были нормализованы по количеству зрителей, известному по продажам билетов. Временное поведение изопрена с начальным резким увеличением с последующим плавным устойчивым повышением и окончательным быстрым снижением аналогично наблюдалось для многих других соединений, переносимых дыханием, таких как CO 2 и ацетон. Увеличение отношения смешения (красная кривая на рис. 1) может быть рассчитано с использованием модели ящика, предполагающей постоянную скорость излучения во время пленки.В рамках модели соотношение смешивания зависит только от входящего и выходящего воздуха и скорости выброса ЛОС из аудитории. Подробное описание модели можно найти в приложении. Смоделированное поведение соотношения смешивания, предполагающее фиксированную скорость излучения (красная кривая на рис. 1), было вычтено из измеренного соотношения смешивания (черная кривая на левой стороне на рис. 1). Результирующая кривая без тенденции к увеличению была названа «остаточным временным рядом», и ее можно увидеть в правой части рисунка 1.
Увеличение отношения смешения (красная кривая на рис. 1) может быть рассчитано с использованием модели ящика, предполагающей постоянную скорость излучения во время пленки.В рамках модели соотношение смешивания зависит только от входящего и выходящего воздуха и скорости выброса ЛОС из аудитории. Подробное описание модели можно найти в приложении. Смоделированное поведение соотношения смешивания, предполагающее фиксированную скорость излучения (красная кривая на рис. 1), было вычтено из измеренного соотношения смешивания (черная кривая на левой стороне на рис. 1). Результирующая кривая без тенденции к увеличению была названа «остаточным временным рядом», и ее можно увидеть в правой части рисунка 1.
Скорректированный временной ряд использовался для извлечения отличительных признаков, включая стандартное отклонение, асимметрию и эксцесс временного ряда, а также нескольких признаков, описывающих возникновение пиков во временном ряду. Кроме того, в набор функций было включено среднее положительных и отрицательных значений, чтобы получить общую меру изменения во временном ряду. Остаточный временной ряд позволяет сравнивать высоты пиков различных пленок. В одном случае были подсчитаны все пики (однократное увеличение и уменьшение временного шага).Во втором случае подсчитывались только пики, показывающие последовательность минимум из 3 последовательных шагов увеличения и уменьшения. В случае высоты пика и ширины пика только 5 самых высоких и самых широких пиков с минимум 3 шагами увеличения и уменьшения были взяты и включены в набор функций. Всего в набор функций было включено 18 функций. Полный список извлеченных характеристик можно увидеть в таблице 2. Эти характеристики были извлечены для каждой пленки и для каждого измеренного ЛОС. Для каждого из 66 измеренных ЛОС была построена отдельная модель.Статистика набора данных показана в дополнительных таблицах S2 и S3.
Остаточный временной ряд позволяет сравнивать высоты пиков различных пленок. В одном случае были подсчитаны все пики (однократное увеличение и уменьшение временного шага).Во втором случае подсчитывались только пики, показывающие последовательность минимум из 3 последовательных шагов увеличения и уменьшения. В случае высоты пика и ширины пика только 5 самых высоких и самых широких пиков с минимум 3 шагами увеличения и уменьшения были взяты и включены в набор функций. Всего в набор функций было включено 18 функций. Полный список извлеченных характеристик можно увидеть в таблице 2. Эти характеристики были извлечены для каждой пленки и для каждого измеренного ЛОС. Для каждого из 66 измеренных ЛОС была построена отдельная модель.Статистика набора данных показана в дополнительных таблицах S2 и S3.
Модель здания.
Экземпляры были созданы для каждой молекулы таким же образом с использованием четырех возрастных категорий «FSK 0», FSK 6, «FSK 12» и «FSK 16». В процессе моделирования фильмы были разделены на обучающую и тестовую. Для каждого рекомендательного класса по возрасту был выбран один фильм для тестовой выборки, а остальные фильмы были включены в учебную выборку. Для получения статистически значимых результатов в тестовую выборку входили только фильмы с 8 или более записанными показами.Исключение составляет рекомендация по возрасту «FSK 16», потому что два фильма оценивались только один раз («Советник» и «Мачете убивает»). Эти два фильма всегда помещались в один набор (обучающий или тестовый) и оценивались вместе. Следовательно, в другой набор входит «Паранормальная активность». В результате получается 24 комбинации различных обучающих и тестовых наборов (два возможных фильма в «FSK 0», «FSK 12» и «FSK 16» и три возможных фильма в «FSK 6»).
Для каждого рекомендательного класса по возрасту был выбран один фильм для тестовой выборки, а остальные фильмы были включены в учебную выборку. Для получения статистически значимых результатов в тестовую выборку входили только фильмы с 8 или более записанными показами.Исключение составляет рекомендация по возрасту «FSK 16», потому что два фильма оценивались только один раз («Советник» и «Мачете убивает»). Эти два фильма всегда помещались в один набор (обучающий или тестовый) и оценивались вместе. Следовательно, в другой набор входит «Паранормальная активность». В результате получается 24 комбинации различных обучающих и тестовых наборов (два возможных фильма в «FSK 0», «FSK 12» и «FSK 16» и три возможных фильма в «FSK 6»).
Для каждой обучающей выборки была построена случайная модель леса.[17] Классификатор случайного леса был запущен со значениями по умолчанию для его параметра, в частности, количество деревьев для роста было установлено на 500, а количество переменных, произвольно выбираемых при каждом разбиении, было установлено на 6 (количество переменных, деленное на 3).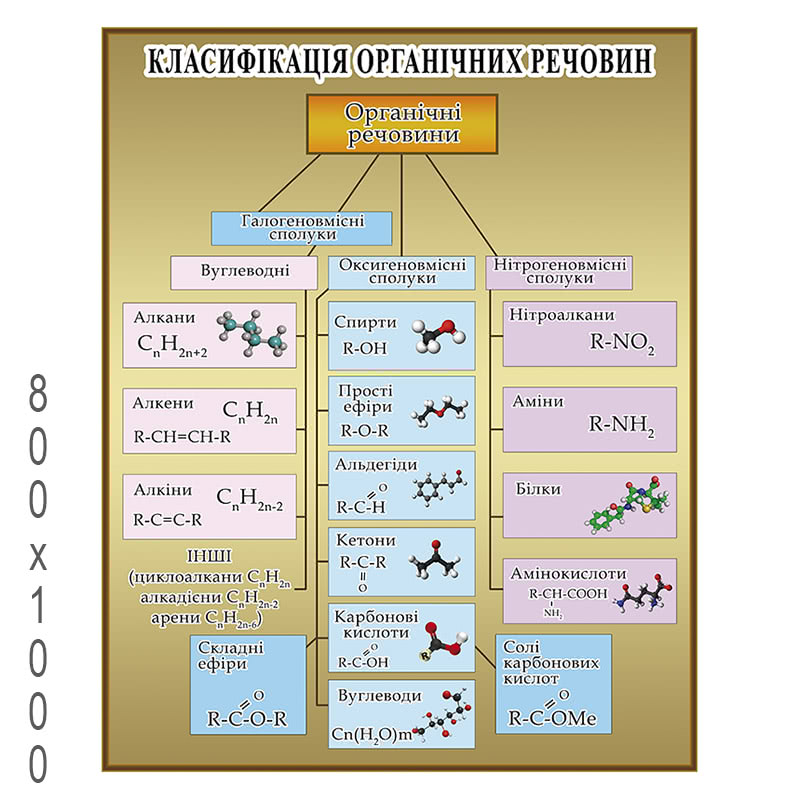 Эта модель использовалась для прогнозирования возрастного рейтинга соответствующего и невидимого набора тестов. Производительность классификатора оценивалась с использованием рабочих характеристик приемника (ROC) [18,19] и кривых прецизионного восстановления (PRC) [20]. Кривая ROC с соответствующим значением площади под кривой (AUC) часто используется в сообществе машинного обучения.Однако этот показатель эффективности не поддается интерпретации, когда речь идет о несбалансированных наборах данных [21]. В нашем исследовании количество отрицательных примеров превышает количество положительных. Например, большое количество ложных срабатываний слабо увеличивает частоту ложных срабатываний, используемую в ROC. С другой стороны, на значение точности влияет большая величина, потому что это значение сравнивает ложные срабатывания и истинные срабатывания. Между кривыми ROC и PRC существует взаимно однозначное отношение, что означает, что каждая точка на одной кривой однозначно соответствует одной точке на другой кривой и наоборот.
Эта модель использовалась для прогнозирования возрастного рейтинга соответствующего и невидимого набора тестов. Производительность классификатора оценивалась с использованием рабочих характеристик приемника (ROC) [18,19] и кривых прецизионного восстановления (PRC) [20]. Кривая ROC с соответствующим значением площади под кривой (AUC) часто используется в сообществе машинного обучения.Однако этот показатель эффективности не поддается интерпретации, когда речь идет о несбалансированных наборах данных [21]. В нашем исследовании количество отрицательных примеров превышает количество положительных. Например, большое количество ложных срабатываний слабо увеличивает частоту ложных срабатываний, используемую в ROC. С другой стороны, на значение точности влияет большая величина, потому что это значение сравнивает ложные срабатывания и истинные срабатывания. Между кривыми ROC и PRC существует взаимно однозначное отношение, что означает, что каждая точка на одной кривой однозначно соответствует одной точке на другой кривой и наоборот. [22]
[22]
Перестановочный тест.
Был проведен тест перестановки для проверки ложных результатов. Для этого теста каждому фильму в обучающей выборке был присвоен случайный возрастной рейтинг, и исходное распределение по классам было сохранено. В наборе тестов сохранены исходные возрастные категории. На основе полученной модели была рассчитана площадь под кривой от ROC и PRC. Для каждой композиции тестового набора метки обучающего набора перемешивались 50 раз, а полученные 50 показателей производительности сравнивались с соответствующими исходными показателями производительности.Таким образом, подсчитывались случаи, в которых показатель эффективности теста перестановок превышал показатель исходной композиции набора тестов, и делился на общее количество перестановок. Расчет p-значения проводился согласно Ojala et al. [13]
Как правило, к p-значениям следует применять поправку Холма-Бонферрони, чтобы противодействовать проблеме множественных сравнений, как в нашем случае, суммируя модели из всех измеренных ЛОС. В этом исследовании мы не применяли эту поправку, так как мы искали только признаки, указывающие на ЛОС, которые могут быть полезны для дальнейшего анализа.Поэтому мы использовали нескорректированные p-значения.
В этом исследовании мы не применяли эту поправку, так как мы искали только признаки, указывающие на ЛОС, которые могут быть полезны для дальнейшего анализа.Поэтому мы использовали нескорректированные p-значения.
Результаты
Результирующие значения AUC сведены в Таблицу 3. Полные результаты с соответствующим стандартным отклонением значений AUC и p-значений приведены в приложении (дополнения к таблицам S4 – S6).
Можно видеть, что большинство ЛОС показывают значения AUC ниже или около 0,5, что указывает на эффективность, аналогичную случайному классификатору. Значение AUC для CO 2 показывает наивысшее значение в возрастном классе «FSK 12», тогда как в других категориях значимости почти не наблюдается.Изопрен показывает значения AUC выше 0,7 для возрастных классов «FSK 0», «FSK 6» и «FSK 12». Значение AUC для возрастного класса «FSK 16» ниже 0,5. Однако этот класс трудно интерпретировать, поскольку мы измерили всего 6 фильмов для этого класса. Это может создать проблему для надежного предсказания этого класса. Поэтому в следующем обсуждении класс рекомендаций по возрасту «FSK 16» был опущен.
Это может создать проблему для надежного предсказания этого класса. Поэтому в следующем обсуждении класс рекомендаций по возрасту «FSK 16» был опущен.
В целом можно видеть, что на основе значений AUC несколько различных соединений способны различать один или несколько возрастных классов.Изопрен, который является одним из основных летучих органических соединений в выдыхаемом воздухе, кажется потенциально полезным соединением для дифференциации возрастных классов FSK 0, 6 и 12. Другие соединения, способные предсказать только один возрастной рекомендуемый класс, — это, например, CO 2. , формальдегид и декаметилциклопентасилоксан. Кроме того, был применен фильтр для фильмов с низкой посещаемостью, и из набора данных были удалены фильмы с участием менее 10 (всего было исключено 5 фильмов) и 20 (всего было исключено 8 фильмов).Полученные значения AUC показывают, что это удаление существенно не влияет на прогноз.
На рис. 2 показано среднее поведение значений AUC, полученных из кривых ROC и PRC для возрастных классов от 0 до 16 для изопрена. В целом, для каждого измеренного ЛОС было построено 24 модели, соответствующие 24 различным комбинациям тестов и обучающих наборов. Графики на рис. 2 показывают среднее значение показателей эффективности, рассчитанных на основе 24 различных комбинаций тестового и обучающего наборов изопрена.В случае возрастного класса «FSK 0» все значения AUC лежат выше 0,5, что указывает на неслучайный классификатор. Для рекомендаций по возрасту «FSK 6» и «FSK 12» некоторые значения AUC лежат около значения 0,5 (медианное значение AUC ~ 0,70), что указывает на то, что некоторые модели, обученные и протестированные на определенных наборах, не могут быть предсказаны с большей вероятностью, чем случайный классификатор. PRC показывает среднюю кривую по всем моделям. Кривая PRC демонстрирует поведение, аналогичное значениям AUC, описывающим возрастной класс «FSK 0» как наилучший прогнозируемый класс, за которым следуют возрастные классы «FSK 6» и «FSK 12».Однако возрастные классы «FSK 6» и «FSK 12» показывают более высокие средние значения точности ~ 0,6 для более низких значений отзыва до 0,2.
В целом, для каждого измеренного ЛОС было построено 24 модели, соответствующие 24 различным комбинациям тестов и обучающих наборов. Графики на рис. 2 показывают среднее значение показателей эффективности, рассчитанных на основе 24 различных комбинаций тестового и обучающего наборов изопрена.В случае возрастного класса «FSK 0» все значения AUC лежат выше 0,5, что указывает на неслучайный классификатор. Для рекомендаций по возрасту «FSK 6» и «FSK 12» некоторые значения AUC лежат около значения 0,5 (медианное значение AUC ~ 0,70), что указывает на то, что некоторые модели, обученные и протестированные на определенных наборах, не могут быть предсказаны с большей вероятностью, чем случайный классификатор. PRC показывает среднюю кривую по всем моделям. Кривая PRC демонстрирует поведение, аналогичное значениям AUC, описывающим возрастной класс «FSK 0» как наилучший прогнозируемый класс, за которым следуют возрастные классы «FSK 6» и «FSK 12».Однако возрастные классы «FSK 6» и «FSK 12» показывают более высокие средние значения точности ~ 0,6 для более низких значений отзыва до 0,2. Значения p из теста перестановки для изопрена для «FSK 0», «FSK 6» и «FSK 12» составляют 0,01, 0,05 и 0,16 соответственно. Следовательно, для уровня значимости α = 0,05 нулевая гипотеза для «FSK 6» и «FSK 12» не может быть отклонена. При изучении важности переменных для всех 24 моделей случайного леса, построенных для изопрена, не было обнаружено каких-либо конкретных признаков, которые отличали бы себя от других.
Значения p из теста перестановки для изопрена для «FSK 0», «FSK 6» и «FSK 12» составляют 0,01, 0,05 и 0,16 соответственно. Следовательно, для уровня значимости α = 0,05 нулевая гипотеза для «FSK 6» и «FSK 12» не может быть отклонена. При изучении важности переменных для всех 24 моделей случайного леса, построенных для изопрена, не было обнаружено каких-либо конкретных признаков, которые отличали бы себя от других.
Рис. 2. Показатели эффективности для моделей изопрена.
Ящичковые диаграммы рассчитанной площади под значениями кривой ROC (слева) и средними кривыми Precision-Recall для всех рекомендаций по возрасту (справа). Показатели эффективности были получены из моделей изопрена. Блок-схемы на верхней левой панели на рис. 2 толстая черная линия в середине блока указывает медианное значение для каждой группы. Поле содержит межквартильный диапазон (IQR) данных, а усы определяют 1.5-кратный IQR или минимум и максимум, если ни один балл не превышает 1,5-кратный IQR.
https://doi. org/10.1371/journal.pone.0203044.g002
org/10.1371/journal.pone.0203044.g002
Этикетки разных жанров
В этом разделе мы исследуем различия в характеристиках классификатора фильмов одной возрастной категории, но с разными жанровыми ярлыками. Жанровые ярлыки для фильмов были взяты из Международной базы данных фильмов (IMDb). [23] Для этого были отобраны фильмы возрастной категории «ФСК 6» из-за их одинаковой периодичности по количеству просмотров (10 фильмов «Бадди», 12 фильмов «Прогулки с динозаврами 3D» и 13 фильмов «Тайна»). Жизнь Уолтера Митти »).Здесь фильм «Прогулка с динозаврами 3D» был обозначен как «боевик», тогда как «Бадди» и «Тайная жизнь Уолтера Митти» — это «комедийные» фильмы.
На рис. 3 показано распределение значений AUC и PRC в зависимости от пленки в тестовом наборе. Справа показаны результаты для возрастной рекомендации «FSK 0», а слева — результаты для «FSK 6». Обратите внимание, что один фильм был выбран в тестовой выборке, а два других фильма были включены в учебную выборку. Слева видно, что максимальное среднее значение AUC (~ 0.77 ± 0,13), поместив фильм «Прогулки с динозаврами 3D» в тестовую установку. Эта комбинация тестов и обучающих наборов также показывает наивысшее стандартное отклонение. На рис. 3 сравниваются средние значения PRC трех фильмов в возрастной категории «FSK 6». В целом, все три кривые PRC, похоже, ведут себя одинаково, несмотря на использование фильмов с разными жанровыми этикетками. Оценка тестов на перестановку отдельно для трех разных фильмов приводит к тому, что p-значения для фильма «Бадди» равны 0,06, «Тайная жизнь Уолтера Митти» равны 0.04 и «Прогулка с динозаврами 3D» — 0,11. В этом случае p-значения были рассчитаны путем сравнения исходных комбинаций тестовых наборов, в которых появляется выбранный фильм, с соответствующими рандомизированными комбинациями. Эти значения p соответствуют диаграмме на рис. 3, показывающей фильм «Прогулки с динозаврами 3D» с самым высоким стандартным отклонением. Таким образом, выше шансы, что значения AUC теста перестановки превышают значения исходного.
Слева видно, что максимальное среднее значение AUC (~ 0.77 ± 0,13), поместив фильм «Прогулки с динозаврами 3D» в тестовую установку. Эта комбинация тестов и обучающих наборов также показывает наивысшее стандартное отклонение. На рис. 3 сравниваются средние значения PRC трех фильмов в возрастной категории «FSK 6». В целом, все три кривые PRC, похоже, ведут себя одинаково, несмотря на использование фильмов с разными жанровыми этикетками. Оценка тестов на перестановку отдельно для трех разных фильмов приводит к тому, что p-значения для фильма «Бадди» равны 0,06, «Тайная жизнь Уолтера Митти» равны 0.04 и «Прогулка с динозаврами 3D» — 0,11. В этом случае p-значения были рассчитаны путем сравнения исходных комбинаций тестовых наборов, в которых появляется выбранный фильм, с соответствующими рандомизированными комбинациями. Эти значения p соответствуют диаграмме на рис. 3, показывающей фильм «Прогулки с динозаврами 3D» с самым высоким стандартным отклонением. Таким образом, выше шансы, что значения AUC теста перестановки превышают значения исходного.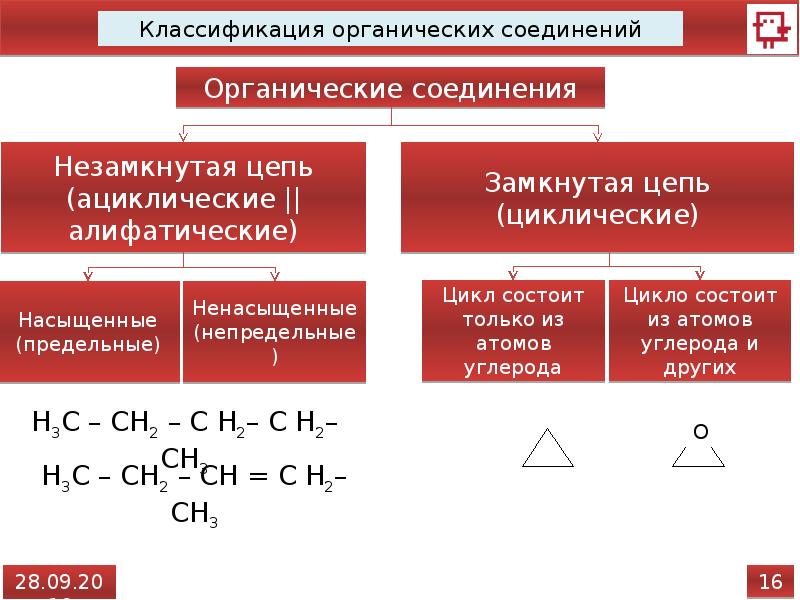 Похоже, что некоторые комбинации тренировочного и тестового набора плохо предсказывают фильм «Прогулки с динозаврами 3D», и что название жанра влияет на результаты предсказания.Однако фильм «Прогулка с динозаврами 3D» можно было бы сравнительно хорошо спрогнозировать, имея в виду, что в учебном наборе нет другого боевика, если в тестовом наборе есть «Прогулка с динозаврами 3D».
Похоже, что некоторые комбинации тренировочного и тестового набора плохо предсказывают фильм «Прогулки с динозаврами 3D», и что название жанра влияет на результаты предсказания.Однако фильм «Прогулка с динозаврами 3D» можно было бы сравнительно хорошо спрогнозировать, имея в виду, что в учебном наборе нет другого боевика, если в тестовом наборе есть «Прогулка с динозаврами 3D».
Рис. 3. Показатели качества для моделей изопрена с использованием только пленок «FSK 6».
Площадь под кривой ROC и кривыми точного восстановления, разделенными на разные пленки в рекомендации по возрасту «FSK 6». Фильм «Прогулка с динозаврами 3D» был назван «боевиком», тогда как «Бадди» и «Тайная жизнь Уолтера Митти» — комедийные фильмы.
https://doi.org/10.1371/journal.pone.0203044.g003
Различный возраст аудитории
Информация о продаже билетов предоставила долю зрителей моложе 12 лет и зрителей старше 12 лет. В возрастном рейтинге «FSK 0» показанные фильмы были ориентированы на самую разную аудиторию. Фильм «Помогите, я уменьшил своего учителя» был классифицирован IMDB как «семейный», и доля зрителей моложе 12 лет составила 64%. Напротив, фильм «Тогда я выхожу» посмотрели только зрители от 12 лет и старше.Фильм «Тогда я уезжаю» был больше ориентирован на взрослых, поскольку он рассказывает о человеке, совершающем паломничество в Испанию. Кроме того, известно, что уровень выбросов CO 2 зависит от возраста и повышается до возраста от 21 до <30 лет для мужчин и женщин, а затем снова снижается [24]. В предыдущей публикации, касающейся уровней выбросов ЛОС, было показано, что уровень выбросов CO 2 для фильма «Тогда я выхожу» выше, чем для фильма «Помогите, я сократил своего учителя».[14] Это важный намек на то, что средний возраст зрителей у фильма «Тогда я выхожу» больше, чем у фильма «Помогите, я уменьшил своего учителя». Примечательно, что этот возрастной рейтинг можно было предсказать с самым высоким AUC 0,84, несмотря на разницу в среднем возрасте зрителей.
Фильм «Помогите, я уменьшил своего учителя» был классифицирован IMDB как «семейный», и доля зрителей моложе 12 лет составила 64%. Напротив, фильм «Тогда я выхожу» посмотрели только зрители от 12 лет и старше.Фильм «Тогда я уезжаю» был больше ориентирован на взрослых, поскольку он рассказывает о человеке, совершающем паломничество в Испанию. Кроме того, известно, что уровень выбросов CO 2 зависит от возраста и повышается до возраста от 21 до <30 лет для мужчин и женщин, а затем снова снижается [24]. В предыдущей публикации, касающейся уровней выбросов ЛОС, было показано, что уровень выбросов CO 2 для фильма «Тогда я выхожу» выше, чем для фильма «Помогите, я сократил своего учителя».[14] Это важный намек на то, что средний возраст зрителей у фильма «Тогда я выхожу» больше, чем у фильма «Помогите, я уменьшил своего учителя». Примечательно, что этот возрастной рейтинг можно было предсказать с самым высоким AUC 0,84, несмотря на разницу в среднем возрасте зрителей.
Разницу в величине AUC между этими двумя пленками с усредненной кривой PRC для каждой пленки можно увидеть на рис. 4 справа. Обе кривые PRC показывают значения точности выше, чем у случайного классификатора.Видно, что классификаторы работают хуже, если в обучающую выборку входят фильм «Тогда я выхожу» и тестовый набор «Помогите, я уменьшил своего учителя», чем наоборот. Тем не менее, разница в возрасте зрителей между этими двумя фильмами, похоже, не ухудшает классификатор критически, и возрастной класс все же можно предсказать в разумной степени.
Рис. 4. Показатели качества для моделей изопрена, включающих только пленки «FKS 0».
Площадь под кривой ROC и кривых прецизионного восстановления, разделенных на разные пленки в рекомендации по возрасту «FSK 0».Фильм «Помоги мне уменьшить своего учителя» посмотрела большая часть зрителей моложе 12 лет (64%), тогда как фильм «Тогда я ухожу» посмотрели только зрители от 12 лет.
https://doi.org/10.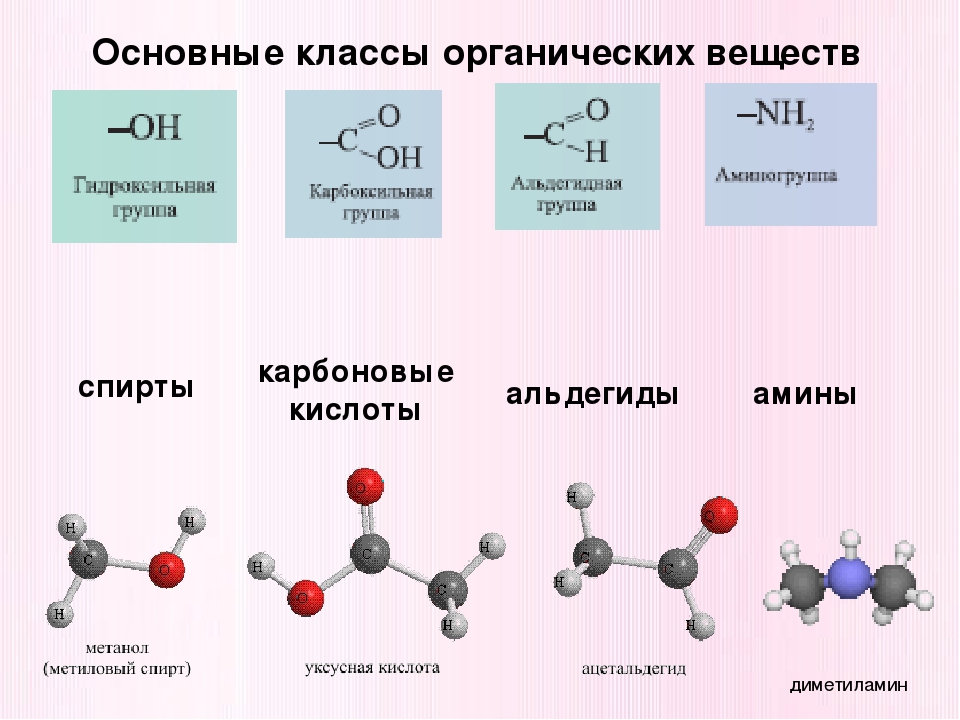 1371/journal.pone.0203044.g004
1371/journal.pone.0203044.g004
Обсуждение
В этом исследовании мы оценили, можно ли предсказать возрастную классификацию фильма на основе изменений содержания химических веществ в воздухе, измеренных в кинотеатре. В предыдущих публикациях [7,8] сообщалось о соответствии между аудиовизуальными стимулами и выбросом ЛОС от человека.Вышеупомянутое исследование показало, что сцены, помеченные как «саспенс» и «комедия», заставили аудиторию значительно изменить свои выбросы химикатов. Тогда интуитивно мы можем подумать, что эти химические изменения могут быть связаны с возрастной классификацией, данной фильму. Например, фильмы с ужасающими сценами вызывают учащение пульса и дыхания и, следовательно, более высокие и более изменчивые уровни CO 2 . Действительно, значения CO 2 эффективны при прогнозировании фильмов FSK 12, вероятно, потому, что фильмы этой категории были боевиками.Однако наши результаты показывают, что большинство измеренных химических веществ, включая CO 2 , не позволяют надежно предсказать все возрастные классификации пленок (0, 6, 12).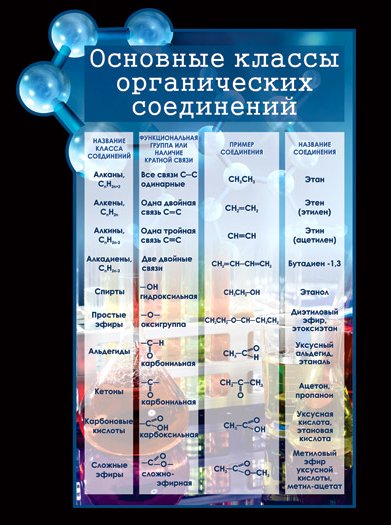 Одна из причин этого может заключаться в том, что текущие возрастные рекомендации для фильмов не связаны исключительно с интенсивностью индуцированного страха или врожденными внутренними реакциями аудитории на содержание фильма. Скорее, он субъективно основан на синтезе множества аспектов, таких как степень и интенсивность насилия, секс, антисоциальное поведение, употребление наркотиков и ненормативная лексика.При условии, что реакция аудитории на эти аспекты фильма каким-то образом отражается в большом наборе химических данных, альтернативная и объективная возрастная классификация все еще возможна. Интересно отразить, что подход, основанный на химических веществах, который предлагается здесь, будет основан на непосредственно измеренных ответах большой тестовой аудитории, тогда как текущая схема основана на субъективной оценке фильма относительно небольшим количеством людей, которым доверено отражать общественное мнение. .
Одна из причин этого может заключаться в том, что текущие возрастные рекомендации для фильмов не связаны исключительно с интенсивностью индуцированного страха или врожденными внутренними реакциями аудитории на содержание фильма. Скорее, он субъективно основан на синтезе множества аспектов, таких как степень и интенсивность насилия, секс, антисоциальное поведение, употребление наркотиков и ненормативная лексика.При условии, что реакция аудитории на эти аспекты фильма каким-то образом отражается в большом наборе химических данных, альтернативная и объективная возрастная классификация все еще возможна. Интересно отразить, что подход, основанный на химических веществах, который предлагается здесь, будет основан на непосредственно измеренных ответах большой тестовой аудитории, тогда как текущая схема основана на субъективной оценке фильма относительно небольшим количеством людей, которым доверено отражать общественное мнение. .
Из всех протестированных видов мы обнаружили, что изопрен лучше всего подходит для прогнозирования различных возрастных категорий. Наибольшее значение AUC было получено для «FSK 0» (значение AUC 0,84 ± 0,07). В этом классе рекомендаций по возрасту у этих двух фильмов была разная пропорция молодых зрителей (в «Помогите, я сократил своего учителя» 64% аудитории были моложе 12 лет, а в «Тогда я выхожу» — только зрители того возраста. от 12 лет и старше). Известно, что дети выделяют изопрена значительно меньше, чем взрослые.[14,25] Тем не менее, было обнаружено, что возрастная структура аудитории не критически ухудшает предсказательную силу классификатора и что особенности, отображающие структуру фильмов, смогли выделить этот класс среди остальных. Более низкие значения точности были зарегистрированы для классов рекомендаций по возрасту «FSK 6» и «FSK 12». Для этих двух классов значение p теста перестановки находится между 0,05 для «FSK 6» и 0,16 для «FSK 12». В возрастную рекомендацию «FSK 6» вошли три фильма с одинаковой частотой, двух разных жанровых категорий (два комедийных фильма и один боевик).Опять же, похоже, это не влияет на работу классификатора.
Наибольшее значение AUC было получено для «FSK 0» (значение AUC 0,84 ± 0,07). В этом классе рекомендаций по возрасту у этих двух фильмов была разная пропорция молодых зрителей (в «Помогите, я сократил своего учителя» 64% аудитории были моложе 12 лет, а в «Тогда я выхожу» — только зрители того возраста. от 12 лет и старше). Известно, что дети выделяют изопрена значительно меньше, чем взрослые.[14,25] Тем не менее, было обнаружено, что возрастная структура аудитории не критически ухудшает предсказательную силу классификатора и что особенности, отображающие структуру фильмов, смогли выделить этот класс среди остальных. Более низкие значения точности были зарегистрированы для классов рекомендаций по возрасту «FSK 6» и «FSK 12». Для этих двух классов значение p теста перестановки находится между 0,05 для «FSK 6» и 0,16 для «FSK 12». В возрастную рекомендацию «FSK 6» вошли три фильма с одинаковой частотой, двух разных жанровых категорий (два комедийных фильма и один боевик).Опять же, похоже, это не влияет на работу классификатора. В случае «FSK 12» средние значения AUC составили 0,63 ± 0,10, если фильм «Звездные войны» включен в тестовую выборку (и фильмы «Голодные игры» и «Голодные игры» в учебную выборку), 0,77 ± 0,05, если фильм «Голодные игры» входит в тестовую выборку (фильмы «Звездные войны» и «Голодные игры» в обучающей выборке). Более низкое значение AUC (0,63) и соответствующее более высокое значение p теста перестановки (0.25 по сравнению с p-значением 0,08, включая «Голодные игры» в тестовой выборке), вероятно, связано с меньшим количеством обучающих примеров (12 просмотров с «Голодными играми» и «Голодными играми» в обучающей выборке).
В случае «FSK 12» средние значения AUC составили 0,63 ± 0,10, если фильм «Звездные войны» включен в тестовую выборку (и фильмы «Голодные игры» и «Голодные игры» в учебную выборку), 0,77 ± 0,05, если фильм «Голодные игры» входит в тестовую выборку (фильмы «Звездные войны» и «Голодные игры» в обучающей выборке). Более низкое значение AUC (0,63) и соответствующее более высокое значение p теста перестановки (0.25 по сравнению с p-значением 0,08, включая «Голодные игры» в тестовой выборке), вероятно, связано с меньшим количеством обучающих примеров (12 просмотров с «Голодными играми» и «Голодными играми» в обучающей выборке).
Изопрен вырабатывается в организме во время холестеринезиса [26] и накапливается в мышечной ткани. Движение мышц заставляет накопленный изопрен попадать в кровоток, а затем выводить его из организма через дыхание. [15,16] Интересно, что этот вид, а не CO 2 , может быть использован в качестве удачного обозначения для классификации пленок. минимум для ФСК 0,6 и 12. Как правило, можно было видеть, что изопрен воспроизводимо выделялся с более высокими скоростями в один и тот же момент времени в одном и том же фильме, даже с разной аудиторией. Высота пиков, изображенная на рис. 5, показывает наименьшие значения для возрастного класса «FSK 0». Это могло быть из-за более низкой концентрации изопрена в дыхании детей в фильме «Помогите мне уменьшить моего учителя» или из-за меньшего количества сцен с напряжением в обоих фильмах. Саспенс-сцены обычно приводят к учащению сердцебиения и дыхания, а также к непроизвольным движениям, которые увеличивают уровень выброса изопрена у зрителей.Мы можем предположить, что в будущем изопрен может использоваться для объективной классификации фильмов, используя набор данных, показанный здесь, в качестве основы или, возможно, измерения тестовой аудитории могут быть использованы классификационной комиссией для помощи в принятии решений в пограничных случаях.
Как правило, можно было видеть, что изопрен воспроизводимо выделялся с более высокими скоростями в один и тот же момент времени в одном и том же фильме, даже с разной аудиторией. Высота пиков, изображенная на рис. 5, показывает наименьшие значения для возрастного класса «FSK 0». Это могло быть из-за более низкой концентрации изопрена в дыхании детей в фильме «Помогите мне уменьшить моего учителя» или из-за меньшего количества сцен с напряжением в обоих фильмах. Саспенс-сцены обычно приводят к учащению сердцебиения и дыхания, а также к непроизвольным движениям, которые увеличивают уровень выброса изопрена у зрителей.Мы можем предположить, что в будущем изопрен может использоваться для объективной классификации фильмов, используя набор данных, показанный здесь, в качестве основы или, возможно, измерения тестовой аудитории могут быть использованы классификационной комиссией для помощи в принятии решений в пограничных случаях.
Из представленных результатов следует, что особенности следа изопрена соответствуют рисунку и интенсивности индуцированных эмоций в пленке. Эту структуру можно отличить от других классов, даже если аудитория между фильмами одного класса состоит из разных возрастных категорий («FSK 0») или жанровые ярлыки фильмов различаются («FSK 6»).В общем, свойства следов изопрена должны отражать субъективную оценку рейтингового агентства (возрастная классификация). Было бы интересно посмотреть, действует ли изопрен в качестве индикатора в других областях с множеством основных стимулов, таких как психологический стресс. Восприятие стресса также может быть вызвано несколькими условиями и событиями окружающей среды.
Эту структуру можно отличить от других классов, даже если аудитория между фильмами одного класса состоит из разных возрастных категорий («FSK 0») или жанровые ярлыки фильмов различаются («FSK 6»).В общем, свойства следов изопрена должны отражать субъективную оценку рейтингового агентства (возрастная классификация). Было бы интересно посмотреть, действует ли изопрен в качестве индикатора в других областях с множеством основных стимулов, таких как психологический стресс. Восприятие стресса также может быть вызвано несколькими условиями и событиями окружающей среды.
В этом исследовании мы использовали случайную модель леса, построенную для каждой измеренной массы отдельно, чтобы предсказать рекомендуемый возраст фильма.Дальнейшая работа должна включать в себя комбинации разных масс. Как показано в таблице 3, массы, такие как m65.0215 или CO 2 , показывают более высокие значения AUC для определенных возрастных классов, таких как «FSK 6» (AUC 0,79 для m65,0215) и «FSK 12» (AUC 0,75 для CO . 2 ), чем изопрен. Эти массы могут лучше реагировать на определенные сцены или снимать похожие структуры фильмов в рамках одного и того же возрастного рекомендательного класса. Таким образом, сочетание характеристик этих масс может помочь отразить структуру пленки и улучшить характеристики классификатора.Этот подход требует большего количества измеряемых фильмов, потому что, как и в нашем случае, классификатор очень хорошо адаптировал особенности нескольких фильмов в обучающей выборке (что привело к идеальной классификации для обучающей выборки), так что экстраполяция на новые фильмы в тесте набор привел к сравнительно низким значениям производительности. Добавление новых функций из других масс усугубляет эту проблему. Следовательно, следует использовать новый набор для проверки, чтобы выбрать лучшие сочетания этих масс и протестировать их на невидимом наборе пленок.Следовательно, будущие наборы данных должны включать большее количество фильмов.
2 ), чем изопрен. Эти массы могут лучше реагировать на определенные сцены или снимать похожие структуры фильмов в рамках одного и того же возрастного рекомендательного класса. Таким образом, сочетание характеристик этих масс может помочь отразить структуру пленки и улучшить характеристики классификатора.Этот подход требует большего количества измеряемых фильмов, потому что, как и в нашем случае, классификатор очень хорошо адаптировал особенности нескольких фильмов в обучающей выборке (что привело к идеальной классификации для обучающей выборки), так что экстраполяция на новые фильмы в тесте набор привел к сравнительно низким значениям производительности. Добавление новых функций из других масс усугубляет эту проблему. Следовательно, следует использовать новый набор для проверки, чтобы выбрать лучшие сочетания этих масс и протестировать их на невидимом наборе пленок.Следовательно, будущие наборы данных должны включать большее количество фильмов.
Заключение
Это исследование представляет основу для объективной оценки фильма в соответствии с системой классификации по возрасту, основанной на летучих органических соединениях и CO 2 в воздухе кинотеатров. Оценка этих соединений привела к тому, что ни одно летучее соединение, произведенное человеком, не могло различить все четыре возрастных класса (0, 6, 12, 16). Проблемы возникают из-за небольшого количества доступных фильмов в каждой возрастной категории, особенно для возрастной категории «FSK 16».В целом результаты этого первого исследования для изопрена многообещающие. Возможно, в будущем можно будет разработать показатели, используя комбинации изопрена и других ЛОС для обозначения классификации фильмов. Это может быть полезно для киноиндустрии, которая занимается монтажом фильмов, чтобы сделать их доступными для желаемой целевой аудитории. Для рекомендаций по возрасту «FSK 0» видно, что классификация основана на фильмах этого класса, а не на возрастной структуре (другая целевая аудитория в «FSK 0»), поэтому классифицирующая способность не основана на более низком выброс изопрена у детей.Предлагаемые здесь концепции можно будет проверить более тщательно, если будет отобрано больше фильмов.
Оценка этих соединений привела к тому, что ни одно летучее соединение, произведенное человеком, не могло различить все четыре возрастных класса (0, 6, 12, 16). Проблемы возникают из-за небольшого количества доступных фильмов в каждой возрастной категории, особенно для возрастной категории «FSK 16».В целом результаты этого первого исследования для изопрена многообещающие. Возможно, в будущем можно будет разработать показатели, используя комбинации изопрена и других ЛОС для обозначения классификации фильмов. Это может быть полезно для киноиндустрии, которая занимается монтажом фильмов, чтобы сделать их доступными для желаемой целевой аудитории. Для рекомендаций по возрасту «FSK 0» видно, что классификация основана на фильмах этого класса, а не на возрастной структуре (другая целевая аудитория в «FSK 0»), поэтому классифицирующая способность не основана на более низком выброс изопрена у детей.Предлагаемые здесь концепции можно будет проверить более тщательно, если будет отобрано больше фильмов. В частности, был бы интересен более крупный набор фильмов с рейтингом «FSK 16» и «FSK 18», поскольку они представляют крайние категории.
В частности, был бы интересен более крупный набор фильмов с рейтингом «FSK 16» и «FSK 18», поскольку они представляют крайние категории.
Благодарности
Мы очень благодарны компании Cinestar за разрешение использовать свои помещения. В частности, мы благодарим Майкла Джинеса, Йохена Вульфа, Константина Максимилиана Беста, Акселя Кесслера, Ричарда Стотца, Стефана Леманна и всю команду поддержки за их восторженную поддержку этого проекта.
Ссылки
- 1. Домашний [Интернет]. MPAA. [цитировано 11 июля 2018 г.]. https://www.mpaa.org/
- 2. FSK — Информация о FSK [Интернет]. [цитировано 11 июля 2018 г.]. https://www.spio-fsk.de/?seitid=1287&tid=480
- 3. Рейтинги фильмов [Интернет]. MPAA. [цитировано 11 июля 2018 г.]. https://www.mpaa.org/film-ratings/
- 4. О нас [Интернет]. [цитировано 11 июля 2018 г.]. https://www.cbfcindia.gov.in/main/about-us.html
- 5.Kriterien [Интернет].
 ук-Т3-Стандарт. 2016 [цитируется 31 марта 2017 г.]. http://fsf.de
ук-Т3-Стандарт. 2016 [цитируется 31 марта 2017 г.]. http://fsf.de - 6. FSK — Prüfverfahren und Ausschüsse [Интернет]. [цитировано 11 июля 2018 г.]. https://www.spio-fsk.de/?seitid=505&tid=72
- 7. Уильямс Дж., Стеннер С., Викер Дж., Краутер Н., Дерстроф Б., Бурцукидис Э. и др. Кинозрители воспроизводимо изменяют химический состав воздуха во время просмотра фильмов, транслируя излучение, характерное для конкретной сцены, на вдохе. Научный доклад, 2016 18 апреля; 6 (25464).
- 8. Wicker J, Krauter N, Derstroff B, Stönner C, Bourtsoukidis E, Klüpfel T. и др. Cinema Data Mining: запах страха. В: Материалы 21-й Международной конференции ACM SIGKDD по открытию знаний и интеллектуальному анализу данных. Нью-Йорк, Нью-Йорк, США: ACM; 2015. с. 1295–1304. (KDD ‘15).
- 9.
Кабинсингха С., Чиндасорн С., Чантрапорнчай С. Подход и применение рейтинга фильмов на основе интеллектуального анализа данных. Int J Eng Innov Technol.
 Июль 2012 г .; 2 (1): 77–83.
Июль 2012 г .; 2 (1): 77–83. - 10.Чангкау П., Конгкачандра Р. Автоматический рейтинг фильмов с использованием визуальной и лингвистической информации. В: 2010 Первая международная конференция по интегрированным интеллектуальным вычислениям. 2010. с. 12–6.
- 11. Lines J, Bagnall A, Caiger-Smith P, Anderson S. Классификация бытовых устройств по профилям использования электроэнергии. В: Интеллектуальная разработка данных и автоматизированное обучение — IDEAL 2011. Springer, Берлин, Гейдельберг; 2011. с. 403–12. (Конспект лекций по информатике).
- 12.Тошнивал Д. Извлечение признаков из данных временных рядов. J Comput Methods Sci Eng. 1 января 2009 г .; 9 (1,2S1): 99–110.
- 13. Ояла М., Гаррига Г.К. Перестановочные тесты для изучения производительности классификатора. J Mach Learn Res. 2010 август; 11: 1833–1863.
- 14.
Стеннер С., Эдтбауэр А., Уильямс Дж. Уровни выбросов летучих органических соединений в реальном мире от сидящих взрослых и детей для использования в исследованиях воздуха в помещениях.
 Внутренний воздух. 6 июля 2017 г .; (0): 1–9.
Внутренний воздух. 6 июля 2017 г .; (0): 1–9. - 15. King J, Mochalski P, Unterkofler K, Teschl G, Klieber M, Stein M и др.Дыхание изопрена: пациенты с мышечной дистрофией поддерживают концепцию пула изопрена на периферии человеческого тела. Biochem Biophys Res Commun. 6 июля 2012 г.; 423 (3): 526–30. pmid: 22683640
- 16. Карл Т., Празеллер П., Майр Д., Джордан А., Ридер Дж., Фолл Р. и др. Изопрен дыхания человека и его связь с уровнем холестерина в крови: новые измерения и моделирование. J Appl Physiol. 2001, 1 августа; 91 (2): 762–70. pmid: 11457792
- 17. Брейман Л. Случайные леса. Mach Learn.2001 г., 1 октября; 45 (1): 5–32.
- 18. Фосетт Т. Графы ROC: заметки и практические соображения для исследователей. 2004 г. 12–56.
- 19. Фосетт Т. Введение в анализ ROC. Pattern Recognit Lett. 2006 июн; 27 (8): 861–74.
- 20.
Пауэрс Д. Оценка: от точности, отзыва и F-меры к ROC, информированности, значимости и корреляции.
 2: 37–63.
2: 37–63. - 21. Сайто Т., Ремсмайер М. График точности-отзыва более информативен, чем график ROC при оценке двоичных классификаторов на несбалансированных наборах данных.PLOS ONE. 2015 4 марта; 10 (3): e0118432. pmid: 25738806
- 22. Дэвис Дж., Гоадрич М. Взаимосвязь между точным воспроизведением и кривыми ROC. В: Материалы 23-й Международной конференции по машинному обучению. Нью-Йорк, Нью-Йорк, США: ACM; 2006. с. 233–240. (ICML ‘06).
- 23. IMDb — фильмы, телевидение и знаменитости [Интернет]. IMDb. [цитируется 3 июня 2016 г.]. http://www.imdb.com/
- 24. Персили А., де Йонге Л. Показатели образования углекислого газа для жителей зданий.Внутренний воздух. 20 марта 2017 г .;
- 25. Лехнер М., Мозер Б., Нидерсеер Д., Карлседер А., Хольцкнехт Б., Фукс М. и др. Гендерные и возрастные различия в уровнях выдыхаемого изопрена. Respir Physiol Neurobiol. 2006 декабрь; 154 (3): 478–83. pmid: 16510318
- 26.
 Stone BG, Besse TJ, Duane WC, Evans CD, DeMaster EG. Влияние регуляции биосинтеза холестерина на выделение изопрена с дыханием у мужчин. Липиды. 1993 августа; 28 (8): 705–8. pmid: 8377584
Stone BG, Besse TJ, Duane WC, Evans CD, DeMaster EG. Влияние регуляции биосинтеза холестерина на выделение изопрена с дыханием у мужчин. Липиды. 1993 августа; 28 (8): 705–8. pmid: 8377584
Глава 13 — Органическая химия
Введение
Органическая химия — это изучение соединений на основе углерода.Структурный и генетический материал живых организмов — это органические соединения. Многие вещества, с которыми мы сталкиваемся ежедневно, представляют собой органические соединения: лекарства, пластмассы, ткани, красители, бумага, продукты питания, витамины и т. Д. Из-за того, как атомы углерода могут связываться друг с другом, количество органических соединений огромен. В этой главе мы исследуем некоторые фундаментальные темы структуры и реакционной способности нескольких классов органических соединений, применяя наши знания о структурах Льюиса, резонансе и кислотно-основной теории Льюиса.13.
 1 Углеводороды
1 УглеводородыВведение
Мы начинаем изучение органической химии с двух классов соединений, содержащих только углерод и водород.Предварительные требования
Цели
•
Назовите и нарисуйте два простейших алкана.•
Нарисуйте линейно-штриховые, льюисовские, конденсированные и скелетные структуры алканов.•
Преобразуйте скелетные структуры в молекулярные формулы.•
Различают прямую или непрерывную цепь и разветвленную цепь.•
Напишите уравнение горения алкана.•
Дайте определение алкену, нарисуйте и назовите два простейших алкена.•
Изобразите изомеры алкена.•
Дайте определение полиену и объясните, почему многие полиены поглощают видимый свет.•
Дайте определение алкинам и обсудите их изомеры.
•
Различают насыщенные и ненасыщенные углеводороды.
Алканы
13.1-1. Определение
Атомы углерода всегда имеют четыре связи: четыре одинарные связи, две одинарные и одну двойную связь, две двойные связи или одинарную связь и тройную связь. Хотя углерод является основным строительным блоком, органические соединения обычно также имеют атомы водорода.Кислород и азот тоже обычны, но почти любой другой элемент можно найти в органических соединениях. В этом разделе мы имеем дело с классом соединений, известных как углеводородов , которые представляют собой соединения, содержащие только углерод и водород. Алканы — простейшие органические соединения. Все атомы углерода в алкане являются sp 3 гибридизированными и тетраэдрическими, и все связи являются сигма-связями, что делает алканы относительно инертными. У них есть общая формула C n H 2 n + 2 , где n — целое число. В таблице 13.1 показаны три простейших алкана.
В таблице 13.1 показаны три простейших алкана.| Алкан | Структура |
|---|---|
| Метан, CH 4 | |
| Этан, C 2 H 6 | |
| Пропан, C 3 H 8 |
Таблица 13.1: Простейшие алканы
13.1-2. Конструкции
Атомы углерода всегда имеют четыре связи в своих соединениях.
Бывают случаи, когда представление штрих-клин-тире используется для демонстрации трехмерной структуры органических соединений, но структуры алканов очень динамичны, потому что групп, связанных одинарной связью, могут вращаться относительно друг друга (во многом как колеса на оси) . Следовательно, часто используются другие сокращенные обозначения. Эти другие методы, показанные на рисунках 13. 1a, 13.1b, 13.1c и 13.1d, основаны на следующих моментах, общих для большинства органических молекул.
1a, 13.1b, 13.1c и 13.1d, основаны на следующих моментах, общих для большинства органических молекул.•
Атомы углерода составляют их основу.•
Атомы углерода всегда имеют четыре связи с собой.•
Обычно присутствует много связей C – H.
 Положения атомов водорода выводятся из числа связей, показанных для каждого углерода. Каждый атом углерода должен иметь четыре связи (двойная связь считается как две связи, а тройная связь считается как три), поэтому количество связей C – H с любым атомом углерода равно четырем минус количество связей, показанных с атомом углерода. в скелетной структуре . Например, скелетная структура показывает только одну связь с каждым из концевых атомов углерода, поэтому также должно быть три связи C – H с каждым из концевых атомов углерода.Структура показывает две связи со средним углеродом, поэтому также должно быть две связи C – H.
Положения атомов водорода выводятся из числа связей, показанных для каждого углерода. Каждый атом углерода должен иметь четыре связи (двойная связь считается как две связи, а тройная связь считается как три), поэтому количество связей C – H с любым атомом углерода равно четырем минус количество связей, показанных с атомом углерода. в скелетной структуре . Например, скелетная структура показывает только одну связь с каждым из концевых атомов углерода, поэтому также должно быть три связи C – H с каждым из концевых атомов углерода.Структура показывает две связи со средним углеродом, поэтому также должно быть две связи C – H.13.1-3. Молекулярные формулы для структур скелета
Ни атомы углерода, ни атомы водорода явно не показаны в структуре скелета.
Используйте следующие правила, чтобы преобразовать скелетные структуры в молекулярные формулы.•
Атомы углерода представлены в виде пересечений или концов линий.
•
Число атомов водорода, присоединенных к атому углерода, равно четырем минус количество связей, включающих атом углерода, потому что атомы углерода всегда участвуют в четырех связях. Обратите внимание, что двойные и тройные связи считаются как 2 и 3 связи соответственно.
Напишите молекулярную формулу для данных структур скелета. Обратите внимание, что порядок элементов в формуле должен быть C, затем H, затем O .1+ для NH 4 1+ . Пропускайте пробелы.)
13.1-4. Цепи
Изомеры — это разные молекулы с одинаковой формулой.
Есть только один способ соединить атомы углерода в каждом из рассмотренных до сих пор алканов, но есть несколько способов соединить атомы углерода во всех алканах с более чем тремя атомами углерода. Способ, которым связаны атомы углерода, называется связностью . Молекулы с одинаковой формулой, но с разной связностью — это разные молекулы, а разные молекулы с одинаковой формулой называются изомерами , , , . Молекулы, в которых углерод не связан более чем с двумя другими атомами углерода, называются прямыми цепями или непрерывными цепями , в то время как молекулы, которые содержат по крайней мере один углерод с тремя или четырьмя присоединенными к нему атомами углерода, называются разветвленных цепей .Бутан (C 4 H 10 ) существует в виде двух изомеров, с одной прямой цепью и одной разветвленной цепью.
Молекулы с одинаковой формулой, но с разной связностью — это разные молекулы, а разные молекулы с одинаковой формулой называются изомерами , , , . Молекулы, в которых углерод не связан более чем с двумя другими атомами углерода, называются прямыми цепями или непрерывными цепями , в то время как молекулы, которые содержат по крайней мере один углерод с тремя или четырьмя присоединенными к нему атомами углерода, называются разветвленных цепей .Бутан (C 4 H 10 ) существует в виде двух изомеров, с одной прямой цепью и одной разветвленной цепью.13.1-5. Горение
Алканы содержатся в основном в природном газе (в основном CH 4 и C 2 H 6 ) и в нефти. Они относительно инертны, но горят хорошо. Горение — это быстрое горение, т.е. реакция с кислородом. Продуктами горения алкана являются CO 2 и H 2 O.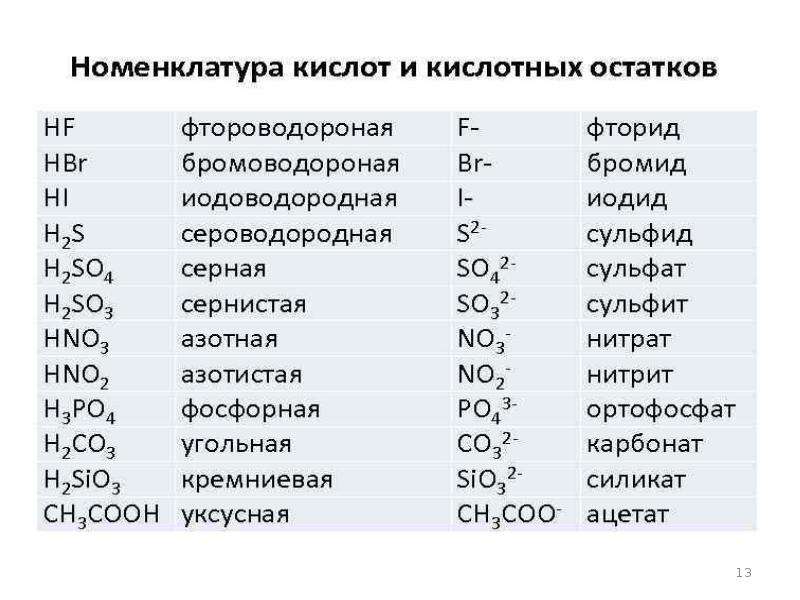 В таблице 13.2 показаны теплоты сгорания для четырех обычных алканов.
В таблице 13.2 показаны теплоты сгорания для четырех обычных алканов.| Алкан | Использовать | Реакция горения | Теплота сгорания (кДж / моль) |
|---|---|---|---|
| метан | печь на природном газе | CH 4 + 2 O 2 → CO 2 + 2 H 2 O | –891 |
| пропан | баллон с пропаном | C 3 H 8 + 5 O 2 → 3 CO 2 + 4 H 2 O | –2220 |
| бутан | зажигалки | С 4 В 10 + 6.5 O 2 → 4 CO 2 + 5 H 2 O | –2855 |
| октановое число | топливо автомобильное | C 8 H 18 + 12,5 O 2 → 8 CO 2 + 9 H 2 O | –5494 |
Таблица 13. 2: Горение некоторых обычных алканов
2: Горение некоторых обычных алканов
13.1-6. Октановое число
Каждый атом в связи C – H или C – C сохраняет один из связывающих электронов во время горения.В результате образуются два вида свободных радикалов, которые имеют неспаренные электроны. Свободные радикалы обладают высокой реакционной способностью, но они стабилизируются, когда неспаренный электрон находится на атоме, который присоединен к другим углеродсодержащим группам. Таким образом, свободные радикалы, образованные из сильно разветвленных атомов углерода, более стабильны и менее реакционноспособны, чем радикалы, образованные из углеводородов с прямой цепью. Действительно, углеводороды с прямой цепью реагируют так быстро и бурно, что могут вызвать «детонацию» двигателя. Октановое число бензина указывает на степень детонации, которую он вызывает.Контрольные молекулы показаны на рисунке 13.4. Углеводород с прямой цепью C 7 H 16 вызывает значительную детонацию и получает октановое число 0, в то время как сильно разветвленный алкан C 8 H 18 (изомер октана) вызывает слабую детонацию и ему присваивается октановое число октановое число 100. Бензин с октановым числом 87 вызывает такие же детонации, что и смесь, которая составляет 87% алкана с разветвленной цепью и 13% алкана с прямой цепью.
Бензин с октановым числом 87 вызывает такие же детонации, что и смесь, которая составляет 87% алкана с разветвленной цепью и 13% алкана с прямой цепью.Алкенес
13.1-7. Определение
Органические соединения, содержащие двойные связи углерод-углерод, называются алкенами . Атомы углерода, участвующие в двойной связи, гибридизованы sp 2 . Двумя простейшими алкенами являются этен (C 2 H 4 ) и пропен (C 3 H 6 ). Алкены, в которых положение двойной связи различно, — это разные молекулы. Однако следует позаботиться о том, чтобы убедиться, что эти два положения действительно разные, а не просто разные взгляды на одну и ту же молекулу.Каждый из двух атомов углерода sp 2 гибридизован, и молекула является плоской. На рис. 13.5a (c) показана связь pi (выделенная красным) как перекрытие двух p-орбиталей, которые не используются для создания гибридных орбиталей. Электронная плотность связи пи лежит выше и ниже плоскости молекулы. Следовательно, пи-электроны могут атаковать другие вещества, т.е.алкены являются слабыми основаниями Льюиса. Может показаться, что двойная связь в C 3 H 6 может быть размещена после первого углерода или перед последним углеродом.Однако эти два положения идентичны, потому что одно может быть преобразовано в другое вращением молекулы. Таким образом, две скелетные структуры, показанные на рисунке 13.5b (c), идентичны, а не изомеры. Просто поверните один вокруг пунктирной линии, чтобы получить другой.
Следовательно, пи-электроны могут атаковать другие вещества, т.е.алкены являются слабыми основаниями Льюиса. Может показаться, что двойная связь в C 3 H 6 может быть размещена после первого углерода или перед последним углеродом.Однако эти два положения идентичны, потому что одно может быть преобразовано в другое вращением молекулы. Таким образом, две скелетные структуры, показанные на рисунке 13.5b (c), идентичны, а не изомеры. Просто поверните один вокруг пунктирной линии, чтобы получить другой.13.1-8. Бутен
Двойная связь в C 4 H 8 может быть размещена в трех различных положениях (после первого или второго углерода в прямой цепи или после первого углерода в разветвленной цепи) с образованием трех изомеров.Вдобавок группы не могут вращаться вокруг двойных связей, как они могут вращаться вокруг одинарных связей, потому что вращение разорвало бы пи-связь. Следовательно, бутен с двумя атомами углерода (две группы CH 3 ) на одной стороне двойной связи отличается от бутена с двумя атомами углерода на противоположных сторонах.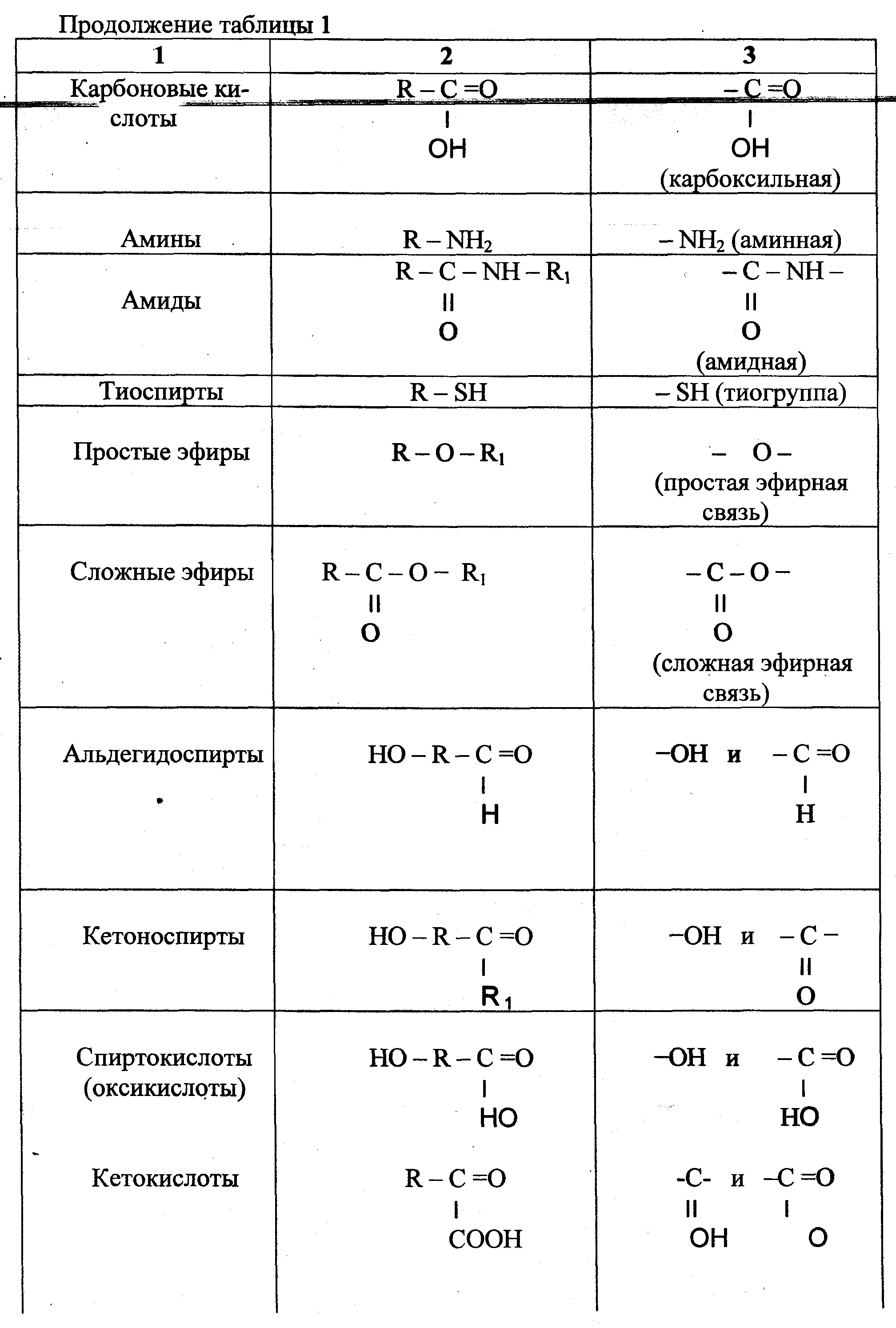 Мы обсудим этот тип изомера более подробно позже. Четыре изомера C 4 H 8 получают, исходя из пропена, следующим образом.
Мы обсудим этот тип изомера более подробно позже. Четыре изомера C 4 H 8 получают, исходя из пропена, следующим образом.| Положение 4 -го C | Структура скелета | Комментарии |
|---|---|---|
| 1 | Это алкен с прямой цепью с двойной связью после второго атома углерода.В этом изомере две группы CH 3 находятся на одной и той же стороне двойной связи. | |
| 2 | Это также алкен с прямой цепью с двойной связью после второго атома углерода. В этом изомере две группы CH 3 находятся на противоположных сторонах двойной связи. | |
| 3 | Этот изомер является единственным разветвленным изомером. | |
| 4 | Это единственный изомер с прямой цепью, в котором двойная связь включает один из концевых атомов углерода. |
Таблица 13.3: Изомеры бутена
13.1-9. Полиены
Органические красители — это полиены с чередующимися одинарными и двойными связями.
Все названия алкенов заканчиваются на — ен , а соединения с большим количеством двойных связей называются полиенами , , , . Расширенная пи-система возникает, когда двойные связи полиена чередуются с одинарными связями (как в — — — -), а пи-электроны делокализованы по чередующимся одинарным и двойным связям.Вспомните из нашего обсуждения зонной теории (глава 8.6), что уровни энергии электронов сближаются, когда электроны распределяются по множеству связей. Также вспомните из главы 6.5, что пи-электроны могут быть делокализованы по многим атомам углерода. Таким образом, хотя большинство органических соединений являются белыми или бесцветными, поскольку их электронные уровни энергии слишком далеко друг от друга, чтобы поглощать видимый свет, многие полиены с чередующимися одинарными и двойными связями поглощают видимый свет и окрашены. Следовательно, их часто используют для изготовления красок.Как мы увидим позже в этой главе, именно поглощение видимого фотона полиеном инициирует процесс зрения. Два обычных полиеновых красителя показаны на рисунках 13.7a и 13.7b.Алкины
13.1-10. Определение
Алкины — это углеводороды, содержащие по крайней мере одну тройную связь. Простейшим алкином является C 2 H 2 , который представляет собой этин или, чаще, ацетилен. Атомы углерода, участвующие в тройных связях, имеют только две электронные области, sp-гибридизованы и имеют валентный угол 180 °.Присутствие π электронов также делает их основными по Льюису, и их химический состав аналогичен описанному выше для алкенов.13.1-11. Изомеры
Как и в случае алкенов, разные положения кратной связи могут приводить к разным изомерам. Однако позиции должны быть разными при просмотре с любого конца молекулы. Например, есть три способа нарисовать бутин, но есть только два изомера. Две молекулы слева на рис. 13.9 — это одна и та же молекула, поскольку каждая тройная связь расположена на концевом атоме углерода.Молекула справа — это изомер молекулы слева.13.1-12. Гидрирование и насыщение
Атомы углерода с четырьмя сигма-связями — это насыщенных атомов углерода , а с менее чем четырьмя сигма-связями — ненасыщенных атомов углерода .
Все атомы углерода в алканах являются насыщенными, потому что они имеют максимальное количество сигма-связей (четыре).Однако атомы углерода, участвующие в множественных (двойных или тройных) связях, являются ненасыщенными, поскольку их пи-связи могут быть заменены сигма-связями, что увеличивает количество электронных областей. Соединения с множеством кратных связей называются полиненасыщенными . Ненасыщенное соединение может быть насыщено гидрированием , то есть реакцией с водородом. При гидрировании H 2 присоединяется по двойной связи, образуя две связи C – H, то есть пи-связь между атомом углерода заменяется двумя сигма-связями C – H.| ненасыщенный углеводород | + | водород | → | углеводород насыщенный |
|---|---|---|---|---|
| + | 3 ч 2 | → | ||
| Множественные связи (двойные и тройные) ненасыщены. Чем больше кратных связей имеет соединение, тем выше степень его ненасыщенности. Ненасыщенные соединения могут быть насыщены путем гидрирования. | Для каждой двойной связи требуется один H 2 . | Все связи C – C являются одинарными связями в указанном выше углеводороде, поэтому он насыщен. |
13.2 Именование простых углеводородов
Введение
Понимание номенклатуры алканов, алкенов и алкинов поможет вам понять часть разнообразия органических молекул, которое будет обсуждаться позже в этой главе.Предварительные требования
Цели
•
Дайте общие корневые названия и окончания для алканов и алкенов.•
Назовите алканы с прямой цепью.•
Определите и назовите две простейшие алкильные группы.•
Назовите разветвленные алканы с одной алкильной группой.•
Назовите разветвленные алканы с двумя алкильными группами.•
Назовите алкены с прямой цепью и алкины.
13.2-1. Корневые имена
Название углеводорода основано на названии самой длинной непрерывной цепи, которую он содержит.
Название органического соединения должно указывать количество атомов углерода в самой длинной непрерывной цепи, которая определяется корневым именем цепи, как указано в таблице 13.4, и тип соединения, который обозначается окончанием имя, как показано ниже.•
Алканы оканчиваются на и .•
Алкены оканчиваются на и .•
Алкины оканчиваются на ун .
| # C атомов | Корневое имя | Имя Алкана | Имя Алкена |
|---|---|---|---|
| 1 | мет | метан | |
| 2 | eth | этан | этен |
| 3 | опора | пропан | пропен |
| 4 | но | бутан | бутен |
| 5 | пент | пентан | пентен |
| 6 | шестигранник | гексан | гексен |
| 7 | гепт | гептан | гептен |
| 8 | окт | октановое число | октен |
| 9 | без | нонан | нонен |
| 10 | дек | декан | децен |
Таблица 13.4. Корневые названия органических соединений
13.2-2. Название органических молекул
Упражнение 13.2:Чтобы назвать алкан с прямой или непрерывной цепью, укажите количество содержащихся в нем атомов углерода с соответствующим корневым именем и добавьте -ane . Например, C 10 H 22 содержит десять атомов углерода, поэтому его корневое имя — dec, и это алкан, поэтому к корневому имени добавляется -ane. Таким образом, C 10 H 22 — декан.
Назовите следующие алканы с прямой или непрерывной цепью.
13.2-3. Алкильные группы
Алкильная группа образуется удалением атома Н из алкана. Это боковые цепи (не самой длинной непрерывной цепи) углеводорода.
Не все атомы углерода входят в самую длинную непрерывную цепь разветвленного углеводорода. Вместо этого эти атомы углерода находятся в группах, называемых боковыми цепями , которые присоединены к самой длинной непрерывной цепи.Боковые цепи могут быть группой любого типа, но мы ограничиваем наше обсуждение алкильными группами . Алкильные группы образуются удалением одного атома водорода из алкана. Образовавшаяся алкильная группа связывается с более длинной цепью в положении удаленного водорода. Алкильные группы входят в состав соединений; они сами не являются составными частями. Название алкильной группы получается добавлением -yl к корневому имени. Две простейшие алкильные группы приведены в таблице 13.5.| Формула алкильной группы | Название алкильной группы |
|---|---|
| –CH 3 | метил |
| –C 2 H 5 | этил |
Таблица 13.5. Простейшие алкильные группы
Тире перед формулой указывает, где они связаны с более длинной цепочкой. Также существуют пропильные, бутильные, пентильные и т. Д. Группы, но каждая из этих алкильных групп содержит более одной. Например, есть две разные пропильные группы, которые различаются положением удаленного водорода, который может происходить от концевого атома углерода или от среднего атома углерода. Мы ограничиваем обсуждение наименования органических соединений соединениями, которые содержат метильные и / или этильные группы, чтобы избежать этой сложности.13.2-4. Именование алканов
Разветвленные алканы имеют боковые цепи, поэтому название разветвленного алкана указывает на самую длинную непрерывную цепь, а также идентичность и положение боковых цепей (алкильных групп). Хотя может быть много боковых цепей разной длины, мы ограничиваем обсуждение разветвленных алканов теми, которые имеют одну или две боковые цепи, которые будут либо метильной, либо этильной группой. Положение алкильной группы обозначается номером атома углерода, к которому она присоединена.Таким образом, необходимо пронумеровать атомы углерода в самой длинной цепи. Чтобы пронумеровать самую длинную непрерывную цепь, начните с конца, который дает наименьшее число для боковой цепи. Чтобы назвать разветвленные алканы:1
Определите самую длинную цепь, выберите соответствующее корневое имя и добавьте и , чтобы указать алкан.2
Пронумеруйте атомы углерода самой длинной непрерывной цепи, начиная с конца, который дает меньшее число для атома углерода, к которому присоединена алкильная группа.3
Определите боковую цепь и ее положение.4
Назовите алкан номером позиции боковой цепи, дефисом, а затем названием алкильной группы, за которым следует имя, полученное на шаге 1.
1
Определите самую длинную непрерывную цепочку. Самая длинная цепь содержит шесть атомов углерода, поэтому это гексан .2
Пронумеруйте самую длинную непрерывную цепь так, чтобы у боковой цепи был наименьший номер. Нумерация цепи слева направо помещает боковую цепь на углерод 4, но при нумерации справа налево боковая цепь помещается на углерод 3.Таким образом, цепь нумеруется справа налево, чтобы получить меньшее число для алкильной группы.3
Определите боковую цепь и ее положение. Боковая цепь содержит один атом углерода, поэтому это метильная группа. Он прикреплен к углеродному номеру 3.4
Назовите соединение, объединив название самой длинной цепи с положением и идентификатором боковой цепи.13.2-5. Упражнение по присвоению имен алканам
Потренируйтесь называть разветвленные алканы, называя три органических соединения в Упражнении 13.3. Имена корней можно найти в Таблице 13.4. Упражнение 13.3:Ответьте на вопросы по каждому из разветвленных алканов.
Сколько атомов углерода в самой длинной непрерывной цепи?Как называется самая длинная непрерывная цепочка?
Как называется алкильная группа в самой длинной цепи?
Каково положение алкильной группы (количество атомов углерода)?
Как называется состав?
Сколько атомов углерода в самой длинной непрерывной цепи?
Как называется самая длинная непрерывная цепочка?
Как называется алкильная группа в самой длинной цепи?
Каково положение алкильной группы (количество атомов углерода)?
Как называется состав?
Сколько атомов углерода в самой длинной непрерывной цепи?
Как называется самая длинная непрерывная цепочка?
Как называется алкильная группа в самой длинной цепи?
Каково положение алкильной группы (количество атомов углерода)?
Как называется состав?
13.2-6. Обозначение алканов с несколькими алкильными группами
Чтобы назвать алканы с более чем одной боковой цепью, просто поместите названия алкильных групп в алфавитном порядке, разделенные дефисами, перед корневым именем. Например, 3-этил-2-метилгептан представляет собой непрерывную цепь из семи углеродов с группой C 2 H 5 на третьем углероде и группой CH 3 , присоединенной ко второму углероду. Если две идентичные группы присоединены к одному и тому же атому углерода, номер позиции повторяется с разделителем-запятой, а количество групп дается префиксом, как в 2,2-диметилгептане. Упражнение 13.4:Назовите следующие соединения.
13.2-7. Обозначение алкенов и алкинов
.Алкены пронумерованы так, чтобы двойная связь C = C имела наименьший возможный номер.
Чтобы назвать алкен с прямой или непрерывной цепью:1
Пронумеруйте цепь так, чтобы атомам углерода в двойной или тройной связи было присвоено наименьшее число.2
Укажите длину цепи с соответствующим корневым именем и добавьте -ene, чтобы указать алкен, или -yne, чтобы указать алкин.3
Укажите положение двойной или тройной связи номером атома углерода в связи с меньшим номером в цепи.4
Имя — это позиция связи, определенная на шаге 3, за которой следует дефис, а затем корневое имя, определенное на шаге 2.
Назовите следующие алкены с прямой или непрерывной цепью.
13,3 Изомеры
Введение
Мы видели, что может существовать несколько органических соединений с одинаковой формулой. Соединения с одинаковой формулой называются изомерами.Изомеры могут иметь самые разные химические и физические свойства. В этом разделе мы вводим две широкие классификации изомеров.Предварительные требования
Цели
•
Изобразите конституционные изомеры с заданной молекулярной формулой.•
Изобразите все конституционные изомеры алкана.•
Определите стереоизомеры.•
Назовите два типа стереоизомеров.•
Различают цис- и транс-изомеры.•
Опишите молекулярный процесс, ответственный за зрение.•
Определите стереоцентры.•
Определите энантиомеры.
Конституционный
13.3-1. Конституционные изомеры
Конституционные изомеры различаются связями.
Число конституционных изомеров увеличивается с увеличением числа атомов углерода. C 3 H 8 O имеет три структурных изомера, но есть шесть изомеров C 4 H 10 O и более сотни изомеров C 12 H 26 O. Конституционные изомеры могут быть один и тот же тип молекулы со схожими свойствами. Например, существует более 100 изомеров C 10 H 22 , но все они алканы.Однако структурные изомеры также могут быть совершенно разными типами молекул с очень разными свойствами. Как показано на рисунке 13.10, существует три изомера C 3 H 8 O. Два — спирты, а один — эфир.•
Ethers содержат соединение C – O – C.•
Спирты содержат соединения C – O – H.
C – O – C, поэтому они являются простыми эфирами, в то время как все остальные структуры содержат гидроксильную группу, которая делает каждый из них спиртами.Для C 12 H 26 O существует более ста изомеров! Существование такого количества конституционных изомеров приводит к огромному разнообразию структур в органической химии. Хотя не существует простой математической зависимости между молекулярной формулой и количеством структурных изомеров, вы можете быть уверены, что молекулы с большим числом атомов углерода будут иметь большое количество конституционных изомеров.
13.3-2. Изомеры гексана
Выполните следующие действия, чтобы определить конституционные изомеры алкана.1
Начните с рисования изомера с прямой цепью.2
Удалите один атом углерода из прямой цепи, полученной выше, и поместите удаленный углерод (метильную группу) на каждый углерод полученной цепи, которая дает другой изомер.•
Метильная группа не может быть размещена на концевом атоме углерода, так как это приведет к той же цепи, что и на предыдущем этапе.•
Не имеет значения, каким образом пронумерованы атомы углерода, поэтому размещение метильной группы на каждом из атомов углерода, которые находятся рядом с концевым углеродом, дает такое же соединение.
3
Удалите второй атом углерода и поместите две метильные группы или одну этильную группу в оставшуюся цепь. Этильная группа не может быть размещена на концевом углероде, поскольку это приведет к образованию самой длинной цепи, полученной на этапе 1, и ее нельзя разместить на втором углероде, поскольку это приведет к образованию одного из изомеров, полученных на этапе 2.4
Продолжайте удалять один атом углерода, пока не дойдете до длины, при которой не удастся получить новые изомеры.
4
3-углеродные цепи Не существует изомеров C 6 H 14 с самыми длинными цепями, содержащими менее четырех атомов углерода. Таким образом, имеется пять изомеров C 6 H 14 .13.3-3. Изомеры гептана — упражнение
Изобразите восемь изомеров алкана C 7 H 16 , добавив метильные группы к самой длинной цепи.Стереоизомеры
13.3-4. Определения
Стереоизомеры имеют одинаковые связи, но различаются пространственным расположением своих атомов. Есть два типа стереоизомеров.•
Геометрические изомеры : Различное пространственное расположение атомов происходит из-за наличия связи, которая не может быть полностью скручена.Мы рассматриваем только случай двойной связи.•
Энантиомеры : Различное пространственное расположение атомов происходит из-за присутствия атома углерода, к которому присоединены четыре разные группы.
13.3-5. Связь скручивания
Группы могут вращаться относительно друг друга по одинарной связи, но не по двойной или тройной связи.
Сигма-связи имеют цилиндрическую форму, и связанные ими группы вращаются вокруг связи, занимая различные относительные положения. На рис. 13.12 (а) показано вращение вокруг сигма-связи. Однако группы, связанные двойными связями, не могут вращаться относительно друг друга без разрыва связи π , потому что вращение сдвинет две p-орбитали, используемые в связи π , друг от друга и устранит их перекрытие.13.3-6. Цис- и транс-изомеры
Два атома на одной стороне двойной связи называются цис , а два атома на противоположных сторонах двойной связи называются транс .
Упражнение 13.6: Рассмотрим следующие три изомера C 2 H 2 F 2 . Один не имеет геометрического изомера, но является конституционным изомером двух других.Два других являются геометрическими изомерами друг друга: один цис, а другой транс. Укажите конституциональный изомер и укажите геометрические изомеры цис и транс.13.3-7. Сетчатка
Процесс зрения инициируется цис-транс-изомеризацией.
Транс-форма алкена может быть скручена в цис-форму, если пи-связь разорвана. Действительно, именно транс → цис-преобразование запускает процесс зрения.Молекулы белка в глазу удерживают молекулы сетчатки в структуре, в которой одна двойная связь находится в менее стабильной цис-конфигурации. Молекула сетчатки может поглощать фотон видимого света из-за наличия чередующихся одинарных и двойных связей. Энергия фотона разрывает пи-связь в цис-двойной связи. Как только пи-связь разрывается, молекула возвращается к более стабильной транс-конфигурации. Это преобразование транс → цис инициирует каскад событий, которые приводят к зрению.13.3-8. Упражнение по присвоению имен цис- и транс-изомерам
Чтобы указать изомер алкена, поместите «цис-» или «транс-» перед названием алкена.
Упражнение 13.7: Назовите следующие соединения. количество атомов углерода в самой длинной цепиколичество атомов углерода в самой длинной цепи
количество атомов углерода в самой длинной цепи
13.3-9. Стереоцентры
Атом углерода с присоединенными к нему четырьмя различными группами называется стереоцентром .
Атомы, присоединенные к стереоцентру, не обязательно должны быть разными, в отличие от групп. Например, группа CH 3 отличается от группы C 2 H 5 , но обе включают атом углерода, присоединенный к стереоцентру. Следующее упражнение должно помочь. Упражнение 13.8:Углерод, помеченный красным, является стереоцентром?
13.3-10. Энантиомеры
Энантиомеры — это изомеры, которые содержат стереоцентры и являются зеркальным отображением друг друга.
Есть дополнительная сложность в структурах органических молекул, которые содержат атомы углерода с четырьмя различными группами, присоединенными к ним.Такие атомы углерода называются стереоцентрами. Центральный углерод, показанный красным в молекулеA на рисунке 13.14, является стереоцентром, поскольку он содержит четыре разные группы: H, OH, CH 3 и Cl. Молекула B на рисунке 13.14 является ее зеркальным отображением. Молекулы A и B — разные молекулы! То, что они разные, можно увидеть, повернув молекулу B на 180 ° вокруг связи C – C (B 1 → B 2 ). Вращение делает группы OH и CH 3 двух молекул (A и B 2 ) наложенными.Однако группы H и Cl в двух молекулах все еще поменяны местами. Следовательно, молекулы A и B не могут накладываться друг на друга. Обратите внимание, что ваша правая и левая руки также являются зеркальными отражениями, которые нельзя накладывать друг на друга. Молекулы со стереоцентром не могут быть наложены на их зеркальные изображения. Пары молекул, которые являются несуперелажными зеркальными отображениями, называются энантиомерами. Энантиомеры являются стереоизомерами, потому что их пространственное расположение различно, в то время как их связи идентичны. Молекулы A и B являются энантиомерами.
13.3-11. Энантиомерное упражнение
Упражнение 13.9: Следующая молекула имеет стереоцентр. Укажите, является ли каждая из следующих молекул одной и той же молекулой или ее энантиомером.13.3-12. Энантиомерные соединения
Энантиомеры имеют одинаковые температуры плавления и кипения, но они часто имеют совершенно разные биологические активности, потому что биологические активности часто основаны на структурах реагирующих молекул.Таким образом, одно соединение может вызывать один эффект, но его энантиомер может вызывать совсем другой эффект или не иметь никакого эффекта. Все биологически активные аминокислоты, кроме одной, имеют стереоцентры, и в каждом случае активен только один энантиомер. Ниже приводится пара примеров.13.3-13. Подсчет зеркальных изображений
Большое структурное разнообразие может иметь место в молекулах, содержащих несколько стереоцентров. В общем, существует 2 n стереоизомеров молекулы с n стереоцентрами.Таким образом, имеется 2 стереоизомера молекулы только с одним стереоцентром, 2 2 = 4 стереоизомера молекулы с двумя стереоцентрами и 2 15 = 32 768 стереоизомеров молекулы с 15 стереоцентрами. Упражнение 13.10: Рассмотрим молекулу сахарозы, столовый сахар. Красная подсветка одного атома углерода предназначена только для обсуждения. В остальном это не особенное. Сколько стереоцентров содержится в молекуле сахарозы?Сколько существует стереоизомеров сахарозы?
13.4 функциональные группы
Введение
Органические молекулы имеют определенные размеры, формы и функциональные группы для выполнения определенных функций (например, создание лучшего лекарства или более прочного пластика). После того, как молекула сконструирована, химики-органики разрабатывают методы ее создания. Эти процедуры, которые могут включать в себя множество этапов, могут быть разработаны, поскольку многие органические реакции протекают по нескольким хорошо понятным механизмам. Органические механизмы основаны на принципах правила октетов, резонанса и кислотно-основной теории Льюиса.Реакции происходят в определенных группах внутри молекулы, называемых функциональными группами . Функциональные группы обладают определенной реакционной способностью, которую можно использовать для получения желаемых реакций. В этом разделе мы познакомим вас с некоторыми функциональными группами и основными типами реакций, которые они претерпевают.Цели
•
Определите некоторые общие функциональные группы.
13.4-1. Спирты
Спирты могут вести себя как кислоты Бренстеда, потому что они содержат атом водорода, присоединенный к электроотрицательному атому, но они также являются основаниями Льюиса, потому что атом кислорода содержит две неподеленные пары.Алкильные группы обычно являются электронодонорными, поэтому спирты, в которых R представляет собой алкильную группу, действуют больше как основания Льюиса, чем кислоты.Спирты имеют общую формулу R – OH, где R — общая группа атомов, а OH — гидроксильная группа.
Спирты, в которых R представляет собой алкильную группу, называют добавлением -анол к корневому названию алкильной группы. Положение гидроксильной группы обозначается номером атома углерода, к которому она присоединена.13.4-2. Карбонилы
Карбонильная группа представляет собой C = O.
Атом углерода sp 2 гибридизирован и окружен всего тремя электронными областями. Кроме того, электроотрицательный кислород накладывает частичный положительный заряд на атом углерода. Эти два свойства делают атом углерода карбонила кислотой Льюиса. На рис. 13.19 слева показана резонансная форма карбонила, описывающая связывание, а справа — реакционная способность карбонила — атом углерода карбонила может быть атакован неподеленной парой цепи Льюиса. база.Кислотность карбонильных групп по Льюису порождает десятки типов химических реакций, которые различаются только разновидностями, служащими основанием Льюиса.13.4-3. Карбоновые кислоты
Карбоксильная группа представляет собой комбинацию карбонильной и гидроксильной группы.
Карбонильный кислород удаляет электронную плотность из связи O – H, что делает карбоксильные группы кислыми.Молекула с карбоксильной группой называется карбоновой кислотой (RCOOH).
Карбоновые кислоты, в которых R представляет собой алкильную группу, названы путем идентификации самой длинной непрерывной цепи, которая содержит карбоксильный углерод, и добавления «анойной» к корневому названию цепи. Например, HCOOH — метановая (или муравьиная) кислота, CH 3 COOH — этановая (или уксусная) кислота и C 2 H 5 COOH — пропановая кислота.Основание, сопряженное с кислотой, называют изменением «ic» на «ate». Таким образом, C 2 H 5 COO 1– — это пропаноат-ион.Замена водорода O – H в карбоновой кислоте на алкильную группу приводит к сложному эфиру (RCOOR ‘).
Сложные эфиры названы по названию алкильной группы, за которым следует название группы, к которой они присоединены. Взгляните на рисунок 13.22, где показан пример уксусной кислоты (активный ингредиент уксуса), которая теряет протон с образованием иона ацетата. Добавление этильной группы к ацетат-иону дает сложный эфир этилацетата (активный ингредиент жидкости для снятия лака с ногтей). Атом углерода карбонила является кислотой Льюиса, поэтому и карбоновые кислоты, и сложные эфиры являются кислотами Льюиса. Кроме того, карбонильная группа отводит электроны (электроотрицательный атом кислорода), поэтому связь O – H в карбоксильной группе ослабляется, что делает карбоновые кислоты кислотами Бренстеда.Когда R представляет собой длинную алкильную цепь, кислота представляет собой жирную кислоту . Жирные кислоты содержатся в клетках. Группа R в жирных кислотах, полученных из клеток животных, является насыщенной, но кислоты, полученные из овощей, ненасыщены (они содержат двойные связи). Стеариновая кислота (рис. 13.23), жирная кислота животного происхождения (насыщенная), используется для изготовления мыла и свечей.13.4-4. Амины и амиды
Амин представляет собой молекулу аммиака, в которой один или несколько атомов водорода заменены на группы R.Если азот присоединен к карбонилу, группа становится амидной группой .
Органические производные аммиака, не связанные с карбонильной группой, называются аминами. Два примера простых аминов: метиламин, CH 3 NH 2 , и диметиламин, (CH 3 ) 2 NH, показаны на рисунке 13.24. Соединения, в которых атом азота связан с карбонильным углеродом, называются амидами.Группы вокруг атома N в амидах копланарны, поэтому N sp 2 гибридизован. Планарность амидной группы объясняется резонансной структурой на рисунке 13.25. Кофеин содержит два атома азота амида (красный), один атом азота амина (синий) и один азот, который не является ни амином, ни амидом, потому что он участвует в двойной связи.13.4-5. Аминокислоты
Аминокислоты содержат амин и карбоновую кислоту.
Амин является хорошим основанием Льюиса, поэтому он может реагировать с карбоновой кислотой с образованием частиц с разделенными зарядами, которые являются наиболее распространенной формой аминокислот в организме человека. Например, рассмотрим структуру аланина на рис. 13.27.13.5 Введение в органические реакции
Введение
Хорошая часть органической химии может быть понята с помощью кислотно-основной теории Льюиса. В этом разделе представлены несколько механизмов различных реакций, но все они являются кислотно-основными реакциями Льюиса.Предварительные требования
Цели
•
Определите кислотные и основные центры Льюиса, участвующие в органической реакции.•
Опишите реакцию присоединения.•
Опишите реакцию конденсации и используйте изогнутые стрелки, чтобы показать механизм реакции карбоновой кислоты и спирта.•
Используйте изогнутые стрелки, чтобы показать действие амина на сложный эфир и предсказать продукт реакции.
13.5-1. Реакции присоединения алкенов
Реакции присоединения — это реакции, в которых два реагента объединяются с образованием единого продукта. В качестве примера мы используем добавление галогенида водорода через двойную связь C = C.- Просмотр видео
•
Просмотрите видео в этом окне, нажав кнопку воспроизведения.•
Используйте элементы управления видео для просмотра видео в полноэкранном режиме.•
Просмотрите видео в текстовом формате, прокрутив вниз.
1
Пи-электроны двойной связи атакуют водород галогенида водорода с образованием связи C – H, галогенид-иона и карбокатиона.2
Неподеленная пара на галогенид-ионе атакует сильный кислотный карбокатион Льюиса с образованием связи C – X.
13.5-2. Этерификация
В реакциях конденсации два реагента объединяются с образованием двух продуктов (одним из которых часто является небольшая молекула, такая как вода).Карбоновая кислота и спирт могут подвергаться реакции конденсации, называемой этерификацией , с образованием сложного эфира и воды. Механизм этерификации очень похож на тот, который мы использовали для объяснения реакции SO 3 и H 2 O в, Глава 12. Действительно, изменились только идентичности кислоты и основания Льюиса.
- Просмотр видео
•
Просмотрите видео в этом окне, нажав кнопку воспроизведения.•
Используйте элементы управления видео для просмотра видео в полноэкранном режиме.•
Просмотрите видео в текстовом формате, прокрутив вниз.
- Просмотр видео
•
Просмотрите видео в этом окне, нажав кнопку воспроизведения.•
Используйте элементы управления видео для просмотра видео в полноэкранном режиме.•
Просмотрите видео в текстовом формате, прокрутив вниз.
1
На первом этапе неподеленная пара на кислороде спирта (основание Льюиса) атакует карбонильный углерод кислоты (кислота Льюиса) в кислотно-основной реакции Льюиса. Неподеленная пара становится связью C – O, а пи-электроны двойной связи C = O карбонила становятся неподеленной парой на кислороде.2
Молекула воды из растворителя (показана зеленым) способствует переносу протона. Сначала он принимает протон от кислорода с положительным формальным зарядом, а затем отдает протон кислороду, участвующему в связи O – H.3
Перенос протона на втором этапе дает группу OH 2 с положительным формальным зарядом на кислороде. Электронная плотность перемещается на кислород с положительным формальным зарядом, образуя молекулу воды.Молекула воды теряется, и пи-связь C – O восстанавливается, в результате чего получается молекула без формального заряда. Потеря малых молекул, таких как вода, является обычным явлением в реакциях конденсации.
13.5-3. Амидная формация
Амиды могут образовываться в кислотно-основной реакции Льюиса амина (основания) и сложного эфира (кислоты). Другой продукт этой реакции конденсации — спирт. Механизм реакции идентичен этерификации.- Просмотр видео
•
Просмотрите видео в этом окне, нажав кнопку воспроизведения.•
Используйте элементы управления видео для просмотра видео в полноэкранном режиме.•
Просмотрите видео в текстовом формате, прокрутив вниз.
- Просмотр видео
•
Просмотрите видео в этом окне, нажав кнопку воспроизведения.•
Используйте элементы управления видео для просмотра видео в полноэкранном режиме.•
Просмотрите видео в текстовом формате, прокрутив вниз.
1
Неподеленная пара на атоме азота амина (основание Льюиса) атакует карбонильный углерод сложного эфира (кислота Льюиса) в кислотно-основной реакции Льюиса. Неподеленная пара становится связью C – N, а пи-электроны двойной связи C = O карбонила становятся неподеленной парой на кислороде.2
Молекула воды из растворителя способствует переносу протона. Сначала он принимает протон от азота с положительным формальным зарядом, а затем отдает протон кислороду, участвующему в связи O – R ‘.3
Перенос протона на втором этапе дает группу R’OH с положительным формальным зарядом на кислороде. Плотность электронов перемещается на кислород с положительным формальным зарядом, образуя молекулу спирта (R’OH), которая теряется при преобразовании пи-связи C – O, что приводит к образованию молекулы без формального заряда.Потеря небольших молекул, таких как спирты, обычна в реакциях конденсации.
13,6 Полимеры
Введение
Природные полимеры, такие как углеводы, белки и нуклеиновые кислоты, являются частью живой ткани и отвечают за увеличение скорости реакций и придание структурных характеристик, таких как прочность и гибкость. Другие хранят наш генетический код. Однако, когда большинство из нас думает о полимерах, мы думаем о синтетических полимерах, таких как ПВХ, тефлон, полиэтилен или полиэфиры.В этом разделе мы исследуем как природные, так и искусственные полимеры.Предварительные требования
Цели
•
Определите мономер, димер, тример и полимер.•
Определите мономер, на котором основан полимер.•
Узнайте о некоторых распространенных полимерах.•
Укажите требования к реагентам, используемым для получения конденсационного полимера.•
Различают полиамид и полипептид.•
Объясните, почему белки часто образуют α -спиралей.•
Опишите пару оснований, объясните, почему они важны, и определите сайты водородных связей в паре оснований.•
Опишите двойную спиральную структуру ДНК и объясните ее происхождение.
Дополнение
13.6-1. Полимеры
Полимеры — это большие молекулы, состоящие из множества единичных строительных блоков, называемых мономерами .
«Мер» используется для обозначения строительного блока. Как используется термин мер, показано на рисунке 13.33, где показаны моно мер (одиночный мер), ди мер (два мера), три мер (три мер) и поли мер. (многие люди).Полимер растет в результате последовательных реакций мономеров, удлиняющих полимерную цепь. У них обычно много изгибов и складок, потому что одинарные связи гибкие. Хотя полимеры могут образовываться с помощью нескольких различных механизмов, мы рассматриваем только те реакции, которые происходят с помощью механизмов, подобных тем, которые мы уже обсуждали. Синтетические полимеры классифицируются как конденсационные или аддитивные полимеры в зависимости от типа реакции, которая используется для их образования.13.6-2. Аддитивные полимеры
Полимеры присоединения образуются в реакциях присоединения.
Аддитивные полимеры на основе алкенов включают некоторые из наиболее распространенных полимеров. Процесс полимеризации представлен на Рисунке 13.34. Обратите внимание, что «x» на рисунке — это большое число, обычно исчисляемое тысячами.Таблица 13.6: Структура и использование некоторых распространенных полимеров
13.6-3. Изобутилен
Взаимодействие изобутилена с галогенидами водорода использовалось в качестве примера реакции присоединения в предыдущем разделе. Теперь рассмотрим механизм реакции.- Просмотр видео
•
Просмотрите видео в этом окне, нажав кнопку воспроизведения.•
Используйте элементы управления видео для просмотра видео в полноэкранном режиме.•
Просмотрите видео в текстовом формате, прокрутив вниз.
- Просмотр видео
•
Просмотрите видео в этом окне, нажав кнопку воспроизведения.•
Используйте элементы управления видео для просмотра видео в полноэкранном режиме.•
Просмотрите видео в текстовом формате, прокрутив вниз.
Конденсационные полимеры
13.6-4. Конденсационные полимеры
Конденсационные полимеры получают в результате реакций конденсации.
Требование для полимеризации состоит в том, что каждый реагент должен иметь два реакционных центра. Образование сложного эфира из карбоновой кислоты и спирта использовалось в предыдущем разделе в качестве примера реакции конденсации, а образование полиэфира из двухосновной кислоты и диола (соединения с двумя карбоксильными и двумя гидроксильными группами) показано на рисунках 13.37a, 13.37b и 13.37c.х дикислота + х диол → полиэстер
Полиэфирный полиэтилен (этилентерефталат) или ПЭТ используется в одежде, обивке, шинах и других продуктах.Он продается как майлар, дакрон и терилен. Ежегодно в США производится 4,5 миллиарда фунтов ПЭТ.13.6-5. Нейлон 66
Нейлоны — это полиамиды, образующиеся в результате реакции сложного диэфира и диамина.
Так же, как реакция сложного эфира и амина дает амид, реакция сложного диэфира и диамина дает полиамид . Полиамиды, полученные таким образом, также называют нейлоном .На каждой стадии полимеризации образуется амидная связь, но продукт всегда содержит амин или сложный эфир на каждом конце, поэтому он может реагировать с другим сложным диэфиром и / или другим диамидом.x диамид + x диэфир → полиамид (нейлон)
Механизм:1
Неподеленные пары на атомах N диаминов (красный и синий на рисунке 13.38a) атакуют карбонильный углерод диэфира с образованием связей C – N.2
Переносы протонов (показаны кружками на рисунке 13.38a) от атомов азота диаминов к атомам кислорода диэфиров производят группы CH 3 OH, которые уходят в виде молекул метанола.
13.6-6. Полипептиды
Полипептиды — это полиамиды, образующиеся в результате реакции аминокислот.
Полиамиды также могут образовываться, когда каждый реагент содержит как карбоновую кислоту, так и амин, а не две кислоты или два амина, то есть полиамиды также могут быть получены в реакции аминокислот. Амиды, полученные в результате реакции аминокислот, называются пептидами , а полиамиды, полученные из аминокислот, называются полипептидами .Полученный пептид всегда имеет два реактивных сайта, и продолжение реакции с другими аминокислотами приводит к полипептиду или, в конечном итоге, к белку. Структуру полипептида можно представить как основу амидных связей, от которых отходят различные боковые цепи, характеризующие различные аминокислоты. Действительно, амидный каркас часто представлен толстыми связями, от которых свисают боковые цепи аминокислот (метильная группа от аланина и этильная группа от серина).13.6-7. H-связывание в белках
Белки — это большие полипептиды.
Белки представляют собой высокомолекулярные полипептиды, которые часто содержат более 100 аминокислот (называемых остатками , ). Водородная связь и диполь-дипольные взаимодействия между группами внутри полипептида ответственны за вторичную структуру полипептида.Самым сильным взаимодействием является водородная связь между группой N – H и группой C = O, которая находится на расстоянии четырех остатков. В результате этого взаимодействия образуется α -спиральная структура белков. Природа и положение аминокислот вокруг ядра спирали α отвечают за специфическую функцию белка.13.6-8. Структура белка
Спираль α показана на рис. 13.41. Цветовой код: красный = кислород, синий = азот, серый = углерод, белый = водород и желтый = сера.Обратите внимание, что показаны только те атомы водорода, которые участвуют в образовании водородных связей.- (а) Модель заполнения пространства
- (b) Модель из шариков и палочек с зеленой лентой, демонстрирующей основу полипептида.
- (c) Шарообразная модель, в которой боковые цепи удалены, а водородные связи показаны пунктирными линиями.
ДНК
13.6-9. Нуклеотиды
Нуклеотид состоит из фосфата, сахара и N-содержащего основания. Нуклеиновые кислоты представляют собой полимеры, образованные из нуклеотидных остатков. Если сахар в нуклеотиде представляет собой дезоксирибозу, тогда нуклеиновая кислота представляет собой нуклеиновую кислоту D, , эоксирибо, N, , , A, , или просто ДНК.13.6-10. Базы
Только четыре основания, которые существуют в двух парах оснований, находятся на нуклеотидах, образующих ДНК.
Каждый нуклеотид ДНК содержит одно из следующих четырех оснований.Местоположение, помеченное как «скелет», указывает положение, в котором каждое основание связывается с сахаром в нуклеотиде. Вышеупомянутые основания могут быть объединены в две пары оснований из-за сильной водородной связи, которая может существовать между членами каждой пары.13.6-11. Упражнение
«Определение пар оснований» Упражнение 13.11:Аденин и гуанин плохо взаимодействуют, поэтому они не являются парами оснований. Определите пару оснований каждого (Т или С) на основе того, насколько хорошо каждое из них взаимодействует с одной из других пар оснований.
13.6-12. Базовые пары
Водородная связь между парами оснований приводит к двойной спиральной структуре ДНК.
Есть благоприятные взаимодействия только в двух парах оснований, которые называются парами оснований.1
аденин (А) — тимин (Т)2
гуанин (G) — цитозин (C)
с цитозином на цепи 2 удерживают две нити ДНК в этой части двойной спиралью .
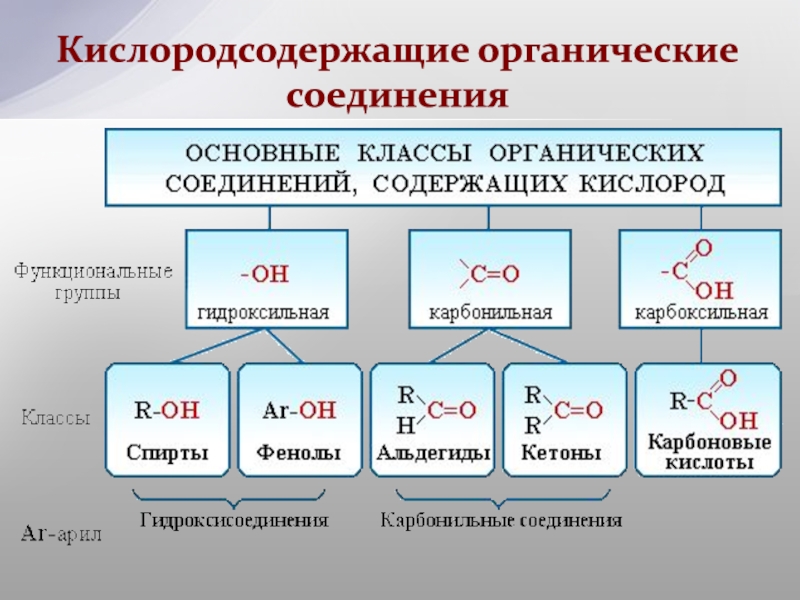
 таблицу 2.3).
таблицу 2.3).
 гликопротеины) и как структурный компонент (часть ДНК / РНК)
гликопротеины) и как структурный компонент (часть ДНК / РНК) ук-Т3-Стандарт. 2016 [цитируется 31 марта 2017 г.]. http://fsf.de
ук-Т3-Стандарт. 2016 [цитируется 31 марта 2017 г.]. http://fsf.de Июль 2012 г .; 2 (1): 77–83.
Июль 2012 г .; 2 (1): 77–83.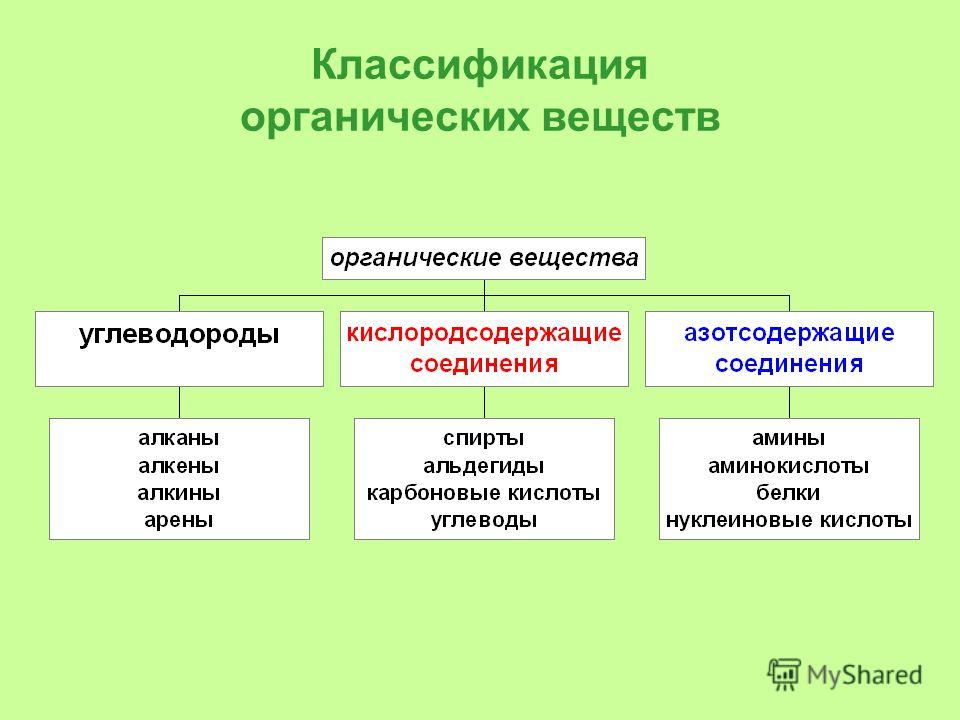 Внутренний воздух. 6 июля 2017 г .; (0): 1–9.
Внутренний воздух. 6 июля 2017 г .; (0): 1–9. 2: 37–63.
2: 37–63. Stone BG, Besse TJ, Duane WC, Evans CD, DeMaster EG. Влияние регуляции биосинтеза холестерина на выделение изопрена с дыханием у мужчин. Липиды. 1993 августа; 28 (8): 705–8. pmid: 8377584
Stone BG, Besse TJ, Duane WC, Evans CD, DeMaster EG. Влияние регуляции биосинтеза холестерина на выделение изопрена с дыханием у мужчин. Липиды. 1993 августа; 28 (8): 705–8. pmid: 8377584
