Таблица «Классификация органических соединений»
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Названия некоторых органических веществ. УГЛЕВОДОРОДЫ.
Класс соединения
Обшая формула
Примеры соединений, системати-ческое название и пояснение
Тривиальные названия
Алканы
CnH2n+2
CH4 метан
Алкены
CnH2n
C2H4 этен CH2 ═ CH2
(CH2 ═ CH─) радикал винил
этилен
C3H6 пропен CH2═ CH─CH3
пропилен
Циклолканы
CnH2n
C4H8 циклобутан CH2─ CH2
│ │
CH2─ CH2
Алкины
CnH2n—
C2H2 этин CH ≡ CH
ацетилен
Алкадиены
CnH2n—2
CH2═ CH─CH ═ CH2
бутадиен -1,3
дивинил
CH2═ C─CH ═ CH2
│
CH3
2-метилбутадиен -1,3
изопрен
Арены
Ароматические
углеводороды
CnH2n-6
C6H6 бензол
(C6H5─) радикал
фенил
C6H5CH3 CH3
метилбензол │
C7H8
толуол
C6H4(CH3)2 C8H10
1,2-диметилбензол
CH3
│
─ CH3
орто-ксилол
(о-ксилол)
C6H4(CH3)2 C8H10
1,3-диметилбензол
CH3
│
─ CH3
мета-ксилол
(м-ксилол)
C6H4(CH3)2 C8H10
1,4-диметилбензол CH3
│
│
CH3
пара-ксилол
(п-ксилол)
Арены
непредельные
CnH2n-8
C6H5─CH═ CH2
винилбензол ─CH ═ CH2
стирол
Названия некоторых органических веществ.
СПИРТЫ.
Класс соединения
Обшая формула
Примеры соединений, системати-ческое название и пояснение
Тривиальные названия
Предельные
одноатомные
спирты
CnH2n+1OH
CnH2n+2O
R─ OH
CH3OH метанол
метиловый спирт
древесный спирт
C2H5OH этанол
этиловый спирт
Непредельные
одноатомные
спирты
CnH2n-1OH
CH2═ CH─CH2─OH
пропен-2-ол-1
аллиловый спирт
Предельные
многоатомные
спирты
CH2 ─ CH2 этандиол-1,2
│ │
OH OH
этиленгликоль
CH2 ─ CH ─ CH2
│ │ │
OH OH OH
пропантриол-1,2,3
глицеринФенолы
C6H5OH Фенол OH
гидроксибензол │
карболовая кислота
C6H4(CH3)OH 2-метилфенол
1-гидрокси-2-метилбензол
OH
│
─ CH3
орто-крезол
(о- крезол)
C6H4(CH3)OH 3-метилфенол
1-гидрокси-3-метилбензол
OH
│
─ CH3
мета-крезол
(м- крезол)
C6H4(CH3)OH 4-метилфенол
1-гидрокси-4-метилбензол
OH
│
│
CH3
пара-крезол
(п- крезол)
Ароматические
спирты
C6H5─CH2 ─ OH
фенилиметанол ─CH2─OH
бензиловый спирт
Названия некоторых органических веществ.
ПРОСТЫЕ ЭФИРЫ.
Класс соединения
Обшая формула
Примеры соединений, системати-ческое название и пояснение
Тривиальные названия
Простые эфиры
CnH2n+2O
R – O – R1
CH3 – O – CH3 метоксиметан
диметиловый эфир
C2H5 – O – C2H5 этоксиэтан
диэтиловый эфир
CH3 – O – C2H5 метоксиэтан
метилэтиловый эфир
Названия некоторых органических веществ.
АЛЬДЕГИДЫ. КЕТОНЫ.
Класс соединения
Обшая формула
Примеры соединений, системати-ческое название и пояснение
Тривиальные названия
Предельные
альдегиды
CnH2n+1СОН
CnH2nO
RCOH
О
//
R─С
\
H
HCOH метаналь О
//
H─С
\
H
муравьиный альдегид,
формальдегид
CH3COH этаналь О
//
CH3─С
\
H
уксусный альдегид,
ацетальдегид
Непредельные
альдегиды
CH2═ CH─COH О
пропеналь //
CH2═ CH─C
\
H
акриловый альдегид, акролеин
Ароматический
альдегид
C6
//
бензальдегид С ─H
│
бензойный альдегид
Кетоны
CnH2nO
RCOR
R – C – R
||
O
CH3 – C – CH3 пропанон
||
O
ацетон, диметилкетон
Названия некоторых органических веществ.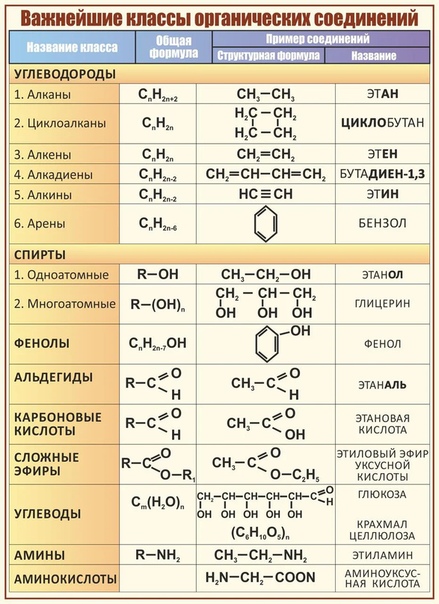
КАРБОНОВЫЕ КИСЛОТЫ.
Класс соединения
Обшая формула
Примеры соединений, системати-ческое название и пояснение
Тривиальные названия
Предельные
карбоновые
кислоты
CnH2n+1СОOН
CnH2nO2
RCOOH
О
//
R─С
\
OH
HCOOH метановая О
кислота //
(соли метаноат) H─С
\
OH
муравьиная
кислота
(соли формиаты)
CH3COOH этановая О
кислота //
(соли этаноат) CH3─С
\
OH
уксусная
кислота, уксус
(соли ацетаты)
высшие предельные кислоты
C15H31COOH гексадекановая кислота
пальмитиновая к-та
(соли пальмитаты)
C17H35COOH октадекановая кислота
стеариновая к-та (соли стеараты)
Непредель-ные
кислоты
CH2═ CH─COOH О
пропеновая //
кислота CH2═ CH─C
\
OH
акриловая кислота
(соли акрилаты)
CH2═ C─COOH
CH3 кислота
метакриловая кислота
(соли метакрилаты)
высшие непредельные кислоты
C17H33COOH
олеиновая кислота
(имеет одну двойную связь)
C17H31COOH
линолевая кислота
(имеет две двойные связи)
C17H29COOH
линоленовая кислота
(имеет три двойные связи)
Аромати-ческая
кислота
C6H5COОH O
//
С ─ОH
│
бензойная кислота
(соли бензоаты)
Двух-основная кислота
предельная
HOOC – COOH
этандиовая кислота
щавелевая кислота
ароматическая
1,4-бензолдикарбоновоя кислота СOОH
│
|
СOОH
терефталевая кислота
Названия некоторых органических веществ.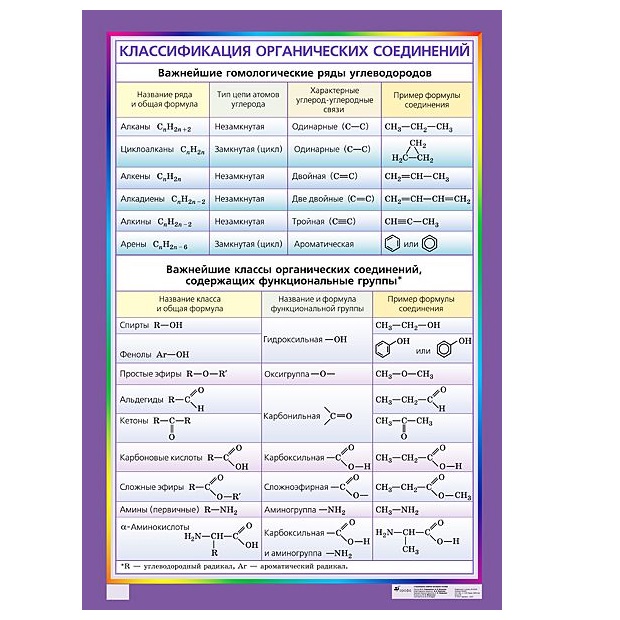
СЛОЖНЫЕ ЭФИРЫ.
Формула соединений
Систематическое название и пояснение
Тривиальные названия
HCOOCH3
метилметаноат
метилформиат, метиловый эфир муравьинной кислоты
CH3COOCH3
метилэтаноат
метилацетат, метиловый эфир уксусной кислоты
CH3COOC2H5
этилэтаноат
этилацетат, этиловый эфир уксусной кислоты
CH2 ═ CH─COOCH3
метилпропеноат
Метилакрилат, метиловый эфир акриловой кислоты
CH2 ═ CH─COOCH3
|
CH3
Метил -2-метилпропеноат
Метилметакрилат, метиловый эфир метакриловой кислоты
ЖИРЫ
(сложные эфиры глицерина и высших карбоновых кислот)
CH2 – O – COC17H35
|
CH – O – COC17H35
|
CH2 – O – COC17H35
тристеарин (твердый жир)
CH2 – O – COC17H33
|
CH – O – COC17H33
|
CH2 – O – COC17H33
триолеин (жидкий жир)
CH2 – O – COC17H33
|
CH – O – COC17H35
|
CH2 – O – COC17H35
олеодистеарин (твердый жир)
Названия некоторых органических веществ.
АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ.
Класс соединения
Обшая формула
Примеры соединений, системати-ческое название и пояснение
Тривиальные названия
Предель-ные
амины
R – NH2 первичный
CH3 – NH2
метиламин
R –NH–R вторичный
CH3 – NH – CH3
диметиламин
R – N – R третичный
|
R
CH3 – N – CH3
|
CH3
триметиламин
Аромати-ческий
амин
C6H5NH2
аминобензол NH2─
фениланин
анилин
Аминокис-лоты
NH2 – CH – COOH
|
R
NH2 – CH2 – COOH
аминоэтановая кислота
аминоуксусная кислота, глицин
NH2 – CH – COOH
|
СH3
2-аминопропановая к-та
аланин
NH2 – CH – COOH
|
СH2─
фенилаланин
Названия некоторых органических веществ.
Систематическое название и пояснение
Тривиальные названия
тринитроглицерин C3H5(ONO2)3
CH2 ─ CH ─ CH2 сложный эфир глицерина
│ │ │ и азотной кислоты
ONO2ONO2ONO2
динамит (взрывчатое вещество)
триацетилцеллюлоза (полимер)
(сложный эфир целлюлозы и уксусного ангидрида)
[C6H7O2( O–COCH3)3]n
ацетатное волокно
полигексаметиленамид (полимер)
(–CO –(CH2)5–NH – )n
капрон (синтетическое волокно)
тринитроцеллюлоза сложный эфир целлюлозы
[C6H7O2( O–NO2)3]n и азотной кислоты
пироксилин (взрывчатое вещество)
1,2,3,4,5,6-гексахлорциклогексан C6H6Cl6
(продукт взаимодействия бензола с хлором)
гексахлоран
2,4,6-тринитрофенол C6H2(NO2)3OH
(продукт взаимодействия фенола с азотной кислотой)
Пикриновая кислота
(взрывчатое вещество)
2 – хлорбутадиен – 1,3
CH2═ C─CH ═ CH2
│
Cl
хлоропрен
Стереорегулярный каучук, полученный полимеризацией хлоропрена
[─CH2─ CCl ═ CH ─ CH2─]n
хлоропреновый каучук
Стереорегулярный каучук, полученный полимеризацией бутадиена – 1,3
[─CH2─ CH ═ CH ─ CH2─]n
бутадиеновый каучук
Стереорегулярный каучук, полученный полимеризацией изопрена
[─CH2─ C(CH3) ═ CH ─ CH2─]n
изопреновый каучук
Полимер, полученный из метилового эфира метакриловой кислоты
(─CH2 ─ C(CH3)(COOCH3)─)n
полиметилметакрилат, органическое стекло
Полиэтилентерефталат, полимер, полученный из сложного эфира терефталевой кислоты и этиленгликоля
лавсан, найлон, полиэстер
1- хлорэтен CH2 ═ CHCl
винилхлорид
Поливинилхлорид, полимер, полученный полимеризацией винилхлорида (─CH2 ─CH ─ )n
│
Cl
основа для производства искусственной кожи
Фенолформальдегидная смола, полимер, полученный поликонденсацией фенола и формальдегида OH
|
(─CH2 ─ ─ CH2 ─ )n
Основа для получения фенолформальдегидных пластмасс
Малкова С. В., учитель химии МБОУ Лужайской ООШ Нижегородской обл. Страница 6
В., учитель химии МБОУ Лужайской ООШ Нижегородской обл. Страница 6
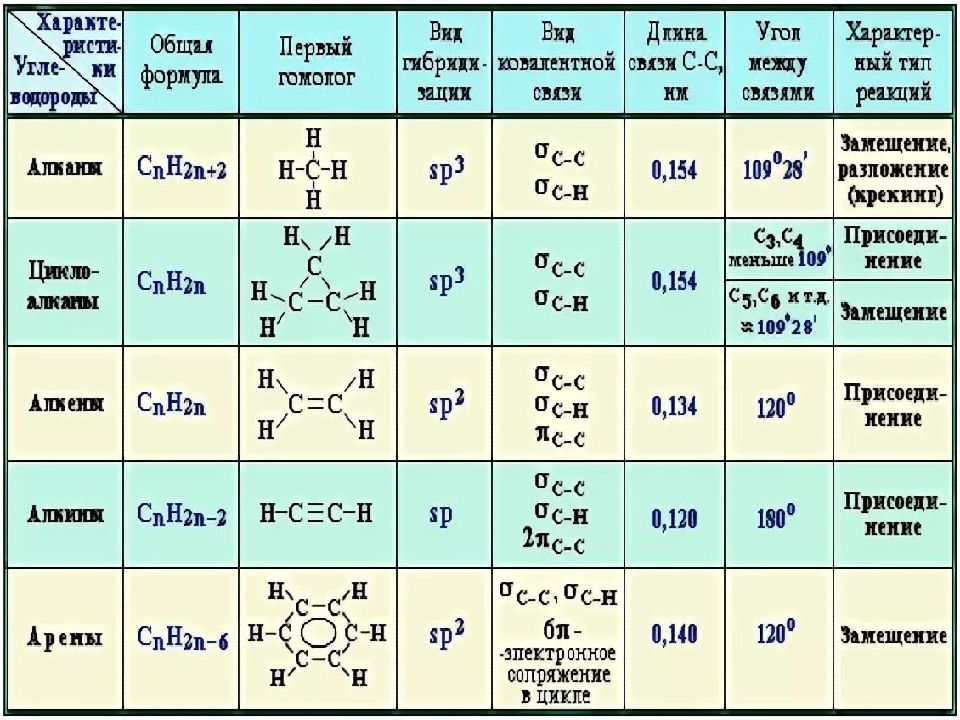
Алканы | Алкены | Алкины | Алкадиены | Циклоалканы | Арены | |
Общая формула | Cnh3n+2 (n≥1) | Cnh3n (n≥2) | Cnh3n-2 (n≥2) | Cnh3n-2 (n≥3) | Cnh3n (n≥3) | Cnh3n-6 (n≥6) |
Особен-ности строения | Все связи одинарные С-С σ-связи | Есть двойная связь С=С (связи: σ,1-π) | Есть тройная связь С≡С (σ,2-π связи) | Есть две двойных связи между атомами углерода (σ,2-π связи) | Есть цикл σ-связи | /бензольное кольцо/ |
Тип гибриди-зации ключевых атомов углерода | sp3 тетраэдрическое строение угол связи 109, 28ₒ | sp2 плоское строение угол связи 120ₒ | sp линейное строение угол связи 180ₒ | sp2 или sp | sp3 | sp2 единая система сопряжённых связей, плоское строение угол связи 120ₒ |
Суффикс в названии | -ан | -ен (-илен) | -ин | -диен | Цикло-…. | Тривиальные названия ……бензол или фенил- |
Пример | C3H8 Ch4-Ch3-Ch4 пропан | C3H6 Ch3=CH-Ch4 пропен (пропилен) | C3h5 CH≡C-Ch4 пропин | C3h5 Ch3=C=Ch3 пропадиен | С6Н12 — циклогексан | С6Н6 — бензол С6Н5 СН3 — толуол /метилбензол/ |
Виды изомерии | -Углеродного скелета (с С4) | -Углеродного скелета (с С4) -Положения = связи (с С4) — Межклассовая с циклоалканами (с С3) -Геометрическая изомерия (цис, транс) | -Углеродного скелета (с С4) -Положения ≡ связи (с С4) -Межклассовая с алкадиенами (с С3) | -Углеродного скелета (с С5) -Взаимного положения = связей (с С4) -Межклассовая с алкинами (с С3) -Геометрическая изомерия (цис, транс) | -Углеродного скелета (размер цикла и положение заместителей) -Межклассовая с алкенами (с С3) Геометрическая- | У бензола и толуола – нет. У гомологов (с С8) –изомерия углеродного скелета (заместителей и их взаимного положения в кольце) |
Физичес-кие свойства | С1-С4-газы, С5-С15 –жидкости с запахом, с С16 –твёрдые вещества. | С2-С4-газы, С5-С16 –жидкости, с С17 –твёрдые вещества. малорастворимы в воде | С2-С4-газы, С5-С16 –жидкости, с С17 –твёрдые вещества. малорастворимы в воде | Бутадиен -1,3 – газ Изопрен – легкокипящая жидкость | С3-С4-газы, С5-С13 –жидкости, с С14 –твёрдые вещества. | Первые члены ряда — бесцветные легкокипящие жидкости |
Алканы | Алкены | Алкины | Алкадиены | Циклоалканы | Арены | |
Типичные химичес-кие реакции | 1. (с галогенами, азотной и серной кислотами) 2.Дегидрирование 3. Крекинг 4. Горение 5. Изомеризация | 1. Присоединение по двойной связи (водорода, галогенов, воды, галогеноводородов) 2. Полимеризация 3. Окисление (полное – горение, неполное окисление KMnO4) | 1. Присоединение (водорода, галогенов, воды, галогеноводородов) 2. Ди-, тримеризация 3. Окисление (полное – горение, неполное окисление KMnO4) 4. Замещение Н, стоящего у тройной связи на атомы металлов (слабые кислотные свойства) | 1. Присоединение (водорода, галогенов, воды, галогеноводородов) 2. Полимеризация (образуются синтетические каучуки) 3. | 1. Для малых циклов (С3-С4) характерны реакции присоединения (сходство с алкенами), для больших – реакции замещения (сходство с алканами). 2. Дегидрирование (образуются ароматические УВ) 3. Горение | 1. Электрофильное замещение (с галогенами, азотной и серной кислотами, галогеналканами) Возможно присоединение водорода 2. Возможно присоединение водорода 3. Окисление (полное – горение, неполное окисление KMnO4 (кроме бензола)) |
Отноше-ние к раствору KMnO4 | Не реагируют | Обесцвечивание | Обесцвечивание | Обесцвечивание | Не реагируют | Окисление заместителей в цикле (бензол не реагирует) |
Отноше-ние к бромной воде | Не реагируют | Обесцвечивание | Обесцвечивание | Обесцвечивание | Устойчивы | Не реагируют |
Взаимодействие с галогенами | Радикальное замещение | Присоединение | Присоединение | Присоединение | У малых – присоединение, у больших – замещение. | Электрофильное (по кольцу) или радикальное (по боковой цепи) замещение |
Каталити-ческое присоеди-нение водорода | Нет | Да | Да | Да | Да, для малых циклов | Да |
Возможность получения полимеров | Нет | Да | Да | Да | Нет | Нет |
«Классификация органических соединений».
 10-й класс
10-й классКласс: 10.
Базовый учебник: химия 10 класс О.С.Габриелян.
Цель урока: познакомить учащихся с общей классификацией органических соединений. Рассмотреть классификацию органических веществ по характеру углеродного скелета и классификацию по функциональной группе.
Оборудование: компьютер, мультимедийный проектор, презентация.
Тип урока: комбинированный
Ход урокаI. Организационный момент.II. Классификация органических соединений.В природе существуют несколько миллионов органических соединений. Каждый год создаются все новые и новые органические вещества. Чтобы разобраться в огромном количестве органических соединений, необходимо их классифицировать. Существуют разные способы классификации органических соединений. Мы будем рассматривать два способа классификации: первый — по характеру углеродной цепи, второй – по функциональной группе.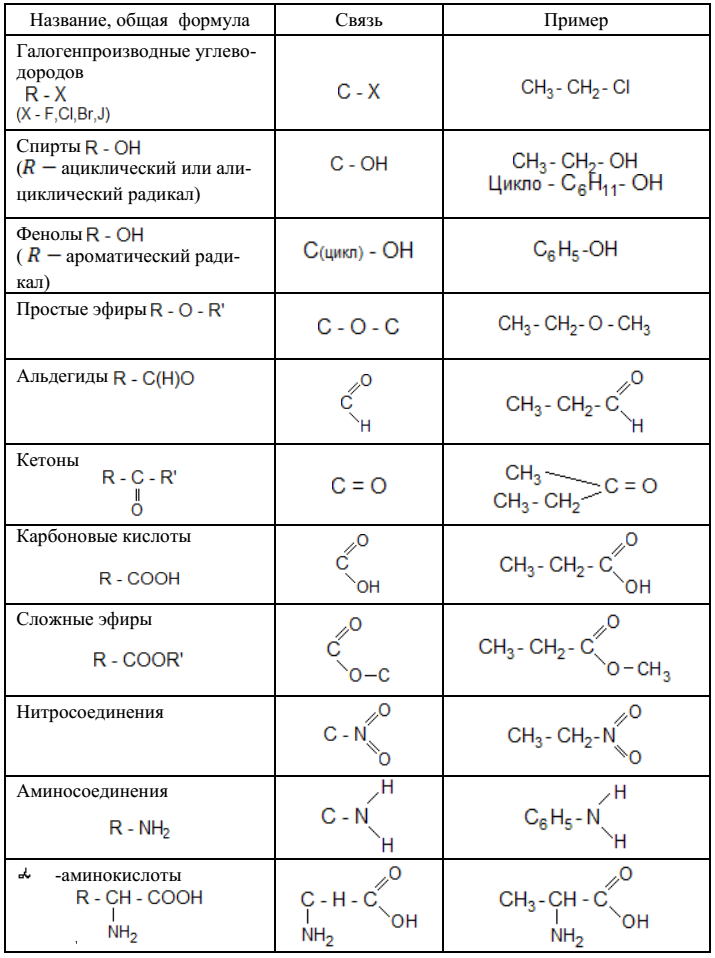 Слайд 2
Слайд 2
Последовательность химически связанных атомов углерода в молекуле составляет ее углеродный скелет. Это основа органического соединения. Поэтому первым признаком классификации органического соединения служит классификация по строению углеродного скелета. Слайд 3
По характеру углеродного скелета органического соединения вещества можно разделить на открытые или ациклические (приставка а- обозначает отрицание, т.е. это незамкнутые цепи) и циклические в них углеродная цепь замкнута в цикл. Слайд 4
Углеродный скелет может быть также неразветвленным или разветвленным. Слайд 5
Органические соединения можно подразделять также по кратности связи. Соединения, содержащие только одинарные связи С-С, называются насыщенными или предельными. Соединения со связями С=С или СС называются ненасыщенными или непредельными. Слайд 6
Циклические соединения – это соединения, в которых углеродные атомы образуют цикл или замкнутую цепь. Циклические соединения делятся на две большие группы: карбоциклические и гетероциклические. Карбоциклические содержат в циклах только атомы углерода и подразделяются на алициклические и ароматические. Гетероциклические соединения содержат циклы, в составе которых кроме атомов С входят один или несколько других атомов, так называемых гетероатомов ( греч. heteros — другой) – O, S, N. Слайд 7
Циклические соединения делятся на две большие группы: карбоциклические и гетероциклические. Карбоциклические содержат в циклах только атомы углерода и подразделяются на алициклические и ароматические. Гетероциклические соединения содержат циклы, в составе которых кроме атомов С входят один или несколько других атомов, так называемых гетероатомов ( греч. heteros — другой) – O, S, N. Слайд 7
Закрепляем новый материал выполнением следующего задания: используя схему классификации, определить к какому классу относятся представленные соединения.
CH2=CH–CH3 CH3–CH3 CH2= CH–CH=CH2Слайд 8
Рассматриваем второй способ классификации органических соединений, по наличию функциональных групп. Формулируем определение функциональной группы, как группы атомов, определяющей химические свойства соединения и принадлежность его к определенному классу органических соединений. Функциональная группа является основным признаком, по которому органические соединения относят к определенному классу. Слайд 9,10
Слайд 9,10
Ставим перед учениками задачу: рассмотреть основные классы органических соединений с точки зрения наличия кратных связей. Рассматриваем более подробно классы органических соединений, относящихся к группе ациклических соединений это классы алканов, алкенов, алкинов и алкадиенов. Слайд 11
К ациклическим соединениям кроме углеводородов, относятся вещества содержащие разнообразные функциональные группы. Главный критерий, по которому вещества относят к ациклическим соединениям – это наличие незамкнутой цепи углеродных атомов. Рассматриваем более подробно классы кислородосодержащих органических соединений. Слайд 12
Закрепляем изученный материал. Определить к какому классу относятся соединения? Слайд 13
III. Рефлексия.Список использованной литературы:
- Учебник Химия 10 класс О.С. Габриелян
- Поурочные разработки по химии М.Ю. Горковенко
- urok.
 1sept.ru/articles/586588/
1sept.ru/articles/586588/ - www.xumuk.ru/rhf/
- urok.1sept.ru/articles/630735
Лекция №
Лекция № 2
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
План
- Классификация органических соединений.
- Номенклатура органических соединений.
1. Классификация органических соединений.
Органические соединения классифицируют по двум основным признакам: строению углеродного скелета и функциональным группам.
По строению углеродного скелета различают ациклические, карбоциклические и гетероциклические соединения.
Ациклические соединения – содержат открытую цепь атомов углерода.
Карбоциклические соединения – содержат замкнутую цепь углеродных
атомов и подразделяются на алициклические и ароматические. К алициклическим
относятся все карбоциклические соединения, кроме ароматических. Ароматические
соединения содержат циклогексатриеновый фрагмент (бензольное ядро).
Ароматические
соединения содержат циклогексатриеновый фрагмент (бензольное ядро).
Гетероциклические соединения — содержат циклы, включающие наряду с атомами углерода один или несколько гетероатомов.
По природе функциональных групп органические соединения делят на классы.
Таблица 2.1. Основные классы органических соединений.
|
Функциональная группа |
Класс соединений |
Общая формула |
|
Отсутствует |
Углеводороды |
R-H |
|
Галоген -F, -Cl, -Br, -I (–Hal) |
Галогенпроизводные |
R-Hal |
|
Гидроксильная -ОН |
Спирты и фенолы |
R-OH Ar-OH |
|
Алкоксильная -OR |
Простые эфиры |
R-OR |
|
Амино -NH2, >NH, >N- |
Амины |
RNH2, R2NH, R3N |
|
Нитро -NO2 |
Нитросоединения |
RNO2 |
|
Карбонильная >C=O |
Альдегиды и кетоны |
|
|
Карбоксильная |
Карбоновые кислоты |
|
|
Алкоксикарбонильная |
Сложные эфиры |
|
|
Карбоксамидная |
Амиды карбоновых кислот |
|
|
Тиольная -SH |
Тиолы |
R-SH |
|
Сульфо -SO3H |
Сульфокислоты |
R-SO3H |
2. Номенклатура органических соединений.
Номенклатура органических соединений.
В настоящее время в органической химии общепринятой является систематическая номенклатура, разработанная Международным союзом чистой и прикладной химии (IUPAC). Наряду с ней сохранились и используются тривиальная и рациональная номенклатуры.
Тривиальная номенклатура состоит из исторически сложившихся названий, которые не отражают состава и строения вещества. Они являются случайными и отражают природный источник вещества (молочная кислота, мочевина, кофеин), характерные свойства (глицерин, гремучая кислота), способ получения (пировиноградная кислота, серный эфир), имя первооткрывателя (кетон Михлера, углеводород Чичибабина), область применения (аскорбиновая кислота). Преимуществом тривиальных названий являетсяих лаконичность, поэтому употребление некоторых из них разрешено правилами IUPAC.
Систематическая номенклатура является научной и отражает
состав, химическое и пространственное строение соединения. Название соединения
выражается при помощи сложного слова, составные части которого отражают
определенные элементы строения молекулы вещества. В основе правил номенклатуры
IUPAC лежат принципы заместительной номенклатуры, согласно которой
молекулы соединений рассматриваются как производные углеводородов, в которых
атомы водорода замещены на другие атомы или группы атомов. При построении
названия в молекуле соединения выделяют следующие структурные элементы.
Название соединения
выражается при помощи сложного слова, составные части которого отражают
определенные элементы строения молекулы вещества. В основе правил номенклатуры
IUPAC лежат принципы заместительной номенклатуры, согласно которой
молекулы соединений рассматриваются как производные углеводородов, в которых
атомы водорода замещены на другие атомы или группы атомов. При построении
названия в молекуле соединения выделяют следующие структурные элементы.
Родоначальная структура – главная цепь углеродная цепь или циклическая структура в карбо- и гетероциклах.
Углеводородный радикал – остаток формульного обозначения углеводорода со свободными валентностями (см. таблицу 2.2).
Характеристическая группа – функциональная группа, связанная с родоначальной структурой или входящая в ее состав (см. таблицу 2.3).
При составлении названия последовательно выполняют следующие правила.
- Определяют старшую
характеристическую группу и указывают ее обозначение в суффиксе (см.
 таблицу 2.3).
таблицу 2.3). - Определяют родоначальную структуру по следующим критериям в порядке падения старшинства: а) содержит старшую характеристическую группу; б) содержит максимальное число характеристических групп; в) содержит максимальное число кратных связей; г) имеет максимальную длину. Родоначальную структуру обозначают в корне названия в соответствии с длиной цепи или размером цикла: С1 – “мет”, С2 – “эт”, С3 – “проп”, С4 – “бут”, С5 и далее – корни греческих числительных.
- Определяют степень насыщенности и отражают ее в суффиксе: “ан” – нет кратных связей, “ен” – двойная связь, “ин” – тройная связь.
- Устанавливают остальные
заместители (углеводородные радикалы и младшие характеристические группы)
и перечисляют их названия в префиксе в алфавитном порядке.

- Устанавливают умножающие префиксы – “ди”, “три”, “тетра”, указывающие число одинаковых структурных элементов (при перечислении заместителей в алфавитном порядке не учитываются).
- Проводят нумерацию родоначальной структуры так, чтобы старшая характеристическая группа имела наименьший порядковый номер. Локанты (цифры) ставят перед названием родоначальной структуры, перед префиксами и перед суффиксами.
Таблица 2.2. Названия алканов и алкильных радикалов, принятые
систематической номенклатурой IUPAC.
|
Алкан |
Название |
Алкильный радикал |
Название |
|
CH4 |
Метан |
СН3— |
Метил |
|
CH3CH3 |
Этан |
CH3CH2— |
Этил |
|
CH3CH2CH3 |
Пропан |
CH3CH2CH2— |
Пропил |
|
Изопропил |
|||
|
CH3CH2СН2CH3 |
н-Бутан |
CH3CH2СН2CH2— |
н-Бутил |
|
втор-Бутил |
|||
|
Изобутан |
Изобутил |
||
|
трет-Бутил |
|||
|
CH3CH2СН2CH2СН3 |
н-Пентан |
CH3CH2СН2CH2СН2— |
н-Пентил |
|
|
Изопентан |
Изопентил |
|
|
Неопентан |
Неопентил |
Таблица 2. 3. Названия характеристических групп (перечислены в порядке
убывания старшинства).
3. Названия характеристических групп (перечислены в порядке
убывания старшинства).
|
Группа |
Название |
|
|
в префиксе |
в суффиксе |
|
|
-(C)OOH* |
— |
овая кислота |
|
-COOH |
карбокси |
карбоновая кислота |
|
-SO3H |
сульфо |
сульфоновая кислота |
|
-(C)HO |
оксо |
аль |
|
-CHO |
формил |
карбальдегид |
|
>(C)=O |
оксо- |
он |
|
-ОН |
гидрокси |
ол |
|
-SH |
меркапто |
тиол |
|
-NH2 |
амино |
амин |
|
-OR** |
алкокси, арокси |
— |
|
-F, -Cl, -Br, -I |
фтор, хлор, бром, иод |
— |
|
-NO2 |
нитро |
— |
*Атом углерода, заключенный в скобки, входит в состав родоначальной
структуры.
**Алкокси-группы и все следующие за ними перечисляются в префиксе по алфавиту и не имеют порядка старшинства.
Рациональная (радикально-функциональная) номенклатура используется для названий простых моно- и бифункциональных соединений и некоторых классов природных соединений. Основу названия составляет название данного класса соединений или одного из членов гомологического ряда с указанием заместителей. В качестве локантов, как правило, используются греческие буквы.
Б.Н. Тарасевич — ИК спектры основных классов органических соединений (справочные материалы) — PDF
Тарасевич Б.Н., МГУ имени М.В.Ломоносова, химический факультет, кафедра органической химииМГУ имени М.В. Ломоносова, химический факультет,кафедра органической химии.доц. Тарасевич Б.Н.ИК спектры основных классов органическихсоединений.Справочные материалы.Москва 20122Тарасевич Б.Н., МГУ имени М.В.Ломоносова, химический факультет, кафедра органической химииВведениеВ настоящее время в области спектрометрическойидентификации органических соединений сложиласьпарадоксальная ситуация.
С одной стороны в интернете, на дисках ив рамках программного обеспечения ИК спектрометров существуютдоступные для пользователей массивы справочных данных в видеИК спектров. В этих условиях роль такого, казалось бы архаичногоинструмента, как таблицы должна сойти на нет. Однако, этого непроисходит. Справочные таблицы незаменимы в процессе освоенияметода ИК спектроскопии при решении учебных задач, табличнымиданными пользуются неспециалисты при эпизодическом обращениик ИК спектрам.
Поисковые и экспертные системы зачастую выдаютрезультат в виде нескольких альтернативных структур иокончательный выбор осуществляется пользователем сиспользованием таблиц или литературных данных.При интерпретации ИК спектров важно обращать вниманиене только на положение максимумов характеристических полос, нои на их интенсивности, форму, расположение относительно другихполос. Нижеприведённые таблицы снабжены рисунками схематическими изображениями характеристических участковспектров отдельных классов органических соединений ифрагментами ИК спектров реальных соединений, что на наш взгляддолжно помочь при интерпретации. Автор будет благодаренчитателям за пожелания и замечания.При составлении настоящих таблиц автор использовалследующие известные издания:1.
Автор будет благодаренчитателям за пожелания и замечания.При составлении настоящих таблиц автор использовалследующие известные издания:1.
Э.Преч, Ф.Бюльманн, К.Аффольтер, Определение строенияорганических соединений, изд. “Мир”, “БИНОМ лабораториязнаний”, М.,2006;2. Л.Беллами, Инфракрасные спектры сложных молекул, ИЛ,М.,1963;3. Л.Беллами, Новые данные по ИК спектрам сложныхмолекул, изд. “Мир”, М.,1971;4. К.Накамото, ИК спектры и спектры КР неорганических икоординационных соединений, изд. “Мир”, М., 1991;Обозначения и сокращенияarаscombhalipoopshstsyэкспс.ср.пер.сл.оч.
сл.шир.ароматическое колебаниеантисимметричное колебаниекомбинационная частотагалогенплоскостное колебание (in plane)внеплоскостное колебание (out of plane)плечо полосы (shoulder)валентное колебание (streth)симметричное колебаниеэкспериментдеформационное колебаниескелетное колебаниечастота, валентное колебаниесильная полосаполоса средней интенсивностиполоса переменной интенсивностислабая полосаочень слабая полосаширокая полосаТарасевич Б. Н., МГУ имени М.В.Ломоносова, химический факультет, кафедра органической химииОглавлениеВведение………………………………………………………………………………………………………………….………………2Колебания связей С-Н в алканах……………………………………………………………………………………….………………4Алкены…………………………………………………………………………………………………………………….……………..5Кумулированные двойные связи……………………………………………………………………………………….………………8Алкины………………………………………………………………………………………………………………….………………..9Ароматические соединения……………………………………………………………………………………………………….……11Спирты и фенолы…………………………………………………………………………………………………….………………….12Простые эфиры, эпоксиды, перекиси………………………………………………………………………………………………….14Альдегиды и кетоны……………………………………………………..……………………………………………………………..16Карбоновые кислоты……………………………………………………………………………………………………………………19Сложные эфиры и лактоны…………………………………………………………………………………………………………….21Производные карбоновых кислот………………………………………………………………………………………………………23Амиды кислот, пептиды, лактамы, уретаны( карбаматы)……………………………………………………………………………25Аминокислоты, белки………………………………………………………………………………………………………………….
Н., МГУ имени М.В.Ломоносова, химический факультет, кафедра органической химииОглавлениеВведение………………………………………………………………………………………………………………….………………2Колебания связей С-Н в алканах……………………………………………………………………………………….………………4Алкены…………………………………………………………………………………………………………………….……………..5Кумулированные двойные связи……………………………………………………………………………………….………………8Алкины………………………………………………………………………………………………………………….………………..9Ароматические соединения……………………………………………………………………………………………………….……11Спирты и фенолы…………………………………………………………………………………………………….………………….12Простые эфиры, эпоксиды, перекиси………………………………………………………………………………………………….14Альдегиды и кетоны……………………………………………………..……………………………………………………………..16Карбоновые кислоты……………………………………………………………………………………………………………………19Сложные эфиры и лактоны…………………………………………………………………………………………………………….21Производные карбоновых кислот………………………………………………………………………………………………………23Амиды кислот, пептиды, лактамы, уретаны( карбаматы)……………………………………………………………………………25Аминокислоты, белки…………………………………………………………………………………………………………………. 28Амины, имины и их соли………………………………………………………………………………………………………………29Непредельные азотсодержащие соединения…………………………………………………………………………………………31Соединения, содержащие связи азот-кислород………………………………………………………………………………………33Гетероциклические cоединения……………………………………………………………………………………………………….36Галогенпроизводные органических соединений……………………………………………………………………………………..37Серосодержащие функциональные группы…………………………………………………………………………………………..39Металлоорганические соединения.
28Амины, имины и их соли………………………………………………………………………………………………………………29Непредельные азотсодержащие соединения…………………………………………………………………………………………31Соединения, содержащие связи азот-кислород………………………………………………………………………………………33Гетероциклические cоединения……………………………………………………………………………………………………….36Галогенпроизводные органических соединений……………………………………………………………………………………..37Серосодержащие функциональные группы…………………………………………………………………………………………..39Металлоорганические соединения.
Металлоалканы…………………………………………………………………………………41Частоты валентных колебаний (см-1) связей углерод-углерод и металл-углерод в винильных и ацетиленовыхметаллоорганических соединениях……………………………………………………………………………………………………42Частоты валентных колебаний (см-1) связей металл-углерод N(МС) и металл-галоген N(МX) вметаллгалогенидных соединениях…………………………………………………………………………………………….……….43Частоты колебаний связей металл-кольцо n(MK) в циклопентадиенильных комплексах МСр2 (D5d или D5h)………….………..44Частоты колебаний (см-1) металл-кольцо n(MK) в дибензольных комплексах МPh3…………………………………. ……….….44Частоты колебаний (см-1) С=О и М-С в моноядерных карбонилах металлов…………………………………….………………..44Соединения бора………………………………………………………………………………………………………………………..45Фосфорорганические соединения……………………………………………………………………………………………………..46Кремнийорганические соединения……………………………………………………………………………………………………48Неорганические ионы и молекулы…………………………………………………………………………………………………….50Влияние изотопического замещения на частоты колебаний…………………………………………………………………………5234Тарасевич Б.Н., МГУ имени М.В.Ломоносова, химический факультет, кафедра органической химииAlkКолебания связей С-Н в алканахПоглощение в циклических алканах.Поглощение в алканах.СТРУКТУРНЫЕФРАГМЕНТЫВОЛНОВЫЕ ЧИСЛА СМ -1(ДЛИНА ВОЛНЫ МКМ)2ТИПЫ КОЛЕБА-НИЙ,(ИНТЕНСИВ-НОСТИ)31-Ch4КОММЕНТАРИИ42975-2950 (3,36-3,39)2885-2860 (3,47-3,50)1470-1435 (6,80-6,97)1385-1370 (7,22-7,30)as с.s (с.)as (ср.)s (с.)Для присоединённых к гетероатомам СН3 групп:O-Ch4 2830-2815 см-1, N-Ch4 2820-2730 см-1C-Ch4 1375 см-1, N-Ch4 1426 см-1, O-Ch4 1455 см-1,P-Ch4 1299 см-1, S-Ch4 1325 см-1-Ch3-2940-2915 (3,40-3,45)2870-2845 (3,49-3,52)1480-1440 (6,76-6,94)as (c.
……….….44Частоты колебаний (см-1) С=О и М-С в моноядерных карбонилах металлов…………………………………….………………..44Соединения бора………………………………………………………………………………………………………………………..45Фосфорорганические соединения……………………………………………………………………………………………………..46Кремнийорганические соединения……………………………………………………………………………………………………48Неорганические ионы и молекулы…………………………………………………………………………………………………….50Влияние изотопического замещения на частоты колебаний…………………………………………………………………………5234Тарасевич Б.Н., МГУ имени М.В.Ломоносова, химический факультет, кафедра органической химииAlkКолебания связей С-Н в алканахПоглощение в циклических алканах.Поглощение в алканах.СТРУКТУРНЫЕФРАГМЕНТЫВОЛНОВЫЕ ЧИСЛА СМ -1(ДЛИНА ВОЛНЫ МКМ)2ТИПЫ КОЛЕБА-НИЙ,(ИНТЕНСИВ-НОСТИ)31-Ch4КОММЕНТАРИИ42975-2950 (3,36-3,39)2885-2860 (3,47-3,50)1470-1435 (6,80-6,97)1385-1370 (7,22-7,30)as с.s (с.)as (ср.)s (с.)Для присоединённых к гетероатомам СН3 групп:O-Ch4 2830-2815 см-1, N-Ch4 2820-2730 см-1C-Ch4 1375 см-1, N-Ch4 1426 см-1, O-Ch4 1455 см-1,P-Ch4 1299 см-1, S-Ch4 1325 см-1-Ch3-2940-2915 (3,40-3,45)2870-2845 (3,49-3,52)1480-1440 (6,76-6,94)as (c.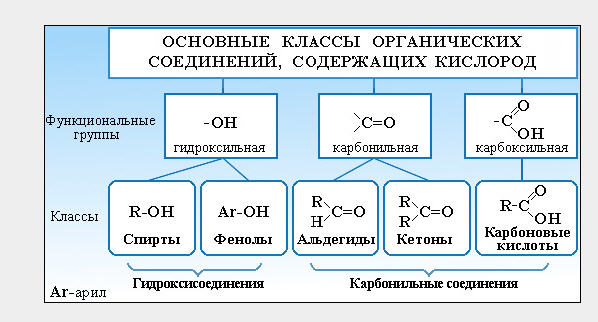 )s (c.), (ср.),СН2 ножничное(Ch3)x720-740 (13,89-13,50), (ср.),СН2 маятниковоеИногда дублет в твердом состоянии (полиэтилен).-Ch3- вциклопропане3080-3040 (3,25-3,29)1020-1000 (9,80-10,0)as (cр.)скелетное (ср.)То же для эпоксисоединений., (ср.),, (ср.),Две полосы примерноравной интенсивности.C(Ch4)2-C(Ch4)31385-1370 (7,22-7,30)1370-1365 (7,30-7,33)1145 (8,73), 1179(8,55)1395-1385 (7,17-7,22)1365 (7,33)В случае –СН2-СО- проявляются в виде сильных узких полосвобласти 1400-1440 см-1Две полосы с отношениеминтенсивностей примерно 1:2.5Тарасевич Б.Н., МГУ имени М.В.Ломоносова, химический факультет, кафедра органической химииПример.
)s (c.), (ср.),СН2 ножничное(Ch3)x720-740 (13,89-13,50), (ср.),СН2 маятниковоеИногда дублет в твердом состоянии (полиэтилен).-Ch3- вциклопропане3080-3040 (3,25-3,29)1020-1000 (9,80-10,0)as (cр.)скелетное (ср.)То же для эпоксисоединений., (ср.),, (ср.),Две полосы примерноравной интенсивности.C(Ch4)2-C(Ch4)31385-1370 (7,22-7,30)1370-1365 (7,30-7,33)1145 (8,73), 1179(8,55)1395-1385 (7,17-7,22)1365 (7,33)В случае –СН2-СО- проявляются в виде сильных узких полосвобласти 1400-1440 см-1Две полосы с отношениеминтенсивностей примерно 1:2.5Тарасевич Б.Н., МГУ имени М.В.Ломоносова, химический факультет, кафедра органической химииПример.
ИК спектр дизельного топлива (смесь углеводородов).Пример. ИК спектр декалина.C=CАлкены.Поглощение в алкенах.HRC=Ch3Валентные колебания связей С-Н в алкенах3095-3010 (3,29-3,32)В эту область попадают валентные колебания С-Нas ср.2975 (3,37)ароматических, гетероароматических, малых циклов,s ср.3040-3010 (3,29-3,32)галогенированных алкильных групп.C-H ср.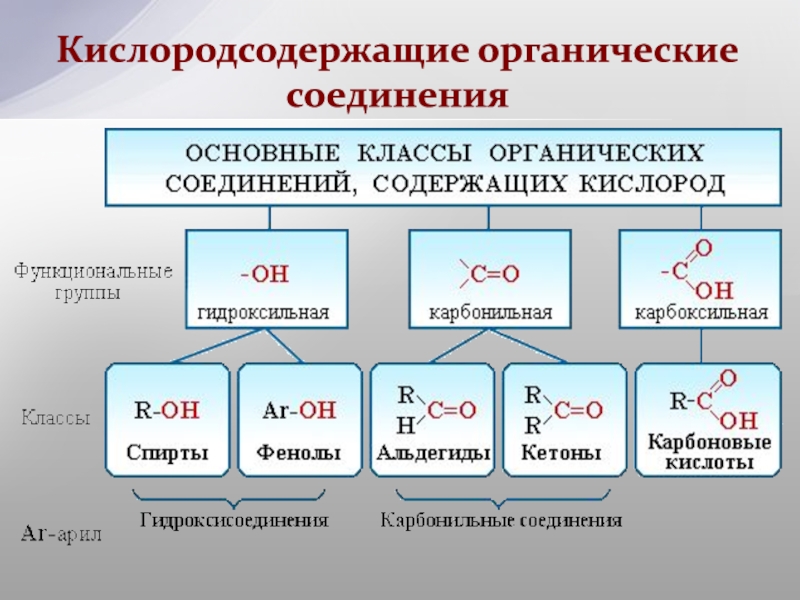 6Тарасевич Б.Н., МГУ имени М.В.Ломоносова, химический факультет, кафедра органической химииRR’C=Ch33095-3075 (3,23-3,25)C-H ср.HRC=CR’h4040-3010 (3,20-3,32)C-H ср.цисHRC=CR’h4040-3010 (3,29-3,32)C-H ср.трансДеформационные колебания связей С-Н в алкенах и типы замещения при двойных связяхHRC=Ch31850-1800 (5,41-5,56)1420-1410 (7,04-7,09)1300-1290 (7,69-7,75)995-985 (10,05-10,15)915-905 (10,93-11,05)RR’C=Ch31800-1750 (5,56-5,62)1420-1410 (7,04-7,09)895-885 (11,17-11,30)HRC=CR’Hцис-1420-1400 (7,04-7,14)730-665 (13,70-15,04)HRC=CR’Hтранс-1310-1290 (7,63-7,75)980-960 (10,20-10,42)RR’C=CR’’HОбертонCH плоскоеCH плоскоеCH неплоскоеCH неплоскоеКонцевая винильная группа.Частоты плоских колебаний попадают в область С-Си С-Н в насыщенных соединениях, они имеютпониженную по сравнению с неплоскими колебаниямиинтенсивность.ОбертонCH плоскоеКонцевая метиленовая группа.CH плоскоеCH неплоскоеCH плоскоеCH неплоскоеCH неплоскоеТризамещение при двойной связи, слабая полоса.850-790 (11,76-12,66)Наиболее характеристичными являются полосы неплоских деформационных колебаний в области 1000 – 650 см-1.
6Тарасевич Б.Н., МГУ имени М.В.Ломоносова, химический факультет, кафедра органической химииRR’C=Ch33095-3075 (3,23-3,25)C-H ср.HRC=CR’h4040-3010 (3,20-3,32)C-H ср.цисHRC=CR’h4040-3010 (3,29-3,32)C-H ср.трансДеформационные колебания связей С-Н в алкенах и типы замещения при двойных связяхHRC=Ch31850-1800 (5,41-5,56)1420-1410 (7,04-7,09)1300-1290 (7,69-7,75)995-985 (10,05-10,15)915-905 (10,93-11,05)RR’C=Ch31800-1750 (5,56-5,62)1420-1410 (7,04-7,09)895-885 (11,17-11,30)HRC=CR’Hцис-1420-1400 (7,04-7,14)730-665 (13,70-15,04)HRC=CR’Hтранс-1310-1290 (7,63-7,75)980-960 (10,20-10,42)RR’C=CR’’HОбертонCH плоскоеCH плоскоеCH неплоскоеCH неплоскоеКонцевая винильная группа.Частоты плоских колебаний попадают в область С-Си С-Н в насыщенных соединениях, они имеютпониженную по сравнению с неплоскими колебаниямиинтенсивность.ОбертонCH плоскоеКонцевая метиленовая группа.CH плоскоеCH неплоскоеCH плоскоеCH неплоскоеCH неплоскоеТризамещение при двойной связи, слабая полоса.850-790 (11,76-12,66)Наиболее характеристичными являются полосы неплоских деформационных колебаний в области 1000 – 650 см-1. C=CВалентные колебания связей С=C в алкенахC=C несопряж.1680-1620 (5,95-6,17)пер.Как правило малоинтенсивная полоса.HRC=Ch31645-1640 (6,08-6,10)ср.Концевая винильная группа.RR’C=Ch31660-1640 (6,02-6,10)ср.Концевая метиленовая группа.HRC=CR’H цис-1665-1635 (6,01-6,12)ср.HRC=CR’H транс-1675-1665 (5,97-6,00)ср.Интенсивность понижается при увеличении симметрии молекулы, всимметричных структурах полоса может отсутствовать.RR’C=CR’’h2675-1665 (5,97-6,00)пер.Тризамещение при двойной связи.7Тарасевич Б.Н., МГУ имени М.В.Ломоносова, химический факультет, кафедра органической химииRR’C=CR’’R’’’ДиеныПолиеныС=С, соряженная сфениломС=С, соряженная сС=ОF2C=C1690-1670 (5,92-5,99)1650 (6,06)1600 (6,25)1650-1580 (6,06-6,33)сл.Тетразамещение при двойной связи.Две полосы, интенсивность полосы ~1650 см-1 повышена.
C=CВалентные колебания связей С=C в алкенахC=C несопряж.1680-1620 (5,95-6,17)пер.Как правило малоинтенсивная полоса.HRC=Ch31645-1640 (6,08-6,10)ср.Концевая винильная группа.RR’C=Ch31660-1640 (6,02-6,10)ср.Концевая метиленовая группа.HRC=CR’H цис-1665-1635 (6,01-6,12)ср.HRC=CR’H транс-1675-1665 (5,97-6,00)ср.Интенсивность понижается при увеличении симметрии молекулы, всимметричных структурах полоса может отсутствовать.RR’C=CR’’h2675-1665 (5,97-6,00)пер.Тризамещение при двойной связи.7Тарасевич Б.Н., МГУ имени М.В.Ломоносова, химический факультет, кафедра органической химииRR’C=CR’’R’’’ДиеныПолиеныС=С, соряженная сфениломС=С, соряженная сС=ОF2C=C1690-1670 (5,92-5,99)1650 (6,06)1600 (6,25)1650-1580 (6,06-6,33)сл.Тетразамещение при двойной связи.Две полосы, интенсивность полосы ~1650 см-1 повышена.
В трансбутадиене-1,3 одна полоса asС=С ~1600 см-1.Широкая полоса.~1625 (~6,16)с.Повышенная интенсивность, может наблюдаться полоса 1590 см-1.1660-1580 (6,02-6,33)с.Повышенная интенсивность.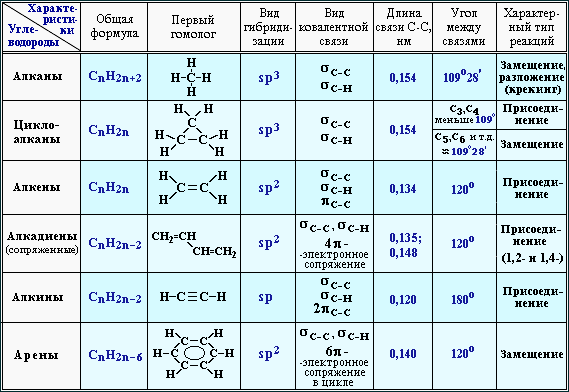 -В группе –НС=СН-СF3 влияния F не наблюдается.При присоединении к С=С Cl, Br, I частота С=С, соответственно,понижается: 1610, 1605, 1593 см-1.~1750 (5,71)Пример. ИК спектр линейного алкена.Пример. ИК спектр несопряжённого диена- (R)-лимонена.Пример. ИК спектр сопряжённого диена– пентадиена-1,3.Валентные колебания С=С связей в циклических олефинахПоглощение в циклических алкенах.C=C8Тарасевич Б.Н., МГУ имени М.В.Ломоносова, химический факультет, кафедра органической химии1640 см-11566 см-11611 см-1h3Ch3C1730 см-11646 см-1h3Ch3C1678 см-11650 см-11657 см-11651 см-1=C=C, С=С=ХКумулированные двойные связиC=C=СС=С=СН2(аллены)1970-1950 (5,08-5,13)1060 (9,43)850 (11,76)C=C=O (кетены)2150 (4,65)1120 (8,93)2349,3 (4,256)as ср.ср.С-Н ср. (с.)(с.)as (оч.с.)~2000 (~5,00) (с.) (оч.с.) (оч.с.)Алифатические.Ароматические.N=C=O(изоцианаты)2155-2130 (4,64-4,70)2145 (4,66), 2115(4,73)2275-2260 (4,39-4,42)1390-1350 (7,19-7,41)as (с.)Положение не зависит от сопряжения.Не имеет практического применения.
-В группе –НС=СН-СF3 влияния F не наблюдается.При присоединении к С=С Cl, Br, I частота С=С, соответственно,понижается: 1610, 1605, 1593 см-1.~1750 (5,71)Пример. ИК спектр линейного алкена.Пример. ИК спектр несопряжённого диена- (R)-лимонена.Пример. ИК спектр сопряжённого диена– пентадиена-1,3.Валентные колебания С=С связей в циклических олефинахПоглощение в циклических алкенах.C=C8Тарасевич Б.Н., МГУ имени М.В.Ломоносова, химический факультет, кафедра органической химии1640 см-11566 см-11611 см-1h3Ch3C1730 см-11646 см-1h3Ch3C1678 см-11650 см-11657 см-11651 см-1=C=C, С=С=ХКумулированные двойные связиC=C=СС=С=СН2(аллены)1970-1950 (5,08-5,13)1060 (9,43)850 (11,76)C=C=O (кетены)2150 (4,65)1120 (8,93)2349,3 (4,256)as ср.ср.С-Н ср. (с.)(с.)as (оч.с.)~2000 (~5,00) (с.) (оч.с.) (оч.с.)Алифатические.Ароматические.N=C=O(изоцианаты)2155-2130 (4,64-4,70)2145 (4,66), 2115(4,73)2275-2260 (4,39-4,42)1390-1350 (7,19-7,41)as (с.)Положение не зависит от сопряжения.Не имеет практического применения. N=C=S(изотиоцианаты)-N3(азиды)2140-1990 (4,67-5,26)2130-2140 (4,70-4,90)2160-2120 (4,63-4,72)1350-1180 (7,41-8,48)О=С=О, СО2С=C=N(кетенимины)N=C=N(карбодиимиды)s (сл.)(с.) (с.)as (с.)s (ср.)Дублет 1930-1970 при концевом положении и приприсоединении электроотрицательных групп.Веерные колебания =СН2, для концевых групп.Атмосферный углекислый газ, используется для градуировки.Алифатические.Ароматические.
N=C=S(изотиоцианаты)-N3(азиды)2140-1990 (4,67-5,26)2130-2140 (4,70-4,90)2160-2120 (4,63-4,72)1350-1180 (7,41-8,48)О=С=О, СО2С=C=N(кетенимины)N=C=N(карбодиимиды)s (сл.)(с.) (с.)as (с.)s (ср.)Дублет 1930-1970 при концевом положении и приприсоединении электроотрицательных групп.Веерные колебания =СН2, для концевых групп.Атмосферный углекислый газ, используется для градуировки.Алифатические.Ароматические.
Другие полосы: 1090 см-1 (с.), 930 см-1 (с.)9Тарасевич Б.Н., МГУ имени М.В.Ломоносова, химический факультет, кафедра органической химииRHC=N+=NRR’C=N+=N(диазосоединения)2050-2035 (4,88-4,92)2030-2000 (4,93-5,00) (с.) (с.)Если R карбонильная группа, 2100-2080 см-1,Если R карбонильная группа, 2075-2050 см-1Пример. ИК спектр 1,2-пентадиена.ИзотиоцианатыПример.
Происхождение нефти, ее состав и основные свойства
Нефтяные месторождения — уникальное хранилище энергии, образованной и накопленной на протяжении миллионов лет в недрах нашей планеты. В этом материале — о том, какой путь проделала нефть, прежде чем там оказаться, из чего она состоит и какими свойствами обладает
В этом материале — о том, какой путь проделала нефть, прежде чем там оказаться, из чего она состоит и какими свойствами обладает
Две гипотезы
У ученых до сих пор нет единого мнения о том, как образовалась нефть. Существуют две принципиально разные теории происхождения нефти. Согласно первой — органической, или биогенной, — из останков древних организмов и растений, которые на протяжении миллионов лет осаждались на дне морей или захоронялись в континентальных условиях. Затем перерабатывались сообществами микроорганизмов и преобразовывались под действием температуры и давлений в результате тектонического опускания вглубь недр, формируя богатые органическим веществом нефтематеринские породы.
Необходимые условия для превращения органики в нефть возникают на глубине 1,5–6 км в так называемом нефтяном окне — при температуре от 70 до 190°C. В верхней его части температура недостаточно высока — и нефть получается «тяжелой»: вязкой, густой, с высоким содержанием смол и асфальтенов.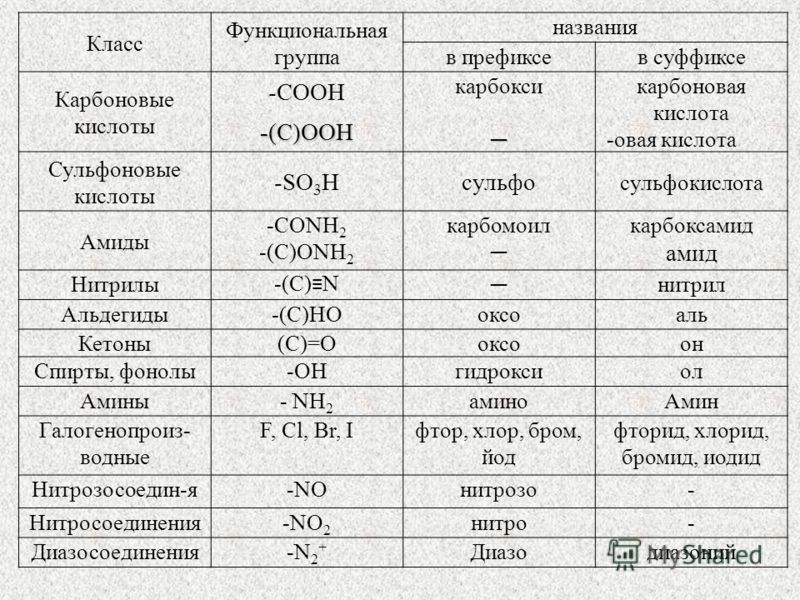 Внизу же температура пластов поднимается настолько, что молекулы органического вещества дробятся на самые простые углеводороды — образуется природный газ. Затем под воздействием различных сил, в том числе
градиента
характеризует степень изменения давления в пространстве, в данном случае — в зависимости от глубины пласта
давления, углеводороды мигрируют из нефтематеринского пласта в выше- или нижележащие породы.
Внизу же температура пластов поднимается настолько, что молекулы органического вещества дробятся на самые простые углеводороды — образуется природный газ. Затем под воздействием различных сил, в том числе
градиента
характеризует степень изменения давления в пространстве, в данном случае — в зависимости от глубины пласта
давления, углеводороды мигрируют из нефтематеринского пласта в выше- или нижележащие породы.
60 млн лет может занимать природный процесс образования нефти из органических останков
Природный процесс образования нефти из органических останков занимает в среднем от 10 до 60 млн лет, но если для органического вещества искусственно создать соответствующий температурный режим, то на его переход в растворимое состояние с образованием всех основных классов углеводородов достаточно часа. Подобные опыты сторонники органической гипотезы толкуют в свою пользу: преобразование органики в нефть налицо.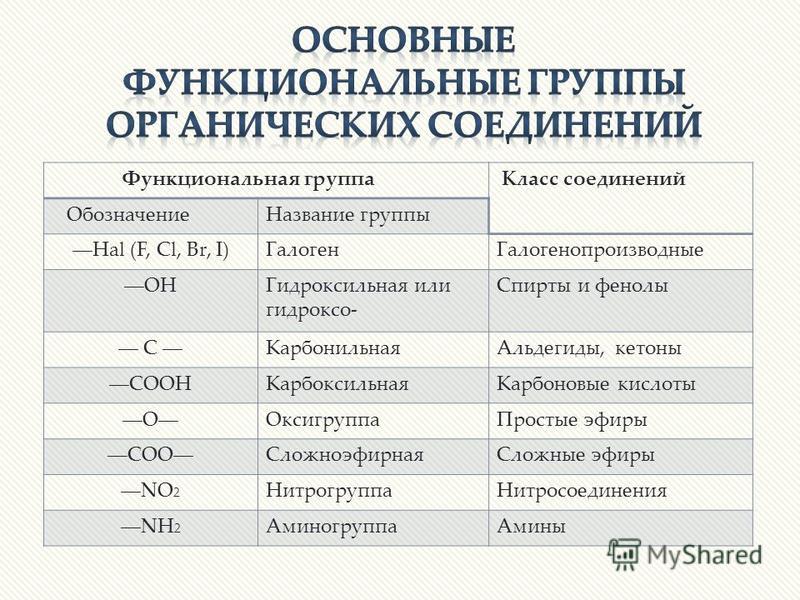 В пользу биогенного происхождения нефти есть и другие аргументы. Так, большинство промышленных скоплений нефти связано с осадочными породами. Мало того — живая материя и нефть сходны по элементному и изотопному составу. В частности, в большинстве нефтяных месторождений обнаруживаются биомаркеры, такие как порфирины — пигменты хлорофилла, широко распространенные в живой природе. Еще более убедительным можно считать совпадение изотопного состава углерода биомаркеров и других углеводородов нефти.
В пользу биогенного происхождения нефти есть и другие аргументы. Так, большинство промышленных скоплений нефти связано с осадочными породами. Мало того — живая материя и нефть сходны по элементному и изотопному составу. В частности, в большинстве нефтяных месторождений обнаруживаются биомаркеры, такие как порфирины — пигменты хлорофилла, широко распространенные в живой природе. Еще более убедительным можно считать совпадение изотопного состава углерода биомаркеров и других углеводородов нефти.
Состав и свойства нефти
ХАРАКТЕРИСТИКИ НЕФТИ МОГУТ ЗНАЧИТЕЛЬНО РАЗЛИЧАТЬСЯ ДЛЯ РАЗНЫХ МЕСТОРОЖДЕНИЙ
Основные химические элементы, из которых состоит нефть: углерод — 83–87%, водород — 12–14% и сера — до 7%. Последняя обычно присутствует в виде сероводорода или меркаптанов, которые могут вызывать коррозию оборудования. Также в нефтях присутствует до 1,7% азота и до 3,5% кислорода в виде разнообразных соединений. В очень небольших количествах в нефтях содержатся редкие металлы (например, V, Ni и др. ).
).
От месторождения к месторождению характеристики и состав нефти могут различаться очень значительно. Ее плотность колеблется от 0,77 до 1,1 г/см³. Чаще всего встречаются нефти с плотностью 0,82–0,92 г/см³.Температура кипения варьирует от 30 до 600°C в зависимости от химического состава. На этом свойстве основана разгонка нефтей на фракции. Вязкость сильно меняется в зависимости от температуры. Поверхностное натяжение может быть различным, но всегда меньше, чем у воды: это свойство используется для вытеснения нефти водой из пор пород-коллекторов.
Большинство ученых сегодня объясняют происхождение нефти биогенной теорией. Однако и неорганики приводят ряд аргументов в пользу своей точки зрения. Есть различные версии возможного неорганического происхождения нефти в недрах земли и других космических тел, но все они опираются на одни и те же факты. Во-первых, многие, хотя и не все месторождения связаны с зонами разломов. Через эти разломы, по мнению сторонников неорганической концепции, нефть и поднимается с больших глубин ближе к поверхности Земли. Во-вторых, месторождения бывают не только в осадочных, но также в магматических и метаморфических горных породах (впрочем, они могли оказаться там и в результате миграции). Кроме того, углеводороды встречаются в веществе, извергающемся из вулканов. Наконец, третий, наиболее весомый аргумент в пользу неорганической теории состоит в том, что углеводороды есть не только на Земле, но и в метеоритах, хвостах комет, в атмосфере других планет и в рассеянном космическом веществе. Так, присутствие метана отмечено на Юпитере, Сатурне, Уране и Нептуне. На Титане, спутнике Сатурна, обнаружены реки и озера, состоящие из смеси метана, этана, пропана, этилена и ацетилена. Если на других планетах Солнечной системы эти вещества могут образовываться без участия биологических объектов, почему это невозможно на Земле?
Во-вторых, месторождения бывают не только в осадочных, но также в магматических и метаморфических горных породах (впрочем, они могли оказаться там и в результате миграции). Кроме того, углеводороды встречаются в веществе, извергающемся из вулканов. Наконец, третий, наиболее весомый аргумент в пользу неорганической теории состоит в том, что углеводороды есть не только на Земле, но и в метеоритах, хвостах комет, в атмосфере других планет и в рассеянном космическом веществе. Так, присутствие метана отмечено на Юпитере, Сатурне, Уране и Нептуне. На Титане, спутнике Сатурна, обнаружены реки и озера, состоящие из смеси метана, этана, пропана, этилена и ацетилена. Если на других планетах Солнечной системы эти вещества могут образовываться без участия биологических объектов, почему это невозможно на Земле?
С точки зрения современных сторонников неорганической, или минеральной, гипотезы, углеводороды образуются из содержащихся в мантии Земли воды и углекислого газа в присутствии закисных соединений металлов на глубинах 100–200 км. Высокое давление в недрах земли препятствует термической деструкции сложных молекул углеводородов. В свою очередь сторонники органики не отрицают, что простые углеводороды, например метан, могут иметь и неорганическое происхождение. Опыты, направленные на подтверждение абиогенной теории, показали, что получаемые углеводороды могут содержать не более пяти атомов углерода, а нефть представляет собой смесь более тяжелых соединений. Этому противоречию объяснений пока нет.
Высокое давление в недрах земли препятствует термической деструкции сложных молекул углеводородов. В свою очередь сторонники органики не отрицают, что простые углеводороды, например метан, могут иметь и неорганическое происхождение. Опыты, направленные на подтверждение абиогенной теории, показали, что получаемые углеводороды могут содержать не более пяти атомов углерода, а нефть представляет собой смесь более тяжелых соединений. Этому противоречию объяснений пока нет.
Этапы образования нефти
СТАДИИ ОБРАЗОВАНИЯ ОСАДОЧНЫХ ПОРОД И ПРЕОБРАЗОВАНИЯ НЕФТИ
- осадконакопление (седиментогенез) — в процессе накопления осадка остатки живых организмов выпадают на дно водных бассейнов или захороняются в континентальной обстановке;
- биохимическая (диагенез) — происходит уплотнение, обезвоживание осадка и биохимические процессы в условиях ограниченного доступа кислорода;
- протокатагенез — опускание пласта органических остатков на глубину до 1,5–2 км при медленном подъеме температуры и давления;
- мезокатагенез, или главная фаза нефтеобразования (ГФ Н), — опускание пласта органических остатков на глубину до 3–4 км при подъеме температуры до 150°C.
 При этом органические вещества подвергаются термокаталитической деструкции, в результате чего образуются битуминозные вещества, составляющие основную массу микронефти. Далее происходит «отжим» нефти за счет перепада давления и эмиграционный вынос микронефти в пласты-коллекторы, а по ним — в ловушки;
При этом органические вещества подвергаются термокаталитической деструкции, в результате чего образуются битуминозные вещества, составляющие основную массу микронефти. Далее происходит «отжим» нефти за счет перепада давления и эмиграционный вынос микронефти в пласты-коллекторы, а по ним — в ловушки; - апокатагенез керогена, или главная фаза газообразования (ГФГ ), — опускание пласта органических остатков на глубину (как правило, более 4,5 км) при подъеме температуры до 180—250°C. При этом органическое вещество теряет нефтегенерирующий потенциал и генерирует газ.
В ловушке
Помимо чисто научного интереса гипотезы, объясняющие происхождение нефти и газа, имеют еще и политическое звучание. Действительно, раз уж нефть может получаться из неорганических веществ и темпы ее образования не десятки миллионов лет, как предполагает биогенная концепция, а во много тысяч раз выше, значит, проблема скорого исчерпания запасов становится как минимум не столь однозначной. Однако для нефтяников вопрос о том, откуда берется нефть, принципиален скорее с той точки зрения, может ли теория предсказать, где именно нужно искать месторождения. С этой задачей органики справляются лучше.
Однако для нефтяников вопрос о том, откуда берется нефть, принципиален скорее с той точки зрения, может ли теория предсказать, где именно нужно искать месторождения. С этой задачей органики справляются лучше.
В сугубо прагматическом отношении для добычи важно знать даже не то, где нефть зародилась, а где она находится сейчас и откуда ее можно извлечь. Дело в том, что в земной коре большая часть нефти не остается в материнской породе, а перемещается и скапливается в особых геологических объектах, называемых ловушками. Даже если предположить, что нефть имеет неорганическое происхождение, ловушки для нее все равно за редким исключением находятся в осадочных бассейнах.
Под действием различных факторов углеводороды отжимаются из нефтематеринских пород в породы-коллекторы, способные вмещать флюиды (нефть, природный газ, воду). Таким образом, нефтяное месторождение — вовсе не подземное «озеро», заполненное жидкостью, а достаточно плотная структура. Коллекторы характеризуются пористостью (долей содержащихся в них пустот) и проницаемостью (способностью пропускать через себя флюид). Для эффективного извлечения нефти из коллектора важно благоприятное сочетание обоих этих параметров.
Для эффективного извлечения нефти из коллектора важно благоприятное сочетание обоих этих параметров.
Типы коллекторов
БОЛЬШАЯ ЧАСТЬ ЗАПАСОВ НЕФТИ СОДЕРЖИТСЯ В ДВУХ ТИПАХ КОЛЛЕКТОРОВ
Терригенные (пески, песчаники, алевролиты, некоторые глинистые породы и др.) состоят из обломков горных пород и минералов. Этот тип коллекторов наиболее распространен: на них приходится 58% мировых запасов нефти и 77% газа. В качестве пустотного пространства, в котором накапливается нефть, в основном выступают поры — свободное пространство между зернами, из которых состоит коллектор.
Карбонатные (в основном известняки и доломиты) занимают второе место по распространенности (42% запасов нефти и 23% газа). Имеют сложную трещиноватую структуру. Нефть обычно содержится в кавернах, появившихся в результате выветривания и вымывания твердой породы, а также в трещинах. Наличие трещин влияет и на фильтрационные свойства коллектора, обеспечивая проводимость жидкости.
Вулканогенные и вулканогенно-осадочные (кислые эффузивы и интрузивы, пемзы, туфы, туфопесчаники и др.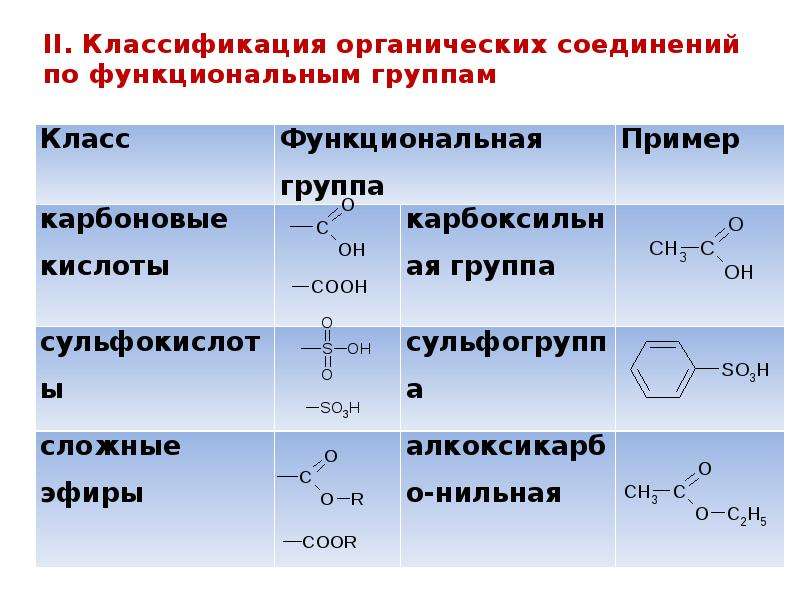 ) коллекторы отличаются характером пустотного пространства — в основном это трещины, — резкой изменчивостью свойств в пределах месторождений.
) коллекторы отличаются характером пустотного пространства — в основном это трещины, — резкой изменчивостью свойств в пределах месторождений.
Глинисто-кремнисто-битуминозные отличаются значительной изменчивостью состава, неодинаковой обогащенностью органическим веществом. Промышленная нефтеносность глинисто-кремнисто-битуминозных пород установлена в баженовской (Западная Сибирь) и пиленгской (Сахалин) свитах.
Двигаясь по коллектору, флюид в какой-то момент может упереться в непроницаемый для него экран — флюидоупор. Слои такой породы называют покрышками, а вместе с коллектором они формируют ловушки, удерживающие нефть и газ в месторождении. В классическом варианте в верхней части ловушки может присутствовать газ (он легче). Снизу залежь подстилается более плотной, чем нефть, водой.
Классификации ловушек чрезвычайно разнообразны (часть из них см. на рис.). Наиболее простая и с точки зрения геологоразведки, и для дальнейшей добычи — антиклинальная ловушка (сводовое поднятие), перекрытая сверху пластом флюидоупора.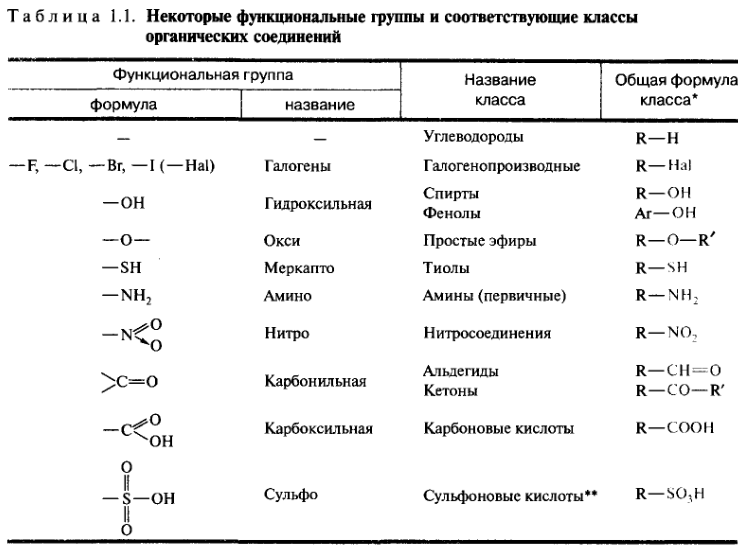 Такие ловушки образуются в результате изгибов пластов осадочного чехла. Однако помимо изгибов внутренние пласты претерпевают и множество других деформаций. В результате тектонических движений, например, пластколлектор может деформироваться и потерять свою однородность. В этом случае процессы геологоразведки и добычи оказываются намного сложнее. Еще одна неприятность, которая поджидает нефтяников со стороны ловушек, — замещение проницаемых пород, обладающих хорошими коллекторскими свойствами, например песчаников, непроницаемыми. Такие ловушки называются литологическими.
Такие ловушки образуются в результате изгибов пластов осадочного чехла. Однако помимо изгибов внутренние пласты претерпевают и множество других деформаций. В результате тектонических движений, например, пластколлектор может деформироваться и потерять свою однородность. В этом случае процессы геологоразведки и добычи оказываются намного сложнее. Еще одна неприятность, которая поджидает нефтяников со стороны ловушек, — замещение проницаемых пород, обладающих хорошими коллекторскими свойствами, например песчаников, непроницаемыми. Такие ловушки называются литологическими.
Антиклиналь
Тектоническая экранированная ловушка
Соляной купол
Стратиграфическая ловушка
Ровесница динозавров
Когда же образовались те структуры, в которых сегодня находят нефть? Основные ее ресурсы сосредоточены в относительно молодых мезозойских и кайнозойских отложениях, сформировавшихся от нескольких десятков млн до 250 млн лет назад.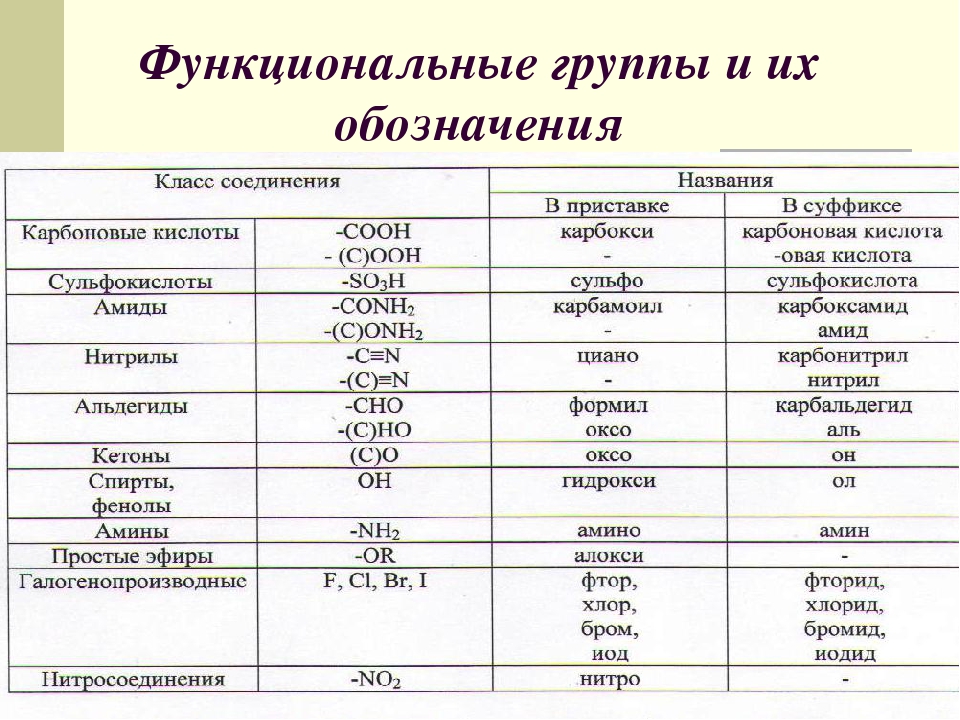 Однако добыча нефти ведется и из палеозойских отложений (до 500 млн лет назад), а в Восточной Сибири — даже из отложений верхнего протерозоя, которым более полумиллиарда лет.
Однако добыча нефти ведется и из палеозойских отложений (до 500 млн лет назад), а в Восточной Сибири — даже из отложений верхнего протерозоя, которым более полумиллиарда лет.
Многочисленные нефтяные месторождения встречаются в отложениях девона (420–360 млн лет назад). В этот период на Земле появились насекомые и земноводные, в морях большого разнообразия достигли рыбы и кораллы. Во время пермского периода (300–250 млн лет назад) климат стал более засушливым, в результате чего высыхали моря и образовывались мощные соляные толщи, ставшие впоследствии идеальными флюидоупорами.
Эпоха господства динозавров — юрский (200–145 млн лет назад) и меловой (145–66 млн лет назад) периоды мезозоя — характеризуется максимальным расцветом жизни и связана с высоким осадконакоплением. Некоторые гигантские и крупные месторождения (Иран, Ирак) нефти находят в отложениях палеогена(66—23 млн лет назад). Известны месторождения нефти в четвертичных породах возрастом менее 2 млн лет (Азербайджан).
Известны месторождения нефти в четвертичных породах возрастом менее 2 млн лет (Азербайджан).
Впрочем, связь между возрастом пород-коллекторов и временем образования нефти не прямолинейна. Этот процесс может быть последовательным: в юрском или меловом периоде органический осадок начал опускаться вниз и преобразовываться в нефть, которая по прошествии нескольких десятков миллионов лет мигрировала в коллекторы, принадлежащие к более молодым комплексам пород. С другой стороны, древние нефтематеринские породы, образованные в палеозое, могли опуститься на достаточную для созревания нефти глубину намного позднее. Таким образом, в одних и тех же коллекторах можно найти и более молодую, и древнюю нефть, значительно различающиеся по своим свойствам.
Смешанные свойства
Между тем моментом, когда на дно морского бассейна опускается отмерший планктон, и тем, когда накопившийся слой органики, погрузившись на несколько километров вниз, отдает нефть, миллионы лет и целый ряд химических и физических преобразований. Поэтому нет ничего удивительного в том, что состав нефти крайне разнообразен и неоднороден. Именно поэтому сами нефтяники привыкли употреблять это слово во множественном числе — говоря о разведке или добыче нефтей и подразумевая, что каждый раз извлекаемая жидкость будет уникальной, отличающейся от всего, что было добыто ранее.
Поэтому нет ничего удивительного в том, что состав нефти крайне разнообразен и неоднороден. Именно поэтому сами нефтяники привыкли употреблять это слово во множественном числе — говоря о разведке или добыче нефтей и подразумевая, что каждый раз извлекаемая жидкость будет уникальной, отличающейся от всего, что было добыто ранее.
В своей основе нефть — сложная смесь углеводородов различной молекулярной массы. Преобладают в ней алканы, нафтены и арены. Наиболее простые из них — алканы (парафиновые углеводороды), у которых к атомам углерода присоединено максимальное количество атомов водорода. К алканам относятся метан, этан, пропан, бутан, пентан и т. д. Они могут быть представлены газами, жидкостями и твердыми кристаллическими веществами. Количество алканов в нефти колеблется от четверти до семидесяти процентов объема. При большом проценте алканов нефть считается парафинистой. С точки зрения добычи такое свойство считается проблемным — при подъеме нефти из скважины и соответственном уменьшении температуры парафины могут кристаллизоваться и выпадать на стенки скважин.
Нафтены — соединения, в которых атомы углерода соединяются в циклическое кольцо (циклопропан, циклобутан, циклопентан и др.). Все связи углерода и водорода здесь насыщены, поэтому нафтеновые нефти обладают устойчивыми свойствами. Нафтены могут иметь от 2 до 5 циклов в молекуле, по их составу химики пытаются определять зрелость и другие свойства нефти.
В составе аренов, или ароматических углеводородов, также есть циклические структуры — бензольные ядра. Для них характерны большая растворяемость, более высокая плотность и температура кипения. Обычно нефть содержит 10–20% аренов, а в ароматических нефтях их содержание доходит до 35%. Наиболее богаты аренами молодые нефти. Арены — ценное сырье при производстве синтетических каучуков, пластмасс, синтетических волокон, анилино-красочных и взрывчатых веществ, фармацевтических препаратов.
Нефть любят называть черным золотом, однако чистые углеводороды бесцветны. Цвет нефтям придают разнообразные примеси, в основном смолы. Асфальтосмолистая часть нефтей — вещество темного цвета. Входящие в ее состав асфальтены растворяются в бензине.
Асфальтосмолистая часть нефтей — вещество темного цвета. Входящие в ее состав асфальтены растворяются в бензине.
Нефтяные смолы, напротив, не растворяются. Они представляют собой вязкую или твердую, но легкоплавкую массу. Наибольшее количество смол отмечается в тяжелых темных нефтях, богатых ароматическими углеводородами. Такие нефти обладают повышенной вязкостью, что затрудняет их извлечение из пласта.
23.2: Функциональные группы и классы органических соединений
Общая химия Libretexts Textmap, организованная вокруг учебника
Химия: принципы, закономерности и приложения
Брюса А. Аверилла
I II III IV V VI VII VIII IX X XI XII XIII X XIV X VII X VIII X IX X X X XI X XII X XII 000 4 XI 9000 ● Домашнее задание
Цели обучения
- Знать основные классы органических соединений и определять важные функциональные группы.

Ранее вы познакомились с несколькими структурными единицами, которые химики используют для классификации органических соединений и прогнозирования их реакционной способности. Эти функциональные группы, которые определяют химическую реакционную способность молекулы при заданном наборе условий, могут состоять из одного атома (например, Cl) или группы атомов (например, CO 2 H). Основные семейства органических соединений характеризуются своими функциональными группами. Рисунок \ (\ PageIndex {1} \) суммирует пять семейств, представленных в предыдущих главах, дает примеры соединений, которые содержат каждую функциональную группу, и перечисляет суффикс или префикс, используемый в систематической номенклатуре соединений, содержащих каждую функциональную группу.
Рисунок \ (\ PageIndex {1} \): основные классы органических соединений
Первое семейство, указанное на рисунке \ (\ PageIndex {1} \), — это углеводороды. К ним относятся алканы с общей молекулярной формулой C n H 2n +2 , где n — целое число; алкены, представленные C n H 2n ; алкины, представленные C n H 2n − 2 ; и арены.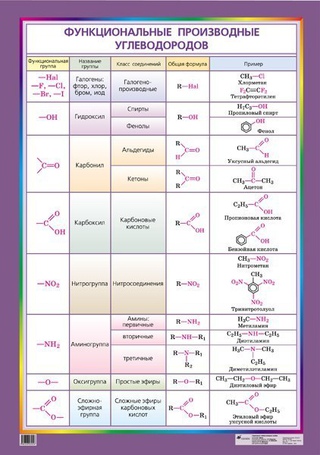 Галогензамещенные алканы, алкены и арены образуют второе основное семейство органических соединений, которое включает алкилгалогениды и арилгалогениды.Кислородсодержащие органические соединения, третье семейство, можно разделить на два основных типа: те, которые содержат по крайней мере одну связь C – O, которые включают спирты, фенолы (производные бензола) и простые эфиры, и те, которые содержат карбонильную группу. (C = O), которые включают альдегиды, кетоны и карбоновые кислоты. Производные карбоновых кислот, четвертое перечисленное семейство, представляют собой соединения, в которых ОН функциональной группы –CO 2 H заменен либо на алкоксигруппу (–OR) с образованием сложного эфира, либо на амидо (–NRR ‘, где R и R ‘могут быть H и / или алкильными группами), образуя амид.Пятое семейство азотсодержащих органических соединений включает амины; нитрилы, которые имеют связь C≡N; и нитросоединения, содержащие группу –NO 2 .
Галогензамещенные алканы, алкены и арены образуют второе основное семейство органических соединений, которое включает алкилгалогениды и арилгалогениды.Кислородсодержащие органические соединения, третье семейство, можно разделить на два основных типа: те, которые содержат по крайней мере одну связь C – O, которые включают спирты, фенолы (производные бензола) и простые эфиры, и те, которые содержат карбонильную группу. (C = O), которые включают альдегиды, кетоны и карбоновые кислоты. Производные карбоновых кислот, четвертое перечисленное семейство, представляют собой соединения, в которых ОН функциональной группы –CO 2 H заменен либо на алкоксигруппу (–OR) с образованием сложного эфира, либо на амидо (–NRR ‘, где R и R ‘могут быть H и / или алкильными группами), образуя амид.Пятое семейство азотсодержащих органических соединений включает амины; нитрилы, которые имеют связь C≡N; и нитросоединения, содержащие группу –NO 2 .
Систематическая номенклатура органических соединений указывает положения заместителей с использованием наименьших цифр, возможных для идентификации их положений в углеродной цепи исходного соединения. Если два соединения имеют одинаковое систематическое название, то это одно и то же соединение. Хотя систематические названия предпочтительнее, поскольку они недвусмысленны, многие органические соединения известны под своими общими названиями, а не систематическими названиями.В общей номенклатуре используется префиксная форма — для соединения, которое не содержит атомов углерода, кроме атомов в функциональной группе, и ацет — для тех, которые имеют один дополнительный атом углерода [два в случае ацетона, (CH 3 ) 2 C = O]. Таким образом, метаналь и этаналь, соответственно, являются систематическими названиями формальдегида и ацетальдегида.
Если два соединения имеют одинаковое систематическое название, то это одно и то же соединение. Хотя систематические названия предпочтительнее, поскольку они недвусмысленны, многие органические соединения известны под своими общими названиями, а не систематическими названиями.В общей номенклатуре используется префиксная форма — для соединения, которое не содержит атомов углерода, кроме атомов в функциональной группе, и ацет — для тех, которые имеют один дополнительный атом углерода [два в случае ацетона, (CH 3 ) 2 C = O]. Таким образом, метаналь и этаналь, соответственно, являются систематическими названиями формальдегида и ацетальдегида.
Напомним, что в систематической номенклатуре ароматических соединений положения групп, присоединенных к ароматическому кольцу, обозначены числами, начиная с 1 и продолжаясь по кольцу в направлении, дающем наименьшие возможные числа.Например, положение первой группы CH 3 в диметилбензоле обозначено цифрой 1, но вторая группа CH 3 , которая может быть помещена в любое из трех положений, дает 1,2-диметилбензол, 1 , 3-диметилбензол или 1,4-диметилбензол (Рисунок \ (\ PageIndex {2} \)). Напротив, в общей номенклатуре префиксы орто-, мета- и пара- используются для описания относительного положения групп, присоединенных к ароматическому кольцу. Если группы CH 3 в диметилбензоле, обычное название которого — ксилол, соседствуют друг с другом, это соединение обычно называют орто-ксилолом, сокращенно о-ксилолом.Если они расположены напротив друг друга на кольце, соединение обычно называют пара-ксилолом или п-ксилолом. Когда расположение является промежуточным между орто- и пара-соединениями, название — мета-ксилол или м-ксилол.
Напротив, в общей номенклатуре префиксы орто-, мета- и пара- используются для описания относительного положения групп, присоединенных к ароматическому кольцу. Если группы CH 3 в диметилбензоле, обычное название которого — ксилол, соседствуют друг с другом, это соединение обычно называют орто-ксилолом, сокращенно о-ксилолом.Если они расположены напротив друг друга на кольце, соединение обычно называют пара-ксилолом или п-ксилолом. Когда расположение является промежуточным между орто- и пара-соединениями, название — мета-ксилол или м-ксилол.
Рисунок \ (\ PageIndex {2} \): Общая номенклатура для замен ароматических колец
Мы начинаем обсуждение структуры и реакционной способности органических соединений с изучения структурных вариаций простых насыщенных углеводородов, известных как алканы.Эти соединения служат каркасом, к которому наиболее часто присоединяются различные функциональные группы.
Резюме
Функциональные группы определяют химическую реакционную способность органической молекулы.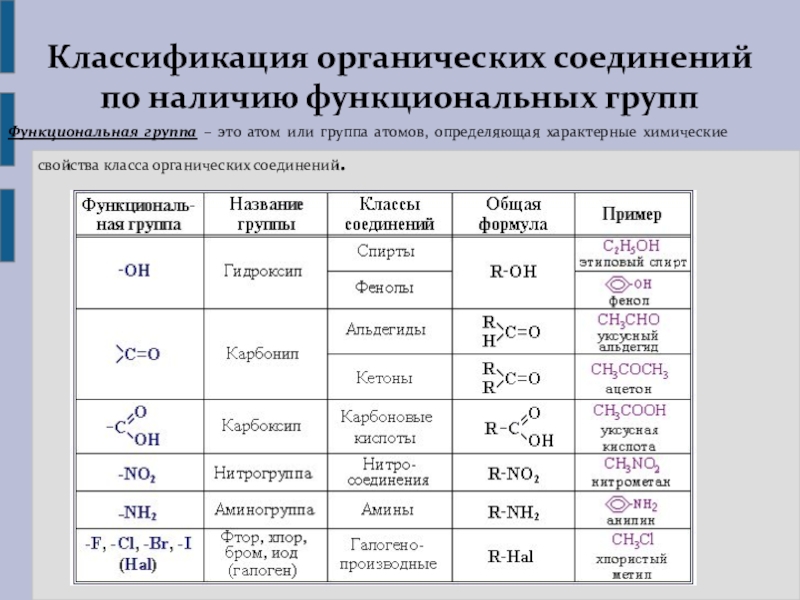 Функциональные группы — это структурные единицы, которые определяют химическую реакционную способность молекулы при заданном наборе условий. Органические соединения подразделяются на несколько основных категорий в зависимости от содержащихся в них функциональных групп. В систематических названиях органических соединений числа указывают положения функциональных групп в основной углеводородной основе.Многие органические соединения также имеют общие названия, в которых используется префиксная форма — для соединения, которое не содержит углеродов, кроме атомов углерода в функциональной группе и ацетате, — для тех, которые имеют один дополнительный атом углерода.
Функциональные группы — это структурные единицы, которые определяют химическую реакционную способность молекулы при заданном наборе условий. Органические соединения подразделяются на несколько основных категорий в зависимости от содержащихся в них функциональных групп. В систематических названиях органических соединений числа указывают положения функциональных групп в основной углеводородной основе.Многие органические соединения также имеют общие названия, в которых используется префиксная форма — для соединения, которое не содержит углеродов, кроме атомов углерода в функциональной группе и ацетате, — для тех, которые имеют один дополнительный атом углерода.
Концептуальные проблемы
- Могут ли два вещества иметь одно и то же систематическое название и быть разными соединениями?
- Считается ли кратная связь углерод-углерод функциональной группой?
Органические соединения
Химические соединения живых существ известны как органических соединений из-за их связи с организмами и потому, что они являются углеродсодержащими соединениями. Органические соединения, которые представляют собой соединения, связанные с жизненными процессами, являются предметом органической химии. Среди многочисленных типов органических соединений во всем живом есть четыре основные категории: углеводы, липиды, белки и нуклеиновые кислоты.
Органические соединения, которые представляют собой соединения, связанные с жизненными процессами, являются предметом органической химии. Среди многочисленных типов органических соединений во всем живом есть четыре основные категории: углеводы, липиды, белки и нуклеиновые кислоты.Углеводы
Почти все организмы используют углеводов в качестве источников энергии. Кроме того, некоторые углеводы служат конструкционными материалами. Углеводы — это молекулы, состоящие из углерода, водорода и кислорода; отношение атомов водорода к атомам кислорода и углерода составляет 2: 1.
Простые углеводы, обычно называемые сахарами, могут быть моносахаридами, , если они состоят из одиночных молекул, или дисахаридами, , если они состоят из двух молекул. Наиболее важным моносахаридом является глюкоза, углевод с молекулярной формулой C 6 H 12 O 6 . Глюкоза — это основная форма топлива для живых существ.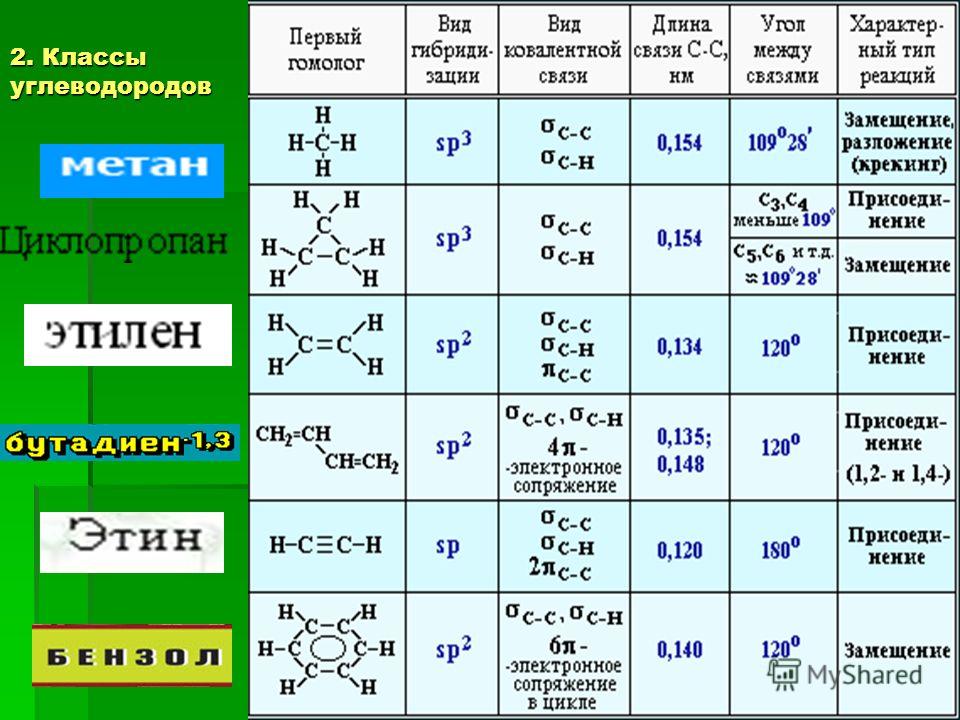 В многоклеточных организмах он растворим и транспортируется жидкостями организма ко всем клеткам, где метаболизируется с высвобождением своей энергии.Глюкоза является исходным материалом для клеточного дыхания и основным продуктом фотосинтеза (см. Главы 5 и 6).
В многоклеточных организмах он растворим и транспортируется жидкостями организма ко всем клеткам, где метаболизируется с высвобождением своей энергии.Глюкоза является исходным материалом для клеточного дыхания и основным продуктом фотосинтеза (см. Главы 5 и 6).
Три важных дисахарида также содержатся в живых организмах: мальтоза, сахароза и лактоза. Мальтоза представляет собой комбинацию двух ковалентно связанных единиц глюкозы. Сахароза столового сахара образуется путем связывания глюкозы с другим моносахаридом, называемым фруктозой. (Рисунок 2-2 показывает, что при синтезе сахарозы образуется молекула воды. Поэтому процесс называется реакцией дегидратации . Обратный процесс — гидролиз, процесс, в котором молекула расщепляется и добавляется вода.) Лактоза состоит из единиц глюкозы и галактозы.
Рисунок 2-2 Молекулы глюкозы и фруктозы объединяются, образуя дисахарид сахарозу.
Сложные углеводы известны как полисахариды . Полисахариды образуются путем связывания бесчисленных моносахаридов. Среди наиболее важных полисахаридов — крахмал, который состоит из сотен или тысяч единиц глюкозы, связанных друг с другом.Крахмал служит формой хранения углеводов. Большая часть населения мира удовлетворяет свои потребности в энергии с помощью крахмала в виде риса, пшеницы, кукурузы и картофеля.
Полисахариды образуются путем связывания бесчисленных моносахаридов. Среди наиболее важных полисахаридов — крахмал, который состоит из сотен или тысяч единиц глюкозы, связанных друг с другом.Крахмал служит формой хранения углеводов. Большая часть населения мира удовлетворяет свои потребности в энергии с помощью крахмала в виде риса, пшеницы, кукурузы и картофеля.
Два других важных полисахарида — это гликоген и целлюлоза. Гликоген также состоит из тысяч единиц глюкозы, но эти единицы связаны другим образом, чем в крахмале. Гликоген — это форма, в которой глюкоза хранится в печени человека. Целлюлоза используется в основном как структурный углевод.Он также состоит из единиц глюкозы, но единицы не могут высвобождаться друг из друга, за исключением нескольких видов организмов. Древесина состоит в основном из целлюлозы, как и стенки растительных клеток. Хлопчатобумажная ткань и бумага — это товарные целлюлозные продукты.
Липиды
Липиды — это органические молекулы, состоящие из атомов углерода, водорода и кислорода.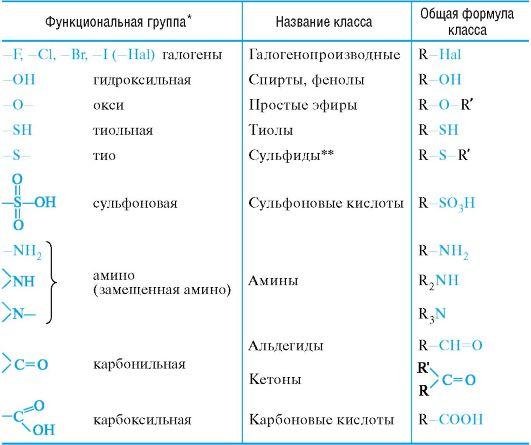 Отношение атомов водорода к атомам кислорода в липидах намного выше, чем в углеводах. Липиды включают стероиды (материал, из которого состоят многие гормоны), воски и жиров.
Отношение атомов водорода к атомам кислорода в липидах намного выше, чем в углеводах. Липиды включают стероиды (материал, из которого состоят многие гормоны), воски и жиров.
Молекулы жира состоят из молекулы глицерина и одной, двух или трех молекул жирных кислот (см. Рис. 2-3). Молекула глицерина содержит три гидроксильные (–ОН) группы. Жирная кислота представляет собой длинную цепочку атомов углерода (от 4 до 24) с карбоксильной (–COOH) группой на одном конце. Все жирные кислоты в жире могут быть одинаковыми или разными. Они связаны с молекулой глицерина в процессе удаления воды.
Некоторые жирные кислоты имеют в своих молекулах одну или несколько двойных связей.Жиры, в состав которых входят эти молекулы, представляют собой ненасыщенных жиров. Другие жирные кислоты не имеют двойных связей. Жиры, в состав которых входят эти жирные кислоты, представляют собой насыщенных жиров. В большинстве случаев, связанных со здоровьем человека, потребление ненасыщенных жиров предпочтительнее насыщенных жиров.
Жиры, хранящиеся в клетках, обычно образуют прозрачные масляные капли, называемые глобулами , потому что жиры не растворяются в воде. Растения часто хранят жиры в своих семенах, а животные — в больших прозрачных шариках в клетках жировой ткани.Жиры в жировой ткани содержат много концентрированной энергии. Следовательно, они служат резервным источником энергии для организма. Фермент липаза расщепляет жиры на жирные кислоты и глицерин в пищеварительной системе человека.
Рисунок 2-3 Молекула жира создается путем объединения молекулы глицерина с тремя молекулами жирных кислот. (Две насыщенные жирные кислоты и одна ненасыщенная жирная кислота показаны для сравнения.) Сконструированная молекула находится внизу.
Белки
Белки, среди самых сложных из всех органических соединений, состоят из аминокислот (см. Рис. 2-4), которые содержат атомы углерода, водорода, кислорода и азота.Некоторые аминокислоты также содержат атомы серы, фосфора или других микроэлементов, таких как железо или медь.
Рисунок 2-4 Структура и химический состав аминокислот. Когда две аминокислоты соединяются в дипептид, –OH одной аминокислоты удаляется, а –H второй удаляется. Итак, вода удалена. Дипептидная связь (справа) образует соединение аминокислот вместе.
Многие белки огромны и чрезвычайно сложны. Однако все белки состоят из длинных цепочек относительно простых аминокислот.Есть 20 видов аминокислот. Каждая аминокислота (см. Левую иллюстрацию на рис. 2-4) имеет амино (–NH 2 ) группу, карбоксильную (–COOH) группу и группу атомов, называемую группой –R (где R обозначает радикал ). Аминокислоты различаются в зависимости от природы группы –R, как показано на средней иллюстрации Рисунка 2-4. Примерами аминокислот являются аланин, валин, глутаминовая кислота, триптофан, тирозин и гистидин.
Удаление молекул воды связывает аминокислоты с образованием белка.Процесс называется дегидратационным синтезом, и побочным продуктом синтеза является вода. Связи между аминокислотами составляют пептидных связей, и небольшие белки часто называют пептидами.
Связи между аминокислотами составляют пептидных связей, и небольшие белки часто называют пептидами.
Все живое зависит от белков. Белки — это основные молекулы, из которых построены живые существа. Некоторые белки растворены или взвешены в водянистом веществе клеток, а другие включены в различные структуры клеток.Белки также являются поддерживающими и укрепляющими материалами в тканях вне клеток. Кости, хрящи, сухожилия и связки состоят из белков.
Одна из важнейших функций белков — это фермент. Ферменты катализируют химические реакции, происходящие в клетках. Они не расходуются в реакции; скорее, они остаются доступными для катализа последующих реакций.
Каждый вид производит белки, уникальные для этого вида. Информация для синтеза уникальных белков находится в ядре клетки.Так называемый генетический код определяет аминокислотную последовательность в белках. Следовательно, генетический код регулирует химию, происходящую внутри клетки. Белки также могут служить резервным источником энергии для клетки. Когда аминогруппа удаляется из аминокислоты, полученное соединение богато энергией.
Белки также могут служить резервным источником энергии для клетки. Когда аминогруппа удаляется из аминокислоты, полученное соединение богато энергией.
Нуклеиновые кислоты
Подобно белкам, нуклеиновые кислоты представляют собой очень большие молекулы. Нуклеиновые кислоты состоят из более мелких единиц, называемых нуклеотида. Каждый нуклеотид содержит молекулу углевода (сахар), фосфатную группу и азотсодержащую молекулу, которая в силу своих свойств представляет собой азотистое основание .
У живых организмов есть две важные нуклеиновые кислоты. Один тип — это дезоксирибонуклеиновая кислота, или ДНК. Другой — рибонуклеиновая кислота, или РНК. ДНК находится в основном в ядре клетки, в то время как РНК обнаруживается как в ядре, так и в цитоплазме , — полужидкое вещество, составляющее объем клетки (см. Главу 3).
ДНК и РНК отличаются друг от друга по своим компонентам.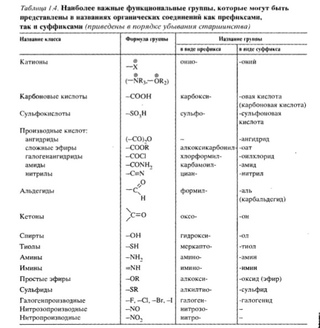 ДНК содержит углевод дезоксирибозу, а РНК — рибозу. Кроме того, ДНК содержит тимин, а РНК — урацил. Структура ДНК и ее значение в жизни клеток рассматриваются в главе 10.
ДНК содержит углевод дезоксирибозу, а РНК — рибозу. Кроме того, ДНК содержит тимин, а РНК — урацил. Структура ДНК и ее значение в жизни клеток рассматриваются в главе 10.
Какие четыре органические молекулы содержатся в живых существах? | Образование
Четыре органические молекулы составляют всю жизнь на Земле. Органические молекулы содержат углерод и водород, химически связанные друг с другом в длинные цепи, с углеродом в качестве основной цепи и атомами водорода, прикрепленными к атомам углерода.Способность этих атомов прикрепляться друг к другу позволяет создавать бесчисленные соединения, способствующие жизни. Всем организмам необходимы четыре типа органических молекул: нуклеиновые кислоты, белки, углеводы и липиды; жизнь не может существовать, если какая-либо из этих молекул отсутствует.
Нуклеиновые кислоты
Нуклеиновые кислоты представляют собой ДНК и РНК или дезоксирибонуклеиновую кислоту и рибонуклеиновую кислоту соответственно. Они производят белки, которые присутствуют почти в каждой структуре и выполняют почти все функции вашего тела.ДНК имеет скрученную лестничную форму, в то время как РНК имеет много разных форм в зависимости от ее функции. ДНК обычно остается в центре или ядре клетки; РНК может перемещаться по клетке туда, где это необходимо. Основы обоих веществ состоят из чередующихся молекул фосфата и сахара. Нуклеотидные основания составляют «перекладины», прикрепленные к позвоночнику. Из двух типов нуклеиновых кислот ДНК более стабильна, что снижает вероятность ее расщепления, чем РНК. Ваши гены состоят из ДНК, и каждый ген обеспечивает код для создания определенного белка.РНК помогает ДНК производить эти белки.
Они производят белки, которые присутствуют почти в каждой структуре и выполняют почти все функции вашего тела.ДНК имеет скрученную лестничную форму, в то время как РНК имеет много разных форм в зависимости от ее функции. ДНК обычно остается в центре или ядре клетки; РНК может перемещаться по клетке туда, где это необходимо. Основы обоих веществ состоят из чередующихся молекул фосфата и сахара. Нуклеотидные основания составляют «перекладины», прикрепленные к позвоночнику. Из двух типов нуклеиновых кислот ДНК более стабильна, что снижает вероятность ее расщепления, чем РНК. Ваши гены состоят из ДНК, и каждый ген обеспечивает код для создания определенного белка.РНК помогает ДНК производить эти белки.
Белки
Белки, вероятно, являются наиболее универсальными из всех органических молекул, они образуют множество структур и выполняют различные функции внутри организмов. Строительные блоки, называемые аминокислотами, составляют белки. Около 20 различных аминокислот объединяются, чтобы сформировать все типы белков на Земле. Все эти аминокислоты имеют почти одинаковый состав; единственное отличие — это группа R, которая отличается для каждой из аминокислот и придает им их уникальность.Когда образуется белок, белок объединяется по одной аминокислоте за раз внутри рибосомы — структуры, в которой происходит синтез белка. Белки имеют четыре уровня структуры: первичная структура — это связывание аминокислот друг с другом; вторичная структура относится к складкам в определенных областях внутри белка; третичная структура — это окончательный трехмерный вид белка; и четвертичная структура состоит из более мелких белковых субъединиц, химически связанных вместе с образованием более крупного белка.
Все эти аминокислоты имеют почти одинаковый состав; единственное отличие — это группа R, которая отличается для каждой из аминокислот и придает им их уникальность.Когда образуется белок, белок объединяется по одной аминокислоте за раз внутри рибосомы — структуры, в которой происходит синтез белка. Белки имеют четыре уровня структуры: первичная структура — это связывание аминокислот друг с другом; вторичная структура относится к складкам в определенных областях внутри белка; третичная структура — это окончательный трехмерный вид белка; и четвертичная структура состоит из более мелких белковых субъединиц, химически связанных вместе с образованием более крупного белка.
Углеводы
Углеводы составляют наибольшее количество органических молекул в организмах. В основном углеводы — это сахара; их происхождение можно проследить до фотосинтеза, процесса, с помощью которого организмы, такие как растения, используют солнечный свет для преобразования углекислого газа и воды в пищу.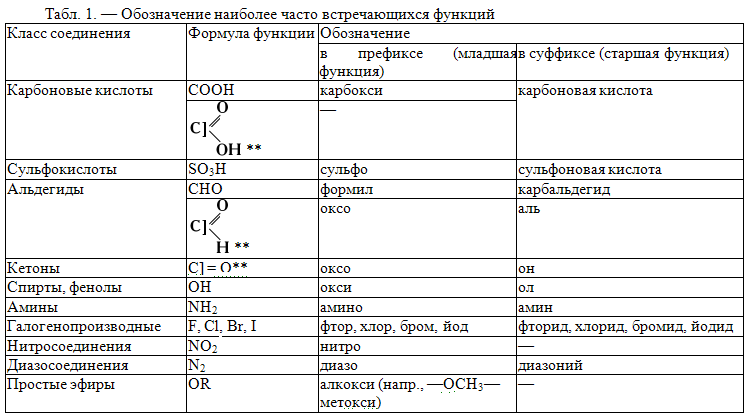 Самый простой сахар — это глюкоза, молекула, используемая для обеспечения топливом многих типов организмов, включая человека. Сахара, содержащиеся в пищевых продуктах, включают: фруктозу во фруктах, галактозу в молоке, мальтозу в овощах и сахарозу в столовом сахаре.Крахмал, содержащийся в цельнозерновых и овощах, представляет собой сложный углевод, состоящий из цепочек более простых молекул глюкозы. В вашем организме есть фермент амилаза, который расщепляет углеводы из пищи, которую вы едите, на глюкозу, которую ваши клетки могут использовать в качестве энергии.
Самый простой сахар — это глюкоза, молекула, используемая для обеспечения топливом многих типов организмов, включая человека. Сахара, содержащиеся в пищевых продуктах, включают: фруктозу во фруктах, галактозу в молоке, мальтозу в овощах и сахарозу в столовом сахаре.Крахмал, содержащийся в цельнозерновых и овощах, представляет собой сложный углевод, состоящий из цепочек более простых молекул глюкозы. В вашем организме есть фермент амилаза, который расщепляет углеводы из пищи, которую вы едите, на глюкозу, которую ваши клетки могут использовать в качестве энергии.
Липиды
Липиды, возможно, более известные как жиры, присутствуют в организме в различных формах и содержат больше всего энергии из всех органических соединений. Когда ваше тело сжигает липиды в качестве топлива, вы получаете больше энергии, чем если бы вы сжигали другие органические молекулы.В организме жиры выполняют множество функций, принимая форму фосфолипидов и холестерина, важных компонентов клеточных мембран; воски, обеспечивающие защитный слой растений и животных; гормоны, которые сигнализируют о различных функциях вашего тела; витамины, которые помогают в различных функциях клеток; и стероиды, которые важны для ряда физиологических процессов. Жиры животных, как правило, более вязкие, чем жиры растений.
Жиры животных, как правило, более вязкие, чем жиры растений.
Ссылки
Ресурсы
Writer Bio
Хо-Дип Динь пишет с 2005 года.Она пишет статьи о eHow и Answerbag, специализируясь на таких темах, как здоровье человека, а также профилактика и лечение заболеваний. Дин получила степень бакалавра физиологии в Калифорнийском университете в Дэвисе.
1,4 Органические соединения | Химия жизни
1.4 Органические соединения (ESG49)
Учащиеся будут изучать углеводы, липиды, белки и нуклеиновые кислоты под следующими заголовками:
- Молекулярный состав : основные элементы, составляющие класс соединений.
- Структурный состав : как мономеры соединяются вместе с образованием полимеров.
- Биологическая роль : важность этих молекул для животных и растений.
- Химический тест : как определить присутствие каждого класса соединений.
Есть также объяснение ферментов в разделе белков.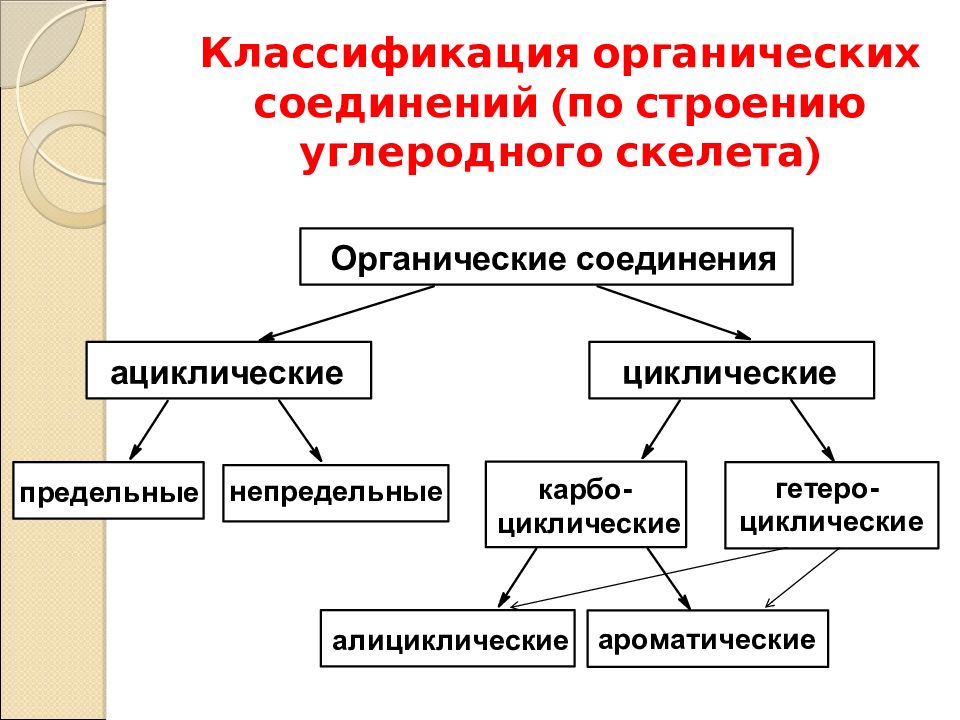 Этот раздел главы содержит наиболее практическую работу, поэтому следует уделить много времени рассмотрению этого раздела.
Этот раздел главы содержит наиболее практическую работу, поэтому следует уделить много времени рассмотрению этого раздела.
Органическое соединение — это соединение, молекулы которого содержат C и обычно по крайней мере одну связь C-C или C-H. Очень маленькие углеродсодержащие молекулы, которые не подчиняются указанным выше правилам, такие как \ (\ text {CO} _ {2} \) и простые карбонаты, считаются неорганическими. Жизнь на Земле была бы невозможна без углерода. Помимо воды, большинство молекул живых клеток основаны на углероде и, следовательно, называются органическими соединениями. Основные классы органических соединений, которые мы рассмотрим в этом разделе, включают углеводы, липиды, белки и нуклеиновые кислоты.
Каждый из этих классов соединений состоит из больших молекул, построенных из малых субъединиц. Самая маленькая из этих субъединиц называется мономером . Несколько мономеров связываются вместе с образованием полимеров . Каждый из этих полимеров характеризуется определенной структурой за счет образующихся химических связей.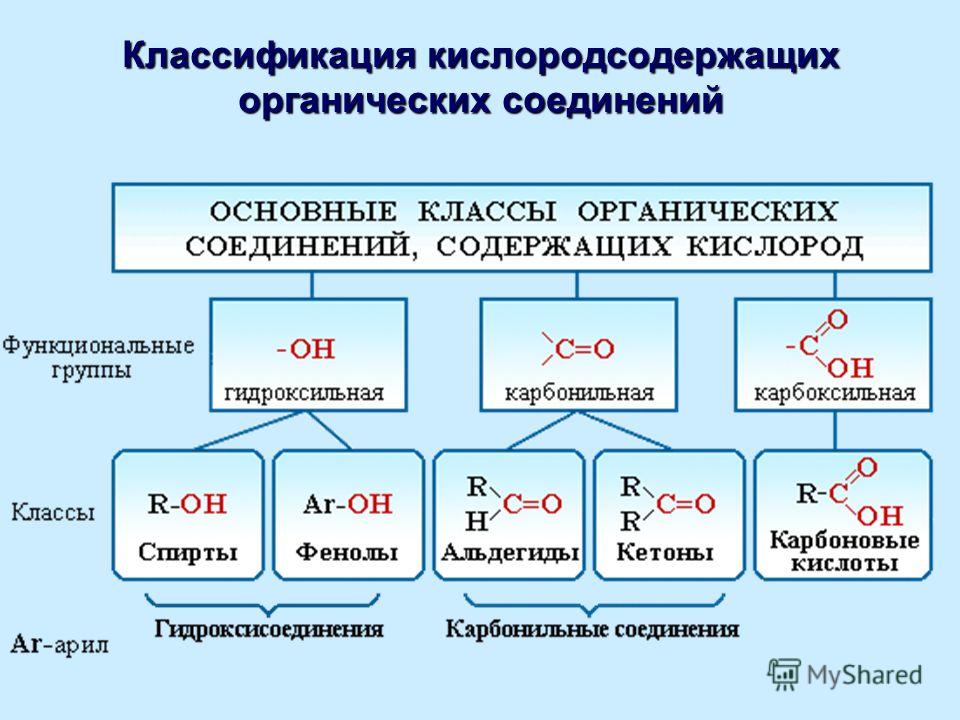 Эти структуры связаны с функцией соединения в живых организмах. Поэтому мы будем изучать каждый класс соединений под следующими заголовками:
Эти структуры связаны с функцией соединения в живых организмах. Поэтому мы будем изучать каждый класс соединений под следующими заголовками:
- Молекулярный состав : основные элементы, составляющие класс соединений.
- Структурный состав : как мономеры соединяются вместе с образованием полимеров.
- Биологическая роль : важность этих молекул для животных и растений.
- Химический тест : как определить присутствие каждого класса соединений.
Углеводы (ESG4B)
Молекулярный состав
Углеводы состоят из углерода (C), водорода (H) и кислорода (O).
Рис. 1.6: Молекула глюкозы состоит из углерода (серые сферы), водорода (белые сферы) и кислорода (красные сферы).
Конструкционный состав
Углеводы состоят из мономеров, известных как моносахаридов . Моносахарид, из которого состоит большинство углеводов, — это глюкоза. Другие моносахариды включают фруктозу, галактозу и дезоксирибозу (обсуждается позже). Эти мономеры могут быть соединены гликозидными связями . Когда два моносахарида химически связаны вместе, они образуют дисахаридов . Примером дисахарида является сахароза (столовый сахар), который состоит из глюкозы и фруктозы.Другие диссахариды включают лактозу, состоящую из глюкозы и галактозы, и мальтозу, состоящую из двух молекул глюкозы. Моносахариды и диссахариды часто называют сахарами или простыми углеводами. Несколько моносахаридов объединяются с образованием полисахаридов . Примеры полисахаридов, с которыми вы столкнетесь, включают гликоген, крахмал и целлюлозу. Полисахариды обычно называют сложными углеводами, так как они дольше расщепляются.
Другие моносахариды включают фруктозу, галактозу и дезоксирибозу (обсуждается позже). Эти мономеры могут быть соединены гликозидными связями . Когда два моносахарида химически связаны вместе, они образуют дисахаридов . Примером дисахарида является сахароза (столовый сахар), который состоит из глюкозы и фруктозы.Другие диссахариды включают лактозу, состоящую из глюкозы и галактозы, и мальтозу, состоящую из двух молекул глюкозы. Моносахариды и диссахариды часто называют сахарами или простыми углеводами. Несколько моносахаридов объединяются с образованием полисахаридов . Примеры полисахаридов, с которыми вы столкнетесь, включают гликоген, крахмал и целлюлозу. Полисахариды обычно называют сложными углеводами, так как они дольше расщепляются.
Рисунок 1.7: Примеры пищевых источников различных моносахаридов, дисахаридов и полисахаридов.
Роль у животных и растений
Основная функция углеводов — это молекулы хранения энергии и субстраты (исходный материал) для производства энергии.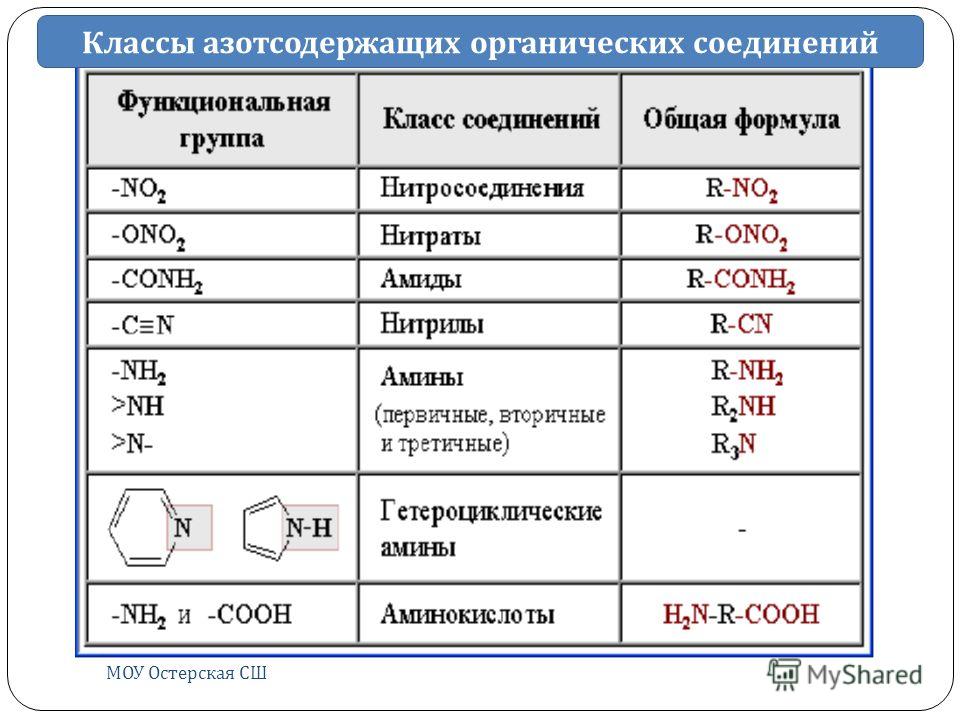 Углеводы расщепляются живыми организмами с выделением энергии. Каждый грамм углеводов обеспечивает около 17 килоджоулей (кДж) энергии. Крахмал и гликоген являются запасными полисахаридами (полимеры, состоящие из мономеров глюкозы) и, таким образом, действуют как хранилище энергии в живых организмах.Крахмал является запасным полисахаридом в растениях, а гликоген — запасным полисахаридом для животных. Целлюлоза содержится в стенках клеток растений и придает им силы. Все полисахариды состоят из мономеров глюкозы, но различие в свойствах этих веществ может быть связано с тем, как молекулы глюкозы соединяются вместе, образуя разные структуры. Ниже представлены изображения гликогена и крахмала.
Углеводы расщепляются живыми организмами с выделением энергии. Каждый грамм углеводов обеспечивает около 17 килоджоулей (кДж) энергии. Крахмал и гликоген являются запасными полисахаридами (полимеры, состоящие из мономеров глюкозы) и, таким образом, действуют как хранилище энергии в живых организмах.Крахмал является запасным полисахаридом в растениях, а гликоген — запасным полисахаридом для животных. Целлюлоза содержится в стенках клеток растений и придает им силы. Все полисахариды состоят из мономеров глюкозы, но различие в свойствах этих веществ может быть связано с тем, как молекулы глюкозы соединяются вместе, образуя разные структуры. Ниже представлены изображения гликогена и крахмала.
Рисунок 1.8: Сравнение крахмала и гликогена. Гликоген более разветвлен, чем крахмал.
Химические тесты для определения наличия крахмала
Вещества, содержащие крахмал, приобретают сине-черный цвет в присутствии раствора йода. Таким образом, наблюдаемое изменение цвета является основой химического теста на соединение.
Таким образом, наблюдаемое изменение цвета является основой химического теста на соединение.
Рис. 1.9: Гранулы пшеничного крахмала, окрашенные раствором йода и сфотографированные с помощью светового микроскопа.
В следующем исследовании мы проверим несколько различных продуктов на наличие крахмала.
Тест на наличие крахмала
(Essential research-CAPS)Цель
Для проверки наличия крахмала.
Аппарат
- кусок картофеля или хлеба
- лист салата
- чашка Петри
- Раствор йода
- капельница
- другие блюда на ваш выбор
Метод
- Поместите кусок картофеля или хлеба, лист салата и другие образцы пищи в отдельные чашки Петри.
- С помощью пипетки добавьте несколько капель раствора йода в продукт в каждой чашке Петри.
Рисунок 1.10: Схема эксперимента: испытание на присутствие крахмала с использованием раствора йода.
Наблюдения
Запишите свои наблюдения.
Картофель или хлеб становятся сине-черными в присутствии раствора йода, а лист салата — нет.
Вопросы
Можно ли этим методом определить , сколько присутствует крахмал ? Поясните свой ответ.
Да. Чем насыщеннее сине-черный цвет, тем выше содержание крахмала. Если присутствует только немного крахмала, полученный цвет будет более бледным и пурпурным, чем черный.Если крахмала нет вообще, видны только исходный цвет материала (например, зеленый лист) и желто-коричневый цвет раствора йода.
Посмотрите видео демонстрацию теста на крахмал.
Видео: 2CMK
Посмотрите видео демонстрацию теста на крахмал.
Видео: 2 см
Посмотрите видео демонстрацию теста на крахмал.
Видео: 2CMN
Химический тест для определения присутствия редуцирующих сахаров
Некоторые моносахариды, такие как глюкоза, известны как редуцирующие сахара . Они определены как сахара, которые могут легко подвергаться реакциям окисления (т. Е. Терять электрон или приобретать атом кислорода) и действовать как восстановитель . Чтобы проверить углеводы, мы обычно проверяем наличие редуцирующих сахаров с помощью теста Benedict или Fehling . Оба раствора (Бенедикта и Фелинга) содержат сульфат меди, который вступает в реакцию с редуцирующими сахарами, вызывая изменение цвета.
Они определены как сахара, которые могут легко подвергаться реакциям окисления (т. Е. Терять электрон или приобретать атом кислорода) и действовать как восстановитель . Чтобы проверить углеводы, мы обычно проверяем наличие редуцирующих сахаров с помощью теста Benedict или Fehling . Оба раствора (Бенедикта и Фелинга) содержат сульфат меди, который вступает в реакцию с редуцирующими сахарами, вызывая изменение цвета.
Посмотрите видео демонстрацию теста на глюкозу.{\ circ} \) В)
Меры предосторожности
- Соблюдайте правила техники безопасности (перечисленные в главе 1) при розжиге горелки Бунзена.
 Не зажигайте его на полке или в замкнутом пространстве. Уберите с места все блокноты, бумаги и излишки химикатов. Соберите длинные волосы, свисающие украшения и свободную одежду и никогда не оставляйте открытое пламя без присмотра, пока оно горит.
Не зажигайте его на полке или в замкнутом пространстве. Уберите с места все блокноты, бумаги и излишки химикатов. Соберите длинные волосы, свисающие украшения и свободную одежду и никогда не оставляйте открытое пламя без присмотра, пока оно горит. - При нагревании пробирок в горячей воде в мензурках убедитесь, что устья пробирок направлены в сторону от вас и других учеников.
- При работе с пробирками, особенно когда они горячие, используйте держатель для пробирок и надевайте защитные очки.
Метод
Приготовьте водяную баню, наполнив стакан водой до половины. Поместите химический стакан на штатив над пламенем Бунзена, как показано на рисунке 1.11. Это будет служить вашей водяной баней.
ПРИМЕЧАНИЕ ДЛЯ УЧИТЕЛЯ: Для этого не обязательно использовать водяную баню. Пробирки можно нагревать напрямую. Однако необходимо иметь водяную баню, если у учителя нет газа и он вынужден пользоваться плиткой.
Пока вода не достигнет желаемой температуры, выполните следующие инструкции:
- Пометьте пробирки 1–4.

- С помощью шприца или мерного цилиндра добавьте в пробирки следующее:
- пробирка 1: \ (\ text {5} \) \ (\ text {ml} \) раствора крахмала \ (\ text {1} \% \)
- пробирка 2: \ (\ text {5} \) \ (\ text {ml} \) \ (\ text {10} \% \) раствор глюкозы
- пробирка 3: \ (\ text {5} \) \ (\ text {ml} \) \ (\ text {1} \% \) раствор белка
- пробирка 4: \ (\ text {5} \) \ (\ text {ml} \) вода.
- Добавьте \ (\ text {5} \) \ (\ text {ml} \) раствор Бенедикта в каждую пробирку.{\ circ} \) В.
- Примерно через \ (\ text {5} \) минут, когда в некоторых пробирках произошло изменение цвета, погасите пламя или выньте пробирки из водяной бани.
- Поместите четыре пробирки в штатив для пробирок и сравните цвета.
Рисунок 1.11: Тест на восстановление сахара с использованием теста Бенедикта
Результаты
Создайте таблицу для записи результатов этого эксперимента. Важно наблюдать и записывать любые произошедшие изменения.
| Номер пробирки | Наблюдения в каждой пробирке |
Вопросы
- Какие изменения цвета (если они есть) вы наблюдали после нагревания образцов с раствором Бенеда?
- Три протестированных раствора являются примерами химических веществ, обнаруженных в клетках: глюкоза, крахмал, белок (белок). Какой из образцов дал положительный результат при добавлении раствора Бенедикта и нагревании пробирки?
- Какие изменения произошли в консистенции раствора Бенедикта, кроме цвета?
- Какие выводы можно сделать по результатам расследования?
- Почему в пробирку 4 попала вода?
Ответы
- Содержимое пробирки 2 становится желто-оранжевым, остальные остаются синими.
- Только глюкоза.
- Стало немного толще / коагулировалось.
- Любое другое тестируемое нами вещество, которое также становится желто-оранжевым при нагревании с раствором Бенедикта, содержит глюкозу или редуцирующий сахар.

- Это контроль, чтобы показать, что раствор Бенедикта вступает в реакцию с другим веществом в пробирке, а не с водой, в которой была растворена глюкоза.
Посмотрите видео-демонстрацию теста на восстановление сахара.
Видео: 2CMQ
Посмотрите видео-демонстрацию теста на восстановление сахара.
Видео: 2CMR
Липиды (ESG4C)
Молекулярный состав
Липиды содержат углерод (C), водород (H) и кислород (O), но содержат меньше кислорода, чем углеводы. Примеры липидов в рационе включают кулинарные масла, такие как подсолнечное и оливковое масло, сливочное масло, маргарин и сало. Многие орехи и семена также содержат большое количество липидов.
Конструкционный состав
Триглицериды — один из наиболее распространенных типов липидов.Молекулы триглицеридов состоят из глицерина и трех жирных кислот (рис. 1.12). Хвосты жирных кислот состоят из множества атомов углерода, соединенных вместе. Количество атомов углерода в цепях жирных кислот может быть разным.
Количество атомов углерода в цепях жирных кислот может быть разным.
При рисовании органических молекул легко запутаться, выписывая все буквы C и H для углерода и водорода соответственно. Ученые преодолевают это, вытягивая углеродную основу и не обращая внимания на водород. Углерод всегда будет образовывать 4 связи с другими атомами, поэтому легко вычислить, сколько должно быть атомов водорода.Углерод обозначен точкой, а связи между молекулами углерода обозначены линиями, соединяющими точки.
Рис. 1.12: Молекула триглицерида.
Роль у животных и растений
Липиды являются важным запасом энергии и содержат 37,8 килоджоулей (кДж) энергии на грамм. Липиды триглицеридов расщепляются с высвобождением глицерина и жирных кислот. Глицерин можно преобразовать в глюкозу и использовать в качестве источника энергии, однако большая часть энергии, обеспечиваемой липидами, происходит за счет разрушения цепей жирных кислот.Некоторые жирные кислоты являются незаменимыми питательными веществами, которые не могут вырабатываться организмом и должны потребляться в небольших количествах. Заменимые жирные кислоты могут вырабатываться в организме из других соединений.
Заменимые жирные кислоты могут вырабатываться в организме из других соединений.
Липиды важны для пищеварения и транспортировки основных витаминов, помогают защитить органы от шока и помогают поддерживать температуру тела. Липиды также играют важную роль в клеточных мембранах.
Вы узнаете о важной роли, которую липиды играют в клеточных мембранах, из следующей главы, посвященной основным единицам жизни .
Насыщенные и ненасыщенные жиры
Углерод может образовывать четыре связи с другими атомами. Большинство атомов углерода в цепи жирной кислоты связано с двумя соседними атомами углерода и с двумя атомами водорода. Когда каждый атом углерода в цепи жирной кислоты образует четыре одинарные связи и имеет максимальное количество атомов водорода, цепь жирной кислоты называется насыщенной , потому что она «насыщена» атомами водорода. Однако иногда два соседних атома углерода образуются из двойной связи. В этом случае каждый атом углерода, участвующий в двойной связи, присоединен только к одному водороду.Жирные кислоты, которые имеют двойные связи углерод-углерод, известны как ненасыщенные , потому что двойная связь может быть «разорвана» и может образоваться дополнительная связь с водородом. Двойные связи сильнее одинарных, и они придают цепи жирных кислот «изгиб». Эти изгибы означают, что молекулы не могут плотно упаковываться вместе, и липиды более текучие. Вот почему ненасыщенные жиры имеют тенденцию быть жидкими при комнатной температуре, а насыщенные жиры — твердыми. Жирная кислота
цепи с множеством двойных связей
называются полиненасыщенными жирными кислотами.
В этом случае каждый атом углерода, участвующий в двойной связи, присоединен только к одному водороду.Жирные кислоты, которые имеют двойные связи углерод-углерод, известны как ненасыщенные , потому что двойная связь может быть «разорвана» и может образоваться дополнительная связь с водородом. Двойные связи сильнее одинарных, и они придают цепи жирных кислот «изгиб». Эти изгибы означают, что молекулы не могут плотно упаковываться вместе, и липиды более текучие. Вот почему ненасыщенные жиры имеют тенденцию быть жидкими при комнатной температуре, а насыщенные жиры — твердыми. Жирная кислота
цепи с множеством двойных связей
называются полиненасыщенными жирными кислотами.
Рис. 1.13: Жирные кислоты могут быть насыщенными, мононенасыщенными или полиненасыщенными в зависимости от количества присутствующих двойных связей. Двойные связи приводят к «перегибам» в цепи жирных кислот.
Холестерин
Холестерин — это органическое химическое вещество, известное как стерол . От вас не требуется понимать его молекулярный состав или структурный состав. Это важный компонент клеточных мембран. Основные пищевые источники холестерина включают сыр, яйца, свинину, птицу, рыбу и креветки.Холестерин переносится через организм с помощью белков крови, известных как липопротеинов . Липопротеин — это любая комбинация липида и белка.
От вас не требуется понимать его молекулярный состав или структурный состав. Это важный компонент клеточных мембран. Основные пищевые источники холестерина включают сыр, яйца, свинину, птицу, рыбу и креветки.Холестерин переносится через организм с помощью белков крови, известных как липопротеинов . Липопротеин — это любая комбинация липида и белка.
Холестерин переносится с кровью через тело липопротеина высокой плотности , липопротеина низкой плотности и триглицеридов.
- Липопротеины низкой плотности (ЛПНП) : Липопротеины низкой плотности переносят холестерин по всему телу. В нем более высокая доля холестерина по сравнению с белком.Его часто называют «плохим» холестерином, потому что более высокий уровень ЛПНП связан с сердечными заболеваниями.
- Липопротеины высокой плотности (ЛПВП) : Липопротеины высокой плотности — самые маленькие из липопротеинов.
 Он имеет высокую долю белка по сравнению с холестерином и поэтому часто известен как «хороший» холестерин. ЛПВП переносит холестерин от клеток в печень, где он расщепляется или выводится из организма в виде отходов.
Он имеет высокую долю белка по сравнению с холестерином и поэтому часто известен как «хороший» холестерин. ЛПВП переносит холестерин от клеток в печень, где он расщепляется или выводится из организма в виде отходов.
Вы узнаете больше о том, как холестерин может закупорить артерии и привести к сердечным заболеваниям, в главе о транспортных системах у животных
Высокий уровень ЛПНП может вызвать сердечные заболевания.Холестерин накапливается в кровеносных сосудах, по которым кровь идет от сердца к тканям и органам тела, называемым артериями. Это приводит к затвердеванию и сужению этих сосудов, что препятствует транспортировке крови и потенциально может привести к сердечному приступу. Самый большой вклад в количество холестерина в крови — это тип жиров, которые вы едите. Насыщенные жиры менее полезны, чем ненасыщенные, поскольку они увеличивают количество холестерина ЛПНП в крови.
Тест на липиды
Тест на липиды основан на том факте, что липиды оставляют полупрозрачное «жирное пятно» на коричневых бумажных пакетах, в то время как нелипидные вещества этого не делают.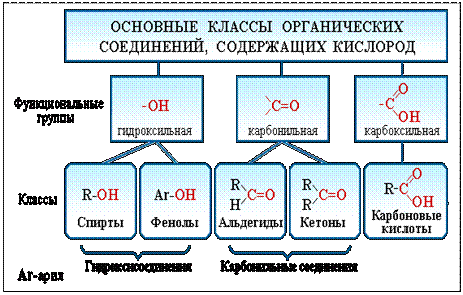
Посмотрите видео, демонстрирующее тест на липиды.
Видео: 2CMS
Translucent означает, что объект пропускает свет.
Тест на наличие липидов
(Essential research-CAPS)Цель
Для проверки на наличие липидов.
Аппарат
- кусок бумаги или бумажный пакет «рыба с жареным картофелем»
- Пищевые продукты, например, картофель фри, кусок горячего мяса и т. Д.
- 10 мл растительного масла (положительный контроль)
- 10 мл воды (отрицательный контроль)
Метод
- Положительный контроль : добавьте кулинарное масло в коричневый бумажный пакет, пока оно не впитается.Часть бумаги, впитывающая масло, должна быть полупрозрачной по сравнению с той, которая не пропускает масло.
- Отрицательный контроль : смочите бумагу водой. Бумага может стать влажной и намокшей, но она не должна стать полупрозрачной.

- Экспериментальные образцы : испачкайте коричневый бумажный пакет исследуемым продуктом и поднесите его к свету. Если он полупрозрачный, как и в положительном контроле, пищевой продукт содержит липид.
Наблюдения
Запишите свои наблюдения, отмечая все ключевые различия между контролем и экспериментальным образцом.
Бумага стала полупрозрачной, когда на нее была помещена маслянистая пища, как и полупрозрачное пятно на бумаге, содержащей растительное масло. Бумага, содержащая воду, была влажной, но легко высыхала и никогда не была полупрозрачной, поэтому мы можем сделать вывод, что еда содержала масла или липиды, а не воду.
Альтернативные методы определения липидов
Альтернативный метод проверки наличия липидов в образце — измельчение или растворение образца в этаноле. Жиры и липиды растворяются в спирте.После приготовления раствора этанола есть два способа проверить, содержит ли этот образец липиды:
- Отфильтруйте раствор этанола через фильтровальную бумагу: липидов, растворенных в этаноле, сделают фильтровальную бумагу полупрозрачной.
 Как только спирт испарится, останется полупрозрачное пятно.
Как только спирт испарится, останется полупрозрачное пятно. - Добавьте образец этанола в воду: липидов не растворяются в воде. Следовательно, если раствор этанола содержит липиды, липиды выпадут в осадок из раствора при смешивании с водой, в результате чего раствор станет молочным.
Белки (ESG4D)
Молекулярный состав
Белки содержат углерод (C), водород (H), кислород (O), азот (N) и могут содержать другие элементы, такие как железо (Fe), фосфор (P) и серу (S).
Конструкционный состав
Белки состоят из аминокислот . Существуют \ (\ text {20} \) распространенные аминокислоты, из которых состоят все белки в живых организмах. Девять из них считаются незаменимыми аминокислотами , поскольку они не могут синтезироваться в организме из других соединений и должны поступать с пищей.Аминокислоты связаны вместе пептидными связями с образованием пептидов . Длинная пептидная цепь образует белок, который складывается в очень специфическую трехмерную форму. Эта трехмерная форма полностью определяется идентичностью и порядком аминокислот в пептидной цепи. Мы часто называем четырьмя различными уровнями структуры белка (рис. 1.14):
Длинная пептидная цепь образует белок, который складывается в очень специфическую трехмерную форму. Эта трехмерная форма полностью определяется идентичностью и порядком аминокислот в пептидной цепи. Мы часто называем четырьмя различными уровнями структуры белка (рис. 1.14):
Поскольку последовательность аминокислот определяет способ сворачивания белка, если вы начнете с определенной пептидной цепи, вы всегда получите одну и ту же трехмерную структуру!
- Первичная структура : Это относится к последовательности аминокислот, соединенных пептидными связями с образованием полипептидной цепи.Некоторые белки содержат менее сотни аминокислот, а другие — несколько тысяч.
- Вторичная структура : Это первый уровень трехмерного складывания. Он полностью управляется водородными связями . Водородная связь обычно приводит к тому, что области намотки цепи и другие области образуют листы.
- Третичная структура : Это второй уровень трехмерного фолдинга и общая окончательная форма белковой молекулы.
 Вторичные структуры и неструктурированные области цепи дополнительно складываются в глобулярную форму за счет гидрофобных взаимодействий (неполярные области, пытающиеся покинуть воду в клеточной среде) и электростатических взаимодействий (полярные и заряженные области, желающие взаимодействовать с водной средой). и друг друга).
Вторичные структуры и неструктурированные области цепи дополнительно складываются в глобулярную форму за счет гидрофобных взаимодействий (неполярные области, пытающиеся покинуть воду в клеточной среде) и электростатических взаимодействий (полярные и заряженные области, желающие взаимодействовать с водной средой). и друг друга). - Четвертичная структура : Некоторые белки являются сложными: две или более пептидных цепей складываются в свои третичные структуры, затем эти полные структуры связываются вместе посредством гидрофобных и электростатических взаимодействий с образованием конечного белка.
Рисунок 1.14: Первичный, вторичный, третичный и четвертичный уровни структуры белка
Роль у животных и растений
Белки играют важную роль в нескольких важнейших биологических функциях. Белки содержатся в волосах, коже, костях, мышцах, сухожилиях, связках и других структурах и выполняют ключевые структурные и механические функции. Белки также важны для клеточной коммуникации и иммунной системы. Белки также могут выступать в качестве запаса энергии при расщеплении в процессе пищеварения.Каждый грамм белка может быть расщеплен, чтобы высвободить 17 кДж энергии. Определенные белки, называемые ферментами , важны для катализации клеточных реакций, которые являются частью метаболизма.
Белки также важны для клеточной коммуникации и иммунной системы. Белки также могут выступать в качестве запаса энергии при расщеплении в процессе пищеварения.Каждый грамм белка может быть расщеплен, чтобы высвободить 17 кДж энергии. Определенные белки, называемые ферментами , важны для катализации клеточных реакций, которые являются частью метаболизма.
Белки необходимы для любой диеты. Недостаток белка приводит к болезни, называемой квашиоркор (рис. 1.15) или маразм (рис. 1.16). Маразм вызывается общим дефицитом питания (голоданием), а квашиоркор — именно недостатком белка.
Рисунок 1.15: Ребенок, страдающий от квашиоркора | Рисунок 1.16: Ребенок, страдающий маразмом |
Мясо или овощи: какой источник белка лучше?
И животный белок, и белок овощей полезны для здоровья. Но каждый тип содержит другие питательные вещества. Итак, какой «пакет» питательных веществ — мясо или овощи — лучше для здоровья?
Итак, какой «пакет» питательных веществ — мясо или овощи — лучше для здоровья?
- 180-граммовый стейк содержит 40 г белка, НО также содержит 38 г жира, что больше, чем рекомендуемая диета
- Из такого же количества лосося получается 34 г белка и 18 г жира.
- В стакане вареной чечевицы содержится 18 г белка и 1 г жира.
Тест на белки
Тест Biuret Test для использования белков включает тестирование на наличие пептидной связи. Реагент биурета — это реагент на основе меди, который становится пурпурным при связывании с белком в щелочном растворе (рис. 1.17). Чем больше присутствует пептидных связей, тем больше интенсивность пурпурного цвета, что указывает на более высокую концентрацию белка.
Наличие белка также можно определить с помощью реагента Миллона .Реагент Миллона реагирует с аминокислотами тирозина, общими для большинства белков, и приводит к образованию красновато-коричневого осадка при нагревании.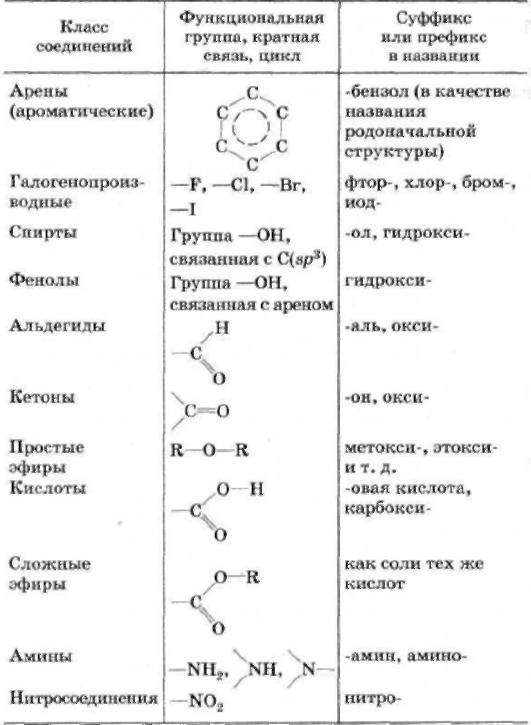
В таблице 1.5 ниже приведены основные тесты и их ожидаемые результаты в присутствии и в отсутствие белка.
Посмотрите видеодемонстрацию теста Биурета на белок.
Видео: 2CMT
| Тестовый реагент | Положительный результат | Отрицательный результат | |||||
| Биуретовый реагент | Фиолетовый / пурпурный цвет | Красный | Фиолетовый цвет коричневый цвет | белый цвет |
Таблица 1.5: Наблюдаемые изменения цвета при тестировании на присутствие белка.
Тест на наличие белков
(Essential research-CAPS)ВНИМАНИЕ: реагент Миллона
Реагент Миллона очень ядовит. Его использование в классе не рекомендуется, если нет альтернативы или если учитель не уверен в его использовании. {\ circ} \) C)
{\ circ} \) C)
- два с раствором альбумина (положительный контроль)
- два с сахарной водой (отрицательный контроль)
- пробирок с образцами для исследования на наличие белка
- пробирка с реактивом Миллона
- пробирка с раствором для биуретовой пробы
( ПРИМЕЧАНИЕ: Реагент Миллона и раствор Биурета в этом эксперименте должны быть приготовлены для вас вашим учителем).
Метод
Тест на белок с реактивом Миллона
ВНИМАНИЕ! Реагент Миллона очень токсичен! Избегайте вдыхания его паров.
- С помощью пипетки или пипетки добавьте несколько капель реагента Миллона в пробирку, содержащую альбумин.
- С помощью пипетки или пипетки добавьте несколько капель реагента Миллона в пробирку, содержащую сахарную воду.
- Используя пипетку или пипетку, добавьте несколько капель реагента Миллона в пробирку, содержащую образцы вашей пищи, которую нужно проверить.

- Нагрейте смеси в кипящей воде в течение 5 минут.
- Обратите внимание на любые изменения цвета.
Тест на белок с помощью теста Biuret
- С помощью капельницы или пипетки добавьте несколько капель раствора биурета в пробирку, содержащую альбумин.
- С помощью пипетки или пипетки добавьте несколько капель раствора Биурета в пробирку, содержащую сахарную воду.
- Используя пипетку или пипетку, добавьте несколько капель раствора Биурета в пробирку, содержащую образцы ваших продуктов, которые нужно протестировать.
- Обратите внимание на любые изменения цвета.
Рисунок 1.17: Биуретовый тест: это ожидаемое изменение цвета, если присутствует белок
Наблюдения
Запишите свои наблюдения, отмечая все ключевые различия между положительным контролем, отрицательным контролем и экспериментальными образцами
Наблюдения: Реагент Миллона
Белок приобретает кирпично-красный цвет и становится твердым. Красноватый цвет указывает на положительный результат теста на белок. Вода с сахаром не становится красной — она остается прозрачной, что свидетельствует об отсутствии белков.Любые образцы пищевых продуктов, которые становятся красновато-коричневыми при нагревании с реактивом Миллонса, также содержат белки.
Красноватый цвет указывает на положительный результат теста на белок. Вода с сахаром не становится красной — она остается прозрачной, что свидетельствует об отсутствии белков.Любые образцы пищевых продуктов, которые становятся красновато-коричневыми при нагревании с реактивом Миллонса, также содержат белки.
Наблюдения: биуретовый тест
Белок становится фиолетовым, что указывает на присутствие белков. Вода с сахаром остается синего цвета добавленного сульфата меди — она не становится фиолетовой, что указывает на отсутствие белков. Любые образцы пищевых продуктов, которые становятся фиолетовыми при добавлении химикатов Biuret, содержат белок.
Посмотреть видео-демонстрацию эксперимента по тестированию белков:
Видео: 2CMV
Ферменты (ESG4F)
Ферменты — это белковые молекулы, которые помогают протекать химическим реакциям в живых организмах.Термин фермент имеет особое значение: фермент — это биологический катализатор, который ускоряет скорость химической реакции, но не используется в самой химической реакции. Разберем это определение подробнее.
Разберем это определение подробнее.
Узнайте, что такое ферменты и как они работают.
Видео: 2CMW
Биологические : Ферменты — это белковые молекулы, состоящие из длинных цепочек аминокислот. Они складываются в уникальные трехмерные структуры с областью, известной как активный центр , где происходят реакции.
Катализатор : Ферменты ускоряют химические реакции, но сами по себе не используются. Все химические реакции требуют определенного минимального количества энергии. Эта энергия известна как свободная энергия активации . Ферменты снижают энергию активации, тем самым ускоряя химические реакции (рис. 1.18).
Рис. 1.18: Ферменты снижают энергию активации, тем самым ускоряя протекание реакций.
Ферменты не расходуются в реакциях, которые они катализируют : они не изменяют равновесия реакций, поэтому они катализируют как прямые, так и обратные реакции.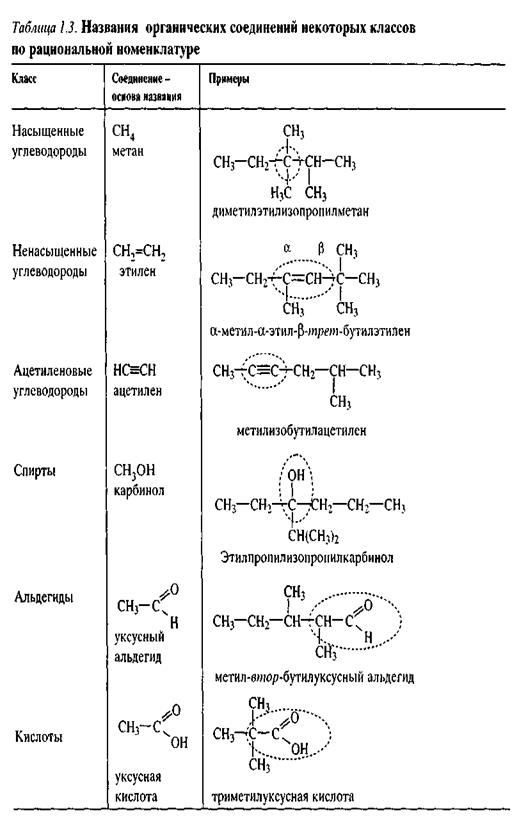 Направление, в котором протекает реакция, определяется концентрацией субстратов и продуктов реакции.
Направление, в котором протекает реакция, определяется концентрацией субстратов и продуктов реакции.
Ферменты могут участвовать в реакциях разрушения или наращивания молекул. Реакции разложения известны как катаболических реакций. Нарастающие реакции известны как анаболических реакций.
Модель действия фермента «замок и ключ»
Ферменты очень специфичны в отношении реакций, которые они катализируют.Специфичность зависит от связей, образованных между активным центром фермента и его субстратом. Активные сайты имеют определенную форму, которая позволяет связывать очень специфический субстрат. Высокоспецифичный характер связывания фермента с субстратом сравнивают с «замком и ключом», где фермент выступает в качестве «замка», а субстрат — в качестве «ключа» (рис. 1.19). Субстрат связывает активный центр с образованием комплекса фермент-субстрат. Происходит реакция, затем продукт покидает активный центр, поскольку он больше не соответствует «замку» так же, как субстрат. Фермент остается неизменным.
Фермент остается неизменным.
Рис. 1.19: Эта диаграмма иллюстрирует «ключ-замок» модель действия фермента.
Исследование того, как действуют биологические стиральные порошки
(Essential research-CAPS)Цель
Для проверки работы ферментов в биологических стиральных порошках.
Аппарат
- два яйца всмятку (яйца вкрутую содержат денатурированные белки, не оставляющие пятен)
- две мензурки
- биологический стиральный порошок (с ферментами)
- Небиологический стиральный порошок (старый тип стирального порошка)
- вода
- две мерные ложки
Метод
- Пометьте 3 стакана «Био», «Небио» и «Контроль», которые будут содержать биологический стиральный порошок, небиологический стиральный порошок и воду (отрицательный контроль) соответственно.
- В стакане с надписью «Био» растворите \ (\ text {5} \) \ (\ text {g} \) биологический стиральный порошок в \ (\ text {30} \) \ (\ text {ml} \) вода.

- В стакане с надписью «Non-Bio» растворите \ (\ text {5} \) \ (\ text {g} \) небиологический стиральный порошок в \ (\ text {30} \) \ (\ text { мл} \) воды.
- Налейте \ (\ text {30} \) \ (\ text {ml} \) водопроводной воды в контрольный стакан.
- Выньте небольшое количество яичного желтка.
- Поместите по чайной ложке с яичным желтком в каждый стакан.
- Оставьте ложки в мензурках на 1-2 часа.
- Наблюдайте за своими результатами.
Результаты
- Запишите свои наблюдения.
- Укажите причину ваших наблюдений.
- Напишите заключение на расследование.
Результаты
Яичный желток в биологическом стиральном порошке медленно растворяется с ложки. Яичный желток в небиологическом стиральном порошке частично поднимается с ложки, но не распадается и не растворяется в воде.В контрольном стакане изменений нет — желток остается на ложке.
Причины наблюдений
Ферменты биологического стирального порошка разбивают яичный желток на более мелкие молекулы, которые отрываются от ложки и растворяются в воде. Этого не произошло ни с небиологическим порошком, ни с контролем.
Этого не произошло ни с небиологическим порошком, ни с контролем.
Заключение
Биологические стиральные порошки лучше, чем небиологические стиральные порошки, удаляют органические пятна с одежды.
Ферменты в повседневной жизни
Свойства ферментов контролировать реакции широко используются в коммерческих целях. Примеры некоторых из этих применений перечислены ниже:
- Биологические стиральные порошки содержат ферменты, такие как липазы (расщепляет липиды) и протеазы (расщепляет белок), которые помогают разлагать пятна, вызванные продуктами питания, кровью, жиром или жиром. Эти биологические стиральные порошки экономят энергию, поскольку эффективны при низких температурах. №
- Размягчители для мяса содержат ферменты, полученные из таких фруктов, как папайя или ананас. Когда эти ферменты используются в мясных смягчителях, они смягчают мясо.
- Молоко без лактозы производится в первую очередь для людей с непереносимостью лактозы.
 У людей с непереносимостью лактозы отсутствует фермент лактаза, который переваривает лактозу (молочный сахар). Лактоза предварительно переваривается путем добавления в молоко лактазы.
У людей с непереносимостью лактозы отсутствует фермент лактаза, который переваривает лактозу (молочный сахар). Лактоза предварительно переваривается путем добавления в молоко лактазы.
Факторы, влияющие на действие фермента
1.Температура
У человека ферменты лучше всего работают в \ (\ text {37} \) \ (\ text {° C} \) (рис. 1.20). Это оптимальная температура. При очень высоких температурах белки денатурируют ; это означает, что водородное, гидрофобное и электростатическое взаимодействия, которые приводят к трехмерной форме белка, разрушаются, превращая белок в его первичную структуру, длинную цепочку аминокислот. Когда белок денатурируется, изменяется форма его активного центра, а также остальная часть формы белка.Субстрат больше не может соответствовать активному центру фермента, и химические реакции не могут происходить. Низкие температуры могут замедлить или даже деактивировать ферменты, поскольку низкая температура означает меньшую доступную кинетическую энергию, так что даже более низкая энергия активации, которую допускает фермент, недоступна. Первый график показывает влияние температуры на активность фермента.
Первый график показывает влияние температуры на активность фермента.
2. pH
Активность фермента чувствительна к pH. Ферменты имеют оптимальный pH, как показано на графике, но они могут эффективно функционировать в пределах диапазона pH.Эффективность фермента резко падает, когда pH выходит за пределы оптимального диапазона. Фермент может денатурироваться при воздействии pH, выходящего за пределы его диапазона pH, поскольку pH влияет на заряд некоторых аминокислот и, следовательно, влияет на электростатические взаимодействия, удерживающие вместе третичную структуру. Второй график показывает влияние pH на активность фермента.
Оптимальный pH и температура для фермента будут определяться видом живого существа, в котором он находится. Оптимальная температура ферментов в организме человека составляет 37 ° C.Бактерии, которые живут в компостных кучах, имеют ферменты с оптимальным диапазоном значений в 40, а бактерии, называемые гипертермофилами (любители очень высоких температур), которые живут в горячих источниках, имеют ферменты с оптимальными температурами выше 80 ° C.
Рис. 1.20: Графики, показывающие влияние температуры и pH на активность фермента соответственно.
В следующем исследовании будет изучено влияние температуры на активность фермента каталазы. Перекись водорода потенциально токсична, поэтому живые ткани содержат фермент каталаза, который расщепляет его на нетоксичные соединения, а именно воду и кислород.Вы изучите влияние фермента каталазы на расщепление перекиси водорода. Далее вы изучите влияние pH и температуры на активность ферментов.
Изучение влияния каталазы из куриной печени на перекись водорода
(Essential research-CAPS)Цель
Для демонстрации действия каталазы на перекись водорода.
Аппарат
- Мерные цилиндры 10 мл
- пипетка
- \ (\ text {3} \% \) Раствор перекиси водорода
- скальпель
- щипцы
- баланс
- Куриная печень комнатной температуры
- Печень куриная отварная
- Замороженная куриная печень
- стержень для перемешивания
Метод
Следуйте инструкциям ниже:
- Отрежьте два квадратных куска весом 0.
 1 г из свежей пробы печени и поместите каждый в отдельный мерный цилиндр на 10 мл.
1 г из свежей пробы печени и поместите каждый в отдельный мерный цилиндр на 10 мл. - Используйте чистый мерный цилиндр для измерения 3 мл воды. Перелейте в один из цилиндров, содержащих свежую печень. Это ваш негативный контроль.
- Используйте чистый мерный цилиндр для измерения 3 мл перекиси водорода. Перелейте в оставшийся цилиндр, содержащий свежую печень. Это ваш положительный контроль.
- Подождите четыре минуты, а затем измерьте и запишите высоту образовавшихся пузырьков кислорода в каждом баллоне.
Вопросы
- Назовите три переменных, которые должны оставаться стабильными на протяжении этих экспериментов, и объясните, почему они должны оставаться стабильными.
- Какая реакция происходит?
- Как бы вы могли сделать этот эксперимент более точным?
- Какие еще факторы влияют на скорость реакции, кроме температуры?
Ответы
- Факторы остались прежними: [любые три из следующих]
- Используйте одинаковое количество куриной печени в каждом мерном цилиндре, чтобы контролировать количество присутствующего фермента.

- Используйте 3 мл воды и 3 мл перекиси водорода в двух разных цилиндрах, чтобы количество жидкости оставалось постоянным.
- Дайте двум цилиндрам одинаковое время для прохождения реакции, чтобы можно было надежно сравнить барботажные колонны.
- Содержимое обоих мерных цилиндров должно иметь одинаковую температуру, чтобы температура не мешала исследуемой реакции.
- Используйте одинаковое количество куриной печени в каждом мерном цилиндре, чтобы контролировать количество присутствующего фермента.
- Это катаболическая реакция / реакция разложения, поскольку перекись водорода распадается на кислород (пузырьки) и воду (оставшаяся жидкость).Реакция также является экзотермической, поскольку мерный цилиндр нагрелся — во время реакции выделялось тепло.
- Повышение точности:
- Залейте жидкость в оба цилиндра одновременно.
- Точнее отмерьте количество куриной печени.
- Должна быть возможность рассчитать объем кислорода, выделяемого при пропускании его через воду, и более точно рассчитать объем кислорода, используя принцип вытеснения. В существующем методе часть кислорода улетучивалась в воздух, когда пузырьки лопались, поэтому измерение высоты является приблизительным значением объема выделившегося кислорода.

- Другие факторы, влияющие на скорость реакции:
- Количество фермента в печени.
- Количество доступного субстрата.
- pH среды.
- Состояние куриной печени — если она не свежая, некоторые ферменты могут быть неактивными.
- Температура печени и жидкости.
Каковы лучшие условия для фермента каталазы? Что происходит, когда фермент или живая ткань помещается в перекись водорода? Узнайте в этом видео.
Видео: 2CMX
Исследование влияния каталазы из куриной печени на перекись водорода — ЧАСТЬ B
Цель
Для демонстрации влияния температуры на активность каталазы.
Метод
- Добавьте 3 мл перекиси водорода в три отдельных градуированных мерных цилиндра на 10 мл. Пометьте один цилиндр «печень куриная замороженная»; второй — «вареная куриная печень» и третий — «куриная печень комнатной температуры».
- Вырежьте по 0,1 г квадрата из замороженной и вареной куриной печени комнатной температуры.
 Положите кусочки печени в мерный цилиндр с соответствующей маркировкой с перекисью водорода.
Положите кусочки печени в мерный цилиндр с соответствующей маркировкой с перекисью водорода. - Оставьте кусочки печени на четыре минуты и измерьте высоту образовавшихся пузырьков.
Вопросы
- Объясните причины различий, наблюдаемых для трех измерительных цилиндров.
- Назовите зависимые и независимые переменные в этом эксперименте.
- Как бы вы могли сделать этот эксперимент более точным?
- Что бы вы сделали на основании своих наблюдений?
Ответы
- Печень при комнатной температуре реагирует очень быстро и производит большое количество больших пенистых белых пузырьков, потому что ферменты очень активны — они близки к своей оптимальной температуре и легко расщепляют перекись водорода на воду и кислород.Замороженная печень сначала реагирует очень медленно и образует очень мало пузырьков, поскольку ферменты неактивны при таких низких температурах — им не хватает энергии активации.
 По мере того, как реакция выделяет тепло, фермент немного позже ускоряется и образует более крупные пузырьки с большей скоростью, но никогда не так быстро, как при комнатной температуре. Вареная печень не проявляет никакой реакции — пузырьки не образуются, так как ферменты денатурировались при кипячении. Их форма изменилась, и они вообще не могут катализировать реакцию.
По мере того, как реакция выделяет тепло, фермент немного позже ускоряется и образует более крупные пузырьки с большей скоростью, но никогда не так быстро, как при комнатной температуре. Вареная печень не проявляет никакой реакции — пузырьки не образуются, так как ферменты денатурировались при кипячении. Их форма изменилась, и они вообще не могут катализировать реакцию. - Зависимой переменной является скорость реакции, то есть количество образовавшегося кислорода, которое было измерено как высота барботажной колонны.
- Независимая переменная — температура — печень была комнатной температуры или была замороженной или вареной.
- Более точно измерьте количество печени и объем перекиси водорода и держите их одинаковыми.
- Убедитесь, что все 3 мерных цилиндра идентичны — одинаковой ширины.
- Залейте перекись водорода в цилиндры одновременно.
- Улавливайте количество выделившегося кислорода и используйте принцип вытеснения для более точного расчета объема газа.

- Температура влияет на активность ферментов. Ферменты наиболее активны при температуре, близкой к их оптимальным температурам, но они денатурируют и не могут функционировать, если температура слишком высока. При очень низких температурах ферменты не могут эффективно функционировать из-за недостатка энергии активации — они работают очень медленно.
Нуклеиновые кислоты (ESG4G)
Нуклеиновые кислоты, такие как ДНК и РНК, представляют собой большие органические молекулы, которые являются ключевыми для всех живых организмов. Строительные блоки нуклеиновых кислот называются нуклеотидами . Каждый нуклеотид состоит из сахара, фосфата и азотистого основания. Нуклеотиды соединены фосфодиэфирными связями , которые соединяют фосфат одного нуклеотида с сахаром другого. Нити фосфат-сахар-фосфат-сахар образуют «основу», на которой выставлены азотсодержащие основания.Следовательно, нуклеиновые кислоты представляют собой полимера, состоящего из множества нуклеотидов. ДНК представляет собой двухцепочечный полимер из-за образования водородных связей между азотистыми основаниями двух комплементарных цепей. РНК — одноцепочечный полимер. Нуклеиновые кислоты не нужно получать с пищей, потому что они синтезируются с использованием промежуточных продуктов углеводного и аминокислотного обмена.
ДНК представляет собой двухцепочечный полимер из-за образования водородных связей между азотистыми основаниями двух комплементарных цепей. РНК — одноцепочечный полимер. Нуклеиновые кислоты не нужно получать с пищей, потому что они синтезируются с использованием промежуточных продуктов углеводного и аминокислотного обмена.
Нуклеиновые кислоты включают:
- Дезоксирибонуклеиновая кислота ( ДНК ): содержит «инструкции» по синтезу белков в форме генов.ДНК находится в ядре каждой клетки, а также в меньших количествах присутствует в митохондриях и хлоропластах.
- Рибонуклеиновая кислота ( РНК ): важна для передачи генетической информации от ДНК для образования белков. Он находится на рибосомах, в цитоплазме и ядре.
также можно найти внутри хлоропластов и митохондрий.
Рисунок 1.21: Схематическая диаграмма ДНК и РНК: ДНК двухцепочечная, а РНК одноцепочечная.
Структура и функция ядра будут подробно объяснены в следующей главе: Основные единицы жизни .
Классификация органических соединений — Видео и стенограмма урока
Органические молекулы: классификация
Органические молекулы можно классифицировать несколькими способами. Их можно разделить на категории в зависимости от того, как они связаны, или других присутствующих атомов, таких как кислород, азот, сера или галогены. В органической молекуле, ответственной за запах скунса, есть атом серы, а в этаноле в вашем вине есть атом кислорода.Давайте исследуем некоторые другие категории органических молекул.
Молекулы могут быть как с открытой, так и с закрытой цепью. Открытая цепь — это молекула, которая не образует кольцо и может быть либо молекулой с прямой, либо разветвленной цепью, что означает, что она идет в разных направлениях. Замкнутая цепь — это молекула, которая действительно образует кольцо. Это также известно как циклическое соединение. Газ в вашем автомобиле имеет молекулы как с разомкнутой, так и с замкнутой цепью.
Гомоциклический vs.
 Гетероциклические соединения
Гетероциклические соединенияЦиклические соединения очень важны, потому что они обладают некоторыми действительно уникальными свойствами. Краска вашей пурпурной рубашки — это циклическая молекула! Циклические соединения можно разделить на две категории:
- Гомоциклические , которые состоят только из атомов углерода и водорода
- Гетероциклический , содержащий атом или атомы, отличные от углерода и водорода
Ароматические и алициклические соединения
Гомоциклические и гетероциклические соединения также можно разделить на две другие категории: ароматические и алициклические.
Мовин, пурпурный краситель, представляет собой ароматическое соединение. Чаще всего ароматическая молекула представляет собой циклическое органическое соединение с нечетным числом двойных связей. Иногда это изображают в виде круга внутри молекулы. Бензол — наиболее распространенный пример ароматической молекулы. Бензол содержится в вашем бензине, а также в кевларе бронежилетов. Все другие неароматические циклические соединения называются алициклическими .
Все другие неароматические циклические соединения называются алициклическими .
Гомологическая серия
Органические соединения также могут быть частью гомологической серии.Гомологическая серия представляет собой семейство органических соединений, которые имеют одинаковые функциональные группы, но разное количество углеродных групп. Думайте об этих молекулах как о братьях и сестрах одной семьи. Каждый из них немного отличается, но вы все равно можете сказать, что они связаны.
Краткое содержание урока
Органические соединения — это молекулы, состоящие в основном из атомов углерода и водорода. Молекула, содержащая только атомы углерода и водорода, называется углеводородом .Органические соединения классифицируются в зависимости от того, являются ли они циклическими или с прямой цепью. Они известны как с замкнутой цепью , циклической органической молекулой и с открытой цепью , которая представляет собой органическую молекулу с прямой или разветвленной цепью («разветвленная» означает движение в более чем одном направлении).
Циклические молекулы могут быть дополнительно классифицированы как гомоциклические , циклические молекулы, содержащие только атомы углерода и водород, и гетероциклические , циклические молекулы, которые содержат атом или атомы, отличные от углерода и водорода.Циклические молекулы можно разделить на две категории:
- Ароматические — нечетное число чередующихся двойных связей, иногда обозначаемое кружком
- Алициклические — все циклические органические соединения, не являющиеся ароматическими
Наконец, органические соединения могут быть организованы в гомологическую серию , которая представляет собой соединения с одной и той же функциональной группой и различным числом атомов углерода.
Глава 9 — Органические соединения кислорода — Химия
Глава 9 — Органические соединения кислорода Вступительное эссе 9.1 Введение в соединения, содержащие кислород 9.2 Спирты и фенолыКлассификация спиртов Свойства спиртов Гликоли Фенолы 9,3 эфира Свойства эфиров 9,4 Альдегиды и кетоны Свойства альдегидов и кетонов Альдегиды Кетоны Точки кипения и растворимость Альдегиды и кетоны в природе 9.5 карбоновых кислот и сложных эфиров Свойства карбоновых кислот и сложных эфиров Карбоновые кислоты Сложные эфиры Точки кипения, точки плавления и растворимость Обычно используемые карбоновые кислоты и сложные эфиры 9.6 Реакции кислородсодержащих соединений Спирты Реакции обезвоживания (устранения) Реакции окисления Альдегиды и кетоны Реакции окисления Реакции восстановления Реакции присоединения со спиртами (полуацетали и гемикетали)
Реакции с образованием ацеталей или кетов Карбоновые кислоты 9.8 источников
Вступительное эссе
Фото: А. Савин
Вернуться к началу
9.1 Введение в соединения, содержащие кислород
В этой главе вы познакомитесь с основными органическими функциональными группами, содержащими кислород. Сюда входят спирты, фенолы, простые эфиры, альдегиды, кетоны, карбоновые кислоты и сложные эфиры. На рисунке 9.1 представлены основные органические функциональные группы для этих соединений и суффикс ИЮПАК, который используется для обозначения этих соединений.Хотя вам не нужно официально называть полные структуры, вы должны иметь возможность идентифицировать функциональные группы, содержащиеся в соединениях, на основе их названий IUPAC. Например, спирт представляет собой органическое соединение с гидроксильной (-ОН) функциональной группой на алифатическом атоме углерода. Поскольку -ОН является функциональной группой всех спиртов, мы часто представляем спирты общей формулой ROH, где R представляет собой алкильную группу. В рекомендациях по номенклатуре ИЮПАК суффикс «-ол» используется для обозначения простых соединений, содержащих спирты.Примером является этанол (CH 3 CH 2 OH).
Рисунок 9.1 Общие органические функциональные группы, содержащие кислород. Суффиксы ИЮПАК, используемые для наименования простых органических молекул, отмечены в таблице
.Вернуться к началу
9.2 Спирты и фенолы
Классификация спиртов
Некоторые свойства и реакционная способность спиртов зависят от числа атомов углерода, присоединенных к конкретному атому углерода, который присоединен к группе -ОН.На этом основании спирты можно разделить на три класса.
- Первичный (1 °) спирт — это спирт, в котором атом углерода (красный) с группой ОН присоединен к одному другому атому углерода (синему). Его общая формула — RCH 2 OH.
- Вторичный (2 °) спирт — это спирт, в котором атом углерода (красный) с группой ОН присоединен к двум другим атомам углерода (синим цветом). Его общая формула: R 2 CHOH.
- Третичный (3 °) спирт — это спирт, в котором атом углерода (красный) с группой ОН присоединен к трем другим атомам углерода (синим цветом).Его общая формула — R 3 COH.
Спирты можно рассматривать как производные воды (H 2 O; также обозначается как HOH).
Как и связь H – O – H в воде, связь R – O – H изогнута, а часть -OH в молекулах спирта полярна. Эта взаимосвязь особенно очевидна для небольших молекул и отражается в физических и химических свойствах спиртов с низкой молярной массой. Замена атома водорода алкана на группу ОН позволяет молекулам связываться посредством водородных связей (Рисунок 9.2).
Рисунок 9.2 Межмолекулярная водородная связь в метаноле. Группы ОН в молекулах спирта делают возможным образование водородных связей.
Напомним, что физические свойства в значительной степени определяются типом межмолекулярных сил. В таблице 9.1 перечислены молярные массы и точки кипения некоторых распространенных соединений. Из таблицы видно, что вещества с одинаковой молярной массой могут иметь совершенно разные точки кипения.
Таблица 9.1 Сравнение молярной массы и температуры кипенияАлканы неполярны и поэтому связаны только через относительно слабые лондонские дисперсионные силы (LDF). Температуры кипения алканов с одним-четырьмя атомами углерода настолько низки, что все эти молекулы являются газами при комнатной температуре. Напротив, если мы проанализируем соединения, содержащие функциональную группу спирта, даже метанол (только с одним атомом углерода) будет жидкостью при комнатной температуре. Поскольку спирты обладают способностью образовывать водородные связи, их точки кипения значительно выше по сравнению с углеводородами сопоставимой молярной массы.Температура кипения — это грубая мера количества энергии, необходимой для отделения молекулы жидкости от ближайших соседей. Если молекулы взаимодействуют посредством водородных связей, для разрушения этого межмолекулярного притяжения необходимо подавать относительно большое количество энергии. Только тогда молекула может перейти из жидкости в газообразное состояние.
Другая интересная тенденция очевидна в таблице 9.1: поскольку молекулы спирта содержат больше атомов углерода, они также имеют более высокие температуры кипения.Это связано с тем, что молекулы могут иметь более одного типа межмолекулярных взаимодействий. Помимо водородных связей, молекулы спирта также имеют LDF, которые возникают между неполярными частями молекул. Как мы видели с алканами, чем больше углеродная цепь, тем больше LDF присутствует в молекуле. Как и в случае с алканами, повышенное количество ЛДФ в спиртосодержащих молекулах также вызывает повышение температуры кипения.
Помимо образования водородных связей между собой, спирты также могут вступать в водородные связи с молекулами воды (Рисунок 9.3). Таким образом, в то время как углеводороды нерастворимы в воде, небольшие спирты с одним-тремя атомами углерода полностью растворимы. Однако с увеличением длины цепи растворимость спиртов в воде снижается; молекулы становятся больше похожими на углеводороды и менее на воду. Спирт 1-деканол (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH), содержащий 10 атомов углерода практически не растворяется в воде.Мы часто обнаруживаем, что граница растворимости в семействе органических соединений находится на четырех или пяти атомах углерода.
Рисунок 9.3 Водородная связь между молекулами метанола и молекулами воды. Водородная связь между ОН метанола и молекулами воды определяет растворимость метанола в воде.
Вернуться к началу
Гликоли
Молекулы, содержащие две функциональные группы спирта, часто называют гликолями .Этиленгликоль, один из простейших гликолей, имеет два основных коммерческих применения. Он используется в качестве сырья при производстве полиэфирных волокон и составов антифризов. Добавление двух или более групп -ОН к углеводороду существенно увеличивает температуру кипения и растворимость спирта. Например, для этиленгликоля точка кипения составляет 197,3 o ° C, по сравнению с этанолом, который имеет точку кипения 78 o ° C. Таким образом, этиленгликоль является полезным охлаждающим веществом для автомобильных двигателей.
Рисунок 9.4 Свойства этиленгликоля. Этиленгликоль часто используется в качестве охлаждающего агента в смесях антифризов из-за его низкой температуры замерзания и высокой температуры кипения.
Этиленгликоль ядовит для людей и других животных, с ним следует обращаться осторожно и утилизировать надлежащим образом. Как прозрачная жидкость со сладким вкусом, она может привести к случайному проглатыванию, особенно домашними животными, или может быть преднамеренно использована в качестве орудия убийства. Этиленгликоль трудно обнаружить в организме, и он вызывает симптомы, в том числе интоксикацию, тяжелую диарею и рвоту, которые можно спутать с другими болезнями или заболеваниями.Его метаболизм производит оксалат кальция, который кристаллизуется в головном мозге, сердце, легких и почках, повреждая их; в зависимости от уровня воздействия, накопление яда в организме может длиться недели или месяцы, прежде чем вызвать смерть, но смерть от острой почечной недостаточности может наступить в течение 72 часов, если человек не получит надлежащего лечения от отравления. Некоторые смеси антифризов на основе этиленгликоля содержат горький агент, такой как денатоний, для предотвращения случайного или преднамеренного употребления.Типичные смеси антифризов также содержат флуоресцентный зеленый краситель, который упрощает обнаружение и удаление пролитого антифриза.
Фенолы
Соединения, в которых группа -ОН присоединена непосредственно к ароматическому кольцу, называются фенолами и в химических уравнениях могут обозначаться как АРОН. Фенолы отличаются от спиртов тем, что в воде они обладают слабой кислотностью. Подобно реакциям кислотно-щелочной нейтрализации двойного вытеснения, они реагируют с водным гидроксидом натрия (NaOH) с образованием соли и воды.
ArOH (водн.) + NaOH (водн.) → ArONa (водн.) + H 2 O
Простейшее фенолсодержащее соединение, C 6 H 5 OH, само называется фенолом. (Более старое название, подчеркивающее его легкую кислотность, было карболовой кислоты ). Фенол — белое кристаллическое соединение, имеющее характерный («больничный запах») запах.
Рисунок 9.5 (Слева) Структура фенола. (справа) Примерно два грамма фенола в стеклянном флаконе.Фото В. Оэлена.Для вашего здоровья: фенолы и мы
Фенолы широко используются как антисептики (вещества, убивающие микроорганизмы на живых тканях) и как дезинфицирующие средства (вещества, предназначенные для уничтожения микроорганизмов на неодушевленных предметах, таких как мебель или полы). Первым широко применяемым антисептиком был фенол. Джозеф Листер использовал его для антисептической хирургии в 1867 году. Однако фенол токсичен для человека и может вызвать серьезные ожоги при нанесении на кожу.В кровотоке это системный яд , что означает, что он проникает во все части тела и поражает их. Его серьезные побочные эффекты привели к поискам более безопасных антисептиков, ряд из которых был найден.
Рисунок 9.6 Операция в 1753 году операции до применения антисептиков. Картина написана Гаспаре Траверси.
В настоящее время фенол используется только в очень малых концентрациях в некоторых безрецептурных медицинских продуктах, таких как хлорасептик для горла.
Рис. 9.7 Фенол все еще используется в низких концентрациях в некоторых медицинских препаратах, таких как хлорасептик.
Более сложные соединения, содержащие фенольные функциональные группы, обычно встречаются в природе, особенно в виде растительных натуральных продуктов. Например, одними из основных метаболитов, обнаруженных в зеленом чае, являются полифенольные катехиновые соединения, представленные на рисунке 9.8А эпигаллокатехингаллатом (ЭКГК) и эпикатехином. Было доказано, что употребление зеленого чая обладает химиопрофилактическими свойствами на лабораторных животных.Считается, что биологическая активность катехинов как антиоксидантных агентов способствует этой активности и другим преимуществам для здоровья, связанным с потреблением чая. Некоторые из биологически активных компонентов марихуаны, такие как тетрагидроканнабинол (THC) и каннабидиол (CBD), также являются фенольными соединениями (рис. 9B).
Рис. 9.8 Натуральные продукты растительного происхождения, содержащие фенольные функциональные группы. (A) Зеленый чай содержит соединения катехина, такие как галлат эпигаллокатехина (ECGC), и эпикатехины, которые, как считается, обладают некоторыми противораковыми преимуществами для здоровья, присущими зеленому чаю.(B) Марихуана содержит множество биологически активных фенольных соединений, включая галлюциногенный компонент марихуаны, тетрагидроканнабинол (THC) и метаболит каннабидиол (CBD). Каннабидиол не обладает психоактивными свойствами и в настоящее время изучается в качестве потенциального средства лечения синдромов рефракционной эпилепсии.
Упражнения по обзору концепции
Почему этанол (CH 3 CH 2 OH) более растворим в воде, чем 1-гексанол (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 OH) ?
Почему 1-бутанол (CH 3 CH 2 CH 2 CH 2 OH) имеет более низкую точку кипения, чем 1-гексанол (CH 3 CH 2 CH 2 CH 2 СН 2 СН 2 ОН)?
Этанол имеет группу -ОН и только 2 атома углерода; 1-гексанол имеет одну группу -ОН для 6 атомов углерода и, таким образом, больше похож на (неполярный) углеводород, чем на этанол.
1-гексанол имеет более длинную углеродную цепь, чем у 1-бутанола, и, следовательно, больше LDF, которые способствуют более высокой температуре кипения.
Ответьте на следующие упражнения, не обращаясь к таблицам в тексте.
Расположите эти спирты в порядке увеличения температуры кипения: 1-бутанол (CH 3 CH 2 CH 2 CH 2 OH), 1-гептанол (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH) и 1-пропанол (CH 3 CH 2 CH 2 OH).
Что имеет более высокую точку кипения — бутан (CH 3 CH 2 CH 2 CH 3 ) или пропанол-1 (CH 3 CH 2 CH 2 OH)?
Расположите эти спирты в порядке увеличения растворимости в воде: 1-бутанол (CH 3 CH 2 CH 2 CH 2 OH), метанол (CH 3 OH) и 1-октанол (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH).
Расположите эти соединения в порядке увеличения растворимости в воде: 1-бутанол (CH 3 CH 2 CH 2 CH 2 OH), этанол (CH 3 CH 2 OH) и пентан. (CH 3 CH 2 CH 2 CH 2 CH 3 ).
1-пропанол <1-бутанол <1-гептанол
1-октанол <1-бутанол <метанол
Вернуться к началу
9.3 эфира
Эфиры — это класс органических соединений, которые содержат кислород между двумя алкильными группами. Они имеют формулу R-O-R ’, где R’s представляют собой алкильные группы. эти соединения используются в красителях, парфюмерии, маслах, восках и в промышленности.
Свойства эфиров Связи C — O в простых эфирах полярны, и, следовательно, эфиры обладают суммарным дипольным моментом. Слабая полярность эфиров не оказывает заметного влияния на их точки кипения, сравнимые с таковыми у алкенов сопоставимой молекулярной массы.Эфиры имеют гораздо более низкие температуры кипения по сравнению с изомерными спиртами. Это связано с тем, что молекулы спиртов связаны водородными связями, в то время как молекулы эфира не могут образовывать водородные связи с другими молекулами эфира. Например, диэтиловый эфир (CH 3 CH 2 OCH 2 CH 3 ) имеет точку кипения 34,6 o ° C, тогда как н-бутанол (CH 3 CH 2 CH 2 CH 2 OH), четырехуглеродный спирт, имеет пионт кипения 117.7 o C.
Эфиры могут образовывать водородные связи с водой, однако, поскольку вода содержит частично положительные атомы водорода, необходимые для образования водородных связей. Таким образом, простые эфиры, содержащие до 3 атомов углерода, растворимы в воде из-за образования Н-связей с молекулами воды.
Растворимость простых эфиров уменьшается с увеличением числа атомов углерода. Относительное увеличение углеводородной части молекулы снижает тенденцию образования водородной связи с водой.Простые эфиры в значительной степени растворимы в более неполярных органических растворителях и фактически могут использоваться в качестве растворителя для растворения неполярных и умеренно полярных молекул. Кроме того, простые эфиры очень неактивны. Фактически, за исключением алканов, циклоалканов и фторуглеродов, простые эфиры, вероятно, являются наименее реакционноспособным обычным классом органических соединений. Таким образом, простые эфиры меньшего размера, такие как диэтиловый эфир (CH 3 CH 2 OCH 2 CH 3 ), широко используются химиками-органиками в качестве растворителей для различных органических реакций.Инертность эфиров по отношению к спиртам, несомненно, связана с отсутствием реакционной связи О – Н.
Для вашего здоровья — Ethers and Us
В середине 1800-х — начале 1900-х годов диэтиловый эфир использовался в качестве анестетика во время хирургических операций, в значительной степени заменяя хлороформ из-за пониженной токсичности. Общий анестетик действует на мозг, вызывая бессознательное состояние и общую нечувствительность к ощущениям или боли.Диэтиловый эфир (CH 3 CH 2 OCH 2 CH 3 ) был первым широко используемым общим анестетиком.
Рис. 9.9 Уильям Мортон, стоматолог из Бостона, ввел диэтиловый эфир в хирургическую практику в 1846 году. На этой картине изображена операция в Бостоне в 1846 году, в которой диэтиловый эфир использовался в качестве анестетика. Вдыхание паров эфира вызывает потерю сознания, подавляя активность центральной нервной системы. Источник: Картина Уильяма Мортона Эрнеста Борта.
Диэтиловый эфир относительно безопасен, поскольку существует довольно большой разрыв между дозой, обеспечивающей эффективный уровень анестезии, и смертельной дозой. Однако, поскольку он легко воспламеняется и имеет дополнительный недостаток, вызывающий тошноту, его заменили более новыми анестетиками для ингаляции, включая фторсодержащие соединения галотан и галогенированные эфиры, десфлуран, изофлуран и севофлуран. Галогенированные простые эфиры, изофлуран, десфлуран и севофлуран демонстрируют меньшие побочные эффекты по сравнению с диэтиловым эфиром.К сожалению, безопасность этих соединений для персонала операционной была поставлена под сомнение. Например, женщины, работающие в операционной, подвергшиеся воздействию галотана, чаще страдают выкидышами, чем женщины в общей популяции.
Простые эфиры также являются общими функциональными группами, обнаруженными в натуральных продуктах, и могут обладать уникальной биологической активностью. Фактически, было обнаружено, что некоторые очень большие соединения, содержащие несколько простых эфиров, называемые полиэфирами , вызывают нейротоксическое отравление моллюсками.В этом примере динофлаггелат, Karina brevis , который является возбудителем цветения водорослей красного прилива, производит класс высокотоксичных полиэфиров, называемых бреватоксинами. Бреватоксин А изображен на рисунке 9.10. Симптомы этого отравления включают рвоту и тошноту, а также различные неврологические симптомы, такие как невнятная речь.
Рисунок 9.10 Нейротоксическое отравление моллюсками. Динофлаггелат, Karina brevis , показанный в верхнем левом углу, является возбудителем вредоносного цветения водорослей красного прилива.Цветение морских водорослей может быть довольно обширным, как показано на фотографии красного прилива (вверху справа), происходящего недалеко от Сан-Диего, Калифорния. K. brevis производит класс полиэфиров, называемых бреватоксинами. Бреватоксин А показан в качестве примера. Моллюски и мышцы, питающиеся фильтром, загрязняются динофлаггелатом и могут вызвать нейротоксическое отравление моллюсками при употреблении в пищу. Красные приливы могут иметь серьезные экономические издержки, поскольку промыслы и промысел моллюсков должны быть закрыты до тех пор, пока уровни токсинов в коммерческих продуктах не вернутся к приемлемым уровням.
Вернуться к началу
9,4 Альдегиды и кетоны
Альдегиды и кетоны характеризуются наличием карбонильной группы (C = O), и их реакционную способность обычно можно понять, признав, что карбонильный углерод содержит частичный положительный заряд (δ +), а карбонильный кислород содержит частичный отрицательный заряд. (δ−). Альдегиды обычно более реакционноспособны, чем кетоны.
Карбонильная группаA карбонильная группа представляет собой химически органическую функциональную группу, состоящую из атома углерода, связанного двойной связью с атомом кислорода -> [ C = O ] Простейшими карбонильными группами являются альдегиды и кетоны, обычно присоединенные к другому углеродному соединению.Эти структуры можно найти во многих ароматических соединениях, влияющих на запах и вкус.
Прежде чем углубляться в подробности, обязательно поймите, что сама сущность C = O известна как « c арбонильная группа », в то время как члены этой группы называются « карбонильные соединения ». «.
Как обсуждалось ранее, мы понимаем, что у кислорода есть две неподеленные пары электронов. Эти электроны делают кислород более электроотрицательным, чем углерод.Тогда углерод будет частично положительным (или электрофильным, = «любящим электроны»), а кислород частично отрицательным ( нуклеофильным = «любящим ядро или протон»). Поляризуемость обозначается дельтой в нижнем регистре и положительным или отрицательным верхним индексом в зависимости от атома. Например, углерод будет иметь δ + , а кислород δ —.
Свойства альдегидов и кетонов Альдегиды
В альдегидах к карбонильной группе присоединен атом водорода вместе с
- второй атом водорода
- или, чаще, углеводородная группа, которая может быть алкильной группой или группой, содержащей бензольное кольцо.
В этом разделе мы игнорируем те, которые содержат бензольные кольца. Ниже приведены некоторые примеры альдегидов
Обратите внимание, что все они имеют один и тот же конец молекулы. Отличается только сложность другой присоединенной углеродной группы. Когда вы пишете формулы для них, альдегидная группа (карбонильная группа с присоединенным атомом водорода) всегда записывается как -CHO — никогда как COH. Его легко спутать с алкоголем.Например, этанал записывается как CH 3 CHO; метанал как HCHO.
В кетонах к карбонильной группе присоединены две углеродные группы. Опять же, это могут быть либо алкильные группы, либо группы, содержащие бензольные кольца. Обратите внимание, что к карбонильной группе кетонов никогда не присоединен атом водорода.
Пропанон обычно обозначается как CH 3 COCH 3 .
Метаналь, также известный как формальдегид (HCHO), представляет собой газ при комнатной температуре (точка кипения -21 ° C), а этаналь, также известный как ацетальдегид, имеет температуру кипения + 21 ° C. Это означает, что этаналь кипит при температуре, близкой к комнатной. Более крупные альдегиды и кетоны являются жидкостями, температура кипения которых повышается по мере увеличения размера молекул. Величина точки кипения определяется силой межмолекулярных сил.В этих молекулах присутствуют две основные межмолекулярные силы:
- Лондонские силы дисперсии : Эти притяжения тем сильнее, чем больше длина молекул и больше электронов. Это увеличивает размеры устанавливаемых временных диполей. Вот почему температуры кипения увеличиваются с увеличением числа атомов углерода в цепях — независимо от того, говорите ли вы об альдегидах или кетонах.
- Диполь-дипольные притяжения : И альдегиды, и кетоны являются полярными молекулами из-за наличия двойной связи углерод-кислород.Помимо дисперсионных сил, между постоянными диполями на соседних молекулах также будет существовать притяжение. Это означает, что точки кипения будут выше, чем у углеводородов аналогичного размера, которые обладают только дисперсионными силами. Интересно сравнить три молекулы одинакового размера. Они имеют одинаковую длину и одинаковое (хотя и не одинаковое) количество электронов.
Поляризация карбонильных групп также влияет на температуру кипения альдегидов и кетонов, которая выше, чем у углеводородов аналогичного размера.Однако, поскольку они не могут образовывать водородные связи, их температуры кипения обычно ниже, чем у спиртов аналогичного размера. В таблице 9.2 приведены некоторые примеры соединений одинаковой массы, но содержащих разные типы функциональных групп. Обратите внимание, что соединения, которые имеют более сильные межмолекулярные силы, имеют более высокие температуры кипения.
Алканы <Альдегиды <Кетоны <Спирты
Таблица 9.2 Сравнение точек кипения и межмолекулярных сил
Из-за полярности карбонильной группы атом кислорода альдегида или кетона вступает в водородную связь с молекулой воды.
Таким образом, растворимость альдегидов и кетонов примерно такая же, как у спиртов и простых эфиров. Формальдегид (HCHO), ацетальдегид (CH 3 CHO) и ацетон ((CH 3 ) 2 CO) растворимы в воде. По мере увеличения длины углеродной цепи растворимость в воде уменьшается. Граница растворимости находится примерно при четырех атомах углерода на атом кислорода. Все альдегиды и кетоны растворимы в органических растворителях и, как правило, менее плотны, чем вода.
Вернуться к началу
Альдегиды и кетоны в природе
Подобно другим кислородсодержащим функциональным группам, обсуждавшимся до сих пор, альдегиды и кетоны также широко распространены в природе и часто сочетаются с другими функциональными группами. Примеры встречающихся в природе молекул, которые содержат функциональную группу альдегида или кетона, показаны на следующих двух рисунках. Соединения на рисунке 9.11 обнаруживаются в основном в растениях или микроорганизмах, а также в соединениях на рисунке 9.12 имеют животное происхождение. Многие из этих молекулярных структур хиральны и имеют отчетливую стереохимию.
Когда хиральные соединения встречаются в природе, они обычно энантиомерно чисты, хотя разные источники могут давать разные энантиомеры. Например, карвон обнаружен как его левовращающий (R) -энантиомер в масле мяты курчавой, тогда как семена тмина содержат правовращающий (S) -энантиомер. В этом случае изменение стереохимии вызывает резкое изменение воспринимаемого запаха.Альдегиды и кетоны известны своим сладким, а иногда и резким запахом. Запах ванильного экстракта исходит от молекулы ванилина. Точно так же бензальдегид придает сильный запах миндаля. Благодаря приятным ароматам молекулы, содержащие альдегиды и кетоны, часто встречаются в парфюмерии. Однако не все ароматы приятны. В частности, 2-гептанон обеспечивает часть резкого запаха голубого сыра, а (R) -Muscone является частью мускусного запаха гималайской кабарги.Наконец, кетоны присутствуют во многих важных гормонах, таких как прогестерон (женский половой гормон) и тестостерон (мужской половой гормон). Обратите внимание, как тонкие различия в структуре могут вызвать резкие изменения в биологической активности. Функциональность кетонов также проявляется в противовоспалительном стероиде кортизоне.
Рис. 9.11 Примеры молекул, содержащих альдегид и кетон, выделенных из растительных источников.
Рисунок 9.12 Примеры молекул, содержащих альдегид и кетон, выделенных из животных источников.
Для вашего здоровья: кетоны в крови, моче и дыхании
Кетоны образуются в организме человека как побочный продукт липидного обмена. Два общих метаболита, продуцируемых в организме человека, — это кетонсодержащая ацетоуксусная кислота и метаболит спирта, β-гидроксибутират. Ацетон также производится как продукт распада ацетоуксусной кислоты. Затем ацетон может выводиться из организма с мочой или в виде летучего продукта через легкие.
Обычно кетоны не попадают в кровоток в заметных количествах. Например, нормальная концентрация ацетона в организме человека составляет менее 1 мг / 100 мл крови. Вместо этого кетоны, которые вырабатываются во время метаболизма липидов внутри клеток, обычно полностью окисляются и расщепляются на углекислый газ и воду. Это потому, что глюкоза является основным источником энергии для тела, особенно для мозга. Глюкоза в контролируемых количествах попадает в кровоток печенью, где она перемещается по всему телу, обеспечивая энергию.Для мозга это основной источник энергии, поскольку гематоэнцефалический барьер блокирует транспорт больших липидных молекул. Однако во время голодания, когда глюкоза недоступна, или при определенных болезненных состояниях, когда метаболизм глюкозы нарушен, например, при неконтролируемом сахарном диабете, концентрации кетонов в крови повышаются до более высоких уровней, чтобы обеспечить мозг альтернативным источником энергии. Однако, поскольку ацетоуксусная кислота и β-гидроксибутират содержат функциональные группы карбоновых кислот, добавление этих молекул в кровь вызывает закисление, которое, если его не контролировать, может вызвать опасное состояние, называемое кетоацидозом.Кетоацидоз может быть опасным для жизни событием. Кетоны легко обнаружить, так как ацетон выводится с мочой. В тяжелых случаях запах ацетона также может ощущаться в дыхании.
Вернуться к началу
9,5 Карбоновые кислоты и сложные эфиры
Карбоновые кислоты можно легко распознать, поскольку они имеют карбонильный углерод, который также непосредственно связан с функциональной группой спирта. Таким образом, карбонильный углерод также присоединен непосредственно к спирту.В функциональной группе сложного эфира карбонильный углерод также непосредственно присоединен как часть функциональной группы простого эфира.
Свойства карбоновых кислот и сложных эфиров Карбоновые кислотыКарбоновые кислоты — это органические соединения, которые включают карбоксильную функциональную группу, CO 2 H. Название карбоксил происходит от того факта, что карбонильная и гидроксильная группы присоединены к одному и тому же атому углерода.
Карбоновые кислоты названы так потому, что они могут отдавать водород для образования карбоксилатного иона.Факторы, влияющие на кислотность карбоновых кислот, будут обсуждены позже.
Сложные эфирыСложный эфир представляет собой органическое соединение, которое является производным карбоновой кислоты, в которой атом водорода гидроксильной группы заменен на алкильную группу. Структура является продуктом карбоновой кислоты (R-часть) и спирта (R’-часть). Общая формула сложного эфира показана ниже.
Группа R может быть водородной или углеродной цепью.Группа R ‘должна быть углеродной цепью, поскольку атом водорода сделает молекулу карбоновой кислотой. Шаги по названию сложных эфиров вместе с двумя примерами показаны ниже.
Точки кипения, точки плавления и растворимостьКарбоновые кислоты могут образовывать димеры с водородными связями, температура кипения которых выше, чем у спиртов аналогичного размера (таблица 9.3).
Таблица 9.3 Сравнение температур кипения соединений аналогичного размера
Мелкие сложные эфиры имеют температуры кипения ниже, чем у альдегидов и кетонов с аналогичной массой (Таблица 9.3). Сложные эфиры, как и альдегиды и кетоны, являются полярными молекулами. однако их диполь-дипольные взаимодействия слабее, чем у альдегидов и кетонов, и они не могут образовывать водородные связи. Таким образом, их температуры кипения выше, чем у простых эфиров, и ниже, чем у альдегидов и кетонов аналогичного размера.
Карбоновые кислоты с низким молекулярным весом обычно жидкие при комнатной температуре, тогда как более крупные молекулы образуют воскообразные твердые вещества. Карбоновые кислоты с длиной углеродной цепи от 12 до 20 атомов углерода обычно называют жирными кислотами, поскольку они обычно содержатся в жирах и маслах.По сравнению с другими кислородсодержащими молекулами, карбоновые кислоты с короткой цепью обычно растворимы в воде из-за их способности образовывать водородные связи. По мере увеличения длины углеродной цепи растворимость карбоновой кислоты в воде снижается. Сложные эфиры также могут связываться водородом с водой, хотя и не так эффективно, как карбоновые кислоты, и поэтому они немного менее растворимы в воде, чем карбоновые кислоты аналогичного размера.
Карбоновые кислоты обычно имеют неприятный, резкий и даже прогорклый запах.Например, запах уксуса возникает из-за этановой кислоты (также известной как уксусная кислота). Запах тренажерных залов и немытых носков в значительной степени вызван бутановой кислотой, а гексановая кислота ответственна за сильный запах лимбургского сыра. Из-за своей кислой природы карбоновые кислоты также имеют кислый вкус, как это отмечается для уксуса и лимонной кислоты, содержащихся во многих фруктах. С другой стороны, сложные эфиры обладают приятным ароматом и ответственны за аромат многих фруктов и цветов. Сложные эфиры также могут иметь фруктовый привкус.
Какое соединение имеет более высокую точку кипения — CH 3 CH 2 CH 2 OCH 2 CH 3 или CH 3 CH 2 CH 2 COOH? Объяснять.
Какое соединение имеет более высокую точку кипения — CH 3 CH 2 CH 2 CH 2 CH 2 OH или CH 3 CH 2 CH 2 COOH? Объяснять.
Какое соединение более растворимо в воде — CH 3 COOH или CH 3 CH 2 CH 2 CH 3 ? Объяснять.
Какое соединение более растворимо в воде — CH 3 CH 2 COOH или CH 3 CH 2 CH 2 CH 2 CH 2 COOH? Объяснять.
CH 3 CH 2 CH 2 COOH из-за водородной связи (Нет межмолекулярной водородной связи с CH 3 CH 2 CH 2 OCH 2 CH 3 .)
CH 3 COOH, потому что он участвует в водородной связи с водой (Нет межмолекулярной водородной связи с CH 3 CH 2 CH 2 CH 3 .)
Обычно используемые карбоновые кислоты и сложные эфиры
Карбоновые кислоты и сложные эфиры широко распространены в природе и используются для множества целей. Например, муравьи из семейства Formicidae используют простейшую карбоновую кислоту, муравьиную кислоту, как в качестве химической защиты, так и в качестве атаки для подавления добычи (рис.9.13А). Разбавленный раствор уксусной кислоты (5%) содержится в уксусе и отвечает за кислый и острый вкус. Уксусная кислота также придает хлебу на закваске острый вкус и отвечает за кислый привкус вина. Лимонная кислота содержится во многих фруктах и является причиной их кислого вкуса. Другие карбоновые кислоты, такие как ПАБК и гликолевая кислота, используются в косметической промышленности. ПАБК, вырабатываемая растениями, грибами и бактериями, является обычным компонентом пищи и по структуре связана с витамином фолиевой кислоты.В 1943 году ПАБК был запатентован как одно из первых соединений, используемых при производстве солнцезащитного крема. Однако с середины 1980-х его использование перестало быть популярным из-за опасений, что он может увеличить клеточное УФ-повреждение, а также способствовать развитию аллергии. Гликолевая кислота является наименьшей из кислот класса α-гидроксикислот, и она нашла применение как в пищевой, так и в косметической промышленности. В пищевой промышленности он используется в качестве консерванта, а в индустрии ухода за кожей он чаще всего используется в качестве химического пилинга для уменьшения рубцов на лице от прыщей.
Рис. 9.13 Источники и использование обычных карбоновых кислот. (A) Муравьиная кислота — это защитный токсин, используемый муравьями семейства Formicidae. Фото Мухаммада Махди Карима (B) Уксус — это 5% раствор уксусной кислоты. На фотографии слева показаны различные сорта уксуса на рынке во Франции. Фото Жоржа Сегена (C) Лимонная кислота — обычный компонент фруктов, придающий им кислый вкус. Фотография лимонов, сделанная Андре Карватом (D). Пара-аминобензойная кислота (ПАБК) — карбоновая кислота, обычно встречающаяся в растениях и пищевых культурах, включая цельное зерно.Он был запатентован в 1943 году для использования в солнцезащитных продуктах. Однако из соображений безопасности и аллергической реакции использование ПАБК для этой цели было прекращено. Фотография солнцезащитного крема предоставлена HYanWong (E) Гликолевая кислота обычно используется в косметике в качестве химического пилинга, используемого для уменьшения рубцов от прыщей. На фото слева — до лечения, а справа — после нескольких процедур с гликолевой кислотой. Исследование гликолей предоставлено Джайшри Шарад.
Сложные эфиры легко синтезируются и в большом количестве естественным образом способствуют возникновению вкусов и ароматов многих фруктов и цветов.Например, сложный эфир метилсалицилата также известен как масло грушанки (рис. 9.14). Фруктовый аромат ананасов, груш и клубники обусловлен сложными эфирами, а также сладким ароматом рома.
Рис. 9.14. Фруктовые и приятные ароматы сложных эфиров можно найти в (A) масле грушанки, (B) аромате ананасов и (C) сладости рома. Фотография (A) Gaultheria procumbens , производителя масла грушанки предоставлена: LGPL (B) фото ананаса предоставлено: David Monniaux, и (C) Фотография рома предоставлена: Summerbl4ck
Сложные эфиры также составляют основную часть животных жиров и растительных масел в виде триглицеридов.Образование липидов и жиров будет более подробно описано в главе 11.
Вернуться к началу
9.6 Реакции кислородсодержащих соединений Спирты
Функциональные группы спирта могут участвовать в нескольких различных типах реакций. В этом разделе мы обсудим два основных типа реакций. Первые — это реакции дегидратации, а вторые — реакции окисления.Спирты также могут участвовать в реакциях присоединения и замещения с другими функциональными группами, такими как альдегиды, кетоны и карбоновые кислоты. Эти типы реакций будут обсуждаться более подробно в разделах, посвященных альдегидам, кетонам и карбоновым кислотам.
Реакции обезвоживания (устранения)В главе 8 мы узнали, что спирты могут образовываться в результате гидратации алкенов во время реакций присоединения. Мы также узнали, что может иметь место и обратная реакция.Спирты могут быть удалены или удалены из молекул посредством процесса дегидратации (или удаления воды). Результатом реакции элиминирования является образование алкена и молекулы воды.
Реакции элиминирования, которые происходят с более сложными молекулами, могут привести к более чем одному возможному продукту. В этих случаях алкен образуется в более замещенном положении (у углерода, который имеет больше атомов углерода и меньше атомов водорода).Например, в реакции ниже спирт не является симметричным. Таким образом, существует два возможных продукта реакции элиминирования, вариант 1 и вариант 2. В варианте 1 алкен образуется с углеродом, который имеет наименьшее количество присоединенных атомов водорода, тогда как в варианте 2 алкен образуется с углеродом, имеющим большинство атомов водорода присоединены. Таким образом, вариант 1 будет основным продуктом реакции, а вариант 2 — второстепенным.
Реакции отщепления спирта с использованием небольших 1 o спиртов также могут быть использованы для получения простых эфиров.Для получения простого эфира, а не алкена, температура реакции должна быть снижена и реакция должна проводиться с избытком спирта в реакционной смеси. Например:
| 2 CH 3 CH 2 -OH + H 2 SO 4 | 130 ºC | CH 3 CH 2 -O-CH 2 CH 3 + H 2 O |
| CH 3 CH 2 -OH + H 2 SO 4 | 150 ºC | CH 2 = CH 2 + H 2 O |
В этой реакции необходимо использовать избыток спирта и поддерживать температуру около 413 К.Если спирт не используется в избытке или температура выше, спирт предпочтительно подвергнется дегидратации с образованием алкена. Дегидратация вторичных и третичных спиртов для получения соответствующих простых эфиров неэффективна, поскольку в этих реакциях слишком легко образуются алкены.
Реакции окисления
Некоторые спирты также могут подвергаться реакциям окисления. Помните, что в окислительно-восстановительных реакциях окисляемый компонент реакции теряет электроны (LEO), в то время как молекула, получающая электроны, восстанавливается (GER).В органических реакциях поток электронов обычно следует за потоком атомов водорода. Таким образом, молекула, теряющая водород, обычно также теряет электроны и является окисленным компонентом. Молекула, набирающая электроны, восстанавливается. Для спиртов могут быть окислены как первичные, так и вторичные спирты. С другой стороны, третичные спирты не окисляются. Во многих реакциях окисления окислитель показан над стрелкой реакции как [O]. Окислитель может быть металлом или другой органической молекулой.В реакции окислителем является молекула, которая восстанавливается или принимает электроны.
В реакциях окисления спирта водород из спирта и водород, связанный с углеродом, к которому присоединен спирт, вместе со своими электронами удаляются из молекулы окислителем. Удаление атомов водорода и их электронов приводит к образованию карбонильной функциональной группы. В случае первичного спирта результатом является образование альдегида.В случае вторичного спирта результатом является образование кетона. Обратите внимание, что для третичного спирта углерод, присоединенный к спиртовой функциональной группе, не имеет присоединенного к нему атома водорода. Таким образом, он не может подвергаться окислению. Когда третичный спирт подвергается действию окислителя, реакции не происходит.
Обратите внимание, что для первичного спирта, который подвергается окислению, он все еще сохраняет атом водорода, который присоединен к карбонильному углероду во вновь образованном альдегиде.Эта молекула может подвергаться вторичной реакции окисления с окислителем и водой, чтобы добавить еще один атом кислорода и удалить карбонильный атом водорода. Это приводит к образованию карбоновой кислоты.
Для вашего здоровья: физиологические эффекты спиртов
Метанол довольно ядовит для человека. Проглатывание всего 15 мл метанола может вызвать слепоту, а 30 мл (1 унцию) — смерть. Однако обычная смертельная доза составляет от 100 до 150 мл.Основная причина токсичности метанола заключается в том, что у нас есть ферменты печени, которые катализируют его окисление до формальдегида, простейшего члена семейства альдегидов:
Формальдегид быстро вступает в реакцию с компонентами клеток, коагулируя белки так же, как при варке яйца. Это свойство формальдегида объясняет большую часть токсичности метанола.
Органические и биохимические уравнения часто записываются, показывая только органические реагенты и продукты.Таким образом, мы концентрируем внимание на органическом исходном материале и продукте, а не на балансировании сложных уравнений.
Этанол окисляется в печени до ацетальдегида:
Ацетальдегид, в свою очередь, окисляется до уксусной кислоты (HC 2 H 3 O 2 ), нормального компонента клеток, которая затем окисляется до диоксида углерода и воды. Даже в этом случае этанол потенциально токсичен для человека. Быстрое употребление 1 pt (около 500 мл) чистого этанола убило бы большинство людей, а от острого отравления этанолом ежегодно умирает несколько сотен человек — часто тех, кто участвует в каком-то соревновании по выпивке.Этанол свободно проникает в мозг, где он угнетает центр контроля дыхания, что приводит к отказу дыхательных мышц в легких и, как следствие, к удушью. Считается, что этанол действует на мембраны нервных клеток, вызывая ухудшение речи, мышления, познания и суждения.
Медицинский спирт обычно представляет собой 70% -ный водный раствор изопропилового спирта. Он имеет высокое давление пара, а его быстрое испарение с кожи дает охлаждающий эффект. При проглатывании он токсичен, но, по сравнению с метанолом, хуже всасывается через кожу.
Напишите уравнение окисления каждого спирта. Используйте [O] над стрелкой, чтобы указать окислитель. Если реакции не происходит, напишите «нет реакции» после стрелки.
- CH 3 CH 2 CH 2 CH 2 CH 2 OH
Первый шаг — определить класс каждого алкоголя как первичный, вторичный или третичный.
Этот спирт имеет группу ОН на атоме углерода, которая связана только с одним другим атомом углерода, так что это первичный спирт. При окислении сначала образуется альдегид, а при дальнейшем окислении образуется карбоновая кислота.
Этот спирт имеет группу ОН на атоме углерода, который присоединен к трем другим атомам углерода, поэтому это третичный спирт. Никакой реакции не происходит.
Этот спирт имеет группу ОН на атоме углерода, который присоединен к двум другим атомам углерода, так что это вторичный спирт; окисление дает кетон.
Напишите уравнение окисления каждого спирта. Используйте [O] над стрелкой, чтобы указать окислитель. Если реакции не происходит, напишите «нет реакции» после стрелки.
Вернуться к началу
Альдегиды и кетоны В этом разделе мы обсудим первичные реакции альдегидов и кетонов. К ним относятся реакции окисления и восстановления, а также реакции сочетания со спиртами.
Как показано выше в разделе, посвященном спиртам, альдегиды могут подвергаться окислению с образованием коарбоновой кислоты. Это связано с тем, что карбонильный атом углерода все еще сохраняет атом водорода, который можно удалить и заменить атомом кислорода. Кетоны, с другой стороны, не содержат атом водорода, связанный с карбонильным атомом углерода. Таким образом, они не могут подвергаться дальнейшему окислению. Как отмечалось выше, кетоны, которые подвергаются действию окислителя, не вступают в реакцию.
Реакции восстановленияРеакции восстановления с альдегидами и кетонами превращают эти соединения в первичные спирты в случае альдегидов и вторичные спирты в случае кетонов. По сути, это реакции, обратные реакциям окисления спирта.
Например, с альдегидом этанал получается первичный спирт, этанол:
Обратите внимание, что это упрощенное уравнение, где [H] означает «водород из восстановителя».В общем, восстановление альдегида приводит к первичному спирту.
Восстановление кетона, такого как пропанон, даст вам вторичный спирт, такой как 2-пропанол:
Восстановление кетона приводит к вторичному спирту.
Реакции присоединения со спиртами
Альдегиды и кетоны могут реагировать со спиртовыми функциональными группами в реакциях присоединения (комбинации).Эти типы реакций обычны по своей природе и очень важны в процессе циклизации молекул сахара. Мы вернемся к этому вопросу в главе 11 во введении к основным макромолекулам тела.
Когда спирт добавляется к альдегиду, результат называется полуацеталем ; когда к кетону добавляют спирт, получается полукетал .
В приведенной выше реакции B: относится к основанию, которое присутствует в растворе и может действовать как акцептор протонов.В этой реакции обычное основание активирует спирт в реакции (кислород спирта показан красным). Кислород спирта тогда заряжается отрицательно, потому что он переносит лишний электрон от водорода. Теперь он может действовать как нуклеофил и атаковать карбонильный углерод альдегида или кетона. Когда кислород спирта образует связь с карбонильным углеродом альдегида или кетона, это замещает одну из двойных связей карбонильной группы. Оксиен из карбонила затем вытягивает водород из обычной кислоты, присутствующей в растворе.На этой диаграмме обычная кислота обозначена как H-A. При этом образуется спирт на месте карбонильной группы альдегида или кетона. Исходная спиртовая группа теперь выглядит как эфирная функциональная группа. Таким образом, вы можете распознать полуацетали и гемикетали в натуральных продуктах как атом углерода, который одновременно связан как со спиртовой, так и с простой эфирной функциональной группой. Если этот углерод также имеет водородную связь с ним, он происходит из альдегида и называется полуацеталем .Если центральный углерод связан с двумя другими атомами углерода (обозначенными выше R 1 и R 3 ) в дополнение к атомам кислорода, молекула произошла от кетона и называется полукеталем .
Приставка « hemi» (половина) используется в каждом термине, потому что, как мы вскоре увидим, может произойти второе добавление нуклеофила спирта, что приведет к образованию видов, называемых ацеталей и кеталей .
Образование полуацеталей и гемикеталей в биологических системах является обычным явлением и часто происходит спонтанно (без присутствия катализатора или фермента), особенно в случае простых молекул сахара.Из-за спонтанности реакций они также очень обратимы: полуацетали и гемикетали легко превращаются обратно в альдегиды и кетоны плюс спирт. Механизм обратного превращения полуацеталя в альдегид показан ниже:
Практические задачи:Реакции с образованием ацеталей или кеталей
Когда полуацеталь (или гемикеталь) подвергается нуклеофильной атаке со стороны второй молекулы спирта, результат называется ацеталь (или кеталь ).
В то время как образование полуацеталя из альдегида и спирта (этап 1 выше) является нуклеофильным присоединением, образование ацеталя из полуацеталя (этап 2 выше) представляет собой реакцию нуклеофильного замещения с исходным карбонилом кислород (показан синим) выходит в виде молекулы воды. Поскольку вода покидает молекулу во второй реакции (стадия 2), эта реакция также известна как реакция дегидратации . Реакция замещения, происходящая на второй стадии, не происходит спонтанно и не является легко обратимой.Внутри биологических систем для образования ацеталя или кеталя потребуется фермент. Обратите внимание, что и ацеталь, и кеталь выглядят как центральный углерод, связанный с двумя функциональными группами простого эфира. Если этот центральный углерод также связан с водородом, то это ацталь, а если он связан с двумя атомами углерода, это кеталь. Обратная реакция будет включать разложение ацеталя или кеталя с использованием гидролиза или проникновения воды в молекулу.
Вернуться к началу
Карбоновые кислоты Кислотность карбоновых кислотСогласно определению кислоты как «вещества, которое отдает протоны (ионы водорода) другим вещам», карбоновые кислоты являются кислыми, потому что водород в группе -COOH может быть передан другим молекулам.В растворе в воде ион водорода передается от группы -COOH к молекуле воды. Например, с этановой кислотой (как показано ниже) вы получаете этаноат-ион, образованный вместе с ионом гидроксония, H 3 O + .
CH 3 COOH + H 2 O ⇌ CH 3 COO — + H 3 O +
Эта реакция обратима, и в случае этановой кислоты (уксусной кислоты) не более 1% кислоты прореагировало с образованием ионов за один раз.
Таким образом, карбоновые кислоты являются слабыми кислотами.
Карбоновые кислоты и образование солейИз-за своей кислой природы карбоновые кислоты могут реагировать с более химически активными металлами с образованием ионных связей и образования солей. Реакции такие же, как и с кислотами, такими как соляная кислота, за исключением того, что они, как правило, более медленные.
2CH 3 COOH (водн.) + Mg (s) → (CH 3 COO) 2 Mg + H 2
В указанной выше реакции разбавленная этановая кислота реагирует с магнием.Магний реагирует с образованием бесцветного раствора этаноата магния и выделяется газообразный водород. Если вы используете магниевую ленту, реакция будет менее интенсивной, чем такая же реакция с соляной кислотой, но с порошком магния обе протекают так быстро, что вы, вероятно, не заметите большой разницы.
Пример проблемы:Напишите уравнение для каждой реакции.
- ионизация пропионовой кислоты (CH 2 CH 2 COOH) в воде (H 2 O)
- Нейтрализация пропионовой кислоты водным гидроксидом натрия (NaOH)
Пропионовая кислота ионизируется в воде с образованием пропионат-иона и иона гидроксония (H 3 O + ).
CH 3 CH 2 COOH (водн.) + H 2 O (ℓ) → CH 3 CH 2 COO — (водн.) + H 3 O + (водн.)
Пропионовая кислота реагирует с NaOH (водн.) С образованием пропионата натрия и воды.
CH 3 CH 2 COOH (водн.) + NaOH (вод.) → CH 3 CH 2 COO — Na + (водн.) + H 2 O ()
Сложный эфир может быть образован путем объединения карбоновой кислоты со спиртом в присутствии сильной кислоты или в присутствии фермента в биологических системах.В реакции этерификации гидроксильная группа карбоновой кислоты действует как уходящая группа и образует молекулу воды в конечном продукте. Он заменен группой -OR из спирта.
Реакция обратимая. В качестве конкретного примера реакции этерификации бутилацетат может быть получен из уксусной кислоты и 1-бутанола.
Подробный обзор: конденсационные полимерыКоммерчески важной реакцией этерификации является конденсационная полимеризация, при которой происходит реакция между дикарбоновой кислотой и двухатомным спиртом (диолом) с удалением воды.Такая реакция дает сложный эфир, который содержит свободную (непрореагировавшую) карбоксильную группу на одном конце и свободную спиртовую группу на другом конце. Затем происходят дальнейшие реакции конденсации с образованием полиэфирных полимеров.
Самый важный полиэфир, полиэтилентерефталат (ПЭТ), производится из мономеров терефталевой кислоты и этиленгликоля:
Из молекул полиэстера получаются отличные волокна, которые используются во многих тканях. Вязаная полиэфирная трубка, которая является биологически инертной, может использоваться в хирургии для восстановления или замены пораженных участков кровеносных сосудов.Из ПЭТ делают бутылки для газировки и других напитков. Из него также образуются пленки, называемые майларом. Лента Mylar с магнитным покрытием используется в аудио- и видеокассетах. Синтетические артерии могут быть изготовлены из ПЭТ, политетрафторэтилена и других полимеров.
Практические задачи:Завершите следующие реакции:
Гидролиз сложных эфировОбратную реакцию образования сложного эфира можно использовать для разложения сложных эфиров на карбоновую кислоту и спирт.Эта реакция требует включения воды в сложноэфирную связь, и поэтому называется реакцией гидролиза .
Сложный эфир нагревают с большим избытком воды, содержащей сильнокислый катализатор. Как и при этерификации, реакция обратима и не доходит до завершения.
В качестве конкретного примера бутилацетат и вода реагируют с образованием уксусной кислоты и 1-бутанола. Реакция обратима и не доходит до завершения.
Практические задачи:Вернуться к началу
9.7 Краткое содержание главыГидроксильная группа (ОН) является функциональной группой из спиртов . Спирты представлены общей формулой ROH. Спирты получают из алканов заменой одного или нескольких атомов водорода на группу ОН. Первичный (1 °) спирт (RCH 2 OH) имеет группу ОН на атоме углерода, присоединенную к еще одному атому углерода; вторичный (2 °) спирт (R 2 CHOH) имеет группу ОН на атоме углерода, присоединенную к двум другим атомам углерода; и третичный (3 °) спирт (R 3 COH) имеет группу ОН на атоме углерода, присоединенном к трем другим атомам углерода.
Способность участвовать в водородных связях значительно увеличивает точки кипения спиртов по сравнению с углеводородами сопоставимой молярной массы. Спирты также могут вступать в водородную связь с молекулами воды, а спирты, содержащие до четырех атомов углерода, растворимы в воде.
Многие спирты можно синтезировать путем гидратации алкенов. Обычные спирты включают метанол, этанол и изопропиловый спирт. Метанол довольно ядовит. Это может вызвать слепоту или даже смерть. Этанол можно получить из этилена или получить путем ферментации.Это «алкоголь» в алкогольных напитках. Иногда люди по ошибке пьют метанол, думая, что это алкогольный напиток. Иногда недобросовестные бутлегеры продают метанол ничего не подозревающим покупателям. В любом случае результаты зачастую трагичны.
Когда вода удаляется из спирта на стадии дегидратации, результатом является либо алкен, либо простой эфир, в зависимости от условий реакции. Первичные спирты окисляются до альдегидов или карбоновых кислот, а вторичные спирты окисляются до кетонов.Третичные спирты не окисляются легко.
Спирты, содержащие две группы ОН на соседних атомах углерода, называются гликолями .
Фенолы (ArOH) представляют собой соединения, имеющие группу ОН, присоединенную к ароматическому кольцу.
Простые эфиры (ROR ′, ROAr, ArOAr) представляют собой соединения, в которых атом кислорода присоединен к двум органическим группам. Молекулы эфира не имеют группы ОН и, следовательно, межмолекулярной водородной связи. Следовательно, простые эфиры имеют довольно низкие температуры кипения для данной молярной массы.Молекулы эфира имеют атом кислорода и могут вступать в водородную связь с молекулами воды. Молекула эфира имеет примерно такую же растворимость в воде, как и спирт, изомерный с ней.
Карбонильная группа , двойная связь углерод-кислород, встречается повсеместно в биологических соединениях. Он содержится в углеводах, жирах, белках, нуклеиновых кислотах, гормонах и витаминах — органических соединениях, важных для живых систем.
Карбонильная группа является определяющей особенностью альдегидов и кетонов .В альдегидах по крайней мере одна связь в карбонильной группе представляет собой связь углерод-водород; в кетонах обе доступные связи у карбонильного атома углерода являются связями углерод-углерод. Альдегиды синтезируются окислением первичных спиртов. Альдегид можно дополнительно окислить до карбоновой кислоты. Кетоны получают окислением вторичных спиртов. Мягкие окислители окисляют альдегиды до карбоновых кислот. Кетоны этими реагентами не окисляются.
Альдегиды и кетоны могут реагировать со спиртами с образованием полуацеталей и гемикеталей соответственно.Эти реакции происходят без добавления катализатора и могут двигаться как в прямом, так и в обратном направлении. Гемиацетали и гемикетали могут вступать в реакцию с дополнительной молекулой спирта с образованием ацеталей и кеталей. Образование ацеталя или кеталя требует удаления воды и называется реакцией дегидратации. Эти реакции требуют катализатора или фермента, чтобы они происходили. Обратная реакция, которая расщепляет ацеталь с образованием полуацеталя и спирта, требует добавления молекулы воды и называется гидролизом.
Карбоновая кислота (RCOOH) содержит функциональную группу COOH, называемую карбоксильной группой , которая имеет группу ОН, присоединенную к карбонильному атому углерода. Сложный эфир (RCOOR ‘) имеет группу OR’, присоединенную к карбонильному атому углерода.
Карбоновая кислота образуется при окислении альдегида с тем же числом атомов углерода. Поскольку альдегиды образуются из первичных спиртов, эти спирты также являются исходным материалом для карбоновых кислот.
Карбоновые кислоты имеют сильный, часто неприятный запах. Это высокополярные молекулы, которые легко образуют водородные связи, поэтому имеют относительно высокие температуры кипения.
Карбоновые кислоты — слабые кислоты. Они реагируют с основаниями с образованием солей и с карбонатами и бикарбонатами с образованием газообразного диоксида углерода и соли кислоты.
Сложные эфиры — это соединения с приятным запахом, отвечающие за аромат цветов и фруктов. У них более низкие температуры кипения, чем у сопоставимых карбоновых кислот, потому что, хотя молекулы сложного эфира в некоторой степени полярны, они не могут участвовать в водородных связях.Однако с водой сложные эфиры могут образовывать водородные связи; следовательно, сложные эфиры с низкой молярной массой растворимы в воде. Сложные эфиры могут быть синтезированы путем этерификации , в которой карбоновая кислота и спирт объединяются в кислых условиях. Сложные эфиры представляют собой нейтральные соединения, которые подвергаются гидролизу , реакции с водой. В кислых условиях гидролиз по существу является обратным этерификации.
Рисунок 9.15 Сводка важных реакций с кислородом.
Фармер С., Ройш В., Александер Э. и Рахим А. (2016) Органическая химия. Либретексты. Доступно по адресу: https://chem.libretexts.org/Core/Organic_Chemistry
.Ball, et al. (2016) MAP: Основы химии GOB. Либретексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)/14%3A_Organic_Compounds_of_Oxygen/14.10%3A_Compounds_of_Oxygen/14.10%3A_Android
McMurray (2017) MAP: Органическая химия.Либретексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Organic_Chemistry_Textbook_Maps/Map%3A_Organic_Chemistry_(McMurry)
Содербург (2015) Карта: органическая химия с биологическим акцентом. Либретексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Organic_Chemistry_Textbook_Maps/Map%3A_Organic_Chemistry_With_a_Biological_Emphasis_(Soderberg)
Антифриз. (2017, 5 января). В Википедия, Бесплатная энциклопедия . Получено 06:07, 21 апреля 2017 г., с https: // en.wikipedia.org/w/index.php?title=Antifreeze&oldid=758484047
Этиленгликоль. (2017, 4 апреля). В Википедия, Бесплатная энциклопедия . Получено в 06:09, 21 апреля 2017 г., с https://en.wikipedia.org/w/index.php?title=Ethylene_glycol&oldid=773769112
.Инструменты оценки воздействия по классам химикатов — прочие органические вещества
Обзор
Органические соединения обычно определяются как вещества со структурой на основе углерода. Хотя некоторые вещества на основе углерода классифицируются как неорганические, все вещества, классифицируемые как органические, имеют углеродную основу.Органические соединения включают в себя очень вариабельную группу повсеместно распространенных веществ, которые используются в различных областях, от потребительских товаров (например, ингредиенты в продуктах личной гигиены, строительных материалов, упаковки пищевых продуктов, одежды, мебели) и лекарств (например, ибупрофен) до компонентов топлива (например, углеводородов). и взрывчатые вещества (например, тротил). Многие пестициды также классифицируются как органические — они более подробно рассматриваются в модуле «Пестициды» в наборе инструментов «Классы химических веществ» EPA ExpoBox.
Органические соединения могут быть натуральными, синтетическими или полусинтетическими.Источник и метод производства органических соединений могут влиять на их свойства и ожидаемые сценарии воздействия. Например, многие природные органические соединения, такие как липиды, белки и углеводы, имеют растительную основу и обладают лечебными или питательными свойствами, которые используются при прямом воздействии этих соединений.
С другой стороны, некоторые синтетические органические соединения образуются непреднамеренно, например, побочные продукты сгорания, такие как полициклические ароматические углеводороды (ПАУ) и диоксин, выделяемые в результате промышленных процессов хлорирования, и воздействие этих соединений может быть в значительной степени косвенным.
Органические соединения часто группируются по структурному сходству. Различные «классы» органических соединений относятся к группам, основанным на определенных структурных характеристиках, включая химические связи и функциональные группы. Сходства в химической структуре влияют на свойства органических соединений и, следовательно, на их использование и воздействие на человека.
Экологическая судьба, перенос и воздействие органических соединений можно оценить на основе моделей, которые учитывают определенные физико-химические свойства, которые могут помочь предсказать поведение разделения в окружающей среде.Некоторые физико-химические свойства также важно учитывать при разработке соответствующих аналитических методов для классов органических соединений.
Поведение органических соединений сильно различается; однако можно сделать некоторые общие выводы для подгрупп соединений. На поведение органических соединений в окружающей среде влияют физико-химические свойства соединения, включая молекулярную массу и присутствие определенных функциональных групп, таких как спирты, амины, карбоновые кислоты и кетоны.
Эти свойства и характеристики часто влияют на растворимость, поведение разделения и реакционную способность соединения относительно предсказуемым образом, что позволяет специалистам по оценке воздействия легко проводить скрининговые оценки, чтобы определить, какие органические соединения могут вызывать наибольшее беспокойство.
Данный набор инструментов не предназначен для предоставления информации, относящейся ко всем органическим соединениям. Как упоминалось выше, органические вещества представляют собой очень изменчивую группу веществ с широким спектром использования.Вместо этого в этом наборе инструментов рассматриваются инструменты для оценки воздействия пяти конкретных групп вызывающих озабоченность органических соединений, в том числе:
- Диоксины, фураны и ПХБ
- Огнезащитные составы
- Углеводороды
- Перфторированные соединения (ПФУ)
- Фталаты и бисфенол А (BPA)
Эти группы соединений, как известно, обладают свойствами, которые увеличивают потенциал воздействия на человека и окружающую среду, и рассматриваются специально в этом наборе инструментов из-за их важности для разработки политики и усилий по управлению рисками.
Многие указанные выше органические соединения попадают в категорию, известную как стойкие органические загрязнители стойкие органические загрязнители Стойкие органические загрязнители (СОЗ) — это химические вещества, которые сохраняются в окружающей среде, биоаккумулируются через пищевую сеть и создают риск неблагоприятных последствий для здоровья человека. здоровье человека и окружающая среда. Программа Организации Объединенных Наций по окружающей среде (https://www.chem.unep.ch/pops/) или СОЗ, включая ПХД, диоксины, фураны, бромированные антипирены и перфторированные соединения (ПФУ).Эти соединения имеют длительный период полураспада в окружающей среде и могут переноситься через окружающую среду на большие расстояния, а это означает, что воздействие может происходить спустя долгое время после выброса химического вещества и в местах, удаленных от первоначального источника загрязнения.
Многие стойкие органические соединения также имеют тенденцию накапливаться в биоте, а это означает, что значительное вторичное воздействие может происходить в результате употребления в пищу продуктов с более высоких уровней пищевой цепи, таких как рыба, мясо и молочные продукты.В этом наборе инструментов также представлена информация, относящаяся к СОЗ.
Летучие органические соединения или ЛОС — это еще одна категория, которая частично совпадает с другими группами, описанными в этом наборе инструментов. Подобно СОЗ, ЛОС определяются физико-химическим свойством, которое определяет уникальную судьбу, условия переноса и воздействия — высокое давление пара при комнатной температуре. Из-за своей высокой летучести ЛОС являются обычными загрязнителями воздуха как на открытом воздухе, так и внутри помещений.
ЛОС можно далее классифицировать по температуре кипения как очень летучие органические соединения (ЛОС ЛОС Например, пропан и бутан.Температура кипения от <0 до 50–100 ° C. См. Ссылку: https://www.epa.gov/iaq/voc2.html#classifications) и полулетучие органические соединения (SVOC SVOC Например, ДДТ, фталаты и антипирены. Температура кипения от 240–260 до 380 –400 ° C. См. Ссылку: https://www.epa.gov/iaq/voc2.html#classifications). Некоторые вещества, включая ДДТ, хлордан и ПХД, классифицируются как как SVOC, так и как СОЗ. В этом модуле также представлена информация, относящаяся к летучим органическим соединениям.
Диоксины, фураны и ПХБ
Полихлорированные дибензодиоксины (ПХДД) и фураны (ПХДФ) и полихлорированные бифенилы (ПХД) являются примерами стойких органических загрязнителей (СОЗ).
Диоксины, фураны и ПХБ имеют аналогичную основную структуру из двух 6-углеродных колец с различными заместителями хлора. Однако термин «диоксин» может быть несколько неоднозначным, поскольку этот термин используется для описания различных групп химических веществ, а также одного химического вещества, в частности. «Диоксины» обычно относятся к группе из семи ПХДД, десяти ПХДФ и двенадцати «диоксиноподобных» ПХБ, которые сгруппированы вместе на основе сходных структурных характеристик и механизмов действия. Конкретный конгенер ПХДД 2,3,7,8-ТХДД является наиболее изученным диоксином и поэтому часто упоминается просто как «диоксин».
ПХДД и ПХДФ не являются химическими веществами, производимыми или производимыми в коммерческих целях; скорее, они выбрасываются в окружающую среду как побочный продукт сгорания (горения) или других промышленных процессов. С другой стороны, печатные платы производились до 1979 года для использования во многих коммерческих и промышленных приложениях. Огнестойкие и изолирующие свойства этих соединений были использованы для использования в трансформаторах, конденсаторах, изоляции кабелей и другом электрическом оборудовании, гидравлических системах, пластмассах, красках и безуглеродной копировальной бумаге, среди прочего.До того, как они были запрещены, ПХД выбрасывались в окружающую среду во время производства и использования и по-прежнему выбрасываются в окружающую среду через плохо обслуживаемые свалки для опасных отходов или утечки из старого оборудования.
Физико-химические свойства
ПХДД, ПХДФ и ПХД — стойкие галогенированные ароматические углеводороды, основная структура которых состоит из двух соединенных хлорированных 6-углеродных колец. ПХБ имеют от 2 до 10 атомов хлора, связанных с общим количеством 12 атомов углерода, что дает 209 различных родственных соединений.ПХДД и ПХДФ отличаются от ПХД тем, что два углеродных кольца соединены вместе атомами кислорода, создавая трехкольцевую структуру. Атомы хлора связываются с оставшимися доступными атомами углерода с образованием 75 различных конгенеров ПХДД и 135 конгенеров ПХДФ. Из 75 ПХДД 7 из них (включая 2,3,7,8-ТХДД) особенно токсичны.
Десять из 135 конгенеров ПХДФ и 12 из 209 ПХД обладают «диоксиноподобными» свойствами. Количество и конфигурация соединений хлора играют большую роль в определении свойств каждого конгенера ПХДД, ПХДФ и ПХД.Например, температура плавления и липофильность повышаются с увеличением степени хлорирования, а давление пара и растворимость в воде снижаются.
| Примеры хлорорганических структур: диоксины, фураны и ПХД | ||
|---|---|---|
| PCDD | ПХДФ | печатных плат |
В таблице ниже представлены основные физико-химические факторы, которые могут повлиять на разделение и судьбу диоксинов, фуранов и ПХД в окружающей среде.Для получения информации о конкретных химических значениях обратитесь к ресурсам, приведенным во введении к этому модулю.
| Имущество | Судьба и транспортные последствия |
|---|---|
| Диоксины и фураны | |
| Давление паров при 25 ° C (атм) | Низкое давление паров указывает на то, что ПХДД и ПХДФ не улетучиваются из чистого органического состояния. |
| Константа закона Генри | Константы закона Генри указывают на то, что улетучивание ПХДД и ПХДФ из воды в воздух может быть важным механизмом переноса при более высоких температурах, что может привести к сезонному улетучиванию / осаждению и переносу по воздуху на большие расстояния. |
| Растворимость в воде (мг / л) | Низкая растворимость в воде означает, что ПХДД и ПХДФ плохо растворяются в воде. |
| Коэффициент разделения октанол-вода (логарифмическое значение) | Умеренно-высокие логарифмические коэффициенты распределения октанола и воды указывают на то, что ПХДД и ПХДФ будут преимущественно разделяться на органические вещества в почвах и отложениях, биоаккумулироваться и биоусиление в водных экосистемах и, возможно, в наземных экосистемах и в организме человека. |
| Коэффициент распределения октанол-воздух (логарифм) | Высокие логарифмические коэффициенты распределения октанола в воздухе указывают на то, что ПХДД и ПХДФ будут преимущественно разделяться на органические вещества из воздуха и биоаккумулироваться и биоусилаться в наземных экосистемах и в организме человека. |
| Резюме: На основании физико-химических свойств ПХДД и ПХДФ ожидается, что эти соединения будут накапливаться в почвах, отложениях, а также в водной и наземной биоте.Эти вещества могут улетучиваться из воды, что приведет к сорбции органическими веществами и испарению с воздухом, особенно в теплую погоду. Ожидаемый сезонный цикл улетучивания / осаждения этих химикатов, как ожидается, приведет к переносу на большие расстояния в воздухе и окончательному осаждению на полюсах. | |
| Печатные платы | |
| Давление паров при 25 ° C (атм) | Давление паров от низкого до среднего указывает на то, что некоторые ПХБ не будут легко улетучиваться из чистого органического состояния, в то время как другие, как ожидается, будут полулетучими. |
| Константа закона Генри | Константы закона Генри указывают на то, что ожидается, что улетучивание ПХБ из воды в воздух будет важным механизмом переноса, который может привести к сезонному улетучиванию / отложению и переносу по воздуху на большие расстояния. |
| Растворимость в воде (мг / л) | Низкая растворимость в воде означает, что ПХБ не растворяются в воде. |
| Коэффициент разделения октанол-вода (логарифмическое значение) | Умеренные логарифмические коэффициенты распределения октанола и воды указывают на то, что ПХД будут преимущественно разделяться на органические вещества в почвах и отложениях, биоаккумулироваться и биоусилаться в водных экосистемах и, возможно, в наземных экосистемах и в организме человека. |
| Коэффициент распределения октанол-воздух (логарифм) | Умеренно-высокие логарифмические коэффициенты распределения октанола в воздухе указывают на то, что ПХДД и ПХДФ будут преимущественно разделяться на органические вещества из воздуха, а также биоаккумулироваться и биоусиление в наземных экосистемах и в организме человека. |
| Резюме: На основании физико-химических свойств ПХБ ожидается, что эти соединения будут накапливаться в почвах, отложениях, водной и наземной биоте.Эти вещества могут улетучиваться из воды и улетучиваться из чистой органической формы, что может привести к накоплению в воздухе и переносу на большие расстояния, особенно полулетучих ПХД. Ожидаемый сезонный цикл улетучивания / осаждения этих соединений, как ожидается, приведет к окончательному осаждению на полюсах. | |
Маршруты
Диоксины и ПХД повсеместно присутствуют в окружающей среде и легко распределяются в жировой ткани животных, что приводит к их накоплению в пищевой цепи.Люди в первую очередь подвергаются воздействию этих соединений при употреблении в пищу зараженных продуктов, таких как мясо, молочные продукты, рыба и моллюски. Внутриутробное воздействие и воздействие из-за проглатывания грудного молока также имеют место и являются путями воздействия, вызывающими озабоченность.
Для полулетучих ПХД также возможно ингаляционное воздействие. Однако относительно низкая летучесть диоксинов, фуранов и некоторых ПХД в типичных условиях окружающей среды предполагает, что прямое вдыхание может быть менее значительным путем воздействия.
Примечание. Набор инструментов Routes в EPA ExpoBox предоставляет дополнительную информацию и ресурсы, организованные по маршрутам.
СМИ
Диоксины, фураны и ПХБ часто обнаруживаются в отложениях и почвах. Они медленно разлагаются и имеют тенденцию накапливаться в живых организмах, поэтому их можно найти в биоте и продуктах питания, особенно в молочных, мясных и рыбных продуктах.
| СМИ | Источники диоксинов, фуранов и ПХД |
|---|---|
| Воздух |
|
| Вода |
|
| Почва |
|
| Продукты питания |
|
| Водная биота |
|
| Потребительские товары |
|
Примечание. Набор средств массовой информации EPA ExpoBox предоставляет дополнительную информацию и ресурсы, организованные средствами массовой информации.
Открытые группы
Фоновое воздействие повсеместных смесей диоксинов и ПХБ приводит к отягощению этих соединений в организме всех людей. Население в целом подвергается дальнейшему воздействию диоксинов и ПХД в результате приема зараженной пищи. Определенные группы населения могут подвергаться повышенному воздействию соединений из-за возраста, географического положения или поведения.
Эти группы населения включают развивающиеся зародыши, грудных младенцев, детей, человеческое и экологическое население, проживающее в определенных регионах, и некоторых профессиональных рабочих.
- Перенос в атмосфере на большие расстояния может привести к более высокому уровню загрязнения окружающей среды в некоторых регионах земного шара; люди, живущие в этих регионах, могут иметь более высокий уровень воздействия.
- Липофильная природа диоксинов и ПХБ способствует накоплению этих химических веществ в грудном молоке.Младенцы, находящиеся на грудном вскармливании, могут подвергаться воздействию химикатов через рот.
- Лица, потребляющие большое количество рыбы или водных млекопитающих (например, тюленей, китов), могут подвергаться воздействию диоксинов и ПХБ, особенно если рыба получена из загрязненных вод. Жирные куски говядины или другого мяса также могут содержать измеряемое загрязнение диоксином или ПХБ.
- Некоторые профессии могут привести к более высокому уровню воздействия на рабочих.
- Отходы ПХД часто маркируются как промышленные отходы и рассматриваются как опасные материалы.Люди, которые живут рядом или работают на свалках опасных отходов или на объектах сжигания опасных отходов с ПХД, могут подвергаться повышенному риску воздействия, особенно при отсутствии надлежащих мер контроля (ATSDR, 2000).
Примечание. В наборе инструментов EPA ExpoBox «Возрасты и популяции» есть дополнительная информация о конкретных группах населения и стадиях жизни.
Инструменты
Огнезащитные составы
Антипирены — это химические вещества или другие промышленные материалы, которые придают свойства, препятствующие распространению огня.Хотя некоторые огнестойкие органические соединения запрещены или добровольно прекращены производителями из-за проблем со здоровьем (например, многие полибромированные дифениловые эфиры [ПБДЭ] и полихлорированные бифенилы [ПХД]), эти соединения могут сохраняться в окружающей среде.
В огнестойких продуктах используется широкий спектр органических химикатов, но большинство из них можно классифицировать как галогенированные (т.е. функционализированные бромом или хлором), на основе фосфора, азота или как комбинации вышеупомянутых компонентов.Для включения огнестойких материалов в продукты используются два основных процесса: реактивный и аддитивный.
В то время как реактивные процессы образуют ковалентные связи между антипиреном и полимерной матрицей, которые эффективно блокируют большую часть огнестойкого химического вещества в продукте, аддитивные процессы не образуют таких связей и, следовательно, увеличивают возможность образования огнезащитного химического вещества. выщелачивать из продукта, на который он наносится.
Одним из основных механизмов, с помощью которого огнестойкие химические вещества (особенно галогенированные) придают огнестойкость, является гашение радикалов в газовой фазе, при котором огнестойкий материал термически разлагается и высвобождает химические радикалы, которые обладают высокой реакционной способностью с кислородом, тем самым уменьшает количество свободного кислорода, необходимого для процесса сгорания.
Результатом этого процесса является высвобождение некоторых атомов галогена из огнестойкого химического вещества и преобразование химического вещества из высокогалогенированных веществ в более низко-галогенированные родственные соединения.
Примеры структур, выбранных из ряда традиционных и новых огнестойких органических соединений, представлены ниже, чтобы продемонстрировать разнообразие соединений в этой группе.
Физико-химические свойства
В таблице ниже представлены основные физико-химические факторы, которые могут повлиять на разделение и судьбу некоторых антипиренов в окружающей среде.Для получения информации о конкретных химических значениях обратитесь к ресурсам, приведенным в Обзоре классов химикатов.
| Имущество | Судьба и транспортные последствия |
|---|---|
| Галогенированные (бромированные) антипирены | |
| Давление паров при 25 ° C (атм) | Низкое давление паров указывает на то, что BFR не улетучиваются из чистого органического состояния. Давление паров снижается с увеличением степени галогенирования. |
| Константа закона Генри | Константа закона Генри для BFR подтверждает низкое давление пара, что указывает на низкую летучесть. |
| Растворимость в воде (мг / л) | BFR обычно имеют низкую растворимость в воде, что означает, что они вряд ли растворятся в поверхностных водах. |
| Коэффициент разделения октанол-вода (логарифмическое значение) | Высокие значения K ow BFR указывают на высокий потенциал биоаккумуляции. |
| Коэффициент распределения октанол-воздух (логарифм) | High log K oa указывает на сильную склонность соединений поглощаться органическими веществами, такими как частицы почвы, пыль или растительность, а не оставаться в воздухе (US EPA, 2010). |
| Резюме: Традиционные бромированные антипирены очень стойкие в почве и отложениях и сорбируются органическими веществами в толще воды или в воздухе (т.э., пыль). Эти соединения обладают высоким потенциалом биоаккумуляции. | |
| Антипирены на основе фосфора (PFR) | |
| Давление паров при 25 ° C (атм) | Низкое давление пара указывает на то, что PFR не улетучиваются из чистого органического состояния, где они существуют в жидком виде. В случае аэрозольной формы PFR, вероятно, будут существовать в паровой фазе. |
| Константа закона Генри | В то время как давление пара указывает на то, что испарение из сухой почвы маловероятно, умеренные константы закона Генри для большинства PFR указывают на то, что улетучивание из влажной почвы может происходить для некоторых PFR. |
| Растворимость в воде (мг / л) | Относительно низкая растворимость в воде большинства PFR указывает на то, что они плохо растворяются в воде и имеют высокий потенциал адсорбции почвы. |
| Коэффициент разделения октанол-вода (логарифмическое значение) | В то время как значения log K ow для PFR сильно различаются, большинство PFR имеют положительные значения log K ow , что позволяет предположить, что эти соединения будут преимущественно распределяться между органическими веществами в почвах и отложениях, а некоторые могут биоаккумулироваться и биоусилаться в водных экосистемах и, возможно, в наземных экосистемах и у человека. |
| Коэффициент распределения октанол-воздух (логарифм) | Хотя значения K oa не определены, давление пара указывает на то, что возможен перенос из органических сред (например, почвы) в воздух. |
| Резюме: Свойства различных PFR сильно различаются. PFR обычно плохо растворимы и липофильны и будут разделяться на почву, отложения или органические вещества, а не оставаться в воде или воздухе.Однако большинство PFR менее липофильны, чем бромированные FR, и существует широкий разброс в константах закона Генри и давлении паров, что указывает на то, что PFR могут возникать в любых типах сред (van der Veen and de Boer, 2012). | |
Маршруты
Воздействие антипиренов происходит в основном при вдыхании или проглатывании пыли. Еще одним источником воздействия являются продукты питания и вода, загрязненные антипиренами. Также может происходить контакт с загрязненной почвой и пылью в результате контакта с кожей.
| Маршрут | Потенциальные источники огнестойкого воздействия |
|---|---|
| Вдыхание |
|
| Прием внутрь |
|
| Кожный контакт |
|
Примечание. Набор инструментов маршрутов EPA ExpoBox предоставляет дополнительную информацию и ресурсы, организованные по маршрутам.
СМИ
ПБДЭ было измерено в воздухе помещений и на открытом воздухе, в воде и отложениях, а также в почве. Их также нашли в домашней пыли. Огнезащитные составы широко используются в потребительских товарах, что делает среду внутри помещений особенно важной для этой группы соединений.
Открытые группы
Антипирены являются повсеместными загрязнителями окружающей среды, что приводит к их потенциальному воздействию на население в целом. Определенные группы населения могут подвергаться риску повышенного воздействия, например:
- Дети могут подвергаться воздействию высоких уровней запыленности в домашних условиях из-за того, что они проводят много времени на полу, а также из-за более высокого уровня контакта рук и рта.Кроме того, многие потребительские товары, предназначенные для детей, намеренно обрабатываются антипиренами, включая пижамы, пеленальные подушки и автомобильные сиденья.
- Рабочие, занимающиеся производством продукции и процессами утилизации продукции (переработка, сжигание, захоронение), могут подвергаться воздействию огнезащитных химикатов, которые наносятся на многочисленные потребительские товары.
- Пожарные и другой аварийный персонал, который может реагировать на пожары дома, на работе или в транспортных средствах, могут подвергаться высокому риску воздействия, поскольку антипирены выделяются по мере того, как материалы поддаются возгоранию.
Примечание. Набор инструментов EPA ExpoBox «Возрасты и популяции» включает дополнительную информацию о конкретных группах населения и образах жизни.
Инструменты
Углеводороды
Углеводороды содержат только водород и атом углерода в различных конфигурациях, включая цепи, разветвленные цепи и кольца. Большинство углеводородов попадает в одну из пяти структурных категорий, описанных в таблице ниже.
| Подкласс | Описание | Примеры структур | |
|---|---|---|---|
| n -алканы | Насыщенные неразветвленные углеводородные цепи | Метан, CH 4 | n -Гексан, C 6 H 14 |
| Алканы разветвленные | Насыщенные разветвленные углеводородные цепи | Изобутан, C 4 H 10 | Неопентан, C 5 H 12 |
| Ненасыщенные и алициклические углеводороды | Ненасыщенные углеводородные цепи и углеводородные кольца | 1,3-Бутадиен, C 4 H 6 | Циклогексан, C 6 H 12 |
| Алкилированные бензолы | Шестиуглеродные ароматические кольца с группами заместителей в углеводородной цепи | Толуол, C 7 H 8 | Этилбензол, C 8 H 10 |
| Полициклические ароматические углеводороды и родственные соединения | Множественные шестиуглеродные ароматические кольца, иногда в сочетании с другими углеводородными кольцевыми структурами | Бензо (а) пирен, C 20 H 12 | Аценафтен, C 12 H 10 |
Некоторые углеводороды получают из нефтяных дистиллятов; другие (e.г., сосновое масло и скипидар) получают из древесины. В качестве компонентов топлива используются многие углеводороды, включая метан, бензол, толуол, этилбензол и ксилолы. Одна конкретная группа углеводородов, представляющая в настоящее время интерес для специалистов по оценке воздействия, — это полициклические ароматические углеводороды полициклические ароматические углеводороды Группа органических химикатов. (Для получения дополнительной информации см. Профили токсичности https://www.epa.gov/region5superfund/ecology/html/toxprofiles.htm#pahs.) (ПАУ), которые содержат кольца атомов углерода с чередующимися одинарными и двойными связями между атомами углерода.
ПАУ содержатся в каменноугольной смоле и сырой нефти и иногда используются в лекарствах или при производстве красителей, пластмасс и пестицидов (ATSDR, 1990).
Коммерческое производство ПАУ минимально; большинство ПАУ, обнаруженных в окружающей среде, образуются в результате неполного сгорания ископаемого топлива или древесины. ПАУ могут образовываться в результате сжигания любого органического материала, включая курение сигарет и приготовление на гриле мяса, овощей или других продуктов.
Некоторые ПАУ возникают как побочные продукты таких промышленных процессов, как производство и переработка металлов.ПАУ также могут выделяться в результате естественных процессов, таких как извержения вулканов или лесные пожары. Поскольку ПАУ образуются и высвобождаются случайно, а не намеренно, они обычно встречаются в смесях (ATSDR, 1990).
Физико-химические свойства
В общем, углеводородные кольца без чередующихся одинарных и двойных связей и углеводородных цепей называются алициклическими или алифатическими углеводородами соответственно, а углеводородные кольца с чередующимися одинарными и двойными связями называются ароматическими углеводородами.Количество двойных или одинарных связей определяет, являются ли алифатические углеводороды «насыщенными» по отношению к водороду или «ненасыщенными» из-за наличия двойных связей.
Насыщенные углеводороды более активны, чем ненасыщенные углеводороды, и их легче расщеплять. С другой стороны, структура связей в кольцевой структуре ПАУ приводит к химическому свойству, называемому ароматичностью, которое придает стабильность этим соединениям.
В таблице ниже представлены основные физико-химические факторы, которые могут повлиять на распределение и судьбу отдельных алифатических и ароматических углеводородов в окружающей среде.Для получения информации о конкретных химических значениях обратитесь к ресурсам, приведенным во введении к этому модулю.
| Имущество | Судьба и транспортные последствия |
|---|---|
| Алифатические углеводороды | |
| Давление паров при 25 ° C (атм) | Давление пара алифатических углеводородов увеличивается с уменьшением длины цепи, что позволяет предположить, что низкомолекулярные углеводороды легко улетучиваются из чистого органического состояния, в то время как высокомолекулярные соединения будут демонстрировать низкую летучесть. |
| Константа закона Генри | H увеличивается с увеличением размера молекулы углеводорода, однако большинство неароматических углеводородов имеют константу закона Генри около 10 или больше. Высокая константа указывает на склонность к улетучиванию, подразумевая, что соединения легко переходят из воды в воздух. |
| Растворимость в воде (мг / л) | По мере увеличения количества атомов углерода в цепи (т.е.е. увеличивается молекулярная масса) растворимость имеет тенденцию к снижению; разветвление также снижает растворимость. Алифатические углеводороды менее растворимы, чем ароматические углеводороды аналогичной молекулярной массы. Поскольку углеводороды обычно встречаются в смесях, растворимость может сильно варьироваться в зависимости от состава выделяющейся углеводородной фракции. |
| Коэффициент разделения октанол-вода (логарифмическое значение) | Гидрофобность алифатических углеводородов обычно увеличивается с увеличением длины цепи; более крупные углеводороды обладают более высоким сорбционным потенциалом и с большей вероятностью биоаккумулируются. |
| Коэффициент распределения октанол-воздух (логарифм) | Как и большинство других свойств, K oa также увеличивается с увеличением молекулярного объема, подразумевая, что высокомолекулярные алифатические углеводороды (более длинная цепь) с меньшей вероятностью разделятся с воздухом и с большей вероятностью останутся сорбированными почвой, отложениями и т. Д. или биота, чем углеводороды с более короткой цепью. |
| Резюме: Более легкие алифатические углеводороды с меньшей длиной цепи обладают более высокой летучестью и растворимостью в воде и с меньшей вероятностью сорбируются частицами или отложениями, чем более крупные углеводороды с более длинной цепью.Таким образом, поведение углеводородной смеси будет сильно варьироваться в зависимости от состава смеси и будет меняться со временем, поскольку более легкие компоненты будут более легко улетучиваться и мигрировать через почвы, в то время как более тяжелые компоненты будут оседать в почве, сорбироваться с органическими веществами и сохраняться при сайт выпуска. | |
| Ароматические углеводороды | |
| Давление паров при 25 ° C (атм) | Давление пара обратно пропорционально размеру ПАУ.ПАУ с большим количеством ароматических колец имеют более высокое давление пара и с большей вероятностью сорбируются твердыми частицами в воздухе, чем ПАУ меньшего размера. |
| Константа закона Генри | Константы закона Генри уменьшаются с увеличением молекулярной массы ПАУ, предполагая, что ПАУ с низкой молекулярной массой легко улетучиваются из воды в воздух, тогда как ПАУ с более высокой молекулярной массой остаются в воде. |
| Растворимость в воде (мг / л) | ПАУ обладают низкой растворимостью в воде, что означает, что они в основном сорбируются частицами, взвешенными в толще воды или оседающими в осадке. |
| Коэффициент разделения октанол-вода (логарифмическое значение) | Высокие значения K ow означают склонность к переходу от воды к липидам, предполагая возможность биоаккумуляции и биоконцентрации в водных системах. |
| Коэффициент распределения октанол-воздух (логарифм) | Высокие значения log K или означают, что ПАУ в атмосфере будут сорбироваться твердыми частицами |
| Резюме: Хотя выброс ПАУ в воздух наиболее вероятен, время пребывания в воздухе ограничено.Ожидается, что ПАУ разделятся на почву или отложения. | |
Маршруты
Воздействие углеводородов чаще всего происходит в результате непреднамеренного проглатывания или вдыхания. Также может произойти воздействие от кожного контакта.
| Маршрут | Потенциальные источники воздействия углеводородов |
|---|---|
| Вдыхание |
|
| Прием внутрь | Проглатывание углеводородов происходит, поскольку эти соединения являются обычным загрязнителем в обработанных пищевых продуктах, особенно в пищевых продуктах, приготовленных на гриле или копчении.ПАУ также могут присутствовать в необработанных пищевых продуктах, таких как фрукты и овощи, которые выращиваются в среде с загрязненной почвой или воздухом.
|
| Кожный контакт | Воздействие на кожу может происходить через контакт с загрязненной почвой или водой, или с антропогенными поверхностями, такими как асфальтовые дороги или поверхности из каменноугольной смолы.
|
Примечание. Набор инструментов маршрутов EPA ExpoBox предоставляет дополнительную информацию и ресурсы, организованные по маршрутам.
СМИ
Углеводороды являются обычными загрязнителями во многих средах окружающей среды, включая воздух, воду и почву.
| СМИ | Источники углеводородов |
|---|---|
| Воздух |
|
| Вода |
|
| Почва | Основным источником углеводородов в почвах являются атмосферные осадки.
|
| Потребительские товары | Углеводороды содержатся во многих потребительских товарах (например, в бензине и других видах топлива, полиролях для мебели, бытовых чистящих средствах и пропеллентах). |
Примечание. Набор средств массовой информации EPA ExpoBox предоставляет дополнительную информацию и ресурсы, организованные средствами массовой информации.
Открытые группы
Углеводороды, особенно ПАУ, повсеместно присутствуют в окружающей среде, и население в целом может подвергаться воздействию как в помещениях, так и вне помещений. Определенные группы населения подвержены более высокому риску воздействия, чем население в целом:
- Курильщики сигарет или люди, которые живут или работают в непосредственной близости от курильщиков, могут подвергаться воздействию ПАУ через вдыхание дыма.
- Поскольку ПАУ являются обычным загрязнителем выхлопных газов транспортных средств, городское население может подвергаться большему воздействию, чем сельское население; однако сельское население может подвергаться высокому воздействию дизельного топлива, используемого в сельскохозяйственном оборудовании или грузовиках, которое может быть менее эффективным при сжигании из-за более старшего возраста, чем некоторые транспортные средства в городских районах.
- Определенные профессии могут привести к высокому воздействию ПАУ, в том числе, помимо прочего: механики, строители, работающие с тротуарами, дорогами или крышами, рабочие коммунальных служб, подвергающиеся воздействию креозота, шахтеры или работники нефтеперерабатывающего завода, сталелитейное производство и алюминий. рабочие.
Примечание. В наборе инструментов EPA ExpoBox «Возрасты и популяции» есть дополнительная информация о конкретных группах населения и стадиях жизни.
Инструменты
Перфторированные соединения (ПФУ)
Перфторированные соединения (ПФС) содержат углеродную цепь с атомами фтора, присоединенными вместо атомов водорода, и одним или несколькими атомами или функциональными группами, присоединенными к концу. Эти соединения являются синтетическими и используются во множестве производственных и промышленных применений, включая огнестойкость и антипригарные поверхности.Широкий спектр потребительских товаров содержит различные уровни ПФУ.
Эти химические вещества использовались в течение многих десятилетий в продуктах, которые устойчивы к маслам, жирам и жидкостям на водной основе или отталкивают их. Сюда входят продукты, рекламируемые как устойчивые к пятнам или антипригарные, такие как посуда, ковры, мягкая мебель или другие ткани, а также не рекламируемые продукты, обладающие репеллентными свойствами, такие как пакеты для попкорна для микроволновой печи и упаковка для пищевых продуктов.
| Пример структур PFC | ||
|---|---|---|
| Фтортеломерный спирт 8: 2 (8: 2 FTOH) | перфтороктановая кислота (PFOA) | перфтороктансульфоновая кислота (ПФОС) |
Физико-химические свойства
ПФУ обычно устойчивы к дальнейшей деградации в окружающей среде или в биоте (Olsen et al., 2007; Харада и др., 2004). Связи углерод-фтор, характерные для ПФУ, очень прочные и стабильные на воздухе при высоких температурах; плохо разлагаются сильными кислотами, щелочами или окислителями; и обычно не подвергаются фотолизу (Lau et al., 2007).
В целом, продолжительность жизни длинноцепочечных ПФУ (ДЦПФУ) (т. Е. 8 или более атомов углерода) в атмосфере составляет от нескольких дней до недель в большинстве атмосферных условий (Lau et al., 2007). Соединения имеют тенденцию разделяться с другими средами окружающей среды.Период полураспада в почве алкилатов от C6 до C11 составляет от 1 до 3 лет и увеличивается с увеличением длины цепи (Washington et al., 2010). Основываясь на физико-химических характеристиках этих соединений, ожидается, что период полураспада LCPFCs и прекурсоров в воде будет очень большим.
В таблице ниже приводится сводка основных физико-химических факторов, которые могут повлиять на разделение и судьбу отдельных ПФУ в окружающей среде. Для получения информации о конкретных химических значениях обратитесь к ресурсам, приведенным в Обзоре химического класса.
| Имущество | Судьба и транспортные последствия |
|---|---|
| Давление паров при 25 ° C (атм) | Давление пара изменяется в зависимости от длины алкильной цепи PFC. Низкое давление паров некоторых ПФУ способствует явлению атмосферного переноса на большие расстояния (LRAT). ПФУ остаются в парообразном состоянии в течение длительных периодов времени и легко перемещаются через атмосферу, что приводит к загрязнению ПФУ в районах, удаленных от источника выброса. |
| Растворимость в воде (мг / л) | Хотя ПФУ растворимы в жирах, они также умеренно растворимы в воде. Многие ПФУ представляют собой кислоты, которые диссоциируют в пресной воде, что увеличивает их растворимость. Это позволяет им оставаться в толще воды. |
| Коэффициент разделения октанол-вода (логарифмическое значение) | ПФУ специально разработаны, чтобы быть гидрофобными и олеофобными, что затрудняет определение значения K ow .Однако исследования биомониторинга показали тенденцию к разделению на органические фракции (биота), где они связываются с белками сыворотки крови, а не с жирами. ПФУ с более длинными алкильными цепями более склонны к биоаккумуляции и биоусилению, чем ПФУ с более короткими цепями. |
| Резюме: ПФУ — это уникальный тип соединений, который одновременно гидрофобен и олеофобен. Их можно измерить в толще воды, но они также будут накапливаться в биоте.Они легко выходят из продуктов в воздух и могут распространяться на большие расстояния в атмосфере из-за низкого давления пара, что означает, что воздействие может происходить далеко от источника. | |
Маршруты
Проглатывание — это первичный путь воздействия ПФУ на человека, но также могут иметь место воздействия от вдыхания и контакта с кожей.
| Маршрут | Потенциальные источники воздействия ПФУ |
|---|---|
| Вдыхание |
|
| Прием внутрь |
|
| Кожный контакт | Хотя воздействие ПФУ через кожу не считается основным путем воздействия, люди могут подвергаться воздействию через попадание через ковры или другие поверхности, такие как одежда. |
Примечание. Набор инструментов маршрутов EPA ExpoBox предоставляет дополнительную информацию и ресурсы, организованные по маршрутам.
СМИ
LCPFC и их предшественники могут быть выпущены в различные среды среды с помощью множества сценариев. ПФУ могут выделяться на производственных площадках или в результате использования потребительских или промышленных товаров, а вторичные выбросы возможны на таких объектах, как очистные сооружения сточных вод (КОС) и свалки. Эти выбросы обычно приводят к прямому попаданию ПФУ в воду или воздух, однако также возможен выброс в почвы и отложения, особенно в сценариях вторичных выбросов, таких как внесение твердых биологических веществ на сельскохозяйственные поля.
| СМИ | Источники ПФУ |
|---|---|
| Воздух |
|
| Вода и осадок |
|
| Почва |
|
| Комнатная пыль |
|
Примечание. Набор средств массовой информации EPA ExpoBox предоставляет дополнительную информацию и ресурсы, организованные средствами массовой информации.
Открытые группы
ПФУ могут быть обнаружены в потребительских товарах, товарах для дома и упаковке пищевых продуктов, что приводит к их контакту с населением в целом. Однако некоторые группы населения могут подвергаться риску более высоких уровней воздействия:
- ПФУ стойкие в окружающей среде и могут подвергаться атмосферному переносу на большие расстояния, что приводит к более высоким уровням загрязнения окружающей среды в определенных регионах.Следовательно, люди, живущие в определенных регионах, могут подвергаться более высокому риску заражения.
- Липофильная природа ПФУ может способствовать накоплению этих химических веществ в грудном молоке. Младенцы, находящиеся на грудном вскармливании, могут подвергаться воздействию химикатов через рот. Кроме того, внутриутробное воздействие может происходить из-за передачи через пуповинную кровь. Также было показано, что детское питание и смеси содержат ПФУ, вероятно, из-за миграции из упаковки пищевых продуктов.
- Поскольку ПФУ биоаккумулируются, люди, потребляющие большое количество рыбы или водных млекопитающих (т.например, тюлень, кит), могут подвергаться воздействию высоких уровней ПФУ, особенно если рыба поступает из загрязненных вод. Жирные куски говядины или другого мяса также могут содержать измеряемое загрязнение ПФУ.
- Жители, проживающие вблизи определенных промышленных объектов, могут подвергаться риску заражения через загрязненную питьевую воду, почву или воздух.
Примечание. В наборе инструментов EPA ExpoBox «Возрасты и популяции» есть дополнительная информация о конкретных группах населения и стадиях жизни.
Инструменты
Фталаты и бисфенол А (BPA)
Фталаты содержат фенильное кольцо с двумя присоединенными и удлиненными ацетатными группами. Многие из этих составов представляют собой жидкости, которые используются для придания пластмасс большей гибкости и упругости, и называются пластификаторами. Фталаты с низким молекулярным весом (например, DMP, DEP, DBP, DIPB) можно найти в некоторых средствах личной гигиены и косметических продуктах (NRC, 2008). Высокомолекулярные фталаты (например, DEHP, DOP и DINP) используются в пластиковых трубках, материалах для упаковки и обработки пищевых продуктов, контейнерах, виниловых игрушках, виниловых напольных покрытиях и строительных изделиях.Ди (2-этилгексил) фталат (ДЭГФ) — наиболее широко используемый фталат.
Бисфенол А (BPA), хотя и не является фталатом, похож на фталаты в том, что он в основном используется для изготовления поликарбонатного пластика и эпоксидных смол, а также для упаковки пищевых продуктов и напитков. BPA также используется в термопечати, например в кассовых чеках, в качестве проявителя химического красителя. Хотя основным применением этого химического вещества, производимого в больших объемах, является поликарбонатный пластик и эпоксидные смолы, его использование в упаковке пищевых продуктов и квитанциях представляет собой значительные пути воздействия на человека (U.С. EPA, 2012).
| Примеры структур фталата и бисфенола А | ||
|---|---|---|
| Общая структура фталата | Бис (2-этилгексил) фталат (ДЭГФ) | Бисфенол А (BPA) |
Физико-химические свойства
В таблице ниже представлены основные физико-химические факторы, которые могут повлиять на разделение и судьбу отдельных фталатов в окружающей среде.Для получения информации о конкретных химических значениях обратитесь к ресурсам, приведенным в Обзоре химического класса.
| Имущество | Судьба и транспортные последствия |
|---|---|
| Давление паров при 25 ° C (атм) | Низкая летучесть большинства фталатов означает, что они не могут переходить из воды в воздух, время пребывания в воздухе ограничено. Низкая летучесть используется при использовании фталатов в пластмассовых изделиях, предназначенных для работы в условиях высоких температур, однако было показано, что фталаты улетучиваются в заметных количествах из таких продуктов, как краски, обивка и напольные покрытия, из-за большой площади поверхности. объемное соотношение этих видов использования. |
| Константа закона Генри | Фталаты имеют низкие константы закона Генри, которые соответствуют низкому давлению паров и подразумевают тенденцию к разделению на воду, а не на воздух. Константа закона Генри увеличивается с увеличением длины алкильной цепи фталата, что означает, что фталаты с большей молекулярной массой имеют более высокий потенциал испарения. |
| Растворимость в воде (мг / л) | Фталаты обладают низкой растворимостью в воде, однако фталаты настолько широко используются, что даже при низкой растворимости их можно обнаружить в значительных концентрациях в городских сточных водах, поверхностных водах и питьевой воде. |
| Коэффициент разделения октанол-вода (логарифмическое значение) | Высокие значения K ow означают, что фталаты являются гидрофобными и предпочтительно распределяются по биоте, почве или отложениям, а не остаются в толще воды. Это подразумевает вероятность биоаккумуляции и биоусиления у животных и людей. K ow увеличивается с увеличением длины алкильной цепи, что означает, что более крупные фталаты более гидрофобны. |
| Коэффициент распределения октанол-воздух (логарифм) | Высокие значения K или предполагают, что фталаты могут сорбироваться пылью или другими частицами в воздухе и оседать, а не оставаться в летучем состоянии. |
| Резюме: Фталаты чаще встречаются в воде или почве, чем в воздухе. Фталаты, которые выбрасываются в воздух или улетучиваются, сорбируются частицами и осаждаются в пыли; аналогично фталаты, попавшие в воду, могут сорбироваться органическими веществами или биоаккумулироваться в биоте. Фталаты с более крупной цепью обладают меньшей растворимостью в воздухе и воде, чем фталаты с более короткой цепью. Несмотря на это, фталаты все еще можно измерить в воздухе, потому что характер использования приводит к высоким уровням выброса в воздух. | |
Маршруты
Люди могут подвергаться воздействию фталатов при приеме внутрь, вдыхании и контакте с кожей на протяжении всей своей жизни, в том числе внутриутробно. (Latini, 2005).
ВоздействиеBPA может происходить при прямом контакте с продуктами, в которых используется BPA, такими как пластмассы, квитанции или другие термобумаги. Остаточный BPA может быть обнаружен в продуктах из переработанной бумаги из-за переработки термобумаги. БФА также можно найти в продуктах питания. Консервы могут быть загрязнены бисфенолом А, потому что он используется для покрытия банок.BPA также может выщелачиваться из пластиковых контейнеров в еду или питье, особенно если его нагреть в микроволновой печи или если пластик разрушился под воздействием высокой температуры.
Примечание. Набор инструментов Routes в EPA ExpoBox предоставляет дополнительную информацию и ресурсы, организованные по маршрутам.
СМИ
Фталаты и бисфенол А могут присутствовать в качестве загрязнителей в большинстве сред окружающей среды.
| СМИ | Источники фталатов и бисфенола А |
|---|---|
| Воздух |
|
| Вода |
|
| Почва |
|
| Продукты питания |
|
| Потребительские товары |
|
Примечание. Набор средств массовой информации EPA ExpoBox предоставляет дополнительную информацию и ресурсы, организованные средствами массовой информации.
Открытые группы
Фталаты и BPA повсеместно используются в потребительских и бытовых товарах, поскольку они используются в продуктах личной гигиены и во многих типах пластмасс. Таким образом, население в целом может подвергаться воздействию фталатов и бисфенола А по ряду различных сценариев:
- Воздействие фталатов может происходить при использовании некоторых лекарств или медицинских устройств (Wittassek et al., 2011). Эта подвергшаяся воздействию группа населения может вызывать особую озабоченность в зависимости от медицинских условий, при которых они используют фталатсодержащие устройства или принимают фталатсодержащие лекарства.
- Кроме того, некоторые исследования показали, что женщины подвержены более высокому воздействию фталатов, чем мужчины, из-за большого количества средств личной гигиены (мыла, шампуни, лосьоны, косметика), содержащих фталаты, и преобладания на рынке женщин (James-Todd et al., 2012).
- Дети также могут подвергаться более высокому воздействию, чем взрослые, из-за наличия фталатов в пластиковых детских игрушках и бутылках, а также из-за того, что дети чаще кладут предметы в рот, чем взрослые.Фактически, многие продукты, специально предназначенные для детей, которые кладут в рот (например, игрушки для прорезывания зубов, пустышки), сделаны из мягкого пластика, содержащего фталаты.
- Рабочие, работающие с квитанциями, например кассиры и официанты в ресторанах, могут подвергаться более высокому воздействию BPA, чем население в целом.
Примечание. Набор инструментов «Образ жизни и население» EPA ExpoBox содержит дополнительную информацию о конкретных группах населения и этапах жизни, включая рабочих, детей и женщин детородного возраста.
Инструменты
Летучие органические соединения (ЛОС)
Летучие органические соединения (ЛОС) — это подкатегория органических соединений с высоким давлением пара при комнатной температуре. Поскольку ЛОС — это категория, основанная на физико-химических свойствах, отдельные ЛОС также классифицируются как углеводороды, пестициды или другие органические соединения.
Многие из соединений, рассматриваемых в других частях этого модуля и модуля по пестицидам, являются ЛОС, включая ДДТ, хлордан, фталаты, полициклические ароматические углеводороды (ПАУ), полихлорированные бифенилы (ПХД) и некоторые другие.ЛОС можно разделить по степени летучести на три подгруппы:
- Очень летучие органические соединения (ЛОС ЛОС Например, пропан и бутан. Температура кипения от <0 до 50–100 ° C. См. Ссылку: https://www.epa.gov/iaq/voc2.html#classifications ), такие как бутан и пропан;
- Летучие органические соединения (ЛОС ЛОС Точка кипения от 50–100 до 240–260 ° C. См. Ссылку: https://www.epa.gov/iaq/voc2.html#classifications), такие как ацетон, толуол, бензол, тетрахлорэтилен [PCE], трихлорэтилен [TCE], винилхлорид и ксилол; и
- Полулетучие органические соединения (SVOC SVOC Например, ДДТ, фталаты и антипирены.Температура кипения от 240–260 до 380–400 ° C. См. Ссылку: https://www.epa.gov/iaq/voc2.html#classifications), например пестициды (например, ДДТ, хлордан), фталаты, полициклические ароматические углеводороды (ПАУ) и полихлорированные бифенилы (ПХД).
Высокая летучесть означает, что воздух является наиболее важной средой окружающей среды для этой группы соединений, и вдыхание, вероятно, будет вызывать опасения. Внутренние помещения представляют особый интерес, поскольку летучие органические соединения, как правило, выделяют газ из потребительских товаров, чистящих средств и строительных материалов, таких как краска для стен, обивка и пол.
Население в целом может подвергаться воздействию ЛОС через повседневные продукты и материалы. Определенные группы населения могут подвергаться повышенному риску воздействия из-за деятельности, которая приводит к более высоким выбросам ЛОС:
- Многие бытовые чистящие средства выделяют летучие органические соединения. Люди, занимающиеся уборкой (например, горничные, дворники) или члены домашнего хозяйства, отвечающие за уборку, могут подвергаться более высокому воздействию ЛОС.
- Краски, бензин и пестициды могут выделять ЛОС.Кроме того, многие новые строительные материалы, такие как ковры, коврики или новая мебель, могут выделять летучие органические соединения. Строители, маляры и ландшафтные дизайнеры могут подвергаться высокому профессиональному воздействию ЛОС.
Стойкие органические загрязнители (СОЗ)
Стойкие органические загрязнители (СОЗ), которые также называют стойкими, способными к биоаккумуляции и токсичными соединениями (СБТ, а иногда и просто химические вещества с СБ), представляют собой подкатегорию органических соединений, которые обладают высокой стойкостью благодаря своим физическим и химическим свойствам.
Стокгольмская конвенция о стойких органических загрязнителях (СОЗ) — это глобальный договор по ликвидации или сокращению выбросов СОЗ в окружающую среду. В Стокгольмской конвенции СОЗ определяются как органические соединения, которые широко распространяются в окружающей среде и остаются нетронутыми в течение длительных периодов времени, накапливаются в жировой ткани живых организмов и обнаруживаются в более высоких концентрациях на более высоких трофических уровнях и токсичны для люди и дикая природа. В настоящее время в Стокгольмской конвенции включены 22 СОЗ, включая те, которые были включены в первоначальную конвенцию в 2001 году, или новые, добавленные в ходе последующих встреч в 2009 и 2011 годах.
| Вещество | Категория |
|---|---|
| Альдрин | Пестицид |
| Хлордан | Пестицид |
| ДДТ | Пестицид |
| Дильдрин | Пестицид |
| Эндрин | Пестицид |
| Гептахлор | Пестицид |
| Гексахлорбензол | Пестицид, промышленный химикат, побочный продукт |
| Мирекс | Пестицид |
| Токсафен | Пестицид |
| Полихлорированные бифенилы (ПХБ) | Промышленная химия, побочный продукт |
| Полихлорированные дибензо-п-диоксины (ПХДД) | Побочный продукт |
| Полихлорированные дибензофураны (ПХДФ) | Побочный продукт |
| Альфа-гексахлорциклогексан | Пестицид, побочный продукт |
| Бета-гексахлорциклогексан | Пестицид, побочный продукт |
| Хлордекон | Пестицид |
| Гексабромдифенил | Промышленная химия |
| Гексабромдифениловый эфир и гептабромдифениловый эфир (коммерческий октабромдифениловый эфир) | Промышленная химия |
| линдан | Пестицид |
| Пентахлорбензол | Пестицид, промышленный химикат, побочный продукт |
| Перфтороктановая сульфоновая кислота, ее соли и перфтороктановый сульфонилфторид | Промышленная химия |
| Технический эндосульфан и родственные ему изомеры | Пестицид |
| Тетрабромдифениловый эфир и пентабромдифениловый эфир (коммерческий пентабромдифениловый эфир) | Промышленная химия |
Источник: Стокгольмская конвенция
Как органические, так и неорганические соединения могут быть стойкими, способными к биоаккумуляции и токсичными (или любой их комбинацией).Агентство по охране окружающей среды США (1999) определяет эти термины следующим образом:
- Стойкие соединения имеют период полураспада> 2 месяцев
- Биоаккумуляционные соединения имеют коэффициент биоаккумуляции или коэффициент биоконцентрации рыб ≥ 1000
- Токсичные соединения идентифицированы с использованием принятых исследований токсичности
Устойчивость вещества представляет интерес при оценке подверженности:
- Некоторые стойкие соединения могут переноситься из источников на большие расстояния.Например, элементарная ртуть, выбрасываемая в атмосферу в виде пара, может оставаться в атмосфере более года. Этот период времени позволяет ртути переноситься на большие расстояния от места выбросов в зависимости от погодных условий, прежде чем она попадет в почву, озера или другие поверхности.
- Некоторые стойкие соединения также могут подвергаться воздействию через много лет после попадания в окружающую среду. Например, ПХБ очень медленно разлагаются в окружающей среде; в результате утечка ПХД (например, из электрического трансформатора) может привести к повышению уровня ПХБ в почве в этом месте на долгие годы (или даже десятилетия).
Способность вещества к биоаккумуляции также имеет значение для оценки воздействия, особенно в сочетании с более длительной стойкостью:
- Когда вещество, которое биоаккумулируется, также является стойким в организме (и, следовательно, не метаболизируется и не разлагается быстро), концентрации этого вещества могут со временем увеличиваться, что может привести к большему риску воздействия.
- Биоаккумулирующиеся вещества также могут вызывать воздействие через пищевую цепочку.Например, диоксины и метилртуть в водной экосистеме могут поглощаться водорослями, которые затем потребляются мелкой рыбой, которая впоследствии может потребляться более крупной рыбой.
- Если уровни стойкого и биоаккумулируемого вещества повышаются с последовательными уровнями пищевой цепи, этот процесс иногда называют биомагнификацией. В этом случае организмы, находящиеся на вершине пищевой цепи, будут подвергаться большему воздействию, чем если бы они подвергались только непосредственному воздействию химического вещества в окружающей среде.
- Стойкие и способные к биоаккумуляции вещества могут вызывать беспокойство у людей, если люди потребляют зараженные организмы, находящиеся на вершине пищевой цепи, например, крупную рыбоядную рыбу.
Список литературы
ATSDR (Агентство регистрации токсичных веществ и заболеваний). (1990). Токсикологический профиль полициклических ароматических углеводородов (ПАУ). Атланта, Джорджия: Министерство здравоохранения и социальных служб США, Служба общественного здравоохранения.
ATSDR (Агентство регистрации токсичных веществ и заболеваний).(2000). Токсикологический профиль полихлорированных дифенилов (ПХД). Атланта, Джорджия: Министерство здравоохранения и социальных служб США, Служба общественного здравоохранения.
Boulanger, B; Варго, Дж; Schnoor, JL; Hornbuckle, KC. (2004). Обнаружение перфтороктановых поверхностно-активных веществ в воде Великих озер. Environ Sci Technol 38: 4064-4070.
Davis, KL; Aucoin, MD; Ларсен, Б.С.; Кайзер, Массачусетс; Hartten, AS. (2007). Транспортировка перфтороктаноата аммония в окружающей среде вблизи завода по производству фторполимеров.Chemosphere 67: 2011-2019.
Egeghy, PP; Лорбер, М. (2011). Оценка воздействия перфтороктанового сульфоната на американцев: сравнение расчетного поступления со значениями, полученными на основе данных NHANES. Журнал J Expo Sci Environ Epidemiol 21: 150-168.
Харада, К; Сайто, N; Иноуэ, К; Ёсинага, Т; Ватанабэ, Т; Сасаки, S; Камияма, S; Коидзуми, А. (2004). Влияние времени, пола и географических факторов на уровни перфтороктанового сульфоната и перфтороктаноата в сыворотке крови человека за последние 25 лет.Журнал «Оккупирующее здоровье» 46: 141-147.
Джеймс-Тодд, Т; Stahlhut, R; Микер, JD; Пауэлл, SG; Hauser, R; Хуанг, Т; Рич-Эдвардс, Дж. (2012). Концентрация метаболитов фталата в моче и диабет среди женщин в Национальном обследовании здоровья и питания (NHANES) 2001–2008 гг. Environ Health Perspect 120: 1307-1313.
Латини, Г. (2005). Мониторинг воздействия фталатов на людей [Обзор]. Clin Chim Acta 361: 20-29.
Lau, C; Анитол, К; Ходс, С; Проложенный; Pfahles-Hutchens, A; Сид, Дж.(2007). Перфторалкиловые кислоты: обзор результатов мониторинга и токсикологических исследований [Обзор]. Toxicol Sci 99: 366-394.
Накаяма, Сан-Франциско; Стрынар, MJ; Райнер, JL; Делинский, А.Д .; Линдстрем, AB. (2010). Определение перфторированных соединений в верхнем бассейне реки Миссисипи. Environ Sci Technol 44: 4103-4109.
NRC (Национальный исследовательский совет). (2008). Фталаты и оценка совокупного риска: предстоящая задача. Вашингтон, округ Колумбия: Национальная академия прессы.
Olsen, GW; Беррис, JM; Эресман, диджей; Froehlich, JW; Seacat, AM; Бутенхофф, JL; Zobel, LR.(2007). Период полувыведения из сыворотки перфтороктансульфоната, перфторгексансульфоната и перфтороктаноата у бывших рабочих фторхимического производства. Перспектива здоровья окружающей среды 115: 1298-1305.
Saito, N; Харада, К; Иноуэ, К; Сасаки, К; Ёсинага, Т; Коидзуми, А. (2004). Концентрация перфтороктаноата и перфтороктанового сульфоната в поверхностных водах в Японии. J. Оккупация здоровья 46: 49-59.
Sinclair, E; Каннан, К. (2006). Массовая загрузка и судьба перфторалкильных ПАВ в очистных сооружениях.Environ Sci Technol 40: 1408-1414.
Trudel, D; Горовиц, L; Wormuth, M; Шерингер, М; Казинс, ИТ; Hungerbuhler, К. (2008). Оценка воздействия на потребителей ПФОС и ПФОК. Анализ рисков 28: 251-269.
U.S. EPA (Агентство по охране окружающей среды США). (2010). Оценка воздействия полибромированных дифениловых эфиров (ПБДЭ) (окончательная). (EPA / 600 / R-08 / 086F). Вашингтон.
U.S. EPA (Агентство по охране окружающей среды США). (2012). Партнерство по оценке альтернатив бисфенолу А в термобумаге.Вашингтон.
Ван дер Вин, I; де Бур, Дж. (2012). Фосфорные антипирены: свойства, производство, распространение в окружающей среде, токсичность и анализ [Обзор].
 .ан
.ан
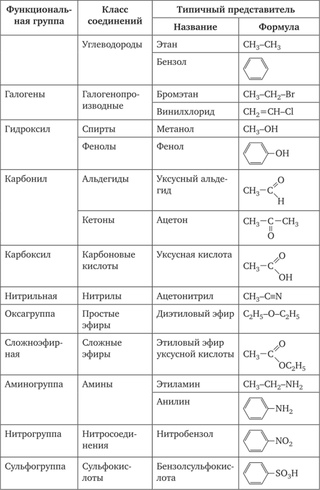 Радикальное замещение
Радикальное замещение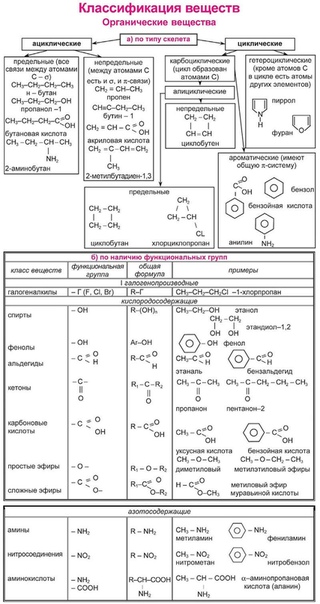 Окисление (полное – горение, неполное)
Окисление (полное – горение, неполное)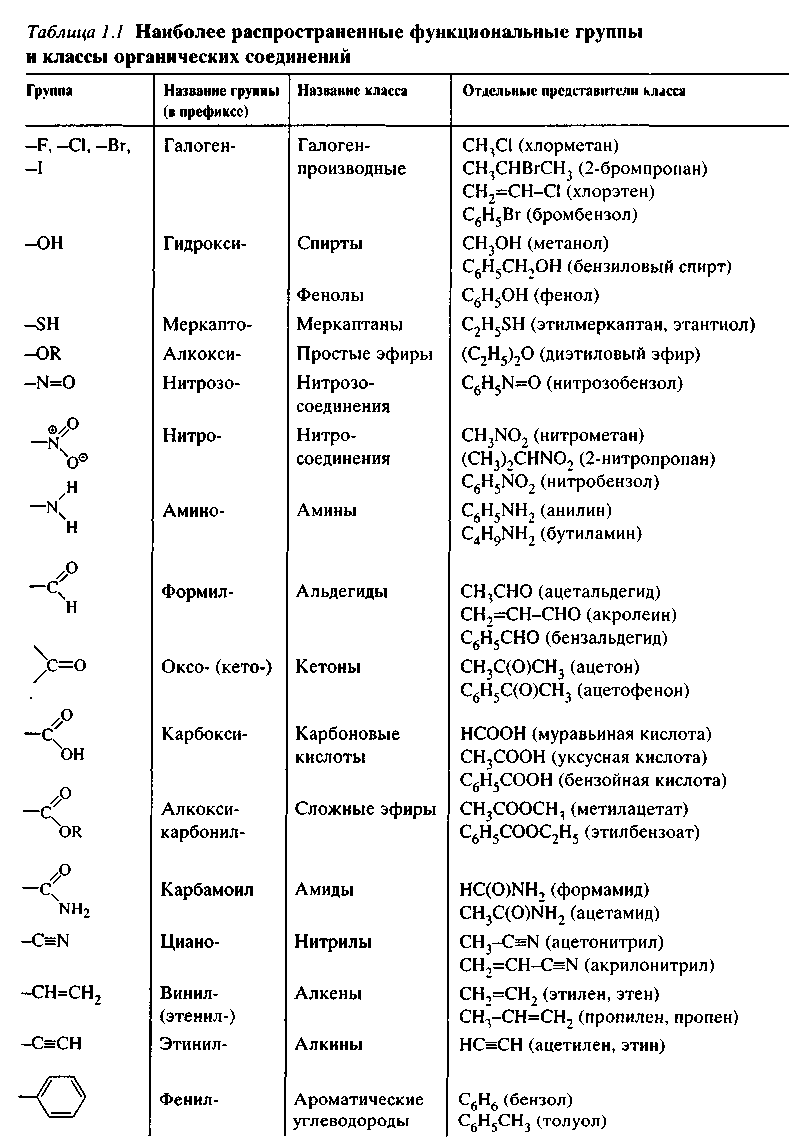
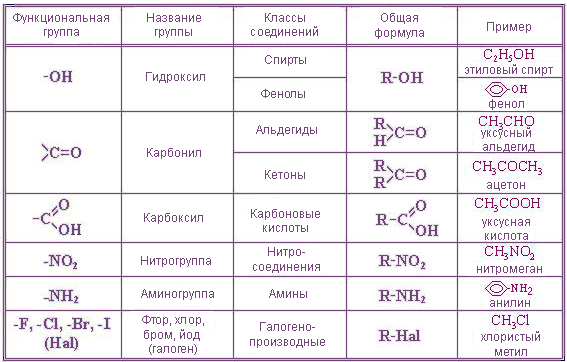 1sept.ru/articles/586588/
1sept.ru/articles/586588/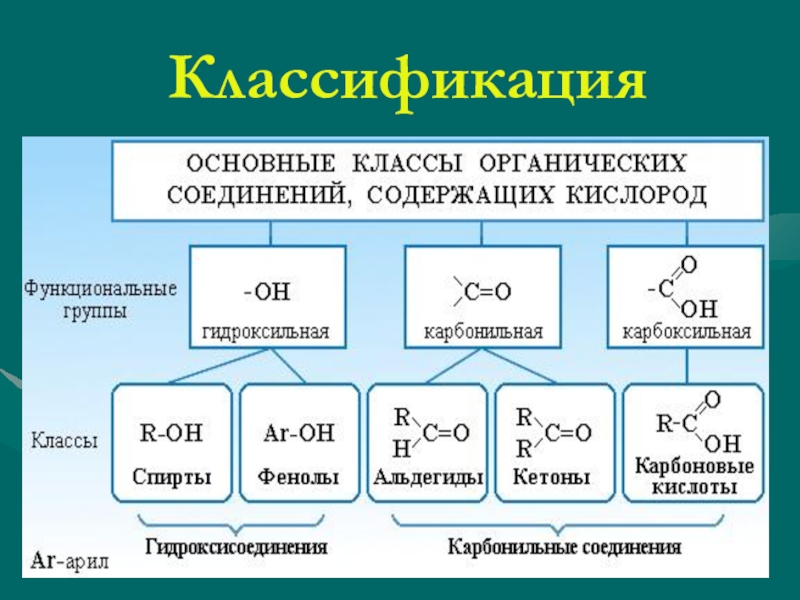 таблицу 2.3).
таблицу 2.3).
 При этом органические вещества подвергаются термокаталитической деструкции, в результате чего образуются битуминозные вещества, составляющие основную массу микронефти. Далее происходит «отжим» нефти за счет перепада давления и эмиграционный вынос микронефти в пласты-коллекторы, а по ним — в ловушки;
При этом органические вещества подвергаются термокаталитической деструкции, в результате чего образуются битуминозные вещества, составляющие основную массу микронефти. Далее происходит «отжим» нефти за счет перепада давления и эмиграционный вынос микронефти в пласты-коллекторы, а по ним — в ловушки;
 Не зажигайте его на полке или в замкнутом пространстве. Уберите с места все блокноты, бумаги и излишки химикатов. Соберите длинные волосы, свисающие украшения и свободную одежду и никогда не оставляйте открытое пламя без присмотра, пока оно горит.
Не зажигайте его на полке или в замкнутом пространстве. Уберите с места все блокноты, бумаги и излишки химикатов. Соберите длинные волосы, свисающие украшения и свободную одежду и никогда не оставляйте открытое пламя без присмотра, пока оно горит.

 Он имеет высокую долю белка по сравнению с холестерином и поэтому часто известен как «хороший» холестерин. ЛПВП переносит холестерин от клеток в печень, где он расщепляется или выводится из организма в виде отходов.
Он имеет высокую долю белка по сравнению с холестерином и поэтому часто известен как «хороший» холестерин. ЛПВП переносит холестерин от клеток в печень, где он расщепляется или выводится из организма в виде отходов.
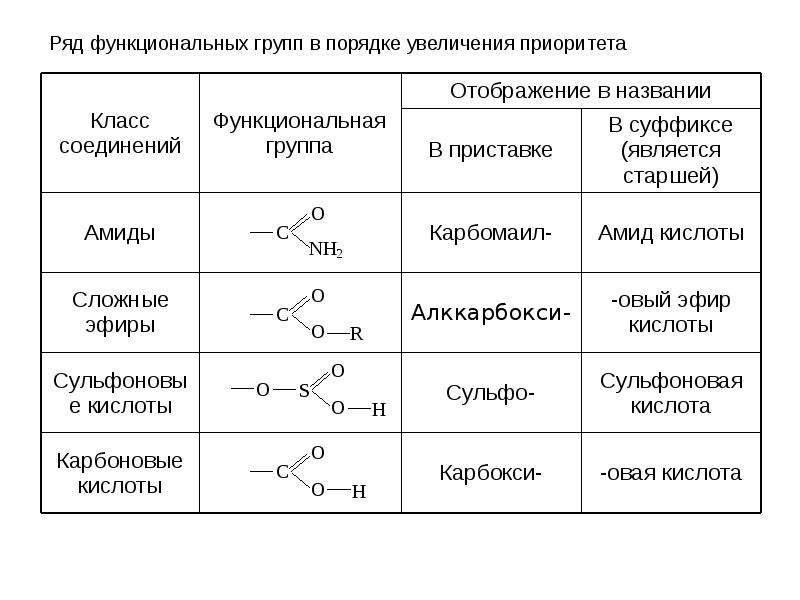 Как только спирт испарится, останется полупрозрачное пятно.
Как только спирт испарится, останется полупрозрачное пятно. Вторичные структуры и неструктурированные области цепи дополнительно складываются в глобулярную форму за счет гидрофобных взаимодействий (неполярные области, пытающиеся покинуть воду в клеточной среде) и электростатических взаимодействий (полярные и заряженные области, желающие взаимодействовать с водной средой). и друг друга).
Вторичные структуры и неструктурированные области цепи дополнительно складываются в глобулярную форму за счет гидрофобных взаимодействий (неполярные области, пытающиеся покинуть воду в клеточной среде) и электростатических взаимодействий (полярные и заряженные области, желающие взаимодействовать с водной средой). и друг друга).

 У людей с непереносимостью лактозы отсутствует фермент лактаза, который переваривает лактозу (молочный сахар). Лактоза предварительно переваривается путем добавления в молоко лактазы.
У людей с непереносимостью лактозы отсутствует фермент лактаза, который переваривает лактозу (молочный сахар). Лактоза предварительно переваривается путем добавления в молоко лактазы. 1 г из свежей пробы печени и поместите каждый в отдельный мерный цилиндр на 10 мл.
1 г из свежей пробы печени и поместите каждый в отдельный мерный цилиндр на 10 мл.

 Положите кусочки печени в мерный цилиндр с соответствующей маркировкой с перекисью водорода.
Положите кусочки печени в мерный цилиндр с соответствующей маркировкой с перекисью водорода. По мере того, как реакция выделяет тепло, фермент немного позже ускоряется и образует более крупные пузырьки с большей скоростью, но никогда не так быстро, как при комнатной температуре. Вареная печень не проявляет никакой реакции — пузырьки не образуются, так как ферменты денатурировались при кипячении. Их форма изменилась, и они вообще не могут катализировать реакцию.
По мере того, как реакция выделяет тепло, фермент немного позже ускоряется и образует более крупные пузырьки с большей скоростью, но никогда не так быстро, как при комнатной температуре. Вареная печень не проявляет никакой реакции — пузырьки не образуются, так как ферменты денатурировались при кипячении. Их форма изменилась, и они вообще не могут катализировать реакцию.