Таблица валентностей химических элементов. Таблица валентности. Стандартные, высшие, низшие, редкие валентности, исключения. Максимальная валентность, минимальная валентность. Версия для печати.Валентность химических элементов – это способность у атомов химических элементов образовывать некоторое число химических связей. Определяется числом электронов атома затраченых на образование химических связей с другим атомом. Справочно: Электронные формулы атомов химических элементов. Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы . Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как многие из неорганических веществ имеют немолекулярное строение, а органических — молекулярное..
|
Таблица валентности химических элементов
Понятие валентности химических элементов
Мерой валентности поэтому может быть число химических связей, образуемых данным атомом с другими атомами. Таким образом, в настоящее время под валентностью химического элемента обычно понимается его способность (в более узком смысле – мера его способности) к образованию химических связей (рис. 1). В представлении метода валентных связей числовое значение валентности соответствует числу ковалентных связей, которые образует атом.
Таким образом, в настоящее время под валентностью химического элемента обычно понимается его способность (в более узком смысле – мера его способности) к образованию химических связей (рис. 1). В представлении метода валентных связей числовое значение валентности соответствует числу ковалентных связей, которые образует атом.
Рис. 1. Схематическое образование молекул воды и аммиака.
Таблица валентности химических элементов
Первоначально за единицу валентности принимали валентность водорода. Валентность другого элемента при этом выражали числом атомов водорода, которые присоединяет к себе или замещает один атом этого элемента (т.н. валентность по водороду). Например, в соединениях состава HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трем, углерода – четырем.
Потом было решено, что определить валентность искомого элемента можно и по кислороду, валентность которого, как правило, равна двум. В этом случае валентность химического элемента рассчитывается как удвоенное число атомов кислорода, которое может присоединить один атом данного элемента (т.н. валентность по кислороду). Например, в соединениях составаN2O, CO, SiO2, SO3валентность по кислороду азота равна единице, углерода – двум, кремния – четырем, серы – шести.
В этом случае валентность химического элемента рассчитывается как удвоенное число атомов кислорода, которое может присоединить один атом данного элемента (т.н. валентность по кислороду). Например, в соединениях составаN2O, CO, SiO2, SO3валентность по кислороду азота равна единице, углерода – двум, кремния – четырем, серы – шести.
На деле оказалось, что у большинства химических элементов значения валентности в водородных и в кислородных соединениях различны: например, валентность серы по водороду равна двум (H2S), а по кислороду – шести (SO3). Кроме того, большинство элементов проявляют в своих соединениях различную валентность. Например, углерод образует два оксида: монооксид CO и диоксид CO2. В первом из которых валентность углерода равна II, а во втором – четырем. Откуда следует, что охарактеризовать валентность элемента каким-нибудь одним числом, как правило, нельзя.
Высшая и низшая валентности химических элементов
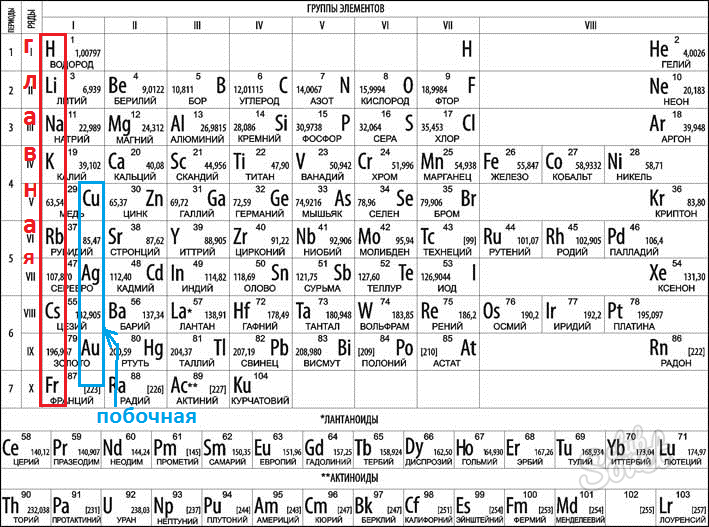
Значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.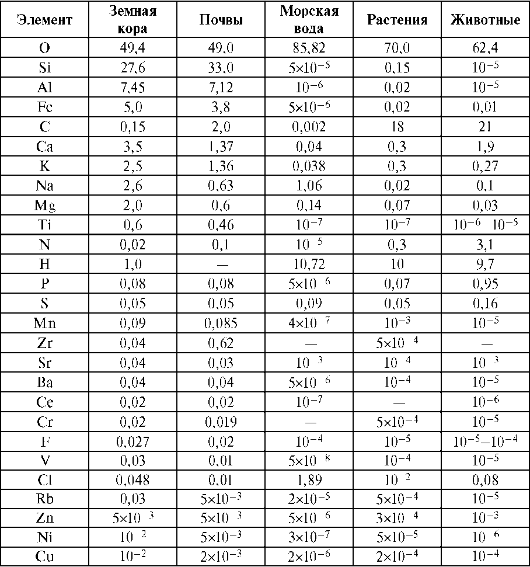 И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая – I.
И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая – I.
Существуют элементы с т.н. постоянной валентностью (металлы IA и IIA групп, алюминий водород, фтор, кислород), которые в своих соединениях проявляют единственную степень окисления, которая чаще всего совпадает с номером группы Периодической таблицы Д.И. Менделеева, где они расположены).
Элементы, для которых характерны несколько значений валентности (причем не всегда это высшая и низшая валентность) называются переменновалентными. Например, для серы характерны валентности II, IV и VI.
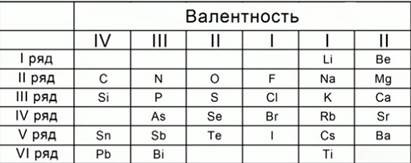
Для того, чтобы легче было запомнить сколько и какие валентности характерны для конкретного химического элемента используют таблицы валентности химических элементов, которые выглядят следующим образом:
|
Порядковый номер |
Русское / англ. |
Химический символ |
Валентность |
|
1 |
Водород / Hydrogen |
H |
I |
|
2 |
Гелий / Helium |
He |
0 |
|
3 |
Литий / Lithium |
Li |
I |
|
4 |
Бериллий / Beryllium |
Be |
II |
|
5 |
Бор / Boron |
B |
III |
|
6 |
Углерод / Carbon |
C |
II, IV |
|
7 |
Азот / Nitrogen |
N |
I, II, III, IV, V |
|
… |
|||
Примеры решения задач
Урок 25.
 классификация химических элементов.понятие о группах сходных элементов.периодический закон и периодическая таблица д. и. менделеева — Химия — 8 класс
классификация химических элементов.понятие о группах сходных элементов.периодический закон и периодическая таблица д. и. менделеева — Химия — 8 классКлассификация химических элементов. Понятие о группах сходных элементов. Периодический закон и периодическая таблица Д. И. Менделеева
Для ориентировки в мире окружающих нас веществ необходима их классификация. Попытки ее создать предпринимались с давних пор. Металлы уже с давних времён выделяли в отдельную группу. Михаил Васильевич Ломоносов говорил про металлы так: «Металлы – суть светлые тела, которые ковать можно». В этих словах заключено общее свойство металлов – ковкость. Если посмотреть на внешний вид металла, то мы заметим ещё одно сходство – все металлы обладают металлическим блеском. И ещё все металлы хорошо проводят тепло и электрический ток. Существуют физические свойства – общие для всех металлов, которые позволили их объединить под этим названием. А у неметаллов общих физических свойств нет. Общим в простых веществах-неметаллах является только то, что для них не характерны свойства металлов. На металлы и неметаллы стали разделять и химические элементы. Такая классификация была слишком условной, учёные не оставляли попыток боле точно классифицировать химические элементы.
Общим в простых веществах-неметаллах является только то, что для них не характерны свойства металлов. На металлы и неметаллы стали разделять и химические элементы. Такая классификация была слишком условной, учёные не оставляли попыток боле точно классифицировать химические элементы.
Дёберейнер Иоганн Вольфганг выявил сходство между химическими элементами, так называемое «Правило Триад»: элементы в триадах образуют сходные по составу со-единения и обладают сходными свойствами (например, общей формулой оксидов)
Li Na K;
Ca Sr Ba;
P As Sb;
S Se Te;
Cl Br I
В дальнейшем число элементов в триадах увеличилось до 4–5. Такие группы полу-чили своё название – естественные семейства химических элементов. К началу 60-х годов XIX века практически все известные химические элементы были объединены в естественные семейства.
Были предприняты и другие попытки создать единую систему химических элемен-тов. Александр Эмиль Бегье де Шанкуртуа Расположил химические элементы по спирали, пытаясь связать свойства с их атомной массой, Джон Александер Ньюлендс расположил элементы в таблицу по возрастанию их атомных масс и сформулировал закон Октав, Лотар-Юлиус Мейер рассмотрел общую систему химических элементов, расположив их по возрастанию атомных масс.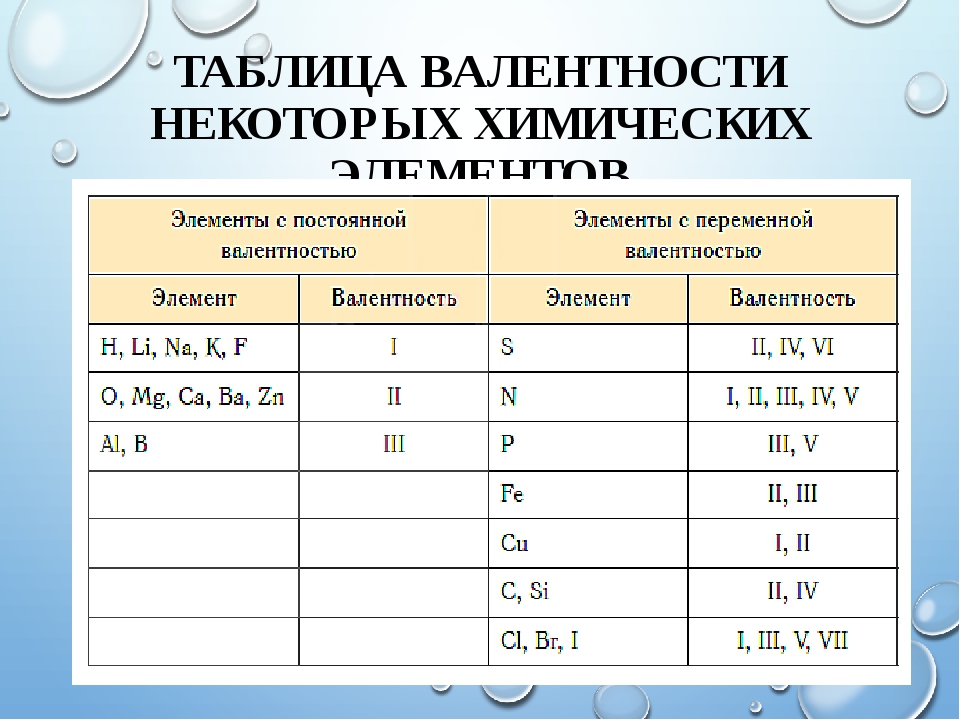
Все предложенные системы имели слишком много исключений из правил, в отли-чие от системы, созданной Дмитрием Ивановичем Менделеевым.
В основу системы были положены следующие подходы:
— расположение химических элементов в порядке возрастания их атомных масс;
учёт валентности и свойств образуемых ими соединений.
В таблице Менделеева были предусмотрены пробелы для ещё неоткрытых химиче-ских элементов. Открытие предсказанных химических элементов только подтвердило теорию Дмитрия Ивановича. С течением времени были изменены атомные массы некото-рых элементов, изменён порядок расположения элементов по сравнению с принципом возрастания атомной массы.
1869 год считается годом открытия периодического закона: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов».
Периодическую систему химических элементов можно представить в виде перио-дической таблицы. Каждый элемент занимает определённое место (клетку) и имеет свой порядковый (атомный) номер. Расположив химические элементы по возрастанию их атомных масс, Менделеев разделил эту последовательность на ряды (периоды), которые начинались щелочным металлом, а заканчивались инертным газом.
Расположив химические элементы по возрастанию их атомных масс, Менделеев разделил эту последовательность на ряды (периоды), которые начинались щелочным металлом, а заканчивались инертным газом.
Например, элементы третьего периода – 11Na 12Mg 13Al 14N 15P 16S 17Cl
В периодах постепенно увеличивается высшая валентность химических элементов, свойства металлов сменяются неметаллическими свойствами.
Вертикальные ряды химических элементов тоже получили своё название – группы.
Малые периоды состоят только из элементов главных подгрупп, символы химических элементов побочных подгрупп находятся сбоку от символов главных. Элементы одной подгруппы обладают сходными свойствами:
1. Одинаковое значение высшей валентности
2. Одинаковые общие формулы высших оксидов, летучих водородных соеди-нений, гидроксидов.
3. Сходство в свойствах простых веществ и соединениях химических элемен-тов.
Как определить валентность в соединениях. Валентные возможности атомов химических элементов
Одного химического элемента присоединять или замещать определённое количество атомов другого.
За единицу валентности принята валентность атома водорода , равная 1, то есть водород одновалентен. Поэтому валентность элемента указывает на то, со сколькими атомами водорода соединён один атом рассматриваемого элемента. Например, HCl , где хлор — одновалентен; H 2O , где кислород — двухвалентен; NH 3 , где азот — трёхвалентен.
Таблица элементов с постоянной валентностью.
Формулы веществ можно составлять по валентностям входящих в них элементов. И наоборот, зная валентности элементов, можно составить из них химическую формулу.
Алгоритм составления формул веществ по валентности.
1. Записать символы элементов.
2. Определить валентности входящих в формулу элементов.
3. Найти наименьшее общее кратное численных значений валентности.
4. Найти соотношения между атомами элементов путём деления найденного наименьшего общего кратного на соответствующие валентности элементов.
5. Записать индексы элементов в химической формуле.
Пример: составим химическую формулу оксида фосфора.
1. Запишем символы:
2. Определим валентности:
4. Найдём соотношения между атомами:
5. Запишем индексы:
Алгоритм определения валентности по формулам химических элементов.
1. Записать формулу химического соединения.
2. Обозначить известную валентность элементов.
3. Найти наименьшее общее кратное валентности и индекса.
4. Найти соотношение наименьшего общего кратного к количеству атомов второго элемента. Это и есть искомая валентность.
5. Сделать проверку путём перемножения валентности и индекса каждого элемента. Их произведения должны быть равны.
Пример: определим валентность элементов сульфида водорода.
1. Запишем формулу:
H 2 S
2. Обозначим известную валентность:
H 2 S
3. Найдём наименьшее общее кратное:
H 2 S
4. Найдём соотношение наименьшего общего кратного к количеству атомов серы :
H 2 S
5. Сделаем проверку.
Сделаем проверку.
В этой статье рассмотрим способы и поймем, как определить валентность элементов таблицы Менделеева.
В химии принято, что валентность химических элементов можно узнать по группе (колонке) в таблице Менделеева . В действительности не всегда валентность элемента соответствует номеру группы, но в большинстве случаев определенная валентность по такому методу даст правильный результат часто элементы, в зависимости от разных факторов, имеют не одну валентность.
За единицу валентности принята валентность атома водорода, равная 1, то есть водород одновалентен. Поэтому валентность элемента указывает на то, со сколькими атомами водорода соединён один атом рассматриваемого элемента. Например, HCl, где хлор — одновалентен; h3O, где кислород — двухвалентен; Nh4, где азот — трёхвалентен.
Как определить валентность по таблице Менделеева.
Таблица Менделеева содержит в себе химические элементы, которые размещены в ней по определенным принципам и законам. Каждый элемент стоит на месте, который определяется его характеристиками и свойствами и каждый элемент имеет свой номер. Горизонтальные линии называются периодами, которые возрастают от первой строки вниз. Если период состоит из двух рядов (что указано сбоку нумерацией), то такой период называется большим. Если он имеет только один ряд, то называется малым.
Каждый элемент стоит на месте, который определяется его характеристиками и свойствами и каждый элемент имеет свой номер. Горизонтальные линии называются периодами, которые возрастают от первой строки вниз. Если период состоит из двух рядов (что указано сбоку нумерацией), то такой период называется большим. Если он имеет только один ряд, то называется малым.
Кроме того, в таблице есть группы, которых всего восемь. Элементы размещаются в столбцах по вертикали. Здесь их размещение неравномерно — с одной стороны больше элементов (главная группа), с другой — меньше (побочная группа).
Валентностью называют способность атома образовывать некоторое количество химических связей с атомами других элементов. по таблице Менделеева поможет понять знание видов валентности.
Для элементов побочных подгрупп (а к ним относятся только металлы) валентность нужно запоминать, тем более что в большинстве случае она равна I, II, реже III. Также придется заучить валентности химических элементов, которые имеют более двух значений. Или постоянно держать под рукой таблицу валентности элементов .
Или постоянно держать под рукой таблицу валентности элементов .
Алгоритм определения валентности по формулам химических элементов.
1. Записать формулу химического соединения.
2. Обозначить известную валентность элементов.
3. Найти наименьшее общее кратное валентности и индекса.
4. Найти соотношение наименьшего общего кратного к количеству атомов второго элемента. Это и есть искомая валентность.
5. Сделать проверку путём перемножения валентности и индекса каждого элемента. Их произведения должны быть равны.
Пример: определим валентность элементов сульфида водорода.
1. Запишем формулу:
2. Обозначим известную валентность:
3. Найдём наименьшее общее кратное:
4. Найдём соотношение наименьшего общего кратного к количеству атомов серы :
5. Сделаем проверку:
Таблица характерных значений валентностей некоторых атомов химических соединений.
Элементы | Валентность | Примеры соединений |
H 2 , HF, Li 2 O, NaCl, KBr | ||
O, Mg, Ca, Sr, Ba, Zn | H 2 O, MgCl 2 , CaH 2 , SrBr 2 , BaO, ZnCl 2 | |
CO 2 , Ch5, SiO 2 , SiCl 4 | ||
CrCl 2 , CrCl 3 , CrO 3 | ||
H 2 S, SO 2 , SO3 | ||
NH 3 , NH 4 Cl, HNO 3 | ||
PH 3 , P 2 O 5 , H 3 PO 4 | ||
SnCl 2 , SnCl 4 , PbO, PbO 2 | ||
HCl, ClF 3 , BrF 5 , IF 7 |
Понятие «валентность» формировалось в химии с начала XIX века. Английский ученый Э. Франкленд обратил внимание, что все элементы могут образовывать с атомами других элементов только определенное количество связей. Он назвал это «соединительной силой». Позже немецкий ученый Ф. А. Кекуле изучал метан и пришел к выводу, что один атом углерода может присоединить в нормальных условиях только четыре атома водорода.
Английский ученый Э. Франкленд обратил внимание, что все элементы могут образовывать с атомами других элементов только определенное количество связей. Он назвал это «соединительной силой». Позже немецкий ученый Ф. А. Кекуле изучал метан и пришел к выводу, что один атом углерода может присоединить в нормальных условиях только четыре атома водорода.
Он назвал это основностью. Основность углерода равна четырем. То есть углерод может образовать четыре связи с другими элементами.
Вконтакте
Дальнейшее развитие понятие получило в работах Д. И. Менделеева. Дмитрий Иванович развивал учение о периодическом изменении свойств простых веществ. Соединительную силу он определял как способность элемента присоединять определенное количество атомов другого элемента.
Определение по таблице Менделеева
Таблица Менделеева позволяет с легкостью определять основность элементов. Для этого нужно уметь читать периодическую таблицу . Таблица по вертикали имеет восемь групп, а по горизонтали располагаются периоды. Если период состоит из двух рядов, то его называют большим, а если из одной — малым. Элементы по вертикали в столбцах, в группах распределены неравномерно. Валентность всегда обозначается римскими цифрами.
Если период состоит из двух рядов, то его называют большим, а если из одной — малым. Элементы по вертикали в столбцах, в группах распределены неравномерно. Валентность всегда обозначается римскими цифрами.
Чтобы определить валентность, нужно знать, какая она бывает. У металлов главных подгрупп она всегда постоянная, а у неметаллов и металлов побочных подгрупп может быть переменной.
Постоянная равна номеру группы. Переменная может быть высшей и низшей. Высшая переменная равна номеру группы, а низкая высчитывается по формуле: восемь минус номер группы. При определении нужно помнить:
- у водорода она равна I;
- у кислорода — II.
Если соединение имеет атом водорода или кислорода, то определить его валентность не составляет труда, особенно если перед нами гидрид или оксид.
Формула и алгоритм
Самая меньшая валентность у тех элементов, которые расположены правее и выше в таблице. И, наоборот, если элемент ниже и левее, то она будет выше. Чтобы определить ее, необходимо следовать универсальному алгоритму:
Чтобы определить ее, необходимо следовать универсальному алгоритму:
Пример: возьмем соединение аммиака — Nh4. Нам известно, что у атома водорода валентность постоянная и равна I. Умножаем I на 3 (количество атомов) — наименьшее кратное — 3. У азота в этой формуле индекс равен единице. Отсюда вывод: 3 делим на 1 и получаем, что у азота она равна IIII.
Величину по водороду и кислороду всегда определять легко. Сложнее, когда ее необходимо определять без них. Например, соединение SiCl4 . Как определить валентность элементов в этом случае? Хлор находится в 7 группе. Значит, его валентность либо 7, либо 1 (восемь минус номер группы). Кремний находится в четвертой группе, значит, его потенциал для образования связей равен четырем. Становится логично, что хлор проявляет в этой ситуации наименьшую валентность и она равна I.
В современных учебниках химии всегда есть таблица валентности химических элементов. Это существенно облегчает задачу учащимся. Тему изучают в восьмом классе — в курсе неорганической химии.
Современные представления
Современные представления о валентности базируются на строении атомов. Атом состоит из ядра и вращающихся на орбиталях электронах.
Само ядро состоит из протонов и нейтронов, которые определяют атомный вес. Для того чтобы вещество было стабильным, его энергетические уровни должны быть заполнены и иметь восемь электронов.
При взаимодействии элементы стремятся к стабильности и либо отдают свои неспаренные электроны, либо принимают их. Взаимодействие происходит по принципу «что легче» — отдать или принять электроны. От этого также зависит то, как изменяется валентность в таблице Менделеева. Количество неспаренных электронов на внешней энергетической орбитали равно номеру группы.
В качестве примера
Щелочной металл натрий находится в первой группе периодической системы Менделеева. Это значит, что у него один неспаренный электрон на внешнем энергетическом уровне. Хлор находится в седьмой группе. Это значит, что у хлора есть семь неспаренных электронов. Для завершения энергетического уровня хлору не хватает ровно одного электрона. Натрий отдает ему свой электрон и становится стабильным в соединении. Хлор же получает дополнительный электрон и тоже становится стабильным. В итоге появляется связь и прочное соединение — NaCl — знаменитая поваренная соль. Валентность хлора и натрия в этом случае будет равна 1.
Для завершения энергетического уровня хлору не хватает ровно одного электрона. Натрий отдает ему свой электрон и становится стабильным в соединении. Хлор же получает дополнительный электрон и тоже становится стабильным. В итоге появляется связь и прочное соединение — NaCl — знаменитая поваренная соль. Валентность хлора и натрия в этом случае будет равна 1.
В окружающем нас мире отдельные атомы химических элементов «сами по себе» существуют очень редко, как правило, атомы различных элементов соединяются друг с другом, образуя молекулы.
Если вместе соединяется несколько одинаковых атомов, получается простое вещество (современная наука знает порядка 500 простых веществ), но гораздо чаще вместе соединяются не одинаковые атомы, которые образуют сложные вещества (см. Атомно-молекулярная теория).
Примеры простых веществ: O 2 (кислород), O 3 (озон).
Примеры сложных веществ: NaCl (поваренная соль), H 2 SO 4 (серная кислота), H 2 O (вода).
Состав и строение молекул описывают при помощи химических формул, которая показывает какие химические элементы входят в состав вещества, а также сколько атомов конкретного химического элемента входит в молекулу вещества.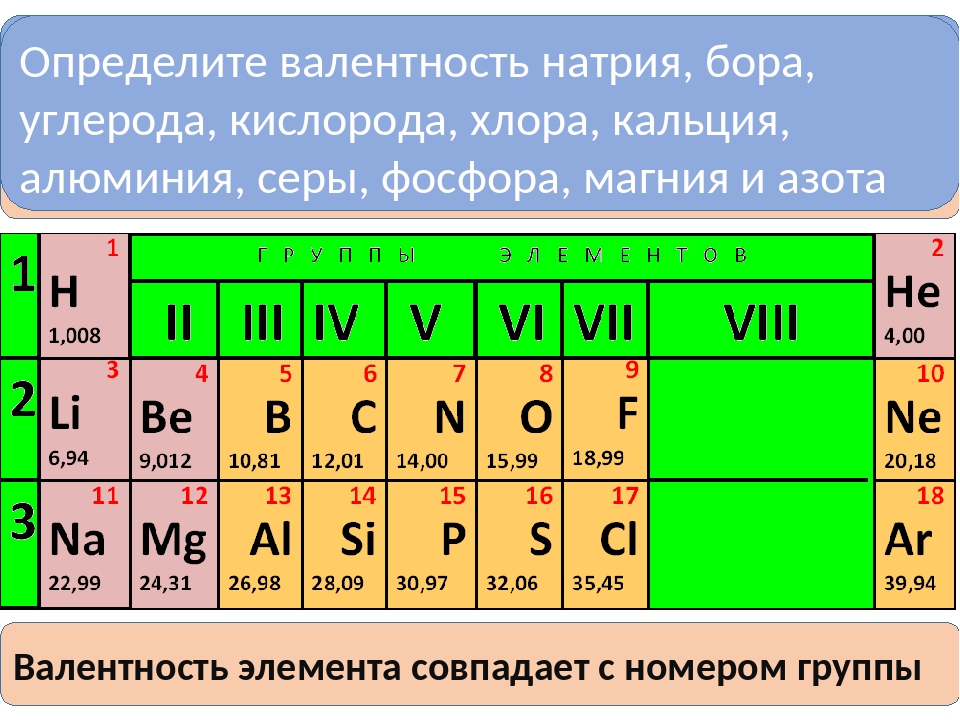 Например, в молекулу серной кислоты (H 2 SO 4) входит водород (2 атома), сера (1 атом), кислород (4 атома).
Например, в молекулу серной кислоты (H 2 SO 4) входит водород (2 атома), сера (1 атом), кислород (4 атома).
По химической формуле очень легко определить молекулярную массу вещества, которая равна сумме атомных масс.
Молекулярная масса серной кислоты равна: H 2 SO 4 = 1·2 + 32 + 16·4 = 98.
Еще одной весьма важной количественной характеристикой взаимодействующих между собой атомов, является валентность .
Валентность определяется по количеству связей, который образует атом с другими атомами. Чтобы написать правильную формулу вещества, необходимо знать валентность атомов, входящих в это вещество.
В структурных формулах химические связи между атомами обозначают чертой (см. формулы ковалентных связей), при этом каждая химическая связь образуется двумя электронами соседних атомов (каждый из атомов выделяет для этой цели по одному своему электрону, находящемуся на крайней внешней орбитали). Таким образом, валентность атома (количество связей, которое атом может образовать с соседними атомами) определяется числом его неспаренных валентных электронов.
Некоторые химические элементы всегда проявляют постоянную валентность:
Другие элементы имеют переменную валентность.
Валентность неизвестного атома вещества можно определить по другим атомам с известной валентностью, входящих в это вещество.
Например, сера может иметь валентности — 2, 4, 6.
Определим, какую валентность имеет сера в соединениях: H 2 S, SO 2 , SO 3 ?
Известно, что валентность водорода = 1, а валентность кислорода = 2. Чтобы решить задачу необходимо известную валентность атома умножить на количество этих атомов, входящих в вещество: Н 2 = 2; О 2 = 4; О 3 = 6. Так как во всех формулах присутствует только один атом серы, то полученные цифры и будут обозначать валентность серы в этих формулах.
Зная валентности всех элементов, входящих в вещество, можно составить правильную химическую формулу вещества. Для этого необходимо сначала найти наименьшее общее кратное, а затем, для определения числа атомов конкретного элемента наименьшее общее кратное разделить на валентность каждого атома, входящего в формулу.
Например, в оксид фосфора входят фосфор (валентность 5) и кислород (2). Наименьшее общее кратное будет 5·2 = 10. 10/5 = 2; 10/2 = 5. Получаем формулу P 2 O 5 .
Почему одни атомы могут иметь только одну валентность, а другие — несколько? Для ответа на этот вопрос см.
– это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0. Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Как можно определить валентность в соединениях:
Валентность водорода (H) постоянна всегда 1. Отсюда в соединении h3O валентность O равна 2.
Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
Высшая валентность всегда равна № группы.
Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.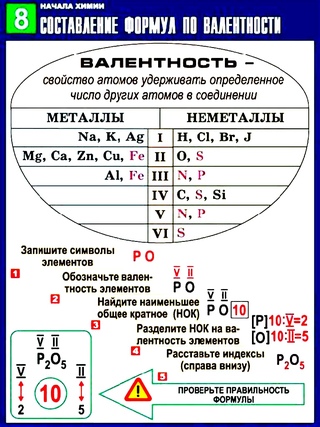
У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
У неметаллов обычно две валентности: высшая и низшая.
Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
Атомный № | Химический элемент | Валентность химических элементов | Примеры соединений | |
Водород / Hydrogen | ||||
Гелий / Helium | отсутствует | |||
Литий / Lithium | ||||
Бериллий / Beryllium | ||||
Углерод / Carbon | ||||
Азот / Nitrogen | ||||
Кислород / Oxygen | ||||
Фтор / Fluorine | ||||
отсутствует | ||||
Натрий / Sodium | ||||
Магний / Magnesium | ||||
Алюминий / Aluminum | ||||
Кремний / Silicon | ||||
Фосфор / Phosphorus | ||||
Сера / Sulfur | ||||
Хлор / Chlorine | ||||
Аргон / Argon | отсутствует | |||
Калий / Potassium | ||||
Кальций / Calcium | ||||
Скандий / Scandium | ||||
Титан / Titanium | Ti 2 O 3 , TiH 4 | |||
Ванадий / Vanadium | ||||
Хром / Chromium | ||||
Марганец / Manganese | II, III, IV, VI, VII | Mn 2 O 7 , Mn 2 (SO 4) 3 | ||
Железо / Iron | ||||
Кобальт / Cobalt | CoI 2 , Co 2 S 3 | |||
Никель / Nickel | ||||
Медь / Copper | ||||
Галлий / Gallium | ||||
Германий / Germanium | GeBr 4 , Ge(OH) 2 | |||
Мышьяк / Arsenic | As 2 S 5 , H 3 AsO 4 | |||
Селен / Selenium | ||||
Бром / Bromine | ||||
Криптон / Krypton | ||||
Рубидий / Rubidium | ||||
Стронций / Strontium | ||||
Иттрий / Yttrium | ||||
Цирконий / Zirconium | ||||
Ниобий / Niobium | I, II, III, IV, V | |||
Молибден / Molybdenum | II, III, IV, V, VI | Mo 2 O 5 , MoF 6 | ||
Технеций / Technetium | ||||
Рутений / Ruthenium | RuO 4 , RuF 5 , RuBr 3 | |||
Родий / Rhodium | I, II, III, IV, V | |||
Палладий / Palladium | ||||
Серебро / Silver | AgO, AgF 2, AgNO 3 | |||
Кадмий / Cadmium | ||||
Индий / Indium | ||||
Олово / Tin | ||||
Сурьма / Antimony | ||||
Теллур / Tellurium | TeH 2 , H 6 TeO 6 | |||
Ксенон / Xenon | II, IV, VI, VIII | XeF 6 , XeO 4 , XeF 2 | ||
Цезий / Cesium | ||||
Барий / Barium | ||||
Лантан / Lanthanum | ||||
Церий / Cerium | ||||
Празеодим / Praseodymium | ||||
Неодим / Neodymium | ||||
Прометий / Promethium | ||||
Самарий / Samarium | ||||
Европий / Europium | ||||
Гадолиний / Gadolinium | ||||
Тербий / Terbium | ||||
Диспрозий / Dysprosium | ||||
Гольмий / Holmium | ||||
Эрбий / Erbium | ||||
Тулий / Thulium | ||||
Иттербий / Ytterbium | ||||
Лютеций / Lutetium | ||||
Гафний / Hafnium | ||||
Тантал / Tantalum | TaCl 5 , TaBr 2 , TaCl 4 | |||
Вольфрам / Tungsten | WBr 6 , Na 2 WO 4 | |||
Рений / Rhenium | Re 2 S 7 , Re 2 O 5 | |||
Осмий / Osmium | OsF 8 , OsI 2 , Os 2 O 3 | |||
Иридий / Iridium | ||||
Платина / Platinum | I, II, III, IV, V | Pt(SO 4) 3 , PtBr 4 | ||
Золото / Gold | AuH, Au 2 O 3 , Au 2 Cl 6 | |||
Ртуть / Mercury | ||||
Талий / Thallium | ||||
Свинец / Lead | ||||
Висмут / Bismuth | BiF 5 , Bi 2 S 3 | |||
Полоний / Polonium | ||||
Астат / Astatine | нет данных | — | ||
Радон / Radon | отсутствует | — | ||
Франций / Francium | — | |||
Радий / Radium | ||||
Актиний / Actinium | ||||
Торий / Thorium | ||||
Проактиний / Protactinium | ||||
Уран / Uranium | ||||
Нептуний | ||||
Плутоний | PuO 2 , PuF 3 , PuF 4 | |||
Америций | ||||
CmO 2 , Cm 2 O 3 | ||||
Калифорний | ||||
Эйнштейний | ||||
Менделевий | ||||
Лоуренсий | ||||
Валентность химических элементов |
4.
 Валентность. Степень окисления химических элементов
Валентность. Степень окисления химических элементовТема № 4. Валентность химических элементов. Степень окисления химических элементов
Рекомендованные видеоуроки
Дополнительные видеоуроки, рекомендованные к просмотру
Теоретический материал
Валентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
— неспаренных электронов;
— неподеленных электронных пар;
— вакантных валентных орбиталей.
Правила определения валентности элементов в соединениях
1. Валентность водорода принимают за I (единицу).
2. Кислород в своих соединениях всегда проявляет валентность II.
3. Высшая валентность равна номеру группы.
4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 — № группы.
5. Валентность может быть постоянной или переменной.
6. Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы).
Валентность элементов не имеет знака.
У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая.
Пример.
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор (P) проявляет валентности V и III.
Запомни!!!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики.
НО!!!
СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления +2
HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления +5
Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1.
Аналогично во всех пероксидах валентность кислорода равна II.
N2h5 (гидразин) — валентность азота равна III, а степень окисления равна +2.
H2I, N2III, O2II, F2I, Cl2I, Br2I, I2I, а степени окисления равны 0.
Степень окисления химических элементов
Степень окисления – это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю!!!
Элементы с постоянной степенью окисления
Степень окисления = +№ группы
I группа главная подгруппа степень окисления +1.
II группа главная подгруппа степень окисления +2.
III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения:
1. Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si+4H4—, B2+3H6—, B+3H3—, где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1 (Na+H—, Ca+2h3—).
2. Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например H2+O2—, Na2+O2—, Ba+2O2— и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2+F2—, O+2F2—.
Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например H2+O2—, Na2+O2—, Ba+2O2— и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2+F2—, O+2F2—.
3. Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).
4. Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе).
5. Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
Высшая степень окисления: +№ группы.
Низшая степень окисления: +№ группы — 8.
Промежуточная степень окисления: +№ группы — 2.
Пример:
Фосфор (P):
Высшая степень окисления: +5.
Низшая степень окисления: -3
Промежуточная степень окисления: +3
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Пример:
Задание. Определите степени окисления всех элементов в соединение N2O5
Определите степени окисления всех элементов в соединение N2O5
Решение. В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Пример:
Задание. Определите степени окисления всех элементов в соединение Na2SO4.
Решение. Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Отсюда х = +6.
Отсюда х = +6. Пример:
Задание. Определите степени окисления всех элементов в соединение K2Cr2O7.
Решение. Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение:
2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6.
Использованные интернет-источники
Как определить валентность в бинарных соединениях. Валентность
Есть элементы, валентность которых всегда постоянна, и их совсем немного. Но все остальные элементы проявляют переменную валентность.
Больше уроков на сайте
С одним атомом одновалентного элемента соединяется один атом другого одновалентного элемента (HСl ). С атомом двухвалентного элемента соединяются два атома одновалентного (H 2 O) или один атом двухвалентного (CaO). Значит, валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента. Вал элемента – это число связей, которое образует атом:
Na – одновалентен (одна связь)
H – одновалентен (одна связь)
O – двухвалентен (две связи у каждого атома)
S – шестивалентна (образует шесть связей с соседними атомами)
Правила определения валентности
элементов в соединениях
1. Вал водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н 2 О к одному атому кислорода присоединено два атома водорода.
2. Кислород в своих соединениях всегда проявляет валентность II . Поэтому углерод в соединении СО 2 (углекислый газ) имеет валентность IV.
Поэтому углерод в соединении СО 2 (углекислый газ) имеет валентность IV.
3. Высшая вал равна номеру группы .
4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 — N группы .
5. У металлов, находящихся в «А» подгруппах, вал равна номеру группы.
6. У неметаллов в основном проявляются две валентности: высшая и низшая.
Образно говоря, вал — это число «рук», которыми атом цепляется за другие атомы. Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Можно сказать иначе: — это способность атома данного элемента присоединять определенное число других атомов.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство).
Элементы с постоянной валентностью необходимо запомнить.
Рассматривая формулы различных соединений, нетрудно заметить, что число атомов одного и того же элемента в молекулах различных веществ не одинаково. Например, HCl, NH 4 Cl, H 2 S, H 3 PO 4 и т.д. Число атомов водорода в этих соединениях изменяется от 1 до 4. Это характерно не только для водорода.
Как же угадать, какой индекс поставить рядом с обозначением химического элемента? Как составляются формулы вещества? Это легко сделать, когда знаешь валентность элементов, входящих в состав молекулы данного вещества.
– это свойство атома данного элемента присоединять, удерживать или замещать в химических реакциях определённое количество атомов другого элемента. За единицу валентности принята валентность атома водорода. Поэтому иногда определение валентности формулируют так: валентность – это свойство атома данного элемента присоединять или замещать определённое количество атомов водорода.
Если к одному атому данного элемента прикрепляется один атом водорода, то элемент одновалентен, если два – двухвалентен и т.д. Водородные соединения известны не для всех элементов, но почти все элементы образуют соединения с кислородом О. Кислород считается постоянно двухвалентным.
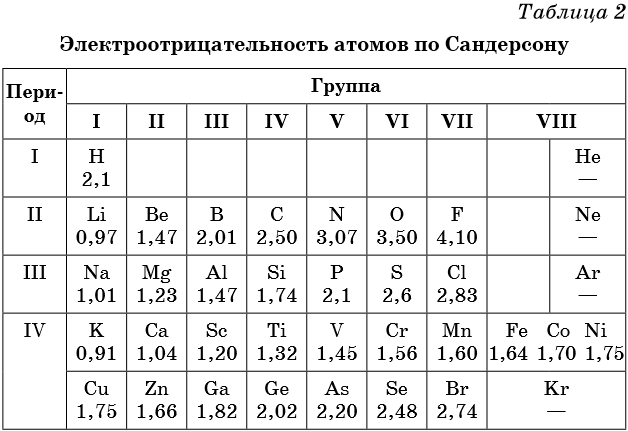
Постоянная валентность:
I – H, Na, Li, K, Rb, Cs
II – O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
III – B, Al, Ga, In
Но как поступить в том случае, если элемент не соединяется с водородом? Тогда валентность необходимого элемента определяют по валентности известного элемента. Чаще всего её находят, используя валентность кислорода, потому что в соединениях его валентность всегда равно 2. Например, не составит труда найти валентность элементов в следующих соединениях: Na 2 O (валентность Na – 1, O – 2), Al 2 O 3 (валентность Al – 3, O – 2).
Химическую формулу данного вещества можно составить, только зная валентность элементов. Например, составить формулы таких соединений, как CaO, BaO, CO, просто, потому что число атомов в молекулах одинаково, так как валентности элементов равны.
Например, составить формулы таких соединений, как CaO, BaO, CO, просто, потому что число атомов в молекулах одинаково, так как валентности элементов равны.
А если валентности разные? Когда мы действуем в таком случае? Необходимо запомнить следующее правило: в формуле любого химического соединения произведение валентности одного элемента на число его атомов в молекуле равно произведению валентности на число атомов другого элемента. Например, если известно, что валентность Mn в соединении равна 7, а O – 2, тогда формула соединения будет выглядеть так Mn 2 O 7.
Как же мы получили формулу?
Рассмотрим алгоритм составления формул по валентности для состоящих из двух химических элементов.
Существует правило, что число валентностей у одного химического элемента равно числу валентностей у другого . Рассмотрим на примере образования молекулы, состоящей из марганца и кислорода.
Будем составлять в соответствии с алгоритмом:
1. Записываем рядом символы химических элементов:
Записываем рядом символы химических элементов:
2. Ставим над химическими элементами цифрами их валентности (валентность химического элемента можно найти в таблице периодической системы Менделева, у марганца – 7, у кислорода – 2.
3. Находим наименьшее общее кратное (наименьшее число, которое делится без остатка на 7 и на 2). Это число 14. Делим его на валентности элементов 14: 7 = 2, 14: 2 = 7, 2 и 7 будут индексами, соответственно у фосфора и кислорода. Подставляем индексы.
Зная валентность одного химического элемента, следуя правилу: валентность одного элемента × число его атомов в молекуле = валентность другого элемента × число атомов этого (другого) элемента, можно определить валентность другого.
Mn 2 O 7 (7 · 2 = 2 · 7).
Понятие о валентности было введено в химию до того, как стало известно строение атома. Сейчас установлено, что это свойство элемента связано с числом внешних электронов. Для многих элементов максимальная валентность вытекает из положения этих элементов в периодической системе.
Остались вопросы? Хотите знать больше о валентности?
Чтобы получить помощь репетитора – .
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Существует несколько определений понятия «валентность». Чаще всего этим термином называют способность атомов одного элемента присоединять определённое число атомов других элементов. Часто у тех, кто только начинает изучать химию, возникает вопрос: Как определить валентность элемента?. Сделать это несложно, зная несколько правил.
Валентности постоянные и переменные
Рассмотрим соединения HF, h3S и Cah3. В каждом из этих примеров один атом водорода присоединяет к себе только один атом другого химического элемента, значит его валентность равна одному. Значение валентности записывают над символом химического элемента римскими цифрами.
В приведённом примере атом фтора связан только с одним одновалентным атомом H, значит валентность его тоже равна 1.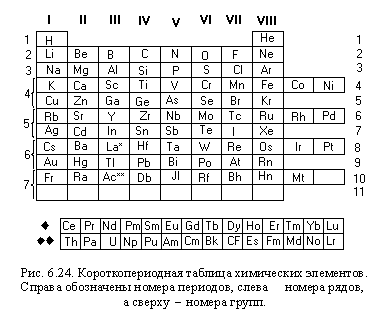 Атом серы в h3S присоединяет к себе уже два атома H, поэтому она в данном соединении двухвалентна. С двумя водородными атомами связан и кальций в его гидриде Cah3, а значит, и его валентность равна двум.
Атом серы в h3S присоединяет к себе уже два атома H, поэтому она в данном соединении двухвалентна. С двумя водородными атомами связан и кальций в его гидриде Cah3, а значит, и его валентность равна двум.
Кислород в подавляющем большинстве своих соединений двухвалентен, то есть образует две химические связи с другими атомами.
Атом серы в первом случае присоединяет к себе два кислородных атома, то есть всего образует 4 химические связи (один кислород образует две связи, значит сера — два раза по 2), то есть валентность ее равна 4.
В соединении SO3 сера присоединяет уже три атома O, поэтому и валентность ее равна 6 (три раза образует по две связи с каждым атомом кислорода). Атом кальция же присоединяет только один атом кислорода, образуя с ним две связи, значит, его валентность такая же, как и у O, то есть равна 2.
Обратите внимание на то, что атом H одновалентен в любом соединении. Всегда (кроме иона гидроксония h4O(+)) равна 2 валентность кислорода. По две химические связи как с водородом, так и с кислородом образует кальций. Это элементы с постоянной валентностью. Кроме уже указанных, постоянную валентность имеют:
Это элементы с постоянной валентностью. Кроме уже указанных, постоянную валентность имеют:
- Li, Na, K, F — одновалентны;
- Be, Mg, Ca, Zn, Cd — обладают валентностью, равной II;
- B, Al и Ga — трехвалентны.
Атом серы, в отличие от рассмотренных случаев, в соединении с водородом имеет валентность, равную II, а с кислородом может быть и четырех- и шестивалентна. Про атомы таких элементов говорят, что они имеют переменную валентность. При этом максимальное ее значение в большинстве случаев совпадает с номером группы, в которой находится элемент в Периодической системе (правило 1).
Из этого правила есть много исключений. Так, элемент 1 группы медь, проявляет валентности и I, и II. Железо, кобальт, никель, азот, фтор, напротив, имеют максимальную валентность, меньшую, чем номер группы. Так, для Fe, Co, Ni это II и III, для N — IV, а для фтора — I.
Минимальное значение валентности всегда соответствует разнице между числом 8 и номером группы (правило 2).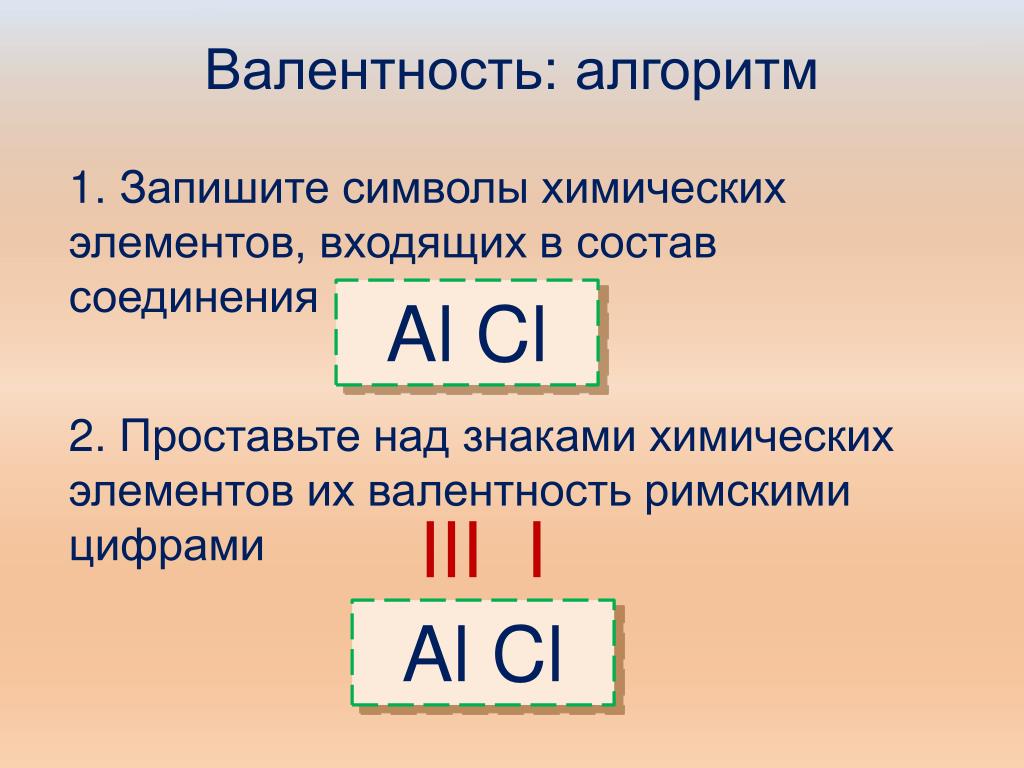
Однозначно определить, какова же валентность элементов, у которых она переменная, можно только по формуле определенного вещества.
Определение валентности в бинарном соединении
Рассмотрим, как определить валентность элемента в бинарном (из двух элементов) соединении. Здесь возможны два варианта: в соединении валентность атомов одного элемента известна точно или же обе частицы с переменной валентностью.
Случай первый:
Случай второй:
Определение валентности по формуле трехэлементной частицы.
Далеко не все химические вещества состоят из двухатомных молекул. Как определить валентность элемента в трёхэлементной частице? Рассмотрим этот вопрос на примере формул двух соединения K2Cr2O7.
Если же вместо калия в формуле будет присутствовать железо, или другой элемент с переменной валентностью, нам потребуется знать, какова же валентность кислотного остатка. Например, нужно вычислить валентности атомов всех элементов в соединении с формулой FeSO4.
Следует отметить, что термин «валентность» чаще использую в органической химии. При составлении формул неорганических соединений чаще используют понятие «степень окисления».
Валентность – это способность атомов присоединять к себе определенное число других атомов.
С одним атомом одновалентного элемента соединяется один атом другого одновалентного элемента (HСl ). С атомом двухвалентного элемента соединяются два атома одновалентного (H 2 O) или один атом двухвалентного (CaO). Значит, валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента. Валентность элемента – это число связей, которое образует атом:
Na – одновалентен (одна связь)
H – одновалентен (одна связь)
O – двухвалентен (две связи у каждого атома)
S – шестивалентна (образует шесть связей с соседними атомами)
Правила
определения валентности
элементов в соединениях
1. Валентность водорода принимают за I (единицу). Тогда в
соответствии с формулой воды Н 2 О к одному атому кислорода
присоединено два атома водорода.
Валентность водорода принимают за I (единицу). Тогда в
соответствии с формулой воды Н 2 О к одному атому кислорода
присоединено два атома водорода.
2. Кислород в своих соединениях всегда проявляет валентность II . Поэтому углерод в соединении СО 2 (углекислый газ) имеет валентность IV.
3. Высшая валентность равна номеру группы .
4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 — N группы .
5. У металлов, находящихся в «А» подгруппах, валентность равна номеру группы.
6. У неметаллов в основном проявляются две валентности: высшая и низшая.
Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
7. Валентность может быть постоянной или переменной.
Валентность элементов необходимо знать,
чтобы составлять химические формулы соединений.
Алгоритм составления формулы соединения оксида фосфора
Последовательность действий | Составление формулы оксида фосфора |
1. Написать символы элементов | Р О |
2. Определить валентности элементов | V II |
3. Найти наименьшее общее кратное численных значений валентностей | 5 2 = 10 |
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов | 10: 5 = 2, 10: 2 = 5; P: О = 2: 5 |
5. Записать индексы при символах элементов | Р 2 О 5 |
6. Формула соединения (оксида) | Р 2 О 5 |
Запомните!
Особенности составления химических формул соединений.
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже.
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO 3.
В соединении кремния с углеродом первый
проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) Атом металла стоит в формуле на первом месте.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы
любых соединений металлов с неметаллами.
Различные химические элементы отличаются по своей способности создавать химические связи, то есть соединяться с другими атомами. Поэтому в сложных веществах они могут находиться только в определенных соотношениях. Разберемся, как определить валентность по таблице Менделеева.
Существует такое определение валентности: это способность атома к образованию определенного числа химических связей. В отличие от , эта величина всегда только положительная и обозначается римскими цифрами.
В качестве единицы используется эта характеристика для водорода, которая принята равной I. Это свойство показывает, с каким числом одновалентных атомов может соединиться данный элемент. Для кислорода эта величина всегда равна II.
Знать эту характеристику необходимо, чтобы верно записывать химические формулы веществ и уравнения . Знание этой величины поможет установить соотношение между числом атомов различных типов в молекуле.
Данное понятие возникло в химии в XIX веке. Начало теории, объясняющей соединение атомов в различных соотношениях, положил Франкленд, но его идеи о «связывающей силе» не были очень распространены. Решающая роль в развитии теории принадлежала Кекуле. Он называл свойство образовывать некоторое количество связей основностью. Кекуле считал, что это фундаментальное и неизменное свойство каждого вида атомов. Важные дополнения к теории сделал Бутлеров. С развитием этой теории стало возможным наглядно изображать молекулы. Это очень помогло в изучении строения различных веществ.
Начало теории, объясняющей соединение атомов в различных соотношениях, положил Франкленд, но его идеи о «связывающей силе» не были очень распространены. Решающая роль в развитии теории принадлежала Кекуле. Он называл свойство образовывать некоторое количество связей основностью. Кекуле считал, что это фундаментальное и неизменное свойство каждого вида атомов. Важные дополнения к теории сделал Бутлеров. С развитием этой теории стало возможным наглядно изображать молекулы. Это очень помогло в изучении строения различных веществ.
Чем поможет периодическая таблица?
Находить валентность можно, посмотрев на номер группы в короткопериодном варианте. Для большинства элементов, у которых эта характеристика постоянная (принимает только одно значение), она совпадает с номером группы.
Такие свойства имеют главных подгрупп. Почему? Номер группы соответствует числу электронов на внешней оболочке. Эти электроны называются валентными. Именно они отвечают за возможность соединяться с другими атомами.
Группу составляют элементы с похожим устройством электронной оболочки, а сверху вниз возрастает заряд ядра. В короткопериодной форме каждая группа делится на главную и побочную подгруппы. Представители главных подгрупп — это s и p-элементы, представители побочных подгрупп имеют электроны на d и f-орбиталях.
Как определить валентность химических элементов, если она меняется? Она может совпадать с номером группы или равняться номеру группы минус восемь, а также принимать другие значения.
Важно! Чем выше и правее элемент, тем его свойство образовывать взаимосвязи меньше. Чем он более смещен вниз и влево, тем она больше.
То, как изменяется валентность в таблице Менделеева для конкретного вида атома, зависит от структуры его электронной оболочки. Сера, например, может быть двух-, четырех- и шестивалентной.
В основном (невозбужденном) состоянии у серы два неспаренных электрона находятся на подуровне 3р. В таком состоянии она может соединиться с двумя атомами водорода и образовать сероводород. Если сера перейдет в более возбужденное состояние, то один электрон перейдет на свободный 3d-подуровень, и неспаренных электронов станет 4.
Если сера перейдет в более возбужденное состояние, то один электрон перейдет на свободный 3d-подуровень, и неспаренных электронов станет 4.
Сера станет четырехвалентной. Если сообщить ей еще больше энергии, то еще один электрон перейдет с подуровня 3s на 3d. Сера перейдет в еще более возбужденное состояние и станет шестивалентной.
Постоянная и переменная
Иногда способность к образованию химических связей может меняться. Она зависит от того, в какое соединение входит элемент. Например, сера в составе h3S двухвалентна, в составе SO2 — четырехвалентна, а в SO3 — шестивалентна. Наибольшее из этих значений называется высшим, а наименьшая — низшим. Высшую и низшую валентности по таблице Менделеева можно установить так: высшая совпадает с номером группы, а низшая равняется 8 минус номер группы.
Как определить валентность химических элементов и то, изменяется ли она? Нужно установить, имеем мы дело с металлом или неметаллом. Если это металл, нужно установить, относится он к главной или побочной подгруппе.
- У металлов главных подгрупп способность к образованию химических взаимосвязей постоянная.
- У металлов побочных подгрупп — переменная.
- У неметаллов — также переменная. В большинстве случаев она принимает два значения — высшее и низшее, но иногда может быть и большее число вариантов. Примеры — сера, хлор, бром, йод, хром и другие.
В соединениях низшую валентность проявляет тот элемент, который находится выше и правее в периодической таблице, соответственно, высшую — тот, который левее и ниже.
Часто способность образовывать химические связи принимает больше двух значений. Тогда по таблице узнать их не получится, а нужно будет выучить. Примеры таких веществ:
- углерод;
- сера;
- хлор;
- бром.
Как определить валентность элемента в формуле соединения? Если она известна для других составляющих вещества, это несложно. Например, требуется рассчитать это свойство для хлора в NaCl. Натрий — элемент главной подгруппы первой группы, поэтому он одновалентен. Следовательно, хлор в этом веществе тоже может создать только одну связь и тоже одновалентен.
Следовательно, хлор в этом веществе тоже может создать только одну связь и тоже одновалентен.
Важно! Однако так не всегда можно узнать это свойство для всех атомов в сложном веществе. Для примера возьмем HClO4. Зная свойства водорода, можно только установить, что ClO4 — одновалентный остаток.
Как еще узнать эту величину?
Способность образовывать определенное количество связей не всегда совпадает с номером группы, и в некоторых случаях ее придется просто заучить . Здесь на помощь придет таблица валентности химических элементов, где приведены значения этой величины. В учебнике химии за 8 класс приведены значения способности соединяться с другими атомами наиболее распространенных видов атомов.
| Н, F, Li, Na, K | 1 |
| O, Mg, Ca, Ba, Sr, Zn | 2 |
| B, Al | 3 |
| C, Si | 4 |
| Cu | 1, 2 |
| Fe | 2, 3 |
| Cr | 2, 3, 6 |
| S | 2, 4, 6 |
| N | 3, 4 |
| P | 3, 5 |
| Sn, Pb | 2, 4 |
| Cl, Br, I | 1, 3, 5, 7 |
Применение
Стоит сказать, что ученые-химики в настоящее время понятие валентности по таблице Менделеева почти не используют. Вместо него для способности вещества образовывать определенное число взаимосвязей применяют понятие степени окисления, для веществ с структурой — ковалентность, а для веществ ионного строения — заряд иона.
Вместо него для способности вещества образовывать определенное число взаимосвязей применяют понятие степени окисления, для веществ с структурой — ковалентность, а для веществ ионного строения — заряд иона.
Однако рассматриваемое понятие применяют в методических целях. С его помощью легко объяснить, почему атомы разных видов соединяются в тех соотношениях, которые мы наблюдаем, и почему эти соотношения для разных соединений различны.
На данный момент подход, согласно которому соединение элементов в новые вещества всегда объяснялось с помощью валентности по таблице Менделеева независимо от типа связи в соединении, устарел. Сейчас мы знаем, что для ионной, ковалентной, металлической связей существуют разные механизмы объединения атомов в молекулы.
Полезное видео
Подведем итоги
По таблице Менделеева определить способность к образованию химических связей возможно не для всех элементов. Для тех, которые проявляют одну валентность по таблице Менделеева, она в большинстве случаев равна номеру группы. Если есть два варианта этой величины, то она может быть равна номеру группы или восемь минус номер группы. Существуют также специальные таблицы, по которым можно узнать эту характеристику.
Если есть два варианта этой величины, то она может быть равна номеру группы или восемь минус номер группы. Существуют также специальные таблицы, по которым можно узнать эту характеристику.
Урок химии в 7 классе по теме «Валентность»
Урок в 7 классе по теме «Валентность химических элементов». Разработала Вишнивецкая В.С.
Урок №
Тема урока: «Валентность химических элементов»
Цель урока:определить понятие «валентность» как способность атомов образовывать химические соединения; ознакомить учащихся со значениями валентностей отдельных атомов; показать учащимся простейшие способы определения валентности по периодической системе; научить определять валентность атомов одного элемента с валентностью другого в бинарных соединениях.
Задачи урока
I. Образовательные.
1. Познакомить учащихся с понятием валентность;
2. Сформировать и закрепить умение определять валентность по химическим формулам;
3. Сформировать и закрепить умение составлять формулы, зная валентность химических элементов.
Сформировать и закрепить умение составлять формулы, зная валентность химических элементов.
II. Воспитательные.
Показать единство материального мира
III. Развивающие.
Умение записывать химические формулы веществ, зная валентность элементов, входящих в состав данного вещества. Приобретение навыков самостоятельной работы.
Тип урока: комбинированный, изучение нового материала.
Форма проведения: путешествие фиксиков в страну Валентонию.
Основные понятия: валентность.
Оборудование: ноутбук, медиа проектор, таблицы и схемы, раздаточный материал.
Прогнозируемые результаты:
Ученики отвечают на вопросы:
- Что такое валентность химических элементов?
- Почему валентность водорода принята за единицу?
Умеют определять валентность по формулам.
Запомнили элементы с постоянной и переменной валентностью.
Научились составлять формулы по валентности.
Ход урока.
- Организационный момент. Приветствие учителя и настройки эмоционально-делового настроения на уроке.
Добрый день, ребята!
Видеть вас я рада.
Успехов творческих желаю.
Теперь урок наш начинаю.
- Прежде всего, хочу представиться. Зовут меня Виктория Сергеевна. Сегодняшний урок химии у вас проведу я. А ваши имена я прочту на бейджиках.
- Надеюсь, сегодняшний наш урок будет взаимно интересным, познавательным и плодотворным.
- Обратите внимание на листы, лежащие на ваших партах. Там содержится справочная информация по теме нашего урока и задания, которые нам предстоит разобрать. Ознакомьтесь с ними.
- Есть ли дежурные в классе? Напишите, пожалуйста, на листочке фамилии отсутствующих.
- Перед вами лежат оценочные карточки, которые предлагаю вам заполнять на протяжении урока.
 Там проставляется балл за каждое задание. Если вы не принимали участие в каком-то виде деятельности, то ставите 0. Но вначале, подчеркните смайлик, который соответствует вашему настроению..
Там проставляется балл за каждое задание. Если вы не принимали участие в каком-то виде деятельности, то ставите 0. Но вначале, подчеркните смайлик, который соответствует вашему настроению..
Смайлик настроения:
- Домашнее задание. Вашедомашнее задание пригодится нам при изучении новой темы.
(беглая проверка домашнего задания)
- Актуализация опорных знаний и мотивация учебной деятельности.
- Сегодня у нас в гостях фиксики. Как вам известно, они очень любопытны. Но они отлично знают устройство машин и приборов. А вот в химии они слабоваты. Поэтому сегодня они будут часто задавать вам вопросы. А потом, вместе с вами, отправятся в увлекательное путешествие по стране Валентонии. Фиксики нашли любопытный цветок. Помогите им с ним разобраться.
Упражнение “Цветик-семицветик” – 7 мин
- Что такое химическая формула?
(химическая формула – это запись, выражающая качественный и количественный состав данного вещества)
- Что такое качественный состав вещества?
(качественный состав – это какие элементы входят в состав данного вещества)
- Что такое количественный состав вещества?
(количественный состав – это в каком соотношении находятся элемент).
- Что такое индекс в химической формуле?
(индекс обозначает число атомов каждого химического элемента, входящего в состав молекулы, пишется справа внизу от символа элемента).
- Что такое коэффициент в химической формуле?
(коэффициент – обозначает количество атомов или молекул, пишется перед символом элемента).
- Что означает следующая запись: 2Сl?
(2Сl – два атома хлора)
- Что означает следующая запись: 3Сl2?
(3Сl2 – три молекулы хлора)
- Изучение новой темы.
- И так, сегодня мы начинаем изучение новой темы «Валентность элементов»
Сегодня нелегкая будет задача.
Пусть нам сопутствует с вами удача!
- Теперь открыли тетради и записали число, классная работа, тема …
- Цели урока.
 Ребята, исходя из темы урока, какие вы перед собой ставите цели и задачи? Чего вы ждете от сегодняшнего урока?
Ребята, исходя из темы урока, какие вы перед собой ставите цели и задачи? Чего вы ждете от сегодняшнего урока? - А цель, которую я перед собой ставлю…. Будем вместе идти к намеченной цели.
- Понятие валентности.
- Только что мы с вами вспомнили, что такое химическая формула. Каждое вещество имеет свою химическую формулу, которая выражает его качественный и количественный состав, т.е. какие элементы и в каком количестве входят в состав одной молекулы данного вещества.
Эвристическая беседа.
(Чтобы ответить на этоти вопросы, вам придется воспользоваться учебником,§__, или справочничком.На подготовку – 3 мин.)
- Так какую же информацию можно получить о молекулу из химической формулы? (Какой качественный и количественный состав вещества).
- А как же узнают состав каждого вещества?(С помощью сложных экспериментов).
- Как составить формулу химического соединения?
(Нужно знать, из атомов каких химических элементов состоит молекула этого вещества и количество атомов каждого вида) - Почему атомы химических элементов образуют молекулы в строго определенном соотношении?(Атомы имеют свойство определяет способность некоторого химического элемента присоединять определенное число атомов других элементов).

Мы будем называть эту способность валентностью. - Однако, зная валентность можно составить формулу любого вещества. Итак, запишем, что же такое валентность:
Валентность – это свойство атомов химического элемента присоединять определенное число атомов других химических элементов
- Так что же такое валетность?
- Запишем несколько химических веществ.
Рассмотрим более подробно их формулы. Что они означают? - Обозначим схематически связь между атомами.
Хлоридная кислота состоит из одного атома Хлора и одного атома Гидрогена. Между ними образуется связь (обозначим ее прямой, связывающей эти два атома). - Вода состоит из двух атомов Гидрогена и одного атома Оксигена.
Так схематично выглядит строение молекулы воды. - Молекула аммониака состоит из одного атома Нитрогена и трех атомов Гидрогена.
- А молекула метана – из одного атома Карбона и 4-х атомов Гидрогена.

- Как вы видите разные атомы могут образовывать только определенное количество связей. Например Гидроген – 1, Хлор – 1, Оксиген – 2, Нитроген — 3, Карбон – 4.
(Слайд 15-19)
Количество связей, которое образует атом, определяет валентность элемента.
- Определение валентности по Гидрогену.
Чтоб валентность элемента в данной формуле узнать,
надо рядом с элементом Гидроген пересчитать,
римской цифрою представить и над формулой поставить.
Задание(устно):Н2S, HBr , PH3
- Определение валентности по Оксигену.
Если рядом с элементом Оксиген,
двухвалентен он, не то, что Гидроген,
сумму всех его валентностей найди
и на индекс элемента раздели.
- Сейчас вместе с Ноликом мы научимся определять валентности элементов по формулам их соединений с Оксигеном.
Кто поможет Нолику установить валентность Ферума?
- Задание на закрепление самостоятельно и у доски 2 человека.
Кто справился быстрее, чем у доски – дополнительный бал
- Определите валентность элементов по формулами назвать только те, в которых валентность элемента совпадает с номером группы (работа в парах, взаимопроверка)
- Вопросы фиксиков:
- Спрашивает Нолик: «Почему валентность Гидрогена принята за единицу?»
Атом водорода не может присоединить более одного атома другого элемента. Таким образом его удобно принять за единицу.
2)Спрашивает Симка: «В реакции Ферума с соляной кислотой НCl один атом металла вытесняет два атома Гидрогена. Как это можно объяснить, пользуясь понятием о валентности?»
Атом Ферума двухвалентный.
3) Спрашивает Мася: «А как быть с другими элементами, кроме Гидрогена и Оксигена?»
Действуй также в каждом случае ином,
только помни непременно об одном:
чтобы правильно задания выполнять
постоянную валентность надо знать
- Валентности атомов химических элементов(Взглянем на таблицу валентностей.Запишите ее в тетрадях)
Валентность | Химический элемент |
Валентность постоянная | |
І | H, Li, Na, K |
ІІ | O, Ca, Mg, Ba, Zn |
ІІІ | Al, B |
Валентность переменная | |
І и ІІ | Сu |
II и III | Fe, Co, Ni |
II и IV | C, Sn, Pb, Mn |
II, IV, VI | S |
I, II, III, IV, V | N |
- Определение валентностей химичних элементов по формулам веществ
- Записать формулу вещества
- Обозначить известные (или постоянные) валентности
- Записать общее количество валентностей известного элемента(число валентностей * количество атомов соответствующего элемента)
- Определить и записать наименьшее общее кратное валентностей для двух элементов
- Рассчитать валентность неизвестного элемента (Общее кратное валентностей / число атомов элемента с неизвестной валентностью)
- Физкультминутка.

Подвижное упражнение «Узнай валентность»
Валентность элемента = І – аплодируем;
Валентность элемента = ІІ – руки вверх;
Валентность элемента = ІІІ – топам ногами.
10) Составление формул по валентности.
Основное правило: «Сумма единиц валентности всех атомов одного элемента должна быть равна сумме единиц валентности другого элемента».
Алгоритм.
Натрий, Калий, серебро
С Гидрогеном заодно.
С Оксигеном– Магний, ртуть,
Кальций, Барий и Бериллий
С ними Цинк не позабудь.
Трехвалентен Алюминий.
- Закрепление изученного материала.
- Упражнение удоски, два ученика (1-ый, 2-ой столбец)
- Дополнительноезадание.
 Решение задач.
Решение задач.
- Домашнее задание.
- Итоги урока.
- Рефлексивный журнал.
- Настроение на конец урока.
атомов, молекул и соединений | manoa.hawaii.edu/ExploringOurFluidEarth
Химические структуры
Свойства элементов и соединений определяются их структурой. Простейшей структурной единицей элемента является атом. Атомы очень маленькие. Сто миллионов (100000000) атомов водорода, поставленных рядом, имеют длину всего один сантиметр!
Некоторые элементы являются одноатомными , что означает, что они состоят из одного ( mon- ) атома ( -атомного ) в их молекулярной форме.Гелий (He, см. Рис. 2.8) является примером одноатомного элемента. Другие элементы содержат два или более атомов в своей молекулярной форме (рис. 2.8). Молекулы водорода (H 2 ), кислорода (O 2 ) и хлора (Cl 2 ), например, содержат по два атома каждая. Другая форма кислорода, озон (O 3 ), состоит из трех атомов, а сера (S 8 ) состоит из восьми атомов. Все элементарные молекулы состоят из атомов одного элемента.
Другая форма кислорода, озон (O 3 ), состоит из трех атомов, а сера (S 8 ) состоит из восьми атомов. Все элементарные молекулы состоят из атомов одного элемента.
Молекулы соединений содержат атомы двух или более различных элементов.Например, вода (H 2 O) имеет три атома, два атома водорода (H) и один атом кислорода (O). Метан (CH 4 ), обычный парниковый газ, состоит из пяти атомов: одного углерода (C) и четырех атомов водорода (H, см. Рис. 2.9).
Электростатические силы
Электростатические силы удерживают атомы в молекулах. Электростатические силы, удерживающие атомы вместе в молекулах, представляют собой силы того же типа, которые вызывают статическое электричество.Распространенные примеры статического электричества — это когда кто-то получает электрический ток, когда тянется к дверной ручке, или когда у ребенка вздымаются волосы, когда он спускается с пластиковой горки (рис. 2.10).
2.10).
Деятельность
Определите, как взаимодействует заряженная материя.
Части атомов
Частицы, составляющие атом, называются субатомными частицами ( sub — означает «меньший размер»). Эти частицы —
- протон (p + ), который заряжен положительно (+);
- электрон (е —), который отрицательно (-) заряжен; и
- нейтрон (n 0 ), у которого нет заряда, он нейтрален (0).
Протоны и нейтроны занимают ядро , или центр атома. Электроны существуют в областях, называемых оболочками , вне ядра атома (рис. 2.11).
Электростатические силы удерживают атомы вместе в молекулах — как два атома водорода, удерживаемые вместе в газе h3. Электростатические силы также удерживают электроны и протоны вместе в атоме. Притяжение между отрицательно заряженными электронами и положительно заряженными протонами в атоме придает атому его структуру.Сильная сила удерживает нейтроны и протоны вместе в ядре. Эта сила получила свое название, потому что она достаточно сильна, чтобы преодолеть силу отталкивания положительно заряженных протонов. Количество электронов и протонов в атоме определяет его химические свойства. Химические свойства включают особые способы реакции атомов и молекул, а также энергию, которую они выделяют или используют в этих реакциях.
Притяжение между отрицательно заряженными электронами и положительно заряженными протонами в атоме придает атому его структуру.Сильная сила удерживает нейтроны и протоны вместе в ядре. Эта сила получила свое название, потому что она достаточно сильна, чтобы преодолеть силу отталкивания положительно заряженных протонов. Количество электронов и протонов в атоме определяет его химические свойства. Химические свойства включают особые способы реакции атомов и молекул, а также энергию, которую они выделяют или используют в этих реакциях.
Размер субатомных частиц
Сто миллионов (100 000 000) атомов водорода, поставленных рядом, равняются примерно сантиметру.Протоны и нейтроны имеют примерно одну тысячную (1/1000) диаметра атома водорода. Это означает, что потребуется около ста миллиардов (100000000000) протонов или нейтронов, поставленных рядом, чтобы равняться сантиметру. Электроны составляют примерно одну тысячную (1/1000) диаметра протона или нейтрона. Это означает, что потребуется сто триллионов (10000000000000000) электронов, поставленных бок о бок, чтобы равняться сантиметру!
Это означает, что потребуется сто триллионов (10000000000000000) электронов, поставленных бок о бок, чтобы равняться сантиметру!
Нейтральные атомы
Субатомные частицы в атоме определяют свойства атома.Некоторые атомы в природе существуют как нейтральные или незаряженные атомы. Один незаряженный атом имеет равное количество протонов (+) и электронов (-). Незаряженный атом электрически нейтрален, потому что электроны и протоны имеют противоположные заряды равных размеров. Когда количество протонов и электронов в атоме одинаково, заряды компенсируются или противодействуют друг другу.
Протоны и нейтроны
Каждый атом определенного элемента имеет одинаковое количество протонов. Атомный номер равен количеству протонов в элементе.В периодической таблице атомный номер обычно указывается как целое число над символом элемента (см. Рис. 2.13). Например, водород (H) имеет атомный номер один (1). Это означает, что у атома водорода есть один протон. Если атом водорода нейтрален, он также должен иметь один электрон. Атом кислорода (O) имеет атомный номер восемь (8). Это означает, что у нейтрального атома кислорода восемь протонов и восемь электронов. Элемент Actium (Ac) имеет атомный номер 89, то есть у него 89 протонов и 89 электронов в нейтральном атоме.Таблица 2.2 показывает атомный номер, атомный символ, атомную структуру и количество протонов, нейтронов и электронов для первых трех элементов.
Если атом водорода нейтрален, он также должен иметь один электрон. Атом кислорода (O) имеет атомный номер восемь (8). Это означает, что у нейтрального атома кислорода восемь протонов и восемь электронов. Элемент Actium (Ac) имеет атомный номер 89, то есть у него 89 протонов и 89 электронов в нейтральном атоме.Таблица 2.2 показывает атомный номер, атомный символ, атомную структуру и количество протонов, нейтронов и электронов для первых трех элементов.
| Водород | Гелий | Литий | |
| Атомный номер | 1 | 2 | 3 |
| Атомарный символ | H | He | Li |
| Число протонов | 1 | 2 | 3 |
| Число электронов | 1 | 2 | 3 |
| Число нейтронов | 0 | 2 | 4 |
| Атомная структура |
Нейтроны влияют на массу атома и играют роль в стабильности атомов. В отличие от протонов, количество нейтронов в элементах разное. Например, у большинства атомов водорода нет нейтронов, но у некоторых есть один нейтрон, а у некоторых редких атомов водорода есть два нейтрона. У большинства атомов гелия есть два нейтрона, но у некоторых есть три нейтрона.
В отличие от протонов, количество нейтронов в элементах разное. Например, у большинства атомов водорода нет нейтронов, но у некоторых есть один нейтрон, а у некоторых редких атомов водорода есть два нейтрона. У большинства атомов гелия есть два нейтрона, но у некоторых есть три нейтрона.
Периоды, группы и периодическая таблица
Периодическая таблица (рис. 2.12) — широко используемый метод организации элементов, который предоставляет полезную информацию об элементах и их поведении.На рис. 2.12 элементы, выделенные синим цветом, являются металлами, а элементы желтым цветом — неметаллами. На рис. 2.13 запись для водорода показывает расположение атомного номера, символа элемента, имени элемента и атомного веса.
Периодическая таблица Менделеева имеет три характерные особенности. Во-первых, таблица Менделеева выстроена в горизонтальные ряды, которые называются периодами , . Есть семь периодов. В периоде 1 есть два элемента: водород (H) и гелий (He).Второй и третий периоды содержат восемь элементов, четвертый и пятый периоды содержат 18 элементов, а шестой и седьмой периоды содержат 32 элемента.
В периоде 1 есть два элемента: водород (H) и гелий (He).Второй и третий периоды содержат восемь элементов, четвертый и пятый периоды содержат 18 элементов, а шестой и седьмой периоды содержат 32 элемента.
Во-вторых, все элементы перечислены последовательно в соответствии с их атомными номерами. Атомный номер соответствует количеству протонов и находится над символом элемента. Например, на рис. 2.13 атомный номер водорода равен 1, что соответствует H
. В-третьих, периодическая таблица состоит из столбцов элементов, которые реагируют одинаково.Эти столбцы называются группами . Номер группы находится вверху столбца. Группы 1–12 содержат только металлы, группы 13–16 содержат как металлы, так и неметаллы, а группы 17 и 18 содержат только неметаллы. Единственное исключение — водород. Хотя технически это неметалл, водород обладает свойствами как металлов, так и неметаллов, и его часто помещают в группу 1. Две длинные строки в нижней части периодической таблицы являются исключением.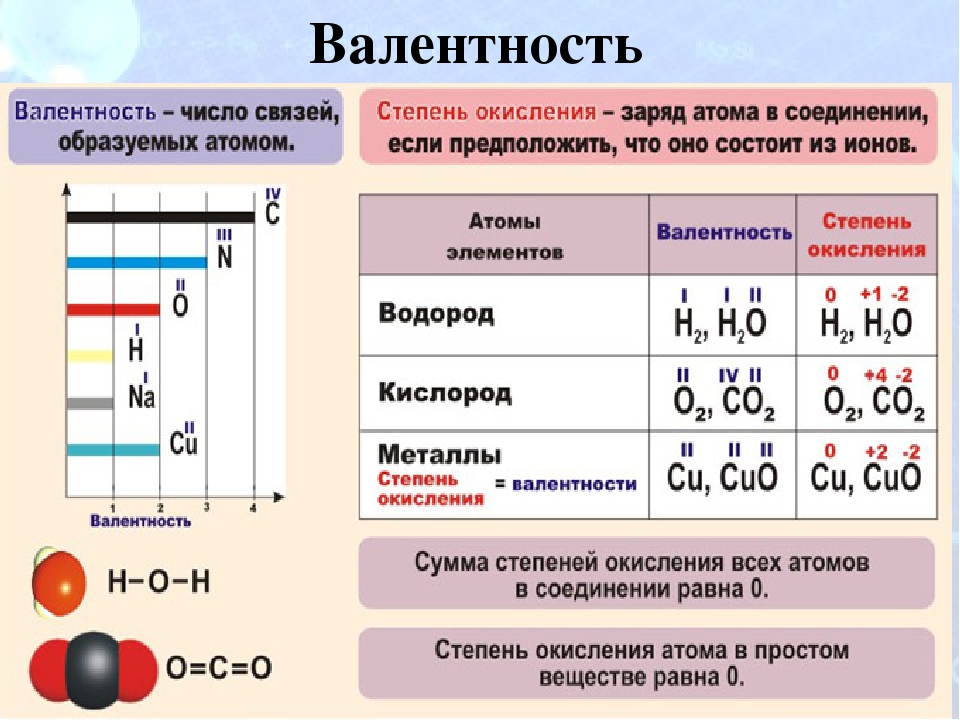 Элементы в каждой из этих строк ведут себя одинаково, поэтому считаются группами.Эти две группы расположены в строках, а не столбцах.
Элементы в каждой из этих строк ведут себя одинаково, поэтому считаются группами.Эти две группы расположены в строках, а не столбцах.
Металлы и неметаллы
Металлы — это элементы, проводящие тепло и электричество. Металлы обычно ковкие, их можно гнуть или формовать без разрушения, а — блестящие, или блестящие. Большинство металлов имеют серебристый цвет (рис. 2.14 A – C), хотя некоторые из них не такие, как медь (Cu, рис. 2.14 D). Большинство металлов твердые при комнатной температуре. Единственным исключением является ртуть (Hg), которая при комнатной температуре является жидкостью (рис.2.14 А). Элементы группы 1, включая литий (Li), натрий (Na, рис. 2.14 B), калий (K, рис. 2.14 C) и рубидий (Rb), являются металлами. Эти металлические элементы Группы 1 имеют аналогичные реакционные свойства. На рис. 2.12 металлы показаны синим цветом.
Неметаллы плохо проводят тепло и электричество; они не блестящие и существуют в природе в виде твердых тел, жидкостей или газов. В твердом состоянии неметаллы имеют тенденцию быть хрупкими, например сера, которая расслаивается, а не изгибается, как металл (рис.2,15 А). Элементы в группе 17, включая фтор (F 2 ), хлор (Cl 2 , рис. 2.15 B), бром (Br 2 , рис. 2.15 C) и йод (I 2 , рис. 2.15 D), все неметаллы. Неметаллы в Группе 17 все двухатомные (два атома) в своей элементной форме и имеют аналогичные реакционные свойства. На рис. 2.12 неметаллы показаны желтым цветом.
В твердом состоянии неметаллы имеют тенденцию быть хрупкими, например сера, которая расслаивается, а не изгибается, как металл (рис.2,15 А). Элементы в группе 17, включая фтор (F 2 ), хлор (Cl 2 , рис. 2.15 B), бром (Br 2 , рис. 2.15 C) и йод (I 2 , рис. 2.15 D), все неметаллы. Неметаллы в Группе 17 все двухатомные (два атома) в своей элементной форме и имеют аналогичные реакционные свойства. На рис. 2.12 неметаллы показаны желтым цветом.
См. Таблицу 2.3, где представлена сводная информация о свойствах металлов и неметаллов.
| Металлы | Неметаллы | |
| Физические свойства | Хороший проводник тепла и электричества | Плохой проводник тепла и электричества |
| Ковкий — можно бить или деформировать без трещин; податливый | Хрупкий | |
| Пластичный — можно перековать в проволоку | Непластичный | |
| Блестящий | Бесцветный, может быть непрозрачным или прозрачным | |
| Твердое вещество при комнатной температуре (кроме Hg и некоторых других металлов, находящихся в жидком состоянии при комнатной температуре или близкой к ней) | Твердое, жидкое или газообразное при комнатной температуре | |
| Химические свойства | Обычно имеют 1-3 валентных электрона | Обычно имеют 4-8 валентных электронов |
| Имеют тенденцию терять валентные электроны | Накапливают электроны |
Другие организационные особенности Периодической таблицы
Есть и другие организационные особенности таблицы Менделеева. Большинство периодов имеют первый элемент периода в группе 1 и последний элемент в группе 18. Исключением является первый период. На рис. 2.12 водород (H) находится в группе 1. Иногда водород (H) помещается в группу 17, выше фтора (F), потому что он имеет свойства, аналогичные неметаллам в этой группе; например, в элементарном состоянии водород существует в виде двухатомного газа h3. Иногда водород помещают в группы 1 и 17.
Большинство периодов имеют первый элемент периода в группе 1 и последний элемент в группе 18. Исключением является первый период. На рис. 2.12 водород (H) находится в группе 1. Иногда водород (H) помещается в группу 17, выше фтора (F), потому что он имеет свойства, аналогичные неметаллам в этой группе; например, в элементарном состоянии водород существует в виде двухатомного газа h3. Иногда водород помещают в группы 1 и 17.
Группы элементов имеют похожие свойства.Свойства некоторых групп настолько уникальны или важны, что группы называются специальными именами. Последняя группа, группа 18, включает гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). Элементы этой группы называются благородными газами. Благородные газы редко вступают в реакцию с другими элементами. Благородные газы имеют множество применений, например, они используются в неоновых вывесках (рис. 2.16).
Группа 1 часто называется щелочными металлами, группа 2 — щелочноземельными металлами, а группа 17 — галогенами. Две группы, которые расположены в нижней части таблицы Менделеева в строках, называются серией редкоземельных элементов лантаноидов (верхняя строка) и серией актинидов (нижняя строка).
Две группы, которые расположены в нижней части таблицы Менделеева в строках, называются серией редкоземельных элементов лантаноидов (верхняя строка) и серией актинидов (нижняя строка).
Периодические свойства элементов
Элементы в периодической таблице расположены в порядке возрастания атомного номера. Все эти элементы демонстрируют несколько других тенденций, и мы можем использовать периодический закон и формирование таблицы, чтобы предсказать их химические, физические и атомные свойства.Понимание этих тенденций достигается путем анализа электронной конфигурации элементов; все элементы предпочитают формирование октетов и будут получать или терять электроны, чтобы сформировать эту стабильную конфигурацию.
Атомный радиус
Мы никогда не сможем определить атомный радиус атома, потому что никогда не бывает нулевой вероятности нахождения электрона и, следовательно, никогда не бывает четкой границы с атомом. Все, что мы можем измерить, — это расстояние между двумя ядрами (межъядерное расстояние). Ковалентный радиус — это половина расстояния между ядрами двух одинаковых атомов.Ионный радиус составляет половину расстояния между ядрами двух ионов в ионной связи. Расстояние должно быть распределено для меньшего катиона и большего аниона. Металлический радиус составляет половину расстояния между ядрами двух соседних атомов в кристаллической структуре. Благородные газы не учитываются в тенденциях изменения атомных радиусов, потому что экспериментальные значения их атомных радиусов вызывают большие споры. Единицами СИ для измерения атомных радиусов являются нанометр (нм) и пикометр (пм).{-12} \, m \).
Ковалентный радиус — это половина расстояния между ядрами двух одинаковых атомов.Ионный радиус составляет половину расстояния между ядрами двух ионов в ионной связи. Расстояние должно быть распределено для меньшего катиона и большего аниона. Металлический радиус составляет половину расстояния между ядрами двух соседних атомов в кристаллической структуре. Благородные газы не учитываются в тенденциях изменения атомных радиусов, потому что экспериментальные значения их атомных радиусов вызывают большие споры. Единицами СИ для измерения атомных радиусов являются нанометр (нм) и пикометр (пм).{-12} \, m \).
Чтобы объяснить эту тенденцию, необходимо понять концепцию скрининга и проникновения. Проникновение обычно известно как расстояние, на котором электрон находится от ядра. Экранирование определяется как концепция внутренних электронов, блокирующих внешние электроны от заряда ядра. В рамках этой концепции мы предполагаем, что между внешними электронами нет экранирования и что внутренние электроны экранируют внешние электроны от общего положительного заряда ядра.Чтобы понять степень экранирования и проникновения в атом, ученые придумали эффективный ядерный заряд , \ (Z_ {eff} \). Уравнение для расчета эффективного заряда ядра показано ниже.
В рамках этой концепции мы предполагаем, что между внешними электронами нет экранирования и что внутренние электроны экранируют внешние электроны от общего положительного заряда ядра.Чтобы понять степень экранирования и проникновения в атом, ученые придумали эффективный ядерный заряд , \ (Z_ {eff} \). Уравнение для расчета эффективного заряда ядра показано ниже.
\ [Z_ {eff} = Z — S \]
В уравнении S представляет количество внутренних электронов, экранирующих внешние электроны. Студенты могут легко найти S, используя атомный номер благородного газа, который находится на одну точку над элементом. Например, S, которое мы использовали бы для хлора, будет 10 (атомный номер неона).Z — общее количество электронов в атоме. Поскольку мы знаем, что нейтральный атом имеет одинаковое количество протонов и электронов, мы можем использовать атомный номер для определения Z. Например, для хлора значение Z будет равно 17 (атомный номер хлора). Продолжая использовать хлор в качестве примера, 10 внутренних электронов (S) будут экранировать положительный заряд десяти протонов.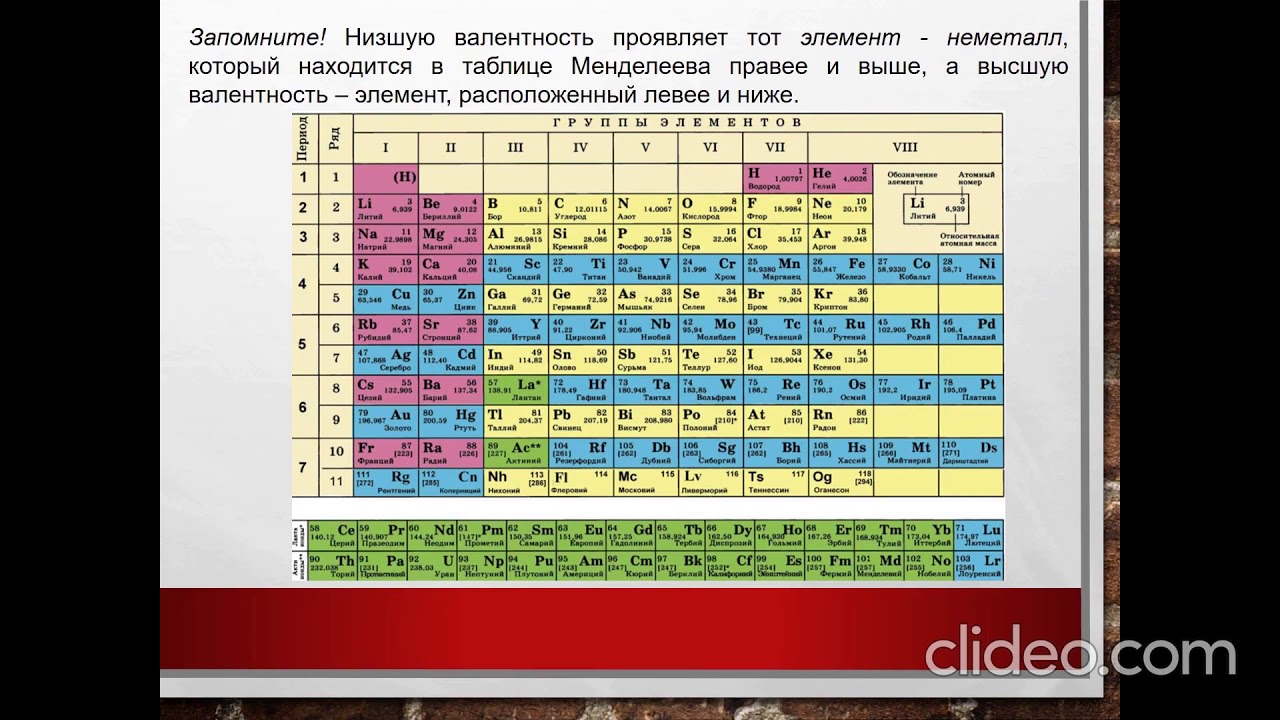 Поэтому был бы и эффективный ядерный заряд 17-10 или +7. Эффективный заряд ядра показывает, что ядро притягивает внешние электроны с зарядом +7, и поэтому внешние электроны притягиваются ближе к ядру, и атомные радиусы меньше.Таким образом, чем больше заряд ядра, тем большее притяжение ядра оказывает на внешние электроны и тем меньше атомные радиусы. Напротив, чем меньше заряд ядра, тем меньшее притяжение ядра оказывает на внешние электроны и тем больше атомные радиусы. Кроме того, с увеличением атомного номера увеличивается и эффективный заряд ядра. На рисунке 3 показано влияние эффективного заряда ядра на атомные радиусы.
Поэтому был бы и эффективный ядерный заряд 17-10 или +7. Эффективный заряд ядра показывает, что ядро притягивает внешние электроны с зарядом +7, и поэтому внешние электроны притягиваются ближе к ядру, и атомные радиусы меньше.Таким образом, чем больше заряд ядра, тем большее притяжение ядра оказывает на внешние электроны и тем меньше атомные радиусы. Напротив, чем меньше заряд ядра, тем меньшее притяжение ядра оказывает на внешние электроны и тем больше атомные радиусы. Кроме того, с увеличением атомного номера увеличивается и эффективный заряд ядра. На рисунке 3 показано влияние эффективного заряда ядра на атомные радиусы.
Теперь мы готовы описать тенденцию атомного радиуса в периодической таблице.Слева направо через период увеличивается атомный номер, а затем и эффективный заряд ядра. Поэтому, двигаясь слева направо по периоду, ядро сильнее притягивает внешние электроны, и атомные радиусы уменьшаются. При движении вниз по группе в периодической таблице количество заполненных электронных оболочек увеличивается. В группе валентные электроны сохраняют одинаковый эффективный заряд ядра, но теперь орбитали удалены от ядра. Следовательно, ядро меньше притягивает внешние электроны, а атомные радиусы больше.
В группе валентные электроны сохраняют одинаковый эффективный заряд ядра, но теперь орбитали удалены от ядра. Следовательно, ядро меньше притягивает внешние электроны, а атомные радиусы больше.
. Теперь мы можем использовать эту концепцию для объяснения различий в атомных радиусах катионов и анионов. Катион — это атом, потерявший один из своих внешних электронов. Катионы имеют меньший радиус, чем атом, из которого они образовались. При потере электрона положительный ядерный заряд обесценивает отрицательный заряд, создаваемый электронами. Следовательно, положительное ядро притягивает электроны сильнее, а радиус меньше.Анион — это атом, который приобрел внешний электрон. Анионы имеют больший радиус, чем атом, из которого они образовались. Усиление электрона не изменяет заряд ядра, но добавление электрона вызывает уменьшение эффективного заряда ядра. Следовательно, электроны удерживаются более свободно, а радиус атома увеличивается.
Энергия ионизации (потенциал ионизации)
Чтобы вытолкнуть электрон из атома, требуется достаточно энергии, чтобы преодолеть магнитное притяжение положительного заряда ядра.{-}} \]
Энергия ионизации увеличивается относительно высокого эффективного заряда. Наивысшую энергию ионизации имеют благородные газы, потому что все они имеют высокий эффективный заряд из-за образования октетов и требуют большого количества энергии для разрушения этой стабильной конфигурации. Наибольшее количество энергии требуется для элементов в правом верхнем углу. Кроме того, элементы в левом углу имеют низкую энергию ионизации, потому что потеря электрона позволяет им иметь конфигурацию благородного газа.Следовательно, требуется меньше энергии для удаления одного из их валентных электронов
| Элемент | 1-й | 2-я | 3-й | 4-я | 5-я | 6-й | 7-й |
|---|---|---|---|---|---|---|---|
| Na | 496 | 4562 | |||||
| мг | 738 | 1451 | 7733 | ||||
| Al | 577 | 1817 | 2745 | 11580 | |||
| Si | 786 | 1577 | 3232 | 4356 | 16090 | ||
п. | 1060 | 1903 | 2912 | 4957 | 6274 | 21270 | |
| S | 999.6 | 2251 | 3361 | 4564 | 7013 | 8496 | 27110 |
| Класс | 1256 | 2297 | 3822 | 5158 | 6542 | 9362 | 11020 |
| Ар | 1520 | 2666 | 3931 | 5771 | 7238 | 8781 | 12000 |
Это энергии ионизации для трех элементов периода. Обратите внимание, как Na после во втором I.E., Mg в третьем I.E., Al в четвертом I.E. и т. Д. — все имеют огромное увеличение энергии по сравнению с исходным. Это происходит из-за того, что текущая конфигурация находилась в стабильном формировании октетов; поэтому для ионизации требуется гораздо большее количество энергии.
Обратите внимание, как Na после во втором I.E., Mg в третьем I.E., Al в четвертом I.E. и т. Д. — все имеют огромное увеличение энергии по сравнению с исходным. Это происходит из-за того, что текущая конфигурация находилась в стабильном формировании октетов; поэтому для ионизации требуется гораздо большее количество энергии.
Энергия ионизации увеличивается слева направо в течение периода и увеличивается при движении вверх по группе. По мере того, как вы поднимаетесь на группу, энергия ионизации увеличивается, потому что меньше электронов защищает внешние электроны от притяжения ядра.Следовательно, требуется больше энергии, чтобы вывести ядро из строя и удалить электрон. Когда мы перемещаемся по периодической таблице слева направо, энергия ионизации увеличивается из-за увеличения эффективного заряда ядра. Это связано с тем, что чем больше эффективный заряд ядра, тем сильнее ядро удерживает электрон и тем больше энергии требуется для его высвобождения.
Рисунок \ (\ PageIndex {6} \): Предоставлено Джессикой Торнтон (UCD) Энергия ионизации — это лишь общее правило. Бывают случаи, когда эта тенденция не подтверждается. Обычно это можно объяснить их электронной конфигурацией. Например, магний имеет более высокую энергию ионизации, чем алюминий. Магний имеет электронную конфигурацию [Ne] 3s2. Магний обладает высокой энергией ионизации, потому что у него заполненная 3-секундная орбиталь, и ему требуется большее количество энергии, чтобы забрать электрон с заполненной орбитали.
Бывают случаи, когда эта тенденция не подтверждается. Обычно это можно объяснить их электронной конфигурацией. Например, магний имеет более высокую энергию ионизации, чем алюминий. Магний имеет электронную конфигурацию [Ne] 3s2. Магний обладает высокой энергией ионизации, потому что у него заполненная 3-секундная орбиталь, и ему требуется большее количество энергии, чтобы забрать электрон с заполненной орбитали.
Сродство к электрону
Сродство к электрону (E.A.) — это изменение энергии, которое происходит, когда электрон присоединяется к газообразному атому.{-}} \]
Труднее найти тенденции, описывающие сродство к электрону. Как правило, элементы в правой части таблицы Менделеева имеют большое отрицательное сродство к электрону. Сродство к электрону станет менее отрицательным по мере того, как вы переходите от вершины к основанию периодической таблицы. Однако азот, кислород и фтор не следуют этой тенденции. Электронная конфигурация благородных газов будет близка к нулю, потому что они не будут легко получать электроны.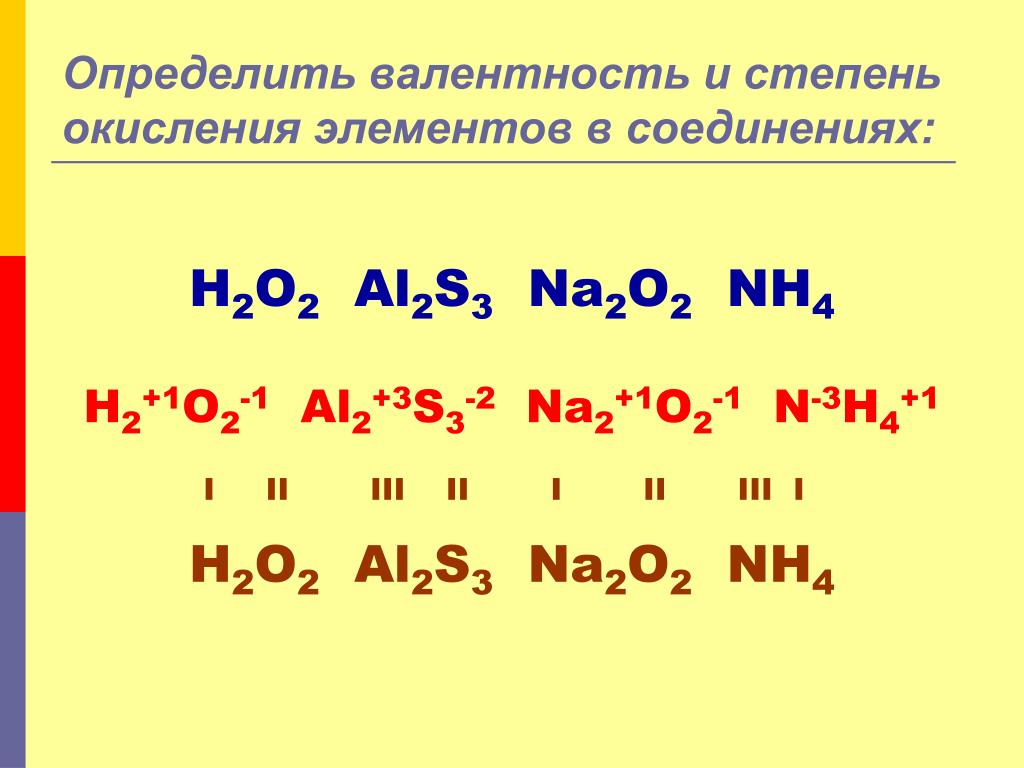
Электроотрицательность
Электроотрицательность — это измерение атома, который борется за электроны в связи.Чем выше электроотрицательность, тем выше его способность приобретать электроны в связи. Электроотрицательность будет важна, когда мы позже определим полярные и неполярные молекулы. Электроотрицательность связана с энергией ионизации и сродством к электрону. Электроны с низкими энергиями ионизации имеют низкую электроотрицательность, поскольку их ядра не оказывают сильного притяжения на электроны. Элементы с высокой энергией ионизации обладают высокой электроотрицательностью из-за сильного притяжения, оказываемого положительным ядром на отрицательные электроны.Следовательно, электроотрицательность увеличивается снизу вверх и слева направо.
Рисунок \ (\ PageIndex {8} \): любезно предоставлено Джессией Торнтон (UCD)Металлический персонаж
Металлический знак используется для определения химических свойств металлических элементов. Обычно металлы теряют электроны с образованием катионов. Неметаллы стремятся получить электроны с образованием анионов. Они также обладают высоким окислительным потенциалом, поэтому легко окисляются и являются сильными восстановителями.Металлы также образуют основные оксиды; чем более щелочной является оксид, тем выше металлический характер.
Обычно металлы теряют электроны с образованием катионов. Неметаллы стремятся получить электроны с образованием анионов. Они также обладают высоким окислительным потенциалом, поэтому легко окисляются и являются сильными восстановителями.Металлы также образуют основные оксиды; чем более щелочной является оксид, тем выше металлический характер.
По мере того, как вы перемещаетесь по таблице слева направо, металлический характер уменьшается, потому что элементы легко принимают электроны, чтобы заполнить свои оболочки. Следовательно, эти элементы принимают неметаллический характер образования анионов. По мере продвижения вверх по таблице металлический характер уменьшается из-за того, что ядро сильнее притягивает внешние электроны.Это большее притяжение затрудняет потерю электронов атомами и образование катионов.
Другие тенденции
Точки плавления: Тенденции изменения точек плавления и молекулярной массы бинарных углерод-галогеновых соединений и галогенидов водорода обусловлены межмолекулярными силами. Плавление разрушает расположение атомов в твердом теле, поэтому количество тепла, необходимое для плавления, зависит от силы притяжения между атомами. Эта сила притяжения увеличивается с увеличением количества электронов.Увеличение количества электронов увеличивает связь.
Плавление разрушает расположение атомов в твердом теле, поэтому количество тепла, необходимое для плавления, зависит от силы притяжения между атомами. Эта сила притяжения увеличивается с увеличением количества электронов.Увеличение количества электронов увеличивает связь.
Пример: Точка плавления HF должна составлять приблизительно -145 ° C от точек плавления HCl, HBr и HI, но наблюдаемое значение составляет -83,6 ° C.
Показатели теплопроводности и электропроводности регулярно меняются в течение периода. Точки плавления могут постепенно увеличиваться или достигать пика внутри группы, а затем в обратном направлении.
Пример: элементы третьего периода Na, Mg и Al являются хорошими проводниками тепла и электричества, тогда как Si — только хороший проводник, а неметаллы P, S, Cl и Ar — плохие проводники.- \]
Использование в знании периодических свойств элементов
- Предсказание большего или меньшего атомного размера и радиального распределения в нейтральных атомах и ионах
- Измерение и сравнение энергий ионизации
- Сравнение сродства к электрону и электроотрицательности
- Прогнозирование окислительно-восстановительного потенциала
- Сравнение металлического характера с другими элементами; его способность образовывать катионы
- Предсказание того, какая реакция может или не может произойти из-за тенденций
- Определение большего потенциала клеток (суммы окислительного и восстановительного потенциалов) между реакциями
- Завершение химических реакций в соответствии с тенденциями
Сводка периодических тенденций
В Периодической таблице элементов схожие элементы классифицируются вместе. Дмитрий Менделеев, русский ученый, был первым, кто создал общепринятое расположение элементов в 1869 году. Менделеев считал, что, когда элементы расположены в порядке увеличения атомной массы, определенные наборы свойств периодически повторяются. Хотя большинство современных периодических таблиц организовано в восемнадцать групп (столбцов) элементов, в первоначальной периодической таблице Менделеева элементы были организованы в восемь групп и двенадцать периодов (строк).
Дмитрий Менделеев, русский ученый, был первым, кто создал общепринятое расположение элементов в 1869 году. Менделеев считал, что, когда элементы расположены в порядке увеличения атомной массы, определенные наборы свойств периодически повторяются. Хотя большинство современных периодических таблиц организовано в восемнадцать групп (столбцов) элементов, в первоначальной периодической таблице Менделеева элементы были организованы в восемь групп и двенадцать периодов (строк).
В периодической таблице элементы, которые имеют похожие свойства, находятся в одних и тех же группах (по вертикали).Слева направо атомный номер (z) элементов увеличивается от одного периода к следующему (по горизонтали). Группы пронумерованы вверху каждого столбца, а точки слева рядом с каждой строкой. Основными элементами группы являются группы 1, 2 и 13–18. Эти группы содержат элементы, наиболее богатые естественным образом, и являются наиболее важными для жизни. Элементы, заштрихованные в приведенной выше таблице светло-розовым цветом, известны как переходные металлы. Два ряда элементов, начинающихся с z = 58, иногда называют внутренними переходными металлами, и они были извлечены и помещены в нижнюю часть таблицы, потому что они сделали бы таблицу слишком широкой, если бы оставались непрерывными.14 элементов, следующих за лантаном (z = 57), называются лантаноидами, а следующие 14 элементов, следующие за актинием (z = 89), называются актинидами.
Элементы, заштрихованные в приведенной выше таблице светло-розовым цветом, известны как переходные металлы. Два ряда элементов, начинающихся с z = 58, иногда называют внутренними переходными металлами, и они были извлечены и помещены в нижнюю часть таблицы, потому что они сделали бы таблицу слишком широкой, если бы оставались непрерывными.14 элементов, следующих за лантаном (z = 57), называются лантаноидами, а следующие 14 элементов, следующие за актинием (z = 89), называются актинидами.
Элементы периодической таблицы можно разделить на две большие категории: металлы и неметаллы. Большинство металлов являются хорошими проводниками тепла и электричества, пластичны и пластичны, а их температура плавления составляет от умеренной до высокой. В общем, неметаллы не являются проводниками тепла и электричества, представляют собой нелегкие твердые вещества, а многие из них являются газами при комнатной температуре. Как показано в таблице выше, металлы и неметаллы в периодической таблице часто разделены ступенчатой диагональной линией, а несколько элементов рядом с этой линией часто называют металлоидами (Si, Ge, As, Sb, Te и At). Металлоиды — это элементы, которые выглядят как металлы и в некотором смысле ведут себя как металлы, но также обладают некоторыми неметаллическими свойствами. Группа в самом дальнем правом углу таблицы, заштрихованная оранжевым цветом, известна как благородные газы. Благородные газы относятся к особой группе неметаллов.
Металлоиды — это элементы, которые выглядят как металлы и в некотором смысле ведут себя как металлы, но также обладают некоторыми неметаллическими свойствами. Группа в самом дальнем правом углу таблицы, заштрихованная оранжевым цветом, известна как благородные газы. Благородные газы относятся к особой группе неметаллов.
Щелочные металлы / Щелочноземельные металлы
Щелочные металлы входят в группу 1 периодической таблицы и состоят из лития, натрия, рубидия, цезия и франция. Эти металлы обладают высокой реакционной способностью и образуют ионные соединения (когда неметалл и металл объединяются), а также многие другие соединения.Все щелочные металлы имеют заряд +1 и самые большие размеры атомов, чем любые другие элементы, в каждый из своих периодов.
Щелочноземельные металлы находятся в группе 2 и состоят из бериллия, магния, кальция, стронция, бария и радия. В отличие от щелочных металлов, земные металлы имеют меньший размер атома и не обладают такой реакционной способностью. Эти металлы также могут образовывать ионные и другие соединения и иметь заряд +2.
Эти металлы также могут образовывать ионные и другие соединения и иметь заряд +2.
переходные металлы
Переходные металлы варьируются от групп IIIB до XIIB в периодической таблице.Эти металлы образуют положительно заряженные ионы, очень твердые и имеют очень высокие температуры плавления и кипения. Переходные металлы также являются хорошими проводниками электричества и пластичны.
Лантаноиды и актиниды
Лантаноиды (показаны в строке ** на диаграмме выше) и актиниды (показаны в строке * на диаграмме выше) образуют блок из двух строк, которые помещены внизу периодической таблицы для проблем с пространством. Они также считаются переходными металлами. Лантаноиды составляют верхний ряд этого блока и представляют собой очень мягкие металлы с высокими температурами кипения и плавления.Актиниды образуют нижний ряд и являются радиоактивными. Они также образуют соединения с большинством неметаллов. Чтобы узнать, почему у этих элементов есть отдельный раздел, посетите страницу электронных конфигураций.
Металлоиды
Как упоминалось во введении, металлоиды расположены вдоль лестницы, отделяющей металлы от неметаллов в периодической таблице. Бор, кремний, германий, мышьяк, сурьма и теллур обладают металлическими и неметаллическими свойствами. Например, кремний имеет металлический блеск, но является хрупким и неэффективным проводником электричества, как неметалл.Поскольку металлоиды обладают сочетанием металлических и неметаллических характеристик, они являются промежуточными проводниками электричества или «полупроводниками».
Галогены
Галогены состоят из пяти неметаллических элементов: фтора, хлора, брома, йода и астата. Они расположены в 17-й группе периодической таблицы и имеют заряд -1. Термин «галоген» означает «солеобразователь», а соединения, содержащие один из галогенов, являются солями. Физические свойства галогенов значительно различаются, поскольку они могут существовать в виде твердых тел, жидкостей и газов при комнатной температуре. Однако в целом галогены очень реакционноспособны, особенно со щелочными и земельными металлами 1-й и 2-й групп, с которыми они образуют ионные соединения.
Однако в целом галогены очень реакционноспособны, особенно со щелочными и земельными металлами 1-й и 2-й групп, с которыми они образуют ионные соединения.
Благородные газы
Благородные газы состоят из группы 18 (иногда называемой группой O) периодической таблицы элементов. Благородные газы имеют очень низкие температуры кипения и плавления и являются газами при комнатной температуре. Они также очень неактивны, поскольку у них уже есть полная валентная оболочка с 8 электронами. Следовательно, благородные газы имеют небольшую тенденцию терять или приобретать электроны.
Полезные связи из периодической таблицы
Периодическая таблица элементов полезна для определения зарядов простых одноатомных ионов. Элементы основной группы, отнесенные к группам 1, 2 и 13-18, образуют ионы, они теряют то же количество электронов, что и соответствующий номер группы, в которую они попадают. Например, атомы K (группа 1) теряют один электрон, чтобы стать K + , а атомы Mg (группа 2) теряют два электрона, чтобы сформировать Mg 2 + . Другие элементы основной группы, входящие в группу 13 и выше, образуют более одного возможного иона.
Другие элементы основной группы, входящие в группу 13 и выше, образуют более одного возможного иона.
Элементы в группах 3–12 называются переходными элементами или переходными металлами. Подобно элементам основной группы, описанным выше, переходные металлы образуют положительные ионы, но из-за их способности образовывать более двух или более ионов разного заряда связь между номером группы и зарядом отсутствует.
Упражнение \ (\ PageIndex {1} \)
Расположите эти элементы по убыванию атомного размера: Na, C, Sr, Cu, Fr
- Ответ
Fr, Sr, Cu, Na, C
Упражнение \ (\ PageIndex {1} \)
Расположите эти элементы по возрастанию отрицательного E.А .: Ba, F, Si, Ca, O
- Ответ
Ba, Ca, Si, O, F
Упражнение \ (\ PageIndex {1} \)
Расположите эти элементы в соответствии с возрастающим металлическим характером: Li, S, Ag, Cs, Ge
- Ответ
Li, S, Ge, Ag, CS
Упражнение \ (\ PageIndex {1} \)
Какая реакция, по вашему мнению, будет иметь больший клеточный потенциал?
- \ (\ ce {2Na (s) + Cl2 (g) → 2NaCl (s) или 2Cs (s) + Cl2 (g) → 2RbCl (s) \)
- \ (\ ce {2Na (s) + Cl2 (g) → 2NaCl (s) или Be (s) + Cl2 (g) → BeCl2 (s)} \)
- Ответ
Второе уравнение
Первое уравнение
Упражнение \ (\ PageIndex {1} \)
Какое уравнение вы ожидаете увидеть?
- \ (\ ce {I2 (s) + 2Br (водн.
 ) → Br2 (l) + 2I (водн.)} \)
) → Br2 (l) + 2I (водн.)} \) - \ (\ ce {Cl2 (g) + 2I (водн.) → I2 (s) + 2Cl (водн.)} \)
- Ответ
5.А) Да
Б) №
Проблемы
* Выделите ответ: _____, чтобы просмотреть ответы.
1. Элемент, который является примером металлоида, представляет собой (а) S; (б) Zn; (c) Ge; d) Re; (e) ни один из этих
Ответ: (c) Ge
2. В периодической таблице вертикальные (верхние и нижние) столбцы называются (а) периодами; (б) переходы; (c) семьи / группы; (г) металлоиды; (e) ничего из этого.
Ответ: (c) семьи / группы
3.Почему благородные газы инертны (инертны)?
Ответ: Благородные газы инертны, потому что они уже имеют полную валентную электронную оболочку и имеют небольшую тенденцию к получению или потере электронов.
4. Как называются соединения, содержащие галоген?
Ответ: Соли
5. Лантаноиды и актиниды: (а) щелочноземельные металлы; (б) переходные металлы; (в) металлоиды; (г) щелочные металлы; (e) ни один из этих
Ответ: (б) переходные металлы
Список литературы
- Хлопок, F.
 А .; Уилкинсон, Г. (1988). Продвинутая неорганическая химия (5-е издание). Нью-Йорк: Вили. ISBN 0-471-84997 стр. 1385.
А .; Уилкинсон, Г. (1988). Продвинутая неорганическая химия (5-е издание). Нью-Йорк: Вили. ISBN 0-471-84997 стр. 1385. - Хатчинсон, Джон. «Журнал химического образования». Исследования развития концепции в химии (2007). Распечатать. Внешние ссылки
- Веселый, Уильям Л. (1991). Современная неорганическая химия (2-е изд.). Нью-Йорк: Макгроу-Хилл. ISBN 0-07-112651-1.
- Петруччи, Ральф Х. Общая химия. 9 изд. Нью-Джерси: Пирсон Прентис Холл, 2005.
Глава 2 — Атомы, элементы и Периодическая таблица — Химия
Глава 2 — Атомы, элементы и Периодическая таблицаЭто содержимое также можно загрузить в виде PDF-файла для печати или интерактивного PDF-файла. Для интерактивного PDF-файла требуется Adobe Reader для полной функциональности.
Этот текст опубликован под лицензией Creative Commons, для ссылки и адаптации нажмите здесь.
Ячейки: 2. 1 Что такое органическая химия? 2.2 Элементы, атомы и периодическая таблица Элементы и изобилие Атомная теория Субатомные частицы Протоны определяют идентичность элемента Изотопы и атомная масса Электроны и Периодическая таблица элементов Характеристики Периодической таблицы Менделеева 2.3 Краткое содержание главы 2,4 Ссылки
1 Что такое органическая химия? 2.2 Элементы, атомы и периодическая таблица Элементы и изобилие Атомная теория Субатомные частицы Протоны определяют идентичность элемента Изотопы и атомная масса Электроны и Периодическая таблица элементов Характеристики Периодической таблицы Менделеева 2.3 Краткое содержание главы 2,4 Ссылки 2.1 Что такое органическая химия?
Вы когда-нибудь задумывались, почему одни растения можно использовать для изготовления лекарств, а другие токсичны и могут убить вас? Или почему одни продукты считаются полезными для здоровья, а другие вредны для вас? Или как производятся такие напитки, как пиво, сидр и вино? Этот курс предназначен для ознакомления читателя с фундаментальными концепциями органической химии с использованием потребительских товаров, технологий и услуг в качестве модельных систем для обучения этим основным концепциям и демонстрации того, как органическая химия является неотъемлемой частью повседневной жизни.
Органическая химия — это растущая подгруппа химии. Проще говоря, это исследование всех углеродных соединений; их структура, свойства и реакции и их использование в синтезе. Это химия жизни, включающая все вещества, полученные из живых систем. Применение органической химии сегодня можно увидеть повсюду, от пластиковых компонентов вашего компьютера до нейлона, из которого сделана ваша одежда, до макромолекул и клеток, из которых состоит само ваше тело! Органическая химия расширила наш мир знаний и является неотъемлемой частью областей медицины, биохимии, биологии, промышленности, нанотехнологий, ракетостроения и многих других!
Чтобы начать обсуждение органической химии, нам нужно сначала взглянуть на химические элементы и понять, как они взаимодействуют с образованием химических соединений.
(Вернуться к началу)
2.2 Элементы, атомы и периодическая таблица Элементы и изобилие
Элемент — это вещество, которое не может быть разложено на более простые химические вещества. На Земле известно около 90 природных элементов. Используя технологии, ученые смогли создать около 30 дополнительных элементов, которые нелегко найти в природе. Сегодня химия распознает в общей сложности 118 элементов, которые все представлены на стандартной таблице элементов, называемой Периодической таблицей элементов (рис.2.1). Каждый элемент представлен одно- или двухбуквенным кодом, где первая буква всегда пишется с заглавной буквы, а если присутствует вторая буква, она пишется строчными буквами. Например, символ водорода — H, а символ углерода — C. Некоторые элементы имеют, казалось бы, странные буквенные коды, например, натрий — это Na. Эти буквенные коды получены из латинской терминологии. Например, символ натрия (Na) происходит от латинского слова natrium, что означает карбонат натрия.
На Земле известно около 90 природных элементов. Используя технологии, ученые смогли создать около 30 дополнительных элементов, которые нелегко найти в природе. Сегодня химия распознает в общей сложности 118 элементов, которые все представлены на стандартной таблице элементов, называемой Периодической таблицей элементов (рис.2.1). Каждый элемент представлен одно- или двухбуквенным кодом, где первая буква всегда пишется с заглавной буквы, а если присутствует вторая буква, она пишется строчными буквами. Например, символ водорода — H, а символ углерода — C. Некоторые элементы имеют, казалось бы, странные буквенные коды, например, натрий — это Na. Эти буквенные коды получены из латинской терминологии. Например, символ натрия (Na) происходит от латинского слова natrium, что означает карбонат натрия.
Рисунок 2.1: Элементы. Некоторые примеры чистых элементов включают (A) висмут, Bi, тяжелый металл, используемый в качестве замены свинца и в некоторых лекарствах, таких как пептобисмол, противодиарейное средство и (B) стронций, Sr, основной компонент фейерверков. (C) Все обнаруженные элементы представлены в Периодической таблице элементов, которая обеспечивает элегантный механизм не только для отображения элементов, но и для описания многих их характеристик.
(C) Все обнаруженные элементы представлены в Периодической таблице элементов, которая обеспечивает элегантный механизм не только для отображения элементов, но и для описания многих их характеристик.
Элементы широко различаются по содержанию.Во Вселенной в целом наиболее распространенным элементом является водород (около 90%), за ним следует гелий (большая часть оставшихся 10%). Все остальные элементы присутствуют в относительно незначительных количествах, насколько мы можем обнаружить. Однако на планете Земля ситуация несколько иная. Кислород составляет 46,1% массы земной коры (относительно тонкий слой горных пород, образующих поверхность Земли), в основном в сочетании с другими элементами, в то время как кремний составляет 28,5%. Водород, самый распространенный элемент во Вселенной, составляет всего 0.14% земной коры. В таблице 2.1 «Элементный состав Земли» перечислены относительные содержания элементов на Земле в целом и в земной коре. Таблица 2.2 «Элементный состав человеческого тела» перечисляет относительное содержание элементов в человеческом теле. Если вы сравните Таблицу 2.1 «Элементный состав Земли» и Таблицу 2.2 «Элементный состав человеческого тела», вы обнаружите несоответствия между процентным содержанием каждого элемента в человеческом теле и на Земле. Кислород имеет самый высокий процент в обоих случаях, но углерод, элемент со вторым по величине процентным содержанием в организме, относительно редко встречается на Земле и даже не фигурирует как отдельная запись в Таблице 2.1 «Элементный состав Земли»; углерод входит в 0,174% «других» элементов. Как человеческое тело концентрирует столько, казалось бы, редких элементов?
Если вы сравните Таблицу 2.1 «Элементный состав Земли» и Таблицу 2.2 «Элементный состав человеческого тела», вы обнаружите несоответствия между процентным содержанием каждого элемента в человеческом теле и на Земле. Кислород имеет самый высокий процент в обоих случаях, но углерод, элемент со вторым по величине процентным содержанием в организме, относительно редко встречается на Земле и даже не фигурирует как отдельная запись в Таблице 2.1 «Элементный состав Земли»; углерод входит в 0,174% «других» элементов. Как человеческое тело концентрирует столько, казалось бы, редких элементов?
Относительное количество элементов в организме связано не столько с их изобилием на Земле, сколько с их доступностью в форме, которую мы можем усвоить. Мы получаем кислород из воздуха, которым дышим, и воды, которую пьем. Мы также получаем водород из воды. С другой стороны, хотя углерод присутствует в атмосфере в виде углекислого газа, и около 80% атмосферы составляет азот, мы получаем эти два элемента из пищи, которую мы едим, а не из воздуха, которым мы дышим.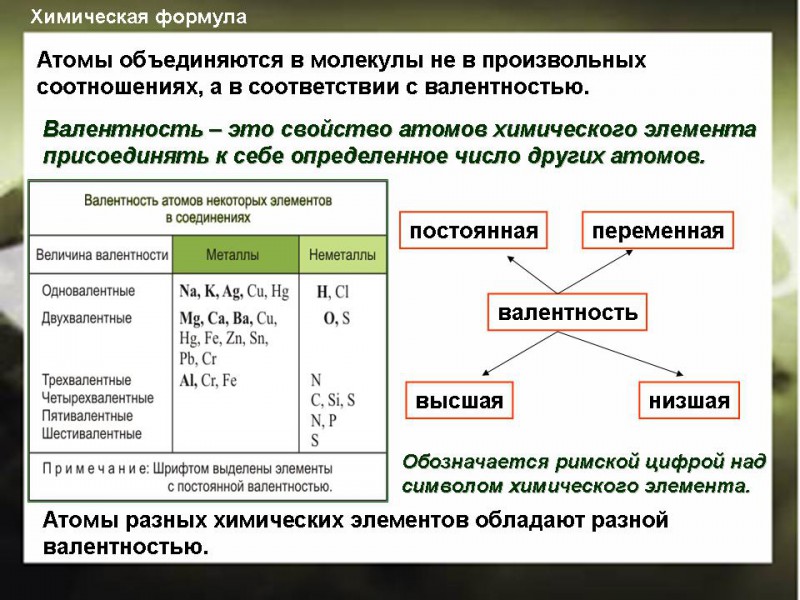
(Вернуться к началу)
Атомная теория
Современная атомная теория, предложенная около 1803 года английским химиком Джоном Дальтоном, представляет собой фундаментальную концепцию, согласно которой все элементы состоят из атомов. Атом — это наименьшая часть элемента, которая поддерживает идентичность этого элемента. Отдельные атомы чрезвычайно малы; даже самый большой атом имеет приблизительный диаметр всего 5,4 × 10 −10 м.При таком размере требуется более 18 миллионов этих атомов, выстроенных бок о бок, чтобы равняться ширине вашего мизинца (около 1 см).
Большинство элементов в чистом виде существуют в виде отдельных атомов. Например, макроскопический кусок металлического железа состоит из отдельных атомов железа. Однако некоторые элементы существуют в виде групп атомов, называемых молекулами. Некоторые важные элементы существуют в виде двухатомных комбинаций и называются двухатомными молекулами. При представлении двухатомной молекулы мы используем символ элемента и включаем нижний индекс 2, чтобы указать, что два атома этого элемента соединены вместе.Элементами, которые существуют в виде двухатомных молекул, являются водород (H 2 ), кислород (O 2 ), азот (N 2 ), фтор (F 2 ), хлор (Cl 2 ), бром ( Br 2 ) и йода (I 2 ).
При представлении двухатомной молекулы мы используем символ элемента и включаем нижний индекс 2, чтобы указать, что два атома этого элемента соединены вместе.Элементами, которые существуют в виде двухатомных молекул, являются водород (H 2 ), кислород (O 2 ), азот (N 2 ), фтор (F 2 ), хлор (Cl 2 ), бром ( Br 2 ) и йода (I 2 ).
(Вернуться к началу)
Субатомные частицы
В атомную теорию Дальтона внесено несколько незначительных, но важных изменений.Во-первых, Дальтон считал атомы неделимыми. Теперь мы знаем, что атомы не только могут быть разделены, но также состоят из трех разных типов частиц со своими собственными свойствами, отличными от химических свойств атомов.
Первая субатомная частица была идентифицирована в 1897 году и названа электроном. Это чрезвычайно крошечная частица с массой около 9,109 × 10 −31 кг. Эксперименты с магнитными полями показали, что электрон имеет отрицательный электрический заряд.
Эксперименты с магнитными полями показали, что электрон имеет отрицательный электрический заряд.
К 1920 году экспериментальные данные указали на существование второй частицы. Протон имеет такой же заряд, что и электрон, но его заряд положительный, а не отрицательный. Еще одно важное различие между протоном и электроном — это масса. Хотя масса протона все еще невероятно мала, она составляет 1,673 × 10 −27 кг, что почти в 2000 раз больше массы электрона. Поскольку противоположные заряды притягиваются друг к другу (в то время как «одинаковые» заряды отталкиваются), протоны притягивают электроны (и наоборот).
Наконец, дополнительные эксперименты указали на существование третьей частицы, называемой нейтроном. Доказательства, полученные в 1932 году, установили существование нейтрона, частицы с массой примерно такой же, как у протона, но без электрического заряда.
Теперь мы понимаем, что все атомы можно разбить на субатомные частицы: протоны, нейтроны и электроны. В таблице 2.3 «Свойства субатомных частиц» перечислены некоторые из их важных характеристик и символы, используемые для обозначения каждой частицы.Эксперимент показал, что протоны и нейтроны сосредоточены в центральной области каждого атома, называемой ядром (во множественном числе, ядрами). Электроны находятся вне ядра и вращаются вокруг него, потому что их притягивает положительный заряд ядра. Большая часть массы атома находится в ядре, в то время как вращающиеся электроны определяют размер атома. В результате атом состоит в основном из пустого пространства. (Рисунки 2.4 и 2.5).
В таблице 2.3 «Свойства субатомных частиц» перечислены некоторые из их важных характеристик и символы, используемые для обозначения каждой частицы.Эксперимент показал, что протоны и нейтроны сосредоточены в центральной области каждого атома, называемой ядром (во множественном числе, ядрами). Электроны находятся вне ядра и вращаются вокруг него, потому что их притягивает положительный заряд ядра. Большая часть массы атома находится в ядре, в то время как вращающиеся электроны определяют размер атома. В результате атом состоит в основном из пустого пространства. (Рисунки 2.4 и 2.5).
Рис. 2.4 Анатомия атома. Протоны и нейтроны атома сгруппированы в центре атома в структуре, называемой ядром. Электроны вращаются вокруг ядра атома внутри электронного облака или пустого пространства, которое окружает ядро атома. Обратите внимание, что большую часть площади атома занимает пустое пространство электронного облака.
Источник: https://upload. wikimedia.org/wikipedia/commons/2/24/Figure_02_01_01.jpg
wikimedia.org/wikipedia/commons/2/24/Figure_02_01_01.jpg
Рис. 2.5. Путь электрона в атоме водорода. Электроны не находятся на дискретных орбитах, как планеты вокруг Солнца. Вместо этого существует вероятность того, что электрон может занять определенное пространство в электронном облаке. (А) Чем темнее цвет, тем выше вероятность того, что один электрон водорода окажется в этой точке в любой момент времени. (б) Точно так же, чем больше точек, тем выше вероятность того, что один электрон водорода окажется в этой точке. На обеих диаграммах ядро находится в центре диаграммы.
(Вернуться к началу)
Протоны определяют идентичность элемента
Оказывается, количество протонов, содержащихся в ядре атома, является ключевой характеристикой, определяющей его химические свойства.Короче говоря, элемент определяется количеством протонов, обнаруженных в его ядре. Число протонов в элементе также называется его атомным номером и обозначается математическим термином Z (рис. 2.6). Если вы вернетесь к Периодической таблице элементов, показанной на рисунке 2.1, вы увидите, что периодическая таблица организована по количеству протонов, содержащихся в элементе. Таким образом, когда вы читаете каждую строку Периодической таблицы (слева направо), каждый элемент увеличивается на один протон (или один атомный номер, Z ).
Рис. 2.6 Структура Периодической таблицы. Каждый элемент периодической таблицы представлен атомным символом (Cu для меди), атомным номером в верхнем левом углу и атомной массой в правом углу.
(Вернуться к началу)
Изотопы, аллотропы и атомная масса
Сколько нейтронов в атомах того или иного элемента? Сначала думали, что количество нейтронов в ядре тоже характерно для элемента.Однако было обнаружено, что атомы одного и того же элемента могут иметь разное количество нейтронов. Атомы одного и того же элемента, имеющие разное количество нейтронов, называются изотопами (рис. 2.7). Например, 99% атомов углерода на Земле имеют в своих ядрах 6 нейтронов и 6 протонов; около 1% атомов углерода имеют в своих ядрах 7 нейтронов и 6 протонов. Таким образом, встречающийся в природе углерод на Земле на самом деле представляет собой смесь изотопов, хотя и на 99% состоит из углерода с 6 нейтронами в каждом ядре.Изотопный состав оказался полезным методом датирования многих слоев горных пород и окаменелостей.
Рис. 2.7 Изотопы водорода. Все атомы водорода имеют один протон и один электрон. Однако они могут различаться по количеству нейтронов. (a) Большинство атомов водорода содержат только один p + и один e- и не содержат нейтронов. (b) Небольшое количество водорода существует в виде изотопа дейтерия, который имеет один протон и один нейтрон в своем ядре, и (c) еще меньшее количество содержит один протон и два нейтрона в его ядре и называется тритием.Обратите внимание, что тритий является нестабильным изотопом и со временем разрушается. Таким образом, тритий — радиоактивный элемент.
Большинство элементов существуют в виде смесей изотопов. Фактически, в настоящее время известно более 3500 изотопов всех элементов. Когда ученые обсуждают отдельные изотопы, им нужен эффективный способ указать количество нейтронов в каждом конкретном ядре. Атомная масса (A) атома — это сумма количества протонов и нейтронов в ядре (рис. 2.6).Зная атомную массу ядра (и зная атомный номер Z этого конкретного атома), вы можете определить количество нейтронов, вычитая атомный номер из атомной массы.
Простой способ указать массовое число конкретного изотопа — указать его как надстрочный индекс слева от символа элемента. Атомные номера часто указываются в виде нижнего индекса слева от символа элемента. Таким образом, мы можем увидеть
, который указывает на конкретный изотоп меди.29 — это атомный номер Z (который одинаков для всех атомов меди), а 63 — это атомная масса (A) изотопа. Чтобы определить количество нейтронов в этом изотопе, мы вычитаем 29 из 63: 63 — 29 = 34, так что в этом атоме 34 нейтрона.
Аллотропы элемента отличаются от термина «изотоп», и их не следует путать. Некоторые химические элементы могут образовывать более одного типа структурной решетки, эти разные структурные решетки известны как аллотропы .Это справедливо для фосфора, как показано на Рисунке 2.2. Белый или желтый фосфор образуется, когда четыре атома фосфора выстраиваются в тетраэдрическую конформацию (рис. 2.8). Другие кристаллические решетки фосфора более сложные и могут быть сформированы путем воздействия на фосфор различных температур и давлений. Например, решетку из красного фосфора в виде клетки можно сформировать, нагревая белый фосфор до температуры выше 280 o ° C (рис. 2.8). Обратите внимание, что аллотропные изменения влияют на то, как атомы элемента взаимодействуют друг с другом, образуя трехмерную структуру.Они не изменяют образец в отношении присутствующих атомных изотопных форм, и НЕ изменяют или не влияют на атомную массу ( A ) элемента.
Различные аллотропы разных элементов могут иметь разные физические и химические свойства и, таким образом, по-прежнему важны для рассмотрения. Например, у кислорода есть два разных аллотропа, причем преобладающим аллотропом является двухатомная форма кислорода, O 2 . Однако кислород также может существовать как O 3 , озон.В нижних слоях атмосферы озон образуется как побочный продукт в выхлопных газах автомобилей и других промышленных процессах, где он способствует загрязнению. Он имеет очень резкий запах и является очень сильным окислителем. Это может вызвать повреждение слизистых оболочек и дыхательных тканей у животных. Воздействие озона связывают с преждевременной смертью, астмой, бронхитом, сердечными приступами и другими сердечно-легочными заболеваниями. В верхних слоях атмосферы он создается естественными электрическими разрядами и существует в очень низких концентрациях.Присутствие озона в верхних слоях атмосферы критически важно, поскольку он улавливает очень разрушительное ультрафиолетовое излучение Солнца, не позволяя ему достичь поверхности Земли.
Рисунок 2.8 Аллотропы фосфора. (A) Белый фосфор существует как (B) тетраэдрическая форма фосфора, тогда как (C) красный фосфор имеет кристаллическую решетку, более похожую на (D) клетку. (E) Различные элементарные формы фосфора могут быть созданы путем обработки образцов белого фосфора при повышении температуры и давления.
Источник: https://en.wikipedia.org/wiki/Allotropes_of_phosphorus
(Вернуться к началу)
Электроны и Периодическая таблица элементов
Помните, что электроны в 2000 раз меньше протонов, и все же каждый из них имеет равный, но противоположный заряд. Электроны имеют отрицательный заряд, а протоны — положительный. Интересно, что когда элементы существуют в своей элементарной форме, как показано в периодической таблице, количество электронов, заключенных в атоме, равно количеству протонов.Следовательно, электрический заряд элемента нейтрализуется, и общий заряд атома равен нулю.
Электроны — подвижная часть атома. Они движутся и вращаются вокруг ядра атома в электронном облаке, этот термин используется для обозначения пространства вокруг ядра. Однако они не перемещаются случайным образом. Электроны имеют адреса или определенные орбитальные вращения в электронном облаке, почти так же, как наши многоквартирные дома имеют адреса в наших городах. Чтобы найти адрес электрона, вам нужно немного узнать об организации электронного облака (… или города, в котором живет электрон).
Электронное облако атома разделено на слои, называемые оболочками, примерно так же, как у луковицы слои, когда вы ее очищаете. Однако неправильно думать о скорлупе как о едином слое без толщины и глубины. Оболочка имеет трехмерное пространство внутри, которое содержит большое количество «квартир» или пространств, которые могут занимать электроны. Таким образом, оболочка или число n — это только первая часть адреса электрона в атоме. Это было бы похоже на знание района, в котором живет ваш друг.Если вы знаете только окрестности, вам будет сложно найти друга, если вы захотите пригласить его на ужин.
Всего у атома может быть 7 оболочек (или слоев) для размещения его электронов. Если атом маленький, у него может быть только 1 или 2 оболочки. Только очень большие атомы имеют все 7 слоев. После этого добавление 8-й оболочки, кажется, делает атом слишком нестабильным, чтобы существовать … по крайней мере, мы никогда не находили атомы, содержащие 8-ю оболочку! В периодической таблице (рис. 2.9) вы заметите, что всего 7 строк в периодической таблице (обратите внимание, что строки элементов лантанидов и актинидов обычно показаны под основной таблицей, чтобы они умещались на одной странице, но они действительно находятся в середине строк 6 и 7 периодической таблицы в соответствии с их атомными номерами).Каждая из этих строк представляет собой электронную оболочку. Таким образом, по мере того, как атомы становятся больше и содержат больше электронов, они приобретают дополнительные оболочки, вплоть до 7.
Рис. 2.9 Структура Периодической таблицы. Каждый элемент периодической таблицы представлен атомным символом (Cu для меди), атомным номером в верхнем левом углу и атомной массой в правом углу.
Источник: Робсон Г. (2006) Википедия. https://en.wikipedia.org/wiki/Electron_shell
В этом учебнике мы не занимаемся изучением адресов всех электронов, но нас очень интересуют электроны, которые находятся ближе всего к поверхности атома, или те, которые находятся на внешней оболочке атома.Электроны, которые находятся ближе всего к поверхности атома, являются наиболее реактивными и участвуют в образовании связей между атомами. Считается, что эти электроны размещены в валентной оболочке атома или электронной оболочке, которая находится дальше всего от ядра атома. (или ближайший к поверхности атома).
(Вернуться к началу)
Особенности периодической таблицы
Элементы со схожими химическими свойствами сгруппированы в столбцы, называемые группами (или семействами).Некоторые из этих групп не только пронумерованы, но и имеют названия — например, щелочные металлы (первый столбец элементов), щелочноземельные металлы (второй столбец элементов), галогены (предпоследний столбец элементов), и благородные газы (последний столбец элементов).
Каждая строка элементов периодической таблицы называется периодом. Периоды имеют разную длину; в первом периоде всего 2 элемента (водород и гелий), а во втором и третьем периодах по 8 элементов. Четвертый и пятый периоды содержат по 18 элементов, а более поздние периоды настолько длинные, что сегмент из каждого удаляется и помещается под основной частью таблицы.
Определенные свойства элементов становятся очевидными при обзоре таблицы Менделеева в целом. Каждый элемент можно классифицировать как металл, неметалл или полуметалл, как показано на Рисунке 2.10 «Типы элементов». Металл — это блестящее вещество, обычно (но не всегда) серебристого цвета, которое отлично проводит электричество и тепло. Металлы бывают также пластичными (их можно раскалывать на тонкие листы) и пластичными (их можно вытягивать в тонкую проволоку). Неметалл обычно тусклый и плохо проводит электричество и тепло.Твердые неметаллы также очень хрупкие. Как показано на рис. 2.7 «Типы элементов», металлы занимают три левых четверти таблицы Менделеева, а неметаллы (за исключением водорода) сгруппированы в верхнем правом углу таблицы Менделеева. Элементы со свойствами, промежуточными между свойствами другого способа категоризации элементов периодической таблицы, показаны на Рисунке 2.11 «Специальные имена для разделов Периодической таблицы». Первые два столбца слева и последние шесть столбцов справа называются элементами основной группы.Блок из десяти столбцов между этими столбцами содержит переходные металлы. Два ряда под основной частью таблицы Менделеева содержат внутренние переходные металлы. Элементы в этих двух рядах также называются соответственно металлами-лантаноидами и металлами-актинидами (рис. 2.11).
Рис. 2.10. Типы элементов. Элементы бывают металлы, неметаллы или полуметаллы. Каждая группа расположена в разных частях периодической таблицы.
Рис 2.11. Специальные имена для разделов Периодической таблицы. Некоторые разделы периодической таблицы имеют особые названия. Например, элементы литий, натрий, калий, рубидий, цезий и франций вместе известны как щелочные металлы. Обратите внимание, что элементы основной группы не включают переходные металлы.
Периодическая таблица Менделеева построена на основе сходства свойств элементов, но чем объясняется это сходство? Оказывается, расположение столбцов или семейств в Периодической таблице отражает то, как подоболочки заполнены электронами.Следует отметить, что элементы в одном столбце имеют одинаковую электронную конфигурацию валентной оболочки. Например, все элементы в первом столбце имеют один электрон в своей валентной оболочке. Это последнее наблюдение очень важно. Химия в значительной степени является результатом взаимодействия валентных электронов разных атомов. Таким образом, атомы с одинаковой электронной конфигурацией валентной оболочки будут иметь схожий химический состав (рис. 2.12).
Рис. 2.12. Число электронов валентной оболочки. Расположение элементов в периодической таблице соответствует количеству валентных электронов, заключенных в этом элементе. Все семейства (столбцы) в периодической таблице содержат одинаковое количество электронов валентной оболочки, что придает им схожие химические свойства и реакционную способность. Вы можете легко пересчитать элементы основной группы, чтобы увидеть увеличивающееся количество электронов в валентной оболочке. Все переходные металлы имеют 2 e- в своей валентной оболочке, хотя они также содержат внутреннюю орбитальную подоболочку, которая очень близка к валентной оболочке.Это придает некоторым из этих металлов разную реакционную способность. Обратите внимание, что максимальное возможное количество электронов валентной оболочки — 8, и это достигается только благородными газами.
Рис. 2.13. Роль железа в транспортировке кислорода. Белок гемоглобина составляет около 95% сухого содержимого красных кровяных телец, и каждый белок гемоглобина может связывать и переносить четыре молекулы кислорода (O 2 ).
Взято из: https: // en.wikipedia.org/wiki/Hemoglobin и https://en.wikipedia.org/wiki/Capillary
(Вернуться к началу)
2.3 Краткое содержание главы
(Вернуться к началу)
2,4 Ссылки
Материалы главы 2 были адаптированы из следующих ресурсов Creative Commons, если не указано иное:
1. Портал органической химии. WikiUniversity. Доступно по адресу: https: // en.wikiversity.org/wiki/Portal:Organic_chemistry
2. Аноним. (2012) Введение в химию: общие, органические и биологические (V1.0). Опубликовано по лицензии Creative Commons by-NC-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html
3. Поульсен Т. (2010) Введение в химию. Опубликовано по лицензии Creative Commons by-NC-sa 3.0. Доступно по адресу: http://openedgroup.org/books/Chemistry.pdf
PhysicalGeology.лекции 3-4
Я могу представить себе, что в классе есть ученики, которые не изучали химию в старшей школе или не перевели ее из другого колледжа. Потребуются некоторые фундаментальные знания химии, а лекции и текст должны предоставить вам достаточный фон. Не паникуйте, если это новый материал. Читайте тексты, прочтите это резюме и задавайте вопросы! Обычно эти аннотации не содержат такого большого количества текста, как это. Это связано с тем, что прошлый опыт подсказывает, что в этом разделе необходим дополнительный материал, чтобы подвести всех примерно к одинаковому уровню понимания.Одна из целей — познакомить вас с некоторыми важными материалами Земли; Показанные выше кристаллы аметиста высоко ценились за их эстетическое качество. [Иллюстрация — http: //www.nosc. mil / planet_earth / photos.html]
Состояния Материи
Все, что имеет массу и занимает пространство, является материей. Следующая классификация поможет определить состояния, в которых может находиться материя.
- Твердое вещество — твердое вещество, которое сохраняет свою форму, если оно не искажается силой.
- Кристаллическое твердое тело — как указано выше, а структура (распределение компонентов) очень регулярная и повторяющаяся — дальний порядок
- Некристаллическое твердое тело — как указано выше, но структура демонстрирует ближний порядок — стекло является некристаллическим или аморфным твердым телом
- Жидкость — легко течет и принимает форму своего сосуда — ближний порядок
- Газ — легко течет и расширяется, заполняя свой контейнер — беспорядок структура
Прочтите этот материал, пока не дойдете до раздела, посвященного скалам.
Минерал:
- представляет собой кристаллическое твердое вещество
- встречается в природе
- является неорганическим — не образуется как часть жизненного процесса
- имеет фиксированный химический состав или состав, который варьируется в известной степени
Вся материя состоит из химических элементов, каждый из которых состоит из частиц, называемых атомами. Довольно грубая, но полезная картина атома — это жесткая сфера. Радиусы этих атомов составляют несколько Ангстрем (где Ангстрем составляет 10-10 см.Есть 92 так называемых естественных элемента, 89 из которых могут быть обнаружены на Земле в настоящее время. Вам остается подумать о том, что случилось с «пропавшей тройкой».
Эти сферы содержат центральное ядро, которое содержит два типа частиц:
- протонов, несущих положительный заряд, и
- нейтронов, нейтральных (без заряда)
Атомный номер — это количество протонов в ядре атома. Атомное массовое число — это количество протонов и нейтронов в ядре.Все атомы элемента имеют одинаковое количество протонов — следовательно, один и тот же атомный номер; например, все атомы водорода имеют в ядре один протон. Каждому элементу присвоен символ — H для водорода. Вы должны выучить символы восьми самых распространенных элементов в земной коре (кислород (O), кремний (Si), алюминий (Al), кальций (Ca), железо (Fe), магний (Mg), натрий ( Na) и калий (K).
Если бы мы могли взвесить отдельные атомы водорода, мы бы обнаружили некоторое изменение их массы; это должно быть связано с вариациями в количестве атомов водорода. нейтроны в своем ядре, как и все, должны иметь одинаковое количество протонов.Атомы, которые имеют одинаковый атомный номер, но разные массовые числа, — это изотопов . Например, все атомы углерода имеют атомный номер 6, но есть три изотопа углерода -12, 13 и 14. (Сколько нейтронов у каждого изотопа?)
Помимо частиц в ядре есть отрицательно заряженные частицы — электрона, , которые «вращаются» вокруг центрального ядра. Признание того, что распределение электронов вокруг ядра не является случайным, было одним из величайших достижений физиков 1920-х годов — квантовой механики.Электроны занимают «уровни», которые отделены от каждого некоторым объемом пространства, через которое электроны могут проходить, но не оставаться. Фактически, большая часть объема атома состоит из пустого пространства. [Я помню, как Супермен мог проходить сквозь твердые объекты!] Электроны «притягиваются» к ядру (притягиваются положительные и отрицательные заряды). Первичное деление этих уровней называется главным квантовым числом. Первый уровень (К) находится ближе всего к ядру. По мере увеличения главного числа 1…2 …. 3 …. 4 количество электронов, которые могут находиться на уровне, увеличивается.
Уровень электронов 1 = К 2 2 = L 8 3 = М 18 4 = N 32Максимальная вместимость = 2n2 (дважды n в квадрате)
В нейтральном атоме количество отрицательных частиц равно количество положительных частиц (электроны = протоны).
Полезное упражнение — начать с первого элемента (водорода) с одним протоном и одним электроном и добавить один протон и один электрон для создания оставшихся химических элементов.Процесс наращивания работает следующим образом. Начнем с одного электрона — он занимает пустое место. ближайший к ядру уровень. второй электрон переходит на первый уровень (атомарный гелий) и оболочка К) заполнена. Собственно, внутри основного уровня есть подуровни (кроме К-оболочка).
Максимальное количество электронов субоболочки с 2 стр. 6 d 10 ж 14Для элемента 11 (Натрий — Na) есть 11 электронов и 11 протонов. Два электрона находятся в оболочке K, 8 — в оболочке L и один — в оболочке M.Самый дальний электрон (ы) называется валентных электронов. Если бы один электрон был удален каков баланс между положительными и отрицательными зарядами? An ион — заряженный атом; то есть есть избыток положительных ( катион, ) или отрицательный заряд ( анион ). Если удалить электрон, катион сформирован. Если добавлен электрон, образуется анион. Из восьми наиболее распространенных элементов в земной коре только кислород образует анионы; остальные образуют катионы, теряя один или несколько электронов.Когда есть 8 самых внешних электронов в s- и p-подоболочках, атом имеет тенденцию сопротивляться изменениям, и ионы образуются с большим трудом, если вообще образуются.
Орбитали основного уровня K 1 с (макс. = 2) Всего = 2 L 2с (макс = 2), 2р (макс = 6) Всего = 8 M 3s (max = 2), 3p (max = 6), 3д (max = 10) Всего = 18Химическая связь — большинство элементов на Земле вступают в реакцию с образованием соединений, хотя некоторые из них стабильны как элементы (например, золото). Есть несколько «моделей склеивания», которые необходимо обобщить.
- Ионная связь — Элемент 11 (натрий) имеет единственный валентный электрон, который может быть относительно легко потерян, поскольку он относительно далеко от положительных зарядов в ядре. Потребность кислорода (атомный номер 8) требует двух электронов, чтобы дать ему полные s- и p-подоболочки. Соединение Na2O состоит из двух катионов натрия и одного аниона кислорода. Каждый натрий вносит один электрон в кислород, придавая ему заряд -2. Это соединение «скреплено» ионными связями.
- Ковалентная связь — Углерод содержит 6 электронов, 4 из которых находятся на самом внешнем уровне (L-уровень).Два атома углерода могут соединиться, поделившись своими четырьмя электронами, что создаст полные s- и p-подоболочки в L-основной оболочке. Ковалентная связь предполагает обмен электронами.
- Металлическое соединение — Металлы известны своей способностью проводить поток электронов. Металлическая связь включает в себя «размытие» валентных электронов атомов металла. Эти электроны легко перемещаются.
- Соединение Ван-дер-Ваальса Атомы углерода в графите связаны друг с другом конвалентными связями, образуя слои из атомов углерода.Листы удерживаются вместе слабыми силами притяжения.
Признание того, что элементы могут быть организованы систематическим образом, чтобы подчеркнуть отношения между атомами, было крупным прорывом в истории химии.Например, все элементы в первом столбце (щелочные металлы) имеют один внешний электрон в своей самой внешней подоболочке (s-подоболочке). Все эти элементы могут потерять один электрон, образуя катион с зарядом +1. Все элементы в крайнем правом столбце (инертные или нобелевские газы) имеют два s-электрона и восемь p-электронов на своем внешнем уровне (называемом валентным уровнем). Обратите внимание, что Периодическая таблица имеет форму искаженной буквы «H». Вертикальные полосы (стороны H) содержат элементы группы A.Центральная полоса содержит «переходные» элементы. Внизу страницы два ряда — «Лантаноиды» и «Актиниды». Посмотрите, где эти строки вписываются в букву «H». Если бы эти строки, которые показаны в правильном положении, Периодическая таблица была бы менее компактной.
Вопросы
- Что такое атом?
- Ничья поперечное сечение атома и найдите эти три частицы.
- Какие 8 наиболее распространенных элементов составляют Землю? корочка? Сколько здесь катионов? Сколько анионов? Какой самый большой? Какой самый маленький? Обратите внимание (из текста и из класса), что кислород и кремний составляют 75% веса земной коры.
- Как этот список соотносится с наиболее распространенными элементами в … Вселенная … атмосфера Земли … вся Земля.
- Опишите связывание … ионное … ковалентное … другие типы
Подумайте о утверждении, что кислород занимает 95% объема земной коры. Если бы кислород был кубиками, их можно было бы собрать вместе, чтобы заполнить пространство. Однако предполагается, что атомы кислорода являются сферами, и вы не можете упаковать сферы одинакового размера, чтобы заполнить все пространство; некоторые открытые пространства останутся внутри каркаса, созданного кислородом.В эти открытые пространства вписываются и другие ионы. В общем, эти пространства «правильные». Один из распространенных типов пространства — это пространство, которое создается, когда есть три атома кислорода внизу и один вверху. Это называется «четырехгранная пустота». (Тетраэдр — это правильное твердое тело, состоящее из четырех граней, каждая из которых представляет собой равносторонний треугольник.) Чем больше ион, тем больше предпочтительное место. Координационное число катиона — это число ближайших соседних анионов. Кремний, за одним исключением, предпочитает «сидеть» в тетраэдрической пустоте, образованной упаковкой анионов кислорода вместе.Таким образом, кремний обычно имеет координационное число 4. Координационные числа используются для получения структурной формулы. Помните, что нижние индексы указывают количество ионов в одной формульной единице, а числа над химическими символами — координационные числа.
Кварцевый 4 SiO2 Стишовит 6 SiO2Кварц и стишовит — полиморфа (много форм). Они имеют одинаковый химический состав, но различаются по структуре и, следовательно, по физическим свойствам. Увеличение давления способствует большему координационному числу.Температура имеет обратный эффект. Если бы большой метеорит столкнулся с кварцем, то мог бы образоваться стишовит (если бы давление было достаточно высоким).
Другие полиморфы
- алмаз и графит (оба углерода)
- кальцит и арагонит (оба карбонат кальция)
Форстерит 6 4 Mg2SiO4 Фаялит 6 4 Fe2SiO4
Обратите внимание, что два минерала различаются химически: один содержит Mg (магний), а другой — Fe (железо). В остальном химические формулы идентичны. Обратите внимание, что и Mg, и Fe находятся в 6-кратных сайтах (октаэдрических). Размеры этих двух ионов почти идентичны, заряд на обоих составляет +2, а связи Mg-O и Fe-O имеют преимущественно ионную природу. Когда происходит такое сходство, ионы могут замещать друг друга, образуя серию твердых растворов .Ряд между этими двумя концевыми элементами называется серией оливина . Составы варьируются от чистого форстерита до чистого фаялита. Не все серии твердых растворов являются полными; некоторые демонстрируют ограниченное количество замещения.
Практически все обычные минералы, с которыми мы будем работать, представляют собой твердые растворы. Кварц — заметное исключение.
Классификация полезных ископаемых
Широчайшая классификация почти 3500 известных минералов основана на химическом составе.Таким образом, мы распознаем природные элементы (отдельные химические элементы), карбонаты (содержащие группу CO3, силикаты (содержащие кремний и кислород) и другие широкие химические группы.
Химически силикаты очень сложны, и не было достигнуто большого прогресса в понимании, пока не была разработана структурная классификация. Самый распространенный «структурный элемент» — кремний / кислородный тетраэдр. Простейший структурный класс силикатов состоит из тех соединений (минералов), которые состоят из отдельных одиночных тетраэдров — несосиликатов.Тетраэдры могут разделять между собой атомы кислорода. Два, три и четыре атома кислорода на тетраэдр могут быть общими, а в некоторых структурах существуют две или более схемы совместного использования. Ниже перечислены наиболее распространенные минералы. (имейте в виду, что все они содержат Si и О. многие также содержат Al).
| Минерал | Структурный тип | Состав | Оливин | Изолированный | Богатый Fe и Mg |
|---|---|---|
| Пироксен | Одинарные цепи | Ca, Fe и Mg с высоким содержанием | Амфибол | Двойные цепи | Богатые Ca, Fe, Mg и K (с OH) | Слюда | Листовые силикаты | K, богатые Na (с «ОН») | Плагиоклаз | Тектозикаты | Богатые Ca и Na | Щелочной полевой шпат | Тектосиликаты | Богатые Na и K | Кварц | Тектосиликаты | Si |
Кроме того, важны следующие минеральные группы — особенно в осадочных породах
Карбонаты
Сульфаты
Соли
Силикатная структурная классификация .[затем вернитесь на эту страницу]
Вопросы
Используйте раздел Properties , чтобы ответить на следующие вопросы.
- Различают излом и скол
- Что такое блеск?
- Кварц имеет твердость 7, а тальк — 1. Кварц в семь раз тверже талька? Объясните, что это за весы Шкала Мооса и как ими пользоваться. Как алмаз «ограняется»?
- Что такое удельный вес? Удельный вес континентальной коры равен 2.6, тогда как удельный вес океанической коры равен 3,0.
- Кварц и полевой шпат — два самых распространенных минерала в земной коре. Как это согласуется со списком самых распространенных элементов в земной коре?
- Континентальная кора — щелочной полевой шпат
- Океаническая кора — плагиоклаз
- Континентальная кора — щелочной полевой шпат
Хороший индекс минералов и драгоценных камней доступен для студентов Университета Висконсина .
Если вам нравится рассматривать образцы минералов, вы, вероятно, захотите взглянуть на некоторые изображения из Смитсоновской коллекции минералов Смитсоновские минералы
Вернуться к списку литературы по Physical Geology
Вернуться на главную страницу Physical Geology
Понимание элементов — Урок — TeachEngineering
(2 Рейтинги)Быстрый просмотр
Уровень оценки: 6 (5-7)
Требуемое время: 15 минут
Зависимость урока: Нет
Тематические области: Химия, Физические науки
Ожидаемые характеристики NGSS:
Поделиться:
Резюме
Студенты изучают периодическую таблицу и свойства элементов.Они изучают базовое определение элемента и 18 элементов, из которых состоит большая часть материи Вселенной. Периодическая таблица описывается как один из методов организации элементов. Также рассмотрены концепции физических и химических свойств. Эта инженерная программа соответствует научным стандартам нового поколения (NGSS).Инженерное соединение
Инженеры используют свойства материи, чтобы решить, какие материалы использовать при создании и строительстве вещей.Например, металлы обладают определенными свойствами, которые позволяют им сгибаться или не сгибаться, расширяться и сжиматься, а также удерживать определенное количество веса. Инженеры также используют химические свойства различных элементов для разработки смесей и веществ для новых лекарств и продуктов.
Цели обучения
- Различают физические и химические свойства.
- Опишите расположение элементов в периодической таблице элементов.
- Опишите, как инженеры используют знания о физических и химических свойствах элементов при выборе материалов для продуктов.
Образовательные стандарты
Каждый урок или задание TeachEngineering соотносится с одним или несколькими научными дисциплинами K-12, образовательные стандарты в области технологий, инженерии или математики (STEM).
Все 100000+ стандартов K-12 STEM, охватываемых TeachEngineering , собираются, обслуживаются и упаковываются сетью стандартов достижений (ASN) , проект D2L (www.achievementstandards.org).
В ASN стандарты иерархически структурированы: сначала по источникам; например , по штатам; внутри источника по типу; например , естественные науки или математика; внутри типа по подтипу, затем по классу, и т. д. .
NGSS: научные стандарты нового поколения — наука| Ожидаемые характеристики NGSS | ||
|---|---|---|
МС-ПС1-1.Разработайте модели для описания атомного состава простых молекул и расширенных структур. (6-8 классы) Вы согласны с таким раскладом? Спасибо за ваш отзыв! | ||
| Нажмите, чтобы просмотреть другие учебные программы, соответствующие этим ожиданиям от результатов | ||
| Этот урок посвящен следующим аспектам трехмерного обучения NGSS: | ||
| Наука и инженерная практика | Основные дисциплинарные идеи | Комплексные концепции |
| Разработайте модель для прогнозирования и / или описания явлений. Соглашение о выравнивании: Спасибо за отзыв! | Вещества состоят из атомов разных типов, которые по-разному сочетаются друг с другом. Атомы образуют молекулы размером от двух до тысяч атомов. Соглашение о выравнивании: Спасибо за отзыв! Твердые вещества могут быть образованы из молекул или они могут быть расширенными структурами с повторяющимися субъединицамиСоглашение о выравнивании: Спасибо за отзыв! | Явления времени, пространства и энергии можно наблюдать в различных масштабах, используя модели для изучения слишком больших или слишком маленьких систем. Соглашение о выравнивании: Спасибо за отзыв! |
Какое альтернативное выравнивание вы предлагаете для этого контента?
Больше подобной программы
Предварительные знания
Студенты должны знать основные свойства и структуру атома.
Введение / Мотивация
Мы хотим узнать больше о свойствах вещества или объекта, чтобы мы могли определить, какие инструменты и материалы использовать при проектировании и создании вещей в качестве инженеров. Например, мелки и маркеры обладают разными свойствами, но они оба дают цвет. Какие свойства у мелка? (Напишите ответы на доске. Возможные ответы: твердая, сухая, восковая текстура, тает, разные цвета и т. Д.) Хорошо, а какие свойства у маркера? (Напишите ответы на доске в новом списке. Возможные ответы: гладкий кончик, сладкий запах, кислый запах, разные цвета, влажный и т. Д.) Мы решаем, будем ли мы раскрашивать картинку мелком или маркером, в зависимости от на конечный результат, который мы хотим. Конечным результатом также является то, как инженеры выбирают, какие материалы они будут использовать для разработки чего-либо.
Свойства вещества можно разделить на две категории: физические и химические.В объекте можно наблюдать физические свойства, такие как размер, форма, цвет и даже температуру кипения. Химические свойства — это способность соединяться с другим веществом и образовывать новое, например, когда вода и железо соединяются, образуя ржавчину. Перечисленные нами свойства — физические или химические? Это физические свойства, потому что они не превращаются во что-то другое.
И физические, и химические свойства основаны на поведении элементов, составляющих объект.Элемент — это нечто, состоящее из атомов того же типа, которые состоят из протонов, электронов и нейтронов. Например, свинец элемента состоит из всех атомов свинца и ничего больше. Хотя существует более 100 элементов, 18 из них составляют большую часть известной вселенной. Некоторые из этих 18 элементов, о которых вы, возможно, уже слышали: водород, гелий, углерод, кислород, азот, натрий, магний, фосфор и сера. Можете ли вы придумать что-нибудь, в чем есть один из этих элементов или их комбинация? Итак, вода и воздух состоят из элементов, которые мы только что перечислили.Фактически, водород составляет 90% всего вещества во Вселенной. Углерод — это элемент, который содержится во всем живом.
Элементы можно расположить разными способами; однако наиболее распространенным способом является то, что мы называем периодической таблицей элементов. Элементы расположены в периодической таблице в зависимости от их свойств (как физических, так и химических, хотя в основном химических). Периодическая таблица организует элементы на основе двух основных вещей: количество оболочек, которые элемент имеет для своих электронов, определяет строки (периоды), в которых размещается элемент, а количество электронов в самой внешней оболочке элемента определяет столбец ( group), где размещается элемент.Точка или группа, в которую помещен элемент, многое говорят нам о свойствах этого элемента. Сегодня мы узнаем об этом больше.
Инженеры учитывают физические и химические свойства материалов при проектировании практически всего, включая здания и новые лекарства. Инженеры хотят проектировать крепкие здания. Они также хотят, чтобы лекарства были безопасными и эффективными. Например, металлы обладают определенными свойствами, которые позволяют им сгибаться или не сгибаться, расширяться и сжиматься, а также удерживать определенное количество веса.Если бы инженеры проектировали мост через реку, они бы выбрали металл, который был бы прочным и несколько гибким. Однако они бы не выбрали металл, который слишком сильно расширяется или сжимается в разные погодные условия. Это потому, что если мост слишком сильно увеличится или уменьшится в размерах, он может обрушиться, что может привести к травмам людей и повреждению окружающих конструкций.
Предпосылки и концепции урока для учителей
Материя часто определяется физическими свойствами.Физические свойства — это атрибуты, которые можно наблюдать в объекте. Некоторые примеры свойств включают цвет, запах, размер, вес, текстуру, плавучесть, точку кипения, точку плавления, точку замерзания и форму. Материя также определяется химическими свойствами. Это атрибуты, которые влияют на химическое состояние вещества. Например, одним химическим свойством может быть способность соединяться с другим элементом в химической реакции.
Рис. 1. Первые 18 элементов периодической таблицы.
Элементы
Элемент — это вещество, которое не может быть расщеплено химическими реакциями.Самая маленькая частица элемента — это атом, состоящий из протонов, электронов и нейтронов. Например, чистое золото состоит из атомов золота и ничего больше. Если вы добавите или вычтете протон из ядра атома, вы создадите совершенно новый элемент. Например, если вычесть один протон из атома золота, у вас будет платина. Если вы добавляете или вычитаете нейтрон из ядра атома, то новый элемент не создается, вместо этого вы создаете новый изотоп . Углерод-14 является изотопом углерода, имеет два дополнительных нейтрона, радиоактивен и используется для датирования углерода.
Было открыто или создано более 100 элементов, но в этом уроке основное внимание уделяется первым 18 элементам, которые составляют большую часть материи Вселенной. Самые легкие элементы — водород и гелий. Водород также считается первым элементом, появившимся на Земле.
В настоящее время более 20 элементов не получены естественным путем, а были искусственно синтезированы человеком. Элементы можно классифицировать по-разному, включая название, символ, атомный номер, атомную массу, точку кипения и точку плавления; однако наиболее распространенной таблицей элементов является таблица Менделеева, в которой элементы организованы по химическим свойствам.
На рис. 1 перечислены первые 18 элементов периодической таблицы.
Периодическая таблица
Периодическая таблица Менделеева была впервые создана в 1869 году химиком Дмитрием Менделеевым. Это диаграмма известных элементов, организованная в виде большой сетки со строками и столбцами. Элементы размещены в строках, которые называются периодами и из-за их схожих характеристик. Все элементы в периоде имеют одинаковое количество оболочек , для своих электронов. Элементы в верхнем ряду имеют одну оболочку, во втором ряду — две оболочки и так далее по таблице максимум семь.Учащиеся могут узнать больше о периодической таблице с помощью соответствующего задания «Инженерия» и «Периодическая таблица», где они будут также работать в качестве инженеров-аниматоров, чтобы создать персонажа супергероя на основе одного из элементов.
Элементы также помещены в столбцы или группы , которые имеют одинаковое количество электронов в их внешних оболочках. Элементы в первом столбце имеют один электрон на своей внешней оболочке, во втором столбце — два электрона и так далее. Некоторые особые группы существуют в периодической таблице, включая благородные газы в группе 18 (или 8, если не считать переходных элементов), которые имеют полные внешние валентные оболочки.Это означает, что им не нужны электроны для завершения оболочки, и поэтому они очень нереактивны. Кроме того, всем галогенам в группе 17 (или 7) не хватает одного электрона, который заполняет их внешние оболочки. Все эти элементы связываются с водородом с образованием кислот, таких как соляная кислота.
Рис. 2. Периодическая таблица природных элементов. Copyright
Copyright © Департамент внутренних дел США, Геологическая служба США http://pubs.usgs.gov/circ/c1143/html/fig9.jpg
Сопутствующие мероприятия
Закрытие урока
Сегодня мы говорили о физических и химических свойствах элементов и о том, насколько они важны для инженеров.Кто помнит, в чем разница между физическими и химическими свойствами? (Послушайте ответы студентов.) Что ж, физические свойства — это те свойства, которые можно наблюдать в объектах, такие как размер, форма, цвет и даже температура кипения или плотность. Химические свойства имеют дело с химическим состоянием объектов, например с их способностью соединяться с другими веществами в реакциях. Мы также узнали, что элементы расположены в периодической таблице на основе физических и химических свойств (хотя в основном химических).То, как элементы расположены в строках и столбцах в периодической таблице, говорит нам о них больше.
Важно, чтобы инженеры использовали свои знания о свойствах элементов и материалов при создании новых технологий. Давайте выберем один предмет в этом классе и перечислим его свойства. Представьте, каким был бы этот объект, если бы он был сделан из совершенно других материалов. Это то, что могут сделать инженеры при создании конструкции, улучшающей существующую технологию.
Словарь / Определения
химическое свойство: характеристика вещества, влияющая на химическую структуру вещества.
элемент: Вещество, которое не может быть разложено химическими реакциями.
изотоп: любые атомы химического элемента с одинаковым атомным номером и почти идентичным химическим поведением, но с разным числом нейтронов в ядре.
Физические свойства: характеристика вещества, такая как точка кипения, точка плавления, точка замерзания, плотность, цвет или запах.
Оценка
Оценка перед уроком
Вопрос для обсуждения : Задайте классу несколько вопросов, чтобы заставить учащихся задуматься о предстоящем уроке.После запроса ответов объясните, что на эти вопросы будут даны ответы во время урока.
- Что такое атом? (Ответ: фундаментальный строительный блок материи. Каждый атом состоит из отрицательно заряженных электронов и ядра, состоящего из положительно заряженных протонов и нейтрально заряженных (ни положительно, ни отрицательно заряженных) нейтронов.)
- Назовите один атом, который вы можете найти в этом классе.
Определите это : В небольших группах предложите учащимся участвовать в открытом обсуждении.Напомните им, что все идеи следует уважительно выслушивать. Спросите у студентов:
- Как бы вы описали «свойство» объекта? (Ответы могут быть разными. Возможные ответы: запахи, без запаха, липкие, большие, маленькие, красные и т. Д.)
Оценка после введения
Словарь : Попросите учащихся записать следующие словарные слова на листе бумаги или в своих научных журналах, а затем разработать свои собственные определения этих слов на основе того, что они уже выучили.Условия использования:
- элемент (Вещество, которое не может быть разрушено химическими реакциями.)
- физическое свойство (характеристика вещества, такая как точка кипения, точка плавления, точка замерзания, плотность, цвет или запах.)
- химическое свойство (характеристика веществ, влияющая на химическую структуру вещества).
Итоги урока Оценка
Инженерная модернизация По аналогии с закрытием урока попросите учащихся (действующих в качестве инженеров) выбрать предмет в классе (доску, стул, стол и т. Д.) И спроектировать предмет, который можно заменить, используя материалы, отличные от материала, из которого он изготовлен. товар в настоящее время изготовлен.Попросите учащихся перечислить преимущества переделки и решить, лучше ли их замена оригинала. Напомните учащимся, что инженеры часто переделывают уже существующие элементы, чтобы улучшить их.
Дополнительные задания к уроку
Исследование : Назначьте каждому ученику отдельный элемент из периодической таблицы (предпочтительно из первых 18) и попросите их изучить, где этот элемент присутствует (то есть какие предметы в классе состоят из этого элемента и т. Д.)). Попросите учащихся подсчитать, сколько строк в периодической таблице имеют их элементы, чтобы увидеть, сколько оболочек имеют элементы для их электронов. Попросите учащихся подсчитать столбцы (слева в таблице), в которых расположены их элементы, чтобы увидеть, сколько электронов находится во внешней оболочке элементов.
Другие игры с элементами: Попросите учащихся поиграть в игры с элементами в лаборатории Джефферсона: http://education.jlab.org/indexpages/elementgames.php
использованная литература
Pearson Education, Inc., Сеть семейного образования, «Протон Дон», по состоянию на 31 августа 2006 г. http://www3.funbrain.com/cgi-bin/pt.cgi?A1=s&A2=1&ACOMMON=1&submit=Play+Proton+Don
Thomas Jefferson National Accelerator Facility — Office of Science Education, Science Education, Games & Puzzles, «Element Games», по состоянию на 31 августа 2006 г. http://education.jlab.org/indexpages/elementgames.html
Министерство внутренних дел США, Геологическая служба США, Publications Warehouse, 16 августа 2006 г., по состоянию на 12 сентября 2006 г.http://pubs.usgs.gov/circ/c1143/html/fig9.jpg
Winter, Mark, Университет Шеффилда, «WebElementsTM Periodic Table Scholar Edition», по состоянию на 12 сентября 2006 г.
авторское право
© 2006 Регенты Университета Колорадо.Авторы
Брайан Кей; Дарья Котыс-Шварц; Малинда Шефер Зарске; Джанет ЙоуэллПрограмма поддержки
Интегрированная программа преподавания и обучения, Инженерный колледж, Университет Колорадо в БоулдереБлагодарности
Содержание этой учебной программы по цифровой библиотеке было разработано за счет гранта Фонда улучшения послесреднего образования (FIPSE), U.S. Министерство образования и Национальный научный фонд ГК-12, грант No. 0338326. Однако это содержание не обязательно отражает политику Министерства образования или Национального научного фонда, и вам не следует предполагать, что оно одобрено федеральным правительством.
Последнее изменение: 24 декабря 2021 г.
Интерактивная периодическая таблица элементов
Щелочные металлы
Щелочные металлы образуют группу I периодической таблицы.Их название относится к щелочным веществам, которые образуются при взаимодействии этих элементов с водой. Самые распространенные из этих элементов — натрий и калий. Рубидий, литий и цезий встречаются реже, составляя 0,03, 0,007 и 0,0007 процента земной коры.
Эти элементы очень реактивны и обычно встречаются в природе уже в сочетании с другими элементами. Они имеют серебристый блеск, высокую пластичность и отлично проводят электричество и тепло. Щелочные металлы имеют низкие температуры плавления, в пределах 28.От 5 ° до 179 ° C.
Щелочноземельные металлы
Щелочноземельные металлы образуют группу 2 периодической таблицы. За исключением радия, все элементы этой группы используются в коммерческих целях. Магний и кальций — два из шести самых распространенных элементов на Земле, которые необходимы для некоторых геологических и биологических процессов.
Эти элементы имеют блестящий серо-белый вид. Они хорошо проводят электричество и имеют более высокие температуры плавления и кипения, чем щелочные металлы.Диапазон температур плавления составляет от 650 ° до 1287 ° C, а температуры кипения — от 1090 ° до 2471 ° C.
Металлы после перехода
Металлы после перехода обычно считаются элементами групп 13, 14 и 15. Все классификации включают элементы галлий, индий, олово, таллий, свинец и висмут. Однако, в зависимости от того, как определяется «постпереход», эта категория может содержать от шести до 22 элементов.
Пост-переходные металлы имеют много общего с металлами, включая пластичность, пластичность и проводимость тепла и электричества, но обычно они более мягкие и имеют более низкие температуры плавления и кипения, чем переходные металлы.Они обладают низкой механической прочностью, образуют ковалентные связи и проявляют кислотно-щелочной амфотеризм.
Лантаноиды
Лантаноиды составляют 15 металлических химических элементов с атомными номерами от 57 до 71. Названные лантаноидами, поскольку они химически подобны лантану, эти элементы и актиниды образуют категорию редкоземельных элементов. Несмотря на это прозвище, этих химических веществ в земной коре довольно много. Например, церий занимает 25-е место по распространенности.
Лантаноиды быстро окисляются во влажном воздухе, быстро растворяются в кислотах и медленно реагируют с кислородом при комнатной температуре.Эти элементы используются в сверхпроводниках и компонентах гибридных автомобилей, в основном в качестве магнитов и батарей. Они также используются при производстве специального стекла.
Актиниды
15 металлических элементов с атомными номерами от 89 до 104, от актиний до лоуренсия, называются актинидами. Все эти элементы радиоактивны, относительно нестабильны и выделяют энергию в виде радиоактивного распада. Однако они могут образовывать стабильные комплексы с лигандами, такими как хлорид, сульфат, карбонат и ацетат.
Их радиоактивность, токсичность, пирофорность и ядерная критичность делают актиниды опасными в обращении. Уран и плутоний использовались на атомных станциях и в атомном оружии. Некоторые актиниды естественным образом встречаются в морской воде или минералах, но актиниды с атомными номерами от 95 до 104 являются искусственными, создаваемыми с помощью ускорителей частиц.
Галогены
Галогены — это неметаллические элементы, входящие в группу 17 Периодической таблицы: фтор, хлор, бром, йод и астат.Это единственная группа, элементы которой при комнатной температуре включают твердые, жидкие и газовые формы вещества. Когда галогены реагируют с металлами, они образуют ряд полезных солей, включая фторид кальция, хлорид натрия, бромид серебра и иодид калия.
Поскольку галогены не имеют полной оболочки на один электрон, они могут сочетаться со многими различными элементами. Они обладают высокой реакционной способностью и в концентрированных количествах могут быть смертельными. В коммерческих целях галогены используются в дезинфицирующих средствах, осветительных приборах и компонентах лекарств.
Благородные газы
Благородные газы образуют группу 18 первых шести периодов таблицы Менделеева. Они бесцветные, без запаха, вкуса и негорючие. Первоначально считалось, что их атомы не могут связываться с другими элементами или образовывать химические соединения, но с тех пор это было опровергнуто.
Некоторые из этих газов считаются очень распространенными на Земле, и все они присутствуют в атмосфере Земли. За исключением гелия и радона, благородные газы могут быть извлечены из воздуха с помощью сжижения и фракционной перегонки.Гелий добывают из скважин с природным газом, а радон является продуктом радиоактивного распада.
Группы
Когда Дмитрий Менделеев создал периодическую таблицу в конце 19 века, он сгруппировал элементы по атомному весу. При группировке по весу поведение элементов проявлялось через равные промежутки времени или периоды. Столбцы современной таблицы Менделеева представляют группы элементов, а строки представляют периоды. Группы пронумерованы от 1 до 18. Можно ожидать, что элементы в одной группе будут вести себя аналогичным образом, потому что они имеют одинаковое количество электронов на своей внешней оболочке.
Периоды
Хотя элементы в одной строке или периоде имеют общее количество электронных оболочек, свойства элементов более тесно связаны с группой (вертикальные столбцы), к которой они принадлежат.
Полезность и влияние ChemSaga в качестве инструмента для обучения периодической таблице элементов
Кевин Клайд А. ОНГ 1 и Джоджи Д. ЛИНАУГО 2
1 Национальная средняя школа Баколод-Сити, Баколод-Сити, Филиппины
2 Департамент образования — Отделение западных негров, Баколод Город, Филиппины
Адрес электронной почты автора, ответственного за переписку: [email protected]
Аннотация
В этом документе была определена полезность и влияние учебной настольной игры на академическую успеваемость учащихся. Разработанная исследователями программа «ChemSaga» усиливает концептуальные темы Периодической таблицы элементов. Игра проверяет изученные навыки и концепции, касающиеся истории Периодической таблицы элементов, положения элементов, которые находятся в Периодической таблице элементов, и периодических тенденций. Эксперимент был проведен на 44 учениках 8-х классов средней школы агропромышленного комплекса Мансилинган.Уровень удовлетворенности учащихся и их приемлемость к игре как образовательному инструменту оценивались с использованием 5-балльной шкалы типа Лайкерта. Результаты показали, что ученики хорошо приняли игру ChemSaga. Распределение ответов студентов в опросе — это в большинстве случаев «удовлетворительная» оценка как по уровню удовлетворенности учащихся, так и по уровню приемлемости. Результаты также показали, что нет значительных различий в успеваемости учащихся разного пола после того, как они познакомились с образовательной настольной игрой.Таким образом, игра применима независимо от пола учащихся. Игра успешно помогла улучшить академическую успеваемость учащихся, укрепив их опыт и основы Периодической таблицы элементов, обеспечив приятные занятия в классе и позволив учащимся социализироваться.
Ключевые слова: Естественное образование, химия, Периодическая таблица элементов, образовательные настольные игры, квазиэкспериментальные исследования, Центральные Филиппины
Список литературы
- Американское химическое общество.(2012). Руководство и рекомендации ACS для преподавания химии в средней школе.
- Американское химическое общество. (2015). Комитет по профессиональному обучению и развитию навыков студентов по учебной программе химии.
- Амори А. и Сиграм Р. (2004). Образовательные игровые модели: концептуализация и оценка. Южноафриканский журнал высшего образования , 17 (2), 206–217. Получено с https://doi.org/10.4314/sajhe.v17i2.2531
- Annetta, L., Mangrum, J., Holmes, S., Collazo, K., & Cheng, M.-T. (2009). Соединяя реальность с виртуальной реальностью: исследование гендерного эффекта и вовлеченности учащихся в обучение с помощью видеоигр в классе начальной школы. Международный журнал естественнонаучного образования , 31 (8), 1091–1113. Получено с https://doi.org/10.1080/095006
968656
- Антунес, М., Пачеко, М.А. Р. и Джованела, М. (2012). Разработка и реализация образовательной игры для преподавания химии в высшем образовании. Журнал химического образования , 89 (4), 517–521. Получено с https://doi.org/10.1021/ed2003077
- Bayir, E. (2014). Разработка и использование игр по химии, чтобы узнать об элементах, соединениях и периодической таблице: Elemental Periodica, Compoundica и Groupica. Журнал химического образования , 91 (4), 531–535. Получено с https://doi.org/10.1021/ed4002249
- Berk, L.E. (1994). Теория Выготского: важность выдуманной игры, 50 (1), 30–39.Получено из базы данных ERIC. (EJ493655)
- Blakstad, O. (2014). Экспериментальные исследования — Руководство к научным экспериментам. Получено 12 августа 2017 г. с сайта https://explorable.com/experiment-research
- Брэдли, Дж., Ланкашир, Р. Дж., Ланг, А. С. И. Д., и Уильямс, А. Дж. (2009). Призрачная игра: использование открытых данных и краудсорсинга для образования, 10 , 1–10. Получено с https://doi.org/10.1186/1758-2946-1-9
- Брунер, Дж. (1915). Discovery Learning (Bruner) — теории обучения. Harvard Educational Review , (37), 16–25. Получено с https://www.learningtheories.com/discovery-learningbruner.html
- Bruner, J. S. (1961). Акт открытия. Harvard Educational Review , (31), 21–32. Получено с http://psycnet.apa.org/record/1962-00777-001
- Bryan, RR, Glynn, SM, & Kittleson, JM (2011) . Продвинутое намерение учащихся старших классов, изучающих естественные науки, 1049–1065. Получено с https://doi.org/10.1002/sce.20462
- Баллок, Д., Колледж, Б., Холлет, В., Льюис, Г., Нация, П., Уильямс, М., и Уолтер, К. (2013). ELT Journal. Лидерство в образовании , 67 (апрель).
- Кэмпбелл, С. & Музыка, Дж. (2002). Химия. Игровые шоу. Journal of Chemical Education , 79 (4), 458. Получено с https://doi.org/10.1021/ed079p458
- Чарски Д. и Ресслер В. (2011). «Игры созданы для развлечения»: уроки о влиянии концептуальных карт на использование компьютерных игр в классе. Компьютеры и образование , 56 (3), 604–615. Получено с https://doi.org/10.1016/ j.compedu.2010.10.001
- Cook, E., Kennedy, E., & McGuire, S. Y. (2013). Влияние стратегий обучения метакогнитивному обучению на успеваемость на курсах общей химии. Журнал химического образования , 90 (8), 961–967. Получено с https://doi.org/10.1021/ed300686h
- Crute, T. D., & Myers, S. A. (2007). Судоку как инструмент изучения химии. Journal of Chemical Education , 84 (4), 612. Получено с https://doi.org/10.1021/ed084p612
- Daubenfeld, T., & Zenker, D. (2015). Игровой подход ко всему курсу физической химии. Журнал химического образования , 92 (2), 269–277. Получено с https://doi.org/10.1021/ed5001697
- de Freitas, S., & Oliver, M. (2006). Как можно наиболее эффективно оценить исследовательское обучение с помощью игр и симуляторов в рамках учебной программы? Компьютеры и образование , 46 , 249–264.
- Деде, К. (2005). Планирование стилей обучения неомилленариев, (1), 7–12.
- Денни, Р. А., Лакшми, Р., Читра, Х., и Деви, Н. (2000). Элементарные Загадки Кто Я. Journal of Chemical Education , 77 (4), 477. Получено с https://doi.org/10.1021/ed077p477
- Echeverria, A., Garcia-Campo, C., Nussbaum, M., Gil, Ф., Вильялта, М., Аместика, М., и Эчеверрия, С. (2011). Платформа для разработки и интеграции совместных классных игр. Компьютеры и образование , 57 (1), 1127–1136. Получено с https://doi.org/10.1016/j.compedu.2010.12.010
- Erdik, E. (2005). Использование головоломок из строительных блоков для отработки рисования органических механизмов. Journal of Chemical Education , 82 (9), 1325. Получено с https://doi.org/10.1021/ed082p1325
- Foster, A. (2008). Игры и мотивация к изучению науки: личность, применимость, актуальность и значимость. Журнал исследований интерактивного обучения , 19 (4), 597–614.Получено с http: // ezproxy. deakin.edu.au/
- Franco-Mariscal, A. J., Martínez, J. M. O., & Márquez, S. B. (2012). Образовательная карточная игра для изучения семей химических элементов. Журнал химического образования , (май 2014 г.). Получено с https://doi.org/10.1021/ed200542x
- Franco-Mariscal, A. J., Oliva-Martínez, J. M., & Almoraima Gil, M. L. (2014). Восприятие учащихся об использовании обучающих игр как инструмента для обучения Периодической таблице элементов на уровне старшей школы. Журнал химического образования , 1 (12), 146–149. Получено с https://doi.org/10.1021/ed4003578
- Franco-Mariscal, A. J., Oliva-Martínez, J. M., & Gil, M. L. A. (2015). Восприятие учащимися обучающих игр как инструмента обучения Периодической таблице элементов. Получено с https://doi.org/10.1021/ed4003578
- Franklin, S., Peat, M., & Lewis, A. (2003). Нетрадиционные вмешательства для стимулирования обсуждения: использование игр и головоломок. Журнал биологического образования , 37 , 79–84.
- Джи, Дж. П. (2004). Обучение по замыслу: игры как обучающие машины. Интерактивные образовательные мультимедиа , 8 (8), 15–23. Получено с http://www.ub.es/multimedia/iem
- Gilakjani, A. P., & Branch, L. (2012). Визуальные, слуховые, кинестетические стили обучения и их влияние на преподавание английского языка, Journal of Studies in Education, 2 (1), 104–113. Получено с https: // doi.org / 10.5296 / jse.v2i1.1007
- Грабовски, Дж. Дж., и Прайс, М. Л. (2003). Простые шаблоны HTML для создания научных опасностей! Игры для активного обучения. Journal of Chemical Education , 80 (8), 2003.
- Герра, А. С. О., Пегас, М. М., и да Силва, Дж. Ф. М. (2015). «Organic & Action» — обучающая игра по органической химии. Instituto de Quimica , 110–115.
- Helser, T. L. (2003). Терминология: четыре загадки из одного поиска. Journal of Chemical Education , 80 (4), 414. Получено с https://doi.org/10.1021/ed080p414
- Herrington & Oliver. (2012). Теория обучения на основе игр. Игры и культура , 1 (1). Получено с http://www.gamesed.co.uk/learning-theory.html
- Houten, J. Van. (2009). «Опасность» в неорганическом классе — преподавание описательной химии в формате телевизионного игрового шоу. В Химическое образование в эпоху ИКТ (стр.11–17). Дордрехт: Springer, Нидерланды. Получено с https://doi.org/10.1007/978-1-4020-9732-4_2
- Hromek, R., & Roffey, S. (2009). Содействие социальному и эмоциональному обучению с помощью игр: «Это весело, и мы учимся». Моделирование и игры , 40 (5), 626–644. Получено с https://doi.org/10.1177/1046878109333793
- Ke, F., & Grabowski, B. (2007). Геймплей для изучения математики: кооперативный или нет? Британский журнал образовательных технологий , 38 (2), 249–259.Получено с https://doi.org/10.1111/j.1467-8535.2006.00593.x
- Кек, М. В. (2000). Заключительное задание по проверке экзамена на основе формата опасности. Journal of Chemical Education , 77 (4), 483. Получено с https://doi.org/10.1021/ed077p483
- Кинзи, М. (2015). Гендерные различия в предпочтениях учащихся средней школы в игровой деятельности: значение для разработки образовательных игр. Исследования и разработки в области образовательных технологий , 1 (август), 1–22.Получено с https://doi.org/10.1007/s11423-007-9076-z
- Kirriemuir, J., & Mcfarlane, A. (2007). Обзор литературы в играх и обучении. Игры и культура , 1 (1), 1–40.
- Кётер, М. (2003). Игра в имена: изучение взаимосвязи между концепциями. Журнал химического образования , 80 (4), 421–422. Получено с https://doi.org/10.1021/ed080p421
- Кумар Р. и Лайтнер Р. (2007). Игры как метод интерактивного обучения: восприятие корпоративных тренеров, преподавателей колледжей и студентов. Международный журнал преподавания и Обучение в высшем образовании , 19 (1), 53–63. Получено с http://isetl.org/ijtlhe/articleView.cfm?id=157
- Marais, F., & Combrinck, S. (2009). Подход к решению трудностей, с которыми сталкиваются студенты-химики со стехиометрией. Южноафриканский химический журнал , 62 (1), 88–96. Получено с https://www.ajol.info/index.php/sajc/arti cle / view / 123215
- Marasigan, A.К. и Эспиноза А.А. (2014). Модифицированный подход полезного обучения: влияние на навыки критического мышления и отношение студентов к химии. Международный журнал обучения, преподавания и педагогических исследований , 1 (1), 35–72.
- Марти-Сентеллес, В., и Рубио-Маньето, Дж. (2014). ChemMend: карточная игра, в которой можно познакомиться с периодической таблицей и изучить ее во время взаимодействия. Журнал химического образования , (апрель). Получено с https://doi.org/10.1021/ed300733w
- Melero, J., & Эрнандес-Лео, Д. (2014). Модель разработки головоломок, включающих виртуальные и физические объекты. Образовательные технологии и общество , 17 (3), 192–207.
- Морено, Л. Ф., Хинкапи, Г., и Альзате, М. В. (2014). Cheminoes: дидактическая игра для изучения химических отношений между валентностью, атомным числом и символом. Журнал химического образования , 91 (6), 872–875. Получено с https://doi.org/10.1021/ed4008183
- Oblinger, D.(2006). Симуляторы, игры и обучение. EDUCAUSE Review , 1 (май), 1–6.
- Папастержиу, М. (2009). Обучение на основе цифровых игр в старших классах Компьютерное образование: влияние на эффективность обучения и мотивацию студентов. Компьютеры и образование , 52 (1), 1–12. Получено с https://doi.org/10.1016/J.COMPEDU.20 08.06.004
- Перис, М. (2007). Дисциплинированная химическая головоломка. Журнал химического образования , 84 (4), 609.Получено с https://doi.org/10.1021/ed084p609
- Piaget, J. (1962). Игра, мечты и подражание в детстве . Нью-Йорк, Нью-Йорк: Norton .
- Пиаже, Дж. (1964). Когнитивное развитие у детей: развитие и обучение Пиаже. Журнал исследований в области преподавания естественных наук , 2 (3), 176–186. Получено с https://doi.org/10.1002/tea.3660020306
- Пьерони, О. И., Вуано, Б. М., и Чолино, А. Э. (2000). Инновации в классе: игры, которые сделают химию более интересной и увлекательной. Учитель-химик , 5 (4), 167–170. Получено с https://doi.org/10.1007/s00897000393a
- Пренски, М. (2001). Развлечения, игра и игры: что делает игры интересными. Обучение на основе цифровых игр , 1–31. Получено с https://doi.org/10.1103/PhysRevB.66.085421
- Rapeepisarn, K., Wong, K. W., Fung, C. C., & Khine, M. S. (2008). Взаимосвязь между игровыми жанрами, методами обучения и стилями обучения в образовательных компьютерных играх. Технологии электронного обучения и цифровых развлечений , 5093 , 497–508. ,
- , Ратнер, Н., и Брунер, Дж. (1978). Игры, социальный обмен и овладение языком. Журнал детского языка , 5 (3), 391–401. Получено с https://doi.org/10.1017/S0305000
2063
- Рассел, Дж. В. (1999). Использование игр для обучения химии: аннотированная библиография. Журнал химического образования , 76 (4), 481. Получено с https: // doi.org / 10.1021 / ed076p481
- Сауро, Дж. (2015). MeasuringU: как измерить надежность ваших методов и показателей. Получено 12 августа 2017 г. с сайта https: // measureu. com / мера-надежность /
- Сирхан, Г. (2007). Трудности обучения химии: обзор. Турецкое научное образование , 4 (2), 2–20.
- Спандлер, К. (2016). Mineral Supertrumps: новая карточная игра для изучения минералогии. Журнал геолого-геофизического образования , 64 (май), 108–114.Получено с https://doi.org/10.5408/15-095.1
- Танни, З. А., и Махмуд, А. А. А. (2012). Использование игр для повышения мотивации студентов к изучению английского языка. Журнал образовательных и психологических исследований и исследований , 2 (5), 11–23.
- Tejeda, S., & Palacios, J. (1995). Химические элементы Бинго. Journal of Chemical Education , 72 (12), 1115. Получено с https://doi.org/10.1021/ed072p1115 Treagust, D. F.(2000). Источники трудностей студентов в изучении химии (январь).
- Фогель Д., Бауэрс К. А. и Бауэрс К. А. (2006). Компьютерные игры и интерактивное моделирование для обучения: метаанализ. Журнал образовательных компьютерных исследований , 34 (3), 229–243. Получено с https://doi.org/10.2190/FLHV-K4WA-WPVQ-H0YM
- Вос, Н., Ван Дер Мейден, Х. и Денессен, Э. (2011). Влияние построения и проведения образовательной игры на мотивацию студентов и использование стратегии глубокого обучения.
 Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов.
Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов.

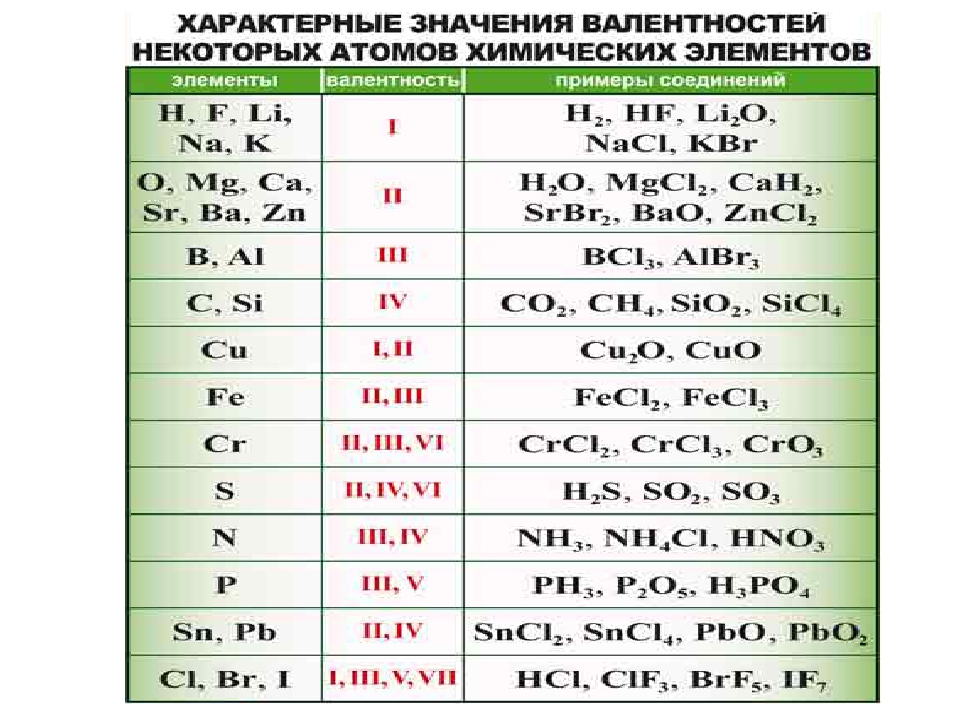



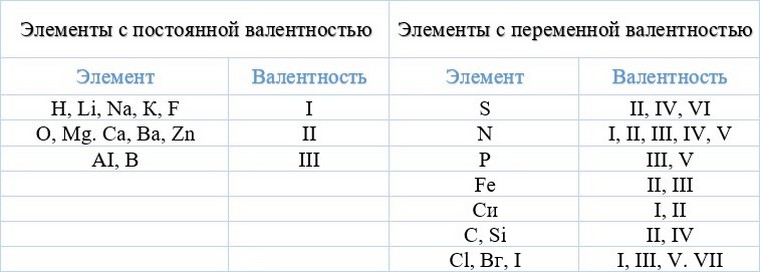 название
название Там проставляется балл за каждое задание. Если вы не принимали участие в каком-то виде деятельности, то ставите 0. Но вначале, подчеркните смайлик, который соответствует вашему настроению..
Там проставляется балл за каждое задание. Если вы не принимали участие в каком-то виде деятельности, то ставите 0. Но вначале, подчеркните смайлик, который соответствует вашему настроению..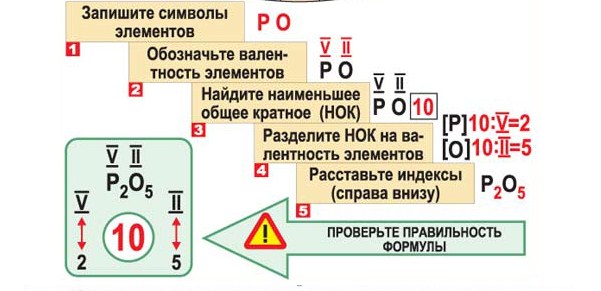 Ребята, исходя из темы урока, какие вы перед собой ставите цели и задачи? Чего вы ждете от сегодняшнего урока?
Ребята, исходя из темы урока, какие вы перед собой ставите цели и задачи? Чего вы ждете от сегодняшнего урока?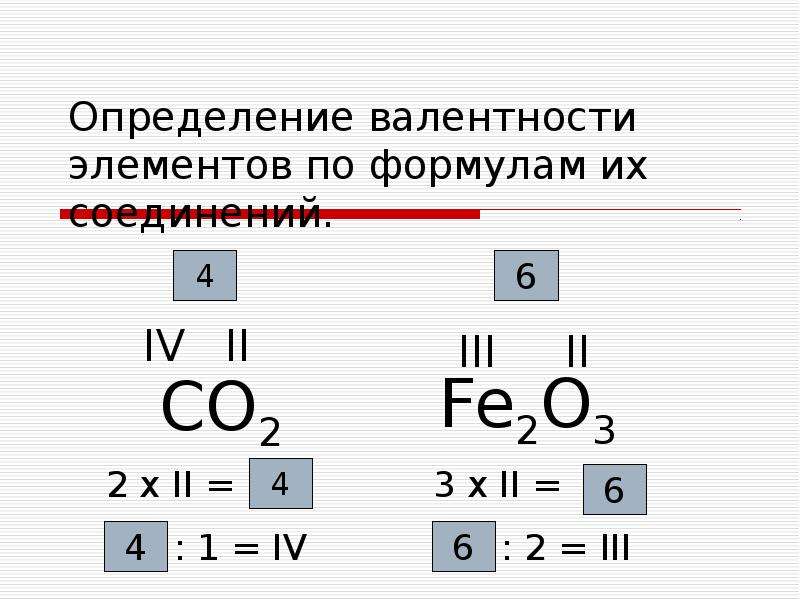

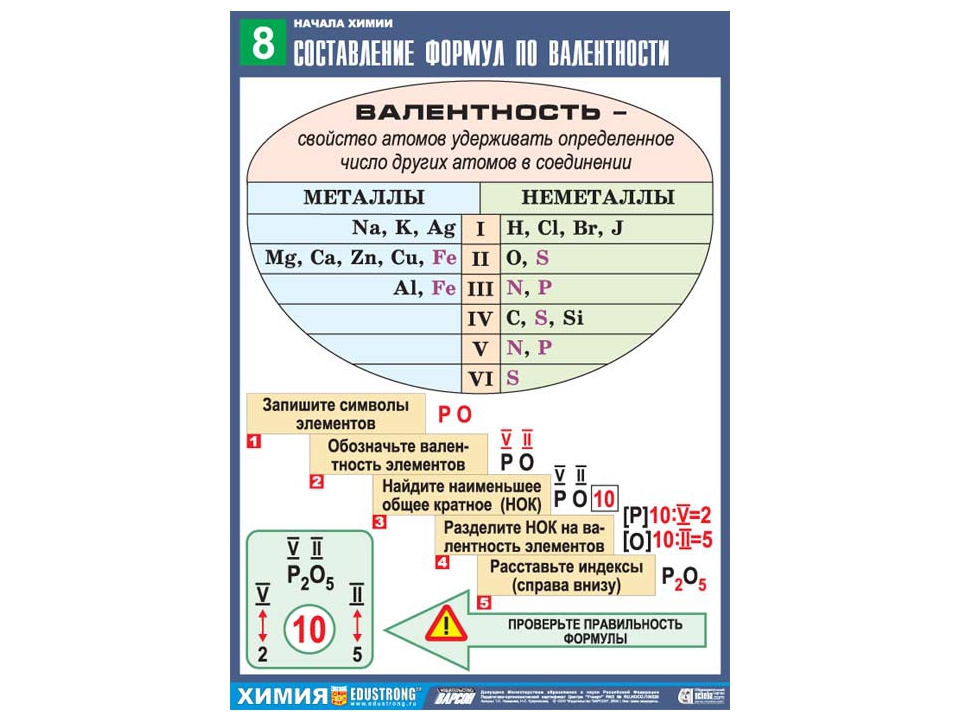
 Решение задач.
Решение задач. Д.)
Д.) ) → Br2 (l) + 2I (водн.)} \)
) → Br2 (l) + 2I (водн.)} \)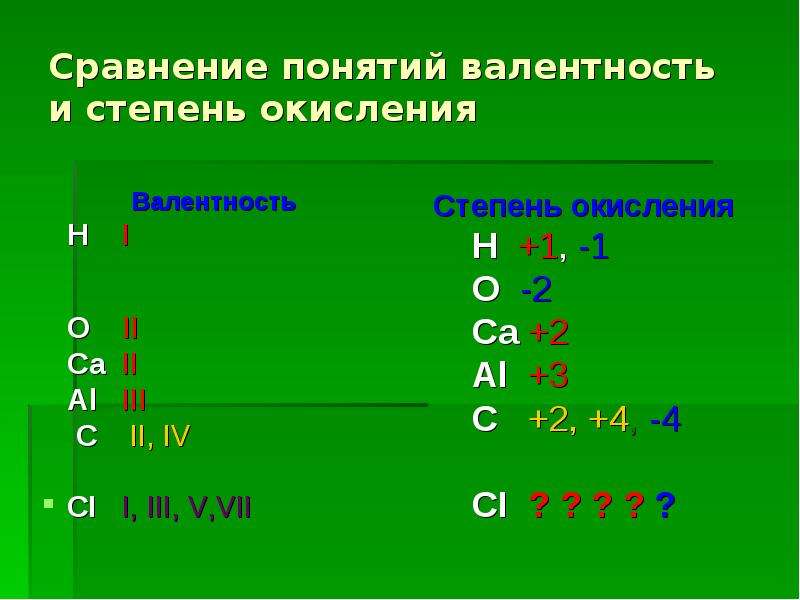 А .; Уилкинсон, Г. (1988). Продвинутая неорганическая химия (5-е издание). Нью-Йорк: Вили. ISBN 0-471-84997 стр. 1385.
А .; Уилкинсон, Г. (1988). Продвинутая неорганическая химия (5-е издание). Нью-Йорк: Вили. ISBN 0-471-84997 стр. 1385.