Таблиця «Найважливіші формули кислот»
Про матеріал
У таблиці «Найважливіші формули кислот» містяться назви, формули, традиційні назви, кислотні залишки і його валентність, назва кислотного залишкуПерегляд файлу
Найважливіші неорганічні кислоти
Назва | Формула | Традиційна назва | Кислотний залишок і його валентність | Назва кислотного залишку | |
Боратна | Н3В03 | борна | ІІІ ВО3 | борат | |
Бромідна | НВг | бромоводнева | І Вг | бромід | |
Дихроматна | Н2Сг2О7 | дихромова | ІІ Сг2О7 | дихромат | |
Йодидна | НІ | йодоводнева | І І | йодид | |
Карбонатна | Н2СО3 | вугільна | ІІ СО3 | карбонат | |
Нітратна | НNО3 | азотна | I NО3 | нітрат | |
Нітритна | НNО2 | азотиста | I NО2 | нітрит | |
Перманга-натна | НМnО4 | марганцева | I МnО4 | перманганат | |
Перхлорат-на | НCIO4 | хлорна | I CIO4 | перхлорат | |
Силікатна | Н2SiO3 | кремнієва | II SiO3 | силікат | |
Сульфатна | Н2SO4 | сірчана | II SO4 | сульфат | |
Сульфітна | Н2SO3 | сірчиста | II SO3 | сульфіт | |
Сульфідна | Н2S | сірководнева | II S | сульфід | |
Фосфатна | Н3РO4 | фосфорна, ортофосфорна | III РO4 | фосфат | |
Фторидна | HF | фтороводнева, плавікова | I F | фторид | |
Хлоридна | HCI | хлороводнева, соляна | I СІ | хлорид | |
Ціанідна | HCN | синільна | I CN | ціанід | |
Кислоти — Дистанційне вивчення хімії
Опанувавши матеріал, ви зможете:
• розрізняти фізичні властивості кислот;
• визначати зміну забарвлення індикаторів у кислому середовищі;
• характеризувати хімічні властивості кислот;
• наводити приклади рівнянь реакцій, що характеризують хімічні властивості кислот;
• прогнозувати перебіг реакцій взаємодії кислот з металами;
• досліджувати хімічні властивості кислот.
Кислоти — це складні речовини, які складаються з атомів Гідрогену, здатних заміщуватися на атоми метали, та кислотних залишків.
Назви кислотних залишків відповідають назвам кислот, якщо забрати закінчення -на.
Назви кислот та кислотних залишків
Виконайте інтерактивну вправу Тренажер «Назви кислот»
Кислоти класифікують за: вмістом атомів Гідрогену (одноосновні, двоосновні. триосновні)та за вмістом Оксигену (оксигеновмісні й безоксигенові).Фізичні властивості кислот.
За агрегатним станом:
Всі кислоти добре розчиняються у воді, крім H2SiO3
Деякі з них, як-от хлоридна, сульфатна, нітратна, є токсичними й небезпечними для життя і функціонування живих організмів. Вони роз’їдають органічні речовини, спричиняють опіки.
Під час роботи з кислотами необхідно дотримуватися правил техніки безпеки!
| Хлоридна кислота | HCl | Хлоридна кислота це водний розчин гідроген хлориду. Прозора рідина, іцо на повітрі «димить». У концентрованому розчині цієї кислоти масова частка гідроген хлориду становить 36 40 %. Важча за воду. Має характерний різкий запах. Вдихання парів концентрованої хлоридної кислоти викликає подразнення й опіки дихальних шляхів. Під час роботи з хлоридною кислотою потрібно дотримуватися правил техніки безпеки. Прозора рідина, іцо на повітрі «димить». У концентрованому розчині цієї кислоти масова частка гідроген хлориду становить 36 40 %. Важча за воду. Має характерний різкий запах. Вдихання парів концентрованої хлоридної кислоти викликає подразнення й опіки дихальних шляхів. Під час роботи з хлоридною кислотою потрібно дотримуватися правил техніки безпеки.У лабораторії хлоридну кислоту добувають розчиненням гідроген хлориду у воді. Гідроген хлорид (хлороводень — традиційна назва) добувають шляхом взаємодії натрій хлориду (NaCI) з концентрованою сульфатною кислотою за нагрівання. |
| Сульфатна кислота | H2SO4 | Сульфатна кислота безбарвна рідина, нелетка, в’язка. Густина 1,84 г/см3. Під час розчинення у воді сильно розігрівається, аж до закипання розчину, що. V свою чергу, спричиняє його розбризгу-ваппя. Щоб уникнути цього, потрібно кислоту вливати у воду, а не навпаки. Характерною властивістю концентрованої сульфатної кислоти є здатність легко вбирати вологу (гігроскопічність). |
| Нітратна кислота | HNO3 | Нітратна кислота безбарвна рідина з різким, задушливим запахом, летка. Концентрована має жовте забарвлення, якого набуває за рахунок розчинення в ній нітроген(IV) оксиду. Масова частка кислоти в концентрованому розчині досягає 98 %. Руйнує білок. За потрапляння па шкіру спричиняє пожовтіння, опіки. |
| Ортофосфатна кислота | H3PO4 | Ортофосфатна кислота безбарвна, тверда, кристалічна речовина. Добре розчинна у воді, важча за воду. За темперетури вище 40 0C перетворюється па в’язку безбарвну рідину. На відміну від інших кислот не отруйна. |
Хімічні властивості кислот
1. Зміна забарвлення індикаторів.
Віртуальний лабораторний дослід 2. ДІЯ РОЗЧИНІВ КИСЛОТ НА ІНДИКАТОРИ
Досліджуємо, як діють кислоти па індикатори.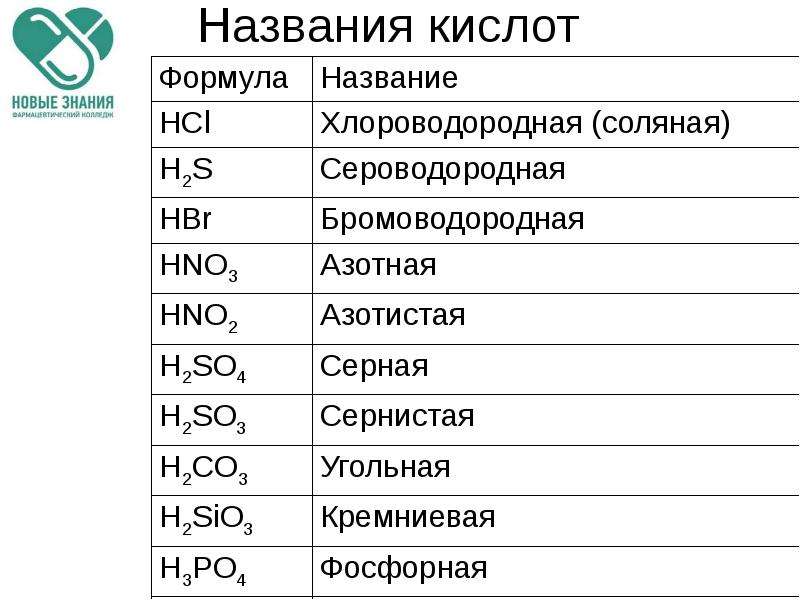 Зверніть увагу, чи всі індикатори можна використовувати для виявлення кислот у розчинах.
Зверніть увагу, чи всі індикатори можна використовувати для виявлення кислот у розчинах.
Відео YouTube
Фенолфталеїн не змінює забарвлення в кислому середовищі. Усі інші індикатори (лакмус, метиловий оранжевий, універсальний індикаторний напір) набувають червоного забарвлення різних відтінків.
2. Взаємодія кислот з металами.
Спільною властивістю кислот є їх взаємодія з металами. Якщо до порошку магнію долити хлоридної кислоти, відбувається характерне «закипання» суміші через інтенсивне виділення газу водню, що витіснився магнієм з кислоти. Рівняння реакції:
Аналогічно виділення водню спостерігається, якщо до гранул цинку долити розчину сульфатної кислоти (рис. 69):
- Реакції заміщення — це реакції, що відбуваються між простою і складною речовинами, унаслідок чого атоми простої речовини заміщають атоми в складній.

Віртуальний лабораторний дослід З. ВЗАЄМОДІЯ ХЛОРИДНОЇ КИСЛОТИ З МЕТАЛАМИ
Досліджуємо, як взаємодіє хлоридна кислота з металами.
Відео YouTube
Це дослідження показує, що хімічна активність металів є неоднаковою. Одні метали проявляють більшу, інші меншу активність під час хімічних перетворень.
На основі експериментальних досліджень російський учений М. Бекетов розмістив метали у внтискувальиий ряд металів.
Виявлено, що метали, розташовані в ряді до водню, мають здатність витискувати його з кислот, утворюючи просту речовину водень (виняток нітратна кислота). П’ять металів, які розміщені після водню, з розчинами кислот не реагують. Кожний наступний метал у ряді є менш хімічно активний, ніж попередній. Самі ж метали заміщають атоми Гідрогену в кислоті. Такий тин реакцій називають реакціями заміщення.
Такий тин реакцій називають реакціями заміщення.
Реакції заміщення це реакції, що відбуваються між простою та складною речовинами, унаслідок чого атоми простої речовини заміщають атоми в складній.
Окрім водню, під час реакції утворюється сіль відповідного металу.
3. Взаємодія кислот з основними оксидами.
Відеодемонстрація
Відео YouTube
Як приклади таких хімічних перетворень можна навести рівняння реакцій:
Реакції обміну — це реакції між двома складними речовинами, під час яких вони обмінюються складовими частинами.
4. Взаємодія кислот з основами
Кислоти взаємодіють з основами, при цьому утворюється сіль та вода.
Взаємодія кислот з оновами з утворенням солі та води називається реакцією нейтралізації.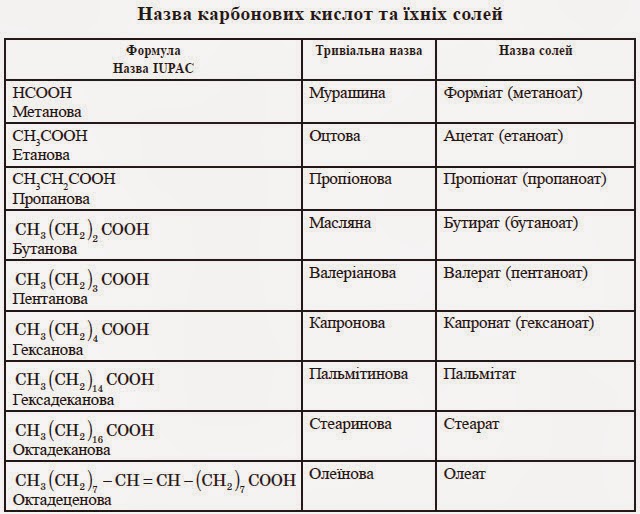
Реакція нейтралізації належить до реакції обміну.
Відео YouTube
NaOH+HCl=NaCl+H20
Відео YouTube
Cu(OH)2+ H2SO4 = CuSO4+ H2O
Приклади реакцій нейтралізації:
Са(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)2 +6H2O
5. Взаємодія кислот з солями
Кислотам властиво взаємодіяти з розчинами солей. Реакції між ними відбуваються за умови, якщо спостерігається:
Реакції між ними відбуваються за умови, якщо спостерігається:
а) випадання осаду;
б) виділення газу;
в) одним із продуктів реакції є вода.
Розглянемо приклад цієї реакції за допомогою відеодемонстраційного досліду.
Відео YouTube
CaCO3 + 2HCl = CaCl2 + H2O +CO2
При взаємодії солей із кислотами більш сильні кислоти витісняють менш сильні кислоти із розчинів їх солей. Витискувальний ряд кислот зображено на рисунку.
Наприклад,K2S + 2HCl = 2KCl + H2S
Na2SO3 + H2SO4 = Na2SO4 +H2O + SO2
Виконай інтерактивну вправу Витискувальний ряд кислот
ПІДСУМОВУЄМО ВИВЧEНE
- Кислоти за нормальних умов є рідинами або твердими речовинами.
 Важчі за воду, безбарвні. Добре розчиняються у воді. Водні розчини — кислі на смак, роз’їдають органічні речовини.
Важчі за воду, безбарвні. Добре розчиняються у воді. Водні розчини — кислі на смак, роз’їдають органічні речовини. - Кислоти змінюють забарвлення індикаторів: лакмусу — на червоний, метилового оранжевого — на рожевий, універсальний індикаторний папір — на червоний.
- Кислоти (за винятком нітратної) взаємодіють з металами, що у витискувальному ряді розташовані до водню. Продуктами реакцій є сіль відповідного металу та водень.
- Реакції заміщення — це реакції, що відбуваються між простою і складною речовинами, унаслідок чого атоми простої речовини заміщають атоми в складній.
- Кислоти взаємодіють з оснбвними оксидами з утворенням солі та води.
- Реакції обміну — це реакції між двома складними речовинами, під час яких вони обмінюються складовими частинами.
- Кислоти взаємодіють з основами, в результаті реакції утворюється сіль та вода.
- Реакція нейтралізації — це взаємодія кислот з оновами з утворенням солі та води.
- Кислоти взаємодіють з солями за умови, якщо спостерігається: а) випадання осаду; б) виділення газу; в) одним із продуктів реакції є вода.

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
Кислоти
Кислоти
Це матеріал з підручника Хімія 8 клас Савчин
Загальна характеристика кислот — урок. Хімія, 8 клас.
Кислотами називають складні речовини, що складаються з атомів Гідрогену, які можуть заміщуватися металами, і кислотних залишків.
Кислотним залишком називають частину молекули кислоти, сполучену з атомами Гідрогену.
При утворенні солей, коли атоми Гідрогену заміщуються йонами металів, кислотні залишки переходять у незмінному вигляді. Якщо кислотний залишок у кислоті сполучений з одним атомом Гідрогену, то він одновалентний, якщо з двома — двовалентний, якщо з трьома — трьохвалентний, тощо.
Валентність кислотного залишку визначається кількістю атомів Гідрогену, здатних заміщуватися металами.
Формули і назви деяких кислот наведено в таблиці.
Найважливіші неорганічні кислоти
Назва кислоти | Формула кислоти | Формула | Назва солі цієї кислоти |
| Флуоридна (фторидна, фтороводнева, плавикова) | HF | −F | флуорид |
| Хлоридна, (хлороводнева, соляна) | HCl | −Cl | хлорид |
Бромідна (бромводнева) | HBr | −Br | бромід |
| Карбонатна (вугільна) | h3CO3 | =CO3 | карбонат |
| Силікатна (кремнієва) | =SiO3 | силікат | |
| Нітратна (азотна) | HNO3 | −NO3 | нітрат |
| Нітритна (азотиста) | HNO2 | −NO2 | нітрит |
Ортофосфатна | h4PO4 | ≡PO4 | ортофосфат |
| Метафосфатна | HPO3 | −PO3 | метафосфат |
| Сульфатна (сірчана) | h3SO4 | =SO4 | сульфат |
| Сульфітна (сірчиста) | h3SO3 | сульфіт | |
| Сульфідна (сірководнева) | h3S | =S | сульфід |
Представником органічних кислот є оцтова кислота Ch4COOH.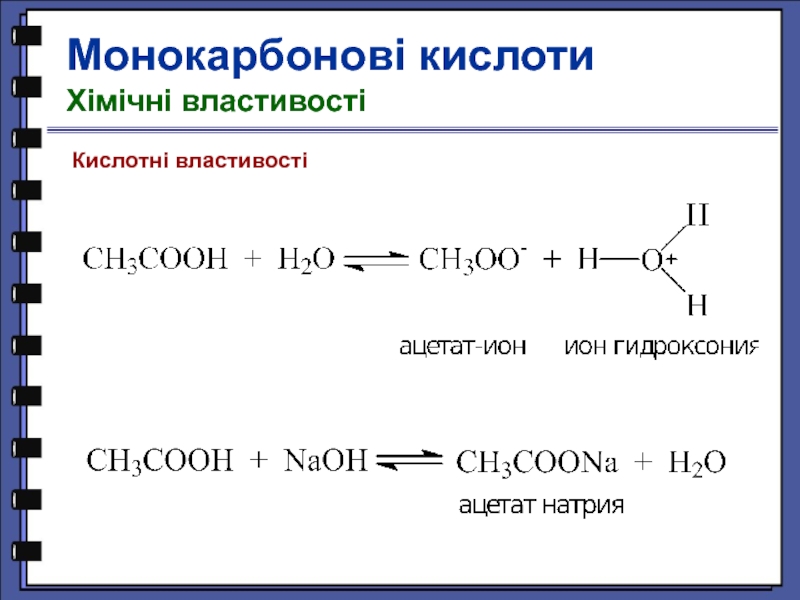 Хоча в молекулі цієї кислоти чотири атоми Гідрогену, лише один з них (що входить до складу групи СООН) може бути заміщений металом. Тому кислотний залишок оцтової кислоти є одновалентним.
Хоча в молекулі цієї кислоти чотири атоми Гідрогену, лише один з них (що входить до складу групи СООН) може бути заміщений металом. Тому кислотний залишок оцтової кислоти є одновалентним.
Кислоти прийнято класифікувати за кількома ознаками.
1. Існують безоксигенові і оксигеновмісні кислоти. Назва цих груп вказує на наявність або відсутність в молекулі кислоти атомів Оксигену.
2. Інша ознака, за якою групують кислоти — кількість атомів Гідрогену в молекулі кислоти, здатних заміщуватися металами. Відповідну характеристику кислоти називають її основністю. Існують одно-, дво- і триосновні кислоти.
Таблиця: Назва кислот і кислотних залишків та їх формули
| Формула кислоти | Назва кислоти | Формула кислотного залишку | Назва кислотного залишку |
| HF | Фтороводород (Плавикова кислота) | F– | Фторид |
| HCl | Хлороводень (Соляна кислота) | Cl– | Хлорид |
| HBr | Бромоводород (Бромистоводневої кислота) | Br– | Бромид |
| H3BO3 | Ортоборна (Борна кислота) | Борати | |
| HI | Йодоводород (Йодоводородная кислота) | I– | Йодид |
| H2S | Сероводород (Сероводородная кислота) | S2- | Сульфід |
| HCN | Ціановодород (Cинильна кислота) | CN– | Ціанід |
| HNO2 | Азотисная | NO2– | Нітрит |
| HNO3 | Азотна | NO3– | Нітрат |
| H3PO4 | Ортофосфорна (Фосфорна кислота) | PO43- | Фосфат |
| H3AsO4 | Миш’якова (Ортомишьяковая) | AsO43- | Арсенат |
| H2SO3 | Сірчиста | SO32- | Сульфіт |
| H2SO4 | Сірчана | SO42- | Сульфат |
| H2CO3 | Вугільна | CO32- | Карбонат |
| H2SiO3 | Кремнієва | SiO32- | Силікат |
| H2CrO4 | Хромова | CrO42- | Хромат |
| H2Cr2O7 | Дихромова | Cr2O72- | Дихромат |
| HMnO4 | Марганцова | MnO4– | Перманганат |
| HClO | Гіпохлоридна | ClO- | Гіпохлорит |
| HClO2 | Хлориста | ClO2– | Хлорит |
| HClO3 | Хлоратна | ClO3– | Хлорат |
| HClO4 | Хлорна | ClO4– | Перхлорат |
| HCOOH | Метанова, Мурашина | HCOO– | Форміат |
| CH3COOH | Метанова, Оцтова | CH3COO– | Ацетат |
| H2C2O4 | Етандіовая, Щавельная | C2O42- | Оксалат |
Терапевтична ефективність альфа-ліпоєвої кислоти (еспа-ліпону) при автоімунному тиреоїдиті з гіпотиреозом
Численними клінічними дослідженнями вірогідно встановлено, що альфа-ліпоєва кислота (АЛК) — еспа-ліпон має виражений антиоксидантний вплив на організм людини [5, 7], регулює ліпідний обмін [2], суттєво впливає на імунологічний механізм [6, 9].
Терапевтичну ефективність та переносимість препарату еспа-ліпон оцінювали у 40 хворих з AIT в поєднанні з гіпотиреозом, 20 з них становили контрольну групу. Препарат еспа-ліпон призначали 20 хворим основної (дослідної) групи протягом 3 міс у дозі 600 мг/доб. внутрішньо за 1 год до сніданку. При цьому за 15-20 хв до їжі досліджувані приймали препарат тироксин. Протягом курсу лікування доза замісної гормональної терапії тироксином у хворих контрольної групи не змінювалася, а у пацієнтів досліджуваної групи змінювалася залежно від динаміки клінічних проявів гіпотиреозу. Група дослідження складалася з 20 хворих на AIT з гіпотиреозом у субкомпенсованому стані. Жінок було 17, чоловіків — 3. Середній вік досліджуваних — 40,4±3,7 років, а тривалість захворювання становила 3,5 року.

Таблиця 1. Динаміка показників ТТГ та титру АМС під впливом препарату еспа-ліпон
|
Групи |
ТТГ, mlU/L |
АМС, IU/ml |
||||
|
до лікування |
після лікування |
Р |
до лікування |
після лікування |
Р |
|
|
Дослідна (n=20) |
6,4±2,7 |
5,2±3,1 |
>0,05 |
71,4±5,6 |
46;6±6,3 |
<0,05 |
|
Контрольна (n=20) |
7,2+1,9 |
7,0±2,2 |
>0,05 |
69,4+3,7 |
68,1±4,1 |
>0,05 |
|
Норма |
0,17-4,05 |
< 20 |
||||
Примітка: Р — вірогідність різниці показників до та після лікування.
Таким чином, включення до комплексного лікування АЛК (еспа-ліпону) суттєво знижує рівень антитіл до мікросомальних фракцій (АМС) (Р<0,05) та значно знижує рівень тиротропіну (ТТГ) (Р>0,05). Позитивний вплив на перебіг гіпотиреозу сприяв зменшенню дози замісної терапії тироксином на 25 мг у 4 хворих (20%). Середні об’єми щитоподібної залози до дослідження становили: 17,2±2,7 см3 (права доля) та 15,4±1,9 см3 (ліва доля) у групи пацієнтів, які приймали АЛК, та 13,5±1,5 см3 (права доля) та 14,3±2,8 см3 (ліва доля) — в контрольній групі. Під впливом комбінованого лікування хворих досліджуваної групи з використанням еспа-ліпону розміри щитоподібної залози суттєво не змінилися, як не змінилися вони і у хворих контрольної групи. Однак, у хворих основної групи спостерігалася незначна тенденція до збільшення об’єму щитоподібної залози, що, можливо, пов’язано з покращанням васкуляризації залози. Ехогенність щитоподібної залози за даними УЗД в основній групі мала позитивну динаміку — від зниженої до ізоехогенної. Дрібновогнищевий фіброз, що супроводжує автоімунний процес у щитоподібній залозі, суттєво не зменшився. Вогнищеві утворення під впливом лікування еспа-ліпоном дещо зменшилися у розмірах. Важливо підкреслити, що протягом 3 міс лікування еспа- ліпоном у паренхімі щитоподібної залози вогнищеутворення призупинилося. Загальний аналіз крові під впливом комбінованої терапії покращився, помітна тенденція до збільшення рівня гемоглобіну та кількості еритроцитів, зменшення кількості лейкоцитів та лімфоцитів у периферичній крові. Біохімічний аналіз крові показав позитивну динаміку рівня загального холестерину. Зміни значень лімфоцитів та загального холестерину наведено у табл. 2. У групі дослідження кількість лімфоцитів вірогідно зменшилася після 2-3 міс лікування, а рівень холестерину — після 3 міс лікування.
Дрібновогнищевий фіброз, що супроводжує автоімунний процес у щитоподібній залозі, суттєво не зменшився. Вогнищеві утворення під впливом лікування еспа-ліпоном дещо зменшилися у розмірах. Важливо підкреслити, що протягом 3 міс лікування еспа- ліпоном у паренхімі щитоподібної залози вогнищеутворення призупинилося. Загальний аналіз крові під впливом комбінованої терапії покращився, помітна тенденція до збільшення рівня гемоглобіну та кількості еритроцитів, зменшення кількості лейкоцитів та лімфоцитів у периферичній крові. Біохімічний аналіз крові показав позитивну динаміку рівня загального холестерину. Зміни значень лімфоцитів та загального холестерину наведено у табл. 2. У групі дослідження кількість лімфоцитів вірогідно зменшилася після 2-3 міс лікування, а рівень холестерину — після 3 міс лікування.
Таблиця 2. Динаміка рівнів лімфоцитів та холестерину під впливом препарату еспа-ліпон
|
Групи |
Лімфоцити, % |
Холестерин, ммоль/л |
||||
|
до лікування |
після лікування |
Р |
до лікування |
після лікування |
Р |
|
|
Дослідна (n=20) |
36,4+1,7 |
28,3±3,1 |
< 0,05 |
5,9+1,4 |
4,2+1,8 |
< 0,05 |
|
Контрольна (n=20) |
35,1±2,3 |
34,9+2,5 |
> 0,05 |
6,3 ±1,2 |
6,1±1,1 |
> 0,05 |
Примітка: Р — вірогідність різниці показників до та після лікування.
Враховуючи той факт, що AIT з гіпотиреозом супроводжується дисметаболічною енцефалопатією [3], нами визначався стан вегетативної нервової системи (ВНС) та мозкової активності при цій патології. Динаміка функціональних тестів стану ВНС наведена в табл. 3.
Таблиця З. Динаміка показників функціональних тестів стану ВНС та вплив препарату еспа-ліпон
|
Етапи лікування |
Тест на глибоке дихання (ЧСС/хв) |
Тест Вальсальви (в.о.) |
Індекс 30:15 (в.о.) |
Ортотест (мм рт.ст.) |
|
Дослідна група (n=20) |
||||
|
До лікування |
15,4±1,2 |
1,29±0,07 |
1,06±0,03 |
16,1±3,1 |
|
Через 3 міс |
12,9±1,7 |
1,13±0,05 |
0,91 ±0,04 |
12,2±2,6 |
|
Р |
< 0,05 |
< 0,05 |
< 0,05 |
< 0,05 |
|
Контрольна група (n=20) |
||||
|
До лікування |
17,1±2,5 |
1,23±0,03 |
1,02±0,03 |
15,4±2,9 |
|
Через 3 міс |
16,9±2,1 |
1,21±0,06 |
1,01±0,02 |
15,3±2,4 |
|
Р |
>0,05 |
>0,05 |
>0,05 |
>0,05 |
Примітка: Р — вірогідність різниці показників до та після лікування.
Виходячи з отриманих результатів показників проведених тестів, слід відзначити значні зміни функціонального стану ВНС під впливом лікування. Значення ортостатичного тесту під впливом лікування у групі обстеження суттєво покращилося (Р<0,05). Це свідчить, що функціональний стан симпатичної ланки ВНС знижується. Однак нормалізація активності СНС формується на тлі значного зниження парасимпатичної активності за трьома тестами (Р<0,05). Зваживши на вище означені тенденції, можна висловити припущення, що зниження парасимпатичної активності та нормалізація симпатичної активності у хворих на AIT з гіпотиреозом при комбінованому лікуванні загалом свідчить про підвищення функціональної активності ВНС. Вивчення ритмограм розширює можливості оцінки стану ВНС. Показники варіаційної пульсометри наведено у табл. 4.
Таблиця 4. Динаміка показників варіаційної пульсометри під впливом препарату еспа-ліпон
|
Показники |
До лікування |
Через 2 міс |
Р1 |
Через 3 міс |
Р2 |
|
Дослідна група (n=20) |
|||||
|
Мо, с |
0,92±0,05 |
0,81±0,05 |
> 0,05 |
0,76±0,05 |
< 0,05 |
|
АМо, % |
43,1±2,7 |
38,1±5,4 |
>0,05 |
35,3±3,8 |
< 0,05 |
|
Δх, с |
0,28±0,01 |
0,34±0,01 |
< 0,05 |
0,36±0,01 |
< 0,05 |
|
ІН, в. |
107,3+2,1 |
65,6±3,1 |
< 0,05 |
63,1+5,2 |
< 0,05 |
|
Контрольна група (n =20) |
|||||
|
Мо, с |
0,90±0,03 |
0,88±0,05 |
> 0,05 |
0,89±0,04 |
> 0,05 |
|
АМо, % |
37,4+3,9 |
36,9+4,1 |
> 0,05 |
36,8+3,1 |
> 0,05 |
|
Δх, с |
0,32±0,03 |
0,31±0,01 |
> 0,05 |
0,33±0,02 |
> 0,05 |
|
ІН, в. |
61,2±3,5 |
66,1±4,1 |
> 0,05 |
59,5±3,8 |
> 0,05 |
Примітка: Р1 — вірогідність різниці показників до лікування та через 2 міс. Р2 — вірогідність різниці показників до лікування та через 3 міс.
Як видно з табл. 4, збільшення варіаційного розмаху (Δ← х), зниження амплітуди моди (АМо) та зниження індексу напруги (ІН) (Р<0,05) підтверджує виявлену функціональними тестами тенденцію до зростання активності ВНС. Наслідком вищезазначених змін було покращання функції внутрішніх органів: серцево-судинної системи, шлунково-кишкового тракту, сечовидільної та статевої систем. Відомо, що гіпотиреоз супроводжується погіршенням пам’яті, уповільненням рухової активності, зменшенням концентрації уваги [1, 4, 10]. Подібні ознаки характеризують дисметаболічну енцефалопатію [8]. Нами було проведено низку психометричних тестів, які дають уявлення про активність та швидкість мислення при виконанні окремих завдань. Динаміка змін показників проведених психометричних тестів наведена в табл. 5.
Таблиця 5. Динаміка показників психометричних тестів під впливом еспа-ліпону
|
Психометричні тести |
До лікування |
Після лікування |
Р |
|
Досліджувана група (n=20) |
|||
|
Тест на цифрову послідовність (с) |
72,3±5,9 |
62,7±6,8 |
< 0,05 |
|
Тест на можливість прямувати лінією (с) |
135,4+11,7 |
120,3+10,5 |
< 0,05 |
|
Тест на цифрові символи (с) |
122,3±13,2 |
103,1±S,7 |
< 0,05 |
|
Контрольйа група (n =20) |
|||
|
Тест на цифрову послідовність (с) |
74,1±4,2 |
71,5±5,2 |
>0,05 |
|
Тест на можливість прямувати лінією (с) |
131,1±10,5 |
130,1±18,6 |
> 0,05 |
|
Тест на цифрові символи (с) |
125,4+12,1 |
124,1±11,9 |
> 0,05 |
Примітка: Р — вірогідність різниці показників до та після лікування.
Під впливом проведеного комбінованого лікування активність процесів мислення значно зросла. Про це свідчить швидкість виконання хворими тестів на цифрову послідовність, можливість прямувати лінією, котрі вірогідно покращуються після 3 міс лікування. Тест на цифрові символи суттєво покращувався вже після 2 міс лікування (Р<0,05). Отримані результати вказують на терапевтичну нейротропну дію препарату еспа-ліпон.
Висновки
- Застосування альфа-ліпоєвої кислоти (еспа-ліпону) при автоімунному тире оїдиті з гіпотиреозом чинить нейротроп ний та імуномодулюючий ефекти.
- У хворих з дисметаболічною енцефалопатією поєднане застосування тироксину та еспа-ліпону покращує функціональну активність ВНС, значно активізує психомоторну мозкову активність.
- Препарат еспа-ліпон раціонально (доцільно) призначати хворим з автоімунним тиреоїдитом, що супроводжується синдромом гіпотиреозу, у дозі 600 мг/доб протягом 3-4 міс перорально.
Література
- Дедов И.И. Болезни органов эндокринной системы: Руководство для врачей.- М.: Медицина, 2000.- 586 с.
- Кирієнко Д.В., Боднар П.М., Щербак О.В.//Ліки — 1998.- №2,- С. 19-24.
- Кириенко Д.В., Щербак А.В.//VII Росс. Нац. конгр. «Человек и лекарство» (10-14 апреля 2000 г., Москва): Тез. докл,- М., 2000.- С. 195.
- Клиническая эндокринология. 3-е изд./Под ред. Н.Т.Старковой,- СПб: Питер, 2002.- 576 с.
- Лечение тиоктовой кислотой: Научный обзор.- М.: Медпрактика-М, 2002.- 18 с.
- Малижев В.О., Анастасия Л.В., Скибун В.М.//Ліки — 1999.- №2.- С. 101-104.
- Щербак О.В. //Ліки- 2001 — №5-6,- С. 45-56.
- Meng W. Die Krankheiten der Schilddrüse: Grundlagen, Klinik, Praxis.- Jena: Urban & Fischer, 1999 — 110 s.
- Skibun V.N., Malysev lLA., Anastasy L.V. et a/.//3-th Int. Symp. «The Diabetic Foot» (5-8 May 1999, Amsterdam).- Amsterdam, 1999.- P. 71.
- Wenzel КЖ//Internist.— 1988 — V.29 — P. 559-563.
Підготували Д.В.Кирієнко, А.О.Пешко, О.В.Щербак
Опубліковано в журналі «Ліки» №3-4’2002
Завантажити статтю в форматі PDFхроматограф газовий для визначення вмісту жирних кислот, в тому числі ерукової кислоти Agilent 7890B (або еквівалент) в комплекті
з технічних питань
Дата подання: 05 вересня 2017 09:03
Дата відповіді: 07 вересня 2017 14:28
Предмет закупівлі зазначено як газовий хроматограф моделі Agilent 7890B або еквівалент, при цьому Інформація про необхідні технічні якісні та кількісні характеристики предмета закупівлі (Додаток 2 Тендерної документації) містить вимоги, які повністю тотожні технічним характеристикам газового хроматографу моделі Agilent 7820A http://www.agilent.com/cs/library/datasheets/public/5991-5345EN.pdf Як відомо, модель 7820A є спрощеним варіантом газового хроматографу виробництва TM Agilent та значно уступає по своїм технічним, експлуатаційним та функціональним характеристикам моделі 7890В. Просимо надати роз’яснення, чому обравши за основу предмета закупівлі технічне завдання містить характеристики моделі 7820А, а назва предмету закупівлі посилається на модель 7890В, яка значно дорожча від попередньої. Можливо це навмисне заплутування учасників для неоправданого завищення вартості предмету закупівлі.
Розгорнути ЗгорнутиВідповідь: Замовник здійснює закупівлю хроматографа газового для визначення вмісту жирних кислот, в тому числі ерукової кислоти Agilent 7890B (або еквівалент) в комплекті. При цьому технічні та якісні характеристики, його комплектність тощо викладені у Додатку 2 до тендерної документації. Відповідно до частини другої статті 22 Закону України «Про публічні закупівлі» технічна специфікація не повинна містити посилання на конкретну торговельну марку чи фірму, патент, конструкцію або тип предмета закупівлі, джерело його походження або виробника. При цьому, у разі якщо таке посилання є необхідним, воно повинно бути обґрунтованим, а специфікація повинна містити вираз «або еквівалент». Учасники можуть пропонувати Замовнику будь-які моделі газових хроматографів за умови, що їх технічні та якісні характеристики не є гіршими, ніж ті, що викладені у Додатку 2. Замовнику необхідно придбати Газовий хроматограф Agilent 7890B, або інший аналогічний до нього газовий хроматограф. Технічні та якісні характеристики, викладені у Додатку 2 до тендерної документації є мінімально необхідними та дозволяють створити конкуренцію серед потенційних учасників процедури закупівлі і виключають дискримінаційні умови для таких учасників
з технічних питань
Дата подання: 05 вересня 2017 09:05
Дата відповіді: 07 вересня 2017 14:28
Просимо звернути увагу, що ТД в Додатку 2 містить вимоги щодо технічних та якісних характеристик предмета закупівлі повністю аналогічні характеристикам моделі газового хроматографу Agilent 7820А. Певні характеристики притаманні тільки цій моделі, та штучно звужують коло потенційних учасників закупівлі, просимо внести зміни в ТД та виключити всі посилання на конкретну модель газового хроматографу, або замінити вимоги на суттєві, що відображають сутність задачі, що покладається на даний предмет закупівлі, а саме визначення вмісту та складу жирних кислот, зокрема ерукової кислоти.
Розгорнути ЗгорнутиВідповідь: Технічні та якісні характеристики Товару, що закуповується, його комплектність тощо викладені у Додатку 2 до тендерної документації, та не містять посилань на конкретну модель хроматографа газового
з технічних питань
Дата подання: 05 вересня 2017 09:07
Дата відповіді: 07 вересня 2017 14:31
Назва предмету закупівлі містить роз’яснення щодо застосування газового хроматографу, а саме що прилад призначений для визначення вмісту жирнокислотного складу та ерукової кислоти. При цьому, комплектація постачання наведена у Додатку 2 Тендерної документації не містить жодного слова про необхідність постачання бодай одного стандартного розчину для проведення визначення жирних кислот. Як відомо, метод газової хроматографії є відносним методом якісного та кількісного аналізу, та потребує для цільового використання наявності стандартів (еталонів) для проведення первинного калібрування. Наразі якщо предмет закупівлі буде постачатися у комплектності наведеній у Додатку 2 Тендерної документації, він не буде виконувати функцію покладену на нього, що відображена у назві предмету закупівлі. Просимо внести зміни в комплект постачання, та включити до нього вимоги щодо стандартних (еталонних) зразків для калібрування.
Розгорнути ЗгорнутиВідповідь: Технічні та якісні характеристики Товару, що закуповується, його комплектність тощо викладені у Додатку 2 до тендерної документації
з технічних питань
Дата подання: 05 вересня 2017 09:11
Дата відповіді: 07 вересня 2017 14:27
Додаток 2 Тендерної документації, п. 1.1. рядок 1 таблиці містить посилання на технічні характеристики конкретної моделі газового хроматографу Agilent 7820A, що штучно обмежує потенційне коло учасників відкритих торгів. Просимо внести зміни до Тендерної документації, а саме видалити пункт про відтворюваність площ піків не гірше 2%, оскільки відтворюваність площ піків в першу чергу залежить від відтворюваності дозування зразку в хроматограф. Дана характеристика викладена в такій редакції не несе жодного змістового навантаження, не є метрологічною характеристикою предмета закупівлі та не відображає вимогу до задачі, яку повинен виконувати хроматограф (визначення жирнокислотного складу та ерукової кислоти). Доцільно вимагати певну відтворюваність Вузлу автоматичного введення зразків (автосамплеру), оскільки саме цей пристрій відповідає за відтворюваність результатів аналізу в першу чергу.
Розгорнути ЗгорнутиВідповідь: Відтворюваність площ піків (так як і відтворюваність часів утримання) є метрологічною характеристикою вимірювального приладу який може бути, а може і не бути оснащеним автосамплером
з технічних питань
Дата подання: 05 вересня 2017 09:13
Дата відповіді: 07 вересня 2017 14:27
Додаток 2 Тендерної документації, п. 1.1. рядок 1.1 таблиці містить посилання на технічні характеристики конкретної моделі газового хроматографу Agilent 7820A, що штучно обмежує потенційне коло учасників відкритих торгів. Просимо внести зміни в ТД, а саме незмістовну вимогу щодо «об’єму термостату колонок не менше ніж 14 л», замінити на «розмір термостату колонок, що дозволяє встановлювати колонки довжиною понад 100 м для детального аналізу жирнокислотного складу з визначенням цис транс ізомерів жирних кислот». Різні виробники газових хроматографів мають різний об’єм термостату колонок, та суттєвою вимогою може бути тільки придатність термостату до розміщення колонок різної геометрії.
Розгорнути ЗгорнутиВідповідь: Замовником внесені зміни до тендерної документації, якими враховане зазначене питання
з технічних питань
Дата подання: 05 вересня 2017 09:15
Дата відповіді: 07 вересня 2017 14:26
Додаток 2 Тендерної документації, п. 1.1. рядок 1.2 таблиці містить посилання на технічні характеристики конкретної моделі газового хроматографу Agilent 7820A, що штучно обмежує потенційне коло учасників відкритих торгів. Просимо внести зміни в ТД, а саме змінити вимогу «можливість швидкої зміни вставки (лайнера) без використання додаткових інструментів» — ця вимога є патентною технологією TM Agilent відома як Turn Top Unit, є обмежуючою для газових хроматографів виробництва інших торгових марок, тому просимо змінити вимогу на «зручна можливість швидкої зміни вставки (лайнера) «.
Розгорнути ЗгорнутиВідповідь: Замовником внесені зміни до тендерної документації, якими враховане зазначене питання
з технічних питань
Дата подання: 05 вересня 2017 09:17
Дата відповіді: 07 вересня 2017 14:26
Додаток 2 Тендерної документації, п. 1.1. рядок 1.3 таблиці містить вимогу «завдання об’єму зразка, що вводиться: 10 нл — 250 мкл». Разом з цим комплект постачання вимагає наявність шприцу автосамплеру об’ємом 10 мкл у кількості 6 шт. Як відомо, об’єм зразку, що вводиться в хроматограф, залежить від об’єму шприца встановленого в автосамплер. Зі шприцом об’ємом 10 мкл можливо вводити від 1 до 50% об’єму шприца, як вказано в технічних характеристиках автосамплеру моделі 7693А Agilent, що для шприца об’ємом 10 мкл становить 100 нл — 5 мкл. Тому просимо усунути невідповідність вимог та змінити об’єм зразку, що вводиться на 100 нл — 5 мкл, або включити у вимоги додаткові шприци малого та великого об’єму ( останнє насправді не має змісту для задачі визначення жирнокислотного складу).
Розгорнути ЗгорнутиВідповідь: Діапазон об’ємів зразка, що вводиться, є технічним параметром автосамплера, що характеризує точність його роботи. Щодо об’ємів шприців, що замовляються, то цей показник не має прямого відношення
з технічних питань
Дата подання: 05 вересня 2017 09:19
Дата відповіді: 07 вересня 2017 14:26
Додаток 2 Тендерної документації, п. 1.1. рядок 1.4 таблиці містить вимогу щодо постачання у складі приладу полум’яно-іонізаційного детектору. Як відомо, даний тип детектору використовує водень у якості палива та стиснене повітря у якості окисника. Вимоги до комплектації постачання взагалі не містять запит на постачання генератору водню та повітряного компресору, які зазвичай є складовими аналітичних комплексів на базі газових хроматографів з ПІД детекторами. Оскільки таке обладнання має значну вартість, що впливає на ціну предмета закупівлі, просимо внести зміни в ТД та доповнити вимоги по комплектації, або якщо замовник вже має у наявності необхідні джерела газів, просимо підтвердити, що предмет закупівлі не повинен включати джерел газів для ПІД детектору.
Розгорнути ЗгорнутиВідповідь: Замовником внесені зміни до тендерної документації, якими враховане зазначене питання
з технічних питань
Дата подання: 05 вересня 2017 09:21
Дата відповіді: 07 вересня 2017 14:26
Додаток 2 Тендерної документації, п. 1.1. рядок 1.5 таблиці, просимо уточнити чи містить комплект управляючого ПК джерело безперебійного живлення. Якщо так, просимо відобразити вимоги до нього. Газовий хроматограф — це високоточне аналітичне обладнання, раптове вимкнення електроживлення при його роботі може пошкодити цілий ряд вузлів обладнання.
Відповідь: Технічні та якісні характеристики Товару, що закуповується, його комплектність тощо викладені у Додатку 2 до тендерної документації
з технічних питань
Дата подання: 05 вересня 2017 09:22
Дата відповіді: 07 вересня 2017 14:25
Додаток 2 Тендерної документації, п. 1.1. рядок1.5 таблиці просимо уточнити щодо «єдиного програмного забезпечення», чи повинен управляючий ПК містити також ліцензійну операційну систему для роботи з керуючим ПЗ, чи можливо Замовник може прийняти «відкриті, т.з. open source » операційні системи.
Відповідь: Замовником внесені зміни до тендерної документації, якими враховане зазначене питання
з технічних питань
Дата подання: 05 вересня 2017 09:24
Дата відповіді: 07 вересня 2017 14:30
Додаток 2 Тендерної пропозиції, п. 1.1. рядок 2.2 таблиці містить вимогу постачання в комплекті витратних матеріалів фільтр для очистки газу-носія гелію. Разом з тим, джерело гелію (балон) та редуктор в комплекті постачання не вимагаються. Просимо підтвердити, що у замовника вже є в наявності джерело гелію з відповідним редуктором для підключення до газового хроматографу, або в противному разі внести зміни у ТД.
Розгорнути ЗгорнутиВідповідь: Технічні та якісні характеристики Товару, що закуповується, його комплектність тощо викладені у Додатку 2 до тендерної документації
з технічних питань
Дата подання: 05 вересня 2017 09:26
Дата відповіді: 07 вересня 2017 14:25
Додаток 2 Тендерної документації, п. 2. примітка позначена * містить вимогу, що у випадку еквіваленту учасник повинен надати порівняльну таблицю запропонованого товару з товаром, який вимагається замовником. Просимо уточнити, який товар вимагає замовник, газовий хроматограф моделі 7890В як вказано в назві предмета закупівлі, чи моделі 7820А, технічні характеристики якого взято за основу вимог Додатку 2 Тендерної документації.
Розгорнути ЗгорнутиВідповідь: Замовник здійснює закупівлю хроматографа газового для визначення вмісту жирних кислот, в тому числі ерукової кислоти Agilent 7890B (або еквівалент) в комплекті. При цьому технічні та якісні характеристики, його комплектність тощо викладені у Додатку 2 до тендерної документації. Відповідно до частини другої статті 22 Закону України «Про публічні закупівлі» технічна специфікація не повинна містити посилання на конкретну торговельну марку чи фірму, патент, конструкцію або тип предмета закупівлі, джерело його походження або виробника. При цьому, у разі якщо таке посилання є необхідним, воно повинно бути обґрунтованим, а специфікація повинна містити вираз «або еквівалент». В зв’язку з цим, учасник повинен запропонувати хроматограф газовий із технічними та якісними характеристиками, які не є гіршими, ніж ті, що викладені у Додатку 2 до тендерної документації, при цьому у випадку надання учасником еквіваленту він має надати порівняльну таблицю запропонованого товару з товаром, який вимагається Замовником.
Розгорнути всі запитання: 12 Згорнути запитанняObesity – Brit
Спосіб використання:
ЗНИЖЕННЯ НАДМІРНОЇ ВАГИ:
Встановіть цільову вагу відповідно до породи і відрегулюйте індивідуальну добову дозу Brit VD Obesity Cat для зниження ваги на 1–2% на тиждень. Для ефективного та безпечного зниження ваги необхідно регулярно перевіряти вагу. Використовуйте Brit VD Obesity Cat протягом щонайменше 2 місяців. Не годуйте кішку жодним іншим кормом для тварин або харчовими продуктами для людини або закусками.
ПІДТРИМАННЯ ОПТИМАЛЬНОЇ ВАГИ:
Після бажаного зниження ваги продовжуйте годувати скориговану дозу Brit VD Obesity Cat протягом наступних 6 місяців.
Таблиця годування:
| Вага кота (кг) | 2 | 3 | 4 | 5 | 6 | 8 | 10 | 12 |
|---|---|---|---|---|---|---|---|---|
| Добова кількість – зменшення ваги (г) | 50 | 60 | 65 | 70 | 80 | 85 | 95 | 110 |
| Добова кількість – оптимізація ваги (г) | 60 | 75 | 80 | 90 | 95 | 110 | 120 | 140 |
Склад:
сушена курка (42%), жовтий горох (18%), білок жовтого гороху, бамбукова лігноцелюлоза (8%), м’якоть яблука, жир лосося(2%),гідролізована куряча печінка (2%), картопляний білок, курячий жир (1%), мінерали, плівка та насіння подорожника (0,8%),сушені водорості (0,5%, Ascophyllum nodosum), гідролізовані панцирі ракоподібних (джерело сульфату глюкозаміну, 0,036%), гідролізовані хрящі (джерело сульфату хондроїтину, 0,025%), екстракт дріжджів (джерело маннан-олігосахаридів, 0,02%), β-глюкани (0,02%), обліпиха (0,015%), фрукто-олігосахариди (0,013%), юка (Mojave yucca) (0,012%).
Метаболічна енергія:
3 480 ккал/кг
Поживні речовини:
сирий протеїн 43,0%, сирий жир 10,0%, сира клітковина 6,0%, сира зола 7,5%, волога 10%, Омега-3 0,5%, Омега-6 1,0%, кальцій 1,3%, фосфор 1,0%, натрій 0,3%, магній 0,06%.
Харчові добавки на 1 кг:
вітамін A (3a672a) 25 000 МО, вітамін D3 (E671) 850 МО, вітамін E (3a700) 1 000 мг, вітамін C (3a312) 300 мг, холінхлорид (3a890) 2 300 мг, біотин (3a880) 3 мг, вітамін B1 (3a821) 10 мг, вітамін B2 30 мг, нікотинамід (3a315) 60 мг, D-пантотенат кальцію (3a841) 50 мг, вітамін B6 (3a831) 35 мг, фолієва кислота (3a316) 15 мг, вітамін B12 0,15 мг, гідрат хелатного комплексу цинку з амінокислотами (3b606) 110 мг, гідрат хелатного комплексу заліза з амінокислотами (E1) 55 мг, гідрат хелатного комплексу марганцю з амінокислотами (E5) 35 мг, йодид калію (3b201) 3 мг, гідрат хелатного комплексу міді з амінокислотами (E4) 3 мг, органічна форма селену, що виробляється пивними дріжджами (Saccharomyces cerevisiae) CNCM I-3060 (інактивовані селенові дріжджі) (3b8.10) 0,2 мг, таурин (3a370) 2 300 мг, L-карнітин (3a910) 600 мг, L-метіонін (3c305) 4 000 мг. Стабілізатори флори кишківника на 1 кг: Enterococcus faecium DSM 10663/NCIMB 10415 (4b1707) 1×109 КСО.
Delta Lake: высокопроизводительное хранилище таблиц ACID через облачные хранилища объектов
Авторов: Майкл Армбруст, Татхагата Дас, Ливен Сун, Бурак Явуз, Шиксионг Чжу, Мукул Мурти, Джозеф Торрес, Херман ван Ховелл, Адриан Ионеску, Алисия Лущак, Михал Свитаковски, Михал Шафранский, Петер Моста Лиешин, Сяо Лиешин, Сяо Лиешин Али Годси, Самир Паранджпье, Питер Сенсер, Рейнольд Синь, Матей Захария
Скачать статьюАннотация
Облачные хранилища объектов, такие как Amazon S3, являются одними из крупнейших и наиболее экономичных систем хранения на планете, что делает человека привлекательной целью для хранения больших хранилищ данных и озер данных.К сожалению, их реализация в виде хранилищ «ключ-значение» затрудняет выполнение транзакций ACID и высокую производительность: операции с метаданными, такие как перечисление объектов, дороги, а гарантии согласованности ограничены. В этой статье мы представляем Delta Lake, уровень хранения таблиц ACID с открытым исходным кодом поверх облачных хранилищ объектов, изначально разработанный в Databricks. Delta Lake использует журнал транзакций, сжатый в формат Apache Parquet, для предоставления свойств ACID, перемещения во времени и значительно более быстрых операций с метаданными для больших наборов табличных данных (например,g., возможность быстрого поиска в миллиардах разделов таблицы тех, которые имеют отношение к запросу). Он также использует эту конструкцию для предоставления высокоуровневых функций, таких как автоматическая оптимизация компоновки данных, upserts, кэширование и журналы аудита. К таблицам Delta Lake можно получить доступ из Apache Spark, Hive, Presto, Redshift и других систем. Delta Lake развернута у тысяч клиентов Databricks, которые обрабатывают эксабайты данных в день, причем самые крупные экземпляры управляют наборами данных эксабайтного масштаба и миллиардами объектов.
Бумага
Как использовать стол pKa — Репетитор по органической химии
В этом уроке я хочу поговорить об основах кислотно-щелочного равновесия и о том, как мы используем его в рамках органической химии. Но прежде чем мы углубимся в детали самого кислотно-основного равновесия, давайте рассмотрим, что такое основание и что такое кислота в соответствии с разными определениями. Есть три наиболее распространенных определения кислот и оснований, и, пожалуй, самым простым является определение Аррениуса.
Аррениусовы кислоты и основания
Согласно определению Аррениуса, предложенному шведским физико-химиком Сванте Аррениусом, кислота является донором протона (H + ), в то время как основание является донором иона гидроксила (OH — ). Типичным примером кислоты Аррениуса является что-то вроде соляной кислоты (HCl). Хотя типичным примером основания Аррениуса является что-то вроде гидроксида натрия (NaOH). Как только эти частицы диссоциируют, HCl дает H + в раствор, а NaOH выделяет ион OH —.
Проблема с этим определением состоит в том, что оно чрезвычайно ограничено по своему охвату и применимо только к водным растворам. Однако в органической химии мы редко имеем дело с водными растворами. Таким образом, это определение не подходит для наших целей.
Кислоты и основания Бренстеда-Лоури
Датский физико-химик Йоханнес Бронстед и английский физико-химик Томас Лоури предложили более общее определение кислотного основания. Согласно теории Бренстеда-Лоури, кислота является донором H + , а основание — акцептором H + .Таким образом, теория может быть расширена на кислоты и основания в любых средах и не ограничивается только водными растворами.
Таким образом, кислота Бренстеда является той же разновидностью, что и кислота Аррениуса. Однако, когда дело доходит до основания, только тот вид, который принимает протон, является основанием. Итак, в гидроксиде натрия (NaOH) только OH — является основанием, а не всей молекулой. Это очень распространенная ошибка, поэтому вы можете ожидать некоторого обмана вокруг этого определения на экзамене.
Также помните, что если вид принял протон, это основа, независимо от того, как мы привыкли думать об этом.Например, если мы возьмем уксусную кислоту и протонируем ее (добавим к ней протон), то уксусная кислота будет действовать как основание в такой реакции.
Конъюгированные кислоты и основания
Теория Бренстеда-Лоури также описывает взаимосвязь между реагентами в кислотно-основной реакции и продуктами. Продукты в кислотно-основной реакции называются конъюгатами . Возьмем, к примеру, реакцию между метилацетатом (сложным эфиром) и серной кислотой. В этой реакции сложный эфир действует как основание, принимая протон, а серная кислота действует как кислота Бренстеда, предоставляя указанный протон.Как только наш сложный эфир (который является основанием на стороне реагента) принимает протон, он становится сопряженной кислотой. Точно так же, как только серная кислота теряет протон, она становится сопряженным основанием.
Таким образом, , как только кислота теряет протон, она становится сопряженным основанием . И , как только основание принимает протон, оно становится сопряженной кислотой . Помните, что когда мы говорим о конъюгатах, мы всегда говорим о продуктах специфической кислотно-основной реакции . Основание конъюгата, которое мы получили в приведенной выше реакции (HSO 4 — ), может диссоциировать дальше и быть кислотой в другой реакции.Но в данном случае ион HSO 4 — является сопряженным основанием.
Кислоты и основания Льюиса
Есть еще одна, еще более общая теория кислотного основания, предложенная американским физико-химиком Гилбертом Льюисом. Его кислотно-щелочную теорию иногда называют электронной теорией кислот и оснований. Согласно теории Льюиса, кислота является акцептором электронной пары, а основание — донором электронной пары.
Для целей этого урока я не собираюсь углубляться в детали теории Льюиса и оставлю это для другого урока.Однако в остальной части этого обсуждения я сосредоточусь исключительно на теории кислот и оснований Бренстеда-Лоури.
Сильные кислоты против слабых
Теперь, когда мы знаем, что такое кислоты и основания, давайте немного поговорим о качественной разнице между ними. А именно, я хочу посмотреть на разницу между сильными и слабыми кислотами.
Когда мы говорим, что кислота сильная, мы имеем в виду, что указанная кислота полностью диссоциирует в растворе. Точно так же, если кислота слабая, она будет только частично диссоциировать.
Ну а что это значит? Давайте посмотрим на эти два примера:
С левой стороны у меня бромистоводородная кислота (HBr), которая является очень сильной кислотой. Справа — уксусная кислота (CH 3 COOH), типичная слабая кислота. Когда сильная кислота полностью диссоциирует, это означает, что в растворе практически не останется HBr. Напротив, когда уксусная кислота диссоциирует, она не дает нам много продуктов диссоциации и в основном остается как есть.
Как определить кислотную силу?
Сказать, что одна кислота сильная, а другая слабая, — это немного махать рукой.Итак, есть ли способ, как мы можем количественно определить «сильные» и «слабые», используя какое-то числовое значение?
Для этой цели мы используем константы кислотной диссоциации (значения K и ). По определению, константа диссоциации кислоты равна отношению концентраций продукта к концентрации реагентов.
Рассмотрим это на примере диссоциации HCN:
Цианистый водород — слабая кислота, диссоциирующая лишь частично. Реагентом в этом случае является сама кислота (HCN).А продуктами являются протон (H + ) и цианид-анион (CN — ). Теперь мы можем получить выражение константы диссоциации, поместив концентрации этих частиц в уравнение для K a . А поскольку цианистый водород — слабая кислота, у нас будет очень небольшое количество наших продуктов. Это приводит к очень маленькому значению K и .
Как читать значения K
и ?Поскольку K a представляет собой математическое выражение для состояния равновесия, его довольно легко интерпретировать.Если значение K a невелико, у нас не так много наших продуктов. Отсутствие продуктов означает отсутствие диссоциации. Отсутствие диссоциации означает слабую кислоту. Точно так же большое значение K a означает тонны продукции. Тонны продуктов — полная диссоциация. Полная диссоциация означает сильную кислоту. Довольно просто.
Проблема со значениями K и заключается в том, что это, как правило, очень уродливые числа, с которыми трудно работать, но в одиночку — помните. Поэтому, как правило, мы будем использовать вместо этого значения pKa.По определению, значение pKa является отрицательным логарифмом значения K a . Это не имеет никакого физического значения, кроме удобства.
Важной особенностью шкалы pKa является то, что она инвертирована по сравнению со шкалой K на шкалу . Таким образом, сильные кислоты будут иметь отрицательные значения pKa, тогда как слабые кислоты будут иметь положительные значения pKa.
Примеры значений pKa и способы их использования
Давайте посмотрим на несколько видов, чтобы увидеть, как значения K , и pKa сравниваются друг с другом.
На этой картинке есть метанол, уксусная кислота, метантиол и метиламин. Рядом с каждым из этих видов указаны соответствующие значения K , и pKa. Проведя быстрое сравнение этих чисел, мы можем увидеть, что уксусная кислота — самая сильная кислота среди этих молекул. Между тем, разновидность амина в самом конце представляет собой самую слабую кислоту с самым низким значением K , и, соответственно, самым высоким значением pKa. Таким образом, если бы мы хотели, например, отсортировать эти молекулы в соответствии с их кислотной силой от самой слабой до самой сильной, мы получили бы следующее:
Вопросы, подобные этому, довольно часто встречаются на экзаменах, поэтому вы можете дополнительно потренироваться, чтобы подготовиться к экзамену.
Использование значений pKa для прогнозирования состояния равновесия
Теперь мы использовали значения K , и pKa для ранжирования силы кислоты. Что еще мы можем с ними сделать?
Ну, еще один типичный вопрос, который вы встретите в тесте, — это вопрос типа «предсказать состояние равновесия». У вас будет какая-то реакция, и вам нужно будет обосновать свой подход к значениям pKa и выяснить, благоприятствует ли ваша реакция продуктам или реагентам.
Как бы вы подошли к подобному вопросу? На самом деле это довольно простая проблема.
- Во-первых, вам нужно определить кислоту и сопряженную кислоту в вашей реакции.
- Затем найдите соответствующие значения pKa в своей таблице pKa.
- И, наконец, сравните эти значения. Равновесие всегда в пользу более слабой кислоты!
Посмотрите на эти два примера здесь:
В первом случае конъюгированное основание имеет более низкое значение pKa, поэтому равновесие благоприятствует продуктам. Во втором примере кислота реагента имеет более низкое значение pKa, что делает ее более подходящей разновидностью, таким образом, равновесие благоприятствует реагентам.
Использование значений pKa для оценки Keq реакции
Наконец, мы можем использовать значения pKa для оценки константы равновесия самой реакции. По сути, это то же самое, что сказать, какую сторону реакции поддерживает равновесие, но в количественной (то есть числовой) манере.
Например, давайте посмотрим на эту реакцию:
Первое, что нам нужно сделать, это найти кислоту и сопряженную кислоту. Затем мы найдем для них значения pKa.Мы знаем, что кислота теряет протон в кислотно-щелочной реакции, поэтому очевидно, что ацетилен слева — это наша кислота. И поскольку NH 2 — принимает этот протон, NH 3 является сопряженной кислотой.
Находя их в моей таблице pKa, я получаю следующие числа:
Основываясь на нашем разговоре, состоявшемся несколько минут назад, мы уже знаем, что это равновесие благоприятствует продуктам, поскольку значение pKa для моей конъюгированной кислоты составляет 36 по сравнению с 25 для исходной кислоты.Но насколько именно это равновесие сдвинуто?
Вот уловка: мы можем легко оценить константу равновесия, взяв 10 в степени pKa для моей конъюгированной кислоты минус pKa для исходной кислоты. Я не собираюсь утомлять вас подробностями того, как это получается. Я покажу точные детали в другом посте, или вы можете увидеть вывод в моих кислотно-щелочных заметках.
Этот расчет для этого конкретного примера дает 10 11 , что указывает на очень благоприятную реакцию.Таким образом, если раньше мы знали, что равновесие благоприятствует продуктам, то теперь мы знаем соотношение между продуктами и реагентами, и оно составляет 10 11 !
Вот еще один пример:
В данном случае мы имеем исходную кислоту, которая намного слабее сопряженной кислоты. Итак, мы знаем, что равновесие будет смещено в сторону реагентов и реакция будет неблагоприятной. Однако, подставив значения в формулу, которую я показал вам только что, мы можем увидеть, что константа равновесия здесь равна 10 -6.5 . И мы знаем, что небольшое число для константы равновесия относится к неблагоприятной реакции.
Ознакомьтесь с вашим столом pKa
В этом уроке мы довольно широко использовали значения pKa. Итак, я хочу подчеркнуть, насколько важно ознакомиться с вашей таблицей pKa. Большинство инструкторов предоставят вам на экзамене что-то вроде таблицы pKa. Однако есть некоторые, которые заставят вас запомнить типичные значения и ничего не дадут. Убедитесь, что вы знаете, чего ожидать, и узнайте заранее, будет ли у вас на тесте таблица pKa!
Я предлагаю вам сделать копию таблицы, которую использует ваш инструктор, и положить ее под лицевую обложку связующего вещества по органической химии.Это сэкономит вам массу времени, когда вам нужно быстро найти значения pKa. И поверьте мне, в этом курсе вы довольно часто будете искать значения pKa!
Затем убедитесь, что вы знаете, как пользоваться своим столом. Некоторым инструкторам нравится использовать таблицу pKa с видами, расположенными в соответствии со значениями pKa. Лично я ненавижу их, потому что в них действительно сложно ориентироваться. Есть еще один тип, в котором таблица организована по функциональным группам. На мой взгляд, это лучшая версия, поскольку вы можете легко ориентироваться в ней, зная, какое соединение и какие функциональные группы находятся перед вами.
Наконец, я настоятельно рекомендую вам запомнить типичные значения pKa для наиболее распространенных функциональных групп. Хотя большинство инструкторов скажут вам, что не нужно ничего запоминать, это не совсем так. Да, вы, вероятно, будете иметь доступ к таблице pKa во время теста. Но представьте, если бы вам приходилось перечитывать инструкции к кофеварке каждое утро, когда вы хотели сварить чашку вкусного кофе. Разве это не будет ужасной тратой времени и неудобством (особенно если вы так же сварливы утром, как я до того, как я выпил свою первую чашку).Вы определенно не захотите этого. То же самое и с таблицей pKa. Если вам придется каждый раз копаться в таблице, когда вы хотите дважды проверить значение pKa для чего-то вроде карбоновой кислоты или спирта, вы потратите много драгоценного времени на тест. И несколько моментов здесь плюс несколько моментов там действительно складываются.
Итак, это была лишь верхушка айсберга того, как может выглядеть кислотно-щелочное равновесие. В следующем уроке мы подробнее поговорим о различных типичных экзаменационных вопросах и о том, как их решать.
Влияние повторных обработок уксусной кислотой на послеуборочные качества столового винограда «Талоппо»
Наиболее важным возбудителем столового винограда является Botrytis cinerea, который вызывает быстрое порчу плодов. Послеуборочные потери контролируются с помощью фумигации SO2, проводимой каждые 7 или 10 дней, но использование этого газа становится все труднее оправдать из-за нежелательного воздействия на плоды и растущей обеспокоенности здоровьем человека.Уксусная кислота, классифицируемая как соединение GRAS, может использоваться без ограничений в качестве консерванта и представляет собой возможный заменитель диоксида серы. Целями настоящей работы были: (1) оценить, сохраняют ли повторные обработки AAC во время хранения качество плодов столового винограда; (2) проверить эффективность 3 различных концентраций и временных интервалов между каждой обработкой и сравнить эффекты от обработки SO2; Количество ААС, используемого при каждой фумигации, проводимой в течение 15 минут, составляло 30, 50 и 75 мкл / л, а обработки проводились 5, 3 и 2 раза соответственно во время хранения, чтобы получить ту же конечную концентрацию (150 мкл / Л).Столовый виноград также окуривали SO2. Плоды хранили в течение 8 недель при 5 ° C и 95% относительной влажности, затем 4 дня имитированного срока хранения (SSL) при 20 ° C и относительной влажности 85%. По окончании эксперимента оценивали потерю веса и визуальную оценку. После восьми недель хранения заболеваемость серой гнилью по отношению к необработанным фруктам снизилась при всех обработках. Сравнение различных обработок не показало значительных различий между фумигациями, выполненными 3 и 2 раза, из которых 24.9% и 27,2% гнили соответственно. Лучший контроль гниения был достигнут при проведении 5 фумигаций каждые 2 недели (18,1% гнилей), в то время как гниль плодов, обработанных SO2, составила 26,2%. В течение периода SSL не наблюдалось особых различий между всеми видами лечения. Ни одна из обработок не повлияла на потерю веса, а также не было обнаружено различий в оценке, приписываемой внешнему качеству (потемнение рахиса и внешний вид ягод). Результаты показали, что хороший контроль серой гнили на столовом винограде может быть достигнут путем повторной фумигации во время хранения.AAC может быть многообещающим соединением для использования в качестве альтернативы SO2 для сохранения качества фруктов.
Таблица общих значений Ka для слабых кислот
K a — константа равновесия реакции диссоциации слабой кислоты. Слабая кислота — это кислота, которая лишь частично диссоциирует в воде или водном растворе. Значение K a используется для расчета pH слабых кислот. Значение pK a используется для выбора буфера при необходимости.Выбор кислоты или основания, где pK a близок к необходимому pH, дает наилучшие результаты.
Соотношение pH, Ka и pKa
pH, Ka и pKa связаны друг с другом. Для кислой ГА:
K a = [H + ] [A — ] / [HA]
pK a = — log K a
pH = — log ([H + ])
В средней точке кривой эквивалентности pH = pK a .
Ка слабых кислот
| Ка слабых кислот | |||
|---|---|---|---|
| Имя | Формула | К а | pK а |
| уксусная | HC 2 ч 3 O 2 | 1.8 х 10 -5 | 4,7 |
| аскорбиновая (I) | H 2 С 6 ч 6 O 6 | 7,9 х 10 -5 | 4,1 |
| аскорбиновая (II) | HC 6 ч 6 O 6 — | 1,6 х 10 -12 | 11,8 |
| бензойная | HC 7 ч 5 O 2 | 6.4 х 10 -5 | 4,2 |
| борная (I) | H 3 BO 3 | 5,4 х 10 -10 | 9,3 |
| борная (II) | H 2 БО 3 — | 1,8 х 10 -13 | 12,7 |
| борная (III) | ГБО 3 2- | 1,6 х 10 -14 | 13.8 |
| угольный (I) | H 2 CO 3 | 4,5 х 10 -7 | 6,3 |
| углекислый (II) | HCO 3 — | 4,7 х 10 -11 | 10,3 |
| лимонный (I) | H 3 С 6 ч 5 O 7 | 3,2 х 10 -7 | 6,5 |
| лимонный (II) | H 2 С 6 ч 5 O 7 — | 1.7 х 10 5 | 4,8 |
| лимонный (III) | HC 6 ч 5 O 7 2- | 4,1 х 10 -7 | 6,4 |
| муравьиная | HCHO 2 | 1,8 х 10 -4 | 3,7 |
| гидразидный | HN 3 | 1,9 х 10 -5 | 4,7 |
| синильная кислота | HCN | 6.2 х 10 -10 | 9,2 |
| плавиковый | HF | 6,3 х 10 -4 | 3,2 |
| перекись водорода | H 2 O 2 | 2,4 х 10 -12 | 11,6 |
| гидросульфат-ион | HSO 4 — | 1,2 х 10 -2 | 1,9 |
| хлорноватистое | HOCl | 3.5 х 10 -8 | 7,5 |
| молочный | HC 3 H 5 O 3 | 8,3 х 10 -4 | 3,1 |
| закись азота | HNO 2 | 4,0 х 10 -4 | 3,4 |
| щавелевая (I) | H 2 С 2 O 4 | 5,8 х 10 -2 | 1,2 |
| щавелевая (II) | HC 2 O 4 — | 6.5 х 10 -5 | 4,2 |
| фенол | HOC 6 ч 5 | 1,6 х 10 -10 | 9,8 |
| пропановый | HC 3 H 5 O 2 | 1,3 х 10 -5 | 4,9 |
| сернистый (I) | H 2 СО 3 | 1,4 х 10 -2 | 1,85 |
| сернистый (II) | HSO 3 — | 6.3 х 10 -8 | 7,2 |
| мочевой | HC 5 ч 3 с.ш. 4 O 3 | 1,3 х 10 -4 | 3,9 |
Смотри: В чем разница между кислотами и основаниями?
Сильные и слабые кислоты и основания
Сильная кислота или сильное основание полностью ионизируется (диссоциирует) в растворе. В воде один моль сильной кислоты HA растворяется, давая один моль H + (в виде иона гидроксония H 3 O + ) и один моль сопряженного основания A —.По существу, не остается неионизированной кислотной ГК.
Сильная кислота: HA + H 2 O → A — (водн.) + H 3 O + (водн.)
Сильное основание: BOH + H 2 O → B + ( водн.) + OH — (водн.)
Примеры сильных кислот и оснований приведены в таблице ниже. В водном растворе каждый из этих ионизируется на 100%.
Слабая кислота или слабое основание только частично диссоциирует . В состоянии равновесия и кислота, и сопряженное основание присутствуют в растворе
Слабая кислота: AH + H 2 O ↔ A — (водн.) + H 3 O + (водн.)
Слабое основание: BOH + H 2 O B + (водн.) + OH — (водн.) Или
B + H 2 O ↔ BH + (водн.) + OH — (водн.)
Примеры слабых кислот и оснований приведены в таблице ниже.
Более сильные кислоты имеют большую константу диссоциации кислоты (Ka) и меньшую логарифмическую константу (pKa = −log Ka), чем более слабые кислоты. Чем сильнее кислота, тем легче она теряет протон H +.
Двумя ключевыми факторами, которые способствуют легкости депротонирования, являются полярность связи H-A и размер атома A, который определяет прочность связи H-A. Сила кислоты также зависит от стабильности конъюгированной основы.
См. Также Кислотно-основные свойства водных растворов солей с ионами кислот и оснований, Буферные растворы, pKa неорганических кислот и оснований, pKa фенолов, спиртов и карбоновых кислот и pKa аминов, диаминов и циклических органических соединений азота , а также кислотно-щелочные индикаторы pH или значения pH некоторых растворов кислот и оснований.
0 Ba (2) HNO3 3 Гидроксид калия| Кислоты Стонга | Сильные основания | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бромистоводородная кислота | HBr | ОН 2 Гидроксид бария | Гидроксид кальция | Ca (OH) 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Йодистоводородная кислота | HI | Гидроксид лития | LiOH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Азотная кислота | 900OH6 9027 9027 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хлорная кислота | HClO 4 | Гидроксид натрия | NaOH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Серная кислота | H 2 SO 4 | Стронция гидроксид | : Константы равновесия кислот и основанийВведениеВ общей химии 1 мы рассчитали pH сильных кислот и оснований, считая, что они полностью диссоциируют, то есть подвергаются 100% ионизации. Теперь мы рассмотрим слабые кислоты и основания, которые не диссоциируют полностью, и воспользуемся константами равновесия для расчета равновесных концентраций. Мы могли бы решить все эти проблемы, используя приемы из предыдущей главы об эквильбрии, но вместо этого мы собираемся разработать краткие методы и определить, когда они применимы.{-}]} {[HA] [H_ {2} O]} \] Но мы можем считать концентрацию воды постоянной, потому что она намного больше, чем у кислоты, которая ионизировалась. Здесь действуют два фактора: во-первых, вода является растворителем, и поэтому [H 2 O] больше, чем [HA], а во-вторых, [HA] является слабой кислотой, и поэтому в равновесии количество ионизированных меньше, чем [HA]. Следует отметить, что это однородное уравнение, и хотя мы игнорируем воду и рассматриваем ее как жидкость, это происходит по другой причине, чем та, которая использовалась в предыдущей главе для гетерогенных равновесий.{-}]} {[HA]} \] , где \ (K_a = K [H_2O] \) K a используется только для слабых кислот. -]} {[B]} \] Примером первого типа может быть метиламин, CH 3 NH 2 .{-14} \] Таким образом, между сопряженной парой существует обратная зависимость.
Рисунок \ (\ PageIndex {1} \): Соотношение между силой кислоты или основания и силой их сопряженного основания или кислоты.+ \; \; К_ {a3} \] \ [K_ {a1}> K_ {a2}> K_ {a3} \] pKa и pK bПоскольку значения pK a и pK b настолько малы, они часто записываются как значения pX, где pX = -logX. Итак pK a = -logK a и K a = 10 -pka Стол KaТаблица \ (\ PageIndex {1} \): Таблица констант ионизации кислоты
Источник данных: CRC Handbook of Chemistry and Physics, 84th Edition (2004). Стол КбТаблица \ (\ PageIndex {2} \): базовые константы ионизации
Источник данных: CRC Handbook of Chemistry and Physics, 84th Edition (2004). Роберт Э. Белфорд (Арканзасский университет Литл-Рока; факультет химии). За широту, глубину и достоверность этой работы отвечает Роберт Э. Белфорд, rebelford@ualr.edu. Вам следует связаться с ним, если у вас есть какие-либо вопросы. Этот материал содержит как оригинальные материалы, так и контент, основанный на предыдущих вкладах сообщества LibreTexts и других ресурсов, включая, помимо прочего: Кислотно-щелочной столКислотно-щелочной стол
Кислотно-щелочной стол . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Цю властивість часто застосовують у промисловості для осушення газів.
Цю властивість часто застосовують у промисловості для осушення газів.
 Важчі за воду, безбарвні. Добре розчиняються у воді. Водні розчини — кислі на смак, роз’їдають органічні речовини.
Важчі за воду, безбарвні. Добре розчиняються у воді. Водні розчини — кислі на смак, роз’їдають органічні речовини.
 о.
о. о.
о.