Электронное строение атома
Так как при химических реакциях ядра реагирующих атомов остаются без изменений (за исключением радиоактивных превращений), то химические свойства атомов зависят от строения их электронных оболочек. Теория электронного строения атомапостроена на основе аппарата квантовой механики. Так, структура энергетических уровней атома может быть получена на основе квантовомеханических расчетов вероятностей нахождения электронов в пространстве вокруг атомного ядра (рис. 4.5).
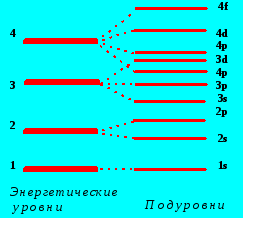
Рис. 4.5. Схема подразделения энергетических уровней на подуровни
Основы теории электронного строения атома сводятся к следующим положениям: состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами: главным квантовым числом
Согласно принципу Паули, в одном и том же атоме не может быть двух электронов, обладающих одинаковой совокупностью четырех квантовых чиселn, l, ml, ms; совокупности электронов с одинаковыми главными квантовыми числами n образуют электронные слои, или энергетические уровни атома, нумеруемые от ядра и обозначаемые какK, L, M, N, O, P, Q, причем в энергетическом слое с данным значениемnмогут находиться не более, чем2n2электронов. Совокупности электронов с одинаковыми квантовыми числамиnиl , образуют подуровни, обозначаемые по мере удаления их от ядра как s, p, d, f .
Вероятностное нахождение положения электрона в пространстве вокруг атомного ядра соответствует принципу неопределенностей Гейзенберга. По квантовомеханическим представлениям, электрон в атоме не имеет определенной траектории движения и может находиться в любой части пространства вокруг ядра, а различные его положения рассматриваются как электронное облако с определенной плотностью отрицательного заряда. Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. В нем заключено порядка 90% электронного облака. Каждому подуровню1s, 2s, 2pи т.д. соответствует определенное количество орбиталей определенной формы. Например,1s— и2s-орбитали имеют сферическую форму, а2p-орбитали (2px, 2py, 2pz-орбитали) ориентированы во взаимно перпендикулярных направлениях и имеют форму гантели (рис. 4.6).
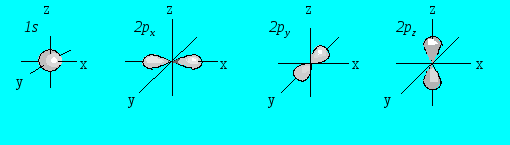
Рис. 4.6. Форма и ориентация электронных орбиталей.
При химических реакциях атомное ядро не претерпевает изменений, изменяются лишь электронные оболочки атомов, строением которых объясняются многие свойства химических элементов. На основе теории электронного строения атома был установлен глубокий физический смысл периодического закона химических элементов Менделеева и создана теория химической связи.
Теоретическое обоснование периодической системы химических элементов включает в себя данные о строении атома, подтверждающие существование связи между периодичностью изменения свойств химических элементов и периодическим повторением сходных типов электронных конфигураций их атомов.
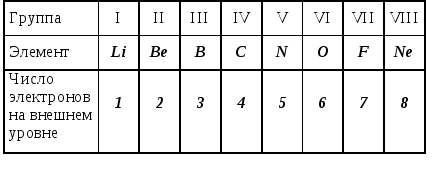
В свете учения о строении атома становится обоснованным разделение Менделеевым всех элементов на семь периодов: номер периода соответствует числу энергетических уровней атомов, заполняемых электронами. В малых периодах с ростом положительных заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 2 в первом периоде, и от 1 до 8 во втором и третьем периодах), что объясняет изменение свойств элементов: в начале периода (кроме первого) находится щелочной металл, затем наблюдается постепенное ослабление металлических свойств и усиление неметаллических. Эта закономерность прослеживается для элементов второго периода в таблице 4.2.
Таблица 4.2.
В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что и объясняет более сложное изменение свойств элементов по сравнению с элементами малых периодов.
Одинаковый характер свойств химических элементов в подгруппах объясняется сходным строением внешнего энергетического уровня, как это показано в
Таблица 4.3.
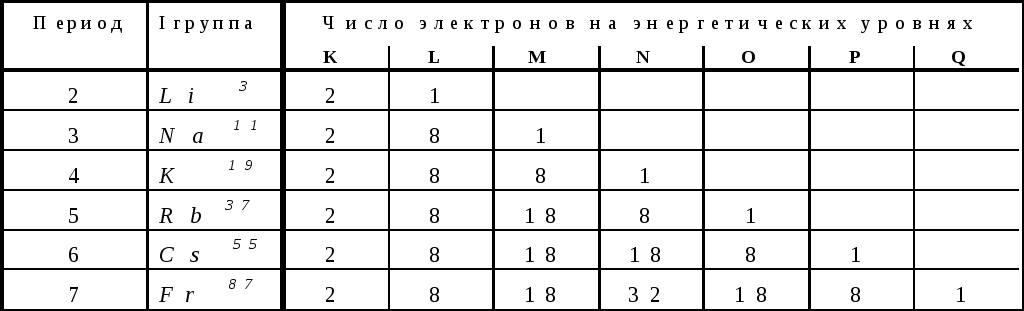
Номер группы, как правило, указывает на число электронов в атоме, которые могут участвовать в образовании химических связей. В этом заключается физический смысл номера группы. В четырех местах периодической системы элементы расположены не в порядке возрастания атомных масс: ArиK,CoиNi,TeиI,ThиPa . Эти отступления считались недостатками периодической системы химических элементов. Учение о строении атома объяснило указанные отступления. Опытное определение зарядов ядер показало, что расположение этих элементов соответствует возрастанию зарядов их ядер. Кроме того, опытное определение зарядов ядер атомов дало возможность определить число элементов между водородом и ураном, а также число лантаноидов. Ныне все места в периодической системе заполнены в промежутке от Z=1доZ=114, однако периодическая система не закончена, возможно открытие новых трансурановых элементов.
Квантовая теория строения атомов
Абсолютно все тела живой и неживой природы, несмотря на их строение и разнообразие, включают в себя мельчайшие частицы — атомы. Первым, кто высказал научное предположение об этом, считается философ Древней Греции Демокрит. Именно этот ученый определил атом как мельчайший неделимый элемент, который образует вещество.
Только в конце XIX столетия были сделаны уникальные открытия, которые смогли продемонстрировать сложность строения указанного элемента, распадающейся на более мелкие элементарные частицы. Тем не менее, это определение широко применяется в современной физике и химии, несмотря на несовпадение его этимологии нынешним представлениям о строении атома.
Демокрит утверждал, что если разделить яблоко на две равные половины, а затем одну из них еще на две части, и продолжать осуществлять деление подобным образом до того момента, как объект исследования перестанет быть яблоком, то мельчайшая частица будет выступать в данном случае атомом яблока.
Группу греческих мыслителей, которые поддерживали теорию о существовании аналогичных крошечных неделимых частиц, называли атомистами.
Определение 1
Атомизм — натурфилософская уникальная гипотеза, которая предполагала, что все чувственно материальные вещи состоят из определенных химически неделимых частиц — атомов.
В современной науке вопрос об атомизме считается до сих пор открытым. Некоторые теоретики выступают за принципы атомизма, однако под атомами подразумевают конкретные фундаментальные частицы, которые далее невозможно разделить.
Квантовая гипотеза строения атома
В основе квантовой теории строения атома можно выделить следующие ключевые положения:- электрон имеет двойственную природу, следовательно, может вести себя и как волна, и как частица, обладающая определенным зарядом и массой;
- точно и одновременно измерить скорость и координату для электрона невозможно одновременно, так как, чем точнее будет данный показатель, тем больше неопределенности появится в самой координате;
- электрон в атоме не может двигаться по определенным траекториям, а может располагаться в любой части ядерного пространства, но возможность его нахождения в разных местах такой среды неодинакова.
Стоит отметить, что пространство вокруг ядра, в котором возможно наблюдать нахождение электрона с большой вероятностью, называют орбиталью.
Правильное формулирование вышеуказанных основ в квантовой теории строения атома составляют суть новой концепции, описывающей постоянное движение микрочастиц, — квантовой механики. Наибольший вклад в развитие указанной гипотезы внесли такие ученые: немец В.Гейзенберг, француз Л. де Бройль, австриец Э.Шредингер и англичанин П.Дирак. В результате своей интеллектуальной деятельности каждый из этих физиков был удостоен Нобелевской премии.
Определение 2
Квантовая механика — очень сложная теория с математической точки зрения, процессы которой описывают принципы построения микромира и являются недоступными не только восприятию органами чувств человека, но и воображению.
Основы атомной теории строения вещества
Рисунок 1. Квантовая модель строения атома. Автор24 — интернет-биржа студенческих работ
В начале 1808 года известный физик Дальтон Джон возродил атомизм как научное течение в физике, доказав действительность существования атомов. Исследователь считал, что мельчайшие частицы представляют собой элементарные химические элементы, которые нельзя заново создать, разделить на более мелкие элементы или же ликвидировать посредством физических превращений. Любая химическая реакция способна только изменить порядок соборности атомов.
Джон Дальтон представил обществу понятие «атомный вес», а затем первым рассчитал атомные массы целого ряда элементов и разработал первую таблицу их относительных координат, заложив своими работами хорошую основу атомной теории строения элементов.
Физик по праву считается одним из самых уважаемых и знаменитых ученых своего времени, который приобрел невероятную популярность благодаря своим новаторским, уникальным работам в разных сферах знания.
Замечание 1
В 1794 году он смог провести многочисленные исследования и описать цветовую слепоту — дефект зрения, позже официально названный в его честь дальтонизмом.
Ученый также открыл закон парциальных явлений и систему равномерного расширения газов при определенной температуре нагревания, концепцию растворимости частиц в жидкости и установил закон кратных систематических отношений, обнаружив процесс полимеризации на примере бутилена и этилена.
В те времена вопрос о внутреннем строении атомом никогда не возникал, так как эти мельчайшие частицы считались неделимыми. В 1897 г. английский исследователь Дж. Томсон исследуя катодные световые лучи, определил, что атомы любого химического элемента содержат только отрицательно заряженные частицы, названные электронами. Огромной заслугой Томсона в области физики стало доказательство того, что все вещества, которые формируют катодные лучи, входят в состав атома и тождественны друг другу.
По утверждениям данного ученого, положительный заряд в атоме занимает практически весь объем этой частицы и распределен в полном объеме с постоянной плотностью, следовательно, в положительно заряженной атмосфере находится сразу несколько электронов, так что атом можно сравнить с кексом, в котором роль изюминок играют электроны.
Планетарная модель атома
Квантовая теория строения атомов имела огромное количество трактовок и методов использования. Электроны, которые входят в состав атомов, в результате критической массы не могут кардинально изменить общую траекторию $α$-частицы. Рассеяние или изменение направления движения элементов, может вызвать только положительно заряженная часть атома с тяжелой массой.
Вскоре стало понятно, что огромное количество $α$-частиц регулярно проходит через тонкий слой металла, однако при этом практически не испытывает отклонений в траектории движения. Такое небольшое количество частиц постепенно отклоняется на значительные углы, превышающие 30°. Эти соображения привели ученых к выводу, что атом практически пустой, и вся его положительная энергия сосредоточена в крайне малом объеме. Эту часть атома в науке называют атомным ядром.
Так появилась первая планетарная модель атома:
- в центре самого атома расположено положительно заряженное ядро, которое занимает ничтожно малую часть пространства внутри этого вещества;
- весь положительный заряд и практически вся масса атома сосредоточены и взаимосвязаны в его ядре;
- вокруг ядра постоянно вращаются электроны, количество которых равно положительному заряду ядра.
Однако на основе данной модели невозможно объяснить факт существования самого атома, его стабильность. Ведь хаотичное движение электронов по орбитам происходит с постоянным и немалым ускорением. Быстро движущийся элемент по законам электродинамики обязан терять энергию и постепенно приближаться к ядру.
Законы микромира и квантовых гипотез в начале 20 столетия еще не были представлены обществу и установлены наукой. Бор смог первым сформулировать их в виде трех известных постулатов, дополняющих атом Резерфорда. Его учение впоследствии привело к возникновению стройной концепции движения микрочастиц — квантовой механики.
61. Теория строения атома по Бору.
В 1913 г. великий датский физик Нильс Бор применил принцип квантования при решении вопроса о строении атома и характеристике атомных спектров, устранив тем самым противоречия, которые возникали при планетарной модели атома Э. Резерфорда. Модель атома, предложенная Резерфордом в 1911 г., напоминала солнечную систему: в центре находится атомное ядро, а вокруг него но своим орбитам движутся электроны. Ядро имеет положительный заряд, а электроны — отрицательный. Вместо сил тяготения, действующего в Солнечной системе, в атоме действуют электрические силы. Электрический заряд ядра атома, численно равный порядковому номеру в периодической системе Менделеева, уравновешивается суммой зарядов электронов — атом электрически нейтрален.
Неразрешимое противоречие этой модели заключалось в том, что электроны, чтобы не потерять устойчивость, должны двигаться вокруг ядра. В то же время они, согласно законам электродинамики, обязательно должны излучать электромагнитную энергию. Но в таком случае электроны очень быстро потеряли бы всю свою энергию и упали на ядро.
Следующее противоречие связано с тем, что спектр излучения электрона должен быть непрерывным, так как электрон, приближаясь к ядру, менял бы свою частоту. Опыт же показывает, что атомы излучают свет только определенных частот. Именно поэтому атомные спектры называют линейчатыми. Другими словами, планетарная модель атома Резерфорда оказалась несовместимой с электродинамикой Дж. К. Максвелла.
Модель атома Н. Бора, разрешавшая эти противоречия, базировалась на планетарной модели Э. Резерфорда и на разработанной им самим квантовой теории строения атома. Н. Бор выдвинул гипотезу строения атома, основанную на двух постулатах, совершенно несовместимых с классической физикой:
1) в каждом атоме существует несколько стационарных состояний (говоря языком планетарной модели, несколько стационарных орбит) электронов, двигаясь по которым электрон может существовать, не излучая;
2) при переходе электрона из одного стационарного состояния в другое атом излучает или поглощает порцию энергии.
Постулаты Бора объясняют устойчивость атомов: находящиеся в стационарных состояниях электроны без внешней на то причины не излучают электромагнитной энергии.
Теория атома Н. Бора позволяла дать точное описание атома водорода, состоящего из одного протона и одного электрона трудностями. Чем подробнее теоретики пытались описать движение электронов в атоме, определить их орбиты, тем большим было расхождение теоретических результатов с экспериментальными данными. Как стало ясно в ходе развития квантовой теории, эти расхождения главным образом были связаны с волновыми свойствами электрона. Т. е., следует учитывать, что электрон не точка и не твердый шарик, он обладает внутренней структурой, которая может изменяться в зависимости от его состояния. При этом детали внутренней структуры электрона неизвестны.
Следовательно, точно описать структуру атома на основании представления об орбитах точечных электронов принципиально невозможно, поскольку таких орбит в действительности не существует. Вследствие своей волновой природы электроны и их заряды как бы размазаны по атому, однако не равномерно, а таким образом, что в некоторых точках усредненная по времени электронная плотность заряда больше, а в других — меньше.
Теория Н. Бора представляет собой как бы пограничную полосу первого этапа развития современной физики. Это последнее усилие описать структуру атома на основе классической физики, дополняя ее лишь небольшим числом новых предположений. Введенные Бором постулаты ясно показали, что классическая физика не в состоянии объяснить даже самые простые опыты, связанные со структурой атома. Постулаты, чужеродные классической физике, нарушили ее цельность, но позволили объяснить лишь небольшой круг экспериментальных данных.
Со временем выяснилось, что атомную модель Н. Бора не следует понимать буквально, как это было вначале. Процессы в атоме, в принципе, нельзя наглядно представить в виде механических моделей по аналогии с событиями в макромире. Даже понятия пространства и времени в существующей в макромире форме оказались неподходящими для описания микрофизических явлений. Атом физиков-теоретиков все больше и больше становился абстрактно-ненаблюдаемой суммой уравнений.
1.2. Квантово — механическое объяснение строения атома
Физический смысл магнитного квантового числа заключается в том, что в спектрах атомов, помещенных во внешнее магнитное поле, обнаруживается дополнительное расщепление спектральных линий. Возникновение новых близлежащих линий свидетельствует о том, что в магнитном поле энергия электронов изменяется. Но это возможно только в случае различной взаимной ориентации электронных облаков. Это говорит о том, что s – электронное облако имеет шаровую симметрию (рис.2,а), р — подуровни расщепляются в магнитном поле на три различных типа ориентации р – облаков в пространстве (рис. 2,б).
Состояние электрона в атоме, которое характеризуется одинаковыми значениями квантовых чисел n, l и ml, т. е. определенными размером, формой и ориентацией в пространстве электронного облака, называется атомной электронной орбиталью (АО) или квантовой ячейкой (иногда их называют ячейки Гунда).
Схематически квантовые ячейки принято обозначатьв виде клеточки □.
Соответственно, s – подуровень состоит из одной АО □, p –
подуровень – из трех АО □□□, d – подуровень – из пяти АО
□□□□□, f – подуровень – из 7 АО □□□□□□□.
Каждый энергетический уровень включает n2 — орбиталей и на нем может располагаться 2n2 электронов. Максимальное число электронов на подуровне равно 2(2l+1) , табл. 1.
Для полной характеристики поведения электрона в атоме оказалось недостаточно трех рассмотренных выше квантовых чисел.
Изучение структуры спектральных линий показало, что два электрона, имеющие одни и те же значенияn, l и ml, т.е. одни и те же энергетические характеристики, ту же форму орбитали и одинаковую ориентацию, могут различаться некоторым особым магнитным свойством, которое обусловливает собственный магнитный момент электрона.
Спиновое квантовое число — спин (s или ms). Спин можно рассматривать как результат вращения электрона вокруг собственнойоси, которое возможно в двух взаимно противоположных направлениях.