Теории строение атома
С давних времен человека занимал вопрос: из чего состоят все тела? Есть ли что-то общее в строении воздуха и камня, воды и огня?
Еще древнегреческий философ Демокрит высказывал мысль о том, что должна существовать мельчайшая неделимая частичка вещества, которую он называл атомом. Атомы, по его мнению, были кирпичиками мироздания. И до начала ХIХ века больше об атоме ничего не было известно.
Первым попытался построить научную теорию атома английский химик Джон Дальтон. Он обнаружил, что все газы, так же, как твердые вещества и жидкости, состоят из невероятно крохотных частичек — атомов. Дальтон определил относительные атомные массы всех известных в то время химических элементов и обнаружил, что при любых химических реакциях атомы элементов не изменяются.
Основываясь на законах механики, физики разработали так называемую молекулярно-кинетическую теорию, с помощью которой им удалось описать строение твердых, жидких и газообразных тел. На основании этой теории удалось объяснить такие понятия, как температура тела и давление газа. Появилась надежда на то, что эта теория объяснит, как из атомов образуются молекулы, и даже позволит описать любое природное явление с помощью законов механики.
Электроны внутри этого «теста» могли колебаться, благодаря чему, по мнению Томсона, в окружающем эфире возникали световые волны. Эта модель атома хоть как-то объясняла происхождение света, валентность химических элементов, а главное — не противоречила механике Ньютона.
В 1911 году Эрнест Резерфорд провел серию опытов, надеясь с помощью уточнить строение атома.
Суть его опытов заключалась в следующем. На пути узкого пучка альфа-частиц, испускаемых радиоактивным веществом, помещала очень тонкая металлическая фольга из золота. Прошедшие сквозь фольгу альфа-частицы регистрировались с помощью люминесцентного экрана, расположенного вокруг мишени.
Если бы атомы золота были сплошными шариками, как предлагал Томсон, то следовало ожидать, что альфа-частицы будут растаскивать атомы золота или отскакивать от них, разлетаясь в разные стороны. В любом случае альфа-частицы должны были рассеиваться, есть вылетать из золотой фольги в различных направлениях.
На деле все оказалось совсем не так. Большая часть альфа-части проходила сквозь металл, как будто на их пути ничего не было. было небольшое количество частиц, которые отклонялись на очень большие угль и даже отскакивали назад.
как движутся планеты вокруг Солнца. Причем ядро занимает ничтожно малую часть объема всего атома, примерно одну стотысячную его диаметра. Атом оказался пуст!
Но на этом история создания атома не закончилась, дело в том, что планетарная модель атома имела существенный изъян. Согласно законам классической физики, вращаясь вокруг ядра, электрон должен был излучать электромагнитные волны, теряя при этом часть своей энергии. В результате электрон должен был упасть на ядро, что означало почти мгновенную «смерть атома.
В действительности этого не происходит. Атом — очень устойчивая система.
Новую теорию атома создал Нильс Бор. Он предположил, что электроны могут двигаться только по определенным орбитам. В таком состоянии атом не излучает и не поглощает энергии. Когда электрон перемещается с одной орбиты на другую, расположенную ближе к ядру, атом излучает порцию энергии, названную квантом.
В 1922 году за работы по квантовой теории строения атома водорода и его излучения Бор получил Нобелевскую премию. Бору удалось объяснить не только спектр атома водорода. Он предугадал структуру заполнения электронных оболочек, что позволило глубже понять физическую природу периодичности химических свойств элементов, отраженную в таблице Менделеева.
Но, как известно, нет предела совершенству. И на смену теории Бора пришла современная квантовая теория атома, которая позволила объяснить строение не только атома водорода, но и атомов других химических элементов.
bookbug.ru
Атомная теория строения вещества • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Слово «атом» — греческого происхождения, и переводится оно «неделимый». Принято считать, что первым идею о том, что кажущаяся гладкой и непрерывной материя на самом деле состоит из великого множества мельчайших и потому невидимых частиц, выдвинул древнегреческий философ Демокрит (чей «расцвет», согласно восхитительному по образности выражению классиков, пришелся на V век до н. э.). О жизни Демокрита нам, однако, практически ничего неизвестно, и оригинальные труды этого мыслителя до наших дней не дошли. Поэтому об идеях Демокрита остается судить в основном по цитатам из его работ, которые мы находим у других авторов, прежде всего у Аристотеля.
Логика рассуждений Демокрита, если перевести ее на современный язык, была крайне проста. Представим, говорил он, что у нас есть самый острый в мире нож. Берем первый попавшийся под руку материальный объект и разрезаем его пополам, затем одну из получившихся половинок также разрезаем пополам, затем разрезаем пополам одну из получившихся четвертинок и так далее. Рано или поздно, утверждал он (основываясь, как и все древнегреческие мыслители, прежде всего на философских соображениях), мы получим частицу столь мелкую, что дальнейшему делению на две она не поддается. Это и будет неделимый атом материи.
По представлениям Демокрита атомы были вечными, неизменными и неделимыми. Изменения во Вселенной происходили исключительно из-за изменений в связях между атомами, но не в них самих. Тем самым он тонко обошел давнишний спор древнегреческих философов о том, подвержена ли переменам сама суть видимого мира или все перемены в нем носят чисто внешний характер.
От древнегреческих представлений об атоме на сегодняшний день сохранилось разве что само слово «атом». Теперь мы знаем, что атом состоит из более фундаментальных частиц (см. Элементарные частицы). Ясно, что между древнегреческой теорией и современными научными исследованиями мало общего: идеи Демокрита не основывались ни на каких наблюдениях или практических опытах. Демокрит, подобно всем натурфилософам античности, просто рассуждал и делал умозрительные заключения относительно природы мира.
Тем не менее труды Демокрита не остались без признания и в современном мире. На последней греческой монете достоинством 10 драхм (теперь она выведена из обращения и заменена евро) на лицевой стороне изображен портрет Демокрита, а на оборотной — схематическая модель атома. Я весьма признателен своему другу Гансу фон Байеру, обратившему мое внимание на то, что на монете изображен атом с тремя электронами — стало быть, это атом лития. Демокрита называли «смеющимся философом» (похоже, он обладал несвойственным другим античным философам чувством юмора). Не потому ли на монете, увековечивающей его память, изображен именно атом лития — химического элемента, который теперь широко используется для лечения депрессии?
Идея об атомном строении материи так и оставалась чисто философским умопостроением вплоть до начала XIX века, когда сформировались основы химии как науки. Химики первыми и обнаружили, что многие вещества в процессе реакций распадаются на более простые компоненты. Например, вода распадается на водород и кислород. Однако некоторые вещества — те же водород и кислород — разложению на составляющие при помощи химических реакций не поддаются. Такие вещества назвали химическими элементами. К началу XIX века было известно около 30 химических элементов (на момент написания этой статьи их открыто более 110, включая искусственно полученные в лабораторных условиях; см. Периодическая система). Кроме того, было установлено, что в процессе химических реакций количественное соотношение веществ, участвующих в данной реакции, не изменяется. Так, для получения воды неизменно берутся восемь массовых долей кислорода и одна доля водорода (см. Закон Авогадро).
Первым осмысленную интерпретацию этих фактов предложил Джон Дальтон, чьё имя увековечено в открытом им законе Дальтона. В своих химических опытах он исследовал поведение газов (см.
Для Дальтона, как и для Демокрита, атомы оставались неделимыми. В черновиках и книгах Дальтона мы находим рисунки, где атомы представлены в виде шариков. Однако основное положение его работы — что каждому химическому элементу соответствует особый тип атома — легло в основу всей современной химии. Этот факт остается непреложным и теперь, когда мы знаем, что каждый атом сам по себе является сложной структурой (см. Опыт Резерфорда) и состоит из тяжелого, положительно заряженного ядра и легких, отрицательно заряженных электронов, вращающихся по орбитам вокруг ядра. Достаточно обратиться к сложностям квантовой механики (см. также Атом Бора и Уравнение Шрёдингера), чтобы понять, что концепция атома не исчерпала себя и в XXI веке.
Неплохо, однако, для идеи, зародившейся в философских спорах 2500 лет назад!
См. также:
2. Современная теория строения атома. Периодический закон и система элементов д.И. Менделеева
2.1. Общие положения
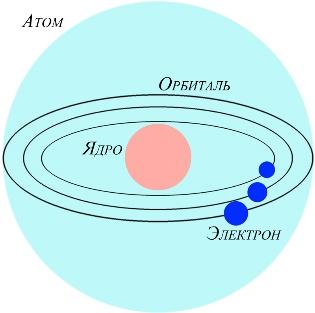
Согласно современным представлениям, атом – это наименьшая частица химического элемента, являющаяся носителем его химических свойств. Атом электрически нейтрален и состоит из положительно заряженного ядра и отрицательно заряженных электронов, которые движутся определённым образом вокруг ядра. Ядро атома, не изменяющееся в ходе химических реакций, составляет его фундаментальную основу и определяет индивидуальность элемента. Поэтому значение заряда ядра выбрали за основной признак, по которому атомы относят к разным видам – химическим элементам.
Ядра атомов включают два вида элементарных частиц: протоны и нейтроны.
Основные характеристики электрона, протона и нейтрона приведены в табл. 2.1.
Таблица 2.1
Сведения о некоторых элементарных частицах.
Частица | Символ | Масса | Заряд | |||
кг | а.е.м. | Кл. | Усл. | |||
протон | p | 1, 673 10-27 | 1, 007276 | 1, 602 10-19 | +1 | |
нейтрон | n | 1, 675 10-27 | 1, 008665 | 0 | 0 | |
электрон | e | 9, 109 10-31 | 0, 000547 | 1, 602 10-19 | -1 | |
Каждый протон несёт положительный заряд, численно равный заряду электрона. Нейтрон же не несёт никакого электрического заряда. Отсюда следует вывод: заряд ядра определяется числом протонов. Количество протонов в ядре атома совпадает с порядковым номером элемента (Z) в периодической системе элементов Д.И. Менделеева.
Как видно из данных табл. 2.1, масса электрона почти в 1840 раз меньше массы протона и нейтрона. В ядре сосредоточено 99,9% массы атома, поэтому масса атома практически равна массе ядра – сумме масс протонов и нейтронов.
Общее число протонов (Z) и нейтронов (N) в ядре называется массовым числом A:
A=Z+N.
Поскольку массы протона и нейтрона практически равны 1а.е.м., то масса атома в а.е.м., как и относительная атомная масса, численно совпадает со значением массового числа А.
Силы, удерживающие протоны и нейтроны в ядре, называют ядерными. Это чрезвычайно большие силы, действующие на очень коротких расстояниях (порядка 10-13 см) и превосходящие силы отталкивания. Природу этих сил изучает ядерная физика.
Исследования
показали, что в природе атомы одного и
того же элемента имеют различные атомные
массы. Так, атомы хлора имеют массу 35 и
37. Ядра этих атомов содержат одинаковое
число протонов, но разное число нейтронов. Атомы с
одинаковым числом протонов, но с различным
числом нейтронов называются изотопами. Для обозначения изотопов пользуются
обычными символами соответствующих
элементов, добавив к ним слева вверху
индекс, указывающий массовое число
изотопа, внизу – индекс, указывающий
количество протонов, равное порядковому
номеру (Z)
элемента (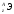 ).
Пример – изотопы водорода:
).
Пример – изотопы водорода:
 –протий
(1р, 0n)
–протий
(1р, 0n)
 –дейтерий
(1р, 1n)
–дейтерий
(1р, 1n)
–тритий (1р, 2n)
В периодической таблице элементов Д.И. Менделеева приводятся усреднённые значения относительных атомных масс с учётом распространённости различных изотопов в природе.
Атомы с различным числом протонов Z и нейтронов N, но с одинаковым числом нуклонов (Z+N) называются изобарами, а с одинаковым числом нейтронов (N) – изотонами.
Примеры изобаров и изотонов:
Изобары Изотоны
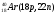

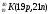
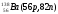
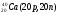


Поскольку атом в целом является электронейтральным, а заряд электрона численно равен заряду протона и противоположен ему по знаку, то общее число электронов в атоме равно числу протонов и, следовательно, равно порядковому номеру элемента в периодической системе элементов.
studfile.net
Модель Томсана, Теория Резерфорда, ядерная модель Резерфорда.
Модель Томсана
По теории Томсона, атом представлял собой шар, по всему объему которого «размазан» положительный заряд. А внутри, как плавающие элементы, находились электроны. В целом, по Томсону, атом был электронейтрален, т. е. заряд такого атома был равен 0. Отрицательные заряды электронов компенсировали положительный заряд самого атома. Размер атома составлял приблизительно 10-10м. Модель Томсона получила название «пудинг с изюмом»: сам «пудинг» – это положительно заряженное «тело» атома, а «изюм» – это электроны


Теория Резерфорда
Атом любого вещества состоит из положительно заряженного ядра, в котором сосредоточена почти вся масса, и вращающихся вокруг него по определенным орбитам отрицательно заряженных частиц — электронов. При этом положительный заряд ядра уравновешивается суммой отрицательных зарядов электронов, и в целом атом является электронейтральным. Заряд ядра каждого химического элемента, измеренный в элементарных единицах, равен атомному номеру вещества в таблице Менделеева и обусловливает его химические свойства.
Ядерная модель(планетарная модель Резерфорда)
В атоме есть массивный положительно заряженный объект и α-частица, сталкиваясь с этой частицей, может отразиться обратно. Пролетающие рядом частицы отклоняются на разные углы. Это явление называется рассеиванием α-частиц.
Положительно заряженный объект, находящийся внутри атома, Резерфорд назвал ядром и рассчитал его размеры – 10-14–10-15 Практически вся масса атома сосредоточена в ядре. Вокруг ядра вращаются электроны.
21. Правила заполнения электрических уровней: правило Хунда, Клечковского, принцип Паули.
Согласно правилу Хунда, устойчивому состоянию электронов в атоме соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина электронов максимально.
Правило Хунда (Гунда): заполнение орбиталей данного подуровня осуществляется так, чтобы суммарный спин был максимален. Орбитали данного подуровня заполняются сначала по одному электрону.
Электронные конфигурации атомов можно записать по уровням, подуровням, орбиталям. Например, электронная формула Р(15ē) может быть записана:
а) по уровням)2)8)5;
б) по подуровням 1s22s22p63s23p3;
в) по орбиталям
Примеры электронных формул некоторых атомов и ионов:
V(23ē) 1s22s22p63s23p63d34s2;
V3+(20ē) 1s22s22p63s23p63d24s0.
Для первого энергетического уровня n=1, l=0, следовательно, возможно существование только s-подуровня, на котором может разместиться не более 2 электронов, что отразим записью 1s2.
На втором энергетическом уровне может быть только два подуровня: s и p, на которых максимальное число электронов равно, соответственно, 2 и 6. Поэтому 8 электронов второго энергетического уровня распределены таким образом: 2s22p6.
Следующие 18 электронов находятся на третьем уровне, на котором должно быть уже три подуровня: s, p и d, на которых максимальное число электронов составляет 2, 6 и 10. Следовательно, электронную конфигурацию третьего 18-электронного уровня можно представить в виде: 3s23p63d10.
Для последнего 4-го уровня могут существовать 4 подуровня: s,p,d,f, на которых может находиться 2, 6, 10 и 14 электронов. Но в атоме цинка на 4 уровне находится всего 2 электрона. Эти два электрона займут самый низший подуровень 4s. Поэтому электронное строение 4 уровня можно записать в виде: 4s2.
Соединив все полученные фрагменты электронного строения по всем уровням, получаем детализированную картину распределения электронов в атоме цинка: 30Zn 1s22s22p63s23p63d104s2.
Таким образом, основные особенности заполнения электронных оболочек атомов в периодической системе следующие:
1. Начало периода совпадает с началом образования нового энергетического уровня электронного слоя.
Период представляет собой последовательный ряд элементов, атомы которых различаются числом электронов в наружных слоях. Каждый период завершается благородным газом. У благородных газов наружная оболочка состоит из 8 электронов, за исключение гелия, у которого на внешней оболочке только 2 электрона.
2. Элементы главных и побочных подгрупп отличаются порядком заполнения электронных оболочек.
У всех элементов главных подгрупп заполняются только внешние оболочки. При этом у элементов I и II групп заполняются s-оболочки, поэтому эти элементы называются s-элементами. А у элементов III-VII групп заполняются p-оболочки, поэтому эти элементы называются р-элементами.
У элементов первых подгрупп (за исключением Mn, Zn, Tc, Ag, Cd, Hg) заполняются внутренние d-оболочки. Такие элементы называются d-элементами.
Элементы, у которых заполняются внутренние f-оболочки, называются f-элементами (лантаноиды и актиноиды).
Правило Клечковского: заполнение электронных подуровней осуществляется в порядке возрастания суммы (n + l), а в случае одинаковой суммы (n + l) – в порядке возрастания числа n.
Согласно правилу Клечковского, заполнение подуровней осуществляется в следующем порядке: 1s, 2s, 2р, 3s, Зр, 4s, 3d, 4р, 5s, 4d, 5р, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s,…
Хотя заполнение подуровней происходит по правилу Клечковского, в электронной формуле подуровни записываются последовательно по уровням: 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4р, 4d, 4f и т. д. Таким образом, электронная формула атома брома записывается следующим образом: Br(35ē) 1s22s22p63s23p63d104s24p5.
Электронные конфигурации ряда атомов отличаются от предсказанных по правилу Клечковского. Так, для Сr и Cu:
Сr(24ē) 1s22s22p63s23p63d54s1 и Cu(29ē) 1s22s22p63s23p63d104s1.
Принцип Паули — В атоме не может быть двух электронов, обладающих одинаковыми свойствами.
Следовательно, максимальное число электронов с одинаковым квантовым числом n выражается суммой

Из правила Паули следует, что на орбитали могут располагаться не более двух электронов, на подуровне может содержаться не более 2(2l + 1) электронов, на уровне содержится не более 2n2 электронов.
studfile.net
Теории строение атома
С давних времен человека занимал вопрос: из чего состоят все тела? Есть ли что-то общее в строении воздуха и камня, воды и огня?
Еще древнегреческий философ Демокрит высказывал мысль о том, что должна существовать мельчайшая неделимая частичка вещества, которую он называл атомом. Атомы, по его мнению, были кирпичиками мироздания. И до начала ХIХ века больше об атоме ничего не было известно.
Первым попытался построить научную теорию атома английский химик Джон Дальтон. Он обнаружил, что все газы, так же, как твердые вещества и жидкости, состоят из невероятно крохотных частичек — атомов. Дальтон определил относительные атомные массы всех известных в то время химических элементов и обнаружил, что при любых химических реакциях атомы элементов не изменяются.
Основываясь на законах механики, физики разработали так называемую молекулярно-кинетическую теорию, с помощью которой им удалось описать строение твердых, жидких и газообразных тел. На основании этой теории удалось объяснить такие понятия, как температура тела и давление газа. Появилась надежда на то, что эта теория объяснит, как из атомов образуются молекулы, и даже позволит описать любое природное явление с помощью законов механики.
И вдруг выяснилось, что атом вовсе не мельчайшая частичка вещества, он имеет достаточно сложную структуру. Этот переворот в науке совершил Джон Томсон. В 1897 году он исследовал катодные лучи и установил, что они представляют собой поток частиц, масса которых во много раз меньше массы атома. На основании своих опытов Томсон создал первую в мире модель атома. Он представилатом в виде сплошного шарик с равномерно распределённым по всему объему положительным зарядом. Внутри атома, по мнению ученого, как изюм в пудинг должны были находиться электроны. Такая модель атома была названа «пудинговой».
Электроны внутри этого «теста» могли колебаться, благодаря чему, по мнению Томсона, в окружающем эфире возникали световые волны. Эта модель атома хоть как-то объясняла происхождение света, валентность химических элементов, а главное — не противоречила механике Ньютона.
В 1911 году Эрнест Резерфорд провел серию опытов, надеясь с помощью уточнить строение атома.
Суть его опытов заключалась в следующем. На пути узкого пучка альфа-частиц, испускаемых радиоактивным веществом, помещала очень тонкая металлическая фольга из золота. Прошедшие сквозь фольгу альфа-частицы регистрировались с помощью люминесцентного экрана, расположенного вокруг мишени.
Если бы атомы золота были сплошными шариками, как предлагал Томсон, то следовало ожидать, что альфа-частицы будут растаскивать атомы золота или отскакивать от них, разлетаясь в разные стороны. В любом случае альфа-частицы должны были рассеиваться, есть вылетать из золотой фольги в различных направлениях.
На деле все оказалось совсем не так. Большая часть альфа-части проходила сквозь металл, как будто на их пути ничего не было. было небольшое количество частиц, которые отклонялись на очень большие угль и даже отскакивали назад.
Эти наблюдения и расчеты привели Резерфорда к идее о планетарной модели атома. Согласно этой модели, атом по структуре аналогичен Солнечной системе. В его центре находится очень тяжелое положительно заряженное ядро, а вокруг него вращаются электроны, подобно тому,
как движутся планеты вокруг Солнца. Причем ядро занимает ничтожно малую часть объема всего атома, примерно одну стотысячную его диаметра. Атом оказался пуст!
Но на этом история создания атома не закончилась, дело в том, что планетарная модель атома имела существенный изъян. Согласно законам классической физики, вращаясь вокруг ядра, электрон должен был излучать электромагнитные волны, теряя при этом часть своей энергии. В результате электрон должен был упасть на ядро, что означало почти мгновенную «смерть атома.
В действительности этого не происходит. Атом — очень устойчивая система.
Новую теорию атома создал Нильс Бор. Он предположил, что электроны могут двигаться только по определенным орбитам. В таком состоянии атом не излучает и не поглощает энергии. Когда электрон перемещается с одной орбиты на другую, расположенную ближе к ядру, атом излучает порцию энергии, названную квантом.
В 1922 году за работы по квантовой теории строения атома водорода и его излучения Бор получил Нобелевскую премию. Бору удалось объяснить не только спектр атома водорода. Он предугадал структуру заполнения электронных оболочек, что позволило глубже понять физическую природу периодичности химических свойств элементов, отраженную в таблице Менделеева.
Но, как известно, нет предела совершенству. И на смену теории Бора пришла современная квантовая теория атома, которая позволила объяснить строение не только атома водорода, но и атомов других химических элементов.
bookbug.ru
I. Строение атома
Тема лекций №№ 13,14: Строение вещества.
I. Строение атома.
Вопросы:
1. Доквантовые модели атома (Томсона, Резерфорда, Бора).
2. Современные теории строения атома:
— протонно-нейтронная,
— квантово-механическая.
3. Радиоактивность: понятие, виды, характеристики.
4. Закономерности заполнения электронных орбиталей атомов.
Электронные схема, формулы.
Самостятельная работа:
1. Первые (до Томсона) модели атома.
2. Спектры испусканния электронов в полупроводниках, светодиоды.
3. Радиоактивность: понятие, виды, характеристики.
1. Доквантовые модели атома (Томсона, Резерфорда, Бора).
2. Протонно-нейтронная теория строения атома.
N(+11p) = Nпорядковый(хим. элемента)
m(+11p) + m(01n) = m (атома), N(+11p) + N(01n) = Ar(атома)
Таблица 1. Характеристики основных элементарных частиц атома
Элементарная ч-ца Абс.масса, кг Отн. масса, а.е.м. Электр.заряд, Кл Отн.заряд
Протон (+11Р) 1,673. 10-27 1,0073 + 1,602.10-19 +1
Нейтрон ( 01n) 1,675.10-27 1,0087 0 0
Электрон (е—) 9,109.10-31 0,00055 — 1,602.10-19 -1
2. Квантово-механическая теория строения атома.
2.1. Три основополагающие идеи (положения) квантовой механики:
1. Квантование энергии электронов в атоме – принцип дискретности физических величин в микромире (микроявлений и микрообъектов), т.е. физические величины могут изменяться не непрерывно, а скачкообразно, принимая только определенные – дискретные значения.
О таких величинах говорят, что они квантуются.
Макс Планк (нем. физик,1900 г.):
тепловое излучение (абсолютно черного тела) состоит из дискретных порций – квантов энергии.
Значение одного кванта энергии ∆E = hν = Eион + Eкин = Eион + mv2/ 2.
h (постоянная Планка) – мера дискретности, которая как бы определяет границу между микро- и макромирами. Это одна из фундаментальнейших постоянных природы. Она входит во все квантово-механические соотношения (h = 6,626 .10 -34 Дж .с); ν = с/λ .
2. Двойственная природа (корпускулярно–волновой дуализм) электрона.
Луи де Бройль, фр. физик – квантовый механик, 1924 г.:
при своем движении электрон (е—), как и др. частицы микромира (микрочастицы), обладает корпускулярно–волновой двойственностью, т.е.
одновременно является и дискретной (отдельной) материальной частицей с массой покоя (m), зарядом (z), размерами, и волной, имея все ее свойства (дифракция, интерференция и др.).
Этот постулат выражается уравнением волны де Бройля: λ = h/ mv,
т.е.: частице, имеющей массу m и движущейся со скоростью v, соответствует волна длиной λ.
Постоянная Планка h связывает воедино корпускулярный и волновой характер движения материи.
В одних условиях на первый план выступают волновые свойства объектов, в других – корпускулярные, в третьих – те и другие одновременно. Свободный или связанный электрон нельзя назвать строго ни волной ни частицей. Электрон – это частица, если речь идет о дискретности, но это и волна, если обсуждается характер его движения.
Из уравнения де Бройля следует: чем меньше масса материальной частицы и больше ее скорость, тем характернее для нее волновые свойства.
Создать наглядную модель микрообъекта принципиально невозможно!
3. Принцип неопределенности Гейзенберга
(1927 г.):
(Вернер Гейзенберг, нем. физик — квантовый механик):
Для электрона, как для любой микрочастицы-волны, в принципе невозможно одновременно с одинаковой точностью измерить координату (местонахождение) и скорость движения (или импульс) — в любой момент времени.
Математическим выражением этого принципа является соотношение:
∆x = m .∆v > h / 2π,
где ∆x – неопределенность (погрешность измере-ния) положения электрона (любой микрочасти-цы) по оси ОХ,
∆v – неопределенность в измерении его скорос-ти (или импульса ∆р = m .∆v).
Чем меньше значение ∆x, т.е. чем точнее определяем положение микрообъекта (в частности, электрона), тем больше неопределенность (ошибка) в определении значения его скорости или импульса, и наоборот.
studfile.net
Теория строения атома — Периодический закон и теория строения атома — Общая химия — Химия
Теория строения атома
Атом — это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.Строение атомных ядер
Ядра атомов состоят из элементарных частиц двух видов: протонов (p) и нейтронов (n). Сумма протонов и нейтронов в ядре одного атома называется нуклонним числом:,
где А — нуклонне число, N — число нейтронов, Z — число протонов.
Протоны имеют положительный заряд (+1), нейтроны заряда не имеют (0), электроны имеют отрицательный заряд (-1). Массы протона и нейтрона примерно одинаковы, их принимают равными 1. Масса электрона намного меньше чем масса протона, поэтому в химии ею пренебрегают, считая, что вся масса атома сосредоточена в его ядре.
Число положительно заряженных протонов в ядре равно числу отрицательно заряженных электронов, то атом в целом електронейтральний.
Атомы с одинаковым зарядом ядра составляют химический элемент.
Атомы различных элементов называются нуклидами.
Изотопы — атомы одного и того же элемента, имеющие разное нуклонне число вследствие разного количества нейтронов в ядре.
Изотопы Водорода
| Название | A | Z | N |
| Протий Н | 1 | 1 | 0 |
| Дейтерий D | 2 | 1 | 1 |
| Тритий T | 3 | 1 | 2 |
Радиоактивный распад
Ядра нуклидов могут распадаться с образованием ядер других элементов, а также , или других частиц.Спонтанный распад атомов некоторых элементов называется радіоактивністю, а такие вещества — радиоактивными. Радиоактивность сопровождается испусканием элементарных частиц и электромагнитных волн — излучениег.
Уравнение ядерного распада— ядерные реакции — записываются следующим образом:
Время, за которое распаду подвергается половина атомов данного нуклида, называется периодом полураспада .
Элементы, состоящие только из радиоактивных изотопов, называются радиоактивнымы. Это элементы 61 и 84-107.
Виды радиоактивного распада
1) -розпад. Излучаются -частицы, т.е. ядра атома Гелия . При этом нуклонне число изотопа уменьшается на 4, а заряд ядра-на 2 единицы, например:2) -розпад.В неустойчивом ядре нейтрон превращается в протон, при этом ядро испускает электроны и антинейтрино. Во время -распада нуклонне число не изменяется, а заряд ядра увеличивается на 1, например:
3) -розпад. Возбужденное ядро испускает лучи с очень малой длиной волны, при этом энергия ядра уменьшается, нуклонне число и заряд ядра не изменяются, например:
Строение электронных оболочек атомов элементов первых трех периодов
Электрон имеет двойственную природу: он может вести себя и как частица, и как волна. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части вокруг ядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятно нахождение электрона, называется орбіталлю.Каждый электрон в атоме находится на определенном расстоянии от ядра согласно запаса его энергии. Электроны с более-менее одинаковой энергией формируют энергетические рівни, или электронные слойи.
Число заполненных электронами энергетических уровней в атоме данного элемента равно номеру периода, в котором он расположен.
Число электронов на внешнем энергетическом уровне равно номеру группы, вкоторой расположен данный элемент.
В пределах одного энергетического уровня электроны могут отличаться формой электронной облакови, или орбитали. Существуют такие формы орбиталей:
s-форма:
p-форма:
Существуют также d-, f-орбитали и другие, с более сложной формой.
Электроны с одинаковой формой электронного облака образуют одноименные энергетические підрівни:s-, p-, d-, f-подуровни.
Количество подуровней на каждом энергетическом уровне равно номеру этого уровня.
В пределах одного энергетического подуровня возможен различный распределение орбиталей в пространстве. Так, в трехмерной системе координат для s-орбитали возможно только одно положение:
для р-орбитали — три:
для d-орбитали — пять, для f-орбитали — семь.
Орбитали изображают:
s-подуровень —
p-подуровень —
d-подуровень —
Электрон на схемах обозначается стрелкой, которая указывает его спин. Под спином понимают вращения электрона вокруг своей оси. Он обозначается стрелкой: или . Два электрона на одной орбитали записываются , но не .
Более двух электронов на одной орбитали находиться не может (принцип Паули).
Принцип наименьшего энергий: в атоме каждый электрон располагается так, чтобы его энергия была минимальной (что соответствует его крупнейшем связи с ядром).
Например, распределение электронов в атоме Хлорав:
Один неспаренный электрон определяет валентность Хлора в таком состоянии — I.
Во время получения дополнительной энергии (облучение, нагревание) возможно розпарування электронов (промотирования). Такое состояние атома называется збудженим. При этом количество неспаренных электронов увеличивается и, соответственно, меняется валентность атома.
Возбужденное состояние атома Хлорв:
Соответственно к числу неспаренных электронов Хлор может иметь валентность III, V и VII.
na-uroke.in.ua