Теория строения органических соединений.10 класс
Урок 2. Теория строения органических соединений
А. М. Бутлерова
Цели урока: Познакомить ребят с основными предпосылкам] создания теории строения органических соединений А. М. Бутле рова. Подробно рассмотреть её основные положения. Привести совре менную формулировку основного положения теории строения. Рас крыть значение теории А. М. Бутлерова для органической химии
Оборудование и реактивы: модели молекул органических соеди нений.
Ход урока
I. Организационный момент. Проверка домашнего задания
Контрольные вопросы для экспресс-опроса класса:
Сформулируйте определение ОХ по Берцелиусу, Шорлеммеру и Кекуле.
Какие открытия способствовали краху учения о витализме?
Перечислите основные особенности органических соединений.
Какие вещества называются гомологами? Сформулируйте определение гомологического ряда.
Какие вещества называются изомерами?
II. Теория строения органических соединений А. М. Бутлерова
Учитель начинает объяснение нового материала с краткого исторического рассказа о ситуации в органической химии, сложившейся к середине 19 века. Перечислите основные научные достижения той поры, послужившие предпосылками для создания теории химического строения органических соединений
Введение в 1853 г. английским химиком К. Э. Франкландом понятия “валентность”.
Накопление к середине 19 века значительного экспериментального материала о соединениях углерода. Поражение учения о “витализме”.
Установление валентности углерода равной четырем.
Установление способности атомов углерода соединяться друг с другом в различные цепи.
Учитель формулирует основные положения теории строения Л.М. Бутлерова так, как это изложено в учебнике. Учащиеся записывают
эти положения в тетради. Далее каждое положение и следствие подробно разбираются на конкретных примерах:
I. Составьте полные структурные формулы нескольких органических соединений,в которых С образует простые и кратные связи. При подсчете химических связей элементов, учащиеся убедятся в четырехвалентности углерода, а также в том, что различные элементы соединяются друг с другом в соответствии с их значениями валентности, т.е. атом Н всегда образует 1 химическую связь, атом О — 2 связи и т.д.:
Полные структурные формулы Сокращенные структурные формулы
н н н н СН3 -СН2-СН2-СН3
Н – С – С – С – С – Н
или
Н Н Н Н н – бутан С
н н н н
I I I I
Н- С= С-С-С-Н или СН2=СН-СН2-СН3
│ │ │
Н н н С4Н8 — бутен-1
Н Н
│ │
С ≡ С – С – С — Н или СН ≡ С — СН2-СН3 С4Н6 — бутин-1
│ │
Н Н
Возможен вариант объяснения, когда учитель представит неверные записи на доске, и предложит учащимся определить, являются ли данные формулы правильными или соответствуют ли они теории строения. Так приведенные ниже формулы неверны, т.к. водород в них двухвалентен, кислород и углерод — трехвалентны, что противоречит теории строения (атомы элементов соединенные не в соответствии со значениями их валентности, выделены курсивом).
Н Н Н Н Н H
│ │ │ │ │ │
Н – С – С – С – С Н — С – С – Н
│ │ │ │ │ │ Н Н Н Н — Н Н – О О – Н
│
Н
Далее учитель сообщает, что структурные формулы показывают порядок соединения атомов в молекуле, но не расположение их в пространстве, поэтому одна и та же формула может быть изображена по-разному на плоскости, например молекулу этиленгликоля можно представить 2 способами:
Н Н Н – О О – Н
│ │ │ │
Н – С – С – Н Н – С – С – Н
│ │ │ │
Н — О О — Н Н Н
Порядок соединения атомов в данных молекулах не меняется, поэтому эти формулы изображают одно и тоже вещество — этиленгликоль.
2. Для разъяснения влияние качественного состава вещества на. его свойства рассматриваете пример из учебника: молекулы метана и метилового спирта (при желании добавьте твердое вещество — аминоуксусную кислоту). Запись на доске (в скобках приведен качественный состав соединений):
СН4 (С, Н) СН3ОН (С, Н, О) H2N-CH2-COOH (С, Н, О, N)
Газ жидкость твердое вещество
Вывод: Различные свойства соединений вызваны их различным качественным составом.
Для разъяснения влияния количественного состава вещества на его свойства приводите примеры из учебника. Запись на доске:
Условия взаимодействия УВ с галогенами (С12, Вг2):
СН4 С2Н4, С2Н2 С6Н6
УФ-свет, t обычные условия катализатор
Вывод: Различие в количественном составе веществ обуславливает их различные химические свойства.
Учитель напоминает, что вещества, имеющие одинаковый каче-ственный и количественный состав и одинаковую молекулярную массу, могут отличаться свойствами, в случае если они имеют различное химическое строение, т.е. порядок соединения атомов в молекуле._
— Как называются такие соединения? {Изомерами.)
Учитель четко формулирует основную причину изомерии — различное химическое строение, т.е. порядок соединения атомов и молекуле. Отметьте, что Бутлеров, изучая химическое строение молекул УВ, пришел к выводу о возможности различного соединения атомов углерода в молекулярные цепи, начиная с бутил. Предложите ребятам самим в этом убедиться. Пока знания по органической химии слабы и навыки составления структурных формул ещё не развиты достаточно хорошо, полезно на простыx примерах поупражняться в составлении структурных формул Составляя их, ученики убедятся, что для первых трех членов ряда метана явление изомерии невозможно. Например, различные варианты изображения на плоскости структурных формул пропана обозначают одно и тоже вещество, поскольку порядок соединения атомов С в цепи одинаков. Во всех трех формулах имеются 2 первичных атома С и 1 вторичный атом С: два атома С соединены с 3 атомами Н и 1 атомом С (концевые атомы С), один атом С соединен с 2 атомами С (в середине цепи) и 2 атомами Н.
н н н н н н сн3
I │ I I I I I
н-с-с-с-н н-с-с-н н-с-с-н
I I I I I I I
н н н н сн3 н н
Дополните объяснение материала работой с моделями органических соединений. Учитель собирает модели молекул УВ из пластилина или представляет их шаростержневые варианты.
Далее рассматриваете по учебнику явление изомерии на примере бутана и изобутана. Акцентируйте внимание учащихся на историческом факте: Бутлеров вначале предсказал существование двух изомеров бутана, а впоследствии и синтезировал изобутан. Сообщите классу физические константы изомеров бутана, с тем, чтобы подтвердить, что они являются разными веществами:
Бутан
Изобутан
20
Относительная плотность, d 4 (под давлением)
0,579
0,557
Т кипения, °С
-0,5
-11,7
Предложите учащимся вспомнить:
— Какой ещё великий русский ученый использовал созданный им закон для предсказания новых фактов, которые затем блестяще подтвердились?
(Д. И. Менделеев на основании открытого им Периодического закона и созданной Таблицы химических элементов предсказал существование трех элементов и описал их свойства, которые впоследствии были открыты другими учеными (Ga, Sc, Ge).)
3. Взаимное влияние атомов в молекулах органических соедине-ний рассмотрите кратко на простейшем примере хлорметана СН3С1. Объясните ребятам, что подробное разъяснение этого пункта будет происходить по мере изучения материала в течение всего учебного года.
Объясняете разницу в химических свойствах метана и хлорме-тана.
а) Влияние атома хлора на радикал метил:
Реакции замещения атомов водорода атомами галогена идут легче в случае молекул СН3С1, чем СН4.
б) Влияние радикала метила на атом хлора:
Атом хлора не способен к диссоциации в виде иона С1— , как, например, в молекуле НС1, поэтому не образуется осадок AgCl при действии на СН3С1 раствора нитрата серебра:
НС1 + AgN03 = AgCl↓+ HN03
СН3С1 + AgN03 — реакция не идет.
В завершении темы расскажите о значении теории строения Бутлерова для развития органической и общей химии. Рассмотрите современную формулировку основного положения теории строения соединений (учебник).
В завершение урока, даете задание: составить структурные формулы изомеров некоторых УВ (пентана, гексана).
Домашнее задание:
§2, упр. 1-3,7.
Урок химии в 10 классе на тему «Формирование органической химии как науки. Теория строения органических соединений А. М. Бутлерова»
Урок химии в 10 классе на тему «Формирование органической химии как науки. Теория строения органических соединений А. М. Бутлерова»
Цель урока: Изучение этапов формирования органической химии как науки, теории строения органических соединений А. М. Бутлерова
Задачи:
Образовательные: Познакомить с основными историческими фактами в развитии органической химии; дать первоначальное понятие об органической химии и органических веществах; определить особенности строения и свойства органических веществ в сравнении с неорганическими; познакомить с основными положениями теории строения органических соединений А. М. Бутлерова и ее значения для науки.
Развивающие: Развивать умения учащихся сравнивать, обобщать, проводить аналогию между неорганическими и органическими веществами.
Воспитательные: Формировать чувство патриотизма, благодаря изучению вклада российских ученых в развитии органической химии.
Используемые технологии обучения, приемы, методы обучения: Технология развития критического мышления через чтение и письмо, приемы («верные и неверные утверждения», «ИНСЕРТ», «синквейн»).
Оборудование и основные источники информации:
Литература:— Фельдман Ф.Г., Рудзитис Г.Е. Учебник «Химия 10» — М.: Просвещение 2012
— Кузнецова Н.Е., Титова И.М., Гара Н.Н. Учебник «Химия 10»–М.: Вентана-Граф, 2013
Формируемые результаты:
Личностные УУД: формирование ответственного отношения к учению, готовности и способности обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию ,личностное, профессиональное самоопределение, смыслообразование
Регулятивные УУД: целеполагание, саморегуляция
Коммуникативные УУД: планирование учебного сотрудничества с учителем и сверстниками — определение цели, функций участников, способов взаимодействия
Познавательные УУД: анализ объектов с целью выделения признаков, структурирование знаний; осознанное и произвольное построение речевого высказывания в устной и письменной форме; выбор наиболее эффективных способов решения задач в зависимости от конкретных условий; подведение под понятие, выведение следствий
Предметные:
Знать: основные положения теории строения органических веществ и ее значение для науки; отличия органических веществ от неорганических, этапы формирования науки органической химии.
Технологическая карта урока
п.п.
Этапы технологии
Цели этапов и учебных заданий
Деятельность учителя
Деятельность ученика
Формируемые компетенции
1.
Организационный момент
4 мин
Включение учащихся в учебную деятельность. Создание благоприятного психологическогоклимата.
Улыбнись! Даже если на сердце темно
И мешают в дороге ошибки,
Посмотри, заглянул теплый день к нам в окно,
Разве это не стоит улыбки?
Давайте улыбнёмся началу нового дня и друг другу. А теперь присаживайтесь на свои места. Я надеюсь на вашу активную работу на уроке.
Приветствуют учителя, проверяют готовность рабочего места и наличие материалов, необходимых к уроку.
Личностные: Самоопределение к деятельности (положительное или отрицательное), формирует волевую сферу. Осуществляет выбор, будет ли учиться (будет активен или пассивен)
2.
Вызов
7 мин
Мотивация учащихся к работе на уроке.
Актуализация ранее полученных знаний об органических веществах.
Выход на тему урока.
Посмотрите на стол, здесь предложены вещества: уксусная кислота, этиловый спирт, глицерин и др. Что объединяет эти вещества?
А теперь, ребята, обратите внимание у вас на столах лежат карточки с утверждениями, прочитайте эти утверждения. Какие утверждения верны, по вашему мнению, какие нет? И попробуйте разделить их на две группы. Даю время на работу с утверждениями.
Слушаю их ответ.
О чём нам говорят утверждения первой и второй группы?
А теперь вы можете сформулировать тему сегодняшнего урока?
Предполагаемый ответ: это органические вещества, органическая химия изучает эти вещества.
Знакомятся с утверждениями. Отмечают, что затрудняются оценить их верность. Разделяют их на две группы. К первой группе относят утверждения -1, 3,5 , ко второй — 2,4,6.
Предполагаемый ответ: Первая группа утверждений об этапах формирования органической химии как науки, вторая группа о теории строения органических соединений.
Предполагаемый ответ: Формирование органической химии как науки. Теория строения органических соединений А. М. Бутлерова
Коммуникативные компетенции: излагать свои мысли связно, логично, используя научный язык
Организация учащихся на постановку цели и задач.
А какая цель будет сегодня на уроке?
Какие задачи будут на сегодняшнем уроке?
Предполагаемый ответ:
Изучить этапы формирования органической химии как науки и теорию строения органических соединений А. М. Бутлерова
Предполагаемый ответ: узнать, когда орг. химия сформировалась как наука, выяснить какие ученые этим занимались, были ли среди них русские, о чем говорит теория строения органических соединений и т.д.
Учебно-познавательные компетенции: владение механизмами целеполагания, планирования
Коммуникативные компетенции: излагать свои мысли связно, логично, используя научный язык
3.
Осмысление
24 мин
Организация учащихся на самостоятельную учебно-познавательную деятельность
Работать с новым материалом вы будете в группах. Развернитесь и сядьте так, чтобы получилось четыре группы. Сначала поработайте с текстом индивидуально, затем обсудите результаты свой работы в группе. Напоминаю правила работы с инсертом. Читаете текст, маркируя его специальными значками:
V — я это знаю;
+ — это новая информация для меня;
— — я думал по-другому, это противоречит тому, что я знал;
? — это мне непонятно, нужны объяснения, уточнения.
Маркировки в тексте удобнее делать на полях карандашом. Затем заполняете таблицу в тетради.
Самостоятельная работа
Прием: «ИНСЕРТ». Учащиеся читают текст, маркируя его специальными значками
Читают текст, делают маркировки на полях, или ведут краткие записи в тетради в виде таблицы.
V+
—
?
Информационные — самостоятельно работать с информацией различных источников, искать, анализировать и отбирать необходимую информацию, организовывать, преобразовывать, сохранять и передавать ее.
Коммуникативные компетенции: письменное формулирование выводов, тезисов
Организация этапа систематизации полученных знаний
Напоминаю, что надо соблюдать правила работы в группе, которые записаны на листочках у каждой группы.
1. Выберите лидера группы.
2. Обсудите пути достижения целей, распределите задания для каждого из членов группы.
3. Слушайте каждого члена группы внимательно, не перебивая.
4. Говорите вежливо, коротко, ясно, чтобы все могли высказаться.
5. Учитесь находить контакты в группе.
6. Стремитесь достигнуть компромисса при принятии решений.
6. В группе согласуется общее решение.
7. Представитель группы защищает согласованное решение перед классом.
8. Лидер группы следит за временем.
Каждая группа должна ознакомить участников других групп с новой информацией своей темы.
Групповая работа
Обсуждают полученную информацию, составляют мини выступления по новой информации.
Коммуникативные: навыки работы в группе, владение различными специальными ролями в коллективе.
Информационные компетенции: составлять конспект текста
Организация представления и обсуждения полученной информации
Выслушиваю
ответы учеников. Обсуждаем содержание других столбиков таблицы.
Представляют полученную информацию с опорой на записи в тетради
Коммуникативные компетенции: презентовать выполненную работу, излагать свои мысли связно, логично, используя научный язык .
4.
Рефлексия
8 мин
Возвращение к утверждениям
А теперь давайте вернемся к утверждениям, с которыми работали в начале урока. Снова прочитайте эти утверждения и скажите, какие из них верны, а какие нет.
Предполагаемый ответ:
1+, 2-,3+, 4+,5-,6+
Обобщение полученной информации на стадии осмысления
Закончите предложенные на доске высказывания.
Обмен мнениями о полученной новой информации оформление выводов «Я считаю…»
«Таким образом…»
«Исходя из этого…»
«Сегодня на уроке я узнал..»
«После сегодняшнего урока я задумался..»
Диагностика эмоционального состояния обучающихся
Поднимите руки те, кто сегодня хорошо поработал на уроке, при выполнении заданий не испытывал затруднения, мог бы поделиться с другими полученной информацией и мог бы поставить себе отметку «5»;
Поднимите руки те, кто сегодня хорошо поработал на уроке, при выполнении заданий испытывал затруднения и мог бы поставить себе отметку «4»;
Поднимите руки те, кто сегодня не очень хорошо поработал на уроке, при выполнении заданий возникали большие трудности, и мог бы поставить себе отметку «3».
Комментируют работу членов группы, высказывают мнения об уроке
Учебно-познавательные — самооценка учебно-познавательной деятельности.
5.
Домашнее задание
2 мин
Закрепление полученных знаний на учебном занятии
Домашнее задание сегодня будет такое: составить «синквейн» по теме «Органическая химия» или написать эссе по теме «Органические вещества в быту»
Записывают в тетрадь
Личностные (самосовершенствование) — интеллектуальное саморазвитие, эмоциональную саморегуляцию
Приложение 1.
Прочитайте предложенные утверждения, разделите их на две группы, проставьте знак «+» напротив утверждений, которые считаете верными и знак «-», неверными.
Приложение 2.
Текст 1. Этапы формирования органической химии как науки
Прочитать текст и на полях сделать маркировки:
“V” — известная информация; “-” противоречит моим представлениям;
“?” — непонятная информация; “+” – новая информация
«Стихийный этап развития органической химии»
Истоки уходят еще в Древний Рим и Египет, в которых очень способные жители научились добывать красящие вещества для окраски предметов и одежды из природного сырья — листьев и стеблей растений. Это были индиго, дающий насыщенный синий цвет, и ализорин, окрашивающий буквально все в сочные и привлекательные оттенки оранжевого и красного.
Научились получать уксус, изготавливать спиртные напитки из сахаро- и крахмалосодержащих веществ растительного происхождения. Известно, что очень распространенными продуктами в применении в этот исторический период были животные жиры, смолы и растительные масла, которые использовались врачевателями и поварами. А также в обиход плотно входили различные яды, как основное оружие внутриусобных отношений. Все эти вещества являются продуктами органической химии. Но, к сожалению, как такового понятия «химия» не существовало, и изучения конкретных веществ с целью выяснения свойств и состава не происходило. Поэтому данный период и называется стихийным. Все открытия носили случайный, нецеленаправленный характер бытового значения.
«XV — XVII века — начало развития или алхимия»
В XVI — XVII веках начали зарождаться непосредственные представления о химии как науке. Благодаря работам ученых того времени были получены некоторые органические вещества, изобретены простейшие устройства для перегонки и возгонки веществ, использовалась специальная химическая посуда для измельчения веществ, разделения продуктов природы на ингредиенты. Стремление получить необходимые лекарства привело к тому, что из растений выделялись эфирные масла и другие сырьевые компоненты. Так, Карлом Шееле были получены некоторые органические кислоты из растительного сырья: яблочная; лимонная; молочная; щавелевая. На исследование растений и выделение этих кислот ученому потребовалось 16 лет (с 1769 г. по 1785 г.). Это стало началом развития, были заложены основы органической химии, которая непосредственно как раздел химии была определена и названа позднее (начало XVIII века).
В этот же период средневековья Г. Ф. Руэль выделил кристаллы мочевой кислоты из мочевины. Другими химиками была получена янтарная кислота из янтаря, винная кислота. В обиход входит метод сухой перегонки растительного и животного сырья, благодаря которому получают уксусную кислоту, диэтиловый эфир, древесный спирт. Так было положено начало интенсивному развитию органической химической промышленности.
«Век XVIII — XIX — господство теории витализма»
Теорию витализма ввел в обиход и обозначил главной Йенс Якобс Берцелиус, который при этом сам же дал и определение органической химии (точный год неизвестен, либо 1807, либо 1808 г.). По положениям данной теории, органические вещества способны образовываться только в живых организмах, так как только в живых существах есть специальная «жизненная сила», позволяющая этим веществам вырабатываться. В то время как из неорганических веществ получить органические совершенно невозможно, так как они являются продуктами неживой природы, негорючими, без visvitalis. Этим же ученым была предложена первая классификация всех известных на тот момент соединений на неорганические (неживые) и органические (живые).
Судьбе было угодно распорядиться так, что именно ученик Йенса Берцелиуса Фридрих Велер способствовал началу краха теории своего учителя. Немецкий ученый работал над соединениями цианидов и в одном из проводимых опытов сумел получить кристаллы, похожие на мочевую кислоту, органическое вещество из неорганического без всякой visvitalis. Сколь бы ни был скептично настроен Берцелиус, он вынужден был признать этот неоспоримый факт. Так был нанесен первый удар по виталистическим взглядам.
«XIX — XX века — интенсивное развитие, научный этап»
В 1857 г. Фридрих Кекуле разрабатывает теорию валентности, открывает строение молекулы ароматического углеводорода бензола. В это же время А. М. Бутлеров формулирует положения теории строения соединений, в которых указывает на четырехвалентность углерода и на явление существования изомерии и изомеров. В. В. Марковников и А. М. Зайцев углубляются в изучение механизмов реакций в органике и формулируют ряд правил, которые эти механизмы объясняют и подтверждают. В 1873 — 1875 гг. И. Вислиценус, Вант-Гофф и Ле Бель изучают пространственное расположение атомов в молекулах, открывают существование стереоизомеров и становятся родоначальниками целой науки — стереохимии.
Конец XIX и XXI века — это времена глобальных открытий в фармацевтике, лакокрасочной промышленности, квантовой химии. Пластмассы, полимеры, волокна, лакокрасочная продукция, каучуки, резины, ПВХ-материалы, полипропилены и полиэтилены. Сотни ученых внесли свой многолетний кропотливый труд, чтобы сложилась общая история развития органической химии.
Текст 2. Органические и неорганические вещества
Общее количество неорганических веществ — 100 тыс. — заметно уступает числу органических — 18 млн, если следовать распространенным в современной химии классификациям. Принципиальных различий между органическими и неорганическими веществами нет. Органические и неорганические вещества отличаются лишь некоторыми особенностями.
Большинство неорганических веществ имеет немолекулярное строение, поэтому они обладают высокими температурами плавления и кипения. Неорганические вещества не содержат углерода. К неорганическим веществам относятся: металлы (Ca, K, Na и др.), неметаллы, благородные газы (He, Ne, Ar, Kr, Xe и др.), амфотерные простые вещеcтва (Fe, Al, Mn и др.), оксиды (различные соединения с кислородом), гидроксиды, соли и бинарные соединения.
К неорганическим веществам относится вода. Она является универсальным растворителем и имеет высокие теплоёмкость и теплопроводность. Вода – это источник кислорода и водорода; основная среда для протекания биохимических и химических реакций.
Органические вещества, как правило, молекулярного строения, имеют низкие температуры плавления, легко разлагаются при нагревании. В состав молекул всех органических веществ входит углерод (за исключением карбидов, карбонатов, оксидов углерода, углеродосодержащих газов и цианидов). Уникальное свойство углерода образовывать цепочки из атомов даёт возможность образовывать огромное количество уникальных соединений. Науке известно уже более 10 миллионов органических соединений.
Большинство основных классов органических веществ биологического происхождения. К ним относятся белки, углеводы, нуклеиновые кислоты, липиды. Эти соединения кроме углерода содержат водород, азот, кислород, серу и фосфор.
Текст 3. Теория строения органических соединений А. М. Бутлерова
В 1861 году Александр Михайлович Бутлеров сформулировал основные идеи теории:
1. Все атомы, образующие молекулы органических веществ, связаны в определенной последовательности согласно их валентностям.
В соответствии с этими представлениями валентность элементов условно изображают черточками, например, в метане CH4.
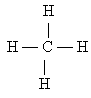
Такое схематичное изображение строения молекул называют формулами строения и структурными формулами. Основываясь на положениях о 4-х валентности углерода и способности его атомов образовывать цепи и циклы, структурные формулы органических веществ можно изобразить так:
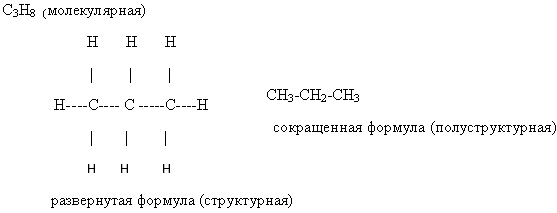
2. Свойства веществ зависят не только от качественного и количественного состава, но и от порядка соединения атомов в молекуле.
Изучая строение молекул углеводородов, А. М. Бутлеров пришел к выводу, что у этих веществ, начиная с бутана (С4Н10), возможен различный порядок соединения атомов при одном и том же составе молекул. Так, в бутане возможно двоякое расположение атомов углерода: в виде прямой (неразветвленной) и разветвленной цепи. Эти вещества имеют одинаковую молекулярную формулу, но разные структурные формулы и разные свойства (температуру кипения). Следовательно, это разные вещества. Такие вещества назвали изомерами.
А явление, при котором может существовать несколько веществ, имеющих один и тот же состав и одну и ту же молекулярную массу, но различающихся строением молекул и свойствами, называют явлением изомерии. Причем с увеличением числа атомов углерода в молекулах углеводородов увеличивается число изомеров. Например, существует 75 изомеров (различных веществ), отвечающих формуле С10Н22, и 1858 изомеров с формулой С14Н30.
Примеры изомеров пентана С5Н12.
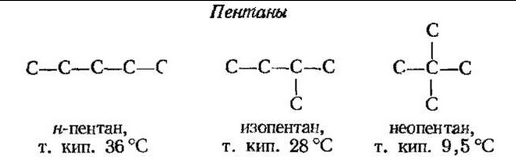
3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы предвидеть свойства.
Пример: Если данное вещество изменяет окраску фиолетового лакмуса на розовый цвет, взаимодействует с металлами, стоящими до водорода, с основными оксидами, основаниями, то мы можем предположить, что это вещество относится к классу кислот, т.е. в своем составе имеет атомы водорода и кислотный остаток. И, наоборот, если данное вещество относится к классу кислот, то проявляет вышеперечисленные свойства. Например: Н2SО4 — серная кислота
Если вещество является газом и обесцвечивает раствор перманганата калия, то мы можем предположить, что это алкен с небольшим числом атомов углерода.
4. Атомы и группы атомов в молекулах веществ взаимно влияют друг на друга.
Это положение можно доказать на примере неорганической химии. Для этого надо сравнить свойства водных растворов NН3, НС1, Н2О (действие индикатора). Во всех трех случаях в состав веществ входят атомы водорода, но они соединены с разными атомами, которые оказывают различное влияние на атомы водорода, поэтому свойства веществ различны.
Текст 4. Значение теории химического строения А. М. Бутлерова
Теория А. М. Бутлерова объяснила неясности и противоречия в знаниях об окружающем мире, творчески обобщила и достижения в области химии. Она указала направления и возможные пути получения новых необходимых людям лекарственных средств, синтетических красителей, полимеров и пластмасс, взрывчатых и других соединений. Теория стала теоретическим фундаментом органической химии и обеспечила бурный расцвет синтеза органических веществ и химической промышленности. По своей значимости она сопоставима с периодической системой Д. И. Менделеева. Подобное признание вклада А. М. Бутлерова в науку и оценку его теории сделал лауреат Нобелевской премии, крупнейший химик ХХ века Л. Полинг: «Среди великих химиков мира я хотел бы назвать также Бутлерова (наряду с Менделеевым), установившего, что каждое вещество состоит из молекул, имеющих различную структуру, которая определяет качество вещества» (1975г).
Прошло почти 160 лет с тех пор, как была создана ТХС органических соединений А.М. Бутлерова но и теперь химики всех стран используют ее в своих работах. Новейшие достижения науки пополняют данную теорию, уточняют и находят все новые подтверждения правильности ее основных идей.
Теория химического строения и сегодня остается фундаментом органической химии.
ТХС органических соединений А.М. Бутлерова внесла существенный вклад в создание общенаучной картины мира, способствовала диалектико – материалистическому пониманию природы.
Разработав теорию, А.М. Бутлеров не считал ее абсолютной и неизменной. Он утверждал, что она должна развиваться. ТХС органических соединений не осталась неизменной.
Итак, важнейшие функции теории: объяснение явлений, прогнозирование, обобщение, систематизация.
Выдающаяся научная и общественная деятельность создала А. М. Бутлерову и русской школе химиков-органиков огромный авторитет.
Приложение 3.
Примерный инсерт по 3 тексту:
V+
—
?
Валентность элементов условно изображают черточками.
Если данное вещество изменяет окраску фиолетового лакмуса на розовый цвет, взаимодействует с металлами, стоящими до водорода, с основными оксидами, основаниями, то мы можем предположить, что это вещество относится к классу кислот, т.е. в своем составе имеет атомы водорода и кислотный остаток. И, наоборот, если данное вещество относится к классу кислот, то проявляет вышеперечисленные свойства.
При сравнении свойства водных растворов NН3, НС1, Н2О (действие индикатора). Во всех трех случаях в состав веществ входят атомы водорода, но они соединены с разными атомами, которые оказывают различное влияние на атомы водорода, поэтому свойства веществ различны.
В 1861 году Александр Михайлович Бутлеров сформулировал основные идеи теории:
1. Все атомы, образующие молекулы органических веществ, связаны в определенной последовательности согласно их валентностям.
2. Свойства веществ зависят не только от качественного и количественного состава, но и от порядка соединения атомов в молекуле.
Изомерия – явление существования нескольких веществ, имеющих один и тот же состав и одну и ту же молекулярную массу, но различающихся строением молекул.
3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы предвидеть свойства.
4. Атомы и группы атомов в молекулах веществ взаимно влияют друг на друга.
Обесцвечивание раствора перманганата калия, происходит этиленом, этан не обесцвечивает, так как не имеет в структуре двойных связей.
Изомеры: н-бутан (tкип.= -0.5 0С) и метилпропан (tкип.=-11.7 0С), этанол и диметиловый эфир.
10 класс. Урок “Теория химического строения органических веществ” « МКОУ средняя общеобразовательная школа д.Васькино
Содержание урока: Теории строения органических соединений: предпосылки создания, основные положения. Химическое строение как порядок соединения и взаимного влияния атомов в молекулах. Гомология, изомерия. Зависимость свойств веществ от химического строения. Основные направления развития теории химического строения. Зависимость появления токсичности у органических соединений от состава и строения их молекул (длина углеродной цепи и степень ее разветвленности, наличие кратных связей, образование циклов и пероксидных мостиков, присутствие атомов галогенов), а также от растворимости и летучести соединения.
Цели урока:
- Организовать деятельность учащихся по ознакомлению и первичному закреплению основных положений теории химического строения.
- Показать учащимся универсальный характер теории химического строения на примере неорганических изомеров и взаимного влияния атомов в неорганических веществах.
Ход урока:
1. Организационный момент.
2. Актуализация знаний учащихся.
1) Что изучает органическая химия?
2) Какие вещества называют изомерами?
3) Какие вещества называют гомологами?
4) Назовите известные вам теории, возникшие в органической химии в начале XIX века.
5) Какими недостатками обладала теория радикалов?
6) Какими недостатками обладала теория типов?
3. Постановка целей и задач урока.
Представления о валентности составили важную часть теории химического строения А.М. Бутлерова в 1861 г.
Периодический закон, сформулированный Д.И. Менделеевым в 1869 г., вскрыл зависимость валентности элемента от его положения в периодической системе.
Оставалось неясным большое многообразие органических веществ, имеющих одинаковый качественный и количественный состав, но разные свойства. К примеру, было известно около 80 разнообразных веществ, отвечающих составу C6H12O2. Йенс Якоб Берцелиус предложил называть эти вещества изомерами.
Ученые многих стран своими работами подготовили почву для создания теории, объясняющей строение и свойства органических веществ.
На съезде немецких естествоиспытателей и врачей в городе Шпейере был прочитан доклад, называвшийся “Нечто в химическом строении тел”. Автором доклада был профессор Казанского университета Александр Михайлович Бутлеров. Именно это самое “нечто” и составило теорию химического строения, которая легла в основу наших современных представлений о химических соединениях.
Органическая химия получила прочную научную основу, обеспечившую ее стремительное развитие в последующее столетие вплоть до наших дней. Эта теория позволила предсказывать существование новых соединений и их свойства. Понятие о химическом строении позволило объяснить такое загадочное явление, как изомерия.
Основные положения теории химического строения сводятся к следующему:
1. Атомы в молекулах органических веществ соединяются в определенной последовательности согласно их валентности.
2. Свойства веществ определяются качественным, количественным составом, порядком соединения и взаимным влиянием атомов и групп атомов в молекуле.
3. Строение молекул может быть установлено на основе изучения их свойств.
Рассмотрим эти положения более подробно. Молекулы органических веществ содержат атомы углерода (валентность IV), водорода (валентность I), кислорода (валентность II), азота (валентность III). Каждый атом углерода в молекулах органических веществ образует четыре химические связи с другими атомами, при этом атомы углерода могут соединяться в цепи и кольца. На основании первого положения теории химического строения мы будем составлять структурные формулы органических веществ. Например, установлено, что метан имеет состав СН4. Учитывая валентности атомов углерода и водорода можно предложить только одну структурную формулу метана:
Химическое строение других органических веществ может быть описано следующими формулами:
этан
этиловый спирт
уксусная кислота
ацетон
Второе положение теории химического строения описывает известную нам взаимосвязь: состав – строение – свойства. Посмотрим проявление этой закономерности на примере органических веществ.
Этан и этиловый спирт имеют разный качественный состав. Молекула спирта в отличие от этана содержит атом кислорода. Как это скажется на свойствах?
| Вещество | Агрегатное состояние при н.у. | Температура кипения, °С | Температура плавления, °С |
| С2Н6 | газ | – 182,8 | – 88,6 |
| СН3СН2ОН | жидкость | – 114 | + 78 |
Введение в молекулу атома кислорода резко меняет физические свойства вещества. Это подтверждает зависимость свойств от качественного состава.
Сравним состав и строение углеводородов метана, этана, пропана и бутана.
пропан
бутан
Метан, этан, пропан и бутан имеют одинаковый качественный состав, но разный количественный (число атомов каждого элемента). Согласно второму положению теории химического строения они должны обладать различными свойствами.
| Вещество | Температура кипения, °С | Температура плавления, °С |
| СН4 | – 182,5 | – 161,5 |
| С2Н6 | – 182,8 | – 88,6 |
| С3Н8 | – 187,6 | – 42,1 |
| С4Н10 | – 138,3 | – 0,5 |
Как видно из таблицы, с увеличением числа атомов углерода в молекуле происходит повышение температур кипения и плавления, что подтверждает зависимость свойств от количественного состава молекул.
Молекулярной формуле С4Н10 соответствует не только бутан, но и его изомер изобутан:
Изомеры имеют одинаковый качественный (атомы углерода и водорода) и количественный (4 атома углерода и десять атомов водорода) состав, но отличаются друг от друга порядком соединения атомов (химическим строением). Посмотрим как различие в строении изомеров скажется на их свойствах.
| Вещество | Температура кипения, °С | Температура плавления, °С |
| Бутан | – 138,3 | – 0,5 |
| Изобутан | – 159,4 | – 11,7 |
Углеводород разветвленного строения (изобутан) имеет более высокие температуры кипения и плавления, чем углеводород нормального строения (бутан). Это можно объяснить более близким расположением молекул друг к другу в бутане, что повышает силы межмолекулярного притяжения и, следовательно, требует больших затрат энергии для их отрыва.
Третье положение теории химического строения показывает обратную связь состава, строения и свойств веществ: состав – строение – свойства. Рассмотрим это на примере соединений состава С2Н6О.
Представим, что у нас имеются образцы двух веществ с одинаковой молекулярной формулой С2Н6О, которая была определена в ходе качественного и количественного анализа. Но как узнать химическое строение этих веществ? Ответить на этот вопрос поможет изучение их физических и химических свойств. При взаимодействии первого вещества с металлическим натрием реакция не идет, а второе – активно с ним взаимодействует с выделением водорода. Определим количественное отношение веществ в реакции. Для этого к известной массе второго вещества прибавим определенную массу натрия. Измерим объем водорода. Вычислим количества веществ. При этом окажется, что из двух моль исследуемого вещества выделяется один моль водорода. Следовательно, каждая молекула этого вещества является источником одного атома водорода. Какой вывод можно сделать? Только один атом водорода отличается по свойствам и значит строением (с какими атомами связан) от всех остальных. Учитывая валентность атомов углерода, водорода и кислорода для данного вещества может быть предложена только одна формула:
Для первого вещества может быть предложена формула, в которой все атомы водорода имеют одинаковое строение и свойства:
Аналогичный результат можно получить и при изучении физических свойств этих веществ.
| Вещество | Температура кипения, °С | Температура плавления, °С |
| Этиловый спирт | – 114 | + 78,4 |
| Диметиловый эфир | – 138,5 | – 25,0 |
Таким образом, на основании изучения свойств веществ можно сделать вывод о его химическом строении.
Значение теории химического строения трудно переоценить. Она вооружила химиков научной основой для изучения строения и свойств органических веществ. Подобное значение имеет и Периодический закон, сформулированный Д.И. Менделеевым. Теория строения обобщила все научные взгляды, сложившиеся в химии того времени. Ученые смогли объяснить поведение органических веществ в ходе химических реакций. На основе теории А.М. Бутлеров предсказал существование изомеров некоторых веществ, которые позднее были получены. Так же как и Периодический закон, теория химического строения получила свое дальнейшее развитие после становления теории строения атома, химической связи и стереохимии.
Презентация по химии на тему «Теория строения органических соединений»» (10 класс)
Инфоурок › Химия ›Презентации›Презентация по химии на тему «Теория строения органических соединений»» (10 класс)Описание презентации по отдельным слайдам:
1 слайд Описание слайда:
Описание слайда:Домашнее задание пар.2,упр.8,9с.22,подг. к сам. раб «Изомерия.Гомологи» Сообщение «Краткие сведения учёных, работы которых нанесли удар по теории витализма».
2 слайд Описание слайда:
Описание слайда:Выполнить у доски упр.5 с.13 Сообщение «Краткие сведения учёных, работы которых нанесли удар по теории витализма».
3 слайд Описание слайда:
Описание слайда:«Ты мне, я тебе»
4 слайд Описание слайда: 5 слайд
Описание слайда: 5 слайд  Описание слайда: 6 слайд
Описание слайда: 6 слайд  Описание слайда:
Описание слайда:Цель, задачи урока
7 слайд Описание слайда:
Описание слайда:Что нам известно?
8 слайд Описание слайда:
Описание слайда:Какие формулы изображены на слайде и в чём их отличие?
9 слайд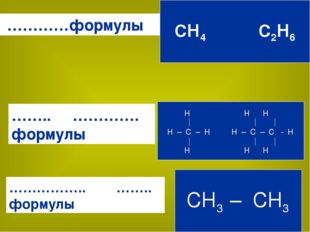 Описание слайда:
Описание слайда:…………формулы …….. …………. формулы …………….. …….. формулы СН4 С2Н6 H H H H – C – H H – C – C — H H H H Ch4 – Ch4
10 слайд Описание слайда:
Описание слайда:Молекулярные формулы: Показывают только состав веществ, но не показывают его строение. Например: СН4, С2Н2, С4Н10, С6Н12О6; Полные (развернутые) структурные формулы: Показывают состав и строение вещества, отображаются связи между всеми атомами. Краткие (сокращенные) структурные формулы: Показывают состав и строение вещества, отображаются только связи между атомами углерода
11 слайд Описание слайда:
Описание слайда:Что такое гомологи?
12 слайд Описание слайда:
Описание слайда:Вещества, которые имеют одинаковый качественный состав и сходное строение, но отличаются друг от друга на группу атомов -СН2 — (одну или несколько),называются гомологами. Приведите примеры.
13 слайд Описание слайда:
Описание слайда:Гомологический ряд метана: СН4 С2Н6 С3Н8 С4Н8 Метан Этан Пропан Бутан Гомологический ряд этилена: С2Н4 С3Н6 С4Н8 С5Н10 Этен Пропен Бутен Пентен
14 слайд Описание слайда:
Описание слайда:Что такое изомеры?
15 слайд Описание слайда:
Описание слайда:Изомеры – это вещества , которые имеют одинаковый качественный и количественный состав, но разное строение.
16 слайд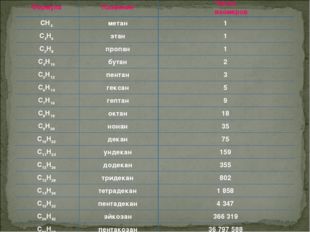 Описание слайда:
Описание слайда:Формула Название Число изомеров Ch5 метан 1 C4H6 этан 1 C3H8 пропан 1 C4h20 бутан 2 C5h22 пентан 3 C6h24 гексан 5 C7h26 гептан 9 C8h28 октан 18 C9h30 нонан 35 C10h32 декан 75 C11h34 ундекан 159 C12h36 додекан 355 C13h38 тридекан 802 C14h40 тетрадекан 1 858 C15h42 пентадекан 4 347 C20h52 эйкозан 366 319 C25H52 пентакозан 36 797 588 C30H62 триаконтан 4 111 846 763 C40H82 тетраконтан 62 491 178 805 831
17 слайд Описание слайда:
Описание слайда:Английский химик Э. Франкланд ввел в науку понятие о валентности. Валентность – это способность атома присоединять или замещать определенное число атомов или групп атомов с образованием химической связи. Углерод (?) валентен
18 слайд Описание слайда: 19 слайд
Описание слайда: 19 слайд  Описание слайда: 20 слайд
Описание слайда: 20 слайд  Описание слайда: 21 слайд
Описание слайда: 21 слайд  Описание слайда: 22 слайд
Описание слайда: 22 слайд  Описание слайда: 23 слайд
Описание слайда: 23 слайд  Описание слайда:
Описание слайда:Подведение итогов Сегодня я узнал… Было интересно… Было трудно… Я научился… У меня получилось… Меня удивило…
24 слайд Описание слайда:
Описание слайда:Урок окончен!!

Курс профессиональной переподготовки
Учитель химии

Курс повышения квалификации

Курс профессиональной переподготовки
Учитель биологии и химии
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
Выберите категорию: Все категорииАлгебраАнглийский языкАстрономияБиологияВсеобщая историяГеографияГеометрияДиректору, завучуДоп. образованиеДошкольное образованиеЕстествознаниеИЗО, МХКИностранные языкиИнформатикаИстория РоссииКлассному руководителюКоррекционное обучениеЛитератураЛитературное чтениеЛогопедия, ДефектологияМатематикаМузыкаНачальные классыНемецкий языкОБЖОбществознаниеОкружающий мирПриродоведениеРелигиоведениеРодная литератураРодной языкРусский языкСоциальному педагогуТехнологияУкраинский языкФизикаФизическая культураФилософияФранцузский языкХимияЧерчениеШкольному психологуЭкологияДругое
Выберите класс: Все классыДошкольники1 класс2 класс3 класс4 класс5 класс6 класс7 класс8 класс9 класс10 класс11 класс
Выберите учебник: Все учебники
Выберите тему: Все темы
также Вы можете выбрать тип материала:

Общая информация
Номер материала: ДБ-228323
Похожие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарийПрезентация по химии на тему «Основные положения теории строения органических веществ А.М. Бутлерова», 10 класс
Инфоурок › Химия ›Презентации›Презентация по химии на тему «Основные положения теории строения органических веществ А.М. Бутлерова», 10 классОписание презентации по отдельным слайдам:
1 слайд Описание слайда:
Описание слайда:Основные положения теории строения органических веществ А.М. Бутлерова
2 слайд Описание слайда:
Описание слайда:Органическая химия – это наука, изучающая вещества , содержащие углерод.
3 слайд Описание слайда:
Описание слайда:Кроме углерода в состав органических веществ обязательно входит водород.
4 слайд Описание слайда:
Описание слайда:В состав органических веществ могут входить кислород , азот , галогены , сера и фосфор – элементы-органогены .
5 слайд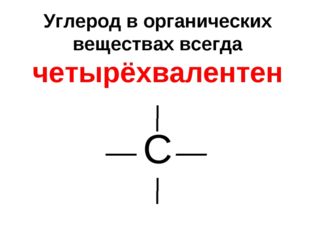 Описание слайда:
Описание слайда:Углерод в органических веществах всегда четырёхвалентен С
6 слайд Описание слайда:
Описание слайда:Атомы углерода способны соединяться друг с другом в цепи
7 слайд Описание слайда:
Описание слайда:1 .Атомы в молекулах соединяются в строго определённом порядке в соответствии с валентностью элементов .
8 слайд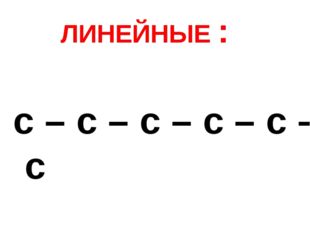 Описание слайда:
Описание слайда:ЛИНЕЙНЫЕ : с – с – с – с – с – с
9 слайд Описание слайда:
Описание слайда:Разветвлённые : с с с с с с
10 слайд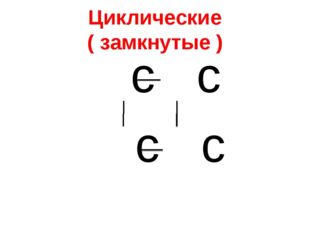 Описание слайда:
Описание слайда:Циклические ( замкнутые ) с с с с
11 слайд Описание слайда:
Описание слайда:Изомеры – это вещества, имеющие одинаковый состав , но разное строение.
12 слайд Описание слайда:
Описание слайда:Изомерия – это явление существования веществ одинакового состава , но разного строения.
13 слайд Описание слайда:
Описание слайда:2.Свойства веществ зависят не только от их качественного и количественного состава ,но и от того , в каком порядке соединены атомы в молекулах ,т . е. от химического строения .
14 слайд Описание слайда:
Описание слайда:3. Атомы в молекулах взаимно влияют друг на друга .
15 слайд Описание слайда:
Описание слайда:4. Свойства веществ определяются их строением , и , наоборот , зная строение , можно прогнозировать свойства.
16 слайд Описание слайда:
Описание слайда:5.Химическое строение веществ может быть установлено химическими методами.
17 слайд Описание слайда:
Описание слайда:Гомологи – это вещества , имеющие общие химические и физические свойства и сходное строение.
18 слайд Описание слайда:
Описание слайда:Гомологи отличаются друг от друга на одну или несколько групп СН2
19 слайд Описание слайда:
Описание слайда:Гомологи , расположенные в порядке возрастания их относительной молекулярной массы , образуют гомологический ряд.
20 слайд Описание слайда:
Описание слайда:Метиленовая группа СН2 называется гомологической разностью.
21 слайд Описание слайда:
Описание слайда:Физические свойства гомологов закономерно изменяются с ростом числа метиленовых групп (сн2)
22 слайд Описание слайда:
Описание слайда: 
Курс профессиональной переподготовки
Учитель химии

Курс повышения квалификации

Курс профессиональной переподготовки
Учитель биологии и химии
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
Выберите категорию: Все категорииАлгебраАнглийский языкАстрономияБиологияВсеобщая историяГеографияГеометрияДиректору, завучуДоп. образованиеДошкольное образованиеЕстествознаниеИЗО, МХКИностранные языкиИнформатикаИстория РоссииКлассному руководителюКоррекционное обучениеЛитератураЛитературное чтениеЛогопедия, ДефектологияМатематикаМузыкаНачальные классыНемецкий языкОБЖОбществознаниеОкружающий мирПриродоведениеРелигиоведениеРодная литератураРодной языкРусский языкСоциальному педагогуТехнологияУкраинский языкФизикаФизическая культураФилософияФранцузский языкХимияЧерчениеШкольному психологуЭкологияДругое
Выберите класс: Все классыДошкольники1 класс2 класс3 класс4 класс5 класс6 класс7 класс8 класс9 класс10 класс11 класс
Выберите учебник: Все учебники
Выберите тему: Все темы
также Вы можете выбрать тип материала:

Общая информация
Номер материала: ДБ-348930
Похожие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарийТеория химического строения органических соединений 10 класс базовый
 Теория химического строения органических соединений 10 класс базовый уровень Шкатова Е. В. ГБОУ СОШ № 269
Теория химического строения органических соединений 10 класс базовый уровень Шкатова Е. В. ГБОУ СОШ № 269
 Основой органической химии является теория строения органических соединений, созданная на основе Теории химического строения А. М. Бутлерова и современных представлений о строении атома и природе химической связи. Свойства вещества определяются химическим строением, электронным строением, пространственным строением.
Основой органической химии является теория строения органических соединений, созданная на основе Теории химического строения А. М. Бутлерова и современных представлений о строении атома и природе химической связи. Свойства вещества определяются химическим строением, электронным строением, пространственным строением.



 Основные положения ТХС А. М. Бутлерова ØАтомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
Основные положения ТХС А. М. Бутлерова ØАтомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
 Ø Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы). Ø Свойства веществ зависят от их химического строения. Ø По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы — предвидеть свойства.
Ø Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы). Ø Свойства веществ зависят от их химического строения. Ø По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы — предвидеть свойства.
 Ø Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга. Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А. М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
Ø Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга. Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А. М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
 Формулы строения Формула строения (структурная формула) описывает порядок соединения атомов в молекуле, т. е. ее химическое строение. Химические связи в структурной формуле изображают черточками. Связь между водородом и другими атомами обычно не указывается (такие формулы называются сокращенными структурными формулами). Например, полная (развернутая) структурная формула н-бутана C 4 H 10 имеет вид:
Формулы строения Формула строения (структурная формула) описывает порядок соединения атомов в молекуле, т. е. ее химическое строение. Химические связи в структурной формуле изображают черточками. Связь между водородом и другими атомами обычно не указывается (такие формулы называются сокращенными структурными формулами). Например, полная (развернутая) структурная формула н-бутана C 4 H 10 имеет вид:
 Часто используется еще более краткая запись формулы, когда не изображают не только связи с атомом водорода, но и символы атомов углерода и водорода. Например, строение бензола C 6 H 6 отражают формулы:
Часто используется еще более краткая запись формулы, когда не изображают не только связи с атомом водорода, но и символы атомов углерода и водорода. Например, строение бензола C 6 H 6 отражают формулы:
 Структурные формулы отличаются от молекулярных (брутто) формул, которые показывают только, какие элементы и в каком соотношении входят в состав вещества (т. е. качественный и количественный элементный состав), но не отражают порядка связывания атомов. Например, н-бутан и изобутан имеют одну молекулярную формулу C 4 H 10, но разную последовательность связей. Таким образом, различие веществ обусловлено не только разным качественным и количественным элементным составом, но и разным химическим строением, которое можно отразить лишь структурными формулами.
Структурные формулы отличаются от молекулярных (брутто) формул, которые показывают только, какие элементы и в каком соотношении входят в состав вещества (т. е. качественный и количественный элементный состав), но не отражают порядка связывания атомов. Например, н-бутан и изобутан имеют одну молекулярную формулу C 4 H 10, но разную последовательность связей. Таким образом, различие веществ обусловлено не только разным качественным и количественным элементным составом, но и разным химическим строением, которое можно отразить лишь структурными формулами.
 Понятие о изомерии Еще до создания теории строения были известны вещества одинакового элементного состава, но c разными свойствами. Такие вещества были названы изомерами, а само это явление – изомерией. В основе изомерии, как показал А. М. Бутлеров, лежит различие в строении молекул, состоящих из одинакового набора атомов. Таким образом, изомерия – это явление существования соединений, имеющих одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства. Например, при содержании в молекуле 4 -х атомов углерода и 10 -ти атомов водорода возможно существование 2 -х изомерных соединений:
Понятие о изомерии Еще до создания теории строения были известны вещества одинакового элементного состава, но c разными свойствами. Такие вещества были названы изомерами, а само это явление – изомерией. В основе изомерии, как показал А. М. Бутлеров, лежит различие в строении молекул, состоящих из одинакового набора атомов. Таким образом, изомерия – это явление существования соединений, имеющих одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства. Например, при содержании в молекуле 4 -х атомов углерода и 10 -ти атомов водорода возможно существование 2 -х изомерных соединений:
 В зависимости от характера отличий в строении изомеров различают структурную и пространственную изомерию. Структурные изомеры – соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т. е химическим строением. Следовательно, структурные изомеры имеют одну и ту же молекулярную формулу, но различные структурные формулы. Типы структурной изомерии Изомерия углеродного скелета Например, структурные изомеры C 5 H 12:
В зависимости от характера отличий в строении изомеров различают структурную и пространственную изомерию. Структурные изомеры – соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т. е химическим строением. Следовательно, структурные изомеры имеют одну и ту же молекулярную формулу, но различные структурные формулы. Типы структурной изомерии Изомерия углеродного скелета Например, структурные изомеры C 5 H 12:
 Изомерия положения: а) кратных связей б) функциональной группы Межклассовая изомерия (изомерия функциональных групп)
Изомерия положения: а) кратных связей б) функциональной группы Межклассовая изомерия (изомерия функциональных групп)
 Стереоизомеры Пространственные изомеры (стереоизомеры) при одинаковом составе и одинаковом химическом строении различаются пространственным расположением атомов в молекуле. Пространственными изомерами являются оптические и цис-транс изомеры (шарики разного цвета обозначают разные атомы или атомные группы): Молекулы таких изомеров несовместимы в пространстве.
Стереоизомеры Пространственные изомеры (стереоизомеры) при одинаковом составе и одинаковом химическом строении различаются пространственным расположением атомов в молекуле. Пространственными изомерами являются оптические и цис-транс изомеры (шарики разного цвета обозначают разные атомы или атомные группы): Молекулы таких изомеров несовместимы в пространстве.
 Электронные представления в органической химии Применение электронной теории строения атома и химической связи в органической химии явилось одним из важнейших этапов развития теории строения органических соединений. Понятие о химическом строении как последовательности связей между атомами(А. М. Бутлеров) электронная теория дополнила представлениями об электронном и пространственном строении и их влиянии на свойства органических соединений. Именно эти представления дают возможность понять способы передачи взаимного влияния атомов в молекулах (электронные и пространственные эффекты) и поведение молекул в химических реакциях. Согласно современным представлениям свойства органических соединений определяются: природой и электронным строением атомов; типом атомных орбиталей и характером их взаимодействия; типом химических связей; химическим, электронным и пространственным строением молекул.
Электронные представления в органической химии Применение электронной теории строения атома и химической связи в органической химии явилось одним из важнейших этапов развития теории строения органических соединений. Понятие о химическом строении как последовательности связей между атомами(А. М. Бутлеров) электронная теория дополнила представлениями об электронном и пространственном строении и их влиянии на свойства органических соединений. Именно эти представления дают возможность понять способы передачи взаимного влияния атомов в молекулах (электронные и пространственные эффекты) и поведение молекул в химических реакциях. Согласно современным представлениям свойства органических соединений определяются: природой и электронным строением атомов; типом атомных орбиталей и характером их взаимодействия; типом химических связей; химическим, электронным и пространственным строением молекул.
 Номенклатура органических соединений Номенклатура ИЮПАК В основе этой номенклатуры – названия предельных углеводородов. Класс соединений обозначается окончанием или суффиксом. -ан предельные углеводороды -ен этиленовые углеводороды -ин ацетиленовые углеводороды -ол спирты -аль альдегиды -овая кислоты
Номенклатура органических соединений Номенклатура ИЮПАК В основе этой номенклатуры – названия предельных углеводородов. Класс соединений обозначается окончанием или суффиксом. -ан предельные углеводороды -ен этиленовые углеводороды -ин ацетиленовые углеводороды -ол спирты -аль альдегиды -овая кислоты
 Историческая номенклатура Вещества называются преимущественно по их происхождению винная кислота древесный спирт мочевина
Историческая номенклатура Вещества называются преимущественно по их происхождению винная кислота древесный спирт мочевина
 Рациональная номенклатура применима для простейших углеводородов с разветвленной цепью Все предельные углеводороды рассматриваются как производные Метана Подходит для составления названий простых веществ, но затрудняет составление названий сложных веществ и изомеров.
Рациональная номенклатура применима для простейших углеводородов с разветвленной цепью Все предельные углеводороды рассматриваются как производные Метана Подходит для составления названий простых веществ, но затрудняет составление названий сложных веществ и изомеров.
 Правила составления названий веществ по номенклатуре ИЮПАК ØВыбрать главную цепь ØПронумеровать ØОпределить положение радикалов и функциональных групп ØНазвать предельный ув, соответствующий главной цепи Название префикс корень суффикс
Правила составления названий веществ по номенклатуре ИЮПАК ØВыбрать главную цепь ØПронумеровать ØОпределить положение радикалов и функциональных групп ØНазвать предельный ув, соответствующий главной цепи Название префикс корень суффикс
 Корень – количество атомов углерода в главной цепи Суффикс – вид связи в соединении Префикс – обозначает атомы или группы атомов в сложных соединениях Локанты – цифры или буквы, указывающие положение заместителей и кратных связей Множительные приставки – указывают число одинаковых заместителей или кратных связей
Корень – количество атомов углерода в главной цепи Суффикс – вид связи в соединении Префикс – обозначает атомы или группы атомов в сложных соединениях Локанты – цифры или буквы, указывающие положение заместителей и кратных связей Множительные приставки – указывают число одинаковых заместителей или кратных связей
 Домашнее задание Уровень1. Изложите основные положения и следствия ТХС. Уровень 2. Составьте структурные формулы: пентана С 5 Н 12, Сероводорода, оксида углерода (IV). Какую информацию о химическом соединении они несут? Уровень 3. Уровень 4. Составьте структурные формулы веществ: С 6 Н 14, С 7 Н 16 Уровень 5. При сгорании углеводорода с плотностью по воздуху равной 2 образовалось 44, 8 л н. у. углекислого газа и 45 г воды. Выведите молекулярную формулу углеводорода и составьте структурные формулы его изомеров.
Домашнее задание Уровень1. Изложите основные положения и следствия ТХС. Уровень 2. Составьте структурные формулы: пентана С 5 Н 12, Сероводорода, оксида углерода (IV). Какую информацию о химическом соединении они несут? Уровень 3. Уровень 4. Составьте структурные формулы веществ: С 6 Н 14, С 7 Н 16 Уровень 5. При сгорании углеводорода с плотностью по воздуху равной 2 образовалось 44, 8 л н. у. углекислого газа и 45 г воды. Выведите молекулярную формулу углеводорода и составьте структурные формулы его изомеров.

План-конспект урока (химия, 10 класс) по теме: «Формирование органической химии как науки. Теория строения органических соединений А.М. Бутлерова».10 класс. УМК Рудзитиса. Базовый уровень
Урок 1
Формирование органической химии как науки. Теория строения органических соединений А.М. Бутлерова. Углеродный скелет. Радикалы. Функциональные группы
Цели урока:
1. Провести первичный инструктаж по правилам техники безопасности при работе в химическом кабинете. Познакомить с основными историческими фактами в развитии органической химии, основными положениями теории строения органических соединений А.М. Бутлерова. Ввести понятия «углеродный скелет», «радикалы», «функциональные группы» (предметный результат).
2. Развивать умение генерировать идеи, выявлять причинно-следственные связи, искать аналогии и работать в команде, пользоваться альтернативными источниками информации (метапредметный результат).
3. Формирование умений управлять своей учебной деятельностью, подготовка к осознанию выбора дальнейшей образовательной траектории (личностный результат).
Ход урока
- Первичный инструктаж по правилам техники безопасности (5 мин).
Ознакомление с плакатами постоянной экспозиции в кабинете химии, ознакомление с порядком эвакуации из кабинета химии в случае возникновения чрезвычайной ситуации.
- Изучение нового материала (30 мин).
Формирование органической химии как науки. До начала 19 века в химии господствовали виталистические взгляды: орг. в-ва возникают т-ко в живых организмах. В 1828 г. Ф. Вёлер получил мочевину из неорганических компонентов. Затем Кольбе синтезировал уксусную кислоту, Бертло синтезировал жир, Бутлеров – сахаристое вещество.
В середине 19 века установлено, что в состав всех орг. в-в входит углерод. Органическая химия – химия соединений углерода. Число известных органических веществ: свыше 25 млн.
Демонстрационные опыты: «Образцы органических веществ и материалов», «Модели молекул органических веществ», «Растворимость органических веществ в воде и неводных растворителях», «Плавление, обугливание и горение органических веществ».
В 1858 году Кекуле установил, что углерод в органических соединениях всегда четырехвалентен. Углерод может объединяться в цепи и циклы.
Структурные формулы – химические формулы, условно изображающие строение молекул органических соединений с учетом геометрического расположения атомов.
Теория строения органических соединений А.М. Бутлерова.
В 1861 году Александр Михайлович Бутлеров сформулировал основные идеи теории:
1. Все атомы, образующие молекулы органических веществ, связаны в определенной последовательности согласно их валентностям.
Пример химического строения: метан, пропан, циклопентан.
Углеродный скелет.
Радикалы – свободные атомы или группы атомов с неспаренными электронами, неустойчивые и способные быстро вступить в химические превращения.
Функциональные группы – группы атомов, обусловливающие характерные химические свойства органических веществ. Карбоксильная, карбонильная, спиртовая и др.
2. Свойства веществ зависят не только от качественного и количественного состава, но и от порядка соединения атомов в молекуле.
Изомеры: н-бутан (tкип.= -0.5 0С) и метилпропан (tкип.=-11.7 0С), этанол и диметиловый эфир.
Изомерия – явление существования нескольких веществ, имеющих один и тот же состав и одну и ту же молекулярную массу, но различающихся строением молекул.
3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы предвидеть свойства.
Этан и этилен. Обесцвечивание раствора перманганата калия.
4. Атомы и группы атомов в молекулах веществ взаимно влияют друг на друга.
Уксусная и хлоруксусная кислоты.
- Подведение итогов учебного занятия, рефлексия (10 мин).
Решение задач по Рябов Сборник задач, упражнений и тестов по химии. 10 класс. – С.8.
Домашнее задание: §1, §2, с. 10 №4.