Тепловой эффект. Уравнение Кирхгофа
Определение 1Тепловой эффект E процесса – это сумма количества теплоты, которую отдала система Q’ в этом процессе, и теплового эквивалента работы A~, элемент которой равняется:
δA~=δA-pdV (1), где δA считается элементарной полной работой системы, pdV – работой расширения.
Тогда получим, что:
E=Q’+A~ (2).
Разрешается записать в виде E=-Q с Q, обозначающей количество теплоты, подведенное к системе. Согласно первому началу термодинамики:
E=-∆U-∫12pdV (3), где ∆U=U2-U1 является изменением внутренней энергии системы, p – давлением, V – объемом.
Тепловой эффект применяется в термохимии. Тепловым эффектом химической реакции считается количество тепла, выделяемое в ходе данной реакции. При выделении теплоты реакция получила название экзотермической, при поглощении – эндотермической. Считается, что уравнение экзотермической реакции характеризуется E>0, а эндотермической –
Допустим, имеется химическая реакция, протекающая при V=const. Это говорит о тепловом эффекте реакции EV, который необходимо рассчитывать по формуле:
Это говорит о тепловом эффекте реакции EV, который необходимо рассчитывать по формуле:
EV=U1-U2 (4).
Если прохождение этой реакции обусловлено наличием постоянного давления, то выражение (3) с использованием тепловой функции запишется:
Так как:
H=U+pV (5), E=h2-h3+∫12Vdp (6), то случай говорит о наличии теплового эффекта реакции с p=const:
Ep=h2-h3 (7).
По уравнениям (4), (5) видно прохождение теплового эффекта при изохорном и изобарном процессах в не зависимости от ее хода реакции (промежуточных стадий). Он определяется начальным и конечным состоянием системы. Данная формулировка получила название закона Гесса – первого закона термохимии. При твердых или жидких начальных и конечных продуктах реакции значения Ep и EV практически аналогичны. Это происходит по причине неизменности системы. Реакции, имеющие газообразные составляющие, в виду существенной переменности объема тепловые эффекты Ep и EV значительно отличаются, а тепловой эффект рассматривается при постоянном давлении.
Из закона Гесса вытекают следствия, упрощающие расчет химических реакций, в системах с p=const или V=const:
- Тепловой эффект реакции разложения химического соединения численно равен и противоположен по знаку тепловому эффекту реакции синтеза этого соединения из продуктов разложения.
- Разность тепловых эффектов двух реакций, приводящих из разных состояний к одинаковым конечным состояниям, равняется тепловому эффекту реакции перехода из одного начального состояния в другое.
- Разность тепловых эффектов двух реакций, приводящих из одного исходного состояния к разным конечным состояниям, равна тепловому эффекту реакции перехода из одного конечного состояния в другое.
Закон Гесса позволяет использовать термохимические уравнения в качестве алгебраических. Зависимость количества теплоты, которая выделяется в реакции E от теплового эффекта реакции Eo, и количества вещества nb одного из участников реакции( вещества b в качестве исходного вещества или продукта реакции), выражается при помощи уравнения:
Зависимость количества теплоты, которая выделяется в реакции E от теплового эффекта реакции Eo, и количества вещества nb одного из участников реакции( вещества b в качестве исходного вещества или продукта реакции), выражается при помощи уравнения:
E=nbvbE0 (8), где vb — является количеством вещества b, задаваемое коэффициентом перед формулой вещества b в химическом уравнении.
Слишком сложно?
Не парься, мы поможем разобраться и подарим скидку 10% на любую работу
Опиши заданиеУравнение Кирхгофа
Большинство термохимических данных в справочниках приведено при температуре 298 К. Чтобы рассчитать тепловые эффекты, обладающие другими температурами, применяют уравнения Кирхгофа. Они записываются для изохорного EV и изобарного Ep тепловых эффектов. Дифференциальная форма приобретает вид:∂EV∂TV=∂U1∂TV-∂U2∂TV=CV1-CV2=-∆Cv (9),∂Ep∂Tp=∂h2∂Tp-∂h3∂Tp=Cp1-Cp2=-∆Cp (10).
В (10), (9) имеется CV, Cp, являющиеся теплоемкостями веществ при соответствующих процессах.
Уравнение Кирхгофа для энтальпии изображается в интегральной форме вида:
HT2=HT1+∫T1T2∆CpTdT (11), где ∆Cp=∑ivjCpBj-∑viCpAiiсчитается разностью изобарных теплоемкостей продуктов реакции и исходных веществ. Зачастую выражение (11) применяют в химии.
Примеры задач на вычислыние теплового эффекта
Пример 1Записать выражение для расчета изменения стандартной энтальпии реакции.
Решение
Для решения задания необходимо взять за основу закон Гесса.
Именно он способствует оперированию термохимическими уравнениями как алгебраическими. Получаем, что запись принимает вид:
∆H=∑jvjHBj-∑iviHAi (1.1), с Bj, являющейся продуктами реакции, Ai – исходными веществами. В задании требуют записать формулу для расчета стандартной энтальпии. Отметим, что все энтальпии, записанные уравнениями (1.1), выбираются при температуре T=298 К. Реже это фиксируется в самой формуле.
Пример 2Даны химические уравнения. Произвести вычисление теплового эффекта реакции E образования 1 моль Fe2O3 при стандартных условиях из Fe и O2.
1. 2Fe+O2=2FeO, h398 К, 1=-529,6 кДж;2. 4FeO+O2=2Fe2O3, H(298 К, 2)=-585,2 кДж.
Решение
По условию видно, что следует рассчитать тепловой эффект образования 1 моль оксида железа Fe2O3 реакции вида:
3. 2Fe+1,5O2=Fe2O3 (2.1).
Из двух данных реакций, следует сформировать реакцию (2.1). Далее нужно разделить коэффициенты в (2) на 2 и произвести сложение с (1). Отсюда:
2Fe+O2+2FeO+0,5O2=2FeO+Fe2O3 (2.2).
Проведем преобразование (сокращение):
2Fe+1,5O2=Fe2O3.
Было получено уравнение (2.1):
Выше перечисленная последовательность действий с уравнениями привела к необходимому (2.1). При проведении аналогичной схемы действий с тепловыми эффектами, будет результат эффекта реакции (2.1). Протекание всех процессов обусловлено стандартными условиями, то есть при T=298 К. Следовательно формула примет вид:
E3=H(1)+0,5H (2) (2.3), где находящиеся в скобках цифры обозначают номер химической реакции. Рассчитаем и получим:
E3=-529,6+0,5·-585,2=-822,2 (кДж).
Ответ: тепловой эффект реакции равняется -822,2 кДж.
Экспериментальное определение тепловых эффектов — Справочник химика 21
Экспериментальное определение теплового эффекта реакции проводится в калориметрической бомбе (ознакомьтесь с термохимическими методами по учебникам и практическим руководствам по физической химии). Поскольку объем калориметрической бомбы заранее известен и не меняется, можно измерить Qv=AU, т. е. тепловой эффект при постоянном объеме. Расчет энтальпии реакции при известном ли проводится при помощи уравнения (203) [c.225]Основой термохимии служат экспериментальные определения тепловых эффектов различных химических реакций (и других термохимических величин) и теоретические закономерности химии и термодинамики. [c.29]
Экспериментальное определение тепловых эффектов ведут с помощью приборов — калориметров.
При экспериментальном.определении тепловых эффектов химических реакций возникают ошибки и неточности, обусловленные главным образом теплообменом прибора с внешней средой. Чтобы уменьшить теплообмен, ведут реакцию возможно быстрее и температуру калориметра в начале опыта поддерживают по возможности равной температуре воздуха в лаборатории. При определении [c.193]
Абсолютные значения внутренней энергии различных веществ (но-видимому, очень большие) нам совершенно неизвестны. Однако разности между значениями внутренней энергии тех или иных веществ измерены во многих случаях с большей точностью. Основанием для этих измерений послужили экспериментальные определения тепловых эффектов различных химических реакций. Поскольку значения внутренней энергии зависят от температуры, от нее зависят и тепловые эффекты реакций. Поэтому для сравнительных расчетов используют стандартные значения тепловых эффектов, приведенные к определенной стандартной температуре.
Экспериментальные определения теплового эффекта гидрокрекинга в лабораторных условиях осложняются протеканием процесса при высоких давлениях и температурах. Поэтому тепловые балансы могут быть составлены только для промышленных и полузаводских реакторов [108], Однако полученные результаты недостаточно надежны вследствие неточности имеющихся данных о теплоемкостях, теплосодержании сырья и продуктов ре- [c.170]
Энергетические эффекты. Тепловые эффекты реакций определяют как экспериментально, так и с помощью термохимических расчетов .
 Следует отметить, что мы не можем оценить абсолютных значений энтальпии и внутренней энергии. Однако для термохимических расчетов и экспериментального определения тепловых эффектов это несущественно, поскольку нас интересует изменение состояния системы, т. е. изменение значений Н и и. [c.196]
Следует отметить, что мы не можем оценить абсолютных значений энтальпии и внутренней энергии. Однако для термохимических расчетов и экспериментального определения тепловых эффектов это несущественно, поскольку нас интересует изменение состояния системы, т. е. изменение значений Н и и. [c.196] Термохимия изучает тепловые эффекты химических реакций. Сюда относится экспериментальное определение тепловых эффектов, их сопоставление и систематика, а также установление закономерностей, позволяющих определять тепловые эффекты для процессов, в которых их экспериментальное определение невозможно. Термохимия имеет как теоретическое, так и практическое значение. С помощью
Тепловые эффекты определяются экспериментально (в калориметре) или с помощью термохимических расчетов. Абсолютные значения энтальпий и внутренней энергии мы определить.-не можем. Но для термодинамических расчетов и экспериментального определения тепловых эффектов важно знать лишь изменение [c. 201]
201]
Тепловые эффекты определяются экспериментально (в калориметре) или с помощью термохимических расчетов. Абсолютные значения энтальпий и внутренней энергии мы определить не можем. Но для термодинамических расчетов и экспериментального определения тепловых эффектов важно знать лишь изменение состояния системы, т. е. изменение значения энтальпии и внутренней энергии. При экзотермических реакциях теплота выделяется, следовательно, энтальпия или внутренняя энергия системы уменьшается, и значения ДЯ и AU для них отрицательны. Напротив, при эндотермических реакциях теплота поглощается, т. е. Н VL и системы возрастают, а потому ДЯ и AU имеют положительные значения. Раньше тепловые эффекты обозначали через Q и считали их положительными, если выделяется теплота, и отрицательными, если она поглощается. В настоящее время тепловой эффект принято обозначать через ДЯ, причем стали считать положительными тепловые эффекты реакций, происходящих с поглощением теплоты, а отрицательными — происходящих с выделением теплоты. [c.235]
[c.235]
Но сжечь углерод только в СО практически не удается, так как всегда образуется еще некоторое количество СО2. Таким образом, экспериментальное определение теплового эффекта образования СО затруднено. Определение тепловых эффектов процесса (а) и (в) возможно. Закон Гесса позволяет, минуя опыт, вычислить тепловой эффект образования СО из элементов по уравнению [c.86]
Второй способ основан на экспериментальном определении тепловых эффектов реакций. Величина теплового эффекта реакции, отнесенная к количеству образовавшегося вещества, называется теплотой образования. [c.153]
При экспериментальном определении тепловых эффектов химических реакций возникают ошибки и неточности, обусловленные главным образом теплообменом прибора с внешней средой. Чтобы уменьшить теплообмен, ведут реакцию возможно быстрее и температуру калориметра в начале опыта поддерживают по возможности равной температуре воздуха в лаборатории. При определении изменения температуры тоже может появиться ряд неточностей. Большей частью для измерения температуры пользуются специальными калориметрическими термометрами. Кроме того, так как не весь столбик ртути находится при той температуре, какая имеется в калориметре, необходимо делать поправку на выступающий столбик . Об этих поправках, а также о предосторожностях, которые необходимо соблюдать, чтобы получить верные результаты, сказано подробно в специальных руководствах по практическому проведению термохимических измерений. [c.190]
При определении изменения температуры тоже может появиться ряд неточностей. Большей частью для измерения температуры пользуются специальными калориметрическими термометрами. Кроме того, так как не весь столбик ртути находится при той температуре, какая имеется в калориметре, необходимо делать поправку на выступающий столбик . Об этих поправках, а также о предосторожностях, которые необходимо соблюдать, чтобы получить верные результаты, сказано подробно в специальных руководствах по практическому проведению термохимических измерений. [c.190]
В данном случае экспериментальное определение тепловых эффектов может быть сравнительно легко проведено для первого и третьего процессов (АЯ1 и АЯз), но определить тепловой эффект сжигания угля до окиси углерода при невысоких температурах затруднительно. Поэтому можно определить АЯг, пользуясь законом Гесса, по уравнению [c.32]
На пути проверки этого правила стоял недостаток в экспериментально определенных тепловых эффектах различных органических реакций. Этот недостаток в значительной степени был устранен в 40-х и следующих годах. [c.158]
Этот недостаток в значительной степени был устранен в 40-х и следующих годах. [c.158]
Определение степени кристалличности полимеров по данным измерения теплоемкости не ограничивается расчетами по уравнениям (2) и (3), требующими обязательного экспериментального определения теплового эффекта плавления. Расчет может быть произведен непосредственно по данным значений теплоемкости Ср на основании уравнения [c.181]
Как правило, экспериментальное определение тепловых эффектов на всех стадиях проводится с большой тщательностью, соблюдаются все предпосылки, вытекающие из закона Гесса (условия, к которым приводятся начальные и конечные продукты сгорания, одинаковый химический состав исходных продуктов и т. д.), сведены до минимума ошибки и неточности, связанные с условиями теплообмена экспериментальной аппаратуры с окружающей средой, способами измерения температур и др., т. е. необратимые потери, связанные с превращением механической энергии непосредственно в тепловую, практически отсутствуют. [c.41]
[c.41]
При экспериментальном определении тепловых эффектов химических реакций возникают ошибки и неточности, обусловленные главным образом теплообменом прибора с внешней средой. Чтобы уменьшить теплообмен, ведут реакцию возможно быстрее и температуру калориметра в начале опыта поддерживают по возможности равной температуре воздуха в лаборатории. При определении изменения температуры тоже может появиться ряд неточностей. Большей частью для изме- [c.176]
ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ ТЕПЛОВЫХ ЭФФЕКТОВ [c.255]
Калориметрическая установка. Экспериментальное определение тепловых эффектов проводят в специальных приборах — калориметрах. Конструкции калориметров разнообразны и зависят [c.115]
Калориметрическая установка. Экспериментальное определение тепловых эффектов проводят в специальных приборах — калориметрах. Конструкции калориметров очень разнообразны и зависят от особенностей изучаемого процесса. Схема простейшего калориметра с изотермической оболочкой представлена на рис. 47. [c.124]
Схема простейшего калориметра с изотермической оболочкой представлена на рис. 47. [c.124]
Экспериментальным определением тепловых эффектов различных реакций занимается раздел химии, называемый термохимией. Найденные величины составляют основы справочников. С их помощью можно рассчитать тепловые эффекты других реакций, даже тех, которые провести экспериментально невозможно. Для этого необходимо составить цикл из термохимических реакций, которые можно осуществить экспериментально и результатом сложения которых является искомая реакция. Для составления подобных термохимических циклов необходимо познакомиться с важнейшими определениями, приведенными ниже. [c.9]
Пользуясь законом Гесса, можно вычислить тепловой эффект таких превращений, при которых затруднительно или невозможно определить тепловой эффект непосредственно опытным путем. Например, закон Гесса позволяет вычислить тепловые эффекты сложных реакций по экспериментально определенным тепловым эффектам более простых реакций. [c.50]
[c.50]
Эти реакции никогда не протекают в чистом виде им всегда сопутствует реакция полного горения, т. е. образование диоксида углерода. Можно привести множество примеров подобного типа и в каждом случае химик окажется перед фактом невозможнссти экспериментального определения теплового эффекта реакции. [c.72]
Экспериментальное определение теплового эффекта в калориметрах может проводиться как при у=сопз1, так и при р=ооп51 таким образом, может непосредственно измеряться как ДI/, так и АН [Скуратов С. М., Колесов В. И., Воробьев А. Ф. Термохимия. Т. 1. — М Изд-во МГУ, 1964].— Прим. ред. [c.225]
Через обозначен условный тепловой эффект реакции при абсолютном нуле, для определения которого необходимо экспериментальное определение теплового эффекта реакции Q при какой-либо одной температуре величина же Дср находится из эмпирических фюрмул, определяющих зависимость от температуры теплоемкостей веществ, реагирующих и получающихся в результате реакций. [c.461]
[c.461]
Экспериментальное определение тепловых эффектов. Для определения тепловых эффектов, сопровождающих химические реакции, применяются специальные приборы, называемые калориметрами. Калориметрическое определение ведется так, чтобы вся химическая энергия выделялась в виде теплоты или частично затрачивалась на совершение внешней работы расширения газа, которая может быть учтена. Простейший калориметр может быть собран по схеме, показанной на рис. 103. Химическая реакция ведется в сосуде Дьюара 1. Он представляет собой стеклянный сосуд с посеребренными изнутри двойными стенками, из пространства между которыми выкачан воздух, вследствие чего стенки сосуда ПОЧТИ не проводят теплоты. Для более равномерного теплообмена с окружающей средой сосуд все же помещают обычно в большой термостат 2. наполненный водойВо время опыта температура термостата поддерживается постоянной. Сосуд покрыт медной крышкой 3 с тремя отверстиями для термометра 4. мешалки 5 и для пробирки 6. В сосуд и пробирку помещают навески реагирующих веществ, где они находятся до тех пор, пока не уравняется температура всех частей прибора. Определив температуру реагирующих веществ до начала реакции, проводят реакцию и определяют температуру в калориметре после реакции. [c.255]
В сосуд и пробирку помещают навески реагирующих веществ, где они находятся до тех пор, пока не уравняется температура всех частей прибора. Определив температуру реагирующих веществ до начала реакции, проводят реакцию и определяют температуру в калориметре после реакции. [c.255]
Наиболее простым способом инициирования реакции хлорирования является термический распад молекулярного хлора на атомы, поэтому термическое хлорирование оказалось наиболее изученным и часто применяющимся на практике методом хлорирования алканов. Обычно процессы термического хлорирования алканов реализуются в газовой фазе, так как температура, при которой появляется достаточное для инициирования реакции количество атомов хлора, лежит значительно выше температуры кипения хлорируемых алканов. Тепловой эффект реакций хлорирования парафиновых углеводородов определяется тепловыми эффектами разрыва связи С1—С1 при образовании атомарного хлора и связи С—Н в углеводороде. В табл. 5 приведены результаты экспериментального определения теплового эффекта хлорирования некоторых углеводородов и их хлорпроизводных (в среднем он составляет 24—25 ккал/молъ) [29]. [c.256]
[c.256]
Этим часто пользуются, когда трудно определить экспериментально теплоту образования каксго-то вещества, но сравнительно легко определить тепловой эффект какой-нибудь реакции с его участием. Например, теплоты образования углеводородов легко вычислять на основании экспериментального определения тепловых эффектов реакций и. горения. [c.28]
Тепловой эффект реакции
Тепловой эффект реакции
В ходе реакции происходит разрыв связей в исходных веществах и образование новых связей в продуктах реакции. Поскольку образование связи идет с выделением, а ее разрыв – с поглощением энергии, то химические реакции сопровождаются энергетическими эффектами. Энергия выделяется, если рвущиеся связи в исходных веществах менее прочны, чем связи, образующиеся в продуктах реакции, в противном случае – энергия поглощается. Обычно энергия выделяется и поглощается в форме теплоты, т.е. химическая форма энергии преобразуется в тепловую. Таким образом, химические реакции сопровождаются тепловыми эффектами.
Тепловой эффект (теплота реакции) – количество теплоты, выделившееся или поглощенное химической системой при протекании в ней химической реакции.
Тепловой эффект обозначается символами Q или ΔH (Q = −ΔH). Его величина соответствует разности между энергиями исходного и конечного состояний реакции: ΔH = Hкон. − Hисх. = Eкон. − Eисх.Реакции, протекающие с выделением теплоты, проявляют положительный тепловой эффект (Q > 0, ΔH < 0) и называются экзотермическими.
Реакции, которые идут с поглощением теплоты из окружающей среды (Q < 0, ΔH > 0), т.е. с отрицательным тепловым эффектом, являются эндотермическими.
Изменение энергии в ходе реакций экзотермической (I) и эндотермической (II)I — стадия процесса хлорирования метана; II — стадия процесса бромирования метана. Из приведенной диаграммы следует, что реакция хлорирования метана (и других алканов) не требует нагревания, а бромирование, напротив, должно идти при повышенной температуре.
 Тепловые эффекты химических реакций изучает термохимия
Термохимия — раздел химической термодинамики, изучающий тепловые эффекты реакций, их взаимосвязь с физико-химическими параметрами, теплоёмкости веществ и теплоты их фазовых переходов., основным законом которой является закон Гесса:
Тепловые эффекты химических реакций изучает термохимия
Термохимия — раздел химической термодинамики, изучающий тепловые эффекты реакций, их взаимосвязь с физико-химическими параметрами, теплоёмкости веществ и теплоты их фазовых переходов., основным законом которой является закон Гесса:Тепловой эффект реакции зависит только от начального и конечного состояний реагирующих веществ и не зависит от пути реакции (т.е. от числа стадий и промежуточных состояний).
Согласно закону Гесса, теплота реакции равна разности теплот образования продуктов реакции и теплот образования исходных веществ. Qреакции = ΣQобр.(продуктов) ΣQобр.(исх.веществ)- где Qобр. – теплота образования 1 моль соединения из простых веществ в стандартных условиях (Т = 298 К, p = 101,3 кПа).
Величину Qобр. = -ΔHoобр. называют стандартной молярной теплотой (энтальпией) образования вещества.
ГЕСС Герман Иванович (7. VIII.1802 – 12.XII.1850)
VIII.1802 – 12.XII.1850)
Русский химик, академик Петербургской АН (с 1830). Родился в Женеве. Окончил Дерптский университет (1825) как доктор медицины. Совершенствовал образование в Стокгольмском университете (1825). С 1830 профессор Петербургского технологического института, в 1832-1849 — Петербургского горного института. Один из основоположников термохимии.

Репетитор-онлайн — подготовка к ЦТ
Тепловой эффект химической реакции. Закон ГессаЛюбая химическая реакция протекает с разрывом химических связей в исходных веществах. Этот процесс требует затраты энергии и сопровождается поглощением энергии (теплоты). С другой стороны, в любой химической реакции образуются новые связи в ее продуктах, а при образовании химических связей энергия (теплота) выделяется. Если, например, разрушенные связи (в исходных веществах) менее прочные, чем образовавшиеся (в продуктах реакции), то энергии при образовании продуктов выделится больше, чем было затрачено на разрыв связей в исходных веществах. Тогда можно утверждать, что данная химическая реакция относится к экзотермическим. Для эндотермических реакций, напротив, разрушающиеся связи более прочные, чем образующиеся. Это позволяет утверждать, что тепловой эффект химической реакции Q
х
можно оценить по разности энергий химических связей в молекулах продуктов и молекулах исходных веществ. Для реакции, протекающей по уравнению
Тогда можно утверждать, что данная химическая реакция относится к экзотермическим. Для эндотермических реакций, напротив, разрушающиеся связи более прочные, чем образующиеся. Это позволяет утверждать, что тепловой эффект химической реакции Q
х
можно оценить по разности энергий химических связей в молекулах продуктов и молекулах исходных веществ. Для реакции, протекающей по уравнению
aА–А + bВ–В = сС–С + dD–D
с учетом стехиометрических коэффициентов можно записать:
Q = сЕ (С−С) + dЕ (D−D) − аЕ (А−А) − bЕ (В−В).
Например, в молекулах HCl, Cl2 и H2:
E (H−Cl) = 431,4 кДж/моль;
E (Cl−Cl) = 242,3 кДж/моль;
E (H−H) = 435,9 кДж/моль.
Тогда с учетом химического количества веществ для реакции
H−H + Cl−Cl = 2H−Cl
тепловой эффект
Q = ∑E (H−Cl) − E (Cl−Cl) − E (H−H),
Q = 2 · 431,4 − 435,9 − 242,3 = 184,6 (кДж).
Однако такой способ расчета теплового эффекта реакций в большинстве случаев не применим к соединениям с ионным типом связи, к тому же и для веществ молекулярного строения обычно дает большую погрешность (хотя знак теплового эффекта всегда предсказывается правильно).
Более универсальным является способ расчета теплового эффекта химических реакций, основанный на использовании закона Гесса: тепловой эффект химической реакции не зависит от пути перехода из начального состояния системы в конечное, а определяется только природой и состоянием исходных и конечных веществ
Например, некоторое вещество Б можно получить из вещества А несколькими способами, используя различные химические реакции 1, 2, 3 или 4, 5:
Согласно закону Гесса, можем записать:
Q 1 + Q 2 + Q 3 = Q 4 + Q 5.
Закон Гесса позволяет рассчитывать тепловые эффекты как суммарных процессов, так и промежуточных стадий. Это очень важно в тех случаях, когда экспериментальное определение теплового эффекта затруднено. Например, очень трудно определить тепловой эффект процесса превращения черного фосфора в белый:
Это очень важно в тех случаях, когда экспериментальное определение теплового эффекта затруднено. Например, очень трудно определить тепловой эффект процесса превращения черного фосфора в белый:
Рчерн = Рбел + Q.
Однако достаточно легко экспериментально найти тепловой эффект реакции сгорания черного и белого фосфора:
Рчерн+54О2=12Р2О5+722,1 кДж/моль,
Рбел+54О2=12Р2О5+760,1 кДж/моль.
Согласно закону Гесса, схему процесса логично представить так:
Тогда получим:
722,1 = Q + 760,1,
Q = −38 кДж/моль.
Рассмотрим еще один пример. При окислении серы образуется SO2, а не SO3, поэтому экспериментально невозможно рассчитать тепловой эффект процесса
S+32О2=SО3+Qx.
Однако известны тепловые эффекты процессов:
S + O2 = SO2 + 297 кДж, (6)
2SO2 + O2 = 2SO3 + 198 кДж. (7)
Рассчитаем тепловой эффект Q
x
. Для этого уравнение (6) умножим на 2, имеем:
Для этого уравнение (6) умножим на 2, имеем:
2S + 2O2 = 2SO2 + 2 · 297 кДж
или
2S + 2O2 = 2SO2 + 594 кДж. (8)
Просуммируем уравнения (7) и (8) и получим:
2S + 3O2 = 2SO3 + 792 кДж
или
S+32О2=SО3+396 кДж/моль.
Следовательно, Q х = 396 кДж/моль.
Непосредственно из закона Гесса следует, что тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ (с учетом химического количества вещества):
Q х = ∑nQ прод − ∑nQ исх.в-в.
При этом теплота образования простых веществ считается равной нулю. Теплоты образования веществ приводятся в специальных справочниках по химии.
Например, требуется рассчитать тепловой эффект реакции
2NO (г) + O2 (г) = 2NO2 (г) + Q
x
.
В справочнике находим теплоты образования NO2 и NO (теплота образования простого вещества O2 равна нулю):
Q (образ. NO2) = − 33,9 кДж/моль,
Q (образ. NO) = − 91,3 кДж/моль.
Тогда
Q x = 2Q (образ. NO2) − 2Q (образ. NO),
Q x = −2 · 33,9 − (−2 · 91,3) = −67,6 + 182,6 = 115 (кДж).
2 AgNO3 (тв) = 2Ag (тв) + 2 NO2 (газ) + О2 (газ) |
|||||||||||||||||||||||||||||||||||||
|
Зависимость теплового эффекта реакции от температуры опрделяется уравнением Кирхгофа:
Тепловой эффект реакции при Т2=0 и Т1=298К вычисляется по уравнению Кирхгофа как: |
|||||||||||||||||||||||||||||||||||||
Тепловой эффект. 2_1{Vdp\left(6\right).}\]
2_1{Vdp\left(6\right).}\]В таком случае тепловой эффект реакции при $p=const$ равен:
\[E_p=H_1-H_2\left(7\right).\]Уравнения (4) и (5) показывают нам, что тепловой эффект реакции при изохорном и изобарном процессах не зависит от хода (промежуточных стадий) реакции, а определяется начальным и конечным состояниями системы. Это формулировка закона Гесса — первый закон термохимии. Если начальные и конечные продукты реакции — твердые или жидкие, то $E_p$ и $E_V$ почти не отличаются друг от друга. Это происходит из-за неизменности объема системы. В реакциях с газообразными составляющими в виду существенной переменности объема тепловые эффекты $E_p$ и $E_V$ существенно отличаются, чаще всего рассматривают тепловой эффект при постоянном давлении. При заданной температуре тепловой эффект реакции $E_p$ практически (а в идеальном газе совсем) не зависит от внешнего давления (которое поддерживают постоянным). Тепловой эффект определённый при t=250C и p=760 мм рт.ст. считается стандартным.
Из закона Гесса вытекают следствия, которые упрощают расчет химических реакций, в системе при $p=const$ или $V=const$:
- тепловой эффект реакции разложения химического соединения численно равен и противоположен по знаку тепловому эффекту реакции синтеза этого соединения из продуктов разложения;
- разность тепловых эффектов двух реакций, приводящих из разных состояний к одинаковым конечным состояниям, равна тепловому эффекту реакции перехода из одного начального состояния в другое;
- разность тепловых эффектов двух реакций, приводящих из одного исходного состояния к разным конечным состояниям, равна тепловому эффекту реакции перехода из одного конечного состояния в другое.
Закон Гесса позволяет оперировать термохимическими уравнениями, как алгебраическими. Зависимость количества теплоты, выделяющейся в реакции (E) от теплового эффекта реакции (Eo) и количества вещества (nb) одного из участников реакции (вещества b — исходного вещества или продукта реакции), выражается уравнением:
\[E=\frac{n_b}{{\nu }_b}E_0,(8)\]Здесь $\ {\nu }_b$— количество вещества b, задаваемое коэффициентом перед формулой вещества b в термохимическом уравнении. {T_2}_{T_1}{\triangle C_p\left(T\right)dT}\left(11\right),\]
{T_2}_{T_1}{\triangle C_p\left(T\right)dT}\left(11\right),\]
где $\triangle C_p=\sum\limits_j{{\nu }_jC_p(B_j})-\sum\limits_i{{\nu }_iC_p(A_i})$ — разность изобарных теплоемкостей продуктов реакции и исходных веществ. Уравнением (11) в химии пользуются чаще всего.
Пример 2
Задание: По приведенным ниже химическим уравнениям вычислите тепловой эффект реакции (E) образования 1 моль ${Fe}_2O_{3\ }$при стандартных условиях из $Fe$ и $O_2$.
- $2Fe+O_2=2FeO,\ H\left(298K,\ 1\right)=-529,6\ кДж$
- $4FeO+O_2=2{Fe}_2O_3,\ H\left(298K,\ 2\right)=-585,2\ кДж$
Решение:
Таким образом, необходимо рассчитать тепловой эффект образования 1 моль оксида железа (${Fe}_2O_3$) в реакции:
- $2Fe+{1,5O}_2={Fe}_2O_3\ \left(2.1\right)$.
Получается, что из двух реакций, приведенных в условиях задачи, необходимо сформировать реакцию (2.1). Для этого разделим коэффициенты в реакции (2) на 2 и сложим с химическим уравнением (1), таким образом, получим:
\[2Fe+O_2+2FeO+{0,5O}_2=2FeO+{Fe}_2O_3\ \left(2. 2\right).\]
2\right).\]Проведем сокращения, получим уравнение реакции:
\[2Fe+1,5O_2={Fe}_2O_3\ \]Мы получили уравнение (2.1)
Так как приведенная выше последовательность манипуляций с химическими уравнениями 1 и 2 из условий задачи привела нас к требуемому уравнению (2.1), то проведя аналогичную схему действий с тепловыми эффектами, мы получим тепловой эффект реакции (2.1). Мы помним, что все процессы протекают в стандартных условиях, то есть при T=298K. Таким образом, получаем:
\[E\left(3\right)=H\left(1\right)+0,5H\left(2\right)\left(2.3\right),\]где цифры в скобках обозначают номер химической реакции. Проведем расчет:
\[E\left(3\right)=-529,6+0,5\cdot \left(-585,2\right)=-822,2\ \left(кДж\right).\]Ответ: Тепловой эффект реакции -822, 2 кДж.
тепловой эффект — Перевод на английский — примеры русский
На основании Вашего запроса эти примеры могут содержать грубую лексику.
На основании Вашего запроса эти примеры могут содержать разговорную лексику.
Если тепловой эффект при рассчитанном времени старения не обеспечивает выход на уровень по крайней мере 95% заданного теплового старения, то цикл «стендового» старения продлевают.
Bench ageing will be extended if the thermal effect of the calculated ageing time is not at least 95 per cent of the target thermal ageing. По мнению Самоа, следует уделить должное внимание необходимости принятия срочных мер по сокращению выбросов газов, имеющих тепловой эффект, и стабилизации концентрации этих газов в атмосфере на уровне, значительно ниже соответствующих уровней концентрации в доиндустриальную эпоху.
In his delegation’s view, due attention must be paid to the need to take urgent action to reduce greenhouse gas emissions and to stabilize concentrations of greenhouse gases in the atmosphere at levels well below those of the pr-industrial era.
Предложить пример
Другие результаты
Новый NETZSCH DSC 404 F1 Pegasus позволяет определить теплоемкость и тепловые эффекты в широком диапазоне температур с высоким ращрешением и точностью.
The new NETZSCH DSC 404 F1 Pegasus, High-Temperature Differential Scanning Calorimeter, allows the determination of specific heat and caloric effects in a broad temperature range with outstanding reliability, best resolution and accuracy. Удельная теплоемкость, коэффициент линейного термического расширения и тепловые эффекты, в том числе и в коррозирующей среде — вот то, что может быть вам нужно измерить.
Specific heat, extension coefficient and characteristic thermal effects also under corrosive conditions may possibly be analytical goals for your applications.
Вы хотите измерить с помощью прибора для измерения теплового эффекта, содержатся ли в грузовом танке взрывчатые смеси газа и воздуха.
На основании результатов измерения теплового потока с учетом теплового эффекта от сжимания жидкости рассчитывают краевой угол смачивания заполненных жидкостью пор, а также размеры пор.
On the basis of the results of the measurement of the heat flow and taking into account the heat of compression of the fluid, the wetting angle of the fluid-filled pores and also the size of the pores are calculated. Наши аналитические инструменты служат для определения характеристических тепловых эффектов и других свойств материала, например, плавление и кристаллизация термопластиков, стеклование, термостойкость и состав смесей резин, характер отверждения термореактивных пластиков и коэффициент эластичности различных анизотропных композитов.
Our analytical instruments serve to determine characteristic thermal effects and materials data: e.g. melting/crystallization of thermoplastics, glass transitions, thermostability and composition of rubber mixtures, curing behavior of thermosetting materials, and coefficient of elasticity values of anisotropic composites. Плавление и кристаллизация лекарственных препаратов и вспомогательных веществ, стеклование патоки, окисление смазочных материалов или отверждение красок и адгезивов — вот те процессы, измерение тепловых эффектов которых можно привести в качестве примера.
The melting and crystallization behavior of pharmaceutical active ingredients and auxiliary substances, the glass transition of treacles, the oxidation behavior of lubricants or the curing behavior of paints and adhesives are thermal effects here exemplified.
С Нет, работа прибора для измерения теплового эффекта
Калориметр ММС 274 Nexus используется для измерений теплоты реакций, скорости реакций, тепловых эффектов, фазовых переходов, при выделении газов и изменении давления.
The MMC 274 Nexus is used for measuring heats of reaction, reaction rates, endotherms, heat capacities, phase changes, gas generation rates and vapor pressures. Кадышевич, Б.В. Гостев, Дифференциальные тепловые эффекты, кинетика и механизм обводнения водяным паром и осушки системы акриламид-вода.
Kadyshevich, S.A. Sitnov, On the Influence of Volcanic Eruptions on the Polarization of Scattered Light in the Twilight Atmosphere, Izv. Необходимо ответственно подходить к конструированию и эксплуатации систем косвенного охлаждения, так чтобы избежать или свести к минимуму сопутствующие потери в энергосбережении, характерные для более ранних конструкций, и обеспечить снижение общего эквивалентного теплового эффекта от хладагента и процесса выработки потребляемой энергии.
Care is needed to design and operate indirect systems to negate or minimize energy efficiency penalties, which were seen in early designs, and to ensure that total equivalent warming impact of refrigerant plus energy is reduced. В городах региона наблюдается заметный эффект теплового купола над городом, обуславливаемый такого рода практикой градостроительства.
Cities in the region are experiencing considerable urban heat island effects due to this type of urban development. Эти меры направлены также на борьбу с «эффектом теплового острова», вызванного обилием бетона и асфальта, которые делают городские районы на несколько градусов теплее, чем окружающие сельские районы.
These measures counter the «heat island effect» caused by an abundance of tarmac and asphalt, which can make urban areas several degrees warmer than surrounding rural areas-as much as six degrees Celsius during the evening.
Подобные крыши не только сдерживают эффект теплового купола, но и экономят энергию, а значит и деньги, сокращают выбросы, способствующие изменению климата, и снижают потери ливневой воды.
The roofs not only temper urban heat island impact but they save energy, and therefore money, the emissions that cause climate change, and they also reduce stormwater runoff. Оба варианта могут использоваться в качестве замены кровельных материалов на основе нефти, которые поглощают тепло, что приводит к эффекту «теплового острова», и разрушаются под воздействием солнца, в результате чего мы ими в итоге дышим.
Both can be used instead of petroleum-based roofing materials that absorb heat, contribute to urban «heat island» effect and degrade under the sun, which we in turn breathe.
Во многих случаях программы уплотнения осуществляются за счет зеленых зон, что приводит к сокращению территории, используемой для отдыха, и увеличению эффекта «теплового острова» в городах.
Often, densification programmes have taken place at the cost of green space, reducing space available for recreational purposes, and thereby increasing the heat island effect of cities. Сокращение площади земли, покрытой зданиями, тротуарами, дорогами и автостоянками, уменьшает как местный эффект «теплового купола», так и нагрузку на канализационную и дренажную системы, поскольку земля может впитать больший объем ливневых осадков.
Reducing the amount of ground covered in buildings, pavements, roads and parking lots reduces both the local heat island effect and the pressure on sewerage and drainage, as the earth can soak up more rainwater under heavy rainfall.
Реализация всех перечисленных и многих других новейших технологических решений и применение нового высокоэффективного основного вспомогательного оборудования в процессе обновления стареющих тепловых электростанций дадут значительный экологический и экономический эффект.
The application of the most up-to-date technological solutions, both those enumerated above and many others, as well as the use of new and highly efficient main auxiliaries as ageing thermal plants are replaced, will produce a significant environmental and economic effect. Thermal Effect — обзор
7.2.2 Температура
Термические эффекты включают изменения, вызванные в композитной системе из-за воздействия колебаний температуры, воздействия температур выше температуры отверждения, воздействия отрицательной температуры (замерзания), высоких температур, и циклы замораживания-оттаивания.
Поскольку волокна обычно устойчивы к температурному воздействию (например, углеродные волокна устойчивы к температуре до 600 ° C), ожидается, что основными источниками разрушения кирпичной кладки, усиленной стеклопластиком, являются эпоксидная смола, кладочная подложка, интерфейс волокно-матрица и интерфейс FRP-кладка.
Хорошо известно, что эпоксидные смолы размягчаются при температурах, превышающих их T г . Это приводит к увеличению их вязкоупругой характеристики, снижению упругих свойств и снижению старения эпоксидной смолы. С другой стороны, воздействие на эпоксидные смолы температур ниже их T г , но выше температуры отверждения, может привести к увеличению их восприимчивости к механическому разрушению, вызывая последующее отверждение и увеличивая T г (Karbhari, 2003b; Кумар, Гупта, 2003).Повышение температуры также может привести к увеличению скорости поглощения влаги в эпоксидных смолах, таким образом оказывая синергетический эффект. С другой стороны, воздействие отрицательных температур приводит к охрупчиванию эпоксидной смолы и увеличению ее эффективной жесткости. Это также может привести к упрочнению матрицы, микротрещинам и ухудшению связи между волокном и матрицей (Karbhari, 2003a). Изменения свойств эпоксидной смолы в результате воздействия температурных условий, как также объяснялось в последнем разделе, могут привести к ухудшению механических свойств композита FRP и сцепления на границах раздела.
С другой стороны, воздействие отрицательных температур приводит к охрупчиванию эпоксидной смолы и увеличению ее эффективной жесткости. Это также может привести к упрочнению матрицы, микротрещинам и ухудшению связи между волокном и матрицей (Karbhari, 2003a). Изменения свойств эпоксидной смолы в результате воздействия температурных условий, как также объяснялось в последнем разделе, могут привести к ухудшению механических свойств композита FRP и сцепления на границах раздела.
Температурные циклы также могут вызывать растрескивание и повреждение на границах раздела волокно-матрица и FRP-подложка из-за проблем термической несовместимости (Green et al., 2003; Karbhari, 2003a; Ghiassi et al., 2014; Maljaee et al., др., 2016а, 2016б). Тепловая несовместимость и последующие повреждения возникают из-за значительной разницы в тепловом расширении между волокнами и полимерными матрицами и / или между FRP и подложками. Большинство эпоксидных смол, используемых в качестве матрицы в стеклопластиках, имеют коэффициенты теплового расширения в диапазоне от 45 × 10 –6 ° C до 65 × 10 –6 ° C. Между тем, стекловолокно обычно имеет коэффициент 5 × 10 −6 ° C, а углеродные волокна имеют коэффициент в диапазоне от -0,2 × 10 −6 ° C до 0,6 × 10 −6 ° C. С другой стороны, коэффициент теплового расширения глиняных кирпичей составляет порядка 5 × 10 −6 ° C (Kralj et al., 1991). Эта большая разница в коэффициентах расширения создает высокие термические напряжения на границах раздела волокно / матрица и матрица / кирпич, что может привести к расслоению, когда структура находится в условиях тепловых циклов (Karbhari et al., 2003; Холлавей, 2010; Гиасси и др., 2014; Maljaee et al., 2016b). Проблема термической несовместимости усугубляется при использовании углеродных волокон, поскольку эти волокна являются анизотропными с положительным коэффициентом теплового расширения в поперечном направлении и отрицательным коэффициентом в продольном направлении. Обычно это приводит к отслаиванию волокон от окружающей матрицы.
Между тем, стекловолокно обычно имеет коэффициент 5 × 10 −6 ° C, а углеродные волокна имеют коэффициент в диапазоне от -0,2 × 10 −6 ° C до 0,6 × 10 −6 ° C. С другой стороны, коэффициент теплового расширения глиняных кирпичей составляет порядка 5 × 10 −6 ° C (Kralj et al., 1991). Эта большая разница в коэффициентах расширения создает высокие термические напряжения на границах раздела волокно / матрица и матрица / кирпич, что может привести к расслоению, когда структура находится в условиях тепловых циклов (Karbhari et al., 2003; Холлавей, 2010; Гиасси и др., 2014; Maljaee et al., 2016b). Проблема термической несовместимости усугубляется при использовании углеродных волокон, поскольку эти волокна являются анизотропными с положительным коэффициентом теплового расширения в поперечном направлении и отрицательным коэффициентом в продольном направлении. Обычно это приводит к отслаиванию волокон от окружающей матрицы.
Тепловой эффект — обзор
2. 1 Термическая активация при микроволновом облучении
1 Термическая активация при микроволновом облучении
Тепловые эффекты, которые сокращают время реакции и наблюдаемые при реакциях при микроволновом облучении, связаны с различным температурным режимом в микроволновых условиях по сравнению с обычными условиями.Однако они могут привести к кажущемуся более быстрому протеканию химических реакций, правильное измерение температуры и ее анализ для всего образца материала (то есть массы реакционной смеси) приводят к скоростям реакции, которые сопоставимы со скоростями реакции, наблюдаемыми при обычных условиях. условия. Рассмотрены три фактора, которые могут вызвать тепловые эффекты [3]:
- ●
перегрев (перегрев) реакционной смеси, который, в частности, может наблюдаться в присутствии большого количества носителей тока (т.е.е., ионы)
- ●
значительно более высокая скорость нагрева реакционной смеси, что означает, что необходимая температура для химической реакции достигается за более короткое время
- ●
увеличение скорости диффузионных процессов на границах фаз
Другой важный эффект, проявляемый при микроволновом облучении и вызываемый перегревом реакционной смеси в герметичных сосудах, — это так называемый «эффект скороварки». Например, в одном из первых опубликованных исследований было замечено, что ряд реакций может быть проведен быстрее при условии, что реакционные смеси помещаются в герметичные сосуды и облучаются в микроволновом резонаторе. Более того, реакции требовали еще более короткого времени реакции, если бы они проводились в растворителях с более низкими температурами кипения. В итоге было показано, что скорость реакций пропорциональна давлению, создаваемому в реакционных сосудах во время облучения [12, 8].В другом примере сокращение времени реакции наблюдали во время синтеза металлоорганических соединений родия (I) и иридия (I), которые обычно получают кипячением реагентов в смеси спиртов и воды в течение нескольких часов. Время реакции во время микроволнового протокола было короче 1 мин. позволить себе продукты с удовлетворительным выходом. Дальнейшее более детальное исследование показало, что существенное сокращение времени реакции было связано с ростом давления и температуры в герметичных реакционных сосудах [19].
Например, в одном из первых опубликованных исследований было замечено, что ряд реакций может быть проведен быстрее при условии, что реакционные смеси помещаются в герметичные сосуды и облучаются в микроволновом резонаторе. Более того, реакции требовали еще более короткого времени реакции, если бы они проводились в растворителях с более низкими температурами кипения. В итоге было показано, что скорость реакций пропорциональна давлению, создаваемому в реакционных сосудах во время облучения [12, 8].В другом примере сокращение времени реакции наблюдали во время синтеза металлоорганических соединений родия (I) и иридия (I), которые обычно получают кипячением реагентов в смеси спиртов и воды в течение нескольких часов. Время реакции во время микроволнового протокола было короче 1 мин. позволить себе продукты с удовлетворительным выходом. Дальнейшее более детальное исследование показало, что существенное сокращение времени реакции было связано с ростом давления и температуры в герметичных реакционных сосудах [19].
Во избежание трудностей, связанных с ростом давления в закрытых сосудах, а также с измерением температуры, реакцию этерификации уксусной кислоты пропанолом проводили в открытом сосуде в условиях дефлегмации. Было обнаружено, что концентрации сложного эфира в ходе реакции были сопоставимы как в обычных, так и в микроволновых условиях [20]. В аналогичной реакции (т. Е. Этерификации триметилбензойной кислоты пропанолом) кинетические параметры реакции по закону Аррениуса были оценены для обычных условий.Затем теоретически рассчитывали концентрации сложного эфира и сравнивали с результатами, полученными для реакции в микроволновых условиях. Было обнаружено, что теоретические значения хорошо коррелируют с экспериментальными результатами, поэтому микроволновое облучение не влияет на скорость реакции [21].
В другом подходе для исследования скорости реакции Дильса-Альдера антрацена и диэтилфумарата использовали высококипящий растворитель, трихлорбензол. Для оценки температуры при микроволновом облучении в реакционную смесь помещали небольшие капиллярные трубки, содержащие соединения с различными температурами плавления. Соединение с наивысшей температурой плавления, которое плавилось во время реакции, характеризует температуру реакции. Затем реакцию повторяли при той же температуре в обычных условиях. Снова было показано, что микроволны не влияют на скорость реакции, и, казалось бы, более высокие выходы реакции в микроволновых условиях можно объяснить более высокой объемной температурой (тепловым эффектом) реакционной смеси в микроволновых условиях [22]. Также сравнение скорости реакции Дильса-Альдера диэтилмалеата и антрацена в обычных и микроволновых условиях дало аналогичные результаты [21].
Соединение с наивысшей температурой плавления, которое плавилось во время реакции, характеризует температуру реакции. Затем реакцию повторяли при той же температуре в обычных условиях. Снова было показано, что микроволны не влияют на скорость реакции, и, казалось бы, более высокие выходы реакции в микроволновых условиях можно объяснить более высокой объемной температурой (тепловым эффектом) реакционной смеси в микроволновых условиях [22]. Также сравнение скорости реакции Дильса-Альдера диэтилмалеата и антрацена в обычных и микроволновых условиях дало аналогичные результаты [21].
Исследование гидролиза аденозинтрифосфатной кислоты (АТФ) показало, что градиент температуры во время реакции в микроволновых условиях может достигать прибл. 30 ° C, поэтому надежное измерение температуры является ключевым фактором для интерпретации и сравнения скорости любой реакции в обычных и микроволновых условиях. В этом случае параметры Аррениуса были оценены для реакции в обычных условиях. Затем с учетом температурного градиента в исследуемых образцах были рассчитаны концентрации реагентов для экспериментов, проведенных в микроволновых условиях, чтобы показать, что как теоретические, так и экспериментальные значения находятся в пределах экспериментальной ошибки [23].
Микроволновый синтез дигидропиримидина по Бигинелли исследовали как в открытых, так и в закрытых реакционных сосудах. Реакция, проводимая при атмосферном давлении при микроволновом облучении в растворе, не показывала увеличения скорости по сравнению с реакциями в обычных условиях, тогда как в условиях повышенного давления выход реакции даже снижался и наблюдалось образование различных побочных продуктов. Увеличение скорости реакции наблюдалось при атмосферном давлении в случае перегрева растворителя (т.е.например, этанол) даже до 116 ° C, но этот эффект можно рационализировать как чисто термический эффект. Более значительный рост скорости реакции и выхода наблюдался, когда растворителю позволяли быстро испаряться и превращать реакционную систему в системы без растворителя [24], что, кстати, является одной из наиболее эффективных систем для микроволновой активации.
Все приведенные выше примеры доказывают, что для исследуемых реакций влияние микроволнового излучения ограничивалось чисто тепловыми эффектами (т. е.е. более высокое давление и / или объемная температура реакционной смеси, развитие температурного градиента, перегрев растворителей), которые могут быть ответственны за кажущиеся более высокие скорости реакции в условиях микроволнового излучения. Однако тщательное рассмотрение всех факторов, влияющих на реакции в условиях микроволнового излучения, может устранить большинство из этих эффектов. Существует несколько реакций, в которых влияние только тепловых эффектов недостаточно для объяснения увеличения выхода и скорости реакций.
е.е. более высокое давление и / или объемная температура реакционной смеси, развитие температурного градиента, перегрев растворителей), которые могут быть ответственны за кажущиеся более высокие скорости реакции в условиях микроволнового излучения. Однако тщательное рассмотрение всех факторов, влияющих на реакции в условиях микроволнового излучения, может устранить большинство из этих эффектов. Существует несколько реакций, в которых влияние только тепловых эффектов недостаточно для объяснения увеличения выхода и скорости реакций.
Термические эффекты в химических реакциях: Введение
Обзор:
В этом модуле используются скринкасты и интерактивное моделирование, чтобы объяснить важность баланса массы и энергии при использовании химического реактора. Затем он предоставляет примеры задач и пошаговые имитации викторин, чтобы пользователь мог проверить себя. Мы предлагаем использовать учебные ресурсы в следующем порядке:
- Попытайтесь ответить на ConcepTest с несколькими вариантами ответов и решить проблему из примера перед просмотром скринкаста или работой с симуляциями.

- Посмотрите видеоролик, в котором применяется баланс энергии к реактору периодической загрузки.
- Воспользуйтесь интерактивным моделированием, чтобы лучше понять взаимосвязь между конверсией и температурой в адиабатическом реакторе.
- Используйте интерактивное моделирование викторины, чтобы проверить свое понимание, выполнив пошаговую подготовку адиабатической обратимой реакции.
- Попытайтесь решить два примера проблем, прежде чем смотреть решения в видеороликах.
- Ответьте на ConcepTests.
- Посмотрите список ключевых моментов, но только после того, как вы попытаетесь сами перечислить ключевые моменты.
Мотивация:
Это
модуль предназначен для курса термодинамики или кинетики. Химические реакторы ограничены равновесием,
который зависит от температуры.
Перед изучением этого модуля вы должны уметь:
После изучения этого модуля вы должны уметь:
- Рассчитывать
температура на выходе из химического реактора, если конверсия на выходе известна.

- Рассчитать
равновесная конверсия в адиабатическом реакторе.
- Рассчитать
температура адиабатического равновесия химической реакции.
- Объяснить
какое влияние окажет добавление инертного вещества на адиабатическую температуру для любого
эндотермическая или экзотермическая реакция.
- Рассчитать
тепло, которое необходимо отводить, чтобы реактор оставался изотермическим, учитывая выход
конверсия из реактора.
Как рассчитать линейное тепловое расширение для погрешности измерения
Введение
Температурное линейное расширение является источником неопределенности, который необходимо учитывать при выполнении размерных и механических испытаний или калибровок.
Как правило, это влияет на результаты измерения, связанные с длиной или смещением. Однако это также может повлиять на результаты измерений в следующих категориях:
- Давление
- Крутящий момент
- Поток
- Объем
- Площадь
При оценке теплового расширения большинство людей знают, как найти коэффициент теплового линейного расширения. Однако у многих людей возникают проблемы с применением его к результатам измерений.
Однако у многих людей возникают проблемы с применением его к результатам измерений.
Итак, я решил создать руководство, которое научит вас всему, что вам нужно знать о тепловом линейном расширении и о том, как оно влияет на результаты ваших измерений.
В этом руководстве вы узнаете:
- Что такое линейное тепловое расширение
- Почему важно линейное тепловое расширение
- Когда включать тепловое расширение в свой бюджет
- Как уменьшить тепловое расширение
- Формула линейного теплового расширения
- Как рассчитать линейное тепловое расширение (шаг за шагом)
- Примеры линейного теплового расширения
Щелкните здесь, чтобы бесплатно загрузить калькулятор теплового расширения!
Что такое линейное тепловое расширение
Согласно Engineering ToolBox, когда объект нагревается или охлаждается, его длина изменяется на величину, пропорциональную исходной длине и изменению температуры.
Согласно Merriam-Webster, тепловое расширение — это увеличение линейных размеров твердого тела или объема жидкости из-за изменения температуры.
Следовательно, это изменение размерных свойств объекта при изменении температуры.
Если вы выполняете размерные и механические испытания или калибровку, вы можете принять во внимание тепловое расширение при оценке погрешности измерения. Скорее всего, это влияет на результаты ваших измерений и должно быть включено в ваш бюджет неопределенности.
Почему важно тепловое расширение
Тепловое расширение важно, поскольку оно может повлиять на результаты ваших измерений. Кроме того, это может повлиять на качество результатов измерений вашего клиента.
В мире, где требуются более жесткие допуски, ошибки теплового расширения могут существенно повлиять на соответствие спецификациям.
Если вы не учитываете его последствия, вы предоставляете своим клиентам плохие результаты измерений, которые могут повлиять на качество их продуктов и услуг. Кроме того, игнорирование этих ошибок может увеличить риск возникновения ложного принятия или ложного отклонения в ваших заявлениях о соответствии.
Кроме того, игнорирование этих ошибок может увеличить риск возникновения ложного принятия или ложного отклонения в ваших заявлениях о соответствии.
В зависимости от деловой активности вашего клиента, плохие результаты измерения могут увеличить риск возникновения проблем, повреждений и незапланированных простоев. Хуже того, это может повлиять на здоровье и безопасность людей.
Согласно недавнему исследованию Vanson Bourne, 23% всех незапланированных простоев на производстве являются результатом человеческой ошибки.
Это может повлиять на следующие измерения:
- Давление (изменение объема и площади)
- Крутящий момент (изменение радиуса)
- Расход (изменение объема и площади)
- Скорость / Скорость (изменение длины / расстояния)
- Энергия (изменение длины / расстояния)
- Объем (изменение длины, ширины и высоты)
- Площадь (изменение длины и ширины)
Когда включать тепловое расширение в ваш бюджет неопределенности
Вы должны включить тепловое расширение в свои бюджеты неопределенности, когда:
- его влияние считается значительным, или
- результат измерения не исправлен.

Обычно погрешность теплового линейного расширения влияет на размерные и механические системы измерения. Однако это не всегда учитывается в бюджете неопределенности.
Если тепловое расширение составляет пять процентов (5%) или более от общей неопределенности, то оно считается значительным и должно быть включено в ваш бюджет неопределенности.
Если эффект оценивается менее чем в 5%, его можно не включать в свой бюджет.
Если вы примете во внимание расширение при проведении испытаний или калибровок, то вы можете исключить его из бюджета неопределенности.Если вы не исправите его во время теста или калибровки, я рекомендую вам включить его в свой анализ неопределенности.
Тем не менее, я всегда рекомендую включать общие источники неопределенности в ваш бюджет, даже если вы даете ему нулевое значение. Просто не забудьте включить примечания, объясняющие, почему это было или не было учтено в анализе. Это поможет вам и оценщикам понять ваши бюджеты неопределенности.
Как уменьшить тепловое расширение
Есть несколько способов уменьшить эффект теплового расширения.Вы можете попробовать:
- Уменьшить контакт / воздействие источников тепла,
- Контроль за окружающей средой,
- Разрешить термостабилизацию и / или
- Поправка на тепловое расширение
Прикосновение к предмету может передать тепло вашего тела этому предмету, вызывая тепловое расширение. Кроме того, размещение предмета рядом с источником тепла, радиатором или источником охлаждения может изменить температуру предмета, что приведет к его расширению или сжатию.
Если вы можете уменьшить контакт или воздействие источников тепла, вы можете уменьшить эффект теплового расширения.
Старайтесь избегать:
- Тепло тела,
- Оборудование, вырабатывающее тепло,
- Окна,
- Солнечный свет,
- вентиляционные отверстия HVAC и
- Объекты с другой температурой
На изображении ниже вы видите, как два объекта с разной температурой соприкасаются. Тепло течет от более теплого объекта к более холодному (1-й закон термодинамики), пока они не достигнут теплового равновесия. Чем больше разница температур, тем больше скорость теплового потока.
Тепло течет от более теплого объекта к более холодному (1-й закон термодинамики), пока они не достигнут теплового равновесия. Чем больше разница температур, тем больше скорость теплового потока.
Чтобы уменьшить эффекты теплового расширения, избегайте контакта с предметами, имеющими разную температуру.
Еще один способ уменьшить тепловые эффекты — контролировать окружающую среду. Хорошо кондиционированная среда снизит теплопередачу и поможет предмету поддерживать стабильную температуру, что уменьшит тепловое расширение.
Кроме того, вы можете свести к минимуму тепловые эффекты, позволив объекту термически стабилизироваться в окружающей среде, в которой он будет тестироваться или откалиброваться.Если вы позволите предмету достичь теплового равновесия с окружающей средой, это уменьшит эффект теплового расширения.
Наконец, вы всегда можете исправить термически вызванные ошибки, чтобы минимизировать влияние на результаты ваших измерений. Убедитесь, что вы контролируете температуру предмета, а не только температуру окружающей среды. Температура воздуха может меняться быстрее, чем температура предмета. Итак, следите за температурой предмета или принимайте во внимание коэффициент теплопроводности материала, чтобы оценить тепловые эффекты, вызванные изменениями температуры воздуха.
Температура воздуха может меняться быстрее, чем температура предмета. Итак, следите за температурой предмета или принимайте во внимание коэффициент теплопроводности материала, чтобы оценить тепловые эффекты, вызванные изменениями температуры воздуха.
Формула линейного теплового расширения
Расчет эффектов теплового линейного расширения несложен. Есть только несколько переменных, которые вам нужно знать, чтобы выполнить расчет. Эти факторы:
Не всегда легко найти точный коэффициент теплового расширения, связанный с исследуемым материалом. Лучшая рекомендация, которую я могу вам дать, — это связаться с производителем объекта, который вы оцениваете, чтобы узнать фактический состав материала и коэффициент расширения.
В противном случае вам, возможно, придется поискать ближайшее значение в справочной таблице.
Используйте приведенную ниже формулу для расчета теплового линейного расширения. Результат можно использовать для оценки теплового воздействия на погрешность измерения.
Как рассчитать линейное тепловое расширение
Следуйте инструкциям ниже, чтобы рассчитать тепловое линейное расширение по формуле из предыдущего раздела.
Шаг 1. Найдите исходную длину объекта
Для этого процесса, давайте оценим тепловое линейное расширение 1-дюймового калибра.
Если вы загружаете калькулятор, связанный с этим руководством, введите исходную длину объекта. Используйте изображение ниже в качестве руководства.
Шаг 2. Найти коэффициент теплового линейного расширения
Чтобы узнать коэффициент теплового линейного расширения, обратитесь к опубликованным производителем характеристикам.Если вы не можете найти его, попробуйте использовать справочную таблицу, чтобы получить приблизительное значение.
Затем введите в калькулятор коэффициент теплового линейного расширения. Используйте изображение ниже в качестве руководства.
Используйте изображение ниже в качестве руководства.
Шаг 3. Найдите начальную температуру
Теперь отслеживайте и записывайте температуру объектов, прежде чем начинать тестирование или калибровку. Это будет начальная температура.
Затем введите начальную температуру в калькулятор.Используйте изображение ниже в качестве руководства.
Шаг 4. Найдите конечную температуру
После завершения теста или калибровки запишите окончательную температуру. Затем введите конечную температуру в калькулятор. Используйте изображение ниже в качестве руководства.
Шаг 5. Рассчитайте изменение длины
Затем вычислите тепловое линейное расширение по формуле из предыдущего раздела.Чтобы упростить задачу, я разбил процесс в соответствии с порядком математических операций.
5а. Рассчитать изменение температуры
Чтобы рассчитать изменение температуры, вычтите конечную температуру из начальной температуры.
5б. Умножить на коэффициент теплового линейного расширения
Затем умножьте результат шага 5а на коэффициент теплового линейного расширения.
5с. Умножить на исходную длину
Теперь умножьте результат шага 5b на исходную длину. Результатом должно быть изменение длины объекта из-за изменений температуры.
Шаг 6. Проверьте результат
Наконец, дважды проверьте свою работу и убедитесь, что результат правильный.
Шаг 7.Рассчитайте коэффициент чувствительности (необязательно)
Если вы предпочитаете использовать коэффициенты чувствительности в своих бюджетах неопределенности, разделите изменение длины объекта (Uy) на изменение температуры (Ux). Это даст вам коэффициент чувствительности.
Теперь вы можете добавить коэффициент чувствительности и изменение температуры в свой бюджет неопределенности.
Использование коэффициентов чувствительности может оказаться полезным, если вам нужно обновить свой бюджет неопределенности.Вы можете просто обновить изменение температуры (Ux).
Общие примеры линейного теплового расширения
Пример 1. Изменение температуры во время испытания / калибровки
Одним из наиболее распространенных источников неопределенности для линейного теплового расширения является изменение температуры во время испытаний или калибровки.
Представьте, что вы калибруете штангенциркуль с 1-дюймовым измерительным блоком из нержавеющей стали. Когда вы начинаете калибровку, температура составляет 20 ° C.Когда вы закончите калибровку, температура изменилась на 20,2 ° C.
Используя уравнение теплового линейного расширения, вы обнаружите, что фактическая длина измерительного блока изменилась на 2,2 микродюйма.
Если вы не исправите это во время тестирования или калибровки, вам следует рассмотреть возможность добавления этого источника неопределенности в свой бюджет неопределенности.
Пример 2. Разница температур между использованием и последней калибровкой
Еще одним распространенным источником неопределенности для теплового линейного расширения является разница в температуре между средой, в которой калибруется элемент, и средой, в которой он используется.
Представьте, что вы калибруете штангенциркуль с 1-дюймовым измерительным блоком из нержавеющей стали. Когда вы выполняете калибровку, температура составляет 21 ° C. Однако измерительный блок был откалиброван при 20 ° C.
Используя уравнение теплового линейного расширения, вы обнаружите, что фактическая длина измерительного блока изменилась на 10,8 микродюймов.
Если вы не исправите это во время тестирования или калибровки, вам следует рассмотреть возможность добавления этого источника неопределенности в свой бюджет неопределенности.
Заключение
Тепловое расширение может повлиять на результаты ваших измерений. Это источник неопределенности, который вам следует включить в свои бюджеты неопределенности, если:
Это источник неопределенности, который вам следует включить в свои бюджеты неопределенности, если:
- Вы выполняете размерные или механические испытания или калибровку,
- Эффект значительный, и / или
- Эффект не исправлен.
Когда требуются более жесткие допуски, важно более высокое качество измерений. Поэтому источники неопределенности измерения, такие как тепловое расширение, необходимо учитывать в результатах ваших измерений и сводить к минимуму, где это возможно.
Из этого руководства вы должны были изучить формулу теплового линейного расширения, как рассчитать линейное расширение и как включить его в свои бюджеты неопределенности.
Попробуйте добавить его в свой бюджет неопределенности в следующий раз и дайте мне знать, как это повлияло на результаты ваших измерений.
Щелкните здесь, чтобы бесплатно загрузить калькулятор теплового расширения!
Влияние температуры на равновесие
Изменение температуры происходит, когда температура повышается или понижается за счет потока тепла. Это смещает химическое равновесие в сторону продуктов или реагентов, что можно определить, изучая реакцию и решая, является ли она эндотермической или экзотермической.
Это смещает химическое равновесие в сторону продуктов или реагентов, что можно определить, изучая реакцию и решая, является ли она эндотермической или экзотермической.
Введение
Принцип Ле Шателье гласит, что изменение температуры, давления или концентрации реагентов в уравновешенной системе будет стимулировать реакцию, которая частично компенсирует изменение, чтобы установить новое равновесие. В случае изменения температуры добавление или удаление тепла сдвигает равновесие.Обычно химические реакции пишутся так, чтобы не учитывать поток тепла в реакции. Например, приведенное ниже химическое уравнение, описывающее окисление углерода с образованием монооксида углерода, содержит всю информацию, касающуюся вещества и связи:
\ [\ ce {2C (s) + O_2 (g) -> 2CO (g)} \ nonumber \]
Однако реакции неизменно включают изменения энтальпии, при этом энергия (обычно в виде тепловой энергии через тепло) либо поглощается, либо выделяется во время реакции.Более полная реакция будет записана как
.
\ [\ ce {2C (s) + O2 (g) -> 2CO (g) + тепло} \ nonumber \]
Теплота реакции
Теплота реакции — это изменение энтальпии химической реакции. В эндотермических реакциях , (\ (ΔH> 0 \)) тепловая энергия поглощается посредством реакции. Другой способ взглянуть на эндотермические реакции состоит в том, что для преодоления сил притяжения между молекулами и отделения их друг от друга (энергия активации) требуется больше (тепловой) энергии, чем (тепловой) выделяется при образовании новых связей.
\ [\ ce {тепло + 6CO2 (г) + 6h3O (л) <=> C6h22O6 (водн.) + 6O2 (г)} \ nonumber \]
В экзотермических реакциях (\ (ΔH <0 \)) тепловая энергия является общей для реакции. Когда образуются новые связи, выделяется больше тепловой энергии, необходимой для разрыва связей в реагентах. В этой химической реакции
\ [\ ce {CaO (s) + h3O (l) <=> Ca (OH) 2 (s) + тепло} \]
прямая реакция экзотермична, поскольку энергия выделяется, когда \ (\ ce {CaO (s)} \) и \ (\ ce {h3O (l)} \) объединяются с образованием \ (\ ce {Ca (OH) 2 ( s)} \). Энергия разрыва связей в \ (\ ce {CaO (s)} \) и \ (\ ce {h3O (l)} \) в левой части уравнения меньше энергии, высвобождаемой при образовании \ ( \ ce {Ca (OH) 2 \; (s)} \) в правой части уравнения; чистая разница составляет тепла в правой части уравнения.
Энергия разрыва связей в \ (\ ce {CaO (s)} \) и \ (\ ce {h3O (l)} \) в левой части уравнения меньше энергии, высвобождаемой при образовании \ ( \ ce {Ca (OH) 2 \; (s)} \) в правой части уравнения; чистая разница составляет тепла в правой части уравнения.
Пример \ (\ PageIndex {1} \)
В реакции окисления
\ [\ ce {CaO (s) + h3O (l) <=> Ca (OH) 2 (s) + тепло} \ nonumber \]
Повышение температуры способствует протеканию реакции , обратной (эндотермической) и аналогично Понижение температуры способствует протеканию реакции вперед (экзотермической)
Пример \ (\ PageIndex {2} \)
В реакции
\ [\ ce {2C (s) + O2 (g) <=> 2CO (g) + тепло} \ nonumber \]
Принцип Ле Шателье объясняет, что реакция протекает таким образом, чтобы противодействовать изменению температуры.Экзотермическая реакция будет способствовать обратной реакции, напротив побочного тепла (обратное верно для эндотермических реакций; реакция будет протекать в прямой реакции)
Хотя это технически некорректно, если тепло рассматривается как продукт в вышеуказанной реакции, тогда становится ясно, что при повышении температуры равновесие сместится влево (с использованием принципа Ле Шателье). Если температура понижается, реакция будет продолжаться, и будет выделяться больше тепла (которого не хватает).Влияние температуры на равновесие также изменит значение константы равновесия.
Если температура понижается, реакция будет продолжаться, и будет выделяться больше тепла (которого не хватает).Влияние температуры на равновесие также изменит значение константы равновесия.
Проблемы
- Если к уравнению фазового перехода при равновесии от твердого вещества к жидкости добавить тепло, в каком направлении пойдет реакция?
- На какой стороне происходит тепло в этой реакции (фотосинтез): \ [6CO_ {2 (g)} + 6H_2O _ {(l)} \ rightleftharpoons C_ {6} H_ {12} O_ {6 (aq)} + 6O_ {2 (g)} \]
- Поглощается или выделяется тепло при реакции горения?
- В этой реакции: \ [H_ {2} O _ {(l)} \ rightleftharpoons H_ {2} O _ {(g)} \], как можно манипулировать условиями для создания большего количества \ (H_2O _ {(l)} \) ?
- Объясните, как определить, является ли реакция экзотермической или эндотермической.
Решения
- Реакция будет переходить в жидкую фазу.
- Тепло находится на стороне реагента в уравнении.

- При реакции горения выделяется тепло.
- Понижение температуры сместит равновесие влево, создавая больше жидкой воды.
- При экзотермической реакции выделяется тепло, а при эндотермической реакции выделяется тепло.
Список литературы
- Петруччи и др.Общая химия: принципы и современные приложения; Девятое издание. Пирсон / Прентис Холл; Аппер-Сэдл-Ривер, Нью-Джерси 07.
Авторы и авторство
- Карисса Пулидо (UCD), Карлин Чаппелл (UCD), Эйлин Макдафф (UCD)
Изменение температуры и теплоемкость
Цели обучения
К концу этого раздела вы сможете:
- Наблюдать за теплопередачей, а также за изменением температуры и массы.
- Расчет конечной температуры после передачи тепла между двумя объектами.
Одним из основных эффектов теплопередачи является изменение температуры: нагрев увеличивает температуру, а охлаждение снижает ее. Мы предполагаем, что фазового перехода нет и что система не выполняет никаких работ. Эксперименты показывают, что передаваемое тепло зависит от трех факторов: изменения температуры, массы системы, а также вещества и фазы вещества.
Мы предполагаем, что фазового перехода нет и что система не выполняет никаких работ. Эксперименты показывают, что передаваемое тепло зависит от трех факторов: изменения температуры, массы системы, а также вещества и фазы вещества.
Рисунок 1.Тепло Q , передаваемое для изменения температуры, зависит от величины изменения температуры, массы системы, а также вещества и фазы. (а) Количество переданного тепла прямо пропорционально изменению температуры. Чтобы удвоить изменение температуры массы m, вам нужно добавить вдвое больше тепла. (б) Количество передаваемого тепла также прямо пропорционально массе. Чтобы вызвать эквивалентное изменение температуры в удвоенной массе, вам нужно добавить в два раза больше тепла.(c) Количество передаваемого тепла зависит от вещества и его фазы. Если требуется количество Q тепла, чтобы вызвать изменение температуры Δ T в данной массе меди, потребуется в 10,8 раза больше тепла, чтобы вызвать эквивалентное изменение температуры в той же массе воды, при условии отсутствия фазы изменение любого вещества.
Зависимость от изменения температуры и массы легко понять. В связи с тем, что (средняя) кинетическая энергия атома или молекулы пропорциональна абсолютной температуре, внутренняя энергия системы пропорциональна абсолютной температуре и количеству атомов или молекул.Благодаря тому, что переданное тепло равно изменению внутренней энергии, тепло пропорционально массе вещества и изменению температуры. Передаваемое тепло также зависит от вещества, так что, например, для повышения температуры требуется меньше тепла, чем для воды. Для одного и того же вещества передаваемое тепло также зависит от фазы (газ, жидкость или твердое тело).
Теплопередача и изменение температуры
Количественная связь между теплопередачей и изменением температуры включает все три фактора: Q = mc Δ T , где Q — символ теплопередачи, m — масса вещества и Δ T — изменение температуры.Обозначение c означает удельную теплоемкость и зависит от материала и фазы. Удельная теплоемкость — это количество тепла, необходимое для изменения температуры 1,00 кг массы на 1,00 ° C. Удельная теплоемкость c — это свойство вещества; его единица СИ — Дж / (кг К) или Дж / (кг ºC). Напомним, что изменение температуры (Δ T ) одинаково в единицах кельвина и градусов Цельсия. Если теплопередача измеряется в килокалориях, то единица удельной теплоемкости — ккал / (кг ⋅ ºC).
Удельная теплоемкость — это количество тепла, необходимое для изменения температуры 1,00 кг массы на 1,00 ° C. Удельная теплоемкость c — это свойство вещества; его единица СИ — Дж / (кг К) или Дж / (кг ºC). Напомним, что изменение температуры (Δ T ) одинаково в единицах кельвина и градусов Цельсия. Если теплопередача измеряется в килокалориях, то единица удельной теплоемкости — ккал / (кг ⋅ ºC).
Значения удельной теплоемкости обычно нужно искать в таблицах, потому что нет простого способа их вычислить. Как правило, удельная теплоемкость также зависит от температуры. В таблице 1 приведены типичные значения теплоемкости для различных веществ. За исключением газов, температурная и объемная зависимость удельной теплоемкости большинства веществ слабая. Из этой таблицы видно, что удельная теплоемкость воды в пять раз больше, чем у стекла и в десять раз больше, чем у железа, что означает, что требуется в пять раз больше тепла, чтобы поднять температуру воды на такую же величину, что и у стекла, и в десять раз больше. много тепла для повышения температуры воды, как для утюга.Фактически, вода имеет одну из самых высоких удельных теплоемкостей среди всех материалов, что важно для поддержания жизни на Земле.
много тепла для повышения температуры воды, как для утюга.Фактически, вода имеет одну из самых высоких удельных теплоемкостей среди всех материалов, что важно для поддержания жизни на Земле.
Пример 1. Расчет необходимого тепла: нагрев воды в алюминиевой кастрюле
Алюминиевая кастрюля массой 0,500 кг на плите используется для нагрева 0,250 литра воды с 20,0 ° C до 80,0 ° C. а) Сколько тепла требуется? Какой процент тепла используется для повышения температуры (б) сковороды и (в) воды?
Стратегия
Кастрюля и вода всегда имеют одинаковую температуру.Когда вы ставите кастрюлю на плиту, температура воды и кастрюли повышается на одинаковую величину. Мы используем уравнение теплопередачи для данного изменения температуры и массы воды и алюминия. Значения удельной теплоемкости воды и алюминия приведены в таблице 1.
Решение
Поскольку вода находится в тепловом контакте с алюминием, кастрюля и вода имеют одинаковую температуру.
Рассчитать разницу температур:
Δ T = T f — T i = 60. 0ºC.
0ºC.
Рассчитайте массу воды. Поскольку плотность воды составляет 1000 кг / м 3 , один литр воды имеет массу 1 кг, а масса 0,250 литра воды составляет м w = 0,250 кг.
Рассчитайте тепло, передаваемое воде. Используйте удельную теплоемкость воды в таблице 1:
Q w = м w c w Δ T = (0,250 кг) (4186 Дж / кгºC) (60,0ºC) = 62.8 кДж.
Рассчитайте тепло, передаваемое алюминию. Используйте удельную теплоемкость алюминия в таблице 1:
. Q Al = м Al c Al Δ T = (0,500 кг) (900 Дж / кгºC) (60,0ºC) = 27,0 × 10 4 Дж = 27,0 кДж . <
Сравните процент тепла, поступающего в сковороду, и в воду. Сначала найдите общее переданное тепло:
Q Итого = Q w + Q Al = 62. 8 кДж + 27,0 кДж = 89,8 кДж.
8 кДж + 27,0 кДж = 89,8 кДж.
Таким образом, количество тепла, идущего на нагревание сковороды, равно
. [латекс] \ frac {27.0 \ text {kJ}} {89.8 \ text {kJ}} \ times100 \% = 30.1 \% \\ [/ latex]
, а на нагрев воды —
. [латекс] \ frac {62,8 \ text {кДж}} {89,8 \ text {кДж}} \ times100 \% = 69,9 \% \\ [/ latex].
Обсуждение
В этом примере тепло, передаваемое контейнеру, составляет значительную долю от общего переданного тепла. Хотя вес кастрюли в два раза больше, чем у воды, удельная теплоемкость воды в четыре раза больше, чем у алюминия.Следовательно, для достижения заданного изменения температуры воды требуется чуть более чем в два раза больше тепла по сравнению с алюминиевым поддоном.
Пример 2. Расчет повышения температуры в результате работы, проделанной с веществом: перегрев тормозов грузовика на спуске
Рис. 2. Дымящиеся тормоза этого грузовика — видимое свидетельство механического эквивалента тепла.
Тормоза грузовика, используемые для управления скоростью на спуске, работают, преобразуя гравитационную потенциальную энергию в повышенную внутреннюю энергию (более высокую температуру) тормозного материала. Это преобразование предотвращает преобразование потенциальной гравитационной энергии в кинетическую энергию грузовика. Проблема в том, что масса грузовика велика по сравнению с массой тормозного материала, поглощающего энергию, и повышение температуры может происходить слишком быстро, чтобы тепло передавалось от тормозов в окружающую среду.
Это преобразование предотвращает преобразование потенциальной гравитационной энергии в кинетическую энергию грузовика. Проблема в том, что масса грузовика велика по сравнению с массой тормозного материала, поглощающего энергию, и повышение температуры может происходить слишком быстро, чтобы тепло передавалось от тормозов в окружающую среду.
Рассчитайте повышение температуры 100 кг тормозного материала со средней удельной теплоемкостью 800 Дж / кг ºC, если материал сохраняет 10% энергии от грузовика массой 10 000 кг, спускающегося 75.0 м (при вертикальном перемещении) с постоянной скоростью.
Стратегия
Если тормоза не применяются, потенциальная гравитационная энергия преобразуется в кинетическую энергию. При срабатывании тормозов потенциальная гравитационная энергия преобразуется во внутреннюю энергию тормозного материала. Сначала мы вычисляем гравитационную потенциальную энергию ( Mgh ), которую весь грузовик теряет при спуске, а затем находим повышение температуры, возникающее только в тормозном материале.
Решение
- Рассчитайте изменение гравитационной потенциальной энергии при спуске грузовика Mgh = (10,000 кг) (9.{\ circ} C \\ [/ латекс].
Обсуждение
Эта температура близка к температуре кипения воды. Если бы грузовик ехал какое-то время, то непосредственно перед спуском температура тормозов, вероятно, была бы выше температуры окружающей среды. Повышение температуры при спуске, скорее всего, приведет к повышению температуры тормозного материала выше точки кипения воды, поэтому этот метод нецелесообразен. Однако та же самая идея лежит в основе недавней гибридной технологии автомобилей, где механическая энергия (гравитационная потенциальная энергия) преобразуется тормозами в электрическую энергию (аккумулятор).
Таблица 1. Удельная теплоемкость различных веществ Вещества Удельная теплоемкость ( c ) Твердые вещества Дж / кг ⋅ ºC ккал / кг ⋅ ºC Алюминий 900 0,215 Асбест 800 0,19 Бетон, гранит (средний) 840 0. 20
20 Медь 387 0,0924 Стекло 840 0,20 Золото 129 0,0308 Человеческое тело (в среднем при 37 ° C) 3500 0,83 Лед (в среднем, от −50 ° C до 0 ° C) 2090 0,50 Чугун, сталь 452 0,108 Свинец 128 0.0305 Серебро 235 0,0562 Дерево 1700 0,4 Жидкости Бензол 1740 0,415 Этанол 2450 0,586 Глицерин 2410 0,576 Меркурий 139 0,0333 Вода (15. 0 ° С)
0 ° С) 4186 1.000 Газы Воздух (сухой) 721 (1015) 0,172 (0,242) Аммиак 1670 (2190) 0,399 (0,523) Двуокись углерода 638 (833) 0,152 (0,199) Азот 739 (1040) 0,177 (0,248) Кислород 651 (913) 0.156 (0,218) Пар (100 ° C) 1520 (2020) 0,363 (0,482)
Обратите внимание, что Пример 2 является иллюстрацией механического эквивалента тепла. В качестве альтернативы повышение температуры может быть произведено с помощью паяльной лампы, а не механически.
Пример 3. Расчет конечной температуры при передаче тепла между двумя телами: заливка холодной воды в горячую кастрюлю
Допустим, вы залили 0,250 кг 20. 0ºC воды (около чашки) в алюминиевую кастрюлю весом 0,500 кг, снятую с плиты, при температуре 150ºC. Предположим, что поддон стоит на изолированной подушке и выкипает незначительное количество воды. Какова температура, когда вода и поддон через короткое время достигают теплового равновесия?
0ºC воды (около чашки) в алюминиевую кастрюлю весом 0,500 кг, снятую с плиты, при температуре 150ºC. Предположим, что поддон стоит на изолированной подушке и выкипает незначительное количество воды. Какова температура, когда вода и поддон через короткое время достигают теплового равновесия?
Стратегия
Сковорода помещается на изолирующую подкладку, так что теплообмен с окружающей средой не происходит. Изначально кастрюля и вода не находятся в тепловом равновесии: кастрюля имеет более высокую температуру, чем вода.Затем теплообмен восстанавливает тепловое равновесие, когда вода и поддон соприкасаются. Поскольку теплопередача между поддоном и водой происходит быстро, масса испарившейся воды незначительна, а величина тепла, теряемого поддоном, равна теплу, полученному водой. Обмен тепла прекращается, когда достигается тепловое равновесие между кастрюлей и водой. Теплообмен можно записать как | Q горячий | = Q холодный .
Решение
Используйте уравнение для теплопередачи Q = mc Δ T , чтобы выразить тепло, теряемое алюминиевой сковородой, через ее массу, удельную теплоемкость алюминия, начальную температуру сковороды и конечная температура: Q горячий = м Al c Al ( T f — 150ºC).
Выразите тепло, полученное водой, через массу воды, удельную теплоемкость воды, начальную температуру воды и конечную температуру: Q холодная = м W c W ( T f — 20,0 ° C).
Обратите внимание, что Q hot <0 и Q cold > 0 и что они должны быть в сумме равными нулю, потому что тепло, теряемое горячей сковородой, должно быть таким же, как тепло, получаемое холодной водой:
[латекс] \ begin {array} {lll} Q _ {\ text {cold}} + Q _ {\ text {hot}} & = & 0 \\ Q _ {\ text {cold}} & = & — Q _ {\ text {hot}} \\ m _ {\ text {W}} c _ {\ text {W}} \ left (T _ {\ text {f}} — 20.{\ circ} \ text {C} \ end {array} \\ [/ latex]
Обсуждение
Это типичная проблема калориметрии — два тела при разных температурах приводят в контакт друг с другом и обмениваются теплом, пока не будет достигнута общая температура. Почему конечная температура намного ближе к 20,0ºC, чем к 150ºC? Причина в том, что вода имеет большую удельную теплоемкость, чем большинство обычных веществ, и поэтому претерпевает небольшое изменение температуры при данной теплопередаче. Большой водоем, например озеро, требует большого количества тепла для значительного повышения температуры.Это объясняет, почему температура в озере остается относительно постоянной в течение дня, даже когда изменение температуры воздуха велико. Однако температура воды действительно меняется в течение длительного времени (например, с лета на зиму).
Почему конечная температура намного ближе к 20,0ºC, чем к 150ºC? Причина в том, что вода имеет большую удельную теплоемкость, чем большинство обычных веществ, и поэтому претерпевает небольшое изменение температуры при данной теплопередаче. Большой водоем, например озеро, требует большого количества тепла для значительного повышения температуры.Это объясняет, почему температура в озере остается относительно постоянной в течение дня, даже когда изменение температуры воздуха велико. Однако температура воды действительно меняется в течение длительного времени (например, с лета на зиму).
Эксперимент на вынос: изменение температуры земли и воды
Что нагревается быстрее, земля или вода?
Для изучения разницы в теплоемкости:
- Поместите равные массы сухого песка (или почвы) и воды одинаковой температуры в две небольшие банки.(Средняя плотность почвы или песка примерно в 1,6 раза больше плотности воды, поэтому вы можете получить примерно равную массу, используя на 50% больше воды по объему.
 )
) - Нагрейте оба (в духовке или нагревательной лампе) одинаковое время.
- Запишите конечную температуру двух масс.
- Теперь доведите обе банки до одинаковой температуры, нагревая в течение более длительного периода времени.
- Снимите банки с источника тепла и измеряйте их температуру каждые 5 минут в течение примерно 30 минут.
Какой образец остывает быстрее всего? Эта деятельность воспроизводит явления, ответственные за дующий с суши и морской бриз.
Проверьте свое понимание
Если 25 кДж необходимо для повышения температуры блока с 25ºC до 30ºC, сколько тепла необходимо для нагрева блока с 45ºC до 50ºC?
Решение
Теплопередача зависит только от разницы температур. Поскольку разница температур в обоих случаях одинакова, во втором случае необходимы те же 25 кДж.
Сводка раздела
- Передача тепла Q , которая приводит к изменению Δ T температуры тела массой м составляет Q = mc Δ T , где c — удельная теплоемкость материала.
 Это соотношение также можно рассматривать как определение удельной теплоемкости.
Это соотношение также можно рассматривать как определение удельной теплоемкости.
Концептуальные вопросы
- Какие три фактора влияют на теплопередачу, необходимую для изменения температуры объекта?
- Тормоза в автомобиле повышают температуру на Δ T при остановке автомобиля со скорости v .Насколько больше было бы Δ T , если бы автомобиль изначально имел вдвое большую скорость? Вы можете предположить, что автомобиль останавливается достаточно быстро, чтобы не отводить тепло от тормозов.
Задачи и упражнения
- В жаркий день температура в бассейне объемом 80 000 л повышается на 1,50ºC. Какова чистая теплопередача при этом нагреве? Игнорируйте любые осложнения, такие как потеря воды из-за испарения.
- Докажите, что 1 кал / г · ºC = 1 ккал / кг · ºC.
- Для стерилизации 50.Стеклянная детская бутылочка 0 г, мы должны поднять ее температуру с 22,0 ° С до 95,0 ° С. Какая требуется теплопередача?
- Одинаковая передача тепла идентичным массам разных веществ вызывает различные изменения температуры.
 Рассчитайте конечную температуру, когда 1,00 ккал тепла передается 1,00 кг следующих веществ, первоначально при 20,0 ° C: (a) вода; (б) бетон; (в) сталь; и (d) ртуть.
Рассчитайте конечную температуру, когда 1,00 ккал тепла передается 1,00 кг следующих веществ, первоначально при 20,0 ° C: (a) вода; (б) бетон; (в) сталь; и (d) ртуть. - Потирание рук согревает их, превращая работу в тепловую энергию. Если женщина потирает руки взад и вперед в общей сложности 20 движений, на расстоянии 7.50 см на руб, а при средней силе трения 40,0 Н, что такое повышение температуры? Масса согреваемых тканей всего 0,100 кг, преимущественно в ладонях и пальцах.
- Блок чистого материала массой 0,250 кг нагревается с 20,0 ° C до 65,0 ° C путем добавления 4,35 кДж энергии. Вычислите его удельную теплоемкость и определите вещество, из которого он, скорее всего, состоит.
- Предположим, что одинаковые количества тепла передаются различным массам меди и воды, вызывая одинаковые изменения температуры.Какое отношение массы меди к воде?
- (a) Количество килокалорий в пище определяется методами калориметрии, при которых пища сжигается и измеряется степень теплообмена.
 Сколько килокалорий на грамм содержится в арахисе весом 5,00 г, если энергия его горения передается 0,500 кг воды, содержащейся в алюминиевой чашке весом 0,100 кг, что вызывает повышение температуры на 54,9 ° C? (b) Сравните свой ответ с информацией на этикетке, найденной на упаковке арахиса, и прокомментируйте, согласуются ли значения.
Сколько килокалорий на грамм содержится в арахисе весом 5,00 г, если энергия его горения передается 0,500 кг воды, содержащейся в алюминиевой чашке весом 0,100 кг, что вызывает повышение температуры на 54,9 ° C? (b) Сравните свой ответ с информацией на этикетке, найденной на упаковке арахиса, и прокомментируйте, согласуются ли значения. - После интенсивных упражнений температура тела человека весом 80,0 кг составляет 40,0 ° C. С какой скоростью в ваттах человек должен передавать тепловую энергию, чтобы снизить температуру тела до 37,0ºC за 30,0 мин, если тело продолжает вырабатывать энергию со скоростью 150 Вт? 1 Вт = 1 джоуль / сек или 1 Вт = 1 Дж / сек.
- Даже при останове после периода нормальной эксплуатации большой промышленный ядерный реактор передает тепловую энергию со скоростью 150 МВт за счет радиоактивного распада продуктов деления.Эта теплопередача вызывает быстрое повышение температуры в случае отказа системы охлаждения (1 Вт = 1 джоуль / сек или 1 Вт = 1 Дж / с и 1 МВт = 1 мегаватт).
 (a) Рассчитайте скорость повышения температуры в градусах Цельсия в секунду (ºC / s), если масса активной зоны реактора составляет 1,60 × 10 5 кг, а ее средняя удельная теплоемкость составляет 0,3349 кДж / кг ºC. (b) Сколько времени потребуется, чтобы получить повышение температуры на 2000ºC, которое может привести к расплавлению некоторых металлов, содержащих радиоактивные материалы? (Начальная скорость повышения температуры будет больше, чем рассчитанная здесь, потому что теплопередача сосредоточена в меньшей массе.Позже, однако, рост температуры замедлится, поскольку стальная защитная оболочка 5 × 10 5 кг также начнет нагреваться.)
(a) Рассчитайте скорость повышения температуры в градусах Цельсия в секунду (ºC / s), если масса активной зоны реактора составляет 1,60 × 10 5 кг, а ее средняя удельная теплоемкость составляет 0,3349 кДж / кг ºC. (b) Сколько времени потребуется, чтобы получить повышение температуры на 2000ºC, которое может привести к расплавлению некоторых металлов, содержащих радиоактивные материалы? (Начальная скорость повышения температуры будет больше, чем рассчитанная здесь, потому что теплопередача сосредоточена в меньшей массе.Позже, однако, рост температуры замедлится, поскольку стальная защитная оболочка 5 × 10 5 кг также начнет нагреваться.)
Рисунок 3. Бассейн с радиоактивным отработавшим топливом на АЭС. Отработанное топливо долгое время остается горячим. (кредит: Министерство энергетики США)
Глоссарий
удельная теплоемкость: количество тепла, необходимое для изменения температуры 1,00 кг вещества на 1,00 ºC
Избранные решения проблем и упражнения
1. 5,02 × 10 8 Дж
5,02 × 10 8 Дж
3. 3.07 × 10 3 Дж
5. 0,171ºC
7. 10,8
9. 617 Вт
Страница 1
% PDF-1.6
%
1 0 obj
>
endobj
1495 0 объект
> поток
Приложение Adobe Acrobat 8.12 Paper Capture Plug-in / pdf
Страница 1 PaperPort http: //www.scansoft.com2008-05-22T17: 57: 59-04: 002008-05-22T17: 57: 59-04: 00uuid: 4c3f311f-3509-4398-8e63-38abb2193cbeuuid: 1206e089-ffb2-4d6c -b3d7-74634cbff596 конечный поток
endobj
3 0 obj
>
endobj
14 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
25 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
36 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
47 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
58 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
69 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
80 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
91 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
102 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
113 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
124 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
135 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
146 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
157 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
168 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
179 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
190 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
201 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
212 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
223 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
234 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
245 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
256 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
267 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
278 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
289 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
300 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
311 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
322 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
333 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
344 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
355 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
366 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
377 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
388 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
399 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
410 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
421 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
432 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
443 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
454 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
465 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
476 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
487 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
498 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
509 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
520 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
531 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
542 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
553 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
564 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
575 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
586 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
597 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
608 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
619 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
630 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
641 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
652 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
663 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
674 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
685 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
696 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
707 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
718 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
729 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageB] >> / Type / Page >>
endobj
728 0 объект
[]
endobj
1494 0 объект
> поток
HW ێ} WyJ1Kb ‹5 / ZCyDYfWS_YSU] uԩ’m% GUctzrxf + W} EojjCYILUv! Uts? = DDX0 2 NdGTmrr0F / O n (BP — +] * hAUhBj: n / zxW8 ^ $ Pike ^
7xwX = {ۭ WHwv 縞> jł> Bs: W1 ޡ ȂVÙHZ% tuO gyv кДж W [o% 8pL> iM) jkc ~ Xjkl (B ,, 89q2Vz̧VĐ
PMV & iT [.

 {T_2}_{T_1}{\triangle C_p\left(T\right)dT}\left(11\right),\]
{T_2}_{T_1}{\triangle C_p\left(T\right)dT}\left(11\right),\]




 С другой стороны, воздействие отрицательных температур приводит к охрупчиванию эпоксидной смолы и увеличению ее эффективной жесткости. Это также может привести к упрочнению матрицы, микротрещинам и ухудшению связи между волокном и матрицей (Karbhari, 2003a). Изменения свойств эпоксидной смолы в результате воздействия температурных условий, как также объяснялось в последнем разделе, могут привести к ухудшению механических свойств композита FRP и сцепления на границах раздела.
С другой стороны, воздействие отрицательных температур приводит к охрупчиванию эпоксидной смолы и увеличению ее эффективной жесткости. Это также может привести к упрочнению матрицы, микротрещинам и ухудшению связи между волокном и матрицей (Karbhari, 2003a). Изменения свойств эпоксидной смолы в результате воздействия температурных условий, как также объяснялось в последнем разделе, могут привести к ухудшению механических свойств композита FRP и сцепления на границах раздела. Между тем, стекловолокно обычно имеет коэффициент 5 × 10 −6 ° C, а углеродные волокна имеют коэффициент в диапазоне от -0,2 × 10 −6 ° C до 0,6 × 10 −6 ° C. С другой стороны, коэффициент теплового расширения глиняных кирпичей составляет порядка 5 × 10 −6 ° C (Kralj et al., 1991). Эта большая разница в коэффициентах расширения создает высокие термические напряжения на границах раздела волокно / матрица и матрица / кирпич, что может привести к расслоению, когда структура находится в условиях тепловых циклов (Karbhari et al., 2003; Холлавей, 2010; Гиасси и др., 2014; Maljaee et al., 2016b). Проблема термической несовместимости усугубляется при использовании углеродных волокон, поскольку эти волокна являются анизотропными с положительным коэффициентом теплового расширения в поперечном направлении и отрицательным коэффициентом в продольном направлении. Обычно это приводит к отслаиванию волокон от окружающей матрицы.
Между тем, стекловолокно обычно имеет коэффициент 5 × 10 −6 ° C, а углеродные волокна имеют коэффициент в диапазоне от -0,2 × 10 −6 ° C до 0,6 × 10 −6 ° C. С другой стороны, коэффициент теплового расширения глиняных кирпичей составляет порядка 5 × 10 −6 ° C (Kralj et al., 1991). Эта большая разница в коэффициентах расширения создает высокие термические напряжения на границах раздела волокно / матрица и матрица / кирпич, что может привести к расслоению, когда структура находится в условиях тепловых циклов (Karbhari et al., 2003; Холлавей, 2010; Гиасси и др., 2014; Maljaee et al., 2016b). Проблема термической несовместимости усугубляется при использовании углеродных волокон, поскольку эти волокна являются анизотропными с положительным коэффициентом теплового расширения в поперечном направлении и отрицательным коэффициентом в продольном направлении. Обычно это приводит к отслаиванию волокон от окружающей матрицы.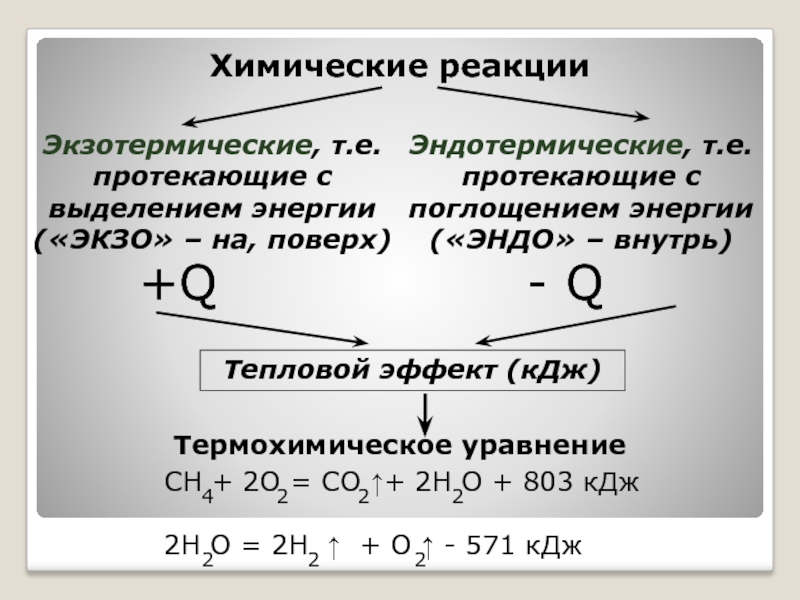 1 Термическая активация при микроволновом облучении
1 Термическая активация при микроволновом облучении перегрев (перегрев) реакционной смеси, который, в частности, может наблюдаться в присутствии большого количества носителей тока (т.е.е., ионы)
значительно более высокая скорость нагрева реакционной смеси, что означает, что необходимая температура для химической реакции достигается за более короткое время
увеличение скорости диффузионных процессов на границах фаз
 Например, в одном из первых опубликованных исследований было замечено, что ряд реакций может быть проведен быстрее при условии, что реакционные смеси помещаются в герметичные сосуды и облучаются в микроволновом резонаторе. Более того, реакции требовали еще более короткого времени реакции, если бы они проводились в растворителях с более низкими температурами кипения. В итоге было показано, что скорость реакций пропорциональна давлению, создаваемому в реакционных сосудах во время облучения [12, 8].В другом примере сокращение времени реакции наблюдали во время синтеза металлоорганических соединений родия (I) и иридия (I), которые обычно получают кипячением реагентов в смеси спиртов и воды в течение нескольких часов. Время реакции во время микроволнового протокола было короче 1 мин. позволить себе продукты с удовлетворительным выходом. Дальнейшее более детальное исследование показало, что существенное сокращение времени реакции было связано с ростом давления и температуры в герметичных реакционных сосудах [19].
Например, в одном из первых опубликованных исследований было замечено, что ряд реакций может быть проведен быстрее при условии, что реакционные смеси помещаются в герметичные сосуды и облучаются в микроволновом резонаторе. Более того, реакции требовали еще более короткого времени реакции, если бы они проводились в растворителях с более низкими температурами кипения. В итоге было показано, что скорость реакций пропорциональна давлению, создаваемому в реакционных сосудах во время облучения [12, 8].В другом примере сокращение времени реакции наблюдали во время синтеза металлоорганических соединений родия (I) и иридия (I), которые обычно получают кипячением реагентов в смеси спиртов и воды в течение нескольких часов. Время реакции во время микроволнового протокола было короче 1 мин. позволить себе продукты с удовлетворительным выходом. Дальнейшее более детальное исследование показало, что существенное сокращение времени реакции было связано с ростом давления и температуры в герметичных реакционных сосудах [19].
 Соединение с наивысшей температурой плавления, которое плавилось во время реакции, характеризует температуру реакции. Затем реакцию повторяли при той же температуре в обычных условиях. Снова было показано, что микроволны не влияют на скорость реакции, и, казалось бы, более высокие выходы реакции в микроволновых условиях можно объяснить более высокой объемной температурой (тепловым эффектом) реакционной смеси в микроволновых условиях [22]. Также сравнение скорости реакции Дильса-Альдера диэтилмалеата и антрацена в обычных и микроволновых условиях дало аналогичные результаты [21].
Соединение с наивысшей температурой плавления, которое плавилось во время реакции, характеризует температуру реакции. Затем реакцию повторяли при той же температуре в обычных условиях. Снова было показано, что микроволны не влияют на скорость реакции, и, казалось бы, более высокие выходы реакции в микроволновых условиях можно объяснить более высокой объемной температурой (тепловым эффектом) реакционной смеси в микроволновых условиях [22]. Также сравнение скорости реакции Дильса-Альдера диэтилмалеата и антрацена в обычных и микроволновых условиях дало аналогичные результаты [21].
 е.е. более высокое давление и / или объемная температура реакционной смеси, развитие температурного градиента, перегрев растворителей), которые могут быть ответственны за кажущиеся более высокие скорости реакции в условиях микроволнового излучения. Однако тщательное рассмотрение всех факторов, влияющих на реакции в условиях микроволнового излучения, может устранить большинство из этих эффектов. Существует несколько реакций, в которых влияние только тепловых эффектов недостаточно для объяснения увеличения выхода и скорости реакций.
е.е. более высокое давление и / или объемная температура реакционной смеси, развитие температурного градиента, перегрев растворителей), которые могут быть ответственны за кажущиеся более высокие скорости реакции в условиях микроволнового излучения. Однако тщательное рассмотрение всех факторов, влияющих на реакции в условиях микроволнового излучения, может устранить большинство из этих эффектов. Существует несколько реакций, в которых влияние только тепловых эффектов недостаточно для объяснения увеличения выхода и скорости реакций.Термические эффекты в химических реакциях: Введение
Обзор:
В этом модуле используются скринкасты и интерактивное моделирование, чтобы объяснить важность баланса массы и энергии при использовании химического реактора. Затем он предоставляет примеры задач и пошаговые имитации викторин, чтобы пользователь мог проверить себя. Мы предлагаем использовать учебные ресурсы в следующем порядке:
- Попытайтесь ответить на ConcepTest с несколькими вариантами ответов и решить проблему из примера перед просмотром скринкаста или работой с симуляциями.

- Посмотрите видеоролик, в котором применяется баланс энергии к реактору периодической загрузки.
- Воспользуйтесь интерактивным моделированием, чтобы лучше понять взаимосвязь между конверсией и температурой в адиабатическом реакторе.
- Используйте интерактивное моделирование викторины, чтобы проверить свое понимание, выполнив пошаговую подготовку адиабатической обратимой реакции.
- Попытайтесь решить два примера проблем, прежде чем смотреть решения в видеороликах.
- Ответьте на ConcepTests.
- Посмотрите список ключевых моментов, но только после того, как вы попытаетесь сами перечислить ключевые моменты.
Мотивация:
Это модуль предназначен для курса термодинамики или кинетики. Химические реакторы ограничены равновесием, который зависит от температуры.
Перед изучением этого модуля вы должны уметь:
После изучения этого модуля вы должны уметь:
- Рассчитывать
температура на выходе из химического реактора, если конверсия на выходе известна.

- Рассчитать равновесная конверсия в адиабатическом реакторе.
- Рассчитать температура адиабатического равновесия химической реакции.
- Объяснить какое влияние окажет добавление инертного вещества на адиабатическую температуру для любого эндотермическая или экзотермическая реакция.
- Рассчитать тепло, которое необходимо отводить, чтобы реактор оставался изотермическим, учитывая выход конверсия из реактора.
 Однако у многих людей возникают проблемы с применением его к результатам измерений.
Однако у многих людей возникают проблемы с применением его к результатам измерений.Щелкните здесь, чтобы бесплатно загрузить калькулятор теплового расширения!

 Кроме того, игнорирование этих ошибок может увеличить риск возникновения ложного принятия или ложного отклонения в ваших заявлениях о соответствии.
Кроме того, игнорирование этих ошибок может увеличить риск возникновения ложного принятия или ложного отклонения в ваших заявлениях о соответствии.Это может повлиять на следующие измерения:


 Тепло течет от более теплого объекта к более холодному (1-й закон термодинамики), пока они не достигнут теплового равновесия. Чем больше разница температур, тем больше скорость теплового потока.
Тепло течет от более теплого объекта к более холодному (1-й закон термодинамики), пока они не достигнут теплового равновесия. Чем больше разница температур, тем больше скорость теплового потока. Температура воздуха может меняться быстрее, чем температура предмета. Итак, следите за температурой предмета или принимайте во внимание коэффициент теплопроводности материала, чтобы оценить тепловые эффекты, вызванные изменениями температуры воздуха.
Температура воздуха может меняться быстрее, чем температура предмета. Итак, следите за температурой предмета или принимайте во внимание коэффициент теплопроводности материала, чтобы оценить тепловые эффекты, вызванные изменениями температуры воздуха.
 Используйте изображение ниже в качестве руководства.
Используйте изображение ниже в качестве руководства.


 Это источник неопределенности, который вам следует включить в свои бюджеты неопределенности, если:
Это источник неопределенности, который вам следует включить в свои бюджеты неопределенности, если:Щелкните здесь, чтобы бесплатно загрузить калькулятор теплового расширения!
 Это смещает химическое равновесие в сторону продуктов или реагентов, что можно определить, изучая реакцию и решая, является ли она эндотермической или экзотермической.
Это смещает химическое равновесие в сторону продуктов или реагентов, что можно определить, изучая реакцию и решая, является ли она эндотермической или экзотермической. Энергия разрыва связей в \ (\ ce {CaO (s)} \) и \ (\ ce {h3O (l)} \) в левой части уравнения меньше энергии, высвобождаемой при образовании \ ( \ ce {Ca (OH) 2 \; (s)} \) в правой части уравнения; чистая разница составляет тепла в правой части уравнения.
Энергия разрыва связей в \ (\ ce {CaO (s)} \) и \ (\ ce {h3O (l)} \) в левой части уравнения меньше энергии, высвобождаемой при образовании \ ( \ ce {Ca (OH) 2 \; (s)} \) в правой части уравнения; чистая разница составляет тепла в правой части уравнения. Если температура понижается, реакция будет продолжаться, и будет выделяться больше тепла (которого не хватает).Влияние температуры на равновесие также изменит значение константы равновесия.
Если температура понижается, реакция будет продолжаться, и будет выделяться больше тепла (которого не хватает).Влияние температуры на равновесие также изменит значение константы равновесия.
 Мы предполагаем, что фазового перехода нет и что система не выполняет никаких работ. Эксперименты показывают, что передаваемое тепло зависит от трех факторов: изменения температуры, массы системы, а также вещества и фазы вещества.
Мы предполагаем, что фазового перехода нет и что система не выполняет никаких работ. Эксперименты показывают, что передаваемое тепло зависит от трех факторов: изменения температуры, массы системы, а также вещества и фазы вещества.
 Удельная теплоемкость — это количество тепла, необходимое для изменения температуры 1,00 кг массы на 1,00 ° C. Удельная теплоемкость c — это свойство вещества; его единица СИ — Дж / (кг К) или Дж / (кг ºC). Напомним, что изменение температуры (Δ T ) одинаково в единицах кельвина и градусов Цельсия. Если теплопередача измеряется в килокалориях, то единица удельной теплоемкости — ккал / (кг ⋅ ºC).
Удельная теплоемкость — это количество тепла, необходимое для изменения температуры 1,00 кг массы на 1,00 ° C. Удельная теплоемкость c — это свойство вещества; его единица СИ — Дж / (кг К) или Дж / (кг ºC). Напомним, что изменение температуры (Δ T ) одинаково в единицах кельвина и градусов Цельсия. Если теплопередача измеряется в килокалориях, то единица удельной теплоемкости — ккал / (кг ⋅ ºC). много тепла для повышения температуры воды, как для утюга.Фактически, вода имеет одну из самых высоких удельных теплоемкостей среди всех материалов, что важно для поддержания жизни на Земле.
много тепла для повышения температуры воды, как для утюга.Фактически, вода имеет одну из самых высоких удельных теплоемкостей среди всех материалов, что важно для поддержания жизни на Земле. 0ºC.
0ºC. 8 кДж + 27,0 кДж = 89,8 кДж.
8 кДж + 27,0 кДж = 89,8 кДж. Это преобразование предотвращает преобразование потенциальной гравитационной энергии в кинетическую энергию грузовика. Проблема в том, что масса грузовика велика по сравнению с массой тормозного материала, поглощающего энергию, и повышение температуры может происходить слишком быстро, чтобы тепло передавалось от тормозов в окружающую среду.
Это преобразование предотвращает преобразование потенциальной гравитационной энергии в кинетическую энергию грузовика. Проблема в том, что масса грузовика велика по сравнению с массой тормозного материала, поглощающего энергию, и повышение температуры может происходить слишком быстро, чтобы тепло передавалось от тормозов в окружающую среду.
 20
20 0 ° С)
0 ° С) 0ºC воды (около чашки) в алюминиевую кастрюлю весом 0,500 кг, снятую с плиты, при температуре 150ºC. Предположим, что поддон стоит на изолированной подушке и выкипает незначительное количество воды. Какова температура, когда вода и поддон через короткое время достигают теплового равновесия?
0ºC воды (около чашки) в алюминиевую кастрюлю весом 0,500 кг, снятую с плиты, при температуре 150ºC. Предположим, что поддон стоит на изолированной подушке и выкипает незначительное количество воды. Какова температура, когда вода и поддон через короткое время достигают теплового равновесия?
 Почему конечная температура намного ближе к 20,0ºC, чем к 150ºC? Причина в том, что вода имеет большую удельную теплоемкость, чем большинство обычных веществ, и поэтому претерпевает небольшое изменение температуры при данной теплопередаче. Большой водоем, например озеро, требует большого количества тепла для значительного повышения температуры.Это объясняет, почему температура в озере остается относительно постоянной в течение дня, даже когда изменение температуры воздуха велико. Однако температура воды действительно меняется в течение длительного времени (например, с лета на зиму).
Почему конечная температура намного ближе к 20,0ºC, чем к 150ºC? Причина в том, что вода имеет большую удельную теплоемкость, чем большинство обычных веществ, и поэтому претерпевает небольшое изменение температуры при данной теплопередаче. Большой водоем, например озеро, требует большого количества тепла для значительного повышения температуры.Это объясняет, почему температура в озере остается относительно постоянной в течение дня, даже когда изменение температуры воздуха велико. Однако температура воды действительно меняется в течение длительного времени (например, с лета на зиму). )
) Это соотношение также можно рассматривать как определение удельной теплоемкости.
Это соотношение также можно рассматривать как определение удельной теплоемкости. Рассчитайте конечную температуру, когда 1,00 ккал тепла передается 1,00 кг следующих веществ, первоначально при 20,0 ° C: (a) вода; (б) бетон; (в) сталь; и (d) ртуть.
Рассчитайте конечную температуру, когда 1,00 ккал тепла передается 1,00 кг следующих веществ, первоначально при 20,0 ° C: (a) вода; (б) бетон; (в) сталь; и (d) ртуть. Сколько килокалорий на грамм содержится в арахисе весом 5,00 г, если энергия его горения передается 0,500 кг воды, содержащейся в алюминиевой чашке весом 0,100 кг, что вызывает повышение температуры на 54,9 ° C? (b) Сравните свой ответ с информацией на этикетке, найденной на упаковке арахиса, и прокомментируйте, согласуются ли значения.
Сколько килокалорий на грамм содержится в арахисе весом 5,00 г, если энергия его горения передается 0,500 кг воды, содержащейся в алюминиевой чашке весом 0,100 кг, что вызывает повышение температуры на 54,9 ° C? (b) Сравните свой ответ с информацией на этикетке, найденной на упаковке арахиса, и прокомментируйте, согласуются ли значения. (a) Рассчитайте скорость повышения температуры в градусах Цельсия в секунду (ºC / s), если масса активной зоны реактора составляет 1,60 × 10 5 кг, а ее средняя удельная теплоемкость составляет 0,3349 кДж / кг ºC. (b) Сколько времени потребуется, чтобы получить повышение температуры на 2000ºC, которое может привести к расплавлению некоторых металлов, содержащих радиоактивные материалы? (Начальная скорость повышения температуры будет больше, чем рассчитанная здесь, потому что теплопередача сосредоточена в меньшей массе.Позже, однако, рост температуры замедлится, поскольку стальная защитная оболочка 5 × 10 5 кг также начнет нагреваться.)
(a) Рассчитайте скорость повышения температуры в градусах Цельсия в секунду (ºC / s), если масса активной зоны реактора составляет 1,60 × 10 5 кг, а ее средняя удельная теплоемкость составляет 0,3349 кДж / кг ºC. (b) Сколько времени потребуется, чтобы получить повышение температуры на 2000ºC, которое может привести к расплавлению некоторых металлов, содержащих радиоактивные материалы? (Начальная скорость повышения температуры будет больше, чем рассчитанная здесь, потому что теплопередача сосредоточена в меньшей массе.Позже, однако, рост температуры замедлится, поскольку стальная защитная оболочка 5 × 10 5 кг также начнет нагреваться.) 5,02 × 10 8 Дж
5,02 × 10 8 Дж VIII.1802 – 12.XII.1850)
VIII.1802 – 12.XII.1850) -в) – изменение теплоемкости системы в результате протекания процесса. (νi – стехиометрические коэффициенты в уравнении химической реакции). Если не пренебрегать изменением теплоемкости с температурой, то есть считать, что Ср=а+bТ+сТ2 или Ср=а+bТ+с’/Т2, то уравнение Кирхгофа принимает вид:
-в) – изменение теплоемкости системы в результате протекания процесса. (νi – стехиометрические коэффициенты в уравнении химической реакции). Если не пренебрегать изменением теплоемкости с температурой, то есть считать, что Ср=а+bТ+сТ2 или Ср=а+bТ+с’/Т2, то уравнение Кирхгофа принимает вид: 2_1{Vdp\left(6\right).}\]
2_1{Vdp\left(6\right).}\] 2\right).\]
2\right).\]







