Тепловой эффект химической реакции. Термохимические уравнения.
Любая химическая реакция сопровождается выделением или поглощением энергии в виде теплоты.
По признаку выделения или поглощения теплоты различают экзотермические и эндотермические реакции.
Экзотермические реакции – такие реакции, в ходе которых тепло выделяется (+Q).
Эндотермические реакции – реакции, при протекании которых тепло поглощается (-Q).
Тепловым эффектом реакции (Q) называют количество теплоты, которое выделяется или поглощается при взаимодействии определенного количества исходных реагентов.
Термохимическим уравнением называют уравнение, в котором указан тепловой эффект химической реакции. Так, например, термохимическими являются уравнения:

Также следует отметить, что термохимические уравнения в обязательном порядке должны включать информацию об агрегатных состояниях реагентов и продуктов, поскольку от этого зависит значение теплового эффекта.
Расчеты теплового эффекта реакции
Пример типовой задачи на нахождение теплового эффекта реакции:
При взаимодействии 45 г глюкозы с избытком кислорода в соответствии с уравнением
C6H12O6(тв.) + 6O2(г) = 6CO2(г) + 6H2O(г) + Q
выделилось 700 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.)
Решение:
Рассчитаем количество вещества глюкозы:
n(C6H12O6) = m(C6H12O6) / M(C6H12O6) = 45 г / 180 г/моль = 0,25 моль
Т.е. при взаимодействии 0,25 моль глюкозы с кислородом выделяется 700 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль глюкозы с кислородом образуется количество теплоты, равное Q (тепловой эффект реакции). Тогда верна следующая пропорция:
0,25 моль глюкозы — 700 кДж
1 моль глюкозы — Q
Из этой пропорции следует соответствующее ей уравнение:
0,25 / 1 = 700 / Q
Решая которое, находим, что:
Q = 2800 кДж
Таким образом, тепловой эффект реакции составляет 2800 кДж.
Расчёты по термохимическим уравнениям
Намного чаще в заданиях ЕГЭ по термохимии значение теплового эффекта уже известно, т.к. в условии дается полное термохимическое уравнение.
Рассчитать в таком случае требуется либо количество теплоты, выделяющееся/поглощающееся при известном количестве реагента или продукта, либо же, наоборот, по известному значению теплоты требуется определить массу, объем или количество вещества какого-либо фигуранта реакции.
Пример 1
В соответствии с термохимическим уравнением реакции
3Fe3O4(тв.) + 8Al(тв.) = 9Fe(тв.) + 4Al2O3(тв.) + 3330 кДж
образовалось 68 г оксида алюминия. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
Решение
Рассчитаем количество вещества оксида алюминия:
n(Al2O3) = m(Al2O3) / M(Al2O3) = 68 г / 102 г/моль = 0,667 моль
В соответствии с термохимическим уравнением реакции при образовании 4 моль оксида алюминия выделяется 3330 кДж. В нашем же случае образуется 0,6667 моль оксида алюминия. Обозначив количество теплоты, выделившейся при этом, через x кДж составим пропорцию:
4 моль Al2O3 — 3330 кДж
0,667 моль Al2O3 — x кДж
Данной пропорции соответствует уравнение:
4 / 0,6667 = 3330 / x
Решая которое, находим, что x = 555 кДж
Т.е. при образовании 68 г оксида алюминия в соответствии с термохимическим уравнением в условии выделяется 555 кДж теплоты.
Пример 2
В результате реакции, термохимическое уравнение которой
4FeS2(тв.) + 11O2(г) = 8SO2(г) + 2Fe2O3(тв.) + 3310 кДж
выделилось 1655 кДж теплоты. Определите объем (л) выделившегося диоксида серы (н.у.). (Запишите число с точностью до целых.)
Решение
В соответствии с термохимическим уравнением реакции при образовании 8 моль SO2 выделяется 3310 кДж теплоты. В нашем же случае выделилось 1655 кДж теплоты. Пусть количество вещества SO2, образовавшегося при этом, равняется x моль. Тогда справедливой является следующая пропорция:
8 моль SO2 — 3310 кДж
x моль SO2 — 1655 кДж
Из которой следует уравнение:
8 / х = 3310 / 1655
Решая которое, находим, что:
x = 4 моль
Таким образом, количество вещества SO2, образовавшееся при этом, составляет 4 моль. Следовательно, его объем равен:
V(SO2) = Vm ∙ n(SO2) = 22,4 л/моль ∙ 4 моль = 89,6 л ≈ 90 л (округляем до целых, т.к. это требуется в условии.)
Больше разобранных задач на тепловой эффект химической реакции можно найти здесь.
scienceforyou.ru
Расчет стандартных тепловых эффектов химических реакций по стандартным теплотам образования веществ, участвующих в реакции
Стандартной
теплотой образования (энтальпией
образования) вещества называется энтальпия реакции образования
1 моля этого вещества из элементов
(простых веществ, то есть состоящих из
атомов одного вида), находящихся в
наиболее устойчивом стандартном
состоянии. Стандартные энтальпии
образования веществ  (кДж/моль) приводятся в справочниках.
При использовании справочных значений
необходимо обращать внимание на фазовое
состояние веществ, участвующих в реакции.
Энтальпия образования наиболее устойчивых
простых веществ равна 0.
(кДж/моль) приводятся в справочниках.
При использовании справочных значений
необходимо обращать внимание на фазовое
состояние веществ, участвующих в реакции.
Энтальпия образования наиболее устойчивых
простых веществ равна 0.
Следствие из закона Гесса о расчете тепловых эффектов химических реакций по теплотам образования: стандартный тепловой эффект химической реакции равен разности теплот образования продуктов реакции и теплот образования исходных веществ с учетом стехиометрических коэффициентов (количества молей) реагентов
 . (1.17)
. (1.17)
П р и м е р 1.2. Рассчитать стандартный тепловой эффект и изменение внутренней энергии при прохождении следующей реакции при P = const:
CH4 + 2 CO = 3 C(графит) + 2 H2O.
газ газ тв. газ
Теплоты образования веществ в указанных фазовых состояниях приведены в табл. 1.2.
Таблица 1.2
Теплоты образования веществ
Вещество | CH4 (газ) (метан) | CO (газ) | C (графит) | H2O (газ) |
Количество молей | 1 | 2 | 3 | 2 |
| –74,85 | –110,53 | 0 | –241,81 |
Р е ш е н и е
Так как реакция проходит при P = const, то стандартный тепловой эффект находим в виде изменения энтальпии по известным теплотам образования по следствию из закона Гесса (формула (1.17):
ΔНо298 = { 2 · (–241,81) + 3·0} – {–74,85 + 2 · (–110,53)} = –187,71 кДж = = –187710 Дж.
ΔНо298 < 0, реакция является экзотермической, протекает с выделением теплоты.
Изменение внутренней энергии находим на основании уравнения (1.16):
ΔUо298 = ΔHо298 – Δν · RT.
Для данной реакции изменений числа молей газообразных веществ за счет прохождения химической реакции Δν = 2 – (1 + 2) = –1; Т = 298 К, тогда
ΔUо298 = –187710 – (–1) · 8,314· 298 = –185232 Дж.Расчет стандартнвх тепловых эффектов химических реакций по стандартным теплотам сгорания веществ, участвующих в реакции
Стандартной
теплотой сгорания (энтальпией сгорания)
вещества называется
тепловой эффект полного окисления 1
моля данного вещества (до высших оксидов
или специально указываемых соединений)
кислородом при условии, что исходные и
конечные вещества имеют стандартную
температуру. Стандартные энтальпии
сгорания веществ  (кДж/моль) приводятся в справочниках.
При использовании справочной величины
необходимо обратить внимание на знак
величины энтальпии реакции сгорания,
которая всегда является экзотермической
(ΔH <0 ), а в таблицах указаны величины
(кДж/моль) приводятся в справочниках.
При использовании справочной величины
необходимо обратить внимание на знак
величины энтальпии реакции сгорания,
которая всегда является экзотермической
(ΔH <0 ), а в таблицах указаны величины 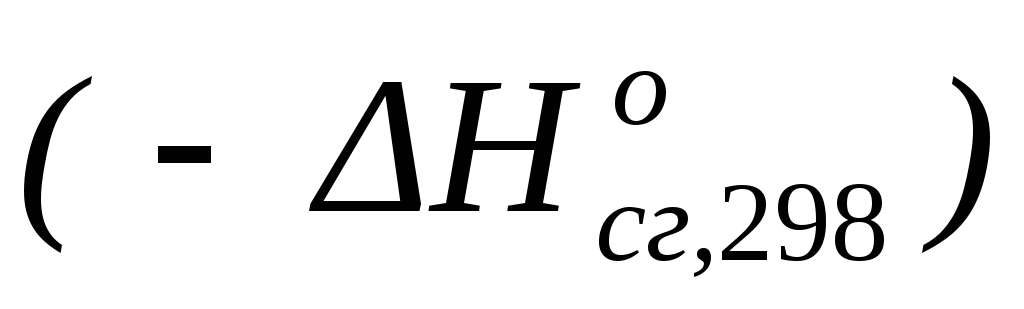 .
.
Следствие из закона Гесса о расчете тепловых эффектов химических реакций по теплотам сгорания: стандартный тепловой эффект химической реакции равен разности теплот сгорания исходных веществ и теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов (количества молей) реагентов:
 . (1.18)
. (1.18)
П р и м е р 1.3. Рассчитать стандартный тепловой эффект реакции получения этилового спирта гидратацией этилена по теплотам сгорания веществ, участвующих в данной реакции (P=const):
C2H4 + H2O = С2Н5ОН.
газ ж ж
studfile.net
Тепловой эффект химической реакции. Термохимия
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
C + O2 = CO2 + Q
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
2KNO3 → 2KNO2 + O2 – Q
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
4NH3 + 3O2 → 2N2 + 6H2O + Q
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения. Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
2Аl + 3/2О2 → Аl2О3 + 1675 кДж
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
4Аl + 3О2 → 2Аl2О3 + 3350 кДж
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
СН4 + 2О2 → СО2 + 2Н2О + 802 кДж
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
N2 + O2 → 2NО – 180 кДж
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
m (H2O)=108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
S(ромб) + O2(г) = SO2(г) + 296 кДж,
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Q = 740 кДж.
Ответ: выделится 740 кДж теплоты.
Поделиться ссылкой:
chemege.ru
Лекция 6. Тепловой эффект химической реакции
Лекция 6. Термохимия. Тепловой эффект химической реакции
Подобно тому, как одной из физических характеристик человека является физическая сила, важнейшей характеристикой любой химической связи является сила связи, т.е. её энергия.
Напомним, что энергия химической связи – эта та энергия, которая выделяется при образовании химической связи или та энергия, которую нужно истратить, чтобы эту связь разрушить.
Химическая реакция в общем случае – это превращение одних веществ в другие. Следовательно, в ходе химической реакции происходит разрыв одних связей и образование других, т.е. превращения энергии.
Фундаментальный закон физики гласит, что энергия не возникает из ничего и не исчезает бесследно, а лишь переходит из одного вида в другой. В силу своей универсальности данный принцип, очевидно, применим и к химической реакции.
Тепловым эффектом химической реакции называется количество теплоты,
выделившееся (или поглотившееся) в ходе реакции и относимое к 1 моль прореагировавшего (или образовавшегося) вещества.
Тепловой эффект обозначается буквой Q и, как правило, измеряется в кДж/моль или в ккал/моль.
Если реакция происходит с выделением тепла (Q > 0), она называется экзотермической, а если с поглощением тепла (Q < 0) – эндотермической.
Если схематично изобразить энергетический профиль реакции, то для эндотермических реакций продукты находятся выше по энергии, чем реагенты, а для экзотермических – наоборот, продукты реакции располагаются ниже по энергии (более стабильны), чем реагенты.
Ясно, что чем больше вещества прореагирует, тем большее количество энергии выделится (или поглотится), т.е. тепловой эффект прямо пропорционален количеству вещества. Поэтому отнесение теплового эффекта к 1 моль вещества обусловлено нашим стремлением сравнивать между собой тепловые эффекты различных реакций.

Лекция 6. Термохимия. Тепловой эффект химической реакции Пример 1. При восстановлении 8,0 г оксида меди(II) водородом образовалась металлическая медь и пары воды и выделилось 7,9 кДж теплоты. Вычислите тепловой эффект реакции восстановления оксида меди(II).
Решение. Уравнение реакции CuO (тв.) + h3 (г.) = Cu (тв.) + h3O (г.) + Q (*)
В реакцию вступило ν = | m | = | 8,0 | = 0,1мольоксида меди(II). |
|
| |||
| M | 63,5 +16 | ||
Составим пропорцию при восстановлении 0,1 моль – выделяется 7,9 кДж при восстановлении 1 моль – выделяется x кДж
Откуда x = + 79 кДж/моль. Уравнение (*) принимает вид
CuO (тв.) + h3 (г.) = Cu (тв.) + h3O (г.) + 79 кДж
Термохимическое уравнение – это уравнение химической реакции, в котором указаны агрегатное состояние компонентов реакционной смеси (реагентов и продуктов) и тепловой эффект реакции.
Изменение агрегатного состояния вещества также обычно | сопряжено |
с тепловыми эффектами. Наиболее известные Вам примеры | связаны с |
изменением агрегатного состояния воды. |
|
Так, чтобы расплавить лед или испарить воду, требуется затратить определенные количества теплоты, тогда как при замерзании жидкой воды или конденсации водяного пара такие же количества теплоты выделяются. Именно поэтому нам холодно, когда мы выходим из воды (испарение воды с поверхности тела требует затрат энергии), а потоотделение является биологическим защитным механизмом от перегрева организма. Напротив, морозильник замораживает воду и нагревает окружающее помещение, отдавая ему избыточное тепло.
На данном примере показаны тепловые эффекты изменения агрегатного состояния воды. Теплота плавления (при 0oC) λ = 3,34×10 5 Дж/кг (физика), или Qпл. = — 6,02 кДж/моль (химия), теплота испарения (парообразования) (при 100oC) q = 2,26×10 6 Дж/кг (физика) или Qисп. = — 40,68 кДж/моль (химия).
кристаллизация | конденсация |
Q > 0 | Q > 0 |
h3O
тв.
плавление
Q < 0
h3O |
|
|
| h3O | |
|
|
| |||
испарение | |||||
ж. | г. | ||||
| Q < 0 | ||||
|
|
| |||
обр,298.
Лекция 6. Термохимия. Тепловой эффект химической реакции Разумеется, возможны процессы сублимации, когда твердое вещество
переходит в газовую фазу, минуя жидкое состояние и обратные процессы осаждения (кристаллизации) из газовой фазы, для них также возможно рассчитать или измерить тепловой эффект.
Ясно, что в каждом веществе есть химические связи, следовательно, каждое вещество обладает некоторым запасом энергии. Однако далеко не все вещества можно превратить друг в друга одной химической реакцией. Поэтому договорились о введении стандартного состояния.
Стандартное состояние вещества – это агрегатное состояние вещества при температуре 298 К, давлении 1 атмосфера в наиболее устойчивой в этих условиях аллотропной модицикации.
Стандартные условия – это температура 298 К и давление 1 атмосфера. Стандартные условия (стандартное состояние) обозначается индексом0.
Стандартной теплотой образования соединения называется тепловой эффект химической реакции образования данного соединения из простых веществ, взятых в их стандартном состоянии. Теплота образования соединения обозначается символом Q0 Для множества соединений стандартные теплоты образования приведены в справочниках физикохимических величин.
Стандартные теплоты образования простых веществ равны 0. Например, Q0обр,298 (O2, газ) = 0, Q0обр,298 (C, тв., графит) = 0.
Например. Запишите термохимическое уравнение образования сульфата меди(II). Из справочника Q0обр,298 (CuSO4) = 770 кДж/моль.
Cu (тв.) + S (тв.) + 2O2 (г.) = CuSO4 (тв.) + 770 кДж.
Замечание: термохимическое уравнение можно записать для любого вещества, однако надо понимать, что в настоящей жизни реакция происходит совершенно по-другому: из перечисленных реагентов образуются при нагревании оксиды меди(II) и серы(IV), но сульфат меди(II) не образуется. Важный вывод: термохимическое уравнение – модель, которая позволяет производить расчеты, она хорошо согласуется с другими термохимическими данными, но не выдерживает проверки практикой (т.е. неспособна правильно предсказать возможность или невозможность реакции).
(B j ) -∑ai ×Qобр0 ,298 i
Лекция 6. Термохимия. Тепловой эффект химической реакции
Уточнение. Для того, чтобы не вводить Вас в заблуждение, сразу добавлю, что химическая термодинамика может предсказывать возможность / невозможность реакции, однако для этого требуются более серьезные «инструменты», которые выходят за рамки школьного курса химии. Термохимическое уравнение по сравнению с этими приемами – первая ступенька на фоне пирамиды Хеопса – без него не обойтись, но высоко не подняться.
Пример 2. Вычислите тепловой эффект конденсации воды массой 5,8г. Решение. Процесс конденсации описывается термохимическим уравнением h3O (г.) = h3O (ж.) + Q – конденсация обычно экзотермический процесс Теплота конденсации воды при 25oC 37 кДж/моль (справочник).
Количество вещества ν = | m | = | 5,8 | = 0,32 моль |
M |
| |||
| 18 |
| ||
Следовательно, Q = 37 × 0,32 = 11,84 кДж.
В 19 веке русским химиком Гессом, изучавшим тепловые эффекты реакций, был экспериментально установлен закон сохранения энергии применительно к химическим реакциям – закон Гесса.
Тепловой эффект химической реакции не зависит от пути процесса и определяется только разностью конечного и начального состояний.
С точки зрения химии и математики данный закон означает, что мы вольны для расчета процесса выбрать любую «траекторию расчета», ведь результат от нее не зависит. По этой причине очень важный закон Гесса имеет невероятно важное следствие закона Гесса.
Тепловой эффект химической реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования реагентов (с учетом стехиометрических коэффициентов).
С точки зрения здравого смысла данное следствие соответствует процессу, в котором сначала все реагенты превратились в простые вещества, которые затем собрались по-новому, так что получились продукты реакции.
В форме уравнения следствие закона Гесса выглядит так Уравнение реакции: a1A1 + a2A2 + … + a nAn = b1B1 + b2B2 + … b
При этом ai и bj – стехиометрические коэффициенты, Ai – реагенты, Bj – продукты реакции.
Тогда следствие закона Гесса имеет вид Q = ∑b j ×Qобр0 ,298
Лекция 6. Термохимия. Тепловой эффект химической реакции Поскольку стандартные теплоты образования многих веществ
а) сведены в специальные таблицы или б) могут быть определены экспериментально, то становится возможным предсказать (рассчитать) тепловой эффект очень большого количества реакций с достаточно высокой точностью.
Пример 3. (Следствие закона Гесса). Рассчитайте тепловой эффект паровой конверсии метана, происходящей в газовой фазе при стандартных условиях:
Ch5 (г.) + h3O (г.) = CO (г.) + 3 h3 (г.)
Определите, является ли данная реакция экзотермической или эндотермической?
Решение: Следствие закона Гесса
Q = 3Q0 | (H | , г) +Q0 | (CO, г) −Q0 | (CH | , г) −Q0 | (H | O, г) — в общем виде. | ||
| обр,298 | 2 |
| обр,298 | обр,298 | 4 | обр,298 | 2 |
|
Qобр0 | ,298 (H 2 , г) = 0 | — простое вещество в стандартном состоянии | |||||||
Из справочника находим теплоты образования остальных компонентов смеси.
Q 0 | (H | O, г) = 241,8 | кДж | , Q0 | (СO, г) = 110,5 | кДж | , Q 0 | (CH | , г) = 74,6 | кДж | . |
|
|
| |||||||||
обр,298 | 2 |
| моль | обр,298 |
| моль | обр,298 | 4 |
| моль | |
|
|
|
|
|
|
|
| ||||
Подставляем значения в уравнение
Q = 0 + 110,5 – 74,6 – 241,8 = -205,9 кДж/моль, реакция сильно эндотермична.
Ответ: Q = -205,9 кДж/моль, эндотермическая
Пример 4. (Применение закона Гесса). Известны теплоты реакций
C (тв.) + ½ O (г.)= CO (г.) + 110,5 кДж
2
С (тв.) + O2 (г.) = CO2 (г.) + 393,5 кДж Найти тепловой эффект реакции 2CO (г.) + O2 (г.) = 2CO2 (г.). Решение Умножим первое и второе уравнение на 2
2C (тв.) + O2 (г.)= 2CO (г.) + 221 кДж 2С (тв.) + 2O2 (г.) = 2CO2 (г.) + 787 кДж
Вычтем из второго уравнения первое
O2 (г.) = 2CO2 (г.) + 787 кДж – 2CO ( г.) – 221 кДж,
откуда
2CO (г.) + O2 (г.) = 2CO2 (г.) + 566 кДж Ответ: 566 кДж/моль.
Замечание: При изучении термохимии мы рассматриваем химическую реакцию извне (снаружи). Напротив, химическая термодинамика – наука о поведении химических систем – рассматривает систему изнутри и оперирует понятием «энтальпии» H как тепловой энергии системы. Энтальпия, таким
Лекция 6. Термохимия. Тепловой эффект химической реакции образом, имеет тот же смысл, что и количество теплоты, но имеет противоположный знак: если энергия выделяется из системы, окружающая среда её получает и греется, а система энергию теряет.
Литература:
1. учебник, В.В. Еремин, Н.Е. Кузьменко и др., Химия 9 класс, параграф 19,
с. 96-100.
2. Учебно-методическое пособие «Основы общей химии» Часть 1.
Составители – С.Г. Барам, И.Н. Миронова. – взять с собой! на следующее семинарское занятие
3. А.В. Мануйлов. Основы химии. http://hemi.nsu.ru/index.htm
§9.1 Тепловой эффект химической реакции. Основные законы термохимии.
§9.2** Термохимия (продолжение). Теплота образования вещества из элементов.
Стандартная энтальпия образования.
Внимание!
Мы переходим к решению расчетных задач, поэтому на семинары по химии отныне и впредь желателен калькулятор.
studfile.net
5.2. Тепловые эффекты химических реакций
Тепловой эффект реакции количество теплоты, которое выделяется или поглощается системой в результате протекания химической реакции. Это может быть Н (Р,Т = const) или U (V,T = const).
Если в результате реакции теплота выделяется, т.е. энтальпия системы понижается (Н 0), то реакция называется экзотермической.
Реакции, сопровождающиеся поглощением теплоты, т.е. с повышением энтальпии системы (Н 0), называются эндотермическими.
Как и другие функции состояния, энтальпия зависит от количества вещества, поэтому ее велечену (Н) обычно относят к 1 моль вещества и выражают в кДж/моль.
Обычно
функции системы определяют при стандартных
условиях, в
которые, кроме параметров стандартного
состояния, входит стандартная температура
T = 298,15 К (25C).
Часто температуру указывают в виде
нижнего индекса ( ).
).
5.3. Термохимические уравнения
Термохимические уравнения реакций уравнения, в которых указан тепловой эффект, условия реакций и агрегатные состояния веществ. Обычно в качестве теплового эффекта указывается энтальпия реакции. Например,
C(графит) + O2 (газ) = CO2 (газ) , Н0298 = 396 кДж.
Тепловой эффект можно записать в уравнении реакции:
C(графит) + O2 (газ) = CO2 (газ) + 396 кДж.
В химической термодинамике первая форма записи употребляется чаще.
Особенности термохимических уравнений.
1. Тепловой эффект зависит от массы реагирующего вещества, поэ-
тому его обычно рассчитывают на один моль вещества. В связи с этим в термохимических уравнениях можно использовать дробные коэффициенты. Например, для случая образования одного моля хлороводорода термохимическое уравнение записывается так:
½H2 + ½Cl2 = HCl, H0298 = 92 кДж
или Н2 + Cl2 = 2HСl, H0298 = 184 кДж.
2. Тепловые эффекты зависят от агрегатного состояния реагентов; оно указывается в термохимических уравнениях индексами: ж жидкое, г газообразное, т твердое или к – кристаллическое, р – растворенное.
Например: H2 + ½ O2 = H2О(ж), Н0298 = -285,8 кДж.
H2 + ½ О2 = H2О(г) , Н0298 = 241,8 кДж.
3. С термохимическими уравнениями можно производить алгебраические действия (их можно складывать, вычитать, умножать на любые коэффициенты вместе с тепловым эффектом).
Термохимические уравнения более полно, чем обычные, отражают происходящие при реакции изменения они показывают не только качественный и количественный состав реагентов и продуктов, но и количественные превращения энергии, которыми данная реакция сопровождается.
5.4. Закон Гесса и его следствия
В основе термохимических расчетов лежит закон открытый российским ученым Гессом Г. И. (1841 г.). Суть его в следующем: тепловой эффект химической реакции зависит только от начального и конечного состояния системы, но не зависит от скорости и пути процесса, то есть от числа промежуточных стадий. Это, в частности, значит, что термохимические реакции можно складывать вместе с их тепловыми эффектами. Например, образование CO2 из углерода и кислорода можно представить следующей схемой:
С+О2 Н1СО2 1. C(граф.) +O2 (г)= CO2 (г) , Н01 = 396 кДж.



2. C(граф.) + 1/2O2 (г)= CO(г),Н02 = Х кДж.
Н2 Н3
3.
CO(г)+ 1/2O2 (г) = CO2 (г) , Н03 = 285,5кДж.
СО + ½О2
Все эти три процесса находят широкое применение в практике. Как известно, тепловые эффекты образования СО2 (Н1) и горения СО (Н3) определяются экспериментально. Тепловой же эффект образования СО (Н2) экспериментально измерить невозможно, так как при горении углерода в условиях недостатка кислорода образуется смесь СО и СО2. Но энтальпию реакции образования СО из простых веществ можно рассчитать.
Из закона Гесса следует, что H01 = H02 + H03. Следовательно,
H02 = H01 H0 3= 396 (285,5) = 110,5 (кДж) – это и есть истенная величина
Таким образом, пользуясь законом Гесса, можно находить теплоту реакций, которые невозможно определить экспериментально.
В термохимических расчетах широко используют два следствия закона Гесса. По первому, тепловой эффект реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (реагентов).
Н0х.р. = nпрод·H0ƒ прод — nисх ·Н0ƒ реагентов ,
где n количество вещества; Н0ƒ стандартная энтальпия (теплота) образования вещества.
Тепловой эффект реакции образования 1 моль сложного вещества из простых веществ, определенный при стандартных условиях, называется стандартной энтальпией образования этого вещества (Н0образ или Н0ƒ кДж/моль).
Так как абсолютную энтальпию вещества определить невозможно, то для измерений и расчетов необходимо определить начало отсчета, то есть систему и условия, для которых принимается значение : Н = 0. В термодинамике в качестве начала отсчета принимают состояния простых веществ в их наиболее устойчивых формах при обычных условиях – в стандартном состоянии.
Например: Н0ƒ (О2) = 0, но Н0ƒ (О3) = 142,3 кДж/моль. Стандартные энтальпии образования определены для многих веществ и проведены в справочниках (табл. 5.1).
В общем виде для реакции аА+ вВ = сС + dD энтальпия , согласно первому следствию определяется по уравнению:
H0298х.р.= (cН0ƒ,C + dН0ƒ,Е) (аH0ƒ,A + вH0ƒ,B).
Второе следствие закона Гесса относится к органическим веществам. Тепловой эффект реакции с участием органических веществ равен сумме теплот сгорания реагентов за вычетом теплот сгорания продуктов.
При этом теплота сгорания определяется в предположении полного
сгорания: углерод окисляется до CO2, водород до H2O, азот до N2 .
Тепловой эффект реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов называется теплотой сгорания этого вещества (Н0сг.). При этом очевидно, что теплоты сгорания O2, CO2, H2O, N2 принимаются равными нулю.
Таблица 5.1
Термодинамические константы некоторых веществ
Вещество | Н0f,298, кДж/ моль | S0298, Дж/ мольK | G0f,298, кДж/ моль | Вещество | Н0f,298,кДж/ моль | S0298, Дж/ мольK | G0f,298, кДж/моль |
Al2O3(кр) | 1676,0 | 50,9 | 1582,0 | Cr2O3(кр) | 1140,6 | 281,0 | 1059,0 |
BaO(кр) | 558,1 | 70,3 | 528,4 | CuO(кр) | 162,0 | 42,6 | 129,4 |
ВеО(кр) | 598,0 | 14,1 | 581,6 | CuCl2(ж) | 227,6 | 210,9 | 244,6 |
BeCO3(кр) | 982,0 | 67,3 | 944,8 | H2O(ж) | 285,8 | 70,08 | 237,3 |
С(графит) | 0 | 5,7 | 0 | H2O(г) | 241,8 | 188,7 | 228,6 |
Cl2(г) | 0 | 222,9 | 0 | H2SO4(ж) | 814,2 | 156,9 | 690,3 |
CaO(кр) | 635,5 | 39,7 | 604,2 | HCl(ж) | 166,9 | 56,5 | 131,2 |
CaH2(кр) | 188,7 | 42,0 | 149,8 | HCl(г) | 91,8 | 186,7 | 94,8 |
CaCO3(кр) | 1206,9 | 92,9 | 1128,8 | H2S(г) | 21,0 | 205,6 | 33,8 |
O2(г) | 0 | 205,0 | 0 | H2 | 0 | 130,5 | 0 |
Ca(OH)2 | 986,6 | 76,1 | 896,8 | NH3(г) | 46,2 | 192,5 | 16,7 |
CH4 | 74,9 | 186,2 | 50,8 | NO | 90,3 | 210,6 | 86,6 |
C2H4 | 52,3 | 219,4 | 68,1 | NO2 | 33,0 | 240,5 | 51,5 |
C2H6 | 89,7 | 229,5 | 32,9 | NH4Clкр | 314,2 | 94,5 | 203,2 |
C6H6(ж) | 82,9 | 269,2 | 129,7 | P2O5(кр) | 1492 | 114,5 | 1348,8 |
C2H2 | 226,8 | 200,8 | 209,2 | SO3(ж) | 439,0 | 122,1 | 368,1 |
C3H8(г) | 103,85 | 269,9 | | Fe | 0 | 27,2 | 0 |
CH3OH(ж) | | 126,8 | | FeO(кр) | 264,8 | 60,7 | 244,3 |
C2H5OH(г) | 235,3 | | | Fe3O4(кр) | 1117,1 | 146,2 | 1014,2 |
CO | 110,5 | 197,5 | 137,1 | Fe2O3(кр) | 822,2 | 89,9 | 740,3 |
CO2 | 393,5 | 213,6 | 394,3 | Ti(кр) | 0 | 30,6 | 0 |
CS2(г) | 115,3 | | | TiO2(кр) | 943,9 | 50,3 | 888,6 |
Например, теплоту сгорания этанола
C2H5OH(ж) + 3O2 = 2CO2 + 3H2O(г)
можно рассчитать по уравнению:
H0х.р. = Н0сг(C2H5OH) = 2Н0ƒ,(CO2)+3Н0ƒ,(H2O) Н0ƒ,(C2H5OH).
Н0сг (C2H5OH) = 2(393,5) + 3(241,8) – (277,7) = 1234,7 кДж/моль.
Значения теплот сгорания также приведены в справочниках.
Пример 1. Определить тепловой эффект реакции дегидратации этанола, если
H0сг (C2H4) =1422,8;H0сг (H2О) = 0; Н0сг(C2H5OH) =1234,7 (кДж/моль).
Решение. Запишем реакцию:C2H5OH(ж)=C2H4+H2O.
Согласно второму следствию определяем тепловой эффект реакции по теплотам сгорания, которые приведены в справочнике:
H0298х.р = H0сг(C2H5OH) H0сг(C2H4) H0сг(H2O) =
1234,7 + 1422,8 = 188,1 кДж/моль.
В технике для характеристики тепловых качеств отдельных видов топлива обычно используют их теплотворную способность.
Теплотворной способностью топлива называется тепловой эффект, который соответствует сгоранию единицы массы (1 кг) для твердых и жидких видов топлива или единицы объема (1 м3) для газообразного топлива (табл. 5.2).
Таблица 5.2
Теплотворная способность и состав некоторых
распространенных видов топлива
Топливо | Содержание, % | Теплотворная способность, кДж/г | ||
углерод | водород | кислород | ||
Антрацит* | 82 | 1 | 2 | 31 |
Бензин | 85 | 15 | 0 | 48 |
H2 | 0 | 100 | 0 | 141 |
Древ. уголь | 100 | | | 34 |
Прир. газ | 70 | 23 | | 49 |
Сырая нефть | 85 | 12 | | 45 |
*Антрацит – каменный уголь с максимальным содержанием углерода (94-96%).
Водород является наиболее эффективным химическим энергоносителем для энергетики, транспорта и технологии будущего, поскольку имеет очень высокую теплотворную способность (табл. 4.2), его относительно легко транспортировать, а при его сгорании образуется только вода, т.е. он является «чистым» горючим, не вызывает загрязнения воздуха. Однако, его широкому использованию в качестве источника энергии мешает слишком малое содержание водорода в природе в свободном состоянии. Большую часть водорода получают разложением воды или углеводородов. Однако, такое разложение требует большого расхода энергии, причем на практике из-за тепловых потерь на получение водорода приходится затратить больше энергии, чем ее потом можно будет получить. В перспективе, если удастся создать большие и дешевые источники энергии (например, в результате развития техники получения ядерной или солнечной энергии), часть ее будет использоваться на получение водорода. Многие ученые убеждены, что энергетика будущего – это водородная энергетика.
С помощью закона Гесса и его следствий можно определять многие величины, в том числе не определяемые экспериментально, если соответствующую неизвестной величине реакцию можно получить, складывая другие реакции с известными характеристиками.
Пример 2.Исходя из теплоты сгорания СН4(Н0сг=890кДж/моль) и Н2(Н0сг=286 кДж/моль), вычислить теплотворную способность газа, содержащего 60 % водорода и 40 % метана СН4.
Решение. Запишем термохимические уравнения реакций сгорания:
1) Н2+½О2= Н2О(ж);Н0f(Н2О)=286 кДж/моль;
СН4+ 2О2= СО2+ 2Н2О(ж);Н02
H02 = Н0ƒ,(CO2) + 2Н0ƒ,(Н20)Н0ƒ,(СН4) =3932.286 + 75 =890 кДж/моль.
1м3газа содержит 600л Н2и 400л СН4,
что составляет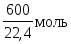 Н2и
Н2и СН4. Теплотворная способность
газа составит:
СН4. Теплотворная способность
газа составит:
 кДж/м3.
кДж/м3.
Пример 3.Используя данные таблицы 5.1, рассчитать тепловой эффект реакции сгорания этилена: С2Н4 + 3О2 = 2СО2 + 2Н2О(г).
Решение.Из таблицы 5.1 выписываем значения энтальпий образования веществ, участвующих в реакции (в кДж/моль):
H0ƒ,co2 =393,5;Н0ƒ,с2н4 = 52,3;Н0ƒ,н2о =241,8.
(Напомним, что энтальпия образования простых веществ равна нулю.)
Согласно следствию из закона Гесса (4.4):
H0298 х.р=nпрод·Н0ƒ,продnисх·Н0ƒ,исх = 2Н0ƒ,со2+ 2Н0ƒ,н2оН0ƒ,с2н4 =
2. (393,5) + 2. (241,8)52,3 =1322,9 кДж.
Пример 4.Исходя из теплового эффекта реакции
3СаО(т)+ Р2О5 (т)= Са3(РО4)2 (т),Н0=739 кДж,
определить энтальпию образования ортофосфата кальция.
Решение.По следствию из закона Гесса:
H0298 х.р=Н0ƒ,Са3(PO4)2(3Н0ƒ,СаО +Н0ƒ,P2O5).
Из табл. 4.1: Н0ƒ,(СаО) =635,5;Н0ƒ,(P2O5)=1492 (кДж/моль).
Н0ƒ,Са3(PO4)2=739 + 3. (635,5)1492 =4137,5 кДж/моль.
Пример 5.Написать термохимическое уравнение реакции сгорания твердой серы в N2O, если известно, что при сгорании 16 г серы выделяется 66,9 кДж тепла (предполагается, что при измерении теплоты температура продуктов снижается до температуры реагентов, равной 298 К).
Решение.Чтобы записать термохимическое уравнение, надо рассчитать тепловой эффект реакции:
S(т)+ 2N2O(г)= SO2 (г)+ 2N2 (г);H0= Х кДж.
По условию задачи известно, что при сгорании 16 г серы выделяется 66,9 кДж, а в реакции участвует 32 г серы. Составляем пропорцию:
16г 66,9 кДж
32г X кДж X = 133,8 к Дж.
Таким образом, термохимическое уравнение записывается так:
S(т)+ 2N2O(г)= SO2 (г)+ 2N2 (г) ,Н0х..р.=133,8 кДж.
(Так как тепло выделяется, реакция экзотермическая, Н00).
Пример 6.Какое количество теплоты выделится при соединении 5,6 л водорода с хлором (н. у.), если энтальпия образования хлористого водорода равна91,8 кДж/моль (температура продуктов и реагентов равна 25С).
Решение. Н0ƒ,(HCl)= -91,8 кДж/моль, это значит, что при образовании одного моля HCl из простых веществ выделяется 91,8 кДж тепла, что соответствует термохимическому уравнению:
½Cl2 +½ H2 =HCl,H0ƒ=91,8 кДж.
Из уравнения видно, что для получения 1 моль HCl расходуется 0,5 моль Н2, т. е. 0,5·22,4 л = 11,2 л. Составляем пропорцию:
11,2 л 91,8 кДж
5,6 л XX= 45,19 кДж.
Ответ: выделится 45,19 кДж тепла.
Пример 7. Определить энтальпию образования оксида железа (III), исходя из трех термохимических уравнений (справочником не пользоваться):
Fe2O3 + 3CO = 2Fe + 3CO2 , Н01 = 26,5 кДж;
С(графит)+½O2= CO,Н02=110,4 кДж;
СO2= C(графит)+ O2 ,Н03= + 393,3 кДж.
Решение:Запишем уравнение, тепловой эффект которого нужно определить:
4Fe + 3O2 = 2Fe2O3; Н04 = 2Х кДж.
Чтобы из первых трех уравнений получить четвертое, надо уравнение 1) умножить на (2), а уравнения 2) и 3) – на (6) и сложить:
1) 4Fe + 6CO2 = 2Fe2O3 + 6CO, Н01 = 2·(+26,5) кДж;
2) 6CO = 6С(графит)+ 3O2,Н02= 6·(+110,4) кДж;
3) 6C(графит)+ 6O2= 6СO2 ,Н03= 6·(393,3) кДж;
Н04= 2Н01+ 6Н02+ 6Н03= +53 + 662,42359,8 =1644,4 кДж.
Отсюда Н0ƒ(Fe2O3) =822,2 кДж/моль.
studfile.net
Тепловой эффект химических реакций. Закон Гесса. » HimEge.ru
При протекании любых химических реакций происходит разрыв химических связей между атомами в молекулах одних веществ и образование химических связей между атомами в молекулах других веществ. Разрыв химических связей связан с затратами энергии, а образование новых химических связей приводит к выделению энергии. Суммы энергий всех разорванных и всех образованных связей не являются равными, поэтому все реакции проходят либо с выделением, либо с поглощением энергии. Энергия может выделяться или поглощаться в виде звуковых волн, света, работы расширения или сжатия и т.п. В большинстве случаев энергия химической реакции выделяется или поглощается в виде тепла.
Выделение или поглощение теплоты при протекании химической реакции называют тепловым эффектом реакции и обозначают буквой Q.
Реакции, при протекании которых теплота выделяется и передается окружающей среде, называют экзотермическими, а те, при протекании которых теплота поглощается из окружающей среды, называют эндотермическими. Экзотермическим реакциям отвечает положительный тепловой эффект +Q, а эндотермическим – отрицательный тепловой эффект -Q .
Уравнения химических реакций, в которых приведен тепловой эффект реакции, называют термохимическими. В термохимических уравнениях указывают агрегатное состояние веществ (кристаллическое, жидкое, газообразное и т. д.) и могут стоять дробные коэффициенты.
Тепловой эффект реакции зависит от температуры и давления, поэтому, как правило, его приводят для стандартных условий, т. е. температуры 298 К и давления 101,3 кПа.
Тепловой эффект химической реакции рассчитывают по термохимическому уравнению. Представленное ниже термохимическое уравнение реакции сгорания водорода в кислороде:
H2(г) + 1/2 O2(г) = H2О(ж) + 286 кДж
показывает, что на 1 моль сгоревшего водорода или на 1 моль образовавшейся воды выделяется 286 кДж теплоты (Q = 286 кДж, Δ Н= -286 кДж). Эта реакция является экзотермической и характеризуется значительным тепловым эффектом. Недаром водород считается эффективным топливом будущего.
При образовании любого соединения выделяется (поглощается) столько же энергии, сколько поглощается (выделяется) при его распаде на исходные вещества.
Поэтому реакция разложения воды электрическим током требует затрат энергии и является эндотермической:
H2О(ж) = H2(г) + 1/2 O2(г) — 286 кДж (ΔH1 = + 286 кДж).
Это является следствием закона сохранения энергии.
Большинство термохимических расчетов основано на важнейшем законе термохимии, которым является закон Гесса. Этот закон, установленный русским ученым Г.И. Гессом в 1840 г., называют также основным законом термохимии.
Этот закон гласит:
тепловой эффект химической реакции зависит только от начального и конечного состояний веществ и не зависит от промежуточных стадий процесса.
Например, тепловой эффект реакции окисления углерода (графит) в оксид углерода (IV) не зависит от того, проводится ли это окисление в одну стадию (при непосредственном сжигании углерода) до углекислого газа:
С(тв) + О2 (г) = СО2 (г) , ΔH1 реакция 1,
или реакция протекает через промежуточную стадию образования оксида углерода (II):
С(тв) + ½О2 (г) = СО (г) , ΔH2 реакция 2
с последующим дожиганием угарного газа в углекислый газ:
СО (г) + ½О2 (г) = СО2 (г) , ΔH3 реакция 3.
При обоих способах проведения процесса система переходит из одного и того же начального состояния (графит) в одно и то же конечное состояние оксид углерода (IV). В соответствии с законом Гесса тепловой эффект реакции 1 равен сумме тепловых эффектов реакций 2 и 3:
ΔH1= ΔH2 + ΔH3.
Используя закон Гесса можно вычислить тепловой эффект промежуточной стадии реакции, если известны общий тепловой эффект реакции и тепловые эффекты других ее промежуточных стадий.
Пример решения задачи на тепловой эффект.
Реакция окисления глюкозы в организме может протекать так:
С6Н12О6 (тв) + 6О2 (г) = 6СО2 (г) + 6Н2О (ж) + 2803 кДж.
Какое количество теплоты выделится при окислении 800 г глюкозы?
Решение.
М (С6Н12О6) = 180 г/моль.
ν(С6Н12О6) =m/M = 800г/180 г/моль = 4,44 моль.
Q1 = ν(С6Н12О6) · Q = 4,44 · 2803 = 12458 кДж.
Ответ. В результате окисления указанного количества глюкозы выделяется 12 458 кДж теплоты.
himege.ru
1.7. Зависимость теплового эффекта от температуры
Тепловой эффект процесса слабо зависит от давления и может существенно изменяться с температурой.
 и
и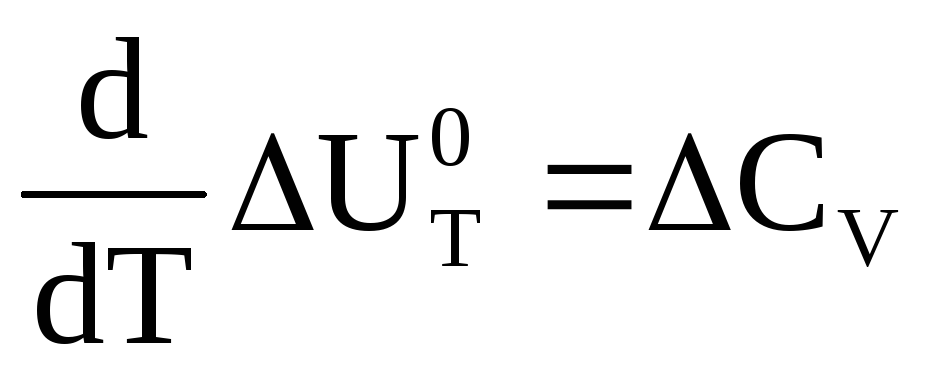 .
.
Эти термодинамические соотношения определяют температурную зависимость теплового эффекта химических реакций и являются дифференциальными выражениеми закона Кирхгофа, одна из формулировок которого гласит:
Температурный коэффициент теплового эффекта равен изменению теплоемкости системы (или разности сумм теплоемкостей продуктов реакции и исходных веществ), происходящему в результате процесса.
Согласно представленным уравнениям,
влияние температуры на тепловой эффект
обуславливается знаками величин 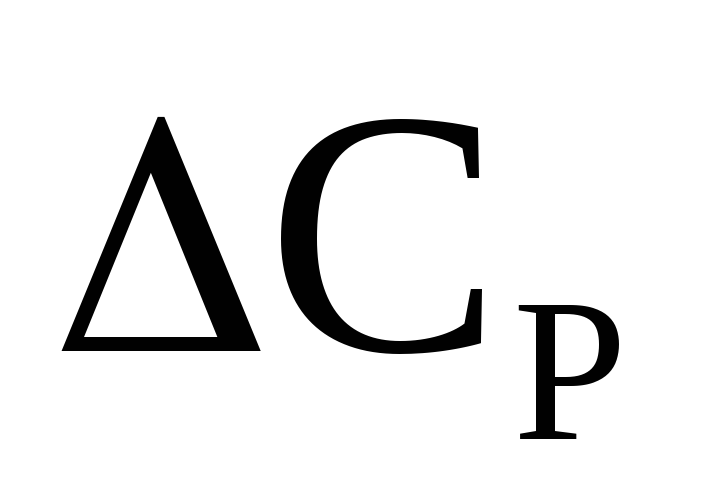 и
и  .
.
Проведем анализ зависимости (рис.4.):

 ,
, ,
таким образом, тепловой эффект процесса
не зависит от температуры
,
таким образом, тепловой эффект процесса
не зависит от температуры ;
; ,
в этом случае тепловой эффект процесса
с ростом температуры увеличивается;
,
в этом случае тепловой эффект процесса
с ростом температуры увеличивается; ,
в этом случае тепловой эффект процесса
с ростом температуры уменьшается.
,
в этом случае тепловой эффект процесса
с ростом температуры уменьшается.
Однако, нам необходимо знать каков тепловой эффект процесса при данной, конкретной температуре.
Интегрируя уравнения Кирхгофа  и
и ,
получим выражения для расчета тепловых
эффектов реакций при произвольных
температурах:
,
получим выражения для расчета тепловых
эффектов реакций при произвольных
температурах:
V = const:

Р = const:
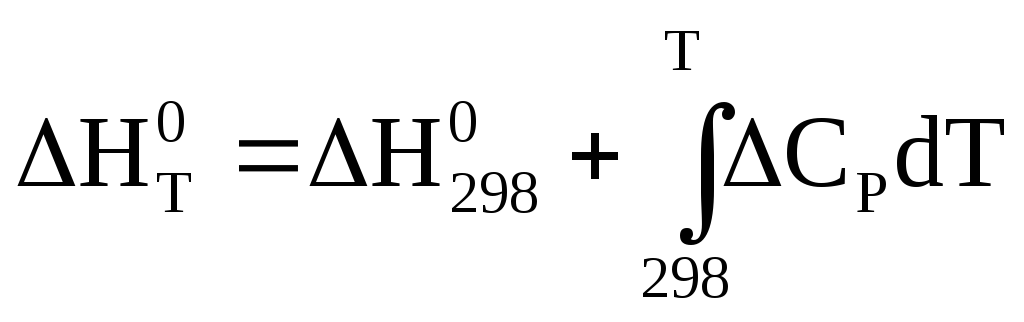 интегральная форма закона Кирхгофа
интегральная форма закона Кирхгофа
где  ,
, – тепловые эффекты, осуществляемые в
стандартных условиях при V,Р = const, которые
рассчитываются по закону Гесса с
использованием стандартных теплот
образования веществ.
– тепловые эффекты, осуществляемые в
стандартных условиях при V,Р = const, которые
рассчитываются по закону Гесса с
использованием стандартных теплот
образования веществ.
Если, например,  и величина отрицательная, то графически
зависимость теплового эффекта от
температуры имеет вид (рис.5.):
и величина отрицательная, то графически
зависимость теплового эффекта от
температуры имеет вид (рис.5.):
В общем случае тепловой эффект при
постоянной теплоемкости можно определить
из уравнения:
общем случае тепловой эффект при
постоянной теплоемкости можно определить
из уравнения:

Часто при проведении расчетов возникает необходимость учета температурной зависимости теплоемкости компонентов реакции. Как правило, аналитическая форма функциональной зависимости C = f(T)неизвестна.В этом случае обычно используют эмпирические соотношения в виде степенных рядов для отдельных компонентов реакции С = + Т + Тn, а затем уже рассчитывается температурная зависимость теплоемкости химической реакции. Тогда, зависимость теплоемкости от температуры приводится к виду
 ,
где
,
где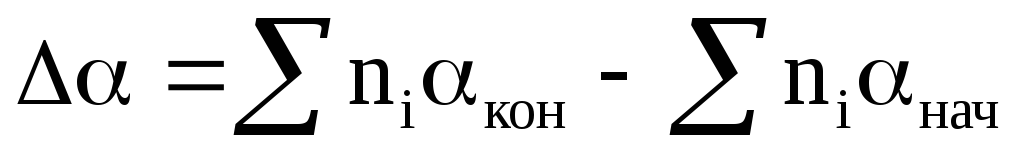 и т.д.
и т.д.
Подставляя это выражение в уравнения Кирхгофа, для стандартных условий, получим
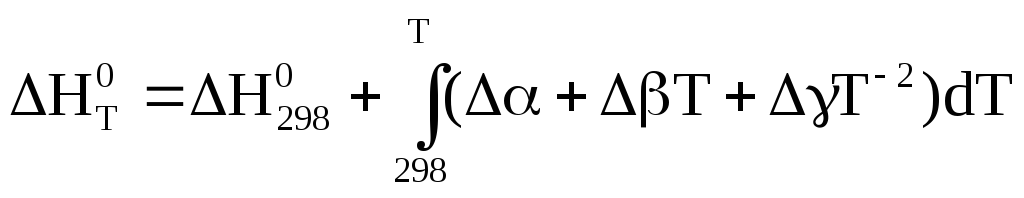 .
.
После интегрирования уравнение приводятся к виду:
 .
.
Если в рассматриваемом интервале температур имеют место фазовые переходы «твердое тело – жидкость», «жидкость – пар», то в уравнениях температурной зависимости теплового эффекта появляются дополнительные составляющие, учитывающие тепловые эффекты фазовых переходов:
 .
.
– изменения изохорной и изобарной теплоемкостей в соответствующих фазовых состояниях (твердом, жидком и газообразном). Температурная зависимость энтальпии, с учетом фазовых переходов, качественно показана на рис.6.

По величине  воспользовавшись соотношением Клаузиуса,
можно рассчитать тепловой эффект
процесса в изохорических условиях, т.е.
приV=const:
воспользовавшись соотношением Клаузиуса,
можно рассчитать тепловой эффект
процесса в изохорических условиях, т.е.
приV=const: ,
гдеn – разность
между числом молей газообразных веществ
в конечном и начальном состояниях
,
гдеn – разность
между числом молей газообразных веществ
в конечном и начальном состояниях .
(например, СО2+С=2СО;n=2-1=1.
.
(например, СО2+С=2СО;n=2-1=1.
При n=0, .
.
2. Второе начало термодинамики. Энтропия.
Все процессы, происходящие в природе, отличаются определенной направленностью, т.е. они совершаются сами собой только в одном направлении, хотя первый закон не запрещает их протекания в обратном направлении.
Необходимо ввести критерии, позволяющие определить возможность и наиболее вероятное направление, а также пределы протекания самопроизвольных процессов.
Попытки найти такой критерий привели к предположению, что самопроизвольно осуществляются только экзотермические процессы. Однако, мы знаем, что многие спонтанные термодинамические процессы, в частности химические реакции, могут протекать как с поглощением теплоты


так и с ее выделение:


сопровождаясь возрастанием неупорядоченности систем (газ более разупорядочен, чем кристалл или жидкость).
Более того, многие реакции, например,


не протекают самопроизвольно, однако сопровождаются отрицательным изменением энтальпии. Поэтому – изменение внутренней энергии или энтальпии не может служить критерием, позволяющим предвидеть направление протекания процесса (реакции).
Критерии возможности направления протекания процесса определяет II закон термодинамики, который был сформулирован в 60-х годах прошлого столетия.
С его помощью решаются сформулированные выше два круга вопросов.
определяется возможность, направление и предел протекания термодинамического процесса в данной системе в заданных условиях.
устанавливаются параметры протекания термодинамического процесса в заданном направлении с необходимой полнотой.
Клаузиусом была введена функция, названная энтропией S, и сформулировано два принципа: принцип существования энтропии и принцип возрастания энтропии в изолированных системах.
Принцип существования энтропии
Для каждой термодинамической системы существует функция состояния системы S — энтропия, определяемая тем, что ее дифференциал (dS) при элементарном обратимом (равновесном) процессе равен отношению бесконечно малого количества теплоты (q), сообщенного системе, к абсолютной температуре системы:
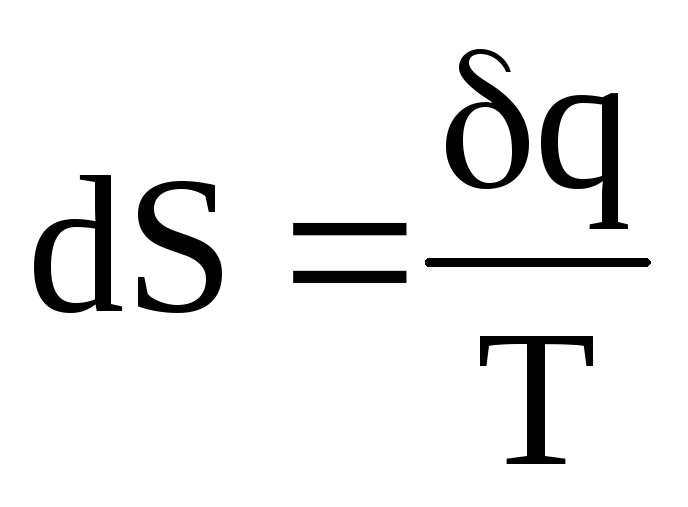 .
.
Принцип возрастания энтропии
Энтропия изолированной системы при наличии в ней необратимых процессов всегда возрастает
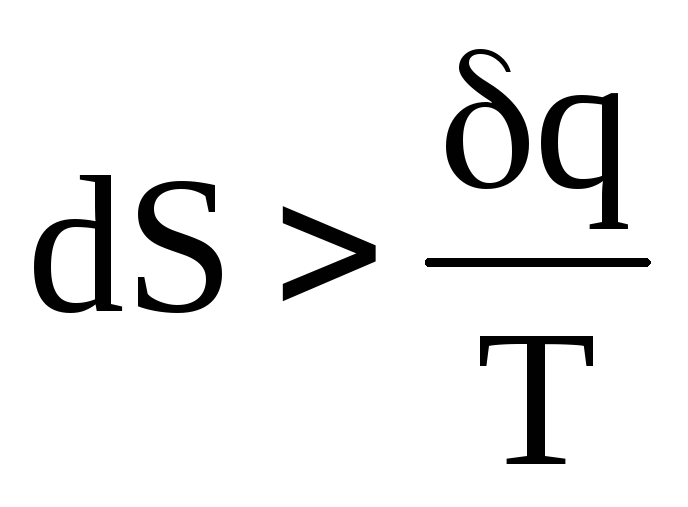 .
.
Таким образом, в изолированной системе обратимые процессы протекают без изменения энтропии, а необратимые — с возрастанием энтропии.
Свойства энтропии
Энтропия– функция состояния системы. Ее изменение зависит от начального и конечного состояний системы.
Энтропияявляется мерой
неупорядоченности системы. .
.
Энтропия – аддитивная функция, т.е. энтропия системы равна сумме энтропий ее частей (это экстенсивный параметр!)
Энтропия– вероятностная функция. Она показывает вероятность процесса и направление наиболее его вероятного протекания:
 ,
(уравнение Больцмана)
,
(уравнение Больцмана)
где W- термодинамическая вероятность;k– постоянная Больцмана. Термодинамическая вероятность – это число микросостояний, т.н. вариантов в расположении частиц (атомов молекул), которыми может быть осуществлено данное макросостояние.
Термодинамическую вероятность, которая может принимать очень большие значения, следует отличать от математической, всегда меньшей единицы.
Энтропия – мера рассеивания энергии в окружающую среду, т.е. та часть энергии, которая в полезную работу не превращается!!!
Все изложенное выше находит отражение в формулировках второго закона термодинамики:
1.Тепло не может самопроизвольно переходить от более холодного к более теплому телу (Клаузиус).
2.Невозможно создать вечный двигатель второго рода, т.е. такую тепловую машину, в которой бы теплота полностью переходила в работу.
3.Любая система, представленная сама себе, будет изменяться в направлении состояния, отвечающего максимальной вероятности (Льюс).
4. Энтропия изолированной системы увеличивается или остается постоянной

> для самопроизвольных необратимых процессов
= для обратимых процессов.
В последней четвертой формулировке заключен критерий самопроизвольности процессов в изолированных системах: спонтанно в такой системе могут протекать те процессы, которые сопровождаются увеличением энтропии (перемешивание газов, выравнивание температур и давлений).
расчет изменения энтропии в обратимых процессах
(равновесных процессах)
1. Нагревание веществ от Т1 до Т2 (неизотермический процесс)
Уравнения для вычисления S изобарного (P=const) и изохорного (V=const) нагревания 1 моля веществ имеют вид:
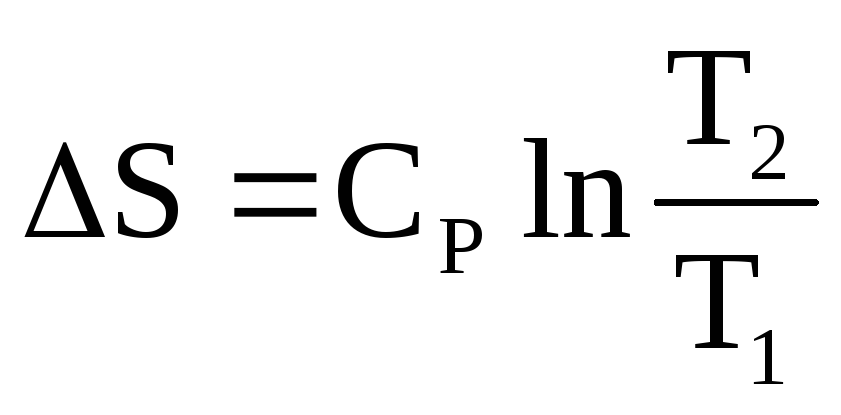 и
и 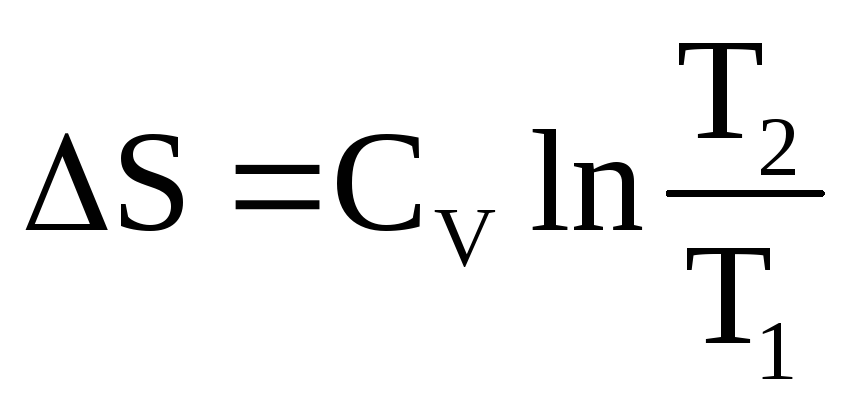 .
.
Для
n
молей:  и
и .
.
2. Изотермическое расширение газа, объем которого изменяется при некоторой температуре Т от V1 до V2:
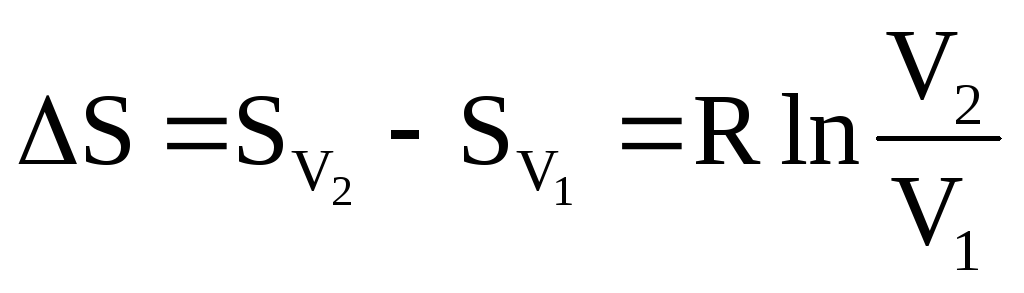 .
.
Для
n
молей: 
3. Изменение энтропии фазовых переходов вычисляется по уравнению
 ,
,
где 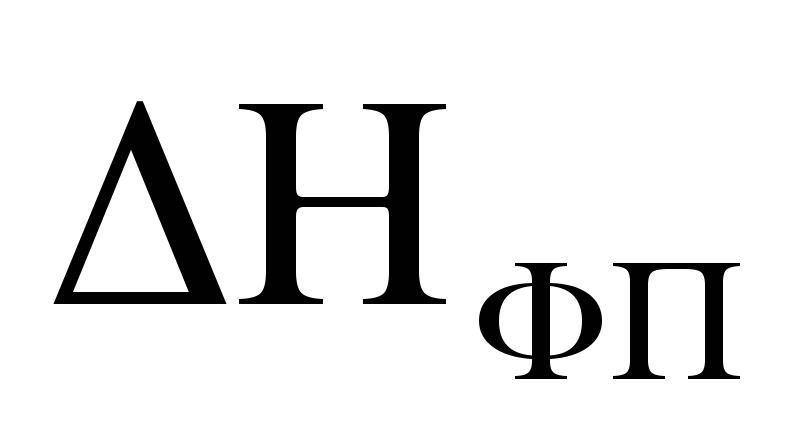 — теплота фазового перехода,
— теплота фазового перехода, —
температура фазового перехода.
—
температура фазового перехода.
Например, теплота фазового перехода воды из жидкого состояния в парообразное (процесс испарения) составляет около 41 кДж/моль. Следовательно, изменение энтропии составляет:
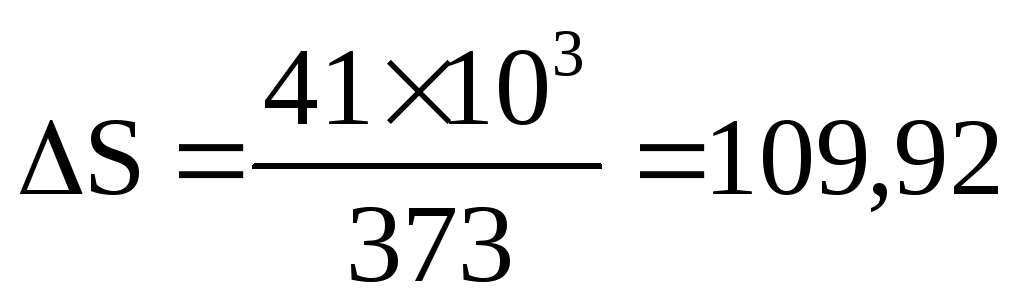 Дж/моль·К.
Дж/моль·К.
4. Изменение энтропии химических реакций, протекающих в изотермических условиях, вычисляется как разность сумм энтропий конечных и исходных веществ участвующих в реакции
 .
.
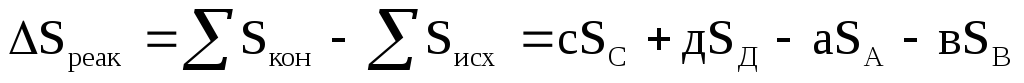 ,
,
где SC, SД, SA, SB — абсолютные энтропии веществ — участников реакции; а, в, с, д — стехиометрические коэффициенты.
Абсолютные значения энтропий веществ вычислены для стандартных условий протекания реакций и представлены в термодинамических справочниках.
Определение абсолютных энтропий веществ стало возможным после формулировки постулата Планка, который позволил определить начало отсчета энтропии — состояния с минимальной энтропией при абсолютном нуле температуры.
Постулат Планка составляет содержание 3 — го закона термодинамики и формулируется так:
«Энтропия полностью упорядоченных кристаллических тел при температуре абсолютного нуля равна 0».
S0К =0, тогда  .
.
Стандартная энтропия индивидуальных веществ (So298) имеют размерность Дж/мольК, т.е. это количество теплоты, которое рассеивается в окружающую среду, если моль вещества нагревается на 1о.
Т. е. Энтропия индивидуальных веществ характеризует энергетически бесполезную теплоту; ту теплоту, которая в работу не переходит.
При расчетах S системы следует не забывать, что энтропии веществ — величины экстенсивные, т.е. зависящие от массы.
применение II закона термодинамика для неизолированных систем
Многие процессы химической технологии
протекают при постоянном давлении и
температуре, если они проводятся в
открытых аппаратах, илипри постоянном
объеме и температуре, если они
проводятся в закрытых аппаратах,
например, в автоклавах. В химической
технологии о направлении процесса и
равновесии в системе при постоянных
давлении и температуре судят по энергии
Гиббса или при постоянных объеме и
температуре — по энергии Гельмгольца.
Это связано с тем, что на практике
рассмотрение изолированных систем и
использование  в качестве критерия равновесия и
направления процесса крайне неудобно,
так как рассмотрение изолированной
системы часто встречает большие
затруднения.
в качестве критерия равновесия и
направления процесса крайне неудобно,
так как рассмотрение изолированной
системы часто встречает большие
затруднения.
Изохорно-изотермические условия (V=const, T=const)
по уравнению Гиббса — Гельмгольца
 .
.
При  — самопроизвольный процесс возможен в
прямом направлении; при
— самопроизвольный процесс возможен в
прямом направлении; при система находится в состоянии равновесия;
при
система находится в состоянии равновесия;
при самопроизвольный процесс в прямом
направлении невозможен, возможен
обратный процесс.Таким
образом, если в системе, находящейся
при Т и V = const, происходит какой-либо
неравновесный самопроизвольный процесс,
то энергия Гельмгольца уменьшается до
тех пор, пока система не достигнет
равновесия.
самопроизвольный процесс в прямом
направлении невозможен, возможен
обратный процесс.Таким
образом, если в системе, находящейся
при Т и V = const, происходит какой-либо
неравновесный самопроизвольный процесс,
то энергия Гельмгольца уменьшается до
тех пор, пока система не достигнет
равновесия.
Изобарно-изотермические условия (Р=const, T=const)
по уравнению Гиббса — Гельмгольца
 .
.
При 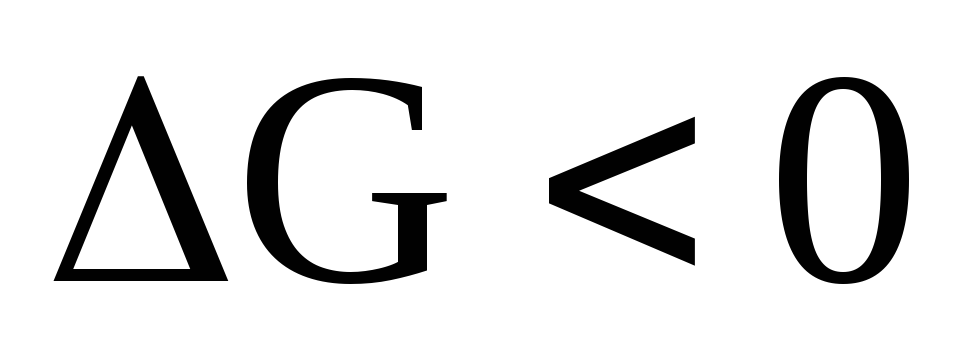 — самопроизвольный процесс возможен в
прямом направлении; при
— самопроизвольный процесс возможен в
прямом направлении; при система находится в состоянии равновесия;
при
система находится в состоянии равновесия;
при самопроизвольный процесс в прямом
направлении невозможен, возможен
обратный процесс.Таким
образом, если в системе, находящейся
при Т и V = const, происходит какой-либо
неравновесный самопроизвольный процесс,
то энергия Гельмгольца уменьшается до
тех пор, пока система не достигнет
равновесия.
самопроизвольный процесс в прямом
направлении невозможен, возможен
обратный процесс.Таким
образом, если в системе, находящейся
при Т и V = const, происходит какой-либо
неравновесный самопроизвольный процесс,
то энергия Гельмгольца уменьшается до
тех пор, пока система не достигнет
равновесия.
studfile.net
 ,
кДж/моль
,
кДж/моль ,
, ,
таким образом, тепловой эффект процесса
не зависит от температуры
,
таким образом, тепловой эффект процесса
не зависит от температуры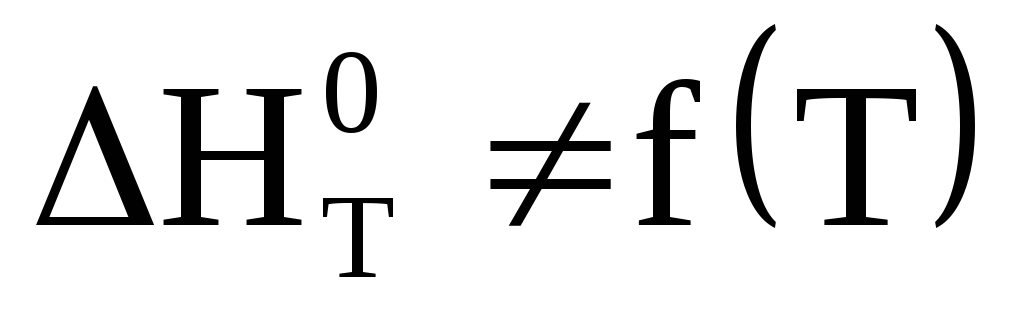 ;
; ,
в этом случае тепловой эффект процесса
с ростом температуры увеличивается;
,
в этом случае тепловой эффект процесса
с ростом температуры увеличивается; ,
в этом случае тепловой эффект процесса
с ростом температуры уменьшается.
,
в этом случае тепловой эффект процесса
с ростом температуры уменьшается.