Термохимические уравнения — Решение задач — Уроки химии — Классная комната
Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Например: Термохимическое уравнение разложения малахита
(CuOH)2 CO3 = 2CuO + H 2 O + CO 2 — 47 кДж
Мы видим, что на разложение 1
моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля
оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в
2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля
оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества.
Решим задачи:
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mq + O2 = 2MqO + 1204 кДж
Дано: m (Mg0) = 120г Найти: Q1 -? | Решение: 1) Определяем
количества оксида магния, используя формулу для нахождения количества
вещества через массу.
n = m / M n(MqO) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции По уравнению 2 моля MqO — 1204 кДж По условию 3 моля MqO — Q1 |
Отсюда
|
| 3 моль* 1204кДж |
|
Q1 | = | = 1803 кДж | |
|
| 2моль |
|
Ответ: При образовании 120г
оксида магния выделится 1803 кДж энергии.
Задача 2. В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
Дано: Q1 = 652,5 кДж Найти: m(C2H2)-? | Решение:
1) Установим пропорциональные отношения между количеством вещества ацетилена и количеством теплоты. По уравнению 2 моль C2H2_———- 2610 кДж По условию х моль ———- 652,5 кДж
Решаем пропорцию
2) Определяем массу ацетилена по формуле m= n * M m
= 0,5 моль * 26 г/моль = 13 г.
|
Ответ: масса сгоревшего ацетилена 13 г.
Задача 3. В результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте термохимическое уравнение этой реакции.
Дано: m(CH4)= 48г Q1 = 2406 кДж Найти: Q -?
| Решение: 1. Запишем уравнение реакции горения метана в общем виде
CH4+ 2O2 = CO2 +2H2O + Q
2. Определим количество 48 г метана
n = m / M n(CH4) = 48г/ 16 г/моль = 3 моль
3. Составляем пропорцию с учетом коэффициентов в уравнении реакции
По условию 3моля CH4 — 2406 кДж По уравнению 1 моль CH4 — Q
Решаем пропорцию
Ответ: термохимическое уравнение реакции горения метана
CH4+ 2O2 = CO2 +2H2O + 802 кДж
|
Задача 4. Какой объем
кислорода (при н.у.) выделится в результате реакции, термохимическое уравнение
которой
Какой объем
кислорода (при н.у.) выделится в результате реакции, термохимическое уравнение
которой
2KClO3 = 2KCl + 3O2 – 91 кДж,
если на разложение бертолетовой соли было затрачено 182 кДж теплоты.
Дано: Q1 = 91 кДж
Найти: V (O2)-? | Решение:
1)Установим пропорциональные отношения между количеством вещества кислорода и количеством теплоты.
По уравнению 3 моль O2 ———- 91 кДж По условию х моль ———- 182 кДж
Решаем пропорцию
2) Вычислим объем кислорода, согласно закону Авогадро (Vm = 22б4 л.
V(O2) = 6 моль * 22,4 л/моль = 134,4 л
|
Ответ: объем выделившегося кислорода равен 134,4 л.
Решите самостоятельно:
1. Согласно термохимическому уравнению реакции
CH4+ 2O2 = CO2 +2H2
O + 802 кДж
определите количество теплоты, выделившейся при сжигании 24 г метана.
2. Тепловой эффект реакции горения серы равен 297 кДж. Какая масса серы сгорела, если выделилось 742,5 кДж теплоты.
3. По термохимическому уравнению H2+ Cl2 = 2HCl + 184,36 кДж рассчитайте, какой объем затрачен на образование хлороводорода (при н.у.), если при этом выделилось 921,8 кДж теплоты.
Проверьте решение на тренажере
Термохимические реакции примеры из органической химии.
 Термохимические уравнения реакций
Термохимические уравнения реакцийЗадача 10.1. Используя термохимическое уравнение: 2Н 2 (г) + O 2 (г) = 2Н 2 О (г) + 484 кДж , определите массу образовавшейся воды, если выделилось 1479 кДж энергии.
Решение. Записываем уравнение реакции в виде:
Имеем
x = (2 моль 1479 кДж) / (484 кДж) = 6,11 моль .
Откуда
m(Н 2 О) = v М = 6,11 моль 18 г/моль = 110 г
Если в условии задачи не указано количество реагирующего вещества, а сообщается лишь об изменении некоторой величины (массы или объема), относящейся, как правило, к смеси веществ, то удобно вводить в уравнение реакции дополнительный член, соответствующий этому изменению.
Задача 10.2. К смеси этана и ацетилена объемом 10 л (н.у.) добавили 10 л (н.у.) водорода. Смесь пропустили над нагретым платиновым катализатором. После приведения продуктов реакции к исходным условиям объем смеси стал равен 16 л. Определите массовую долю ацетилена в смеси.
Решение. Водород реагирует с ацетиленом, но не с этаном.
Водород реагирует с ацетиленом, но не с этаном.
С 2 Н 6 + Н2 2 ≠
С 2 Н 2 + 2Н 2 → С 2 Н 6
При этом объем системы уменьшается на
ΔV = 10 + 10 — 16 = 4 л .
Уменьшение объема связано с тем, что объем продукта (С 2 Н 6) меньше объема реагентов (С 2 Н 2 и Н 2).
Запишем уравнение реакции, введя выражение ΔV.
Если в реакцию вступят 1 л С 2 Н 2 и 2л Н 2 , а образуется 1 л С 2 Н 6 , то
ΔV = 1 + 2 — 1 = 2 л .
Из уравнения видно, что
V(С 2 Н 2) = х = 2 л .
Тогда
V(С 2 Н 6) = (10 — х) = 8 л .
Из выражением
m / М = V / V M
имеем
m = М V / V M
m(С 2 Н 2) = М V / V M = (26 г/моль 2л) / (22,4 л/моль) = 2,32 г,
m(С 2 Н 6) = М V / V M ,
m(смеси) = m(С 2 Н 2) + m(С 2 Н 6) = 2,32 г + 10,71 г = 13,03 г ,
w(С 2 Н 2) = m(С 2 Н 2) / m(смеси) = 2,32 г / 13,03 г = 0,18 .
Задача 10.3. Железную пластинку массой 52,8 г поместили в раствор сульфата меди (II). Определите массу растворившегося железа, если масса пластинки стала равной 54,4 г.
Определите массу растворившегося железа, если масса пластинки стала равной 54,4 г.
Решение. Изменение массы пластинки равно:
Δm = 54,4 — 52,8 = 1,6 г .
Запишем уравнение реакции. Видно, что если из пластинки растворится 56 г железа, то на пластинку будет осаждено 64 г меди и пластинка станет тяжелее на 8 г:
Видно, что
m(Fe) = х = 56 г 1,6 г / 8 г = 11,2 г .
Задача 10.4. В 100 г раствора, содержащего смесь хлороводородной и азотной кислот, растворяется максимум 24,0 г оксида меди(II). После упаривания раствора и прокаливания остатка его масса составляет 29,5 г. Напишите уравнения происходящих реакций и определите массовую долю хлороводородной кислоты в исходном растворе.
Решение. Напишем уравнения реакций:
СuО + 2НCl = СuСl 2 + Н 2 O (1)
СuО + 2НNO 3 = Сu(NO 3) 2 + Н 2 O (2)
2Сu(NO 3) 2 = 2СuО + 4NO 2 + O 2 (3)
Видно, что увеличение массы с 24,0 г до 29,5 г связано только с первой реакцией, ведь оксид меди, растворенный в азотной кислоте по реакции (2), в ходе реакции (3) вновь превратился в оксид меди такой же массы. Если в ходе реакции (1) прореагирует 1 моль СuО массой 80 г и образуется 1 моль СuСl 2 массой 135 г, то масса увеличится на 55 г. Учитывая, что масса 2 моль НСl равна 73 г, напишем уравнение (1) еще раз, добавив выражение Δm.
Если в ходе реакции (1) прореагирует 1 моль СuО массой 80 г и образуется 1 моль СuСl 2 массой 135 г, то масса увеличится на 55 г. Учитывая, что масса 2 моль НСl равна 73 г, напишем уравнение (1) еще раз, добавив выражение Δm.
Видно, что
m(НСl) = х = 73 г 5,5 г / 55 г = 7,3 г .
Находим массовую долю кислоты:
w(НСl) = m(НСl) / m р-ра =
= 7,3 г / 100 г = 0,073 .
Из материалов урока вы узнаете, какое уравнение химической реакции называют термохимическим. Урок посвящен изучению алгоритма расчетов по термохимическому уравнению реакций.
Тема: Вещества и их превращения
Урок: Расчеты по термохимическим уравнениям
Практически все реакции протекают с выделением или поглощением теплоты. Количество теплоты, которое выделяется или поглощается в ходе реакции, называется тепловым эффектом химической реакции .
Если тепловой эффект записан в уравнении химической реакции, то такое уравнение называют термохимическим .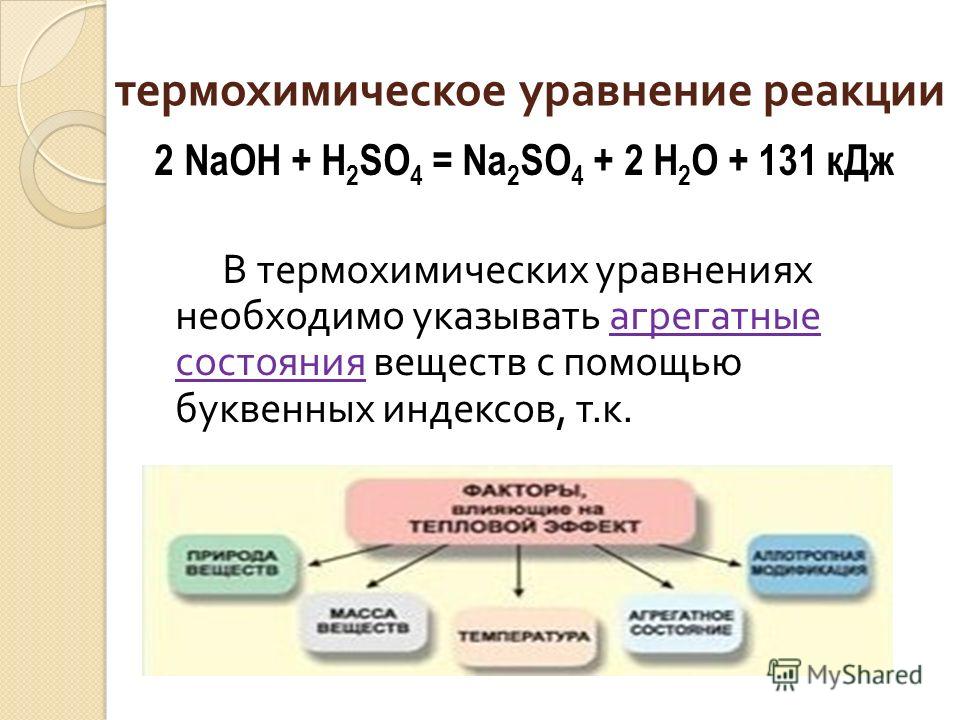
В термохимических уравнениях, в отличие от обычных химических, обязательно указывают агрегатное состояние вещества (твердое, жидкое, газообразное).
Например, термохимическое уравнение реакции между оксидом кальция и водой выглядит так:
СаО (т) + Н 2 О (ж) = Са(ОН) 2(т) + 64 кДж
Количество теплоты Q, выделившееся или поглощенное при протекании химической реакции, пропорционально количеству вещества реагента или продукта. Поэтому, пользуясь термохимическими уравнениями, можно производить различные расчеты.
Рассмотрим примеры решения задач.
Задача 1: Определите количество теплоты, затраченное на разложение 3,6 г воды в соответствии с ТХУ реакции разложения воды:
Решить эту задачу можно с помощью пропорции:
при разложении 36 г воды поглотилось 484 кДж
при разложении 3,6 г воды поглотилось x кДж
Таким образом, можно составить уравнение реакции. Полное решение задачи приведено на Рис.1.
Рис.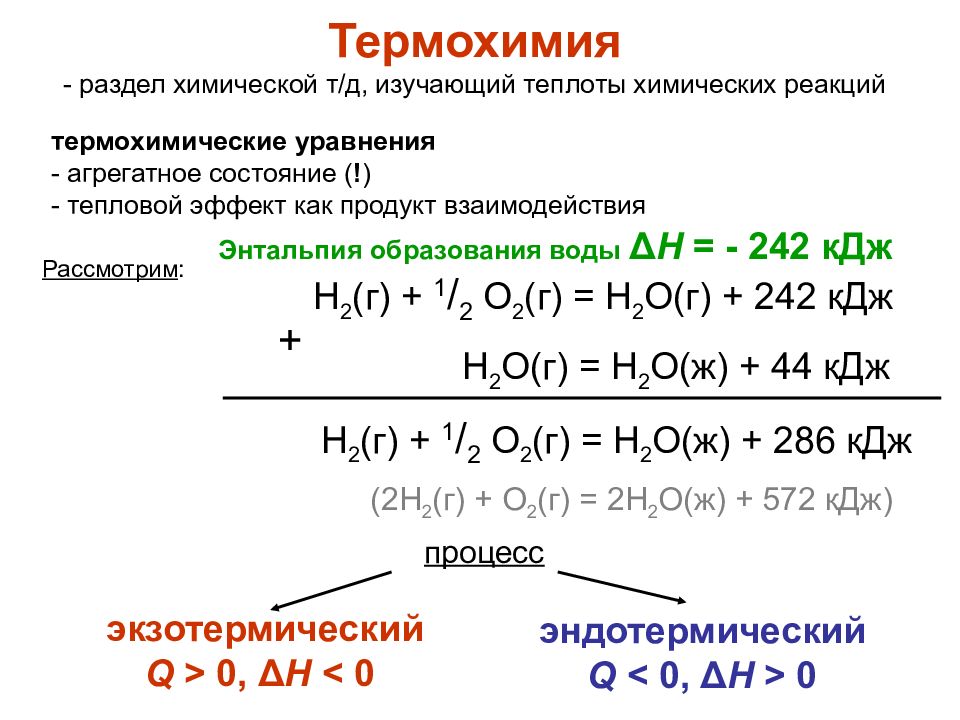 1. Оформление решения задачи 1
1. Оформление решения задачи 1
Задача может быть сформулирована таким образом, что вам нужно будет составить термохимическое уравнение реакции. Рассмотрим пример такой задачи.
Задача 2 : При взаимодействии 7 г железа с серой выделилось 12,15 кДж теплоты. На основании этих данных составьте термохимическое уравнение реакции.
Обращаю ваше внимание на то, что ответом в данной задаче служит само термохимическое уравнение реакции.
Рис. 2. Оформление решения задачи 2
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П.А. Оржековского и др. «Химия. 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. — М.: АСТ: Астрель, 2006. (с.80-84)
2. Химия: неорган. химия: учеб. для 8кл. общеобр. учрежд. /Г.Е. Рудзитис, Ф.Г. Фельдман. — М.: Просвещение, ОАО «Московские учебники», 2009. (§23)
3. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. — М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Решение задач: расчеты по термохимическим уравнениям ().
Решение задач: расчеты по термохимическим уравнениям ().
2. Термохимические уравнения ().
Домашнее задание
1) с. 69 задачи №№ 1,2 из учебника «Химия: неорган. химия: учеб. для 8кл. общеобр. учрежд.» /Г.Е. Рудзитис, Ф.Г. Фельдман. — М.: Просвещение, ОАО «Московские учебники», 2009.
2) с.80-84 №№ 241, 245 из Сборника задач и упражнений по химии: 8-й кл.: к учеб. П.А. Оржековского и др. «Химия. 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. — М.: АСТ: Астрель, 2006.
Термохимические уравнении. Количество теплоты. которое выделяется или поглощается в результате реакции между определенными количествами реагентов, задаваемых стехиометричес-кими коэффициентами, называют тепловым эффектом химической реакции и обычно обозначают символом Q.
Экзотермические н эндотермические реакции.
Термохимический закон Гессе
Реакции, протекающие с выделением энергии в форме теплоты, получили название экзотермических; реакции, протекающие с поглощением энергии в форме теплоты,- эндотермических. Доказано, что в изобарных химических процессах выделившаяся (или поглощенная) теплота есть мера уменьшения (или, соответственно, увеличения) энтальпии реакции ЛЯ.
Таким образом, при экзотермических реакциях, когда теплота выделяется, АН отрицательна. При эндотермических реакциях (теплота поглощается) АН положительна.
Величина теплового эффекта химической реакции зависит от природы исходных веществ и продуктов реакция, их агрегатного состояния и температуры.
Уравнение реакции, в правой части которого наряду с продуктами реакции указывается изменение энтальпии АН или тепловой эффект реакции Qp, называют термохимическим.
Примером экзотермической реакции может служить реакция образования воды:
2Н2(Г) + 02(г)=2Н20(Г)
Для осуществления этой реакции необходимо затратить энергию на разрыв связей в молекулах Н2 и 02. Эти количества энергии соответственно равны 435 и 494 кДж/моль. С другой стороны, при образовании связи О — Н выделяется 462 кДж/моль энергии.
Суммарное количество энергии (1848 кДж), выделившейся при образовании связей О — Н, больше, чем суммарное количество энергии (1364 кДж), затраченной на разрыв связей Н — Н и О = О, поэтому реакция является экзотермической, т.
Доказано, что в изобарных химических процессах выделившаяся (или поглощенная) теплота есть мера уменьшения (или, соответственно, увеличения) энтальпии реакции ЛЯ.
Таким образом, при экзотермических реакциях, когда теплота выделяется, АН отрицательна. При эндотермических реакциях (теплота поглощается) АН положительна.
Величина теплового эффекта химической реакции зависит от природы исходных веществ и продуктов реакция, их агрегатного состояния и температуры.
Уравнение реакции, в правой части которого наряду с продуктами реакции указывается изменение энтальпии АН или тепловой эффект реакции Qp, называют термохимическим.
Примером экзотермической реакции может служить реакция образования воды:
2Н2(Г) + 02(г)=2Н20(Г)
Для осуществления этой реакции необходимо затратить энергию на разрыв связей в молекулах Н2 и 02. Эти количества энергии соответственно равны 435 и 494 кДж/моль. С другой стороны, при образовании связи О — Н выделяется 462 кДж/моль энергии.
Суммарное количество энергии (1848 кДж), выделившейся при образовании связей О — Н, больше, чем суммарное количество энергии (1364 кДж), затраченной на разрыв связей Н — Н и О = О, поэтому реакция является экзотермической, т. е. при образовании двух молей парообразной воды выделится 484 кДж энергии.
Уравнение реакции образования воды, записанное с учетом изменения энтальпии
Экзотермические н эндотермические реакции.
Термохимический закон Гессе
будет уже термохимическим уравнением реакции.
Примером эндотермической реакции может служить образование оксида азота (II)
Для осуществления этой реакции необходимо затратить энергию на разрыв связей N = N и 0 = 0 в молекулах исходных веществ. Они соответственно равны 945 и 494 кДж/моль. При образовании связи N = О выделяется энергия в количестве 628,5 кДж/моль. Суммарное количество энергии, необходимой для разрыва связей в молекулах исходных веществ, равно 1439 кДж и больше, чем выделившаяся энергия образования связей в молекулах продукта реакции (1257 кДж). Поэтому реакция является эндотермической и для ее протекания требуется поглощение энергии в количестве 182 кДж из окружающей среды.
Термохимические уравнения Экзотермические н эндотермические реакции.
Термохимический закон Гессе
Этим и объясняется, что оксид азота (II) образуется только при высоких температурах, например, в выхлопных газах автомобилей, в грозовых разрядах и не образуется в обычных условиях.
е. при образовании двух молей парообразной воды выделится 484 кДж энергии.
Уравнение реакции образования воды, записанное с учетом изменения энтальпии
Экзотермические н эндотермические реакции.
Термохимический закон Гессе
будет уже термохимическим уравнением реакции.
Примером эндотермической реакции может служить образование оксида азота (II)
Для осуществления этой реакции необходимо затратить энергию на разрыв связей N = N и 0 = 0 в молекулах исходных веществ. Они соответственно равны 945 и 494 кДж/моль. При образовании связи N = О выделяется энергия в количестве 628,5 кДж/моль. Суммарное количество энергии, необходимой для разрыва связей в молекулах исходных веществ, равно 1439 кДж и больше, чем выделившаяся энергия образования связей в молекулах продукта реакции (1257 кДж). Поэтому реакция является эндотермической и для ее протекания требуется поглощение энергии в количестве 182 кДж из окружающей среды.
Термохимические уравнения Экзотермические н эндотермические реакции.
Термохимический закон Гессе
Этим и объясняется, что оксид азота (II) образуется только при высоких температурах, например, в выхлопных газах автомобилей, в грозовых разрядах и не образуется в обычных условиях.
Для того, чтобы сравнивать энергетические эффекты различных процессов, тепловые эффекты определяют при стандартных условиях . За стандартные принимают давление 100 кПа (1 бар), температуру 25 0 С (298 К), концентрацию — 1 моль/л. Если исходные вещества и продукты реакции находятся в стандартном состоянии, то тепловой эффект химической реакции называется стандартной энтальпией системы и обозначается ΔН 0 298 или ΔН 0 .
Уравнения химических реакций с указанием теплового эффекта называют термохимическими уравнениями .
В
термохимических уравнениях указывают
фазовое состояние и полиморфную
модификацию реагирующих и образующихся
веществ: г -газовое, ж — жидкое, к
-кристаллическое, т — твердое, р —
растворенное и др. Если агрегатные
состояния веществ для условий реакции
очевидны, например, О 2 ,
N 2 ,
Н 2 — газы, Аl 2 О 3 ,
СаСО 3 — твердые вещества и т. д. при 298 К, то их
могут не указывать.
д. при 298 К, то их
могут не указывать.
Термохимическое уравнение включает в себя тепловой эффект реакции ΔН , который в современной терминологии записывают рядом с уравнением. Например:
С 6 Н 6(Ж) + 7,5О 2 = 6СО 2 + 3Н 2 О (Ж) ΔН 0 = — 3267,7 кДж
N 2 + 3Н 2 = 2NН 3(Г) ΔН 0 = — 92,4 кДж.
С термохимическими уравнениями можно оперировать, как и с алгебраическими уравнениями (складывать, вычитать друг из друга, умножать на постоянную величину и т.д.).
Термохимические
уравнения часто (но не всегда) приводятся
для одного моля рассматриваемого
вещества (получаемого или расходуемого).
При этом другие участники процесса
могут входить в уравнение с дробными
коэффициентами. Это допускается, так
как термохимические уравнения оперируют
не с молекулами, а с молями веществ.
Это допускается, так
как термохимические уравнения оперируют
не с молекулами, а с молями веществ.
Термохимические расчеты
Тепловые эффекты химических реакций определяют как экспериментально, так и с помощью термохимических расчетов.
В основе термохимических расчетов лежит закон Гесса (1841 г):
Тепловой эффект реакции не зависит от пути, по которому протекает реакция (т.е. от числа промежуточных стадий), а определяется начальным и конечным состоянием системы.
Например, реакция горения метана может протекать по уравнению:
СН 4 +2О 2 = СО 2 + 2Н 2 О (Г) ΔН 0 1 = -802,34 кДж
Эту же реакцию можно провести через стадию образования СО:
СН 4 +3/2О 2 = СО + 2Н 2 О (Г) ΔН 0 2 = -519,33 кДж
СО +1/2О 2 = СО 2 ΔН 0 3 = -283,01 кДж
При
этом оказывается, что ΔН 0 1 = ΔН 0 2 + ΔН 0 3 . Следовательно, тепловой эффект реакции,
протекающей по двум путям, одинаков.
Закон Гесса хорошо иллюстрируется с
помощью энтальпийных диаграмм (рис.2)
Следовательно, тепловой эффект реакции,
протекающей по двум путям, одинаков.
Закон Гесса хорошо иллюстрируется с
помощью энтальпийных диаграмм (рис.2)
Из закона Гесса вытекает ряд следствий:
1. Тепловой эффект прямой реакции равен тепловому эффекту обратной реакции с противоположным знаком.
2. Если в результате ряда последовательных химических реакций система приходит в состояние, полностью совпадающее с исходным, то сумма тепловых эффектов этих реакций равна нулю (ΔН = 0). Процессы, в которых система после последовательных превращений возвращается в исходное состояние, называются круговыми процессами или циклами . Метод циклов широко используется в термохимических расчетах. .
3. Энтальпия химической реакции равна сумме энтальпий образования продуктов реакций за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
Здесь встречаемся с понятием «»энтальпия образования»» .
Энтальпией
(теплотой) образования химического
соединения называется тепловой эффект
реакции образования 1 моля этого
соединения из простых веществ, взятых
в их устойчивом состоянии при данных
условиях. Обычно теплоты образования относят к
стандартному состоянию, т.е. 25 0 С
(298 К) и 100 кПа. Стандартные энтальпии
образования химических веществ
обозначаются ΔН 0 298 (или ΔН 0 ),
измеряются в кДж/моль и приводятся в
справочниках. Энтальпию образования
простых веществ, устойчивых при 298 К и
давлении 100 кПа, принимают равной нулю.
Обычно теплоты образования относят к
стандартному состоянию, т.е. 25 0 С
(298 К) и 100 кПа. Стандартные энтальпии
образования химических веществ
обозначаются ΔН 0 298 (или ΔН 0 ),
измеряются в кДж/моль и приводятся в
справочниках. Энтальпию образования
простых веществ, устойчивых при 298 К и
давлении 100 кПа, принимают равной нулю.
В таком случае следствие из закона Гесса для теплового эффекта химической реакции (ΔН (Х.Р.) ) имеет вид:
ΔН (Х.Р.) = ∑ΔН 0 продуктов реакции — ∑ΔН 0 исходных веществ
Используя закон Гесса, можно рассчитывать энергию химической связи, энергию кристаллических решеток, теплоты сгорания топлив, калорийность пищи и т.д.
Наиболее распространенные расчеты – вычисление тепловых эффектов (энтальпий) реакций, что необходимо для технологических и научных целей.
Пример
1. Напишите
термохимическое уравнение реакции
между СО 2(Г) и водородом,
в результате которой образуются СН 4(Г) и Н 2 О (Г) ,
вычислив ее тепловой эффект на основе
данных, приведенных в приложении. Сколько
теплоты выделится в этой реакции при
получении 67,2 л метана в пересчете на
стандартные условия?
Сколько
теплоты выделится в этой реакции при
получении 67,2 л метана в пересчете на
стандартные условия?
Решение .
СО 2(Г) + 3Н 2(Г) = СН 4(Г) + 2Н 2 О (Г)
Находим в справочнике (приложение) стандартные теплоты образования соединений, участвующих в процессе:
ΔН 0 (СО 2(Г) ) = -393,51 кДж/моль ΔН 0 (СН 4(Г) ) = -74,85 кДж/моль ΔН 0 (Н 2(Г) ) = 0 кДж/моль ΔН 0 (Н 2 О (Г) ) = ―241,83 кДж/моль
Обратите
внимание, что теплота образования
водорода, как и всех простых веществ в
их устойчивом при данных условиях
состоянии, равна нулю. Рассчитываем
тепловой эффект реакции:
Рассчитываем
тепловой эффект реакции:
ΔН (Х.Р.) = ∑ΔН 0 (прод.) — ∑ΔН 0 (исх.) =
ΔН 0 (СН 4(Г) ) + 2ΔН 0 (Н 2 О (Г) ) — ΔН 0 (СО 2(Г) ) -3ΔН 0 (Н 2(Г) )) =
74,85 + 2(-241,83) — (-393,51) — 3·0 = -165,00 кДж/моль.
Термохимическое уравнение имеет вид:
СО 2(Г) + 3Н 2(Г) = СН 4(Г) + 2Н 2 О (Г) ; ΔН = -165,00 кДж
Согласно этому термохимическому уравнению, 165,00 кДж теплоты выделится при получении 1 моль, т.е. 22,4 л метана. Количество теплоты, выделившейся при получении 67,2 л метана, находим из пропорции:
22,4 л — 165,00 кДж 67,2·165,00
67,2 л — Q кДж Q = —— = 22,4
Пример
2. При сгорании
1л этилена С 2 Н 4(Г)
(стандартные условия) с образованием
газообразного оксида углерода (IV) и
жидкой воды выделяется 63,00 кДж теплоты.
Рассчитайте по этим данным мольную
энтальпию горения этилена и запишите
термохимическое уравнение реакции.
Вычислите энтальпию образования С 2 Н 4(Г)
и сравните полученное значение с
литературными данными (приложение).
При сгорании
1л этилена С 2 Н 4(Г)
(стандартные условия) с образованием
газообразного оксида углерода (IV) и
жидкой воды выделяется 63,00 кДж теплоты.
Рассчитайте по этим данным мольную
энтальпию горения этилена и запишите
термохимическое уравнение реакции.
Вычислите энтальпию образования С 2 Н 4(Г)
и сравните полученное значение с
литературными данными (приложение).
Решение. Составляем и уравниваем химическую часть требующегося термохимического уравнения:
С 2 Н 4(Г) + 3О 2(Г) = 2СО 2(Г) + 2Н 2 О (Ж) ; Н = ?
Создаваемое термохимическое уравнение описывает горение 1 моль, т.е. 22,4 л этилена. Необходимую для него мольную теплоту горения этилена находим из пропорции:
1л — 63,00 кДж 22,4·63,00
22,4 л — Q кДж Q = —— =
1410,96 кДж
Н = -Q , термохимическое уравнение горения этилена имеет вид: С 2 Н 4(Г) + 3О 2(Г) = 2СО 2(Г) + 2Н 2 О (Ж) ; Н = -1410,96 кДж
Для
расчета энтальпии образования С 2 Н 4(Г) привлекаем
следствие из закона Гесса: ΔН (Х. Р.) = ∑ΔН 0 (прод.)
— ∑ΔН 0 (исх.).
Р.) = ∑ΔН 0 (прод.)
— ∑ΔН 0 (исх.).
Используем найденную нами энтальпию горения этилена и приведенные в приложении энтальпии образования всех (кроме этилена) участников процесса.
1410,96 = 2·(-393,51) + 2·(-285,84) — ΔН 0 (С 2 Н 4(Г) ) — 3·0
Отсюда ΔН 0 (С 2 Н 4(Г) ) = 52,26 кДж/моль. Это совпадает со значением, приведенным в приложении и доказывает правильность наших вычислений.
Пример 3. Напишите термохимическое уравнение образования метана из простых веществ, вычислив энтальпию этого процесса из следующих термохимических уравнений:
СН 4(Г) + 2О 2(Г) = СО 2(Г) + 2Н 2 О (Ж) ΔН 1 = -890,31 кДж (1)
С (ГРАФИТ) + О 2(Г) = СО 2(Г) Н 2 = -393,51 кДж (2)
Н 2(Г) + ½О 2(Г) = Н 2 О (Ж) Н 3 = -285,84 кДж (3)
Сравните
полученное значение с табличными данными
(приложение).
Решение. Составляем и уравниваем химическую часть требующегося термохимического уравнения:
С (ГРАФИТ) + 2Н 2(Г) = СН 4(Г) Н 4 = Н 0 (СН 4(Г)) ) =? (4)
С термохимическими уравнениями можно оперировать так же, как и с алгебраическими. Мы должны в результате алгебраических действий с уравнениями 1, 2 и 3 получить уравнение 4. Для этого следует уравнение 3 умножить на 2, результат сложить с уравнением 2 и вычесть уравнение 1.
2Н 2(Г) + О 2(Г) = 2Н 2 О (Ж) Н 0 (СН 4(Г) ) = 2 Н 3 + Н 2 — Н 1
+ С (ГРАФИТ) + О 2(Г) + СО 2(Г) Н 0 (СН 4(Г) ) = 2(-285,84)
— СН 4(Г) — 2О 2(Г) -СО 2(Г) — 2Н 2 О (Ж) + (-393,51)
С (ГРАФИТ) + 2Н 2(Г) = СН 4(Г) Н 0 (СН 4(Г) ) = -74,88 кДж
Это
совпадает со значением, приведенным в
приложении, что доказывает правильность
наших вычислений.
Задача 1.
При сгорании 560 мл (н.у.) ацетилена согласно термохимическому уравнению:
2С 2 Н 2(Г) + 5О 2(г) = 4СО 2(Г) + 2Н 2 О (Г) + 2602,4 кДж
выделилось:
1) 16,256 кДж; 2) 32,53кДж; 3) 32530 кДж; 4) 16265кДж
Дано:
объем ацетилена: V(С 2 Н 2) = 560 мл.
Найти: количество выделившейся теплоты.
Решение:
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 2.
Небольшая хитрость, приводящая невнимательных учеников к неверному ответу № 3, заключалась в единицах измерения объема ацетилена. Объем, указанный в условии в миллилитрах, обязательно нужно было перевести в литры, так как молярный объем измеряется в (л/моль).
Объем, указанный в условии в миллилитрах, обязательно нужно было перевести в литры, так как молярный объем измеряется в (л/моль).
Изредка встречаются задачи, в которых термохимическое уравнение необходимо составить самостоятельно по значению теплоты образования сложного вещества.
Задача 1.2.
Теплота образования оксида алюминия равна 1676 кДж/моль. Определите тепловой эффект реакции, в которой при взаимодейс твии алюминия с кислородом получено
25,5г А1 2 О 3 .
1) 140кДж; 2) 209,5кДж; 3) 419кДж; 4) 838кДж.
Дано:
теплота образования оксида алюминия: Qобр (А1 2 О 3) = = 1676 кДж/моль;
масса полученного оксида алюминия: m(А1 2 О 3) = 25,5 г.
Найти: тепловой эффект.
Решение:
Данный тип задач можно решить двумя способами:
I способ
Согласно определению теплота образования сложного вещества — это тепловой эффект химической реакции образования 1 моль этого сложного вещества из простых веществ.
Записываем реакцию образования оксида алюминия из А1 и О 2 . При расстановке коэффициентов в полученном уравнении учитываем, что перед А1 2 О 3 должен быть коэффициент «1» , который соответствует количеству вещества в 1 моль. В этом случае мы можем использовать теплоту образования, указанную в условии:
2А1 (ТВ) + 3/2О 2(г) ——> А1 2 О 3(ТВ) + 1676 кДж
Получили термохимическое уравнение.
Для того чтобы коэффициент перед А1 2 О 3 остался равен «1», коэффициент перед кислородом должен быть дробным.
При записи термохимических уравнений допускаются дробные коэффициенты.
Рассчитываем количество теплоты, которое выделится при образовании 25,5 г А1 2 О 3:
Составляем пропорцию:
при получении 25,5 г А1 2 О 3 выделяется х кДж (по условию)
при получении 102 г А1 2 О 3 выделяется 1676 кДж (по уравнению)
Подходит ответ № 3.
При решении последней задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
Рассмотрим этот способ.
II способ
Согласно определению теплоты образования 1676 кДж выделяется при образовании 1 моль А1 2 О 3 . Масса 1 моль А1 2 О 3 составляет 102 г, следовательно, можно составить пропорцию:
1676 кДж выделяется при образовании 102 г А1 2 О 3
х кДж выделяется при образовании 25,5 г А1 2 О 3
Подходит ответ № 3.
Ответ: Q = 419кДж.
Задача 1.3.
При образовании 2 моль СuS из простых веществ выделяется 106,2 кДж теплоты. При образовании 288г СuS выделяется теплота количеством:
1) 53,1кДж; 2) 159,З кДж; 3) 212,4 кДж; 4) 26,6кДж
Решение:
Находим массу 2 моль СuS:
m(СuS) = n(СuS) . М(СuS) = 2 . 96 = 192 г.
В текст условия вместо значения количества вещества СuS подставляем массу 2 моль этого вещества и получаем готовую пропорцию:
при образовании 192 г СuS выделяется 106,2 кДж теплоты
при образовании 288 г СuS выделяется теплота количеством х кДж.
Подходит ответ № 2.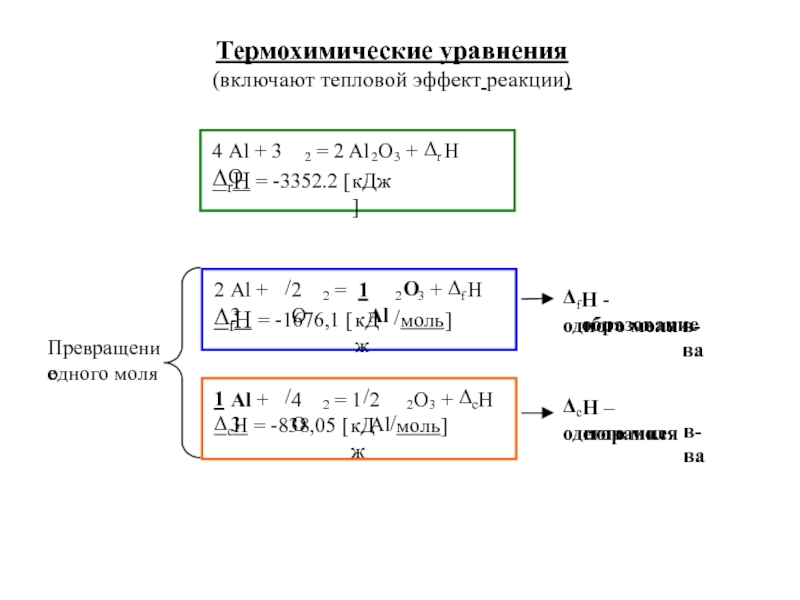
Второй вид задач можно решать как по закону объемных отношений, так и без его использования. Рассмотрим оба варианта решения на примере.
Задачи на применение закона объемных отношений:
Задача 1.4.
Определите объем кислорода (н.у.), который потребуется для сжигания 5 литров угарного газа (н.у.).
1) 5 л; 2) 10 л; 3) 2,5 л; 4) 1,5 л.
Дано:
объем угарного газа (н.у.): VСО) = 5 л.
Найти: объем кислорода (н.у.): V(О 2) = ?
Решение:
В первую очередь необходимо составить уравнение реакции:
2СО + О 2 = 2СО
n = 2 моль n =1 моль
Применяем закон объемных отношений:
Отношение мы находим по уравнению реакции, а
V(CO) возьмем из условия. Подставив все эти значения в закон объемных отношений, получим:
Отсюда: V(O 2) = 5/2 = 2,5л.
Подходит ответ № 3.
Без использования закона объемных отношений задача решается с помощью расчета по уравнению:
Составляем пропорцию:
5 л С02 взаимодействуют с х л О2 (по условию) 44,8 л СО2 взаимодействуют с 22,4 л О2(по уравнению):
Получили тот же вариант ответа № 3.
Термохимические уравнения | Задачи 1.11
Задача 1.11
Теплота образования оксида железа (III) равна 817 кДж/моль. Определите тепловой эффект реакции, в которой из 16,8 г железа и необходимого количества кислорода образовался Fe2О3.
1) 245,1кДж; 2) 2723кДж; 3) 122,55 кДж; 4) 367,65 кДж.
Дано: теплота образования оксида железа (III) равна: Qобр (Fe2О3) = 817 кДж/моль;
масса потраченного железа: m (Fe) = 16,8 г.
Найти: тепловой эффект.
Решение:
Данный тип задач можно решить двумя способами:
I способ
Согласно определению теплота образования сложного вещества — это тепловой эффект химической реакции образования 1 моль этого сложного вещества из простых веществ.
Записываем реакцию оксида железа (III) из Fe и О2. При расстановке коэффициентов в полученном уравнении учитываем, что перед Fe2О3 должен быть коэффициент «1», который соответствует количеству вещества в 1 моль. В этом случае мы можем использовать теплоту образования, указанную в условии:
В этом случае мы можем использовать теплоту образования, указанную в условии:
2Fe(ТВ) + 3/2О2(г) → Fe2О3(ТВ) + 817 кДж
Получили термохимическое уравнение.
Для того чтобы коэффициент перед Fe2О3 остался равен «1», коэффициент перед кислородом должен быть дробным (3/2).
При записи термохимических уравнений допускаются дробные коэффициенты.
Рассчитываем количество теплоты, которое выделится при образовании Fe2О3 из 16,8 г Fe:
Составляем пропорцию:
при использовании 16,8 г Fe выделяется х кДж (по условию)
при использовании 111,7 г Fe выделяется 817 кДж (по уравнению)
Ближе всего подходит ответ № 3.
При решении последней задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
II способ
Согласно определению теплоты образования 817 кДж выделяется при использовании 111,7 г Fe. При использовании 16,8 г Fe выделяется х кДж, следовательно, можно составить пропорцию:
При использовании 16,8 г Fe выделяется х кДж, следовательно, можно составить пропорцию:
817 кДж выделяется при при использовании 16,8 г Fe
х кДж выделяется при использовании 111,7 г Fe
Подходит ответ № 3.
Ответ: Q = 122,88 кДж.
Задача 1.12
На каталитическое окисление 5 л оксида серы (IV) до оксида серы (VI) расходуется кислород объемом:
1) 2,5 л; 2) 5 л; 3) 7,5 л; 4) 10 л.
Дано: объем оксида серы (IV) (н.у.): V(SО2) = 5 л.
Найти: объем кислорода (н.у.): V(О2) = ?
Решение:
В первую очередь необходимо составить уравнение реакции:
2SО2 + О2 = 2SО3
п = 2 моль п =1 моль
Применяем закон объемных отношений:
Отношение мы находим по уравнению реакции, а V(SO2) возьмем из условия. Подставив все эти значения в закон объемных отношений, получим:
Подставив все эти значения в закон объемных отношений, получим:
Отсюда: V(O2) = 5/2 = 2,5л.
Подходит ответ № 1.
Без использования закона объемных отношений задача решается с помощью расчета по уравнению:
Составляем пропорцию:
5 л SO2 взаимодействуют с х л О2 (по условию)
44,8 л SО2 взаимодействуют с 22,4 л О2(по уравнению)
Получили тот же вариант ответа № 1.
Ответ: V(O2) = 2,5л.
Задача 1.13
Объем кислорода, необходимый для сгорания 2 л пропана равен:
1) 2 л; 2) 4 л; 3) 6 л; 4) 10 л.
Дано:
объем пропана(н.у.): V(С3Н8) = 2 л.
Найти: объем кислорода (н.у.): V(О2) = ?
Решение :
В первую очередь необходимо составить уравнение реакции:
2С3Н8 + 10О2 = 6СО2 + 8Н2О
n= 2 моль n =10 моль
Применяем закон объемных отношений:
Отношение мы находим по уравнению реакции, а V(С3Н8) возьмем из условия. Подставив все эти значения в закон объемных отношений, получим:
Подставив все эти значения в закон объемных отношений, получим:
Отсюда: V(O2) = 2 .10/2 = 10л.
Подходит ответ № 4.
Без использования закона объемных отношений задача решается с помощью расчета по уравнению:
Составляем пропорцию:
2 л С3Н8 взаимодействуют с х л О2 (по условию)
44,8 л С3Н8 взаимодействуют с 224 л О2(по уравнению)
Получили тот же вариант ответа № 4.
Ответ: V(O2) = 10л.
Термохимические уравнения — Справочник химика 21
Пример 1. Исходя из теплоты образования газообразного диоксида углерода (ДЯ° = —393,5 кДж/моль) и термохимического уравнения [c.76]Решение. Ниже даны термохимические уравнения реакции сгорания ) [c.145]
Горение графита выражается термохимическим уравнением С (графит)-f Оа = U2 +393,5 кДж [c. 169]
169]
Решение. Запишем термохимические уравнения реакций образования СО2. Н2О и СН4 [c.76]
Ниже даны примеры расчета теплового эффекта реакции на основе закона Гесса с помощью суммирования термохимических уравнений. [c.144]
Пример VI-9. Даны термохимические уравнения реакции конверсии этилена и метана водяным паром [c.145]
Для случая образования воды из водорода и кислорода термохимическое уравнение имеет следующий вид [c.70]
Таким образом, термохимическое уравнение исследуемой реакции имеет следующий вид [c.120]
Химические уравнения, в которых указаны изменения энтальпии (тепловые эффекты реакций), называются термохимическими уравнениями. Например, уравнение [c.75]
Решение. Складывая последние два термохимических уравнения, получим С+02 = С02—393 421 Дж/моль. Сравнивая это значение с приведенным в тексте, видно, что в пределах ошибки эксперимента закон Гесса выполняется и для этих реакций. [c.68]
Сравнивая это значение с приведенным в тексте, видно, что в пределах ошибки эксперимента закон Гесса выполняется и для этих реакций. [c.68]
Пример VI-12. Решить пример VI-9, если известны термохимические уравнения реакции гидрогенизации [c.146]
Термохимическое уравнение имеет следующий вид [c.40]
СО + Ог = Oj + 283,0 кДж и сложим термохимические уравнения, отвечающие этим стадиям. [c.170]
Р е ш с II и е. Обозначив искомую величину через х, запишем термохимическое уравнение образования N2O из простых веществ [c.76]
Термохимическое уравнение реакции нейтрализации муравьиной кислоты [c.215]
Складывая последние три термохимические уравнения, отвечающие проведению реакции по стадиям, получим суммарное уравнение горения метана [c.170]
Пример V1-10. Решить предыдущий пример, если даны (как в примере VI-8) термохимические уравнения реакций сгорания реагентов (табл. VI-2)i [c.145]
VI-2)i [c.145]
Химические уравнения, в которых указан тепловой эффект реакции при постоянных давлении и температуре (АЯ процесса), называются термохимическими уравнениями. Тепловой эффект АЯ считают положительным для эндотермических процессов и отрицательным для экзотермических. Значение АЯ реакции (в кДж) указывают после уравнения реакции (через точку с запятой). Значение АЯ относят к числу молей веществ, участвующих в реакции, которое указывают стехиометрическими коэффициентами (часто они бывают дробными). Кроме того, в термохимических уравнениях отмечают состояние веществ (к) — кристаллическое, [c.163]
Теплота, выделяющаяся при осуществлении экзотермических химических реакций и физических превращений исходных материалов Qj, определяется при составлении материального баланса по термохимическим уравнениям (см. стр. 20). [c.140]
Сложив уравнение (I) с удвоенным уравнением (2) и вычтя из найденной суммы уравнение (3), получим термохимическое уравнение интересующе нас реакции [c. 77]
77]
С термохимическими уравнениями можно производить те же алгебраические действия, что и с обычными алгебраическими урав-,цениями. [c.73]
Термохимическое уравнение реакции горения ГеЗа получим из этих уравнений [c.40]
Таким образом, рассмотренный процесс (II) в записи, отвечающей термохимическому уравнению [c.10]
Из этой схемы видно, что двумя способами было получено одно и то же значение теплового эффекта (в пределах ошибки опыта). Химическое уравнение вместе с теплотой процесса называется термохимическим уравнением. С ними можно производить любые четыре алгебраических действия. [c.67]
Решение. Составим термохимические уравнения в таком виде [c.69]
Тепловые эффекты можно включать в уравнения реакций. Химические уравнения, в которых указано количество выделяющейся или поглощаемой теплоты, называются термохимическими уравнениями. Величигга теплового эффекта указывается обычно в правой части уравнения со знаком плюс в случае экзотермической реакции и со знаком минус в случае эндотермической реакции. Панример, термокнмическое уравнение реакции [c.167]
Величигга теплового эффекта указывается обычно в правой части уравнения со знаком плюс в случае экзотермической реакции и со знаком минус в случае эндотермической реакции. Панример, термокнмическое уравнение реакции [c.167]
Теплота реакции и закон Г. И. Гесса. Теплота реакции (с/) п о I а 3 ы в а е т, сколько при данной температуре н ы д е л я е г с я и л и п о г л о щ а е т с я г е п л а в р е у л ь т а т е того или иного химического взаимодействия в е- цес1 в. Поэтому при расчетах всегда необходимо знать термохимическое уравнение данной реакции, т. е. химическое уравнение, включающее также и тепловой эф([)ект реакции. [c.107]
Из зТих термохимических уравнений видно, что при сгорании 4-12(,0 = 480,0 кг пирита, или, что то же, на 256,3 кг серы в нем, выде.1ится 800000 ккал тепла, а при сгорании 12,0 кг углерода— 97800 ккал теила. [c.327]
Из закона Гесса следует, в частности, что термохимические уравнения можно складывать, вычитать и умножать на числепные множители. [c.76]
[c.76]
Запишем также термохимическое уравнение реакции образования Oair.) из простых веществ [c.76]
Таким образом, подобно обычным уравмепиям химических реакций, термохимические уравнения можно складывать. [c.169]
Рассмотрим еще один пример применения закона Гесса. Вычислим тепловой эффект реакции сгорания метана СН , зная теплоты образования метана (74,9 кДж/моль) и продуктов его сгорания — диоксида у1лерода (393,5 кДж/моль) и воды (285,8 кДж/моль). Для вычисления запишем реакцию горения метана сначала непосредственно, а затем разбив на стадии. Соответствующие термохимические уравнения будут иметь вид [c.170]
В термохимических уравнениях (см. 55) положительной нринято счн-тать теплоту, выделенную системой. В уравнениях термодинамики принято обратное условие положительной считается теплота, поглощенная системой. [c.195]
При сжигании 1 моль глюкозы СбН120б до газообразных СОг и Н2О выделяется 67,3 ккал (281,8 кДж). Напишите термохимическое уравнение реакции (в уравнение входит тепловой эффект). Чему равно изменение энтальпии при сгораннч [c.57]
Напишите термохимическое уравнение реакции (в уравнение входит тепловой эффект). Чему равно изменение энтальпии при сгораннч [c.57]
Теплота изохорного и изобарного процессов приобретает свойства функции состояния, т. е. она не зависит от пути процесса, а зависит только от начального и конечного состояния системы. Это положение быдо сформулировано Г. И. Гессом. Термохимические расчеты, основанные на законе Гесса, следует выполнять с помощью термохимических уравнений, представляющих собой стехиометрические уравнения химических реакций, дополненные необходимыми сведениями о состоянии реагирующих и образующихся веществ, а также указанием тепловых эффектов. [c.9]
Обобщенное термохимическое уравнение печного процесса при системном методе ИлМеет следующий вид [c.10]
Запись химической реакции, совпровождаемую указанием теплового эффекта, принято называть термохимическим уравнением. [c.10]
Определите теплоту образования AsjOg из простых веществ при 298 К и стандартном давлении, если известны следующие термохимические уравнения [c. 60]
60]
Вычислите AG29S для реакции С(гр> + 2Нг(г) = СН4[c.77]
Вычислите ДСиа для реакции С[c.89]
Общая химия (1984) — [ c.206 , c.209 ]
Общая химия и неорганическая химия издание 5 (1952) — [ c.54 ]
Неорганическая химия (1979) — [ c.28 ]
Химия (1985) — [ c.79 ]
Химия (1982) — [ c.61 ]
Физическая химия Том 1 Издание 5 (1944) — [ c.272 ]
Физическая и коллоидная химия (1954) — [ c.46 ]
Общая химия Изд2 (2000) — [ c.121 ]
Основы общей химии Т 1 (1965) — [
c. 54
]
54
]
Практикум по общей химии Издание 3 (1957) — [ c.60 ]
Практикум по общей химии Издание 4 (1960) — [ c.60 ]
Практикум по общей химии Издание 5 (1964) — [ c.64 ]
Курс общей химии (0) — [ c.90 ]
Курс общей химии (0) — [ c.90 ]
Основы общей химии том №1 (1965) — [ c.54 ]
Предмет химии (0) — [ c.90 ]
Расчеты по термохимическим уравнениям реакций
Осознание содержания этого пункта позволяет: вычислять тепловые эффекты химических реакций;
решать расчетные задачи с термохимическими уравнениями реакций.
Для вычислений по термохимическими уравнениями реакций нужно знать следующее.
1. Термохимической называются уравнения химических реакций, в которых указывается тепловой эффект химической реакции.
2. Тепловой эффект химической реакции — это количество теплоты, которая выделяется или превышает во время ее течения. Сказывается ЛН (дельта аш) или буквой Q (кью). Единицей измерения является килоджоуль (сокращенно кДж).
3. Химические реакции, сопровождающиеся выделением теплоты, называются экзотермическими. Примеры: горение углерода, взаимодействие водорода с кислородом, реакция нейтрализации и т.п..
4. Химические реакции, сопровождающиеся впитыванием теплоты, называются эндотермическими. Примеры: большинство реакций разложения, реакции взаимодействия углерода с углекислым газом или водой.
5. Термохимические уравнения реакций составляются по определенным правилам:
а) коэффициенты в нем соответствуют количеству вещества, поэтому могут быть как целыми, так и дробными числами;
б) если в ходе реакции выделяется теплота, то в правой части уравнения тепловой эффект ЛН записывают со знаком «-», если поглощается — со знаком «+»;
в) тепловой эффект химической реакции зависит от агрегатного состояния реагентов и продуктов реакции или типа их аллотропной видоизменения. Поэтому в термохимических уравнениях реакций у формул веществ сказывается их агрегатное состояние или видоизменение. например,
Поэтому в термохимических уравнениях реакций у формул веществ сказывается их агрегатное состояние или видоизменение. например,
Н2 (г) + 0,5 О2 (г) = Н2О (г) ДН = — 286 кДж
Н2 (г) + 0,5 О2 (г) = Н2О (г), ДН = — 242 кДж
С (графит) + О2 (г) = СО2 (г), ДН = — 394 кДж
С (алмаз) + О2 (г) = СО2 (г), ДН = — 392,1 кДж
6. Теплота, выделяемого или поглощаемого в ходе реакции, прямо пропорциональна массе, объема, количества вещества каждого вещества в реакции. Так, если в реакцию вступает в 10 раз больше вещества, чем указано в термохимической уравнении реакции, то теплоты выделяется так же в 10 раз больше.
Термохимическое уравнение реакции отражает материальный и энергетический баланс реакции. Это позволяет осуществлять расчеты количества исходных веществ и продуктов реакции и энергии в виде теплоты, которая выделяется или поглощается в ходе реакции.
Решая химические задачи по термохимическим уравнением реакции, следует помнить, что между количеством вещества, массой, объемом реагентов и теплотой, которая поглощается или выделяется в ходе реакции, существует прямая пропорциональная зависимость.
Составляя математическую пропорцию, надо обязательно применять одну и ту же величину количественной характеристики вещества (массу, объем или ее количество).
категория: ХимияТермохимические расчёты
Термохимические расчёты
Огромное число химических реакций используется для получения энергии. К ним относятся, например, реакции сгорания различных топлив, для оценки которых требуется знать количество выделяемой тепловой энергии (тепловых эффектов).
Тепловые эффекты реакций определяют как экспериментально, так и с помощью термохимических расчётов, основанных на законе Гесса.
Тепловой эффект реакции зависит только от начального и конечного состояний реагирующих веществ и не зависит от пути реакции (т.е. от числа стадий и промежуточных состояний).
См. также часть I. Тепловой эффект реакции Это можно показать на примере реакции горения метана:Задача 1. Рассчитайте количество теплоты, выделившейся при сгорании 0,25 моль метана, используя термохимическое уравнение реакции горения метана:
СН4 + 2О2 = СО2 + 2Н2О + 890 кДж Краткие условия: РешениеПри сгорании 1 моль CH4 выделяется 890 кДж.
 Следовательно, количество теплоты, выделяемое при сгорании 0,25 моль метана, будет равно:
Следовательно, количество теплоты, выделяемое при сгорании 0,25 моль метана, будет равно:- Q = 0,25 моль · 890 кДж/1 моль = 223 кДж.
Ответ: Q = 223 кДж.
Задача 2. Известны стандартные молярные теплоты образования Qобр (кДж/моль) метана (74,9), СО (110), О2 (0) и воды (285,8). Вычислите тепловой эффект реакции неполного сгорания 1 моль метана до оксида углерода (II).
РешениеЗапишем уравнение реакции неполного сгорания метана.
- 2СН4 + 3О2 = 2СО + 4Н2О + Q
- Qреакции = ΣQобр.(продуктов) ΣQобр.(исх.веществ)
- Qреакции = 2Qобр(CO) + 4Qобр(H2O) – 2Qобр(CH4) – 3Qобр(O2) =
= 2 · 110 + 4 · 285,8 – 2 · 74,9 – 0 = 1213,4 кДж.

Ответ: Qреакции = 1213,4 кДж.
Открытый урок «Тепловые эффекты химических реакций» 9 класс
Тема урока «Тепловые эффекты химических реакций» 9класс
Цель: Познакомить с понятием “тепловой эффект химических реакций”, классификацией химических реакций (явлений) по тепловому эффекту. Уметь составлять термохимические уравнения и производить расчеты теплоты по уравнению реакции. Владеть понятиями “теплота”, “энергия”, “экзо- и эндотермические реакции”, “тепловой эффект”, “термохимическое уравнение”, выделение и поглощение энергии.
Задачи:
Образовательная: Сформировать понятие об экзо- и эндотермических реакциях, тепловом эффекте химической реакции, термохимическом уравнении. Научиться составлять термохимические уравнения и производить расчеты теплоты по уравнению реакции.
Развивающая: Развитие
логического мышления и умений сравнивать, обобщать, анализировать
, наблюдать, анализировать природные явления и проводимый химический
эксперимент.
Воспитательная: Воспитание интереса к предмету химия. Формирование у учащихся коммуникативных навыков, чувства товарищества и взаимопомощи, умения работать в парах.
Тип урока: Изучение материала
Ход урока:
I. Организационно-мотивационный этап
Приветствие учащихся.
II. Актуализация знаний учащихся
На столе зажженная свеча.
Зачитывается отрывок из стихотворения Б.Пастернака «Зимняя ночь»
Мело, мело по всей земле
Во все пределы.
Свеча горела на столе,
Свеча горела.
О каком явлении идет речь в этом стихотворении? О горении свечи. А горение свечи это какое явление физическое или химическое? Правильно, химическое. А как иначе называются химические явления? Верно, химическими реакциями. Опишите признаки наблюдаемой реакции. Выделение света и тепла. А все ли реакции сопровождаются выделением тепла и света?
Давайте проведем
химический эксперимент и найдем ответ на поставленный вопрос.
III. Объяснение нового материала
Приступим к выполнению эксперимента:
Демонстрация:
Опыт 1. Взаимодействие основания с кислотой.
В пробирку с основанием осторожно приливаем раствор кислоты HCl, что наблюдаете? (термометр)
Давайте запишем уравнение данной реакции и укажем ее признаки.
NaOH+H2SO4=Na2SO4+H2O+ Q
Признаками проводимой реакции будут выделение газа и теплоты.
Опыт 2. Растворение хлорида аммония в воде
В пробирку с белым кристаллическим веществом прилейте имеющуюся воду, встряхните. (термометр)
NH4Cl + H2O ⇄ NH4OH + HCl – Q
Признаком проводимой реакции будет поглощение теплоты.
Мы провели с вами 2 реакции, по какому признаку можно их классифицировать ?
Правильно, по
поглощению или по выделению теплоты.
Тема сегодняшнего урока. Тепловой эффект химической реакции.
Количество теплоты, которое выделяется или поглощается при химической реакции, называют тепловым эффектом реакции.
Тепловой эффект обозначается Q и измеряется в Дж или кДж.
Давайте запишем классификацию химических реакций по тепловому эффекту.
Реакции, протекающие с выделение теплоты, называют экзотермическими.
Реакции, протекающие с поглощением теплоты, называют эндотермическими.
Химические уравнения, в которых указывается тепловой эффект, называют термохимическими.
Например: 2HgO —> 2Hg + O2 – 180 кДж, С(тв) + O2(г) —> СO2(г) + 394 кДж
Раздел химии, в задачу которого входит определение и изучение тепловых эффектов реакции называется Термохимией.
4. По
термохимическим уравнениям реакций можно проводить различные расчёты. Для решения задач
по термохимическим уравнениям реакций нужно записать само уравнение и провести
необходимые расчеты по нему.
Для решения задач
по термохимическим уравнениям реакций нужно записать само уравнение и провести
необходимые расчеты по нему.
Алгоритм решения задач по термохимическому уравнению реакции
1.Кратко записать условия задачи (“дано”).
2.Записать термохимическое уравнение реакции (ТХУ), одной чертой в уравнении реакции подчеркивают то, что известно, двумя чертами подчёркивают то, что необходимо определить.
3.Провести вспомогательные вычисления. m=M* v
3.Составить пропорцию, используя вспомогательные вычисления и условия задачи, и решить ее.
4.Записать ответ.
Объяснение решения задач:
1. Вычислите массу разложившегося мела (СаСО3), если известно, что на его разложение затрачено 1570 кДж.
Мr (СаСО3) = Аr(Са) + Аr(С) + Аr(О) 3 = 40 + 12 + 16 3 = 100
Мr = Мr m = v * М
M(СаСО3) = 1 моль* 100 г/моль = 100г
100г СаСО3 — 157 кДж —
х г СаСО3 — 1570 кДж
100г : 157 кДж = х г : 1570 кДж
х = 1000г СаСО3
Ответ: m (СаСО3) = 1 кг (или разложилось 1000г мела)
IV. Закрепление:
Закрепление:
Задача № 1 По термохимическому уравнению реакции Н2 + СI2 = 2HCI + 184 кДж определите, сколько теплоты выделится при сгорании 4 граммов водорода в хлоре. ( Ответ: 368 кДж)
Задача № 2 При сжигании 48 граммов метана выделилось 2676 кДж теплоты. Найдите тепловой эффект
реакции ( Q ). Уравнение реакции:СН4 + 2О2 = СО2 + 2Н2О + Q ( Ответ: 892 кДж)
Задача № 3 Найти тепловой эффект реакции, если при сгорании 3,5 граммов азота поглотилось 45,2 кДж теплоты. При сгорании азота образуется оксид азота ( II) – NO ( Ответ: 361,6 кДж)
V.Рефлексия: Рефлексия
(подведение итогов занятия)
Беседа:
― С реакциями, какого типа мы познакомились на уроке?
― Чем экзотермические реакции отличаются от эндотермических?
― Что такое тепловой эффект реакции?
― Какие данные нужно обязательно указывать при составлении
термохимических уравнений?
― Приведите примеры экзо- и эндотермических реакций.
Приём «Личный результат»
Я знаю… Я умею…. Я затрудняюсь….. Мне было….
VI. Домашнее задание: §
№ воп-роса | 1 вариант | № воп-роса | 2 вариант |
1 | 1. Что доказал А.Лавуазье своими опытами в 1774г.? | 1 | Наличие каких 5 простых веществ составе воздуха было доказано в конце 19 в.? |
2 | 2. Каково содержание азота в воздухе по объему и по массе? | 2 | Каково содержание кислорода в воздухе по объему и по массе? |
3 | 3. | 3 | Напишите уравнение реакции горения С2Н6 |
4 | 4. Назовите 2 условия прекращения горения | 4 | Назовите 2 условия возникновения горения |
5 | Почему рекомендуют выходить из зоны горения пригнувшись, или даже ползком? | 5 | Почему нельзя открывать окна и двери при пожаре? |
6 | Перечислите 3 вида твердого топлива | 6 | Перечислите 3 вида жидкого топлива |
Тест по теме «Воздух. Горение»
Тест по теме: «Воздух»
Выберите один правильный ответ
1. Воздух это –
Воздух это –
А) вещество, которое одновременно может находиться в разных состояниях: жидком, твёрдом и газообразном
Б) смесь газов, пыли и пара В) любое вещество природы.
2. В состав воздуха входит
А) водород и кислород Б) углекислый газ, азот и кислород
В) азот, кислород, углекислый газ и различные примеси.
3. Для горения и дыхания необходим
А) азот Б) кислород В) углекислый газ
4. При спуске к поверхности Земли температура воздуха
А) увеличивается Б) уменьшается В) не изменяется
5. Простейшие свойства воздуха:
А) белый цвет, без запаха и вкуса Б) бесцветный, нет запаха и имеет вкус
В) бесцветный, нет запаха и вкуса
6. Где больше всего кислорода?
А) над городом Б) над озером В) над лесом
7. Воздух обладает
А) твердостью и упругостью Б) сжимаемостью и упругостью
В) только упругостью
Воздух. Кислород. Горение».
Кислород. Горение».
1-вариант
1. Является окислительным процессом:
а) дыхание; в) взаимодействие СuО и Н2; с) горение; д) гниение.
2. Коэффициентами уравнения … Li + … O2 = … Li2O являются:
а) 4, 0, 2; в) 4, 1, 2; с) 2, 1, 2; д) 4, 1, 2.
3. Когда кислород собирают способом вытеснения воздуха, то сосуд держат:
а) произвольно; в) вверх дном; с) вниз дном; д) горизонтально.
4. Формула оксида азота(II):
а) N2O; в) NO; с) N2O5; д) NO2.
5. Речь идет о простом веществе кислород:
а) кислород входит в состав оксидов;
в) в молекуле оксида фосфора(V) содержится пять атомов кислорода;
с) кислород поддерживает горение;
д) в земной коре
содержится 49% кислорода.
6. Является реакцией горения:
а) СuО + Н2 = Сu + Н2О; в) Zn + 2HCl = ZnCl2 + H2; с) Zn + S = ZnS; д) 4Р + 5О2 = 2Р2О5
7. Воздух – это:
а) газ; в) смесь газов; с) азот и кислород; д) смесь газов, водяного пара и пыли.
8. Какой посуде хранят газообразного кислорода
А) в обыкновенной стеклянной посуде В) в пластмассовой посуде С) Сосуд Дьюара Д) Стальной баллоне
9. Аллотропной модификацией кислорода является:
а) азот; в) озон; с) сера; д) водород.
10. Из веществ, названия и формулы которых приведены, к числу простых относится:
а) кислород О2; в) оксид азота (II) NO; с) оксид алюминия Аl2О3; д) оксид серы (IV) SO2.
11. Защищает растения и живые организмы от ультрафиолетовых лучей
А) озон В) кислород С) атмосферный воздух Д) азот
«Воздух. Кислород. Горение» 2 вариант
Кислород. Горение» 2 вариант
1. Взаимодействие металла с кислородом приводит к образованию:
A) кислотного оксида B) бескислородной кислоты C) гидрида металла D) основного оксида
2.Формула оксида хрома(VI):
а) CrO6; в) СrO; с) Cr2O3; д) CrO3
3. Основное сырье для получения кислорода:
а) вода; в) КМnО4; с) воздух; д) КСlO3.
4. Относительная атомная масса кислорода:
а) 16 в)32 с) 12 д) 14
5. Кислород обладает следующими свойствами:
а) легче воздуха, в) плохо растворим в воде, с) поддерживает дыхание, д) не поддерживает горение.
6. Кислород выделяется в результате процесса:
а) брожения фруктовых соков в) гниения отмерших частей растений
с) фотосинтеза д) дыхания человека и животных
7. Название
химическому элементу кислороду дал:
Название
химическому элементу кислороду дал:
а) Дальтон, в) Лавуазье, с) Шееле д) Д.И. Менделеев
8. Кислород в лаборатории можно собрать методом:
а) вытеснения воздуха, в) методом вытеснения воды,
с) обоими перечисленными методами, д) ни одним из этих методов.
9. Бесцветный газ, не имеющий вкуса и запаха:
А) озон В) кислород С) водород Д) углерод
10.Образуется под влиянием электрических разрядов, молний и окисления древесных смол сосновых деревьев:
А) кислород В) водород С) углерод С) озон
11. В составе воздуха по объему больше
А) азота В) кислорода С) углекислого газа С) водорода
«Воздух. Кислород. Горение» 3- вариант
1. Кислороду не соответствует свойство:
A) мало растворим в воде B) поддерживает дыхание C) бесцветный газ D) легче воздуха
2. В атмосфере
кислорода приблизительно:
В атмосфере
кислорода приблизительно:
а) 16% в) 8% с)21% д) 7%
3. Газ голубоватого цвета, обладающий характерным запахом:
А) озон В) кислород С) водород Д) углерод
4. Кислород впервые экспериментальным способом был получен :
А) Д.М. Менделеевым В) А. Лавуазье С) А. Авогадро Д) К. Шееле и Дж. Пристли
5. Вещества которые ускоряют химические реакции, но сами не участвуют в них остаются без изменения называются:
А) катализаторами В) индикаторами С) ферментами Д) реактивами
6. В лаборатории кислород получают:
А) перегонкой жидкого газа В) фотосинтеза С) из перманганата калия Д) из серной кислоты
7. Напишите взаимодействие фосфора с кислородом
A) C + O2= CO2 B) S + O2= SO2 C) 4 P + 5O2= 2P2 O5 D)3 Fe + 2O2 = Fe 3O4
8. В процессе
фотосинтеза в атмосферу выделяется
В процессе
фотосинтеза в атмосферу выделяется
А) водород В) углекислый газ С) кислород Д) азот
9. Коэффициентами уравнения …Zn+ …O= …ZnO являются:
А)3,2,1 В) 2,1,2 С) 2,2,1 Д) 4,1,2
10. В промышленности кислород получают:
А) перегонкой жидкого газа В) фотосинтеза С) из перманганата калия Д) из серной кислоты
11. Какой посуде хранят жидкий кислород
А) в обыкновенной стеклянной посуде В) в пластмассовой посуде С) Сосуд Дьюара Д) Стальной баллоне
«Воздух. Кислород. Горение» 4 – вариант
1.В организме человека содержится кислорода:
А) 65% В)2,4% С)24% Д)7,4%
2. Газ необходимый для дыхания живых организмов:
А) углекислый В) азотный С) кислород Д) Водород
3. Взаимодействие
вещества с кислородом называется реакцией:
Взаимодействие
вещества с кислородом называется реакцией:
А) расщепления В) разложения С) окисления Д) соединения
4. Аллотропным видоизменением кислорода является;
А) озон В) углекислый газ С) водород Д) углерод
5.При какой температуре кислород переходит в твердое состояние
А) -2180С В) -200 0С С) -1180С Д) -1830С
6. В чистом воздухе меньше всего по объему газа
A) Кислорода. B) Аргона. C) Углекислого газа D) Азота.
7. Впервые состав воздуха установил
А) Д. И. Менделеев В) А. Лавуазье С) А. Авогадро Д) К. Шееле
8. Напишите взаимодействие углерода с кислородом
A) C + O2= CO2 B) S + O2= SO2 C) 4 P + 5O2= 2P2 O5 D)3 Fe + 2O2 = Fe 3O4
9. Газ который 1,5
раза тяжелее кислорода:
Газ который 1,5
раза тяжелее кислорода:
А)азот В)водород С)гелий Д)озон
10. Процесс горения возникает только при нагревании вещества до определенной температуры, которая называется:
А) удельной теплотой сгорания В) температурой плавления
С) температурой воспламенения Д) температурой сгорания
11. Кислород собирают способом вытеснения:
а) воздуха, держа сосуд вверх дном; в) воздуха, держа сосуд горизонтально;
с) воды, держа сосуд вниз дном; д) воздуха, держа сосуд вниз дном
Самоанализ урока химии по теме
На уроке использованы элементы ФГОС, что способствовало осознанному восприятию учащимися темы урока.
Взаимное приветствие учителя и учеников на
этапе организации создало доброжелательную атмосферу. Чтение отрывка из
стихотворения Б.Пастернака показало, что литературный символ (горящая свеча)
может стать предметом для «химического» разговора.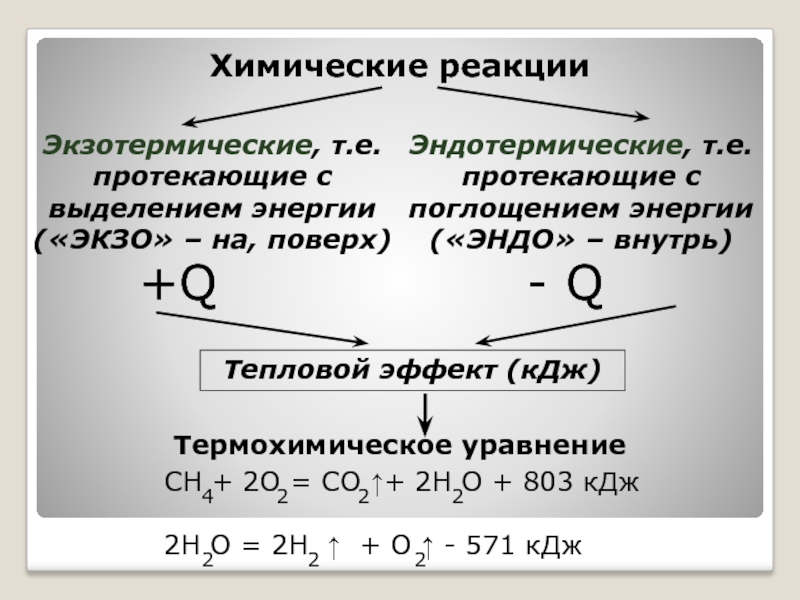
Определение темы и целеполагание на данном уроке не только настроило на рабочий лад, но и создало ситуацию прогнозирования познавательной деятельности.
Метод химического эксперимента позволил наглядно продемонстрировать результаты термохимических реакций. Решение проблемного вопроса было наглядно и доказательно.
Теоретические сведения были введены в процессе экспериментальной работы. Микроитог урока подведён с помощью самостоятельного формулирования учащимися основных вопросов темы.
Мною был дан образец решения задачи, связанной с термохимическим уравнением для данной реакции. Мини-тестирование, проведённое на следующем этапе, позволило подвести промежуточные итоги с помощью самопроверки.
Самооценка и взаимооценка – важные этапы урока, так как позволяют учащимся оценить собственную учебную деятельность и присмотреться к одноклассникам с точки зрения их обучаемости.
Рефлексия – мощный мотивирующий метод,
задачами которого является формирование умения посмотреть на себя «вглубь» и
взглянуть «вдаль» — на перспективу.
Знания, полученные учениками на этом уроке, рассчитаны на долгосрочную перспективу. Большинство химических реакций являются термохимическими, поэтому данные знания будут использоваться на протяжении всего курса изучения химии. Кроме того, коммуникативные навыки, приёмы и методы познавательной деятельности на уроке являются важными составляющими учебно-воспитательного процесса.
В целом школьники показали хороший уровень самостоятельного мышления, высокую познавательную активность, хороший уровень усвоения и использования материала. Это значит, что цели урока достигнуты.
Урок начинается с мотивация учебной деятельности, целью этапа является: развитие познавательного интереса, интереса к изучению химии, с помощью проблемного метода.
На уроке Хадижат Ахмедовна использовала
следующие приемы: интонационное выделение логически важных моментов изложения;
повторное, более краткое предъявление учащимся готового знания; подробное
резюмирование каждого отдельного законченного этапа изложения; сопровождение
обобщенных выводов с приведением конкретных примеров; предъявление учащимся
переформулированных вопросов, облегчающих понимание их смысла; инструктаж
учащихся по составлению (заполнению) таблиц; членение излагаемого учителем
материала на развивающие смысловые моменты.
Применение компьютерной техники на данном уроке было обоснованным, так как дало возможность:
-разнообразить задания для активизации знаний обучающихся;
-активизировать работу на уроке в целом;
-использовать яркую и красочную наглядность;
-увеличить темп и плотность урока.
При изучении нового материала были выбраны
методы объяснительно- иллюстративный, словесный и частично – поисковый. Знания
не давались в готовом виде. На этом этапе был проведен эксперимент с
веществами, которые окружают нас в повседневной жизни. Для того, чтобы
приблизить химию к жизни, Хадижат Ахмедовна намерено брала вещества такие, как
карбонат натрия, дрожжи, что привело к достижению цели данного этапа. На данном
этапе при выполнении практической работы учащиеся были активными, с интересом
наблюдали за проведением химического эксперимента, делали выводы, наблюдали,
обобщали, сравнивали. На уроке была использована проблемная ситуация, которая
способствовала повышению познавательного интереса при изучении новой темы.
Между этапами урока прослеживается логическая связь, по всем этапам урока были подведены промежуточные итоги.
Все время на уроке использовалось рационально. На каждый этап было отведено оптимальное для данной работы время.
В течении всего урока обеспечивалась высокая работоспособность учащихся. Это стало возможным благодаря частой смене деятельности учащихся и разными видами предлагаемых заданий.
Доброжелательная атмосфера урока поддерживалась за счет культуры общения с учащимися, а также эмоционального настроя в начале урока.
При закреплении знаний учащимся были предложены вопросы на выявление степени усвоения нового материала.
На уроке четко был виден деятельностный
подход, так как большую часть урока ученики работали самостоятельно и
осознанно, что позволило успешно реализовать цели урока. В течении урока шла
активизация учебной и познавательной деятельности обучающихся. Этому
способствовали такие методы: словесный, практический, иллюстративный, метод
самостоятельной работы.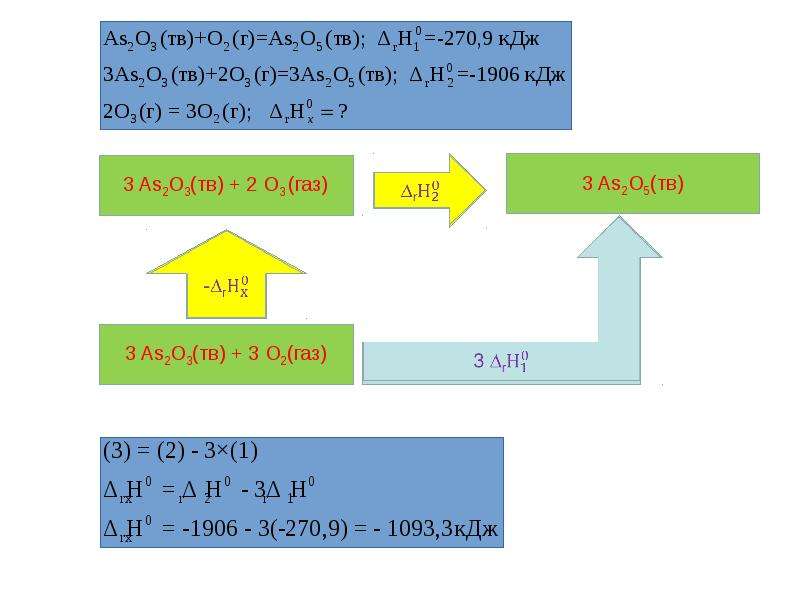 Была создана ситуация успеха через формирование
ответственного отношения к учению.
Была создана ситуация успеха через формирование
ответственного отношения к учению.
Характер домашнего задания, полученного учащимися, позволяет закрепить новые знания, активизировать их. Домашнее задание обеспечило целостность и завершенность всего урока.
Скачано с www.znanio.ru
3.8: Термохимические уравнения — Chemistry LibreTexts
Изменения энергии, сопровождающие химические реакции, почти всегда выражаются термохимическими уравнениями , такими как
\ [\ text {C} H_ {4} (g) + 2 \ text {O} _ {2} (g) \ rightarrow \ text {C} \ text {O} _ {2} (g) + 2 \ text {H} _ {2} \ text {O} (l) \ text {(25 ° C, давление 1 атм)} \\ \ Delta H_ {m} = –890 \ text {кДж} \ label {1 } \]
, который отображается на атомарном уровне ниже. Чтобы понять, как выглядит эта реакция на макроскопическом уровне, посмотрите на пламя справа.
Здесь Δ H m (дельта H , индекс m) сообщает нам, выделяется или поглощается тепловая энергия, когда реакция происходит, как написано, а также позволяет нам определить фактическое количество задействованной энергии. Условно, если Δ H м равно положительному значению , тепло поглощается реакцией; т.е. это эндотермический . Чаще Δ H м равно отрицательному значению , как в уравнении.\ (\ ref {1} \), что означает, что тепловая энергия выделяется , а не поглощается реакцией, и что реакция экзотермическая . Это соглашение относительно того, является ли Δ H m положительным или отрицательным, рассматривает изменение тепла с точки зрения вещества, фактически участвующего в реакции, а не его окружения. В реакции в формуле. \ (\ ref {1} \) атомы C, H и O вместе потеряли энергию, и именно эта потеря обозначается отрицательным значением Δ H m .
Условно, если Δ H м равно положительному значению , тепло поглощается реакцией; т.е. это эндотермический . Чаще Δ H м равно отрицательному значению , как в уравнении.\ (\ ref {1} \), что означает, что тепловая энергия выделяется , а не поглощается реакцией, и что реакция экзотермическая . Это соглашение относительно того, является ли Δ H m положительным или отрицательным, рассматривает изменение тепла с точки зрения вещества, фактически участвующего в реакции, а не его окружения. В реакции в формуле. \ (\ ref {1} \) атомы C, H и O вместе потеряли энергию, и именно эта потеря обозначается отрицательным значением Δ H m .
Важно отметить, что Δ H m — это энергия реакции, как написано. В случае уравнения \ (\ ref {1} \) это представляет образование 1 моля диоксида углерода и 2 моль воды. Количество тепла, выделяемого или поглощаемого реакцией, пропорционально количеству каждого вещества, потребляемого или производимого в результате реакции. Таким образом, уравнение. \ (\ ref {1} \) говорит нам, что 890,4 кДж тепловой энергии выделяется на каждый моль из CH 4 , которые потребляются.В качестве альтернативы он говорит нам, что выделяется 890,4 кДж, на каждые 2 моля произведенного H 2 O. С этой точки зрения Δ H m — это коэффициент преобразования, позволяющий рассчитать тепло, поглощаемое или выделяемое при потреблении или производстве заданного количества вещества. Если q — количество поглощенного или выделенного тепла, а n — количество вовлеченного вещества, то
Таким образом, уравнение. \ (\ ref {1} \) говорит нам, что 890,4 кДж тепловой энергии выделяется на каждый моль из CH 4 , которые потребляются.В качестве альтернативы он говорит нам, что выделяется 890,4 кДж, на каждые 2 моля произведенного H 2 O. С этой точки зрения Δ H m — это коэффициент преобразования, позволяющий рассчитать тепло, поглощаемое или выделяемое при потреблении или производстве заданного количества вещества. Если q — количество поглощенного или выделенного тепла, а n — количество вовлеченного вещества, то
\ [\ large \ Delta H _ {\ text {m}} = \ frac {q} {n} \]
Пример \ (\ PageIndex {1} \): Тепловая энергия
Сколько тепловой энергии получается при сжигании 1 кг газообразного этана, C 2 H 6 , в кислороде в соответствии с уравнением:
\ [2 \ text {C} _ {2} \ text {H} _ {6} (g) + 7 \ text {O} _ {2} (g) \ rightarrow 4 \ text {C} \ text { O} _ {2} (g) + 6 \ text {H} _ {2} \ text {O} (l) \]
с \ (\ Delta H_ {m} = –3120 \ text {кДж} \). 3 \ text {g} \ ce {C2H6} \ times \ frac {\ text {1 mol} \ ce {C2H6}} {\ text {30 .07 g} \ ce {C2H6}} \ times \ frac {-3120 \ text {kJ}} {\ text {2 mol} \ ce {C2H6}} \\ & = — \ text {51 879 кДж} = — \ текст {51.88 MJ} \ end {align *} \]
3 \ text {g} \ ce {C2H6} \ times \ frac {\ text {1 mol} \ ce {C2H6}} {\ text {30 .07 g} \ ce {C2H6}} \ times \ frac {-3120 \ text {kJ}} {\ text {2 mol} \ ce {C2H6}} \\ & = — \ text {51 879 кДж} = — \ текст {51.88 MJ} \ end {align *} \]
По соглашению, отрицательное значение q соответствует выделению тепловой энергии веществом, участвующим в реакции.
Величина Δ H m упоминается как изменение энтальпии на для реакции . В этом контексте символ Δ (дельта) означает изменение «, а H — символ изменяемой величины, а именно энтальпии.Мы рассмотрим энтальпию более подробно в гл. 15. На данный момент мы можем думать об этом как о свойстве материи, которое увеличивается, когда материя поглощает энергию, и уменьшается, когда материя выделяет энергию.
Важно понимать, что значение Δ H m , данное в термохимических уравнениях, таких как \ (\ ref {1} \) или \ (\ ref {3} \), зависит от физического состояния обоих реагентов. и продукты. Таким образом, если вода была получена в виде газа, а не жидкости в реакции в формуле.\ (\ ref {1} \) значение Δ H m будет отличаться от -890,4 кДж. Также необходимо указать как температуру, так и давление, поскольку значение Δ H m очень слабо зависит от этих переменных. Если они не указаны, они обычно относятся к 25 ° C и нормальному атмосферному давлению.
и продукты. Таким образом, если вода была получена в виде газа, а не жидкости в реакции в формуле.\ (\ ref {1} \) значение Δ H m будет отличаться от -890,4 кДж. Также необходимо указать как температуру, так и давление, поскольку значение Δ H m очень слабо зависит от этих переменных. Если они не указаны, они обычно относятся к 25 ° C и нормальному атмосферному давлению.
Еще две характеристики термохимических уравнений вытекают из закона сохранения энергии. Во-первых, запись уравнения в обратном направлении меняет знак изменения энтальпии. Например,
\ [\ text {H} _ {2} \ text {O} (l) \ rightarrow \ text {H} _ {2} \ text {O} (g) \\ \ Delta \ text {H} _ { m} = 44 \ text {кДж} \]
На изображении выше пламя вводит энергию в воду, давая ей энергию, необходимую для перехода в газовую фазу. Поскольку пламя дает энергию для фазового перехода, это эндотермическая реакция (энергия поглощается).
говорит нам, что когда моль жидкой воды испаряется, поглощается 44 кДж тепла. Это соответствует тому факту, что при испарении пота ваша кожа поглощает тепло, и вы остываетесь. С другой стороны, при конденсации 1 моля водяного пара выделяется точно такое же количество тепла. \ [\ text {H} _ {2} \ text {O} (g) \ rightarrow \ text {H} _ {2} \ text {O} (l) \\ \ Delta \ text {H} _ {m } = –44 \ text {кДж} \]
Это соответствует тому факту, что при испарении пота ваша кожа поглощает тепло, и вы остываетесь. С другой стороны, при конденсации 1 моля водяного пара выделяется точно такое же количество тепла. \ [\ text {H} _ {2} \ text {O} (g) \ rightarrow \ text {H} _ {2} \ text {O} (l) \\ \ Delta \ text {H} _ {m } = –44 \ text {кДж} \]
Это нелогично, но обычное летнее явление, показанное выше, на самом деле экзотермическое. Поскольку реакция не является сильно экзотермической (например, горение CH 4 ), нам трудно связать ее с выделением энергии.Термодинамика позволяет нам лучше понять на микроуровне изменения энергии, подобные этому.
Чтобы понять, почему это должно быть правдой, предположим, что Δ H м [Ур. (4a)] = 44 кДж, тогда как Δ H m [Ур. (4b)] = –50,0 кДж. Если мы возьмем 1 моль жидкой воды и позволим ему испариться, то будет поглощено 44 кДж. Тогда мы могли бы конденсировать водяной пар, и было бы выделено 50,0 кДж. У нас снова может быть 1 моль жидкой воды при 25 ° C, но у нас также будет 6 кДж тепла, которое было создано из ниоткуда! Это нарушило бы закон сохранения энергии.Единственный способ избежать проблемы состоит в том, чтобы Δ H m обратной реакции было равно по величине, но противоположно по знаку, чем Δ H m прямой реакции. То есть
У нас снова может быть 1 моль жидкой воды при 25 ° C, но у нас также будет 6 кДж тепла, которое было создано из ниоткуда! Это нарушило бы закон сохранения энергии.Единственный способ избежать проблемы состоит в том, чтобы Δ H m обратной реакции было равно по величине, но противоположно по знаку, чем Δ H m прямой реакции. То есть
\ [\ Delta \ text {H} _ {m} \ text {forward} = — \ Delta \ text {H} _ {m} \ text {reverse} \]
17.8: Термохимические уравнения — Химия LibreTexts
Отопление дома становится все дороже и дороже. Решение использовать газ, нефть, электричество или дрова может быть многогранным.Частично решение зависит от того, какое топливо обеспечит наибольшее выделение энергии при сгорании. Исследования термохимии могут быть очень полезны для получения надежной информации для принятия этих важных решений.
Термохимическое уравнение
При сжигании метана выделяется тепло, что делает реакцию экзотермической. В частности, при сгорании \ (1 \: \ text {mol} \) метана выделяется 890,4 килоджоулей тепловой энергии. Эта информация может быть отображена как часть сбалансированного уравнения:
В частности, при сгорании \ (1 \: \ text {mol} \) метана выделяется 890,4 килоджоулей тепловой энергии. Эта информация может быть отображена как часть сбалансированного уравнения:
\ [\ ce {CH_4} \ left (g \ right) + 2 \ ce {O_2} \ left (g \ right) \ rightarrow \ ce {CO_2} \ left (g \ right) + 2 \ ce {H_2O} \ влево (л \ вправо) + 890.4 \: \ text {кДж} \]
Уравнение говорит нам, что \ (1 \: \ text {mol} \) метана соединяется с \ (2 \: \ text {mol} \) кислорода с образованием \ (1 \: \ text {mol} \) диоксида углерода и \ (2 \: \ text {mol} \) воды. В процессе высвобождается \ (890.4 \: \ text {kJ} \), и поэтому он записывается как продукт реакции. Термохимическое уравнение — это химическое уравнение, которое включает изменение энтальпии реакции. Процесс в приведенном выше термохимическом уравнении можно визуально показать на рисунке ниже.
Рисунок \ (\ PageIndex {1} \) : (A) Поскольку реагенты превращаются в продукты в экзотермической реакции, энтальпия выделяется в окружающую среду. Изменение энтальпии реакции отрицательное. (B) Поскольку реагенты превращаются в продукты в эндотермической реакции, энтальпия поглощается из окружающей среды. Изменение энтальпии реакции положительное. (CC BY-NC; CK-12)
Изменение энтальпии реакции отрицательное. (B) Поскольку реагенты превращаются в продукты в эндотермической реакции, энтальпия поглощается из окружающей среды. Изменение энтальпии реакции положительное. (CC BY-NC; CK-12)В примере сгорания метана изменение энтальпии отрицательное, поскольку система выделяет тепло.Следовательно, общая энтальпия системы уменьшается. теплота реакции — это изменение энтальпии химической реакции. В приведенном выше случае теплота реакции равна \ (- 890,4 \: \ text {кДж} \). Термохимическую реакцию также можно записать так:
\ [\ ce {CH_4} \ left (g \ right) + 2 \ ce {O_2} \ left (g \ right) \ rightarrow \ ce {CO_2} \ left (g \ right) + 2 \ ce {H_2O} \ left (l \ right) \: \: \: \: \: \ Delta H = -890.4 \: \ text {kJ} \]
Теплота реакции обычно измеряется в килоджоулей.Важно включить физические состояния реагентов и продуктов в термохимическое уравнение, поскольку значение \ (\ Delta H \) зависит от этих состояний.
Эндотермические реакции поглощают энергию из окружающей среды по мере протекания реакции. Когда \ (1 \: \ text {mol} \) карбоната кальция разлагается на \ (1 \: \ text {mol} \) оксида кальция и \ (1 \: \ text {mol} \) диоксида углерода, \ (177.8 \: \ text {кДж} \) тепла поглощается. Визуально процесс показан на рисунке выше (B).Термохимическая реакция показана ниже.
\ [\ ce {CaCO_3} \ left (s \ right) + 177,8 \: \ text {kJ} \ rightarrow \ ce {CaO} \ left (s \ right) + \ ce {CO_2} \ left (g \ right ) \]
Поскольку тепло поглощается системой, \ (177.8 \: \ text {кДж} \) записывается как реагент. Теплота реакции положительна для эндотермической реакции.
\ [\ ce {CaCO_3} \ left (s \ right) \ rightarrow \ ce {CaO} \ left (s \ right) + \ ce {CO_2} \ left (g \ right) \: \: \: \: \: \ Delta H = 177,8 \: \ text {кДж} \]
Способ написания реакции влияет на значение изменения энтальпии реакции.Многие реакции обратимы, что означает, что продукт (ы) реакции способен объединять и преобразовывать реагент (ы).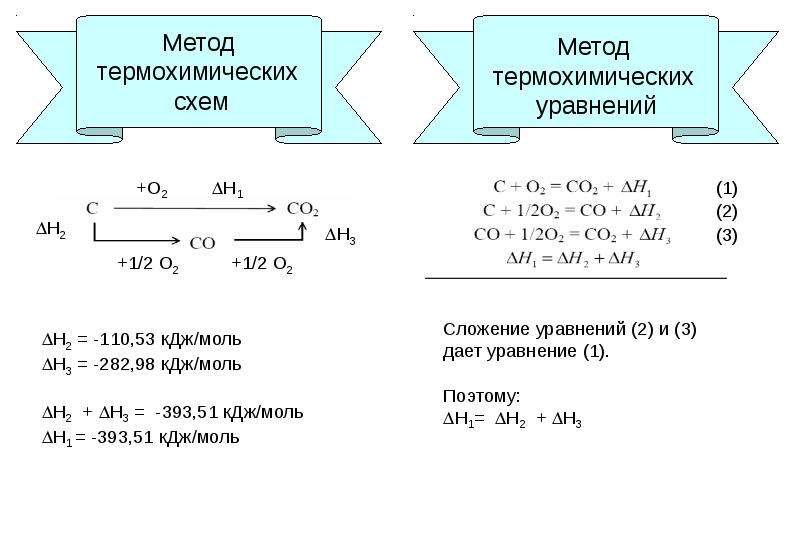 Если реакция написана в обратном направлении, знак \ (\ Delta H \) меняется. Например, мы можем написать уравнение реакции оксида кальция с диоксидом углерода с образованием карбоната кальция:
Если реакция написана в обратном направлении, знак \ (\ Delta H \) меняется. Например, мы можем написать уравнение реакции оксида кальция с диоксидом углерода с образованием карбоната кальция:
\ [\ ce {CaO} \ left (s \ right) + \ ce {CO_2} \ left (g \ right) \ rightarrow \ ce {CaCO_3} \ left (s \ right) + 177,8 \: \ text {кДж } \]
Реакция экзотермическая, поэтому знак изменения энтальпии отрицательный.
\ [\ ce {CaO} \ left (s \ right) + \ ce {CO_2} \ left (g \ right) \ rightarrow \ ce {CaCO_3} \ left (s \ right) \: \: \: \: \: \ Delta H = -177,8 \: \ text {кДж} \]
Энтальпия и термохимические реакции | Интернет-уроки химии
Энтальпия и термохимические реакции
Физические и химические изменения происходят под постоянным давлением. Полученное или потерянное тепло в реакциях при постоянном давлении называется изменением энтальпии . Энтальпия — это полная кинетическая и потенциальная энергия частиц вещества. Обозначается буквой «Н». Энтальпию веществ нельзя измерить, однако можно измерить изменение энтальпии. Мы можем найти изменение энтальпии, как указано ниже;
Обозначается буквой «Н». Энтальпию веществ нельзя измерить, однако можно измерить изменение энтальпии. Мы можем найти изменение энтальпии, как указано ниже;
Реагенты → Продукция
Если H R — энтальпия реагентов, а H P — энтальпия продуктов, изменение энтальпии станет,
∆H = H P -H R
- В экзотермических реакциях H R больше, чем H P , поэтому изменение энтальпии становится отрицательным
H P
- Поскольку эндотермические реакции поглощают тепло, H P > H R и изменение энтальпии становится положительным.
H P > H R так; ∆H> 0
- Изменение энтальпии зависит от температуры и давления. Таким образом, вы должны сравнить изменения энтальпии реакций при одинаковых температуре и давлении.
- Изменение энтальпии при давлении 1 атм и температуре 25 0 ° C называется изменением стандартной энтальпии .

В эндотермических реакциях энтальпия системы увеличивается. Например, энтальпия воды больше энтальпии льда при той же температуре.На приведенном ниже графике показана энтальпия эндотермических реакций;
В экзотермических реакциях;
Термохимические реакции
Реакции, демонстрирующие как изменения вещества, так и энергии, называются термохимическими реакциями.Примеры термохимических реакций;
C (т) + O 2 (г) → CO 2 (г); ∆H = -94 ккал
Эта реакция говорит нам, что 1 моль C (s) реагирует с 1 моль O 2 (s) и производит 1 моль CO 2 и выделяется 94 ккал тепла.
C (т) + O 2 (г) → CO 2 (г) + 94 ккал
2H 2 O (г) → 2H 2 (г) + O 2 (г); ∆H = 116 ккал
Эта реакция объясняет нас, 2 моль H 2 O поглощает тепло и разлагается на 2 моль H 2 и O 2 .
2H 2 O (г) + 116 ккал → 2H 2 (г) + O 2 (г)
Свойства термохимических реакций
- Коэффициенты перед каждым элементом показывают количество молей вещества, а данное значение ∆H показывает тепло, выделяемое или поглощаемое реакцией, уравновешенное этими числами.
Пример: Найдите тепло, выделяющееся при реакции, в которой 2 моль CH 4 и 2 моль Cl 2 реагируют с образованием CCl 4 и HCl.
CH 4 (г) 4Cl 2 (г) → CCl 4 (г) + 4HCl (г) + 104 ккал
Раствор:
Приведенная выше реакция сбалансирована для 1 моль CH 4 , мы должны сначала найти ограничивающий материал.
1 моль CH 4 реагирует с 4 моль CCl 4
? моль CH 4 реагирует с 2 моль CC l4
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
? = 0,5 моль CH 4
2-0,5 = 1,5 моль CH 4 не используется в этой реакции, поскольку CCl 2 является ограничивающим веществом.
Тепловыделение в результате реакции рассчитывается с учетом ограничения;
4 моль Cl 2 выделение 104 ккал тепла
2 моль Cl 2 выпуск? ккал тепла
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
? = 52 ккал тепла выделяется при реакции 2 моль Cl 2 .
- Если вы умножаете реакцию на число «n», то вы должны умножить значение ∆H также на «n».
Пример:
CO (г) + 1 / 2O 2 (г) → CO 2 (г); ∆H = -68 ккал
Когда мы умножаем реакцию на 2;
2CO (г) + O 2 (г) → 2CO 2 (г); ∆H = 2 (-68) = — 136 ккал
- При изменении направления термохимической реакции меняется и знак ∆H.
Пример:
2H 2 O (г) → 2H 2 (г) + O 2 (г) ∆H = 116 ккал
2H 2 (г) + O 2 (г) → 2H 2 O (г) ∆H = -116 ккал
Как видно из примера, при изменении направления реакции меняется и знак изменения энтальпии.
- Поскольку ∆H зависит от состояния веществ, вы должны записывать состояния веществ в термохимических реакциях.
H 2 (г) + 1 / 2O 2 (г) → H 2 O (г) ∆H = -58 ккал
H 2 (г) + 1 / 2O 2 (г) → H 2 O (л) ∆H = -68 ккал
Как видно из примеров, энтальпия воды в жидком состоянии ниже энтальпии воды в газообразном состоянии.
Термохимические экзамены и решения проблем
| Термохимия <Пред. | Далее> Закон Гесса (Суммирование термохимических реакций) |
|---|
8 примеров экзотермической реакции в повседневной жизни — StudiousGuy
Экзотермические реакции варьируются от безопасных, щадящих до драматических, взрывных и включают интересные химические, а также физические реакции, потому что высвобождение энергии может вызвать искры, пламя, звуки или дым, а иногда даже звуки.
Экзотермическая реакция — это выделение тепловой энергии (-ΔH) , когда она вытекает из системы. Тепловая энергия отрицательна, потому что энергия выделяется, а начальная потенциальная энергия реагентов больше, чем энергия, выделяемая из продуктов.
Давайте исследуем экзотермические реакции, происходящие вокруг нас:
1. Клеточное дыхание
Это важная экзотермическая реакция, которая происходит в каждой клетке и дает нашим клеткам энергию для поддержания всех жизненно важных функций нашего тела.Молекулы сахара нашего тела распадаются на молекулы углекислого газа и воды, а также выделяют энергию. Энергия, выделяющаяся при расщеплении сахара, используется в синтезе АТФ, который является молекулой энергоносителя клеток.
2. Кубики льда Когда вода превращается в кубики льда, энергия выделяется в виде тепла. Когда молекулы воды начинают замерзать, их частицы сближаются и образуют новую связь. Как и в экзотермической реакции, выделяемая энергия больше при образовании новых связей, чем энергия, необходимая при разрыве связей.Итак, образование кубиков льда — экзотермический процесс.
Как и в экзотермической реакции, выделяемая энергия больше при образовании новых связей, чем энергия, необходимая при разрыве связей.Итак, образование кубиков льда — экзотермический процесс.
Процесс образования снега — экзотермическая реакция. В процессе конденсации образуются облака, а в некоторых облаках даже есть лед. Когда молекулы воды приближаются друг к другу и образуют связи, выделяется энергия, и поэтому во время снегопада воздух становится теплее.
4. Горячие пакеты Все мы используем горячие компрессы зимой или когда нам больно; скажите боль в ногах или головная боль, а также при лечении травм.В горячих пакетах есть два пакета. Внутренний мешок содержит воду, а внешний мешок содержит ионные соли, такие как хлорид кальция и сульфат магния. Когда эти ионные соли реагируют с водой; Происходит экзотермическая реакция, и энергия выделяется в виде тепла.
Ржавление железа — это реакция экзотермического окисления. Когда чистая форма железа или сплава вступает в контакт с воздухом (кислородом, ржавчина происходит вместе с выделением тепла.
6. Горение свечейГорение свечи — экзотермическая реакция. Свеча представляет собой парафиновый воск, состоящий из углеводородов. Когда свеча горит, она вступает в контакт с кислородом, и происходит разрыв углеводородных связей, и, следовательно, происходит высвобождение энергии. Вот почему вокруг горящей свечи становится тепло.
7. Молния матчаMatch Stick состоит из фосфора, серы и других химикатов.При воспламенении спички происходит химическая реакция между фосфором, серой и воздухом, что приводит к возгоранию и выделению тепла.
8. Укладка цемента и бетона Химическая реакция, происходящая между цементом и водой, называется гидратацией цемента. Гидратация цемента — экзотермический процесс. Смешивание тепла с водой приведет к быстрому выделению тепла в течение нескольких минут. Это выделение тепла происходит из-за химических веществ, присутствующих в цементоподобных ди- и трикальциевых алюминатах и силикатах.
Гидратация цемента — экзотермический процесс. Смешивание тепла с водой приведет к быстрому выделению тепла в течение нескольких минут. Это выделение тепла происходит из-за химических веществ, присутствующих в цементоподобных ди- и трикальциевых алюминатах и силикатах.
Термохимическая реакция — обзор
Для лучшего понимания реакций, протекающих в исследуемой системе, было проведено моделирование термохимических реакций в замкнутой системе SiC – SiO 2 . Расчеты проводились в 1-мольной системе, где SiC содержит 2 мас.% SiO 2 (рис. 4.2; Galusek et al., 2011). При 0,0001 моль Ar весь SiO 2 (точка плавления 1723 ° C) образовал оксидную жидкость, которая полностью израсходовалась при 1812 ° C.При 0,01 моль Ar весь SiO 2 был израсходован при 1780 ° C. Если использовали 0,1 моль Ar, весь SiO 2 был израсходован при 1663 ° C и жидкий оксид не образовывался. Реакция, ответственная за потребление диоксида кремния, выглядит следующим образом:
Рисунок 4. 2. Результаты расчетов термохимических реакций для SiC и 2 мас.% SiO 2 с 0,0001 моль инертного газа Ar. (а) Диаграмма фазового соотношения. (б) Парциальное давление преобладающих газов в равновесии с конденсированными фазами (Галусек и др., 2011). LM , жидкий металл.
2. Результаты расчетов термохимических реакций для SiC и 2 мас.% SiO 2 с 0,0001 моль инертного газа Ar. (а) Диаграмма фазового соотношения. (б) Парциальное давление преобладающих газов в равновесии с конденсированными фазами (Галусек и др., 2011). LM , жидкий металл.
(4.6) SiC (s) + 2SiO2 (s, l) = 3SiO (g) + CO (g)
До этих температур парциальное давление SiO было в три раза выше парциального давления CO. Образование жидкости с высоким содержанием кремния, содержащей небольшое количество растворенного углерода, было обнаружено при 1738 ° C.
После израсходования всего SiO 2 и при более высоких температурах расчеты показали, что количество SiC в системе немного уменьшилось, тогда как количество жидкого металлического Si увеличивалось с температурой.Количество газовой фазы оставалось почти постоянным, но мольная доля SiO уменьшалась. Количество CO увеличивалось с повышением температуры примерно с той же скоростью. Молярное соотношение SiC, израсходованного при образовании расплава кремния Si (l), составило 1: 2.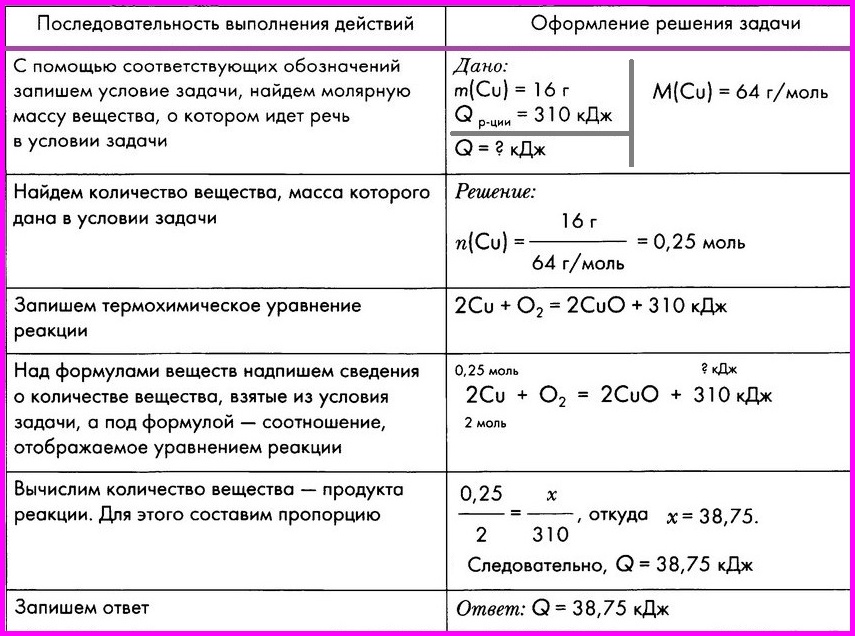 Это означало, что при более высоких температурах в системе протекает следующая реакция:
Это означало, что при более высоких температурах в системе протекает следующая реакция:
(4.7) SiC (s) + SiO (g) = 2Si (l) + CO (g)
Результаты расчетов (фазовая доля диаграммы) для системы Al 2 O 3 -SiC-SiO 2 с 8 об.% SiC показаны на рис.4.3 (Галусек и др., 2011). Согласно расчетам, SiO 2 был израсходован в реакции с Al 2 O 3 , давая фазу муллита в равновесии с избытком Al 2 O 3 . До 1734 ° C основными газами были SiO и CO в молярном соотношении SiO / CO = 3. Это указывало на то, что SiC реагировал с SiO 2 из муллита, давая Al 2 O 3 и газообразные частицы:
Рисунок 4.3. Результаты расчетов термохимических реакций для Al 2 O 3 и SiC с 0.0001 моль инертного газа Ar. (а) Диаграмма фазового соотношения. (б) Газофазный состав (Galusek et al., 2011). LM , жидкий металл.
(4.8) 3Al2O3 · 2SiO2 (s) + SiC (s) = 3Al2O3 (s) + 3SiO (g) + CO (g)
Муллитовая фаза полностью израсходована при 1862 ° C (0,0001 моль Ar), 1840 г.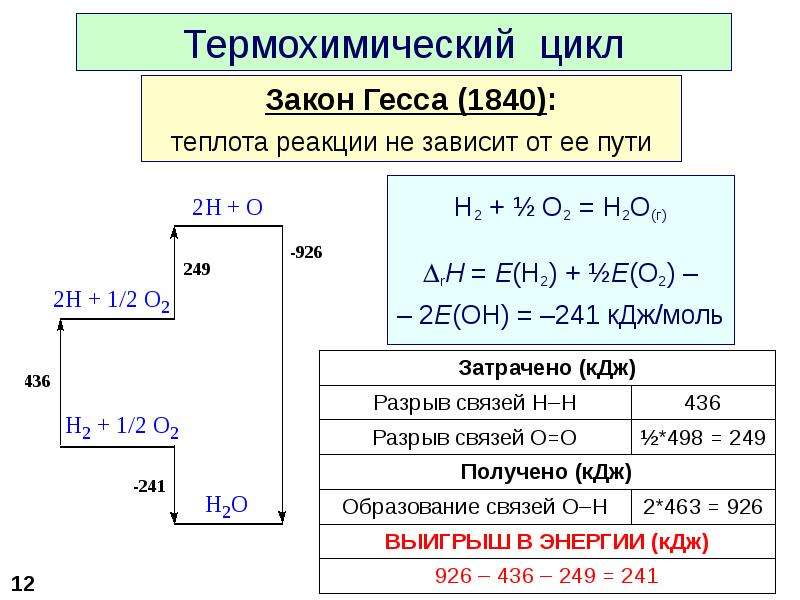 ° C (0,001 моль Ar) и 1735 ° C (0,01 моль Ar) соответственно. Однако, когда в расчетах использовали 0,1 моль Ar, ни одна фаза муллита не была стабильной при температуре выше 1600 ° C. Когда весь муллит был израсходован, фазовое равновесие происходило более сложным образом, и реакции, происходящие в системе, можно было схематично описать уравнением.(4.9), как сообщается также Can et al. (2006):
° C (0,001 моль Ar) и 1735 ° C (0,01 моль Ar) соответственно. Однако, когда в расчетах использовали 0,1 моль Ar, ни одна фаза муллита не была стабильной при температуре выше 1600 ° C. Когда весь муллит был израсходован, фазовое равновесие происходило более сложным образом, и реакции, происходящие в системе, можно было схематично описать уравнением.(4.9), как сообщается также Can et al. (2006):
(4.9) 4SiC (s) + 2Al2O3 (s, l) = 4CO (g) + SiO (g) + Al2O (g) + 3Si (l) + 2Al (l)
Согласно По расчетам, SiC полностью расходуется при 2050 ° C (0,0001 и 0,001 моль Ar) или при 2046 ° C (0,01 моль Ar). При этой температуре количество образовавшегося раствора жидкого металла (начало образования при 1734 ° C) достигло максимума, постепенно уменьшаясь с повышением температуры. Количество газовой фазы увеличивалось с повышением температуры примерно с той же скоростью, что и количество жидкого металла.Увеличение количества газовой фазы происходило в основном за счет образования SiO и Al 2 O, в то время как вклад образования CO был небольшим. Незначительное увеличение содержания CO отражало небольшое количество свободного углерода, растворенного в расплаве Si – Al. Количество ионной жидкости (расплав Al 2 O 3 ) уменьшилось (рис. 4.3; Galusek et al., 2011). Это подразумевает реакции между Al 2 O 3 и составляющими жидкого металлического раствора (Si, Al и C) или частицами газа-элемента Si (г) и Al (г).Таким образом, реакции, которые могут протекать в системе при более высоких температурах (> 2050 ° C), можно схематически выразить следующим образом:
Незначительное увеличение содержания CO отражало небольшое количество свободного углерода, растворенного в расплаве Si – Al. Количество ионной жидкости (расплав Al 2 O 3 ) уменьшилось (рис. 4.3; Galusek et al., 2011). Это подразумевает реакции между Al 2 O 3 и составляющими жидкого металлического раствора (Si, Al и C) или частицами газа-элемента Si (г) и Al (г).Таким образом, реакции, которые могут протекать в системе при более высоких температурах (> 2050 ° C), можно схематически выразить следующим образом:
(4,10) Al2O3 (l) + 3C (s, sol) = 2Al (l, g) + 3CO. (г)
(4,11) Al2O3 (ж) + 4Al (l, г) = 3Al2O (г)
(4,12) Al2O3 (ж) + 2Si (l, г) = 2SiO (г) + Al2O (г)
Некоторые схемы реакций, включающие SiC в трехфазных системах SiC-Al 2 O 3 -C и SiC-Al 2 O 3 -Si, были предложены Baud et al. (2003), которые исследовали количественное испарение этих систем с помощью МС с методом множественных ячеек Кнудсена. Реакции (4.11) и (4.12) между Al 2 O 3 и Si или Al при высоких температурах также были предложены другими авторами (Fujii et al., 2004; Gao et al., 2007). Расчеты в системах, содержащих 3 и 5 об.% SiC, дали аналогичные результаты.
Реакции (4.11) и (4.12) между Al 2 O 3 и Si или Al при высоких температурах также были предложены другими авторами (Fujii et al., 2004; Gao et al., 2007). Расчеты в системах, содержащих 3 и 5 об.% SiC, дали аналогичные результаты.
Результаты термодинамических расчетов показали сильное влияние диоксида кремния, обычно присутствующего в системе в качестве продукта низкотемпературного окисления предшественника полимера или аморфного SiC, и количества инертного газа на термическую стабильность, фазовый состав и реакции разложения. в системе Al 2 O 3 -SiC.Также может представлять интерес разложение SiC в исследованном диапазоне температур, на что указывают реакции (4.6), (4.7) и (4.9) с CO, SiO и Al 2 O в качестве основных газообразных продуктов термического разложения. откол карбида кремния.
Энтальпия и химические реакции
7.3 Энтальпия и химические реакции
Цели обучения
- Определите энтальпию .

- Правильно выразите изменение энтальпии химических реакций.
- Объясните, как изменения энтальпии измеряются экспериментально.
Теперь, когда мы показали, как связаны энергия, работа и тепло, мы готовы рассмотреть изменения энергии в химических реакциях. Фундаментальная концепция состоит в том, что каждая химическая реакция происходит с одновременным изменением энергии . Теперь нам нужно научиться правильно выражать эти энергетические изменения.
Наше исследование газов в главе 6 «Газы» и наше определение работы в разделе 7.2 «Работа и тепло» указывают на то, что такие условия, как давление, объем и температура, влияют на энергосодержание системы. Что нам нужно, так это определение энергии, которое имеет место, когда указаны некоторые из этих условий (что-то вроде нашего определения стандартной температуры и давления в нашем исследовании газов). Мы определяем изменение энтальпии Теплота процесса при постоянном давлении; обозначается ΔH. (Δ H ) как тепло процесса при постоянном давлении:
(Δ H ) как тепло процесса при постоянном давлении:
Буква H означает «энтальпию», вид энергии, а Δ означает изменение количества.Нас всегда будет интересовать изменение H , а не абсолютное значение самого H .
Когда происходит химическая реакция, наблюдается характерное изменение энтальпии. Изменение энтальпии реакции обычно записывается после сбалансированного химического уравнения и в той же строке. Например, когда два моля водорода реагируют с одним молем кислорода с образованием двух моль воды, характерное изменение энтальпии составляет 570 кДж. Запишем уравнение как
2H 2 (г) + O 2 (г) → 2H 2 O (ℓ) Δ H = −570 кДж Химическое уравнение, которое включает изменение энтальпии, называется термохимическим уравнением. Химическое уравнение, которое включает изменение энтальпии.. Предполагается, что термохимическое уравнение относится к уравнению в молярных количествах, что означает, что его следует интерпретировать с точки зрения молей, а не отдельных молекул.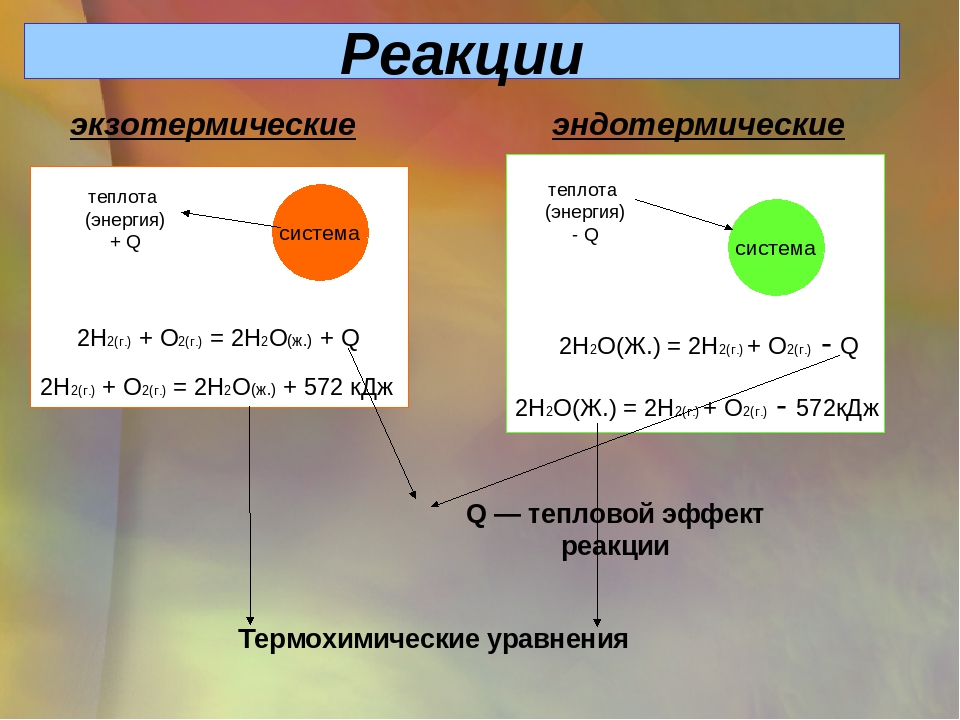
Пример 5
Напишите термохимическое уравнение реакции PCl 3 (г) с Cl 2 (г) с образованием PCl 5 (г), у которого изменение энтальпии составляет -88 кДж.
Решение
Термохимическое уравнение
PCl 3 (г) + Cl 2 (г) → PCl 5 (г) Δ H = -88 кДжПроверьте себя
Напишите термохимическое уравнение реакции N 2 (г) с O 2 (г) с образованием 2NO (г) с изменением энтальпии 181 кДж.
Ответ
N 2 (г) + O 2 (г) → 2NO (г) Δ H = 181 кДж Вы могли заметить, что Δ H для химической реакции может быть положительным или отрицательным. Число считается положительным, если у него нет знака; знак + можно добавить явно, чтобы избежать путаницы. Химическая реакция, имеющая положительное значение Δ H , называется эндотермической химической реакцией, которая имеет положительное изменение энтальпии. , в то время как химическая реакция, имеющая отрицательное значение Δ H , называется экзотермической химической реакцией, имеющей отрицательное изменение энтальпии.
, в то время как химическая реакция, имеющая отрицательное значение Δ H , называется экзотермической химической реакцией, имеющей отрицательное изменение энтальпии.
Что означает положительное значение Δ H процесса? Это означает, что система, в которой происходит химическая реакция, набирает энергию. Если рассматривать энергию системы в виде высоты на вертикальном графике энергии, изменение энтальпии, которое сопровождает реакцию, можно представить в виде диаграммы в части (а) на рисунке 7.3 «Энергия реакции»: энергия реагентов имеет некоторую энергию, и система увеличивает ее энергию по мере перехода к продуктам. Продукты выше по вертикали, чем реагенты. Таким образом, эндотермический режим означает, что система получает или поглощает энергию.
Противоположная ситуация существует для экзотермического процесса, как показано в части (b) на Рисунке 7.3 «Энергия реакции». Если изменение энтальпии реакции отрицательное, система теряет энергию, поэтому продукты имеют меньше энергии, чем реагенты, а продукты ниже по вертикальной шкале энергии, чем реагенты. Таким образом, экзотермический эффект означает, что система теряет или отдает энергию.
Таким образом, экзотермический эффект означает, что система теряет или отдает энергию.
Рисунок 7.3 Энергия реакции
(a) При эндотермической реакции энергия системы увеличивается (т. Е. Перемещается выше по вертикальной шкале энергии). (b) При экзотермической реакции энергия системы уменьшается (т.е. перемещается ниже по вертикальной шкале энергии).
Пример 6
Рассмотрим это термохимическое уравнение.
2CO (г) + O 2 (г) → 2CO 2 (г) Δ H = −565 кДжЭкзотермический или эндотермический? Сколько энергии выделяется или поглощается?
Решение
По определению, химическая реакция с отрицательной Δ H является экзотермической, что означает, что такая большая энергия — в данном случае 565 кДж — выделяется реакцией.
Проверьте себя
Рассмотрим это термохимическое уравнение.
Экзотермический или эндотермический? Сколько энергии выделяется или поглощается?
Ответ
эндотермический; Поглощается 42 кДж.
Как экспериментально измеряются значения Δ H ? На самом деле Δ H не измеряется; q измеряется. Но измерения проводятся в условиях постоянного давления, поэтому Δ H равно измеренному q .
Экспериментально q измеряется с помощью уравнения
q = мк Δ T Мы предварительно измеряем массу химикатов в системе. Затем мы позволяем протекать химической реакции и измеряем изменение температуры (Δ T ) системы. Если мы знаем удельную теплоемкость материалов в системе (как правило, мы это знаем), мы можем вычислить q . Это значение q численно равно Δ H процесса, которое мы можем масштабировать до молярной шкалы. Контейнер, в котором находится система, обычно изолирован, поэтому любое изменение энергии идет на изменение температуры системы, а не на утечку из системы. Контейнер называется калориметром. Контейнер, используемый для измерения теплоты химической реакции., А процесс измерения изменений энтальпии называется калориметрией. Процесс измерения изменений энтальпии для химических реакций ..
Контейнер, в котором находится система, обычно изолирован, поэтому любое изменение энергии идет на изменение температуры системы, а не на утечку из системы. Контейнер называется калориметром. Контейнер, используемый для измерения теплоты химической реакции., А процесс измерения изменений энтальпии называется калориметрией. Процесс измерения изменений энтальпии для химических реакций ..
Рисунок 7.4 Калориметры
Простой калориметр может быть построен из нескольких вложенных друг в друга поролоновых кофейных чашек, крышки, термометра и мешалки.
Например, предположим, что 4,0 г NaOH или 0,10 моль NaOH растворяются для получения 100,0 мл водного раствора, а 3,65 г HCl или 0,10 моль HCl растворяются для получения еще 100,0 мл водного раствора. Два раствора смешивают в изолированном калориметре, вставляют термометр и накрывают калориметр (см. Рисунок 7.4 «Калориметры» для примера установки). Термометр измеряет изменение температуры, поскольку происходит следующая химическая реакция:
NaOH (водн.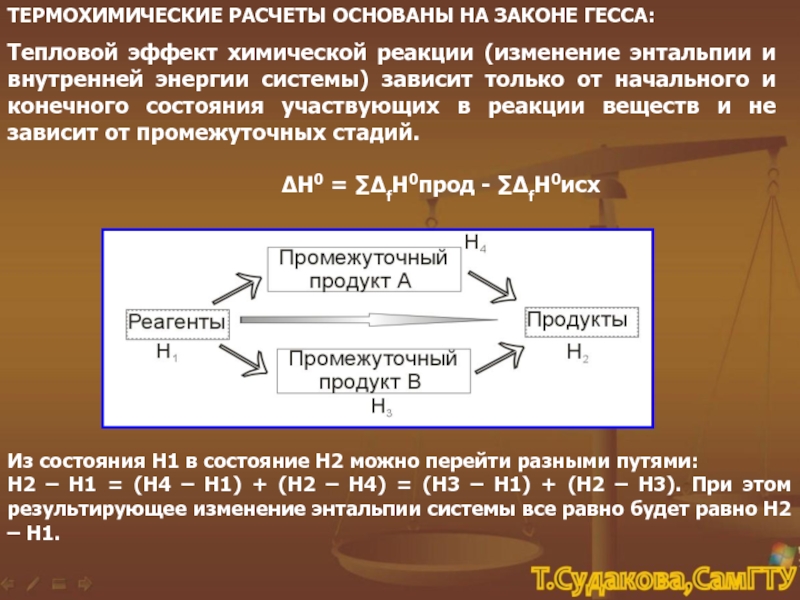 ) + HCl (водн.) → NaCl (водн.) + H 2 O (ℓ)
) + HCl (водн.) → NaCl (водн.) + H 2 O (ℓ)Наблюдатель отмечает, что температура повышается с 22.От 4 ° C до 29,1 ° C. Предполагая, что теплоемкость и плотность растворов такие же, как у чистой воды, теперь у нас есть информация, необходимая для определения изменения энтальпии химической реакции. Общее количество раствора составляет 200,0 мл, а при плотности 1,00 г / мл мы получаем 200,0 г раствора. Используя уравнение для q , мы заменяем наши экспериментальные измерения и удельную теплоемкость воды (Таблица 7.1 «Удельная теплоемкость различных веществ»):
q = (200.0 г) (4,184 Дж г⋅ ° C) (6,7 ° C)Решая для q , получаем
q = 5600 Дж≡ΔH для реакцииТеплота q равна Δ H для реакции, потому что химическая реакция происходит при постоянном давлении. Однако реакция выделяет такое количество энергии, поэтому фактический знак Δ H отрицательный:
Δ H = −5,600 Дж для реакцииТаким образом, мы имеем следующее термохимическое уравнение химической реакции, протекающей в калориметре:
110 NaOH (водн. ) +110 HCl (водн.) → 110 NaCl (водн.) +110 h3O () ΔH = −5,600 Дж
) +110 HCl (водн.) → 110 NaCl (водн.) +110 h3O () ΔH = −5,600 ДжКоэффициенты 1/10 присутствуют, чтобы напомнить нам, что мы начали с одной десятой моля каждого реагента, поэтому мы получаем одну десятую моля каждого продукта.Однако обычно мы приводим термохимические уравнения в молях, а не в одной десятой части моля. Чтобы перейти к молярным величинам, мы должны умножить коэффициенты на 10. Однако, когда мы делаем это, мы получаем в 10 раз больше энергии. Таким образом, имеем
NaOH (водн.) + HCl (водн.) → NaCl (водн.) + H 2 O (ℓ) Δ H = −56,000 ДжΔ H может быть преобразовано в единицы кДж, поэтому окончательное термохимическое уравнение составляет
. NaOH (водн.) + HCl (водн.) → NaCl (водн.) + H 2 O (ℓ) Δ H = −56 кДж Мы только что взяли наши экспериментальные данные из калориметрии и определили изменение энтальпии химической реакции.Аналогичные измерения других химических реакций могут определить значения Δ H любой химической реакции, которую вы хотите изучить.
Пример 7
100 мл раствора 0,25 моль Ca 2+ (водн.) Смешали с 0,50 моль ионов F — (водн.), И выпал CaF 2 :
Ca 2+ (водн.) + 2F — (водн.) → CaF 2 (т)Температура раствора увеличилась на 10,5 ° C. Как изменилась энтальпия химической реакции? Каково изменение энтальпии при производстве 1 моля CaF 2 ? Предположим, что раствор имеет ту же плотность и удельную теплоемкость, что и вода.
Решение
Поскольку нам прямо дано Δ T , мы можем определить теплоту реакции, которая равна Δ H :
q = (100 г) (4,184 Дж г⋅ ° C) (10,5 ° C)Решая для q , получаем
q = 4400 ДжСледовательно, Δ H = −4 400 Дж.
Согласно стехиометрии реакции образуется ровно 0,25 моль CaF 2 , так что это количество тепла равно нулю. 25 мол. Для 1 моля CaF 2 нам нужно увеличить тепло в четыре раза:
25 мол. Для 1 моля CaF 2 нам нужно увеличить тепло в четыре раза:
Изменение энтальпии на молярной основе составляет
Δ H = −17 600 Дж = −17,6 кДжПроверьте себя
В калориметре при постоянном давлении реагируют 0,10 моль CH 4 (г) и 0,20 моль O 2 (г).
CH 4 (г) + 2O 2 (г) → CO 2 (г) + 2H 2 O (ℓ)Реакция согревает 750.0 г H 2 O при 28,4 ° C. Что такое Δ H для реакции в молярном масштабе?
Ответ
−891 кДж
Основные выводы
- Каждая химическая реакция происходит с одновременным изменением энергии.
- Изменение энтальпии равняется теплу при постоянном давлении.
- Изменения энтальпии можно выразить с помощью термохимических уравнений.

- Изменения энтальпии измеряются калориметрическим методом.
Упражнения
При каких обстоятельствах q и Δ H одинаковы?
При каких обстоятельствах q и Δ H отличаются?
Газообразный водород и газообразный хлор реагируют с образованием газообразного хлористого водорода с соответствующим изменением энтальпии на –184 кДж.Напишите правильно сбалансированное термохимическое уравнение для этого процесса.
Пропан (C 3 H 8 ) реагирует с газообразным элементарным кислородом с образованием диоксида углерода и жидкой воды с сопутствующим изменением энтальпии на -2 220 кДж.
 Напишите правильно сбалансированное термохимическое уравнение для этого процесса.
Напишите правильно сбалансированное термохимическое уравнение для этого процесса.Газообразный азот реагирует с газообразным кислородом с образованием NO (г) при поглощении 180 кДж.Напишите правильно сбалансированное термохимическое уравнение для этого процесса.
Твердый натрий реагирует с газообразным хлором с образованием твердого хлорида натрия с выделением 772 кДж. Напишите правильно сбалансированное термохимическое уравнение для этого процесса.
Газообразный водород и газообразный хлор реагируют с образованием газообразного хлористого водорода с соответствующим изменением энтальпии на –184 кДж.Это эндотермический или экзотермический процесс?
Пропан (C 3 H 8 ) реагирует с газообразным элементарным кислородом с образованием диоксида углерода с выделением 2220 кДж энергии.
 Это эндотермический или экзотермический процесс?
Это эндотермический или экзотермический процесс?Газообразный азот реагирует с газообразным кислородом с образованием NO (г) при поглощении 180 кДж.Это экзотермический или эндотермический процесс?
Металлический натрий может реагировать с азотом с образованием азида натрия (NaN 3 ) с Δ H 21,72 кДж. Это экзотермический или эндотермический процесс?
В растворе 250 мл 0.Объединяют 25 моль КОН (водн.) И 0,25 моль HNO 3 (водн.). Температура раствора повышается с 22,5 ° C до 35,9 ° C. Предположим, что раствор имеет ту же плотность и теплоемкость, что и вода.
 Какова теплота реакции и каково молярное значение Δ H реакции?
Какова теплота реакции и каково молярное значение Δ H реакции?В растворе объемом 600 мл смешивают 0,50 моль Ca (OH) 2 (водн.) И 0,50 моль H 2 SO 4 (водн.).Температура раствора повышается на 22,3 ° C. Какова теплота реакции и каково молярное значение Δ H реакции? Предположим, что раствор имеет ту же плотность и теплоемкость, что и вода.
Для нагревания 400,0 г H 2 O сжигают 0,050 моль этанола (C 2 H 5 OH). Вода прогревается от 24,6 ° C до 65,6 ° C. Какова теплота реакции и каково молярное значение Δ H реакции?
Утеплить 100.Сжигается 0 г H 2 O, 0,066 моль пчелиного воска.
 Вода прогревается от 21,4 ° C до 25,5 ° C. Какова теплота реакции и каково молярное значение Δ H реакции?
Вода прогревается от 21,4 ° C до 25,5 ° C. Какова теплота реакции и каково молярное значение Δ H реакции?
ответов
в условиях постоянного давления
H 2 (г) + Cl 2 (г) → 2HCl (г) Δ H = −184 кДж
N 2 (г) + O 2 (г) → 2NO (г) Δ H = 180 кДж
теплота реакции = −14.
 0 кДж; Δ H = −56,0 кДж / моль реагентов
0 кДж; Δ H = −56,0 кДж / моль реагентовтеплота реакции = -68,6 кДж; Δ H = -1,370 кДж / моль этанола
Энтальпия и химические реакции — Вводная химия — 1-е канадское издание
- Определите энтальпию .
- Правильно выразите изменение энтальпии химических реакций.
- Объясните, как изменения энтальпии измеряются экспериментально.
Теперь, когда мы показали, как связаны энергия, работа и тепло, мы готовы рассмотреть изменения энергии в химических реакциях. Фундаментальная концепция заключается в том, что каждая химическая реакция происходит с одновременным изменением энергии . Теперь нам нужно научиться правильно выражать эти энергетические изменения.
Наше исследование газов в главе 6 «Газы» и наше определение работы в разделе «Работа и тепло» показывают, что такие условия, как давление, объем и температура, влияют на энергосодержание системы.Что нам нужно, так это определение энергии, которое имеет место, когда указаны некоторые из этих условий (что-то вроде нашего определения стандартной температуры и давления в нашем исследовании газов). Мы определяем изменение энтальпии (Δ H ) как тепло процесса, когда давление поддерживается постоянным:
Буква H означает «энтальпию», вид энергии, а Δ означает изменение количества. Нас всегда будет интересовать изменение H , а не абсолютное значение H как таковое.
Когда происходит химическая реакция, наблюдается характерное изменение энтальпии. Изменение энтальпии реакции обычно записывается после сбалансированного химического уравнения и в той же строке. Например, когда два моля водорода реагируют с одним молем кислорода с образованием двух моль воды, характерное изменение энтальпии составляет 570 кДж. Запишем уравнение как:
Запишем уравнение как:
Химическое уравнение, которое включает изменение энтальпии, называется термохимическим уравнением. Предполагается, что термохимическое уравнение относится к уравнению в молярных количествах, что означает, что его следует интерпретировать с точки зрения молей, а не отдельных молекул.
Напишите термохимическое уравнение реакции PCl 3 (г) с Cl 2 (г) с образованием PCl 5 (г), у которого изменение энтальпии составляет -88 кДж.
Решение
Напишите термохимическое уравнение реакции N 2 (г) с O 2 (г) с образованием 2NO (г) с изменением энтальпии 181 кДж.
Ответ
Вы могли заметить, что Δ H для химической реакции может быть положительным или отрицательным.Число считается положительным, если у него нет знака; знак + можно добавить явно, чтобы избежать путаницы. Химическая реакция, имеющая положительное значение Δ H , называется эндотермической, а химическая реакция, имеющая отрицательное значение Δ H , считается экзотермической.
Что означает положительное значение Δ H процесса? Это означает, что система, в которой происходит химическая реакция, набирает энергию. Если рассматривать энергию системы в виде высоты на вертикальном графике энергии, изменение энтальпии, которое сопровождает реакцию, можно представить в виде диаграммы в части (а) на рисунке 7.3 «Энергия реакции»: энергия реагентов имеет некоторую энергию, и система увеличивает ее энергию по мере перехода к продуктам. Продукты выше по вертикали, чем реагенты. Таким образом, эндотермический режим означает, что система получает или поглощает энергию.
Противоположная ситуация существует для экзотермического процесса, как показано в части (b) на Рисунке 7.3 «Энергия реакции». Если изменение энтальпии реакции отрицательное, система теряет энергию, поэтому продукты имеют меньше энергии, чем реагенты, а продукты ниже по вертикальной шкале энергии, чем реагенты.Таким образом, экзотермический эффект означает, что система теряет или отдает энергию.
Рассмотрим это термохимическое уравнение:
Экзотермический или эндотермический? Сколько энергии выделяется или поглощается?
Решение
По определению, химическая реакция с отрицательной Δ H является экзотермической, что означает, что такая большая энергия — в данном случае 565 кДж — выделяется реакцией.
Рассмотрим это термохимическое уравнение:
Экзотермический или эндотермический? Сколько энергии выделяется или поглощается?
Ответ
эндотермический; Поглощается 42 кДж.
Как экспериментально измеряются значения Δ H ? На самом деле Δ H не измеряется; q измеряется. Но измерения проводятся в условиях постоянного давления, поэтому Δ H равно измеренному q .
Экспериментально q измеряется с помощью следующего уравнения:
Мы предварительно измеряем массу химикатов в системе. Затем мы позволяем протекать химической реакции и измеряем изменение температуры (Δ T ) системы. Если мы знаем удельную теплоемкость материалов в системе (как правило, мы это знаем), мы можем вычислить q . Это значение q численно равно Δ H процесса, которое мы можем масштабировать до молярной шкалы.Контейнер, в котором находится система, обычно изолирован, поэтому любое изменение энергии идет на изменение температуры системы, а не на утечку из системы. Контейнер называется калориметром, а процесс измерения изменений энтальпии называется калориметрией.
Рисунок 7.4 «Калориметр». Простой калориметр может быть построен из нескольких вложенных друг в друга поролоновых кофейных чашек, крышки, термометра и мешалки. Например, предположим, что 4,0 г NaOH или 0,10 моль NaOH растворяются, чтобы получить 100. 0 мл водного раствора растворяют 3,65 г HCl или 0,10 моль HCl, чтобы получить еще 100,0 мл водного раствора. Два раствора смешивают в изолированном калориметре, вставляют термометр и накрывают калориметр (см. Рисунок 7.4 «Калориметр» для примера установки). Термометр измеряет изменение температуры, поскольку происходит следующая химическая реакция:
0 мл водного раствора растворяют 3,65 г HCl или 0,10 моль HCl, чтобы получить еще 100,0 мл водного раствора. Два раствора смешивают в изолированном калориметре, вставляют термометр и накрывают калориметр (см. Рисунок 7.4 «Калориметр» для примера установки). Термометр измеряет изменение температуры, поскольку происходит следующая химическая реакция:
Наблюдатель отмечает, что температура повышается с 22,4 ° C до 29,1 ° C. Предполагая, что теплоемкость и плотность растворов такие же, как у чистой воды, теперь у нас есть информация, необходимая для определения изменения энтальпии химической реакции.Общее количество раствора составляет 200,0 мл, а при плотности 1,00 г / мл мы получаем 200,0 г раствора. Используя уравнение для q , мы заменяем наши экспериментальные измерения и удельную теплоемкость воды (см. Таблицу 7.1 «Энтальпии образования различных веществ» в разделе «Реакции образования»):
Решая q , получаем:
Теплота q равна Δ H для реакции, потому что химическая реакция происходит при постоянном давлении. Однако реакция выделяет такое количество энергии, поэтому фактический знак Δ H отрицательный:
Однако реакция выделяет такое количество энергии, поэтому фактический знак Δ H отрицательный:
Таким образом, мы имеем следующее термохимическое уравнение химической реакции, протекающей в калориметре:
Коэффициенты присутствуют, чтобы напомнить нам, что мы начали с одной десятой моля каждого реагента, поэтому мы получаем одну десятую моля каждого продукта. Однако обычно мы приводим термохимические уравнения в молях, а не в одной десятой части моля.Чтобы перейти к молярным величинам, мы должны умножить коэффициенты на 10. Однако, когда мы делаем это, мы получаем в 10 раз больше энергии. Таким образом, имеем:
Δ H можно преобразовать в единицы кДж, поэтому окончательное термохимическое уравнение будет:
Мы только что взяли наши экспериментальные данные из калориметрии и определили изменение энтальпии химической реакции. Аналогичные измерения других химических реакций могут определить значения Δ H любой химической реакции, которую вы хотите изучить.
100 мл раствора 0,25 моль Ca 2+ (водн.) Смешали с 0,50 моль ионов F — (водн.), И выпал CaF 2 :
Температура раствора увеличилась на 10,5 ° C. Как изменилась энтальпия химической реакции? Каково изменение энтальпии при производстве 1 моля CaF 2 ? Предположим, что раствор имеет ту же плотность и удельную теплоемкость, что и вода.
Решение
Поскольку нам прямо дано Δ T , мы можем определить теплоту реакции, которая равна Δ H :
Решая q , получаем:
Следовательно, Δ H = −4 400 Дж.
Согласно стехиометрии реакции, образуется точно 0,25 моль CaF 2 , поэтому это количество тепла составляет 0,25 моль. Для 1 моля CaF 2 нам нужно увеличить тепло в четыре раза:
Изменение энтальпии на молярной основе составляет:
В калориметре при постоянном давлении 0,10 моль CH 4 (г) и 0,20 моль O 2 (г) реагируют в соответствии со следующим уравнением:
Реакция согревает 750. 0 г H 2 O при 28,4 ° C. Что такое Δ H для реакции в молярном масштабе?
0 г H 2 O при 28,4 ° C. Что такое Δ H для реакции в молярном масштабе?
Ответ
−891 кДж
- Каждая химическая реакция происходит с одновременным изменением энергии.
- Изменение энтальпии равняется теплу при постоянном давлении.
- Изменения энтальпии можно выразить с помощью термохимических уравнений.
- Изменения энтальпии измеряются калориметрическим методом.
- При каких обстоятельствах q и Δ H одинаковы?
- При каких обстоятельствах q и Δ H отличаются?
- Газообразный водород и газообразный хлор реагируют с образованием газообразного хлористого водорода с соответствующим изменением энтальпии на –184 кДж.Напишите правильно сбалансированное термохимическое уравнение для этого процесса.
- Пропан (C 3 H 8 ) реагирует с газообразным элементарным кислородом с образованием диоксида углерода и жидкой воды с сопутствующим изменением энтальпии на -2 220 кДж.
 Напишите правильно сбалансированное термохимическое уравнение для этого процесса.
Напишите правильно сбалансированное термохимическое уравнение для этого процесса. - Газообразный азот реагирует с газообразным кислородом с образованием NO (г) при поглощении 180 кДж. Напишите правильно сбалансированное термохимическое уравнение для этого процесса.
- Твердый натрий реагирует с газообразным хлором с образованием твердого хлорида натрия с выделением 772 кДж.Напишите правильно сбалансированное термохимическое уравнение для этого процесса.
- Газообразный водород и газообразный хлор реагируют с образованием газообразного хлористого водорода с соответствующим изменением энтальпии на –184 кДж. Это эндотермический или экзотермический процесс?
- Пропан (C 3 H 8 ) реагирует с газообразным элементарным кислородом с образованием диоксида углерода с выделением 2220 кДж энергии. Это эндотермический или экзотермический процесс?
- Газообразный азот реагирует с газообразным кислородом с образованием NO (г) при поглощении 180 кДж.
 Это экзотермический или эндотермический процесс?
Это экзотермический или эндотермический процесс? - Металлический натрий может реагировать с азотом с образованием азида натрия (NaN 3 ) с Δ H 21,72 кДж. Это экзотермический или эндотермический процесс?
- Нарисуйте диаграмму уровней энергии для химической реакции в упражнении 8. (См. Пример на Рис. 7.3 «Энергия реакции».)
- Нарисуйте диаграмму уровней энергии химической реакции в упражнении 9. (См. Пример на Рис. 7.3 «Энергия реакции».)
- В 250 мл раствора 0.Объединяют 25 моль КОН (водн.) И 0,25 моль HNO 3 (водн.). Температура раствора повышается с 22,5 ° C до 35,9 ° C. Предположим, что раствор имеет ту же плотность и теплоемкость, что и вода. Какова теплота реакции и каково Δ H реакции на молярной основе?
- В растворе объемом 600 мл смешивают 0,50 моль Ca (OH) 2 (водн.) И 0,50 моль H 2 SO 4 (водн.). Температура раствора повышается на 22,3 ° C. Какова теплота реакции и каково Δ H реакции на молярной основе? Предположим, что раствор имеет ту же плотность и теплоемкость, что и вода.

- Для нагревания 400,0 г H 2 O сжигают 0,050 моль этанола (C 2 H 5 OH). Вода прогревается от 24,6 ° C до 65,6 ° C. Какова теплота реакции и каково Δ H реакции на молярной основе?
- Для нагревания 100,0 г H 2 O сжигают 0,066 моль пчелиного воска. Вода прогревается от 21,4 ° C до 25,5 ° C. Какова теплота реакции и каково Δ H реакции на молярной основе?
- в условиях постоянного давления
- экзотермический
- эндотермический
- теплота реакции = -14.0 кДж; Δ H = −56,0 кДж / моль реагентов
- теплота реакции = -68,6 кДж; Δ H = -1,370 кДж / моль этанола
авторство в СМИ
.


 моль) V = n * Vm
моль) V = n * Vm Напишите
уравнение реакции горения С3Н6
Напишите
уравнение реакции горения С3Н6


 Напишите правильно сбалансированное термохимическое уравнение для этого процесса.
Напишите правильно сбалансированное термохимическое уравнение для этого процесса. Это эндотермический или экзотермический процесс?
Это эндотермический или экзотермический процесс? Какова теплота реакции и каково молярное значение Δ H реакции?
Какова теплота реакции и каково молярное значение Δ H реакции? Вода прогревается от 21,4 ° C до 25,5 ° C. Какова теплота реакции и каково молярное значение Δ H реакции?
Вода прогревается от 21,4 ° C до 25,5 ° C. Какова теплота реакции и каково молярное значение Δ H реакции? 0 кДж; Δ H = −56,0 кДж / моль реагентов
0 кДж; Δ H = −56,0 кДж / моль реагентов Напишите правильно сбалансированное термохимическое уравнение для этого процесса.
Напишите правильно сбалансированное термохимическое уравнение для этого процесса. Это экзотермический или эндотермический процесс?
Это экзотермический или эндотермический процесс?