Расчеты по термохимическим уравнениям. Видеоурок. Химия 8 Класс
Из материалов урока вы узнаете, какое уравнение химической реакции называют термохимическим. Урок посвящен изучению алгоритма расчетов по термохимическому уравнению реакций.
Тема: Вещества и их превращения
Урок: Расчеты по термохимическим уравнениям
Практически все реакции протекают с выделением или поглощением теплоты. Количество теплоты, которое выделяется или поглощается в ходе реакции, называется тепловым эффектом химической реакции.
Если тепловой эффект записан в уравнении химической реакции, то такое уравнение называют термохимическим.
В термохимических уравнениях, в отличие от обычных химических, обязательно указывают агрегатное состояние вещества (твердое, жидкое, газообразное).
Например, термохимическое уравнение реакции между оксидом кальция и водой выглядит так:
СаО(т) + Н2О(ж) = Са(ОН)2(т)
Количество теплоты Q, выделившееся или поглощенное при протекании химической реакции, пропорционально количеству вещества реагента или продукта. Поэтому, пользуясь термохимическими уравнениями, можно производить различные расчеты.
Рассмотрим примеры решения задач.
Задача 1:Определите количество теплоты, затраченное на разложение 3,6 г воды в соответствии с ТХУ реакции разложения воды:

Решить эту задачу можно с помощью пропорции:
при разложении 36 г воды поглотилось 484 кДж
при разложении 3,6 г воды поглотилось x кДж
Таким образом, можно составить уравнение реакции. Полное решение задачи приведено на Рис.1.
Рис. 1. Оформление решения задачи 1
Задача может быть сформулирована таким образом, что вам нужно будет составить термохимическое уравнение реакции. Рассмотрим пример такой задачи.
Задача 2: При взаимодействии 7 г железа с серой выделилось 12,15 кДж теплоты. На основании этих данных составьте термохимическое уравнение реакции.
Обращаю ваше внимание на то, что ответом в данной задаче служит само термохимическое уравнение реакции.
Рис. 2. Оформление решения задачи 2
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П.А. Оржековского и др. «Химия. 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с.80-84)
2. Химия: неорган. химия: учеб. для 8кл. общеобр. учрежд. /Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§23)
3. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Решение задач: расчеты по термохимическим уравнениям (Источник).
2. Термохимические уравнения (Источник).
Домашнее задание
1) с. 69 задачи №№ 1,2 из учебника «Химия: неорган. химия: учеб. для 8кл. общеобр. учрежд.» /Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009.
2) с.80-84 №№ 241, 245 из Сборника задач и упражнений по химии: 8-й кл.: к учеб. П.А. Оржековского и др. «Химия. 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
interneturok.ru
Термохимические уравнения
Для того, чтобы сравнивать энергетические эффекты различных процессов, тепловые эффекты определяют при стандартных условиях
. За стандартные принимают давление 100 кПа (1 бар), температуру 250С (298 К), концентрацию — 1 моль/л. Если исходные вещества и продукты реакции находятся в стандартном состоянии, то тепловой эффект химической реакции называется стандартной энтальпией системы и обозначается ΔН0298 или ΔН0.Уравнения химических реакций с указанием теплового эффекта называют термохимическими уравнениями.
В термохимических уравнениях указывают фазовое состояние и полиморфную модификацию реагирующих и образующихся веществ: г —газовое, ж — жидкое, к —кристаллическое, т — твердое, р — растворенное и др. Если агрегатные состояния веществ для условий реакции очевидны, например, О2, N2, Н2 — газы, Аl2О3, СаСО
Термохимическое уравнение включает в себя тепловой эффект реакции ΔН, который в современной терминологии записывают рядом с уравнением. Например:
С6Н6(Ж) + 7,5О2 = 6СО2 + 3Н2О(Ж) ΔН0 = — 3267,7 кДж
N2 + 3Н2 = 2NН3(Г) ΔН0 = — 92,4 кДж.
С термохимическими уравнениями можно оперировать, как и с алгебраическими уравнениями (складывать, вычитать друг из друга, умножать на постоянную величину и т.д.).
Термохимические уравнения часто (но не всегда) приводятся для одного моля рассматриваемого вещества (получаемого или расходуемого). При этом другие участники процесса могут входить в уравнение с дробными коэффициентами. Это допускается, так как термохимические уравнения оперируют не с молекулами, а с молями веществ.
Термохимические расчеты
Тепловые эффекты химических реакций определяют как экспериментально, так и с помощью термохимических расчетов.
В основе термохимических расчетов лежит закон Гесса (1841 г):
Тепловой эффект реакции не зависит от пути, по которому протекает реакция (т.е. от числа промежуточных стадий), а определяется начальным и конечным состоянием системы.
Например, реакция горения метана может протекать по уравнению:
СН4 +2О2 = СО2 + 2Н2О(Г)
Эту же реакцию можно провести через стадию образования СО:
СН4 +3/2О2 = СО + 2Н2О(Г) ΔН02 = —519,33 кДж
СО +1/2О2 = СО2 ΔН03 = —283,01 кДж
При этом оказывается, что ΔН01 = ΔН02 + ΔН03 . Следовательно, тепловой эффект реакции, протекающей по двум путям, одинаков. Закон Гесса хорошо иллюстрируется с помощью энтальпийных диаграмм (рис.2)
Из закона Гесса вытекает ряд следствий:
1. Тепловой эффект прямой реакции равен тепловому эффекту обратной реакции с противоположным знаком.
2. Если в результате ряда последовательных химических реакций система приходит в состояние, полностью совпадающее с исходным, то сумма тепловых эффектов этих реакций равна нулю (ΔН = 0). Процессы, в которых система после последовательных превращений возвращается в исходное состояние, называются круговыми процессами или циклами. Метод циклов широко используется в термохимических расчетах. .
3. Энтальпия химической реакции равна сумме энтальпий образования продуктов реакций за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
Здесь встречаемся с понятием »энтальпия образования».
Энтальпией (теплотой) образования химического соединения называется тепловой эффект реакции образования 1 моля этого соединения из простых веществ, взятых в их устойчивом состоянии при данных условиях.
В таком случае следствие из закона Гесса для теплового эффекта химической реакции (ΔН(Х.Р.)) имеет вид:
ΔН(Х.Р.) = ∑ΔН0продуктов реакции — ∑ΔН0исходных веществ
Используя закон Гесса, можно рассчитывать энергию химической связи, энергию кристаллических решеток, теплоты сгорания топлив, калорийность пищи и т.д.
Наиболее распространенные расчеты – вычисление тепловых эффектов (энтальпий) реакций, что необходимо для технологических и научных целей.
Пример 1. Напишите термохимическое уравнение реакции между СО2(Г) и водородом, в результате которой образуются СН4(Г) и Н2О(Г), вычислив ее тепловой эффект на основе данных, приведенных в приложении. Сколько теплоты выделится в этой реакции при получении 67,2 л метана в пересчете на стандартные условия?
Решение. Составляем и уравниваем химическую часть требующегося термохимического уравнения:
СО2(Г) + 3Н2(Г) = СН4(Г) + 2Н2О(Г)
Находим в справочнике (приложение) стандартные теплоты образования соединений, участвующих в процессе:
ΔН0 (СО2(Г)) = —393,51 кДж/моль ΔН0 (СН4(Г)) = —74,85 кДж/моль ΔН0 (Н2(Г)) = 0 кДж/моль ΔН0 (Н2О(Г)) = ―241,83 кДж/моль
Обратите внимание, что теплота образования водорода, как и всех простых веществ в их устойчивом при данных условиях состоянии, равна нулю. Рассчитываем тепловой эффект реакции:
ΔН(Х.Р.) = ∑ΔН0(прод.) — ∑ΔН0(исх.)=
ΔН0(СН4(Г)) + 2ΔН0(Н2О(Г)) — ΔН0(СО2(Г)) —3ΔН0 (Н2(Г))) =
—74,85 + 2(—241,83) — (—393,51) — 3·0 = —165,00 кДж/моль.
Термохимическое уравнение имеет вид:
СО2(Г) + 3Н2(Г) = СН4(Г) + 2Н2О(Г); ΔН = —165,00 кДж
Согласно этому термохимическому уравнению, 165,00 кДж теплоты выделится при получении 1 моль, т.е. 22,4 л метана. Количество теплоты, выделившейся при получении 67,2 л метана, находим из пропорции:
22,4 л —— 165,00 кДж 67,2·165,00
67,2 л —— Q кДж Q = —————— = 22,4
= 495,00 кДж
Пример 2. При сгорании 1л этилена С2Н4(Г) (стандартные условия) с образованием газообразного оксида углерода (IV) и жидкой воды выделяется 63,00 кДж теплоты. Рассчитайте по этим данным мольную энтальпию горения этилена и запишите термохимическое уравнение реакции. Вычислите энтальпию образования С2Н4(Г) и сравните полученное значение с литературными данными (приложение).
Решение. Составляем и уравниваем химическую часть требующегося термохимического уравнения:
С2Н4(Г) + 3О2(Г) = 2СО2(Г) + 2Н2О(Ж); Н = ?
Создаваемое термохимическое уравнение описывает горение 1 моль, т.е. 22,4 л этилена. Необходимую для него мольную теплоту горения этилена находим из пропорции:
1л —— 63,00 кДж 22,4·63,00
22,4 л —— Q кДж Q = —————— =
1
= 1410,96 кДж
Н = -Q, термохимическое уравнение горения этилена имеет вид: С2Н4(Г) + 3О2(Г) = 2СО2(Г) + 2Н2О(Ж); Н = -1410,96 кДж
Для расчета энтальпии образования С2Н4(Г) привлекаем следствие из закона Гесса: ΔН(Х.Р.) = ∑ΔН0(прод.) — ∑ΔН0(исх.).
Используем найденную нами энтальпию горения этилена и приведенные в приложении энтальпии образования всех (кроме этилена) участников процесса.
—1410,96 = 2·(—393,51) + 2·(—285,84) — ΔН0(С2Н4(Г)) — 3·0
Отсюда ΔН0(С2Н4(Г)) = 52,26 кДж/моль. Это совпадает со значением, приведенным в приложении и доказывает правильность наших вычислений.
Пример 3. Напишите термохимическое уравнение образования метана из простых веществ, вычислив энтальпию этого процесса из следующих термохимических уравнений:
СН4(Г) + 2О2(Г) = СО2(Г)+ 2Н2О(Ж) ΔН1 = -890,31 кДж (1)
С( ГРАФИТ) + О2(Г) = СО2(Г) Н2 = -393,51 кДж (2)
Н2(Г) + ½О2(Г) = Н2О(Ж) Н3 = -285,84 кДж (3)
Сравните полученное значение с табличными данными (приложение).
Решение. Составляем и уравниваем химическую часть требующегося термохимического уравнения:
С(ГРАФИТ) + 2Н2(Г) = СН4(Г) Н4 = Н0(СН4(Г))) =? (4)
С термохимическими уравнениями можно оперировать так же, как и с алгебраическими. Мы должны в результате алгебраических действий с уравнениями 1, 2 и 3 получить уравнение 4. Для этого следует уравнение 3 умножить на 2, результат сложить с уравнением 2 и вычесть уравнение 1.
2Н2(Г) + О2(Г) = 2Н2О(Ж)Н0(СН4(Г)) = 2Н3 + Н2 — Н1
+ С(ГРАФИТ) + О2(Г) + СО2(Г) Н0(СН4(Г)) = 2(—285,84)
— СН4(Г) — 2О2(Г) —СО2(Г)— 2Н2О(Ж) + (—393,51)
― (—890,31).
С(ГРАФИТ) + 2Н2(Г) = СН4(Г) Н0(СН4(Г)) = —74,88 кДж
Это совпадает со значением, приведенным в приложении, что доказывает правильность наших вычислений.
studfile.net
Термохимические уравнения — Решение задач — Уроки химии — Классная комната
Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Например: Термохимическое уравнение разложения малахита
(CuOH)2 CO3 = 2CuO + H 2 O + CO 2 — 47 кДж
Мы видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества.
Решим задачи:
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mq + O2 = 2MqO + 1204 кДж
Дано: m (Mg0) = 120г Найти: Q1 -? | Решение: 1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
n = m / M n(MqO) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции По уравнению 2 моля MqO — 1204 кДж По условию 3 моля MqO — Q1 |
Отсюда
|
| 3 моль* 1204кДж |
|
Q1 | = | ———————— | = 1803 кДж |
|
| 2моль |
|
Ответ: При образовании 120г оксида магния выделится 1803 кДж энергии.
Задача 2. В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
Дано: Q1 = 652,5 кДж Найти: m(C2H2)-? | Решение:
1) Установим пропорциональные отношения между количеством вещества ацетилена и количеством теплоты. По уравнению 2 моль C2H2_———- 2610 кДж По условию х моль ———- 652,5 кДж
Решаем пропорцию
2) Определяем массу ацетилена по формуле m= n * M m = 0,5 моль * 26 г/моль = 13 г.
|
Ответ: масса сгоревшего ацетилена 13 г.
Задача 3. В результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте термохимическое уравнение этой реакции.
Дано: m(CH4)= 48г Q1 = 2406 кДж Найти: Q -?
| Решение: 1. Запишем уравнение реакции горения метана в общем виде
CH4+ 2O2 = CO2 +2H2O + Q
2. Определим количество 48 г метана
n = m / M n(CH4) = 48г/ 16 г/моль = 3 моль
3. Составляем пропорцию с учетом коэффициентов в уравнении реакции
По условию 3моля CH4 — 2406 кДж По уравнению 1 моль CH4 — Q
Решаем пропорцию
Ответ: термохимическое уравнение реакции горения метана
CH4+ 2O2 = CO2 +2H2O + 802 кДж
|
Задача 4. Какой объем кислорода (при н.у.) выделится в результате реакции, термохимическое уравнение которой
2KClO3 = 2KCl + 3O2 – 91 кДж,
если на разложение бертолетовой соли было затрачено 182 кДж теплоты.
Дано: Q1 = 91 кДж
Найти: V (O2)-? | Решение:
1)Установим пропорциональные отношения между количеством вещества кислорода и количеством теплоты.
По уравнению 3 моль O2 ———- 91 кДж По условию х моль ———- 182 кДж
Решаем пропорцию
2) Вычислим объем кислорода, согласно закону Авогадро (Vm = 22б4 л.моль) V = n * Vm
V(O2) = 6 моль * 22,4 л/моль = 134,4 л
|
Ответ: объем выделившегося кислорода равен 134,4 л.
Решите самостоятельно:
1. Согласно термохимическому уравнению реакции
CH4+ 2O2 = CO2 +2H2O + 802 кДж
определите количество теплоты, выделившейся при сжигании 24 г метана.
2. Тепловой эффект реакции горения серы равен 297 кДж. Какая масса серы сгорела, если выделилось 742,5 кДж теплоты.
3. По термохимическому уравнению H2+ Cl2 = 2HCl + 184,36 кДж рассчитайте, какой объем затрачен на образование хлороводорода (при н.у.), если при этом выделилось 921,8 кДж теплоты.
Проверьте решение на тренажере
himekoscho.ucoz.ru
1.4.2 Тепловой эффект химической реакции. Термохимические уравнения
Видеоурок 1: Тепловой эффект реакции
Видеоурок 2: Расчеты по термохимическим уравнениям
Лекция: Тепловой эффект химической реакции. Термохимические уравнения
 Тепловой эффект химической реакции
Тепловой эффект химической реакции
Термохимия – это раздел химии, изучающий термические, т.е. тепловые эффекты реакций.

Как вам известно, каждый химический элемент обладает n-количеством энергии. Мы сталкиваемся с этим каждый день, т.к. каждый прием пищи запасает наш организм энергией химических соединений. Без этого у нас не будет сил двигаться, работать. Эта энергия поддерживает в нашем теле постоянную t 36,6.
В момент протекания реакций энергия элементов затрачивается либо на разрушение, либо на образование химических связей между атомами. Для разрушения связи энергию нужно затратить, а для образования выделить. И вот когда выделяемая энергия больше, чем затрачиваемая, образовавшийся избыток энергии превращается в тепло. Таким образом:
Выделение и поглощение теплоты при химических реакциях называется тепловым эффектом реакции, и обозначается буков Q.
Экзотермические реакции – в процессе таких реакций происходит выделение теплоты, и она передается окружающей среде.
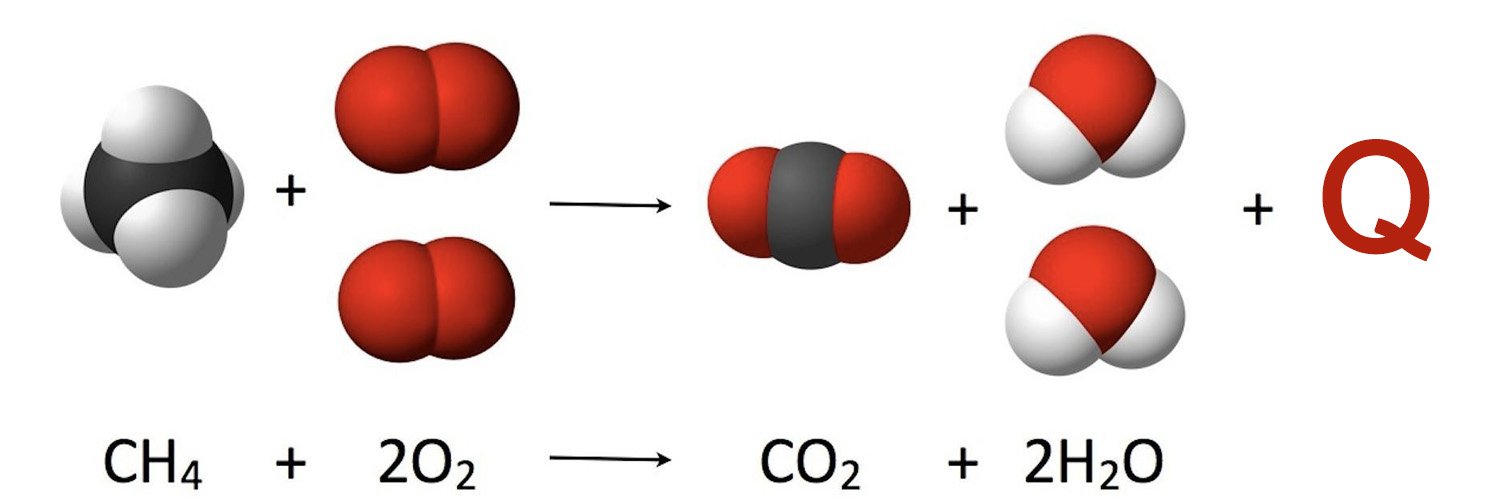
У данного типа реакции положительный тепловой эффект +Q. В качестве примера возьмем реакцию горения метана:
Эндотермические реакции – в процессе таких реакций происходит поглощение теплоты.
У данного типа реакции отрицательный тепловой эффект -Q. К примеру, рассмотрим реакцию угля и воды при высокой t:
 Тепловой эффект реакции напрямую зависит от температуры, а также от давления.
Тепловой эффект реакции напрямую зависит от температуры, а также от давления. Термохимические уравнения
Термохимические уравнения

Тепловой эффект реакции определяется с применением термохимического уравнения. Чем оно отличается? В данном уравнении возле символа элемента указывается его агрегатное состояние (твердое, жидкое, газообразное). Это необходимо делать т.к. на тепловой эффект химических реакций влияет масса вещества в агрегатном состоянии. В конце уравнения за знаком = указывается численное значение тепловых эффектов в Дж или кДж.
В качестве примера представлено уравнение реакции, показывающее процесс сгорания водорода в кислороде: H2(г) + ½O2(г) → H2O(ж) + 286 кДж.
Уравнение показывает, что на 1 моль кислорода, и на 1 моль образовавшейся воды выделяется 286 кДж теплоты. Реакция — экзотермическая. Данная реакция отличается значительным тепловым эффектом.
При образовании, какого — либо соединения, будет выделяться или поглощаться такое же количество энергии, какое поглощается или выделяется при его распаде на первичные вещества.
Практически все термохимические расчеты, основываются на законе термохимии – законе Гесса. Закон был выведен в 1840 году, знаменитым российским ученым Г. И. Гессом.
Основной закон термохимии: тепловой эффект реакции, зависит от природы и физического состояния исходных и конечных веществ, но не зависит от пути протекания реакции.
Применяя данный закон, удастся вычислить тепловой эффект промежуточной стадии реакции, если известны общий тепловой эффект реакции, и тепловые эффекты других промежуточных стадий.
Знание теплового эффекта реакции имеет большое практическое значение. К примеру, врачи – диетологи используют их при составлении правильного рациона питания; в химической промышленности эти знания необходимы при нагревании реакторов и наконец, без расчёта теплового эффекта невозможно вывести ракету на орбиту.
cknow.ru
10.Что такое термохимическое уравнение? Перечислите особенности записи термохимических уравнений.
Уравнения химических реакций, в которых указаны их тепловые
эффекты, называются термохимическими уравнениями.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Термохимические уравнения имеют ряд особенностей:
а) Поскольку от агрегатных состояний веществ зависит состояние системы
в целом, в термохимических уравнениях с помощью буквенных индексов
(к), (ж), (р) и (г) обозначаются состояния веществ (кристаллическое, жид-кое, растворенное и газообразное). Например,
б) Чтобы тепловой эффект реакции был выражен в кДж/моль одного из ис-ходных веществ или продуктов реакции, в термохимических уравнениях
допускаются дробные коэффициенты. Например,
1
2
N
2(г)
+
3
2
H
2(г)
= NH
3(г)
, ∆H
0
298
=−46,2кДж/моль.
в) Часто теплота реакции (тепловой эффект) записывается как∆H
0
T
или
∆H
0
298
. Верхний индекс 0 означает стандартную величину теплового эф-фекта (величину, полученную при стандартных условиях, т. е. при давле-нии 101 кПа), а нижний — температуру, при которой идет взаимодействие.
Особенность термохимических уравнений заключается в том, что при работе с ними можно переносить формулы веществ и величины тепловых эффектов из одной части уравнения в другую. С обычными уравнениями химических реакций так поступать, как правило, нельзя.
Допускается также почленное сложение и вычитание термохимических уравнений. Это бывает нужно для определения тепловых эффектов реакций, которые трудно или невозможно измерить в опыте.
11.Сформулируйте закон Гесса и следствие из закона Гесса.
Закон Гессаформулируется следующим образом: тепловой эффект химической реакции не зависит от пути ее протекания, а зависит лишь от природы и физического состояния (энтальпии) исходных веществ и продуктов реакции.
Следствие 1. Тепловой эффект реакции равен разности сумм теп-лот образования продуктов реакции и теплот образования исход-ных веществ с учетом их стехиометрических коэффициентов.
Следствие 2. Если известны тепловые эффекты ряда реакций, то можно определить тепловой эффект другой реакции, в которую входят вещества и соединения, входящие в уравнения, для которых тепловой эффект известен. При этом с термохимическими уравнениями можно производить самые различные арифметические действия (сложение, вычитание, умножение, деление) как с алгебраическими уравнениями.
12.Что такое стандартная энтальпия образования вещества?
Стандартной энтальпией образования вещества называют тепловой эффект реакции образования 1 моль данного вещества из соответствующего количества простых веществ, находящихся в стандартных условиях.
13.Что такое энтропия? в чем она измеряется?
Энтропия — термодинамическая функция состояния системы, и ее величина зависит от количества рассматриваемого вещества (массы), температуры, агрегатного состояния.
Единицы измерения Дж/К
14.Сформулируйте 2 и 3 законы термодинамики.
Второй закон термодинамики
В изолированных системах (Q= 0, A= 0, U= const) самопроизвольно идут
только те процессы, которые сопровождаются ростом энтропии системы, т. е.S>0.
Самопроизвольный процесс заканчивается при достижении максимальной при
данных условиях энтропии S max, т. е. когда ∆S= 0.
Таким образом, в изолированных системах критерием самопроизвольного про-цесса является возрастание энтропии, а пределом такого процесса —∆S= 0.
Третий закон термодинамики
Энтропия каждого химического элемента в идеальном кристаллическом состо-янии при температуре, близкой к абсолютному нулю, близка к нулю.
ST→0→0.
Энтропия неидеальных кристаллов больше нуля, т. к. их можно рассматривать
как смеси, обладающие энтропией смешения. Это справедливо также для кри-сталлов, имеющих дефекты кристаллической структуры. Отсюда следует принцип
недостижимости абсолютного нуля температуры. В настоящее время достигнута
самая низкая температура 0,00001 К.
studfile.net
Термохимия
Термохимия
Раздел — химической термодинамики ,изучающий тепловые эффекты химических реакций и фазовых превращений ,называется термохимией.
В ходе химической реакции происходит перестройка энергетических уровней атомов, молекул, изменяется внутренняя энергия и, следовательно, должно наблюдаться поглощение или выделение теплоты — тепловой эффект.
В изохорно-изотермических условиях это Qv= ΔU, а в изобарно-изотермических условиях протекания реакции это Qp = ΔH.
Теплота равная термодинамическим функциям состояния сама является термодинамической функцией состояния и, следовательно, не зависит от пути процесса, а зависит только от начального и конечного состояния системы. Этот закон был установлен в 1841 г. русским акад. Г.И. Гессом.
Он лежит в основе термохимии и распространяется на все процессы, сопровождающиеся тепловыми эффектами — фазовые превращения, растворение, испарение, кристаллизация и т.д.
Поскольку в большинстве случаев химические реакции протекают при постоянном давлении, то в дальнейшем будем рассматривать изобарические условия и тепловой эффект будет являться энтальпией реакции Н. Если исходные вещества и продукты реакции находятся в стандартном состоянии, то тепловой эффект реакции называется стандартной энтальпией реакции Н0.
Стандартное состояние веществ не зависит от температуры. Если в ходе реакции теплота выделяется, т.е. энтальпия системы понижается (ΔН < 0), то реакция называется экзотермической. Реакция, протекающая с поглощением теплоты, т.е. с повышением энтальпии системы (ΔН > 0), называется эндотермической.
Тепловой эффект реакции относительно мало зависит от температуры реакции и давления, поэтому в расчетах можно использовать стандартные значения энтальпий реакций (Н0) .
Термохимия оперирует термохимическими уравнениями. В них указывают тепловой эффект, агрегатные состояния веществ и допускаются дробные коэффициенты.
С термохимическими уравнениями можно оперировать, как и с алгебраическими уравнениями.
Термохимические расчеты
Закон Гесса:
Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции.
Закон лежит в основе термохимических расчетов. Рассмотрим реакцию сгорания метана:

Эту же реакцию можно провести через стадию образования СО:
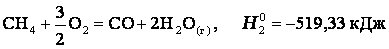

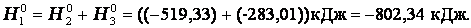
Итак, видно, тепловой эффект реакции, протекающей по двум путям, одинаков.
При термохимических расчетах для определения тепловых эффектов применяют следствия из закона Гесса.
Следствия закона Гесса:
1 следствие
Тепловой эффект химической реакции равен разности между суммами теплот (энтальпий) образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов в уравнении.
Тепловой эффект реакции:
bB + dD =lL + mM
рассчитывается по уравнению
ΔН1 = lΔfHL + mΔfHM – dΔfHD — bΔfHB
Для термохимических расчетов используют стандартные энтальпии образования веществ ΔfH0 – это изменение энтальпии в процессе образования 1 моля соединения в стандартном состоянии из простых веществ, тоже находящихся в стандартном состоянии в устойчивых формах и модификациях.
Стандартные энтальпии образования простых веществ, устойчивых в стандартных условиях, условно принимаются равными нулю.
Стандартные энтальпии образования веществ приведены в справочниках термодинамических величин и известны примерно для 8000 тысяч веществ, что позволяет расчетным путем установить тепловой эффект любого процесса.
2 следствие
Важно для реакций, протекающих с участием органических веществ.
Тепловой эффект реакции равен разности между суммами теплот (энтальпий) сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции.
Теплота (энтальпия) сгорания – это тепловой эффект сгорания 1 моль органического вещества до СО2 и Н2О. Остальные продукты определяются конкретно для каждого случая.
Термохимические уравнения.
Теплота, высвобождаемая или поглощаемая конкретной химической реакцией, пропорциональна степени превращения реагентов, определяемой по количеству любого из расходуемых либо образующихся продуктов. Изменение внутренней энергии или энтальпии реагирующей системы определяют по химическому уравнению реакции. Например, сгорание смеси газообразных метана и кислорода описывается термохимическим уравнением
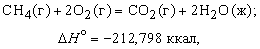
Здесь буквы в скобках обозначают агрегатные состояния веществ (газ или жидкость). Символом DH° обозначается изменение энтальпии в химическом превращении при стандартных давлении 1 атм и температуре 298 K (25° С) (знак градуса в верхнем индексе H указывает, что данная величина относится к веществам в стандартных состояниях (при p = 1 атм и T = 298 K)). Химическая формула каждого вещества в таком уравнении обозначает вполне определенное количество вещества, а именно его молекулярную массу, выраженную в граммах. Молекулярная масса получается сложением атомных масс всех элементов, входящих в формулу, с коэффициентами, равными числу атомов данного элемента в молекуле. Молекулярная масса метана равна 16,042, и, согласно предыдущему уравнению, при сгорании 16,042 г (1 моля) метана получаются продукты, энтальпия которых на 212,798 ккал меньше энтальпии реагентов. В соответствии с уравнением (5) такое количество теплоты высвобождается, когда 1 моль метана сгорает в кислороде при постоянном давлении 1 атм. Соответствующее уменьшение внутренней энергии системы в ходе реакции составляет 211,615 ккал. Разница междуDH° и DU° равна -1,183 ккал и представляет работу p (V2 — V1), совершаемую, когда 3 моля газообразных реагентов сжимаются при давлении 1 атм до 1 моля газообразного диоксида углерода и 2 молей жидкой воды.
studfile.net
приведите три примера термохимических реакций
Вспомним, что химическими реакциями мы называем любые химические явления природы. При химической реакции происходит разрыв одних и образование других химических связей. В результате реакции из одних химических веществ получаются другие вещества 1.Примеры реакций соединения: C + O2 = CO2; (1) Na2O + CO2 = Na2CO3; (2) Nh4 + CO2 + h3O = Nh5HCO3. (3) 2.Примеры реакций разложения: 2Ag2O 4Ag + O2 ; (4) CaCO3 CaO + CO2 ; (5) (Nh5)2Cr2O7 N2 + Cr2O3 + 4h3O . (6) 3.Примеры реакций замещения: CuSO4 + Fe = FeSO4 + Cu ; (7) 2NaI + Cl2 = 2NaCl + I2; (8) CaCO3 + SiO2 = CaSiO3 + CO2 . (9) 4.Примеры реакций обмена: Ba(OH)2 + h3SO4 = BaSO4 + 2h3O; (10) HCl + KNO2 = KCl + HNO2; (11) AgNO3 + NaCl = AgCl + NaNO3. (12) Традиционная классификация химических реакций не охватывает все их разнообразие – кроме реакций четырех основных типов существует еще и множество более сложных реакций. Выделение двух других типов химических реакций основано на участии в них двух важнейших нехимических частиц: электрона и протона. При протекании некоторых реакций происходит полная или частичная передача электронов от одних атомов к другим. При этом степени окисления атомов элементов, входящих в состав исходных веществ, изменяются; из приведенных примеров это реакции 1, 4, 6, 7 и 8. Эти реакции называются окислительно-восстановительными.
известь не гашеная + вода, сода+кислота, глицерин+марганец,
1. Горение углерода С+О2=СО2+402,24 Дж 2. Разложение оксида ртути 2HgO=2Hg+O2+180 кДж 3. Образование сульфида железа Fe+S=FeS+97.2 кДж То что приводили выше то обычные реакции. За это 2 получишь
touch.otvet.mail.ru