Типы кристаллических решеток и свойства веществ
По характеру структуры кристаллические решетки всех веществ относят к одному из четырех основных типов:
а) молекулярная решетка,
б) атомная,
в) ионная,
г) металлическая.
В основу этой классификации положен род структурных частиц (молекулы-атомы-ионы), находящихся в узлах кристаллической решетки.
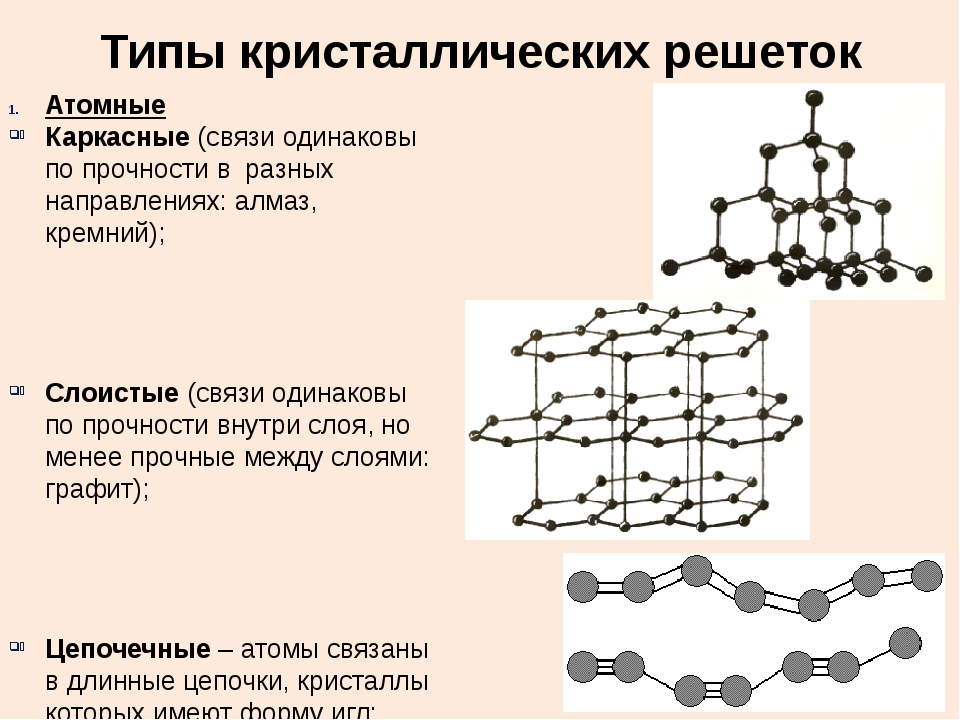
Молекулярная решеткаВ узлах молекулярной решетки находятся полярные или неполярные молекулы, связанные между собой слабыми силами межмолекулярного взаимодействия (силами Ван-дер-Ваальса). Молекулы в кристалле способны совершать незначительные колебания различного характера. Вещества с молекулярным типом решетки, например, органические вещества, кристаллы инертных газов и большинства неметаллов, сухой лед (СО2 тверд.) обладают малой твердостью, низкими температурами плавления и кипения. Эти характеристики объясняются тем, что при приложении незначительной энергии межмолекулярные связи разрываются и кристалл разрушается с образованием отдельных молекул, что и наблюдается при плавлении и при испарении кристаллов.
В узлах атомной кристаллической решетки находятся атомы. Роль сил межмолекулярного взаимодействия здесь играют достаточно прочные ковалентные связи. Выделить из общей массы атомов один невозможно. Вещества с атомным типом кристаллической решетки (алмаз, бор, кремний, карборунд SiC, нитрид алюминия и другие) характеризуются очень большой твердостью, иногда сочетающейся с хрупкостью, нерастворимостью в обычных растворителях, очень высокими температурами плавления и кипения. Все связи в кристалле равноценны. При разрыве этих связей, достигаемом лишь при высокой температуре, кристалл диссоциирует на отдельные атомы: плавление, кипение и термическая диссоциация практически совпадают.
Ионная (координационная) решеткаВ узлах ионной кристаллической решетки находятся чередующиеся положительные и отрицательные ионы, связанные между собой силами кулоновского взаимодействия..jpg) Особенностью этих сил является их ненасыщаемость. Это приводит к тому, что отдельный ион координирует вокруг себя несколько ионов противоположного заряда. Ионы в кристаллах совершают упорядоченные колебания. Энергия связей между противоположно заряженными ионами очень велика, и такие кристаллы, казалось бы, должны обладать наиболее высокой твердостью и высокими температурами плавления и кипения. На самом деле эти свойства у них ниже, чем у кристаллов с атомной структурой. Причина заключается в том, что наряду с силами притяжения в кристалле действуют силы отталкивания между одноименно заряженными ионами, причем соотношение этих сил приводит к определенному равновесному состоянию. Вещества с ионной решеткой растворимы в той или иной степени в полярных растворителях.
Особенностью этих сил является их ненасыщаемость. Это приводит к тому, что отдельный ион координирует вокруг себя несколько ионов противоположного заряда. Ионы в кристаллах совершают упорядоченные колебания. Энергия связей между противоположно заряженными ионами очень велика, и такие кристаллы, казалось бы, должны обладать наиболее высокой твердостью и высокими температурами плавления и кипения. На самом деле эти свойства у них ниже, чем у кристаллов с атомной структурой. Причина заключается в том, что наряду с силами притяжения в кристалле действуют силы отталкивания между одноименно заряженными ионами, причем соотношение этих сил приводит к определенному равновесному состоянию. Вещества с ионной решеткой растворимы в той или иной степени в полярных растворителях.
В узлах металлической решетки находятся положительно заряженные ионы металлов, окруженные электронами. Эти электроны, связанные отчасти с ионами силами электростатического взаимодействия, являются «полусвободными», иначе говоря «не прикреплены» к отдельным ионам, а более или менее свободно перемещаются между ними. Этот «электронный газ» обусловливает типичные для металлов свойства: тепло- и электропроводность, серовато-серебристый (у большинства металлов) цвет, металлический блеск (отражательную способность), способность отражать радиоволны, пластичность, ковкость и в то же время достаточную прочность (результат обволакивания ионов «электронным газом»). Подходя к катиону металла, электроны образуют с ним на мгновение электронейтральную частицу, которая быстро разрушается и через мгновение такой же непрочный «атом» образуется с этим или другим электроном и другим ионом металла. Между «атомами» возникают мгновенные ковалентные связи. Это и приводит к возникновению особой металлической связи, промежуточной по характеру между ионной и ковалентной, качественно отличающейся от той и другой и наблюдаемой лишь в куске металла. Энергия электронов в металле недостаточна, чтобы они могли «оторваться» от катионов металла и самопроизвольно покинуть металлическую решетку. Но при подведении энергии извне выход электронов наблюдается: фотоэлектрический эффект, термоэлектронная эмиссия.
Этот «электронный газ» обусловливает типичные для металлов свойства: тепло- и электропроводность, серовато-серебристый (у большинства металлов) цвет, металлический блеск (отражательную способность), способность отражать радиоволны, пластичность, ковкость и в то же время достаточную прочность (результат обволакивания ионов «электронным газом»). Подходя к катиону металла, электроны образуют с ним на мгновение электронейтральную частицу, которая быстро разрушается и через мгновение такой же непрочный «атом» образуется с этим или другим электроном и другим ионом металла. Между «атомами» возникают мгновенные ковалентные связи. Это и приводит к возникновению особой металлической связи, промежуточной по характеру между ионной и ковалентной, качественно отличающейся от той и другой и наблюдаемой лишь в куске металла. Энергия электронов в металле недостаточна, чтобы они могли «оторваться» от катионов металла и самопроизвольно покинуть металлическую решетку. Но при подведении энергии извне выход электронов наблюдается: фотоэлектрический эффект, термоэлектронная эмиссия.
а) все атомы алюминия отдали по два электрона в «электронный газ»;
б) все атомы отдали по три электрона, но в среднем одна треть образовавшихся ионов Al+3 снова образует «атомы», поэтому средний заряд всех структурных частиц +2.
Таким образом, металлическое состояние в упрощенном представлении подобно атомарному ввиду его суммарной электронейтральности; это сосуществование и взаимосвязь «атомов»-ионов-электронов.
Типы кристаллических решеток и свойства веществ№ | Тип кристаллической решетки | Структурные частицы кристалла | Характер связи между структурными частицами кристалла | Характер связи в молекулах | Примеры кристаллических веществ | Характерные свойства |
1. | Молекулярная | Полярные молекулы – диполи | 1. Электростатическое взаимодействие диполей. | Ковалентные полярные | HF, H2O, HCl, H2S, PCl3, NH3 (твердые) | Межмолекулярное взаимодействие средней силы. |
| Неполярные молекулы | Силы Ван-дер-Ваальса (слабые) | Ковалентные неполярные и ковалентные полярные | H2, Cl2, O2, N2, F2, СО2, SO3 (образованы молекулами симметричного строения) | Межмолекулярное взаимодействие слабое. Растворимы в неполярных растворителях, очень малая термическая устойчивость, очень слабая электропроводность, легкая летучесть (очень низкие температуры плавления и кипения), очень слабые механические свойства. | ||
2. | Атомная | Атомы | Ковалентные связи | — | C, Si, SiC, AlN, ВеО (образованы элементами, среднее арифметическое номеров групп которых равно 4) | Нерастворимы в обычных растворителях, термически устойчивы, неэлектропроводны, температуры плавления и кипения очень высокие; твердые, но хрупкие, прочность связей между частицами очень высокая. |
3. | Ионная | Ионы: катионы, анионы | 1. Электростатическое взаимодействие. | — | CsF, KCl, CaF2, CsH, NaF, ВаCl2 | Растворимы в полярных растворителях, термическая устойчивость высокая, большая электропроводность в растворах и расплавах, высокие температуры плавления; вещества твердые, но хрупкие, прочность связей между частицами высокая. |
4. | Металлическая | Катионы, «атомы», электроны | 1. Электростатическое притяжение ионов и электронов. | — | Na, K, Cu, Zn, Fe, Pt, Pb | Растворимы в расплавленных металлах, термическая устойчивость различная, электропроводность высокая, температуры плавления и кипения лежат в широких пределах; вещества пластичные, твердость, как и прочность связей между частицами, различная. |
Типы кристаллических решёток
Для определения типа кристаллической решётки поступают следующим образом. Если связь в соединении ионная, то кристаллическая решётка всегда ионного типа: хлорид калия, нитрат калия, нитрид кальция, карбид кальция, оксид алюминия.
Если связь металлическая, то и кристаллическая решётка всегда металлическая: латунь, железо, медь, натрий.
Если связь ковалентная, то решётка может быть, как атомной, так и молекулярной. Веществами с атомной кристаллической решёткой являются: карборунд, оксид кремния четыре, бор, кремний, алмаз, графит, чёрный и красный фосфор.
У веществ с молекулярной кристаллической решёткой в узлах кристаллической решётки расположены молекулы, прочность данной связи слабая.
Для веществ с молекулярной
кристаллической решёткой характерны низкие температуры плавления,
то есть они легкоплавки и летучи, значительная сжимаемость, иногда запах, а
также явление сублимации, или возгонки, как для йода и твёрдого углекислого
газа.
Для веществ с молекулярной кристаллической решёткой характерна небольшая твёрдость, большинство этих веществ хорошо растворимы в воде. Молекулярную кристаллическую решётку имеют газы и жидкости в твёрдом агрегатном состоянии. Например, кристаллический йод, сера, белый фосфор, углекислый газ, большинство органических соединений.
У веществ с атомной кристаллической решёткой в узлах расположены атомы. Связь между атомами в кристаллические решётки – ковалентная, очень прочная. Для этих веществ характерны высокие температуры кипения и плавления, то есть они тугоплавки и нелетучий, очень твёрдые, практически не растворимы в воде и не имеют запаха.
Примером веществ с таким типом кристаллических решёток являются алмаз и графит.
Как известно,
твёрдость алмаза оценивается по шкале Мооса самым высоким значением –
10. Благодаря высокой твёрдости алмаз используют для изготовления буров, свёрл,
шлифовальных инструментов, стеклорезов. Алмаз является камнем ювелиров, они
используют отшлифованные алмазы – бриллианты.
Алмаз является камнем ювелиров, они
используют отшлифованные алмазы – бриллианты.
Графит также является веществом с атомной кристаллической решёткой, но несмотря на это, он мягкий, так как имеет слоистую структуру. В кристаллической решётке графита атомы углерода, лежащие в одной плоскости, связаны в правильные шестиугольники. Связи между слоями непрочные, за счёт этого графит мягкий. Графит, как и алмаз, тугоплавкий. Из него изготавливают электроды, твёрдые смазки, стержни для карандашей, замедлители нейтронов в ядерных реакторах.
Атомные кристаллические решётки имеют не только простые, но и сложные вещества. Например, все разновидности оксида алюминия. Такие, как наждак, корунд, рубин, сапфир.
Наиболее распространённое соединение кремния – это оксид кремния четыре, который также имеет атомную кристаллическую решётку. Почти чистым оксидом кремния четыре является минерал кварц.
У веществ с ионным
типом связи в узлах кристаллической решётки расположены ионы, связь между
частицами – ионная, она прочная.
Для веществ с ионным типом связи характерны следующие свойства: высокие температуры плавления и кипения, они тугоплавки и нелетучи, они твёрдые, хрупкие, многие растворимы в воде. Их хрупкость объясняется тем, что если попробовать деформировать такую кристаллическую решётку, то один из её слоёв будет двигаться относительно другого слоя до тех пор, пока одинаково заряженные ионы не будут друг против друга. Эти ионы начнут отталкиваться друг от друга, и кристаллическая решётка разрушиться.
Вещества с ионным типом связи плохо проводят электрический ток и тепло. Но их растворы и расплавы проводят электрический ток. Вещества с ионным типом связи не имеют запаха.
Ионное соединение представляет собой гигантскую ассоциацию ионов, расположенных в пространстве благодаря равновесию сил притяжения и отталкивания.
Например, кристалл
хлорида натрия состоит из катионов натрия и анионов хлора. Каждый катион натрия
окружён шестью анионами хлора, а каждый анион хлора – шестью катионами натрия. Наименьшей структурной единицей кристалла является элементарная ячейка.
Строение элементарной ячейки зависит от соотношения размеров катиона и аниона.
Наименьшей структурной единицей кристалла является элементарная ячейка.
Строение элементарной ячейки зависит от соотношения размеров катиона и аниона.
У веществ с металлическим типом связи в узлах кристаллической решётки расположены атом-ионы, связь между ними металлическая. Связь может быть различной по прочности.
Металлическая кристаллическая решётка определяет свойства металлов: ковкость, пластичность, электро-и теплопроводность, металлический блеск, способность образовывать сплавы.
Пластичность выражается в способности металлов деформироваться под действием механической нагрузки. Это свойство лежит в основе ковки, прокатки металлов, их способности вытягиваться в проволоку. Пластичность объясняется тем, что под воздействием силы слои перемещаются относительно друг друга без разрыва связи между ними.
Например, если
двумя плоскими стеклянными пластинками поместить несколько капель воды, то
пластинки будут свободно скользить относительно друг друга, но вот разъединить
их будет достаточно сложно. Таким образом, в данном опыте вода играла роль
свободных электронов, которые находятся в металлической кристаллической
решётке.
Таким образом, в данном опыте вода играла роль
свободных электронов, которые находятся в металлической кристаллической
решётке.
Наиболее пластичными металлами являются золото, серебро и медь. Именно из золота можно сделать самую тонкую фольгу толщиной три тысячных миллиметра. Такую тонкую фольгу использую для золочения. Примером может служить Янтарная комната в Большом Екатерининском дворце.
Высокая электропроводность металлов обусловлена наличием свободных электронов, которые под действием электрического тока приобретают направленное движение.
Лучшими проводниками электрического ока являются серебро и медь, немного худшим – алюминий. Однако в большинстве случаев в качестве электропроводов используют алюминий, а не медь.
Теплопроводность
металлов также объясняется движением свободных электронов, которые
сталкиваются с атом-ионами в узлах кристаллической решётки и обмениваются с
ними энергией. Благодаря этому свойству металлическая посуда равномерно
нагревается.
Вещества с металлическим типом кристаллической решётки имеют металлический блеск из-за отражения световых лучей.
Высокой светоотражающей способностью обладают ртуть, серебро, палладий и алюминий. Из серебра, палладия и алюминия изготавливают зеркала, прожектора и фары. В порошкообразном состоянии металлы теряют свой блеск, только магний и алюминий сохраняют его.
Большинство металлов имеет серебристо-белый цвет. Только золото окрашено в жёлтый цвет, а медь в красный.
Металлическая кристаллическая решётка характерна не только для металлов, но и для сплавов. Это отличает металлические сплавы от других сплавов: стекла, фарфора, керамики, базальтов, гранитов, гнейсов.
Типы кристаллических решеток — ХИМИЧЕСКАЯ СВЯЗЬ
Часть И. ОБЩАЯ ХИМИЯ
Раздел 3. ХИМИЧЕСКИЙ СВЯЗЬ
§ 3.7. Типы кристаллических решеток
Твердые вещества, как правило, имеют
кристаллическое строение.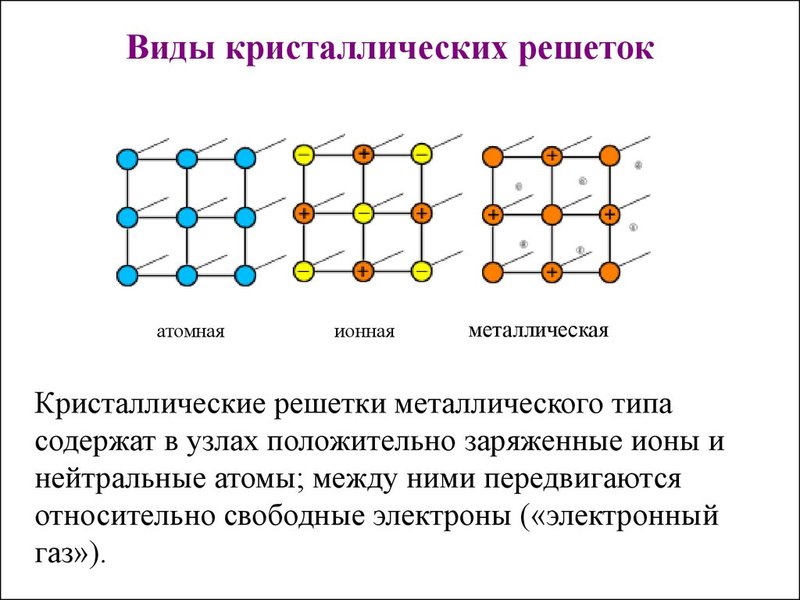 Она характеризуется правильным расположением частиц в
четко определенных точках пространства. При мысленном соединении этих точек прямыми
линиями, которые пересекаются, образуется пространственный каркас, который называют
кристаллической решеткой. Точки, в которых размещены частицы, называются узлами
кристаллической решетки. В узлах воображаемой решетки Могут находиться ионы, атомы
или молекулы. Они совершают колебательное движение. С повышением температуры
амплитуда колебаний увеличивается, что проявляется в тепловом расширении тел.
Она характеризуется правильным расположением частиц в
четко определенных точках пространства. При мысленном соединении этих точек прямыми
линиями, которые пересекаются, образуется пространственный каркас, который называют
кристаллической решеткой. Точки, в которых размещены частицы, называются узлами
кристаллической решетки. В узлах воображаемой решетки Могут находиться ионы, атомы
или молекулы. Они совершают колебательное движение. С повышением температуры
амплитуда колебаний увеличивается, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Кристаллические решетки, состоящие
из ионов, называются іонними. их образуют вещества с ионными связями.
Примером может быть кристалл хлорида натрия, в котором, как уже отмечалось, каждый
ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион — шестью ионами
натрия.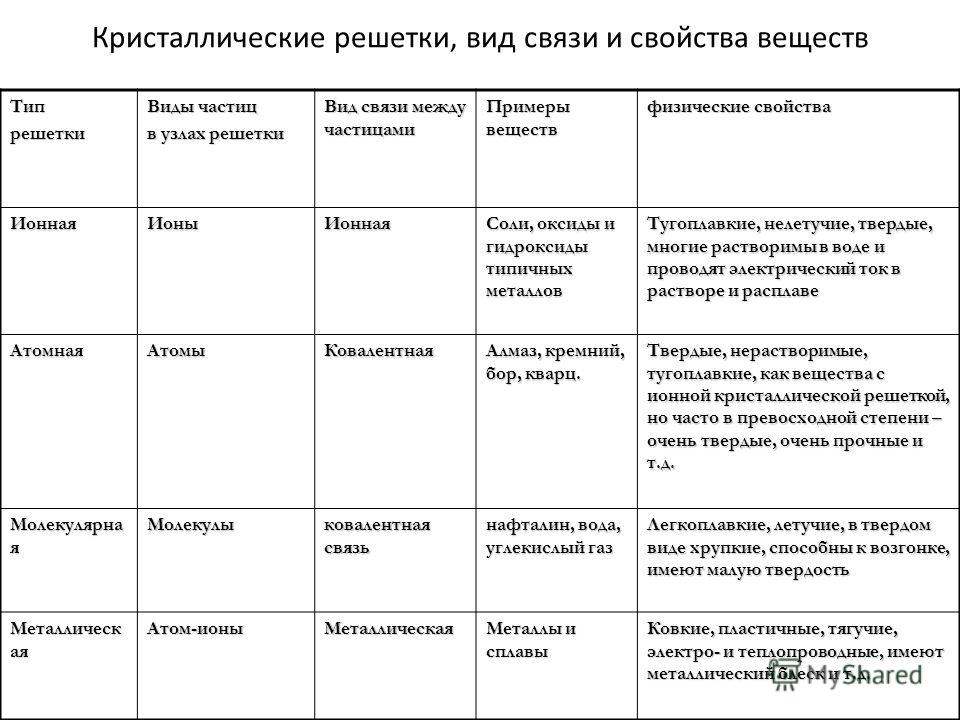 Такому размещению отвечает самая плотная упаковка, если ионы представить в
виде шаров, размещенных в кристалле (рис. 3.15). Очень часто кристаллические решетки
изображают так, как показано на рис. 3.16, где указано лишь взаимное размещение
частиц, но не их размеры.
Такому размещению отвечает самая плотная упаковка, если ионы представить в
виде шаров, размещенных в кристалле (рис. 3.15). Очень часто кристаллические решетки
изображают так, как показано на рис. 3.16, где указано лишь взаимное размещение
частиц, но не их размеры.
Число ближайших соседних частиц, плотно присоединяются к данной частицы в кристалле или в отдельной молекуле, называется координационным числом.
В решетке хлорида натрия координационные числа обоих ионов равны 6. Следовательно, в кристалле хлорида натрия невозможно выделить отдельные молекулы соли. их нет. Весь кристалл следует рассматривать как гігантськумакромолекулу, состоящая из одинакового числа ионов Na+ и Сl— , NanCln, где n — большое число (см. рис. 3.15). Связи между ионами в таком кристалле достаточно прочные. Поэтому вещества с ионной решеткой имеют сравнительно высокую твердость. Они тугоплавкие и малолеткі.
Плавления ионных кристаллов вызывает
в нарушение геометрически правильной ориентации ионов относительно друг друга и
уменьшение прочности связи между ними. Поэтому их расплавы проводят электрический
ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих
из полярных молекул, например в воде.
Поэтому их расплавы проводят электрический
ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих
из полярных молекул, например в воде.
Рис. 3.15. Пространственное размещение ионов в ионной решетке NaCl (мелкие шарики — ионы натрия)
Рис. 3.16. Кристаллическая решетка NaCl
Кристаллические решетки,в узлах которых
размещаются отдельные атомы, называются атомными. Атомы в таких решетках
соединенные между собой прочными ковалентними связями. Примером может служить алмаз —
одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых
связан с четырьмя соседними атомами. Координационное число углерода в алмазе —
4. Структура алмаза представлена на рис. 11.1. В решетке алмаза, как и в решетке
хлорида натрия, молекул нет. Весь кристалл следует рассматривать как гигантскую
молекулу. В неорганической химии известная значительное количество веществ с атомной
кристаллической решеткой. Они имеют высокие температуры плавления (для алмаза
свыше 500°С), крепкие и твердые, практически не растворимые в жидкостях. Атомная
кристаллическая решетка характерна для твердого бора, кремния, германия и соединений
некоторых элементов с карбоном и силіцієм. Кристаллические решетки,
состоящие из молекул (полярных и неполярных), называются молекулярными.
Молекулы в таких решетках соединены между собой сравнительно слабыми
межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую
твердость, низкие температуры плавления, нерастворимые или малорастворимые в воде,
их растворы почти не проводят электрического тока. Число неорганических веществ с
молекулярной решеткой незначительное. Примерами их являются лед, твердый оксид углерода(ИV) (“сухой лед”), твердые
галогеноводні, твердые простые вещества, образованные одно- (благородные газы), двух-
(F2, Сl2, r2, l2, Н2, О2, N2), трех- (О3), четырех-
(Г4), восьми- (S8)
атомными молекулами.
Они имеют высокие температуры плавления (для алмаза
свыше 500°С), крепкие и твердые, практически не растворимые в жидкостях. Атомная
кристаллическая решетка характерна для твердого бора, кремния, германия и соединений
некоторых элементов с карбоном и силіцієм. Кристаллические решетки,
состоящие из молекул (полярных и неполярных), называются молекулярными.
Молекулы в таких решетках соединены между собой сравнительно слабыми
межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую
твердость, низкие температуры плавления, нерастворимые или малорастворимые в воде,
их растворы почти не проводят электрического тока. Число неорганических веществ с
молекулярной решеткой незначительное. Примерами их являются лед, твердый оксид углерода(ИV) (“сухой лед”), твердые
галогеноводні, твердые простые вещества, образованные одно- (благородные газы), двух-
(F2, Сl2, r2, l2, Н2, О2, N2), трех- (О3), четырех-
(Г4), восьми- (S8)
атомными молекулами. Молекулярная кристаллическая решетка йода представлена на рис. 3.17.
Большинство кристаллических органических соединений имеют молекулярную решетку.
Молекулярная кристаллическая решетка йода представлена на рис. 3.17.
Большинство кристаллических органических соединений имеют молекулярную решетку.
Рис. 3.17. Кристаллическая решетка йода
Рис. 3.18. Схематическое изображение металлической решетки
В твердом состоянии металлы образуют
металлические кристаллические решетки. Последние обычно описывают как сочетание катионов
металла, соединенных в одно целое валентными электронами, то есть негативно
заряженным “электронным газом”. Электроны электростатически притягиваются катионами,
что обеспечивает стабильность решетки. На рис. 3.18 представлено схематическое изображение
металлической решетки. На рис. 3.18 представлено схематическое изображение металлической
решетки (свободные электроны изображены точками). Сравните ее с другими типами
кристаллических решеток.
Кристаллические решетки
Как мы уже знаем, вещество может существовать в трех агрегатных состояниях: газообразном, твердом и жидком. Кислород, который при обычных условиях находится в газообразном состоянии, при температуре -194° С преобразуется в жидкость голубоватого цвета, а при температуре -218,8° С превращается в снегообразную массу с кристаллами синего цвета.
Температурный интервал существования вещества в твердом состоянии определяется температурами кипения и плавления. Твердые вещества бывают кристаллическими и аморфными.
У аморфных веществ нет фиксированной температуры плавления – при нагревании они постепенно размягчаются и переходят в текучее состояние. В таком состоянии, например, находятся различные смолы, пластилин.
Кристаллические вещества отличаются закономерным расположением частиц, из которых они состоят: атомов, молекул и ионов, – в строго определенных точках пространства.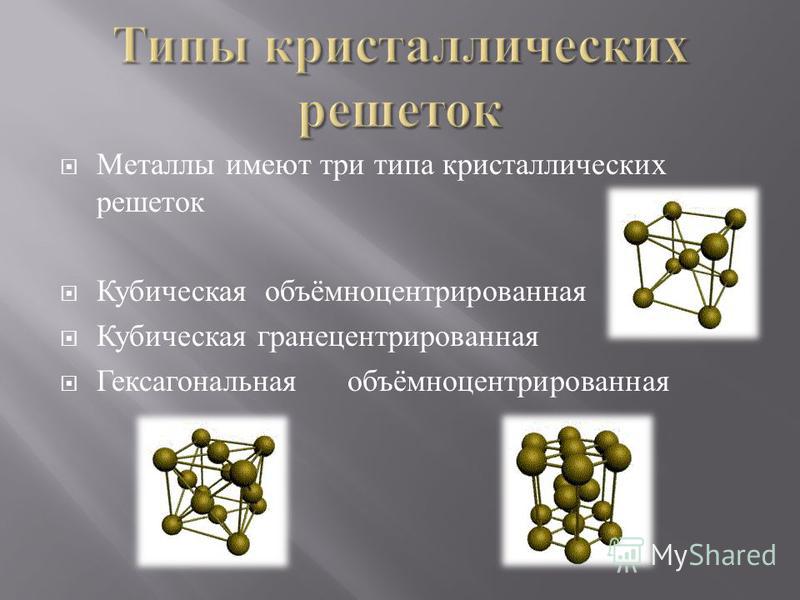 Когда эти точки соединяются прямыми линиями, создается пространственный каркас, его называют кристаллической решеткой. Точки, в которых находятся частицы кристалла, называют узлами решетки.
Когда эти точки соединяются прямыми линиями, создается пространственный каркас, его называют кристаллической решеткой. Точки, в которых находятся частицы кристалла, называют узлами решетки.
В узлах воображаемой нами решетки могут находиться ионы, атомы и молекулы. Эти частицы совершают колебательные движения. Когда температура увеличивается, размах этих колебаний тоже возрастает, что приводит к тепловому расширению тел.
В зависимости от разновидности частиц, находящихся в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионными называют такие кристаллические решетки, в узлах которых расположены ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl- , так и сложные SO24-, OH-. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксилы металлов, т. е. те вещества, в которых существует ионная химическая связь. Рассмотрим кристалл хлорида натрия, он состоит из положительно чередующихся ионов Na+ и отрицательных CL-, вместе они образуют решетку в виде куба. Связи между ионами в таком кристалле чрезвычайно устойчивы. Из-за этого вещества с ионной решеткой обладают сравнительно высокой прочностью и твердостью, они тугоплавки и нелетучи.
е. те вещества, в которых существует ионная химическая связь. Рассмотрим кристалл хлорида натрия, он состоит из положительно чередующихся ионов Na+ и отрицательных CL-, вместе они образуют решетку в виде куба. Связи между ионами в таком кристалле чрезвычайно устойчивы. Из-за этого вещества с ионной решеткой обладают сравнительно высокой прочностью и твердостью, они тугоплавки и нелетучи.
Атомными кристаллическими решетками называют такие кристаллические решетки, в узлах которых находятся отдельные атомы. В подобных решетках атомы соединяются между собой очень крепкими ковалентными связями. К примеру, алмаз – одно из аллотропных видоизменений углерода.
Вещества с атомной кристаллической решеткой не сильно распространены в природе. К ним относятся кристаллический бор, кремний и германий, а также сложные вещества, например такие, в составе которых есть оксид кремния (IV) – SiO2: кремнезем, кварц, песок, горный хрусталь.
Подавляющее большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (у алмаза она превышает 3500° С), такие вещества прочны и тверды, практически не растворимы.
Молекулярными называют такие кристаллические решетки, в узлах которых расположены молекулы. Химические связи в этих молекулах могут быть также, как полярными (HCl, H20), так и неполярными (N2, O3). И хотя атомы внутри молекукл связаны очень крепкими ковалентными связями, между самими молекулами действует слабые силы межмолекулярного притяжения. Именно поэтому вещества с молекулярными кристаллическими решетками характеризуются малой твердостью, низкой температурой плавления, летучестью.
Примерами таких веществ могут послужить твердая вода – лед, твердый оксид углерода (IV) – «сухой лед», твердые хлороводород и сероводород, твердые простые вещества, образованные одно – (благородные газы), двух – (H2, O2, CL2, N2, I2), трех – (O3), четырех – (P4), восьмиатомными (S8) молекулами. Подавляющее большинство твердых органических соединений обладают молекулярными кристаллическими решетками (нафталин, глюкоза, сахар).
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Конспект урока «Типы кристаллических решеток». (11 класс, химия)
Урок химии в 11 классе. «_____» ______________ 20 ___ г.
Типы кристаллических решеток.
Цель. Расширить знания о типах кристаллических решеток.
Задачи:
Образовательная: сформировать понятия о кристаллическом состоянии твердых тел,
ознакомить учащихся с различными типами кристаллических решеток, установить
зависимость физических свойств кристалла от характера химической связи в кристалле и
типа кристаллической решетки, дать учащимся основные представления о влиянии
природы химической связи и типов кристаллических решеток на свойства вещества.
Воспитательная: воспитывать умения организовать свой учебный труд, соблюдать
правила работы в коллективе. Развивающая: развивать познавательный интерес школьников, используя проблемные
ситуации; совершенствовать умения учащихся устанавливать причинноследственную
зависимость физических свойств веществ от химической связи и типа кристаллической
решетки, предсказывать тип кристаллической решетки на основе физических свойств
вещества.
Ход урока.
1. Орг. момент.
2. Повторение изученного материала.
Определите вид химической связи в следующих соединениях:
h3, HI, KCl, h3O, Ca, HF, h3S, Na2O, Ba, O2, K2O, S, C, MgO, Nh4, BaS, Al, MgCl2,
Ph4, N2.
3. Изучение новой темы.
Вещества находятся в различных агрегатных состояниях. Приведите примеры веществ,
которые при различных температурах могут существовать во всех трех агрегатных
состояниях.
Ответ: Вода. При обычных условиях вода находится в жидком состоянии, при понижении
температуры ниже 00С вода переходит в твердое состояние лед, а при повышении
температуры до 1000С мы получим водяной пар (газообразное состояние).
Любое вещество можно получить в твердом, жидком и газообразном виде.
Развивающая: развивать познавательный интерес школьников, используя проблемные
ситуации; совершенствовать умения учащихся устанавливать причинноследственную
зависимость физических свойств веществ от химической связи и типа кристаллической
решетки, предсказывать тип кристаллической решетки на основе физических свойств
вещества.
Ход урока.
1. Орг. момент.
2. Повторение изученного материала.
Определите вид химической связи в следующих соединениях:
h3, HI, KCl, h3O, Ca, HF, h3S, Na2O, Ba, O2, K2O, S, C, MgO, Nh4, BaS, Al, MgCl2,
Ph4, N2.
3. Изучение новой темы.
Вещества находятся в различных агрегатных состояниях. Приведите примеры веществ,
которые при различных температурах могут существовать во всех трех агрегатных
состояниях.
Ответ: Вода. При обычных условиях вода находится в жидком состоянии, при понижении
температуры ниже 00С вода переходит в твердое состояние лед, а при повышении
температуры до 1000С мы получим водяной пар (газообразное состояние).
Любое вещество можно получить в твердом, жидком и газообразном виде. Кроме воды –
это металлы, которые при нормальных условиях находятся в твердом состоянии, при
нагревании начинают размягчаться, и при определенной температуре(tпл) переходят в
жидкое состояние плавятся. При дальнейшем нагревании, до температуры кипения,
металлы начинают испаряться, т.е. переходить в газообразное состояние. Любой газ можно
перевести в жидкое и твердое состояние, понижая температуру: например, кислород,
который при температуре (1940С) превращается в жидкость голубого цвета, а при
температуре (218,80С) затвердевает в снегообразную массу, состоящую из кристаллов
синего цвета. Сегодня на уроке мы будем рассматривать твердое состояние вещества.
Кристаллические вещества имеют строго определенную температуру плавления и, главное,
характеризуются правильным расположением частиц, из которых они построены.
Кристаллическая решетка – пространственный каркас вещества Свойства веществ в твердом состоянии зависят от типа кристаллической решетки (прежде
всего от того, какие частицы находятся в ее узлах), что, в свою очередь, обусловлено
типом химической связи в данном веществе.
Кроме воды –
это металлы, которые при нормальных условиях находятся в твердом состоянии, при
нагревании начинают размягчаться, и при определенной температуре(tпл) переходят в
жидкое состояние плавятся. При дальнейшем нагревании, до температуры кипения,
металлы начинают испаряться, т.е. переходить в газообразное состояние. Любой газ можно
перевести в жидкое и твердое состояние, понижая температуру: например, кислород,
который при температуре (1940С) превращается в жидкость голубого цвета, а при
температуре (218,80С) затвердевает в снегообразную массу, состоящую из кристаллов
синего цвета. Сегодня на уроке мы будем рассматривать твердое состояние вещества.
Кристаллические вещества имеют строго определенную температуру плавления и, главное,
характеризуются правильным расположением частиц, из которых они построены.
Кристаллическая решетка – пространственный каркас вещества Свойства веществ в твердом состоянии зависят от типа кристаллической решетки (прежде
всего от того, какие частицы находятся в ее узлах), что, в свою очередь, обусловлено
типом химической связи в данном веществе.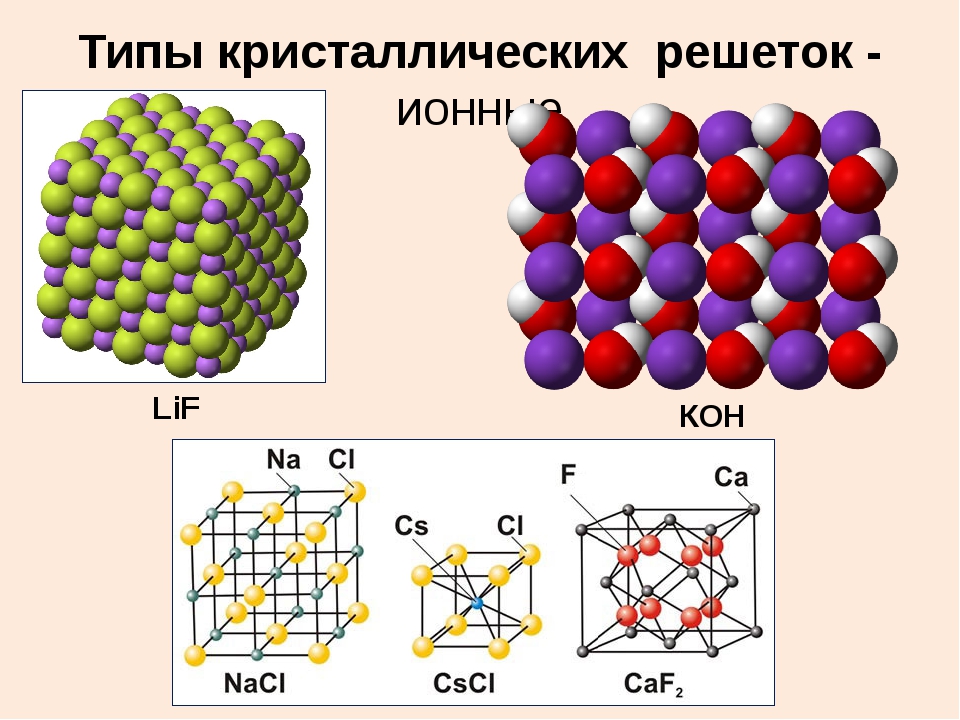 В зависимости от вида частиц и от характера связи между ними различают четыре типа
кристаллических решеток: ионные, молекулярные, атомные и металлические.
Кристаллические решетки.
Тип решетки
Вид химической
связи
Что в узлах
Физические
свойства
Схема строения.
примеры.
стр. 26, 33, 34, 38
Беседа по таблице.
1. Какие должны быть отличительные свойства веществ с молекулярной решеткой?
2. Каково их агрегатное состояние?
3. Приведите примеры веществ с молекулярной кристаллической решеткой?
4. Какие должны быть отличительные свойства веществ с ионной решеткой?
5. Каково их агрегатное состояние?
6. Приведите примеры веществ с ионной кристаллической решеткой?
7. Какие должны быть отличительные свойства веществ с атомной решеткой?
8. Каково их агрегатное состояние?
9. Приведите примеры веществ с атомной кристаллической решеткой?
10. Какие должны быть отличительные свойства веществ с металлической решеткой?
11. Каково их агрегатное состояние?
12. Приведите примеры веществ с металлической решеткой?
4.
В зависимости от вида частиц и от характера связи между ними различают четыре типа
кристаллических решеток: ионные, молекулярные, атомные и металлические.
Кристаллические решетки.
Тип решетки
Вид химической
связи
Что в узлах
Физические
свойства
Схема строения.
примеры.
стр. 26, 33, 34, 38
Беседа по таблице.
1. Какие должны быть отличительные свойства веществ с молекулярной решеткой?
2. Каково их агрегатное состояние?
3. Приведите примеры веществ с молекулярной кристаллической решеткой?
4. Какие должны быть отличительные свойства веществ с ионной решеткой?
5. Каково их агрегатное состояние?
6. Приведите примеры веществ с ионной кристаллической решеткой?
7. Какие должны быть отличительные свойства веществ с атомной решеткой?
8. Каково их агрегатное состояние?
9. Приведите примеры веществ с атомной кристаллической решеткой?
10. Какие должны быть отличительные свойства веществ с металлической решеткой?
11. Каково их агрегатное состояние?
12. Приведите примеры веществ с металлической решеткой?
4. Закрепление.
в) молекулы
г) атомионы
1. Вид частиц в ионной решетке:
а) ионы
б) атомы
2. Характер химической связи в атомной решетке:
а) металлическая
б) ковалентная
в) ионная
г) сила межмолекул. взаимодействия в) слабая
г) разной прочности
в) жидкое
в) атомной
г) ионной
3. Прочность связи в молекулярной решетке
а) очень прочная
б) прочная
4. Агрегатное состояние у веществ с ионной решеткой:
а) твердое
б) газообразное
5. Очень тугоплавкими являются вещества с решеткой:
а) металлической
б) молекулярной
6. Пластичностью обладают вещества с:
а) металлической
б) ионной
7. Кремний имеет решетку:
а) молекулярную
в) ионную
б) атомную б) металлическую
8. Щелочи имеют решетку:
а) молекулярную
б) металлическую
9. Вода имеет решетку:
а) молекулярную
в) ионную
б) атомную б) металлическую
в) молекулярной
г) атомной
в) ионную
5. Домашнее задание.
§3,4,5 упр.9 стр. 29
Закрепление.
в) молекулы
г) атомионы
1. Вид частиц в ионной решетке:
а) ионы
б) атомы
2. Характер химической связи в атомной решетке:
а) металлическая
б) ковалентная
в) ионная
г) сила межмолекул. взаимодействия в) слабая
г) разной прочности
в) жидкое
в) атомной
г) ионной
3. Прочность связи в молекулярной решетке
а) очень прочная
б) прочная
4. Агрегатное состояние у веществ с ионной решеткой:
а) твердое
б) газообразное
5. Очень тугоплавкими являются вещества с решеткой:
а) металлической
б) молекулярной
6. Пластичностью обладают вещества с:
а) металлической
б) ионной
7. Кремний имеет решетку:
а) молекулярную
в) ионную
б) атомную б) металлическую
8. Щелочи имеют решетку:
а) молекулярную
б) металлическую
9. Вода имеет решетку:
а) молекулярную
в) ионную
б) атомную б) металлическую
в) молекулярной
г) атомной
в) ионную
5. Домашнее задание.
§3,4,5 упр.9 стр. 29
Кристаллические решетки | himiyaklas.ru
Поговорим о твердых телах. Твердые тела можно разделить на две большие группы: аморфные и кристаллические. Разделять мы их будем по принципу есть порядок или нет.
Разделять мы их будем по принципу есть порядок или нет.
В аморфных веществах молекулы располагаются хаотично. В их пространственном расположении нет никаких закономерностей. По сути, аморфные вещества – это очень вязкие жидкости, настолько вязкие, что твердые.
Отсюда и название: «а-» – отрицательная частица, «morphe» – форма. К аморфным веществам относятся: стекла, смолы, воск, парафин, мыло.
Отсутствие порядка в расположении частиц обусловливает физические свойства аморфных тел: они не имеют фиксированных температур плавления. По мере нагревания их вязкость постепенно снижается, и они также постепенно переходят в жидкое состояние.
В противоположность аморфным веществам существуют кристаллические. Частицы кристаллического вещества пространственно упорядочены. Это правильная структура пространственного расположения частиц в кристаллическом веществе называется кристаллической решеткой.
В отличии от аморфных тел, кристаллические вещества имеют фиксированные температуры плавления.
В зависимости от того какие частицы находятся в узлах решетки, и от того какие связи удерживают их различают: молекулярную, атомную, ионную и металлическую решетки.
Для чего принципиально важно знать, какая у вещества кристаллическая решетка? Что она определяет? Все. Структура определяет, как химические и физические свойства вещества.
Самый простой пример: ДНК. У всех организмов на земле она построена из одинакового набора структурных компонентов: нуклеотидов четырех видов. А какое многообразие жизни. Это все определяется структурой: порядком, в котором эти нуклеотиды расположены.
Молекулярная кристаллическая решетка.Типичный пример вода – в твердом состоянии (лед). В узлах решетки находятся целые молекулы. И удерживают их вместе межмолекулярные взаимодействия: водородные связи, силы Ван-дер-Ваальса.
Связи эти слабые, поэтому молекулярная решетка – самая непрочная, температура плавления таких веществ низкая.
Хороший диагностический признак: если вещество имеет при нормальных условиях жидкое или газообразное состояние и/или имеет запах – то скорее всего у этого вещества молекулярная кристаллическая решетка. Ведь жидкое и газообразное состояния – это следствие того, что молекулы на поверхности кристалла плохо держатся (связи то слабые). И их «сдувает». Это свойство называется летучестью. А сдутые молекулы, диффундируя в воздухе доходят до наших органов обоняния, что субъективно ощущается как запах.
Молекулярную кристаллическую решетку имеют:
- Некоторые простые вещества неметаллов: I2, P, S (то есть все неметаллы, у которых не атомная решетка).
- Почти все органические вещества (кроме солей).
- И как уже говорилось ранее, вещества при нормальных условиях жидкие, либо газообразные (будучи замороженными) и/или имеющие запах (NH3, O2, H2O, кислоты, CO2).

В узлах атомной кристаллической решетки, в отличие от молекулярной, располагаются отдельные атомы. Получается, что удерживают решетку ковалентные связи (ведь именно они связывают нейтральные атомы).
Классический пример – эталон прочности твердости – алмаз (по химической природе – это простое вещество углерод). Связи: ковалентные неполярные, так как решетку образуют только атомы углерода.
А вот, например, в кристалле кварца (химическая формула которого SiO2) есть атомы Si и O. Поэтому связи ковалентные полярные.
Физические свойства веществ с атомной кристаллической решеткой:
- прочность, твердость
- высокие температуры плавления (тугоплавкость)
- нелетучие вещества
- нерастворимы (ни в воде, ни в других растворителях)
Все эти свойства обусловлены прочностью ковалентных связей.
Веществ в атомной кристаллической решеткой немного. Особой закономерности нет, поэтому их нужно просто запомнить:
- Аллотропные модификации углерода (C): алмаз, графит.

- Бор (B), кремний (Si), германий (Ge).
- Только две аллотропные модификации фосфора имеют атомную кристаллическую решетку: красный фосфор и черный фосфор. (у белого фосфора – молекулярная кристаллическая решетка).
- SiC – карборунд (карбид кремния).
- BN – нитрид бора.
- Кремнезем, горный хрусталь, кварц, речной песок – все эти вещества имеют состав SiO2.
- Корунд, рубин, сапфир – у этих веществ состав Al2O3.
Наверняка возникает вопрос: С – это и алмаз, и графит. Но они же совершенно разные: графит непрозрачный, пачкает, проводит электрический ток, а алмаз прозрачный, не пачкает и ток не проводит. Отличаются они структурой.
И то, и то – атомная решетка, но разная. Поэтому и свойства разные.
Ионная кристаллическая решетка.Классический пример: поваренная соль: NaCl. В узлах решетки располагаются отдельные ионы: Na+ и Cl–. Удерживает решетку электростатические силы притяжения между ионами («плюс» притягивается к «минусу»), то есть ионная связь.
Ионные кристаллические решетки довольно прочные, но хрупкие, температуры плавления таких веществ довольно высокие (выше, чем у представителей металлической, но ниже чем у веществ с атомной решеткой). Многие растворимы в воде.
С определением ионной кристаллической решетки, как правило, проблем не возникает: там, где ионная связь – там ионная кристаллическая решетка. Это: все соли, оксиды металлов, щелочи (и другие основные гидроксиды).
Металлическая кристаллическая решетка.Металлическая решетка реализуется в простых веществах металлах. Ранее мы говорили, что все великолепие металлической связи можно понять лишь вместе с металлической кристаллической решеткой. Час настал.
Главное свойство металлов: электроны на внешнем энергетическом уровне плохо удерживаются, поэтому легко отдаются. Потеряв электрон металл превращается в положительно заряженный ион – катион:
Na0 – 1e → Na+
В металлической кристаллической решетке постоянно протекают процессы отдачи, и присоединения электронов: от атома металла в одном узле решетки отрывается электрон. Образуется катион. Оторвавшийся электрон притягивается другим катионом (или этим же): вновь образуется нейтральный атом.
Образуется катион. Оторвавшийся электрон притягивается другим катионом (или этим же): вновь образуется нейтральный атом.
В узлах металлической кристаллической решетки находятся как нейтральные атомы, так и катионы металла. А между узлами путешествуют свободные электроны:
Эти свободные электроны называются электронным газом. Именно они обусловливают физические свойства простых веществ металлов:
- тепло- и электропроводность
- металлический блеск
- ковкость, пластичность
Это и есть металлическая связь: катионы металлов притягиваются к нейтральным атомам и все это «склеивают» склеивают свободные электроны.
Как определить тип кристаллической решетки.
P.S. Есть кое-что в школьной программе и программе ЕГЭ по этой теме то, с чем мы не совсем согласны. А именно: обобщение, о том, что любая связь металл-неметалл – это ионная связь. Это допущение, намеренно сделано, видимо, для упрощения программы.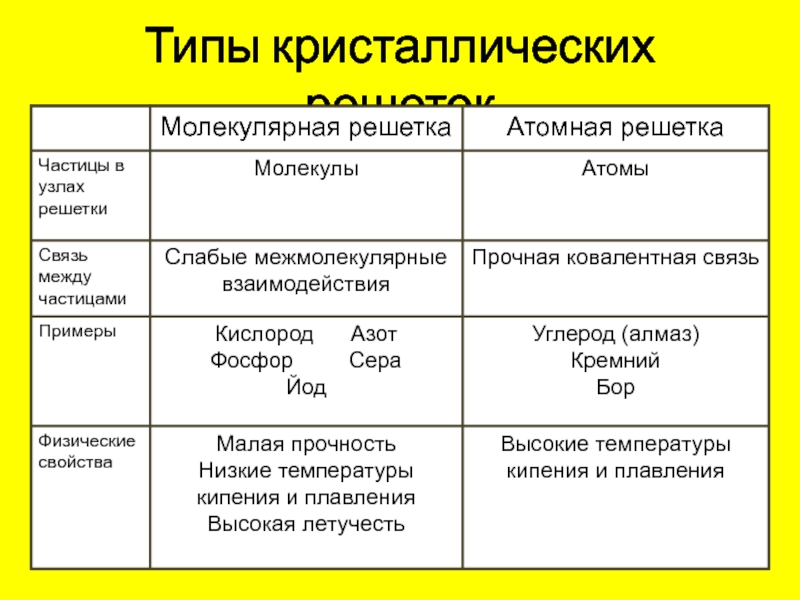 Но это ведет к искажению. Граница между ионной и ковалентной связью условная. У каждой связи есть свой процент «ионности» и «ковалентности». Связь с малоактивным металлом имеет малый процент «ионности», она больше похожа на ковалентную. Но по программе ЕГЭ, она «округляется» в сторону ионной. Это порождает, порой абсурдные вещи. Например, Al2O3 – вещество с атомной кристаллической решеткой. О какой ионности здесь может идти речь. Только ковалентная связь может удерживать таким образом атомы. Но по стандарту «металл-неметалл» мы квалифицируем эту связь как ионную. И получается противоречие: решетка атомная, а связь ионная. Вот к чему приводит, излишнее упрощение.
Но это ведет к искажению. Граница между ионной и ковалентной связью условная. У каждой связи есть свой процент «ионности» и «ковалентности». Связь с малоактивным металлом имеет малый процент «ионности», она больше похожа на ковалентную. Но по программе ЕГЭ, она «округляется» в сторону ионной. Это порождает, порой абсурдные вещи. Например, Al2O3 – вещество с атомной кристаллической решеткой. О какой ионности здесь может идти речь. Только ковалентная связь может удерживать таким образом атомы. Но по стандарту «металл-неметалл» мы квалифицируем эту связь как ионную. И получается противоречие: решетка атомная, а связь ионная. Вот к чему приводит, излишнее упрощение.
Онлайн урок: Кристаллическое состояние веществ по предмету Химия 8 класс
Кристаллические решётки бывают:
- молекулярные
- атомные (атомно- ковалентные)
- ионные
- металлические (атомно- металлические)
Остановимся на характеристике основных типов кристаллических решеток и установим зависимость от них свойств веществ.
Молекулярные кристаллические решетки– это решетки, в узлах которых расположены молекулы, связанные между собой слабыми силами межмолекулярного взаимодействия.
Примером вещества с молекулярной кристаллической решеткой может служить кристаллический оксид углерода (IV) CO2 – «сухой лед».
С помощь сухого льда кулинары делают забавные представления, ведь он совершенно безопасен для здоровья!
Рассмотрим модель его кристаллической решетки.
В ее узлах находятся молекулы.
Многие вещества в твердом состоянии имеют молекулярную кристаллическую решетку, особенно органические (например, белки, углеводы, полимеры).
Атомы в их молекулах связаны прочными ковалентными связями.
Молекулы же в кристаллах стянуты слабыми межмолекулярными силами, которые легко разорвать.
Поэтому кристаллы с молекулярной решеткой обладают малой твердостью, легкоплавкие, летучие.
Молекулярные вещества легко переходят из одного агрегатного состояния в другое.
Примером может служить сублимация йода.
Сублимация – возгонка, переход из твердого состояния не в жидкое, а сразу в газообразное.
Йод – это твёрдый (при нормальных условиях) неметалл темно-фиолетового цвета.
При нагревании йод не плавится, а возгоняется: сразу переходит в газообразное состояние.
У меня есть дополнительная информация к этой части урока!
ЗакрытьТот же эффект можно наблюдать и с сухим льдом. Если положить на стол кусочек сухого льда, то он не плавится, а сразу же испаряется (то есть переходит в газообразное состояние).
Интересно то, что он при этом начинает бегать по поверхности. Происходит это потому, что между кристаллом и столом образуется слой углекислого газа, который и толкает этот кристалл в разные стороны.
Если ненадолго взять его в руку, мы почувствуем небольшой холод, но жидкости не будет. Именно поэтому это вещество и назвали «сухой лёд».
Однако получить эти вещества в жидком виде всё же возможно. Эти жидкости существуют при повышенном давлении. Хотя термин «повышенное давление» в данном случае понятие весьма растяжимое и вовсе не означает большущие гидравлические прессы размером со шкаф. Например, жидкий йод можно легко получить в пробирке, нагревая его кристаллы, но при этом охлаждая горлышко пробирки. В таком случае пары йода не будут выходить из пробирки, а будут опять оседать на ней в виде кристаллов, и в итоге в пробирке образуется повышенное давление паров йода.
Атомные кристаллические решетки – решетки, в которых расположены атомы, стянутые в кристалле прочными ковалентными связями.
Атомных кристаллов сравнительно немного.
Примерами таких твердых веществ служат как простые вещества: алмаз, кремний; так и сложные вещества: карбид кальция, сульфид цинка, диоксид кремния и др.
Так, например, кристалл алмаза имеет форму тетраэдра.
Следовательно, структурную его единицу представляет тетраэдр.
В центре его ячейки расположен атом углерода, прочно связанный с четырьмя другими атомами углерода с помощью электронных пар.
Все связи одинаковы, как и углы, образующиеся между атомами.
Именно благодаря ковалентным связям атомные кристаллы имеют высокую твёрдость и температуру плавления.
Именно тот факт, что в алмазе каждый атом связан четырьмя ковалентными связями, и объясняет столь высокую его твёрдость.
Ионные кристаллические решетки – это решетки, в узлах которых расположены ионы с противоположными зарядами.
Связь между ионами осуществляется за счет электростатических сил притяжения.
Типичный представитель веществ с такой решеткой – поваренная соль (схематичное изображение решетки поваренной соли есть выше в этом уроке).
Ионные кристаллические решетки характерны для многих соединений с ионной связью. Это соли щелочных и щелочно-земельных металлов, щёлочи.
Ионные кристаллы отличаются высокой твердостью и температурой плавления, малой летучестью. По физическим свойствам они сходны с атомными кристаллами.
Металлические кристаллические решетки присущи простым веществам – металлам. Подробно они будут рассмотрены позже.
Многие простые и сложные вещества имеют кристаллическую структуру.
Для них характерны закономерное расположение частиц в трехмерном пространстве и строгая правильная геометрическая форма кристаллов. Свойства таких веществ зависят не только от строения образующих их атомов и характера их химической связи, но и от кристаллической структуры веществ.
Определить тип кристаллической решетки вещества поможет таблица:
| Металл | Неметалл | Тип кристаллической решетки | Свойства веществ с этим типом кристаллической решетки | |
1, 2, 3 гр главных п/г | не 1, 2, 3 гр главных п/г | ||||
Простые вещества | — | — | С (алмаз и графит) Р (черный фосфор) | Атомная | Твердые, тугоплавкие, нерастворимые или слаборастворимые. Диэлектрики или полупроводники |
+ | + | — | Металлическая | Твердые, пластичные, нерастворимые. Проводники | |
— | — | + |
Молекулярная | Непрочные, летучие, жидкие и твердые, растворимые в большинстве. Диэлектрики | |
Сложные вещества | — | — | + | ||
— | + | — | Атомная | Твердые, тугоплавкие, нерастворимые или слаборастворимые. Диэлектрики или полупроводники | |
+ | — | — | Ионная | Твердые, тугоплавкие, растворимые. Проводники или полупроводники | |
Выводы:
- Если вещество состоит из одного металла, то решетка металлическая.
- Если в составе вещества нет металла, либо оно органическое, то решетка молекулярная. Исключение составляют С (алмаз и графит) и Р (черный фосфор), имеющие атомную решетку.
- Если в составе вещества есть металл 1, 2, 3 групп главных подгрупп, то решетка ионная.
- Если в составе вещества есть металл не из 1, 2, 3 групп главных подгрупп, то решетка атомная.
 Так же атомную решетку имеют простые вещества С (алмаз и графит) и Р (черный фосфор).
Так же атомную решетку имеют простые вещества С (алмаз и графит) и Р (черный фосфор).
Исходя из сказанного выше составим обобщающую таблицу:
Характеристика решетки | Металлическая | Атомная | Ионная | Молекулярная |
(атомно- металлическая) | (атомно- ковалентная) | |||
Состав узла решетки | Атом металла и электрон | Атомы, связанные ковалентной полярной и неполярной связью | Атомы, связанные ионной связью | Молекулы с слабыми связями |
Тип связи между структурами решетки | Металлическая | Ковалентная | Ионная
| Водородная |
Частично ковалентная | Ковалентная полярная и неполярная | |||
Прочность связи | умеренно прочная | Очень прочная | Умеренно прочная | Непрочная |
Агрегатное состояние | Твердые, пластичные, металлы и сплавы | Твердые, тугоплавкие | Твердые, тугоплавкие | Летучие (имеют запах) |
Жидкие | ||||
Твердые | ||||
Температура плавления | Высокая | Высокая | Высокая | Низкая |
Электропроводность | Проводники | Диэлектрики и полупроводники | Проводники и полупроводники | Диэлектрики |
Растворимость в воде | Нерастворимы | Нерастворимы или полурастворимы | Растворимы | Растворимы в большинстве |
Металл | Да | Металл в составе вещества | Нет | |
Состав | Простые вещества | Сложные вещества | Простые вещества неметаллы и сложные в-ва | |
Металлы | Металлы | Неметаллы | ||
побочных групп | 1, 2, 3 групп главных подгрупп | с неметаллами | ||
с неметаллами (в том числе оксиды), щелочами, солями | ||||
кремниевая кислота (исключение) | все кислоты за исключением кремниевой | |||
благородные газы | ||||
органические вещества | ||||
двухатомные молекулы за исключением ранее преречисленных | ||||
Пример | Al, Cu, Mn, Fe, Zn | Н2SiO3, SiO2, B, Al2O3, C (алмаз и графит), Р (черный фосфор) | NaCl, KNO3, Na3PO4, K2SO4 | NH3, H2O, Cl2, CO2, N2, J2, Br2, P (красный и белый фосфор) |
12.
 6: Кристаллические структуры — Химия LibreTexts
6: Кристаллические структуры — Химия LibreTextsЦели обучения
- Чтобы знать характерные свойства кристаллических и аморфных твердых тел.
- Для распознавания элементарной ячейки кристаллического твердого тела.
- Для расчета плотности твердого тела по его элементарной ячейке.
Кристаллические твердые тела имеют регулярные упорядоченные массивы компонентов, удерживаемых вместе однородными межмолекулярными силами, тогда как компоненты аморфных твердых тел не расположены в регулярных массивах.За некоторыми исключениями, частицы, составляющие твердый материал, будь то ионный, молекулярный, ковалентный или металлический, удерживаются на месте сильными силами притяжения между ними. Поэтому, когда мы обсуждаем твердые тела, мы рассматриваем положения атомов, молекул или ионов, которые по существу фиксированы в пространстве, а не их движения (которые более важны в жидкостях и газах). Составляющие твердого тела могут быть расположены двумя основными способами: они могут образовывать регулярную повторяющуюся трехмерную структуру, называемую кристаллической решеткой, таким образом производя кристаллическое твердое тело, или они могут агрегироваться без определенного порядка, и в этом случае они образуют аморфное твердый (от греческого ámorphos, что означает «бесформенный»).
Кристаллические твердые тела или кристаллы имеют отличительную внутреннюю структуру, которая, в свою очередь, приводит к отличительным плоским поверхностям или граням.Грани пересекаются под углами, характерными для вещества. Под воздействием рентгеновских лучей каждая структура также создает отличительный узор, который можно использовать для идентификации материала. Характерные углы не зависят от размера кристалла; они отражают регулярное повторяющееся расположение составляющих атомов, молекул или ионов в пространстве. Когда ионный кристалл раскалывается (рис. \ (\ PageIndex {2} \), например, отталкивающие взаимодействия заставляют его разрушаться по фиксированным плоскостям, образуя новые грани, пересекающиеся под теми же углами, что и в исходном кристалле.В ковалентном твердом теле, таком как ограненный алмаз, углы, под которыми встречаются грани, также не произвольны, а определяются расположением атомов углерода в кристалле.
\ (\ PageIndex {2} \), например, отталкивающие взаимодействия заставляют его разрушаться по фиксированным плоскостям, образуя новые грани, пересекающиеся под теми же углами, что и в исходном кристалле.В ковалентном твердом теле, таком как ограненный алмаз, углы, под которыми встречаются грани, также не произвольны, а определяются расположением атомов углерода в кристалле.
Кристаллы, как правило, имеют относительно острые, четко определенные точки плавления, потому что все составляющие атомы, молекулы или ионы находятся на одинаковом расстоянии от одного и того же числа и типа соседей; то есть регулярность кристаллической решетки создает одинаковые локальные среды.Таким образом, межмолекулярные силы, удерживающие твердое тело вместе, однородны, и для одновременного разрыва каждого взаимодействия требуется одинаковое количество тепловой энергии.
Аморфные твердые тела обладают двумя характерными свойствами. При раскалывании или разрыве они образуют осколки с неправильной, часто изогнутой поверхностью; и при воздействии рентгеновских лучей они имеют плохо определяемые узоры, поскольку их компоненты не расположены в виде регулярного массива. Аморфное полупрозрачное твердое тело называется стеклом. Практически любое вещество может затвердеть в аморфной форме, если жидкую фазу охладить достаточно быстро.Однако некоторые твердые вещества по своей природе аморфны, потому что либо их компоненты не могут достаточно хорошо сочетаться друг с другом, чтобы образовать стабильную кристаллическую решетку, либо они содержат примеси, которые разрушают решетку. Например, хотя химический состав и основные структурные единицы кристалла кварца и кварцевого стекла одинаковы (оба являются SiO 2 и оба состоят из связанных тетраэдров SiO 4 ), расположение атомов в пространстве отличается. Кристаллический кварц содержит высокоупорядоченное расположение атомов кремния и кислорода, но в кварцевом стекле атомы расположены почти беспорядочно. Когда расплавленный SiO 2 быстро охлаждается (4 К / мин), он образует кварцевое стекло, тогда как большие идеальные кристаллы кварца, продаваемые в магазинах минералов, охлаждались тысячелетиями. Напротив, алюминий кристаллизуется намного быстрее. Аморфный алюминий образуется только тогда, когда жидкость охлаждается с необычайной скоростью 4 × 10 13 К / с, что не позволяет атомам организовываться в регулярный массив.
Когда расплавленный SiO 2 быстро охлаждается (4 К / мин), он образует кварцевое стекло, тогда как большие идеальные кристаллы кварца, продаваемые в магазинах минералов, охлаждались тысячелетиями. Напротив, алюминий кристаллизуется намного быстрее. Аморфный алюминий образуется только тогда, когда жидкость охлаждается с необычайной скоростью 4 × 10 13 К / с, что не позволяет атомам организовываться в регулярный массив.
В аморфном твердом теле локальная среда, включая расстояния до соседних единиц и количество соседей, варьируется по всему материалу. Для преодоления этих различных взаимодействий необходимо различное количество тепловой энергии. Следовательно, аморфные твердые вещества имеют тенденцию медленно размягчаться в широком диапазоне температур, а не иметь четко определенную точку плавления, как кристаллическое твердое вещество.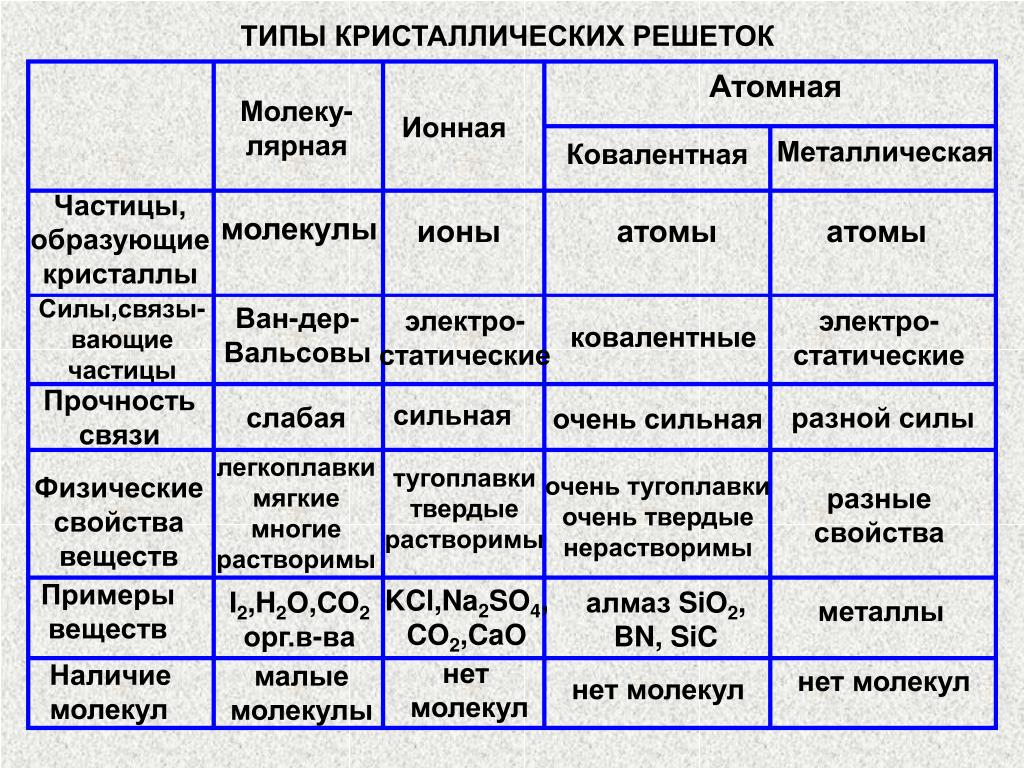 Если аморфное твердое вещество выдерживается при температуре чуть ниже его точки плавления в течение длительных периодов времени, составляющие молекулы, атомы или ионы могут постепенно перестраиваться в более упорядоченную кристаллическую форму.
Если аморфное твердое вещество выдерживается при температуре чуть ниже его точки плавления в течение длительных периодов времени, составляющие молекулы, атомы или ионы могут постепенно перестраиваться в более упорядоченную кристаллическую форму.
Кристаллы имеют четко выраженные точки плавления; аморфные твердые тела — нет.
Кристаллы
Поскольку кристаллическое твердое тело состоит из повторяющихся узоров его компонентов в трех измерениях (кристаллическая решетка), мы можем представить весь кристалл, нарисовав структуру мельчайших идентичных единиц, которые, будучи сложены вместе, образуют кристалл. Эта основная повторяющаяся единица называется элементарной ячейкой. Например, элементарная ячейка листа идентичных почтовых марок представляет собой отдельную марку, а элементарная ячейка стопки кирпичей — это отдельный кирпич.В этом разделе мы описываем расположение атомов в различных элементарных ячейках.
Рисунок \ (\ PageIndex {4} \): Единичные ячейки в двух измерениях. (a – c) Три двумерные решетки иллюстрируют возможные варианты выбора элементарной ячейки. Элементарные ячейки различаются своим относительным расположением или ориентацией внутри решетки, но все они являются допустимым выбором, потому что их повторение в любом направлении заполняет общий узор точек. (d) Треугольник не является действительной элементарной ячейкой, потому что его повторение в пространстве заполняет только половину пространства в шаблоне.
(a – c) Три двумерные решетки иллюстрируют возможные варианты выбора элементарной ячейки. Элементарные ячейки различаются своим относительным расположением или ориентацией внутри решетки, но все они являются допустимым выбором, потому что их повторение в любом направлении заполняет общий узор точек. (d) Треугольник не является действительной элементарной ячейкой, потому что его повторение в пространстве заполняет только половину пространства в шаблоне. Элементарные ячейки проще всего визуализировать в двух измерениях. Во многих случаях для представления данной структуры можно использовать более одной элементарной ячейки, как показано для рисунка Эшера в открытии главы и для двумерной кристаллической решетки на рисунке \ (\ PageIndex {4} \). Обычно выбирается наименьшая элементарная ячейка, полностью описывающая порядок. Единственное требование к действительной элементарной ячейке состоит в том, что повторение ее в пространстве должно давать правильную решетку. Таким образом, элементарная ячейка на рисунке \ (\ PageIndex {4d} \) не является правильным выбором, потому что повторение ее в пространстве не дает желаемой решетки (есть треугольные отверстия). Концепция элементарных ячеек расширена до трехмерной решетки на схематическом чертеже на рисунке \ (\ PageIndex {5} \).
Концепция элементарных ячеек расширена до трехмерной решетки на схематическом чертеже на рисунке \ (\ PageIndex {5} \).
Единичная ячейка
Существует семь принципиально различных типов элементарных ячеек, которые различаются относительной длиной ребер и углами между ними (рисунок \ (\ PageIndex {6} \)). Каждая элементарная ячейка имеет шесть сторон, каждая из которых представляет собой параллелограмм.Мы сосредотачиваемся в первую очередь на кубических элементарных ячейках, у которых все стороны имеют одинаковую длину и все углы равны 90 °, но концепции, которые мы вводим, также применимы к веществам, элементарные ячейки которых не являются кубическими.
Рисунок \ (\ PageIndex {6} \): Общие характеристики семи основных элементарных ячеек. Длины краев элементарных ячеек обозначены буквами a, b и c, а углы определены следующим образом: α, угол между b и c; β — угол между a и c; и γ — угол между a и b.
Если кубическая элементарная ячейка состоит из восьми компонентных атомов, молекул или ионов, расположенных в углах куба, то она называется простой кубической (рис. \ (\ PageIndex {7a} \)).Если элементарная ячейка также содержит идентичный компонент в центре куба, то это объемно-центрированный куб (ОЦК) (\ (\ PageIndex {7b} \)). Если в центре каждой грани есть компоненты в дополнение к компонентам в углах куба, то элементарная ячейка является гранецентрированной кубической (ГЦК) (рисунок \ (\ PageIndex {7c} \)).
Рисунок \ (\ PageIndex {7} \): Три вида кубической элементарной ячейки. Для трех видов кубических элементарных ячеек, простой кубической (a), объемно-центрированной кубической (b) и гранецентрированной кубической (c), есть три представления для каждой: модель шара и палки, пространственно-центрированная кубическая модель (c). модель заполнения в разрезе, которая показывает часть каждого атома, которая находится в элементарной ячейке, и совокупность нескольких элементарных ячеек.
Как показано на рисунке \ (\ PageIndex {7} \), твердое тело состоит из большого количества элементарных ячеек, расположенных в трех измерениях. Поэтому любое интенсивное свойство объемного материала, такое как его плотность, также должно быть связано с его элементарной ячейкой. Поскольку плотность — это масса вещества на единицу объема, мы можем вычислить плотность объемного материала из плотности одной элементарной ячейки. Для этого нам нужно знать размер элементарной ячейки (чтобы получить ее объем), молярную массу ее компонентов и количество компонентов в элементарной ячейке.Однако, когда мы считаем атомы или ионы в элементарной ячейке, те, которые лежат на грани, ребре или углу, вносят вклад в более чем одну элементарную ячейку, как показано на рисунке \ (\ PageIndex {7} \). Например, атом, который находится на грани элементарной ячейки, является общим для двух соседних элементарных ячеек и поэтому считается как \ ({1 \ over 2} \) атом на элементарную ячейку. Точно так же атом, который находится на краю элементарной ячейки, является общим для четырех соседних элементарных ячеек, поэтому он вносит вклад в \ ({1 \ over 4} \) атом в каждую. Атом в углу элементарной ячейки является общим для всех восьми соседних элементарных ячеек и, следовательно, вносит вклад в \ ({1 \ over 8} \) атом в каждую.Утверждение, что атомы, лежащие на ребре или углу элементарной ячейки, считаются \ ({1 \ over 4} \) или \ ({1 \ over 8} \) атомами на элементарную ячейку, соответственно, верно для всех ячеек, за исключением шестиугольной, в котором три элементарные ячейки имеют каждое вертикальное ребро, а шесть — каждый угол (рис. \ (\ PageIndex {7} \) :), что приводит к значениям \ ({1 \ over 3} \) и \ ({1 \ over 6} \) атома на элементарную ячейку, соответственно, для атомов в этих позициях. Напротив, атомы, которые полностью лежат в элементарной ячейке, например атом в центре объемно-центрированной кубической элементарной ячейки, принадлежат только этой элементарной ячейке.
Атом в углу элементарной ячейки является общим для всех восьми соседних элементарных ячеек и, следовательно, вносит вклад в \ ({1 \ over 8} \) атом в каждую.Утверждение, что атомы, лежащие на ребре или углу элементарной ячейки, считаются \ ({1 \ over 4} \) или \ ({1 \ over 8} \) атомами на элементарную ячейку, соответственно, верно для всех ячеек, за исключением шестиугольной, в котором три элементарные ячейки имеют каждое вертикальное ребро, а шесть — каждый угол (рис. \ (\ PageIndex {7} \) :), что приводит к значениям \ ({1 \ over 3} \) и \ ({1 \ over 6} \) атома на элементарную ячейку, соответственно, для атомов в этих позициях. Напротив, атомы, которые полностью лежат в элементарной ячейке, например атом в центре объемно-центрированной кубической элементарной ячейки, принадлежат только этой элементарной ячейке.
Для всех элементарных ячеек, кроме гексагональной, атомы на гранях вносят вклад в \ ({1 \ over 2} \) атом в каждую элементарную ячейку, атомы на краях вносят вклад в \ ({1 \ over 4} \) атом в каждую элементарную ячейку, а атомы по углам вносят \ ({1 \ over 8} \) атом в каждую элементарную ячейку.
Пример \ (\ PageIndex {1} \): единичная ячейка для золота
Металлическое золото имеет гранецентрированную кубическую элементарную ячейку (\ (\ PageIndex {7c} \)). Сколько атомов Au в каждой элементарной ячейке?
Дано : элементарная ячейка
Запрошено : количество атомов в элементарной ячейке
Стратегия
Используя рисунок \ (\ PageIndex {7} \), определите положения атомов Au в гранецентрированной кубической элементарной ячейке, а затем определите, какой вклад каждый атом Au вносит в элементарную ячейку.Сложите вклады всех атомов Au, чтобы получить общее количество атомов Au в элементарной ячейке.
Решение
Как показано на рисунке \ (\ PageIndex {7} \), гранецентрированная кубическая элементарная ячейка имеет восемь атомов в углах куба и шесть атомов на гранях. Поскольку атомы на грани являются общими для двух элементарных ячеек, каждый считается как \ ({1 \ over 2} \) атом на элементарную ячейку, что дает \ (6 \ times {1 \ over 2} = 3 \) атомов Au на единицу. клетка. Атомы в углу разделяются на восемь элементарных ячеек и, следовательно, дают только \ ({1 \ over 8} \) атом на элементарную ячейку, что дает \ (8 \ times {1 \ over 8} = 1 \) атом Au на элементарную ячейку. .Таким образом, общее количество атомов Au в каждой элементарной ячейке равно \ (3 + 1 = 4 \).
клетка. Атомы в углу разделяются на восемь элементарных ячеек и, следовательно, дают только \ ({1 \ over 8} \) атом на элементарную ячейку, что дает \ (8 \ times {1 \ over 8} = 1 \) атом Au на элементарную ячейку. .Таким образом, общее количество атомов Au в каждой элементарной ячейке равно \ (3 + 1 = 4 \).
Упражнение \ (\ PageIndex {1} \): Элементарная ячейка для железа
Металлическое железо имеет объемно-центрированную кубическую элементарную ячейку (рисунок \ (\ PageIndex {7b} \)). Сколько атомов Fe в каждой элементарной ячейке?
- Ответ
два
Теперь, когда мы знаем, как считать атомы в элементарных ячейках, мы можем использовать элементарные ячейки для расчета плотности простых соединений.Однако обратите внимание, что мы предполагаем, что твердое тело состоит из идеального регулярного массива элементарных ячеек, тогда как реальные вещества содержат примеси и дефекты, которые влияют на многие из их объемных свойств, включая плотность. Следовательно, результаты наших расчетов будут близки, но не обязательно идентичны экспериментально полученным значениям.
Следовательно, результаты наших расчетов будут близки, но не обязательно идентичны экспериментально полученным значениям.
Пример \ (\ PageIndex {2} \): плотность железа
Рассчитайте плотность металлического железа, имеющего объемно-центрированную кубическую элементарную ячейку (рисунок \ (\ PageIndex {7b} \)) с длиной ребра 286.18:00.
Дано : элементарная ячейка и длина ребра
Запрошено : плотность
Стратегия :
- Определите количество атомов железа в элементарной ячейке.
- Рассчитайте массу атомов железа в элементарной ячейке, используя молярную массу и число Авогадро. Затем разделите массу на объем клетки.
Решение :
A Из примера \ (\ PageIndex {1} \) мы знаем, что каждая элементарная ячейка металлического железа содержит два атома Fe.{3} \ nonumber \]
Этот результат хорошо согласуется с экспериментальным значением 7,874 г / см, приведенным в таблице. 3 .
3 .
Упражнение \ (\ PageIndex {2} \): плотность золота
Рассчитайте плотность золота, имеющего гранецентрированную кубическую элементарную ячейку (рисунок \ (\ PageIndex {7c} \)) с длиной ребра 407,8 пм.
- Ответ
19,29 г / см 3
Упаковка сфер
Наше обсуждение трехмерных структур твердых тел рассматривало только те вещества, в которых все компоненты идентичны.Как мы увидим, такие вещества можно рассматривать как состоящие из идентичных сфер, упакованных вместе в пространстве; способ упаковки компонентов приводит к получению различных элементарных ячеек. Большинство веществ со структурой этого типа — металлы.
Простая кубическая структура
Расположение атомов в твердом теле, имеющем простую кубическую элементарную ячейку, показано на рисунке \ (\ PageIndex {5a} \). Каждый атом в решетке имеет только шесть ближайших соседей в октаэдрическом расположении. Следовательно, простая кубическая решетка — неэффективный способ упаковать атомы вместе в пространстве: только 52% всего пространства заполнено атомами. Единственный элемент, который кристаллизуется в простой кубической элементарной ячейке, — это полоний. Однако простые кубические элементарные ячейки распространены среди бинарных ионных соединений, где каждый катион окружен шестью анионами, и наоборот (рисунок \ (\ PageIndex {8} \)).
Следовательно, простая кубическая решетка — неэффективный способ упаковать атомы вместе в пространстве: только 52% всего пространства заполнено атомами. Единственный элемент, который кристаллизуется в простой кубической элементарной ячейке, — это полоний. Однако простые кубические элементарные ячейки распространены среди бинарных ионных соединений, где каждый катион окружен шестью анионами, и наоборот (рисунок \ (\ PageIndex {8} \)).
Объемно-центрированная кубическая структура
Объемно-центрированная кубическая элементарная ячейка является более эффективным способом упаковки сфер вместе и гораздо более распространена среди чистых элементов. Каждый атом имеет восемь ближайших соседей в элементарной ячейке, а атомы занимают 68% объема. Как показано на рисунке \ (\ PageIndex {8} \), объемно-центрированная кубическая структура состоит из одного слоя сфер, контактирующих друг с другом и выровненных так, что их центры находятся в углах квадрата; второй слой сфер занимает квадратные «дыры» над сферами в первом слое. Третий слой сфер занимает квадратные отверстия, образованные вторым слоем, так что каждое из них находится непосредственно над сферой в первом слое и так далее. Все щелочные металлы, барий, радий и некоторые переходные металлы имеют объемно-центрированную кубическую структуру.
Третий слой сфер занимает квадратные отверстия, образованные вторым слоем, так что каждое из них находится непосредственно над сферой в первом слое и так далее. Все щелочные металлы, барий, радий и некоторые переходные металлы имеют объемно-центрированную кубическую структуру.
Плотноупакованные шестиугольные и кубические плотноупакованные конструкции
Самый эффективный способ упаковки сфер — это плотная упаковка, которая имеет два варианта. Один слой плотно упакованных сфер показан на рисунке \ (\ PageIndex {6a} \).Каждая сфера окружена шестью другими в той же плоскости, образуя гексагональное расположение. Над любым набором из семи сфер находятся шесть углублений, расположенных в форме шестиугольника. В принципе, все шесть узлов одинаковы, и любой из них может быть занят атомом следующего слоя. На самом деле, однако, эти шесть сайтов можно разделить на два набора, обозначенных B и C на рисунке \ (\ PageIndex {9a} \). Сайты B и C отличаются, потому что как только мы помещаем сферу в позицию B, мы больше не можем разместить сферу ни в одной из трех позиций C, смежных с A, и наоборот.
Если мы поместим второй слой сфер в позиции B на рисунке \ (\ PageIndex {9a} \), мы получим двухслойную структуру, показанную на рисунке \ (\ PageIndex {9b} \). Теперь есть две альтернативы для размещения первого атома третьего слоя: мы можем разместить его непосредственно над одним из атомов в первом слое (положение A) или в одном из положений C, соответствующих положениям, которые мы не использовали. используйте для атомов в первом или втором слоях (Рисунок \ (\ PageIndex {9c} \)). Если мы выберем первое расположение и повторим узор в последующих слоях, позиции атомов будут чередоваться от слоя к слою в узоре ABABAB…, в результате получится гексагональная структура с плотной упаковкой (ГПУ) (Рисунок \ (\ PageIndex {9a}) \)).Если мы выберем второе расположение и будем повторять шаблон до бесконечности, позиции атомов будут чередоваться как ABCABC…, давая кубическую плотноупакованную структуру (ccp) (рисунок \ (\ PageIndex {9b} \)). Поскольку структура ccp содержит гексагонально упакованные слои, она не выглядит особенно кубической. Однако, как показано на рисунке \ (\ PageIndex {9b} \), простое вращение структуры показывает ее кубическую природу, которая идентична структуре ГЦК. Структуры hcp и ccp различаются только способом наложения слоев.Обе структуры имеют общую эффективность упаковки 74%, и в обеих каждый атом имеет 12 ближайших соседей (6 в одной плоскости плюс 3 в каждой из плоскостей непосредственно выше и ниже).
Если мы выберем первое расположение и повторим узор в последующих слоях, позиции атомов будут чередоваться от слоя к слою в узоре ABABAB…, в результате получится гексагональная структура с плотной упаковкой (ГПУ) (Рисунок \ (\ PageIndex {9a}) \)).Если мы выберем второе расположение и будем повторять шаблон до бесконечности, позиции атомов будут чередоваться как ABCABC…, давая кубическую плотноупакованную структуру (ccp) (рисунок \ (\ PageIndex {9b} \)). Поскольку структура ccp содержит гексагонально упакованные слои, она не выглядит особенно кубической. Однако, как показано на рисунке \ (\ PageIndex {9b} \), простое вращение структуры показывает ее кубическую природу, которая идентична структуре ГЦК. Структуры hcp и ccp различаются только способом наложения слоев.Обе структуры имеют общую эффективность упаковки 74%, и в обеих каждый атом имеет 12 ближайших соседей (6 в одной плоскости плюс 3 в каждой из плоскостей непосредственно выше и ниже).
 Повернутое изображение подчеркивает ГЦК-природу элементарной ячейки (выделено). Линия, соединяющая атомы в первом и четвертом слоях структуры ccp, является диагональю тела куба.
Повернутое изображение подчеркивает ГЦК-природу элементарной ячейки (выделено). Линия, соединяющая атомы в первом и четвертом слоях структуры ccp, является диагональю тела куба.Таблица \ (\ PageIndex {1} \) сравнивает эффективность упаковки и количество ближайших соседей для различных кубических структур и структур с плотной упаковкой; количество ближайших соседей называется координационным числом.Большинство металлов имеют ГПУ-, ГПУ- или ОЦК-структуры, хотя некоторые металлы обладают как ГПУ-, так и ГПУ-структурой, в зависимости от температуры и давления.
| Структура | Процент пространства, занятого атомами | Координационный номер |
|---|---|---|
| простая кубическая | 52 | 6 |
| объемно-центрированная кубическая | 68 | 8 |
| гексагональный плотно упакованный | 74 | 12 |
| кубический плотноупакованный (идентичен гранецентрированному кубу) | 74 | 12 |
Резюме
Кристаллическое твердое тело может быть представлено его элементарной ячейкой, которая представляет собой наименьшую идентичную единицу, которая, будучи сложена вместе, дает характерную трехмерную структуру. Твердые тела характеризуются расширенным трехмерным расположением атомов, ионов или молекул, в котором компоненты обычно заблокированы в своих положениях. Компоненты могут быть расположены в регулярном повторяющемся трехмерном массиве (кристаллической решетке), что приводит к кристаллическому твердому телу, или более или менее беспорядочно для получения аморфного твердого тела. Кристаллические твердые тела имеют четко очерченные края и грани, дифрагируют рентгеновские лучи и имеют тенденцию к резким температурам плавления. Напротив, аморфные твердые вещества имеют неправильную или искривленную поверхность, не дают хорошо разрешенных рентгенограмм и плавятся в широком диапазоне температур.
Твердые тела характеризуются расширенным трехмерным расположением атомов, ионов или молекул, в котором компоненты обычно заблокированы в своих положениях. Компоненты могут быть расположены в регулярном повторяющемся трехмерном массиве (кристаллической решетке), что приводит к кристаллическому твердому телу, или более или менее беспорядочно для получения аморфного твердого тела. Кристаллические твердые тела имеют четко очерченные края и грани, дифрагируют рентгеновские лучи и имеют тенденцию к резким температурам плавления. Напротив, аморфные твердые вещества имеют неправильную или искривленную поверхность, не дают хорошо разрешенных рентгенограмм и плавятся в широком диапазоне температур.
Наименьшей повторяющейся единицей кристаллической решетки является элементарная ячейка. Простая кубическая элементарная ячейка содержит всего восемь атомов, молекул или ионов в углах куба. Объемно-центрированная кубическая (ОЦК) элементарная ячейка содержит один дополнительный компонент в центре куба. Гранецентрированная кубическая (ГЦК) элементарная ячейка содержит компонент в центре каждой грани в дополнение к компонентам в углах куба. Простые кубические и ОЦК-схемы заполняют атомами только 52% и 68% доступного пространства соответственно.Гексагональная плотноупакованная (ГПУ) структура имеет повторяющееся расположение ABABAB…, а кубическая плотноупакованная (ГПУ) структура имеет повторяющийся узор ABCABC…; последняя идентична ГЦК решетке. Компоновки ГПУ и ЦПУ заполняют 74% доступного пространства и имеют координационное число 12 для каждого атома в решетке, число ближайших соседей. Простая кубическая и ОЦК-решетки имеют координационные числа 6 и 8 соответственно.
Гранецентрированная кубическая (ГЦК) элементарная ячейка содержит компонент в центре каждой грани в дополнение к компонентам в углах куба. Простые кубические и ОЦК-схемы заполняют атомами только 52% и 68% доступного пространства соответственно.Гексагональная плотноупакованная (ГПУ) структура имеет повторяющееся расположение ABABAB…, а кубическая плотноупакованная (ГПУ) структура имеет повторяющийся узор ABCABC…; последняя идентична ГЦК решетке. Компоновки ГПУ и ЦПУ заполняют 74% доступного пространства и имеют координационное число 12 для каждого атома в решетке, число ближайших соседей. Простая кубическая и ОЦК-решетки имеют координационные числа 6 и 8 соответственно.
Авторы и ссылки
💎 Основные типы кристаллической структуры металла
Что такое кристаллическая структура?
Мы знаем, что кристаллическая структура имеет дело с расположением атомов в твердой кристаллической структуре, показывающей регулярный трехмерный узор атомов.С геометрической точки зрения кристаллическая структура известна как пространственная решетка или точечная решетка.
Давайте узнаем о различных типах кристаллической структуры.
Схема различных 4 типов кристаллической структурыРазличные типы кристаллической структуры:
Существует четыре типа кристаллической структуры, как указано ниже:
- Простая кубическая кристаллическая структура (SC)
- Объемно-центрированная кристаллическая структура (ОЦК)
- Гранецентрированная кристаллическая структура (FCC)
- Гексагональная плотноупакованная структура (HCP)
Подробнее: 5 лучших справочников по металлургии
1.Простая кубическая кристаллическая структура (SC):
В этом типе кристаллической структуры один атом расположен в каждом углу элементарной ячейки, как показано на рисунке. В простой кубической кристаллической структуре общее количество атомов равно восьми.
Простая кубическая кристаллическая структура не имеет атома в центре элементарной ячейки или на гранях элементарной ячейки. Теперь мы можем сказать, что среднее количество атомов на единицу в простой кубической кристаллической структуре одно. Такой тип кристаллической структуры не существует ни в одном инженерном материале.
Такой тип кристаллической структуры не существует ни в одном инженерном материале.
2. Объемно-центрированная кристаллическая структура (ОЦК):
В объемно-центрированной кристаллической структуре по одному атому помещают в каждый угол элементарной ячейки, как в простой кубической кристаллической структуре, но, помимо этого, есть еще один атом в центре элементарной ячейки. Объемно-центрированная кристаллическая структура более сложна по сравнению с простой кубической кристаллической структурой.
Центральный атом в объемно-центрированной кристаллической структуре не контактирует с другим атомом, следовательно, он остается неподеленным.Среднее число атомов на элементарную ячейку в объемно-центрированной кристаллической структуре равно двум. Такие металлы, как Li, K, Na, V, Ta и т. Д., Имеют такую кристаллическую структуру.
3. Гранецентрированная кристаллическая структура (FCC):
В гранецентрированной кристаллической структуре атом помещен в каждый угол элементарной ячейки, что составляет восемь угловых атомов. В центре каждой грани помещен один атом, то есть шесть атомов грани. В гранецентрированной кристаллической структуре центральный атом отсутствует. В этом типе кристаллической структуры среднее количество атомов в элементарной ячейке равно четырем.Металлы, такие как Cu, Ag, Al, Ca, Pt и т. Д., Содержат этот тип кристаллической структуры.
В центре каждой грани помещен один атом, то есть шесть атомов грани. В гранецентрированной кристаллической структуре центральный атом отсутствует. В этом типе кристаллической структуры среднее количество атомов в элементарной ячейке равно четырем.Металлы, такие как Cu, Ag, Al, Ca, Pt и т. Д., Содержат этот тип кристаллической структуры.
Подробнее: Координационные числа различных кристаллических структур
4. Гексагональная плотноупакованная структура (HCP):
В гексагональной плотноупакованной структуре кристаллическая структура показывает по одному атому в каждом углу шестиугольника. Следовательно, в гексагональной плотноупакованной структуре 12 угловых атомов. Кроме того, на каждой грани шестиугольника есть по одному атому.
Три внутренних атома шестиугольника остаются неподеленными.В гексагональной плотноупакованной структуре среднее количество атомов в элементарной ячейке равно шести. Такие металлы, как Zn, Co, Cd, Mg, Be, Ca и т. Д., Имеют такую кристаллическую структуру.
Вывод:
Мы подробно обсудили кристаллическую структуру и типы кристаллической структуры, такие как простая кубическая, объемно-центрированная, гранецентрированная и гексагональная плотноупакованная кристаллическая структура. Если у вас есть какие-либо вопросы по этой статье, не стесняйтесь поделиться ею в поле для комментариев.
10.6. Структуры решеток в кристаллических твердых телах — химия
Цели обучения
К концу этого раздела вы сможете:
- Опишите расположение атомов и ионов в кристаллических структурах
- Вычислить ионные радиусы, используя размеры элементарной ячейки
- Объяснить использование измерений дифракции рентгеновских лучей для определения кристаллических структур
Более 90% твердых веществ природного и антропогенного происхождения являются кристаллическими.Большинство твердых веществ образуются с регулярным расположением своих частиц, потому что общее притягивающее взаимодействие между частицами максимизируется, а общая межмолекулярная энергия сводится к минимуму, когда частицы упаковываются наиболее эффективным образом. Регулярное расположение на атомном уровне часто отражается на макроскопическом уровне. В этом модуле мы исследуем некоторые детали структур металлических и ионных кристаллических твердых тел и узнаем, как эти структуры определяются экспериментально.
Регулярное расположение на атомном уровне часто отражается на макроскопическом уровне. В этом модуле мы исследуем некоторые детали структур металлических и ионных кристаллических твердых тел и узнаем, как эти структуры определяются экспериментально.
Мы начнем обсуждение кристаллических твердых тел с рассмотрения элементарных металлов, которые относительно просты, поскольку каждый содержит только один тип атомов. Чистый металл — это кристаллическое твердое тело, атомы которого плотно упакованы в повторяющийся узор. Некоторые свойства металлов в целом, такие как их пластичность и пластичность, во многом обусловлены наличием одинаковых атомов, расположенных в правильном порядке. Различные свойства одного металла по сравнению с другим частично зависят от размеров их атомов и особенностей их пространственного расположения.В следующих разделах мы исследуем сходства и различия четырех наиболее распространенных геометрических форм металлических кристаллов.
Структуру кристаллического твердого вещества, будь то металл или нет, лучше всего описать, рассматривая его простейшую повторяющуюся единицу, которая упоминается как ее элементарная ячейка .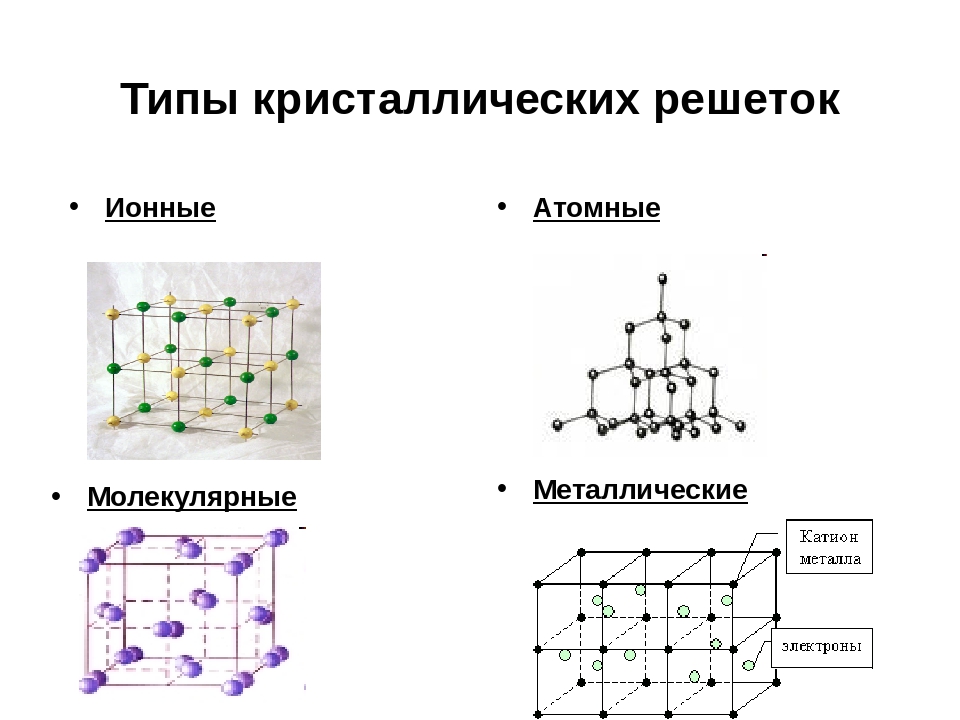 Элементарная ячейка состоит из узлов решетки, которые представляют расположение атомов или ионов. Вся структура состоит из этой элементарной ячейки, повторяющейся в трех измерениях, как показано на рисунке 1.
Элементарная ячейка состоит из узлов решетки, которые представляют расположение атомов или ионов. Вся структура состоит из этой элементарной ячейки, повторяющейся в трех измерениях, как показано на рисунке 1.
Давайте начнем наше исследование структуры кристаллической решетки и элементарных ячеек с самой простой структуры и самой простой элементарной ячейки. Чтобы визуализировать это, представьте, что вы берете большое количество одинаковых сфер, таких как теннисные мячи, и равномерно размещаете их в контейнере. Самый простой способ сделать это — создать слои, в которых сферы в одном слое находятся прямо над сферами в слое ниже, как показано на рисунке 2.Эта конструкция называется простой кубической структурой , а элементарная ячейка называется простой кубической элементарной ячейкой или примитивной кубической элементарной ячейкой.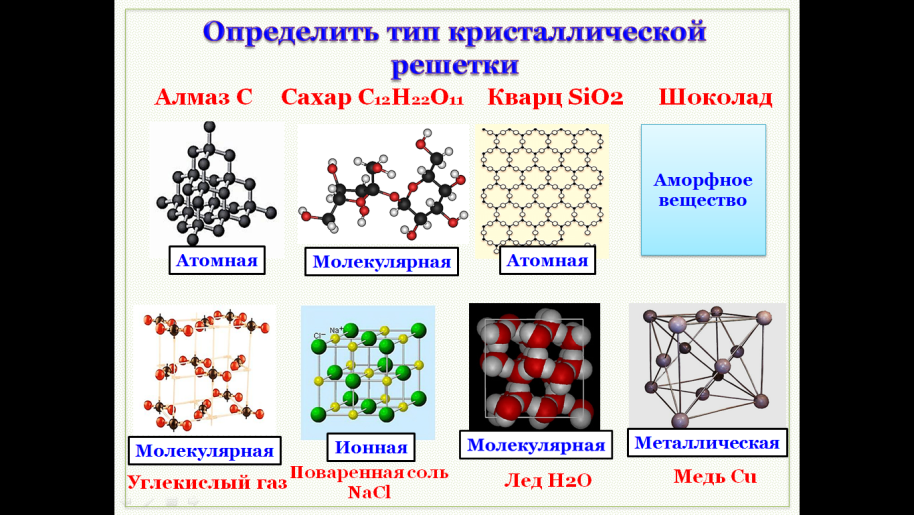
В простой кубической структуре сферы не упакованы так плотно, как могли бы, и они «заполняют» только около 52% объема контейнера.Это относительно неэффективное устройство, и только один металл (полоний, Po) кристаллизуется в простой кубической структуре. Как показано на рисунке 3, твердое тело с таким расположением состоит из плоскостей (или слоев), в которых каждый атом контактирует только с четырьмя ближайшими соседями в своем слое; один атом прямо над ним в верхнем слое; и один атом прямо под ним в слое ниже. Число других частиц, с которыми контактирует каждая частица в кристаллическом твердом теле, известно как его координационное число .Следовательно, для атома полония в простом кубическом массиве координационное число равно шести.
Рис. 3. Атом в простой структуре кубической решетки контактирует с шестью другими атомами, поэтому его координационное число равно шести.
3. Атом в простой структуре кубической решетки контактирует с шестью другими атомами, поэтому его координационное число равно шести.В простой кубической решетке элементарная ячейка, повторяющаяся во всех направлениях, представляет собой куб, определяемый центрами восьми атомов, как показано на рисунке 4. Атомы в соседних углах этой элементарной ячейки контактируют друг с другом, поэтому длина ребра этой ячейки ячейка равна двум атомным радиусам или одному атомному диаметру.Кубическая элементарная ячейка содержит только те части этих атомов, которые находятся в ней. Поскольку атом в углу простой кубической элементарной ячейки состоит в общей сложности из восьми элементарных ячеек, только одна восьмая этого атома находится в конкретной элементарной ячейке. А поскольку каждая простая кубическая элементарная ячейка имеет по одному атому в каждом из восьми «углов», в одной простой кубической ячейке находится [латекс] 8 \; \ times \; \ frac {1} {8} = 1 [/ latex] атом. ячейка.
Рис. 4. Простая элементарная ячейка кубической решетки содержит одну восьмую атома в каждом из восьми углов, поэтому она содержит всего один атом.
4. Простая элементарная ячейка кубической решетки содержит одну восьмую атома в каждом из восьми углов, поэтому она содержит всего один атом.Пример 1
Расчет атомного радиуса и плотности металлов, часть 1
Длина края элементарной ячейки альфа-полония составляет 336 мкм.
(а) Определите радиус атома полония.
(b) Определите плотность альфа-полония.
Раствор
Альфа-полоний кристаллизуется в простой кубической элементарной ячейке:
(a) Два соседних атома По контактируют друг с другом, поэтому длина края этой ячейки равна двум атомным радиусам По: l = 2 r .Следовательно, радиус Po равен [latex] r = \ frac {\ text {l}} {2} = \ frac {336 \; \ text {pm}} {2} = 168 \; \ text {pm} [ /латекс].
(b) Плотность определяется как [латекс] \ text {density} = \ frac {\ text {mass}} {\ text {volume}} [/ latex]. Плотность полония можно определить, определив плотность его элементарной ячейки (масса, содержащаяся в элементарной ячейке, деленная на объем элементарной ячейки). Поскольку элементарная ячейка По содержит одну восьмую атома По в каждом из восьми углов, элементарная ячейка содержит один атом По.
Поскольку элементарная ячейка По содержит одну восьмую атома По в каждом из восьми углов, элементарная ячейка содержит один атом По.
Массу элементарной ячейки По можно найти по формуле:
[латекс] 1 \; \ text {Po \; unit \; cell} \; \ times \; \ frac {1 \; \ text {Po \; atom}} {1 \; \ text {Po \; unit \; cell}} \; \ times \; \ frac {1 \; \ text {mol \; Po}} {6.3 [/ латекс]
Поскольку фактическая плотность Ni не близка к этой, Ni не образует простой кубической структуры.
Большинство металлических кристаллов являются одним из четырех основных типов элементарных ячеек. А пока мы сосредоточимся на трех кубических элементарных ячейках: простой кубической (которые мы уже видели), объемноцентрированной кубической элементарной ячейке и гранецентрированной кубической элементарной ячейке , все из которых показаны на рисунке 5. (Обратите внимание, что на самом деле существует семь различных систем решеток, некоторые из которых имеют более одного типа решетки, всего 14 различных типов элементарных ячеек.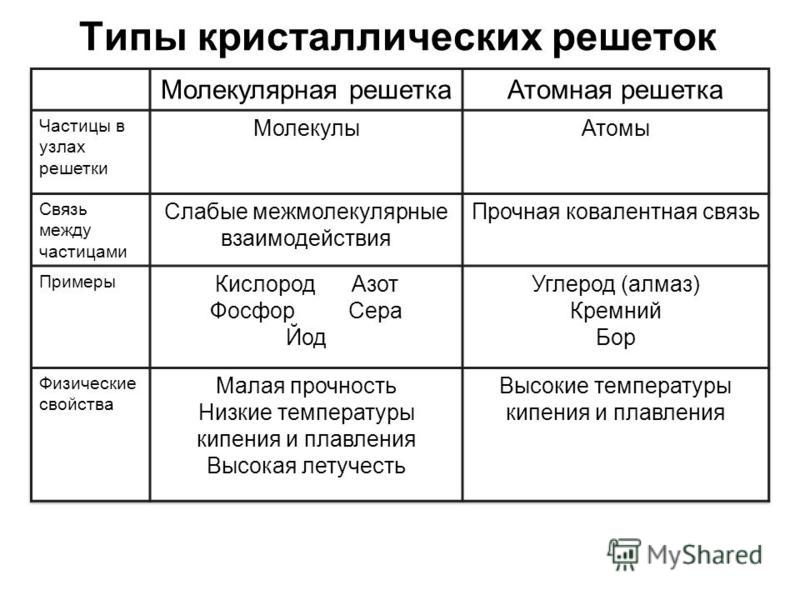 Мы оставляем более сложные геометрические формы на потом в этом модуле.)
Мы оставляем более сложные геометрические формы на потом в этом модуле.)
Некоторые металлы кристаллизуются в структуре, которая имеет кубическую элементарную ячейку с атомами во всех углах и атомом в центре, как показано на Рисунке 6. Это называется объемно-центрированным кубическим (ОЦК) твердым телом . Атомы в углах элементарной ячейки ОЦК не контактируют друг с другом, а контактируют с атомом в центре.Элементарная ячейка BCC содержит два атома: по одной восьмой атома в каждом из восьми углов ([latex] 8 \; \ times \; \ frac {1} {8} = 1 [/ latex] атом от углов) плюс один атом от центра. Любой атом в этой структуре касается четырех атомов в слое над ним и четырех атомов в слое под ним. Таким образом, атом в структуре ОЦК имеет координационное число восемь.
Рис. 6. В объемно-центрированной кубической структуре атомы в определенном слое не соприкасаются друг с другом. Каждый атом касается четырех атомов в слое выше и четырех атомов в слое ниже.
6. В объемно-центрированной кубической структуре атомы в определенном слое не соприкасаются друг с другом. Каждый атом касается четырех атомов в слое выше и четырех атомов в слое ниже.Атомы в структурах ОЦК упакованы намного эффективнее, чем в простой кубической структуре, занимая около 68% от общего объема. Изоморфные металлы со структурой BCC включают K, Ba, Cr, Mo, W и Fe при комнатной температуре. (Элементы или соединения, которые кристаллизуются с такой же структурой, называются изоморфными .)
Многие другие металлы, такие как алюминий, медь и свинец, кристаллизуются в структуре, которая имеет кубическую элементарную ячейку с атомами во всех углах и в центре каждой грани, как показано на рисунке 7.Такое расположение называется гранецентрированным кубическим (FCC) твердым телом . Элементарная ячейка FCC содержит четыре атома: по одной восьмой атома в каждом из восьми углов ([latex] 8 \; \ times \; \ frac {1} {8} = 1 [/ latex] атом от углов) и по половине атома на каждой из шести граней ([latex] 6 \; \ times \; \ frac {1} {2} = 3 [/ latex] атома от граней). Атомы в углах касаются атомов в центрах соседних граней по диагоналям граней куба. Поскольку атомы находятся в идентичных узлах решетки, они имеют идентичное окружение.
Атомы в углах касаются атомов в центрах соседних граней по диагоналям граней куба. Поскольку атомы находятся в идентичных узлах решетки, они имеют идентичное окружение.
Атомы в системе ГЦК упакованы как можно ближе друг к другу, причем атомы занимают 74% объема. Эта структура также называется кубической плотнейшей упаковки (CCP) . В CCP есть три повторяющихся слоя гексагонально расположенных атомов. Каждый атом контактирует с шестью атомами в своем собственном слое, с тремя в слое выше и с тремя в слое ниже.В этом расположении каждый атом касается 12 ближайших соседей и, следовательно, имеет координационное число 12. Тот факт, что устройства FCC и CCP эквивалентны, может быть не сразу очевиден, но почему они на самом деле являются одной и той же структурой, показано на рисунке 8.
Рис. 8. Компоновка CCP состоит из трех повторяющихся слоев (ABCABC…) гексагонально расположенных атомов. Атомы в структуре CCP имеют координационное число 12, потому что они контактируют с шестью атомами в своем слое, плюс три атома в слое выше и три атома в слое ниже.Поворачивая перспективу, мы видим, что структура CCP имеет элементарную ячейку с гранью, содержащей атом из слоя A в одном углу, атомы из слоя B по диагонали (в двух углах и в середине лица) и атом из слоя C в оставшемся углу. Это то же самое, что и гранецентрированное кубическое расположение.
Компоновка CCP состоит из трех повторяющихся слоев (ABCABC…) гексагонально расположенных атомов. Атомы в структуре CCP имеют координационное число 12, потому что они контактируют с шестью атомами в своем слое, плюс три атома в слое выше и три атома в слое ниже.Поворачивая перспективу, мы видим, что структура CCP имеет элементарную ячейку с гранью, содержащей атом из слоя A в одном углу, атомы из слоя B по диагонали (в двух углах и в середине лица) и атом из слоя C в оставшемся углу. Это то же самое, что и гранецентрированное кубическое расположение. Поскольку более тесная упаковка максимизирует общее притяжение между атомами и минимизирует общую межмолекулярную энергию, атомы в большинстве металлов упаковываются таким образом. Мы находим два типа плотнейшей упаковки в простых металлических кристаллических структурах: CCP, с которой мы уже сталкивались, и гексагональная плотнейшая упаковка (HCP) , показанная на рисунке 9.Оба состоят из повторяющихся слоев гексагонально расположенных атомов. В обоих типах второй слой (B) размещается на первом слое (A), так что каждый атом во втором слое контактирует с тремя атомами в первом слое. Третий слой размещается одним из двух способов. В HCP атомы в третьем слое находятся непосредственно над атомами в первом слое (т.е. третий слой также относится к типу A), а наложение состоит из чередующихся плотноупакованных слоев типа A и типа B (то есть ABABAB). В CCP атомы в третьем слое не находятся над атомами ни в одном из первых двух слоев (т.е.е., третий слой относится к типу C), а наложение состоит из чередующихся плотно упакованных слоев типа A, типа B и типа C (т. е. ABCABCABC). Около двух третей всех металлов кристаллизуются в плотноупакованных массивах с координационным числом 12. Металлы, которые кристаллизуются в структуре HCP, включают Cd, Co, Li, Mg, Na и Zn, а металлы, которые кристаллизуются в структуре CCP, включают Ag , Al, Ca, Cu, Ni, Pb и Pt.
В обоих типах второй слой (B) размещается на первом слое (A), так что каждый атом во втором слое контактирует с тремя атомами в первом слое. Третий слой размещается одним из двух способов. В HCP атомы в третьем слое находятся непосредственно над атомами в первом слое (т.е. третий слой также относится к типу A), а наложение состоит из чередующихся плотноупакованных слоев типа A и типа B (то есть ABABAB). В CCP атомы в третьем слое не находятся над атомами ни в одном из первых двух слоев (т.е.е., третий слой относится к типу C), а наложение состоит из чередующихся плотно упакованных слоев типа A, типа B и типа C (т. е. ABCABCABC). Около двух третей всех металлов кристаллизуются в плотноупакованных массивах с координационным числом 12. Металлы, которые кристаллизуются в структуре HCP, включают Cd, Co, Li, Mg, Na и Zn, а металлы, которые кристаллизуются в структуре CCP, включают Ag , Al, Ca, Cu, Ni, Pb и Pt.
 Гексагональная плотнейшая упаковка состоит из двух чередующихся слоев (ABABAB…). Плотнейшая кубическая упаковка состоит из трех чередующихся слоев (ABCABCABC…).
Гексагональная плотнейшая упаковка состоит из двух чередующихся слоев (ABABAB…). Плотнейшая кубическая упаковка состоит из трех чередующихся слоев (ABCABCABC…).Пример 2
Расчет атомного радиуса и плотности металлов, часть 2
Кальций кристаллизуется в гранецентрированной кубической структуре. Длина ребра его элементарной ячейки составляет 558,8 пм.
(а) Каков атомный радиус Са в этой структуре?
(b) Рассчитайте плотность Ca.
Решение
(a) В структуре ГЦК атомы Са контактируют друг с другом по диагонали грани, поэтому длина диагонали равна четырем атомным радиусам Са (d = 4 r ).2} {16}} = 197,6 \; \ text {pmg \; для \; a \; Ca \; radius} [/ latex].
(b) Плотность определяется как [латекс] \ text {density} = \ frac {\ text {mass}} {\ text {volume}} [/ latex]. Плотность кальция можно определить, определив плотность его элементарной ячейки: например, массу, содержащуюся в элементарной ячейке, деленную на объем элементарной ячейки. Гранецентрированная элементарная ячейка Са имеет по одной восьмой атома в каждом из восьми углов ([латекс] 8 \; \ times \; \ frac {1} {8} = 1 [/ латекс] атом) и один — половина атома на каждой из шести граней [латекс] 6 \; \ times \; \ frac {1} {2} = 3 [/ latex]), всего четыре атома в элементарной ячейке.3 [/ латекс]
Гранецентрированная элементарная ячейка Са имеет по одной восьмой атома в каждом из восьми углов ([латекс] 8 \; \ times \; \ frac {1} {8} = 1 [/ латекс] атом) и один — половина атома на каждой из шести граней [латекс] 6 \; \ times \; \ frac {1} {2} = 3 [/ latex]), всего четыре атома в элементарной ячейке.3 [/ латекс]
Проверьте свои знания
Серебро кристаллизуется в структуре FCC. Длина ребра его элементарной ячейки 409 мкм.
(а) Каков атомный радиус Ag в этой структуре?
(b) Рассчитайте плотность Ag.
Ответ:
(а) 144 пм; (б) 10,5 г / см 3
В общем случае элементарная ячейка определяется длиной трех осей ( a , b и c ) и углами ( α , β и γ ) между ними, как проиллюстрировано на рисунке 10.Оси определяются как длины между точками пространственной решетки. Следовательно, оси элементарной ячейки соединяют точки с идентичной средой.
Рис. 10. Элементарная ячейка определяется длиной трех ее осей ( a , b и c ) и углами ( α , β и γ ) между топоры.
10. Элементарная ячейка определяется длиной трех ее осей ( a , b и c ) и углами ( α , β и γ ) между топоры.Существует семь различных систем решеток, некоторые из которых имеют более одного типа решетки, всего четырнадцать различных элементарных ячеек, которые имеют форму, показанную на рисунке 11.
Рис. 11. Существует семь различных систем решеток и 14 различных элементарных ячеек.Ионные кристаллы состоят из двух или более различных типов ионов, которые обычно имеют разные размеры. Упаковка этих ионов в кристаллическую структуру более сложна, чем упаковка атомов металла того же размера.
Большинство одноатомных ионов ведут себя как заряженные сферы, и их притяжение для ионов противоположного заряда одинаково во всех направлениях. Следовательно, стабильные структуры для ионных соединений возникают (1), когда ионы одного заряда окружены как можно большим количеством ионов противоположного заряда, и (2) когда катионы и анионы контактируют друг с другом. Структуры определяются двумя основными факторами: относительными размерами ионов и соотношением количества положительных и отрицательных ионов в соединении.
Структуры определяются двумя основными факторами: относительными размерами ионов и соотношением количества положительных и отрицательных ионов в соединении.
В простых ионных структурах мы обычно находим анионы, которые обычно больше, чем катионы, расположенные в виде плотнейшей упаковки. (Как было замечено ранее, дополнительные электроны, притянутые к одному и тому же ядру, делают анионы больше, а меньшее количество электронов, притягиваемых к тому же ядру, делает катионы меньше по сравнению с атомами, из которых они образованы.Катионы меньшего размера обычно занимают один из двух типов лунок, (или пустот), оставшихся между анионами. Меньшее из отверстий находится между тремя анионами в одной плоскости и одним анионом в соседней плоскости. Четыре аниона, окружающие это отверстие, расположены по углам тетраэдра, поэтому отверстие называется тетраэдрическим отверстием и . Дыра большего размера находится в центре шести анионов (три в одном слое и три в соседнем слое), расположенных в углах октаэдра; это называется октаэдрическим отверстием . На рисунке 12 показаны оба этих типа отверстий.
На рисунке 12 показаны оба этих типа отверстий.
В зависимости от относительных размеров катионов и анионов, катионы ионного соединения могут занимать тетраэдрические или октаэдрические дырки, как показано на рисунке 13. Относительно небольшие катионы занимают тетраэдрические дырки, а более крупные катионы занимают октаэдрические дырки. Если катионы слишком велики, чтобы поместиться в октаэдрические отверстия, анионы могут принять более открытую структуру, такую как простой кубический массив.Тогда более крупные катионы могут занять большие кубические отверстия, что стало возможным благодаря более открытому пространству.
Рис. 13. Размер катиона и форма отверстия, занимаемого соединением, напрямую связаны. Есть две тетраэдрические дырки для каждого аниона в массиве анионов HCP или CCP. Соединение, которое кристаллизуется в виде плотноупакованного массива анионов с катионами в тетраэдрических отверстиях, может иметь максимальное соотношение катион: анион 2: 1; все тетраэдрические отверстия заполнены при этом соотношении. Примеры включают Li 2 O, Na 2 O, Li 2 S и Na 2 S. Соединения с соотношением менее 2: 1 также могут кристаллизоваться в виде плотноупакованного массива анионов с катионами. в тетраэдрических отверстиях, если подходят ионные размеры. Однако в этих соединениях часть тетраэдрических дырок остается вакантной.
Примеры включают Li 2 O, Na 2 O, Li 2 S и Na 2 S. Соединения с соотношением менее 2: 1 также могут кристаллизоваться в виде плотноупакованного массива анионов с катионами. в тетраэдрических отверстиях, если подходят ионные размеры. Однако в этих соединениях часть тетраэдрических дырок остается вакантной.
Пример 3
Заполнение четырехгранных отверстий
Сульфид цинка является важным промышленным источником цинка, а также используется в качестве белого пигмента в красках.Сульфид цинка кристаллизуется с ионами цинка, занимающими половину тетраэдрических дырок в плотноупакованном массиве сульфид-ионов. Какая формула сульфида цинка?
Раствор
Поскольку на каждый анион (сульфид-ион) приходится две тетраэдрических дырки и половина этих дырок занята ионами цинка, должен быть [латекс] \ frac {1} {2} \; \ times \; 2 [/ латекс], или 1 ион цинка на ион сульфида. Таким образом, формула ZnS.
Проверьте свои знания
Селенид лития можно описать как плотнейшую упаковку ионов селенида с ионами лития во всех тетраэдрических отверстиях.Какая у него формула селенида лития?
Отношение октаэдрических дырок к анионам в структуре HCP или CCP составляет 1: 1. Таким образом, соединения с катионами в октаэдрических дырках в плотноупакованном массиве анионов могут иметь максимальное соотношение катион: анион 1: 1. Например, в NiO, MnS, NaCl и KH все октаэдрические отверстия заполнены. Отношения менее 1: 1 наблюдаются, когда некоторые из октаэдрических отверстий остаются пустыми.
Пример 4
Стехиометрия ионных соединений
Сапфир — это оксид алюминия.Оксид алюминия кристаллизуется с ионами алюминия в двух третях октаэдрических отверстий в плотноупакованном массиве оксидных ионов. Какая формула у оксида алюминия?
Раствор
Поскольку на каждый анион (оксидный ион) приходится одна октаэдрическая дырка и только две трети этих дырок заняты, отношение алюминия к кислороду должно быть [латекс] \ frac {2} {3}: 1 [ / latex], что даст [латекс] \ text {Al} _ {2/3} \ text {O} [/ latex]. Простейшее целочисленное отношение 2: 3, поэтому формула Al 2 O 3 .
Простейшее целочисленное отношение 2: 3, поэтому формула Al 2 O 3 .
Проверьте свои знания
Белый пигмент оксида титана кристаллизуется с ионами титана в половине октаэдрических отверстий в плотноупакованном массиве оксидных ионов. Какая формула оксида титана?
В простом кубическом массиве анионов есть одно кубическое отверстие, которое может быть занято катионом для каждого аниона в массиве. В CsCl и других соединениях с такой же структурой все кубические дырки заняты. Половина кубических дырок занята в SrH 2 , UO 2 , SrCl 2 и CaF 2 .
Различные типы ионных соединений часто кристаллизуются в одной и той же структуре, если относительные размеры их ионов и их стехиометрия (две основные характеристики, определяющие структуру) схожи.
Многие ионные соединения кристаллизуются с кубическими элементарными ячейками, и мы будем использовать эти соединения, чтобы описать общие особенности ионных структур.
Когда ионное соединение состоит из катионов и анионов одинакового размера в соотношении 1: 1, оно обычно образует простую кубическую структуру.Примером этого является хлорид цезия, CsCl (проиллюстрированный на рисунке 14), при этом Cs + и Cl — имеют радиусы 174 и 181 мкм соответственно. Мы можем представить это как ионы хлорида, образующие простую кубическую элементарную ячейку с ионом цезия в центре; или в виде ионов цезия, образующих элементарную ячейку с ионом хлорида в центре; или как простые кубические элементарные ячейки, образованные ионами Cs + , перекрывающими элементарные ячейки, образованные ионами Cl — . Ионы цезия и ионы хлора соприкасаются по диагоналям тела элементарных ячеек.Один ион цезия и один ион хлорида присутствуют в элементарной ячейке, что дает стехиометрию 1: 1, требуемую формулой для хлорида цезия. Обратите внимание, что в центре ячейки нет точки решетки, и CsCl не является структурой BCC, потому что ион цезия не идентичен иону хлорида.
Мы сказали, что расположение точек решетки произвольно. Это иллюстрируется альтернативным описанием структуры CsCl, в которой узлы решетки расположены в центрах ионов цезия. В этом описании ионы цезия расположены в точках решетки в углах ячейки, а ион хлорида расположен в центре ячейки. Две элементарные ячейки разные, но они описывают идентичные структуры.
Когда ионное соединение состоит из катионов и анионов в соотношении 1: 1, которые значительно различаются по размеру, оно обычно кристаллизуется с помощью элементарной ячейки FCC, как показано на рисунке 15.Примером этого является хлорид натрия, NaCl, причем Na + и Cl — имеют радиусы 102 и 181 мкм соответственно. Мы можем представить это как ионы хлора, образующие ячейку FCC, причем ионы натрия расположены в октаэдрических отверстиях в середине краев ячейки и в центре ячейки. Ионы натрия и хлора соприкасаются друг с другом по краям ячейки. Элементарная ячейка содержит четыре иона натрия и четыре иона хлорида, что дает стехиометрию 1: 1, требуемую формулой NaCl.
Ионы натрия и хлора соприкасаются друг с другом по краям ячейки. Элементарная ячейка содержит четыре иона натрия и четыре иона хлорида, что дает стехиометрию 1: 1, требуемую формулой NaCl.
Кубическая форма сульфида цинка, цинковая обманка, также кристаллизуется в элементарной ячейке FCC, как показано на рисунке 16. Эта структура содержит ионы сульфида в узлах решетки решетки FCC. (Расположение сульфид-ионов идентично расположению хлорид-ионов в хлориде натрия.) Радиус иона цинка составляет всего около 40% от радиуса сульфид-иона, поэтому эти маленькие ионы Zn 2+ расположены в чередующихся тетраэдрических дырках, то есть в одной половине тетраэдрических дырок. В элементарной ячейке четыре иона цинка и четыре иона сульфида, что дает эмпирическую формулу ZnS.
Элементарная ячейка с фторидом кальция, подобная той, что показана на рисунке 17, также является элементарной ячейкой FCC, но в этом случае катионы расположены в точках решетки; эквивалентные ионы кальция расположены в узлах решетки ГЦК-решетки. Все тетраэдрические позиции в массиве ГЦК ионов кальция заняты ионами фтора. В элементарной ячейке четыре иона кальция и восемь ионов фтора, что дает соотношение кальций: фтор 1: 2 в соответствии с химической формулой CaF 2 . Внимательное изучение рисунка 17 покажет простой кубический массив ионов фтора с ионами кальция в одной половине кубических дырок.Структура не может быть описана в терминах пространственной решетки точек на фторид-ионах, потому что не все фторид-ионы имеют одинаковое окружение. Ориентация четырех ионов кальция относительно ионов фтора различается.
Ориентация четырех ионов кальция относительно ионов фтора различается.
Если мы знаем длину края элементарной ячейки ионного соединения и положение ионов в ячейке, мы можем вычислить ионные радиусы для ионов в соединении, если мы сделаем предположения об индивидуальных формах ионов и контактах.
Пример 5
Расчет ионных радиусов
Длина края элементарной ячейки LiCl (NaCl-подобная структура, FCC) составляет 0,514 нм или 5,14 Å. Предполагая, что ион лития достаточно мал, чтобы ионы хлора контактировали, как показано на рисунке 15, рассчитайте ионный радиус для иона хлорида.
Примечание. Единица измерения длины, Å, часто используется для представления размеров в атомном масштабе и эквивалентна 10 −10 м.
Раствор
На лицевой стороне элементарной ячейки LiCl ионы хлора контактируют друг с другом по диагонали грани:
Рисуя прямоугольный треугольник на поверхности элементарной ячейки, мы видим, что длина диагонали равна четырем радиусам хлорида (один радиус от каждого углового хлорида и один диаметр, равный двум радиусам, от иона хлорида в центре). грани), поэтому d = 4 r .{-} \; \ text {радиус} [/ латекс].
грани), поэтому d = 4 r .{-} \; \ text {радиус} [/ латекс].
Проверьте свои знания
Длина края элементарной ячейки KCl (NaCl-подобная структура, FCC) составляет 6,28 Å. Предполагая, что анион-катионный контакт проходит по краю ячейки, рассчитайте радиус иона калия. Радиус иона хлорида составляет 1,82 Å.
Ответ:
Радиус иона калия 1,33 Å.
Важно понимать, что значения ионных радиусов, рассчитанные из длин краев элементарных ячеек, зависят от множества предположений, таких как идеальная сферическая форма для ионов, которые в лучшем случае являются приблизительными.Следовательно, такие расчетные значения сами по себе являются приблизительными, и сравнения нельзя зайти слишком далеко. Тем не менее, этот метод оказался полезным для расчета ионных радиусов на основе экспериментальных измерений, таких как рентгеновские кристаллографические определения.
Размер элементарной ячейки и расположение атомов в кристалле можно определить из измерений дифракции рентгеновских лучей на кристалле, называемых рентгеновской кристаллографией . Дифракция — это изменение направления движения, испытываемое электромагнитной волной, когда она встречает физический барьер, размеры которого сопоставимы с размерами длины волны света.Рентгеновские лучи — это электромагнитное излучение с длиной волны, равной расстоянию между соседними атомами в кристаллах (порядка нескольких Å).
Дифракция — это изменение направления движения, испытываемое электромагнитной волной, когда она встречает физический барьер, размеры которого сопоставимы с размерами длины волны света.Рентгеновские лучи — это электромагнитное излучение с длиной волны, равной расстоянию между соседними атомами в кристаллах (порядка нескольких Å).
Когда пучок монохроматических рентгеновских лучей попадает на кристалл, его лучи рассеиваются во всех направлениях атомами внутри кристалла. Когда рассеянные волны, распространяющиеся в одном направлении, сталкиваются друг с другом, они претерпевают интерференцию , процесс, посредством которого волны объединяются, приводя к увеличению или уменьшению амплитуды (интенсивности) в зависимости от степени, в которой максимумы объединяющихся волн находятся разделены (см. рисунок 18).
Рис. 18. Световые волны, занимающие одно и то же пространство, испытывают интерференцию, объединяясь, давая волны большей (а) или меньшей (б) интенсивности, в зависимости от разделения их максимумов и минимумов.
Когда рентгеновские лучи определенной длины волны, λ , рассеиваются атомами в соседних кристаллических плоскостях, разделенных расстоянием, d , они могут претерпевать конструктивную интерференцию, когда разница между расстояниями, пройденными двумя волнами до их комбинация представляет собой целочисленный множитель длины волны n .Это условие выполняется, когда угол дифрагированного луча, θ , связан с длиной волны и межатомным расстоянием уравнением:
[латекс] n {\ lambda} = 2d \; \ text {sin} \; {\ theta} [/ latex]
Это соотношение известно как уравнение Брэгга в честь У. Х. Брэгга , английского физика, который первым объяснил это явление. На рисунке 19 показаны два примера дифрагированных волн от одних и тех же двух плоскостей кристалла. На рисунке слева изображены волны, дифрагированные под углом Брэгга, приводящие к конструктивной интерференции, а на рисунке справа показаны дифракция и другой угол, который не удовлетворяет условию Брэгга, что приводит к деструктивной интерференции.
Посетите этот сайт, чтобы получить более подробную информацию об уравнении Брэгга и симуляторе, который позволяет исследовать влияние каждой переменной на интенсивность дифрагированной волны.
Рентгеновский дифрактометр, такой как показанный на рисунке 20, может использоваться для измерения углов, под которыми рентгеновские лучи дифрагируют при взаимодействии с кристаллом, как описано ранее. Из таких измерений можно использовать уравнение Брэгга для вычисления расстояний между атомами, как показано в следующем примере упражнения.
Рис. 20. (a) В дифрактометре луч рентгеновских лучей попадает на кристаллический материал, создавая (b) картину дифракции рентгеновских лучей, которая может быть проанализирована для определения кристаллической структуры.
Пример 6
Использование уравнения Брэгга
В дифрактометре рентгеновские лучи с длиной волны 0,1315 нм использовались для получения дифракционной картины для меди. Дифракция первого порядка ( n = 1) произошла под углом θ = 25,25 °. Определите расстояние между дифрагирующими плоскостями в меди.
Решение
Расстояние между плоскостями находится путем решения уравнения Брэгга, nλ = 2 d sin θ , для d .{\ circ})} = 0,154 \; \ text {nm} [/ latex]
Проверьте свои знания
Кристалл с расстоянием между плоскостями, равным 0,394 нм, дифрагирует рентгеновские лучи с длиной волны 0,147 нм. Каков угол дифракции первого порядка?
Рентгеновский кристаллограф Розалинд Франклин
Открытие структуры ДНК в 1953 году Фрэнсисом Криком и Джеймсом Уотсоном является одним из величайших достижений в истории науки.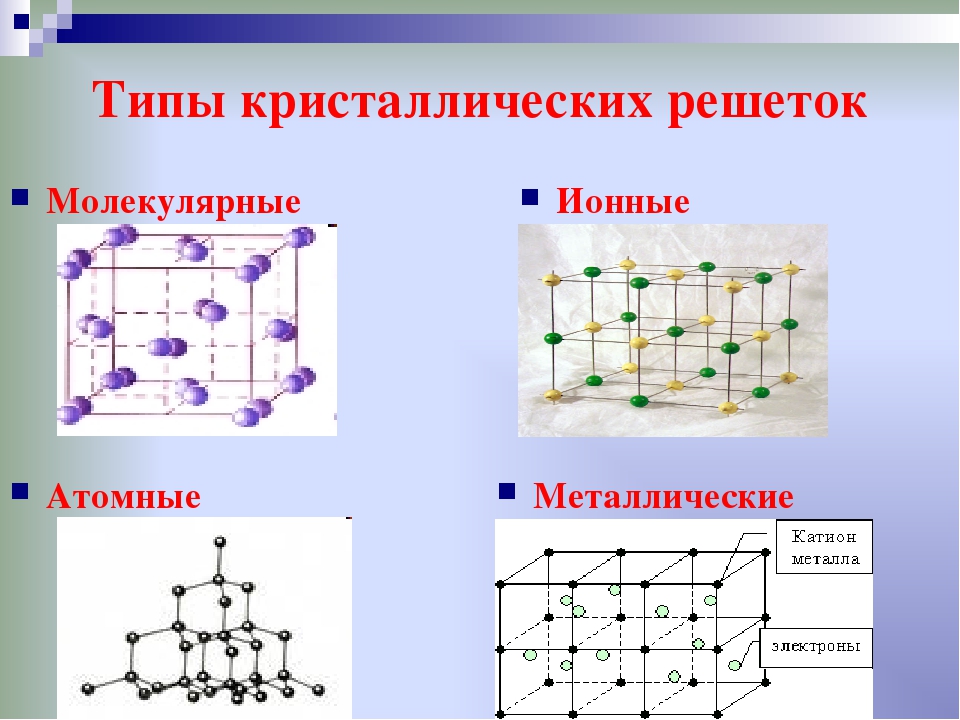 Они были удостоены Нобелевской премии по физиологии и медицине 1962 года вместе с Морисом Уилкинсом , предоставившим экспериментальное доказательство структуры ДНК.Британский химик Розалинд Франклин внесла неоценимый вклад в это грандиозное достижение благодаря своей работе по измерению рентгеновских дифракционных изображений ДНК. В начале своей карьеры исследования Франклин структуры углей оказались полезными для британских военных действий. В начале 1950-х годов Франклин и докторант Реймонд Гослинг переключили свое внимание на биологические системы и обнаружили, что ДНК состоит из двух форм: длинного тонкого волокна, образующегося при намокании (тип «B»), и короткого широкого волокна, образующегося при сушке ( наберите «А»).Ее рентгеновские дифракционные изображения ДНК (рис. 21) предоставили важную информацию, которая позволила Уотсону и Крику подтвердить, что ДНК образует двойную спираль, и определить детали ее размера и структуры. Франклин также провел новаторское исследование вирусов и РНК, содержащей их генетическую информацию, обнаружив новую информацию, которая радикально изменила совокупность знаний в этой области.
Они были удостоены Нобелевской премии по физиологии и медицине 1962 года вместе с Морисом Уилкинсом , предоставившим экспериментальное доказательство структуры ДНК.Британский химик Розалинд Франклин внесла неоценимый вклад в это грандиозное достижение благодаря своей работе по измерению рентгеновских дифракционных изображений ДНК. В начале своей карьеры исследования Франклин структуры углей оказались полезными для британских военных действий. В начале 1950-х годов Франклин и докторант Реймонд Гослинг переключили свое внимание на биологические системы и обнаружили, что ДНК состоит из двух форм: длинного тонкого волокна, образующегося при намокании (тип «B»), и короткого широкого волокна, образующегося при сушке ( наберите «А»).Ее рентгеновские дифракционные изображения ДНК (рис. 21) предоставили важную информацию, которая позволила Уотсону и Крику подтвердить, что ДНК образует двойную спираль, и определить детали ее размера и структуры. Франклин также провел новаторское исследование вирусов и РНК, содержащей их генетическую информацию, обнаружив новую информацию, которая радикально изменила совокупность знаний в этой области. После развития рака яичников Франклин продолжала работать до своей смерти в 1958 году в возрасте 37 лет. Среди множества посмертных признаний ее работы, Чикагская медицинская школа Финчского университета медицинских наук изменила свое название на Университет медицины и науки Розалинды Франклин в 2004 году. и приняла изображение ее знаменитого рентгеновского дифракционного изображения ДНК в качестве официального логотипа университета.
После развития рака яичников Франклин продолжала работать до своей смерти в 1958 году в возрасте 37 лет. Среди множества посмертных признаний ее работы, Чикагская медицинская школа Финчского университета медицинских наук изменила свое название на Университет медицины и науки Розалинды Франклин в 2004 году. и приняла изображение ее знаменитого рентгеновского дифракционного изображения ДНК в качестве официального логотипа университета.
Структуры кристаллических металлов и простых ионных соединений можно описать в терминах упаковки сфер. Атомы металла могут упаковываться в гексагональные структуры с плотнейшей упаковкой, кубические структуры с плотнейшей упаковкой, объемно-центрированные структуры и простые кубические структуры. Анионы в простых ионных структурах обычно принимают одну из этих структур, а катионы занимают пространства, оставшиеся между анионами. Маленькие катионы обычно занимают тетраэдрические дырки в плотноупакованном массиве анионов. Катионы большего размера обычно занимают октаэдрические отверстия. Катионы еще большего размера могут занимать кубические дырки в простом кубическом массиве анионов. Структуру твердого тела можно описать, указав размер и форму элементарной ячейки и ее содержимое. Тип структуры и размеры элементарной ячейки могут быть определены путем измерения дифракции рентгеновских лучей.
Маленькие катионы обычно занимают тетраэдрические дырки в плотноупакованном массиве анионов. Катионы большего размера обычно занимают октаэдрические отверстия. Катионы еще большего размера могут занимать кубические дырки в простом кубическом массиве анионов. Структуру твердого тела можно описать, указав размер и форму элементарной ячейки и ее содержимое. Тип структуры и размеры элементарной ячейки могут быть определены путем измерения дифракции рентгеновских лучей.
- [латекс] n {\ lambda} = 2d \; \ text {sin} \; {\ theta} [/ latex]
Химия: упражнения в конце главы
- Опишите кристаллическую структуру железа, которое кристаллизуется с двумя эквивалентными атомами металла в кубической элементарной ячейке.
- Опишите кристаллическую структуру Pt, которая кристаллизуется с четырьмя эквивалентными атомами металла в кубической элементарной ячейке.
- Какое координационное число атома хрома в объемноцентрированной кубической структуре хрома?
- Какое координационное число атома алюминия в гранецентрированной кубической структуре алюминия?
- Металлический кобальт кристаллизуется в гексагональной плотноупакованной структуре.
 Какое координационное число атома кобальта?
Какое координационное число атома кобальта? - Металлический никель кристаллизуется в кубической плотноупакованной структуре.Какое координационное число атома никеля?
- Вольфрам кристаллизуется в объемно-центрированной кубической элементарной ячейке с длиной ребра 3,165 Å.
(а) Каков атомный радиус вольфрама в этой структуре?
(б) Рассчитайте плотность вольфрама.
- Платина (атомный радиус = 1,38 Å) кристаллизуется в кубической плотноупакованной структуре. Рассчитайте длину кромки гранецентрированной кубической элементарной ячейки и плотность платины.
- Барий кристаллизуется в объемноцентрированной кубической элементарной ячейке с длиной ребра 5.025 Å
(а) Каков атомный радиус бария в этой структуре?
(б) Рассчитайте плотность бария.
- Алюминий (атомный радиус 1,43 Å) кристаллизуется в кубической плотноупакованной структуре. Рассчитайте длину ребра гранецентрированной кубической элементарной ячейки и плотность алюминия.

- Плотность алюминия 2,7 г / см 3 ; кремния 2,3 г / см 3 . Объясните, почему Si имеет более низкую плотность, хотя в нем более тяжелые атомы.
- Свободное пространство в металле может быть найдено путем вычитания объема атомов в элементарной ячейке из объема ячейки. Вычислите процент свободного пространства в каждой из трех кубических решеток, если все атомы в каждой имеют одинаковый размер и касаются своих ближайших соседей. Какая из этих структур представляет собой наиболее эффективную упаковку? То есть в каких упаковках меньше всего неиспользуемого места?
- Сульфид кадмия, иногда используемый художниками в качестве желтого пигмента, кристаллизуется с кадмием, занимая половину тетраэдрических отверстий в плотно упакованном массиве сульфид-ионов.Какая формула сульфида кадмия? Поясните свой ответ.
- Соединение кадмия, олова и фосфора используется в производстве некоторых полупроводников. Он кристаллизуется с кадмием, занимающим одну четверть тетраэдрических дырок, и оловом, занимающим одну четверть тетраэдрических дырок в плотно упакованном массиве фосфид-ионов.
 Какая формула соединения? Поясните свой ответ.
Какая формула соединения? Поясните свой ответ. - Какова формула магнитного оксида кобальта, используемого в записывающих лентах, который кристаллизуется с атомами кобальта, занимающими одну восьмую тетраэдрических дырок и половину октаэдрических дырок в плотно упакованном массиве оксидных ионов?
- Соединение, содержащее цинк, алюминий и серу, кристаллизуется с плотнейшей упаковкой сульфид-ионов.Ионы цинка находятся в одной восьмой тетраэдрических дырок, а ионы алюминия — в половине октаэдрических дырок. Какова эмпирическая формула соединения?
- Соединение таллия и йода кристаллизуется в виде простого кубического массива иодид-ионов с ионами таллия во всех кубических дырках. Какая формула этого йодида? Поясните свой ответ.
- Какой из следующих элементов реагирует с серой с образованием твердого тела, в котором атомы серы образуют плотноупакованный массив со всеми занятыми октаэдрическими дырками: Li, Na, Be, Ca или Al?
- Каков массовый процент титана в рутиле, минерале, содержащем титан и кислород, если структуру можно описать как плотно упакованный массив оксидных ионов с ионами титана в половине октаэдрических отверстий? Какова степень окисления титана?
- Объясните, почему химически похожие хлориды щелочных металлов NaCl и CsCl имеют разную структуру, тогда как химически разные NaCl и MnS имеют одинаковую структуру.

- Поскольку минералы образовались из расплавленной магмы, разные ионы занимали одни и те же участки в кристаллах. Литий часто встречается вместе с магнием в минералах, несмотря на разницу в заряде их ионов. Предложите объяснение.
- Иодид рубидия кристаллизуется с кубической элементарной ячейкой, содержащей иодид-ионы по углам и ион рубидия в центре. Какая формула соединения?
- Один из различных оксидов марганца кристаллизуется с кубической элементарной ячейкой, содержащей ионы марганца по углам и в центре.Ионы оксида расположены в центре каждого края элементарной ячейки. Какая формула соединения?
- NaH кристаллизуется с той же кристаллической структурой, что и NaCl. Длина ребра кубической элементарной ячейки NaH составляет 4,880 Å.
(a) Рассчитайте ионный радиус H — . (Ионный радиус Li + составляет 0,0,95 Å.)
(b) Рассчитайте плотность NaH.
- Иодид таллия (I) кристаллизуется с той же структурой, что и CsCl.
 Длина ребра элементарной ячейки TlI равна 4.20 Å. Вычислите ионный радиус TI + . (Ионный радиус I — составляет 2,16 Å.)
Длина ребра элементарной ячейки TlI равна 4.20 Å. Вычислите ионный радиус TI + . (Ионный радиус I — составляет 2,16 Å.) - Кубическая элементарная ячейка содержит ионы марганца по углам и ионы фтора в центре каждого края.
(а) Какова эмпирическая формула этого соединения? Поясните свой ответ.
(б) Каково координационное число иона Mn 3+ ?
(c) Рассчитайте длину края элементарной ячейки, если радиус иона Mn 3+ составляет 0,65 A.
(d) Рассчитайте плотность соединения.
- Каково расстояние между плоскостями кристалла, которые дифрагируют рентгеновские лучи с длиной волны 1,541 нм под углом θ 15,55 ° (отражение первого порядка)?
- Дифрактометр, использующий рентгеновские лучи с длиной волны 0,2287 нм, дает пик дифракции первого порядка для угла кристалла θ = 16,21 °. Определите расстояние между дифрагирующими плоскостями в этом кристалле.
- Металл с расстоянием между плоскостями 0,4164 нм дифрагирует рентгеновские лучи с длиной волны 0.
 2879 нм. Каков угол дифракции для дифракционного пика первого порядка?
2879 нм. Каков угол дифракции для дифракционного пика первого порядка? - Золото кристаллизуется в кубической гранецентрированной элементарной ячейке. Отражение второго порядка (n = 2) рентгеновских лучей для плоскостей, составляющих вершину и основание элементарных ячеек, находится при θ = 22,20 °. Длина волны рентгеновского излучения составляет 1,54 Å. Какова плотность металлического золота?
- Когда электрон в возбужденном атоме молибдена падает с L на K-оболочку, испускается рентгеновское излучение. Эти рентгеновские лучи дифрагируют под углом 7.75 ° плоскостями с расстоянием 2,64 Å. Какова разница в энергии между K-оболочкой и L-оболочкой в молибдене в предположении дифракции первого порядка?
Глоссарий
- объемно-центрированная кубическая (ОЦК) твердое тело
- Кристаллическая структура, которая имеет кубическую элементарную ячейку с точками решетки по углам и в центре ячейки
- объемно-центрированная кубическая элементарная ячейка
- простейший повторяющийся элемент объемно-центрированного кубического кристалла; это куб, содержащий точки решетки в каждом углу и в центре куба
- Уравнение Брэгга
- Уравнение, связывающее углы, под которыми рентгеновские лучи дифрагируют на атомах внутри кристалла
- координационный номер
- Число атомов, ближайших к любому данному атому в кристалле или к центральному атому металла в комплексе
- плотнейшая кубическая упаковка (ПГУ)
- Кристаллическая структура, в которой плоскости плотно упакованных атомов или ионов уложены в виде серии из трех чередующихся слоев с различной относительной ориентацией (ABC)
- дифракция
- перенаправление электромагнитного излучения, возникающее при столкновении с физическим барьером соответствующих размеров
- гранецентрированный кубический (FCC) твердый
- Кристаллическая структура, состоящая из кубической элементарной ячейки с точками решетки по углам и в центре каждой грани
- элементарная гранецентрированная кубическая ячейка
- простейший повторяющийся элемент гранецентрированного кубического кристалла; это куб, содержащий точки решетки в каждом углу и в центре каждой грани
- Гексагональная плотная упаковка (HCP)
- Кристаллическая структура, в которой плотно упакованные слои атомов или ионов уложены в виде серии из двух чередующихся слоев с различной относительной ориентацией (AB)
- отверстие
- (также межузельное пространство) пространство между атомами внутри кристалла
- изоморфный
- с такой же кристаллической структурой
- восьмигранное отверстие
- открытое пространство в кристалле в центре из шести частиц, расположенных по углам октаэдра
- простая кубическая элементарная ячейка
- (также примитивная кубическая элементарная ячейка) элементарная ячейка в простой кубической структуре
- простая кубическая структура
- Кристаллическая структура с кубической элементарной ячейкой с узлами решетки только по углам
- пространственная решетка
- все точки в кристалле, которые имеют идентичное окружение
- четырехгранное отверстие
- тетраэдрическое пространство, образованное четырьмя атомами или ионами в кристалле
- элементарная ячейка
- наименьшая часть пространственной решетки, которая повторяется в трех измерениях, образуя всю решетку
- Рентгеновская кристаллография
- экспериментальный метод определения расстояний между атомами в кристалле путем измерения углов, под которыми рентгеновские лучи дифрагируют при прохождении через кристалл
Решения
Ответы на упражнения в конце главы по химии
1. Структура этой низкотемпературной формы железа (ниже 910 ° C) является объемно-центрированной кубической. В каждом из восьми углов куба находится по одной восьмой атома, а в центре куба — по одному атому.
Структура этой низкотемпературной формы железа (ниже 910 ° C) является объемно-центрированной кубической. В каждом из восьми углов куба находится по одной восьмой атома, а в центре куба — по одному атому.
3. восемь
5. 12
7. (а) 1,370 Å; (б) 19,26 г / см
9. (а) 2,176 Å; (б) 3,595 г / см 3
11. Кристаллическая структура Si показывает, что он менее плотно упакован (координационное число 4) в твердом теле, чем Al (координационное число 12).
13.В наиболее плотно упакованном массиве для каждого аниона существуют две тетраэдрические дырки. Если занята только половина тетраэдрических дырок, количество анионов и катионов равно. Формула сульфида кадмия — CdS.
15. Co 3 O 4
17. В простом кубическом массиве только одно кубическое отверстие может быть занято катионом для каждого аниона в массиве. Соотношение таллия и йодида должно быть 1: 1; следовательно, формула таллия — TlI.
19 59,95%; Степень окисления титана +4.
21. Оба иона близки по размеру: Mg 0,65; Ли 0,60. Это сходство позволяет им довольно легко обмениваться друг с другом. Разница в заряде обычно компенсируется переключателем Si 4+ на Al 3+ .
23. Mn 2 O 3
25. 1,48 Å
27. 2,874 Å
29. 20.2 °
31. 1,74 × 10 4 эВ
Кристаллическая решетка: определение и структура — видео и стенограмма урока
Структура кристаллической решетки
Когда мы смотрим на структуру кристаллической решетки, помните о схемах расположения каждой точки, а также об их симметрии.Участки кристаллической решетки просматриваются только под микроскопом и невидимы невооруженным глазом. Чтобы увидеть эти структуры, мы должны взять кристалл (твердый объект), поместить его под микроскоп и рассмотреть узлы кристаллической решетки.
Здесь показана структура кристаллической решетки. Вспомните, что кристаллическая решетка — это расположение атомов в кристалле (черные и белые точки на изображении — это ваши атомы).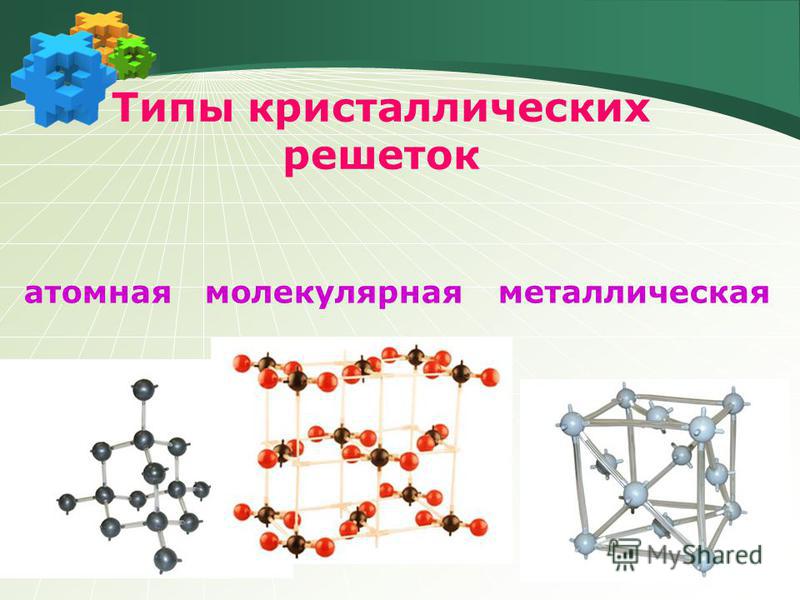 Такое расположение можно определить как пересечение трех параллельных плоскостей.Итак, если мы разрежем эту диаграмму на три части, вы увидите три разных плоскости. Когда эти плоскости пересекаются друг с другом, в результате получается трехмерная сеть с гранями. Думайте о каждом лице как о параллельном прямоугольнике.
Такое расположение можно определить как пересечение трех параллельных плоскостей.Итак, если мы разрежем эту диаграмму на три части, вы увидите три разных плоскости. Когда эти плоскости пересекаются друг с другом, в результате получается трехмерная сеть с гранями. Думайте о каждом лице как о параллельном прямоугольнике.
Симметрия
Вы же не думаете, что я забуду о симметрии нашего друга, не так ли? Конечно, нет; Фактически, эти коробки (или грани) вносят вклад в симметрию структуры кристаллической решетки.Каждый блок содержит информацию о симметрии, необходимую для обеспечения трансляционной кристаллической структуры.
Трансляционная симметрия возникает, когда объект перемещается (или перемещается) на определенное расстояние в определенном месте. Например, вы хотите построить деревянный пол с рисунком. Вы кладете один кусок дерева по диагонали через каждые 20 дюймов. Этот стиль дерева с определенным рисунком имеет определенное расстояние (20 дюймов) и направление (диагональ).
Вы кладете один кусок дерева по диагонали через каждые 20 дюймов. Этот стиль дерева с определенным рисунком имеет определенное расстояние (20 дюймов) и направление (диагональ).
Классификация
Кристаллические решетки можно разделить на одноатомные и многоатомные.Эта классификация основана на типе атомов, присутствующих на поверхности в решетчатой структуре. Если для создания грани (или прямоугольника) используется только один тип атома, это одноатомный . Многоатомная кристаллическая решетка содержит более одного типа атомов, используемых для создания грани.
Если мы посмотрим на структуру кристаллической решетки поваренной соли (NaCl) — решетка (а) и алмаза — решетка (б), мы увидим, что обе они имеют разные структуры решетки. Одно лицо в поваренной соли состоит из красных и зеленых точек.Это означает, что присутствует более одного типа атомов. Следовательно, эта структура многоатомна. В структуре алмазной решетки есть только одна цветная точка (синяя). Эта структура одноатомна.
Эта структура одноатомна.
Типы структур кристаллической решетки
Существует 14 различных типов кристаллических решеток. Каждый тип уникально описывает геометрическую симметрию кристалла.В частности, эти типы кристаллических решеток называются решетками Браве. Решетка Браве просто описывает разные типы трех разных решеток, которые могут быть созданы для данного кристалла.
Каждый из 14 типов решеток подразделяется на 7 кристаллических систем. Думайте о каждой системе как о группе структур кристаллической решетки (решетки Браве), которые однозначно описывают геометрическую симметрию кристалла. Приведены таблицы, в которых перечислены семь систем и их структуры.Если мы вернемся к нашему примеру с поваренной солью, как вы думаете, к какому типу кристаллической системы она принадлежит? Верно! Поваренная соль (NaCl) относится к системе кубической решетки.
Кристаллическая решетка является основой структуры твердого объекта.В следующий раз, когда вы будете поливать пищу солью или чистить этот сверкающий алмаз, помните об упорядоченной структуре кристаллической решетки, использованной для создания этого объекта.
Краткое содержание урока
Большинство твердых предметов содержат крошечные взаимосвязанные кристаллы. Кристалл представляет собой твердый материал, который содержит атомы или группы атомов, образующие высокоупорядоченную структуру. Эта структурная схема является трехмерной. Кристаллическая решетка описывает расположение этих атомов в кристалле и характеризуется трансляционной симметрией.Если на поверхности кристаллической решетки присутствует один тип атома, он называется одноатомным . Наличие более одного типа атомов означает, что структура решетки состоит из многоатомных атомов. Существует 14 различных типов кристаллических решеток, называемых решетками Браве . Каждая из этих решетчатых структур подразделяется на семь кристаллических систем.
Эта структурная схема является трехмерной. Кристаллическая решетка описывает расположение этих атомов в кристалле и характеризуется трансляционной симметрией.Если на поверхности кристаллической решетки присутствует один тип атома, он называется одноатомным . Наличие более одного типа атомов означает, что структура решетки состоит из многоатомных атомов. Существует 14 различных типов кристаллических решеток, называемых решетками Браве . Каждая из этих решетчатых структур подразделяется на семь кристаллических систем.
Ключевые термины для кристаллической решетки
- Кристалл : твердое вещество, содержащее атомы или группы атомов, расположенные в упорядоченной структуре
- Кристаллическая решетка : расположение атомов в кристаллических формах с трансляционной симметрией
- Одноатомный : только один тип атомов в решетке
- Многоатомный : более одного типа атомов в решетке
- Bravais Lattices : 7 кристаллических систем, состоящих из 14 различных типов кристаллических решеток
Результаты обучения
Завершите этот урок, чтобы успешно выполнить следующие задания:
- Опишите кристаллическую решетку
- Покажите, как формируются кристаллические решетки
- Деталь различных типов кристаллических решеток
Crystal: определение, типы, структура и свойства — видео и стенограмма урока
Типы кристаллов
Ковалентные кристаллы — это кристаллы, атомы которых связаны ковалентными связями. Ковалентные связи существуют там, где атомы разделяют электроны. Эти связи чрезвычайно прочные, и их очень трудно разорвать. Из-за этого сами кристаллы также очень прочные и имеют высокие температуры плавления. Представьте себе склеивание бусинок суперклеем. Супер клей — это ковалентная связь. Теперь подумайте о том, чтобы попытаться склеить бусинки вместе с помощью клея. Вероятно, они не очень хорошо держались бы вместе. Клей-карандаш аналогичен другому кристаллу, о котором мы поговорим позже. Примером ковалентного кристалла является алмаз, который является одним из самых твердых веществ, известных человеку.
Ковалентные связи существуют там, где атомы разделяют электроны. Эти связи чрезвычайно прочные, и их очень трудно разорвать. Из-за этого сами кристаллы также очень прочные и имеют высокие температуры плавления. Представьте себе склеивание бусинок суперклеем. Супер клей — это ковалентная связь. Теперь подумайте о том, чтобы попытаться склеить бусинки вместе с помощью клея. Вероятно, они не очень хорошо держались бы вместе. Клей-карандаш аналогичен другому кристаллу, о котором мы поговорим позже. Примером ковалентного кристалла является алмаз, который является одним из самых твердых веществ, известных человеку.
Ионные кристаллы — это кристаллы, атомы которых удерживаются вместе ионными или заряженными связями. С помощью этих ионных связей один атом заряжен отрицательно и притягивается к другим атомам в кристалле, которые заряжены положительно. Они расположены по схеме, основанной на начислениях. Эти кристаллы обычно твердые с высокой температурой плавления. Примером ионного кристалла является поваренная соль.
Примером ионного кристалла является поваренная соль.
Металлические кристаллы — это кристаллы, состоящие из металлических элементов.Эти кристаллы сверкают блестящим блеском, которое мы думаем о металлах. Они очень хорошо проводят тепло и электричество. Медь может быть извлечена из кристаллов меди для образования медного провода, используемого для передачи электричества в наших домах. Температура плавления этих кристаллов зависит от металла, используемого в кристалле. Золотые самородки — пример металлических кристаллов.
Молекулярные кристаллы — это кристаллы, образованные из слабых связей, называемых водородными связями. Это связано с тем, как крошечные заряженные частицы на атомах, называемые электронами, располагаются между разными атомами водорода.Эти связи очень слабые и аналогичны клею-карандашу, о котором мы говорили ранее. Из-за этого молекулярные кристаллы обычно имеют более низкие температуры плавления, чем другие кристаллы. Знакомый пример — это леденец, кристаллический леденец на палочке. Другими примерами являются кристаллы льда и сухой лед или замороженный диоксид углерода. Ученые используют молекулярные кристаллы для определения формы различных микроскопических белков внутри клеток.
Другими примерами являются кристаллы льда и сухой лед или замороженный диоксид углерода. Ученые используют молекулярные кристаллы для определения формы различных микроскопических белков внутри клеток.
Структура кристаллов
Кристаллы получают свою структуру благодаря тому, как атомы внутри них связываются вместе.Это приводит к появлению определенной формы по мере роста кристалла. Ученые используют форму и тип связей между атомами для классификации кристаллов. Кристаллические структуры обозначаются как кристаллических систем . Существует семь типов кристаллических систем, каждая из которых создает кристаллы разного вида. Первый тип — кубический кристалл. Кубические кристаллы имеют равные размеры сторон и имеют форму куба. Этот кристалл пирита, разновидность кубического кристалла, прикрепился к горной породе.
Гексагональные кристаллы имеют шесть сторон равной длины и два параллельных друг другу конца в форме шестиугольника. Тетрагональные кристаллы имеют вид прямоугольников. Есть также орторомбических кристаллов , которые не имеют прямоугольной формы, а выглядят как две пирамиды, соединенные вместе с цилиндром между ними. Тригональные кристаллы похожи друг на друга, но имеют форму двух пирамид, прикрепленных встык. Моноклинные кристаллы образуют призмы и триклинные кристаллы не имеют правильной геометрической формы, а образуют абстрактные формы.
Тетрагональные кристаллы имеют вид прямоугольников. Есть также орторомбических кристаллов , которые не имеют прямоугольной формы, а выглядят как две пирамиды, соединенные вместе с цилиндром между ними. Тригональные кристаллы похожи друг на друга, но имеют форму двух пирамид, прикрепленных встык. Моноклинные кристаллы образуют призмы и триклинные кристаллы не имеют правильной геометрической формы, а образуют абстрактные формы.
Резюме урока
Итак, кристалл — это любой твердый материал, атомы которого организованы в повторяющийся узор. Есть четыре типа кристаллов. Ковалентные кристаллы возникают, когда атомы образуют прочные ковалентные связи. Такие кристаллы, как и алмазы, очень прочные. Ионные кристаллы , как и поваренная соль, твердые и стабильные, но состоят из атомов, связанных электрическими зарядами. Металлические кристаллы состоят из металлических элементов и хорошо проводят электричество. Молекулярные кристаллы , как и леденцы, образуются за счет водородных связей, обычно являются слабыми и имеют низкую температуру плавления. В зависимости от формы кристалла существует семь основных структур кристаллов. Это кубический, гексагональный, тетрагональный, ромбический, тригональный, моноклинный и триклинный.
Молекулярные кристаллы , как и леденцы, образуются за счет водородных связей, обычно являются слабыми и имеют низкую температуру плавления. В зависимости от формы кристалла существует семь основных структур кристаллов. Это кубический, гексагональный, тетрагональный, ромбический, тригональный, моноклинный и триклинный.
Кристальный словарь и определения
- Кристалл : любой твердый материал, атомы которого организованы в повторяющуюся структуру одного из четырех типов: ковалентного, ионного, металлического и молекулярного.
- Ковалентный кристалл : атомы разделяют электроны; алмаз
- Ионный кристалл : атомы стянуты противоположными зарядами; поваренная соль
- Металлические кристаллы : атомы — металлические элементы; золотые самородки
- Молекулярные кристаллы : атомы образуют слабые водородные связи; рок конфеты
- Кристаллические системы : Атомы в кристаллической связи принимают определенные формы и узоры, известные как системы.
 Четыре типа кристаллов могут появиться как один из семи структурных / системных типов: кубический, гексагональный, тетрагональный, ромбический, тригональный, моноклинный и триклинный.
Четыре типа кристаллов могут появиться как один из семи структурных / системных типов: кубический, гексагональный, тетрагональный, ромбический, тригональный, моноклинный и триклинный.
Результаты обучения
После того, как учащиеся завершили этот урок, они должны быть готовы:
- Определить кристаллы и кристаллические системы
- Опишите четыре типа кристаллов, включая типы облигаций
- Перечислите примеры четырех типов кристаллов
- Обозначьте семь кристаллических систем
Crystal Lattices — обзор
Кристаллическую решетку можно описать в терминах регулярной или прямой решетки, которая представляет собой набор векторных положений ядер внутри кристалла.Положения ядер регулярной решетки содержат набор пространственных интервалов между каждой точкой решетки и другими точками решетки. Преобразование Фурье пространственных положений ядер регулярной решетки отображается в соответствующий набор обратных интервалов. Эти взаимные интервалы образуют набор плоскостей, разделительные расстояния которых можно приравнять к длинам волн, в которых волновые узлы находятся в этих плоскостях. Максимальная длина волны (и, следовательно, минимальное волновое число) охватывает минимальное расстояние между соседними параллельными плоскостями ядер решетки..
Эти взаимные интервалы образуют набор плоскостей, разделительные расстояния которых можно приравнять к длинам волн, в которых волновые узлы находятся в этих плоскостях. Максимальная длина волны (и, следовательно, минимальное волновое число) охватывает минимальное расстояние между соседними параллельными плоскостями ядер решетки..
Объем v r элементарной ячейки обратной решетки равен
(17) vr = a ∗ ⋅b ∗ × c ∗ = b ∗ ⋅c ∗ × a ∗ = c ∗ ⋅a ∗ × b ∗
или
(18) vr = 2π3v0 = 2π3a⋅b × c.
Векторы обратной решетки перпендикулярны двум из трех векторов реального пространства решетки, как видно из приведенных выше перекрестных произведений, где, например,
(19) a ∗ × b = a ∗ × c = 0.
Скалярное произведение вектора обратной решетки с его вектором двойной решетки в реальном пространстве равно 2 π , потому что вектор обратной решетки и его вектор двойной решетки являются обратными или обратными друг другу, где
(20 ) a ∗ ⋅a = b ∗ ⋅b = c ∗ ⋅c = 2π. c.
c.
Величина | τhkl | вектора обратной решетки ( h , k , l ) составляет
(23) τhkl = h3a ∗ ⋅a ∗ + k2b ∗ ⋅b ∗ + l2c ∗ ⋅c ∗.
Векторы трансляции обратной решетки ( a *, b *, c *) могут быть выражены через векторы трансляции прямой решетки ( a, b, c ), где величина τhkl вектор обратной решетки принимает вид
(24) τhkl = 2πh3a2 + k2b2 + l2c2.
Равномерное расстояние d hkl между определенным набором параллельных плоскостей ( h , k , l ) в обратной решетке составляет
(25) dhkl = 2πτhkl = 1h2a2 + l2c2b .
Ориентация кристаллической плоскости определяется тремя неколлинеарными, определяющими плоскость, а именно осями ( a, b, c ). Более полезный метод адресации подмножеств кристаллических плоскостей — это индексы Миллера ( h , k , l ). Чтобы определить индексы Миллера для набора плоскостей, сначала определяют точки пересечения (a1, b1, c1) через тройной целочисленный адрес [ m , n , o ] плоскостей на ( a , b, c ) оси, где
(28) a1 = mab1 = nbc1 = oc.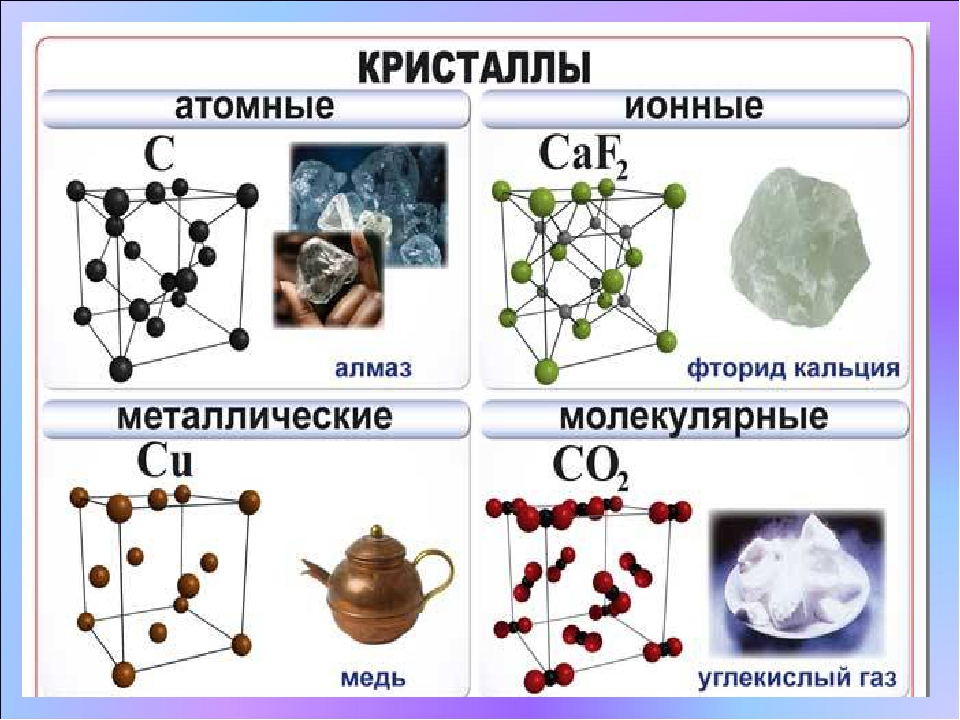
Возьмите обратные числа [ m , n , o ], которые представляют собой три дроби, а затем уменьшите эти дроби до целых чисел с таким же соотношением, которые являются индексами обратной решетки; т.е. индексы Миллера ( h , k , l ). То есть плоскость, имеющая [ м , n , o ] на осях ( a, b, c ), дает дроби (1 m, 1 ∕ n, 1 ∕ o). Затем находят три наименьших целых числа с одинаковым соотношением.Это соотношение получается путем умножения (1 m, 1 ∕ n, 1 ∕ o) на их ненулевое обратное произведение, mno , в котором mno ≠ 0. Умножение триплетных дробей (1 ∕ m, 1 ∕ n, 1 ∕ o) их обратным произведением mno дает ( no , mo , mn ). Затем получают индексы Миллера ( h , k , l ) путем нахождения наибольшего общего делителя, отличного от 1; то есть наибольший общий знаменатель ( no , mo , mn ), который обозначается GCD , где
(29) h = noGCDk = moGCDl = mnGCD.
Представляется, что плоскость кристалла, параллельная определенной оси кристалла, пересекает эту ось кристалла на бесконечности. Если один из точек пересечения m , n или o находится на бесконечности ∞, то заменяется 1/ m , 1/ n или 1/ o , обратное (1 / ∞) на ноль. Например, если (m, n, o) = (m, n, ∞), то соответствующие дроби равны
(30) (1 ∕ m, 1 ∕ n, 1 ∕ ∞),
Здесь 1 / ∞ = 0, и обратное произведение равно mn , а деление на наибольший общий знаменатель (НОД), отличный от 1, дает
(31) (h, k, l) = (n, m, 0) НОД.
Если точка пересечения m , n или o находится на бесконечности, то эта точка пересечения на бесконечности не включается во обратное произведение. Например, (1) если точки пересечения (a1, b1, c1) элементарной ячейки равны (2, 1, 3), то индексы Миллера ( h , k , l ) равны (3, 6, 2) и (2), если элементарная ячейка пересекает (a1, b1, c1) равны (1 ∕ 2,1, ∞), то индексы Миллера ( h , k , l ) равны (2, 1, 0). .
.
Определение кристаллической решетки — химический словарь
Что такое решетка?
Решетка — это упорядоченный массив точек, описывающий расположение частиц, образующих кристалл.
Элементарная ячейка кристалла определяется узлами решетки. Элементарная ячейка — это наименьшая часть кристалла, которая регулярно повторяется посредством трансляции в трех измерениях, создавая весь кристалл.
Например, показанное здесь изображение представляет собой элементарную ячейку примитивной кубической структуры.
В нарисованной структуре все частицы (желтые) одинаковы. В этом частном случае точки решетки, определяющие элементарную ячейку, совпадают с центрами частиц кристалла. Так должно быть не всегда.
Ионная решетка
Если кристалл состоит из ионов, соединение можно описать как ионную решетку.
Хорошо известными примерами ионных решеток являются хлорид натрия, перманганат калия, бура (борат натрия) и сульфат меди (II).
Кристаллы перманганата калия. Изображение Бена Миллса.
Элементарная ячейка перманганата калия. Изображение Бена Миллса.
Ковалентная решетка
Если кристалл состоит из ковалентно связанных атомов, его можно описать как ковалентную решетку или бесконечную ковалентную решетку.
Хорошо известными примерами ковалентных решеток являются алмаз, кварц (диоксид кремния), кремний и серое олово.
Кристаллический кремний. Изображение Энрикорос.
Небольшой участок кристаллической структуры кремния.
Константы решетки
Постоянные решетки (или параметры решетки) — это длины и углы между краями элементарной ячейки.
На этой решетчатой диаграмме параллелепипеда постоянные решетки — это a, b и c (длины) и α, β и γ (углы).
Решетчатые конструкции
Решетки Браве. На основе изображения Napy1 Kenobi.
Кристаллические материалы вписываются в одну из четырнадцати известных структур решетки.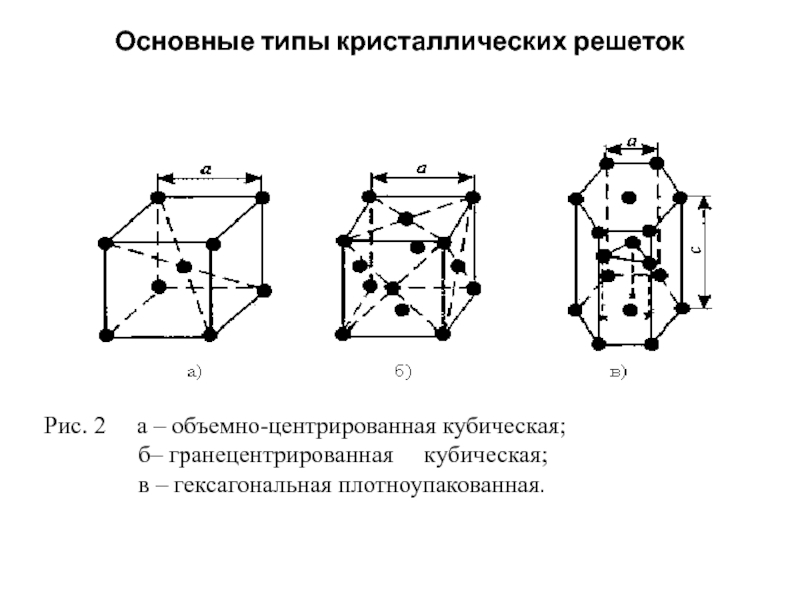 Они известны как решетки Браве .
Они известны как решетки Браве .
Названия систем кристаллической решетки, соответствующие номерам на диаграммах, следующие:
1. Примитивная кубическая
2. Кубическая центрированная по телу
3. Кубическая центрированная по граням
4. Примитивная четырехугольная
5. Телоцентрированная четырехугольная
6. Примитивная орторомбическая
7. Орторомбическая с центрированием по основанию
8. Орторомбическая с центрированием по телу
9. С центрированием по граням Орторомбическая
10. Примитивная моноклинная
11.Моноклиническая форма с центром в основании
12. Триклиническая форма
13. Ромбоэдрическая форма
14. Гексагональная
Дефекты решетки
Если предположить, что кристалл основан на математически совершенной ионной решетке, его расчетная прочность на растяжение была бы намного больше, чем наблюдается на самом деле.
Реальные кристаллы имеют дефекты решетки, которые являются источниками слабости.





 Так же атомную решетку имеют простые вещества С (алмаз и графит) и Р (черный фосфор).
Так же атомную решетку имеют простые вещества С (алмаз и графит) и Р (черный фосфор). Какое координационное число атома кобальта?
Какое координационное число атома кобальта?
 Какая формула соединения? Поясните свой ответ.
Какая формула соединения? Поясните свой ответ.
 Длина ребра элементарной ячейки TlI равна 4.20 Å. Вычислите ионный радиус TI + . (Ионный радиус I — составляет 2,16 Å.)
Длина ребра элементарной ячейки TlI равна 4.20 Å. Вычислите ионный радиус TI + . (Ионный радиус I — составляет 2,16 Å.) 2879 нм. Каков угол дифракции для дифракционного пика первого порядка?
2879 нм. Каков угол дифракции для дифракционного пика первого порядка?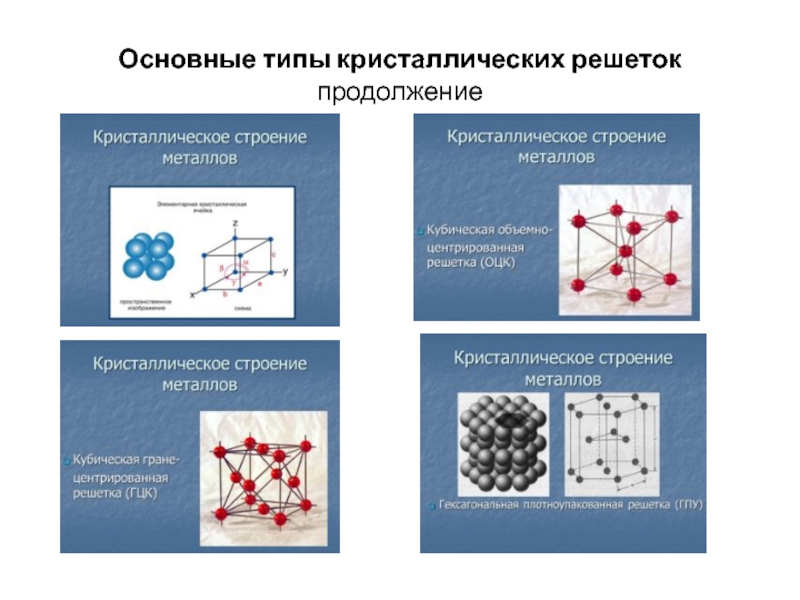 Четыре типа кристаллов могут появиться как один из семи структурных / системных типов: кубический, гексагональный, тетрагональный, ромбический, тригональный, моноклинный и триклинный.
Четыре типа кристаллов могут появиться как один из семи структурных / системных типов: кубический, гексагональный, тетрагональный, ромбический, тригональный, моноклинный и триклинный.