Типы органических оснований. Факторы, определяющие основность. Примеры.
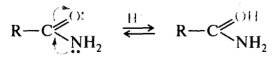
Среди оснований Брёнстеда анионы по сравнению с нейтральными молекулами, как правило, обладают более сильно выраженными основными свойствами. Например, амид-ион NH2—, гидроксид-ион НО— и алкоксид-ион RO— по основности превосходят аммиак NH3, воду Н2О и спирт ROH соответственно. Перечисленные ионы являются очень сильными основаниями. В результате присоединения протона к нейтральному основанию образуются солеобразные ониевые соединения:
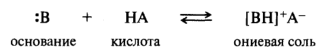
В зависимости от природы гетероатома получаются соли: аммониевые (центр основности — атом азота), оксониевые (атом кислорода) и
Сила основания определяется как доступностью пары электронов гетероатома, так и стабильностью образующегося катиона (сопряженной кислоты). Чем стабильнее катион, тем сильнее основание. Для качественной оценки основности органических оснований привлекаются те же факторы, что и для оценки кислотности с той разницей, что влияние этих факторов на стабильность катиона противоположно (за исключением сольватации) тому влиянию, которое эти факторы оказывают на стабильность аниона.
Основность соединений с разными гетероатомами в центре основности, но с одинаковыми заместителями при нем, зависит от электроотрицательности и поляризуемости элемента в основном центре. Из двух элементов второго периода — азота и кислорода — электроотрицательность больше у кислорода, поэтому он прочнее удерживает неподеленную пару электронов и менее склонен присоединять протон по сравнению с азотом. Амины являются более сильными основаниями, чем спирты. У элементов третьего периода — серы и фосфора — электронная плотность неподеленной пары электронов рассредоточена в большем объеме (фактор поляризуемости). Эти атомы слабее связывают протон, поэтому тиолы, как правило, более слабые основания, чем спирты и тем более чем амины. В целом сила n-оснований с одинаковыми заместителями при гетероатоме уменьшается в следующем порядке:

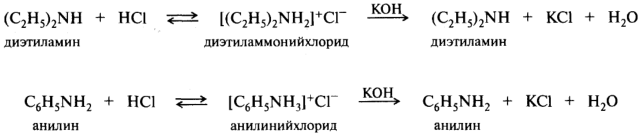
Наибольшая основность среди органических соединений характерна для алифатических аминов, значения рKвн+ которых находятся в диапазоне 9 — 11 единиц. При взаимодействии с кислотами амины превращаются в аммониевые соли. Под действием более сильного основания аммониевые соли депротонируются с освобождением исходного амина:
Перевод водонерастворимых органических оснований в растворимые соли часто служит способом выделения таких оснований из смесей и их очистки.
У спиртов, простых и сложных эфиров, альдегидов, кетонов, карбоновых кислот значения pKBH+ лежат в диапазоне от — 2 до – 7. Это очень слабые основания, могут протонироваться только сильными кислотами. Образующиеся оксониевые соли легко гидролизуются избытком воды до исходных соединений:
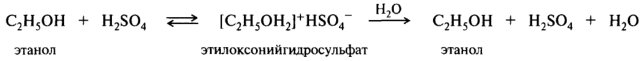
Серосодержащие n-основания еще слабее кислородсодержащих.
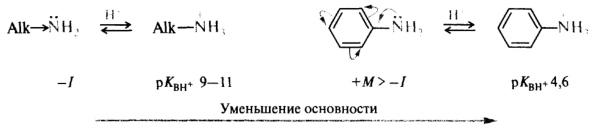
Основность соединений с одинаковыми гетероатомами в центре основности определяется доступностью электронной пары гетероатома для связи с протоном, электронным влиянием заместителей и эффектом сольватации. В ароматических аминах аминогруппа находится в p,π-сопряжении с π-электронами бензольного кольца, что приводит к делокализации неподеленной пары электронов по общей сопряженной системе. В этом случае атом азота становится менее склонным к образованию ковалентной связи с протоном, и поэтому ароматические амины более слабые основания, чем алифатические. Кроме того, катионы ароматических аминов вследствие большого размера ароматического радикала плохо сольватируются в протонсодержащих растворителях.
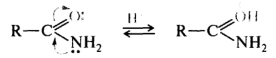
В амидах карбоновых кислот участие неподеленной пары электронов атома азота в p,π-сопряжении с акцепторной карбонильной группой приводит к тому, что более сильным основным центром становится атом кислорода:
Влияние заместителей на собственную основность, т. е. основность в газовой фазе, подчиняется следующим закономерностям: (!) электронодонорные заместители повышают основность, электроноакцепторные — понижают.
Алифатические амины, содержащие электронодонорные алкильные группы у атома азота, более сильные основания, чем аммиак, и наоборот, из-за наличия сильных электроноакцепторных трифторометильных групп перфторотриметиламин практически не проявляет основных свойств:
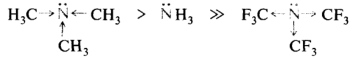
Сольватация может оказывать сильное воздействие на собственную основность алифатических аминов. Однако в ароматических аминах, размеры катионов которых не различаются слишком сильно, электронные эффекты заместителей вносят главный вклад в стабилизацию катиона и, следовательно, определяют силу оснований:

Многие соли органических оснований, особенно гидрохлориды, растворимы в воде. Поэтому лекарственные органические вещества часто используются в виде солей.
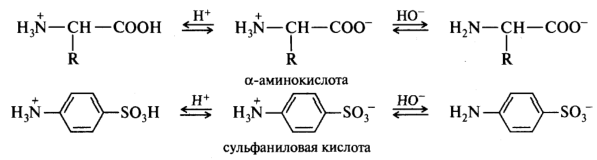
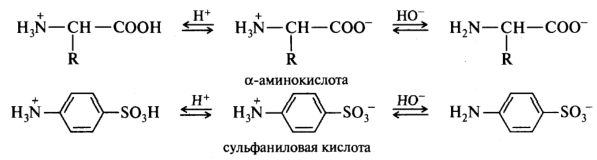
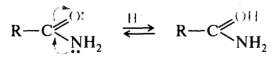
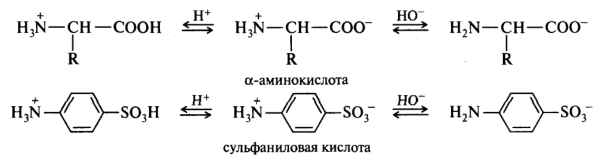
Некоторые органические соединения обладают одновременно и кислотными, и основными свойствами, т. е. являются амфотерными. В зависимости от соотношения силы кислотного и основного центров это может приводить либо к образованию внутренней соли (полный перенос протона), либо к образованию водородных связей внутри молекулы или между молекулами. Например, амфотерными соединениями являются спирты, амиды, аминокислоты, аминосульфоновые кислоты:
Лекция № 4 органические кислоты и основания
Протонная теория кислот и оснований Бренстеда.
Классификация кислот и оснований по Бренстеду.
Влияние структурных факторов на кислотность и основность.
Кислоты и основания Льюиса. Теория жестких и мягких кислот и оснований.
В настоящее время существуют две основных теории кислот и оснований: теория Брёнстеда и теория Льюиса.
Протонная теория кислот и оснований Брёнстеда
Кислоты Брёнстеда – это соединения, способные отдавать протон (доноры протона).
Основания Брёнстеда – это соединения, способные присоединять протон (акцепторы протона). Для взаимодействия с протоном основание должно иметь свободную пару электронов или электроны π-связи.
Кислоты и основания образуют сопряженные кислотно-основные пары, например:
CH3COOH | + | H2O |
| CH3COO— | + | H3O+ |
кислота1 |
| основание2 |
| основание1 |
| кислота2 |
CH3NH2 | + | H2O |
| CH3NH3+ | + | OH— |
основание1 |
| кислота2 |
| кислота1 |
| основание2 |
В общем виде:
Н-А | + | :В |
| :А | + | Н-В |
кислота1 |
| основание2 |
| основание1 |
| кислота2 |
Сила кислоты НА будет зависеть от силы основания :В. Поэтому для создания единой шкалы силу кислот и оснований Бренстеда определяют относительно воды, которая является амфотерным соединением и может проявлять и кислотные, и основные свойства.
Сила кислот определяется константой равновесия их взаимодействия с водой как основанием, например:
CH3COOH + H2O CH3COO— + H3O+


Так как в разбавленных растворах [H2O]=const, то ее можно внести в константу равновесия, которую называют константой кислотности:

На практике чаще пользуются величинами pKa= — lg Ka. Чем меньше величина pKa, тем сильнее кислота.
Сила оснований определяется константой равновесия взаимодействия их с водой как кислотой:
RNH2 + H2O RNH3+ + OH—
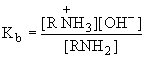 — константа
основности.
— константа
основности.
Для
сопряженных кислоты и основания KaKb=KW.
Таким образом, в сопряженной
кислотно-основной паре, чем сильнее
кислота, тем слабее основание и наоборот.
Силу основания чаще выражают не константой
основности, а константой кислотности
сопряженной кислоты 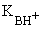 .
Например, для основания RNH2 величина
.
Например, для основания RNH2 величина  —
это константа кислотности сопряженной
кислоты
—
это константа кислотности сопряженной
кислоты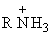 :
:
RNH3+ + H2O RNH2 + H3О+
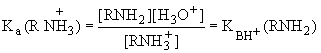
На
практике чаще пользуются величиной  .
Чем больше величина
.
Чем больше величина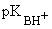 ,
тем сильнее основание.
,
тем сильнее основание.
Классификация органических кислот и оснований
Кислоты и основания Брёнстеда классифицируют по природе атома при кислотном или основном центре.
В зависимости от природы элемента, с которым связан протон, различают четыре основных типа органических кислот Брёнстеда:
O-H – кислоты — карбоновые кислоты, спирты, фенолы;
S-H – кислоты — тиолы;
N-H – кислоты — амины, амиды, имиды;
C-H – кислоты — углеводороды и их производные.
В зависимости от природы атома, к неподеленной паре электронов которого присоединяется протон, основания Брёнстеда делят на три основных типа:
N (аммониевые) основания — амины, нитрилы, азотсодержащие гетероциклические соединения;
О (оксониевые) основания — спирты, простые эфиры, альдегиды, кетоны, карбоновые кислоты и их функциональные производные;
S (сульфониевые) основания — тиолы, сульфиды.
Особый тип оснований Бренстеда представляют π-основания, в которых центром основности являются электроны π-связи (алкены, арены).
 Обратная связь ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса — ваш вокал Как цель узнает о ваших желаниях прежде, чем вы начнете действовать. Как компании прогнозируют привычки и манипулируют ими Целительная привычка Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Тренинг уверенности в себе Вкуснейший «Салат из свеклы с чесноком» Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Как слышать голос Бога Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной
Оси и плоскости тела человека — Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
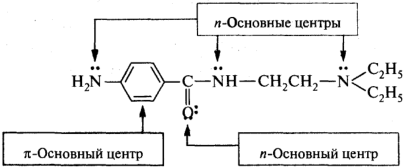
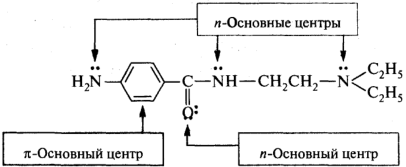
| Среди оснований Брёнстеда анионы по сравнению с нейтральными молекулами, как правило, обладают более сильно выраженными основными свойствами. Например, амид-ион NH2—, гидроксид-ион НО— и алкоксид-ион RO— по основности превосходят аммиак NH3, воду Н2О и спирт ROH соответственно. Перечисленные ионы являются очень сильными основаниями. В результате присоединения протона к нейтральному основанию образуются солеобразные ониевые соединения: В зависимости от природы гетероатома получаются соли: аммониевые (центр основности — атом азота), оксониевые (атом кислорода) и сульфониевые (атом серы). На примере молекулы новокаинамида:
Сила основания определяется как доступностью пары электронов гетероатома, так и стабильностью образующегося катиона (сопряженной кислоты). Чем стабильнее катион, тем сильнее основание. Для качественной оценки основности органических оснований привлекаются те же факторы, что и для оценки кислотности с той разницей, что влияние этих факторов на стабильность катиона противоположно (за исключением сольватации) тому влиянию, которое эти факторы оказывают на стабильность аниона. Основность соединений с разными гетероатомами в центре основности, но с одинаковыми заместителями при нем, зависит от электроотрицательности и поляризуемости элемента в основном центре. Из двух элементов второго периода — азота и кислорода — электроотрицательность больше у кислорода, поэтому он прочнее удерживает неподеленную пару электронов и менее склонен присоединять протон по сравнению с азотом. Амины являются более сильными основаниями, чем спирты. У элементов третьего периода — серы и фосфора — электронная плотность неподеленной пары электронов рассредоточена в большем объеме (фактор поляризуемости). Эти атомы слабее связывают протон, поэтому тиолы, как правило, более слабые основания, чем спирты и тем более чем амины. В целом сила n-оснований с одинаковыми заместителями при гетероатоме уменьшается в следующем порядке: Наибольшая основность среди органических соединений характерна для алифатических аминов, значения рKвн+ которых находятся в диапазоне 9 — 11 единиц. При взаимодействии с кислотами амины превращаются в аммониевые соли. Под действием более сильного основания аммониевые соли депротонируются с освобождением исходного амина: Перевод водонерастворимых органических оснований в растворимые соли часто служит способом выделения таких оснований из смесей и их очистки. У спиртов, простых и сложных эфиров, альдегидов, кетонов, карбоновых кислот значения pKBH+ лежат в диапазоне от — 2 до – 7. Это очень слабые основания, могут протонироваться только сильными кислотами. Образующиеся оксониевые соли легко гидролизуются избытком воды до исходных соединений: Серосодержащие n-основания еще слабее кислородсодержащих. Основность соединений с одинаковыми гетероатомами в центре основности определяется доступностью электронной пары гетероатома для связи с протоном, электронным влиянием заместителей и эффектом сольватации. В ароматических аминах аминогруппа находится в p,π-сопряжении с π-электронами бензольного кольца, что приводит к делокализации неподеленной пары электронов по общей сопряженной системе. В этом случае атом азота становится менее склонным к образованию ковалентной связи с протоном, и поэтому ароматические амины более слабые основания, чем алифатические. Кроме того, катионы ароматических аминов вследствие большого размера ароматического радикала плохо сольватируются в протонсодержащих растворителях. В амидах карбоновых кислот участие неподеленной пары электронов атома азота в p,π-сопряжении с акцепторной карбонильной группой приводит к тому, что более сильным основным центром становится атом кислорода:
Влияние заместителей на собственную основность, т. е. основность в газовой фазе, подчиняется следующим закономерностям: (!) электронодонорные заместители повышают основность, электроноакцепторные — понижают. Алифатические амины, содержащие электронодонорные алкильные группы у атома азота, более сильные основания, чем аммиак, и наоборот, из-за наличия сильных электроноакцепторных трифторометильных групп перфторотриметиламин практически не проявляет основных свойств: Сольватация может оказывать сильное воздействие на собственную основность алифатических аминов. Однако в ароматических аминах, размеры катионов которых не различаются слишком сильно, электронные эффекты заместителей вносят главный вклад в стабилизацию катиона и, следовательно, определяют силу оснований:
Многие соли органических оснований, особенно гидрохлориды, растворимы в воде. Поэтому лекарственные органические вещества часто используются в виде солей. Некоторые органические соединения обладают одновременно и кислотными, и основными свойствами, т. е. являются амфотерными. В зависимости от соотношения силы кислотного и основного центров это может приводить либо к образованию внутренней соли (полный перенос протона), либо к образованию водородных связей внутри молекулы или между молекулами. Например, амфотерными соединениями являются спирты, амиды, аминокислоты, аминосульфоновые кислоты:
|
Электронодонорные и электроноакцепторные заместители. Распределение электронной плотности в молекуле. Примеры.
Графически I-эффект обозначается стрелкой на конце валентной черты, направленной в сторону более электроотрицательного атома. Направление I-эффекта заместителя качественно оценивают, сравнивая с практически неполярной связью С—Н и полагая I-эффект водорода равным нулю. Заместители, смещающие электронную плотность σ-связи сильнее, чем водород, проявляют отрицательный I-эффект (-I-эффект). Такие электронооттягивающие заместители снижают электронную плотность в системе σ-связей, их называют электроноакцепторными. Эффект тем сильнее, чем больше электроотрицательность гетероатома.
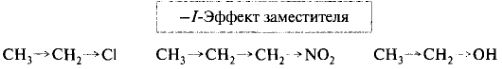
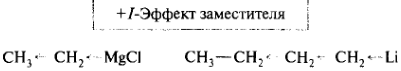
Электроноподающие заместители повышают электронную плотность в цепи σ-связей по сравнению с водородом, т. е. проявляют +I-эффект и являются электронодонорными. К ним относятся атомы с низкой электроотрицательностью, а также отрицательно заряженные атомы или группы, обладающие избытком электронной плотности, которую стремятся перераспределить на соседние связи.
Алкильные группы, связанные с атомами углерода в sp2— или sp-гибридном состоянии, проявляют +I-эффект. Например, в молекуле пропена 12С метальной группы в sp3-гибридном состоянии, менее электроотрицателен, чем гибридизованные 12С двойной связи. Поэтому метальная группа выступает в роли электронодонора и ее влияние в первую очередь испытывает π-связь. Смещение электронной плотности π-связи обозначают изогнутой стрелкой:
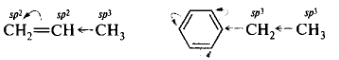

Алкильные группы проявляют +I-эффект только в растворе, в газовой фазе они могут обнаруживать и -I-эффект. Наибольшего значения индуктивные эффекты достигают в том случае, когда на атоме или группе атомов имеется полный заряд. Ионы индуцируют особенно сильное смещение электронной плотности, которое распространяется далеко по цепи.
Заместитель может вносить в систему сопряжения π-связь (π,π-сопряжение) или р-АО, которая может быть либо вакантной, либо занятой 1 электроном или неподеленной парой электронов (p,π-сопряжение). М-эффект отражает тот факт, что р-орбитали заместителя, перекрываясь с орбиталями π-связей, образуют делокализованную орбиталь более низкой энергии. М-эффект передается по сопряженной системе без затухания.
Заместители, понижающие электронную плотность в сопряженной системе (смещающие электронную плотность в свою сторону), проявляют отрицательный мезомерный эффект (-М-эффект) и являются электроноакцепторными. К ним относятся заместители, содержащие кратные связи атома углерода с более электроотрицательным гетероатомом.
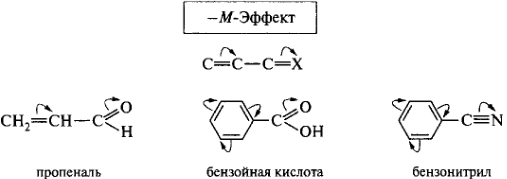
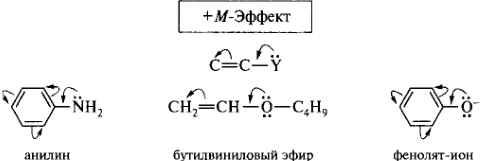
Заместители, повышающие электронную плотность в сопряженной системе (смещающие электронную плотность от себя в сторону сопряженной системы), проявляют положительный мезомерный эффект (+М-эффект). К ним относятся заместители, содержащие гетероатом с неподеленной парой электронов или имеющие отрицательный заряд. Эти заместители являются электронодонорными и за счет включения в состав сопряженной системы своей пары электронов создают избыточность электронной плотности в цепи сопряжения.
Влияние растворителя.
Взаимодействие молекул или ионов растворенного вещества с растворителем называется процессом сольватации. Стабильность аниона существенно зависит от его сольватации в растворе: чем больше ион сольватирован, тем он устойчивее, а сольватация тем больше, чем меньше размер иона и чем меньше делокализация в нем отрицательного заряда.
.
Основные свойства органических соединений. π-основания и n-основания.
Основность органических соединений.
Органические соединения, в состав молекулы которых входят атомы азота, кислорода, серы, могут выступать в роли оснований, присоединяя протон водорода за счет неподеленной пары электронов на внешнем энергетическом уровне. Гетероатом в молекуле органического вещества, присоединяющий протон, называется центром основности.
Основания по Бренстеду делятся на n– основания и π – основания.
n – Основаниямогут быть нейтральными или отрицательно заряженными частицами. К ним относятся:аммониевые (R3N,R=NH,RCN), оксониевые (RC(O)R1,R-O-R1), сульфониевые (R-S-R1,RC(S)R1)
. π-основания(алкины, алкены, диены, арены) в них центром основности являются электроны π-связи. Это очень слабые основания, так как протонируемые электронные пары несвободны.
Сила основания определяется стабильностью образующегося катиона (сопряженной кислоты). Чем стабильнее катион, тем сильнее основание.
Для количественной характеристики основности обычно используют величину pKBH+ — показатель константы основности сопряженной кислоты. Чем большеpKBH+, тем сильнее основание.
Факторы, влияющие на основность
Природа гетероатома в основном центре
Н3С -NH2> Н3С -OHН3С -OH> Н3С –SH
Сила оснований зависит от электроотрицательности гетероатома в основном центре. Чем больше ЭО атома, тем слабее основные свойства, поэтому спирты и простые эфиры являются более слабыми основаниями по сравнению с аминами.
Строение радикала, связанного с основным центром.
 анилин Н3С
→ СН2→NH2 этиламин
анилин Н3С
→ СН2→NH2 этиламин
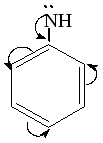
Алифатические амины проявляют более выраженные основные свойства, чем ароматические, так как электронная плотность от углеводородного радикала смещается к NH2, а чем больше электронной плотности на основном центре, тем лучше присоединяется Н+. в ароматических аминахNH2входит в общее сопряжение с бензольным кольцом и отдает электронную плотность на кольцо, поэтому Н+ присоединяется труднее, основные свойства слабее.
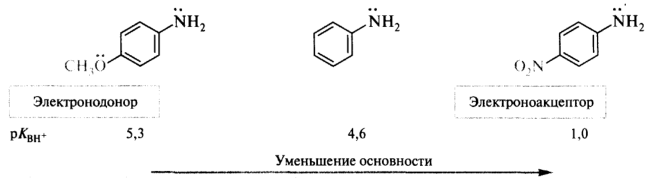
Влияние заместителей. Электронодонорые заместители усиливают основные свойства, а электроноакцепторные – уменьшают, например:
 4-хлоранилин
4-хлоранилин анилин
анилин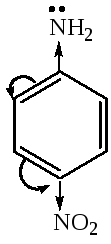 4-нитроанилин
4-нитроанилин
РКВН+5,1 4,6 1,0
уменьшение основности
Влияние растворителя
В водной среде важную роль играет уменьшение пространственных препятствий для гидратации, поэтому вторичные амины лучше гидратируются, чем третичные, которые пространственно труднодоступны.
H 3C
— NH – CH3 > H3C
– NH2 > H3C
— N – CH3
3C
— NH – CH3 > H3C
– NH2 > H3C
— N – CH3
CH3

основность уменьшается
В газовой среде основность возрастает с увеличением углеводородных радикалов, так как усиливается их стабилизирующее действие за счет +I-эффекта на катион сопряженной кислоты, поэтому третичные амины проявляют более сильные основные свойства по сравнению с другими аминами.
H 3C
— N – CH3 > H3C
— NH – CH3 > H3C
– NH2
3C
— N – CH3 > H3C
— NH – CH3 > H3C
– NH2
CH3
о сновность
уменьшается
сновность
уменьшается
Типы органических оснований. Факторы, определяющие основность. Примеры.
Среди оснований Брёнстеда анионы по сравнению с нейтральными молекулами, как правило, обладают более сильно выраженными основными свойствами. Например, амид-ион NH2—, гидроксид-ион НО— и алкоксид-ион RO— по основности превосходят аммиак NH3, воду Н2О и спирт ROH соответственно. Перечисленные ионы являются очень сильными основаниями. В результате присоединения протона к нейтральному основанию образуются солеобразные ониевые соединения:
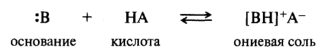
В зависимости от природы гетероатома получаются соли: аммониевые (центр основности — атом азота), оксониевые (атом кислорода) и сульфониевые (атом серы). На примере молекулы новокаинамида:
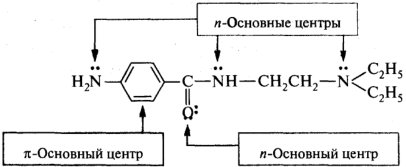
Сила основания определяется как доступностью пары электронов гетероатома, так и стабильностью образующегося катиона (сопряженной кислоты). Чем стабильнее катион, тем сильнее основание. Для качественной оценки основности органических оснований привлекаются те же факторы, что и для оценки кислотности с той разницей, что влияние этих факторов на стабильность катиона противоположно (за исключением сольватации) тому влиянию, которое эти факторы оказывают на стабильность аниона.
Основность соединений с разными гетероатомами в центре основности, но с одинаковыми заместителями при нем, зависит от электроотрицательности и поляризуемости элемента в основном центре. Из двух элементов второго периода — азота и кислорода — электроотрицательность больше у кислорода, поэтому он прочнее удерживает неподеленную пару электронов и менее склонен присоединять протон по сравнению с азотом. Амины являются более сильными основаниями, чем спирты. У элементов третьего периода — серы и фосфора — электронная плотность неподеленной пары электронов рассредоточена в большем объеме (фактор поляризуемости). Эти атомы слабее связывают протон, поэтому тиолы, как правило, более слабые основания, чем спирты и тем более чем амины. В целом сила n-оснований с одинаковыми заместителями при гетероатоме уменьшается в следующем порядке:
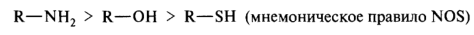
Наибольшая основность среди органических соединений характерна для алифатических аминов, значения рKвн+ которых находятся в диапазоне 9 — 11 единиц. При взаимодействии с кислотами амины превращаются в аммониевые соли. Под действием более сильного основания аммониевые соли депротонируются с освобождением исходного амина:
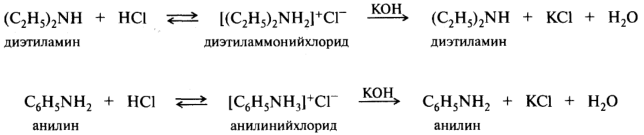
Перевод водонерастворимых органических оснований в растворимые соли часто служит способом выделения таких оснований из смесей и их очистки.
У спиртов, простых и сложных эфиров, альдегидов, кетонов, карбоновых кислот значения pKBH+ лежат в диапазоне от — 2 до – 7. Это очень слабые основания, могут протонироваться только сильными кислотами. Образующиеся оксониевые соли легко гидролизуются избытком воды до исходных соединений:
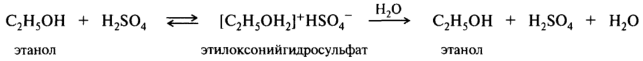
Серосодержащие n-основания еще слабее кислородсодержащих.
Основность соединений с одинаковыми гетероатомами в центре основности определяется доступностью электронной пары гетероатома для связи с протоном, электронным влиянием заместителей и эффектом сольватации. В ароматических аминах аминогруппа находится в p,π-сопряжении с π-электронами бензольного кольца, что приводит к делокализации неподеленной пары электронов по общей сопряженной системе. В этом случае атом азота становится менее склонным к образованию ковалентной связи с протоном, и поэтому ароматические амины более слабые основания, чем алифатические. Кроме того, катионы ароматических аминов вследствие большого размера ароматического радикала плохо сольватируются в протонсодержащих растворителях.

В амидах карбоновых кислот участие неподеленной пары электронов атома азота в p,π-сопряжении с акцепторной карбонильной группой приводит к тому, что более сильным основным центром становится атом кислорода:
Влияние заместителей на собственную основность, т. е. основность в газовой фазе, подчиняется следующим закономерностям: (!) электронодонорные заместители повышают основность, электроноакцепторные — понижают.
Алифатические амины, содержащие электронодонорные алкильные группы у атома азота, более сильные основания, чем аммиак, и наоборот, из-за наличия сильных электроноакцепторных трифторометильных групп перфторотриметиламин практически не проявляет основных свойств:

Сольватация может оказывать сильное воздействие на собственную основность алифатических аминов. Однако в ароматических аминах, размеры катионов которых не различаются слишком сильно, электронные эффекты заместителей вносят главный вклад в стабилизацию катиона и, следовательно, определяют силу оснований:

Многие соли органических оснований, особенно гидрохлориды, растворимы в воде. Поэтому лекарственные органические вещества часто используются в виде солей.
Некоторые органические соединения обладают одновременно и кислотными, и основными свойствами, т. е. являются амфотерными. В зависимости от соотношения силы кислотного и основного центров это может приводить либо к образованию внутренней соли (полный перенос протона), либо к образованию водородных связей внутри молекулы или между молекулами. Например, амфотерными соединениями являются спирты, амиды, аминокислоты, аминосульфоновые кислоты:
Дата добавления: 2016-06-18; просмотров: 2390;
Похожие статьи:
Классификация органических кислот и оснований
Кислоты и основания Бренстеда классифицируют по природе атома при кислотном или основном центре.
В зависимости от природы элемента, с которым связан протон, различают четыре основных типа органических кислот Бренстеда:
- O-H – кислоты — карбоновые кислоты, спирты, фенолы;
- S-H – кислоты — тиолы;
- N-H – кислоты — амины, амиды, имиды;
- C-H – кислоты — углеводороды и их производные.
В зависимости от природы атома, к неподеленной паре электронов которого присоединяется протон, основания Бренстеда делят на три основных типа:
- аммониевые основания — амины, нитрилы, азотсодержащие гетероциклические соединения;
- оксониевые основания — спирты, простые эфиры, альдегиды, кетоны, карбоновые кислоты и их функциональные производные;
- сульфониевые основания — тиолы, сульфиды.
Особый тип оснований Бренстеда представляют p-основания, в которых центром основности являются электроны p-связи (алкены, арены).B + H 2 O ⇌ B H + + O H − . {\displaystyle {\mathsf {B+H_{2}O}}\rightleftharpoons {\mathsf {BH^{+}+OH^{-}}}.}
Классификация неорганических оснований .
ОСНОВАНИЯ. Основания – сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания – сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или Nh5+) и гидроксид – анионы OH-). Классификация. Растворимые в воде (щёлочи) и нерастворимые. Амфотерные основания проявляют также свойства слабых кислот.
Общие свойства оснований обусловлены наличием в их растворах иона ОН—, создающего в растворе щелочную среду (фенолфталеин окрашивается в малиновый цвет, метилоранж – в желтый, лакмус – в синий).
1. Химические свойства щелочей:
1) взаимодействие с кислотными оксидами:
2KOH+CO2®K2CO3+H2O;
2) реакция с кислотами (реакция нейтрализации):
2NaOH+ H2SO4®Na2SO4+2H2O;
3) взаимодействие с растворимыми солями (только в том случае, если при действии щелочи на растворимую соль выпадает осадок или выделяется газ):
2NaOH+ CuSO4®Cu(OH)2¯+Na2SO4,
Ba(OH)2+Na2SO4®BaSO4¯+2NaOH, KOH(конц.)+NH4Cl(крист.)®NH3+KCl+H2O.
2. Химические свойства нерастворимых оснований:
1) взаимодействие оснований с кислотами:
Fe(OH)2+H2SO4®FeSO4+2H2O;
2) разложение при нагревании. Нерастворимые основания при нагревании разлагаются на основный оксид и воду:
Cu(OH)2®CuO+H2O
Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства. Для них также характерно образование донорно-акцепторной связи.
I. Свойства аминов как оснований (акцепторов протонов)
1. Водные растворы алифатических аминов проявляют щелочную реакцию, т.к. при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
Связь протона с амином, как и с аммиаком, образуется по донорно-акцепторному механизму за счет неподеленной электронной пары атома азота.
Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
2. Взаимодействуя с кислотами, амины образуют соли:
Соли аминов – твердые вещества, хорошо растворимые в воде. При нагревании щелочи вытесняют из них амины:
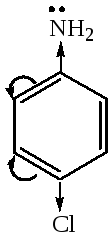
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его p-электронами.
или
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4), а его водный раствор не окрашивает лакмус в синий цвет.
Таким образом, основные свойства изменяются в ряду:
C6H5NH2 < NH3 < RNH2 < R2NH < R3N (в газовой фазе)
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:


 Отёска стен и прирубка косяков — Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу.
Отёска стен и прирубка косяков — Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу. Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) — В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар.
Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) — В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар.