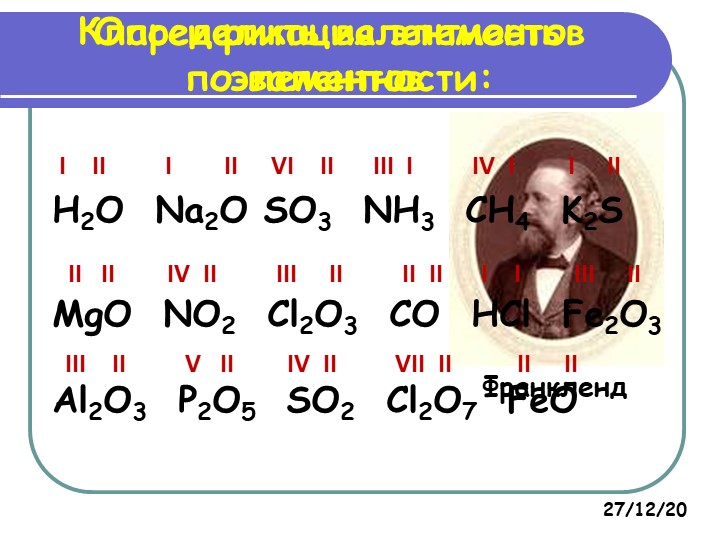
Валентность брома (Br), формулы и примеры
Общие сведения о валентности брома
В виде простого вещества бром представляет собой жидкость красно-бурого цвета, обладающую резким неприятным запахом. Ядовит. Плотность 3,19 г/см3 (при t0 = 0oC). При кипении (t0 = 58,6oC) бром из жидкого состояния переходит в газообразное – образует буро-коричневый пар.
Молекула брома двухатомна Br2.
Валентность брома в соединениях
Бром – тридцать пятый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в четвертом периоде в VIIA группе. В ядре атома брома содержится 35 протонов и 45 нейтронов (массовое число равно 80). В атоме брома есть четыре энергетических уровня, на которых находятся 35 электронов (рис. 1).
Рис. 1. Строение атома брома.
Электронная формула атома брома в основном состоянии имеет следующий вид:
1s22s22p63s23p63

А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие одного неспаренного электрона свидетельствует о том, что бром способен проявлять валентность I (низшая валентность) в своих соединениях (HBr, HBrO).
Для атома брома характерно наличие нескольких возбужденных состояний из-за того, что орбитали 4d-подуровня являются вакантными (на четвертом энергетическом слое помимо 4s- и 4p-подуровней есть еще и 4d-подуровень). Сначала распариваются электроны 4p -подуровня и занимают свободные d-орбитали, а после – электроны 4s-подуровня:
Наличие трех, пяти и семи неспаренных электронов в возбужденном состоянии свидетельствует о том, что бром проявляет в своих соединениях валентности III (AuBr3
, HBrO2), V (HBrO3) и VII (HBrO4) (высшая валентность).Примеры решения задач
Валентность брома в его соединениях
Валентность брома в его соединениях [c. 88]
88]Чему равна валентность брома, серы, фосфора в следующих соединениях НВг, Нг5 и РНз [c.65]
Валентность брома в соединениях с водородом и металлами отрицательная — минус 1, в известных кислородных соединениях — положительная — от плюс 1 до плюс 5. [c.102]
Валентность брома в соединениях с водородом и металлами I в известных кислородных соединениях — переменная от 1 до 5. [c.28]
Галогены — фтор Р, хлор С1, бром Вг, йод I — являются элементами главной подгруппы VII группы периодической системы. Они имеют на внешнем энергетическом уровне 7 электронов, в связи с чем проявляют главным образом отрицательную валентность. Соединения, в которых галогены проявляют положительную валентность (кислородные соединения), известны для всех галогенов, кроме фтора, но они являются нетипичными для них, и если образуются, то довольно легко разлагаются, оказывая при этом сильное окислительное действие, например хлорная известь Са(СЮ)2.
Молекула брома в парообразном состоянии состоит из двух атомов Вг . Атом брома на внешнем электронном слое имеет 7 электронов. Поэтому бром в соединениях с водородом и металлами образует отрицательно одновалентные ионы (Вг ). Высшая вероятная положительная валентность брома -f-7. [c.182]
К числу исключений прежде относили также бром, для которого не были известны соединения с валентностью, равной 7, но в 1968 г. был получен пербромат калия КВг 4 (валентность брома +7) из бромата калия (валентность — -5) при действии сильным окислителем (озоном, дифторидом ксенона).
[c.99] Все большее применение в технике получают так называемые соединения нестехиометрического состава, отличающиеся видимым избытком того или иного элемента. Во многих случаях видимая нестехиометричность соединений объясняется тем, что их состав рассчитывают исходя из предполагаемых, а не истинных значений эквивалентов, отвечающих действительному валентному состоянию элементов в данном веществе. Иначе говоря, эмпирические формулы так называемых нестехиометрических соединений не точно отражают их состав в них некоторые элементы должны быть представлены в двух или нескольких валентных состояниях. При этом условии, очевидно, всегда будут получаться правильные стехиометрические отношения. В вышеприведенном примере хемосорбции брома 1/2 Вг +е- Вг электроны отнимаются от ионов серебра Ag+ — — e-i-Ag2+. Складывая эти два уравнения, получаем
Иначе говоря, эмпирические формулы так называемых нестехиометрических соединений не точно отражают их состав в них некоторые элементы должны быть представлены в двух или нескольких валентных состояниях. При этом условии, очевидно, всегда будут получаться правильные стехиометрические отношения. В вышеприведенном примере хемосорбции брома 1/2 Вг +е- Вг электроны отнимаются от ионов серебра Ag+ — — e-i-Ag2+. Складывая эти два уравнения, получаем
Следовательно, галогены — типичные неметаллы. Свойство терять электроны выражено у них гораздо слабее. Свободных положительно заряженных ионов они не образуют. Согласно строению атомов их максимальная положительная валентность должна быть равна семи. Но такую валентность проявляют только хлор и нод. Наибольшая положительная валентность брома в известных его соединениях равна пяти. [c.94]
Таким образом, для увеличения общей скорости окисления углеводородов необходимо создать условия, при которых обеспечивается высокая скорость ооразования свободных радикалов и снижается скорость их рекомбинаций. Для этой цели используют катализаторные системы, состоящие из металлов переменной валентности и соединений брома. [c.45]
Для этой цели используют катализаторные системы, состоящие из металлов переменной валентности и соединений брома. [c.45]
Вопросы и задачи. 1. Привести химические знаки, атомные массы, заря ды ядер атомов элементов а) брома, б) иода, в) фтора. Объяснить название — галогены. 2. Какую валентность в соединениях с водородом, металлами и кислородом проявляет а) бром, б) иод, в) фтор 3. Рассказать о распространении в природе а) брома, б) иода, в) фтора. 4. Как получают а) бром, б) иод.
[c.107]Органические сульфиды образуют стабильные комплексные соединения с галогенами, органическими галоидпроизводными, галогенидами — тяжелых металлов и некоторыми другими веществами. Природа сил взаимодействия при комплексообразовании сульфидов с этими соединениями изучена недостаточно. Полагают [47], что донорно-акцепторная связь осуществляется за счет передачи неподеленной пары электронов атома серы на свободную валентную орбиталь атома металла (ртути, алюминия, олова, титана и др.
 ). На структуру и свойства комплексных соединений влияют условия их образования, химическое строение сульфида и соединения, вступающего с ним в реакцию [48]. При взаимодействии сульфидов с бромом или иодом иногда образуются кристаллические комплексные соединения, а при взаимодействии с йодистыми алкилами и галогенированными жирными кислотами — кристаллические сульфониевые соли. Наиболее стабильны комплексные соединения сульфидов с галогенидами ртути, ацетатом ртути, солями платины, олова, титана, палладия, алюминия. В зависимости от химического строения и условий комплексообразования сульфиды могут присоединять различное число молекул одного и того же комплексообразователя (акцептора).
). На структуру и свойства комплексных соединений влияют условия их образования, химическое строение сульфида и соединения, вступающего с ним в реакцию [48]. При взаимодействии сульфидов с бромом или иодом иногда образуются кристаллические комплексные соединения, а при взаимодействии с йодистыми алкилами и галогенированными жирными кислотами — кристаллические сульфониевые соли. Наиболее стабильны комплексные соединения сульфидов с галогенидами ртути, ацетатом ртути, солями платины, олова, титана, палладия, алюминия. В зависимости от химического строения и условий комплексообразования сульфиды могут присоединять различное число молекул одного и того же комплексообразователя (акцептора). Галоидирование. Катализаторы, наиболее часто применяющиеся для хлорирования металлическое железо, окись меди, бром, сера, иод, галоиды железа, сурьмы, олова, мышьяка, фосфора, алюминия и меди растительный и животный уголь, активированный боксит и другие глины. Большинство этих катализаторов является носителями галоидов.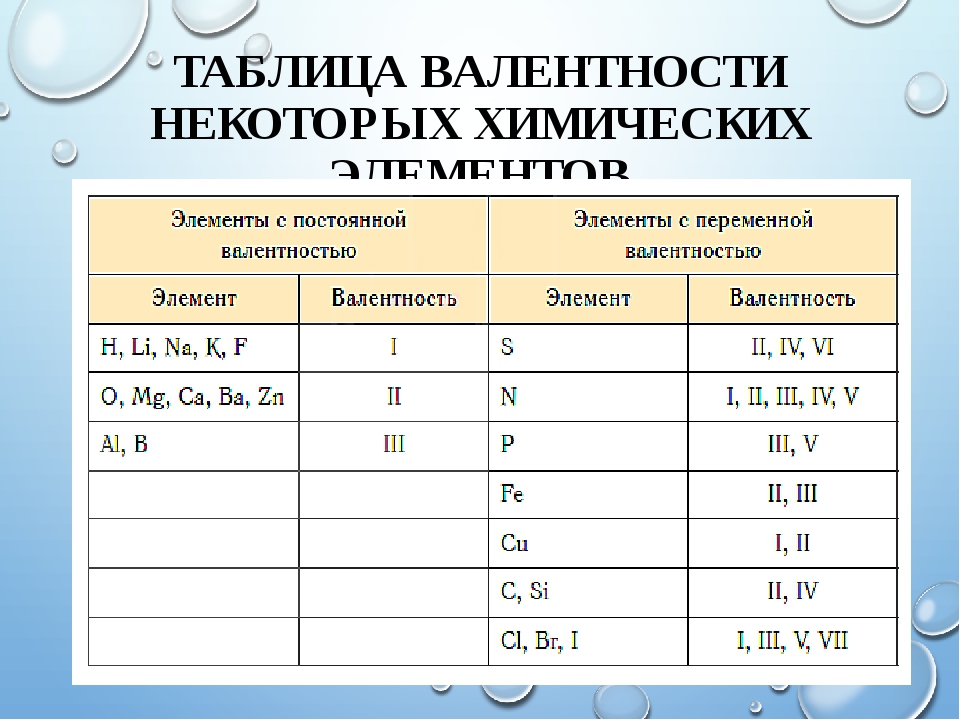
Свойство отдавать электроны выражено у атомов галогенов гораздо слабее. Фтор, как самый активный неметалл, вообще пе обладает таким свойством и не имеет положительной валентности. Остальные галогены проявляют положительную валентность в соединениях с кислородом. При этом высшую положительную валентность, равную семи, могут проявлять только хлор и йод. Наибольшая положительная валентность у брома равна пяти. Кислородные соединения галогенов менее устойчивы, чем водородные, и почти не встречаются в природе.
В соединениях с электроотрицательными элементами галогены наряду с семивалентным состоянием выступают также в пяти-, трех- и одновалентном состоянии. Хлор, кроме того, образует окисел, в котором он четырехвалентен (двуокись хлора СЮг). С химической точки зрения реакции галогенов, приводящие к различным валентным состояниям, а также их соединения могут быть лучше всего поняты, если рассматривать галогены в их соединениях с более электроотрицательными веществами электроположительно заряженными. В этом случае, например, обнаруживается правило, широко определяющее поведение галогенов, заключающееся в том, что последние в общем наиболее устойчивы в крайних, более всего различающихся валентных состояниях, т. е. когда они отрицательно одно- и положительно семи-валентны (бром соответственно пятивалентен). Однако иод в ряде случаев наряду с семивалентным проявляет и пятивалентное состояние.
[c.741] Подгруппа фтора (галогены) Н, Р, С1, Вг, I, (5 , х р ). Наружный слой состоит из 7 электронов у водорода— из 1. Максимальная положительная валентность галогенов 7 для брома и астата 5 фтор в соединениях не бывает положительно валентным. Отрицательная валентность 1. [c.84]
Наружный слой состоит из 7 электронов у водорода— из 1. Максимальная положительная валентность галогенов 7 для брома и астата 5 фтор в соединениях не бывает положительно валентным. Отрицательная валентность 1. [c.84]
Составьте энергетические диаграммы распределения электронов атомов 1) углерода, 2) азота, 3) кислорода, 4) серы, 5) хлора, 6) брома, 7) йода. Предскажите возможные валентные состояния (или степени окисления) элементов. Выделите те состояния, при которых отвечающие им соединения могут играть роли восстановителя, окислителя, а также окислителя и восстацовителя одновременно. [c.266]
В процессах окисления органических веществ в жидкой фазе часто используются не специально приготовленные катализаторы, а обычные неорганические соединения, в их состав обычно входят элементы, атомы которых легко меняют свою валентность, например Со, Си, Мо. Эти ионы, как правило, соединены с достаточно большими органическими фрагментами и образуют соли или хелаты, растворимые в окисляющемся органическом веществе.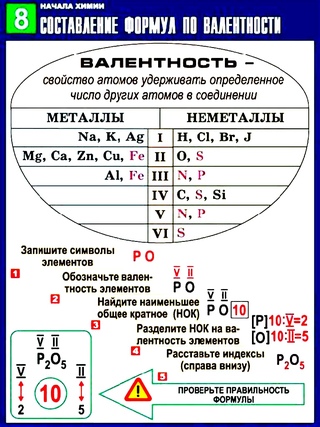
Высшая положительная валентность элементов обычно отвечает номеру группы, причем в высших оксидах и гидроксидах кислотный характер растет слева направо по периодам, а основной — ослабевает. У фтора вообще не обнаружена положительная валентность в соединениях он всегда одновалентен. Положительная валентность кислорода проявляется только в соединениях с фтором и равна двум. Железо, кобальт и никель проявляют высшую валентность соответственно шесть, четыре и три, палладий — четыре, родий, иридий и платина — шесть, бром и астат — пять. У некоторых благородных газов высшая положительная валентность достигает восьми (ХеРв). У элементов подгруппы меди в образовании валентных связей могут участвовать с1-злектроны предпоследнего уровня, поэтому их высшая положительная валентность оказывается больше номера группы — бывает +1, +2, +3. Эти элементы являются неполными аналогами элементов главной подгруппы I группы и вместе с тем продолжают развитие свойств элементов семейства железа и платиновых металлов, к которым они вплотную примыкают в системе элементов. [c.79]
Эти элементы являются неполными аналогами элементов главной подгруппы I группы и вместе с тем продолжают развитие свойств элементов семейства железа и платиновых металлов, к которым они вплотную примыкают в системе элементов. [c.79]
Выход продукта восстановления можно снизить, если в реакционную смесь предварительно ввести эквимольное количество безводного бромида магния. Как было упомянуто выше, на атоме магния в этой соли имеется больший, по сравнению с реактивом Гриньяра, дефицит электронной плотности, так как атом магния в этом соединении обеими валентностями связан с более электроотрицательными, чем атом углерода, атомами брома. Поэтому он более прочно, чем реактив Гриньяра, координируется по атому кислорода карбонильной группы, ограничивая возможность гидридного перехода от -углеродного атома радикала )еактива Гриньяра к атому углерода карбонильной группы формула (36)], и тем самым повышает выход продукта нуклеофильного присоединения.
 [c.283]
[c.283]Лишь два элемента во фторидах и хлоридах проявляют высшую степень окисления, равную 6 уран и нептуний. Замена фтора и хлора менее сильными окислителями — бромом и иодом — позволяет получить четырехвалентные соединения для урана тогда как нептуний только с бромом проявляет дань[ую валентность, а с иодом дает лишь трииодид. После нептуния изредка осуществляется валентность, равная 4, а доминирует валентность 3. [c.289]
Высшие интергалогенные соединения имеют формулы ХХ3, ХХ5 или XX,, где Х -хлор, бром или иод, а Х -фтор (единственным исключением является 1С1з, в котором Х -хлор). Из проведенного в разд. 7.7, ч. 1, обсуждения химической связи и структуры следует, что соединения такого типа образуются с участием надвалентных орбиталей центрального атома. Пользуясь теорией отталкивания валентных электронных пар (ОВЭП), изложенной в разд. 8.1, ч. 1, можно предсказать геометрическое строение таких соединений. Характер химической связи между центральным и периферическими атомами в интергалогенных соединениях можно описать и в рамках представлений [c. 295]
295]
Как видно из приведенного обзора, галогены, как правило, могут образовать между собой соединения тем с большим числом атомов, чем дальше они отстоят один от другого в периодической системе. Галогены, расположённые в периодической системе непосредственно один над другим, способны в обш ем проявлять друг по отношению к другу только о мов лент-ность лишь хлор по отношению к фтору может быть также г/)еа валентным. Бром по отношению к фтору может быть максимально гая гивалентным, а иод — максимально сел4ивалентным. [c.870]
Высшая положительная валентность брома, полученная в настоящее время, равна — -5 (соединения — -7-валснтного брома не получены). [c.197]
Гораздо слабее выражено у галогенов свойство атоиШг отдавать электроны. Фтор, как самый активный неметалл, вообще не обладает этим свойством и не проявляет положительной валентности. Остальные галогены проявляют ее в соединениях с кислородом. При этом высшая валентность +7 наблюдается только у хлора и йода. Высшая положительная валентность брома равна — -5. Кислородные соединения галогенов менее устойчивы, чем водородные, и почти не встречаются в природе. Наиболее устойчивы кислородные соединения йода. [c.153]
Высшая положительная валентность брома равна — -5. Кислородные соединения галогенов менее устойчивы, чем водородные, и почти не встречаются в природе. Наиболее устойчивы кислородные соединения йода. [c.153]
Выделение п-ксилола с помощью клатратных соединений. В последние годы был открыт класс неорганических комплексных соединений, которые способны образовывать молекулярные соединения с углеводородами [105]. Они получили название клатратных соединений [106]. Наиболее пригодны для образования клатратных соединений с углеводородами комплексы общей формулы МР4Х2, где М — элемент переменной валентности Р — пиридиновый остаток X — анион. Из ионов металлов наилучпше результаты дают двухвалентные никель, кобальт, марганец и железо. Наиболее пригодные азотистые основания — замещенные в 3- или 4-положении пиридины, а также хинолины. Анионом может быть простой одноатомный ион — хлор или бром, или многоатомный ион — тиоцианат, формиат, цианат, или нитрат [76, с. 235—298, 107]. [c.129]
[c.129]
В хлорной воде присоединение хлора идет достаточно медленно для того, чтобы почти количественно образовывался этиленхлоргидрин (см. стр. 370). Реакции олефинов с хлором и бромом в жидкой фазе идут обычно исключительно быстро 130], и применение растворителя, как правило, сказывается благоприятно. Этилен легко хлорируется при низких температурах в дихлорэтаповом растворе, как это применяется в промышленности. Хлориды элементов, образующих с хлором соединения высшей и низшей валентностей, как сурьма, железо, селен, являются эффективными катализаторами присоединения хлора к этилену. Присутствие полярных веществ можот катализировать присоединение галоидов например, реакция брома с этиленом в гааовой фазе сильно ускоряется, если стенки реактора покрыты стеариновой кислотой, но скорость реакции приближается к нулю, если стенки покрыты парафином [64]. Степень замещения хлором при реакции олефинов с хлором, как показано в табл. 3, поразительно велика [80]. Реакция замещения часто сопровождается перемещением двойной связи. [c.364]
[c.364]
В большинстве случаев галоидирование ускоряется под действием светового облучения (длина волны 3000—5000 А) или высокой температуры (в присутствии катализатора или без него). В качестве катализаторов обычно применяют галоидные соединения металлов, имеющих два валентных состояния, способные отдавать атомы галоидов при переходе из одного валентного состояния в другое, — P I5, P I3, Fe lg. Используют также хлористую сурьму или хлористый марганец, а также неметаллические катализаторы — иод, бром или фосфор. [c.259]
Исходя из строения атомов галогенов, ука-затг>, какие валентные состояния ха[)актерны для фтора, хлора, брома и иода. Какие степени окисленности проявляют галогены в своих соединениях [c.221]
Почему при непосредственном взаимодействии хлора, брома и йода с железом образуются соединения с различным валентным состоянием железа РеС1з, РеВг2 и РеЬ [c.158]
Вплоть до 1962 г. не удавалось получить валентные соединения инертных газов. Если рассмотреть величины энергий понизации неметаллов (табл. В.21), оказывается, что теоретически тяжелые инертные газы могут соединяться с другими наиболее электроотрицательными элементами. Энергия ионизации криптона практически равна энергии ионизации кислорода. Энергия ионизации ксенона ниже таковой для кислорода и хлора, и т1енамного выше, чем для брома. [c.491]
не удавалось получить валентные соединения инертных газов. Если рассмотреть величины энергий понизации неметаллов (табл. В.21), оказывается, что теоретически тяжелые инертные газы могут соединяться с другими наиболее электроотрицательными элементами. Энергия ионизации криптона практически равна энергии ионизации кислорода. Энергия ионизации ксенона ниже таковой для кислорода и хлора, и т1енамного выше, чем для брома. [c.491]
ГАЛОГЕНЫ (галоиды) — химические элементы главной подгруппы VII группы периодической системы элементов Д. И. Менделеева фтор F, хлор С1, бром Вг, иод I и астат At. Название галогены происходит от греч. hais — соль и genes — рождать. Неправильное название галоиды , которое ввел Г. И. Гесс, означает солеподобный . Атомы Г. имеют конфигурацию валентных электронов присоединяя один электрон, приобретают конфигурацию инертного газа s p . Все Г.— активные неметаллы, непосредственно соединяются с большинством элементов, образуя галогениды. Г.— энергичные окислители, их окислительная способность падает от F к I. Г. в соединениях с электроположительными элементами проявляют степень окисления— 1. С увеличением порядкового номера химическая активность Г. уменьшается, химическгя активность ненов Р , С1 , Вг , 1 увеличивается. С водородом все Г. образуют галогеноводороды — прн обычных условиях газы, из которых по свойствам значительно выделяется НР. Все галогеноводороды хорошо растворяются в воде, образуя сильные кислоты. Кислородные соединения Г. неустойчивы (кроме оксидов I), часто разлагаются со взрывом. Г. и их соединения имеют большое практическое значение в промышленности, в лабораторной практике и в быту. [c.65]
Г. в соединениях с электроположительными элементами проявляют степень окисления— 1. С увеличением порядкового номера химическая активность Г. уменьшается, химическгя активность ненов Р , С1 , Вг , 1 увеличивается. С водородом все Г. образуют галогеноводороды — прн обычных условиях газы, из которых по свойствам значительно выделяется НР. Все галогеноводороды хорошо растворяются в воде, образуя сильные кислоты. Кислородные соединения Г. неустойчивы (кроме оксидов I), часто разлагаются со взрывом. Г. и их соединения имеют большое практическое значение в промышленности, в лабораторной практике и в быту. [c.65]
В настоящее время явление химического транспорта успешно используется в целях глубокой очистки ряда веществ, как простых, так и сложных, а также для получения эпитаксиальных полупроводниковых пленок и монокристаллов. Реагентами, с помощью которых осуществляется перевод очищаемого вещества в транспортируемое соединение, помимо указанных выше оксида углерода (И) и иода служат хлор, бром, галогеноводо-роды, галогениды.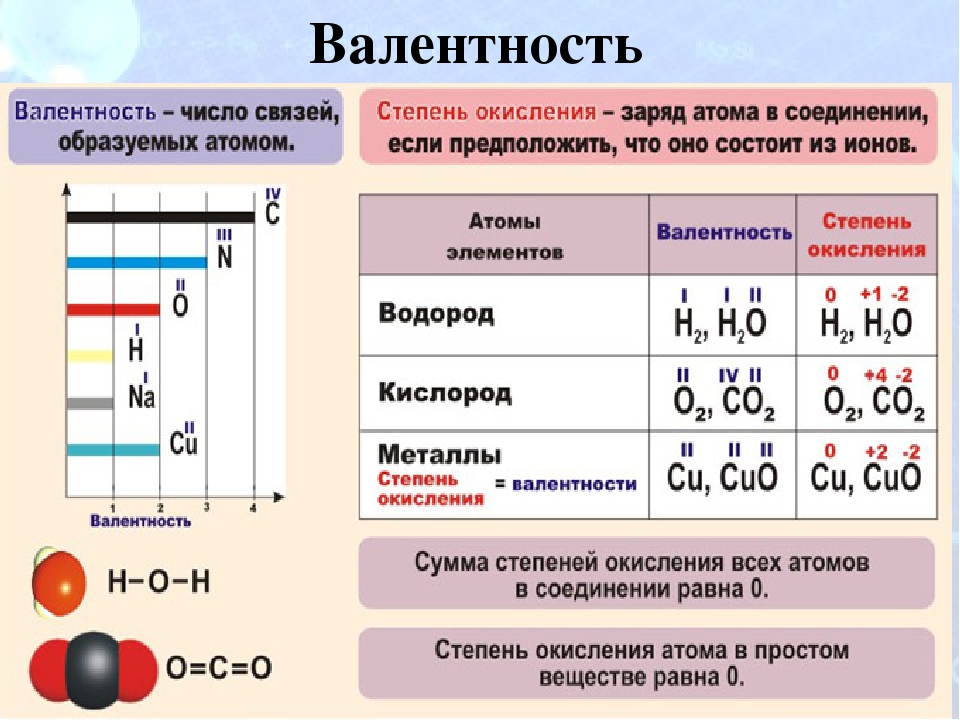 Интересно отметить, что при использовании последних процесс переноса обычно протекает через стадию образования соответствующего субгалогенида, т. е. соединения с низшей валентностью. В результате перенос вещества в целом осуществляется за счет реакции диспропорционирования, как это, например, имеет место в случае очистки элементов III— IV групп периодической системы [c.22]
Интересно отметить, что при использовании последних процесс переноса обычно протекает через стадию образования соответствующего субгалогенида, т. е. соединения с низшей валентностью. В результате перенос вещества в целом осуществляется за счет реакции диспропорционирования, как это, например, имеет место в случае очистки элементов III— IV групп периодической системы [c.22]
Пример 4 ИК-спектр неизвестного соединения, показанный на рис. 1.14, надо использовать для получения первичной информации о природе вещества. Важнейшая особенность этого спектра состоит в отсутствии полос валентных колебаний С—Н на участке 2800— 3000 см , следовательно, вещество вообще не содержит алкильных или циклоалкильных радикалов. Две довольно интенсивные узкие полосы 3070 и 3110 см — по своему положению и контуру должны быть приписаны валентным колебаниям водорода при ароматических кольцах или двойных связях. (Повышенное значение частоты 3110 см — может рассматриваться как указание на гетероароматическую структуру. ) Никаких других полос валентных колебаний водорода в спектре нет, так что несомненно отсутствуют т кие функциональные группы, как ОН, СООН, ЫН, 8Н, 51Н, PH. Огсутствуют также тройные связи, но в области двойных связей имеются две неполностью разрешенные полосы 1550 и 1580 см» , которые можно приписать ароматическим кольцам или сопряженным поли-енам. Невысокая их интенсивность свидетельствует скорее в пользу первых. В пользу ароматических структур может быть истолковано и наличие нескольких слабых полос в области 1650— 2000 см . При отсутствии водорода алкильных и циклоалкильных радикалов можно ожидать радикалов, полностью замещенных галогеном. Наличие перфторалкильных групп маловероятно, так как в области 1400— 1100 см имеются только две полосы, однако перхлоралкильные группировки могут присутствовать, поскольку в спектре имеется очень сильная широкая полоса 720 см» с неоднозначным истолкованием. Относительно бром- и кислородсодержащих группировок рас- [c.25]
) Никаких других полос валентных колебаний водорода в спектре нет, так что несомненно отсутствуют т кие функциональные группы, как ОН, СООН, ЫН, 8Н, 51Н, PH. Огсутствуют также тройные связи, но в области двойных связей имеются две неполностью разрешенные полосы 1550 и 1580 см» , которые можно приписать ароматическим кольцам или сопряженным поли-енам. Невысокая их интенсивность свидетельствует скорее в пользу первых. В пользу ароматических структур может быть истолковано и наличие нескольких слабых полос в области 1650— 2000 см . При отсутствии водорода алкильных и циклоалкильных радикалов можно ожидать радикалов, полностью замещенных галогеном. Наличие перфторалкильных групп маловероятно, так как в области 1400— 1100 см имеются только две полосы, однако перхлоралкильные группировки могут присутствовать, поскольку в спектре имеется очень сильная широкая полоса 720 см» с неоднозначным истолкованием. Относительно бром- и кислородсодержащих группировок рас- [c.25]
Фосфор — неметалл. В своих соединениях проявляет валентность, равную —3, -ЬЗ и +5. Энергично соединяется со многими элементами кислородом, хлором, бромом, серой и др. С водородом известно несколько соединений, простейшим из которых является фосфористый водород РНз (фосфин). Вещество, аналогичное аммиаку Nh4, но значительно менее прочное. Фосфин — ядовитый газ. Ph5J — йодистый фосфоний. [c.479]
В своих соединениях проявляет валентность, равную —3, -ЬЗ и +5. Энергично соединяется со многими элементами кислородом, хлором, бромом, серой и др. С водородом известно несколько соединений, простейшим из которых является фосфористый водород РНз (фосфин). Вещество, аналогичное аммиаку Nh4, но значительно менее прочное. Фосфин — ядовитый газ. Ph5J — йодистый фосфоний. [c.479]
Галогены, расположенные рядом в группе, образуют соединения, в которых они одновалентны исключение представляет хлор, образующий с фтором соединение IF3. Бром по отношению к фтору может быть трех- и пятивалентным, а иод пяти- и семивалентным. Иод по отношению к хлору имеет наивысшую валентность —три. [c.613]
Как видно из рассмотренного выше материала, аналогия брома и иода с хлором в их кислородных соединениях выражена уже далеко не столь полно, как в водородных закономерный характер изменения свойств при переходе по ряду С1—Вг—I здесь ограничивается главным образом кислотами типов НОГ и НГО3 и их солями. О кислородных соединениях астата известно лишь, что они существуют, причем высшая степень окисления отвечает иону АЮГ, т. е. валентности -f5. [c.273]
О кислородных соединениях астата известно лишь, что они существуют, причем высшая степень окисления отвечает иону АЮГ, т. е. валентности -f5. [c.273]
Задача по химии №20
| Исходя из электронных структур атомов марганца и брома, их места в периодической системе, объясните сходство и различие их химических свойств. | |
|
Решение:
|
|
Бром и его действие на организм человека. Справка
При обычных условиях бром – тяжелая жидкость с резким запахом, в отраженном свете темно фиолетового, почти черного цвета, в проходящем – темно красного; легко образует желто бурые пары. Температура плавления 7,25 °С, температура кипения 59,2 °С.
Бром растворим в воде (3,58 г в 100 г при 20 °С), в присутствии хлоридов (химические соединения хлора) и особенно бромидов (химические соединения брома) растворимость повышается, а в присутствии сульфатов понижается.
По реакционной способности бром занимает промежуточное положение между хлором и йодом.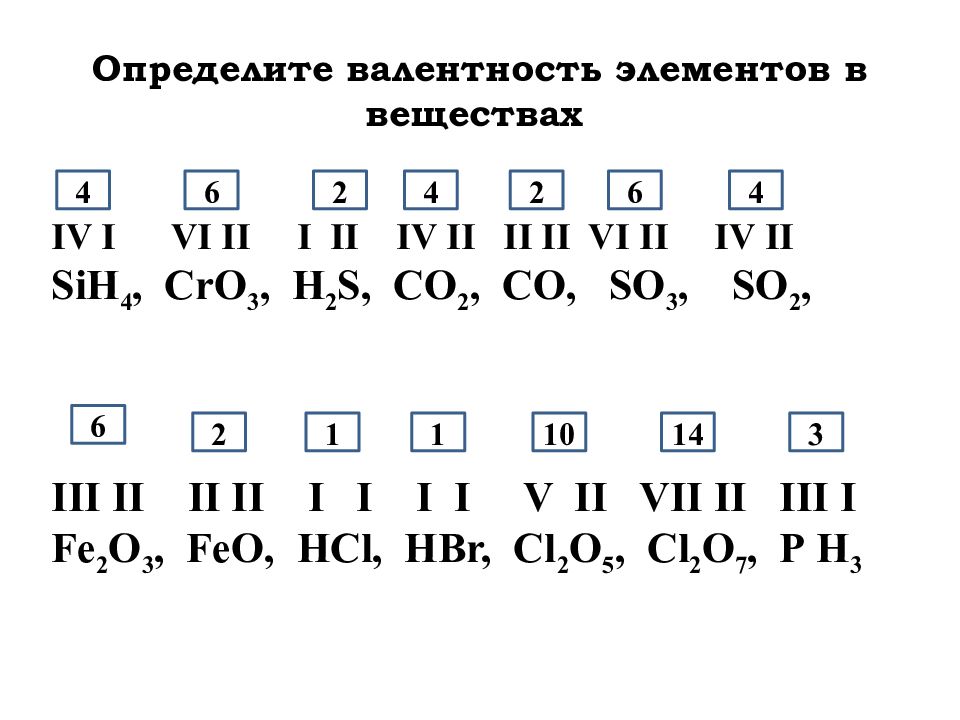 С другими галогенами (фтором, хлором, йодом) образует неустойчивые соединения, отличающиеся высокой химической активностью.
С другими галогенами (фтором, хлором, йодом) образует неустойчивые соединения, отличающиеся высокой химической активностью.
С кислородом и азотом бром непосредственно не реагирует даже при повышенных температурах, его нестойкие соединения с этими элементами получают косвенными методами. Бром также не вступает в реакцию с углеродом.
При взаимодействии со многими металлами бром образует бромиды. К действию брома устойчивы тантал и платина, в меньшей степени — серебро, титан и свинец.
Бром – сильный окислитель.
Бром – довольно редкий в земной коре элемент. Его содержание в ней оценивается в 0,37х10 4 (примерно 50 е место).
Химически бром высоко активен и поэтому в свободном виде в природе не встречается. Входит в состав большого числа различных соединений (бромиды натрия, калия, магния и др.), сопутствующих хлоридам натрия, калия и магния. Собственные минералы брома – бромаргирит (бромид серебра) и эмболит (смешанный хлорид и бромид серебра) – чрезвычайно редки.
Источником брома служат воды горьких озер, соляные рассолы, сопутствующие нефти и различным соляным месторождениям, и морская вода. В настоящее время бром обычно извлекают из вод некоторых горьких озер, одно из которых расположено, в частности, в Кулундинской степи на Алтае.
Бром применяют при получении ряда неорганических и органических веществ, в аналитической химии. Соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения. Широко известны содержащие бром лекарственные препараты.
Бром ядовит: токсическая доза для организма составляет 3 г, летальная – от 35 г.
При содержании брома в воздухе 0,001% наблюдаются раздражение слизистых оболочек, головокружение, кровотечение из носа. При концентрации 0,02% – удушье, спазмы, заболевание дыхательных путей. Попадание на кожу жидкого брома вызывает зуд, при длительном действии образуются медленно заживающие язвы.
Бром оказывает очень глубокое действие на лимфатические железы, в особенности на околоушную железу, яичники и яички. Он вызывает быстрое увеличение их в объеме и особого рода затвердение: пораженная железа тверда, как камень. Важная характеристика: поражаются железы только на левой стороне.
Он вызывает быстрое увеличение их в объеме и особого рода затвердение: пораженная железа тверда, как камень. Важная характеристика: поражаются железы только на левой стороне.
При внутреннем употреблении малых доз и очень высоких разведений бром производит своеобразное действие на головной и спинной мозг – он понижает интеллектуальную работоспособность и подавляет рефлекторную возбудимость, возбуждает сонливость.
При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух. Для восстановления дыхания можно пользоваться тампоном, смоченным нашатырным спиртом, периодически поднося его к носу пострадавшего на короткое время. Дальнейшее лечение должно проводиться под наблюдением врача.
При бытовом отравлении бромом или бромидами, принятыми внутрь: дать пострадавшему молока с размешанным в нем яйцом, несколько раз вызвать рвоту, контролируя, чтобы рвотные массы не попали в дыхательные пути. Можно также дать выпить теплый крахмальный или мучной клейстер и активированный уголь. Внутрь для выведения брома из организма в течение дня необходимо принять 10 30 г поваренной соли в большом количестве воды (3 5 л). Дальнейшее лечение – симптоматическое.
Внутрь для выведения брома из организма в течение дня необходимо принять 10 30 г поваренной соли в большом количестве воды (3 5 л). Дальнейшее лечение – симптоматическое.
Кожа, обожженная жидким бромом, промывается многократно водой.
Из-за высокой химической активности и ядовитости как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде. Склянки с бромом располагают в емкостях с песком, который предохраняет склянки от разрушения при встряхивании. Из за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда ядовитая жидкость окажется на полу).
Мерами индивидуальной защиты являются применение фильтрующих промышленных противогазов, резиновых перчаток, сапог, фартуков, строгое выполнение правил техники безопасности.
Материал подготовлен на основе информации открытых источников
Электронные формулы марганца, брома и ванадия. Задачи 4
Электронные структуры атомов марганца и брома
Задача 4
Исходя из электронных структур атомов марганца и брома, их места в периодической системе, объясните сходство и различие их химических свойств.
Решение:
Марганец — 25 –й элемент таблицы Менделеева. Электронная формула марганца имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d5
Валентные электроны находятся на 4s и 3d подуровнях. На валентных орбиталях атома марганца находится 7электронов.
Бром – 35 элемент периодической таблицы Электронная формула брома имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Валентные электроны находятся на 4s и 4р подуровнях. На валентных орбиталях атома находится 7 электронов.
Таким образом, марганец и бром не являются электронными аналогами и не должны размещаться в одной и той же подгруппе. Но на валентных орбиталях атомов этих элементов находится одинаковое число электронов – 7. Поэтому оба элемента помещают в одну и ту же группу периодической системы Д.И.Менделеева. Марганец – d-элемент VIIB-группы, а бром – p-элемент VIIA-группы.
Но на валентных орбиталях атомов этих элементов находится одинаковое число электронов – 7. Поэтому оба элемента помещают в одну и ту же группу периодической системы Д.И.Менделеева. Марганец – d-элемент VIIB-группы, а бром – p-элемент VIIA-группы.
На внешнем энергетическом уровне у атома марганца два электрона, а у брома – семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем уровне содержат более трех электронов, обладают определенным сродством к электрону, а следовательно, приобретают отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих p- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома.
Общей закономерностью для всех групп, содержащих p- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома.
Электронная формула ванадия
Задача 5.
Напишите электронно-графическую формулу для 23 элемента, определите его валентные электроны и охарактеризуйте их с помощью квантовых чисел.
Решение:
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, p, d, f), x – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+1 (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+1 (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s>2s>2р>3s>3р>4s>3d>4р>5s>4d>5р>6s>(5d1) >4f>5d>6р>7s>(6d1-2)>5f>6d>7р
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для 23 элемента — ванадия( V –порядковый № 23) электронная формула имеют вид:
V23 1s22s22р63s23р64s23d3
Валентные электроны ванадия — 4s23d3 — находятся на 4s и 3d подуровнях На валентных орбиталях атома ванадия находится 5 электронов.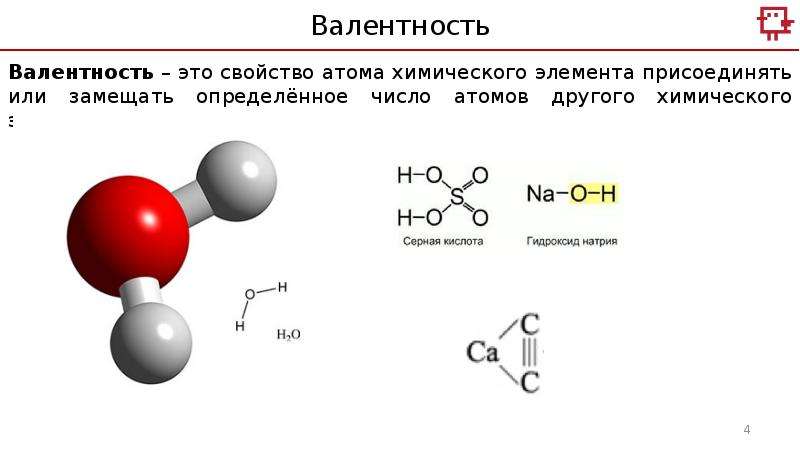 Поэтому элемент помещают в пятую группу периодической системы Д.И.Менделеева.
Поэтому элемент помещают в пятую группу периодической системы Д.И.Менделеева.
Оксид брома(V), химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Сколько валентных электронов имеет бром (Br)? [Валентность брома]
Бром , химическое вещество элемент с символом Br и атомным номером 35 является очень активным газом, так что не встречается в свободном состоянии, но существует в виде галогенидных солей или столовых солей. В стандарте температуре и давлении, он находится в виде жидкости, подобной ртути.
Вы здесь, чтобы знаете валентные электроны атома брома, не так ли? Не волнуйтесь вместе с бромом валентных электронов мы объясним и его валентность.Но перед этим давайте некоторые основные идеи о том, что эти два термина:
Разница между Валентные электроны и валентность
Валентные электроны
общее количество электронов, присутствующих на внешней оболочке атома
(т.е. на самой внешней орбите). Валентные электроны нейтрального атома равны
всегда определена, она не может изменяться (более или менее) ни при каких условиях для
конкретного атома и может быть или не быть равным его валентности.
Валентность определена как общее количество электронов, которые атом может потерять, приобрести или разделить за это время. образования связи для получения стабильной электронной конфигурации i.е. завершить октет. Валентность атома может быть разной в разных соединениях или химические реакции из-за различных условий соединения. Большую часть времени валентность меняется/изменяется из-за изменения степеней окисления и восстановления.
Бром (Br) Валентные электроны
Есть четыре простых шаги, чтобы узнать валентные электроны для атома брома, которые:
Шаг 1: Найдите Атомный номер
Узнать атомный номер брома, мы можем использовать периодическую таблицу.С помощью периодической таблицы, мы можем легко увидеть, что атомный номер брома равен 35. Поскольку его атомный номер 35, он имеет 35 протонов, а для нейтрального брома число протонов всегда равно числу электронов, т.е. имеет 35 электронов в его ядро.
Шаг 2: Напишите Электронная конфигурация
Электрон
конфигурация – это расположение электронов на орбиталях. Атом брома
имеет в общей сложности 35 электронов, поэтому мы должны поместить 35 электронов на орбитали.То
электроны будут размещены на разных орбиталях в зависимости от энергетического уровня:
[1с, 2с, 2п, 3с, 3п, 4с, 3д, 4п, 5с, 4д, 5п, 6с, 4ж, 5д, 6п, 7с, 5ф]. Сейчас
Атом брома
имеет в общей сложности 35 электронов, поэтому мы должны поместить 35 электронов на орбитали.То
электроны будут размещены на разных орбиталях в зависимости от энергетического уровня:
[1с, 2с, 2п, 3с, 3п, 4с, 3д, 4п, 5с, 4д, 5п, 6с, 4ж, 5д, 6п, 7с, 5ф]. Сейчас
Бром электрон конфигурация Br (35) = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 903 2 49093 конфигурация).
= [Ar] 4s² 3d¹⁰ 4p⁵(сокращенная конфигурация).
Шаг 3: Определить Валанс Шелл
Как известно, валентную оболочку атома можно найти по наибольшему числу принципиальных квантовые числа выражаются через n, а в [Ar] 4s² 3d¹⁰ 4p⁵ наибольшее значение n равно 4, так что валентная оболочка брома равна 4s² 3d¹⁰ 4p⁵.
Шаг 4: Найдите Валентные электроны
Общее количество
электроны, находящиеся на валентной оболочке атома, называются валентными электронами,
а всего на валентной оболочке брома присутствует семь электронов. (4с² 3д¹⁰ 4п⁵). Таким образом, бром имеет семь валентных электронов.
(4с² 3д¹⁰ 4п⁵). Таким образом, бром имеет семь валентных электронов.
Валентность брома (Бр)
Есть много различные способы узнать валентность атома, которая отражает способность атом для связи с другими атомами. Валентность описывает, насколько легко атом или свободный радикал может сочетаться с другими химическими видами.Валентность атома определяется на основе количества электронов, потерянных, полученных или разделенных с другого атома в момент образования связи.
Говорят, что атом
быть стабильным, когда его самые внешние оболочки имеют восемь электронов (кроме H и He).
Если общее количество электронов на самых внешних оболочках составляет от одного до четырех,
атом имеет положительную валентность, и если электронов от четырех до восьми,
валентность рассчитывается путем вычитания из восьми, и валентность будет равна нулю. Атомы
наличие четырех крайних электронов имеет как положительную, так и отрицательную валентность, и
атомы, имеющие восемь крайних электронов, валентность будет равна нулю (т. е. благородный
газы).
е. благородный
газы).
Элементы, такие как бром может достичь стабильного состояния (ближайшая конфигурация инертного газа: Ar), получив один электрон. Так что валентность брома равна 1,
.Математически электронная конфигурация брома 2, 8, 18, 7. А как известно, если электронов в самой внешней оболочке превышают от 4, его следует вычесть из 8. Итак,
Электрон Конфигурация брома (Br) = 2, 8, 18, 7
Мы можем видеть самая внешняя оболочка брома имеет 7 электронов, поэтому ее нужно вычесть из 8.
8 – 7 = 1
Вот почему валентность брома 1.
Примечание: Обычно бром
имеет стабильную степень окисления -1 большую часть времени, но может отличаться
некоторые соединения со значениями 0 (Br2), +1 (NaBrO), +3 (NaBrO2), +4 (BrO3), +5 (NaBrO3),
+7 (NaBrO4). Не путайте с -1 или еще с чем-то (+1, +3, +4 и т.д.) с положительным или отрицательным знаком, это просто степень окисления, которая может варьироваться от соединения к соединению. Но его валентность в любом случае всегда равна 1.
Но его валентность в любом случае всегда равна 1.
В другом смысле атом брома может образовывать максимум одну ковалентную связь в химической связи (например: HBr, Ch4Br, CaBr2 и др.), а то, что такое валентность, максимальная способность к образованию связи с атомами во время химической связи.
Мы также можем найти валентность брома с помощью таблицы Менделеева. Как бром принадлежит к группе 17 (17A или VIIA) вместе с фтором (F), хлором (Cl), йодом (I) и астатин (Ат). Эти элементы группы также называются галогенами .Все эти элементы иметь валентность один.
валентных электронов брома | Валентность брома (Br) Точечная диаграмма
Получите полное представление о валентных электронах брома здесь, в статье. Далее вы будете изучать элементы с другими важными свойствами. В химии бром — это химический элемент с атомным номером 35. В периодической таблице он имеет обозначение Br.
Сколько валентных электронов имеет
Бром ? Бром относится к группе галогенов и, следовательно, имеет аналогичные свойства. Будучи элементом галогена, бром может легко испаряться при данной комнатной температуре. Бром впервые был открыт в 1825 году двумя химиками вместе. Он также имеет химические свойства между йодом и хлором.
Будучи элементом галогена, бром может легко испаряться при данной комнатной температуре. Бром впервые был открыт в 1825 году двумя химиками вместе. Он также имеет химические свойства между йодом и хлором.
В природе бром имеет наименьшую свободную форму, поэтому он содержится в источнике минеральной воды. Второй источник брома находится в горных породах земной коры. Бромидная соль содержит незначительное количество брома в качестве побочного продукта. Кроме того, в океанах содержится значительное количество брома, но его трудно добывать.
Соединенные Штаты и Израиль являются странами, имеющими значительные местные источники брома. Страны обычно экспортируют необходимое количество брома в другие страны.
Основное потребление брома идет на производство броморганических соединений. Другая значительная часть используется в производстве антипиренов. Некоторое количество брома полезно использовать в качестве пестицидов для сельскохозяйственных культур. Итак, в заключение, бром имеет очень ограниченное практическое применение на данный момент.
Итак, в заключение, бром имеет очень ограниченное практическое применение на данный момент.
Вы можете изучить валентные электроны брома с помощью точечной диаграммы Льюиса. На диаграмме показано общее количество валентных электронов атомов брома.
Точечная диаграмма дополнительно помогает понять взаимодействие валентных электронов. Он рисует количество точек вокруг символа Br как валентных электронов.
Валентность бромаНу, точная валентность брома остается равной 7 в качестве его комбинирующей способности.Итак, у него 7 валентных электронов на внешней энергетической оболочке.
Сколько валентных электронов имеет бром(Br)?
35-й элемент периодической таблицы — бром. Элемент 17-й группы — бром, его символ — «Br». Бром является галогенным элементом. Бром образует связи через свои валентные электроны. В этой статье подробно обсуждаются валентные электроны брома (Br). Надеюсь, после прочтения этой статьи вы подробно узнаете о валентных электронах брома.
Надеюсь, после прочтения этой статьи вы подробно узнаете о валентных электронах брома.
Сколько протонов и электронов имеет бром(Br)?
Ядро расположено в центре атома. Протоны и нейтроны находятся в ядре. Атомный номер брома — 35. Атомный номер — это число протонов.
То есть число протонов в броме (Br) равно тридцати пяти. Электроны, равные протонам, расположены в круглой оболочке вне ядра. То есть атом брома имеет всего тридцать пять электронов.
Каковы валентные электроны брома (Br)?
Бром является неметаллическим элементом.Бром является элементом 17 группы. Валентный электрон — это общее количество электронов на последней орбите (оболочке). Общее количество электронов в последней оболочке после электронной конфигурации брома (Br) называется валентными электронами брома. Валентные электроны определяют свойства элемента и участвуют в образовании связей.
Электронная конфигурация атома брома (Br) (модель Бора) 35-й элемент периодической таблицы — бром. То есть атом элемента брома имеет всего тридцать пять электронов.Электронная конфигурация брома показывает, что последняя оболочка брома имеет в общей сложности семь электронов.
То есть атом элемента брома имеет всего тридцать пять электронов.Электронная конфигурация брома показывает, что последняя оболочка брома имеет в общей сложности семь электронов.
То есть мы легко можем сказать, что у брома семь валентных электронов. На этом сайте есть статья с подробным описанием электронной конфигурации брома, вы можете прочитать ее, если хотите.
Как рассчитать количество валентных электронов в атоме брома?
Теперь мы будем знать, как легко определить валентный электрон брома (Br). Валентный электрон необходимо определить, выполнив несколько шагов.Электронная конфигурация является одной из них. Невозможно определить валентный электрон без электронной конфигурации.
Правильно зная электронную конфигурацию, очень легко определить валентные электроны всех элементов. На этом сайте опубликована статья с подробным описанием электронной конфигурации, вы можете прочитать ее, если хотите. Однако в этой статье кратко обсуждается электронная конфигурация брома.
Ученый Нильс Бор первым дал представление об орбите атома.Он представил модель атома в 1913 году. Там дается полное представление об орбите. Электроны атома вращаются вокруг ядра по определенной круговой траектории. Эти круговые пути называются орбитами (оболочками). Эти оболочки выражаются n. [ п знак равно 1,2 3 4 . . .]
K — название первой орбиты, L — второй, M — третьей, N — название четвертой оболочки. Электронная удерживающая способность каждой орбиты составляет 2n 2 .
Теперь
- n = 1 для K-орбиты.
Электронная удерживающая способность K-орбиты составляет 2n 2 = 2 × 1 2 = 2 электрона. - Для L-орбиты n = 2.
Электронная емкость L-орбиты составляет 2n 2 = 2 × 2 2 = 8 электронов. - n=3 для М-орбиты.
Максимальная емкость для электронов на М-орбите составляет 2n 2 = 2 × 3 2 = 18 электронов. - n=4 для N-орбиты.
Максимальная емкость для электронов на N-орбите составляет 2n 2 = 2 × 4 2 = 32 электрона.
В дополнение к этому методу конфигурация электронов может быть выполнена с помощью суборбит. Немецкий физик Ауфбау впервые предложил идею конфигурации электронов через суборбиты . Метод Ауфбау заключается в том, чтобы выполнить конфигурацию электрона через подэнергетический уровень.
Электронная конфигурацияЭти суборбитали обозначаются буквой «l». Принцип Ауфбау заключается в том, что электроны, присутствующие в атоме, сначала завершают орбиталь с самой низкой энергией, а затем постепенно продолжают завершать орбиталь с более высокой энергией.Эти орбитали называются s, p, d, f. Электронная удерживающая способность этих орбиталей составляет s = 2, p = 6, d = 10 и f = 14.
Однако валентные электроны можно легко идентифицировать, расположив электроны в соответствии с принципом Бора. Теперь мы научимся определять валентный электрон брома.
Шаг-1: Определение общего количества электронов в броме (Br)
1-й нам нужно знать общее количество электронов в атоме брома. Чтобы узнать количество электронов, нужно знать количество протонов в броме.А чтобы узнать количество протонов, нужно знать атомный номер элемента брома.
Чтобы узнать количество электронов, нужно знать количество протонов в броме.А чтобы узнать количество протонов, нужно знать атомный номер элемента брома.
Чтобы узнать атомный номер, нам нужно воспользоваться помощью периодической таблицы. Необходимо знать атомный номер бромистого элемента из таблицы Менделеева. Атомный номер — это количество протонов. А электроны, равные протонам, находятся вне ядра.
Положение брома(Br) в таблице МенделееваТо есть, можно окончательно сказать, что в атоме брома(Br) есть электроны, равные атомному номеру.Из таблицы Менделеева мы видим, что атомный номер брома равен 35. То есть атом брома имеет всего тридцать пять электронов.
Этап-2: Необходимо определить электронную конфигурацию брома
Этап-2 очень важен. На этом этапе электроны брома должны быть организованы. Мы знаем, что атомы брома имеют в общей сложности тридцать пять электронов. Электронная конфигурация брома показывает, что есть два электрона на K-оболочке, восемь на L-оболочке, восемнадцать на M-оболочке и семь на N-оболочке (орбите).
То есть первая оболочка брома (Br) имеет два электрона, вторая оболочка имеет восемь электронов, 3-я оболочка имеет восемнадцать электронов и 4-я оболочка (последняя орбита) имеет семь электронов. Число электронов на оболочку брома равно 2, 8, 18, 7. Электронная конфигурация брома на подорбите: 2 3d 10 4p 5 .
Этап-3: Определение валентной оболочки и расчет общего числа электронов
Третий шаг — диагностика валентной оболочки. Последняя оболочка после электронной конфигурации называется валентной оболочкой. Общее число электронов в валентной оболочке называется валентным электроном. Электронная конфигурация брома (Br) показывает, что последняя оболочка брома имеет семь ( 4s 2 4p 5 ) электронов. Следовательно, валентных электронов брома семь.
Электроны валентности для брома (Br)
Какова валентность брома (Br)?
Способность одного атома элемента присоединяться к другому атому при образовании молекулы называется валентностью (валентностью). Число неспаренных электронов на последней орбите элемента является валентностью этого элемента.
Число неспаренных электронов на последней орбите элемента является валентностью этого элемента.
Электронная конфигурация брома в взволнованном Бромине BR * (35) = 1S 2 2S 2 2P 6 3S 2 3P 6 4S 2 3D 10 4P x 2 4p y 2 4p z 1 . Электронная конфигурация брома показывает, что на последней орбите брома есть неспаренный электрон.Следовательно, валентность брома (Br) равна 1.
Сколько валентных электронов имеет ион брома (Br
– )?Элементы, имеющие 5, 6 или 7 электронов на последней оболочке, получают электроны последней оболочки во время образования связи. Элементы, которые принимают электроны и образуют связи, называются анионами. То есть бром является анионным элементом.
Валентность и валентные электроны брома(Br)Br + e – → Br –
Последняя оболочка принимает электрон и превращается в ион брома (Br – ). Электронная конфигурация BROMINE ION (BR — ) составляет 1S 2 2S 2 2P 2 2P 6 3S 2 3P 6 4S 2 3D 10 4P 6 . Электронная конфигурация ионов брома показывает, что ионы брома имеют четыре оболочки, а последняя оболочка имеет восемь электронов.
Электронная конфигурация BROMINE ION (BR — ) составляет 1S 2 2S 2 2P 2 2P 6 3S 2 3P 6 4S 2 3D 10 4P 6 . Электронная конфигурация ионов брома показывает, что ионы брома имеют четыре оболочки, а последняя оболочка имеет восемь электронов.
Электронная конфигурация показывает, что ион брома приобрел электронную конфигурацию криптона. Поскольку последняя оболочка иона брома имеет восемь электронов, валентных электронов иона брома (Br – ) восемь.
Сколько валентных электронов имеет бром?
Что такое валентные электроны? — Урок для детей
Откройте для себя особую группу электронов, называемую валентными электронами. Узнайте, как электроны расположены вокруг ядра атома, где расположены валентные электроны и как предсказать количество валентных электронов для элемента.
Узнайте, как электроны расположены вокруг ядра атома, где расположены валентные электроны и как предсказать количество валентных электронов для элемента.
Химические связи I: ковалентные
Ковалентная связь возникает, когда два атома имеют общие электроны.Узнайте о химической связи, узнайте, как образуются ковалентные связи, откройте для себя валентные электроны и изучите структуру молекулы.
Изотопы и средняя атомная масса
Изотопы — это вариации одного и того же элемента с разным числом нейтронов и, следовательно, с разной атомной массой. Узнайте, как ученые рассматривают изотопы при расчете средней атомной массы.
Узнайте, как ученые рассматривают изотопы при расчете средней атомной массы.
Что такое движение? — Определение и уравнения
Движение возникает, когда что-то движется, и является относительным в зависимости от того, с чем измеряется движение.Изучите определение и уравнения движения и ускорения и научитесь использовать их на примере расчета.
Эксперимент с катодным излучением: резюме и объяснение
В экспериментах с катодными лучами используются катодные лучи, пучки невидимых частиц в вакуумных ваннах для изучения поведения субатомных частиц.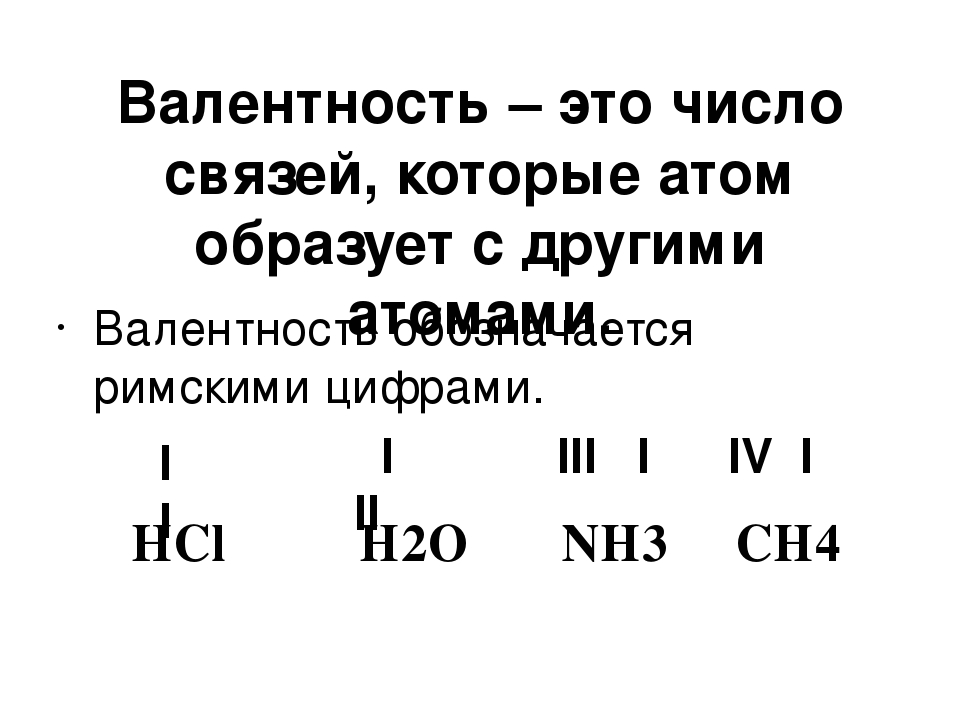 Узнайте о первом эксперименте с катодным излучением в 1897 году и о том, как интерпретировались результаты для доказательства присутствия электронов.
Узнайте о первом эксперименте с катодным излучением в 1897 году и о том, как интерпретировались результаты для доказательства присутствия электронов.
Электроотрицательность | Примеры и тенденции
Выучите определение электроотрицательности.Посмотрите пример электроотрицательности и узнайте, как найти электроотрицательность, используя правильные инструменты для измерения.
Правило октетаи структура атомов Льюиса
Что такое правило октета? Изучите определение правила октетов и структуры Льюиса. См. правила рисования структуры Льюиса и ее зависимость от периодической таблицы.
См. правила рисования структуры Льюиса и ее зависимость от периодической таблицы.
Точка эквивалентности: определение и расчет
Точка эквивалентности химической реакции достигается, когда реагенты достигают идеального числа.Узнайте больше о точках эквивалентности, внимательно изучив их определение и простые, сложные примеры расчета и титрования.
Теплопередача и фазовые переходы
Теплопередача происходит, когда вступают в контакт объекты с разной температурой, а фазовые переходы происходят, когда температура влияет на расстояние между молекулами. Узнайте о теплопередаче и фазовых переходах, в том числе о роли, которую первое может сыграть во втором.
Узнайте о теплопередаче и фазовых переходах, в том числе о роли, которую первое может сыграть во втором.
Элементы урока для детей: определение и факты
Узнайте о различных элементах, из которых состоит вся материя во Вселенной.Исследуйте, что определяет элементы, их материальные состояния, атомный номер и символ элементов, а также то, как они расположены в периодической таблице.
Прокламация об освобождении: сводка и анализ
Прокламация об освобождении 1863 года сместила акцент Гражданской войны в США с сохранения целостности Союза на освобождение рабов. Изучите этот знаменательный документ с помощью краткого изложения и анализа и изучите предысторию, предшествовавшую его выпуску.
Изучите этот знаменательный документ с помощью краткого изложения и анализа и изучите предысторию, предшествовавшую его выпуску.
Неполярная ковалентная связь: определение и примеры
Неполярная ковалентная связь возникает, когда атомы поровну делят свои внешние электроны друг с другом.Узнайте об определении неполярной связи, о том, почему атомы связаны, о равном и неравном распределении электронов и электронной плотности.
Br Информация об элементе брома: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементов
История брома
Элемент бром был открыт Антуаном Жеромом Баларом в
1826 г. во Франции
.Бром
получил свое название от греческого bromos, что означает «вонь».
во Франции
.Бром
получил свое название от греческого bromos, что означает «вонь».
Присутствие брома: изобилие в природе и вокруг нас
В таблице ниже показано содержание брома во Вселенной, на Солнце, в метеоритах, Земная кора, океаны и тело человека.
Кристаллическая структура брома
Твердотельная структура брома представляет собой орторомбическую структуру с центром в основании .
Кристаллическую структуру можно описать с точки зрения ее элементарной ячейки. Единичные клетки повторяются в три объемное пространство для формирования конструкции.
Параметры ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| и | б | с |
|---|---|---|
672. 65 65 | 464,51 | 870,23 вечера |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π/2 | №/2 | №/2 |
Положения атомов внутри элементарной ячейки описываются набором положений атомов ( x i , y i , z i ) измеряется от опорной точки решетки.
Свойства симметрии кристалла описываются понятием пространственных групп. Все возможное
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются различными.
Атомные и орбитальные свойства брома
Атомы брома имеют 35 электронов и структура электронной оболочки [2, 8, 18, 7] с атомарным символом (квантовыми числами) 2 P 3/2 .
Оболочечная структура брома – количество электронов на единицу энергии уровень
| нет | с | р | д | ф | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | л | 2 | 6 | ||
| 3 | М | 2 | 6 | 10 | |
| 4 | Н | 2 | 5 |
Электронная конфигурация брома в основном состоянии — нейтральная Атом брома
Электронная конфигурация нейтрального атома брома в основном состоянии
[Ар] 3d10 4s2 4p5. Часть конфигурации брома, эквивалентная благородному газу
предшествующий период обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используется сокращенная нотация. Это важно, поскольку это
валентные электроны 3d10 4s2 4p5, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации брома, эквивалентная благородному газу
предшествующий период обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используется сокращенная нотация. Это важно, поскольку это
валентные электроны 3d10 4s2 4p5, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального брома
Полная электронная конфигурация основного состояния для атома брома, Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5
Атомная структура брома
Атомный радиус брома составляет 94 пм, а его ковалентный радиус равен 114 пм.
Атомный спектр брома
Химические свойства брома: Энергии ионизации брома и сродство к электрону
Сродство к электрону брома составляет 324,6 кДж/моль.
Энергия ионизации брома
Энергии ионизации брома
см. в таблице ниже.| Номер энергии ионизации | Энтальпия — кДж/моль |
|---|---|
| 1 | 1139.9 |
| 2 | 2103 |
| 3 | 3470 |
| 4 | 4560 |
| 5 | 5760 |
| 6 | 8550 |
| 7 | 9940 |
| 8 | 1.86×104 |
Физические свойства брома
Физические свойства брома см.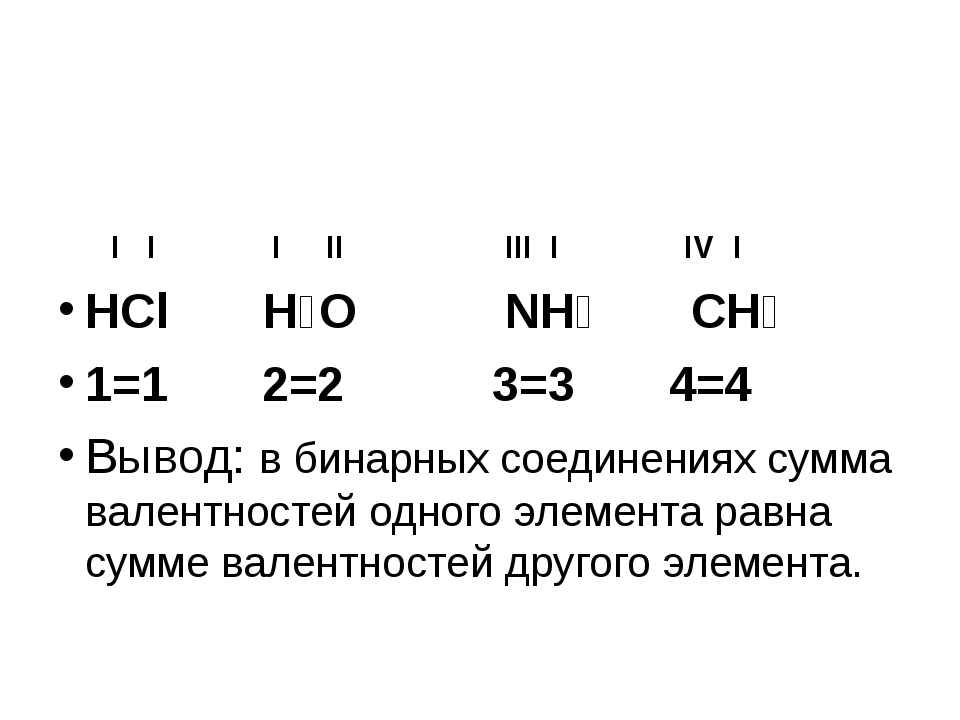 в таблице ниже.
в таблице ниже.
| Плотность | 3,12 г/см3 |
| Молярный объем | 25,6102564103 см3 |
Упругие свойства
Твердость брома. Испытания для измерения твердости элемента
Электрические свойства брома
Бром изолятор электричества.Ссылаться на Таблица ниже для электрических свойств брома
Свойства тепла и проводимости брома
Магнитные свойства брома
Оптические свойства брома
Акустические свойства брома
Тепловые свойства брома – энтальпии и термодинамика
См. таблицу ниже для тепловых свойств брома
.
Энтальпии брома
Изотопы брома — ядерные свойства брома
Изотопы родия.Встречающийся в природе бром имеет 2 стабильный изотоп — 79Бр, 81Бр.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим затухания |
|---|---|---|---|---|
| 67Бр | ||||
| 68Br | ||||
| 69Бр | ||||
| 70Br | ||||
| 71Br | ||||
| 72Br | ||||
| 73Br | ||||
| 74Br | ||||
| 75Бр | ||||
| 76Br | ||||
| 77Бр | ||||
| 78Br | ||||
| 79Бр | 50. 69% 69% | Стабильный | Н/Д | |
| 80Br | ||||
| 81Бр | 49. 31% 31% | Стабильный | Н/Д | |
| 82Br | ||||
| 83Br | ||||
| 84Br | ||||
| 85Бр | ||||
| 86Br | ||||
| 87Бр | ||||
| 88Бр | ||||
| 89Br | ||||
| 90Бр | ||||
| 91Br | ||||
| 92Br | ||||
| 93Br | ||||
| 94Br | ||||
| 95Br | ||||
| 96Br | ||||
| 97Br |
Нормативно-правовое регулирование и здоровье – Параметры и рекомендации по охране здоровья и безопасности
Поиск по базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химических реестров
Изучите нашу интерактивную периодическую таблицу
Сравнение элементов периодической таблицы
Вертикальная наука 7 класса
Валентные электроны и химические свойства
Вы узнали, что атомы вообще не очень стабильны. На самом деле известно всего шесть химически стабильных атомов: благородные газы. Атомы благородных газов химически стабильны из-за их электронных конфигураций. Каждый из них имеет «полный» набор электронов на внешней оболочке.
На самом деле известно всего шесть химически стабильных атомов: благородные газы. Атомы благородных газов химически стабильны из-за их электронных конфигураций. Каждый из них имеет «полный» набор электронов на внешней оболочке.
Атом гелия (4He)
Атом неона (20Ne)
Атом аргона (40Ar)
Но подождите минутку. Атомы гелия и неона имеют полные внешние электронные оболочки… атом гелия имеет два электрона на своей первой (внешней) оболочке, а атом неона имеет восемь электронов на своей второй (внешней) оболочке… но атом аргона имеет только восемь электронов на своей первой (внешней) оболочке. третья (внешняя) оболочка, когда третья оболочка может содержать до восемнадцати электронов.Как внешняя оболочка атома аргона близка к полной?
девятнадцатый электрон в атоме калия (40К)
двадцатый электрон в атоме кальция (20Ca)
двадцать первый электрон в атоме скандия (45Sc)
Причина в том, что модель атома Бора, основанная на электронных оболочках, не является точной.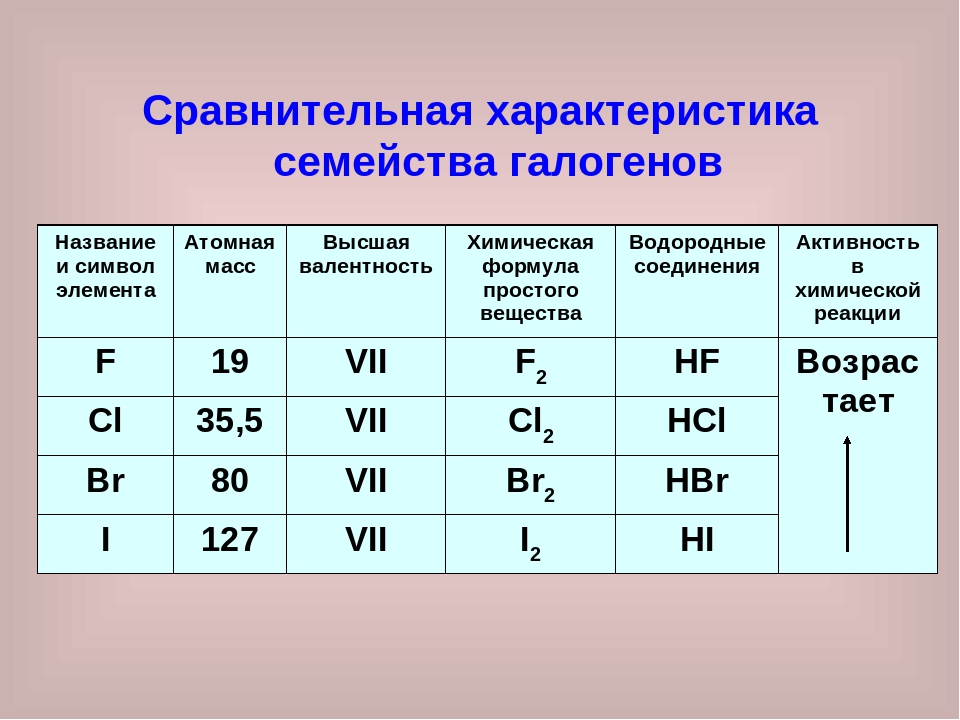 Электроны не занимают электронные оболочки; они занимают атомные орбитали. Следующим после аргона элементом является калий (К).Атом калия имеет на один протон и на один электрон больше, чем атом аргона. Модель Бора предсказывает, что этот девятнадцатый электрон перейдет в третью электронную оболочку. Но на самом деле девятнадцатый электрон переходит на s-орбиталь четвертой электронной оболочки, хотя третья оболочка еще не полностью заполнена. Остальные орбитали в третьей оболочке заполняются только после того, как первой будет заполнена s-орбиталь в четвертой оболочке. (Диаграммы Бора точны только до аргона.)
Электроны не занимают электронные оболочки; они занимают атомные орбитали. Следующим после аргона элементом является калий (К).Атом калия имеет на один протон и на один электрон больше, чем атом аргона. Модель Бора предсказывает, что этот девятнадцатый электрон перейдет в третью электронную оболочку. Но на самом деле девятнадцатый электрон переходит на s-орбиталь четвертой электронной оболочки, хотя третья оболочка еще не полностью заполнена. Остальные орбитали в третьей оболочке заполняются только после того, как первой будет заполнена s-орбиталь в четвертой оболочке. (Диаграммы Бора точны только до аргона.)
Хотя третья электронная оболочка может содержать 18 электронов, четвертая электронная оболочка может содержать 32 электрона, пятая электронная оболочка может содержать 50 электронов, а шестая электронная оболочка может содержать 72 электрона, когда каждая из этих электронных оболочек заполняется 8 электронами. , следующие два электрона перейдут в следующую более высокую электронную оболочку. Это означает, что самая внешняя оболочка атома может иметь только от 1 до 8 электронов, прежде чем запустится новая внешняя оболочка, и эта оболочка вместо этого станет внутренней оболочкой. Электроны на внешней оболочке атома называются валентными электронами.
Это означает, что самая внешняя оболочка атома может иметь только от 1 до 8 электронов, прежде чем запустится новая внешняя оболочка, и эта оболочка вместо этого станет внутренней оболочкой. Электроны на внешней оболочке атома называются валентными электронами.
Если атом имеет только один электрон, то все атомные орбитали электронной оболочки эквивалентны и имеют одинаковую энергию, и не имеет значения, какую атомную орбиталь занимает электрон.Но когда атом имеет более одного электрона, геометрия атомных орбиталей и положения других электронов действительно влияют на энергию атомной орбитали и порядок их заполнения.
Первая электронная оболочка имеет одну атомную орбиталь: s-орбиталь. Все s-орбитали имеют форму сфер. Вторая электронная оболочка имеет четыре атомные орбитали: одну s-орбиталь и три р-орбитали. Р-орбитали имеют форму гантелей, чтобы максимально увеличить расстояние между электронами.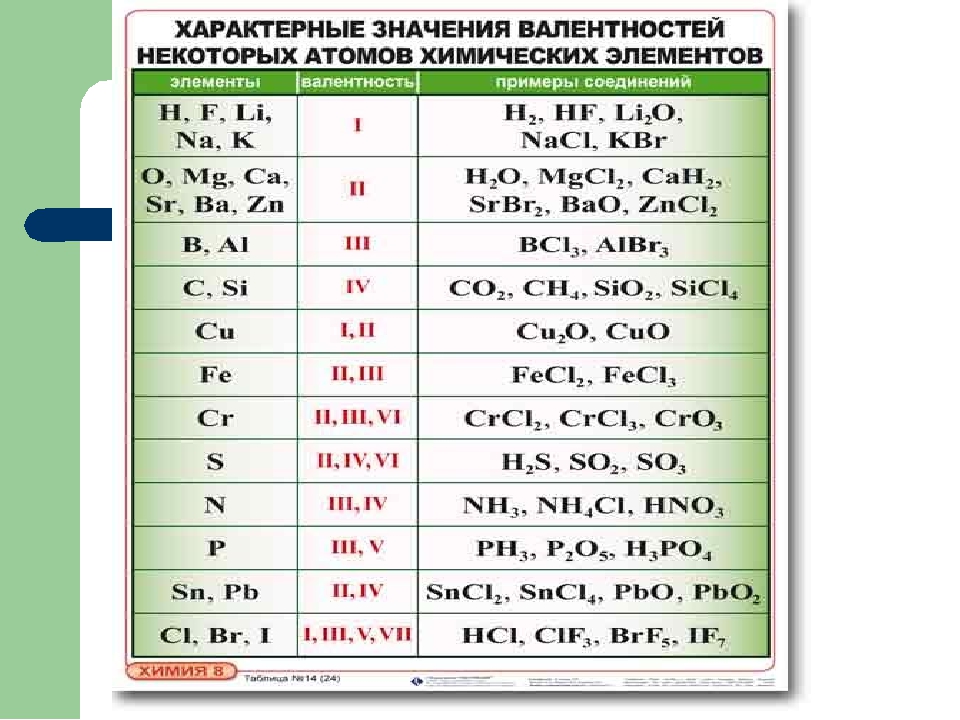 Максимальное расстояние между электронами делает атом более стабильным, потому что электроны отрицательно заряжены и отталкиваются друг от друга.
Максимальное расстояние между электронами делает атом более стабильным, потому что электроны отрицательно заряжены и отталкиваются друг от друга.
Два электрона на px-орбитали проводят большую часть своего времени в областях слева и справа от атомного ядра; два электрона на пи-орбитали проводят большую часть своего времени в областях выше и ниже атомного ядра; и два электрона на pz-орбитали проводят большую часть своего времени в областях перед и за атомным ядром.Геометрия этих орбиталей максимально рассеивает электроны, но все же есть некоторое перекрытие, которое снижает стабильность и немного увеличивает энергию p-орбиталей. Вот почему на самом деле s-орбиталь заполняется раньше p-орбиталей.
Третья электронная оболочка имеет девять атомных орбиталей: одну s-орбиталь, три p-орбитали и пять d-орбиталей. D-орбитали имеют еще более сложную и вытянутую форму, чтобы максимально увеличить расстояние между электронами, но они настолько сильно перекрываются, что s-орбиталь в четвертой электронной оболочке фактически заполняется раньше, чем пять d-орбиталей в третьей. электронная оболочка начинает заполняться.
электронная оболочка начинает заполняться.
В этой таблице показан порядок заполнения атомных орбиталей. 1s — s-орбиталь в первой электронной оболочке. 2s — s-орбиталь второй электронной оболочки. 2p — p-орбитали во второй электронной оболочке.
Правило октетов и структуры Льюиса
Поскольку большинство атомов не очень стабильны, они склонны химически связываться с другими атомами, образуя стабильные молекулы.То, как связываются многие атомы, можно предсказать с помощью правила октетов. Правило октета гласит, что атомы имеют тенденцию терять, принимать или делиться электронами до тех пор, пока они не приобретут электронную конфигурацию с «полной» внешней оболочкой (в данном случае полной, что означает два электрона, если самая внешняя оболочка является первой оболочкой, и восемь электронов). если самая внешняя оболочка является второй или более высокой оболочкой). Это та же электронная конфигурация, что и у атомов благородных газов, которые являются единственными химически стабильными атомами в периодической таблице. Правило октета не всегда работает, так как существует так много переменных, которые могут повлиять на стабильность атома.Как правило, правило октета не применяется к переходным или внутренним переходным металлам.
Это та же электронная конфигурация, что и у атомов благородных газов, которые являются единственными химически стабильными атомами в периодической таблице. Правило октета не всегда работает, так как существует так много переменных, которые могут повлиять на стабильность атома.Как правило, правило октета не применяется к переходным или внутренним переходным металлам.
Как вы видели, диаграммы Бора могут немного вводить в заблуждение. Они также не очень полезны для предсказания химических свойств атомов. Химические свойства описывают, как атом или молекула реагирует в присутствии других атомов или молекул. Атомы реагируют, теряя, принимая или делясь электронами, и это почти всегда касается самых внешних (валентных) электронов атома, а не электронов во внутренних оболочках.Структура Льюиса — это диаграмма, на которой выделены валентные электроны атома. Это может быть очень полезно для предсказания того, как атомы будут реагировать друг на друга.
Чтобы нарисовать структуру Льюиса атома, найдите символ атома и положение в периодической таблице.
Символ брома — Br. У него 35 протонов и 35 электронов, и он находится в четвертом ряду и семнадцатом столбце периодической таблицы.
Начните заполнять валентные электроны брома.Поскольку бром находится в четвертой строке периодической таблицы, его валентные электроны будут находиться в четвертой электронной оболочке.
Начните с первого элемента в четвертой строке периодической таблицы (K) и начните отсчет. Девятнадцатый электрон брома переходит на 4s-орбиталь. Нарисуйте одну точку справа от символа брома.
Двадцатый электрон также переходит на 4s-орбиталь.Нарисуйте вторую точку справа от символа брома.
Теперь 4s-орбиталь заполнена, и следующие десять электронов переходят на 3d-орбитали. Поскольку эти электроны входят в третью электронную оболочку, они являются внутренними электронами, а не валентными электронами. Не добавляйте точки к символу брома.
Поскольку эти электроны входят в третью электронную оболочку, они являются внутренними электронами, а не валентными электронами. Не добавляйте точки к символу брома.
руб.
Тридцать первый электрон переходит на 4px-орбиталь.Нарисуйте одну точку над символом брома.
Тридцать второй электрон переходит на 4py-орбиталь. Нарисуйте одну точку слева от символа брома.
Тридцать третий электрон переходит на 4pz-орбиталь. Нарисуйте одну точку под символом брома. Каждая 4p-орбиталь теперь имеет один электрон.
Тридцать четвертый электрон переходит на 4px-орбиталь. Нарисуйте вторую точку над символом брома.Теперь орбиталь 4px заполнена.
Тридцать пятый (и последний) электрон переходит на 4py-орбиталь. Нарисуйте вторую точку слева от символа брома. Теперь 4py-орбиталь заполнена.
Нарисуйте вторую точку слева от символа брома. Теперь 4py-орбиталь заполнена.
Структура Льюиса атома брома завершена. У него семь валентных электронов на внешней оболочке. Поскольку самая внешняя оболочка не является «полной» (у нее короткий один электрон), атом брома химически нестабилен и будет реагировать с другими атомами или молекулами до тех пор, пока его внешняя оболочка не заполнится.
Некоторые люди заполняют точки (валентные электроны) структуры Льюиса в разном порядке. Кажется, что нет единственно правильного способа сделать это, но это способ, который я предпочитаю. Начните с заполнения s-орбитальных электронов справа от символа атома, а затем заполните p-орбитальные электроны один за другим, двигаясь против часовой стрелки вокруг символа.
Группы элементов в периодической таблице
Если бы вы нарисовали структуры Льюиса для всех элементов таблицы Менделеева, вы бы обнаружили интересную закономерность. Все элементы семнадцатого столбца периодической таблицы имеют одинаковую структуру Льюиса.
Все элементы семнадцатого столбца периодической таблицы имеют одинаковую структуру Льюиса.
Эти элементы вместе известны как галогены или группа фтора. Поскольку они имеют семь валентных электронов в одной и той же электронной конфигурации, они имеют схожие химические свойства. Галогены очень реакционноспособны и будут связываться с другими атомами, принимая или разделяя один электрон, чтобы заполнить их валентные оболочки.
На другом конце периодической таблицы находятся щелочные металлы или группа лития.Поскольку они имеют один валентный электрон в одной и той же электронной конфигурации, щелочные металлы также имеют схожие химические свойства. Они очень реактивны и будут связываться с другими атомами, теряя свой один валентный электрон. Это делает следующую более низкую (и полную) электронную оболочку самой внешней, валентной оболочкой. Хотя технически водород относится к этой группе, он обладает некоторыми другими химическими свойствами. Это связано с тем, что, помимо потери своего электрона, атом водорода может также принять или разделить электрон, чтобы заполнить свою валентную оболочку.
Периодическая таблица — Химия в старших классах
Если вы считаете, что контент, доступный с помощью Веб-сайта (как это определено в наших Условиях обслуживания), нарушает одно или более ваших авторских прав, пожалуйста, сообщите нам, предоставив письменное уведомление («Уведомление о нарушении»), содержащее в информацию, описанную ниже, назначенному агенту, указанному ниже. Если университетские наставники примут меры в ответ на ан Уведомление о нарушении, он предпримет добросовестную попытку связаться со стороной, предоставившей такой контент средства самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении может быть направлено стороне, предоставившей контент, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатов), если вы существенно
искажать информацию о том, что продукт или деятельность нарушают ваши авторские права. Таким образом, если вы не уверены, что содержимое находится
на Веб-сайте или на который ссылается Веб-сайт, нарушает ваши авторские права, вам следует сначала обратиться к адвокату.
Таким образом, если вы не уверены, что содержимое находится
на Веб-сайте или на который ссылается Веб-сайт, нарушает ваши авторские права, вам следует сначала обратиться к адвокату.
Чтобы подать уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись владельца авторских прав или лица, уполномоченного действовать от его имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, как вы утверждаете, нарушает ваши авторские права, в \
достаточно подробно, чтобы преподаватели университета могли найти и точно идентифицировать этот контент; например, мы требуем
а
ссылку на конкретный вопрос (а не только название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
Отправьте жалобу нашему назначенному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
Сент-Луис, Миссури 63105
Или заполните форму ниже:
.
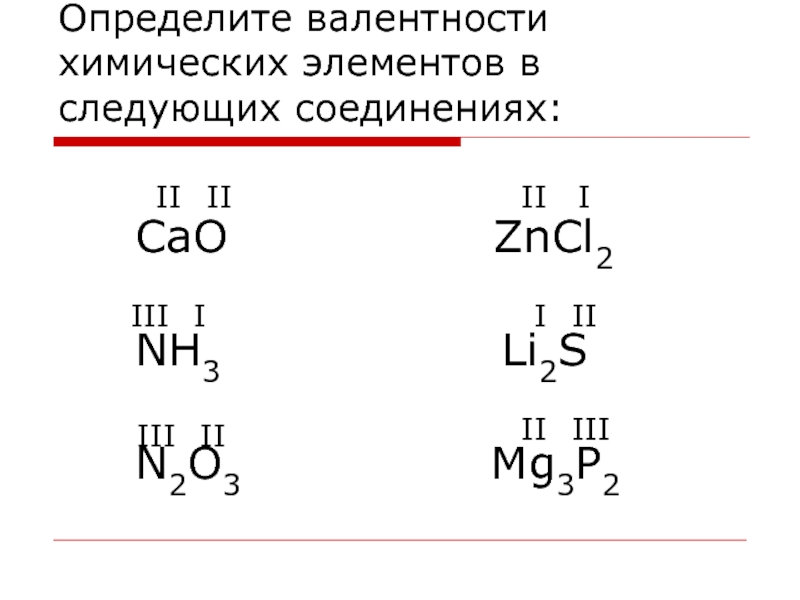
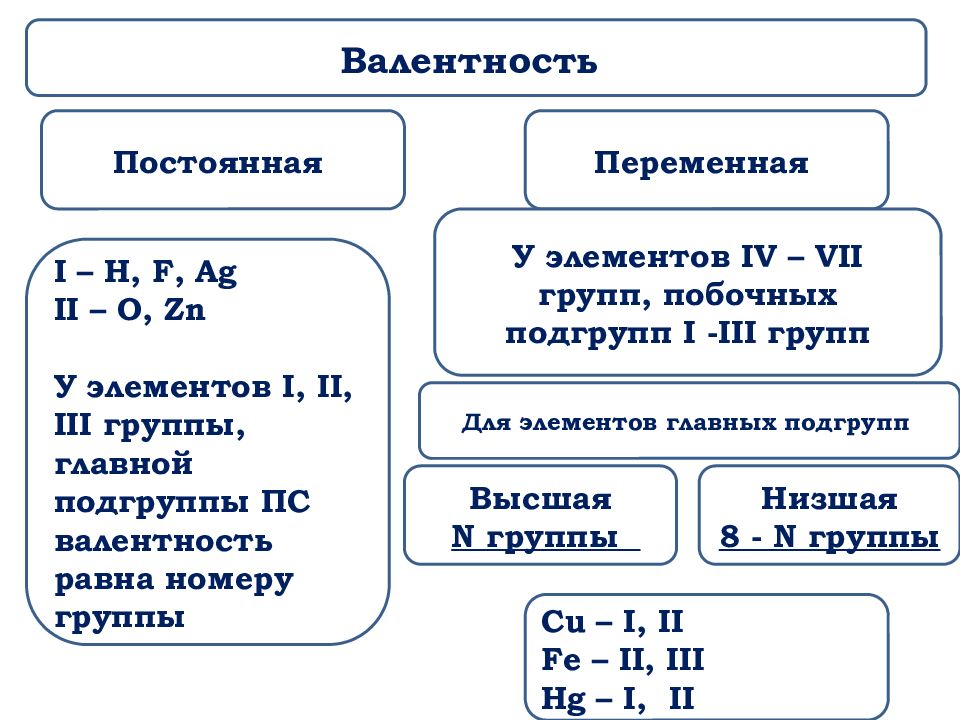 На валентных орбиталях атома находится 7 электронов.
На валентных орбиталях атома находится 7 электронов.  Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих p- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома.
Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих p- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома.