Урок «Химические уравнения», 2 урок
Урок химии в 8 классе. «____»__________________ 20____ г.
Химические уравнения.
Цель. Продолжить формирование умения составлять уравнения химических реакций.
Задачи.
Образовательные: закрепить умение записывать уравнения химических реакций и расставлять коэффициенты, соблюдая закон сохранения массы веществ.
Развивающие: формирование умения трансформировать текстовое описание химической реакции в его знаковую модель – химическое уравнение; развивать химический язык;
Воспитательные: продолжить формирование естественнонаучного мировоззрения, представления о единичном и целом при знакомстве с химическими уравнениями.
Ход урока.
Орг. момент.
Повторение изученного материала.
Фронтальный опрос.
Сформулируйте закон сохранения массы веществ.
Что мы понимаем под понятием «уравнение химической реакции».
Письменная работа
Запишите названия исходных веществ и продуктов реакции для следующих уравнений химических реакций:
А) Са + О2→СаО
Исходные вещества:________________________________________________
Продукты реакции:_________________________________________________
Б) Сu(OH)2→CuO + h3O
Исходные вещества:________________________________________________
Продукты реакции:_________________________________________________
В)NaOH + HCl→NaCl + h3O
Исходные вещества:________________________________________________
Продукты реакции:_________________________________________________
Составьте уравнения химических реакций.
А)Исходные вещества: железо и сера
Продукт реакции: сульфид железа(II)
Уравнение реакции:________________________________________________
Б) Исходное вещество: гидроксид железа (III)
Продукты реакции: оксид железа (III) и вода
Уравнение реакции:_________________________________________________
В) Исходные вещества: сульфат алюминия и нитрат бария
Продукты реакции: сульфат бария и нитрат алюминия
Уравнение реакции:________________________________________________
Решение задач и упражнений.
Расставьте коэффициенты в следующих уравнениях реакций:
N2 + h3 →Nh4
CO + O2→CO2
Al + Cl2→AlCl3
Fe3O4+ h3→Fe + h3O
Ca+ HCl→CaCl2 + h3
Fe2O3+ HCl→FeCl3 + h3O
KOH + h3SO4 →K2SO4 + h3O
Составьте формулы веществ, получающихся в результатe реакции, и поставьте коэффициенты в уравнения реакций:
Al+ S→Al+3S-2
Ba + O2→Ba+2O-2
P+ S→P+5S-2
Запишите уравнения реакций по схемам:
А) оксид фосфора (V) + вода→ фосфорная кислота
Б) алюминий + серная кислота сульфат →алюминия и водород
В) фосфорная кислота + гидроксид кальция →фосфат кальция + вода
Г) оксид кальция + оксид углерода(IV)→ карбонат кальция
Закрепление.
1 вариант.
Признаки химических реакций:
образование осадка, запаха;
образование осадка, запаха, выделение газа;
образование осадка, запаха, выделение газа, теплоты;
образование осадка, запаха, выделение газа, теплоты, изменение цвета.
Эндотермическая реакция – это реакция, идущая
с образованием осадка;
с выделением теплоты;
с поглощением запаха;
с поглощением теплоты.
Закон сохранения массы веществ был установлен ученым:
Менделеевым
Ломоносовым
Кельвином
Кавендишем
Уравнение химической реакции – это условная запись химической реакции посредством:
схем
графиков
рисунков
химических знаков и формул
В ходе химической реакции атомы:
разрушаются
сохраняются
одни превращаются в другие
образуются
В уравнении реакции, схема которой:Al + O2→Al2O3 , коэффициент оксида алюминия равен:
1 2) 2 3) 3 4) 4
Сумма коэффициентов в уравнении реакции, схема которой: СН4 + О2→ СО2 + Н2О , равна:
1) 6 2) 4 3) 3 4) 2
Уравнению реакции, схема которой:Fe + h3O→Fe3O4 + h3 , соответствует последовательность коэффициентов:
3,4,3,4 2) 3,4,1,4 3) 3,4,2,4 4) 3,4,2,2
2 вариант.
Условия для начала химических реакций:
соприкосновение, измельчение, растворение, нагревание;
соприкосновение, измельчение, растворение;
соприкосновение, измельчение;
соприкосновение.
Экзотермическая реакция – это реакция, идущая
с образованием осадка;
с выделением теплоты;
с поглощением запаха;
с поглощением теплоты.
По уравнению химической реакции можно судить о:
признаках реакции
условиях реакции
физических свойствах продуктов реакции
том, какие вещества вступают в реакцию и какие образуются
При химических реакциях:
Молекулы сохраняются
Молекулы только разрушаются
Из молекул одних веществ образуются молекулы других веществ
Молекулы только образуются
При добавлении соды к лимонной кислоте происходит:
Выпадение осадка
Образование газа
Изменение окраски
Испарение воды
Коэффициент перед формулой железа в уравнении реакции, схема которой
Fe + O2 →Fe3O4 , равен:
4 2) 3 3) 2 4) 8
Уравнению реакции, схема которой: Al + CuCl2→AlCl3 + Cu, соответствует последовательность коэффициентов:
3,2,3,2 2) 2,3,2,3 3) 1,2,1,2 4) 1,3,1,3
В реакции, схема которой:Fe2O3 + h3→Fe + h3O сумма коэффициентов равна:
8 2) 9 3) 10 4) 11
Домашнее задание.
§ 27 упр. 3 стр. 145
РАБОЧАЯ КАРТА УРОКА
Учени______ 8 класса _______________________________________________________
ТЕМА _____________________________________________________________________
Запишите названия исходных веществ и продуктов реакции для следующих уравнений химических реакций:
А) Са + О2→СаО
Исходные вещества:________________________________________________
Продукты реакции:_________________________________________________
Б) Сu(OH)2→CuO + h3O
Исходные вещества:________________________________________________
Продукты реакции:_________________________________________________
В) NaOH + HCl→NaCl + h3O
Исходные вещества:________________________________________________
Продукты реакции:_________________________________________________
Составьте уравнения химических реакций.
А) Исходные вещества: железо и сера
Продукт реакции: сульфид железа(II)
Уравнение реакции:_________________________________________________
Б) Исходное вещество: гидроксид железа (III)
Продукты реакции: оксид железа (III) и вода
Уравнение реакции:_________________________________________________
В) Исходные вещества: сульфат алюминия и нитрат бария
Продукты реакции: сульфат бария и нитрат алюминия
Уравнение реакции:_________________________________________________
Расставьте коэффициенты в следующих уравнениях реакций:
N2 + h3→ Nh4
CO + O2→ CO2
Al + Cl2→ AlCl3
Fe3O4 + h3→ Fe + h3O
Ca + HCl→ CaCl2 + h3
Fe2O3 + HCl→ FeCl3 + h3O
KOH + h3SO4 → K2SO4 + h3O
Составьте формулы веществ, получающихся в результатe реакции, и поставьте коэффициенты в уравнения реакций:
Al + S→ Al+3S-2
Ba + O2→ Ba+2O-2
P + S→ P+5S-2
Запишите уравнения реакций по схемам:
А) оксид фосфора (V) + вода→ фосфорная кислота
_____________________________________________________________________________
Б) алюминий + серная кислота сульфат →алюминия и водород
_____________________________________________________________________________
В) фосфорная кислота + гидроксид кальция →фосфат кальция + вода
_____________________________________________________________________________
Г) оксид кальция + оксид углерода(IV)→ карбонат кальция
_____________________________________________________________________________
вариант.
Признаки химических реакций:
образование осадка, запаха;
образование осадка, запаха, выделение газа;
образование осадка, запаха, выделение газа, теплоты;
образование осадка, запаха, выделение газа, теплоты, изменение цвета.
Эндотермическая реакция – это реакция, идущая
с образованием осадка;
с выделением теплоты;
с поглощением запаха;
с поглощением теплоты.
Закон сохранения массы веществ был установлен ученым:
Менделеевым
Ломоносовым
Кельвином
Кавендишем
Уравнение химической реакции – это условная запись химической реакции посредством:
схем
графиков
рисунков
химических знаков и формул
В ходе химической реакции атомы:
разрушаются
сохраняются
одни превращаются в другие
образуются
В уравнении реакции, схема которой:Al + O2→Al2O3 , коэффициент оксида алюминия равен:
1 2) 2 3) 3 4) 4
Сумма коэффициентов в уравнении реакции, схема которой: СН4 + О2 → СО2 + Н2О , равна:
1) 6 2) 4 3) 3 4) 2
Уравнению реакции, схема которой:Fe + h3O→Fe3O4 + h3 , соответствует последовательность коэффициентов:
3,4,3,4 2) 3,4,1,4 3) 3,4,2,4 4) 3,4,2,2
РАБОЧАЯ КАРТА УРОКА
Учени______ 8 класса _______________________________________________________
ТЕМА _____________________________________________________________________
Запишите названия исходных веществ и продуктов реакции для следующих уравнений химических реакций:
А) Са + О2→СаО
Исходные вещества:_______________________________________________
Продукты реакции:________________________________________________
Б) Сu(OH)2→CuO + h3O
Исходные вещества:_______________________________________________
Продукты реакции:________________________________________________
В) NaOH + HCl→NaCl + h3O
Исходные вещества:_______________________________________________
Продукты реакции:________________________________________________
Составьте уравнения химических реакций.
А) Исходные вещества: железо и сера
Продукт реакции: сульфид железа(II)
Уравнение реакции:_______________________________________________
Б) Исходное вещество: гидроксид железа (III)
Продукты реакции: оксид железа (III) и вода
Уравнение реакции:_______________________________________________
В) Исходные вещества: сульфат алюминия и нитрат бария
Продукты реакции: сульфат бария и нитрат алюминия
Уравнение реакции:_______________________________________________
Расставьте коэффициенты в следующих уравнениях реакций:
N2 + h3 → Nh4
CO + O2→ CO2
Al + Cl2→ AlCl3
Fe3O4 + h3→ Fe + h3O
Ca + HCl→ CaCl2 + h3
Fe2O3 + HCl→ FeCl3 + h3O
KOH + h3SO4 → K2SO4 + h3O
Составьте формулы веществ, получающихся в результатe реакции, и поставьте коэффициенты в уравнения реакций:
Al + S→ Al+3S-2
Ba + O2→ Ba+2O-2
P + S→ P+5S-2
Запишите уравнения реакций по схемам:
А) оксид фосфора (V) + вода→ фосфорная кислота
_____________________________________________________________________________
Б) алюминий + серная кислота сульфат →алюминия и водород
_____________________________________________________________________________
В) фосфорная кислота + гидроксид кальция →фосфат кальция + вода
_____________________________________________________________________________
Г) оксид кальция + оксид углерода(IV)→ карбонат кальция
_____________________________________________________________________________
2 вариант.
Условия для начала химических реакций:
соприкосновение, измельчение, растворение, нагревание;
соприкосновение, измельчение, растворение;
соприкосновение, измельчение;
соприкосновение.
Экзотермическая реакция – это реакция, идущая
с образованием осадка;
с выделением теплоты;
с поглощением запаха;
с поглощением теплоты.
По уравнению химической реакции можно судить о:
признаках реакции
условиях реакции
физических свойствах продуктов реакции
том, какие вещества вступают в реакцию и какие образуются
При химических реакциях:
Молекулы сохраняются
Молекулы только разрушаются
Из молекул одних веществ образуются молекулы других веществ
Молекулы только образуются
При добавлении соды к лимонной кислоте происходит:
Выпадение осадка
Образование газа
Изменение окраски
Испарение воды
Коэффициент перед формулой железа в уравнении реакции, схема которой
Fe + O2→Fe3O4 , равен:
4 2) 3 3) 2 4) 8
Уравнению реакции, схема которой: Al + CuCl2→AlCl3 + Cu, соответствует последовательность коэффициентов:
3,2,3,2 2) 2,3,2,3 3) 1,2,1,2 4) 1,3,1,3
В реакции, схема которой: Fe2O3 + h3→Fe + h3O сумма коэффициентов равна
8 2) 9 3) 10 4) 11
Реакции окисления алканов
Реакции окисления алканов
В органической химии реакции окисления и восстановления рассматриваются как реакции, связанные с потерей и приобретением органическим соединением атомов водорода и кислорода (часть I. Реакции окисления и восстановления). Эти процессы, естественно, сопровождаются изменением степеней окисления атомов.
Реакции окисления и восстановления). Эти процессы, естественно, сопровождаются изменением степеней окисления атомов.- Окисление органического вещества — введение в его состав кислорода и (или) отщепление водорода.
Восстановление — обратный процесс (введение водорода и отщепление кислорода).
При обычной температуре алканы не вступают в реакции даже с сильными окислителями (Н
Молекулы кислорода с неспаренными электронами •OO• инициируют цепную реакцию, вызывая гомолитический разрыв связей C–H в молекулах RH. Образующиеся радикальные частицы R• и НOO• развивают цепь дальнейших превращений. Продуктами реакции в зависимости от условий (температура, катализатор, количество кислорода) могут быть спирты ROH, альдегиды RCHO, кетоны R 2CO, карбоновые кислоты RCOOH, оксиды углерода CO и CO2, а также углерод. При горенииГорение – процесс быстрого высокотемпературного окисления, состоящий из большого числа элементарных окислительно-восстановительных реакций, обусловленных перераспределением валентных электронов.
 углеводородов в избытке кислорода происходит их полное окисление до СО2, где углерод имеет высшую степень окисления +4, и воды. Процесс сопровождается разрывом всех связей С–С и С–Н с выделением большого количества тепла (экзотермическая реакция): CH4 + 2O2 CO
углеводородов в избытке кислорода происходит их полное окисление до СО2, где углерод имеет высшую степень окисления +4, и воды. Процесс сопровождается разрывом всех связей С–С и С–Н с выделением большого количества тепла (экзотермическая реакция): CH4 + 2O2 COСхема превращений при окислении метана
C2H6 + 3,5O2 2CO2 + 3H2O + 1560 кДж/моль
C3H8 + 5O2 3CO2 + 4H2O + 2220 кДж/моль
C4H10 + 6,5O2 4CO2 + 5H2O + 2878 кДж/моль
Уравнение реакции горения алканов в общем виде:
Молярные теплоты сгорания (Qв-ва, кДж/моль) в ряду алканов пропорциональны числу атомов углерода в молекуле.
Каждый дополнительный атом углерода увеличивает теплоту сгорания на 700 кДж/моль (вклад группы CН2). При этом удельная теплота сгорания различных алканов (Qв-ва в пересчете на массу, например, в кДж/кг) практически постоянна и составляет примерно 50 000 кДж/кг.
При этом удельная теплота сгорания различных алканов (Qв-ва в пересчете на массу, например, в кДж/кг) практически постоянна и составляет примерно 50 000 кДж/кг.
Процесс горения углеводородов — основной источник энергии для всех сфер хозяйственно-экономической деятельности (промышленность, транспорт, коммунальные хозяйства и т.п.). На углеводородном топливе работают двигатели внутреннего сгорания, тепловые электростанции, котельные и др.
Негативным фактором широкого применения углеводородного горючего является выброс и накопление в атмосфере больших количеств углекислого газа СО2, вызывающего «парниковый эффект» и углекислотные дожди (CO2 + H2O H2CO3 Поэтому значение приобретают альтернативные безуглеродные источники энергии, не загрязняющие окружающую среду.
Поэтому значение приобретают альтернативные безуглеродные источники энергии, не загрязняющие окружающую среду.Горение алканов в недостатке кислорода приводит к продуктам неполного окисления.
Из общего уравнения реакции горения алканов следует, что с увеличением числа углеродных атомов (n) в молекулах увеличивается количество кислорода, необходимого для их полного окисления до СO2. При горении высших алканов (n >>1) кислорода, содержащегося в воздухе, может оказаться недостаточно и тогда образуются продукты частичного окисления:
— угарный газ СО (степень окисления углерода +2),
— сажа (мелкодисперсный углерод, нулевая степень окисления).
Поэтому высшие алканы горят на воздухе коптящим пламенем, а выделяющийся попутно токсичный угарный газ (без запаха и цвета) представляет опасность для человека и животных (концентрация СО в воздухе более 0,1 % — смертельна!).
Последняя реакция используется в промышленности для получения сажи из природного газа, содержащего 80-97% метана.
Высшие алканы (n >25) в жидкой фазе под действием кислорода воздуха в присутствии солей марганца превращаются в смесь карбоновых кислот (RCOOH) со средней длиной цепи С
Синтез-газ получают также паровой и парокислородной конверсией
различных углеродсодержащих веществ — нефтепродуктов, угля и т. п.
п.
- Синтез-газ — экономически доступный базовый полупродукт, играющий ключевую роль в химической промышленности:
- исходное сырье в органическом синтезе метанолаCO + 2H2 CH3OH, синтетического бензина (алканы С6-С12), альдегидов (оксосинтез) и других соединений;
- монооксид углерода из синтез-газа — реагент в органическом синтезе и при получении карбонилов металлов;
- основной источник водорода для химической и нефтехимической промышленности. Наибольшая доля потребления водорода (около половины мирового производства) приходится на синтез аммиакаN2 + 3H2 2NH3 — исходного продукта при получении азотсодержащих соединений (азотной кислоты, азотных удобрений, красителей, взрывчатых веществ и др.). Значительные количества водорода требуются для процессов гидроочистки нефтепродуктов, гидрирования непредельных соединений, в том числе для гидрогенизации жиров (превращение растительных масел в твёрдые жиры).
 Водород широко используется как восстановитель в органическом синтезе и при выделении металлов из их оксидов.
Водород широко используется как восстановитель в органическом синтезе и при выделении металлов из их оксидов.В связи с перспективой развития водородной энергетикиВодородная энергетика — комплекс технологий, включающий способы получения, хранения, транспортировки и использования водорода как источника энергии. Это альтернатива углеродной (углеводородной) энергетике, вредной для окружающей среды.
сгорания водорода
является вода:
2H2 + O2 2H2O и эффективного топлива.Водород обладает высокой теплотворной способностью: удельная теплота его сгорания 120-140 МДж/кг, что значительно выше аналогичной характеристики для углеводородов (~50 МДж/кг).
Пример использования водородного топлива (2017 г.), видео
youtube.com/embed/rk8UE5yFgjw?rel=0″ frameborder=»0″ allowfullscreen=»»/>
Степень окисления
– условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер.Это означает, что более электроотрицательный атом, смещая к себе одну электронную пару, приобретает заряд –1, две электронных пары — заряд –2. Связь между одинаковыми атомами не дает вклада в степень окисления.
Таким образом, связь между атомами С-С соответствует нулевой степени их окисления. В связи C-H углероду как более электроотрицательному атому соответствует заряд –1, а в связи C-O заряд углерода (менее электроотрицательного) равен +1.
Степень окисления атома в молекуле подсчитывается как алгебраическая сумма зарядов, которые дают все связи данного атома.
Так, в молекуле CH3Cl три связи C-H дают суммарный заряд на атоме C, равный –3, а связь C-Cl — заряд +1. Следовательно, степень окисления атома углерода в этом соединении равна:

Степень окисления углерода в его соединениях изменяется в диапазоне от –4 (в метане CH
Acetyl
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Сбалансированные химические уравнения — Формулы и уравнения — OCR 21C — GCSE Chemistry (Single Science) Revision — OCR 21st Century
Напишите сбалансированное химическое уравнение для полного сгорания метана (CH 4 ) с кислородом (O 2 ) .
Словесное уравнение: метан + кислород → углекислый газ + вода
Простое химическое уравнение: CH 4 + O 2 → CO 2 + H mh989j5zv2.0.0.0.1:0.1.0.$0.$4.$7.3.$1.$7″> 2 O
Реагенты: 1 × H, 4 × H , 2 × O
Продукты: 1 × C, 3 × O, 2 × H несбалансированные
Попробуйте: CH 4 + O 2 → CO 2 + 2H 2 O 1 9003 Реагенты: × C, 4 × H, 2 × O
Изделия: 1 × C, 4 × H, 4 × O несбалансированные
O
Реагенты: 1 × C, 4 × H, 4 × O
0.0.0.1:0.1.0.$0.$4.$7.3.$9″> Продукты: 1 × C, 4 × H, 4 × O сбалансированыСбалансированное химическое уравнение: CH 4 + 2O 2 → CO 2 + 2H 2 O
Открытые учебники | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Класс 7А
Класс 7Б
Класс 7 (объединенные A и B)
Африкаанс
Граад 7А
Граад 7Б
Graad 7 (A en B saam)
Пособия для учителей
- Читать онлайн
Учебники
Английский
Класс 8А
Класс 8Б
Класс 8 (объединенные A и B)
Африкаанс
Граад 8А
Граад 8Б
Graad 8 (A en B saam)
Пособия для учителей
- Читать онлайн
Учебники
Английский
Класс 9А
Класс 9Б
Класс 9 (объединенные A и B)
Африкаанс
Граад 9А
Граад 9Б
Graad 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 4А
Класс 4Б
Класс 4 (объединенные А и В)
Африкаанс
Граад 4А
Граад 4Б
Graad 4 (A en B saam)
Пособия для учителей
- Читать онлайн
Учебники
Английский
Класс 5А
Класс 5Б
Класс 5 (объединенные А и В)
Африкаанс
Граад 5А
Граад 5Б
Graad 5 (A en B saam)
Пособия для учителей
- Читать онлайн
Учебники
Английский
Класс 6А
Класс 6Б
Класс 6 (объединенные А и В)
Африкаанс
Граад 6А
Граад 6Б
Graad 6 (A en B saam)
Пособия для учителя
Лицензирование нашей книги
Эти книги не только бесплатны, но и имеют открытую лицензию! Один и тот же контент, но разные версии (фирменные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий.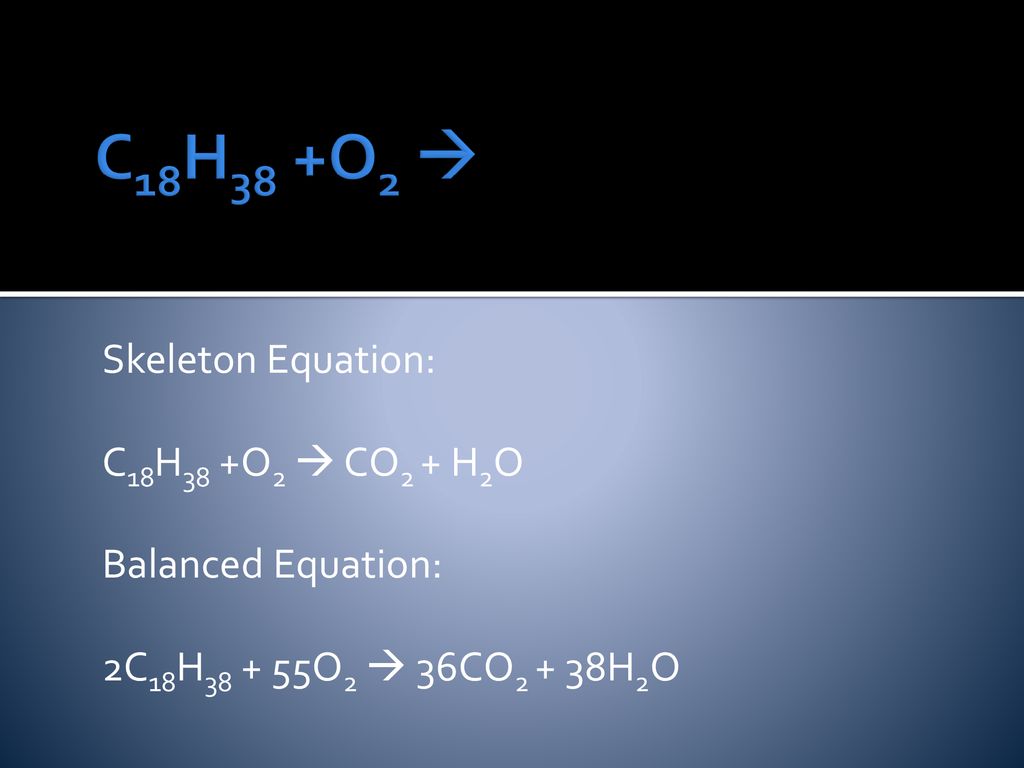 Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте здесь больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без торговой марки)
Эти версии одного и того же контента без торговой марки доступны для вас, чтобы вы могли делиться ими, адаптировать, преобразовывать, изменять или развивать их любым способом, при единственном требовании — отдать должное Сиявуле. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
4.2: Сколько углекислого газа?
Цели обучения
- Объяснить понятие стехиометрии применительно к химическим реакциям
- Использовать сбалансированные химические уравнения для получения стехиометрических коэффициентов, связывающих количества реагентов и продуктов
- Выполнение стехиометрических расчетов с учетом массы, молей и молярности раствора
Сбалансированное химическое уравнение предоставляет большой объем информации в очень сжатой форме. Химические формулы обеспечивают идентичность реагентов и продуктов, участвующих в химическом изменении, что позволяет классифицировать реакцию.Коэффициенты обеспечивают относительное количество этих химических соединений, что позволяет количественно оценить взаимосвязь между количествами веществ, потребляемых и образующихся в результате реакции. Эти количественные соотношения известны как стехиометрия реакции, термин, происходящий от греческих слов stoicheion (что означает «элемент») и metron (что означает «мера»). В этом модуле исследуется использование сбалансированных химических уравнений для различных стехиометрических приложений.
В этом модуле исследуется использование сбалансированных химических уравнений для различных стехиометрических приложений.
Общий подход к использованию стехиометрических соотношений по своей концепции аналогичен тому, как люди занимаются многими обычными делами. Кулинария, например, предлагает подходящее сравнение. Предположим, рецепт приготовления восьми блинов требует 1 стакана смеси для блинов, \(\dfrac{3}{4}\) стакана молока и одного яйца. «Уравнение», представляющее приготовление блинов по этому рецепту, равно
.\[\mathrm{1\:чашка\: смесь+\dfrac{3}{4}\:чашка\: молоко+1\: яйцо \стрелка вправо 8\: блины} \label{4.4.1}\]
Если для большого семейного завтрака требуется две дюжины блинов, количество ингредиентов необходимо увеличить пропорционально количеству, указанному в рецепте.Например, для приготовления 24 блинов нужно
яиц.\[\mathrm{24\: \cancel{блинчики} \times \dfrac{1\: яйцо}{8\: \cancel{блинчики}}=3\: яйца} \label{4.4.2}\]
Сбалансированные химические уравнения используются почти таким же образом для определения количества одного реагента, необходимого для реакции с данным количеством другого реагента, или для получения данного количества продукта и т. д. Коэффициенты в сбалансированном уравнении используются для получения стехиометрических коэффициентов, которые позволяют вычислить желаемую величину.Чтобы проиллюстрировать эту идею, рассмотрим производство аммиака реакцией водорода и азота:
д. Коэффициенты в сбалансированном уравнении используются для получения стехиометрических коэффициентов, которые позволяют вычислить желаемую величину.Чтобы проиллюстрировать эту идею, рассмотрим производство аммиака реакцией водорода и азота:
\[\ce{N2}(g)+\ce{3h3}(g)\rightarrow \ce{2Nh4}(g) \label{4.4.3}\]
Это уравнение показывает, что молекулы аммиака образуются из молекул водорода в соотношении 2:3, и стехиометрические коэффициенты могут быть получены с использованием любого количества (числа) единица:
\[\ce{\dfrac{2Nh4\:молекулы}{3h3\:молекулы}\:или\:\dfrac{2\:doz\:Nh4\:молекулы}{3\:doz\:h3\:молекулы } \: или \: \dfrac{2\: моль\: Nh4\: молекулы}{3\: моль\: h3\: молекулы}} \label{4.4.4}\]
Эти стехиометрические коэффициенты можно использовать для расчета количества молекул аммиака, полученных из заданного количества молекул водорода, или количества молекул водорода, необходимых для производства заданного количества молекул аммиака. Подобные коэффициенты могут быть получены для любой пары веществ в любом химическом уравнении.
Пример \(\PageIndex{1}\): количество молей реагента, необходимое для реакции
Сколько молей I 2 требуется для реакции с 0,429 моль Al в соответствии со следующим уравнением (см. рисунок \(\PageIndex{2}\))?
\[\ce{2Al + 3I2 \rightarrow 2AlI3} \label{4.4.5}\]
Рисунок \(\PageIndex{1}\): Алюминий и йод реагируют с образованием йодида алюминия. Тепло реакции испаряет часть твердого йода в виде пурпурного пара. (кредит: модификация работы Марка Отта)Решение
Ссылаясь на сбалансированное химическое уравнение, стехиометрический коэффициент, связывающий два интересующих вещества, равен \(\ce{\dfrac{3\: моль\: I2}{2\: моль\: Al}}\). Молярное количество йода получается путем умножения предоставленного молярного количества алюминия на этот коэффициент:
\[\begin{align*} \mathrm{mol\: I_2} &=\mathrm{0.429\: \cancel{mol\: Al}\times \dfrac{3\: mol\: I_2}{2\:\cancel{mol\: Al}}} \\[4pt] &=\mathrm{0,644\ : моль\: I_2} \end{align*}\]
Упражнение \(\PageIndex{1}\)
Сколько молей Ca(OH) 2 требуется для реакции с 1,36 моль H 3 PO 4 с образованием Ca 3 (PO 4 ) 2 \(\ по уравнению ce{3Ca(OH)2 + 2h4PO4 \rightarrow Ca3(PO4)2 + 6h3O}\) ?
- Ответить
2.
 04 моль
04 моль
Пример \(\PageIndex{2}\): количество молекул продукта, образующихся в результате реакции
Сколько молекул углекислого газа образуется при сгорании 0,75 моль пропана по этому уравнению?
\[\ce{C3H8 + 5O2 \rightarrow 3CO2 + 4h3O} \label{4.4.6}\]
Раствор
Подход здесь тот же, что и в примере \(\PageIndex{1}\), но запрашивается абсолютное количество молекул, а не количество молей молекул.Это просто потребует использования коэффициента преобразования молей в числа, числа Авогадро.
Сбалансированное уравнение показывает, что диоксид углерода образуется из пропана в соотношении 3:1:
\[\ce{\dfrac{3\: моль\: CO2}{1\: моль\: C3H8}} \label{4.4.7}\]
Используя этот стехиометрический коэффициент, предоставленное молярное количество пропана и число Авогадро,
\[\mathrm{0,75\: \cancel{mol\: C_3H_8}\times \dfrac{3\: \cancel{mol\: CO_2}}{1\:\cancel{mol\:C_3H_8}}\times \ дфрак {6. {24}\:CO_2\:молекулы} \label{4.4.8}\]
{24}\:CO_2\:молекулы} \label{4.4.8}\]
Упражнение \(\PageIndex{1}\)
Сколько молекул NH 3 образуется при взаимодействии 4,0 моль Ca(OH) 2 по следующему уравнению:
\[\ce{(Nh5)2SO4 + Ca(OH)2 \rightarrow 2Nh4 + CaSO4 + 2h3O} \label{4.4.9} \nonumber\]
- Ответить
4,8 × 10 24 NH 3 молекулы
Эти примеры иллюстрируют, с какой легкостью можно соотнести количества веществ, участвующих в химической реакции известной стехиометрии.Однако непосредственное измерение количества атомов и молекул — непростая задача, и практическое применение стехиометрии требует, чтобы мы использовали более легко измеряемое свойство массы.
Пример \(\PageIndex{3}\): отношение масс реагентов и продуктов
Какая масса гидроксида натрия, NaOH, потребуется для получения 16 г магнезиального антацидного молока [гидроксид магния, Mg(OH) 2 ] по следующей реакции?
\(\ce{MgCl2}(водн. )+\ce{2NaOH}(водн.)\rightarrow \ce{Mg(OH)2}(s)+\ce{2NaCl}(водн.)\)
)+\ce{2NaOH}(водн.)\rightarrow \ce{Mg(OH)2}(s)+\ce{2NaCl}(водн.)\)
Раствор
Здесь также используется подход, использованный ранее в примерах \(\PageIndex{1}\) и \(\PageIndex{2}\); то есть мы должны вывести соответствующий стехиометрический коэффициент из сбалансированного химического уравнения и использовать его, чтобы связать количества двух интересующих веществ.В этом случае, однако, предоставляются и запрашиваются массы (а не молярные количества), поэтому требуются дополнительные шаги, подобные тем, которые были изучены в предыдущей главе. Необходимые расчеты представлены на этой блок-схеме:
\[\mathrm{16\:\cancel{g\: Mg(OH)_2} \times \dfrac{1\:\cancel{mol\: Mg(OH)_2}}}{58,3\:\cancel{g \: Mg(OH)_2}}\times \dfrac{2\:\cancel{mol\: NaOH}}{1\:\cancel{mol\: Mg(OH)_2}}\times \dfrac{40,0\ : г\: NaOH}{\отменить{моль\: NaOH}}=22\: г\: NaOH}\]
Упражнение \(\PageIndex{3}\)
Какую массу оксида галлия Ga 2 O 3 можно получить из 29. 0 г металлического галлия? Уравнение реакции: \(\ce{4Ga + 3O2 \rightarrow 2Ga2O3}\).
0 г металлического галлия? Уравнение реакции: \(\ce{4Ga + 3O2 \rightarrow 2Ga2O3}\).
- Ответить
39,0 г
Пример \(\PageIndex{4}\): относительные массы реагентов
Какая масса газообразного кислорода O 2 из воздуха расходуется при сгорании 702 г октана C 8 H 18 , одного из основных компонентов бензина?
\[\ce{2C8h28 + 25O2 \rightarrow 16CO2 + 18h3O} \номер\]
Раствор
Здесь требуется тот же подход, что и в примере \(\PageIndex{3}\), отличающийся только тем, что предоставленные и запрошенные массы относятся к реагентам.3\:g\:\ce{O2}}\)
Упражнение \(\PageIndex{4}\)
Какая масса СО требуется для реакции с 25,13 г Fe 2 O 3 по уравнению \(\ce{Fe2O3 + 3CO \rightarrow 2Fe + 3CO2}\)?
- Ответить
13,22 г
Эти примеры иллюстрируют лишь несколько примеров расчета стехиометрии реакции. Возможны многочисленные вариации начальных и конечных вычислительных шагов в зависимости от того, какие конкретные величины предоставляются и запрашиваются (объемы, концентрации растворов и т. д.).Независимо от деталей, все эти расчеты имеют общий важный компонент: использование стехиометрических коэффициентов, полученных из сбалансированных химических уравнений. На рисунке \(\PageIndex{2}\) представлена общая схема различных вычислительных этапов, связанных с расчетами стехиометрии многих реакций.
Возможны многочисленные вариации начальных и конечных вычислительных шагов в зависимости от того, какие конкретные величины предоставляются и запрашиваются (объемы, концентрации растворов и т. д.).Независимо от деталей, все эти расчеты имеют общий важный компонент: использование стехиометрических коэффициентов, полученных из сбалансированных химических уравнений. На рисунке \(\PageIndex{2}\) представлена общая схема различных вычислительных этапов, связанных с расчетами стехиометрии многих реакций.
Подушки безопасности
Подушки безопасности (Рисунок \(\PageIndex{3}\)) – это средство обеспечения безопасности, которым оснащается большинство автомобилей с 1990-х годов.Для эффективной работы подушки безопасности необходимо, чтобы она быстро наполнялась соответствующим количеством (объемом) газа, когда автомобиль участвует в столкновении. Это требование удовлетворяется во многих автомобильных системах подушек безопасности за счет использования взрывоопасных химических реакций, одним из которых является разложение азида натрия NaN 3 . Когда датчики в автомобиле обнаруживают столкновение, электрический ток пропускают через тщательно отмеренное количество NaN 3 , чтобы инициировать его разложение:
Это требование удовлетворяется во многих автомобильных системах подушек безопасности за счет использования взрывоопасных химических реакций, одним из которых является разложение азида натрия NaN 3 . Когда датчики в автомобиле обнаруживают столкновение, электрический ток пропускают через тщательно отмеренное количество NaN 3 , чтобы инициировать его разложение:
\[\ce{2NaN3}(s)\rightarrow \ce{3N2}(g)+\ce{2Na}(s)\]
Эта реакция протекает очень быстро, образуя газообразный азот, который может развернуть и полностью надуть обычную подушку безопасности за доли секунды (~0,000 секунды).03–0,1 с). Среди многих технических соображений количество используемого азида натрия должно быть достаточным для производства достаточного количества газообразного азота для полного надувания подушки безопасности и обеспечения ее надлежащего функционирования. Например, небольшая масса (~100 г) NaN 3 будет генерировать приблизительно 50 л N 2 .
Резюме
Сбалансированное химическое уравнение может использоваться для описания стехиометрии реакции (отношения между количествами реагентов и продуктов).Коэффициенты из уравнения используются для получения стехиометрических коэффициентов, которые впоследствии могут быть использованы для расчетов, касающихся масс реагентов и продуктов, молярных количеств и других количественных свойств.
Глоссарий
- стехиометрический коэффициент
- отношение коэффициентов в уравновешенном химическом уравнении, используемое в вычислениях, касающихся количеств реагентов и продуктов
- стехиометрия
- отношения между количествами реагентов и продуктов химической реакции
Авторы и авторство
Реакция углекислого газа с водой | Эксперимент
Это относительно краткое и прямое исследование реакции углекислого газа и воды на простом уровне, которое должно занять не более 15 минут.
При реакции углекислого газа с водой образуется слабая кислота. Углекислый газ, присутствующий в выдыхаемом воздухе, вдувают в колбу, содержащую индикатор, чувствительный к небольшим изменениям pH в соответствующем диапазоне шкалы pH, и последующее изменение цвета наблюдают и регистрируют. Для соответствующих учащихся можно представить уравнение реакции между углекислым газом и водой.
Если учащиеся еще не знакомы с составом вдыхаемого и выдыхаемого воздуха, этот эксперимент может служить частью последовательности изучения темы дыхания и дыхания во вводном научном курсе с использованием надлежащего элементарного подхода к рассматриваемой химии.
Для учащихся, которые уже рассмотрели тему дыхания и знают, что двуокись углерода является важным компонентом выдыхаемого воздуха, основное внимание в этом эксперименте можно перенести на характер химической реакции (другими связанными темами могут быть кислотные дожди). , газожидкостные реакции или индикаторы).
Уравнение реакции между углекислым газом и водой может быть представлено для соответствующих учащихся.
Оборудование
Аппарат
- Защита для глаз
- Коническая колба, 250 см 3 , 2 шт.
- Индикаторные флаконы с пипетками, 3 шт.
Химикаты
- Этанол (IDA – Промышленный денатурированный спирт) (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ВРЕДНЫЙ)
- Индикаторный раствор тимолфталеина (ЛЕГКО ОГНЕОПАСНЫЙ), доступ к маленькому флакону с пипеткой
- Индикаторный раствор фенолового красного (ЛЕГКО ОГНЕОПАСНЫЙ), доступ к маленькому флакону с пипеткой
- Раствор гидроксида натрия, 0.4 М (РАЗДРАЖАЮЩЕЕ), маленький флакон с капельницей
- Дистиллированная (или деионизированная) вода, 125 см 3 , 2 шт.
Примечания по охране труда и технике безопасности
- Ознакомьтесь с нашим стандартным руководством по охране труда и технике безопасности.
- Всегда используйте защитные очки.
- Красный индикатор фенола – см. CLEAPSS Hazcard HC032.
 Индикатор можно приобрести в виде твердого реагента или в виде готового раствора в этаноле. Раствор можно приготовить из твердых реагентов, приготовив 5% вес./об. раствор в этаноле (IDA).Если доступны флаконы для капельницы 30 см 3 или 60 см 3 со встроенными пипетками, они идеально подходят для дозирования растворов индикатора. Хотя сам по себе феноловый красный не воспламеняется, его раствор в этаноле легко воспламеняется.
Индикатор можно приобрести в виде твердого реагента или в виде готового раствора в этаноле. Раствор можно приготовить из твердых реагентов, приготовив 5% вес./об. раствор в этаноле (IDA).Если доступны флаконы для капельницы 30 см 3 или 60 см 3 со встроенными пипетками, они идеально подходят для дозирования растворов индикатора. Хотя сам по себе феноловый красный не воспламеняется, его раствор в этаноле легко воспламеняется. - Тимолфталеиновый индикатор – см. карточку опасности CLEAPSS HC032. Индикатор можно приобрести в виде твердого реагента или в виде готового раствора в этаноле. Раствор можно приготовить из твердых реагентов, приготовив 5% вес./об. раствор в этаноле (IDA).Если доступны флаконы для капельницы 30 см 3 или 60 см 3 со встроенными пипетками, они идеально подходят для дозирования растворов индикатора. Хотя сам тимолфталеин не воспламеняется, его раствор в этаноле легко воспламеняется.
- Этанол (IDA – Промышленный денатурированный спирт), CH 3 CH 2 OH(l), (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ВРЕДНЫЙ) – см.
 CLEAPSS Hazcard HC040A.
CLEAPSS Hazcard HC040A. - Раствор гидроксида натрия, NaOH (водн.) (РАЗДРАЖАЮЩЕЕ при используемой концентрации) – см. карточку опасности CLEAPSS HC091a и книгу рецептов CLEAPSS RB085.
Процедура
Показать в полноэкранном режиме Деятельность 1- Налейте около 125 см 3 воды в 250 см 3 коническую колбу.
- Добавьте в воду пять или шесть капель индикатора тимолфталеина.
- Добавьте ровно столько раствора гидроксида натрия (около двух или трех капель), чтобы получился синий цвет.
- Аккуратно поговорите или подуйте в колбу, т.е. добавьте углекислый газ.
- Продолжайте добавлять углекислый газ, пока не заметите изменение цвета.
- Налейте около 125 см 3 воды в 250 см 3 коническую колбу.
- Добавьте в воду одну или две капли фенолового красного.

- Добавьте две капли раствора гидроксида натрия, чтобы получить красный раствор.
- Осторожно поговорите или подуйте в колбу – т.е. добавьте углекислый газ.
- Продолжайте добавлять углекислый газ, пока не заметите изменение цвета.
Вопросы для класса
- Почему изменение цвета не происходит мгновенно?
- По какой причине перед каждым экспериментом добавляют несколько капель раствора гидроксида натрия (NaOH)?
Ответы на вопросы
- Количество углекислого газа в каждом вдохе невелико, поэтому для реакции со щелочью требуется много вдохов.
- Для обеспечения слабой щелочности раствора в начале и для нейтрализации любого CO 2 или любой другой кислоты, изначально присутствующей.
Учебные заметки
Соломинки не нужны для вдувания выдыхаемого воздуха в колбу; достаточно просто дышать или говорить в колбу, чтобы индикатор изменил цвет.
Индикатор феноловый красный меняет цвет с желтого на красный в диапазоне рН 6,8–8,4. Тимолфталеин (также можно использовать альтернативный бромтимоловый синий) меняет цвет с синего (щелочной) на бесцветный (кислотный) в диапазоне pH 9.3–10,5. См. Книгу рецептов CLAPSS RB000, в которой также рассматривается раствор бикарбонатного индикатора.
Со временем достаточное количество углекислого газа из дыхания учеников растворяется и образует в растворе достаточно кислоты, чтобы изменить цвет индикатора:
CO 2 (водн.) + H 2 O(л) ⇌ H + (водн.) + HCO 3 – (водн.)
CO 2 также реагирует с NaOH. Эта реакция дает менее щелочной Na 2 CO 3 :
2NaOH(водн.) + CO 2 (г) → Na 2 CO 3 (водн.) + H 2 O(л)
Равновесие между углекислым газом и водой можно изменить, нагрев слабокислый раствор чуть ниже температуры кипения. С повышением температуры растворимость углекислого газа в воде уменьшается, и он уносится в атмосферу. Поэтому концентрация растворенного диоксида углерода падает, что приводит к смещению равновесия влево и изменению цвета индикатора обратно на красный. При охлаждении раствора и повторном вдувании выдыхаемого воздуха в колбу последовательность действий можно повторить.
С повышением температуры растворимость углекислого газа в воде уменьшается, и он уносится в атмосферу. Поэтому концентрация растворенного диоксида углерода падает, что приводит к смещению равновесия влево и изменению цвета индикатора обратно на красный. При охлаждении раствора и повторном вдувании выдыхаемого воздуха в колбу последовательность действий можно повторить.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера для приема файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Какой тип реакции соответствует уравнению C O2 CO2? – М.В.Организинг
Какой тип реакции соответствует уравнению C O2 CO2?
Другим особым типом комбинированной реакции является горение, то есть реакция, при которой что-то соединяется с кислородом и выделяет тепло и свет: C + O2 → CO2 2 Mg + O2 → 2 MgO Горение соединения включает расщепление (разложение) соединения в первую очередь.
Какой тип реакции является co O2 → CO2?
Реакции горения
Является ли C o2 CO2 экзотермической реакцией?
Это экзотермическая реакция, так как во время реакции выделяется тепло. Это комбинированная реакция, когда углерод соединяется с кислородом с образованием углекислого газа. Это реакция горения, когда углерод сгорает в присутствии кислорода.
Является ли Ch5 2O2 CO2 2h3O сбалансированным уравнением?
Используйте коэффициенты для балансировки уравнений • Ch5 + 2O2 > CO2 + 2h3O • C=1, H=4, O=4 > C=1, H= 4, O=4 • Теперь уравнение сбалансировано!
Является ли C o2 CO2 реакцией окисления?
Каждый атом как в реагентах, так и в продуктах имеет формальный заряд 0.Этот кажущийся заряд называется степенью окисления. Когда мы используем этот метод для реакции C в CO2, C в двуокиси углерода имеет степень окисления 4+, в то время как два кислорода имеют степень окисления 2-.
Что является окислителем в C O2 CO2?
CO — восстановитель, O 2 — окислитель. ; Бесцветный газ без запаха. [Примечание: Поставляется как несжиженный или сжиженный сжатый газ.]… Поиск по реагентам (CO, O 2)
; Бесцветный газ без запаха. [Примечание: Поставляется как несжиженный или сжиженный сжатый газ.]… Поиск по реагентам (CO, O 2)
| 1 | О2 + СО → СО2 |
|---|---|
| 4 | O2 + NO + CO → CO2 + NO2 |
| 5 | O2 + NaOH + CO → h3O + Na2CO3 |
CO2 окисляется или восстанавливается?
Наиболее восстановленная форма углерода – Ch5, наиболее окисленная – CO2.Таким образом, степень окисления одноуглеродного фрагмента однозначна и определяется количеством связей C-H, которые были заменены связями C-X, где X = любой электроотрицательный элемент (см. периодическую таблицу на предыдущей странице).
Кислород окисляется или восстанавливается?
Окисление – это присоединение кислорода. Редукция – это потеря кислорода.
Как определить, что окислено, а что восстановлено?
Атом окисляется, если его степень окисления увеличивается, восстановитель, а атом восстанавливается, если уменьшается его степень окисления, окислитель. Атом, который окисляется, является восстановителем, а атом, который восстанавливается, является окислителем.
Атом, который окисляется, является восстановителем, а атом, который восстанавливается, является окислителем.
Добавляет ли окисление кислород?
Окисление означает присоединение кислорода к молекуле или удаление водорода из молекулы. Восстановление означает присоединение водорода к молекуле или удаление кислорода из молекулы.
Что окисляется, а что восстанавливается?
Окисление — это потеря электронов или увеличение степени окисления атома, иона или определенных атомов в молекуле.Восстановление — это приобретение электронов или уменьшение степени окисления атома, иона или некоторых атомов в молекуле (уменьшение степени окисления).
Что означает окисление?
Окисление – это потеря электронов во время реакции молекулой, атомом или ионом. Окисление происходит, когда степень окисления молекулы, атома или иона увеличивается. В этой реакции водород окисляется, а фтор восстанавливается. …
Какой водород будет удален при окислении?
Прирост и потеря кислорода водород окисляется, а кислород восстанавливается. Сочетание азота и кислорода, возникающее при высоких температурах, происходит по той же схеме. и углерод, и водород окисляются (приобретают кислород).
Сочетание азота и кислорода, возникающее при высоких температурах, происходит по той же схеме. и углерод, и водород окисляются (приобретают кислород).
Почему это называется окислением?
Окисление означает процесс потери электронов любым веществом. Окисление также означает процесс присоединения кислорода. Поскольку к соединению добавляется кислород, этот процесс называется окислением.
Почему потеря электрона называется окислением?
Потеря электронов называется окислением.Присоединение электронов называется восстановлением. Поскольку любая потеря электронов одним веществом должна сопровождаться приобретением электронов чем-то другим, окисление и восстановление всегда происходят вместе.
Почему окисление не может происходить без восстановления?
Сокращение происходит, когда вид получает электроны. Следовательно, окисление не может происходить без восстановления, потому что, когда вид теряет электроны, этот электрон должен быть получен следующим видом в реакции. Для этого окисление и восстановление должны происходить одновременно.
Для этого окисление и восстановление должны происходить одновременно.
Какая польза от степени окисления?
Число окисления. Часто полезно следить за химическими реакциями, наблюдая за изменениями степени окисления атомов в каждом соединении во время реакции. Числа окисления также играют важную роль в систематической номенклатуре химических соединений.
Что такое окислительно-восстановительный процесс?
Окислительно-восстановительная (окислительно-восстановительная) реакция — это тип химической реакции, связанной с переносом электронов между двумя частицами.Окислительно-восстановительная реакция — это любая химическая реакция, в которой степень окисления молекулы, атома или иона изменяется путем приобретения или потери электрона.
Как написать уравновешенную полуреакцию?
Руководство по балансировке окислительно-восстановительных уравнений:
- Определите степени окисления каждого вида.
- Запишите каждую половину реакции и для каждой:
- Сбалансируйте количество электронов, переданных для каждой полуреакции, используя соответствующий коэффициент, чтобы электроны компенсировались.

- Сложите две полуреакции вместе и при необходимости упростите.
Что такое реакция окисления объясните на примере?
Термин окисление первоначально использовался для описания реакций, в которых элемент соединяется с кислородом. Пример: Реакция между металлическим магнием и кислородом с образованием оксида магния включает окисление магния.
Возможно ли восстановление без окисления или окисление без восстановления?
Нет.Окисление происходит потому, что агент, вызывающий окисление, — окислитель — сам должен восстановиться. Вы можете быть сбиты с толку тем, что значит иметь полуреакцию; в них один атом или соединение восстанавливается или окисляется, но больше ничего не окисляется или не восстанавливается.
Может ли иметь место окисление или восстановление?
Нет, восстановление и окисление не могут происходить по отдельности. Если один реагент окисляется, то это подтверждает, что восстановление будет происходить и в другом соединении. Отсюда и название окислительно-восстановительных реакций.
Отсюда и название окислительно-восстановительных реакций.
Можно ли провести окисление без восстановления?
Окислительно-восстановительные реакции представляют собой согласованный набор, то есть не может быть реакции окисления без одновременной реакции восстановления. Реакция окисления и реакция восстановления всегда протекают вместе, образуя целую реакцию.
Может ли окисление или восстановление происходить само по себе?
Следовательно, окисление и восстановление не могут происходить поодиночке. Если происходит одно, должно произойти и другое. Реакции, включающие окисление и восстановление, называются окислительно-восстановительными реакциями.Степень окисления (шаг) элемента — удобный способ отслеживать перенос электрона.
Какой элемент легче всего окисляется?
Порядок некоторых распространенных металлов в электродвижущем ряду, начиная с наиболее легко окисляемых, следующий: литий, калий, кальций, натрий, магний, алюминий, цинк, хром, железо, кобальт, никель, свинец, водород, медь, ртуть. , серебро, платина и золото.
, серебро, платина и золото.
Возможно ли окисление без восстановления quizlet?
Возможно ли окисление без восстановления? Нет, потому что это дополнительные процессы.
%PDF-1.7 % 223 0 объект > эндообъект внешняя ссылка 223 85 0000000016 00000 н 0000002657 00000 н 0000002820 00000 н 0000003496 00000 н 0000003545 00000 н 0000003582 00000 н 0000003696 00000 н 0000015725 00000 н 0000028312 00000 н 0000040811 00000 н 0000053064 00000 н 0000065441 00000 н 0000077725 00000 н 0000078168 00000 н 0000078560 00000 н 0000079186 00000 н 0000079777 00000 н 0000079866 00000 н 0000080272 00000 н 0000080644 00000 н 0000081095 00000 н 0000081460 00000 н 0000081757 00000 н 0000081784 00000 н 0000082258 00000 н 0000082672 00000 н 0000083434 00000 н 0000083863 00000 н 0000084230 00000 н 0000084365 00000 н 0000084507 00000 н 0000097028 00000 н 0000109791 00000 н 0000109965 00000 н 0000110238 00000 н 0000113674 00000 н 0000115166 00000 н 0000115250 00000 н 0000115320 00000 н 0000117413 00000 н 0000122557 00000 н 0000125113 00000 н 0000125166 00000 н 0000125522 00000 н 0000125557 00000 н 0000125635 00000 н 0000130145 00000 н 0000130474 00000 н 0000130540 00000 н 0000130656 00000 н 0000130780 00000 н 0000130850 00000 н 0000130934 00000 н 0000133552 00000 н 0000133824 00000 н 0000133989 00000 н 0000134016 00000 н 0000134317 00000 н 0000135176 00000 н 0000135489 00000 н 0000135833 00000 н 0000136659 00000 н 0000136698 00000 н 0000141132 00000 н 0000141171 00000 н 0000141319 00000 н 0000141460 00000 н 0000141575 00000 н 0000141721 00000 н 0000141870 00000 н 0000141948 00000 н 0000142063 00000 н 0000142330 00000 н 0000142408 00000 н 0000142670 00000 н 0000144446 00000 н 0000158996 00000 н 0000162993 00000 н 0000163271 00000 н 0000186113 00000 н 0000208955 00000 н 0000211009 00000 н 0000250377 00000 н 0000002478 00000 н 0000001996 00000 н трейлер ]/Предыдущая 306547/XRefStm 2478>> startxref 0 %%EOF 307 0 объект >поток ht](ak_ |eRL\ҊI>n|Bl$…wY\Dʅp с! кЭт
.
 04 моль
04 моль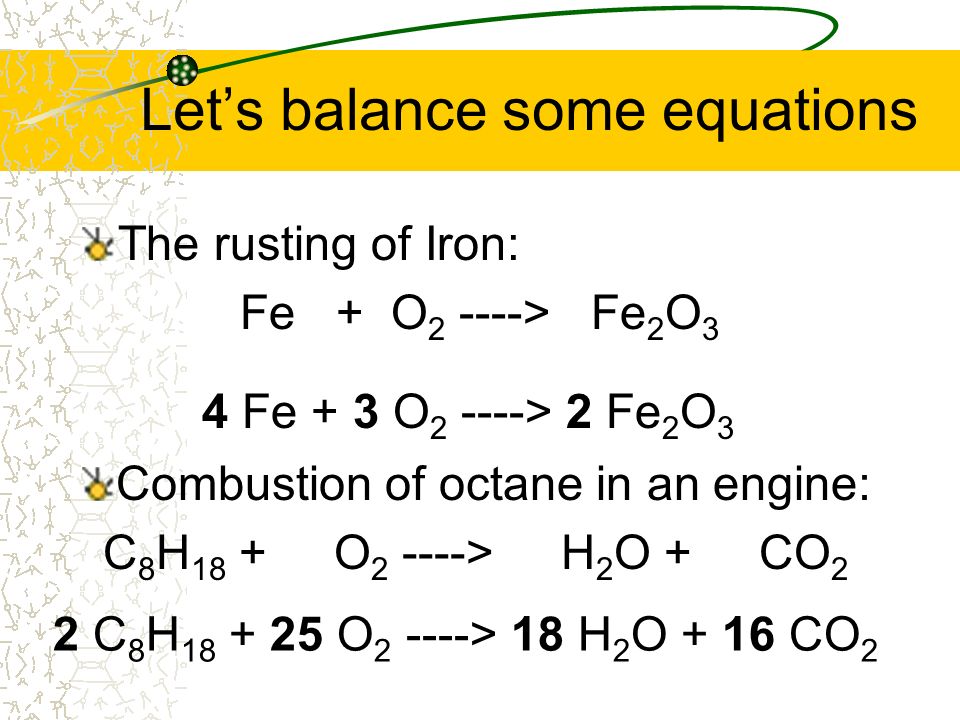 Индикатор можно приобрести в виде твердого реагента или в виде готового раствора в этаноле. Раствор можно приготовить из твердых реагентов, приготовив 5% вес./об. раствор в этаноле (IDA).Если доступны флаконы для капельницы 30 см 3 или 60 см 3 со встроенными пипетками, они идеально подходят для дозирования растворов индикатора. Хотя сам по себе феноловый красный не воспламеняется, его раствор в этаноле легко воспламеняется.
Индикатор можно приобрести в виде твердого реагента или в виде готового раствора в этаноле. Раствор можно приготовить из твердых реагентов, приготовив 5% вес./об. раствор в этаноле (IDA).Если доступны флаконы для капельницы 30 см 3 или 60 см 3 со встроенными пипетками, они идеально подходят для дозирования растворов индикатора. Хотя сам по себе феноловый красный не воспламеняется, его раствор в этаноле легко воспламеняется. CLEAPSS Hazcard HC040A.
CLEAPSS Hazcard HC040A.

