Кислород валентность — Справочник химика 21
Составим формулу соединения, которое состоит и. фосфора (валентность V) и кислорода (валентность II). [c.19]При образовании связей с менее электроотрицательными атомами (для фтора это — все элементы, для хлора — все, кроме фтора и кислорода) валентность всех галогенов равна . Степень окисления -1 и заряд иона 1-. Положительные степени окисления невозможны для фтора. Хлор же проявляет различные положительные степени окисления вплоть до +7 (номер группы). Примеры соединений приведены в Справочной части. [c.75]
Минерал Координация вокруг иона кислорода Валентность кислорода, как сумма сил связей [c.300]
У кислорода валентная оболочка содержит шесть электронов,, поэтому он может достраивать свою электронную оболочку да октета одним из следующих простейших способов [c.191]
Понятие валентность появилось в начале XIX в.
В подгруппах азота (валентность центрального атома 5), кислорода (валентность центрального атома 6), фтора (валентность центрального атома 7) оксиды и гидроксиды имеют кислотный характер. [c.98]
Теперь рассмотрим предельный случай соединения, такого, как Т1(ЫОз)4, содержащего маленький ион Т1 +, который обычно имеет координацию 6 по кислороду. Валентные усилия связи Т1—О в этом случае были бы равны 2/3, т. е. вдвое превышали бы заряд кислорода в ЫОз , так что достичь баланса заря- [c.398]
Валентные усилия связи Т1—О в этом случае были бы равны 2/3, т. е. вдвое превышали бы заряд кислорода в ЫОз , так что достичь баланса заря- [c.398]
Способность янтарной и глутаровой кислот давать циклические ангидриды можно легко объяснить, пользуясь тетраэдрической моделью Вант-Гоффа. При расположении атомов углерода в виде клешни (см. рис. 24, з и б на стр. 162) конечные звенья цепи из четырех, а особенно из пяти атомов будут весьма близко подходить друг к другу. Если на концах этой цепи находятся гидроксильные группы (как, например, у янтарной и глутаровой кислот), то кислород, валентные связи которого направлены под некоторым углом (см, стр. 65), легко замкнет кольцо.
В молекуле воды ядра водорода и кислорода образуют равнобедренный треугольник, в основании которого находятся два мелких ядра водорода, в вершине — более крупное ядро кислорода. Валентный угол у центрального атома кислорода, образованный связями Н — О — Н, составляет 104°27 (рис.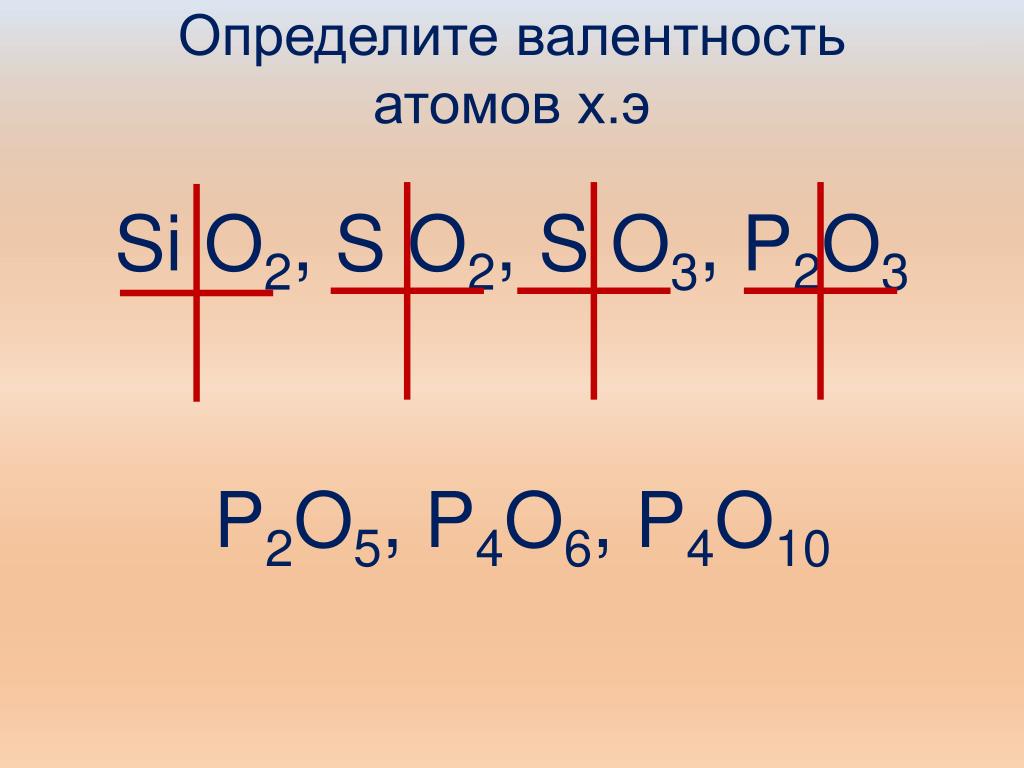 1.1, электронного облака молекулы схематично показана на рис. 1.1, 6. Две внешние пары электронов, образующих связи О — Н, смещены к атому кислорода, поэтому вблизи ядер атомов водорода создается избыток положительного заряда. Две не поделенные пары электронов также смещены относительно ядра атома кислорода, и их отрицательные заряды остаются частично не скомпенсированными. Условно можно представить, что лепестки электронного облака направлены к вершинам частично искаженного тетраэдра, что иллюстрируется рис. 1.1, в. [c.12]
1.1, электронного облака молекулы схематично показана на рис. 1.1, 6. Две внешние пары электронов, образующих связи О — Н, смещены к атому кислорода, поэтому вблизи ядер атомов водорода создается избыток положительного заряда. Две не поделенные пары электронов также смещены относительно ядра атома кислорода, и их отрицательные заряды остаются частично не скомпенсированными. Условно можно представить, что лепестки электронного облака направлены к вершинам частично искаженного тетраэдра, что иллюстрируется рис. 1.1, в. [c.12]
Валентность. Одним из основных химическ> х свойств элементов является валентность. Под валентностью подразумевают свойство атома одного элемента присоединять к себе один или несколько атомов другого элемента. Первоначально различали валентность элементов по водороду (валентность водорода принимали за 1) и по кислороду (валентность его равна 2). В связи с развитием представлений о строении атома валентность стали подразделять на положительную и отрицательную.
Большинство приведенных данных может быть объяснено образованием при отдаче (как и для случая с радиоактивным марганцем) заряженных радикалов, содержащих радиоактивные атомы, соединенные с кислородом. Валентность элемента при распаде молекул не меняется. Эти радикалы в некоторых случаях способны к реакциям окисления или восстановления воды с образованием радиоактивных окислов низших степеней окисления (МпО,). свободных радиоактивных изотопов (Se) или отрицательно заряженных ионов радиоактивных изотопов (СГ). Кроме того, они могут гидратироваться с образованием радиоактивной материнской молекулы. Радиоактивная материнская молекула может получиться также в результате изотопного обмена.
Помимо семи периодов и десяти рядов, в периодической системе элементов различают еще девять расположенных по вертикалям групп элементов с близкими свойствами и с одинаковой максимальной по кислороду валентностью. В первой группе слева расположены одновалентные элементы, во второй — двухвалентные и т. д. В последней группе размещены инертные газы, не проявляющие никакой валентности. Последняя группа называется поэтому нулевой группой. Элементы каждой группы характеризуются также определенной валентностью по водороду. [c.198]
д. В последней группе размещены инертные газы, не проявляющие никакой валентности. Последняя группа называется поэтому нулевой группой. Элементы каждой группы характеризуются также определенной валентностью по водороду. [c.198]
Химический знак хлора С1 (произносится в формулах хлор). Заряд ядра 17, следовательно, электронов тоже 17, размещенных в трех слоях в первом — два, втором — восемь, третьем — семь. Атомная масса хлора округленно 35,5. Валентность в соединениях с водородом и металлами отрицательная — минус 1. В соединениях с кислородом валентность положительная — от плюс I до плюс 7.
[c.94] Каталитическое действие ванадиевого ангидрида сводится к следующему при повышенных температурах он является сильным окислителем, так как легко отщепляет кислород. Сернистый газ адсорбируется на его поверхности и окисляется до серного ангидрида, который десорбируется. За счет отдачи кислорода валентность ванадия понижается, и образуются низшие окислы. Затем эти соединения снова окисляются до пятиокиси ванадия, которая выполняет роль переносчика кислорода. [c.49]
Затем эти соединения снова окисляются до пятиокиси ванадия, которая выполняет роль переносчика кислорода. [c.49]
Второе важное обстоятельство, определяющее развитие первичной стадии окисления, заключается в необходимости выполнения закона валентности. Все атомы металлической поверхности, пришедшие в первичное соприкосновение с частицами кислорода, должны образовать сочетания с кислородом, удовлетворяющие валентным отношениям . Исходя из этого, первичный слой окисла на серебре изображен в виде сочетаний пар поверхностных металлических атомов с одиночными атомами кислорода. Валентное насыщение будет достигнуто для атомов всего поверхностного (исходного) слоя металличе-
Рассмотрим далее такое важное химическое свойство элементов, как их валентность. Валентностью называется способность атома данного элемента соединяться с определённым числом атомов водорода, валентность которого принимается за единицу, или с равноценным числом других атомов, например, атомов кислорода, валентность которого равна двум.
 У одного и того же элемента валентность может иметь различные значения. Так, если взять валентность по кислороду, то, например, у ртути она равна или 1 ( в закиси ртути) или 2 (в окиси ртути). Менделеев учитывал наибольшую валентность элементов по кислороду, которая проявляется в их окисях, следовательно, ту, которая у ртути равна 2. [c.14]
У одного и того же элемента валентность может иметь различные значения. Так, если взять валентность по кислороду, то, например, у ртути она равна или 1 ( в закиси ртути) или 2 (в окиси ртути). Менделеев учитывал наибольшую валентность элементов по кислороду, которая проявляется в их окисях, следовательно, ту, которая у ртути равна 2. [c.14]Следовательно, в этих молекулах атому водорода приписывается валентность, равная единице, атому, кислорода — валентность, равная двум. Атомы водорода и кислорода этих рядов, как следует из формул строения, могут образовывать связи О—Н и О—О. На основании постулата, изложенного выше, возможно существование, например, следующих других молекул, содержащих атомы и связи тех же родов [c.52]
Для кислорода валентность II является постоянной. Это объясняется так кислород — элемент второго периода, на внешнем энергетическом уровне (п = 2) атома кислорода отсутствует /-подуровень, и поэтому невозможно возбуждение атома в пределах второго энергетического уровня, а для перехода спаренных (ё-нов второго уровня на третий требуется затрата очень большого количества энергии.
В молекуле воды ядра водорода и кислорода образуют равнобедренный треугольник, в основании которого находятся два мелких ядра водорода, в вершине — более крупное ядро кислорода. Валентный угол у центрального атома кислорода, образованный связями Н—О—Н, составляет 104 27 (рис. 1, а). Структура электронного облака молекулы схематично показана на рис. 1, б. Две внешние пары электронов, образующих связи О—Н, смещены кг атому кислорода, поэтому вблизи ядер атомов водорода создается избыток положительного заряда. Две неподеленные пары электронов также смещены относительно ядра атома кислорода, и их отрицательные заряды остаются частично не-скомпенсированными. Условно можно представить, что лепестки электронного облака направлены к вершинам частично искаженного тетраэдра, что иллюстрируется рис. 1, в, Ассиметричность распределения электрических зарядов обусловливает ярко выраженные полярные свойства молекулы воды, которая представляет собой диполь с очень высоким электрическим моментом.
Во многих катализаторах содержатся металлы, которые могут иметь несколько различных степеней окисления. Например, в исходном катализаторе, содержащем железо, могут присутствовать ионы Ре , Ре + или и те и другие. Есть основания считать, что каталитические свойства определяются именно смесями ионов разного заряда или ионами с изменяющимися степенями окисления. При исследовании катализаторов с переменной степенью окисления следует оценивать возможную валентность их ионов в заданных условиях. Например, в условиях, способствующих протеканию реакции восстановления, оксиды молибдена находятся в низкой степени окисления (4-Н и ниже), а при их использовании в качестве катализаторов окисления при избытке кислорода валентность молибдена близка к максимальной (6-Н). Можно сравнивать каталитические свойства М0О2 и МоОз в отношении определенной реакции, но нужно помнить, что в заданных условиях может существовать только одно из этих соединений.
Решение. Прежде всего запишем льюисову (валентную) структуру молекулы. Полное число валентных электронов в ней равно 42 8 от атома ксенона, по 7 от каждого из четырех атомов фтора и б от атома кислорода. Валентная структура молекулы ХеОР показана на рис. 21.7, а. Мы видим, что в валентной оболочке Хе содержится 12 электронов. Следовательно, можно предположить, что шесть электронных пар образуют октаэдрическую конфигурацию. Одна из них осуществляет связь с атомом кислорода. [c.288]
Прежде всего запишем льюисову (валентную) структуру молекулы. Полное число валентных электронов в ней равно 42 8 от атома ксенона, по 7 от каждого из четырех атомов фтора и б от атома кислорода. Валентная структура молекулы ХеОР показана на рис. 21.7, а. Мы видим, что в валентной оболочке Хе содержится 12 электронов. Следовательно, можно предположить, что шесть электронных пар образуют октаэдрическую конфигурацию. Одна из них осуществляет связь с атомом кислорода. [c.288]
Для кислорода валентность II является пo тoян oй, Это объясняется так кислород — элемент второго периода, на внешнем энергетическом уровне (п=2) атома кислорода отсутствует [c.352]
Для кремния, который имеет валентность 4 и может образовать четыре связи с прочностью 1, можно ожидать образования связей Si—О—Si, не обладающих избыточной энергией. И действительно, устойчивость поликремневых кислот вплоть до предельного содержания в них ЗЮг такая же, как и устойчивость самой кремневой кислоты.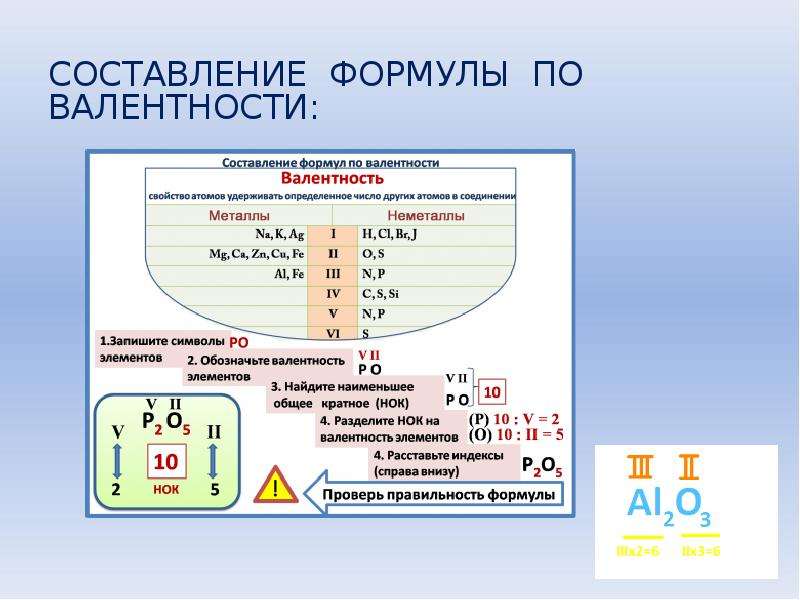 С другой стороны, прочность IV2 для четырех эквивалентных связей сера — кислород (валентность 6 для серы) приводит к сумме 3 для S—О—S, к вдвое большему отклонению от значения 2, требующегося для насыщения валентности кислорода в случае Р—О—Р. Ниже приведены экспериментально найденные значения количества теплоты, выделяющейся при гидролизе трех дикислот и соответствующего окисла хлора I2O7 (со всевозрастающим отклонением от электронейтральиости) [c.228]
С другой стороны, прочность IV2 для четырех эквивалентных связей сера — кислород (валентность 6 для серы) приводит к сумме 3 для S—О—S, к вдвое большему отклонению от значения 2, требующегося для насыщения валентности кислорода в случае Р—О—Р. Ниже приведены экспериментально найденные значения количества теплоты, выделяющейся при гидролизе трех дикислот и соответствующего окисла хлора I2O7 (со всевозрастающим отклонением от электронейтральиости) [c.228]
На примере поведения серы в реакциях образования органич. и неорганич. полимеров можно лишний раз убедиться в неполноте аналогий , основывающихся на периодич. таблице элементов. Так, в органич. полимерах связи С — ОиС — 8во многом аналогичны. При замене углерода на кремний эта аналогия исчезает, а попутно становится ясной ограниченность аналогии самих элементов О и 8. Действительно, никакого тиоаналога силикатов не существует, хотя при взаимодействии с кремнием сера и не проявляет свои дополнительные (по сравнению с кислородом) валентности. Известен циклолинейный спирополимер силикондисульфид, образующийся при взаимодействии сульфида алюминия и окиси кремния [c.183]
Известен циклолинейный спирополимер силикондисульфид, образующийся при взаимодействии сульфида алюминия и окиси кремния [c.183]
Например, стандартный потенциал окислительно-восстановительного перехода Ре +/РеЗ+ близок к +0,78 в, а перехода Рез04/Ре20з — к +0,27 в. При потенциалах выделения кислорода валентность никеля в окисле достигает уже 4, а гидратный комплекс никеля остается двухвалентным и т. д. [c.17]
Сопоставление атомного состава разнообразнейших молекул привело к выводу о том, что в самой природе атомов заложено некоторое свойство, определяющее строгие количественные закономерности в построении молекул из атомов и нашедшее свое конкретное выражение в законе Пруста. Лрирода этого свойства была неясна, но оно получило название валентности (от латинского valentia — сила, могущество, иногда — прочность). Термин предложен Э. Франк-ландом (1853). В качестве основы для количественного выражения избрали водород и кислород валентность первого была принята равной единице, а второго — двум. Основываясь на этом, можно по химической формуле вещества вычислять валентность и других элементов. Например, валентность углерода в метане СН4 равна четырем, а серы в SO3 —шести. Валентность элемента, вычисленная на основе химической форму- [c.118]
Основываясь на этом, можно по химической формуле вещества вычислять валентность и других элементов. Например, валентность углерода в метане СН4 равна четырем, а серы в SO3 —шести. Валентность элемента, вычисленная на основе химической форму- [c.118]
В соединениях с металлами и водородом сера двухвалентна. В важнейших соединениях с кислородом валентность серы равна 4 или 6. [c.138]
Если молекула состоит из большого числа атомов, отнесение наблюдаемых полос поглощения в ИК-спектре к определенным видам колебания часто представляет трудную задачу. При отнесении полос поглощения может оказаться полезным наб.чюдение сдвигов частот при изотопном замещении. Ситуация особенно проста, когда рассматриваются валентные колебания связей с атомами водорода. Как отмечалось выше, эти колебания обычно проявляются как характеристические колебания связей. Так как атом водорода обычно намного легче атома, с которым он связан, например атома кислорода, валентные колебания связи можно приближенно рассматривать как для случая двухатомной молекулы, в которой приведенная масса приблизительно равна массе атома водорода. Тогда изотопное замещение дает изотопный сдвиг, приб.пиженно вычисляемый по уравнению (6) [c.333]
Тогда изотопное замещение дает изотопный сдвиг, приб.пиженно вычисляемый по уравнению (6) [c.333]
Из структурной формулы молекулы Р2О5 видно, что в ней действительно использованы все валентности и фосфора и кислорода. Валентность всех элементо В приведена в периодической системе Д. И. Менделеева. В периодической таблице указана валентность элементов и по водороду, и по кислороду. В нижней части таблицы под каждой группой элементов а всего в таблице 9 групп) дается общая формула соединений элементов данной группы с водородом и кислородом. [c.52]
В том случае, когда крем, некислородные тетраэдры в описанных выше листах имеют поочередную направленность свободной валентности кислорода, оказывается, что при наложении двух таких листов можно заменить каждую пару ненасыщенных кислородов одним общим кислородом, валентности которого будут связывать листы между собой (рис. 23). Таким образом возникают пространственные решетки, состоящие из групп [5104], имеющие вид каркасов или сот. Обычно этот тип структур называется каркасным или остовным. Подобные структуры наблюдаются у модификаций кристаллического кремнезема (кварц, тридимит, крис-тобалит) и у ряда алюмосиликатов типа нефелина и полевых шпатов. [c.62]
Обычно этот тип структур называется каркасным или остовным. Подобные структуры наблюдаются у модификаций кристаллического кремнезема (кварц, тридимит, крис-тобалит) и у ряда алюмосиликатов типа нефелина и полевых шпатов. [c.62]
В атоме кислорода валентными орбиталями являются 2 и 2р. Использование наряду с 2р, атомных 25-орбпталей кислорода приводит к значительно более точному виду о-МО. Однако для простоты при образовании 0-МО мы будем учитывать только 2/>2 орби-тали атома кислорода. [c.111]
Физиологическая роль меди теснейшим образом связана с окислительными процессами, происходящими в растительных и животных организмах. Медь является составной частью ряда важнейших окислительных ферментов — полифенолоксидазы, аскорбиноксидазы, лакказы и дегидрогеназы бутирил-кофермен-та А. Сравнительно недавно Г. Малером было показано, что уриказа, или иначе, урикооксидаза, — фермент, производящий окисление мочевой кислоты, также содержит медь . Все указанные медьсодержащие ферменты осуществляют реакции окисления путем переноса электронов с субстрата к молекулярному кислороду, являющемуся акцептором электронов. В связи с функциями переноса электронов от субстрата к атмосферному кислороду валентность меди в протекающих окислительно-восстановительных реакциях изменяется от двухвалентного к одновалентному состоянию и обратно. [c.114]
Все указанные медьсодержащие ферменты осуществляют реакции окисления путем переноса электронов с субстрата к молекулярному кислороду, являющемуся акцептором электронов. В связи с функциями переноса электронов от субстрата к атмосферному кислороду валентность меди в протекающих окислительно-восстановительных реакциях изменяется от двухвалентного к одновалентному состоянию и обратно. [c.114]
Валентность элементов в соединениях определяют- из их формул на основании следующих положений валентность водорода принимается равной 1, валентность кислорода — равной 2 произведение валентности элемента на число атомов его в одной половине молекулы бинарного соединения, состоящего из двух видов атомов, численно равно произведению валентности второго элемента на число атомов его в другой половине хмолекулы при отсутствии в соединении водорода и кислорода валентность -элемента определяется по известной валентности другого элемента. [c.41]
Поверхность металлов существенно отличается от оксидов как в структурном, так и электронном аспектах. Ближайшими атомами теперь служат атомы металла, а не кислорода. Валентная зона и зона проводимости теперь перекрываются, что приводит к отсутствию термоактивационного характера переноса электрона и электронной проводимости. В массивных металлах длина носителей электронной проводимости составляет десятки нанометров, и, таким образом, уменьшение пленок металла до таких размеров приводит к размерной зависимости проводимости. Большое значение для определения положения электронных уровней в металле имеет работа выхода электрона с поверхности. Работа выхода электрона ф или работа удаления электрона с верхнего заполненного уровня (уровня Ферми) в вакуум представляет собой вообще-то объемную характеристику и определяет положение уровня Ферми в объеме металла. Тем не менее на нее влияет асимметрия потенциала на фани металл — вакуум и, таким образом, работа выхода может быть использована для исследования элекфонной структуры поверхности. [c.128]
Ближайшими атомами теперь служат атомы металла, а не кислорода. Валентная зона и зона проводимости теперь перекрываются, что приводит к отсутствию термоактивационного характера переноса электрона и электронной проводимости. В массивных металлах длина носителей электронной проводимости составляет десятки нанометров, и, таким образом, уменьшение пленок металла до таких размеров приводит к размерной зависимости проводимости. Большое значение для определения положения электронных уровней в металле имеет работа выхода электрона с поверхности. Работа выхода электрона ф или работа удаления электрона с верхнего заполненного уровня (уровня Ферми) в вакуум представляет собой вообще-то объемную характеристику и определяет положение уровня Ферми в объеме металла. Тем не менее на нее влияет асимметрия потенциала на фани металл — вакуум и, таким образом, работа выхода может быть использована для исследования элекфонной структуры поверхности. [c.128]
Что такое валентность и как составлять формулы?
☰
Атомы одних и тех же химических элементов в разных соединениях присоединяют разное количество других атомов. Например, в воде атом кислорода присоединяет два атома водорода (H2O), а в оксиде меди — только один атом меди (CuO). При этом молекула углекислого газа содержи два атома кислорода и один углерода (CO2).
Например, в воде атом кислорода присоединяет два атома водорода (H2O), а в оксиде меди — только один атом меди (CuO). При этом молекула углекислого газа содержи два атома кислорода и один углерода (CO2).
Атомы, составляющие молекулы, соединяются между собой с помощью химических связей. Атомы разных химических элементов могут образовывать только характерное для них количество химических связей. Например, водород может образовывать только одну связь, а кислород — две. Поэтому в молекуле воды каждый атом водорода связан с кислородом одной связью, таким образом у кислорода «задействованы» все две связи. Атом меди может образовывать две связи, как и кислород. В результате в оксиде меди между атомом меди и атомом кислорода устанавливается двойная связь. В углекислом газе углерод образует четыре связи, а кислород только две. Поэтому требуется два атома кислорода, чтобы соединиться ч четырьмя связями углерода.
В химии используются так называемые структурные формулы. В них отражается число атомов в молекуле и химические связи между атомами. Например, молекулу воды можно изобразить так: H—O—H. Здесь видно, что у кислорода две связи, а у каждого атома водорода только одна. Кроме того, видно, что атомы водорода соединены с кислородом, но не друг с другом. Структурную формулу оксида меди можно изобразить так: Cu=O (двойная связь между атомами). Структурная формула углекислого газа: O=C=O.
В них отражается число атомов в молекуле и химические связи между атомами. Например, молекулу воды можно изобразить так: H—O—H. Здесь видно, что у кислорода две связи, а у каждого атома водорода только одна. Кроме того, видно, что атомы водорода соединены с кислородом, но не друг с другом. Структурную формулу оксида меди можно изобразить так: Cu=O (двойная связь между атомами). Структурная формула углекислого газа: O=C=O.
Если знать валентность одного атома в молекуле и формулу молекулы, то можно определить валентность другого атома. Например, Fe2O3. Здесь кислород двухвалентен, следовательно, три атома кислорода образуют шесть связей. В формулу входит всего два атома железа. Если учесть, что они не соединяются между собой, то все их связи должны соединиться с шестью связями кислорода. Так как атомов железа всего два, то тогда валентность железа будет равна как 6/2 = 3. Валентность принято обозначать римскими цифрами. Таким образом, валентность железа в оксиде Fe2O3 равна III.
Произведение числа атомов одного элемента на его валентность равно произведению числа атомов второго элемента на его валентность.
Валентность одних химических элементов всегда постоянна. К таким элементам относятся кислород (II), водород (I), натрий (I), кальций (II), алюминий (III) и многие другие элементы.
Однако существует немало химических элементов, чьи атомы проявляют переменную валентность. К таким элементам относится углерод. В углекислом газе он проявляет валентность равную четырем, однако существует также оксид углерода (II) — CO. Сера может быть двух-, четырех- и шестивалентной. Фосфор — трех- и пятивалентным.
Валентность. Как найти валентность. Элементы с постоянной валентностью
Валентность — это способность атома данного элемента образовывать определенное количество химических связей.
Образно говоря, валентность — это число «рук», которыми атом цепляется за другие атомы. Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Можно сказать иначе: валентность — это способность атома данного элемента присоединять определенное число других атомов.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство).
Элементы с постоянной валентностью необходимо запомнить:
| Элементы | Постоянная валентность |
| щелочные металлы (Li, Na, K, Rb , Cs, Fr) | I |
| металлы II группы, главной подгруппы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| алюминий (Al) | III |
| кислород (О) | II |
| фтор (F) | I |
Остальные элементы могут проявлять разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент.

Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Важно запомнить несколько исключений: максимальная (и единственная) валентность фтора равна I (а не VII), кислорода — II (а не VI), азота — IV (способность азота проявлять валентность V — популярный миф, который встречается даже в некоторых школьных учебниках).
Валентность и степень окисления — это не тождественные понятия.
Эти понятия достаточно близки, но не следует их путать! Степень окисления имеет знак (+ или -), валентность — нет; степень окисления элемента в веществе может быть равна нулю, валентность равна нулю лишь в случае, если мы имеем дело с изолированным атомом; численное значение степени окисления может НЕ совпадать с валентностью. Например, валентность азота в N2 равна III, а степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.
Например, валентность азота в N2 равна III, а степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого.
Делается это весьма просто. Запомните формальное правило: произведение числа атомов первого элемента в молекуле на его валентность должно быть равно аналогичному произведению для второго элемента.
В соединении AxBy: валентность (А) • x = валентность (В) • y
Пример 1. Найти валентности всех элементов в соединении NH3.
Решение. Валентность водорода нам известна — она постоянна и равна I. Умножаем валентность Н на число атомов водорода в молекуле аммиака: 1 • 3 = 3. Следовательно, для азота произведение 1 (число атомов N) на X (валентность азота) также должно быть равно 3. Очевидно, что Х = 3. Ответ: N(III), H(I).
Пример 2. Найти валентности всех элементов в молекуле Cl2O5.
Решение. У кислорода валентность постоянна (II), в молекуле данного оксида пять атомов кислорода и два атома хлора. Пусть валентность хлора = Х. Составляем уравнение: 5 • 2 = 2 • Х. Очевидно, что Х = 5. Ответ: Cl(V), O(II).
Пример 3. Найти валентность хлора в молекуле SCl2, если известно, что валентность серы равна II.
Решение. Если бы авторы задачи не сообщили нам валентность серы, решить ее было бы невозможно. И S, и Cl — элементы с переменной валентностью. С учетом дополнительной информации, решение строится по схеме примеров 1 и 2. Ответ: Cl(I).
Зная валентности двух элементов, можно составить формулу бинарного соединения.
В примерах 1 — 3 мы по формуле определяли валентность, попробуем теперь проделать обратную процедуру.
Пример 4. Составьте формулу соединения кальция с водородом.
Решение. Валентности кальция и водорода известны — II и I соответственно. Пусть формула искомого соединения — CaxHy. Вновь составляем известное уравнение: 2 • x = 1 • у. В качестве одного из решений этого уравнения можно взять x = 1, y = 2. Ответ: CaH2.
«А почему именно CaH2? — спросите вы. — Ведь варианты Ca2H4 и Ca4H8 и даже Ca10H20 не противоречат нашему правилу!»
Ответ прост: берите минимально возможные значения х и у. В приведенном примере эти минимальные (натуральные!) значения как раз и равны 1 и 2.
«Значит, соединения типа N2O4 или C6H6 невозможны? — спросите вы. — Следует заменить эти формулы на NO2 и CH?»
Нет, возможны. Более того, N2O4 и NO2 — это совершенно разные вещества. А вот формула СН вообще не соответствует никакому реальному устойчивому веществу (в отличие от С6Н6).
Несмотря на все сказанное, в большинстве случаев можно руководствоваться правилом: берите наименьшие значения индексов.
Пример 5. Составьте формулу соединения серы с фтором, если известно, что валентность серы равна шести.
Решение. Пусть формула соединения — SxFy. Валентность серы дана (VI), валентность фтора постоянна (I). Вновь составляем уравнение: 6 • x = 1 • y. Несложно понять, что наименьшие возможные значения переменных — это 1 и 6. Ответ: SF6.
Вот, собственно, и все основные моменты.
А теперь проверьте себя! Предлагаю пройти небольшой тест по теме «Валентность».
Хотите узнать, почему «классическое» определение валентности часто не «работает»? Почему валентность железа в FeO не равна двум? Почему для описания комплексных веществ используется понятие «координационное число»?
Смотрите продолжение этой статьи →
Как определить валентность
Как определить валентность:
Заметьте, что количество атомов кислорода отличается в разных соединениях.
Например, CO2 и H2O. В углекислом газе на 1 молекулу углерода, 2 молекулы кислорода, а в воде наоборот 2 водорода и только один кислород.
Дело в том, что разные вещества могут присоединить к себе разное количество атомов (образовывать определенное количество связей): водород — 1 атом (1 связь), кислород — 2 атома (2 связи) и т.д. Это свойство атомов называют валентность (от лат. «имеющий силу» — тот же корень, что и у имени «Валентин», который тоже «имеющий силу»).
Есть также определенная последовательность этой связи, которая выражается в структурных формулах, где связи показаны черточками.
Вот структурная формула для воды (H2O):
Водород здесь связан только с кислородом, но не между собой. Значит у каждого атома водорода по одной связи, он одновалентен.
У кислорода две связи — он двухвалентный.
Еще одна структурная (графическая) формула для углекислого газа (CO2):
O = C = O
Здесь кислород двухвалентен, его атомы связаны только с четырехвалентным углеродом.
Трехвалентный азот в аммиаке и четырехвалентный углерод в метане будут выглядеть так:
Валентность можно обозначать и римскими цифрами сверху:
Зная валентность одного вещества, можно легко понять валентность второго:
Например, Fe2O3 — 3 атома кислорода имеют валентность 2, значит 3*2 = 6, а железа у нас 2 атома, значит его валентность 6:2 = 3.
Однако, валентность некоторых элементов может быть переменной, т.е. отличаться. в зависимости от вещества, с которым вступает в связь. Переменную валентность указывают в скобках: CO2 (IV), CO (II).
В простых веществах нет смысла указывать валентность. Валентность может быть интересна только в молекулярных веществах, куда входят 2 и более элементов.
Редактировать этот урок и/или добавить задание Добавить свой урок и/или заданиеДобавить интересную новость
Какая валентность элементов в h3O2? У кислорода же валентность 2? Или 1?
30. Значение ферментов в регуляции обмена веществ. Применение ферментов в ме-ДИЦИНе,31. Авитаминозные, гиповитаминозные и гипервитаминозные состояния … организмачеловека. Причины возникновения. Примеры.в. Биологическая роль Витаминов,
реакция конденсации формальдегида с этиленом.Реакция конечного продукта с h3O2?
Напишите кинетическое уравнение скорости химических реакций:С(тв)+О2(г)=СО2 ; Zn(тв)+2HCl(ж)=ZnCl2+h3 ; N2(г)+3h3(г)=2Nh4
Определите строение соединения А состава С8Н16О. Оно не реагирует с металлическим натрием, не выделяет газ с алкилмагнийбромидом, не взаимодействует с … водой. С йодистым волородом оно образует продукт Б состава С8Н17ОI, переходящий при обработке щелочью в вещество В. Последнее окисляется в соединение Г состава С8Н14О4, теряющее при нагреве воду с образованием вещества Д (С8Н12О3). При нагревании с концентрированным аммиаком и цирковой пылью, Д образует 3,4-диэтилпиррол. Из Г при термической обработке в присутствии щёлочи получается н-гексан.(-5).
Какой окрас с раствором йода образуют амилодекстрины, эритродекстрины и ахродекстрины?
Кислород. Оксиды. Валентность — презентация онлайн
1. Кислород. Оксиды. Валентность
2. Кислород (химический элемент)
168
O
Самый распространённый элемент на Земле
3. Кислород (простое вещество)
Кислород – двухатомная молекула O2Газ б/цв., б/запаха, плохо растворим в h3O
Поддерживает горение
Mr(O2) = 32, т.е. тяжелее воздуха (Mr(воздуха) = 29)
Жидкий кислород – вещество голубого цв., tпл = -183 °С
Твёрдый кислород – вещество синего цв., tпл = -219 °С
Аллотропная модификация кислорода – озон O3
4. Получение кислорода
Лабораторные способы:1.
2HgO
2.
2KClO3 (нагревание)→ 2KCl + 3O2↑
(нагревание)→
2Hg + O2↑ (Дж. Пристли 1774 г.)
разложение бертолетовой соли
3.
2KMnO4 (нагревание)→ K2MnO4 + MnO2 + O2↑
4.
2h3O2
(нагревание или катализатор или фермент)→
2h3O + O2↑
5. Получение кислорода
Промышленный способ:Сжижение чистого воздуха (при высоком давлении и
низкой температуре до -200 °С) → O2(жид.) + N2(жид.)
O2(жид.) tкип = -183 °С
N2(жид.) tкип = -196 °С
6. Химические свойства кислорода
Кислород реагирует с простыми веществами:1.
Me + O2 → MeO (оксид металла)
4Al + 2O2 → 2Al2O3 – оксид алюминия
2.
неMe + O2 → неMeO (оксид неметалла)
C + O2 → CO2↑ – оксид углерода(IV)
S + O2 → SO2↑ – оксид серы(IV)
P + O2 → P2O5↑ – оксид фосфора(V)
Кислород реагирует со сложными веществами:
Ch5 + 2O2 → CO2↑ + 2h3O
2h3S + 3O2 → SO2↑ + 2h3O
7. Оксиды – это сложные вещества, состоящие из двух видов атомов (химических элементов), один из которых кислород.
8. Валентность – это число связей, которое один атом может образовать с другим атомом.
Группа/
Период
I гр.
1
HI
2
II гр.
III гр.
IV гр.
LiI
BeII
BIII
CII, IV
3
NaI
MgII
AlIII
SiII, IV
4
KI
CaII
V гр.
NI,
VI гр.
VII гр.
OII
FI
SII, IV, VI
ClI, III, V, VII
постоянная
валентность
переменная
валентность
II, III, IV, V
PI, III, V
! У элементов VIII группы (He, Ne, Ar, Kr, Xe, Rn) валентностей
не существует.
9. Составление формул оксидов по валентности
Последовательностьдействий
Записать символы хим. элементов
(кислород на втором месте) и указать
их валентность (кислород всегда
двухвалентен, а валентность второго
элемента либо дана в названии, либо
является постоянной)
Составление формулы
Оксид алюминия
AlIIIOII
Оксид азота(V)
NVOII
Найти НОК (наименьшее общее
кратное) валентностей элементов
III и II → 6
V и II → 10
Найти индексы, разделив НОК на
валентности каждого элемента
6 : III = 2 (Al)
6 : II = 3 (O)
10 : V = 2 (N)
10 : II = 5 (O)
Записать индексы после символов
химических элементов
Al2IIIO3II
N2VO5II
10. Определение валентности по формуле оксида
Последовательностьдействий
Указать валентность кислорода
Умножить кол-во атомов кислорода
(индекс) на его валентность (II)
Разделить полученное значение (НОК)
на индекс второго элемента
Записать значение валентности над
символом второго элемента
Определение валентности
Fe2O3II
SO3II
3 ∙ II = 6
3 ∙ II = 6
6 : 2 = III (Fe)
6 : 1 = VI (S)
Fe2IIIO3II
SVIO3II
Группа
/
Период
I гр.
1
h3IOII
оксид
водорода
2
3
4
Li2IOII
оксид лития
Na2IOII
оксид натрия
K2IOII
оксид калия
II гр.
BeIIOII
оксид
бериллия
MgIIOII
оксид магния
CaIIOII
оксид
кальцияа
III гр.
IV гр.
СIIOII
B2IIIO3II
оксид бора
Al2IIIO3II
оксид
алюминия
оксид углерода(II)
СIVO2II
оксид
углерода(IV)
SiIIOII
оксид кремния(II)
SiIVO2II
оксид кремния(IV)
V гр.
VI гр.
N2IOII
оксид азота(I)
NIIOII
оксид азота(II)
N2IIIO3II
оксид азота(III)
NIVO2II
оксид азота(IV)
N2VO5II
оксид азота(V)
OII
P2IOII
SIIOII
оксид фосфора(I)
P2IIIO3II
оксид фосфора(III)
P2VO5II
оксид фосфора(V)
оксид серы(II)
SIVO2II
оксид серы(IV)
SVIO3II
оксид серы(VI)
VII гр.
FI
Не сущ.!
Cl2IOII
оксид хлора(I)
Cl2IIIO3II
оксид хлора(III)
Cl2VO5II
оксид хлора(V)
Cl2VIIO7II
оксид хлора(V)
12. Воздух —
Воздух это смесьразличных газов.
Mr(воздуха) = 29
Благородные
газы 0.94%
Прочие газы и примеси 0.03%
CO2 0.03%
Кислород
O2 21%
Азот N2
78%
Г. П. Лучинский
Происхождение понятия валентности. Валентность химических элементов является одним из самых важных их свойств. Понятие валентности было введено в науку Э. Франкландом в 1852 г. Вначале понятие носило исключительно стехиометрический характер и вытекало из закона эквивалентов. Смысл понятия валентности вытекал из сопоставления величин атомной массы и эквивалента химических элементов.
С установлением атомно-молекулярных представлений понятие валентности приобрело определенный структурно-теоретический смысл. Под валентностью стали понимать способность одного атома данного элемента присоединять к себе то или иное число атомов другого химического элемента. За единицу валентности была принята соответствующая способность атома водорода, поскольку отношение атомной массы водорода к его эквиваленту равно единице. Таким образом валентность химического элемента определяли как способность его атома присоединять то или иное число атомов водорода. Если данный элемент не образовывал соединений с водородом, его валентность определялась как способность его атома замещать то или иное число атомов водорода в его соединениях.Такое представление о валентности подтверждалось для простейших соединений.
На основе представления о валентности элементов возникло представление и о валентности целых групп. Так, например, группе OH, поскольку она присоединяла один атом водорода или замещала один атом водорода в других его соединениях, приписывалась валентность, равная единице. Однако представление о валентности теряло свою однозначность, когда дело касалось соединений более сложных. Так, например, в перекиси водорода H2O2 валентность кислорода должна быть признана равной единице, поскольку в этом соединении на каждый атом кислорода приходится один атом водорода. Однако известно, что каждый атом кислорода в H2O2 соединен с одним атомом водорода и одной одновалентной группой OH, т. е. кислород двухвалентен. Подобным образом валентность углерода в этане C2H6 должна быть признана равной трем, так как в этом соединении на каждый атом углерода приходится по три атома водорода, но, поскольку каждый атом углерода соединен с тремя атомами водорода и одной одновалентной групой CH3, валентность углерода в C2H6 равна четырем. Следует заметить, что при формировании представлений о валентности отдельных элементов указанные осложняющие обстоятельства не принимались во внимание, а учитывался только состав простейших соединений. Но и при этом оказалось, что у многих элементов валентность в различных соединениях не одинакова. Особенно это было заметно для соединений некоторых элементов с водородом и кислородом, в которых проявлялась различная валентность. Так, в соединении с водородом валентность серы оказалась равной двум, а с кислородом – шести. Поэтому стали различать валентность по водороду и валентность по кислороду.В дальнейшем в связи с представлением о том, что в соединениях одни атомы поляризованы положиельно, а другие отрицательно, понятие о валентности в кислородных и водородных соединениях было заменено понятием о положительной и отрицательной валентности.
Различные значения валентности у одних и тех же элементов проявлялись также в их различных соединениях с кислородом. Другими словами, одни и те же элементы оказались способны проявлять различную положительную валентность. Так появилось представление о переменной положительной валентности некоторых элементов. Что касается отрицательной валентности неметаллических элементов, то она, как правило, оказалась у одних и тех же элементов постоянной.
Элементов, проявляющих переменную положительную валентность, оказалось большинство. Однако для каждого из таких элементов характерной оказалась его максимальная валентность. Такая максимальная валентность получила название характеристичной.
В дальнейшем, в связи с возникновением и развитием электронной теории строения атома и химической связи, валентность стали связывать с числом электронов, переходящих от одного атома к другому, или с числом химических связей, возникающих между атомами в процессе образования химического соединения.
Электровалентность и ковалентность. Положительная или отрицательная валентность элемента – проще всего определить, если два элемента образовывали ионное соединение: считалось, что элемент, атом которого стал положительно заряженным ионом, проявил положительную валентность, а элемент, атом которого стал отрицательно заряженным ионом, – отрицательную. Численное значение валентности считалось равным величине заряда ионов. Поскольку ионы в соединениях образуются посредством отдачи и присоединения атомами электронов, величина заряда ионов обусловливается числом отданных (положительный) и присоединенных (отрицательный) атомами электронов. В соответствии с этим положительная валентность элемента измерялась числом отданных его атомом электронов, а отрицательная валентность – числом электронов, присоединенных данным атомом. Таким образом, поскольку валентность измерялась величиной электрического заряда атомов, она и получила название электровалентности. Ее называют также ионной валентностью.
Среди химических соединений встречаются такие, в молекулах которых атомы не поляризованы. Очевидно, для них понятие о положительной и отрицательной электровалентности неприменимо. Если же молекула составлена из атомов одного элемента (элементарные вещества), теряет смысл и обычное понятие о стехиометрической валентности. Однако, чтобы оценивать способность атомов присоединять то или иное число других атомов, стали использовать число химических связей, которые возникают между данным атомом и другими атомами при образовании химического соединения. Поскольку эти химические связи, представляющие собой электронные пары, одновременно принадлежащие обоим соединенным атомам, называются ковалентными, способность атома образовать то или иное число химических связей с другими атомами получила название ковалентности. Для установления ковалентности используются структурные формулы, в которых химические связи изображаются черточками.
Степень окисления и окислительное число. При реакциях образования ионных соединений переход электронов от одних реагирующих атомов или ионов к другим сопровождается соответствующим изменением величины или знака их электровалентности. При образовании соединений ковалентной природы такого изменения электровалентного состояния атомов фактически не происходит, а только имеет место перераспределение электронных связей, причем валентность исходных реагирующих веществ не изменяется. В настоящее время для характеристики состояния элемента в соединениях введено условное понятие степени окисления. Численное выражение степени окисления называют окислительным числом.
Окислительные числа атомов могут иметь положительное, нулевое и отрицательное значения. Положительное окислительное число определяется числом электронов, оттянутых от данного атома, а отрицательное окислительное число – числом притянутых данным атомом электронов. Окислительное число может быть приписано каждому атому в любом веществе, для чего нужно руководствоваться следующими простыми правилами:
1. Окислительные числа атомов в любых элементарных веществах равны нулю.
2. Окислительные числа элементарных ионов в веществах ионной природы равны значениям электрических зарядов этих ионов.
3. Окислительные числа атомов в соединениях ковалентной природы определяются при условном расчете, что каждый отянутый от атома электрон придает ему заряд, равный +1, а каждый притянутый электрон – заряд, равный –1.
4. Алгебраическая сумма окислительных чисел всех атомов любого соединения равна нулю.
5. Атом фтора во всех его соединениях с другими элементами имеет окислительное число –1.
Определение степени окисления связано с понятием об электроотрицательности элементов. С использованием этого понятия формулируется еще одно правило.
6. В соединениях окислительное число отрицательно у атомов элементов с большей электроотрицательностью и положительно – у атомов элементов с меньшей электроотрицательностью.
Понятие степени окисления, таким образом, пришло на смену понятию электровалентности. В связи с этим представляется нецелесообразным пользоваться и понятием ковалентности. Для характеристики элементов лучше применять понятие валентности, определяя ее числом электронов, используемых данным атомом для образования электронных пар, независимо от того, притягиваются они к данному атому, или, наоборот, оттягиваются от него. Тогда валентность будет выражаться числом без знака. В отличие от валентности степень окисления определяется числом электронов, оттянутых от данного атома, – положительная, или притянутых к нему, – отрицательная. Во многих случаях арифметические значения валентности и степени окисления совпадают – это вполне естественно. В некоторых же случаях числовые значения валентности и степени окисления отличаются друг от друга. Так, например, в молекулах свободных галогенов валентность обоих атомов равна единице, а степень окисления – нулю. В молекулах кислорода и перекиси водорода валентность обоих атомов кислорода равна двум, а степень окисления их в молекуле кислорода равна нулю, а в молекуле перекиси водорода – минус единице. В молекулах азота и гидразина – N4H2 – валентность обоих атомов азота равна трем, а степень окисления в молекуле элементарного азота – нулю, а в молекуле гидразина – минус двум.Очевидно, что валентность характеризует атомы, только входящие в состав какого-либо соединения, хотя бы гомоядерного, т. е. состоящего из атомов одного элемента; о валентности же отдельных атомов говорить бессмысленно. Степень же окисления характеризует состояние атомов как входящих в какое-либо соединение, так и существующих отдельно.
Координационное число. Первоначальное понятие валентности оказалось явно недостаточным для установления природы более сложных соединений, чем рассмотренные выше. А. Вернер в 1891 г. для случаев, когда к молекулам соединений, в которых валентность элементов была полностью насыщена, присоединялись другие молекулы, предложил понятие побочной валентности. Вслед за этим (в 1893 г.) он ввел в химию понятие координационного числа, которое соответствует числу атомов или групп, непосредственно связанных с атомом, считающимся в молекуле центральным. Эти связанные с центральным атомом частицы, роль которых могут играть атомы, группы атомов, элементарные и сложные ионы, в настоящее время названы лигандами. Таким образом, координационное число показывает, сколько лигандов скоординировано около центрального атома.
С течением времени понятие побочной валентности постепенно утрачивало свое значение, понятие же координационного числа оказалось чрезвычайно плодотворным. Первоначально же Вернер подчеркивал, что понятие координационного числа есть чисто экспериментальное.
Значения координационного числа обычно соответствуют числу вершин в правильных многогранниках (тетраэдр – 4, октаэдр – 6, куб – 8, додекаэдр – 12) или в простейших правильных плоских фигурах (отрезок прямой линии – 2, равносторонний треугольник – 3, квадрат – 4).
<<<
Сколько валентных электронов в кислороде (O)? [Валентность кислорода]
Кислород , химическое вещество элемент с символом P и атомным номером 15, представляет собой высокореактивный неметалл и очень хороший окислитель, который легко образует оксиды, которые в большинстве своем элементы, а также соединения. При стандартной температуре и давлении два кислородных атомы связываются, образуя бесцветный двухатомный газообразный кислород без запаха, который составляет 21% поверхности Земли.
Газ O2 обеспечивает энергия горения при свете и огне.Он играет очень большую биологическую роль в все живые организмы в форме аэробного клеточного дыхания, а также играет важную роль в фотосинтезе. Простая формула фотосинтеза: приведено ниже:
6 CO2 (двуокись углерода) + 6 h3O (вода) + фотоны (солнечный свет) → C6h22O6 (глюкоза) + O2 (диоксид кислорода)
Вы здесь, чтобы знаете валентные электроны атома кислорода, не так ли? Не волнуйся вместе с кислородом валентных электронов мы также объясним его валентность. Но перед этим давайте некоторые основные идеи об этих двух терминах:
Разница между Валентные электроны и валентность
Валентные электроны общее количество электронов, присутствующих во внешней оболочке атома (я.е. на самой внешней орбите). Валентные электроны нейтрального атома равны всегда определен, он не может быть изменен (более или менее) ни при каких условиях конкретный атом и может быть или не быть равным его валентности.
Валентность определяется как общее количество электронов, которые атом может потерять, получить или разделить в то время образования связи, чтобы получить стабильную электронную конфигурацию, т.е. октет. Валентность атома может изменяться в разных соединениях или химические реакции из-за различных условий склеивания.Большую часть времени Валентность меняется / изменяется из-за изменения состояний окисления и восстановления.
Кислород (O) Валентность Электроны
Всего четыре простые шаги, чтобы узнать валентные электроны для атома кислорода:
Шаг 1. Найдите Атомный номер
Чтобы узнать атомный номер кислорода, мы можем использовать периодическую таблицу. С помощью Периодической таблицы, мы можем легко увидеть, что атомный номер кислорода равен 8. Поскольку его атомный номер 8, в нем 8 протонов, а для нейтрального кислорода количество протонов всегда равно количеству электронов i.е. имеет 8 электронов в своем ядро.
Шаг 2: Запись Электронная конфигурация
Электрон Конфигурация — это расположение электронов на орбиталях. Атом кислорода имеет в общей сложности 8 электронов, поэтому мы должны поместить 8 электронов на орбитали. В электроны будут размещены на разных орбиталях в зависимости от уровня энергии: [1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f]. Сейчас,
Кислородный электрон конфигурация O (8) = 1s 2 2s 2 2p 4 (в комплекте конфигурация).
= [He] 2s²2p⁴ (сжатая конфигурация).
Шаг 3: Определить Валентная оболочка
Как известно, валентную оболочку атома можно найти из наибольшего числа принципа квантовые числа, которые выражаются в члене n, а в [He] 2s²2p⁴ максимальное значение n равно 2, так что валентная оболочка кислорода равна 2s²2p⁴.
Шаг 4: Найти Валентные электроны
Общее количество электроны, присутствующие в валентной оболочке атома, называются валентными электронами, и в валентной оболочке кислорода (2s²2p⁴) присутствует всего шесть электронов.Таким образом, кислород имеет шесть валентных электронов.
Также читают:
Валентность кислорода (O)
Есть много различные способы узнать валентность атома, отражающую способность атом для связи с другими атомами. Валентность описывает, насколько легко атом или свободный радикал может сочетаться с другими химическими соединениями. Валентность атома определяется на основе количества электронов, потерянных, приобретенных или разделенных с другой атом во время образования связи.
Считается, что атом быть стабильным, когда его внешние оболочки имеют восемь электронов (кроме H и He).Если общее количество электронов во внешних оболочках составляет от одного до четырех, атом имеет положительную валентность, и если электронов от четырех до восьми, Валентность рассчитывается путем вычитания из восьми, и валентность будет равна нулю. Атомы имея четыре крайних электрона, обладают как положительной, так и отрицательной валентностью, и атомов, имеющих восемь крайних электронов, валентность будет равна нулю (т. е. благородная газы).
Элементы, такие как кислород может достичь стабильного состояния (ближайшая конфигурация инертного газа: Ne), получив 2 электроны.Так что валентность кислорода равна 2.
Математически электронная конфигурация кислорода 2, 6. А как известно, если электроны в крайняя оболочка превышает 4, следует вычесть из 8.
Электрон Конфигурация кислорода (O) = 2, 6
Мы видим внешний большая часть кислородной оболочки имеет 6 электронов, поэтому нужно вычесть их из 8.
8–6 = 2
Вот почему валентность кислорода 2.
Примечание: Обычно кислород имеет стабильную степень окисления -2 в большинстве соединений, но может варьироваться в некоторые составы из-за разной прочности связи.Не путайте с -2, это это просто степень окисления, которая может варьироваться от соединения к соединению. Но его валентность 2 только в любом случае.
В другом смысле Атом кислорода может образовывать максимум 2 ковалентные связи в химической связи (например: CO2, h3O и т. Д.), И то, что такое валентность, максимальная способность образовывать связи с атомами во время химических реакций.
Мы также можем найти валентность кислорода с помощью таблицы Менделеева. Поскольку кислород принадлежит группа 16 (6A или VIA) вместе с серой (S), мышьяком (As) и селеном (Se), теллуром (Te), полоний (Po) и ливерморий (Lv).Эти элементы группы также называют халькогенами . Все эти элементы имеют валентность 2.
.Сколько валентных электронов у кислорода?
Что такое валентные электроны? — Урок для детей
Валентные электроны похожи на указания в наборе Lego.В этом уроке мы узнаем, что такое валентные электроны и почему ученым нужно знать количество валентных электронов в атоме.
Работа и мощность во вращательном движении
Посмотрев этот урок, вы сможете объяснить, что такое работа и мощность в контексте вращательного движения, и использовать уравнения для решения задач, связанных с вращательной работой и мощностью.После этого будет проведена короткая викторина.
Электронные конфигурации на s, p и d орбиталях
Вас смущают длинные списки, которые начинаются с единиц и, кажется, продолжаются бесконечно? Не волнуйтесь, этот урок электронной конфигурации поможет вам быстро понять, как описать размещение электронов.
УрокElements для детей: определение и факты
Золото. Кислород. Вести.Дармштадтиум. Вы, возможно, никогда не слышали о дармштадтиуме, хотите верьте, хотите нет, но у него есть что-то общее с золотом, кислородом и свинцом. Все четыре слова — это названия элементов. Готовимся узнать все об элементах!
Изотопы и средняя атомная масса
Когда вы выпиваете стакан воды, вы на самом деле пьете смесь тяжелой и легкой воды.Какая разница? Это вредно? Это видео объяснит разницу между двумя типами воды и подробно расскажет о значении различных изотопов элементов.
Точка эквивалентности: определение и расчет
Этот урок объясняет термин «точка эквивалентности» в химии.Мы рассмотрим несколько примеров распространенных стратегий решения проблем, связанных с вычислением точки эквивалентности, и укажем на распространенные ошибки.
Правило октетов и структуры атомов Льюиса
Изучите правило октетов и его применение к уровням энергии электронов.Определите валентные электроны и узнайте, как их определять, глядя на таблицу Менделеева. Также узнайте, какое отношение они имеют к правилу октетов. Узнайте, как нарисовать диаграмму Льюиса атома, и поймите, как она дает ключи к разгадке химической связи.
Валентные электроны и уровни энергии атомов элементов
Таблица Менделеева содержит огромное количество информации.Этот урок объяснит, как использовать его для быстрого определения наиболее полезной информации о наиболее важных электронах. Мы сосредоточим наше обсуждение на валентных электронах и уровнях энергии.
Электронные конфигурации на уровнях атомной энергии
Этот урок объяснит, что делают электроны внутри атома.Настройтесь, чтобы узнать, как мы указываем, где они расположены, и как это описание местоположения поможет нам предсказать свойства элемента.
Химические связи I: ковалентные
Мама всегда говорила, что делиться заботой.В этом уроке будет изучено, как электроны влияют на химическую реакционную способность атомов и, в частности, на преимущества совместного использования электронов.
Химические связи III: полярный ковалент
Вы не знаете, как определить, какую связь образуют два атома? Этот урок поможет вам понять разницу между полярными и неполярными ковалентными связями, а также как предсказать, как два атома будут взаимодействовать.
Теплопередача и фазовые изменения
Посмотрев этот урок, вы сможете объяснить, что такое теплопередача, и описать различные фазовые изменения, которые могут возникнуть в результате теплопередачи, с точки зрения положения молекул.Вы также сможете дать названия этим фазовым изменениям. После этого будет проведена короткая викторина.
Ионные связи: определения и примеры
Знаете ли вы, что когда атомы слипаются, образуя молекулы, они приобретают и теряют электроны, делая их заряженными отрицательно или положительно? В этом уроке вы узнаете, как катионы и анионы образуют один тип химической связи, называемый ионной связью.
Электроотрицательность: определение и тенденции
Притяжение электронов разное в зависимости от элемента.Эта степень притяжения измеряется электроотрицательностью элемента. В этом уроке мы обсудим электроотрицательность, ее тенденции в периодической таблице и связи.
учащихся с ограниченными интеллектуальными возможностями
Учащиеся с ограниченными интеллектуальными возможностями обладают уникальными характеристиками и особыми потребностями.В этом уроке определяется и объясняется концепция умственной отсталости и рассматривается, как эти ученики могут по-разному взаимодействовать и учиться в классе.
Обзор химических связей
Узнайте о наиболее распространенных видах химических связей: ионных, ковалентных, полярных ковалентных и металлических.Узнайте, как они формируются и почему держатся вместе. Пройдите тест и посмотрите, сколько знаний вы сохранили.
Что такое движение? — Определение и уравнения
Посмотрев это видео, вы сможете объяснить, что такое движение, и использовать основные уравнения движения для решения задач.Для проверки ваших знаний последует короткая викторина.
Именование и запись формул для бинарных молекулярных соединений
В этом уроке вы узнаете, что значит быть бинарным молекулярным соединением и как правильно называть эти типы химических веществ.Вы попрактикуетесь в составлении имен, научитесь писать формулы и закончите тестированием себя с помощью короткой викторины.
Lewis Structures
Льюис Конструкции
Написание структур Льюиса методом проб и ошибок
Структура Льюиса соединения может быть получена пробным путем. и ошибка. Начнем с написания символов, содержащих правильные количество валентных электронов для атомов в молекуле.Мы затем объедините электроны, чтобы сформировать ковалентные связи, пока мы не придем со структурой Льюиса, в которой все элементы (с за исключением атомов водорода) имеют октет валентности электроны.
Пример: применим подход проб и ошибок к генерируя структуру Льюиса диоксида углерода, CO 2 . Начнем с определения количества валентных электронов на каждом атом из электронных конфигураций элементов. Углерод имеет четыре валентных электрона, а у кислорода шесть.
C: [He] 2 с 2 2 с 2
O: [He] 2 с 2 2 с 4
Мы можем обозначить эту информацию символами, как показано в верхней части рисунок ниже. Теперь мы объединяем по одному электрону от каждого атома, чтобы сформировать ковалентные связи между атомами. Когда это будет сделано, каждый кислород атом имеет в общей сложности семь валентных электронов, а атом углерода имеет в общей сложности шесть валентных электронов.Потому что ни один из этих атомов есть октет валентных электронов, мы объединяем другой электрон на каждом атоме с образованием еще двух связей. Результат — Льюис структура, в которой каждый атом имеет октет валентных электронов.
Пошаговый подход Для написания структур Льюиса
Метод проб и ошибок для записи структур Льюиса может быть кропотливый. Для всех молекул, кроме простейших, следующие пошаговый процесс быстрее.
Шаг 1: Определите общее количество валентностей электроны.
Шаг 2: Запишите структуру скелета молекулы.
Шаг 3: Используйте два валентных электрона для образования каждой связи в каркасная структура.
Шаг 4: Попытайтесь удовлетворить октеты атомов с помощью распределяя оставшиеся валентные электроны как несвязывающие электроны.
Первый шаг в этом процессе заключается в вычислении количества валентных электронов в молекуле или ионе.Для нейтрального молекула это не что иное, как сумма валентностей электроны на каждом атоме. Если молекула несет в себе электрический заряда, мы добавляем по одному электрону на каждый отрицательный заряд или вычитаем электрон на каждый положительный заряд.
Пример: Определим количество валентных электронов в хлорат (ClO 3 —) ион.
Атом хлора (группа VIIA) имеет семь валентных электронов и каждый атом кислорода (группа VIA) имеет шесть валентных электронов.Так как ион хлората имеет заряд -1, этот ион содержит еще один электрон, чем нейтральная молекула ClO 3 . Таким образом, ClO 3 — Ион имеет в общей сложности 26 валентных электронов.
ClO 3 — : 7 + 3 (6) + 1 = 26
Второй шаг в этом процессе включает определение того, какие атомы в молекуле связаны ковалентными связями.Формула соединение часто дает намек на структуру скелета. Формула для хлорат-иона, например, предлагает следующая структура скелета.
На третьем этапе предполагается, что каркасная структура молекула удерживается ковалентными связями. Валентность поэтому электроны делятся на две категории: связывание электронов и несвязывающих электронов . Потому что это требует два электрона, чтобы образовать ковалентную связь, мы можем вычислить количество несвязывающих электронов в молекуле, вычитая два электронов от общего количества валентных электронов для каждого связь в структуре скелета.
В наиболее разумном каркасе есть три ковалентные связи структура для хлорат-иона. В результате шесть из 26 валентные электроны должны использоваться в качестве связывающих электронов. Это оставляет 20 несвязывающих электронов в валентной оболочке.
| 26 валентных электронов |
| -6 связывающих электронов |
| 20 несвязывающих электронов |
Несвязывающие валентные электроны теперь используются для удовлетворения октеты атомов в молекуле.Каждый атом кислорода в ClO 3 — ион уже имеет два электрона электроны в ковалентной связи Cl-O. Потому что каждый атом кислорода требуется шесть несвязывающих электронов для удовлетворения своего октета, требуется 18 несвязывающие электроны, чтобы удовлетворить три атома кислорода. Этот оставляет одну пару несвязывающих электронов, которые можно использовать для заполнить октет центрального атома.
Чертеж каркаса Конструкции
Самая сложная часть четырехэтапного процесса в в предыдущем разделе написана структура скелета молекула.Как правило, менее электроотрицательный элемент в центре молекулы.
Пример: формулы тионилхлорида (SOCl 2 ) и сульфурилхлорид (SO 2 Cl 2 ) может быть переведены в следующие каркасные структуры.
Также полезно знать, что формулы для сложных молекулы часто написаны таким образом, который намекает на скелет структура молекулы.
Пример: диметиловый эфир часто обозначают как CH 3 OCH 3 , что переводится в следующую структуру скелета.
Наконец, полезно признать, что многие соединения, которые кислоты содержат связи O-H.
Пример: Формула уксусной кислоты часто записывается как CH 3 CO 2 H, потому что эта молекула содержит следующую структуру скелета.
Молекулы, которые тоже содержат Много или мало электронов
Слишком мало электронов
Иногда мы встречаем молекулу, которая, кажется, не имеет достаточно валентных электронов.Если мы не сможем получить удовлетворительного Льюиса структура, разделяя единственную пару электронов, это может быть можно достичь этой цели, поделив две или даже три пары электронов.
Пример: рассмотрим формальдегид (H 2 CO), который содержит 12 валентных электронов.
H 2 CO: 2 (1) + 4 + 6 = 12
Формула этой молекулы предполагает следующий скелет состав.
В этой каркасной структуре есть три ковалентные связи, Это означает, что шесть валентных электронов должны использоваться как связывающие электроны. Остается шесть несвязывающих электронов. это невозможно, однако, удовлетворить октеты атомов в этом молекула только с шестью несвязывающими электронами. Когда несвязанность электроны используются, чтобы удовлетворить октет атома кислорода, Атом углерода имеет всего шесть валентных электронов.
Таким образом, мы предполагаем, что атомы углерода и кислорода имеют два общих пары электронов. В скелете теперь четыре связи. структура, которая оставляет только четыре несвязывающих электрона. Это однако достаточно, чтобы удовлетворить октеты углерода и кислорода атомы.
Время от времени мы встречаем молекулу, для которой это невозможно написать удовлетворительную структуру Льюиса.
Пример: рассмотрим трифторид бора (BF 3 ), который содержит 24 валентных электрона.
BF 3 : 3 + 3 (7) = 24
В наиболее разумном каркасе есть три ковалентные связи структура молекулы. Потому что для образуют каркасную структуру, имеется 18 несвязывающих валентностей. электроны. Каждому атому фтора требуется шесть несвязывающих электронов, чтобы удовлетворить его октет. Таким образом, все несвязывающие электроны являются потребляется тремя атомами фтора.В результате у нас заканчивается электронов, в то время как атом бора имеет только шесть валентных электронов.
Элементами, образующими сильные двойные или тройные связи, являются C, N, O, P и S. Поскольку ни бор, ни фтор не попадают в эту категории, мы должны остановиться на том, что кажется неудовлетворительная структура Льюиса.
Слишком много электронов
Также можно встретить молекулу, которая, кажется, имеет слишком много валентных электронов.Когда это происходит, мы расширяем валентная оболочка центрального атома.
Пример: рассмотрим структуру Льюиса для тетрафторида серы. (SF 4 ), который содержит 34 валентных электрона.
SF 4 : 6 + 4 (7) = 34
В структуре скелета SF 4 есть четыре ковалентные связи. Поскольку это требует использования восьми валентных электронов для формирования ковалентных связей, которые удерживают молекулу вместе, насчитывается 26 несвязывающие валентные электроны.
Каждому атому фтора требуется шесть несвязывающих электронов для удовлетворения его октет. Поскольку таких атомов четыре, нам нужно 24 несвязывающие электроны для этой цели. Но есть 26 несвязывающие электроны в этой молекуле. Мы уже довольны октеты для всех пяти атомов, и у нас остается еще одна пара валентные электроны. Поэтому мы расширяем валентную оболочку атом серы удерживает более восьми электронов.
Возникает интересный вопрос: как имеет ли атом серы в SF 4 10 электронов в своем валентной оболочки? Электронная конфигурация нейтральной серы атом, кажется, предполагает, что требуется восемь электронов, чтобы заполнить 3 s и 3 p орбиталей в валентной оболочке этого атома.Но давайте еще раз посмотрим на правила выбора атомных орбитали. Согласно этим правилам, n = 3 снаряда orbitals содержит 3 s , 3 p и 3 d орбиталей. Поскольку 3 d орбиталей на нейтральном атоме серы все пустой, одна из этих орбиталей может использоваться для удержания дополнительной пары электронов на атоме серы в SF 4 .
S: [Ne] 3 s 2 3 p 4 3 д 0
Резонансные гибриды
Для диоксида серы можно записать две структуры Льюиса.
Единственное различие между этими структурами Льюиса — это идентичность атома кислорода, с которым образуется двойная связь. В результате они должны быть одинаково удовлетворительными представлениями молекула.
Интересно, что ни одна из этих структур неверна. Две структуры Льюиса предполагают, что одна из серо-кислородных облигации сильнее, чем другие.Нет разницы между длина двух связей в SO 2 , однако, что предполагает, что две связи сера-кислород одинаково сильны.
Когда мы можем написать более одного удовлетворительная структура Льюиса, молекула имеет средний резонанс или гибрид , из этих структур. Значение термина резонанс лучше всего можно понять по аналогии. В музыке ноты в часто говорят, что аккорд резонирует они смешиваются, чтобы получить нечто большее, чем сумма его части.В аналогичном смысле две структуры Льюиса для SO 2 молекула находится в резонансе. Их смешивают, чтобы получить более чем сумма его компонентов. Тот факт, что SO 2 является резонансный гибрид двух структур Льюиса обозначается записью двусторонняя стрелка между этими структурами Льюиса, как показано на рисунок выше.
Официальное обвинение
Иногда бывает полезно вычислить формальное значение . заряд на каждый атом в структуре Льюиса.Первый шаг в этот расчет включает деление электронов на каждый ковалентный связь между атомами, образующими связь. Число валентности электроны, формально назначенные каждому атому, затем сравниваются с количество валентных электронов на нейтральном атоме элемента. Если у атома больше валентных электронов, чем у нейтрального атома, он предполагается, что несет формальный отрицательный заряд. Если у него меньше валентным электронам приписывается формальный положительный заряд.
| Практическая задача 5: формула аминокислоты, известной как глицин, часто записывается как H 3 N + CH 2 CO 2 —.Используйте концепцию формального заряда, чтобы объяснить значение положительных и отрицательных знаков в следующем Льюисе состав. Нажмите здесь, чтобы проверить свой ответ на практическую задачу 5 |
CHM1045 Обзорные материалы
CHM1045 Обзорные материалыОбзор материала CHM1045
Продолжая CHM1045, вы должны иметь твердое представление о нескольких темах, чтобы понимать концепции, представленные в CHM1046.
1) Строение атома
2) Валентные электроны
3) Льюис Структуры
4) Ионы и соли
5) Полярность
Начнем с первой из этих тем: Строение атома.
Атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны расположены в ядре атома, а электроны — в оболочках, окружающих ядро.
Атомный номер элемента равен количеству протонов, находящихся в его ядре. Если вы измените количество протонов, вы измените элемент, о котором говорите. Атомная масса элемента равна массе его протонов плюс нейтронов. По массе в периодической таблице и атомному номеру вы сможете определить количество нейтронов в атоме.
Пример:
Кислород имеет атомный номер 8 и массу ~ 16 а.е.м.Это указывает на то, что в ядре атома кислорода 16-8 = 8 нейтронов.
Число электронов в атоме всегда равно числу протонов, пока атом нейтрален. Когда количество протонов (+ зарядов) не равно количеству электронов (-зарядов), атом называется ионом. Отрицательно заряженные атомы называются анионами, а положительно заряженные атомы — катионами.
Ионы образуются для повышения стабильности атома. Элементы VIII группы, благородные газы, являются наиболее стабильными элементами и имеют восемь валентных электронов (электроны внешней оболочки).Все другие элементы в группах I -VII образуют ионы и связи, стремясь получить восемь электронов на своей внешней оболочке.
Пример: Азот является элементом Группы V. Чтобы стать похожим на благородный газ Неон, он должен получить 3 электрона. Таким образом, когда азот образует ионы, они имеют 3 заряда, а когда он образует связи, он обычно связывается с тремя другими элементами.
Показанная выше структура аммиака является структурой Льюиса. Структуры Льюиса представляют собой молекулы, в которых линии обозначают связи, а точки — неподеленные пары электронов.Есть несколько основных правил рисования структур Льюиса, с которыми вам следует ознакомиться:
Структуры Льюиса построены так, чтобы удовлетворять правилу октетов для каждого из атомов в молекуле. Связи представлены знаком «-», а неподеленные пары электронов представлены знаком «:».
Есть простые шаги для создания правильной структуры Льюиса:
1) Рассчитайте общее количество доступных валентных электронов.
2) Определите, какой атом будет центральным в молекуле.
3) Расположите атомы симметрично вокруг центрального атома.
4) Поместите связи / электроны вокруг атомов, пока не будет выполнено правило октетов для каждого атома. При необходимости используйте двойные или тройные связки.
5) Покажите любые заряды на молекуле, используя квадратные скобки [], и поместите заряд в верхнем правом углу сразу за скобками.
Шаг 1: Рассчитайте общее количество доступных валентных электронов.
В качестве примера возьмем PO 4 3- .
Нам нужно знать, сколько электронов доступно для образования связей для фосфат-иона.
Фосфор находится в группе VA, поэтому он имеет 5 валентных электронов, а кислород находится в группе VIA, поэтому каждый кислород имеет 6 валентных электронов. Общее количество валентных электронов = 5 + 4 (6) = 29. НО подождите минуту, это нечетное количество электронов, и мы на самом деле не обсуждали этот вопрос, поэтому чего-то, должно быть, не хватает … О, заряд. Для каждого отрицательного заряда иона нам нужно добавить 1 валентный электрон, так что всего получается 29 + 3 = 32 валентных электрона.
Это означает, что у нас есть 32 электрона, которые нужно распределить в связи для образования фосфатного иона.
Шаг 2: Определите, какой атом будет центральным в молекуле.
Центральный атом в молекуле обычно наименее электроотрицательный атом. Также часто атом позволяет создать наиболее симметричную молекулу. Для фосфата, PO 4 3- , фосфат является наименее электроотрицательным атомом, и он позволит нам создать наиболее симметричную молекулу, поэтому он будет наиболее вероятным центральным атомом.Кстати, для других молекул, содержащих водород, мы знаем, что водород может образовывать только 1 связь, поэтому атомы водорода НИКОГДА не могут быть центральными атомами.
Шаг 3. Расположите атомы симметрично вокруг центрального атома.
Большинство творений природы симметричны, и то же самое верно для большинства химических соединений. При написании структур Льюиса лучше всего использовать наиболее симметричное расположение атомов вокруг центрального атома.
Для фосфата: четыре атома кислорода расположены симметрично относительно фосфора.
Шаг 4: Поместите связи / электроны вокруг атомов, пока не будет выполнено правило октетов для каждого атома. При необходимости используйте двойные или тройные связки . Вы должны использовать все валентные электроны. (Обратите внимание, что показанный заряд является формальным зарядом этих ионов)
Шаг 5: Покажите все заряды на молекуле, используя квадратные скобки [], и поместите заряд в верхнем правом углу сразу за скобками
Фосфат-ион, показанный выше, может объединяться с положительными ионами с образованием солей.Соль — это ионное соединение (металл + неметалл), которое образуется, когда два противоположно заряженных иона объединяются, образуя нейтральное соединение.
Пример: фосфат натрия = Na 3 PO 4 Это соль, состоящая из ионов Na + и PO 4 3-. На этом этапе вы должны уметь построить правильную соль из любой комбинации положительных и отрицательных ионов и назвать полученное соединение. Если вы все еще не можете делать это очень хорошо, вам следует практиковаться !!
Ионные соединения считаются наиболее полярной формой молекулы, потому что все они в той или иной степени диссоциируют в воде.Другие молекулы, ковалентные молекулы, не распадаются на части в воде и поэтому считаются неполярными.
Третья группа молекул ковалентна и полярна и поэтому в некоторой степени смешивается с водой. Большая часть материала в первых нескольких главах CHM1046 будет зависеть от ваших знаний об этих типах соединений, поэтому вам нужно будет различать, является ли молекула полярной или нет.
Что вызывает полярность?
Полярные молекулы содержат электроотрицательный атом, который притягивает электроны в молекуле к себе и от других атомов в молекуле.Вы можете думать об этом как о конкурсе популярности, и самый электроотрицательный атом является самым популярным. Все электроны хотят проводить с ним больше времени. Когда это происходит, электроны (- заряды) концентрируются в одной точке молекулы, а протоны (+ заряды) других атомов остаются в некоторой степени незащищенными. Это неравномерное распределение создает то, что называется диполем, а молекулы, содержащие диполи, считаются полярными.
В этом случае атомы Cl более электроотрицательны, чем углерод, образуя частичные заряды на атомах и диполе.
Итак, какие элементы электроотрицательны? Самый электроотрицательный элемент — фтор, и тенденция электроотрицательности увеличивается слева направо и снизу вверх в периодической таблице.
Другие основные тенденции, о которых вам следует знать, — это тенденции в энергии ионизации и атомном радиусе.
Энергия ионизации или потенциал ионизации — это энергия, необходимая для удаления электрона из нейтрального атома. Обычно он увеличивается снизу вверх (легче отобрать электрон у атома с большим количеством электронов, чем у атома с несколькими электронами) и слева направо в периодической таблице.Двигаясь слева направо по периоду периодической таблицы, вы увеличиваете количество протонов в ядре, но остаетесь в пределах той же орбитальной оболочки. Это означает, что тяга к ядру увеличивается по мере продвижения слева направо, но экранирование (электроны во внутренних оболочках) остается постоянным. Если электроны удерживаются сильнее, энергия, позволяющая освободить их, будет увеличиваться. Вот почему элементы в правом углу таблицы (кроме благородных газов) принимают электроны гораздо лучше, чем отдают их.
Атомный радиус увеличивается сверху вниз и справа налево в периодической таблице. Сверху вниз имеет смысл, потому что вы добавляете большое количество электронов, но увеличение размера справа налево часто сбивает с толку. Двигаясь слева направо по периоду периодической таблицы, вы увеличиваете количество протонов в ядре, но остаетесь в пределах той же орбитальной оболочки. Это означает, что тяга к ядру увеличивается по мере продвижения слева направо, но экранирование (электроны во внутренних оболочках) остается постоянным.Это означает, что электроны во внешней оболочке сжимаются все сильнее и сильнее по мере прохождения периода, и, таким образом, атомный радиус сокращается.
Сколько валентных электронов нужно кислороду?
Может ли кислород иметь 7 валентных электронов?
Углерод имеет четыре валентных электрона, а кислород — шесть.
…
Теперь мы объединяем по одному электрону от каждого атома, чтобы образовать ковалентные связи между атомами.
Когда это будет сделано, у каждого атома кислорода будет всего семь валентных электронов, а у атома углерода всего шесть валентных электронов.
Есть ли у кислорода 2 валентных электрона?
Валентные электроны — это электроны на внешней оболочке или энергетическом уровне атома. Например, кислород имеет шесть валентных электронов, два в подоболочке 2s и четыре в подоболочке 2p.
Имеет ли бериллий два валентных электрона?
Бериллий имеет два валентных электрона.
Почему валентность фосфора 3 и 5?
Фосфор имеет валентность 3 и 5. Фосфор с валентностью 3: с тремя неспаренными электронами на трех p-орбиталях фосфор имеет валентность 3, как и в случае соединения PCl3. Таким образом, атом фосфора подвергается sp3d-гибридизации с образованием пяти эквивалентных sp3d-орбиталей, каждая из которых содержит один неспаренный электрон.
Сколько валентных электронов имеет группа 9?
девять валентных электронов Число валентных электронов увеличивается сверху вниз в каждой группе.Все элементы в группе 9 имеют девять валентных электронов. Элементы с наибольшим количеством валентных электронов находятся в группе 18.
Какой элемент имеет более 4 валентных электронов?
Группа 15,16,17,18. Входит в состав переходных металлов, лантаноидов и актинидов.
Почему у кислорода 2 валентных электрона?
1 Ответ. Стефан В. Кислоду нужно еще 2 электрона, чтобы заполнить его внешнюю оболочку. … Как видите, у кислорода 2 из 8 электронов находятся в ближайшей к ядру оболочке, а оставшиеся 6 электронов — которые называются валентными электронами — во второй оболочке — это самая внешняя оболочка кислорода.
Сколько валентных электронов в be 2?
Число валентных электронов Группа периодической таблицы Валентные электроны Группа 1 (I) (щелочные металлы) 1 Группа 2 (II) (щелочноземельные металлы) 2 Группы 3-12 (переходные металлы) 2 * (Оболочка 4s завершена и больше не может удерживать электроны ) Группа 13 (III) (группа бора) еще 35 строк • 5.06.2019
Почему валентные электроны обладают наибольшей энергией?
По мере удаления от ядра электроны с более высокими энергетическими уровнями обладают большей энергией.… Максимальное количество электронов на данном уровне энергии зависит от количества его орбиталей. На орбитали приходится не более двух электронов. Электроны на внешнем энергетическом уровне атома называются валентными электронами.
Сколько еще валентных электронов нужно кислороду, чтобы иметь полную внешнюю валентную оболочку?
twoOxygen имеет две оболочки, первая из которых уже заполнена, а вторая имеет только 6 электронов, поэтому кислороду нужно еще 2 электрона, чтобы иметь полную внешнюю оболочку из 8.
Какой электрон имеет наибольшую энергию?
Валентные электроны Валентные электроны — это электроны с наивысшей энергией в атоме и, следовательно, они являются наиболее реактивными.
Что такое 9-й класс валентности?
Валентность. Это способность атома приобретать или терять электрон для достижения конфигурации благородного газа. Это относится к способности элемента объединяться с другим элементом. Он получается путем определения количества электронов во внешней оболочке (также называемой валентной оболочкой) каждого атома элемента.
Как мне запомнить валентность?
Самый простой метод определения валентностей — это просто взглянуть на таблицу Менделеева. Поместите копию элементов таблицы Менделеева на поверхность, где все атомы, представленные в таблице, легко доступны.
Является ли валентность кислорода?
Валентность кислорода равна 2, потому что для образования воды ему нужны два атома водорода.
Что такое валентность?
валентность.[vā’ləns] Целое число, которое представляет способность атома или группы атомов объединяться с другими атомами или группами атомов. Валентность определяется количеством электронов, которые атом может потерять, добавить или разделить.
Где у электронов больше всего энергии?
Электроны на более высоких уровнях энергии, которые дальше от ядра, обладают большей энергией. У них также больше орбиталей и большее возможное количество электронов. Электроны на внешнем энергетическом уровне атома называются валентными электронами.
Как определить валентность кислорода?
Если его валентные электроны меньше 4, то валентность равна количеству валентных электронов, а если больше 4, то валентность получается вычитанием количества валентных электронов из 8. Атомный номер кислорода равен 8. Итак, электронный Конфигурация кислорода = 2, 6.
Сколько электронов заполняет внешнюю оболочку кислорода?
два электрона Кислороду нужны два электрона, чтобы заполнить его внешнюю электронную оболочку.
Имеет ли фтор полную валентную электронную оболочку?
У фтора 7 валентных электронов. Валентные электроны — это те электроны, которые присутствуют во внешней оболочке атома. … В каждом стабильном (нейтральном) атоме количество электронов равно количеству протонов. Следовательно, количество электронов в атоме фтора равно 9.
Какова валентность золота?
Золото — это металлический элемент и переходный элемент, имеющий формулу Au.Он имеет валентность 3 или 1.
Какой номер группы у кислорода?
16Факт-бокс Группа 16 Точка плавления Период 2 Точка кипения Блок p Плотность (г см − 3) Атомный номер8 Относительная атомная масса Состояние при 20 ° C Газ Ключевые изотопы 2 другие строки
Сколько электронов необходимо в кислороде?
8 электронов Итак… для элемента КИСЛОРОД, вы уже знаете, что атомный номер говорит вам количество электронов. Это означает, что в атоме кислорода 8 электронов.Глядя на картинку, вы можете увидеть, что в первой оболочке два электрона, а во второй — шесть.
Какова валентность первых 20 элементов?
Валентность первых 20 элементовЭлементСимвол ВалентностьHydrogenh2He0LithiumLi1BerylliumBe216 другие строки
Может ли кислород иметь 8 валентных электронов?
Кислород имеет 8 валентных электронов. Следовательно, он принадлежит к группе 6 периодической таблицы. Это означает, что у него всего 2 электрона в первой оболочке (или K-оболочке) и 6 электронов в первой оболочке (или K-оболочке).
Как рассчитать валентные электроны?
Для нейтральных атомов количество валентных электронов равно номеру основной группы атома. Номер основной группы элемента можно найти в его столбце в периодической таблице. Например, углерод находится в группе 4 и имеет 4 валентных электрона. Кислород находится в группе 6 и имеет 6 валентных электронов.
Какова валентность кислорода и калия?
Валентность первых 30 элементовЭлементАтомный номер Валентность Валентность хлора171 Валентность аргона 180 Валентность калия (K) 191 Валентность кальция 20 226 другие строки
Какая оболочка имеет больше энергии K или L? Оболочка
L имеет более высокую энергию, потому что согласно теории Бора оболочка, которая находится ближе к ядру, имеет более низкую энергию, а оболочка, которая находится вдали от ядра, имеет более высокую энергию.K ближе к ядру. Таким образом, он имеет меньшую энергию, чем L-оболочка.
1.6.3.2: Ковалентные связи — Chemistry LibreTexts
Цели обучения
- Чтобы описать, как образуется ковалентная связь.
- Применение правила октетов к ковалентным соединениям
Вы уже видели примеры веществ, содержащих ковалентные связи. Одно из упомянутых ранее веществ — вода (\ (\ ce {h3O} \)). Вы можете сказать по его формуле, что это не ионное соединение; он не состоит из металла и неметалла.Следовательно, его свойства отличаются от свойств ионных соединений.
Обмен электронами
Ранее мы обсуждали ионную связь, при которой электроны могут передаваться от одного атома к другому, так что оба атома имеют энергетически стабильную внешнюю электронную оболочку. Поскольку в большинстве заполненных электронных оболочек содержится восемь электронов, химики назвали эту тенденцию правилом октетов. Однако есть еще один способ, которым атом может создать полную валентную оболочку: атомов могут совместно использовать электрон.
Эту концепцию можно проиллюстрировать на примере двух атомов водорода, каждый из которых имеет один электрон на валентной оболочке. (Для небольших атомов, таких как атомы водорода, валентная оболочка будет первой оболочкой, содержащей только два электрона.) Мы можем представить два отдельных атома водорода следующим образом:
Напротив, когда два атома водорода сближаются достаточно близко друг к другу, чтобы поделиться своими электронами, их можно представить следующим образом:
Обменивая свои валентные электроны, оба атома водорода теперь имеют по два электрона в соответствующих валентных оболочках.Поскольку каждая валентная оболочка теперь заполнена, это расположение более стабильно, чем когда два атома разделены. Обмен электронами между атомами называется ковалентной связью, а два электрона, которые соединяют атомы ковалентной связью, называются связывающей парой электронов. Дискретная группа атомов, соединенных ковалентными связями, называется молекулой — наименьшей частью соединения, которая сохраняет химическую идентичность этого соединения.
Химики часто используют диаграммы Льюиса для представления ковалентных связей в молекулярных веществах.Например, диаграммы Льюиса двух отдельных атомов водорода выглядят следующим образом:
Диаграмма Льюиса двух атомов водорода, разделяющих электроны, выглядит так:
Это изображение молекул дополнительно упрощено за счет использования тире для обозначения ковалентной связи. Молекула водорода тогда представлена следующим образом:
Помните, что прочерк, также называемый одинарной связью, представляет собой пару электронов.
Связь в молекуле водорода, измеренная как расстояние между двумя ядрами, составляет примерно 7,4 × 10 −11 м, или 74 пикометра (пм; 1 пм = 1 × 10 −12 м). Эта конкретная длина связи представляет собой баланс между несколькими силами: притяжением между противоположно заряженными электронами и ядрами, отталкиванием между двумя отрицательно заряженными электронами и отталкиванием между двумя положительно заряженными ядрами. Если бы ядра были ближе друг к другу, они бы отталкивали друг друга сильнее; если бы ядра были дальше друг от друга, между положительными и отрицательными частицами было бы меньше притяжения.
Фтор — еще один элемент, атомы которого соединяются попарно с образованием двухатомных (двухатомных) молекул. Два отдельных атома фтора имеют следующие электронные точечные диаграммы:
Каждый атом фтора вносит один валентный электрон, образуя одинарную связь и давая каждому атому полную валентную оболочку, что соответствует правилу октетов :
Кружки показывают, что вокруг каждого атома фтора восемь электронов. Как и в случае с водородом, мы можем изобразить молекулу фтора с чертой вместо связывающих электронов:
Каждый атом фтора имеет шесть электронов или три пары электронов, которые не участвуют в ковалентной связи.Считается, что они не являются общими, а принадлежат одному атому. Их называют несвязывающими парами (или неподеленными парами) электронов.
Ковалентные связи между разными атомами
Теперь, когда мы рассмотрели распределение электронов между атомами одного и того же элемента, давайте посмотрим на образование ковалентных связей между атомами разных элементов. Рассмотрим молекулу, состоящую из одного атома водорода и одного атома фтора:
Каждому атому требуется один дополнительный электрон для завершения своей валентной оболочки.Каждый вкладывая один электрон, они образуют следующую молекулу:
В этой молекуле атом водорода не имеет несвязывающих электронов, а атом фтора имеет шесть несвязывающих электронов (три неподеленные электронные пары). Кружками показано, как заполнены валентные электронные оболочки обоих атомов.
Пример \ (\ PageIndex {1} \)
Используйте диаграммы Льюиса, чтобы обозначить формирование следующего:
- Класс 2
- HBr
Раствор
а.Когда два атома хлора образуют молекулу хлора, они разделяют одну пару электронов. В молекуле Cl 2 каждый атом хлора окружен октетами с числом электронов .
Диаграмма Льюиса для молекулы Cl 2 аналогична диаграмме для F 2 (показана выше).
г. Когда атом водорода и атом брома образуют HBr, они разделяют одну пару электронов.В молекуле HBr H достигает полной валентности двух электронов ( дуэт ), а Br достигает октета . Диаграмма Льюиса для HBr аналогична диаграмме для HF, показанной выше.
Упражнение \ (\ PageIndex {1} \)
Нарисуйте диаграмму Льюиса для каждого соединения.
- молекула, состоящая из одного атома хлора и одного атома фтора
- Молекула, состоящая из одного атома водорода и одного атома йода
- Ответ:
- Ответ b:
Ковалентные связи в более крупных молекулах
Образование молекулы воды из двух атомов водорода и атома кислорода можно проиллюстрировать с помощью точечных символов Льюиса (показаны ниже).Структура справа — это электронная структура Льюиса или структура Льюиса для H 2 O. С двумя связующими парами и двумя неподеленными парами атом кислорода теперь завершил свой октет . Более того, благодаря совместной паре связи с кислородом каждый атом водорода теперь имеет полную валентную оболочку из двух электронов. Химики обычно указывают пары склеивания одной линией, как показано (ниже).
Другие большие молекулы построены аналогичным образом, при этом некоторые атомы участвуют в более чем одной ковалентной связи.Например, метан (\ (\ ce {Ch5} \)), центральный атом углерода, связанный с четырьмя атомами водорода, может быть представлен с использованием любой из структур Льюиса, представленных ниже. Опять же, совместное использование электронов между атомами C и H приводит к получению C и октету, в то время как H достигает двойного числа электронов.
Сколько образуется ковалентных связей?
Число связей, которые может образовать атом, часто можно предсказать, исходя из числа электронов, необходимых для достижения октета (восьми валентных электронов).В структуре Льюиса количество связей, образованных элементом в нейтральном соединении, равно количеству неспаренных электронов, которые он должен разделить с другими атомами, чтобы завершить свой октет электронов. Например, каждый атом элемента группы 4A (14) имеет четыре электрона в своей внешней оболочке, и поэтому для достижения октета требуется еще четыре электрона. Эти четыре электрона могут быть получены путем образования четырех ковалентных связей , как показано здесь для углерода в CH 4 (метан). Группа 5A (15) элементы, такие как азот, имеют пять валентных электронов в атомном символе Льюиса: одна неподеленная пара и три неспаренных электрона. Для получения октета эти атомы образуют три ковалентные связи , как в NH 3 (аммиак). Кислород и другие атомы в группе 6A (16) получают октет, образуя две ковалентные связи . Фтор и другие галогены в группе 7A (17) имеют семь валентных электронов и могут получить октет, образуя одну ковалентную связь .
Обычно атомы группы 4A образуют 4 ковалентные связи; группа 5А образуют 3 связи; группа 6А образуют 2 связи; и группа 7A образуют одну связь. Количество электронов, необходимых для получения октета, определяет количество ковалентных связей, которые может образовать атом. Это кратко изложено в таблице ниже. В каждом случае сумма количества связей и количества неподеленных пар равна 4, что эквивалентно восьми (октетам) электронов.
| Атом (номер группы) | Количество облигаций | Количество одиночных пар |
| Углерод (Группа 14 или 4A) | 4 | 0 |
| Азот (группа 15 или 5A) | 3 | 1 |
| Кислород (группа 16 или 6A) | 2 | 2 |
| Фтор (группа 17 или 7A) | 1 | 3 |
Поскольку водороду нужны только два электрона, чтобы заполнить его валентную оболочку, он следует правилу дуэта.Это исключение из правила октетов. Водород должен образовать только одну связь. Это причина, по которой H всегда является конечным атомом и никогда не является центральным атомом. На рисунке \ (\ PageIndex {1} \) показано количество ковалентных связей, которые обычно образуют различные атомы.
Переходные элементы и внутренние переходные элементы также не подчиняются правилу октетов, поскольку в их валентных оболочках присутствуют d- и f-электроны.
Рисунок \ (\ PageIndex {1} \): Сколько образуется ковалентных связей? В молекулах существует определенное количество ковалентных связей, которые могут образовывать разные атомы.Каждый блок с номером указывает количество ковалентных связей, образованных этим атомом в нейтральных соединениях.
Пример \ (\ PageIndex {2} \)
Изучите структуру Льюиса OF 2 ниже. Подсчитайте количество связей, образованных каждым элементом. Основываясь на расположении элемента в периодической таблице, соответствует ли оно ожидаемому количеству связей, показанному в таблице 4.1? Соответствует ли приведенная ниже структура Льюиса правилу октетов?
Решение
Да.F (группа 7A) образует одну связь, а O (группа 6A) образует 2 связи. Каждый атом окружен 8 электронами. Эта структура удовлетворяет правилу октетов.
Упражнение \ (\ PageIndex {2} \)
Изучите структуру Льюиса NCl 3 ниже. Подсчитайте количество связей, образованных каждым элементом. Основываясь на расположении элемента в периодической таблице, соответствует ли оно ожидаемому количеству связей, показанному в таблице 4.1? Соответствует ли приведенная ниже структура Льюиса правилу октетов?
- Ответ
И Cl, и N образуют ожидаемое количество облигаций.Cl (группа 7A) имеет одну связь и 3 неподеленные пары. Центральный атом N (группа 5А) имеет 3 связи и одну неподеленную пару. Да, структура Льюиса NCl 3 следует правилу октетов.
Упражнения по обзору концепции
Как образуется ковалентная связь между двумя атомами?
Как ковалентная связь позволяет атомам в группе 6A удовлетворять правилу октетов?
ответы
Ковалентные связи образованы двумя атомами, разделяющими электроны.
Атомы в группе 6A образуют две ковалентные связи.
Основные выводы
- Ковалентная связь образуется между двумя атомами за счет обмена электронами.
- Число связей, которые элемент образует в ковалентном соединении, определяется числом электронов, необходимых для достижения октета.
- Водород — исключение из правила октетов. H образует только одну связь, потому что ему нужно всего два электрона.
Упражнения
Что такое обмен электронами?
Изобразите диаграмму Льюиса для ковалентной связи в молекуле H 2 .
Изобразите диаграмму Льюиса для ковалентной связи в молекуле Br 2 .
Изобразите диаграмму Льюиса для ковалентной связи в молекуле HCl.
В чем разница между молекулой и формульной единицей?
Почему атомы водорода не подчиняются правилу октетов, когда они образуют ковалентные связи?
Изобразите диаграмму Льюиса для ковалентной связи в H 2 S. Сколько связывающих электронов и несвязывающих электронов в молекуле?
Изобразите диаграмму Льюиса для ковалентной связи в CF 4 .Сколько в молекуле связывающих электронов и несвязывающих электронов?
Изобразите диаграмму Льюиса для ковалентной связи в PCl 3 . Сколько связывающих электронов и несвязывающих электронов в молекуле?
Сколько ковалентных связей обычно образует атом водорода? Почему?
Сколько ковалентных связей обычно образует атом кислорода? Почему?
Атомы теллура образуют ковалентные связи.Сколько ковалентных связей образовал бы атом теллура? Предскажите формулу соединения теллура и водорода.
Атомы олова образуют ковалентные связи. Сколько ковалентных связей образовал бы атом олова? Предскажите формулу соединения олова и водорода.
Астатин — синтетический элемент, производимый по одному атому в огромных машинах для уничтожения атомов. Он находится в группе галогенов в периодической таблице.Сколько ковалентных связей образовал бы атом этого элемента?
Были сообщения, что атомы элемента 116 (Lv) были образованы путем столкновения более мелких атомов вместе. Используя периодическую таблицу, определите, в каком столбце будет элемент 116, и предположите, сколько ковалентных связей образовал бы атом этого элемента.
ответы
1. Ковалентная связь образуется, когда два атома разделяют электроны.
2. Обмен электронами соединяет два атома ковалентной связью.Это более стабильное расположение, чем 2 отдельных атома.
3.
4.
5.
6. Молекула — это дискретная комбинация атомов; формульная единица — это наименьшее соотношение ионов в кристалле.
7. Атомы водорода подчиняются правилу дуэта (а не правилу октетов). Это потому, что у него только одна оболочка, и эта оболочка может содержать только 2 электрона.
8.
связывающих электронов: 4; несвязывающие электроны: 4
9.
связывающих электронов: 8; несвязывающие электроны: 24
10.
связывающих электронов: 6; несвязывающие электроны: 20
11. Атомы водорода образуют только одну ковалентную связь, потому что у них есть только один валентный электрон для спаривания.
12. Атомы кислорода образуют 2 ковалентные связи, потому что атомы кислорода имеют 6 валентных электронов (2 неподеленные пары плюс 2 неспаренных электрона, которые используются для получения октета).
13.два; H 2 Te
14. четыре: SnH 4
3.3: Химическая связь — Биология LibreTexts
Не все химические связи образуются так же, как связи в воде. На самом деле существует четыре различных типа химических связей, которые мы обсудим здесь: неполярные ковалентные, полярные ковалентные, водородные и ионные. Каждый тип облигации описан ниже.
Неполярные ковалентные связи
Для метана (CH 4 ) на рисунке \ (\ PageIndex {3} \) атом углерода (с четырьмя электронами на внешней валентной энергетической оболочке) имеет по одному электрону от каждого из четырех атомов водорода.Водород имеет один валентный электрон в своей первой энергетической оболочке. Ковалентное связывание преобладает в органических соединениях. Фактически, ваше тело скреплено электронами, которые разделяют атомы углерода и водорода! Электроны распределяются поровну во всех направлениях; поэтому этот тип ковалентной связи называется неполярной.
Рисунок \ (\ PageIndex {3} \): Метан образуется при ковалентной связи четырех атомов водорода и одного углерода.Полярные ковалентные связи и водородные связи
Ковалентная связь — это сила притяжения, которая удерживает вместе два неметаллических атома, которые разделяют пару электронов.Один электрон обеспечивается каждым атомом, и пара электронов притягивается к положительным ядрам обоих атомов. Молекула воды, представленная на рисунке \ (\ PageIndex {4} \), содержит полярные ковалентные связи.
Сила притяжения между молекулами воды — это дипольное взаимодействие. Атомы водорода связаны с сильно электроотрицательным атомом кислорода (который также имеет два набора неподеленных пар электронов, что создает очень полярную связь. Затем частично положительный атом водорода одной молекулы притягивается к частично отрицательному атому кислорода соседней воды. молекула, как показано на рисунке \ (\ PageIndex {4} \)).
Рисунок \ (\ PageIndex {4} \): Водородная связь в воде возникает между атомом водорода одной молекулы воды и неподеленной парой электронов на атоме кислорода соседней молекулы водыA водородная связь является межмолекулярная и внутримолекулярная сила притяжения, при которой атом водорода, ковалентно связанный с сильно отрицательным атомом , притягивается к неподеленной паре электронов на атоме или к частично отрицательному атому в соседней полярной молекуле.Водородные связи также обнаруживаются внутримолекулярно в третичных и четвертичных структурах белков и цепей ДНК.
Водородная связь возникает только в молекулах, в которых водород ковалентно связан с одним из трех элементов: фтором, кислородом или азотом. Эти три элемента настолько электроотрицательны, что отбирают большую часть электронной плотности в ковалентной связи с водородом, оставляя атом H с дефицитом электронов. Атом H действует почти как голый протон, в результате чего его очень привлекают электроны неподеленной пары на соседнем атоме.
Рисунок \ (\ PageIndex {5} \): Множественные водородные связи возникают одновременно в воде из-за ее изогнутой формы и наличия двух атомов водорода в молекуле.Водородная связь, возникающая в воде, приводит к некоторым необычным, но очень важным свойствам. Большинство молекулярных соединений, имеющих массу, аналогичную массе воды, являются газами при комнатной температуре. Благодаря сильным водородным связям молекулы воды могут оставаться в жидком состоянии в конденсированном состоянии. На рисунке \ (\ PageIndex {5} \) показано, как изогнутая форма и два атома водорода на молекулу позволяют каждой молекуле воды образовывать водородную связь с двумя другими молекулами.
В жидком состоянии водородные связи воды могут разрываться и преобразовываться, когда молекулы перетекают из одного места в другое. Когда вода охлаждается, молекулы начинают замедляться. В конце концов, когда вода превращается в лед, водородные связи образуют очень специфическую сеть, показанную в правой части рисунка \ (\ PageIndex {6} \). Когда вода жидкая, молекулы более подвижны и не образуют эту жесткую структуру.
Рисунок \ (\ PageIndex {6} \): Когда вода замерзает до состояния льда, сеть водородных связей становится более стабильной.Каждый атом кислорода имеет приблизительно тетраэдрическую геометрию — две ковалентные связи и две водородные связи.Ионные связи
Электроны переносятся между атомами. Ион отдает один или несколько электронов другому иону. Поваренная соль, хлорид натрия (NaCl), является распространенным примером ионного соединения.