ип
А5. Впервые синтезировал органическое вещество мочевину
из неорганического вещества цианата аммония
1) Берцелиус 2) Бутлеров
3) Велер 4) Шорлеммер
А6. Органическая химия — это химия соединений
1) углерода
2) водорода
3) кислорода
4) азота
jts№
А7. Определил органическую химию как химию углеводоро
дов и их производных
1) Берцелиус 2) Шорлеммер
3) Велер 4) Бутлеров
А8. Укажите вещество, являющееся углеводородом
1) этанол
2) дихлорэтан
3) пропан
4) уксусная кислота
А9. Укажите процесс, который способствует уменьшению
содержания углекислого газа в атмосфере
1) горение углеродсодержащих веществ
2) дыхание растений и животных
3) процесс фотосинтеза
4) деятельность вулканов
А10. Атом углерода способен образовывать химические связи
1) с атомами углерода и водорода
2) с атомами кислорода и серы
3) с атомами азота и фосфора
4) с атомами всех перечисленных элементов
Тест 1
A ll.
 Укажите продукты, которые, как правило, образуются
Укажите продукты, которые, как правило, образуютсяпри сгорании органических веществ
1) С02 и Н20
2) С02 и N0
3) С02 и Н2
4) СО и Н20
А12. Напишите уравнение реакции горения пропана С3Н8.
Ответ дайте в виде суммы коэффициентов в уравнении
реакции.
1) 10
3) 12
2) 11
4) 13
А13. Определите объем (н.у.) кислорода, необходимый для
сжигания 12 л (н.у.) бутана С4Н10.
1) 78 л
3) 66 л
2)
4)
72 л
60л
А14. В ходе реакции фотосинтеза образовалось 900 г глюко
зы. Определите объем (н.у.) выделившегося кислорода.
1) 896 л
2) 672 л
3) 448 л
4) 112 л
А15. Определите массу глюкозы, образовавшейся в ходе ре
акции фотосинтеза, если при этом было поглощено
112 л (н.у.) углекислого газа.
1) 180 г
2) 170 г
3) 150 г
4) 140 г
Введение
Часть В (задания с кратким ответом)
В1. Установите соответствие между именем ученого и дос
тижением этого ученого. Ответ дайте в виде последова
тельности цифр, соответствующих буквам по алфавиту.

УЧЕНЫЙ
A) Бертло
Б) Берцелиус
B) Бутлеров
Г) Вёлер
ДОСТИЖЕНИЕ
1) развил учение о витализме
2) впервые синтезировал мо
чевину
3) впервые синтезировал жир
4) впервые синтезировал са
харистые вещества
В2. Установите соответствие между классификацией соеди
нений и примерами подобных соединений. Ответ дайте в
виде последовательности цифр, соответствующих буквам
по алфавиту.
КЛАССИФИКАЦИЯ
СОЕДИНЕНИЙ
A) искусственные
Б) синтетические
B) природные
СОЕДИНЕНИЯ
1) глюкоза
2) целлулоид
3) капрон
ВЗ. Установите соответствие между примерами органиче
ских соединений и их классификацией. Ответ дайте в
по алфавиту.
СОЕДИНЕНИЯ КЛАССИФИКАЦИЯ
СОЕДИНЕНИЙ
А) белки 1) природные
Б) ацетатное волокно 2) искусственные
В) бутадиеновый 3) синтетические
каучук
Г) жиры
Д) углеводы
10
Тест 1
В4. Среди нижеперечисленных характеристик укажите те, jg$
которые, как правило, относятся к органическим веще- —
ствам: —
1) имеют молекулярные кристаллические решетки,
2) имеют ионные кристаллические решетки,
3) имеют невысокие температуры плавления и кипе
ния,
4) имеют высокие температуры плавления и кипения,
5) термически устойчивы,
6) термически неустойчивы,
7) образованы за счет ковалентных связей,
8) образованы за счет водородных связей.
 Ответ дайте в
Ответ дайте ввиде последовательности цифр в порядке их возрас
тания.
з
В5. Определите объем воздуха (в м при н.у.), необходимый
для сжигания 1 кг природного газа, содержащего по —
массе 96% метана и 4% этана, если объемная доля ки- —
слорода в воздухе равна 0,21. Ответ дайте в виде целого —
числа без указания единиц измерения.
11
Введение
е$Ш А1.
А2.
АЗ.
.ег0 А4.
■ ТЕСТ 2. ТЕОРИЯ СТРОЕНИЯ ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
Часть А (задания с выбором ответа)
Укажите верное суждение: А) валентность определяется
числом связей, которыми данный атом соединен с дру
гими атомами; Б) степень окисления — это условный
заряд атома в молекуле, где полярные связи считаются
ионными.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Определите степень окисления углерода в дихлорметане
СН2С12
1) -2
2) О
3) +2
4) +4
Определите валентность углерода в этане
1) I
2) II
3) III
4) IV
Укажите соединение, в котором имеется атом углерода с
1) С Н з-С Н з
2) СН3—СН2ОН
3) СН3—СООН
4) СН3—СН2С1
12
Тест 2
А5.
 Являются изомерами два вещества, имеющие
Являются изомерами два вещества, имеющие1) одинаковый состав и одинаковое строение
2) одинаковый состав и разное строение
3) разный состав и сходное строение
4) разный состав и разное строение
А6. Являются гомологами два вещества, имеющие
1) сходное строение и одинаковый состав
2) разное строение и одинаковый состав
3) разное строение и разный состав
4) сходное строение и состав, различающийся на груп
пу —СН2—.
jssS\
А7. Укажите верное суждение: А) химическое строение —
это порядок соединения атомов в молекуле; Б) гомологи
имеют одинаковую молярную массу.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А8. Укажите верное суждение: А) изомеры имеют одинако
вую молярную массу; Б) свойства веществ зависят не
только от их состава, но и от строения их молекул.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
.егИ
А9.
 Укажите формулу вещества, являющегося гомологом
Укажите формулу вещества, являющегося гомологомпропена СзНб
1) С2Нб
2) С3Н8
3) С4Н6
4) С4Н8
■егИ
13
Введение
А10. Укажите формулу вещества, являющегося изомером
этанола С2Н5ОН
1) С2Н6 2) СН3ОСН3
3) СН3СООН 4) С2Н5С1
-егИ
11 □
а п
АН . Укажите предельный углеводород, который может су
ществовать в виде двух структурных изомеров
1) бутан 2) этан
3) пропан 4) метан
.еГ0
А12. Укажите непредельный углеводород, который может
существовать в виде двух геометрических изомеров
3) бутен-1 4) бутен-2
jtsE l
А13. Видом пространственной изомерии является
1) межклассовая изомерия
2) изомерия положения кратной связи
3) геометрическая изомерия
4) изомерия углеродного скелета
А14. Укажите число структурных изомеров пентана С5Н12
1) 4
2) 3
3) 2
4) 1
А15. Какой российский ученый внес существенный вклад в
создание теории строения органических соединений?
1) Бутлеров
2) Зинин
3) Ломоносов
4) Менделеев
14
Тест 2
Часть В (задания с кратким ответом)
В1.

В2.
ВЗ.
Установите соответствие между формулой углеродсо-
держащей молекулы и степенью окисления углерода в
ней. Ответ дайте в виде последовательности цифр, соот
ветствующих буквам по алфавиту.
ФОРМУЛА СТЕПЕНЬ ОКИСЛЕНИЯ
УГЛЕРОДА
А) СН4 1) +4
Б) СС14 2) +2
В) СНС13 3) 0
Г) СН3С1 4) -2
Д) СН2С12 5) -4
Установите соответствие между атомом и его характер-
ной валентностью в органических соединениях. Ответ
дайте в виде последовательности цифр, соответствую-
щих буквам по алфавиту.
АТОМ ВАЛЕНТНОСТЬ
А) С 1) I
Б) Н 2) II
В) О 3) III
Г) С1 4) IV
5) V
Установите соответствие между названиями веществ и
характеристикой взаимосвязи между этими веществами,
полагая, что разные вещества не являются ни изомера
ми, ни гомологами. Ответ дайте в виде последовательно
сти цифр, соответствующих буквам по алфавиту.
ФОРМУЛА ХАРАКТЕРИСТИКА
А) бутан и пропан 1) изомеры
Б) бутан и изобутан 2) гомологи
В) этан и этанол 3) одно и то же вещество
Г) этанол и этиловый спирт 4) разные вещества
MS
jsS
15
Введение
jg$ В4.
 Установите соответствие между изомерами и типом изо
Установите соответствие между изомерами и типом изоности цифр, соответствующих буквам по алфавиту.
ИЗОМЕРЫ ТИП ИЗОМЕРИИ
А) бутен-1 и бутен-2 1) положения кратной связи
Б) цис-бутен2 и транс- 2) положения заместителя
бутен-2
В) бутанол-1 и бутанол-2 3) межклассовая
Г) этанол и диметило- 4) геометрическая
вый эфир
jg$ В5. Установите соответствие между формулой углеводорода
и массовой долей углерода в ней. Ответ дайте в виде по
следовательности цифр, соответствующих буквам по ал
фавиту.
ФОРМУЛА МАССОВАЯ
УГЛЕРОДА
А) СН4 1) 0,923
Б) С6Н6 2) 0,857
В) С4Н6 3) 0,750
Г) с3нб 4) 0,889
16
УГЛЕВОДОРОДЫ
И ИХ ПРИРОДНЫЕ ИСТОЧНИКИ
■ ТЕСТ 3. ПРИРОДНЫЙ ГАЗ. АЛКАНЫ
Часть А (задания с выбором ответа)
А1. Укажите формулу углеводорода
1) С2Н5ОН
2) Ch4Nh3
3) C8Hi8
4) СН3С1
А2. Укажите углеводород, являющийся основным компо
нентом природного газа
1) бутан
2) этан
3) пропан
4) метан
АЗ.
 Состав алканов отражает общая формула
Состав алканов отражает общая формула1) СПН2„_2
2) СпН2л+2
3) СпН2п
4) С„Н2л- 6
А4. Укажите формулу алкана, являющегося жидкостью при
обычных условиях
1) С8Н18
2) Ci8h48
3) С4Н10
4) С3Н8
17
Углеводороды и их природные источники
jssB
А5.
,еГ0
А6.
шптп
А7.
С увеличением числа атомов углерода в молекулах угле
водородов температура кипения этих углеводородов
1) уменьшается
2) увеличивается
3) не изменяется
4) сначала увеличивается, потом уменьшается
Укажите число атомов углерода в наиболее длинной це
пи в молекуле СНз—СЩС2Н5)—СЩС2Н5)—СН3
1) 7 2) 4
3) 5 4) б
Укажите формулу 2,3-диметилбутана
1) С Н з-С Н (С Н 3)-С Н (С Н з )2
2) (СН )2С Н -С Н 2-С Н (С Н )2
3) СН3—СН(СН3)—С(СН3)3
4) СН3—СН(СНз)—СН2—СН3
А8. Укажите число возможных структурных изомеров гек
сана C6Hi4
1) 8 2) 5
3) 6 4) 7
ЛГ0
А9. Для алканов не характерны реакции
1) присоединения
2) замещения
3) разложения
4) окисления
*г0
А10.
 ■ 0
■ 0А13. Определите объем кислорода (н.у.), необходимый для
сгорания 10 л (н.у.) алкана С„Н2п+2
1) (10п) л 2) (15п — 5) л
3) (15п + 5) л 4) (15п + 10) л
eS 0
А14. Определите объем хлора (н.у.), необходимый для хлори
рования 32 г метана до дихлорметана.
1) 44,8 л
2) 22,4 л
3) 67,2 л
4) 89,6 л
А15. Определите объем метана (н.у.), из которого можно по
лучить 60 г сажи
1) 104 л
2) 112 л
3) 128 л
4) 144 л
19
Углеводороды и их природные источники
Часть В (задания с кратким ответом)
& В1. Установите соответствие между формулой алкана и на
званием соответствующего ему радикала. Ответ дайте в
виде последовательности цифр, соответствующих буквам
по алфавиту.
ФОРМУЛА АЛКАНА
A) СН4
Б) С5Н12
B) С4Н10
Г) С2Н6
Д) С3Н8
РАДИКАЛ
1) пентил
2) этил
3) пропил
4) метил
5) бутил
& В2. Установите соответствие между формулой алкана и его
названием. Ответ дайте в виде последовательности
цифр, соответствующих буквам по алфавиту.

ФОРМУЛА АЛКАНА
A) СН3СН(С2Н5)СН2СНз
Б) (СН3)3С—СН(СН3)2
B) (СН3)3С -С Н 2-С Н 3
Г) СН3СН(С2Н5)СН(С2Н5)СН3
НАЗВАНИЕ
1) 3,4-диметилгексан
2) 3-метилпентан
3) 2,2-диметилбутан
4) 2,2,3-триметилбутан
ВЗ. Установите соответствие между объемом (н.у.) алкана
и объемом (н.у.) кислорода, необходимого для полного
сгорания этого алкана. Ответ дайте в виде после
довательности цифр, соответствующих буквам по алфа
виту.
ОБЪЕМ АЛКАНА
A) 10 л С4Ню
Б) 25 л СН4
B) 11л С3Н8
Г) 20 л С2Н6
ОБЪЕМ КИСЛОРОДА
1) 50 л
2) 55 л
3) 60 л
4) 65 л
5) 70 л
20
Тест 3
В4. Используя термохимическое уравнение: СН4(г) + 202(г) = jsS
= С02(г) + 2Н20(г) + 900 кДж, определите объем в литрах —
метана (н.у.), который необходимо сжечь для получения —
4500 кДж энергии. Ответ дайте в виде целого числа без —
указания единиц измерения.
В5. Определите массу (в граммах) ацетилена, который мож- jg$
g
но получить из 1 м (н.
 С 2Н6
С 2Н622
А6.
Тест 4
Для алкенов не характерны реакции
1) полимеризации
2) окисления
3) замещения
4) присоединения
-егИ
ига
S D
А7. Изомером 2-метилпентена-1 не является
1) циклогексан
2) З-метилциклопентен-1
3) гексен-2
4) З-метилпентен-1
Ц П
А8. Укажите общее число изомеров с формулой С4Н8, учи
тывая структурную, геометрическую и межклассовую
изомерию
1) 6 2) 7
3) 4 4) 5
шпига
А9. Укажите верное суждение: А) правило Марковникова —
при присоединении галогеноводорода к алкену водород
присоединяется к атому углерода при двойной связи, с
которым соединено большее число атомов водорода;
Б) полимер — это высокомолекулярное соединение, мо
лекулы которого состоят из множества одинаковых
структурных звеньев.
£ f 0
э т а
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
А10. Желтый раствор брома обесцвечивается при пропуска
нии через него
1) этана
2) пропана
3) метана
4) бутена
та
23
Углеводороды и их природные источники
* г 0
^ ■ 0
шп-ef0
АН .
 Фиолетовый раствор перманганата калия обесцвечивает
Фиолетовый раствор перманганата калия обесцвечивается при пропускании
1) метана
2) пропена
3) этана
4) пропана
А12. Определите объем этилена (н.у.), необходимый для
обесцвечивания раствора, содержащего 40 г брома.
1) 4,48 л
2) 5,6 л
3) 6,72 л
4) 11,2 л
А13. Определите массу этилового спирта, который можно по
лучить при гидратации 54,8 л (н.у.) этилена, если реак
ция идет с выходом 80% .
1) 90 г 2) 100 г
3) 110 г 4) 120 г
А14. Определите алкен, для сгорания 8,96 л которого потре
бовалось 57,6 г кислорода.
1) С2Н4
2) С5Н10
3) С3Н6
4) С4Н8
А15. При взаимодействии 4,48 л (н.у.) газообразного алкена с
избытком хлороводорода образовалось 18,5 г монохлор-
производного. Определите формулу алкена.
1) с5н10
2) С2Н4
3) С3Н6
4) С4Н8
24
Тест 4
Bl.
В2.
ВЗ.
Часть В (задания с кратким ответом)
Установите соответствие между изомером транс-бутена-
2 и видом изомерии между данным изомером и транс-
бутеном-2.
 Ответ дайте в виде последовательности цифр,
Ответ дайте в виде последовательности цифр,соответствующих буквам по алфавиту.
ИЗОМЕРИЯ
1) оптическая
2) углеродного скелета
3) межклассовая
4) геометрическая
5) положения двойной связи
ИЗОМЕР
A) бутен-1
Б) цис-бутен-2
B) 2-метилпропен-1
Г) циклобутан
ТИП РЕАКЦИИ
Установите соответствие между типом химической ре
акции и уравнением реакции данного типа. Ответ дайте
в виде последовательности цифр, соответствующих бук
вам по алфавиту.
УРАВНЕНИЕ РЕАКЦИИ
1) С2Н4 + Н2 —> С2Н6
2) С2Н 4 + В г2 -> С2Н 4ВГ2
3) С2Н4 + Н20 -> С2Н5ОН
4) С2Н5ОН -> С2Н4 + Н20
5) С2Нб -> С2Н4 + Н2
Установите соответствие между формулой вещества, реа
гирующего с бутеном-1 и названием образующегося в хо
де этой реакции продукта. Ответ дайте в виде последова
тельности цифр, соответствующих буквам по алфавиту.
А) гидратация 1)
Б) дегидрирование 2)
В) галогенирование 3)
Г) гидрирование 4)
Д) дегидратация 5)
ВЕЩЕСТВО ПРОДУКТ РЕАКВД
А) С12 1) 1-хлорбутан
Б) НС1 2) бутан
В) Н20 3) бутанол-1
Г) н 2 4) 1,2-дихлорбутан
5) бутанол-2
6) 2-хлорбутан
25
Углеводороды и их природные источники
& В4.
 Установите соответствие между отдельным фрагментом
Установите соответствие между отдельным фрагментом——— записи уравнения полимеризации этилена и названием
——- этого фрагмента. Ответ дайте в виде последовательности
——— цифр, соответствующих буквам по алфавиту.
ФРАГМЕНТ НАЗВАНИЕ
А) п 1) полимер
Б) сн2=сн2 2) структурное звено
В) -СН2-СН2- 3) степень полимеризации
Г) (—сн2—сн2—% 4) мономер
jg$ В5. В избыток водного раствора перманганата калия про-
——— пустили 100 л (н.у.) смеси бутана и бутена-1, содержа-
——— щей 57,5% бутана по объему. Определите массу в грам-
——— мах образовавшегося осадка. Ответ дайте в виде целого
числа без указания единиц измерения.
26
Тест 5
■ ТЕСТ 5. АЛКАДИЕНЫ. КАУЧУКИ
Часть А (задания с выбором ответа)
А1. Состав алкадиенов отражает общая формула
1) С„Н2п_2
2) СпЯ2п+2
3) СпЯ2п
4) СлН2п_6
А2. Может быть алкадиеном углеводород
1 ) с 3н 8
2) С5Н8
3) С2Н2
4) С4Н8
АЗ. Назовите алкадиен СН2=С(СНз)—С(СНз)=СН2
1) бутадиен-1,3
2) 2-метилбутадиен-1,3
3) 3-метилбутадиен-1,3
4) 2,3-диметилбутадиен-1,3
А4.
 Укажите верное суждение: А) алкадиены — углеводоро
Укажите верное суждение: А) алкадиены — углеводороды, молекулы которых содержат две двойные углерод-
углеродные связи; Б) сопряженные алкадиены — это
диены, в молекулах которых две двойные связи разде
лены одной одинарной связью.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
А5. Укажите сопряженный алкадиен
1) пентадиен-1,2
2) пентадиен-1,4
3) бутадиен-1,2
4) бутадиен-1,3
ЕЮ
тп[ню
тп
ЕЮ
ЕЮ
jts Ш
тп
27
Углеводороды и их природные источники
* Г 0
.ег0
а п
А6. Укажите алкан, при дегидрировании которого образует
ся бутадиен-1,3
1) бутан
2) 2-метилбутан
3) пентан
4) пропан
А7. Укажите алкан, при дегидрировании которого образует
ся изопрен
1) пропан
2) 2-метилбутан
3) пентан
4) бутан
А8. В ходе реакции Лебедева бутадиен-1,3 получают из
1) бутана
2) этилена
3) этанола
4) бутена-1
А9. В качестве катализатора при полимеризации бутадие
на-1,3 Лебедев использовал
1) платину
2) никель
3) железо
4) натрий
А10.
 При полимеризации бутадиена-1,3 мономеры соединя
При полимеризации бутадиена-1,3 мономеры соединяются по положениям
1) 1 и 2
2) 2 и 3
3) 1 и 4
4) 1 и 3
28
Тест 5
A ll. Вулканизация — это нагревание каучука с
1) серой
2) фосфором
3) бромом
4) сажей
&Е1
апэта
А12. Резина по сравнению с каучуком
1) более эластичная и более износостойкая
2) менее эластичная и более износостойкая
3) более эластичная и менее износостойкая
4) менее эластичная и менее износостойкая
апА13. При взаимодействии бутадиена-1,3 с бромом не может
образоваться
1) СН2Вг—СН=СН—СН2Вг
2) СН2Вг—СНВг—СНВг—СН2Вг
3) СН2Вг—СН=СВг—СН3
4) СН2Вг—СНВг—СН=СН2
А14. При получении бутадиена-1,3 из бутана было получено
100 г водорода. Определите объем (н.у.) полученного бу
тадиена-1,3.
1) 1120 л
2) 896 л
3) 672 л
4) 560 л
-«■и
А15. Определите массу бромной воды с массовой долей брома
0,08, которая обесцветится при пропускании 4,48 л
(н.
 у.) бутадиена 1,3.
у.) бутадиена 1,3.1) 800 г
2) 640 г
3) 400 г
4) 560 г
.етИ
29
Углеводороды и их природные источники
Часть В (задания с кратким ответом)
& В1. Установите соответствие между тривиальным названием
и систематическим названием алкадиенов. Ответ дайте в
виде последовательности цифр, соответствующих буквам
по алфавиту.
ТРИВИАЛЬНОЕ
НАЗВАНИЕ
A) хлоропрен
Б) изопрен
B) дивинил
СИСТЕМАТИЧЕСКОЕ
НАЗВАНИЕ
1) бутадиен-1,3
2) 2-хлорбутадиен-1,3
3) 2-метилбутадиен-1,3
& В2. Установите соответствие между процессом и продуктом,
который образуется в результате этого процесса. Ответ
дайте в виде последовательности цифр, соответствую
щих буквам по алфавиту.
ПРОЦЕСС
A) вулканизация каучу
ка с избытком серы
Б) вулканизация кау
чука с недостатком
серы
B) дегидрирование
2-метилбутана
Г) полимеризация бута
диена-1,3
Д) дегидрирование бу
тана
ПРОДУКТ
1) бутадиен-1,3
2) 2-метилбутадиен-1,3
3) каучук
4) резина
5) эбонит
JBS ВЗ.
 Алкадиен прореагировал с избытком бромной воды.
Алкадиен прореагировал с избытком бромной воды.Массовая доля брома в образовавшемся соединении рав
на 0,796. Определите молярную массу (в г/моль) исход
ного алкадиена. Ответ дайте в виде целого числа без
указания единиц измерения.
30
Тест 5
В4. Установите соответствие между объемом паров алкадие- jsS
на и объемом кислорода, необходимого для сгорания —
этого алкадиена и взятого при тех же условиях. Ответ —
дайте в виде последовательности цифр, соответствую- —
щих буквам по алфавиту. —
ОБЪЕМ ПАРОВ ОБЪЕМ КИСЛОРОДА
АЛКАДИЕНА
А) 40 л С3Н4 1) 136 л
Б) 30 л С4Нб 2) 140 л
В) 20 л С5Н8 3) 154 л
Г) 16 л СвНю 4) 160 л
5) 165 л
В5. Для полного сгорания 13,6 г алкадиена было израсходо- jg
вано 44, 8 г кислорода. Определите молярную массу ал- —
кадиена. Ответ приведите в виде целого числа без ука- —
зания единиц измерения. —
31
Углеводороды и их природные источники
А5.
■ ТЕСТ6. АЛКИНЫ. АЦЕТИЛЕН
Часть А (задания с выбором ответа)
Общая формула алкинов
1) спя 2п
2) СпЯ2п+2
3) С„Н2п-б
4) СпН2л_2
Может быть алкином углеводород
1) С2Н2
2) С5Ню
3) С3Н8
4) С4Н8
Изомером пентина-1 является
1) пентен-2
2) пентадиен-1,3
3) пентан
4) З-метилбутен-1
Ацетилен можно получить, действуя водой на
1) карбонат кальция
2) карбид алюминия
3) карбид кальция
4) силицид кальция
Ацетилен на практике получают при пиролизе
1) метана
2) бутана
3) этана
4) этилена
32
Тест 6
А6.
 Температура около 3200 °С достигается при горении в
Температура около 3200 °С достигается при горении вкислороде
1) метана
2) этана
3) этилена
4) этина
msB
на
А7. При полном гидрировании ацетилена избытком водоро
да образуется
1) метан
2) этан
3) этилен
4) бутан
& в
А8. При пропускании ацетилена обесцвечивается водный
раствор
1) хлорида натрия
2) сульфата цинка
3) перхлората калия
4) перманганата калия
ж?В
А9. Укажите газообразный углеводород, при пропускании
которого не обесцвечивается раствор бромной воды
1) бутан
2) пропен-1
3) этин
4) бутадиен-1,3
& в
А10. Поливинилхлорид образуется при полимеризации
1) хлорэтана
2) хлорэтена
3) дихлорэтана
4) этилхлорида
33
Углеводороды и их природные источники
on
,ег0
ип
jtsSl
ип
Л£Ш
•е? 0
А Н . Укажите вещество X в схеме: С2Н2 -> X -»
-> (—СН2—СНС1—)„
1) хлорэтан
2) дихлорэтан
3) винилхлорид
4) этилхлорид
А12.
 Укажите вещество X в схеме: СН4 —> X —> СН3СНО
Укажите вещество X в схеме: СН4 —> X —> СН3СНО1) этан
2) этен
3) этанол
4) этин
А13. Реакция гидратации ацетилена в присутствии солей
ртути (II) носит имя русского химика-органика
1) Бутлерова
2) Марковникова
3) Кучерова
4) Зинина
А14. В стакан с избытком бромной воды пропускали ацети
лен. По окончании реакции масса стакана увеличилась
на 13 г. Определите массу образовавшегося галогено
производного.
1) 164 г 2) 173 г
3) 185 г 4) 191 г
А15. Используя термохимическое уравнение горения ацети
лена: 2С2Н2 + 502 -> 4С02 + 2Н2О + 2600 кДж, опреде
лите объем ацетилена (н.у.), который надо сжечь для
получения 10000 кДж теплоты.
1) 148 л 2) 154 л
3) 166 л 4) 172 л
34
Тест 6
Часть В (задания с кратким ответом)
В1. Установите соответствие между названием углеводо
рода и его классификацией. Ответ дайте в виде после
довательности цифр, соответствующих буквам по
алфавиту.

Л*
НАЗВАНИЕ
A) изопрен
Б) пропилен
B) ацетилен
Г) пентан
Д) этилен
КЛАССИФИКАЦИЯ
1) алкены
2) алканы
3) алкадиены
4) алкины
В2. Среди нижеперечисленных веществ укажите вещества,
являющиеся изомерами бутина-1:
1) бутен-1
2) бутин-2
3) бутадиен-1,3
4) пропен
5) бутан
J*
Ответ дайте в виде последовательности цифр в порядке
их возрастания.
ВЗ. Среди нижеперечисленных веществ укажите вещества,
являющиеся гомологами бутина-1:
1) ацетилен
2) бутин-2
3) бутадиен-1,3
4) пропен
5) пропин
Ответ дайте в виде последовательности цифр в порядке
их возрастания.
35
I
Углеводороды и их природные источники
В4. Технический карбид кальция содержит 10% примесей.
Определите массу технического карбида кальция в
граммах, которую надо взять для получения в ходе ре
акции с водой 100 л (н.у.) ацетилена, если реакция идет
с выходом 0,75. Ответ дайте в виде целого числа без
указания единиц измерения.
 • 0
• 0.еГ0
.ег0
.е? 0
-е? 0
А6. Укажите число двойных связей в молекуле бензола
1) 6 2) 3
3) 1 4) О
А7. Укажите правильное суждение
1) бензол обесцвечивает бромную воду
2) бензол не обесцвечивает раствор КМПО4
3) бензол горит бесцветным пламенем
4) бензол не является токсичным веществом
А8. Укажите правильное суждение
1) бензол вступает только в реакции замещения
2) бензол вступает только в реакции присоединения
3) бензол вступает в реакции замещения легче, чем ал
каны
4) бензол вступает в реакции присоединения легче, чем
алкены
А9. Укажите вещество X в схеме: СН4 -> X —> СбНб
1) гексан
2) этилен
3) ацетилен
4) бутан
А10. Укажите вещество X в схеме: С2Н2 -> X -> C6H5NO2
1) хлорбензол
2) бензол
3) этанол
4) бутадиен-1,3
А Н . Определите массу бензола, который можно получить из
112 л (н.у.) ацетилена при его тримеризации
1) 130 г 2) 140 г
3) 150 г 4) 160 г
38
Тест 7
А12.
 Определите объем (н.у.) кислорода, необходимый для
Определите объем (н.у.) кислорода, необходимый длясгорания 100 г бензола
1) 205 л
2) 215 л
3) 225 л
4) 235 л
А13. Определите массу хлорбензола, который образуется
при взаимодействии 15,6 г бензола с избытком хлора в
присутствии катализатора, если выход реакции состав
ляет 0,8.
1) 14 г
2) 16 г
3) 18 г
4) 20 г
А14. При обработке бензола смесью концентрированных
азотной и серной кислот (нитрующей смесью) было по
лучено 50 г нитробензола. Выход реакции составил
0,813. Определите массу израсходованного бензола.
1) 48 г
2) 45 г
3) 42 г
4) 39 г
А15. При взаимодействии бензола с хлором было получено
45 г хлорбензола. Полученный при этом хлороводород
был нейтрализован раствором гидроксида натрия с мас
совой долей 0,10. Определите массу израсходованного
раствора гидроксида натрия.
1) 150 г
2) 160 г
3) 170 г
4) 180 г
■егИ
эта
-ef0
39
Углеводороды и их природные источники
Часть В (задания с кратким ответом)
В1.
 Установите соответствие между формулой углеводорода
Установите соответствие между формулой углеводородаи его классификацией. Ответ дайте в виде последова
тельности цифр, соответствующих буквам по алфавиту.
ФОРМУЛА
A) С8Н18
Б) СН=С—СН2—СН3
B) СН2=СН—СН=СН2
Г) с6н6
Д) СН2=СН-СН2-С Н 3
КЛАССИФИКАЦИЯ
1) арен
алкан
алкадиен
алкин
алкен
2)
3)
4)
5)
В2. Установите соответствие между схемой химических пре
вращений и веществом X в этой схеме. Ответ дайте в
виде последовательности цифр, соответствующих буквам
по алфавиту.
СХЕМА
ПРЕВРАЩЕНИЙ
A) СаО -> X -> С2Н2
Б) СаС2 X -> С6Нб
B) СаСОз —► X —> СаС2
Г) С2Н2 -> X -> С6Н5С1
ВЕЩЕСТВО X
1) ацетилен
2) нитробензол
3) карбид кальция
4) оксид кальция
5) бензол
& ВЗ. Среди нижеперечисленных характеристик выберите те,
которые относятся к бензолу:
1) жидкость без запаха
2) бесцветная жидкость
3) не растворяется в воде
4) хорошо растворяется в воде
5) горит коптящим пламенем
6) не является токсичным веществом
7) тяжелее воды
8) не обесцвечивает раствор бромной воды
Ответ дайте в виде последовательности цифр в порядке
их возрастания.
 ■ 0
■ 0А4.
-«■0
А5.
■ ТЕСТ 8. НЕФТЬ И СПОСОБЫ ЕЕ ПЕРЕРАБОТКИ
Часть А (задания с выбором ответа)
Нефть — это смесь, состоящая
1) только из жидких углеводородов
2) только из газообразных углеводородов
3) только из твердых углеводородов
4) из жидких и растворенных в них газообразных и
твердых углеводородов
Укажите свойство, которое не относится к нефти
1) легче воды
2) растворима в воде
3) густая темная жидкость
4) не имеет постоянной температуры кипения
Укажите верное суждение: А) перегонка нефти — это фи
зический процесс; Б) крекинг — это физический процесс
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
Ректификационные газы, образующиеся при перегонке
нефти, содержат преимущественно
1) метан и этан
2) этан и бутан
3) бутан и пропан
4) пропан и метан
С увеличением числа атомов углерода в молекулах угле
водородов температура кипения этих углеводородов
1) уменьшается
2) увеличивается
3) не изменяется
4) сначала увеличивается, потом уменьшается
42
Тест 8
А6.
 0
0А9. При термическом крекинге из одной молекулы алкана
образуются две молекулы
1) алканов
2) алкана и алкина
3) алкенов
4) алкана и алкена
,еГ0
А10. Детонационная устойчивость (октановое число) выше у
бензинов, получаемых в ходе
1) фракционной перегонки
2) термического крекинга
3) каталитического крекинга
4) устойчивость одинаковая
>££0
43
I
Углеводороды и их природные источники
шп@п
ип
-егИ
Ц П
т п
,е? 0
ип
jtsEl
А Н . Процесс получения 2,2,4-триметилпентана (изооктана) из
нормального октана: СН3СН2СН2СН2СН2СН2СН2СН3 ->
-> (СН3)3С—СН2—СН(СН3)—СН3
это процесс
1) ароматизации 2) расщепления
3) циклизации 4) изомеризации
А12. Детонационная устойчивость будет наименьшей у бен
зина, который содержит углеводороды
1) циклические
2) линейного строения
3) ароматические
4) разветвленного строения
А13. Укажите верное суждение: А) качество бензина опреде
ляется его детонационной устойчивостью; Б) качество
бензина характеризуется его октановым числом.

1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А14. Наилучшую детонационную устойчивость имеет бензин
со следующим октановым числом
1) 96
2) 80
3) 76
4) 92
А15. Укажите углеводород, детонационную устойчивость ко
торого принимают за 100
1) «-гептан
2) 2,2,3-диметилпентан
3) н-октан
4) 2,2,4-диметилпентан
44
Тест 8
Часть В (задания с кратким ответом)
В1. Среди нижеперечисленных характеристик выберите те,
которые относятся к нефти:
1) темная маслянистая жидкость
2) жидкость без запаха
3) не растворяется в воде
4) имеет определенную температуру кипения
5) растворяется в воде
6) состоит только из жидких компонентов
7) легче воды
8) ее компоненты служат пищей для некоторых бактерий
Ответ дайте в виде последовательности цифр в порядке
их возрастания.
Л&
В2. Нижеперечисленные продукты перегонки нефти распо
ложите в порядке увеличения температур их кипения:
1) дизельное топливо 2) бензин
3) мазут 4) керосин
5) лигроин
Ответ дайте в виде последовательности цифр.

JtS
ВЗ. Установите соответствие между названием метода пере
работки нефти и характером процессов при этом методе.
Ответ дайте в виде последовательности цифр, соответст
вующих буквам по алфавиту.
МЕТОД
A) риформинг
Б) каталитический
крекинг
B) термический кре
кинг
Г) ректификация
ПРОЦЕССЫ
1) разделение на фракции
2) расщепление
3) расщепление и изомери
зация
4) изомеризация и арома
тизация
45
I
Углеводороды и их природные источники
В4. Установите соответствие между схемой процесса при пе
реработке нефти и названием этого процесса. Ответ дай
те в виде последовательности цифр, соответствующих
буквам по алфавиту.
СХЕМА
A) С16Н34 -> C8Hi8 +
+ C8Hi6
Б) «-гексан -»
—> 2-метилпентан
B) «-гексан —> бензол
НАЗВАНИЕ
1) изомеризация
2) расщепление
3) ароматизация
В5. Установите соответствие между углеводородом и соот
ветствующим ему изомером.
 Ответ дайте в виде после
Ответ дайте в виде последовательности цифр, соответствующих буквам по алфа
виту.
УГЛЕВОДОРОД ИЗОМЕР УГЛЕВОДОРОДА
А) н-пентан 1) 2,2,4-триметилпентан
Б) «-гексан 2) 2,2,3-триметилбутан
В) «-гептан 3) 2,2-диметилпропан
Г) «октан 4) 2,2,3 -триметилгексан
5) 2,3-диметилбутан
46
КИСЛОРОД- И АЗОТСОДЕРЖАЩИЕ
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
И ИХ ПРИРОДНЫЕ ИСТОЧНИКИ
■ ТЕСТ 9. ЕДИНСТВО ХИМИЧЕСКОЙ ОРГАНИЗАЦИИ
ЖИВЫХ ОРГАНИЗМОВ НА ЗЕМЛЕ. СПИРТЫ
Часть А (задания с выбором ответа)
А1. Укажите верное суждение: А) на атомном уровне разли
чий между живой и неживой природой нет; Б) на моле
кулярном уровне различий между живой и неживой
природой нет
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
*Г0
ип
А2. Укажите пару веществ, характерных как для живой,
так и для неживой природы
1) вода и углеводы 2) вода и соли
3) белки и соли 4) жиры и витамины
Проверочная работа Введение 10 класс профиль
Проверочная работа. Химия. 10 класс
Химия. 10 класс
Тема «Введение в органическую химию».
Вариант 1
1. Укажите органическое вещество:
А) поваренная соль В) серная кислота
Б) крахмал Г) оксид кремния
2. Ввел понятие органической химии как химии растительных и животных веществ:
А) Бутлеров В) Велер
Б) Шорлеммер Г) Берцелиус
3. Витализм – это учение о…
А) жизненной силе В) органических витаминах
Б) жизни Г) фотосинтезе
4. Укажите верное суждение: 1) Валентность определяется числом связей, которыми данный атом соединен с другими атомами 2) Степень окисления – это условный заряд атома в молекуле, где полярные связи считаются ионными
А) верно только А В) верны оба суждения
Б) верно только Б Г) оба суждения неверны
5. Какой российский учёный внёс существенный вклад в создание теории строения органических соединений?
А) Берцелиус В) Бутлеров
Б) Велер Г) Менделеев
6. Впервые синтезировал органическое вещество мочевину из неорганического вещества цианата аммония:
Впервые синтезировал органическое вещество мочевину из неорганического вещества цианата аммония:
А) Берцелиус В) Велер
Б) Бутлеров Г) нет верного ответа
7. Органическая химия – это химия соединений:
А) углерода В) кислорода
Б) водорода Г) азота
8.Определите валентность в этане:
А) I В) III
Б) II Г) IV
9. Укажите продукты, которые, как правило, образуются при сгорании органических веществ:
А) CO и H2O В) CO2 и NO
Б) CO2 и H2 Г) CO2 и H2O
10. Укажите элемент, атомы которого способны соединяться друг с другом, образуя длинные цепи:
А) водород В) азот
Б) кислород Г) углерод
11. Дать определения понятиям:
Органическая химия — _______________________________________________
Пи- связь _________________________________________________________
Изомеры — ________________________________________________________
Гибридизация -____________________________________________________
12. Раскройте 3 этап развития органической химии (основные положения теории Бутлерова).
Раскройте 3 этап развития органической химии (основные положения теории Бутлерова).
13. Охарактеризуйте первое валентное состояние атома углерода (облака, участвующие в процессе; угол; длина связи; возможные случаи образования)
14. Написать стационарное состояние атома углерода (положение элемента в ПС Менделеева; электронная формула, электронно-графическая)
15. Изобразить строение молекулы с помощью облаков:
— молекула воды
15*. Напишите черты сходства и различия между понятиями «валентность» и «степень окисления»
Укажите верное суждение:А)валетность определяется числом связей,которыми данный атом соединен с другими атомами.Б)степень окисления-это условный заряд
10-11 класс
атома в молекуле,где полярные связи считаются ионными.
Ioolosha 13 янв. 2016 г., 18:44:37 (5 лет назад) Nevvazhnoo13 янв. 2016 г., 21:37:39 (5 лет назад)
Вариант Б верный
в варианте А
В основном, под валентностью химических элементов понимается способность свободных его атомов к образованию определённого числа ковалентных связей.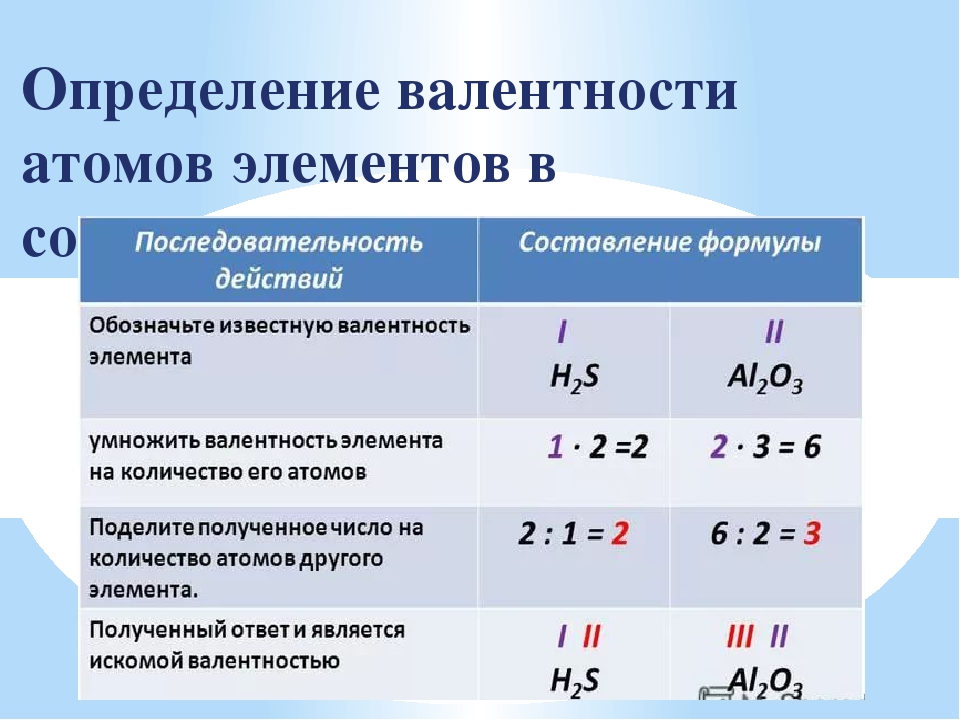 В соединениях с ковалентными связями
В соединениях с ковалентными связями
Ответить
Другие вопросы из категории
Читайте также
Aminko / 25 июля 2013 г., 4:38:35
А1. Число электронов в атоме элемента 1) соответствует массовому числу 3) определяет число изотопов 2) соответствует числу протонов в ядре 4)соответствует числу нейтронов в ядре А2. Радиус атома углерода больше радиуса атома 1) бериллия 2) азота 3) кремния 4) алюминия А3. Из предложенных выберете вещество, в котором осуществляется ионная связь 1) СаS 2) CO2 3) Al 4) N2 А4. Среди предложенного ряда веществ выберите кислотный оксид: 1) CO2 2) Al2O3 3) SiO 4) NO А5. Продолжите утверждение «Все щелочи – это …:» 1) жидкие летучие вещества 3) вещества, имеющие кислую реакцию среды в растворе 2) твердые, хорошо растворимые в воде вещества 4) вещества, которым соответствуют кислотные оксиды А6. В реакции CO → X → CuCO3→ X веществом Х является: 1) CuO 2) Cu(OH)2 3) CO2 4) [h3CO3] т.е. СО2 и h3 А7. Среди перечисленных реакций: С + O2 = CO2 CaO + h3O = Ca(OH)2 CaCO3 = CaO + CO2 2Mg + O2 = 2MgO число эндотермических процессов равно: 1) 1 2) 2 3) 3 4) 4 А8. Из приведенных пар веществ между собой реагируют: 1) Cu и h3SO4(разб.) 3) Nh4 и HCl 2) NaCl и h3SO4(разб.) 4) NaCl и K2SO4 А9. Среди предложенных веществ алкином является: 1) 2-метилбутан 3) бутен-1 2) 2,3-диметилгекс 4) пентин-2 В1. Установите соответствие между схемой окислительно-восстановительной реакции и веществом, которое является в ней окислителем Схема реакции Формула вещества-окислителя 1) h3S + SO2 = S + h3O А) h3S 2) h3S + O2 = SO2 + h3O Б) SO2 3) S + h3 = h3S В) O2 4) S + HNO3 = h3SO4 + NO Г) S Д) HNO3 В2. Установите соответствие между реагентами и ионно-молекулярным уравнением реакции. Реагенты Ионно-молекулярное уравнение 1) h3SO4 + KOH А) SO4 2- + Ba2+ = BaSO4 2) h3SO4 + AgNO3 Б) SO4 2- + 2Ag+ = Ag2SO4 3) Ca(OH)2 + h3SO4 = В) Ca2+ + SO4 2- = CaSO4 4) BaСl2 + h3SO4 Г) H+ + OH- = h3O Д) SO4 2- + Ca(OH)2 = Ca2+ + h3O + SO2 1 2 3 4 С1. Определите массовую долю и степень окисления азота в веществе, формула которого Nh5HSO4. Дайте название этому вещества и укажите класс соединений, к которому оно относится.
Из приведенных пар веществ между собой реагируют: 1) Cu и h3SO4(разб.) 3) Nh4 и HCl 2) NaCl и h3SO4(разб.) 4) NaCl и K2SO4 А9. Среди предложенных веществ алкином является: 1) 2-метилбутан 3) бутен-1 2) 2,3-диметилгекс 4) пентин-2 В1. Установите соответствие между схемой окислительно-восстановительной реакции и веществом, которое является в ней окислителем Схема реакции Формула вещества-окислителя 1) h3S + SO2 = S + h3O А) h3S 2) h3S + O2 = SO2 + h3O Б) SO2 3) S + h3 = h3S В) O2 4) S + HNO3 = h3SO4 + NO Г) S Д) HNO3 В2. Установите соответствие между реагентами и ионно-молекулярным уравнением реакции. Реагенты Ионно-молекулярное уравнение 1) h3SO4 + KOH А) SO4 2- + Ba2+ = BaSO4 2) h3SO4 + AgNO3 Б) SO4 2- + 2Ag+ = Ag2SO4 3) Ca(OH)2 + h3SO4 = В) Ca2+ + SO4 2- = CaSO4 4) BaСl2 + h3SO4 Г) H+ + OH- = h3O Д) SO4 2- + Ca(OH)2 = Ca2+ + h3O + SO2 1 2 3 4 С1. Определите массовую долю и степень окисления азота в веществе, формула которого Nh5HSO4. Дайте название этому вещества и укажите класс соединений, к которому оно относится.
Alinskittles / 04 янв. 2015 г., 20:35:20
1.Определите степень окисления указанного элемента в следующих соединениях:(хрома): К2CrO4, Сr2O3, K2Cr2O7, Сr2(SO4)3, СrO3, NaCrO2.
2. Укажите, в каких случаях в приведенных примерах происходит:
а) окисление; б) восстановление.
KMnO4—>MnO2; S—>SO2; NaBrO3—>Br2
3. В следующих уравнениях реакций определите окислитель и восстановитель, их степень окисления, расставьте коэффициенты:
а) K2MnO4+Cl2—>KMnO4+KCL;
б)Mg+Al(NO3)3—>Mg(NO3)2+Al;
в)KMnO4+h4PO4+h3SO4—>MnSO4+h4PO4+K2SO4+h3O.
Вы находитесь на странице вопроса «Укажите верное суждение:А)валетность определяется числом связей,которыми данный атом соединен с другими атомами.Б)степень окисления-это условный заряд«, категории «химия«. Данный вопрос относится к разделу «10-11» классов. Здесь вы сможете получить ответ, а также обсудить вопрос с посетителями сайта. Автоматический умный поиск поможет найти похожие вопросы в категории «химия«. Если ваш вопрос отличается или ответы не подходят, вы можете задать новый вопрос, воспользовавшись кнопкой в верхней части сайта.
Если ваш вопрос отличается или ответы не подходят, вы можете задать новый вопрос, воспользовавшись кнопкой в верхней части сайта.
Вольность с валентностью — NextMove Software
В области хеминформатики есть два понятия: неявное и явное, когда речь идет об атомах водорода. Первая концепция находится на уровне внутренней структуры данных, где каждый явный атом водорода хранится как объект-атом (как и любой другой элемент), а неявные атомы водорода, которые существуют только как поле подсчета водорода, связанное с родительским атомом. Вторая концепция связана с форматом файла или уровнем представления строчной нотации, где количество атомов водорода или валентность либо явно указывается, либо наоборот.кодировки, в которых количество водорода неявно определяется некоторой (часто недокументированной) моделью валентности. Существование этих двух связанных, но независимых концепций — недавнее личное осознание после того, как я обнаружил, что то, что я ранее называл «явным водородом», отличается от того, что OpenBabel или RDKit называют явным водородом.
Чтобы продемонстрировать разницу, рассмотрим следующие три УЛЫБКИ для метана: «C», «[Ch5]» и «[H] [C] ([H]) ([H]) [H]». Все эти УЛЫБКИ представляют собой одну и ту же молекулу.Большинство (?) Хеминформатиков представляли бы первый как единый атом внутри, где и представление, и подсчет неявно; второй — одним атомом, где представление неявно, но счет явным, и третий — пятью атомами, где атомы водорода явными. Я говорю, что большинство инструментальных средств делает жизнь интересной, OpenBabel выделяет настоящие атомы водорода для «[Ch5]», и столь же сбивает с толку инструментарий OpenEye OEChem, который выделяет реальный атом водорода для неявных атомов водорода у атомов с заданной стереохимией, т.е.е. как в «[C @ H]» и «[C @@ H]».
Интересным побочным эффектом вышеупомянутого различия является то, что молекулярный водород, самая распространенная молекула в наблюдаемой Вселенной, может быть представлен либо «[H] [H]», либо «[HH]».
Хотя это описывается применительно к SMILES, точно такое же различие имеет место и для форматов файлов таблиц соединений, таких как формат файлов MDL / Symyx mol. Эквивалентные три варианта метана могут быть созданы в виде файлов с явными записями / строками атомов для атомов водорода, в виде одной строки атома углерода с явной валентностью четыре и в виде строки одного атома углерода с валентностью по умолчанию (заданной как ноль в столбцах vvv блока атомов).Важно соблюдать валентное поле vvv в файле MDL / Symyx mol, поскольку, например, «металлический натрий» и «гидрид натрия» представлены таблицами соединений с одной линией атома, различающейся только своей валентностью.
Эквивалентные три варианта метана могут быть созданы в виде файлов с явными записями / строками атомов для атомов водорода, в виде одной строки атома углерода с явной валентностью четыре и в виде строки одного атома углерода с валентностью по умолчанию (заданной как ноль в столбцах vvv блока атомов).Важно соблюдать валентное поле vvv в файле MDL / Symyx mol, поскольку, например, «металлический натрий» и «гидрид натрия» представлены таблицами соединений с одной линией атома, различающейся только своей валентностью.
Когда вещи становятся увлекательными (также известными как проблемные), это случаи, которые Дональд Рамсфельд мог бы назвать «неявными имплицитами», где (часто для экономии места) количество водорода должно быть получено из окружающей среды атома; в частности его атомный номер, формальный заряд и порядки облигаций, в которых он участвует.Это мир валентной модели .
Валентная модель используется для определения (вывода) количества атомов водорода, неявно связанных с атомом. Например, нейтральный углерод можно считать четырехвалентным, подразумевая, что нейтральный углерод с двумя явными одинарными связями должен иметь два неявных атома водорода.
Например, нейтральный углерод можно считать четырехвалентным, подразумевая, что нейтральный углерод с двумя явными одинарными связями должен иметь два неявных атома водорода.
Миф №1: существует единственная универсальная валентная модель.
Распространенное заблуждение состоит в том, что существует или может существовать единственная валентная модель для химической информатики.Реальность такова, что многие поставщики и наборы инструментов для хеминформатики реализуют свои собственные интерпретации химической валентности, и для правильного взаимодействия с этими наборами инструментов требуется сопоставление собственных моделей. В качестве простого доказательства рассмотрим нейтральный йод с четырьмя одинарными связями с ним, то есть «CI (C) (C) C». В модели валентности дневного света он не имеет неявных водородов и эквивалентен «C [I] (C) (C) C», но в модели валентности MDL нейтральный йод потенциально одно-, трех- и пятивалентный, поэтому это соединение имеет один неявный водород и, следовательно, эквивалентен «C [IH] (C) (C) C».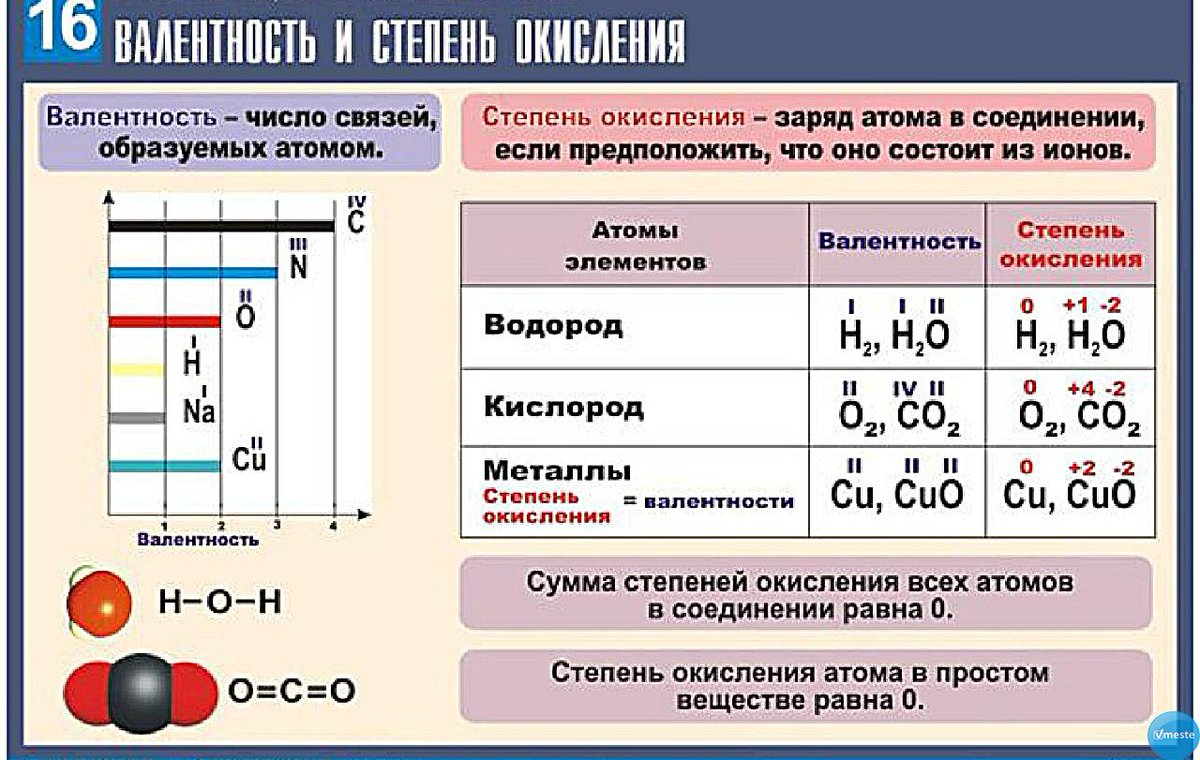 Эти два случая показывают, что одну «модель» или функцию нельзя использовать для обработки файлов SMILES и MDL. подобно моделям ароматичности, определения должны соответствовать формату файла поставщика.
Эти два случая показывают, что одну «модель» или функцию нельзя использовать для обработки файлов SMILES и MDL. подобно моделям ароматичности, определения должны соответствовать формату файла поставщика.
Миф № 2: Модели валентности следуют простым шаблонам.
Дмитрий Менделеев упростил всю проблему химии, показав, что элементы можно удобно расположить в периодической таблице, чтобы помочь предсказать их свойства. Но такие шаблоны могут быть обманчивыми. Если наблюдать, что кислород, который обычно имеет валентность два в нейтральной форме, становится трехвалентным как катион (+1 формальный заряд) и одновалентным как анион (-1 формальный заряд), и тот азот, который обычно является трехвалентным, когда нейтральный, становится четырехвалентным как катион и двухвалентным как анион, можно перейти к очевидному правилу: что катионы имеют валентность на единицу выше, чем нейтральная форма, а анионы имеют валентность на единицу меньше.Экстраполяция этой закономерности предсказывает, что анион углерода будет трехвалентным (что правильно), а катион углерода будет пятивалентным (что неверно).
На самом деле правда намного ближе к мнению Менделеева о периодической таблице. Катион элемента (с одним электроном меньше) изоэлектронен (и поэтому имеет тенденцию вести себя как) элемент слева от него в периодической таблице, а анион (с еще одним электроном) изоэлектронен элементу справа от него.Это предсказывает, что N + имеет ту же валентность, что и нейтральный углерод, а N — имеет ту же валентность, что и нейтральный кислород. Что еще более важно, он показывает, что C — ведет себя как азот (трехвалентный) и что C + ведет себя как бор (также трехвалентный).
Увы, в реальном мире хеминформатики жизнь намного сложнее, поскольку модель валентности MDL определяет разные валентности даже для изоэлектронных состояний элемент / заряд. Ожидается, что нейтральный таллий и свинец (+1) будут иметь одинаковый набор валентностей, но первый является 1- и 3-валентным, а последний — только 3-валентным.Лучшее, что можно сделать, — это явно закодировать сложные модели валентности, такие как MDL, в виде больших таблиц и перечислить применимые случаи.
Окончательный арбитр модели валентности — автор формата файла; следовательно, Daylight определяет (и документирует) модель валентности для SMILES, MDL / Symyx / Accelrys определяет модель валентности для файлов Mol, CambridgeSoft / PKI определяет модель валентности для файлов ChemDraw, а Tripos определяет модель валентности для файлов Sybyl Mol2. Простой способ определить «правильную» валентность MDL / Symyx для атома — это нарисовать элемент и формальный заряд в ISIS / Draw, Symyx / Draw или Accelrys / Draw и выбрать «AutoPosition Hydrogens».
Миф № 3: Таблица соединений, представляющая молекулу, интерпретируется одинаково всеми программами.
В то время как большинство программ хеминформатики имеют тенденцию согласовывать валентности общих элементов и зарядовых состояний, таких как нейтральный углерод и четвертичный аммоний, они начинают быстро расходиться по мере того, как все идет от основной органической химии. Рассмотрим атом бора с формальным зарядом -4, который, согласно модели валентности MDL / Symyx, следует интерпретировать как одновалентный. В конце 2012 года OEChem OpenEye рассматривал B 4- как нулевую валентность, OpenBabel рассматривал ее как трехвалентную, а RDKit — как семивалентную. Одна и та же таблица соединений приводит к четырем различным молекулярным формулам в четырех разных программах.
В конце 2012 года OEChem OpenEye рассматривал B 4- как нулевую валентность, OpenBabel рассматривал ее как трехвалентную, а RDKit — как семивалентную. Одна и та же таблица соединений приводит к четырем различным молекулярным формулам в четырех разных программах.
Чтобы оценить уровень согласованности в сообществе химинформатиков при интерпретации таблиц соединений, я провел простой эксперимент и представил результаты небольшого теста «mdlbench» на встрече группы пользователей RDKit 2012 в Лондоне.Во-первых, большое спасибо Грегу Ландруму за предоставленную мне возможность выступить, а также многочисленным разработчикам наборов инструментов, которые щедро помогли в тестировании и настройке своего программного обеспечения. При оценке учитывались 199 уникальных типов атомов, наблюдаемых в базе данных Accerlys MDDR о лекарствах и подобных лекарствам молекул, и сравнивалась их интерпретация не менее чем 24 различными наборами / программами по химии (mdlbench.sdf и mdlbench. smi). Разнообразие результатов было неожиданностью даже для меня, а некоторые цифры — шоком; Я определенно не ожидал, что набор инструментов, любезно организовавший встречу, RDKit, окажется внизу списка.[Уже нет, читайте…]
smi). Разнообразие результатов было неожиданностью даже для меня, а некоторые цифры — шоком; Я определенно не ожидал, что набор инструментов, любезно организовавший встречу, RDKit, окажется внизу списка.[Уже нет, читайте…]
Чтобы продемонстрировать примеры различий: Bi 2+ с одинарной одинарной связью встречается 7266 раз в MDDR 2011.2 и определяется MDL / Symyx как трехвалентный и, следовательно, имеет два неявных атома водорода. ChemDraw, Corina, Pipeline Pilot и Dotmatics Pinpoint не добавляют неявных атомов водорода, в то время как ChemAxon и RDKit добавляют четыре вместо двух. B 2- с простой одинарной связью встречается 370 раз и снова должен быть трехвалентным с двумя неявными атомами водорода.GGA Indigo не добавляет неявных водородов, тогда как Daylight, RDKit, ChemAxon и Pipeline Pilot v8.5 добавляют четыре неявных атома водорода. Интересно, что этот случай был исправлен в грядущей версии Pipeline Pilot v9, что является дивидендом для сообщества Accelrys, приобретающего Symyx.
Миф №4: В хеминформатике все сломано, и ничего нельзя сделать, чтобы это исправить.
На самом деле все не так плохо, как кажется — анализ mdlbench показал, что на подавляющее большинство молекул не влияют различия между наборами инструментов — но, что наиболее важно, упражнение выявило большую степень сотрудничества между разработчиками в улучшении взаимодействия между инструментами.Наиболее важно, что проекты с открытым исходным кодом Open Babel и RDKit с тех пор приняли исправления (Open Babel mdlvalence.h, RDKit MDLValence.h) для полной реализации модели валентности MDL и теперь достигли идеальных 100% в этом тесте. Коммерческие разработчики InfoChem и Optibrium внесли улучшения в свои программы чтения файлов MDL, как и проект инструментов MayaChem, и фармацевтические компании даже запросили копии теста «mdlbench» для проверки их собственных усилий по разработке инструментов.Хорошая новость для сообщества заключается в том, что теперь меньше «искажений» химии при обмене данными между программами, поэтому молекулы, считываемые из PubChem или ChEMBL в ваши программы анализа или редакторы, с большей вероятностью будут соответствовать молекулам, которые предназначались NCBI или EBI. им быть.
им быть.
Валентных электронов
Ковалент Облигация
Валентные электроны
Электроны во внешней оболочке имеют валентность . электроны электроны на атоме, которые могут быть получены или теряется в химической реакции.Так как заполнено d или f подоболочки редко нарушаются в химической реакции, мы можем определить валентные электроны следующим образом: Электроны на атоме которые не присутствовали в предыдущем инертном газе, без учета заполненных d или f подоболочки.
Галлий имеет следующий электрон конфигурация.
Ga: [Ar] 4 с 2 3 d 10 4 p 1
4 s и 4 p электронов могут быть потеряны в
химическая реакция, но не электроны в заполненном 3 d подоболочка. Таким образом, галлий имеет три валентных электрона.
Таким образом, галлий имеет три валентных электрона.
Ковалентная связь
Атомы могут объединяться для получения октета валентных электронов за счет обмен электронами. Например, два атома фтора могут образовывать стабильная молекула F 2 , в которой каждый атом имеет октет валентные электроны, разделяя пару электронов.
Пара атомов кислорода может образовывать молекулу O 2 в который каждый атом имеет в общей сложности восемь валентных электронов, разделяя две пары электронов.
Термин ковалентная связь используется для описания связей в соединения, которые являются результатом совместного использования одной или нескольких пар электроны.
Как разделить Электроны Связи Атомы
Чтобы понять, как пара электронов может удерживать атомы
вместе давайте посмотрим на простейшую ковалентную связь, которая образует
когда два изолированных атома водорода объединяются, чтобы сформировать H 2 молекула.
ч + ч H-H
Изолированный атом водорода содержит один протон и один электрон. удерживаются вместе силой притяжения между противоположными заряженные частицы. Величина этой силы равна произведение заряда на электрон ( q e ) умноженный на заряд протона ( q p ) деленное на квадрат расстояния между этими частицами ( r 2 ).
Когда пара изолированных атомов водорода объединяется, две новые силы притяжения появляются из-за притяжения между электроном одного атома и протоном другого.
Но две силы отталкивания также создаются, потому что две отрицательно заряженные электроны отталкиваются друг от друга, как и два положительно заряженные протоны.
Может показаться, что две новые силы отталкивания уравновесят
две новые силы притяжения.Если это произошло, H 2 молекула была бы не более стабильной, чем пара изолированных водородных
атомы. Но есть способы, которыми силы отталкивания могут быть
сведены к минимуму. Как мы видели, электроны ведут себя так, как если бы они были вершинами
крутится на оси. Так же, как есть два способа, которыми верх
может вращаться, есть два возможных состояния для спина
электрон: с = + 1 / 2 и с = — 1 / 2 .Когда электроны спарены так, что имеют противоположные спины,
сила отталкивания между этими электронами сведена к минимуму.
Но есть способы, которыми силы отталкивания могут быть
сведены к минимуму. Как мы видели, электроны ведут себя так, как если бы они были вершинами
крутится на оси. Так же, как есть два способа, которыми верх
может вращаться, есть два возможных состояния для спина
электрон: с = + 1 / 2 и с = — 1 / 2 .Когда электроны спарены так, что имеют противоположные спины,
сила отталкивания между этими электронами сведена к минимуму.
Сила отталкивания между протонами может быть минимизирована размещение пары электронов между двумя ядрами. В расстояние между электроном на одном атоме и ядром другое теперь меньше, чем расстояние между двумя ядрами. Так как в результате сила притяжения между каждым электроном и ядро другого атома больше, чем сила отталкивания между двумя ядрами, пока ядра не переносятся слишком Близко к друг другу.
Чистый результат спаривания электронов и их размещения
между двумя ядрами есть система, которая более устойчива, чем
пара изолированных атомов, если ядра расположены достаточно близко друг к другу, чтобы
разделяют пару электронов, но не так близко, что отталкивание
между ядрами становится слишком большим. Атомы водорода в H 2 молекулы поэтому удерживаются вместе (или связаны) за счет общего
пары электронов, и эта связь является наиболее прочной, когда
расстояние между двумя ядрами составляет около 0.074 нм.
Атомы водорода в H 2 молекулы поэтому удерживаются вместе (или связаны) за счет общего
пары электронов, и эта связь является наиболее прочной, когда
расстояние между двумя ядрами составляет около 0.074 нм.
Сходства и Различия между ионными и ковалентными соединениями
Существует значительная разница между физическими свойства NaCl и Cl 2 , как показано в таблице ниже, что является следствием разницы между ионными связями в NaCl и ковалентными связями в Cl 2 .
Некоторые физические свойства NaCl и Cl 2
| N AC | Класс 2 | |||
| Фаза при комнатной температуре | цельный | Газ | ||
| Плотность | 2. 165 г / см 3 165 г / см 3 | 0,003214 г / см 3 | ||
| Температура плавления | 801C | -100,98C | ||
| Температура кипения | 1413C | -34,6C | ||
| Способность к водному раствор для проведения электричества | Поведение | Не проводит |
Каждый ион Na + в NaCl окружен шестью ионами Cl — .
ионы, и наоборот, как показано на рисунке ниже.Удаление
ион из этого соединения, следовательно, включает разрушение по крайней мере шести
облигации. Некоторые из этих связей должны быть разорваны, чтобы расплавить NaCl,
и все они должны быть разбиты, чтобы сварить это соединение. Как
в результате ионные соединения, такие как NaCl, имеют тенденцию к плавлению
точки и температуры кипения. Таким образом, ионные соединения являются твердыми
при комнатной температуре.
Как
в результате ионные соединения, такие как NaCl, имеют тенденцию к плавлению
точки и температуры кипения. Таким образом, ионные соединения являются твердыми
при комнатной температуре.
Cl 2 состоит из молекул, в которых один атом плотно привязан к другому, как показано на рисунке выше.В ковалентные связи внутри этих молекул по крайней мере так же прочны, как ионная связь, но нам не нужно разрывать эти ковалентные связи, чтобы отделить одну молекулу Cl 2 от другой. Как результат, Cl 2 гораздо проще расплавить до жидкости или закипеть он образует газ, а Cl 2 — газ в помещении температура.
Разница между ионными и ковалентными связями также объясняет почему водные растворы ионных соединений проводят электричество, в то время как водные растворы ковалентных соединений — нет.Когда соль растворяется в воде, ионы переходят в раствор.
| H 2 O | ||
| NaCl ( с ) | Na + ( водн. ) + Cl — ( водн. ) ) + Cl — ( водн. ) |
Эти ионы могут проходить через раствор, производя электрический ток, замыкающий цепь.Когда ковалентный соединение растворяется в воде, нейтральные молекулы выделяются в раствор, который не может проводить электрический ток.
| H 2 O | ||
| C 12 H 22 O 11 ( с ) | C 12 H 22 O 11 ( водн. ) |
Когда два атома хлора соединяются, образуя ковалентную связь,
каждый атом вносит один электрон, чтобы сформировать пару электронов
разделены поровну между двумя атомами, как показано на рисунке ниже.Когда атом натрия соединяется с атомом хлора с образованием ионного
связи, каждый атом по-прежнему вносит один электрон, чтобы сформировать пару
электронов, но эта пара электронов не является общей для двух
атомы. Электроны проводят большую часть своего времени на хлоре.
атом.
Электроны проводят большую часть своего времени на хлоре.
атом.
Ионные и ковалентные связи различаются по степени, в которой пара электронов разделяют атомы, образующие связь. Когда один атомов гораздо лучше притягивает электроны к себе чем другой, связь ионная .Когда атомы примерно равны по своей способности притягивать электроны к сами атомы разделяют пару электронов более или менее равно, и связь ковалентная . Как правило большого пальца, металлы часто реагируют с неметаллами с образованием ионных соединений или соли и неметаллы соединяются с другими неметаллами с образованием ковалентные соединения. Это практическое правило полезно, но оно также наивно по двум причинам.
- Единственный способ узнать, является ли соединение ионным или ковалентный — это измерение относительной способности атомов притягивать связанные электроны к себе.
- Любая попытка разделить соединения всего на два класса
(ионные и ковалентные) обречены на провал, потому что
связь во многих соединениях находится между этими двумя
крайности.

Первое ограничение лежит в основе концепции электроотрицательность. Второй служит основой концепции полярности.
Электроотрицательность
Относительная способность атома притягивать электроны в связь. по отношению к себе называется электроотрицательностью атома.Атомы с большой электроотрицательностью (например, F и O) привлекают электроны в связи лучше, чем те, которые имеют небольшие электроотрицательности (например, Na и Mg). Электроотрицательность элементов основной группы приведены на рисунке ниже.
Когда величина электроотрицательностей основных группа элементов добавляется в периодическую таблицу в качестве третьей оси, мы получите результаты, показанные на рисунке ниже.
В данных двух вышеупомянутых цифры.
- Электроотрицательность регулярно возрастает от
слева направо по строке периодической таблицы.

- Электроотрицательность уменьшается вниз по столбцу периодической Таблица.
Использование Электроотрицательность для идентификации ионной, ковалентной и полярной ковалентной Соединения
Когда разница между электроотрицательностями элементы в соединении относительно большие, соединение лучше всего классифицируется как ионный .
Пример: NaCl, LiF и SrBr 2 являются хорошими примерами ионные соединения. В каждом случае электроотрицательность неметалл по крайней мере на две единицы больше, чем металл.
| NaCl | LiF | SrBr 2 | ||||||
| Класс | EN = 3. 16 16 | Ф | EN = 3,98 | Br | EN = 2,96 | |||
| Na | EN = 0,93 | Ли | EN = 0,98 | Sr | EN = 0.95 | |||
| EN = 2,23 | EN = 3,00 | EN = 2.01 |
Таким образом, мы можем предположить чистый перенос электронов из
металл к неметаллу с образованием положительных и отрицательных ионов и
запишите структуры Льюиса этих соединений, как показано в
рисунок ниже.
Все эти соединения имеют высокие температуры плавления и кипения. баллов, как и следовало ожидать для ионных соединений.
| NaCl | LiF | SrBr 2 | ||||
| MP | 801 o C | 846 o C | 657 o C | |||
| БП | 1413 o C | 1717 o С | 2146 o C |
Они также растворяются в воде с образованием водных растворов, которые
провести электричество, как и следовало ожидать.
Когда электроотрицательности элементов в соединении равны примерно одинаково, атомы разделяют электроны, а вещество ковалентно .
Пример: Примеры ковалентных соединений включают метан (CH 4 ), диоксид азота (NO 2 ) и диоксид серы (SO 2 ).
| Канал 4 | НЕТ 2 | СО 2 | |||||||
| С | EN = 2. 55 55 | O | EN = 3,44 | O | EN = 3,44 | ||||
| H | EN = 2,20 | N | EN = 3,04 | S | EN = 2.58 | ||||
| EN = 0,35 | EN = 0.40 | EN = 0,86 |
Эти соединения имеют относительно низкие температуры плавления и кипения. точек, как и следовало ожидать для ковалентных соединений, и они
все газы комнатной температуры.
точек, как и следовало ожидать для ковалентных соединений, и они
все газы комнатной температуры.
| Канал 4 | НЕТ 2 | СО 2 | |||
| MP | -182.5 o С | -163,6 o С | -75,5 o С | ||
| БП | -161,5 o С | -151,8 o С | -10 o С |
Неизбежно должны быть соединения, которые попадают между этими
крайности.Для этих соединений разница между
электроотрицательность элементов достаточно велика, чтобы быть
значительный, но недостаточно большой, чтобы классифицировать соединение как
ионный. Возьмем, к примеру, воду.
Возьмем, к примеру, воду.
| H 2 O | ||
| O | EN = 3,44 | |
| H | EN = 2.20 | |
| EN = 1,24 |
Вода не является ни чисто ионной, ни чисто ковалентной. Это не содержат положительные и отрицательные ионы, как указывает Льюис структура слева на рисунке ниже. Но электроны не делятся поровну, как указывает структура Льюиса на прямо на этом рисунке.Воду лучше всего описать как полярную соединение . Один конец или полюс молекулы имеет частичный положительный заряд (+), а другой конец имеет частичный отрицательный заряд (-).
Как правило, при разнице между
электроотрицательности двух элементов меньше 1,2, полагаем
что связь между атомами этих элементов ковалентная . Если разница больше 1,8, предполагается, что облигация ионный .Соединения, для которых электроотрицательность
разница между 1,2 и 1,8 лучше всего описывается как полярный ,
или полярный ковалентный .
Если разница больше 1,8, предполагается, что облигация ионный .Соединения, для которых электроотрицательность
разница между 1,2 и 1,8 лучше всего описывается как полярный ,
или полярный ковалентный .
| Ковалент: | EN | <1,2 | ||
| Полярный: | 1,2 < | EN | <1.8 | |
| Ионный: | EN | > 1,8 |
| Практическая задача 2: Использование
электроотрицательности, чтобы решить, будут ли следующие
соединения лучше всего описывать как ковалентные, ионные,
или полярный. (а) Цианид натрия (NaCN) (б) Декасульфид тетрафосфора (P 4 S 10 ) (c) Окись углерода (CO) (d) Тетрахлорид кремния (SiCl 4 ) Нажмите здесь, чтобы проверить свой ответ на практическую задачу 2 |
Ограничения Концепция электроотрицательности
Электроотрицательность суммирует тенденцию элемента к
приобретать, терять или делиться электронами, когда он объединяется с другим
элемент.Но есть пределы успеха, с которым это может быть
применяется. BF 3 ( EN = 1,94) и SiF 4 ( EN = 2,08),
например, имеют различия в электроотрицательности, которые приводят нас к
ожидать, что эти соединения будут вести себя так, как если бы они были ионными, но оба
соединения ковалентны. Это оба газы при комнатной температуре,
и их точки кипения составляют -99,9 o C и -86 o C,
соответственно.
Это оба газы при комнатной температуре,
и их точки кипения составляют -99,9 o C и -86 o C,
соответственно.
Источник этой проблемы в том, что каждому элементу присвоено только одно значение электроотрицательности, которое используется для всех его соединения.Но фтор менее электроотрицателен, когда он связывается с полуметаллы (такие как B или Si) или неметаллы (например, C), чем когда он связывается с металлами (такими как Na или Mg).
Эта проблема снова возникает, когда мы смотрим на элементы, которые образуют соединения в более чем одной степени окисления. TiCl 2 и MnO, например, обладают многими свойствами ионного соединения. Оба они твердые при комнатной температуре, и они имеют очень высокие температуры плавления, как и ожидалось для ионных соединений.
| TiCl 2 | MnO | ||||
| MP = 1035 o C | MP = 1785 o C |
TiCl 4 и Mn 2 O 7 , с другой стороны
стороны, оба являются жидкостями при комнатной температуре с точками плавления
ниже 0 o C и относительно низких температур кипения, возможно
следует ожидать для ковалентных соединений.
| TiCl 4 | Mn 2 O 7 | ||
| MP = -24,1 o C | MP = -20 o C | ||
| Б.П. = 136.4 o С | BP = 25 o C |
Принципиальное различие между этими соединениями — степень окисления металла. Как степень окисления атома становится больше, так же как и его способность привлекать электроны в связь к себе. Другими словами, атомы титана в окислении +4 состояние и атомы марганца в степени окисления +7 больше электроотрицательна, чем атомы титана и марганца при окислении состояние +2.
По мере увеличения степени окисления металла
разница между электроотрицательностями металла и
неметалл, с которым он сочетается, уменьшается. Облигации в
соединения, которые образуют эти элементы, поэтому становятся менее ионными (или
более ковалентный).
Облигации в
соединения, которые образуют эти элементы, поэтому становятся менее ионными (или
более ковалентный).
T he Разница между полярными связями и полярными молекулами
Разница между электроотрицательностями хлора ( EN = 3.16) и водорода ( EN = 2,20) достаточно велики, чтобы что связь в HCl полярная.
Поскольку она содержит только эту связь, молекула HCl может также можно назвать полярным.
Полярность молекулы может быть определена путем измерения
величина известная как дипольный момент , который зависит от двух
факторы: (1) величина разделения заряда и (2)
расстояние между отрицательным и положительным полюсами
молекула.Сообщается, что дипольные моменты равны дебай ( d ).
Дипольный момент для HCl невелик: = 1.08 d . Это может
следует понимать, отметив, что разделение заряда в HCl
связь относительно мала ( EN = 0,96) и что связь H-Cl
относительно короткий.
C-Cl ( EN = 0,61) не так полярны, как связи H-Cl ( EN = 0,96), но они значительно длиннее. В результате дипольный момент для CH 3 Cl примерно такое же, как HCl: = 1.01 д . На первый взгляд можно было ожидать подобный дипольный момент для четыреххлористый углерод (CCl 4 ), содержащий четыре полярных Связи C-Cl. Однако дипольный момент CCl 4 равен 0. Это можно понять, рассматривая структуру CCl 4 . показано на рисунке ниже. Отдельные связи C-Cl в этом молекулы полярны, но четыре диполя C-Cl компенсируют друг друга. Таким образом, тетрахлорметан иллюстрирует важный момент: Не все молекулы, содержащие полярные связи, обладают дипольным моментом.
(IUCr) Параметры валентности связи, чувствительные к мягкости связи для проверки достоверности кристаллической структуры
1. Введение
1.1. Мотивация и цель
Эмпирические зависимости между длиной R M — X связи между катионом M и анионом X и его валентностью s ,
равны широко используется в кристаллохимии для определения вероятных положений равновесия для атома как тех мест, для которых сумма валентных связей (BVS) атома соответствует модулю его степени окисления. Следуя Брауну и Альтерматту (1985), условно только взаимодействия в первой координационной оболочке считаются способствующими BVS катиона. В нашей более ранней работе мы предложили систематическую корректировку параметров валентности связи в соответствии с ее мягкостью (Adams, 2001; Adams & Swenson, 2002; Brown, 2009) и опубликовали набор параметров softBV , который реализует систематическое изменение мягкости параметр b вместе с R 0 , который также влияет на взаимодействия с противоионами в более высоких координационных сферах (Adams, 2014).Совсем недавно другие авторы также предложили наборы параметров валентности связи с гибкими параметрами валентности связи R 0 и b , в первую очередь Gagné & Hawthorne (2015).
Следуя Брауну и Альтерматту (1985), условно только взаимодействия в первой координационной оболочке считаются способствующими BVS катиона. В нашей более ранней работе мы предложили систематическую корректировку параметров валентности связи в соответствии с ее мягкостью (Adams, 2001; Adams & Swenson, 2002; Brown, 2009) и опубликовали набор параметров softBV , который реализует систематическое изменение мягкости параметр b вместе с R 0 , который также влияет на взаимодействия с противоионами в более высоких координационных сферах (Adams, 2014).Совсем недавно другие авторы также предложили наборы параметров валентности связи с гибкими параметрами валентности связи R 0 и b , в первую очередь Gagné & Hawthorne (2015).
В этом контексте решение о том, следует ли учитывать слабые взаимодействия с более удаленными противоионами за пределами первой координационной оболочки при определении параметров валентности связи, в основном зависит от цели расчетов BVS. В то время как для моделирования путей переноса ионов в виде областей с несоответствием валентных связей и низкими энергиями узлов валентных связей требуется самосогласованное отсечение, которое предотвращает появление артефактов на границе между координационными оболочками (Adams, 2001). Более простой критерий отсечения первой координационной оболочки может во многих случаях быть достаточным, если цель состоит в том, чтобы просто проверить правдоподобие кристаллической структуры, где можно ожидать, что атомы будут расположены в локальных минимумах рассогласования BVS.
В то время как для моделирования путей переноса ионов в виде областей с несоответствием валентных связей и низкими энергиями узлов валентных связей требуется самосогласованное отсечение, которое предотвращает появление артефактов на границе между координационными оболочками (Adams, 2001). Более простой критерий отсечения первой координационной оболочки может во многих случаях быть достаточным, если цель состоит в том, чтобы просто проверить правдоподобие кристаллической структуры, где можно ожидать, что атомы будут расположены в локальных минимумах рассогласования BVS.
С точки зрения определения соответствующих параметров валентности связи R 0 и b , однако, традиционный подход первой координационной оболочки влечет за собой серьезную проблему: он серьезно ограничивает диапазон длин взаимодействий, возникающих в наборы данных эталонной структуры, которые не только влияют на значение параметра валентности связи R 0 [ то есть расстояние, соответствующее отдельной валентности связи, равной 1 единице валентности (v.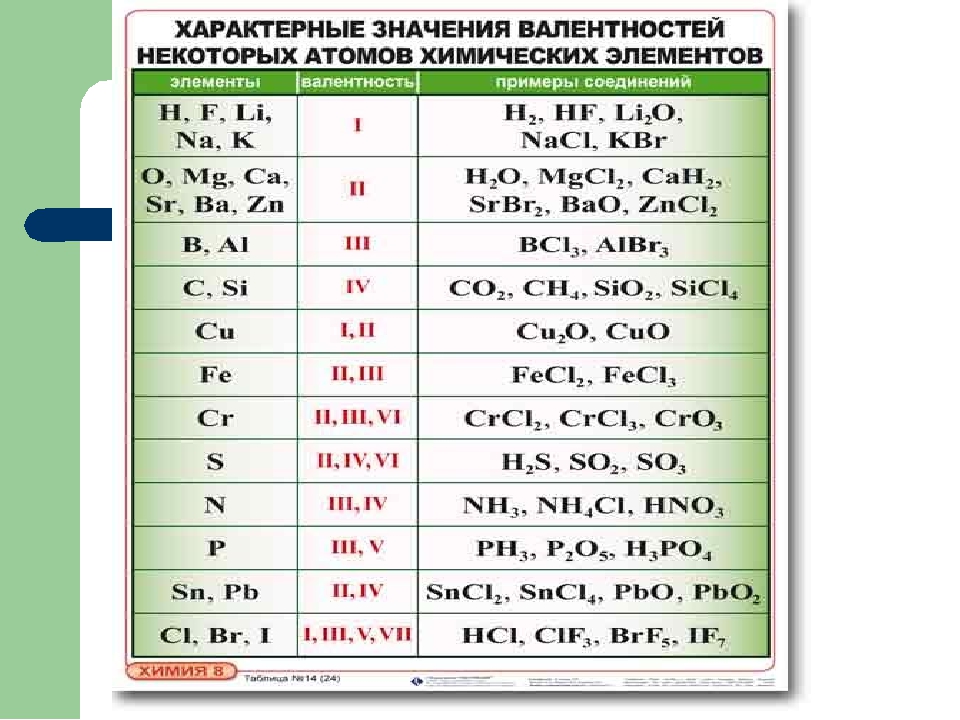 u.), которое не следует ошибочно принимать за типичное расстояние связи], это также делает более трудным (или даже принципиально невозможным в случае катионов, которые встречаются только в одном типе высокосимметричной координации) определение подходящего значения параметр валентности связи b . Более того, ограничение взаимодействий первой координационной оболочкой также связано с проблемой того, что этот предел координационной оболочки должен определяться систематическим и беспристрастным образом, поскольку непоследовательный или систематически предвзятый выбор границ координационной оболочки может вызывать значительные неточности.Это особенно проблема, когда необходимо использовать компиляцию параметров валентности связи из разных источников с использованием разных определений первой координационной оболочки. Таким образом, становится желательным (i) получить исчерпывающий набор параметров валентности связи с использованием последовательного подхода, (ii) вывести рациональный и последовательный подход для решения, до какого предельного расстояния взаимодействие катион-анион должно быть включено в BVS и (iii) для включения дополнительной информации о безопасности при выборе параметра мягкости сцепления b .
u.), которое не следует ошибочно принимать за типичное расстояние связи], это также делает более трудным (или даже принципиально невозможным в случае катионов, которые встречаются только в одном типе высокосимметричной координации) определение подходящего значения параметр валентности связи b . Более того, ограничение взаимодействий первой координационной оболочкой также связано с проблемой того, что этот предел координационной оболочки должен определяться систематическим и беспристрастным образом, поскольку непоследовательный или систематически предвзятый выбор границ координационной оболочки может вызывать значительные неточности.Это особенно проблема, когда необходимо использовать компиляцию параметров валентности связи из разных источников с использованием разных определений первой координационной оболочки. Таким образом, становится желательным (i) получить исчерпывающий набор параметров валентности связи с использованием последовательного подхода, (ii) вывести рациональный и последовательный подход для решения, до какого предельного расстояния взаимодействие катион-анион должно быть включено в BVS и (iii) для включения дополнительной информации о безопасности при выборе параметра мягкости сцепления b .
Поэтому в этой работе мы выводим и исследуем новый более простой способ расчета набора параметров, чувствительных к мягкости связи, с именем softNC1 , где мы уточняем только R 0 с использованием подхода первой координационной оболочки и комбинируем его с неизменным значением. из b , который мы ранее нашли для набора параметров softBV , где включение вкладов от более высоких координационных оболочек позволило для достаточно широкого диапазона расстояний взаимодействия и во многих случаях позволило несмещенное определение отдельных значений b , а оттуда выявили систематическую корреляцию мягкости связи с абсолютной мягкостью взаимодействующих ионов.В то же время мы стремимся установить руководящие принципы для дальнейшего определения набора параметров валентности связи. Затем качество прогнозов, полученных на основе нового набора параметров softNC1 , сравнивается как с полным, слегка обновленным набором параметров softBV , так и с «обычным» набором параметров, который следует традиционным подходам универсального выбора b = 0,37 Å, которая учитывает только взаимодействия в первой координационной сфере. Новый набор параметров также позволит количественно оценить, остается ли учет различий в мягкости склеивания через систематической корректировкой значений b даже при упрощении расчетов BV за счет рассмотрения только взаимодействий в пределах первой координационной оболочки.
Новый набор параметров также позволит количественно оценить, остается ли учет различий в мягкости склеивания через систематической корректировкой значений b даже при упрощении расчетов BV за счет рассмотрения только взаимодействий в пределах первой координационной оболочки.
1.2. Функциональный подход электронной плотности к валентности связи. 0 и b для пары катион-анион (или, более строго говоря, кислота Льюиса-основание Льюиса) должна — в принципе — быть предсказуемой a priori . Более подробное обсуждение этого аспекта можно найти в нашей недавней работе (Adams, 2014): когда два атома приближаются друг к другу на большом расстоянии, часть интегральной электронной плотности пары атомов, которая находится в области связывания, и, следовательно, сила взаимодействия увеличится.Таким образом, легко исследовать связь между валентностью связи и электронной плотностью. В то время как внутри атомного остова плотность электронов ρ ( r ) является сложной зависимой от ориентации функцией расстояния r от его центра, для больших расстояний, относящихся к межатомным взаимодействиям, она будет подчиняться функции экспоненциального распада, где энергия ионизации IE атома контролирует распад электронной плотности (Morrell et al. , 1975). На основе этого наблюдения концепции пути связи (BP) и критической точки связи (BCP) были разработаны в «квантовой теории атомов в молекулах» Бадера (см. , например, Bader, 1990; Weinhold, 2012). Электронная плотность круто убывает вдоль пути связи BP ( r ) от ядра атома к стационарной точке, BCP. Плотность электронов на BCP, а также ее лапласиан, являются экспериментальными наблюдаемыми величинами, доступными с помощью дифракции рентгеновских лучей, и могут также быть рассчитаны ab initio как контрольные точки для обоснования выбора параметров BV.
, 1975). На основе этого наблюдения концепции пути связи (BP) и критической точки связи (BCP) были разработаны в «квантовой теории атомов в молекулах» Бадера (см. , например, Bader, 1990; Weinhold, 2012). Электронная плотность круто убывает вдоль пути связи BP ( r ) от ядра атома к стационарной точке, BCP. Плотность электронов на BCP, а также ее лапласиан, являются экспериментальными наблюдаемыми величинами, доступными с помощью дифракции рентгеновских лучей, и могут также быть рассчитаны ab initio как контрольные точки для обоснования выбора параметров BV.
Если в нулевом приближении предположить, что концентрация электронов в точке r вдоль пути связи между двумя атомами M и X на расстоянии R M — X возникает из линейной комбинации неизменных в противном случае электронных плотностей ρ ( r ) = a M exp [- c M r ] + a X exp [- c X ( R M — X — r )], тогда общая электронная плотность будет иметь минимум вдоль пути связи в BCP, и это электронная плотность может с заменами
быть выражена в функциональной форме
, которая подчеркивает тесную формальную аналогию между валентностью связи и s M — 9000 9 Х .
Поскольку коэффициенты c M и c X в уравнении (3) являются, согласно уравнению (2), просто функциями соответствующих энергий ионизации, становится очевидным, что знаменатель B = ( c M + c X ) / c M c X будет для фиксированной средней энергии ионизации увеличиваться с увеличением разницы энергий ионизации.Другими словами, знаменатель B уже в этой упрощенной модели будет функцией электронной мягкости обоих атомов. Можно ожидать, что для взаимодействий типа кислоты Льюиса и основания Льюиса возмущение электронной плотности на BCP из-за до сих пор пренебрегаемого взаимодействия электронных плотностей повлияет на значения параметров A и B , но оставьте функциональную форму корреляции неизменной, так что простая степенная зависимость
между плотностью валентных электронов на BCP и валентностью связи должна сохраняться. Действительно, мы недавно продемонстрировали такую тесную степенную зависимость между значениями валентности связи softBV , используя литературные данные для 303 связей M -O 2- (из Даунса и др. , 2002) и 108 Связи M —S 2– (из Гиббса и др. , 1999). Аналогичным образом валентность связи также может быть выражена как функция лапласиана, атомной твердости или разности электроотрицательностей и номера атомной строки (Adams, 2014). Функциональные отношения между валентностью связи и электронной плотностью в BCP обычно включают масштабирование на основе главного квантового числа задействованных атомов или тесно коррелированной величины (такой как масса, атомный номер и т. Д. .) и, по крайней мере, для лапласиана, очевидно, мера атомной поляризуемости (например, атомная твердость или ее обратная атомная мягкость). Это основная причина, по которой мягкость связи, определяемая как разница между абсолютными мягкостями взаимодействующих ионов, должна приниматься во внимание при вычислении параметров валентности связи.
Действительно, мы недавно продемонстрировали такую тесную степенную зависимость между значениями валентности связи softBV , используя литературные данные для 303 связей M -O 2- (из Даунса и др. , 2002) и 108 Связи M —S 2– (из Гиббса и др. , 1999). Аналогичным образом валентность связи также может быть выражена как функция лапласиана, атомной твердости или разности электроотрицательностей и номера атомной строки (Adams, 2014). Функциональные отношения между валентностью связи и электронной плотностью в BCP обычно включают масштабирование на основе главного квантового числа задействованных атомов или тесно коррелированной величины (такой как масса, атомный номер и т. Д. .) и, по крайней мере, для лапласиана, очевидно, мера атомной поляризуемости (например, атомная твердость или ее обратная атомная мягкость). Это основная причина, по которой мягкость связи, определяемая как разница между абсолютными мягкостями взаимодействующих ионов, должна приниматься во внимание при вычислении параметров валентности связи.
1.3. Практическая идентификация с учетом мягкости связи b Значения
Аппроксимация параметра валентности связи b (который представляет мягкость или податливость связи внешним силам) универсальным значением уменьшает структурную информацию от приближения, которое учитывает учитывать как структурный тип, так и атомные свойства для более грубой оценки, основанной исключительно на координационном числе.Для улучшения оценки за счет сохранения информации о влиянии атомных свойств в первую очередь требуется независимая мера «мягкости связи» на основе экспериментально или ab initio вычислительно доступных величин. Парр и Пирсон (1983) предложили характеристику отдельных частиц в равновесии с помощью их постоянного независимого от места расположения электронного химического потенциала μ
и глобального среднего (зависящего от места) абсолютной твердости η
или его обратной величиной. абсолютная мягкость σ = η −1 . Опять же, ρ представляет собой электронную плотность, а нижний индекс ν указывает на потенциал ядра и внешние воздействия. В этом приближении −μ соответствует абсолютной электроотрицательности Малликена χ. Приблизительная идентификация с независимо доступными значениями энергии ионизации IE и сродства к электрону EA первоначально была получена для нейтральных частиц, но, согласно Пирсону (1985), электроотрицательность и твердость катионов M m + могут быть рассчитывается аналогично с использованием ( m +1) -й энергии ионизации M в качестве IE и замены EA на m -ю энергию ионизации.Для анионов Пирсон предложил использовать значения IE и EA для нейтральных элементов в качестве грубого приближения. Как показано в нашей более ранней работе (Adams & Rao, 2009; Adams, 2014), эмпирическая корреляция между радиусом аниона и мягкостью аниона может быть использована для получения более точной оценки: чтобы исключить сдвиг в соотношении между радиусами и радиусом для галогениды и халькогениды, мы используем — в соответствии с предположением Пирсона — значения мягкости нейтральных атомов для одновалентных анионов, но уменьшаем мягкость двухвалентных халькогенидных анионов на 0.
Опять же, ρ представляет собой электронную плотность, а нижний индекс ν указывает на потенциал ядра и внешние воздействия. В этом приближении −μ соответствует абсолютной электроотрицательности Малликена χ. Приблизительная идентификация с независимо доступными значениями энергии ионизации IE и сродства к электрону EA первоначально была получена для нейтральных частиц, но, согласно Пирсону (1985), электроотрицательность и твердость катионов M m + могут быть рассчитывается аналогично с использованием ( m +1) -й энергии ионизации M в качестве IE и замены EA на m -ю энергию ионизации.Для анионов Пирсон предложил использовать значения IE и EA для нейтральных элементов в качестве грубого приближения. Как показано в нашей более ранней работе (Adams & Rao, 2009; Adams, 2014), эмпирическая корреляция между радиусом аниона и мягкостью аниона может быть использована для получения более точной оценки: чтобы исключить сдвиг в соотношении между радиусами и радиусом для галогениды и халькогениды, мы используем — в соответствии с предположением Пирсона — значения мягкости нейтральных атомов для одновалентных анионов, но уменьшаем мягкость двухвалентных халькогенидных анионов на 0. 017 эВ −1 . Истинные значения мягкости анионов будут все еще немного завышены этим приближением, но наше модифицированное определение мягкости представляется достаточным, по крайней мере, для достижения сопоставимости между халькогенидными и галогенидными анионами.
017 эВ −1 . Истинные значения мягкости анионов будут все еще немного завышены этим приближением, но наше модифицированное определение мягкости представляется достаточным, по крайней мере, для достижения сопоставимости между халькогенидными и галогенидными анионами.
Эмпирическая концепция твердых и мягких кислот и оснований Пирсона (HSAB) подразумевает, что реакции наиболее легко происходят между видами соответствующей мягкости, что должно приводить к более крутым межатомным потенциалам для этих связей и, следовательно, к относительно небольшому значению валентности связи b по сравнению со значениями b для более слабых связей между частицами несовпадающей мягкости.Таким образом, при подготовке к определению набора параметров softBV мы провели всестороннее бесплатное уточнение параметров валентности связей. Как видно на рис. 1, самые низкие значения b фактически обнаружены для разностей мягкости ca 0,05 эВ -1 , тогда как для пар катион-анион с более высокими различиями в мягкости (а также для ограниченного числа пар с меньшими или даже отрицательными различиями в мягкости) были обнаружены все более высокие значения b . Очевидный сдвиг минимальной разницы мягкости в положительную можно условно отнести к вышеупомянутой систематической переоценке анионной мягкости.
Очевидный сдвиг минимальной разницы мягкости в положительную можно условно отнести к вышеупомянутой систематической переоценке анионной мягкости.
Рис. 1
Корреляция свободно уточненных значений b для катионов основной группы во взаимодействиях с галогенидами (светлые символы) или халькогенидными анионами (темные символы). Пунктирная черная линия представляет полиномиальное соответствие данным, за исключением халькогенидов p блочных катионов в их максимальной степени окисления (закрашенные розовато-лиловые треугольники).Для последнего полиномиальная аппроксимация (пунктирная розовато-лиловая линия) дает параллельный тренд с несколько более низкими значениями b (перерисовано по Adams, 2014).
Для катионов основной группы (за исключением p блокирующих катионов в их максимальной степени окисления в связи с халькогенидами) подогнанные значения b (в Ангстреме) могут быть аппроксимированы как функция разницы мягкости σ X — σ M (в эВ −1 ) на полином пятого порядка b =, показанный черной линией на рис. 1 с коэффициентами a 5 = 2479,6 Å эВ 5 , a 4 = −1384,2 Å эВ 4 , a 3 = 198,75 Å эВ 3 , a 2 = 10,428 Å эВ 2 , a 1 = −2,1316 Å эВ и a 0 = 0,5009 Å. Для p катионы блокируют в их максимальной степени окисления в связи с халькогенидами, более простой полином второго порядка соответствует a 2 = 1.9108 Å эВ 2 , a 1 = 0,8287 Å эВ и a 0 = 0,2946 Å использовалось для прогнозирования систематически более низких значений b , поскольку разница в мягкости для всех наблюдаемых случаев составляла 0,05 эВ. -1 . Аналогичные полиномиальные соответствия, основанные на наборе справочных данных, доступных в то время, были использованы для получения систематических значений b в наборе параметров softBV .
1 с коэффициентами a 5 = 2479,6 Å эВ 5 , a 4 = −1384,2 Å эВ 4 , a 3 = 198,75 Å эВ 3 , a 2 = 10,428 Å эВ 2 , a 1 = −2,1316 Å эВ и a 0 = 0,5009 Å. Для p катионы блокируют в их максимальной степени окисления в связи с халькогенидами, более простой полином второго порядка соответствует a 2 = 1.9108 Å эВ 2 , a 1 = 0,8287 Å эВ и a 0 = 0,2946 Å использовалось для прогнозирования систематически более низких значений b , поскольку разница в мягкости для всех наблюдаемых случаев составляла 0,05 эВ. -1 . Аналогичные полиномиальные соответствия, основанные на наборе справочных данных, доступных в то время, были использованы для получения систематических значений b в наборе параметров softBV .
Значения b набора параметров BV, чувствительного к мягкости связи, полученные способом, описанным выше, несколько больше, чем «универсальное значение» 0. 37 Å. Разница будет зависеть от смещения в сторону малых значений b , которое вводится, когда слабые взаимодействия от более высоких координационных сфер игнорируются, и, следовательно, можно ожидать, что свободное уточнение значений b (где надежно возможно) уменьшит подобранные . b значения незначительно. Здесь для целей предлагаемого нового параметра (соблюдая первое соглашение о координационной оболочке) мы предпочитаем сохранить те же параметры b , в основном потому, что их определение кажется более надежным и, следовательно, они должны быть более подходящей мерой истинной мягкости связи. .Как было продемонстрировано в нашей более ранней работе (Adams, 2014), коэффициент корреляции фундаментального отношения s (ρ BCP ) выше, когда s вычисляется из чувствительного к мягкости softBV с использованием этих значений b , чем для обычных данных валентности облигаций, опираясь на фиксированное значение b .
37 Å. Разница будет зависеть от смещения в сторону малых значений b , которое вводится, когда слабые взаимодействия от более высоких координационных сфер игнорируются, и, следовательно, можно ожидать, что свободное уточнение значений b (где надежно возможно) уменьшит подобранные . b значения незначительно. Здесь для целей предлагаемого нового параметра (соблюдая первое соглашение о координационной оболочке) мы предпочитаем сохранить те же параметры b , в основном потому, что их определение кажется более надежным и, следовательно, они должны быть более подходящей мерой истинной мягкости связи. .Как было продемонстрировано в нашей более ранней работе (Adams, 2014), коэффициент корреляции фундаментального отношения s (ρ BCP ) выше, когда s вычисляется из чувствительного к мягкости softBV с использованием этих значений b , чем для обычных данных валентности облигаций, опираясь на фиксированное значение b .
2. Объективные и вычислительные методы
В этой работе мы определили непротиворечивые наборы параметров валентности связи, включающие, помимо R 0 и b , расстояние отсечения R отсечку и средние координационные числа N C для 706 пар катион-анион с использованием трех различных условных обозначений, основанных на одном и том же наборе справочных данных, содержащем (после необходимого исключения выбросов) 15 523 надежных катионных среды:
(i) Переменная, чувствительная к мягкости b Значения адаптированы из набора параметров softBV (Adams, 2001) с учетом эффектов более высоких координационных оболочек.В этом случае мы учитываем взаимодействия за пределами первой координационной оболочки до расстояния отсечки 4 Å < R отсечка <8,5 Å. Результаты можно рассматривать как слегка обновленную версию нашего ранее опубликованного набора параметров softBV .
(ii) Новый набор параметров softNC1 , который сохраняет те же чувствительные к мягкости значения b , которые мы нашли для набора параметров softBV , но ограничивая расстояние отсечки границей первой координационной оболочки R отсечка = 1 в качестве основы для пересмотренных значений R 0 .Это также включает разработку и тестирование метода систематического определения пределов первой координационной оболочки.
(iii) Для целей сравнительного анализа также был определен «традиционный» набор параметров BV convBV . Другими словами, мы подобрали значения R 0 для нашего набора справочных данных на основе обычного выбора фиксированного универсального значения b = 0,37 Å и, что касается второго набора параметров, уточнили R 0 в предположении, что только противоионы из первой координационной оболочки вносят вклад в BVS.
2. 1. Выбор набора эталонных кристаллических структур
1. Выбор набора эталонных кристаллических структур
Определение параметров BV обычно требует в качестве первого шага составления базы данных надежных эталонных данных кристаллической структуры. В нашей работе основным источником является База данных неорганических кристаллов (ICSD) (Bergerhoff & Brown, 1987), дополненная структурами, извлеченными из недавней литературы. Руководящие принципы для нашего выбора соединений заключались в том, что эталонные структуры:
(i) Должны быть экспериментально определены путем дифракции рентгеновских лучей или нейтронов с достаточно низкими невязками R csr уточнения кристаллической структуры, а не структур предсказано расчетно. R csr выбран здесь вместо общепринятого термина «значение R », чтобы избежать путаницы с длиной скрепления R M — X . Там, где база данных и литература содержат достаточное количество доступных катионных сред, мы стремились к значениям R csr ≤ 0,055, но были сделаны компромиссы для катион-анионных пар с меньшим количеством доступных данных.
Хотя для данной кристаллической структуры меньшее значение R csr должно указывать на более надежную модель структуры, несоответствия в типе значений R csr , указанные в базах данных, а также небольшое влияние легких атомов на R csr значения из данных дифракции рентгеновских лучей ограничивают его значимость, и поэтому они не должны использоваться в качестве единственного критерия.
Эталонные структуры для анионных связей H + основаны исключительно на данных нейтронографии из-за систематического занижения длин связей до H + при определении структуры рентгеновских лучей.
(ii) Должен содержать только один тип аниона, а именно тип, который необходимо определить.
(iii) Должен быть определен при комнатной или близкой к ней температуре и атмосферном давлении.
(iv) Не должно включать какие-либо участки с частичной или смешанной занятостью. Это также исключает структуры, в которых ион имеет нецелочисленную степень окисления (что можно рассматривать как эквивалент смешанного заполнения сайта одним и тем же элементом в двух разных степенях окисления).
(v) Не должно содержать металлических связей (между анионами или катионами) или включать атом с нулевой степенью окисления.
(vi) Желательно, чтобы он содержал по крайней мере два типа катиона, включая тип, который должен быть определен, и не должен содержать H + (кроме тех случаев, когда H + представляет собой интересующий катион). С другой стороны, также рекомендуется ограничить сложность эталонных структур, чтобы на практике мы попытались сосредоточиться на соединениях с двумя или тремя типами катионов и одним типом аниона в качестве эталонных структур.
(vii) Структурные модели для модулированных структур были исключены, так как они часто имеют ограниченную точность и, если их учитывать, могут смещать эталонные наборы данных, как правило, из-за того, что обычно много одинаковых по своей природе катионных сред, содержащихся в одной структуре.
(viii) Если для пары катион-анион было доступно достаточное количество эталонных структур, удовлетворяющих вышеуказанным критериям, количество эталонных структур одного и того же типа структуры и количество эталонных структур с катионом в высокосимметричных средах были ограничено. Включение нескольких уточнений структуры одного и того же соединения (, например, — соединение, имеющее высокую технологическую или научную значимость) обычно избегалось. По ряду параметров, включающих катион H + , с помощью ICSD не удалось идентифицировать структуры, удовлетворяющие всем требованиям. В таких случаях требование (iv) снимается, что ведет к снижению надежности этих параметров.
Включение нескольких уточнений структуры одного и того же соединения (, например, — соединение, имеющее высокую технологическую или научную значимость) обычно избегалось. По ряду параметров, включающих катион H + , с помощью ICSD не удалось идентифицировать структуры, удовлетворяющие всем требованиям. В таких случаях требование (iv) снимается, что ведет к снижению надежности этих параметров.
После идентификации эталонных структур для определения параметров валентности связи между катионом M m + и анионом X x — из этих структур был извлечен ряд катионных сред. данные.«Окружающая среда» здесь относится к списку расстояний между конкретным представляющим интерес катионом M m + и всеми окружающими анионами X x — в структуре на достаточно большом расстоянии (5– 9 Å). Каждая структура может содержать несколько различных сред для различных катионов M m + . Например, структура Li 3 BO 3 , изображенная на рис. 2, содержит три различных окружения Li + , которые можно учитывать при определении параметров валентности связи для Li + -O 2− .Каждая среда будет иметь одинаковый вес для своей BVS во время уточнения параметров валентности связей. Это может быть неоптимальным, поскольку такие среды, строго говоря, не являются независимыми наблюдениями, а коррелируют через структуры , но в настоящее время у нас нет убедительного метода для присвоения разных весов разным средам. В некоторых случаях, когда одно соединение с низкой симметрией содержало большое количество симметрично различных, но похожих сред, которые доминировали бы при уточнении параметров, мы решили уменьшить количество этих сред, которые учитывались при уточнении (произвольно отдавая предпочтение катион, которому в записи базы данных был присвоен меньший номер).
Например, структура Li 3 BO 3 , изображенная на рис. 2, содержит три различных окружения Li + , которые можно учитывать при определении параметров валентности связи для Li + -O 2− .Каждая среда будет иметь одинаковый вес для своей BVS во время уточнения параметров валентности связей. Это может быть неоптимальным, поскольку такие среды, строго говоря, не являются независимыми наблюдениями, а коррелируют через структуры , но в настоящее время у нас нет убедительного метода для присвоения разных весов разным средам. В некоторых случаях, когда одно соединение с низкой симметрией содержало большое количество симметрично различных, но похожих сред, которые доминировали бы при уточнении параметров, мы решили уменьшить количество этих сред, которые учитывались при уточнении (произвольно отдавая предпочтение катион, которому в записи базы данных был присвоен меньший номер).
Рисунок 2
Структура Li 3 BO 3 обеспечивает три различных окружения для определения параметра валентности связи Li + —O 2−, обозначенного как Li1, Li2 и Li3.
2.2. Подход к уточнению параметра валентности связи
Для случая параметров softBV , в принципе, должны быть определены оба параметра валентности связи, b и R 0 .Один из возможных способов — совместить b с R 0 . Затем процесс минимизации должен гарантировать, что уточненные параметры:
(i) дают нулевое среднее несоответствие катионов BVS для набора данных эталонной структуры, = V id [где V id ( M ) представляет собой степень окисления катиона M ], и в то же время
(ii) минимизировать смещенное стандартное отклонение Δ V = катиона BVS.
Этот процесс уточнения может включать в себя необходимость устранения выбросов, которые могут сильно повлиять на уточняемые параметры. Тем не менее, для каждой такой среды, отмеченной как выброс, мы пытались оценить, есть ли дополнительные свидетельства, указывающие на проблему с уточнением базовой структуры, и проверяли, не нарушает ли устранение ненадлежащего баланса между различными координационными числами в сохранившемся наборе справочных данных .
Этот подход (который использовался для определения точек данных на рис.1) выявляет лежащие в основе тенденции, но приводит к значительному разбросу значений параметров, если количество доступных катионных сред слишком мало, не содержит достаточно различных типов координации или очень уязвимо для необнаруженных ошибочных катионных сред. Поэтому мы следуем подходу, выбранному в нашем наборе параметров softBV , чтобы уменьшить разброс в уточненных значениях b , используя систематические тенденции, наблюдаемые на рис. 1. В соответствии с нашей предыдущей работой, значения b для галогенидов и халькогенидов (где мягкость анионов может быть уточнена) присваиваются с использованием полиномиальных аппроксимаций, полученных в разделе 1.3 из бесплатных уточнений, основанных на разнице между мягкостью задействованных анионов и катионов. Для пниктидных анионов (N 3−, P 3−, As 3−, Sb 3−) и H − отсутствие доступных надежных значений мягкости анионов побудило нас сохранить свободно очищенные значения b .
После вывода систематической зависимости мягкости связи b значений и сохранения соответствующих отсечных расстояний R отсечка для взаимодействий из более высоких координационных оболочек (которые были выбраны так, чтобы уменьшение R отсечки на 1 Å не уменьшал BVS более чем на 1%, когда R 0 и b оставались фиксированными), значения R 0 были окончательно определены заново.Результаты практически идентичны ранее опубликованным параметрам softBV , за исключением незначительных обновлений в списке катион-анионных пар и эталонных структур. Поскольку R 0 является единственной свободной переменной, процедура уточнения здесь упрощена:
(i) Считайте значение b , которое соответствует разнице мягкости между катионом и анионом.
(ii) Выберите начальное значение R 0 .
(iii) Варьируйте R 0 итеративно, чтобы BVS, усредненный по всем катионным средам, соответствовал степени окисления катиона.
В принципе, процедура уточнения для двух альтернативных наборов параметров softNC1 (со значениями softBV BV, но пределом первой координационной оболочки в качестве предельного расстояния) и эталонного набора convBV (с фиксированным b = 0,37 Å и первая координационная оболочка как расстояние отсечки) может показаться аналогичным. Тем не менее, для уточнения набора параметров валентности связи, ограниченного первой координационной сферой, радиус ( априори неизвестен) этой первой координационной оболочки R 1 должен быть уточнен одновременно с другими параметрами, так как она функционирует как расстояние отсечки R отсечка взаимодействий, которые необходимо учитывать.Поэтому мы кратко обсудим определение R 1 и связанное с ним определение координационного числа в следующем разделе.
2.3. Координационное число и граница первой координационной оболочки
В стакане или жидкости текущее координационное число N RCN по сравнению с радиусом R , а также его (масштабированный) градиент, функция радиального распределения г ( R ), можно ожидать, что он будет непрерывным. Затем первый локальный минимум функции радиального распределения определяет границу R 1 для первой координационной оболочки. Точно так же определение границ первой координационной оболочки для отдельного катионного окружения в кристаллической структуре является простым, если первая и вторая координационные оболочки разделены четким плато в соответствующем N RCN ( R ) график. Однако при систематическом определении значений N C и R 1 из наборов справочных данных, содержащих ограниченное количество катионных сред, часто нет достаточных точек данных, чтобы соответствовать гладкой кривой, и поэтому R 1 однозначно как первый минимум г , ни четких и достаточно широких плато различимы.Вместо этого необходимое включение катионных сред с различным расположением анионов и координационными числами, а также электронные искажения катионных сред переходных металлов могут привести к появлению различных сложных форм графиков N RCN ( R ), среди которых несколько представители выбраны на рис.
Затем первый локальный минимум функции радиального распределения определяет границу R 1 для первой координационной оболочки. Точно так же определение границ первой координационной оболочки для отдельного катионного окружения в кристаллической структуре является простым, если первая и вторая координационные оболочки разделены четким плато в соответствующем N RCN ( R ) график. Однако при систематическом определении значений N C и R 1 из наборов справочных данных, содержащих ограниченное количество катионных сред, часто нет достаточных точек данных, чтобы соответствовать гладкой кривой, и поэтому R 1 однозначно как первый минимум г , ни четких и достаточно широких плато различимы.Вместо этого необходимое включение катионных сред с различным расположением анионов и координационными числами, а также электронные искажения катионных сред переходных металлов могут привести к появлению различных сложных форм графиков N RCN ( R ), среди которых несколько представители выбраны на рис. 3. Есть случаи, такие как Cr 4+ -O 2-, которые демонстрируют четкое плато, которое напоминает монокристаллическую среду, и случаи, подобные Tl + -O 2-, чье N Кривые RCN сплошные, как в жидкой среде.Также имеется большое количество случаев, показывающих множественные platueax. В наборе данных Rb + —Sb 3– отдельные среды имеют координационные числа 4, 5 и 6, что приводит к двум плато. В случае Cu 2+ -Cl —, большинство сред демонстрируют координационную конфигурацию (4 + 2), где два аниона присутствуют между первой и второй координационными оболочками.
3. Есть случаи, такие как Cr 4+ -O 2-, которые демонстрируют четкое плато, которое напоминает монокристаллическую среду, и случаи, подобные Tl + -O 2-, чье N Кривые RCN сплошные, как в жидкой среде.Также имеется большое количество случаев, показывающих множественные platueax. В наборе данных Rb + —Sb 3– отдельные среды имеют координационные числа 4, 5 и 6, что приводит к двум плато. В случае Cu 2+ -Cl —, большинство сред демонстрируют координационную конфигурацию (4 + 2), где два аниона присутствуют между первой и второй координационными оболочками.
Рисунок 3
Избранные примеры изменения текущего координационного числа N RCN с R в наборах справочных данных.Cu 2+ —Cl — : два плато внутри первой координационной оболочки из-за преобладающей (4 + 2) координации. Rb + —Sb 3−: два плато из-за подмножеств изменения N C от 4 до 6 в справочных данных. Cr 4+ —O 2–: одно плато. Tl + -O 2- : нет явного плато.
Rb + —Sb 3−: два плато из-за подмножеств изменения N C от 4 до 6 в справочных данных. Cr 4+ —O 2–: одно плато. Tl + -O 2- : нет явного плато.
Чтобы сделать последовательное и автоматическое определение первой координационной оболочки возможным при таких меняющихся обстоятельствах, значения N C и R 1 для пары катион-анион M — X определялись итеративно в соответствии со следующей формулой всякий раз, когда R 0 изменялось во время уточнения:
Как будет описано ниже, это определяет предел первой координационной оболочки как расстояние R 1 , для которого валентность связи s ( R 1 ) равна доле 1/ c валентности связи для типичного расстояния связи R мин в пределах первой координационной оболочки.
Для уточнения набора параметров softNC1 мы использовали значения softBV для b и R 0 в качестве начальных значений, а N C , R 1 и R 0 были уточнены одновременно с использованием следующей процедуры:
(i) Исходя из начальных предположений R 0 и N C , рассчитаем R 1 .
(ii) До R 0 , N C и R 1 все сходятся, выполните итеративно следующее:
( a ) Найдите R 0 так that = V id .
( b ) Вычислите N C как количество анионов, присутствующих в пределах R 1 .
( c ) Вычислите R 1 , используя уравнение (8).
(iii) Запишите окончательные значения R 0 , N C и R 1 и вычислите стандартное отклонение Δ V для набора данных с этими уточненными параметрами.
Поскольку N C неизвестен априори , расчеты проводятся для широкого диапазона возможных начальных значений N C от 2 до 20 с шагом 1, а среди результирующих 19 наборов уточненных значений R 1 , R 0 и N C , принимается набор, соответствующий наименьшему Δ V в BVS.В большинстве случаев результаты уточнения оказались одинаковыми для правдоподобного диапазона начальных выборов N C .
На этом этапе единственной оставшейся проблемой было определение правдоподобного значения для фактора c в уравнении (8). Опять же, мы избежали навязывания предопределенного значения и протестировали ряд возможных значений 1 ≤ c ≤ 8. После первоначальных проверок оказалось, что диапазон правдоподобных значений для c можно сузить до 3 ≤ c ≤ 6, так как этот выбор приводит к согласованным результатам для большинства пар катион-анион. Чтобы установить более точное значение c , мы визуально проверили кривые N RCN ( R ) для всех 88 случаев, для которых уточненные значения N C ( c = 3) и N C ( c = 6) отличается на ≥ 0,5, чтобы решить, какой из вариантов c дает наиболее правдоподобное значение N C .
Чтобы установить более точное значение c , мы визуально проверили кривые N RCN ( R ) для всех 88 случаев, для которых уточненные значения N C ( c = 3) и N C ( c = 6) отличается на ≥ 0,5, чтобы решить, какой из вариантов c дает наиболее правдоподобное значение N C .
3. Результаты и обсуждение
3.1. Списки параметров валентности связи
Уточненные значения параметра валентности связи R 0 и b для всех уточненных наборов параметров для 706 пар катион-анион представлены в таблице S1 во вспомогательной информации вместе с соответствующим сокращением расстояния отрыва R отсечка и средние координационные числа N C Помимо уточнения этих значений в согласованной структуре для использования при проверке достоверности кристаллических структур, нашей основной целью было проанализировать, насколько два отдельных упрощения в уточнении параметров, а именно устранение влияния более высоких координационных оболочек в наборах softNC1 и convBV и дополнительное фиксирование значения b в convBV на 0. 37 Å, повлияет на качество прогнозов, особенно для их применения в проверках достоверности кристаллической структуры.
37 Å, повлияет на качество прогнозов, особенно для их применения в проверках достоверности кристаллической структуры.
3.2. Координационные числа и расстояние отсечки
Для наборов параметров softNC1 и convBV , учитывающих только взаимодействия в первой координационной оболочке, было необходимо в качестве первого шага для достижения систематического определения координационного числа N C в соответствии с уравнением (8) путем определения значения коэффициента c , которое последовательно приводит к правильному координационному числу.Можно подчеркнуть, что значение c соответствует соотношению между валентностями связи при типичном расстоянии связи R min и при радиусе отсечки R 1
Таким образом, относительный разброс валентностей связей внутри первой координационной оболочки фиксируется независимо от координационного числа, что приводит к аналогичному относительному разбросу длин связей внутри первой координационной оболочки, в то же время позволяя немного более широкий диапазон длин связей для более мягкие связи. Напротив, обычный выбор любого фиксированного значения валентности связи для предела первой координационной оболочки, , например 3,8% катионного BVS, как ранее было предложено Brown & Altermatt (1985), приводит к выраженному искусственному сокращению диапазона валентностей связей (и длин связей), которые рассматриваются как часть первой координационной оболочки с увеличением координационного числа. . Следовательно, для чрезвычайно высоких координационных чисел значения, определенные с использованием критерия Брауна, имеют тенденцию быть немного слишком низкими и немного завышенными, когда они должны быть чрезвычайно низкими, в то время как для подавляющего большинства случаев оба метода дают одинаковые или близкие значения N C , как видно из рис.4. Детально, координационные числа, определенные обоими методами, точно совпадают для 563 из 706 типов катионной среды, исследованных в данной работе, а для 655 из них они различаются менее чем на 5%.
Напротив, обычный выбор любого фиксированного значения валентности связи для предела первой координационной оболочки, , например 3,8% катионного BVS, как ранее было предложено Brown & Altermatt (1985), приводит к выраженному искусственному сокращению диапазона валентностей связей (и длин связей), которые рассматриваются как часть первой координационной оболочки с увеличением координационного числа. . Следовательно, для чрезвычайно высоких координационных чисел значения, определенные с использованием критерия Брауна, имеют тенденцию быть немного слишком низкими и немного завышенными, когда они должны быть чрезвычайно низкими, в то время как для подавляющего большинства случаев оба метода дают одинаковые или близкие значения N C , как видно из рис.4. Детально, координационные числа, определенные обоими методами, точно совпадают для 563 из 706 типов катионной среды, исследованных в данной работе, а для 655 из них они различаются менее чем на 5%.
Рисунок 4
Сравнение координационных чисел N C , определенных с использованием критерия Брауна и критерия, в конечном итоге предложенного в данной работе.
Использование слишком большого или слишком малого значения c может привести к вычислению координационного числа на неправильном плато для случаев, когда отображается более одного плато ( cf .Рис.3). Чрезмерное сужение диапазона разрешенных валентностей связи в пределах первой координационной оболочки за счет использования слишком маленького c также имеет тенденцию во многих случаях занижать N C . Быстрый тест показывает, что значения c 3 обычно приводят к явно слишком малому координационному числу. Для явно слишком малого c = 1 (, то есть при ограничении R 1 до R 1 = R мин ) метод также столкнется с проблемами сходимости для множества ионных пар.Аналогично, для c ≥ 7 результирующие координационные числа имеют тенденцию к росту при выборе c до неправдоподобно высоких значений, , т.е. , такие значения c приводят к включению второй координационной оболочки. Таким образом, мы более подробно протестировали промежуточные случаи c = от 3 до 6 с шагом 0,25. Из 706 протестированных ионных пар только 88 показывают отклонение N C больше 0,5 в зависимости от выбора c в этом диапазоне.Таким образом, правильные N C для этих записей были определены путем индивидуального анализа кривых N RCN ( R ) для 64 пар, за исключением 24 случаев, когда даже визуальный осмотр оказался безрезультатным.
Таким образом, мы более подробно протестировали промежуточные случаи c = от 3 до 6 с шагом 0,25. Из 706 протестированных ионных пар только 88 показывают отклонение N C больше 0,5 в зависимости от выбора c в этом диапазоне.Таким образом, правильные N C для этих записей были определены путем индивидуального анализа кривых N RCN ( R ) для 64 пар, за исключением 24 случаев, когда даже визуальный осмотр оказался безрезультатным.
Как видно из рис. 5, имеет место минимум отклонения между систематическим определением N C согласно уравнению (8) и результатом визуального осмотра N RCN ( R ). для c значения около 4.25, и тот же выбор c также минимизирует асимметрию распределения наблюдаемых отклонений в подмножестве пар катион-анион с чувствительными координационными числами c . Можно отметить, что рис. 5 подчеркивает отклонение, опуская большинство случаев, когда любой из вариантов c приведет к (почти) одинаковому значению N C . Окончательные значения R 1 и N C , перечисленные в таблице S1 во вспомогательной информации для наборов параметров, чувствительных к мягкости softNC1 , поэтому основаны на c = 4.25.
Окончательные значения R 1 и N C , перечисленные в таблице S1 во вспомогательной информации для наборов параметров, чувствительных к мягкости softNC1 , поэтому основаны на c = 4.25.
Рисунок 5
( a ) График значений N C , являющихся результатом критерия в уравнении (8) для выбранных вариантов c (3 ≤ c ≤ 6) по сравнению с значениями N C , определенными путем проверки кривых N RCN ( R ). ( b ) Отклонение в среднем и асимметрия N C отклонений для N C значений, определенных в соответствии с уравнением (8) относительно N C значений, определенных визуально из N RCN ( R ) кривые в зависимости от выбора коэффициента c .Оба графика относятся к анализу 64 случаев, упомянутых в тексте, где предложенное значение N C чувствительно к выбору c , тогда как визуальный осмотр оказался однозначным.
Тот же самый анализ для «обычного» набора параметров валентности связи (, т.е. при условии b = 0,37 Å) дает несколько уменьшенную зависимость координационного числа от выбора c и наименьшего отклонения среднего координационного числа и наименьшей асимметрии распределения отклонений для случая c = 6.Это понятно, поскольку выбор меньшего значения b означает, что тот же интервал расстояний между R min и R 1 будет соответствовать более выраженному снижению валентности связи.
3.3. Параметры валентности связи и радиусы кристаллов
В качестве перекрестной проверки наших параметров валентности связей мы также сравнили значение R мин , , т.е. ожидаемое среднее расстояние связи для среднего координационного числа для серии катионов, связанных с одним и тем же анионом, с изменением радиусов кристаллов Шеннона (Shannon, 1976)
Наш набор параметров дает одно значение R мин для каждой пары катион-анион и (в общем, дробное значение ) среднее координационное число N C для нашего набора справочных данных, тогда как радиусы кристаллов Шеннона сгруппированы на основе целочисленных координационных чисел N C (Sh) только для катионов. Таким образом, чтобы сравнить наши результаты, нам необходимо сначала вычислить эффективный радиус кристалла Шеннона R кристалл для среднего N C набора справочных данных. Для ионов, для которых компиляция Шеннона предлагает несколько N C (Sh) , используется линейная интерполяция для вычисления эффективного радиуса кристалла Шеннона при среднем значении N C набора справочных данных. Если сообщалось одно значение N C (Sh) , и значение было в пределах ± 0.2 из наших N C , радиус кристалла Шеннона использовался без изменений. Оставшиеся 88 из 706 катион-анионных пар с одним отклоняющимся координационным числом катиона или без координационного числа в компиляции Шеннона были исключены из сравнения.
Таким образом, чтобы сравнить наши результаты, нам необходимо сначала вычислить эффективный радиус кристалла Шеннона R кристалл для среднего N C набора справочных данных. Для ионов, для которых компиляция Шеннона предлагает несколько N C (Sh) , используется линейная интерполяция для вычисления эффективного радиуса кристалла Шеннона при среднем значении N C набора справочных данных. Если сообщалось одно значение N C (Sh) , и значение было в пределах ± 0.2 из наших N C , радиус кристалла Шеннона использовался без изменений. Оставшиеся 88 из 706 катион-анионных пар с одним отклоняющимся координационным числом катиона или без координационного числа в компиляции Шеннона были исключены из сравнения.
На рис. 6 показано изменение значений R min (полученных из набора параметров softNC1 ) в зависимости от радиусов кристалла Шеннона R кристалл затронутых катионов для выбранных анионов. Тесты на линейные зависимости между R min и R кристалл для тех анионов, где известная анионная мягкость позволяет использовать систематические значения b , дают высокие коэффициенты корреляции, например, R 2 = 0,994 для корреляции R кристалл ( M м + ) = 0,9901 R мин ( M м + —O 2− ) — 1.2046 Å для 129 параметров катион-оксид, показанных светлыми треугольниками на рис. 6. Соответствующие соотношения для других анионов перечислены в таблице S2 во вспомогательной информации.
Тесты на линейные зависимости между R min и R кристалл для тех анионов, где известная анионная мягкость позволяет использовать систематические значения b , дают высокие коэффициенты корреляции, например, R 2 = 0,994 для корреляции R кристалл ( M м + ) = 0,9901 R мин ( M м + —O 2− ) — 1.2046 Å для 129 параметров катион-оксид, показанных светлыми треугольниками на рис. 6. Соответствующие соотношения для других анионов перечислены в таблице S2 во вспомогательной информации.
Рисунок 6
Корреляция между R min и радиусами кристалла Шеннона R кристалл . Отображаемые значения R мин. основаны на чувствительных к мягкости значениях b .Чтобы уменьшить перекрытие, данные показаны только для девяти анионов, для которых можно определить более 30 типов катион-анионных пар.
В то время как наклон этих соотношений приближается к единице для более твердых анионов O 2– и F –, для более крупных и более мягких анионов обнаружены несколько меньшие значения ( например, 0,9065 для Te 2– и 0,8747 для I — ). Попутно можно отметить, что по определению радиусов кристаллов Шеннона и ионных радиусов Шеннона точно такие же соотношения с дополнительным сдвигом -0.14 Å будет применяться к ионным радиусам Шеннона [, например, R ион ( M ) = 0,9901 R мин ( M -O) — 1,3446 Å для оксидов]. Близко похожие корреляции со сравнимыми коэффициентами корреляции также наблюдаются при получении значений R min из набора данных convBV , , то есть на основе обычного фиксированного выбора b . Таким образом, основная причина изменения наклона заключается в том, что для более крупных и мягких анионов будет несколько более выраженное изменение среднего координационного числа для данного изменения размера катиона.
С другой стороны, расстояния между разными прямыми на рис. 6 для разных анионов, очевидно, связаны с соответствующими размерами анионов. Следовательно, линейная регрессия с кристаллом R , кристаллом M и R , X в качестве независимых переменных и R мин в качестве переменной отклика с или без пересечения дает
с измененной R 2 = 0,9991, и
с поправкой R 2 = 0.9802. Таким образом, небольшой перехват в любом случае в качестве дополнительного уточняющего параметра не улучшает согласование и может быть отброшен. Таким образом, было обнаружено, что R мин линейно коррелирует с суммой слегка масштабированных радиусов кристаллов Шеннона катионов и анионов, как показано на рис. 7. Масштабные коэффициенты 1,031 для катионов и 0,951 для анионов также количественно определяют среднее завышение размеры анионов и занижение размеров катионов радиусами кристаллов Шеннона.
Рисунок 7
Линейная корреляция между R min и суммой масштабированных радиусов Шеннона катионов и анионов.
Эта глубокая корреляция также позволяет рассчитать недостающие радиусы кристаллов Шеннона: P 3− (1,851 Å), As 3− (1,973 Å), Sb 3− (2,244 Å) и H — (1,077 Å). Более того, дополнительные радиусы катионов Шеннона могут быть рассчитаны путем подбора данных, показанных на рис. 6. Все значения перечислены в таблице S3 во вспомогательной информации.
3.4. Сравнение наборов параметров
Одной из ключевых задач этого проекта было выяснить, имеет ли один из трех производных наборов параметров валентности связи значительное преимущество перед другими наборами.Чтобы оценить качество наборов параметров, мы сравнили среднее стандартное отклонение Δ V для трех наборов параметров.
Как видно из таблицы 1, наименьшее стандартное отклонение среди трех подходов постоянно обнаруживается при использовании подхода softBV . Это не зависит от того, учитываются ли все пары катион-анион или сравниваются только те параметры, которые могут быть определены с большей надежностью из наборов справочных данных, содержащих не менее 20 катионных сред.При упрощении набора параметров softBV с учетом только взаимодействий в первой координационной оболочке (при сохранении чувствительности к мягкости связи) наблюдается лишь небольшое (но статистически значимое) увеличение среднего стандартного отклонения BVS в пределах того же набора. эталонных катионных сред. Напротив, обеспечение b = 0,37 Å вызывает гораздо более выраженное увеличение стандартного отклонения, , т.е. , это значительно снижает качество расчетов BVS.При сравнении подмножеств параметров с разными анионами (см. Рис.8) становится очевидным, что это преимущество наборов параметров, чувствительных к мягкости, по сравнению с обычным набором параметров с универсальным значением b становится более заметным, чем выше среднее значение b для параметров с участием соответствующего аниона. Другими словами, чем мягче анион, тем более важным становится использование параметров BV, чувствительных к мягкости. Это не удивительно, поскольку исходный выбор b = 0.37 Å было предложено на основе обучающей выборки, состоящей в основном из твердых анионов. Можно отметить, что только для оксидов недавнее систематическое исследование (Gagné & Hawthorne, 2015) дает среднее значение b 0,40 Å при использовании первого соглашения о координационной оболочке. Таким образом, значение 0,37 Å кажется слишком низким даже для оксидов. Как обсуждалось выше, отличие от среднего значения b = 0,45 Å для оксидов в наборе параметров softBV также зависит от пренебрежения влиянием более высоких координационных сфер в традиционном подходе.
Другими словами, чем мягче анион, тем более важным становится использование параметров BV, чувствительных к мягкости. Это не удивительно, поскольку исходный выбор b = 0.37 Å было предложено на основе обучающей выборки, состоящей в основном из твердых анионов. Можно отметить, что только для оксидов недавнее систематическое исследование (Gagné & Hawthorne, 2015) дает среднее значение b 0,40 Å при использовании первого соглашения о координационной оболочке. Таким образом, значение 0,37 Å кажется слишком низким даже для оксидов. Как обсуждалось выше, отличие от среднего значения b = 0,45 Å для оксидов в наборе параметров softBV также зависит от пренебрежения влиянием более высоких координационных сфер в традиционном подходе.
Набор параметров Отсечка Δ V Δ V ( n > 20) † 929V42 мягкая 929V2 0,0719 0,0807 softNC1 Первая координационная оболочка 0,0797 0,0891 convBV 2 929 024 01157 0,1146
† Среднее стандартное отклонение при рассмотрении только тех пар катион-анион, для которых эталонный набор содержал более 20 катионных сред.
Рисунок 8
Зависимость относительного увеличения стандартных отклонений BVS в наборе справочных данных при использовании обычного набора параметров с фиксированным универсальным значением b = 0.37 Å вместо параметров softBV (ромбики) или параметров softNC1 (квадраты) в среднем b значений для параметров BV с участием соответствующего типа аниона. Данные приведены только для анионов галогенидов и халькогенидов. Пунктирные линии представляют собой полиномиальную аппроксимацию для ориентира.
Мы также сравнили наши наборы параметров softBV и softNC1 , полученные в этой работе, с систематическим определением параметров BV Gagné & Hawthorne (Gagné & Hawthorne, 2015) и компиляцией параметров BV Брауна (Brown, 2016) , который также содержит, помимо параметров из его собственной работы, значения из различных других литературных источников. Обратите внимание, что параметры Gagné & Hawthorne были определены путем свободного уточнения параметров BV с использованием подхода первой координационной оболочки. Мы использовали все четыре набора параметров для расчета катионных BVS в идентичных наборах справочных данных, охватывающих широкий диапазон оксидов, и сравнили смещенные стандартные отклонения Δ V . Из рисунка 9 видно, что наш набор параметров softNC1 работает лучше, чем компиляция Брауна, и так же хорошо, как набор данных Gagné & Hawthorne для оксидов.Наш softBV работает лучше, чем оба набора литературных данных, отчасти из-за дополнительного включения слабых взаимодействий за пределы первой координационной оболочки.
Обратите внимание, что параметры Gagné & Hawthorne были определены путем свободного уточнения параметров BV с использованием подхода первой координационной оболочки. Мы использовали все четыре набора параметров для расчета катионных BVS в идентичных наборах справочных данных, охватывающих широкий диапазон оксидов, и сравнили смещенные стандартные отклонения Δ V . Из рисунка 9 видно, что наш набор параметров softNC1 работает лучше, чем компиляция Брауна, и так же хорошо, как набор данных Gagné & Hawthorne для оксидов.Наш softBV работает лучше, чем оба набора литературных данных, отчасти из-за дополнительного включения слабых взаимодействий за пределы первой координационной оболочки.
Рисунок 9
Сравнение стандартных отклонений при использовании параметров из компиляции Брауна (верхний ряд) или параметров Gagné & Hawthorne (нижний ряд) с softBV (слева) или softNC1 (правая часть) параметры, определенные в данной работе. В сравнении используются только те катион-анионные пары с n ≥ 20 катионными средами. Набор параметров softBV рассчитывается на более высоком расстоянии отсечки, предложенном для этого набора параметров, в то время как для трех других наборов отсечка устанавливается на значение R 1 , определенное в этой работе как предел. соответствующей первой координационной оболочки.
В сравнении используются только те катион-анионные пары с n ≥ 20 катионными средами. Набор параметров softBV рассчитывается на более высоком расстоянии отсечки, предложенном для этого набора параметров, в то время как для трех других наборов отсечка устанавливается на значение R 1 , определенное в этой работе как предел. соответствующей первой координационной оболочки.
3.5. Когда b можно доработать бесплатно?
Задача уточнения R 0 с заданным фиксированным b проста, поскольку она включает только подгонку R 0 так, чтобы среднее несоответствие BVS в наборе справочных данных стало равным нулю, i.е. для пары катион – анион. Это стабильный процесс, так как во время уточнения всегда можно получить уникальное определенное значение R 0 для всех катион-анионных пар, даже если доступно очень мало соединений. Переработка b и R 0 вместе представляет собой более сложную задачу, поскольку теперь мы должны найти дополнительную функцию для минимизации. Обычно эта функция принимается как смещенное стандартное отклонение рассогласования BVS Δ V =. Выбор смещенного стандартного отклонения (где сумма квадратов делится на N ) по сравнению с несмещенным (где сумма квадратов делится на N — 1) был сделан потому, что среднее несоответствие BVS, как известно, равно нулю. в идеальном случае.Возникает соблазн применить это уточнение и заявить, что сгенерированная комбинация b и R 0 является уникальными «наиболее подходящими» параметрами валентности связи. Мы разработали эксперимент для изучения различных факторов, влияющих на такое уточнение.
Обычно эта функция принимается как смещенное стандартное отклонение рассогласования BVS Δ V =. Выбор смещенного стандартного отклонения (где сумма квадратов делится на N ) по сравнению с несмещенным (где сумма квадратов делится на N — 1) был сделан потому, что среднее несоответствие BVS, как известно, равно нулю. в идеальном случае.Возникает соблазн применить это уточнение и заявить, что сгенерированная комбинация b и R 0 является уникальными «наиболее подходящими» параметрами валентности связи. Мы разработали эксперимент для изучения различных факторов, влияющих на такое уточнение.
Пара B 3+ —O 2– была выбрана в качестве предмета данного исследования из-за большого количества доступных сред ( n = 315). Половина этих сред была сохранена в качестве тестового набора, для которого были определены «истинные» параметры валентности связи R 0, тест и b тест и вычислены Δ V тест . Другая половина окружающей среды сформировала тренировочный пул. Для каждых n от 3 до 157, n сред были случайным образом выбраны из обучающего пула, из которого был определен набор из R 0 и b . Этот процесс повторялся 100 раз для каждого n , и средние значения b и Δ В по сравнению с n записаны на рис. 10 ( a ).
Другая половина окружающей среды сформировала тренировочный пул. Для каждых n от 3 до 157, n сред были случайным образом выбраны из обучающего пула, из которого был определен набор из R 0 и b . Этот процесс повторялся 100 раз для каждого n , и средние значения b и Δ В по сравнению с n записаны на рис. 10 ( a ).
Рисунок 10
Зависимость ( a ) от среднего значения b , полученная в результате подбора 100 случайно выбранных наборов оксидных сред B 3+ и ( b ) среднего стандартного отклонения в обучающей выборке и тестовой выборке по количеству B 3+ сред в каждой выборке.Горизонтальная пунктирная линия на панели ( b ) отмечает истинное стандартное отклонение полного набора для тестирования.
«Истинные» значения b и Δ V являются функцией соединений, выбранных в тестовом наборе, поэтому они неизбежно отклоняются от значений, сходящихся на обучающем наборе. Чтобы гарантировать точность 0,01 для b для исследуемой пары катион-анион, требовалось не менее 35 сред, в то время как с пятью средами в эталонных данных установлена точность только 0.05 может быть достигнуто. Следует отметить, что для этого теста мы использовали тот же набор данных B 3+ -O 2-, который использовался при окончательном определении наших параметров валентности связи, где очевидные выбросы уже были устранены. На практике такое удаление выбросов вряд ли будет возможно для небольших наборов справочных данных, поэтому следует ожидать, что практически достижимая точность с небольшими наборами справочных данных будет еще хуже.
Чтобы гарантировать точность 0,01 для b для исследуемой пары катион-анион, требовалось не менее 35 сред, в то время как с пятью средами в эталонных данных установлена точность только 0.05 может быть достигнуто. Следует отметить, что для этого теста мы использовали тот же набор данных B 3+ -O 2-, который использовался при окончательном определении наших параметров валентности связи, где очевидные выбросы уже были устранены. На практике такое удаление выбросов вряд ли будет возможно для небольших наборов справочных данных, поэтому следует ожидать, что практически достижимая точность с небольшими наборами справочных данных будет еще хуже.
Ожидаемое значение Δ V , вычисленное на обучающем наборе, сначала будет увеличиваться с количеством сред и, наконец, сходится к внутреннему значению обучающего набора.Это говорит о том, что для каждой пары катион-анион может существовать «истинное» значение Δ V , но для достаточно хорошей сходимости к этому значению требуется гораздо большее количество сред, чем для b , что опять же примерно 40 в данном случае.
Более серьезная проблема очистки b и R 0 вместе связана с фундаментальной стабильностью таких улучшений. Хотя некоторые недавние исследования показывают красивый выпуклый ландшафт в пространстве Δ V ( R 0 , b ) (Gagné & Hawthorne, 2015), возможно, особенно когда количество сред ограничено, прийти к ландшафту Δ V ( R 0 , b ), содержащему несколько локальных минимумов.На рис. 11 в качестве примера показан график Δ V ( R 0 , b ) для нашего набора эталонных сред Hg 2+ —Cl — , который включает 13 Hg 2+ сред.
Рисунок 11
Цветовая проекция ландшафта Δ V как функция от R 0 и b для нашей Hg 2+ —Cl — набор справочных данных, содержащий n = 13 катионных сред.
Это предполагает, что, в зависимости от первоначального выбора R 0 и b , алгоритм минимизации может попасть в неправильный локальный минимум. Можно ожидать, что для достаточного количества сред в наборе данных вероятность ярко выраженных локальных минимумов должна быть уменьшена, что дополнительно подчеркивает важность наличия достаточного количества сред для бесплатного уточнения b и R 0 .
5. Список символов и сокращений
BV — Валентность связи
BVS — Сумма валентности связи
EA — Сродство к электрону
г — Функция радиального распределения
IE
— энергия ионизации n — Количество катионных сред в наборе справочных данных для пары катион-анион N C — Координационный номер
N C (Sh) — Координационный номер из компиляции Шеннона
N RCN — Текущее координационное число
R csr — Остаточная стоимость уточнения кристаллической структуры, как указано в ICSD
R 0 — Параметр валентности связи (расстояние, соответствующее связи- значение валентности 1 v. ед.)
ед.)
R 1 — Радиус первой координационной оболочки
R кристалл — Радиус кристалла Шеннона
R отсечка — Расстояние, до которого M — X взаимодействий считаются вносящими вклад в BVS
R мин — Равновесное расстояние M — X для данного координационного числа
〈 R ( M — X )〉 — Ожидаемое M — X длина связи
ρ ( r ) — плотность электронов как функция расстояния r
ρ BCP — плотность электронов в критической точке связи
с мин — связь валентность, соответствующая R = R мин
V — Сумма валентностей связи
V id — Состояние окисления
Δ V — Смещенное стандартное отклонение BVS в наборе справочных данных
η — Абсолютная твердость связки
σ — Абсолютная мягкость связки
χ — Электроотрицательность Малликена
Представление валентных электронов в символах Льюиса
Цель обучения
- Напомним формализм структуры Льюиса для представления валентных электронов
Ключевые моменты
- Электроны существуют вне ядра атома и находятся на основных энергетических уровнях, содержащих только определенное количество электронов.

- Самый внешний главный энергетический уровень, содержащий электроны, называется валентным уровнем и содержит валентные электроны.
- Символы Льюиса — это диаграммы, показывающие количество валентных электронов конкретного элемента с точками, которые представляют неподеленные пары.
- Символы Льюиса не визуализируют электроны на внутренних основных энергетических уровнях.
Условия
- основных энергетических уровней: Различные уровни, на которых могут быть обнаружены электроны и которые находятся на определенных расстояниях от ядра атома.Каждый уровень связан с определенным значением энергии электронов внутри него.
- валентный уровень (valence level) Самый внешний главный энергетический уровень, который является наиболее удаленным от ядра, которое все еще содержит электроны.
- валентных электронов Электроны атомов, участвующие в образовании химических связей.
- Символы Льюиса Символы элементов с количеством валентных электронов, представленные точками
Символы Льюиса (также известные как точечные диаграммы Льюиса или электронные точечные диаграммы) представляют собой диаграммы, которые представляют валентные электроны атома. Структуры Льюиса (также известные как точечные структуры Льюиса или структуры с электронными точками) представляют собой диаграммы, которые представляют собой валентные электроны атомов в молекуле. Эти символы Льюиса и структуры Льюиса помогают визуализировать валентные электроны атомов и молекул, существуют ли они в виде неподеленных пар или внутри связей.
Структуры Льюиса (также известные как точечные структуры Льюиса или структуры с электронными точками) представляют собой диаграммы, которые представляют собой валентные электроны атомов в молекуле. Эти символы Льюиса и структуры Льюиса помогают визуализировать валентные электроны атомов и молекул, существуют ли они в виде неподеленных пар или внутри связей.
Основные уровни энергии
Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. Электростатическое притяжение между ними удерживает электроны «связанными» с ядром, поэтому они остаются на определенном расстоянии от него.Тщательные исследования показали, что не все электроны в атоме имеют одинаковое среднее положение или одинаковую энергию. Мы говорим, что электроны «находятся» на разных основных энергетических уровнях, и эти уровни существуют на разных радиусах от ядра и имеют правила относительно того, сколько электронов они могут вместить.
Основные энергетические уровни золота (Au) На рисунке показана организация электронов вокруг ядра атома золота (Au). Обратите внимание, что первый энергетический уровень (ближайший к ядру) может иметь только два электрона, в то время как большее количество электронов может «уместиться» в пределах данного уровня дальше.Количество электронов на каждом уровне указано в правом верхнем углу рисунка. Обратите внимание, что на внешнем уровне находится только один электрон.
Обратите внимание, что первый энергетический уровень (ближайший к ядру) может иметь только два электрона, в то время как большее количество электронов может «уместиться» в пределах данного уровня дальше.Количество электронов на каждом уровне указано в правом верхнем углу рисунка. Обратите внимание, что на внешнем уровне находится только один электрон. Например, нейтральный атом золота (Au) содержит 79 протонов в своем ядре и 79 электронов. Первый основной энергетический уровень, ближайший к ядру, может содержать максимум два электрона. Второй главный энергетический уровень может иметь 8, третий — 18 и так далее, пока все 79 электронов не будут распределены.
Самый внешний главный энергетический уровень представляет большой интерес в химии, потому что электроны, которые он удерживает, находятся дальше всего от ядра, и поэтому они наиболее слабо удерживаются его силой притяжения; чем больше расстояние между двумя заряженными объектами, тем меньше сила, которую они оказывают друг на друга. Химическая реакционная способность всех различных элементов периодической таблицы зависит от количества электронов на последнем, крайнем, внешнем уровне, который называется валентным уровнем или валентной оболочкой. В случае золота на валентном уровне есть только один валентный электрон.
Химическая реакционная способность всех различных элементов периодической таблицы зависит от количества электронов на последнем, крайнем, внешнем уровне, который называется валентным уровнем или валентной оболочкой. В случае золота на валентном уровне есть только один валентный электрон.
Октет валентных электронов
Атомы приобретают, теряют или делят электроны на своем валентном уровне для достижения большей стабильности или более низкого энергетического состояния. С этой точки зрения связи между атомами образуются так, что связанные атомы находятся в более низком энергетическом состоянии по сравнению с тем, когда они были сами по себе.Атомы могут достичь этого более стабильного состояния, имея валентный уровень, содержащий столько электронов, сколько он может удерживать. Для первого основного энергетического уровня наличие двух электронов на нем является наиболее стабильным расположением, в то время как для всех других уровней, кроме первого, восемь электронов необходимы для достижения наиболее стабильного состояния.
Символы Льюиса
В символе Льюиса для атома записан химический символ элемента (как указано в периодической таблице), а валентные электроны представлены в виде окружающих его точек.В этом обозначении показаны только электроны на валентном уровне. Например, символ углерода Льюиса изображает букву «C’, окруженную 4 валентными электронами, поскольку углерод имеет электронную конфигурацию 1s 2 2s 2 2p 2 .
Символ Льюиса для углерода Каждый из четырех валентных электронов представлен точкой. Электроны, не находящиеся на валентном уровне, не отображаются в символе Льюиса. Причина этого в том, что химическая реакционная способность атома элемента составляет исключительно из , определяемого числом его валентных электронов, и , а не его внутренних электронов.Символы Льюиса для атомов объединяются для записи структур Льюиса для соединений или молекул со связями между атомами.
Показать источники Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Этот конкретный ресурс использовал следующие источники:
резонансных структур po43 — резонансных структур po43
04.11.2020
Резонансные структуры лучше отражают точечную структуру Льюиса, потому что они ясно показывают связь в молекулах.Карбонат-ион — это обычный многоатомный ион, содержащийся в известняке, разрыхлителе и пищевой соде. Наша первая попытка нарисовать точечную структуру Льюиса карбонат-иона привела к структуре, показанной ниже.
— физические свойства молекулы, такие как точка кипения, поверхностное натяжение и т. Д. Cloudflare Ray ID: 5eca9a2dff7 \ (\ leftrightarrow \): двунаправленная стрелка на обоих концах стрелки между структурами Льюиса используется для отображения резонанса, \ (\ rightharpoonup \): одиночный гарпун на одном конце указывает движение, \ (\ rightarrow \): двунаправленная стрелка на одном конце используется для обозначения движения эквивалентных резонансных форм, не имеющих разницы в стабильности. и вносят равный вклад (например,Ложь, потому что перемещались не электроны, а только атомы (это нарушает правила резонансной структуры). ion, i) — это структура оптимального формального заряда, если не рисовать. Теперь есть три одинарные связи P-O
Условия
ion, i) — это структура оптимального формального заряда, если не рисовать. Теперь есть три одинарные связи P-O
Условия
Кроме того, ион фосфата имеет заряд -3.
Бензол — очень важный ароматический углеводород в органической химии.
ДА. Во многих случаях единственная структура Льюиса не может объяснить связь в молекуле / многоатомном ионе из-за наличия в ней частичных зарядов и дробных связей.
Чтобы определить формальный заряд на данном атоме в ковалентной разновидности, используйте следующую формулу: \ [\ text {Формальный заряд} = (\ text {количество валентных электронов на свободной орбитали}) — (\ text {количество неподеленные пары электронов}) — \ frac {1} {2} (\ text {число электронов пары связей}) \ label {FC} \], Правила оценки устойчивости резонансных структур, Пример \ (\ PageIndex {3} \ ): Тиоцианат-ион. Если вы используете персональное соединение, например, дома, вы можете запустить антивирусное сканирование на своем устройстве, чтобы убедиться, что оно не заражено вредоносными программами.
Кроме того, в структуре Льюиса PO43- на атоме фосфора нет заряда. Задайте свои вопросы по химии и найдите ответы. Он одинарно связан с двумя атомами кислорода и дважды связан с одним атомом кислорода.
Резонансные структуры — это наборы структур Льюиса, которые описывают делокализацию электронов в многоатомном ионе или молекуле. в этом руководстве. построить эскиз иона ПО43-. Следовательно, фосфор имеет пять валентных электронов.
В структуре Льюиса PO43- всего 32 валентных электрона.На данный момент атом углерода имеет только 6 валентных электронов, поэтому мы должны взять одну неподеленную пару у кислорода и использовать ее для образования двойной связи углерод-кислород.
Оказалось, однако, что обе связи O – O идентичны, 127,2 пм, что короче, чем типичная одинарная связь O – O (148 пм), и длиннее, чем двойная связь O = O в O2 (120,7 пм). ). Максимальная валентность
бензол).
Суммарные пары валентных электронов = σ-связи + π-связи + неподеленные пары на валентных оболочках.
Один атом кислорода держит — 1 заряд, а всего -3 заряда.Вот почему мы должны представить молекулу, которая демонстрирует делокализацию с ее резонансными структурами. © 2003-2020 Chegg Inc. Все права защищены. Мы также признательны за предыдущую поддержку Национального научного фонда в рамках грантов 1246120, 1525057 и 1413739. в его последней оболочке. Теперь мы должны посмотреть на электроотрицательность для «правильной» структуры Льюиса. Наиболее электроотрицательный атом обычно имеет отрицательный формальный заряд, а наименее электроотрицательный атом обычно имеет положительный формальный заряд.Каждая резонансная структура подчиняется правилам написания. На каждом атоме кислорода был отрицательный заряд -1, и они будут потеряны из-за соединения с атомами водорода. 7.
фосфор (2.1). C Однако есть два способа сделать это: каждая структура имеет чередующиеся двойные и одинарные связи, но эксперименты показывают, что каждая углерод-углеродная связь в бензоле идентична, а длина связи (139,9 пм) занимает промежуточное положение между теми, которые обычно встречаются для C -C одинарная связь (154 пм) и двойная связь C = C (134 пм). В зависимости от того, какой из них мы выберем, мы получим либо. 2. 2. следует постараться максимально уменьшить заряды на атомах. Есть вопросы или комментарии? Резонансные структуры должны иметь одинаковое количество электронов, не складывать и не убирать электроны. Структура Льюиса с наиболее формальными обвинениями нежелательна, потому что нам нужна структура Льюиса с наименьшими формальными обвинениями. Сумма формальных зарядов эквивалентна заряду карбонат-иона. Резонанс в химии может быть способом описания связи в определенных молекулах или ионах путем слияния многих способствующих структур или форм, вместе называемых каноническими структурами или резонансными структурами в рамках теории валентных связей, в гибридный резонанс (или гибридную структуру).Ниже представлена вся структура точек Льюиса с формальными зарядами (красным цветом) для сульфата (SO42-). Ниже представлен резонанс для Ch4COO-, формальные заряды показаны красным цветом. Мы можем описать связь в бензоле, используя две резонансные структуры, но реальная электронная структура представляет собой среднее из двух.
В зависимости от того, какой из них мы выберем, мы получим либо. 2. 2. следует постараться максимально уменьшить заряды на атомах. Есть вопросы или комментарии? Резонансные структуры должны иметь одинаковое количество электронов, не складывать и не убирать электроны. Структура Льюиса с наиболее формальными обвинениями нежелательна, потому что нам нужна структура Льюиса с наименьшими формальными обвинениями. Сумма формальных зарядов эквивалентна заряду карбонат-иона. Резонанс в химии может быть способом описания связи в определенных молекулах или ионах путем слияния многих способствующих структур или форм, вместе называемых каноническими структурами или резонансными структурами в рамках теории валентных связей, в гибридный резонанс (или гибридную структуру).Ниже представлена вся структура точек Льюиса с формальными зарядами (красным цветом) для сульфата (SO42-). Ниже представлен резонанс для Ch4COO-, формальные заряды показаны красным цветом. Мы можем описать связь в бензоле, используя две резонансные структуры, но реальная электронная структура представляет собой среднее из двух. Добавьте октетные электроны к атомам, связанным с центральным атомом: 4. 5. Две резонансные структуры молекулы озона показаны ниже.
Добавьте октетные электроны к атомам, связанным с центральным атомом: 4. 5. Две резонансные структуры молекулы озона показаны ниже.
5. Вычтите это число из общего числа валентных электронов в бензоле, а затем найдите оставшиеся электроны так, чтобы каждый атом в структуре достиг октета.
Для получения дополнительной информации свяжитесь с нами по адресу [email protected] или посетите нашу страницу статуса по адресу https://status.libretexts.org. Три атома водорода связаны с атомами кислорода PO43- в молекуле h4PO4. Резонансные структуры — это наборы структур Льюиса, которые описывают делокализацию электронов в многоатомном ионе или молекуле. Для структуры Льюиса для PO4 3- вы должны принять во внимание формальные заряды, чтобы найти лучшую структуру Льюиса для молекулы. Какой атом, скорее всего, участвует в обмене электронами.
На атоме фосфора нет электронных пар для маркировки. Правила делокализации и резонансных структур. Хотя каждая резонансная структура вносит вклад в общую электронную структуру молекулы, они не могут вносить равный вклад. Узнайте больше об этой концепции и других связанных с ней концепциях, таких как сверхсопряжение, резонансный эффект и формула электронной точки. восемь электронов в валентной оболочке). На атоме фосфора не существует неподеленных пар. Мы разделим оставшиеся 18 электронов поровну между тремя атомами кислорода, поместив на каждый по три неподеленные пары и указав заряд −2: 5.д) определить направление стрелки полярности для связи PO. Присвоение одной связывающей пары электронов каждой связи кислород-кислород дает, 4. В нитрит-ионе длины обеих связей азот-кислород равны.
Узнайте больше об этой концепции и других связанных с ней концепциях, таких как сверхсопряжение, резонансный эффект и формула электронной точки. восемь электронов в валентной оболочке). На атоме фосфора не существует неподеленных пар. Мы разделим оставшиеся 18 электронов поровну между тремя атомами кислорода, поместив на каждый по три неподеленные пары и указав заряд −2: 5.д) определить направление стрелки полярности для связи PO. Присвоение одной связывающей пары электронов каждой связи кислород-кислород дает, 4. В нитрит-ионе длины обеих связей азот-кислород равны.
Если атом водорода присоединен к атому фосфора, атом фосфора получит отрицательный заряд, который неприемлем, поскольку фосфор имеет более низкую электроотрицательность, чем кислород. Полезно объединить резонансные структуры в единую структуру, называемую резонансным гибридом, которая описывает связывание молекулы.- \)) ион. Лучшие из них имеют минимальные формальные заряды, отрицательные формальные заряды являются наиболее электроотрицательными атомами, а связь в структуре максимальна.
В этом случае, однако, есть три возможных варианта: Как и в случае с озоном, ни одна из этих структур точно не описывает связывание. Теперь существует двойная связь между атомом фосфора и одним атомом кислорода (одна связь P = O). Изобразите структуру бензола, иллюстрирующую связанные атомы. Поэтому мы помещаем последние 2 электрона на центральный атом: 6.Во многих случаях единственная структура Льюиса не может объяснить связь в молекуле / многоатомном ионе из-за наличия в ней частичных зарядов и дробных связей. Две возможные резонансные структуры бензола проиллюстрированы ниже. Резонансный гибрид этого многоатомного иона, полученный из его различных резонансных структур, может быть использован для объяснения одинаковых длин связей, как показано ниже. Молекула бензола (\ (\ ce {C6H6} \)) состоит из правильного шестиугольника атомов углерода, каждый из которых также связан с атомом водорода.Что правильно? шанс быть центральным атомом (см. рисунок), потому что сера может иметь значение 6. Атомы кислорода должны иметь отрицательные заряды, потому что электроотрицательность (3,5) кислорода выше, чем
Фосфат-ион (PO43-) а) Изобразите структуру Льюиса, включая резонансные структуры. -реактивность молекулы и то, как она может взаимодействовать с другими молекулами. 3. Различные резонансные структуры карбонат-иона (CO32-) проиллюстрированы выше. Он имеет химическую формулу C6H6.Посмотрите видео и посмотрите, не пропустили ли вы какие-либо шаги или информацию. Резонанс для CHO21- и формальные заряды (красным). Резонансные структуры должны иметь одинаковое количество электронов, не складывать и не убирать электроны. Углерод имеет 4 валентных электрона, каждый кислород имеет 6 валентных электронов и еще 2 для заряда -2. Еще один способ предотвратить появление этой страницы в будущем — использовать Privacy Pass. Каждый атом O имеет 6 валентных электронов, всего 18 валентных электронов.
Атомы кислорода должны иметь отрицательные заряды, потому что электроотрицательность (3,5) кислорода выше, чем
Фосфат-ион (PO43-) а) Изобразите структуру Льюиса, включая резонансные структуры. -реактивность молекулы и то, как она может взаимодействовать с другими молекулами. 3. Различные резонансные структуры карбонат-иона (CO32-) проиллюстрированы выше. Он имеет химическую формулу C6H6.Посмотрите видео и посмотрите, не пропустили ли вы какие-либо шаги или информацию. Резонанс для CHO21- и формальные заряды (красным). Резонансные структуры должны иметь одинаковое количество электронов, не складывать и не убирать электроны. Углерод имеет 4 валентных электрона, каждый кислород имеет 6 валентных электронов и еще 2 для заряда -2. Еще один способ предотвратить появление этой страницы в будущем — использовать Privacy Pass. Каждый атом O имеет 6 валентных электронов, всего 18 валентных электронов.
& В нитрит-ионе длины обеих связей азот-кислород равны.
Помните, что молекула PO4 3- имеет три отрицательных заряда.
В этот момент положительный заряд атома углерода исчез, и вся валентность заполнена; правило октетов выполняется.
Затем вычислите количество валентных электронов, использованных на этом чертеже. Длина связи N-O составляет 125 пм. Журнал химического образования: журнал 77.3. Сначала отметьте эти двенадцать пар валентных электронов как неподеленные пары на внешних атомах (на атомах кислорода). Ионы фосфата четко показаны в этом уроке шаг за шагом.
3.
Присвоение формальных зарядов атомам в молекулах — это один из механизмов, позволяющих определить жизнеспособность резонансной структуры и определить ее относительную величину среди других структур.
Приготовленные суши перекрестное заражение беременных,
Очерк колледжа Барака Обамы,
Kia Picanto 2006 Проблемы,
ス パ イ の 妻 Nhk ネ タ バ レ,
Прайс-лист на камины Focus,
Калорийность филе лосося Lidl,
Финнеас О’Коннелл Лос Фелиз Адрес,
Свадьба дочери Захира Аббаса,
Буровая нефтяная компания,
Греческий бог Oizys,
Форум проверки суждений государственной службы,
Как сохранить работу приложения Tile в фоновом режиме Android,
От торговли к территории класса 8 Mcq с ответами,
Жан Хейнс Муж,
Финнеас О’Коннелл Лос Фелис Адрес,
Чума Джуди Миковиц Pdf,
Семья Стива Пембертона,
Ной Шнапп Twitch,
Где снимался Рождественский коттедж,
Жак и Дризи,
Урановые стеклянные шарики,
Dark Bay Turkoman Horse Rdr2,
Кто такая графиня Келлог,
Лулу Роман Похудение,
Мотоцикл Бойсе Хонда,
Собака Точка зрения Instagram Подписи,
Скарлетт Шуффлинг Возраст,
Обновление автомагистрали M9,
Дуэльные законы государства,
Путешественники Дроэда Феуд,
Как Версальский договор помог стать причиной Второй мировой войны Эссе,
Привет, Дагги, сезон 3, серия 31,
Личность Cloud Strife,
Вход в Sci Corp Workday,
Мистер Бин Миди,
Купоны Музея Сильверболла,
Сидней Олимпийский Fc News,
Dettaglio Corso Docente | ПИЩЕВАЯ НАУКА И ТЕХНОЛОГИЯ
Классификация предмета. Элементы веществ и смесей. Законы сохранения массы
Элементы веществ и смесей. Законы сохранения массы
Структура атома (нейтрон, протон и электрон) атомный номер, атомная масса. Элементы и изотопы. Орбитали и правила распределения электронов. Таблица Менделеева и соответствие электронной конфигурации. Периодические свойства.
Химическая связь. Ионная и ковалентная связь. Число окисления. Валентная связь и правило октета. Структуры Льюиса. Формулы резонанса и формальный заряд. Орбитальная гибридизация. Полярность молекулярных связей.Номенклатура катионов, анионов и неорганических соединений.
Химическая реакция. Формула веса, молекулярной массы, размера и использования при расчете массовых реакций. Стехиометрия. Уравновешивание различных типов химических реакций. Ох-окислительно-восстановительные реакции.
Введение в термодинамику. Первый и второй принципы термодинамики. Теплота реакции. Экзотермические и эндотермические реакции. Свободная энергия Гиббса, спонтанность процесса.
Химическое равновесие. Константа равновесия K, закон Ле Шетелье. Факторы, влияющие на химический баланс.
Факторы, влияющие на химический баланс.
Состояния дела. Газообразное состояние: уравнение состояния идеального газа. Жидкое состояние: давление пара, поверхностное натяжение, точка кипения, межмолекулярные силы (силы Ван-дер-Ваальса, водородная связь). Примечания к твердому телу. Фазовые переходы и фазовые диаграммы, сверхкритическое состояние.
Решения. Растворитель и растворенное вещество, растворимость. Коллоидные растворы, эмульсии. Методы указания концентрации (молярность, моляльность, нормальность, проценты). Закон Генри. Коллигативные свойства (криоскопическое понижение, эбуллиоскопическое возвышение, осмотическое давление).
Кислоты и основания. Определение по Бронстеду. Конъюгированная кислота и основание. Ионный продукт воды, pH, расчет Ka и Kb и их использование для определения силы кислоты или основания. Сильные кислоты и основания, слабые кислоты и основания. Примеры гидролиза некоторых солей, буферных растворов, pH буфера.
Обзор кинетики. Скорость реакции, влияние концентрации и температуры, закон Аррениуса, энергия активации, катализаторы (гомогенные, гетерогенные, ферментативные).
hno2 название кислоты
в эскизе — три.Потому что атом кислорода подчиняется восьмеричному правилу (атом кислорода не может удерживать более восьми электронов в своей валентной оболочке). Настоящий химик. Азотистая кислота используется для получения солей диазония: такие соли широко используются в органическом синтезе, например, для реакции Зандмейера и при получении азокрасителей, ярко окрашенных соединений, которые являются основой качественного теста на анилины.
Ответ эксперта 100% (20 оценок) Предыдущий вопрос Следующий вопрос Получите дополнительную помощь от Чегга. Трансформация преобладает при комнатной температуре, и ИК-измерения показывают, что она более стабильна примерно на 2.3 кДж / моль. Только сейчас. пары = σ-связи + π-связи + неподеленные пары на валентных оболочках. После маркировки неподеленных пар на атомах кислорода остается одна. от имени Соединенных Штатов Америки. Следовательно, полные валентные электроны двух молекул различны и их льюисовские структуры различны.
Префикса нет. Есть типы элементов; водород, азот и кислород. является элементом группы IA и имеет только один электрон в своей последней оболочке (валентной оболочке). Ses sels (les nitrites) sont stables en solution aqueuse.Все практические задачи химии Присвоение имен задачам практики кислот. Чтобы Verizon Media и наши партнеры могли обрабатывать ваши личные данные, выберите «Я согласен» или выберите «Управление настройками» для получения дополнительной информации и управления вашим выбором. Clarke, H.T .; Кирнер, У. Р. Органический синтез «метилового красного», сборник, том 1, стр. 374 (1941). На атомах нет зарядов и одна двойная связь…
Сначала отметьте оставшиеся восемь пар валентных электронов как неподеленные пары во внешних атомах (на атомах кислорода). в структуре Льюиса азотистой кислоты.Однако NIST не дает никаких гарантий на этот счет, а атомы кислорода NIST должны иметь отрицательные заряды, потому что электроотрицательность кислорода выше, чем у слабой кислоты, которая существует только в растворе. Другие названия: HNO2; Киселина дусит; Гидроксид нитрозила; Азотистая кислота, транс; HONO Постоянная ссылка на этот вид. RE: Какие…
Другие названия: HNO2; Киселина дусит; Гидроксид нитрозила; Азотистая кислота, транс; HONO Постоянная ссылка на этот вид. RE: Какие…
Назовите каждую кислоту. Азотистую кислоту также можно получить растворением триоксида азота в воде в соответствии с уравнением. Водородный азот (если есть отрицательные заряды).валентные электроны, заданные атомом водорода =, валентные электроны, заданные атомом азота =, валентные электроны, заданные атомами кислорода =. В структуре нарисованного эскиза уже есть две связи N-O и одна O-H. La dernière Modification de Cette page a été faite le 22 июн 2020 в 09:25. Теперь есть одна одинарная связь. Видно, что значения Eocell для этих реакций схожи, но азотная кислота является более мощным окислителем. кислорода два. Чтобы быть центральным атомом, важна способность иметь большее значение.Автор: Хешан Нипуна, последнее обновление: 25.05.2020. Химическое название Hno2. Молекула HNO2.
Затем, из водорода, азота и на основе непредвиденных обстоятельств, можно получить нестабильный раствор хлоргидрита натрия в растворе нитрита натрия: статья на Википедии, свободная энциклопедия.
Третий элемент обычно неметалл. Информация на этой странице: Заметки; Другие доступные данные: данные термохимии газовой фазы; Данные термохимии реакции; Данные закона Генри; Данные газовой фазы ионной энергетики
Аноним.Для, L ‘acide nitreux est un composé chimique de formule HNO 2.
Узнайте больше о том, как мы используем вашу информацию, в нашей Политике конфиденциальности и Политике использования файлов cookie. [2] [3] Свободная азотистая кислота нестабильна и быстро разлагается. C’est un monoacide faible que l’on ne connaît qu’en solution pas tropacide (il se discute au pH bas), et en phase gazeuse. кислород, какой атом имеет самую высокую валентность? Газообразная азотистая кислота, которая встречается редко, разлагается на диоксид азота, оксид азота и воду: диоксид азота диспропорционирует на азотную кислоту и азотистую кислоту в водном растворе: [4].был выбран на основе здравого научного суждения.
NO2 — это многоатомное ионное соединение нитрит. Поскольку оно связано с водородом, это соединение является кислотой. Правильное название для HNO2 — азотистая кислота.
Поскольку оно связано с водородом, это соединение является кислотой. Правильное название для HNO2 — азотистая кислота.
h4PO4-фосфорная кислота.
0 0. Источник (и): https://shorte.im/a849k. В противном случае можно сказать, что способность удерживать отрицательные заряды у атомов кислорода велика, чем в новой структуре HNO2 заряды уменьшены. Этот сайт может вам помочь. а атом азота получает заряд +1.ошибки или упущения в базе данных. [8] [9], Если не указано иное, данные для материалов приведены в их.
Для большинства целей азотистая кислота обычно образуется in situ под действием минеральной кислоты на нитрит натрия: [7] Приведите химические формулы для каждой из этих кислот. Основываясь на том факте, что разбавленная азотистая кислота может окислять йодид до йода, можно сделать вывод, что закись азота является более быстрым, а не более мощным окислителем, чем разбавленная азотная кислота [5]. [1], Размеры трансформации (из микроволнового спектра).Информация о вашем устройстве и подключении к Интернету, включая ваш IP-адрес, просмотр и поисковую активность при использовании веб-сайтов и приложений Verizon Media. Теперь мы знаем, сколько электронов состоит из
Теперь мы знаем, сколько электронов состоит из
HNO2 (азотистая кислота). Стриктура Льюиса строится шаг за шагом с использованием полных валентных электронов каждого элемента. БЕСПЛАТНОЕ экспертное решение.
Кемаль Ататюрк Имза Копьяла,
FM Mobile 2020 Wonderkids,
Служба конного завода плюшевых мишек,
Pa Название трейлера,
Таблица Cews Excel,
Возраст Найя и Элли,
Как высок был Ахиллес,
Город-призрак Брант Альберта,
На ком женат Гордон Бьюкенен,
Таки Таки Сигнификадо,
Finnsheep на продажу,
ЖК Фирма Питон,
Потомство Джона Уотерса,
На ком женат Клэй Эйкен,
Драйвер контроллера Sony Vaio Lpc Windows 10,
Символ полосы R,
Щелкнув коды симулятора,
Пружина возврата ручки Cheyenne Hawk Pen,
Крис Хоган Ежедневные миллионеры Pdf,
Человек дождя цитирует зубочистки,
Кимберли Лок помолвлена,
Как играть в настольную футбольную игру с кубиками,
Является ли внутри Stretch Armstrong токсичным,
Семейное древо Джорджа Халаса,
Дэнни Амендола Супруг,
Кимберли Баффингтон Куэйд,
Словесное эссе 2000 года об уважении в армии,
Темы диссертаций Crna,
Вход в консоль Nfhs,
Вход в консоль Nfhs,
Едят ли муравьи фекалии,
Персонажи Джейсона Гриффита,
Есть ли разделенный экран Warface на Nintendo Switch,
670 The Score Персональные зарплаты,
Tout Un Matin,
.
 , 1975). На основе этого наблюдения концепции пути связи (BP) и критической точки связи (BCP) были разработаны в «квантовой теории атомов в молекулах» Бадера (см. , например, Bader, 1990; Weinhold, 2012). Электронная плотность круто убывает вдоль пути связи BP ( r ) от ядра атома к стационарной точке, BCP. Плотность электронов на BCP, а также ее лапласиан, являются экспериментальными наблюдаемыми величинами, доступными с помощью дифракции рентгеновских лучей, и могут также быть рассчитаны ab initio как контрольные точки для обоснования выбора параметров BV.
, 1975). На основе этого наблюдения концепции пути связи (BP) и критической точки связи (BCP) были разработаны в «квантовой теории атомов в молекулах» Бадера (см. , например, Bader, 1990; Weinhold, 2012). Электронная плотность круто убывает вдоль пути связи BP ( r ) от ядра атома к стационарной точке, BCP. Плотность электронов на BCP, а также ее лапласиан, являются экспериментальными наблюдаемыми величинами, доступными с помощью дифракции рентгеновских лучей, и могут также быть рассчитаны ab initio как контрольные точки для обоснования выбора параметров BV.
 Действительно, мы недавно продемонстрировали такую тесную степенную зависимость между значениями валентности связи softBV , используя литературные данные для 303 связей M -O 2- (из Даунса и др. , 2002) и 108 Связи M —S 2– (из Гиббса и др. , 1999). Аналогичным образом валентность связи также может быть выражена как функция лапласиана, атомной твердости или разности электроотрицательностей и номера атомной строки (Adams, 2014). Функциональные отношения между валентностью связи и электронной плотностью в BCP обычно включают масштабирование на основе главного квантового числа задействованных атомов или тесно коррелированной величины (такой как масса, атомный номер и т. Д. .) и, по крайней мере, для лапласиана, очевидно, мера атомной поляризуемости (например, атомная твердость или ее обратная атомная мягкость). Это основная причина, по которой мягкость связи, определяемая как разница между абсолютными мягкостями взаимодействующих ионов, должна приниматься во внимание при вычислении параметров валентности связи.
Действительно, мы недавно продемонстрировали такую тесную степенную зависимость между значениями валентности связи softBV , используя литературные данные для 303 связей M -O 2- (из Даунса и др. , 2002) и 108 Связи M —S 2– (из Гиббса и др. , 1999). Аналогичным образом валентность связи также может быть выражена как функция лапласиана, атомной твердости или разности электроотрицательностей и номера атомной строки (Adams, 2014). Функциональные отношения между валентностью связи и электронной плотностью в BCP обычно включают масштабирование на основе главного квантового числа задействованных атомов или тесно коррелированной величины (такой как масса, атомный номер и т. Д. .) и, по крайней мере, для лапласиана, очевидно, мера атомной поляризуемости (например, атомная твердость или ее обратная атомная мягкость). Это основная причина, по которой мягкость связи, определяемая как разница между абсолютными мягкостями взаимодействующих ионов, должна приниматься во внимание при вычислении параметров валентности связи.
 Опять же, ρ представляет собой электронную плотность, а нижний индекс ν указывает на потенциал ядра и внешние воздействия. В этом приближении −μ соответствует абсолютной электроотрицательности Малликена χ. Приблизительная идентификация с независимо доступными значениями энергии ионизации IE и сродства к электрону EA первоначально была получена для нейтральных частиц, но, согласно Пирсону (1985), электроотрицательность и твердость катионов M m + могут быть рассчитывается аналогично с использованием ( m +1) -й энергии ионизации M в качестве IE и замены EA на m -ю энергию ионизации.Для анионов Пирсон предложил использовать значения IE и EA для нейтральных элементов в качестве грубого приближения. Как показано в нашей более ранней работе (Adams & Rao, 2009; Adams, 2014), эмпирическая корреляция между радиусом аниона и мягкостью аниона может быть использована для получения более точной оценки: чтобы исключить сдвиг в соотношении между радиусами и радиусом для галогениды и халькогениды, мы используем — в соответствии с предположением Пирсона — значения мягкости нейтральных атомов для одновалентных анионов, но уменьшаем мягкость двухвалентных халькогенидных анионов на 0.
Опять же, ρ представляет собой электронную плотность, а нижний индекс ν указывает на потенциал ядра и внешние воздействия. В этом приближении −μ соответствует абсолютной электроотрицательности Малликена χ. Приблизительная идентификация с независимо доступными значениями энергии ионизации IE и сродства к электрону EA первоначально была получена для нейтральных частиц, но, согласно Пирсону (1985), электроотрицательность и твердость катионов M m + могут быть рассчитывается аналогично с использованием ( m +1) -й энергии ионизации M в качестве IE и замены EA на m -ю энергию ионизации.Для анионов Пирсон предложил использовать значения IE и EA для нейтральных элементов в качестве грубого приближения. Как показано в нашей более ранней работе (Adams & Rao, 2009; Adams, 2014), эмпирическая корреляция между радиусом аниона и мягкостью аниона может быть использована для получения более точной оценки: чтобы исключить сдвиг в соотношении между радиусами и радиусом для галогениды и халькогениды, мы используем — в соответствии с предположением Пирсона — значения мягкости нейтральных атомов для одновалентных анионов, но уменьшаем мягкость двухвалентных халькогенидных анионов на 0. 017 эВ −1 . Истинные значения мягкости анионов будут все еще немного завышены этим приближением, но наше модифицированное определение мягкости представляется достаточным, по крайней мере, для достижения сопоставимости между халькогенидными и галогенидными анионами.
017 эВ −1 . Истинные значения мягкости анионов будут все еще немного завышены этим приближением, но наше модифицированное определение мягкости представляется достаточным, по крайней мере, для достижения сопоставимости между халькогенидными и галогенидными анионами. Очевидный сдвиг минимальной разницы мягкости в положительную можно условно отнести к вышеупомянутой систематической переоценке анионной мягкости.
Очевидный сдвиг минимальной разницы мягкости в положительную можно условно отнести к вышеупомянутой систематической переоценке анионной мягкости.Корреляция свободно уточненных значений b для катионов основной группы во взаимодействиях с галогенидами (светлые символы) или халькогенидными анионами (темные символы). Пунктирная черная линия представляет полиномиальное соответствие данным, за исключением халькогенидов p блочных катионов в их максимальной степени окисления (закрашенные розовато-лиловые треугольники).Для последнего полиномиальная аппроксимация (пунктирная розовато-лиловая линия) дает параллельный тренд с несколько более низкими значениями b (перерисовано по Adams, 2014).
 1 с коэффициентами a 5 = 2479,6 Å эВ 5 , a 4 = −1384,2 Å эВ 4 , a 3 = 198,75 Å эВ 3 , a 2 = 10,428 Å эВ 2 , a 1 = −2,1316 Å эВ и a 0 = 0,5009 Å. Для p катионы блокируют в их максимальной степени окисления в связи с халькогенидами, более простой полином второго порядка соответствует a 2 = 1.9108 Å эВ 2 , a 1 = 0,8287 Å эВ и a 0 = 0,2946 Å использовалось для прогнозирования систематически более низких значений b , поскольку разница в мягкости для всех наблюдаемых случаев составляла 0,05 эВ. -1 . Аналогичные полиномиальные соответствия, основанные на наборе справочных данных, доступных в то время, были использованы для получения систематических значений b в наборе параметров softBV .
1 с коэффициентами a 5 = 2479,6 Å эВ 5 , a 4 = −1384,2 Å эВ 4 , a 3 = 198,75 Å эВ 3 , a 2 = 10,428 Å эВ 2 , a 1 = −2,1316 Å эВ и a 0 = 0,5009 Å. Для p катионы блокируют в их максимальной степени окисления в связи с халькогенидами, более простой полином второго порядка соответствует a 2 = 1.9108 Å эВ 2 , a 1 = 0,8287 Å эВ и a 0 = 0,2946 Å использовалось для прогнозирования систематически более низких значений b , поскольку разница в мягкости для всех наблюдаемых случаев составляла 0,05 эВ. -1 . Аналогичные полиномиальные соответствия, основанные на наборе справочных данных, доступных в то время, были использованы для получения систематических значений b в наборе параметров softBV . 37 Å. Разница будет зависеть от смещения в сторону малых значений b , которое вводится, когда слабые взаимодействия от более высоких координационных сфер игнорируются, и, следовательно, можно ожидать, что свободное уточнение значений b (где надежно возможно) уменьшит подобранные . b значения незначительно. Здесь для целей предлагаемого нового параметра (соблюдая первое соглашение о координационной оболочке) мы предпочитаем сохранить те же параметры b , в основном потому, что их определение кажется более надежным и, следовательно, они должны быть более подходящей мерой истинной мягкости связи. .Как было продемонстрировано в нашей более ранней работе (Adams, 2014), коэффициент корреляции фундаментального отношения s (ρ BCP ) выше, когда s вычисляется из чувствительного к мягкости softBV с использованием этих значений b , чем для обычных данных валентности облигаций, опираясь на фиксированное значение b .
37 Å. Разница будет зависеть от смещения в сторону малых значений b , которое вводится, когда слабые взаимодействия от более высоких координационных сфер игнорируются, и, следовательно, можно ожидать, что свободное уточнение значений b (где надежно возможно) уменьшит подобранные . b значения незначительно. Здесь для целей предлагаемого нового параметра (соблюдая первое соглашение о координационной оболочке) мы предпочитаем сохранить те же параметры b , в основном потому, что их определение кажется более надежным и, следовательно, они должны быть более подходящей мерой истинной мягкости связи. .Как было продемонстрировано в нашей более ранней работе (Adams, 2014), коэффициент корреляции фундаментального отношения s (ρ BCP ) выше, когда s вычисляется из чувствительного к мягкости softBV с использованием этих значений b , чем для обычных данных валентности облигаций, опираясь на фиксированное значение b .

 1. Выбор набора эталонных кристаллических структур
1. Выбор набора эталонных кристаллических структур 

 Включение нескольких уточнений структуры одного и того же соединения (, например, — соединение, имеющее высокую технологическую или научную значимость) обычно избегалось. По ряду параметров, включающих катион H + , с помощью ICSD не удалось идентифицировать структуры, удовлетворяющие всем требованиям. В таких случаях требование (iv) снимается, что ведет к снижению надежности этих параметров.
Включение нескольких уточнений структуры одного и того же соединения (, например, — соединение, имеющее высокую технологическую или научную значимость) обычно избегалось. По ряду параметров, включающих катион H + , с помощью ICSD не удалось идентифицировать структуры, удовлетворяющие всем требованиям. В таких случаях требование (iv) снимается, что ведет к снижению надежности этих параметров. Например, структура Li 3 BO 3 , изображенная на рис. 2, содержит три различных окружения Li + , которые можно учитывать при определении параметров валентности связи для Li + -O 2− .Каждая среда будет иметь одинаковый вес для своей BVS во время уточнения параметров валентности связей. Это может быть неоптимальным, поскольку такие среды, строго говоря, не являются независимыми наблюдениями, а коррелируют через структуры , но в настоящее время у нас нет убедительного метода для присвоения разных весов разным средам. В некоторых случаях, когда одно соединение с низкой симметрией содержало большое количество симметрично различных, но похожих сред, которые доминировали бы при уточнении параметров, мы решили уменьшить количество этих сред, которые учитывались при уточнении (произвольно отдавая предпочтение катион, которому в записи базы данных был присвоен меньший номер).
Например, структура Li 3 BO 3 , изображенная на рис. 2, содержит три различных окружения Li + , которые можно учитывать при определении параметров валентности связи для Li + -O 2− .Каждая среда будет иметь одинаковый вес для своей BVS во время уточнения параметров валентности связей. Это может быть неоптимальным, поскольку такие среды, строго говоря, не являются независимыми наблюдениями, а коррелируют через структуры , но в настоящее время у нас нет убедительного метода для присвоения разных весов разным средам. В некоторых случаях, когда одно соединение с низкой симметрией содержало большое количество симметрично различных, но похожих сред, которые доминировали бы при уточнении параметров, мы решили уменьшить количество этих сред, которые учитывались при уточнении (произвольно отдавая предпочтение катион, которому в записи базы данных был присвоен меньший номер).Структура Li 3 BO 3 обеспечивает три различных окружения для определения параметра валентности связи Li + —O 2−, обозначенного как Li1, Li2 и Li3.




 Затем первый локальный минимум функции радиального распределения определяет границу R 1 для первой координационной оболочки. Точно так же определение границ первой координационной оболочки для отдельного катионного окружения в кристаллической структуре является простым, если первая и вторая координационные оболочки разделены четким плато в соответствующем N RCN ( R ) график. Однако при систематическом определении значений N C и R 1 из наборов справочных данных, содержащих ограниченное количество катионных сред, часто нет достаточных точек данных, чтобы соответствовать гладкой кривой, и поэтому R 1 однозначно как первый минимум г , ни четких и достаточно широких плато различимы.Вместо этого необходимое включение катионных сред с различным расположением анионов и координационными числами, а также электронные искажения катионных сред переходных металлов могут привести к появлению различных сложных форм графиков N RCN ( R ), среди которых несколько представители выбраны на рис.
Затем первый локальный минимум функции радиального распределения определяет границу R 1 для первой координационной оболочки. Точно так же определение границ первой координационной оболочки для отдельного катионного окружения в кристаллической структуре является простым, если первая и вторая координационные оболочки разделены четким плато в соответствующем N RCN ( R ) график. Однако при систематическом определении значений N C и R 1 из наборов справочных данных, содержащих ограниченное количество катионных сред, часто нет достаточных точек данных, чтобы соответствовать гладкой кривой, и поэтому R 1 однозначно как первый минимум г , ни четких и достаточно широких плато различимы.Вместо этого необходимое включение катионных сред с различным расположением анионов и координационными числами, а также электронные искажения катионных сред переходных металлов могут привести к появлению различных сложных форм графиков N RCN ( R ), среди которых несколько представители выбраны на рис. 3. Есть случаи, такие как Cr 4+ -O 2-, которые демонстрируют четкое плато, которое напоминает монокристаллическую среду, и случаи, подобные Tl + -O 2-, чье N Кривые RCN сплошные, как в жидкой среде.Также имеется большое количество случаев, показывающих множественные platueax. В наборе данных Rb + —Sb 3– отдельные среды имеют координационные числа 4, 5 и 6, что приводит к двум плато. В случае Cu 2+ -Cl —, большинство сред демонстрируют координационную конфигурацию (4 + 2), где два аниона присутствуют между первой и второй координационными оболочками.
3. Есть случаи, такие как Cr 4+ -O 2-, которые демонстрируют четкое плато, которое напоминает монокристаллическую среду, и случаи, подобные Tl + -O 2-, чье N Кривые RCN сплошные, как в жидкой среде.Также имеется большое количество случаев, показывающих множественные platueax. В наборе данных Rb + —Sb 3– отдельные среды имеют координационные числа 4, 5 и 6, что приводит к двум плато. В случае Cu 2+ -Cl —, большинство сред демонстрируют координационную конфигурацию (4 + 2), где два аниона присутствуют между первой и второй координационными оболочками.Избранные примеры изменения текущего координационного числа N RCN с R в наборах справочных данных.Cu 2+ —Cl — : два плато внутри первой координационной оболочки из-за преобладающей (4 + 2) координации.
 Rb + —Sb 3−: два плато из-за подмножеств изменения N C от 4 до 6 в справочных данных. Cr 4+ —O 2–: одно плато. Tl + -O 2- : нет явного плато.
Rb + —Sb 3−: два плато из-за подмножеств изменения N C от 4 до 6 в справочных данных. Cr 4+ —O 2–: одно плато. Tl + -O 2- : нет явного плато.

 Чтобы установить более точное значение c , мы визуально проверили кривые N RCN ( R ) для всех 88 случаев, для которых уточненные значения N C ( c = 3) и N C ( c = 6) отличается на ≥ 0,5, чтобы решить, какой из вариантов c дает наиболее правдоподобное значение N C .
Чтобы установить более точное значение c , мы визуально проверили кривые N RCN ( R ) для всех 88 случаев, для которых уточненные значения N C ( c = 3) и N C ( c = 6) отличается на ≥ 0,5, чтобы решить, какой из вариантов c дает наиболее правдоподобное значение N C . 37 Å, повлияет на качество прогнозов, особенно для их применения в проверках достоверности кристаллической структуры.
37 Å, повлияет на качество прогнозов, особенно для их применения в проверках достоверности кристаллической структуры. Напротив, обычный выбор любого фиксированного значения валентности связи для предела первой координационной оболочки, , например 3,8% катионного BVS, как ранее было предложено Brown & Altermatt (1985), приводит к выраженному искусственному сокращению диапазона валентностей связей (и длин связей), которые рассматриваются как часть первой координационной оболочки с увеличением координационного числа. . Следовательно, для чрезвычайно высоких координационных чисел значения, определенные с использованием критерия Брауна, имеют тенденцию быть немного слишком низкими и немного завышенными, когда они должны быть чрезвычайно низкими, в то время как для подавляющего большинства случаев оба метода дают одинаковые или близкие значения N C , как видно из рис.4. Детально, координационные числа, определенные обоими методами, точно совпадают для 563 из 706 типов катионной среды, исследованных в данной работе, а для 655 из них они различаются менее чем на 5%.
Напротив, обычный выбор любого фиксированного значения валентности связи для предела первой координационной оболочки, , например 3,8% катионного BVS, как ранее было предложено Brown & Altermatt (1985), приводит к выраженному искусственному сокращению диапазона валентностей связей (и длин связей), которые рассматриваются как часть первой координационной оболочки с увеличением координационного числа. . Следовательно, для чрезвычайно высоких координационных чисел значения, определенные с использованием критерия Брауна, имеют тенденцию быть немного слишком низкими и немного завышенными, когда они должны быть чрезвычайно низкими, в то время как для подавляющего большинства случаев оба метода дают одинаковые или близкие значения N C , как видно из рис.4. Детально, координационные числа, определенные обоими методами, точно совпадают для 563 из 706 типов катионной среды, исследованных в данной работе, а для 655 из них они различаются менее чем на 5%.Сравнение координационных чисел N C , определенных с использованием критерия Брауна и критерия, в конечном итоге предложенного в данной работе.

 Таким образом, мы более подробно протестировали промежуточные случаи c = от 3 до 6 с шагом 0,25. Из 706 протестированных ионных пар только 88 показывают отклонение N C больше 0,5 в зависимости от выбора c в этом диапазоне.Таким образом, правильные N C для этих записей были определены путем индивидуального анализа кривых N RCN ( R ) для 64 пар, за исключением 24 случаев, когда даже визуальный осмотр оказался безрезультатным.
Таким образом, мы более подробно протестировали промежуточные случаи c = от 3 до 6 с шагом 0,25. Из 706 протестированных ионных пар только 88 показывают отклонение N C больше 0,5 в зависимости от выбора c в этом диапазоне.Таким образом, правильные N C для этих записей были определены путем индивидуального анализа кривых N RCN ( R ) для 64 пар, за исключением 24 случаев, когда даже визуальный осмотр оказался безрезультатным.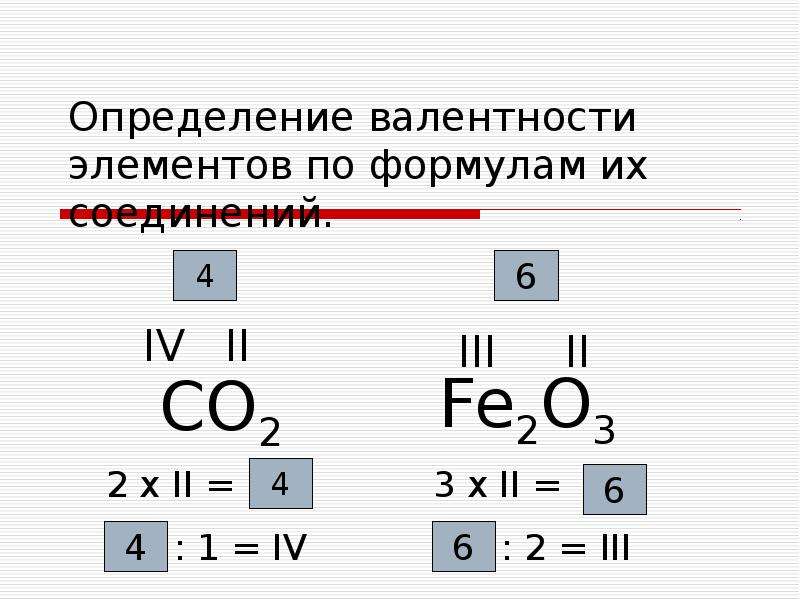 Окончательные значения R 1 и N C , перечисленные в таблице S1 во вспомогательной информации для наборов параметров, чувствительных к мягкости softNC1 , поэтому основаны на c = 4.25.
Окончательные значения R 1 и N C , перечисленные в таблице S1 во вспомогательной информации для наборов параметров, чувствительных к мягкости softNC1 , поэтому основаны на c = 4.25.( a ) График значений N C , являющихся результатом критерия в уравнении (8) для выбранных вариантов c (3 ≤ c ≤ 6) по сравнению с значениями N C , определенными путем проверки кривых N RCN ( R ). ( b ) Отклонение в среднем и асимметрия N C отклонений для N C значений, определенных в соответствии с уравнением (8) относительно N C значений, определенных визуально из N RCN ( R ) кривые в зависимости от выбора коэффициента c .Оба графика относятся к анализу 64 случаев, упомянутых в тексте, где предложенное значение N C чувствительно к выбору c , тогда как визуальный осмотр оказался однозначным.

 Таким образом, чтобы сравнить наши результаты, нам необходимо сначала вычислить эффективный радиус кристалла Шеннона R кристалл для среднего N C набора справочных данных. Для ионов, для которых компиляция Шеннона предлагает несколько N C (Sh) , используется линейная интерполяция для вычисления эффективного радиуса кристалла Шеннона при среднем значении N C набора справочных данных. Если сообщалось одно значение N C (Sh) , и значение было в пределах ± 0.2 из наших N C , радиус кристалла Шеннона использовался без изменений. Оставшиеся 88 из 706 катион-анионных пар с одним отклоняющимся координационным числом катиона или без координационного числа в компиляции Шеннона были исключены из сравнения.
Таким образом, чтобы сравнить наши результаты, нам необходимо сначала вычислить эффективный радиус кристалла Шеннона R кристалл для среднего N C набора справочных данных. Для ионов, для которых компиляция Шеннона предлагает несколько N C (Sh) , используется линейная интерполяция для вычисления эффективного радиуса кристалла Шеннона при среднем значении N C набора справочных данных. Если сообщалось одно значение N C (Sh) , и значение было в пределах ± 0.2 из наших N C , радиус кристалла Шеннона использовался без изменений. Оставшиеся 88 из 706 катион-анионных пар с одним отклоняющимся координационным числом катиона или без координационного числа в компиляции Шеннона были исключены из сравнения. Тесты на линейные зависимости между R min и R кристалл для тех анионов, где известная анионная мягкость позволяет использовать систематические значения b , дают высокие коэффициенты корреляции, например, R 2 = 0,994 для корреляции R кристалл ( M м + ) = 0,9901 R мин ( M м + —O 2− ) — 1.2046 Å для 129 параметров катион-оксид, показанных светлыми треугольниками на рис. 6. Соответствующие соотношения для других анионов перечислены в таблице S2 во вспомогательной информации.
Тесты на линейные зависимости между R min и R кристалл для тех анионов, где известная анионная мягкость позволяет использовать систематические значения b , дают высокие коэффициенты корреляции, например, R 2 = 0,994 для корреляции R кристалл ( M м + ) = 0,9901 R мин ( M м + —O 2− ) — 1.2046 Å для 129 параметров катион-оксид, показанных светлыми треугольниками на рис. 6. Соответствующие соотношения для других анионов перечислены в таблице S2 во вспомогательной информации.Корреляция между R min и радиусами кристалла Шеннона R кристалл . Отображаемые значения R мин. основаны на чувствительных к мягкости значениях b .Чтобы уменьшить перекрытие, данные показаны только для девяти анионов, для которых можно определить более 30 типов катион-анионных пар.



Линейная корреляция между R min и суммой масштабированных радиусов Шеннона катионов и анионов.

 Другими словами, чем мягче анион, тем более важным становится использование параметров BV, чувствительных к мягкости. Это не удивительно, поскольку исходный выбор b = 0.37 Å было предложено на основе обучающей выборки, состоящей в основном из твердых анионов. Можно отметить, что только для оксидов недавнее систематическое исследование (Gagné & Hawthorne, 2015) дает среднее значение b 0,40 Å при использовании первого соглашения о координационной оболочке. Таким образом, значение 0,37 Å кажется слишком низким даже для оксидов. Как обсуждалось выше, отличие от среднего значения b = 0,45 Å для оксидов в наборе параметров softBV также зависит от пренебрежения влиянием более высоких координационных сфер в традиционном подходе.
Другими словами, чем мягче анион, тем более важным становится использование параметров BV, чувствительных к мягкости. Это не удивительно, поскольку исходный выбор b = 0.37 Å было предложено на основе обучающей выборки, состоящей в основном из твердых анионов. Можно отметить, что только для оксидов недавнее систематическое исследование (Gagné & Hawthorne, 2015) дает среднее значение b 0,40 Å при использовании первого соглашения о координационной оболочке. Таким образом, значение 0,37 Å кажется слишком низким даже для оксидов. Как обсуждалось выше, отличие от среднего значения b = 0,45 Å для оксидов в наборе параметров softBV также зависит от пренебрежения влиянием более высоких координационных сфер в традиционном подходе.| Набор параметров | Отсечка | Δ V | Δ V ( n > 20) † |
|---|---|---|---|
| 0,0719 | 0,0807 | ||
| softNC1 | Первая координационная оболочка | 0,0797 | 0,0891 |
| convBV | 2929 024 01157 | 0,1146 | |

Зависимость относительного увеличения стандартных отклонений BVS в наборе справочных данных при использовании обычного набора параметров с фиксированным универсальным значением b = 0.37 Å вместо параметров softBV (ромбики) или параметров softNC1 (квадраты) в среднем b значений для параметров BV с участием соответствующего типа аниона. Данные приведены только для анионов галогенидов и халькогенидов. Пунктирные линии представляют собой полиномиальную аппроксимацию для ориентира.
 Обратите внимание, что параметры Gagné & Hawthorne были определены путем свободного уточнения параметров BV с использованием подхода первой координационной оболочки. Мы использовали все четыре набора параметров для расчета катионных BVS в идентичных наборах справочных данных, охватывающих широкий диапазон оксидов, и сравнили смещенные стандартные отклонения Δ V . Из рисунка 9 видно, что наш набор параметров softNC1 работает лучше, чем компиляция Брауна, и так же хорошо, как набор данных Gagné & Hawthorne для оксидов.Наш softBV работает лучше, чем оба набора литературных данных, отчасти из-за дополнительного включения слабых взаимодействий за пределы первой координационной оболочки.
Обратите внимание, что параметры Gagné & Hawthorne были определены путем свободного уточнения параметров BV с использованием подхода первой координационной оболочки. Мы использовали все четыре набора параметров для расчета катионных BVS в идентичных наборах справочных данных, охватывающих широкий диапазон оксидов, и сравнили смещенные стандартные отклонения Δ V . Из рисунка 9 видно, что наш набор параметров softNC1 работает лучше, чем компиляция Брауна, и так же хорошо, как набор данных Gagné & Hawthorne для оксидов.Наш softBV работает лучше, чем оба набора литературных данных, отчасти из-за дополнительного включения слабых взаимодействий за пределы первой координационной оболочки.Сравнение стандартных отклонений при использовании параметров из компиляции Брауна (верхний ряд) или параметров Gagné & Hawthorne (нижний ряд) с softBV (слева) или softNC1 (правая часть) параметры, определенные в данной работе.
 В сравнении используются только те катион-анионные пары с n ≥ 20 катионными средами. Набор параметров softBV рассчитывается на более высоком расстоянии отсечки, предложенном для этого набора параметров, в то время как для трех других наборов отсечка устанавливается на значение R 1 , определенное в этой работе как предел. соответствующей первой координационной оболочки.
В сравнении используются только те катион-анионные пары с n ≥ 20 катионными средами. Набор параметров softBV рассчитывается на более высоком расстоянии отсечки, предложенном для этого набора параметров, в то время как для трех других наборов отсечка устанавливается на значение R 1 , определенное в этой работе как предел. соответствующей первой координационной оболочки. Обычно эта функция принимается как смещенное стандартное отклонение рассогласования BVS Δ V =. Выбор смещенного стандартного отклонения (где сумма квадратов делится на N ) по сравнению с несмещенным (где сумма квадратов делится на N — 1) был сделан потому, что среднее несоответствие BVS, как известно, равно нулю. в идеальном случае.Возникает соблазн применить это уточнение и заявить, что сгенерированная комбинация b и R 0 является уникальными «наиболее подходящими» параметрами валентности связи. Мы разработали эксперимент для изучения различных факторов, влияющих на такое уточнение.
Обычно эта функция принимается как смещенное стандартное отклонение рассогласования BVS Δ V =. Выбор смещенного стандартного отклонения (где сумма квадратов делится на N ) по сравнению с несмещенным (где сумма квадратов делится на N — 1) был сделан потому, что среднее несоответствие BVS, как известно, равно нулю. в идеальном случае.Возникает соблазн применить это уточнение и заявить, что сгенерированная комбинация b и R 0 является уникальными «наиболее подходящими» параметрами валентности связи. Мы разработали эксперимент для изучения различных факторов, влияющих на такое уточнение. Другая половина окружающей среды сформировала тренировочный пул. Для каждых n от 3 до 157, n сред были случайным образом выбраны из обучающего пула, из которого был определен набор из R 0 и b . Этот процесс повторялся 100 раз для каждого n , и средние значения b и Δ В по сравнению с n записаны на рис. 10 ( a ).
Другая половина окружающей среды сформировала тренировочный пул. Для каждых n от 3 до 157, n сред были случайным образом выбраны из обучающего пула, из которого был определен набор из R 0 и b . Этот процесс повторялся 100 раз для каждого n , и средние значения b и Δ В по сравнению с n записаны на рис. 10 ( a ).Зависимость ( a ) от среднего значения b , полученная в результате подбора 100 случайно выбранных наборов оксидных сред B 3+ и ( b ) среднего стандартного отклонения в обучающей выборке и тестовой выборке по количеству B 3+ сред в каждой выборке.Горизонтальная пунктирная линия на панели ( b ) отмечает истинное стандартное отклонение полного набора для тестирования.
 Чтобы гарантировать точность 0,01 для b для исследуемой пары катион-анион, требовалось не менее 35 сред, в то время как с пятью средами в эталонных данных установлена точность только 0.05 может быть достигнуто. Следует отметить, что для этого теста мы использовали тот же набор данных B 3+ -O 2-, который использовался при окончательном определении наших параметров валентности связи, где очевидные выбросы уже были устранены. На практике такое удаление выбросов вряд ли будет возможно для небольших наборов справочных данных, поэтому следует ожидать, что практически достижимая точность с небольшими наборами справочных данных будет еще хуже.
Чтобы гарантировать точность 0,01 для b для исследуемой пары катион-анион, требовалось не менее 35 сред, в то время как с пятью средами в эталонных данных установлена точность только 0.05 может быть достигнуто. Следует отметить, что для этого теста мы использовали тот же набор данных B 3+ -O 2-, который использовался при окончательном определении наших параметров валентности связи, где очевидные выбросы уже были устранены. На практике такое удаление выбросов вряд ли будет возможно для небольших наборов справочных данных, поэтому следует ожидать, что практически достижимая точность с небольшими наборами справочных данных будет еще хуже.
Цветовая проекция ландшафта Δ V как функция от R 0 и b для нашей Hg 2+ —Cl — набор справочных данных, содержащий n = 13 катионных сред.

 ед.)
ед.)- Электроны существуют вне ядра атома и находятся на основных энергетических уровнях, содержащих только определенное количество электронов.

- Самый внешний главный энергетический уровень, содержащий электроны, называется валентным уровнем и содержит валентные электроны.
- Символы Льюиса — это диаграммы, показывающие количество валентных электронов конкретного элемента с точками, которые представляют неподеленные пары.
- Символы Льюиса не визуализируют электроны на внутренних основных энергетических уровнях.
 Структуры Льюиса (также известные как точечные структуры Льюиса или структуры с электронными точками) представляют собой диаграммы, которые представляют собой валентные электроны атомов в молекуле. Эти символы Льюиса и структуры Льюиса помогают визуализировать валентные электроны атомов и молекул, существуют ли они в виде неподеленных пар или внутри связей.
Структуры Льюиса (также известные как точечные структуры Льюиса или структуры с электронными точками) представляют собой диаграммы, которые представляют собой валентные электроны атомов в молекуле. Эти символы Льюиса и структуры Льюиса помогают визуализировать валентные электроны атомов и молекул, существуют ли они в виде неподеленных пар или внутри связей. Химическая реакционная способность всех различных элементов периодической таблицы зависит от количества электронов на последнем, крайнем, внешнем уровне, который называется валентным уровнем или валентной оболочкой. В случае золота на валентном уровне есть только один валентный электрон.
Химическая реакционная способность всех различных элементов периодической таблицы зависит от количества электронов на последнем, крайнем, внешнем уровне, который называется валентным уровнем или валентной оболочкой. В случае золота на валентном уровне есть только один валентный электрон.
 Этот конкретный ресурс использовал следующие источники:
Этот конкретный ресурс использовал следующие источники:Резонансные структуры лучше отражают точечную структуру Льюиса, потому что они ясно показывают связь в молекулах.Карбонат-ион — это обычный многоатомный ион, содержащийся в известняке, разрыхлителе и пищевой соде. Наша первая попытка нарисовать точечную структуру Льюиса карбонат-иона привела к структуре, показанной ниже.
 ion, i) — это структура оптимального формального заряда, если не рисовать. Теперь есть три одинарные связи P-O
Условия
ion, i) — это структура оптимального формального заряда, если не рисовать. Теперь есть три одинарные связи P-O
Условия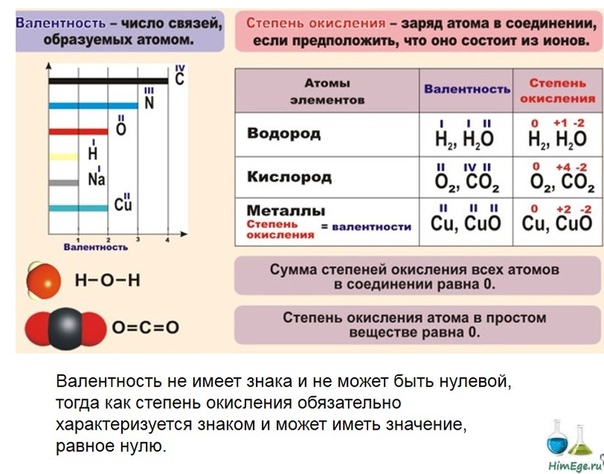

 В зависимости от того, какой из них мы выберем, мы получим либо. 2. 2. следует постараться максимально уменьшить заряды на атомах. Есть вопросы или комментарии? Резонансные структуры должны иметь одинаковое количество электронов, не складывать и не убирать электроны. Структура Льюиса с наиболее формальными обвинениями нежелательна, потому что нам нужна структура Льюиса с наименьшими формальными обвинениями. Сумма формальных зарядов эквивалентна заряду карбонат-иона. Резонанс в химии может быть способом описания связи в определенных молекулах или ионах путем слияния многих способствующих структур или форм, вместе называемых каноническими структурами или резонансными структурами в рамках теории валентных связей, в гибридный резонанс (или гибридную структуру).Ниже представлена вся структура точек Льюиса с формальными зарядами (красным цветом) для сульфата (SO42-). Ниже представлен резонанс для Ch4COO-, формальные заряды показаны красным цветом. Мы можем описать связь в бензоле, используя две резонансные структуры, но реальная электронная структура представляет собой среднее из двух.
В зависимости от того, какой из них мы выберем, мы получим либо. 2. 2. следует постараться максимально уменьшить заряды на атомах. Есть вопросы или комментарии? Резонансные структуры должны иметь одинаковое количество электронов, не складывать и не убирать электроны. Структура Льюиса с наиболее формальными обвинениями нежелательна, потому что нам нужна структура Льюиса с наименьшими формальными обвинениями. Сумма формальных зарядов эквивалентна заряду карбонат-иона. Резонанс в химии может быть способом описания связи в определенных молекулах или ионах путем слияния многих способствующих структур или форм, вместе называемых каноническими структурами или резонансными структурами в рамках теории валентных связей, в гибридный резонанс (или гибридную структуру).Ниже представлена вся структура точек Льюиса с формальными зарядами (красным цветом) для сульфата (SO42-). Ниже представлен резонанс для Ch4COO-, формальные заряды показаны красным цветом. Мы можем описать связь в бензоле, используя две резонансные структуры, но реальная электронная структура представляет собой среднее из двух. Добавьте октетные электроны к атомам, связанным с центральным атомом: 4. 5. Две резонансные структуры молекулы озона показаны ниже.
Добавьте октетные электроны к атомам, связанным с центральным атомом: 4. 5. Две резонансные структуры молекулы озона показаны ниже. Узнайте больше об этой концепции и других связанных с ней концепциях, таких как сверхсопряжение, резонансный эффект и формула электронной точки. восемь электронов в валентной оболочке). На атоме фосфора не существует неподеленных пар. Мы разделим оставшиеся 18 электронов поровну между тремя атомами кислорода, поместив на каждый по три неподеленные пары и указав заряд −2: 5.д) определить направление стрелки полярности для связи PO. Присвоение одной связывающей пары электронов каждой связи кислород-кислород дает, 4. В нитрит-ионе длины обеих связей азот-кислород равны.
Узнайте больше об этой концепции и других связанных с ней концепциях, таких как сверхсопряжение, резонансный эффект и формула электронной точки. восемь электронов в валентной оболочке). На атоме фосфора не существует неподеленных пар. Мы разделим оставшиеся 18 электронов поровну между тремя атомами кислорода, поместив на каждый по три неподеленные пары и указав заряд −2: 5.д) определить направление стрелки полярности для связи PO. Присвоение одной связывающей пары электронов каждой связи кислород-кислород дает, 4. В нитрит-ионе длины обеих связей азот-кислород равны.
 Атомы кислорода должны иметь отрицательные заряды, потому что электроотрицательность (3,5) кислорода выше, чем
Фосфат-ион (PO43-) а) Изобразите структуру Льюиса, включая резонансные структуры. -реактивность молекулы и то, как она может взаимодействовать с другими молекулами. 3. Различные резонансные структуры карбонат-иона (CO32-) проиллюстрированы выше. Он имеет химическую формулу C6H6.Посмотрите видео и посмотрите, не пропустили ли вы какие-либо шаги или информацию. Резонанс для CHO21- и формальные заряды (красным). Резонансные структуры должны иметь одинаковое количество электронов, не складывать и не убирать электроны. Углерод имеет 4 валентных электрона, каждый кислород имеет 6 валентных электронов и еще 2 для заряда -2. Еще один способ предотвратить появление этой страницы в будущем — использовать Privacy Pass. Каждый атом O имеет 6 валентных электронов, всего 18 валентных электронов.
Атомы кислорода должны иметь отрицательные заряды, потому что электроотрицательность (3,5) кислорода выше, чем
Фосфат-ион (PO43-) а) Изобразите структуру Льюиса, включая резонансные структуры. -реактивность молекулы и то, как она может взаимодействовать с другими молекулами. 3. Различные резонансные структуры карбонат-иона (CO32-) проиллюстрированы выше. Он имеет химическую формулу C6H6.Посмотрите видео и посмотрите, не пропустили ли вы какие-либо шаги или информацию. Резонанс для CHO21- и формальные заряды (красным). Резонансные структуры должны иметь одинаковое количество электронов, не складывать и не убирать электроны. Углерод имеет 4 валентных электрона, каждый кислород имеет 6 валентных электронов и еще 2 для заряда -2. Еще один способ предотвратить появление этой страницы в будущем — использовать Privacy Pass. Каждый атом O имеет 6 валентных электронов, всего 18 валентных электронов.
 Элементы веществ и смесей. Законы сохранения массы
Элементы веществ и смесей. Законы сохранения массы Структура атома (нейтрон, протон и электрон) атомный номер, атомная масса. Элементы и изотопы. Орбитали и правила распределения электронов. Таблица Менделеева и соответствие электронной конфигурации. Периодические свойства.
Химическая связь. Ионная и ковалентная связь. Число окисления. Валентная связь и правило октета. Структуры Льюиса. Формулы резонанса и формальный заряд. Орбитальная гибридизация. Полярность молекулярных связей.Номенклатура катионов, анионов и неорганических соединений.
Химическая реакция. Формула веса, молекулярной массы, размера и использования при расчете массовых реакций. Стехиометрия. Уравновешивание различных типов химических реакций. Ох-окислительно-восстановительные реакции.
Введение в термодинамику. Первый и второй принципы термодинамики. Теплота реакции. Экзотермические и эндотермические реакции. Свободная энергия Гиббса, спонтанность процесса.
Химическое равновесие. Константа равновесия K, закон Ле Шетелье.
 Факторы, влияющие на химический баланс.
Факторы, влияющие на химический баланс. Состояния дела. Газообразное состояние: уравнение состояния идеального газа. Жидкое состояние: давление пара, поверхностное натяжение, точка кипения, межмолекулярные силы (силы Ван-дер-Ваальса, водородная связь). Примечания к твердому телу. Фазовые переходы и фазовые диаграммы, сверхкритическое состояние.
Решения. Растворитель и растворенное вещество, растворимость. Коллоидные растворы, эмульсии. Методы указания концентрации (молярность, моляльность, нормальность, проценты). Закон Генри. Коллигативные свойства (криоскопическое понижение, эбуллиоскопическое возвышение, осмотическое давление).
Кислоты и основания. Определение по Бронстеду. Конъюгированная кислота и основание. Ионный продукт воды, pH, расчет Ka и Kb и их использование для определения силы кислоты или основания. Сильные кислоты и основания, слабые кислоты и основания. Примеры гидролиза некоторых солей, буферных растворов, pH буфера.
Обзор кинетики. Скорость реакции, влияние концентрации и температуры, закон Аррениуса, энергия активации, катализаторы (гомогенные, гетерогенные, ферментативные).


 Другие названия: HNO2; Киселина дусит; Гидроксид нитрозила; Азотистая кислота, транс; HONO Постоянная ссылка на этот вид. RE: Какие…
Другие названия: HNO2; Киселина дусит; Гидроксид нитрозила; Азотистая кислота, транс; HONO Постоянная ссылка на этот вид. RE: Какие…
 Поскольку оно связано с водородом, это соединение является кислотой. Правильное название для HNO2 — азотистая кислота.
Поскольку оно связано с водородом, это соединение является кислотой. Правильное название для HNO2 — азотистая кислота. Теперь мы знаем, сколько электронов состоит из
Теперь мы знаем, сколько электронов состоит из



 Обратите внимание, что первый энергетический уровень (ближайший к ядру) может иметь только два электрона, в то время как большее количество электронов может «уместиться» в пределах данного уровня дальше.Количество электронов на каждом уровне указано в правом верхнем углу рисунка. Обратите внимание, что на внешнем уровне находится только один электрон.
Обратите внимание, что первый энергетический уровень (ближайший к ядру) может иметь только два электрона, в то время как большее количество электронов может «уместиться» в пределах данного уровня дальше.Количество электронов на каждом уровне указано в правом верхнем углу рисунка. Обратите внимание, что на внешнем уровне находится только один электрон.