Составление уравнений полуреакций в кислой среде
Составить уравнения полуреакций окисления или восстановления с учетом кислотности среды (кислая среда):
Решение задачи
Ионно-молекулярные уравнения полуреакций:
При составлении уравнений окислительно-восстановительных реакций, протекающих в водных растворах, часто отдают предпочтение ионно-электронному методу, который основан на составлении уравнений полуреакций восстановления иона (молекулы) окислителя и окисления иона (молекулы) восстановителя. Поэтому этот метод называют также методом полуреакций.
Рассмотрим порядок действий при составлении уравнений полуреакций, учитывая, что по условию задачи среда кислая.
1. В ионно-молекулярном уравнении каждой полуреакции уравнивают числа атомов всех элементов.
Обратите ваше внимание на следующие моменты. Если исходный ион или молекула содержит больше атомов кислорода, чем продукт реакции, избыток атомов кислорода в кислой среде связывается ионами водорода (H+) в молекулы воды. Если исходный ион или молекула содержит меньше число атомов кислорода, чем продукт реакции, то недостаток атомов кислорода в кислых растворах компенсируется за счет молекул воды (H2O).
В данном случае среда кислая, поэтому ионно-молекулярные уравнения полуреакций имеют вид:
2. Составляют электронно-ионные уравнения полуреакций. Для этого в левую часть каждой полуреакции добавляют (или вычитают) электроны с таким расчетом, чтобы суммарый заряд в левой и правой частях уравнений стал одинаковым.
Получаем:
Далее получают ионно-молекулярное уравнение окислительно-восстановительной реакции, по которому составляют молекулярное уравнение. Для этого по схеме реакции определяют, из каких молекул получены данные ионы.
Уравнения полуреакций окисления | Задачи 625
Задача 625.
Составить уравнения полуреакций окисления с учетом кислотности среды:
;; .
Решение:
Задача 626.
Закончить уравнения реакций:
а) Mn(OH)2 + Cl2 + KOH = MO2 +
б) MnO2 + O2 + KOH = K2MnO4 +
в) FeSO4 + Br2 + H2SO4 =
г) NaAsO2 + I2 + NaOH = Na3AsO4 +
Решение:
а) Mn(OH)2 + Cl2 + KOH = MO2 +
Одна молекула Mn(OH)2 превращается в один ион Mn2+ и два иона OH—:
Mn(OH)2 = Mn2+ + 2OH—.
Источником кислорода для протекания процесса превращения Mn
Уравнения полуреакций:
Ионно-молекулярная форма процесса:
Mn2+ + 4OH— + Cl20 = MnO2 + 2H2O + 2Cl—
Молекулярная форма процесса:
Mn(OH)2 + Cl2 + 2KOH = MO2 + 2KCl + 2H2O.
б) MnO2 + O2 + KOH = K2MnO4 +
Марганец повышает свою степень окисления от +4 до +6, т. е. проявляет свойства восстановителя, а кислород понижает свою степень окисления от 0 до -2, проявляя свойства окислителя.
Уравнения полуреакций:
Ионно-молекулярная форма процесса:
2MnO2 + 8OH— + O20 = 2MnO 42- + 4H2O + 2O2-
Молекулярная форма процесса:
2MnO2 + O2 + 8KOH = 2K2MnO4 + 2K2O + 4H2O.
в) FeSO4 + Br2 + H2SO4 =
Уравнения полуреакций:
Ионно-молекулярная форма процесса:
2Fe2+ + Br20 = 2Fe3+ + 2Br—
Молекулярная форма процесса:
2FeSO4 + Br2 + H2SO4 = Fe2(SO4)3 + 2HBr
г) NaAsO2 + I2 + NaOH = Na3AsO4 +
Уравнения полуреакций:
Ионно-молекулярная форма процесса:
AsO2- + I20 + 4OH— = AsO43- + 2I— + 2H2O
Молекулярная форма процесса:
NaAsO2 + I2 + 4NaOH = Na3AsO4 + 2NaI + 2H2O.
Метод электронно-ионных уравнений (полуреакций). — Студопедия
Метод электронных уравнений
При составлении уравнений окислительно-восстановительных реакций этим методом рекомендуется придерживаться следующего порядка:
1. Запишите схему реакции с указанием исходных и образующихся веществ, определите элементы, которые изменяют в результате реакции степень окисления, найдите окислитель и восстановитель.
2. Составьте электронные уравнения исходя из того, что окислитель принимает электроны, а восстановитель их отдает.
3. Подберите множители (основные коэффициенты) для электронных уравнений так, чтобы число электронов, отданных при окислении, было равно числу электронов, полученных при восстановлении.
4. Расставьте коэффициенты в уравнении реакции.
ПРИМЕР 3: Составить уравнение реакции восстановления оксида железа (III) углеродом. Реакция протекает по схеме:
Fe2O3 + C → Fe + CO
Решение: Железо восстанавливается, понижая степень окисления от +3 до 0; углерод окисляется, его степень окисления повышается от 0 до +2.
Составим схемы этих процессов.
восстановитель 1| 2Fe+3 + 6e = 2Fe
окислитель 3| C0 -2e = C+2 , процесс восстановления
Общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем. Найдя наименьшее общее кратное между числами 2 и 6, определяем, что молекул восстановителя должно быть три, а молекул окислителя — две, т.е. находим соответствующие коэффициенты в уравнении реакции перед восстановителем, окислителем и продуктами окисления и восстановления.
Уравнение будет иметь вид:
Fe2O3 + 3C = 2Fe + 3CO
Метод электронно-ионных уравнений (полуреакций).
При составлении электронно-ионных уравнений учитывают форму существования веществ в растворе (простой или сложный ион, атом или молекула нерастворимого или труднодиссоциирующего в воде вещества).
Чтобы составить уравнения окислительно-восстановительных реакций данным методом, рекомендуется придерживаться следующего порядка:
1.Составьте схему реакции с указанием исходных веществ и продуктов реакции, отметьте ионы, изменяющие в результате реакции степень окисления, определите окислитель и восстановитель.
2. Составьте схемы полуреакций окисления и восстановления с указанием исходных и образующихся в условиях реакции ионов или молекул.
3. Уравняйте число атомов каждого элемента в левой и правой частях полуреакций; при этом следует помнить, что в водных растворах в реакциях могут участвовать молекулы воды, ионы Н+ или ОН—.
Следует помнить, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходят по- разному, в зависимости от рН среды. В кислых растворах избыток кислорода связывается ионами водорода с образованием молекул воды, а в нейтральных и щелочных – молекулами воды с образованием гидроксид-ионов. Например,
MnO4— + 8H+ + 5e = Mn
NO3— + 6H2O + 8e = NH3 + 9OH— (нейтральная или щелочная среда).
Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде – за счет гидроксид ионов с образованием молекул воды. Например,
I2 + 6H2O – 10e = 2IO3— + 12H+ (кислая или нейтральная среда)
CrO2— + 4OH— — 3e = CrO42- + 2H2O (щелочная среда)
4. Уравняйте суммарное число зарядов в обеих частях каждой полуреакции; для этого прибавьте к левой и правой частям полуреакции необходимое число электронов.
5. Подберите множители (основные коэффициенты) для полуреакций так, чтобы число электронов, отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении.
6. Сложите уравнения полуреакций с учетом найденных основных коэффициентов.
7. Расставьте коэффициенты в уравнении реакции.
ПРИМЕР 4: Составить уравнение окисления сероводорода хлорной водой.
Реакция протекает по схеме:
H2S + Cl2 + H2O → H2SO4 + HCl
Решение. Восстановлению хлора соответствует следующее уравнение полуреакции: Cl2 + 2e = 2Cl—.
При составлении уравнения полуреакции окисления серы исходим из схемы: H2S → SO42- . В ходе этого процесса атом серы связывается с четырьмя атомами кислорода, источником которых служат молекулы воды. При этом образуются восемь ионов Н+; кроме того, два иона Н+ высвобождаются из молекулы Н2S.
Всего образуются 10 ионов водорода:
H2S + 4H2O → SO42- + 10 H+
Левая часть схемы содержит только незаряженные частицы, а суммарный заряд ионов в правой части схемы равен +8. Следовательно, в результате окисления высвобождаются восемь электронов:
H2S + 4H2O → SO42- + 10 H+
Поскольку отношение чисел электронов, принятых при восстановлении хлора и отданных при окислении серы, равно 8?2 или 4?1, то, складывая уравнения полуреакций восстановления и окисления, надо первое из них умножить на 4, а второе – на 1.
Получаем:
Cl2+ 2e = 2Cl— | 4
H2S + 4H2O = SO42- + 10H+ +8e — | 1
4Cl2 + H2S + 4H2O = 8Cl— + SO42- +10H+
В молекулярной форме полученное уравнение имеет следующий вид:
4Cl2 + H2S + 4H2O = 8HCl + H2SO4
Одно и то же вещество в различных условиях может окисляться или восстанавливаться до разных степеней окисления соответствующего элемента, поэтому величина эквивалента окислителя и восстановителя также может иметь различные значения.
Эквивалентная масса окислителя равна его молярной массе деленной на число электронов n, которые присоединяет одна молекула окислителя в данной реакции.
Например, в реакции восстановления Cl2 + 2e = 2Cl—. n = 2 Следовательно, эквивалентная масса Сl2 равна М/2, т.е. 71/2 = 35,5г/моль.
Эквивалентная масса восстановителя равна его молярной массе деленной на число электронов n, которые отдает одна молекула восстановителя в данной реакции.
Например, в реакции окисления H2S + 4H2O — 8е = SO42- + 10 H+
n = 8. Следовательно, эквивалентная масса H2S равна М/8, т.е. 34,08/8 = 4,26г/моль.
6.1. Подбор коэффициентов окислительно-восстановительных реакций
Наиболее распространенными способами подбора коэффициентов таких реакций являются метод электронного баланса и метод полуреакций (ионно-электронный метод). Метод электронного баланса универсален и применим ко всем окислительно-восстановительным реакциям – между газообразными, жидкими и твердыми веществами, а также к реакциям в растворах. Однако молекулярные уравнения не полностью отражают ионный характер окисления и восстановления электролитов в водном растворе, и для подбора коэффициентов в уравнениях таких реакций используется метод полуреакций.
При подборе коэффициентов любым методом должны соблюдаться законы сохранения массы и электрических зарядов:
1. Следствие закона сохранения массы: число атомов каждого элемента в левой и правой части уравнения должно быть одинаковым.
2. Правило электронейтральности: общая сумма зарядов в обеих частях равенства должна быть одинаковой.
3. Правило эквивалентности: число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем.
6.2. Метод электронного баланса
При использовании метода электронного баланса:
Составляют схему реакции с указанием исходных веществ и продуктов реакции.
Находят элементы, атомы которых изменяют степень окисления.
Составляют электронные уравнения отдачи и присоединения электронов, разбивая единый процесс окисления – восстановления на два: окисление и восстановление.
Для процессов окисления и восстановления уравнивают правые и левые части равенств по числу атомов и числу зарядов, используя в последнем случае электроны.
Находят коэффициенты для окислителя и восстановителя, используя правила эквивалентности.
Полученные коэффициенты переносят в молекулярное уравнение.
Рассмотрим применение метода на конкретных примерах.
Пример 1. Окисление сульфида цинка кислородом.
Составляют схему реакции: ZnS + O2 ZnO + SO2.
Находят элементы, изменившие степень окисления. В данной реакции это сера и кислород.

3 – 5. Составляют электронные уравнения процессов окисления и восстановления, используя приведенные выше законы.

Дополнительные множители (2 и 6) в схеме указывают на число атомов в реагирующих веществах и число электронов, участвующих в реакции. В приведенной реакции участвуют два атома серы, шесть атомов кислорода, двенадцать электронов.
6. Коэффициенты из электронной схемы переносят в молекулярное уравнение.
2ZnS + 3O2 = 2ZnO + 2SO2.
Проверяют число атомов каждого элемента в левой и правой частях равенства.
6.3. Метод полуреакций
При использовании метода полуреакций придерживаются определенного порядка действий.
Составляют схему реакции с указанием исходных веществ и продуктов.
Записывают ионное уравнение реакции. При этом пользуются правилами составления ионных уравнений. Сильные электролиты записывают в виде ионов. Неэлектролиты, слабые электролиты, осадки и газы – в виде молекул. Устанавливают атомы, ионы, молекулы, изменившиеся в результате реакции. Записывают схему их изменения в виде полуреакции. В левой части полуреакции помещают частицы, вступающие в химическую реакцию, в правой – продукты их превращения (это должны быть реально существующие в условиях реакции ионы или молекулы).
В каждой полуреакции уравнивают число атомов всех элементов (число атомов каждого элемента в правой и левой части полуреакции должно быть одинаковым). При уравнивании числа атомов водорода и кислорода, входящих в состав сложных ионов, используют частицы, характеризующие данную среду: в кислой среде – ионы Н+ и молекулы Н2О, в щелочной среде – ионы ОН— и молекулы Н2О. При этом необходимо руководствоваться следующими правилами:
а) в кислой среде недостаток водорода компенсируют ионами Н+, а избыток кислорода связывают в воду при помощи ионов Н+;
б) в щелочной среде избыток кислорода связывают при помощи воды в ионы ОН—, а избыток водорода при помощи ионов ОН— в воду.
Уравнивают заряды правой и левой части полуреакции, используя для этого электроны (к этому приступают только после уравнивания числа атомов всех элементов).
Подбирают множители (основные коэффициенты) для полуреакций так, чтобы число электронов, отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении.
Обе полуреакции суммируют с учетом найденных (основных) коэффициентов. При этом получают сокращенное ионное уравнение окислительно-восстановительной реакции.
Коэффициенты из сокращенного ионного уравнения переносят в молекулярное уравнение.
Проверяют число атомов каждого вида в правой и левой части уравнения окислительно-восстановительной реакции.
Среду считают кислой, если среди реагентов или продуктов реакции присутствует кислота.
Среду считают основной, если среди реагентов или продуктов реакции присутствует основание.
Рассмотрим конкретные примеры подбора коэффициентов в реакциях.
Пример 1. Реакция между перманганатом калия и нитритом натрия в кислой среде.
1. Записываем схему реакции:
KMnO4 + KNO2 + H2SO4 MnSO4 + KNO3 + K2SO4 + H2O.
2. Записываем ионное уравнение реакции:
K+ + MnO4— + K+ + NO2— + 2H+ + SO42- Mn2+ + SO42- + K+ + NO3— + 2K+ + SO42- + H2O.
3. Из ионного уравнения устанавливаем, что из ионов MnO4— и NO2— образовались ионы Mn2+ и NO3—, соответственно. Составляем полуреакции для этих превращений:
MnO4— ® Mn2+;
NO2— ® NO3—.
Уравниваем количество атомов каждого элемента в правой и левой части этих полуреакций, используя ионы водорода и молекулы воды:
MnO4— + 8H+ ® Mn2+ + 4H2O;
NO2— + H2O ® NO3— + 2H+.
4. С помощью электронов уравниваем заряды правой и левой части каждой полуреакции:
MnO4— + 8H+ +  ® Mn2+ + 4H2O;
® Mn2+ + 4H2O;
NO2— + H2O – 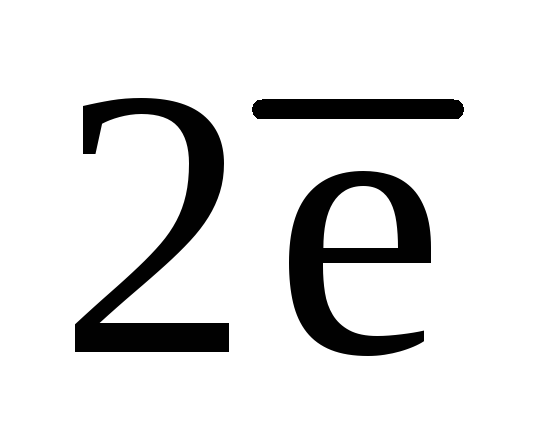 ® NO3— +
2H+.
® NO3— +
2H+.
5. Находим основные коэффициенты для окислителя и восстановителя и суммируем обе полуреакции с учетом этих коэффициентов:

6. После приведения подобных членов в обеих частях уравнения получаем сокращенное ионное уравнение реакции:
2MnO4— + 5NO2— + 6H+ ® 2Mn2+ + 5NO3— + 3H2O.
7. Полученные коэффициенты переносим в молекулярное уравнение:
2KMnO4 + 5KNO2 + 3H2SO4 ® 2MnSO4 + 5KNO3 + K2SO4 + 3H2O.
8. Проверяем число атомов каждого элемента в правой и левой части уравнения.
Пример 2. Реакция в кислой среде между сероводородом и хлорной водой.
1. Записываем схему реакции:
H2S + Cl2 + H2O ® H2SO4 + HCl.
2. Составляем ионное уравнение этой реакции:
H2S + Cl2 + H2O ® 2H+ + SO42- + H+ + Cl—.
3 – 5. Из ионного уравнения ясно, что первая полуреакция связана с окислением сероводорода до сульфат-иона, а вторая полуреакция – с восстановлением элементарного хлора до хлорид-ионов. При составлении уравнения полуреакции окисления сероводорода исходим из схемы: H2S SO42-. В ходе этого процесса атом серы связывается с четырьмя атомами кислорода, источником которых служат четыре молекулы воды. При этом освобождается восемь ионов Н+; кроме того, два иона Н+ высвобождаются из молекулы H2S. Всего, следовательно, образуется десять ионов водорода:
H2S + 4H2O SO42- + 10H+.
Левая часть полуреакции содержит только незаряженные частицы, а суммарный заряд ионов в правой части схемы равен +8. Следовательно, в результате окисления высвобождаются восемь электронов:
H2S + 4H2O –  ® SO42- + 10H+.
® SO42- + 10H+.
Составление полуреакции восстановления хлора не представляет сложности:
Cl2 +  ®
2Cl—.
®
2Cl—.
6. Поскольку отношение числа электронов, отданных при окислении серы и принятых при восстановлении хлора, равно 4:1, то, складывая уравнения полуреакций окисления и восстановления, надо первое умножить на 1, а второе – на 4:

7. Переносим коэффициенты из сокращенного ионного уравнения в молекулярное:
H2S + 4Cl2 + 4H2O ® H2SO4 + 8HCl.
8. Проверяем количество атомов каждого элемента в правой и левой части молекулярного уравнения.
Пример 3. Реакция между перманганатом калия и иодидом калия в щелочной среде.
1. Записываем схему реакции:
KMnO4 + KI + KOH ® K2MnO4 + KIO3 + H2O.
2. Составляем ионное уравнение реакции:
K+ + MnO4— + K+ + I— + K+ + OH— ® 2K+ + MnO42- + K+ + IO3— + H2O.
3 – 5. Из ионного уравнения устанавливаем, что в результате реакции изменились ионы MnO4— и I—. Продуктами их превращения являются ионы MnO42- и IO3—, соответственно. Составляем полуреакции для этих превращений. Кислород уравниваем добавлением ОН—-ионов, а водород – добавлением молекул воды:

С помощью электронов уравниваем заряды правой и левой части каждой полуреакции:

6. Находим основные коэффициенты для окислителя и восстановителя и суммируем обе полуреакции с учетом этих коэффициентов:

7. Коэффициенты из ионного уравнения переносим в молекулярное:
6KMnO4 + KI + 6KOH ® 6K2MnO4 + KIO3 + 3H2O.
8. Проверяем количество атомов каждого элемента в молекулярном уравнении.
Достоинство метода полуреакций по
сравнению с методом электронного
баланса в том, что в нем используются
реально существующие молекулы и ионы.
В самом деле, в растворе нет ионов  ,
а есть ионы
,
а есть ионы  .
При использовании метода полуреакций
не нужно проставлять степени окисления
атомов.
.
При использовании метода полуреакций
не нужно проставлять степени окисления
атомов.
Умение составлять полуреакции необходимо для понимания химических процессов в гальваническом элементе и при электролизе. Этот метод выявляет роль среды как активного участника всего процесса. При использовании метода полуреакций не нужно знать все продукты реакции, они появляются в уравнении реакции при составлении полуреакций. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно-восстановительных реакций, протекающих в водных растворах.
Уравнение окисления-восстановления
Уравнения окисления-восстановления
Баланс уравнения окисления-восстановления
Метод проб и ошибок к уравновешиванию химических уравнений включает в себя игру с уравнение, регулирующее соотношение реагенты и продукты до были достигнуты следующие цели.
Цели для балансировки химических уравнений 1.Количество атомов каждого элемента в обеих частях уравнения одинаково и следовательно, масса сохраняется. 2. Сумма положительных и отрицательных зарядов одинакова на обеих сторонах уравнение и, следовательно, заряд сохраняется. (Заряд сохраняется, потому что электроны не создается и не разрушается в результате химической реакции.) |
Есть две ситуации, в которых метод проб и ошибок может привести к неприятностям.Иногда уравнение слишком сложно, чтобы его можно было решить методом проб и ошибок в разумных пределах. количество времени. Рассмотрим, например, следующую реакцию.
3 Cu ( с ) + 8 HNO 3 ( водн. ) 3 Cu 2+ ( водн. ) + 2 НО ( г ) + 6 НО 3 — ( водн. ) + 4 H 2 O ( л )
В других случаях можно написать более одного уравнения, которое кажется сбалансированным. Ниже приведены лишь некоторые из сбалансированных уравнений, которые можно записать для реакции между перманганат-ионом и перекисью водорода, например.
| 2 MnO 4 — ( водн. ) + H 2 O 2 ( водн. ) + 6 H + ( водн. ) 2 Mn 2+ ( водн. ) + 3 O 2 ( г ) + 4 H 2 O ( л ) |
| 2 MnO 4 — ( водн. ) + 3 H 2 O 2 ( водн. ) + 6 H + ( водн. ) 2 Mn 2+ ( водн. ) + 4 O 2 ( г ) + 6 H 2 O ( l ) |
| 2 MnO 4 — ( водн. ) + 5 H 2 O 2 ( водн. ) + 6 H + ( водн. ) 2 Mn 2+ ( водн. ) + 5 O 2 ( г ) + 8 H 2 O ( l ) |
| 2 MnO 4 — ( водн. ) + 7 H 2 O 2 ( водн. ) + 6 H + ( водн. ) 2 Mn 2+ ( водн. ) + 6 O 2 ( г ) + 10 H 2 O ( л ) |
Уравнения, подобные этим, должны быть сбалансированы с помощью более систематического подхода, чем испытания и ошибка.
Метод полуреакции уравновешивания окислительно-восстановительного потенциала Уравнения
Мощный метод балансировки уравнений окисления-восстановления включает в себя разделение эти реакции разделены на отдельные полуреакции окисления и восстановления. Затем мы уравновешиваем полуреакции, одну за другой, и объединить их так, чтобы электроны не создавались и не разрушается в реакции.
Шаги, включенные в метод полуреакции для уравновешивания уравнений, могут быть проиллюстрировано рассмотрением реакции, используемой для определения количества иона трииодида (I 3 — ) в растворе титрованием тиосульфатом (S 2 O 3 2- ) ион.
ШАГ 1 : Напишите скелетное уравнение реакции . Каркасное уравнение для реакции, на которой основано это титрование, можно записать как следующим образом.
I 3 — + S 2 O 3 2- I — + S 4 O 6 2-
ШАГ 2 : Присвойте атомам степени окисления с обеих сторон уравнение . Отрицательный заряд в ионе I 3 — формально распределены по трем атомам йода, что означает, что средняя степень окисления Атомы йода в этом ионе — 1 / 3 .В S 4 O 6 2- иона общая степень окисления атомов серы +10. Средняя степень окисления атомы серы, следовательно, +2 1 / 2 .
| I 3 — | + | S 2 O 3 2- | I — | + | S 4 O 6 2- | |||
| – 1 / 3 | +2-2 | -1 | +2 1 / 2 -2 | |||||
ШАГ 3 : Определите, какие атомы окислены, а какие уменьшено .
ШАГ 4 : Разделите реакцию на окисление и восстановление. полуреакции и уравновешивайте эти полуреакции по одной . Эта реакция может условно разделить на две полуреакции. Половина реакции описывает, что происходит при окислении.
| Окисление: | S 2 O 3 2- | S 4 O 6 2- | ||||
| +2 | +2 1 / 2 |
Другой описывает восстановление половины реакции.
| Сокращение: | I 3 — | I — | ||||
| – 1 / 3 | -1 |
Неважно, какую половину реакции мы балансируем в первую очередь, поэтому давайте начнем с уменьшение полуреакции.Наша цель — сбалансировать эту половину реакции с точки зрения как заряда и масса. Кажется разумным начать с балансировки количества атомов йода на обоих стороны уравнения.
| Сокращение: | I 3 — | 3 I — |
Затем мы уравновешиваем заряд, отмечая, что два электрона должны быть добавлены к I 3 — ион для производства 3 I — ионов,
| Сокращение: | I 3 — | + | 2 e — | 3 I — |
, как видно из структур Льюиса этих ионов, показанных на рисунке ниже.
Теперь перейдем к полуреакции окисления. Структуры Льюиса стартовой Материал и продукт этой полуреакции позволяют предположить, что мы можем получить S 4 O 6 2- ион путем удаления двух электронов из пары ионов S 2 O 3 2-, как показано на рисунке ниже.
| Окисление: | 2 S 2 O 3 2- | S 4 O 6 2- | + | 2 e — |
ШАГ 5 : Объедините эти полуреакции, чтобы электроны не создавал и не уничтожал .При окислении выделяются два электрона. полуреакция и два электрона захватываются в полуреакции восстановления. Мы можем поэтому получите сбалансированное химическое уравнение, просто объединив эти половинные реакции.
| (2 S 2 O 3 2- S 4 O 6 2- + 2 e —) |
| + (I 3 — + 2 e — 3 I — ) |
| I 3 — + 2 S 2 O 3 2- 3 I — + S 4 O 6 2- |
STEP 6 : Уравновесить остаток уравнения путем проверки, при необходимости .Поскольку общее уравнение уже сбалансировано с точки зрения как заряда и массы, мы просто вводим символы, описывающие состояния реагентов и продукты.
I 3 — ( водн. ) + 2 S 2 O 3 2- ( водн. ) 3 I — ( водн. ) + S 4 O 6 2- ( водн. )
Редокс-реакции в кислых растворах
Некоторые могут возразить, что нам не нужно использовать полуреакции для уравновешивания уравнений, потому что их можно уравновесить методом проб и ошибок.Техника полуреакции становится незаменим, однако, в уравновешивающих реакциях, таких как окисление диоксида серы дихромат-ион в кислом растворе.
| H + | ||||||
| SO 2 ( водн. ) | + | Cr 2 O 7 2- ( водн. ) | SO 4 2- ( водн. ) | + | Cr 3+ ( водн. ) |
Причина, по которой это уравнение труднее сбалансировать, не имеет ничего общего. с отношением молей SO 2 к молям Cr 2 O 7 2- ; это происходит из-за того, что растворитель играет активную роль в обеих полуреакциях.
Реакция между щавелевой кислотой и перманганатом калия в кислом растворе классический метод стандартизации растворов иона MnO 4 — . Эти решения необходимо стандартизировать, прежде чем их можно будет использовать, потому что их сложно получить чистый перманганат калия. Есть три источника ошибок.
- Образцы KMnO 4 обычно загрязнены MnO 2 .
- Некоторые из KMnO 4 вступают в реакцию со следовыми загрязнениями при растворении в воде, даже когда в качестве растворителя используется дистиллированная вода.
- Присутствие следов MnO 2 в этой системе катализирует разложение MnO 4 — ион в стоячем состоянии.
Следовательно, растворы этого иона необходимо стандартизировать титрованием непосредственно перед тем, как они используются. Образец оксалата натрия х.ч. (Na 2 C 2 O 4 ) отвешивают, растворяют в дистиллированной воде, подкисляют серной кислотой, а затем перемешивают до растворения оксалата.Полученный раствор щавелевой кислоты затем используют для титровать MnO 4 — до конечной точки титрования, которая является точкой при котором последняя капля иона MnO 4 — составляет обесцвеченный и слабый розовый цвет сохраняется в течение 30 секунд.
Растворы иона MnO 4 — , стандартизованные относительно щавелевая кислота, используя уравнение, сбалансированное в предыдущей практической задаче, может быть использована для определить концентрацию водных растворов перекиси водорода, используя уравнение уравновешивают в следующей практической задаче.
Окислительно-восстановительные реакции в основных растворах
Полураакции также полезны для уравновешивания уравнений в основных решениях. Ключ к Успех этих реакций заключается в признании того, что основные растворы содержат H 2 O молекул и ионов OH — . Поэтому мы можем добавлять молекулы воды или ионы гидроксида. к любой стороне уравнения, если необходимо.
Следующее уравнение описывает реакцию между перманганат-ионом и водородом. перекисью в кислом растворе.
2 MnO 4 — ( водн. ) + 5 H 2 O 2 ( водн. ) + 6 H + ( водн. ) 2 Mn 2+ ( водн. ) + 5 O 2 ( г ) + 8 H 2 O ( l )
Было бы интересно посмотреть, что происходит, когда это реакция происходит в основном растворе.
Реакции, в которых один реагент подвергается как окислению, так и восстановлению, называются диспропорционированием. реакция .Бром, например, непропорционирует с образованием бромид- и бромат-ионы при добавлении сильного основания к водному раствору брома.
| ОН — | |||||
| рублей 2 | Br — | + | BrO 3 — |
Молекулярные окислительно-восстановительные реакции
Структуры Льюиса могут играть жизненно важную роль в понимании окислительно-восстановительных реакций со сложными молекулами.Рассмотрим, например, следующую реакцию, которая используется в Алкотестер для определения количества этилового спирта или этанола в выдыхаемом воздухе. лица, подозреваемые в управлении транспортным средством в нетрезвом виде.
3 CH 3 CH 2 OH ( г ) + 2 Cr 2 O 7 2- ( водн. ) + 16 H + ( водн. ) 3 CH 3 CO 2 H ( водн. ) + 4 Cr 3+ ( водн. ) + 11 H 2 O ( л )
Мы могли бы сбалансировать полуреакцию окисления в терминах молекулярных формул исходный материал и продукт этой полуреакции.
| Окисление: | C 2 H 6 O | C 2 H 4 O 2 |
Однако легче понять, что происходит в этой реакции, если присвоить степени окисления для каждого из атомов углерода в структурах Льюиса компонентов эта реакция, как показано на рисунке ниже.
Атому углерода в группе CH 3 в этаноле присвоена степень окисления. -3, так что он может сбалансировать степени окисления трех атомов H, которые он несет. Применение того же метода к группе CH 2 OH в исходном материале дает степень окисления -1.
Углерод в группе CH 3 в уксусной кислоте, образующейся в этой реакции, имеет та же степень окисления, что и у исходного материала: -3.Есть изменение в степень окисления другого атома углерода, однако, от -1 до +3. Окисление Таким образом, полуреакция формально соответствует потере четырех электронов одним из атомы углерода.
| Окисление: | СН 3 СН 2 ОН | CH 3 CO 2 H | + | 4 e — |
Поскольку эта реакция протекает в кислотном растворе, мы можем добавить H + и H 2 O молекул по мере необходимости, чтобы сбалансировать уравнение.
| Окисление: | СН 3 СН 2 ОН | + | H 2 O | CH 3 CO 2 H | + | 4 e — | + | 4 часа + |
Другая половина этой реакции включает шестиэлектронное восстановление Cr 2 O 7 2- ион в кислом растворе с образованием пары ионов Cr 3+ .
| Сокращение: | Cr 2 O 7 2- | + | 6 e — | 2 Cr 3+ |
Добавление ионов H + и молекул H 2 O по мере необходимости дает следующее сбалансированное уравнение для этой полуреакции.
| Сокращение: | Cr 2 O 7 2- | + | 14 часов + | + | 6 e — | 2 Cr 3+ | + | 7 H 2 O |
Теперь мы готовы объединить две половинные реакции, предположив, что электроны ни создан, ни разрушен в этой реакции.
| 3 (CH 3 CH 2 OH + H 2 O CH 3 CO 2 H + 4 e — + 4 H + ) |
| 2 (Cr 2 O 7 2- + 14 H + + 6 e — 2 Cr 3+ + 7 H 2 O) |
| 3 CH 3 CH 2 OH + 2 Cr 2 O 7 2- + 28 H + + 3 H 2 O |
| 3 CH 3 CO 2 H + 4 Cr 3+ + 12 H + + 14 H 2 O |
Упростим это уравнение, удалив 3 H 2 молекул O и 12 H + ионы с обеих сторон уравнения дает сбалансированное уравнение для этой реакции.
3 CH 3 CH 2 OH ( г ) + 2 Cr 2 O 7 2- ( водн. ) + 16 часов + ( водн. ) 3 CH 3 CO 2 H ( водн. ) + 4 Cr 3+ ( водн. ) + 11 H 2 O ( л )
| Практическая задача 8: Метиллитий (CH 3 Li) может использоваться для образования связей между углеродом и металлами основной группы или переходными металлы: HgCl 2 ( с ) + 2 CH 3 Li ( л ) Hg (CH 3 ) 2 ( л ) + 2 LiCl ( с ) WCl 6 (s) + 6 CH 3 Li ( л ) W (CH 3 ) 6 ( л ) + 6 LiCl ( с ) Может использоваться также для образования связей между углеродом и другими неметаллами: PCl 3 (s) + 3 CH 3 Li ( л ) P (CH 3 ) 3 ( л ) + 3 LiCl ( с ) или между атомами углерода: CH 3 Li ( л ) + H 2 CO ( г ) [CH 3 CH 2 OLi] CH 3 CH 2 OH ( л ) Используйте структуры Льюиса для объяснения стехиометрии следующих реакция окисления, которая используется для синтеза метиллития: CH 3 Br ( л ) + 2 Li ( s ) CH 3 Li ( л ) + LiBr ( с ) Нажмите здесь, чтобы проверить свой ответ на «Практика» Проблема 8. |
,
Уравновешивание окислительно-восстановительных реакций ионно-электронным методом
У вас есть уравнение окислительно-восстановительного потенциала, которое вы не знаете, как сбалансировать? Помимо простой балансировки рассматриваемого уравнения, эти программы также предоставят вам подробный обзор всего процесса балансировки с помощью выбранного вами метода.
- Ионно-электронный метод (также называемый методом полуреакции)
- Метод изменения окислительного числа
- Метод агрегированных окислительно-восстановительных видов (или метод ARS) — Новое в periodni.com [1]
ионно-электронным методом
В ионно-электронном методе (также называемом методом полуреакции) уравнение окислительно-восстановительного потенциала разделяется на два полууравнения — одно для окисления, а второе для восстановления. Каждую из этих полуреакций уравновешивают отдельно, а затем объединяют для получения сбалансированного окислительно-восстановительного уравнения.
Введите уравнение химической реакции и нажмите «Отправить» (например: mn2 ++ bio3- + h + = mno4- + bi3 +).
Правила набора уравнений
- Пробелы не имеют значения, например Cu SO 4 равен CuSO4
- Все типы круглых скобок верны, например K3 [Fe (CN) 6]
- Чтобы ввести виды заряда, просто введите их как есть, например Hg2 +, Hg22 + или Hg2 ^ 2 +
- Чтобы ввести знак уравнения, вы можете использовать символы «=», «->» или «→».
- Уравнение можно писать строчными буквами. Если элементы в химической формуле правильно написаны с заглавной буквы, преобразователь смарт-кейсов оставит их так, как вы ввели.
Почему необходимо сбалансировать химические уравнения?
Сбалансированное химическое уравнение точно описывает количества реагентов и продуктов в химических реакциях. Закон сохранения массы гласит, что масса не создается и не разрушается при обычной химической реакции.Это означает, что химическое уравнение должно иметь одинаковое количество атомов каждого элемента на обеих сторонах уравнения. Также сумма зарядов на одной стороне уравнения должна быть равна сумме зарядов на другой стороне. Когда эти два условия выполняются, уравнение считается сбалансированным.
Руководство по уравновешиванию уравнений окислительно-восстановительного потенциала
- Шаг 1. Запишите несбалансированное уравнение
- Шаг 2. Разделите окислительно-восстановительную реакцию на половину реакции.
- а) Назначьте степени окисления для каждого атома
- б) Определите и запишите все окислительно-восстановительные пары в реакции .
- c) Объединить эти окислительно-восстановительные пары в две полуреакции
- Шаг 3.Сбалансируйте атомы в каждой половине реакции
- a) Уравновесить все остальные атомы, кроме H и O
- б) Уравновесить атомы кислорода с помощью H 2 O
- c) Уравновесить атомы водорода с помощью H +
- d) В базовой среде добавьте по одному OH — с каждой стороны на каждые H + .
- Шаг 4. Уравновесить расходы с помощью e —
- Шаг 5: Сделайте усиление электронов эквивалентным потере электронов в полуреакциях
- Шаг 6: сложите половину реакции
- Шаг 7: Упростите уравнение
- Наконец, убедитесь, что элементы и заряды сбалансированы.
Пример уравнения окислительно-восстановительного потенциала
Ионное уравнение против молекулярного вида
Когда уравнение записано в молекулярной форме, программа будет иметь проблемы с балансировкой атомов в полуреакциях (шаг 3.). Этого можно избежать, записав уравнение в ионной форме.
Разные решения
- KSCN + 4I 2 + 4H 2 O → KHSO 4 + 7HI + ICN
- SCN — + 5I 2 + 4H 2 O → HSO 4 — + 8I — + CN — + 2I + + 7H +
полуреакций — Chemistry LibreTexts
Полуреакция представляет собой окислительно-восстановительный компонент окислительно-восстановительной реакции. Половина реакции получается путем рассмотрения изменения степени окисления отдельных веществ, участвующих в окислительно-восстановительной реакции. [1]
Часто концепция полуреакций используется для описания того, что происходит в электрохимическом элементе, таком как гальванический элемент. Можно написать полуреакции, описывающие как металл, подвергающийся окислению (известный как анод), так и металл, подвергающийся восстановлению (известный как катод).
Полуреакции часто используются как метод уравновешивания окислительно-восстановительных реакций. Для окислительно-восстановительных реакций в кислых условиях после уравновешивания атомов и степени окисления необходимо добавить ионы H + , чтобы уравновесить ионы водорода в полуреакции. Для окислительно-восстановительных реакций в основных условиях, после уравновешивания атомов и степеней окисления, сначала относитесь к нему как к кислому раствору, а затем добавляйте ионы OH — , чтобы уравновесить ионы H + в полуреакциях (что даст H 2 O).
Пример: гальванический элемент из цинка и меди
Гальванический элементРассмотрим гальванический элемент, показанный на изображении справа: он состоит из куска цинка (Zn), погруженного в раствор сульфата цинка (ZnSO 2 ), и куска меди (Cu), погруженного в раствор сульфат меди (II) (CuSO 4 ). Общая реакция:
- Zn (т.) + CuSO 4 (водн.) → ZnSO 4 (водн.) + Cu (т.)
На аноде из цинка происходит окисление (металл теряет электроны).Это представлено в следующей полуреакции окисления (обратите внимание, что электроны находятся на стороне продуктов):
- Zn (т) → Zn 2 + + 2e —
На медном катоде происходит восстановление (принимаются электроны). Это представлено в следующей полуреакции восстановления (обратите внимание, что электроны находятся на стороне реагентов):
- Cu 2 + + 2e — → Cu (тв)
Пример: окисление магния
Фотография горящей магниевой ленты с очень короткой выдержкой для получения деталей окисления.Рассмотрим пример обжига магниевой ленты (Mg). Когда магний горит, он соединяется с кислородом (O2) из воздуха с образованием оксида магния (MgO) в соответствии со следующим уравнением:
- 2Mg (тв) + O 2 (г) → 2MgO (тв)
Оксид магния — это ионное соединение, содержащее ионы Mg 2 + и O 2–, тогда как Mg (s) и O 2 (g) являются элементами без заряда. Mg (s) с нулевым зарядом получает заряд +2, идущий от стороны реагента к стороне продукта, а O 2 (g) с нулевым зарядом получает заряд -2.Это потому, что когда Mg (s) становится Mg 2 + , он теряет 2 электрона. Поскольку на левой стороне 2 Mg, всего теряется 4 электрона в соответствии со следующей полуреакцией окисления:
- 2Mg (s) → 2Mg 2 + + 4e —
С другой стороны, O 2 был восстановлен: его степень окисления изменяется от 0 до -2. Таким образом, можно записать полуреакцию восстановления для O 2 , поскольку он получает 4 электрона:
- O 2 (г) + 4e — → 2O 2 —
Общая реакция является суммой обеих полуреакций:
- 2Mg (s) + O 2 (g) + 4e — → 2Mg 2 + + 2O 2 — + 4e —
Когда происходит химическая реакция, особенно окислительно-восстановительная реакция, мы не видим электроны, как они появляются и исчезают в ходе реакции.Мы видим реагенты (исходный материал) и конечные продукты. Благодаря этому электроны, появляющиеся по обе стороны уравнения, сокращаются. После отмены уравнение переписывается как
- 2Mg (s) + O 2 (г) → 2Mg 2 + + 2O 2 —
Два иона, положительный (Mg 2 + ) и отрицательный (O 2–) присутствуют на стороне продукта и сразу же объединяются, образуя сложный оксид магния (MgO) из-за их противоположных зарядов (электростатическое притяжение).В любой данной окислительно-восстановительной реакции есть две полуреакции — полуреакция окисления и полуреакция восстановления. Сумма этих двух полуреакций и есть реакция окисления-восстановления.
Метод уравновешивания полуреакций
Рассмотрим реакцию ниже:
- Класс 2 + 2Fe 2+ → 2Cl — + 2Fe 3+
Два вовлеченных элемента, железо и хлор, изменяют степень окисления каждый; железо от +2 до +3, хлор от 0 до -1.Таким образом, фактически происходят две реакции и половина . Эти изменения можно представить формулами, вставив соответствующие электроны в каждую половину реакции:
- Fe 2 + → Fe 3 + + e —
- Класс 2 + 2e — → 2Cl —
При наличии двух полуреакций, зная соответствующие электродные потенциалы, можно таким же образом прийти к полной (исходной) реакции.Разложение реакции на полуреакции является ключом к пониманию множества химических процессов. Например, в приведенной выше реакции можно показать, что это окислительно-восстановительная реакция, в которой Fe окисляется, а Cl восстанавливается. Обратите внимание на перенос электронов от Fe к Cl. Разложение — это также способ упростить балансировку химического уравнения. Химик может атомировать баланс и заряжать баланс по одной части уравнения за раз.
Например:
- Fe 2+ → Fe 3+ + e — становится 2Fe 2+ → 2Fe 3+ + 2e —
- добавляется к Cl 2 + 2e — → 2Cl —
- и, наконец, становится Cl 2 + 2Fe 2+ → 2Cl — + 2Fe 3+
Также возможно и иногда необходимо рассматривать полуреакцию либо в основных, либо в кислых условиях, так как в окислительно-восстановительной реакции может присутствовать кислотный или основной электролит.Из-за этого электролита может быть труднее обеспечить баланс как атомов, так и зарядов. Это делается путем добавления H 2 O, OH — , e — и / или H + к любой стороне реакции до тех пор, пока атомы и заряды не будут сбалансированы.
Рассмотрим полуреакцию ниже:
PbO 2 → PbO
OH — , H 2 O и e — можно использовать для балансировки зарядов и атомов в основных условиях.
2e — + H 2 O + PbO 2 → PbO + 2OH —
Снова Рассмотрим полуреакцию ниже:
PbO 2 → PbO
H + , H 2 O и e — можно использовать для балансировки зарядов и атомов в кислых условиях.
2e — + 2H + + PbO 2 → PbO + H 2 O
Обратите внимание, что обе стороны сбалансированы по заряду и по атомам.
Часто и H + , и OH — присутствуют в кислых и основных условиях, но в результате реакции двух ионов образуется вода H 2 O (показано ниже):
H + + OH — → H 2 O
,{2 +} (\ text {aq}) + 8 \ text {H} _ {2} \ text {O} (\ text {l}) \) ,