1. Физические величины в химии, их обозначение и единицы измерения. Постоянные
В химии используются международные обозначения физических величин и единицы их измерения.
Для использования в химических расчётах некоторые международные единицы оказываются не совсем удобными (слишком большими или слишком маленькими), поэтому чаще применяют кратные единицы — г, мг, дм³, см³.
Иногда в задачах встречаются также несистемные единицы — л, мл.
Физические величины, их обозначения и единицы измерения
Величина | Обозначение | Единицы измерения |
| Число частиц | \(\)N\(\) | частиц |
| Количество вещества | \(\)n\(\) | |
| Масса | \(\)m\(\) | г, кг, мг, а. е. м., u |
| Относительная атомная масса | Ar | — |
| Относительная молекулярная масса | Mr | — |
| Молярная масса | \(\)M\(\) | |
| Объём | \(\)V\(\) | дм³, м³, см³, л, мл |
| Молярный объём | Vm | дм³/моль, л/моль
|
| Плотность | ρ | |
| Массовая доля | \(\)w\(\) | — |
В химических расчётах часто используются постоянные величины, значения которых надо запомнить.
Некоторые постоянные, применяемые в химических расчётах
| Постоянная Авогадро | 6,02⋅1023 моль-1, 6,02⋅1023 1/моль |
| Молярный объём газов при н. у. | \(22,4\) дм³/моль |
| Атомная единица массы | 1,66⋅10−24 г, 1,66⋅10−27 кг |
| Плотность воды при \(4\) °С | \(1\) г/см³, \(1\) г/мл, \(1000\) г/дм³ |
Основные Химические формулы для решения задач.
| № | Количественные характеристики вещества | Обозначение | Единицы измерения | Формула для расчета |
|---|---|---|---|---|
| 1 | Плотность вещества | ρ | кг/м³ | ρ = m / V(Массу делим на объем вещества) |
| 2 | Относительная атомная масса элемента | Аr | — | Ar = ma / u см. в периодической система химических элементов |
| 3 | Атомная единица массы | u а. 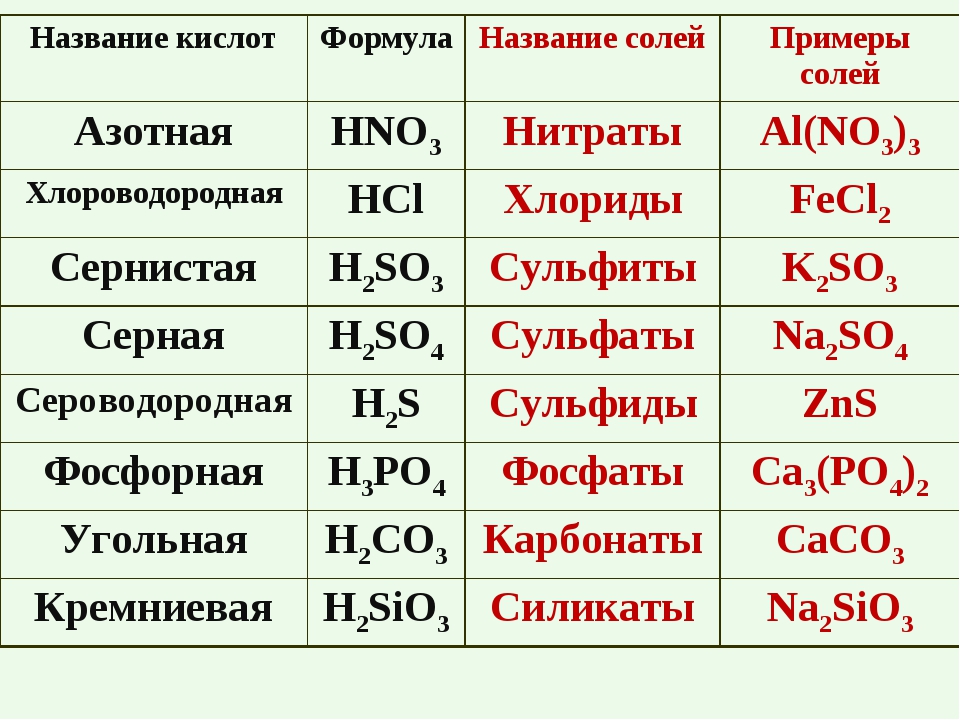 е.м. е.м. | кг | u = 1/12 * ma (12C) const = 1.66*10-27 |
| 4 | Масса атома (абсолютная) | ma | кг | ma = Ar * u |
| 5 | Относительная молекулярная (формульная) масса вещества | Mr | — | Mr (AxBy)=m(AB) / u |
| 6 | Масса молекулы (формульной единицы) | m M | кг | mM = Mr*u |
| 7 | Количество вещества | n | моль | n=m/M n=N/NA n=V/VM |
| 8 | Молярная масса (масса 1 моль вещества) | M | г/моль | M=m/n M=Mr M=Ar (для простых веществ) |
| 9 | Масса вещества | m | г (кг) | m=M*n m=ρ*V |
| 10 | Число структурных единиц | N | атомов, молекул, ионов, частиц, формульных единиц (Ф.Е.) | N=NA*n |
| 11 | Молярный объем — число 1 моль ГАЗООБРАЗНОГО вещества в нормальных условиях (н. у.) у.) | VM | л/моль | const=22,4 |
| 12 | Объем газа при н.у. | V | л | V=VM*n V=m/ρ |
| 13 | Постоянная Авогадро | NA | частиц/моль | const=6,02*1023 |
| 14 | Массовая доля вещества (омега) | ωЭ/В | % | ωЭ/В = (Ar(э) * k) / Mr(В) |
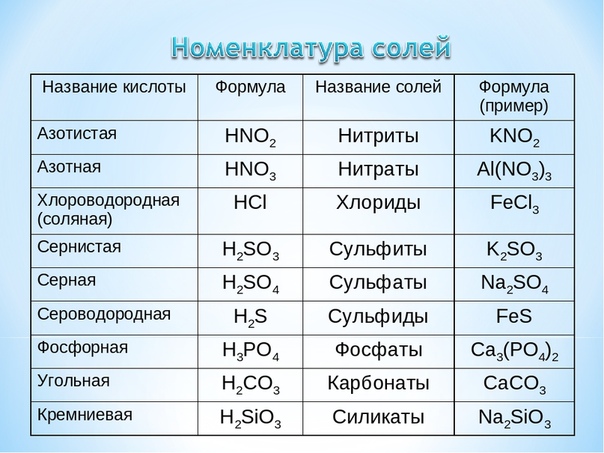
| Формула | Название кислоты | Формула кислотного остатка | Название кислотного остатка |
|---|---|---|---|
| HF | Фтороводород, плавиковая | F— | Фторид |
| HCl | Хлороводород, соляная | Cl— | Хлорид |
| HBr | Бромоводород | Br— | Бромид |
| HI | Йодоводород | I— | Йодид |
| h3S | Сероводород | S2- | Сульфид |
| HCN | Циановодородная | CN— | Цианид |
| HNO2 | Азотистая | NO2— | Нитрит |
| HNO3 | Азотная | NO3— | Нитрат |
| h4PO4 | Ортофосфорная | PO43- | Фосфат |
| h4AsO4 | Мышьяковая | AsO43- | Арсенат |
| h3SO3 | Сернистая | SO32- | Сульфит |
| h3SO4 | Серная | SO42- | Сульфат |
| h3CO3 | Угольная | CO32- | Карбонат |
| h3SiO3 | Кремниевая | SiO32- | Силикат |
| h3CrO4 | Хромовая | CrO42- | Хромат |
| h3Cr2O7 | Дихромовая | Cr2O72- | Дихромат |
| HMnO4 | Марганцовая | MnO4— | Перманганат |
| HClO | Хлорноватистая | ClO— | Гипохлорит |
| HClO2 | Хлористая | ClO2— | Хлорит |
| HClO3 | Хлорноватая | ClO3— | Хлорат |
| HClO4 | Хлорная | ClO4— | Перхлорат |
| HCOOH | Метановая, муравьиная | HCOO— | Формиат |
| Ch4COOH | Этановая, уксусная | Ch4COO— | Ацетат |
| h4C2O4 | Этандиовая, щавелевая | C2O42- | Оксалат |
Нажмите на картинку для увеличения
Урок 8.
 количество вещества. молярная масса. молярный объём газазакон авогадро — Химия — 8 класс
количество вещества. молярная масса. молярный объём газазакон авогадро — Химия — 8 класс Количество вещества. Молярная масса. Молярный объем газа. Закон Авогадро
Из курса физики мы знаем о таких физических величинах, как масса, объём и плотность. При помощи этих величин легко характеризовать вещества. Например, мы идём в магазин и покупаем 1 кг сахара или литровую бутылку минеральной воды. Но оказывается, что этих величин недостаточно, если необходимо рассмотреть вещество с точки зрения числа частиц. Сколько молекул сахара содержится в 1 кг сахара? А сколько молекул воды в литровой бутылке? А в одной капле? Ответ на этот вопрос можно получить, если знать ещё об одной физической величине, которая называется количество вещества. Точное число молекул посчитать сложно, но если считать не штуками, а порциями, то задача упрощается. Например, мы никогда не покупаем в магазине спички поштучно, но купив одну порцию спичек – коробок, знаем, что там 100 штук.

Количество вещества – это порция вещества с определённым числом структурных частиц. Количество вещества принято обозначать греческой буквой ν [ню]. В системе СИ единица измерения количества вещества называется моль. Один моль вещества содержит столько же структурных частиц, сколько атомов содержится в 12 г углерода, а именно 6*1023 частиц. Это количество является постоянной величиной и называется «постоянная Авогадро». Количество вещества можно определить как отношение числа структурных частиц к числу частиц в одном моле вещества.
Например, количество вещества, которое соответствует 3*1023 атомов железа можно легко рассчитать по этой формуле.
Преобразовав исходную формулу легко определить число структурных частиц по известному количеству вещества: N = v * NA
Своё имя эта постоянная получила в честь Амедео Авогадро, который в 1811 году сделал предположение, которое затем подтвердилось экспериментально и теперь носит имя Закона Авогадро.
 Закон Авогадро: «в равных объёмах различных газов при одинаковых условиях (температура и давление) содержится одинаковое количество молекул».
Закон Авогадро: «в равных объёмах различных газов при одинаковых условиях (температура и давление) содержится одинаковое количество молекул».При нормальных условиях количество вещества это отношение объёма к молярному объему.
По этой формуле можно определить объём вещества, если известно его количество: V = ν * Vm
Массу вещества количеством 1 моль называют молярной массой, обозначают буквой M. Молярная масса численно равна относительной молекулярной массе. Единица измерения молярной массы г/моль.
Зная массу вещества, легко определить количество вещества.

Найдём количество вещества 5,6 г железа.
Справочный материал
• Количество вещества ν [ню] – это физическая величина, характеризующая количество однотипных структурных единиц (любые частицы, из которых состоит вещество – атомы, молекулы, ионы и т.д), содержащихся в веществе. Единица измерения количества вещества в Международной системе единиц (СИ) – моль.
• Моль – это единица измерения количества вещества. Один моль вещества содержит столько же структурных частиц, сколько атомов содержится в 12 г углерода.
• Молярная масса (M) – масса вещества количеством один моль. Единица измерения г/моль.
• Нормальные условия (н.у.) – физические условия, определяемые давлением 101325 Па (нормальная атмосфера) и температурой 273,15 К (0 °С).
• Молярный объём (Vm) – объём вещества количеством один моль. Единица измерения л/моль; при н.у. Vm = 22,4 л/моль
• Закон Авогадро – в равных объёмах различных газов при одинаковых условиях (температура и давление) содержится одинаковое количество молекул.

• Постоянная Авогадро (NA) показывает число структурных частиц в веществе количеством один моль.
Формула количества вещества в химии
Определение и формула количества вещества
Моль – количество вещества системы, которое содержит столько определенных структурных звеньев (молекул, атомов, ионов, электронов и т.д.), сколько содержится в 0,012 кг углерода-12.
Масса одного атома 12С равна 12 а.е.м., поэтому число атомов в 12 г изотопа 12С равно:
NA = 12 г / 12 × 1,66057×10-24 г = 1/1,66057×10-24 = 6,0221×10-23.
Таким образом, моль вещества содержит 6,0221×10-23 частиц этого вещества.
Физическую величину NA называют постоянной Авогадро, она имеет размерность [N A] = моль-1. Число 6,0221×10-23 называют числом Авогадро. Таким образом количество вещества будет вычисляться как:
n = N / NA,
где N – число структурных звеньев, а NA — постоянная Авогадро.
Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
M = NA × m (1 молекулы) = NA × Mr × 1 а.е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
Это означает, что если масса некоторой молекулы равна, например, 44 а.е.м., то масса одного моля молекул равна 44 г.
Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных отношений к молярным. Поэтому другая формула для вычисления количество вещества выглядит следующим образом:
n = m / M,
где m – масса вещества (г), а М – его молярная масса (г/моль).
Количество вещества газа можно рассчитать при помощи закона Авогадро: в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Следовательно, при нормальных условиях 1 моль различных газов занимает объем, равный 22,4 л. Этот объем называется молярным объемом газа:
Следовательно, при нормальных условиях 1 моль различных газов занимает объем, равный 22,4 л. Этот объем называется молярным объемом газа:
n= V /Vm,
где V – объем газа (л), а Vm – молярный объем (л/моль).
Примеры решения задач
Катализируй это: за что дали Нобелевку по химии в 2021 году | Статьи
В этом году Нобелевскую премию по химии присудили двум ученым из Германии и США, которые независимо друг от друга открыли новый тип катализаторов — веществ, запускающих химические реакции. С их помощью можно синтезировать различные вещества, которые будут дешевле сделанных другими способами. Сейчас это направление органической химии активно развивается, позволяя разрабатывать новые лекарства и диагностические системы, пояснили опрошенные «Известиями» эксперты.
Сам себе катализаторНобелевскую премию по химии за 2021 год присудили ученому из Германии Бенджамину Листу и американцу Дэвиду Макмиллану «за развитие асимметрического органокатализа». Катализаторы — важнейшие инструменты для химиков, на которых построена вся современная химическая промышленность.
Катализаторы — важнейшие инструменты для химиков, на которых построена вся современная химическая промышленность.
Бенджамин Лист
Фото: Hokkaido University Institute for Chemical Reaction Design and Discovery
Бенджамин Лист, который сейчас трудится в Институте исследований углерода Макса Планка (Германия), в свое время работал в Исследовательском институте Скриппс в США — одной из крупнейших частных научных организаций, специализирующихся на химии.
Дэвид Макмиллан — шотландско-британский химик, но сейчас работает в США. Этот ученый — заслуженный профессор Принстонского университета и член Национальной академии наук США. Макмиллан использовал небольшие органические молекулы и заменил атом металла в катализаторе на ионы органического происхождения со связью между атомом азота и атомом углерода.
Понятие о катализе было сформулировано в 1835 году шведским химиком Якобом Берцелиусом на основе наблюдений за тем, что природные ферменты способны ускорять протекание процессов в живых организмах. Сегодня известно множество типов катализаторов: металлы и их комплексы, ферменты, оксиды и другие.
Сегодня известно множество типов катализаторов: металлы и их комплексы, ферменты, оксиды и другие.
Дэвид Макмиллан
Фото: REUTERS/Princeton University/Denise Applewhite
— Листом и Макмиланом создана серия катализаторов для различных химических реакций. Важным в их многочисленных работах является определение механизма реакции, что позволяет конструировать сам катализатор, — отметил в беседе с «Известиями» доцент Института живых систем Балтийского федерального университета им. И. Канта Евгений Чупахин. — Представьте, что вы собираете модель из «Лего» и у вас есть схема сборки, но кубики столь малы, что вы не можете их точно соединить друг с другом, и они соединяются случайно, не повторяя симметрию. Вам нужен макетный стенд, который будет правильно ориентировать кубики в пространстве. Катализатор и работает как этот стенд, и Макмиллан с Листом нашли способ его направленного конструирования, что эффективнее, чем систематически проверять сотни вариантов.
Бенджамин Лист и Давид Макмиллан в своих работах сфокусировались на органокатализаторах — то есть катализаторах, представляющих собой небольшие (по сравнению с природными ферментами) органические молекулы.
— Органокатализаторы могут рассматриваться как некие синтетические аналоги природных катализаторов-ферментов, катализирующих химические процессы в живой природе, — отметил заведующий отделом Института катализа СО РАН, профессор РАН Константин Брыляков. — То есть Лист и Макмиллан в своих работах, фактически, попытались моделировать происходящие в природе биохимические процессы на более низком химическом уровне. Все-таки ферменты — это объекты сложные, а большинство органокатализаторов имеют невысокий молекулярный вес, это достаточно маленькие (и недорогие) объекты, специально синтезированные для катализа какого-то одного процесса, нужного исследователю. Подход, избранный ими, называют биомиметическим (биомоделирующим).
Бенджамин Лист во многом отталкивался от природных соединений, подчеркнул Константин Брыляков.
— К примеру, он брал природный алкалоид хинин, модифицировал его для придания необходимой каталитической активности и использовал в качестве катализатора. Такой подход в итоге дал очень яркие результаты в области синтетической органической химии, — рассказал эксперт.
Заслуга номинантов этого года именно в том, что они независимо друг от друга сумели перенести реакции, происходящие в природе, в лаборатории, подчеркнул в беседе с «Известиями» заведующий лабораторией в Институте элементоорганических соединений им. А.Н. Несмеянова, грантополучатель РНФ Дмитрий Перекалин.
Процесс брожения вина
Фото: РИА Новости/Виталий Тимкив
— Нельзя сказать, что до них человечество этим не пользовалось: тот же процесс брожения и производства спирта — это такой же органокаталитический процесс, когда бактерии добавляются в виноградный сок и делают за вас всю работу. Но это всё равно достаточно сложный процесс. Выяснилось, что необязательно использовать такие системы, а даже самые простые природные «кирпичики» — аминокислоты — могут выступать катализатором и помочь сделать другие органические молекулы, — отметил химик.
Как подчеркивают эксперты, несомненный плюс метода, за разработку которого присуждена премия этого года, — в том, что он позволяет уйти от использования металлов (которые могут быть токсичными), а значит, сделать производство тех же лекарств более безопасным. Также технология позволяет химикам не зависеть от рынка ценных металлов — это удешевляет процесс производства и делает синтез новых веществ более доступным.
Сейчас это направление органической химии активно развивается во всем мире, в том числе и в России. Катализаторы, созданные по новому принципу, применяют для синтеза лекарств, получения полимеров, создания новых молекулярных органических проводников для электроники и других целей. Сами нобелевские лауреаты активно работают с учеными со всего мира, в том числе и из России.
— Мы работали с Бенджамином Листом над несколькими проектами, — сообщил «Известиям» руководитель группы эффективного катализа Института элементоорганических соединений им. А.Н. Несмеянова РАН Денис Чусов. — В первом мы разрабатывали новый тип асимметрической кислоты, которую можно использовать так же, как и ту кислоту, которая содержится в желудке человека, только производить процессы с большей избирательностью. Это нужно для превращения одних органических веществ в другие.
А.Н. Несмеянова РАН Денис Чусов. — В первом мы разрабатывали новый тип асимметрической кислоты, которую можно использовать так же, как и ту кислоту, которая содержится в желудке человека, только производить процессы с большей избирательностью. Это нужно для превращения одних органических веществ в другие.
Второй проект посвящен экологии, и ученые продолжают им заниматься, добавил специалист.
Выбросы одного из металлургических комбинатов
Фото: ТАСС/Ведомости/Андрей Гордеев
— Он не относится к области асимметрического катализа. Одним из основных отходов при производстве стали является угарный газ. Выбрасывать его в атмосферу нельзя, потому что он ядовит. Его сжигают с использованием кислорода и уже после этого выбрасывают в атмосферу. Но можно поступить по-другому и использовать его на благо человечества. Мы показали, что у него есть уникальные восстановительные свойства, которые можно использовать в органической химии для реакций восстановления и получать продукты, которые раньше получить было, в принципе, невозможно, — рассказал Денис Чусов.
И Лист, и Макмиллан продолжают совершенствовать направление асимметрического катализа. Помимо работы в лабораториях, они занимаются преподавательской деятельностью.
— Я слушал доклад Дэвида Макмиллана в Институте органической химии в 2014 году, — рассказал профессор кафедры органической химии химического факультета МГУ им. М.В. Ломоносова, заведующий лабораторией супрамолекулярной химии ИОХ РАН Сергей Вацадзе.
По его словам, несмотря на ранее утро воскресенья, аудитория была полной.
Лаборатория химии нитросоединений (№ 42)
✓ Разработан метод синтеза и изучены свойства нового высокоэнергетического соединения – [1,2,3,4]тетразино[5,6-е][1,2,3,4]тетразин-1,3,6,8-тетраоксида (ТТТО). Он был синтезирован в десять стадий из 2,2-бис(трет-бутил-NNO-азокси)ацетонитрила. Синтетическая стратегия была основана на последовательном замыкании двух 1,2,3,4-тетразин-1,3-диоксидных колец путем генерации ионов оксодиазония и их внутримолекулярной реакции с трет-бутил-NNO-азоксигруппами. Структура ТТТО была подтверждена с помощью монокристального рентгеноструктурного анализа.
Структура ТТТО была подтверждена с помощью монокристального рентгеноструктурного анализа.
✓ (Трет-бутил-NNO-азокси)ацетонитрил был получен путем нового одностадийного превращения оксимной группы в метиленовый мостик с использованием аминирующего агента. Это соединение с активным метиленовым мостиком сыграло ключевую роль в создании нового подхода к синтезу тетразол-1-оксидов.
✓ Разработан синтетический подход к неизвестным ранее 1,2,3,4-тетразин-1,3-диоксидам, аннелированным 1(2)-арил-1,2,3-триазолами. Первый этап синтеза включает получение 5-амино-4-(трет-бутил-NNO-азокси)-1(2)-арил-1(2)Н-1,2,3-триазолов из (трет-бутил-NNO-азокси)ацетонитрила. Второй этап включает их циклизацию с получением целевых триазолотетразинов. Их структуры были подтверждены спектроскопией ЯМР 1Н, 13С и 14N, HRMS и рентгеноструктурными исследованиями. Были исследованы общие черты и различия в молекулярных структурах этих соединений, включая ароматичность.
✓ Разработан синтетический подход к 5,11-дегидро-5Н,11Н-[1,2,3,4]тетразино[5′,6′:4,5]-[1,2,3]триазоло[2,1-а][1,2,3]бензотриазол-1,3-диоксиду и 5,11-дегидро-5Н,11Н-[1,2,3,4]тетразино-[5′,6′:4,5][1,2,3]триазоло[2,1-а][1,2,3]бензотриазол-2,4-диоксиду. Эти полициклические системы являются первыми, в которых 1,2,3,4-тетразин-1,3-диоксидный цикл непосредственно сконденсирован с 1,3а,4,6а-тетраазапенталеновой системой. Синтетическая цепочка начинается с (трет-бутил-NNO-азокси)ацетонитрила и включает сначала замыкание 1,2,3,4-тетразин-1,3-диоксидного цикла, а затем образование тетраазапенталеновой системы. Также были получены производные новых полициклических систем, нитрованные по бензольному кольцу. Структуры синтезированных соединений были подтверждены спектроскопией ЯМР и рентгеноструктурными исследованиями.
✓ Разработан метод синтеза нового энергоемкого соединения – 7-нитро-3-(нитро-NNO-азокси)-[1,2,4]триазоло[5,1-с][1,2,4]триазин-4-амина, содержащего смежные нитро-NNO-азокси и аминные группы. Это термически устойчивое (температура начала разложения 154 °C), высокоэнергетическое (расчетная теплота образования 580 ккал·кг–1) и плотное (1.875 г см–3) соединение с кислородным балансом на уровне CO.
Это термически устойчивое (температура начала разложения 154 °C), высокоэнергетическое (расчетная теплота образования 580 ккал·кг–1) и плотное (1.875 г см–3) соединение с кислородным балансом на уровне CO.
✓ Первые алифатические нитро-NNO-азокси соединения были синтезированы путем заместительного нитрования соответствующих трет-бутил-NNO-азокси соединений тетрафторборатом нитрония. Были получены нитро(нитро-NNO-азокси)метан (1), (трет-бутил-NNO-азокси)(нитро-NNO-азокси)метан (2), бис(нитро-NNO-азокси)метан (3) и 2-нитро-2-(нитро-NNO-азокси)пропан (4). Соединение 4 с нитро-NNO-азоксигруппой, связанной с третичным атомом углерода, оказалось наиболее стабильным (ДСК, температура начала разложения 104 °C). Соединение 2 было менее стабильным (ДСК, температура начала разложения 88 °C). Соединения с сильными электроноакцепторными заместителями обладали наименьшей стабильностью, предположительно, из-за достаточно высокой кислотности CH протонов наряду с нестабильностью С-анионов нитро-NNO-азоксисоединений.
✓ Высокоэнергетические соединения, состоящие из одного или двух фуразановых циклов, связанных азо- или азокси-мостиками, и одной или двух нитро-NNO-азоксигрупп, были синтезированы нитрованием соответствующих трет-бутил-NNO-азокси соединений под действием NO2BF4. Разработаны новые методы синтеза 3,4-бис(трет-бутил-NNO-азокси)фуразана и бис-4,4′-(трет-бутил-NNO-азокси)-3,3′-азоксифуразана. Полученные нитро-NNO-азокси соединения демонстрируют высокие расчетные детонационные характеристики (vD = 8.07–9.40 км·с−1 и PC-J = 27.4–43.4 ГПа), что превосходит соответствующие нитрофуразаны (DNF, DNAzF, DNAF). Замена нитрофуразанов соответствующими (нитро-NNO-азокси)фуразанами увеличивает удельный импульс модельных составов смесевого твердого ракетного топлива на 2–10 с, что обусловлено высокими расчетными энтальпиями образования (600–892 ккал·кг−1) и положительным кислородным балансом (0–20 %) последних соединений.
✓ Разработан простой метод синтеза 4Н-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазол-5-оксида и его энергоемких солей (аммониевой, гидроксиламмониевой, гуанидиниевой, триаминогуанидиниевой). Синтезированные соединения были охарактеризованы методами ядерного магнитного резонанса (ЯМР), инфракрасной спектроскопии (ИК), масс-спектрометрии, элементным анализом, дифференциальной сканирующей калориметрией, монокристаллической и порошковой рентгеновской дифракцией. Все полученные соединения обладают высокой энтальпией образования (88.9–168.0 ккал·моль–1). Эти данные в сочетании с экспериментально определенными плотностями (1.702–1.934 г·см–1) были использованы для расчета скоростей (8.86–9.31 км·с–1) и давлений детонации (33.9–43.1 ГПа). Большинство синтезированных энергоемких солей обладают умеренной чувствительностью к удару и трению, что делает их перспективными кандидатами для практического применения, включая их использование в качестве компонентов смесевых твердых ракетных топлив. Показано, что ряд соединений имеют более высокие энергетические характеристики в качестве компонентов смесевых твердых ракетных топлив (удельный импульс выше на 5–10 с), чем HMX или CL-20 в составах таких топлив.
Синтезированные соединения были охарактеризованы методами ядерного магнитного резонанса (ЯМР), инфракрасной спектроскопии (ИК), масс-спектрометрии, элементным анализом, дифференциальной сканирующей калориметрией, монокристаллической и порошковой рентгеновской дифракцией. Все полученные соединения обладают высокой энтальпией образования (88.9–168.0 ккал·моль–1). Эти данные в сочетании с экспериментально определенными плотностями (1.702–1.934 г·см–1) были использованы для расчета скоростей (8.86–9.31 км·с–1) и давлений детонации (33.9–43.1 ГПа). Большинство синтезированных энергоемких солей обладают умеренной чувствительностью к удару и трению, что делает их перспективными кандидатами для практического применения, включая их использование в качестве компонентов смесевых твердых ракетных топлив. Показано, что ряд соединений имеют более высокие энергетические характеристики в качестве компонентов смесевых твердых ракетных топлив (удельный импульс выше на 5–10 с), чем HMX или CL-20 в составах таких топлив.
✓ Циклодегидратация доступных N-алкилэтаноламинов под действием альдегидов и одновременная или последующая кватернизация дают функционализированные четвертичные аммониевые соли N-нитроимидазолидина, оксазолидина и аннелированного бис-морфолина. Последующая замена анионов в этих солях остатками энергоемких кислот обеспечивает получение ряда энергоемких четвертичных солей с богатым содержанием водорода, обладающих удовлетворительными энергетическими характеристиками и достаточно высокой термостабильностью.
✓ Проведено компьютерное моделирование структур сокристаллов [1,2,5]оксадиазоло[3,4-е][1,2,3,4]тетразин-4,6-диоксида (ФТДО) с бензотрифуроксаном (БТФ) в соотношениях (1 : 1), (2 : 1) и (3 : 1). Рассчитаны термодинамическая стабильность и физико-химические характеристики этих сокристаллов. Согласно расчетам, сокристалл (3 : 1) термодинамически наиболее стабилен и предпочтителен для сокристаллизации. Это было экспериментально подтверждено получением сокристалла только в соотношении 3 : 1. Сокристаллы охарактеризованы методами рентгеновской дифракции и колебательной спектроскопии. В колебательных спектрах наблюдались некоторые новые полосы по сравнению со спектрами исходных соединений. Кроме того, исчезли некоторые полосы чистых ФТДО и БТФ, что характерно для образования молекулярных комплексов. Исследованы термическое разложение и чувствительность сокристаллов к ударам и трению. Чувствительность к удару (2.8 Дж) оказалась равной чувствительности менее чувствительного компонента (БТФ). Кроме того, чувствительность к трению (14 Н) снизилась в три раза по сравнению с высокочувствительным ФТДО, что необычно для сокристаллов высокоэнергетических соединений. Сокристалл (3 : 1) имеет высокую плотность: 1.888 г‧см−3 (расч.) и 1.865 г‧см−3 (эксп.). Рассчитанная скорость детонации (9.14 км‧с−1) и давление Чепмена–Жуге (38.08 ГПа) являются высокими и указывают на возможные перспективы использования этого cокристалла.
Это было экспериментально подтверждено получением сокристалла только в соотношении 3 : 1. Сокристаллы охарактеризованы методами рентгеновской дифракции и колебательной спектроскопии. В колебательных спектрах наблюдались некоторые новые полосы по сравнению со спектрами исходных соединений. Кроме того, исчезли некоторые полосы чистых ФТДО и БТФ, что характерно для образования молекулярных комплексов. Исследованы термическое разложение и чувствительность сокристаллов к ударам и трению. Чувствительность к удару (2.8 Дж) оказалась равной чувствительности менее чувствительного компонента (БТФ). Кроме того, чувствительность к трению (14 Н) снизилась в три раза по сравнению с высокочувствительным ФТДО, что необычно для сокристаллов высокоэнергетических соединений. Сокристалл (3 : 1) имеет высокую плотность: 1.888 г‧см−3 (расч.) и 1.865 г‧см−3 (эксп.). Рассчитанная скорость детонации (9.14 км‧с−1) и давление Чепмена–Жуге (38.08 ГПа) являются высокими и указывают на возможные перспективы использования этого cокристалла.
Молярный объем
Молярный объём – это объём 1 моль вещества. Понятие молярного объема применимо для газов. Например, если взять 1 моль воды, то мы не взвешиваем на весах 18 г воды, т.к. это совершенно неудобно, а зная, что плотность воды 1 г/мл, мы измеряем её объем цилиндром или мензуркой.
Молярный объем воды в таком случае будет равен 18 мл/моль. Молярный объём твёрдых веществ и жидкостей зависит от их плотности. Молярный объём воды, кислоты, сахара и соли отличается между собой, потому что и плотности их тоже отличаются.
Если
взять 1 моль кислорода, 1 моль углекислого газа, 1 моль водорода, то при
одинаковых нормальных условиях они будут занимать одинаковый объем,
равный 22,4 л. Эти газы также будут содержать и одинаковое число частиц,
т. е. 6,02 · 1023. Нормальными условиями или н.у. принято
считать температуру 0 0С (градусов по Цельсию) и давление 760 мм.
рт. ст. (миллиметров ртутного столба) или 101,3 кПа (килопаскаля).
е. 6,02 · 1023. Нормальными условиями или н.у. принято
считать температуру 0 0С (градусов по Цельсию) и давление 760 мм.
рт. ст. (миллиметров ртутного столба) или 101,3 кПа (килопаскаля).
Следовательно, молярный объём – это объём газа количеством 1 моль. Обозначается молярный объём, как и любой другой объем, но с символом Vm.
Кроме того, молярный объём – это физическая величина, равная отношению объёма вещества к количеству вещества. Это можно записать в виде формулы:
Vm=
V – это объём газа, n – это количество вещества.
Из этого выражения можно найти и V.
V= n · Vm
Единицей
измерения молярного объёма является л/моль, и т. к. это величина
постоянная при нормальных условиях, то молярный объём равен 22,4 л/моль.
к. это величина
постоянная при нормальных условиях, то молярный объём равен 22,4 л/моль.
Объём 1 кмоля называют киломолярным объёмом и измеряют в м3/кмоль, т.е. он равен 22,4 м3/кмоль, а объём 1 ммоля называют миллимолярным объёмом, измеряют его в мл/ммоль, т.е. миллимолярный объём равен 22, 4 мл/ммоль.
Используя новые формулы, решим задачи.
1. Найдите объём азота (N2) количеством 2 моль.
Найдем объем азота (N2)
количеством 2 моль. По условию нам дано количество вещества азота – 2 моль.
Найти необходимо его объем. Для решения задачи используем формулу нахождения
объема газа через количество вещества, т.е. нужно молярный объем умножить на
количество вещества. Подставляем значения в формулу, т.е. 22,4 литра на моль
умножаем на 2 моль, в результате получаем 44,8 литра. Следовательно, 2 моль
азота занимает объем 44,8 л.
Следовательно, 2 моль
азота занимает объем 44,8 л.
2. Найдите количество вещества озона (O3) объёмом 67,2 л.
По условию задачи нам дан объем озона – 67,2 литра, найти нужно количество вещества озона. Для решения задачи используем формулу: объем, разделенный на молярный объем, подставим значения в формулу, т.е. 67,2 литра делим на 22,4 литра на моль, получаем результат – 3 моль. Поэтому 3 моль озона занимают объем 67,2 л.
Что означают% об. / Об.,% Мас. / Мас. И% мас. / Об.?
Покупая химические продукты в Интернете, вы заметите, что их концентрации обозначены как v / v, w / w или w / v. Это общие выражения, так что же они означают , а именно ?
% об. / Об. Объемная концентрация раствора выражается в% об. / Об., Что означает объем на объем. Это используется, когда оба химиката в растворе жидкие.
Это используется, когда оба химиката в растворе жидкие.
Например, если 50 мл серной кислоты разбавить 50 мл воды, в общем объеме 100 мл будет 50 мл серной кислоты.Следовательно, мы бы выразили концентрацию этого раствора как 50% серной кислоты по объему.
% по массеМассовая концентрация раствора выражается в% мас. / Мас. Как и раньше, это означает вес на вес. В этом случае объем каждого химического вещества не учитывается и используется только вес.
Итак, если общая масса 100 г раствора состоит из 30 г соляной кислоты в 70 г воды, то мы бы выразили это как соляная кислота 30% по весу.
% мас. / Об.Массовая концентрация раствора выражается в% мас. / Об. Для массы на объем.В качестве альтернативы это может быть сокращено до m / v для обозначения массы на объем. Это используется, когда твердое химическое вещество растворяется в жидкости.
Если 1 г йодида калия используется для получения общего объема 100 мл, то получается 1% -ный раствор йодида калия.
Каждый процентный тип можно рассчитать, внеся небольшие изменения в тот же метод. Например, чтобы найти% мас. / Об. Раствора, необходимо вычислить:
(Масса растворенного вещества (г) / Объем раствора (мл)) x 100
Следовательно, чтобы вычислить% мас. / Об. 100 мл раствора, состоящего из 65 г азотной кислоты, мы разделим 65 г на 100 мл, а затем умножим ответ на 100.Это говорит нам о том, что существует раствор азотной кислоты с концентрацией 65% мас. / Об.
При расчете% об. / Об. Раствора используется тот же метод, за исключением того, что объем растворенного вещества (мл) делится на объем раствора (мл). Например, раствор на 1000 мл, содержащий 450 мл метанола, имеет концентрацию метанола 45% об. / Об. (450/1000 x 100).
Опять же, метод расчета% по весу использует те же шаги, вместо этого вес делится на вес.
Важно точно понимать, что вы покупаете. Вот почему в ReAgent есть опытная и преданная своему делу команда, с которой вы можете поговорить по любому вопросу о продукте, который у вас может возникнуть. Свяжитесь с нами сегодня, чтобы узнать, чем мы можем помочь.
Вот почему в ReAgent есть опытная и преданная своему делу команда, с которой вы можете поговорить по любому вопросу о продукте, который у вас может возникнуть. Свяжитесь с нами сегодня, чтобы узнать, чем мы можем помочь.
ванадий | химический элемент | Britannica
ванадий (V) , химический элемент, серебристо-белый мягкий металл группы 5 (Vb) периодической таблицы. Он легирован сталью и чугуном для получения быстрорежущей инструментальной стали, высокопрочной низколегированной стали и износостойкого чугуна.
Ванадий был открыт (1801 г.) испанским минералогом Андресом Мануэлем дель Рио, который назвал его эритронием, но в конце концов пришел к выводу, что это просто нечистый хром.Этот элемент был заново открыт (1830 г.) шведским химиком Нильсом Габриэлем Сефстремом, который назвал его в честь Ванадис, скандинавской богини красоты и молодости, название было подсказано красивыми цветами соединений ванадия в растворе. Английский химик Генри Энфилд Роско впервые выделил металл в 1867 году восстановлением водородом дихлорида ванадия, VCl 2 , а американские химики Джон Уэсли Марден и Малкольм Н. Рич получили его чистотой 99,7% в 1925 году восстановлением пятиокиси ванадия V. 2 O 5 , с металлическим кальцием.
Рич получили его чистотой 99,7% в 1925 году восстановлением пятиокиси ванадия V. 2 O 5 , с металлическим кальцием.
Британская викторина
118 Названия и символы из таблицы Менделеева
Периодическая таблица Менделеева состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
Ванадий, содержащийся в различных минералах, угле и нефти, является 22-м наиболее распространенным элементом в земной коре. Некоторыми коммерческими источниками являются минералы карнотит, ванадинит и роскоелит. (Залежи важного ванадийсодержащего минерала патронита, встречающегося в угле в Мина Рагра, Перу, существенно истощены. ) Другими коммерческими источниками являются ванадийсодержащий магнетит и дымовая пыль из дымовых труб и котлов судов, сжигающих некоторые венесуэльские и мексиканские масла.Китай, Южная Африка и Россия были ведущими производителями ванадия в начале 21 века.
) Другими коммерческими источниками являются ванадийсодержащий магнетит и дымовая пыль из дымовых труб и котлов судов, сжигающих некоторые венесуэльские и мексиканские масла.Китай, Южная Африка и Россия были ведущими производителями ванадия в начале 21 века.
Ванадий получают из руд в виде пятиокиси ванадия (V 2 O 5 ) посредством различных процессов плавки, выщелачивания и обжига. Затем пятиокись восстанавливается до порошка феррованадия или ванадия. Получение очень чистого ванадия затруднено, потому что этот металл довольно реактивен по отношению к кислороду, азоту и углероду при повышенных температурах.
Ванадий металлический, лист, полоса, фольга, пруток, проволока и трубки нашли применение в высокотемпературных условиях эксплуатации, в химической промышленности и для склеивания других металлов.Поскольку основное коммерческое использование ванадия находится в стали и чугуне, которым он придает пластичность и ударопрочность, большая часть произведенного ванадия используется вместе с железом в качестве феррованадия (около 85 процентов ванадия) при производстве ванадиевой стали. Ванадий (добавленный в количестве от 0,1 до 5,0%) оказывает на сталь два эффекта: он измельчает зерно стальной матрицы и с присутствующим углеродом образует карбиды. Таким образом, ванадиевая сталь отличается особой прочностью и твердостью с повышенной устойчивостью к ударам.Когда требуется очень чистый металл, его можно получить способами, аналогичными процессам для титана. Очень чистый металлический ванадий похож на титан тем, что он довольно устойчив к коррозии, твердый и имеет стально-серый цвет.
Ванадий (добавленный в количестве от 0,1 до 5,0%) оказывает на сталь два эффекта: он измельчает зерно стальной матрицы и с присутствующим углеродом образует карбиды. Таким образом, ванадиевая сталь отличается особой прочностью и твердостью с повышенной устойчивостью к ударам.Когда требуется очень чистый металл, его можно получить способами, аналогичными процессам для титана. Очень чистый металлический ванадий похож на титан тем, что он довольно устойчив к коррозии, твердый и имеет стально-серый цвет.
Соединения ванадия (пентоксид и некоторые ванадаты) используются в качестве катализаторов в контактном процессе производства серной кислоты; в качестве катализаторов окисления при синтезе фталевых и малеиновых ангидридов; при производстве полиамидов, таких как нейлон; и при окислении таких органических веществ, как этанол до ацетальдегида, сахара до щавелевой кислоты и антрацена до антрахинона.
Природный ванадий состоит из двух изотопов: стабильного ванадия-51 (99,76 процента) и слаборадиоактивного ванадия-50 (0,24 процента). Произведено девять искусственных радиоактивных изотопов. Ванадий растворяется в концентрированной серной кислоте, азотной кислоте, плавиковой кислоте и царской водке. В массивном состоянии он не подвергается воздействию воздуха, воды, щелочей или неокисляющих кислот, кроме плавиковой кислоты. На воздухе он не тускнеет, но при нагревании соединяется почти со всеми неметаллами.Для ванадия важными степенями окисления являются +2, +3, +4 и +5. Оксиды, соответствующие четырем степеням окисления: VO, V 2 O 3 , VO 2 и V 2 O 5 . Водородно-кислородные соединения ванадия в двух нижних степенях окисления являются основными; в двух высших, амфотерных (как кислотных, так и основных). В водном растворе ионы имеют разные цвета в зависимости от степени окисления — бледно-лиловый в состоянии +2, зеленый в состоянии +3, синий в состоянии +4 и желтый в состоянии +5.
Произведено девять искусственных радиоактивных изотопов. Ванадий растворяется в концентрированной серной кислоте, азотной кислоте, плавиковой кислоте и царской водке. В массивном состоянии он не подвергается воздействию воздуха, воды, щелочей или неокисляющих кислот, кроме плавиковой кислоты. На воздухе он не тускнеет, но при нагревании соединяется почти со всеми неметаллами.Для ванадия важными степенями окисления являются +2, +3, +4 и +5. Оксиды, соответствующие четырем степеням окисления: VO, V 2 O 3 , VO 2 и V 2 O 5 . Водородно-кислородные соединения ванадия в двух нижних степенях окисления являются основными; в двух высших, амфотерных (как кислотных, так и основных). В водном растворе ионы имеют разные цвета в зависимости от степени окисления — бледно-лиловый в состоянии +2, зеленый в состоянии +3, синий в состоянии +4 и желтый в состоянии +5.
| атомный номер | 23 |
|---|---|
| атомный вес | 50.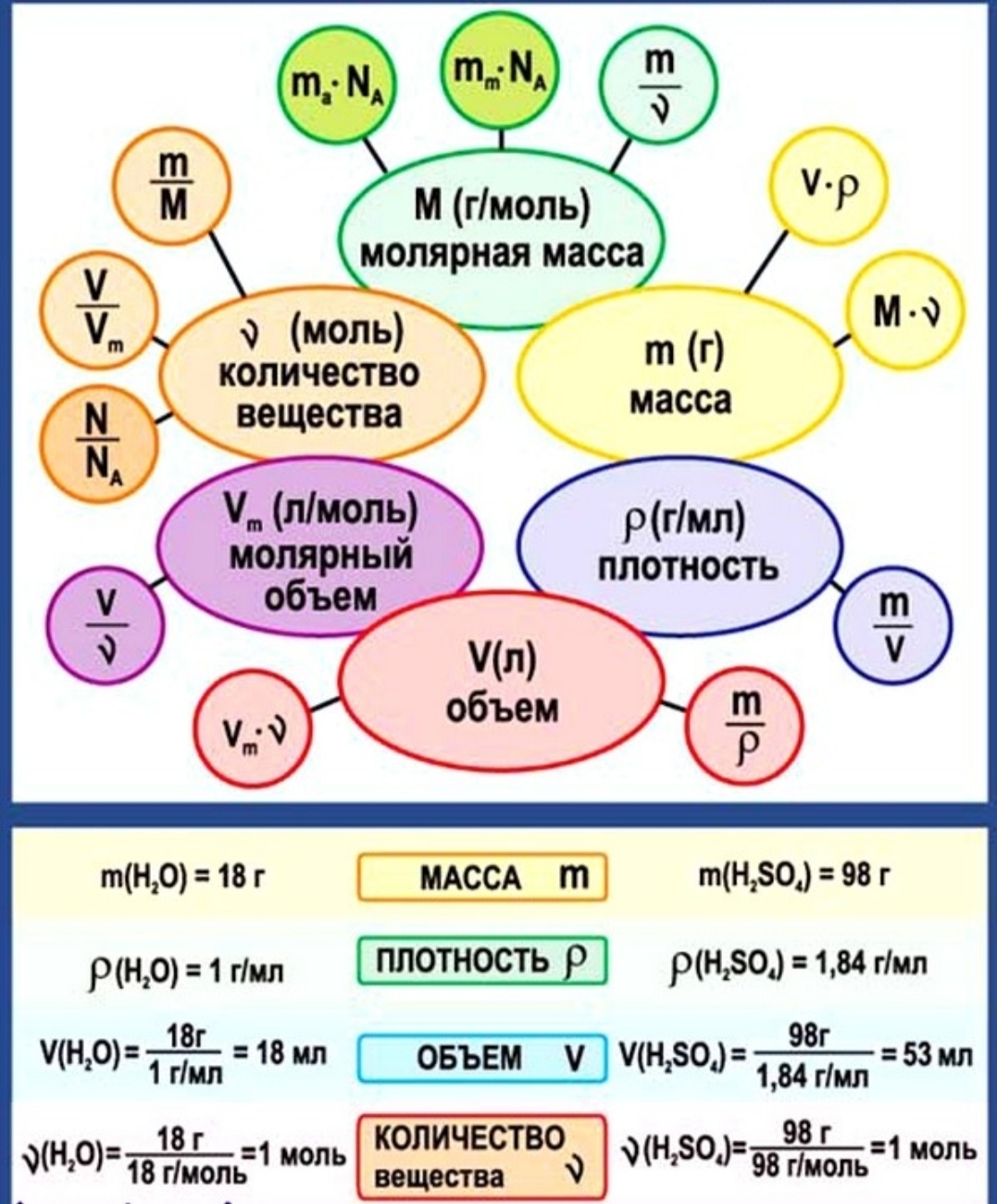 942 942 |
| точка плавления | 1890 ° C (3434 ° F) |
| удельный вес | 5,96 при 20 ° C (68 ° F) |
| степени окисления | +2, +3, +4, +5 |
| электронная конфигурация | [Ar] 3 d 3 4 s 2 |
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
|
Химическое изменение по сравнению с физическим изменением
Разница между физической реакцией и химической реакцией составляет состав . В химической реакции происходит изменение состава рассматриваемых веществ; при физическом изменении есть различие во внешнем виде, запахе или простом отображении образца вещества без изменения его состава. Хотя мы называем их физическими «реакциями», на самом деле никакой реакции не происходит.Чтобы реакция произошла, должно произойти изменение элементного состава рассматриваемого вещества. Таким образом, с этого момента мы будем просто называть физические «реакции» физическими изменениями.
Введение
Физические изменения ограничиваются изменениями, которые приводят к различию в отображении без изменения композиции. Некоторые общие изменения (но не ограничиваются ими):
- Текстура
- Цвет
- Температура
- Форма
- Изменение состояния (точка кипения и точка плавления являются важными факторами в определении этого изменения.
 )
)
Физические свойства включают многие другие аспекты вещества. Ниже приведены (но не ограничиваются ими) физические свойства.
- Глянец
- Ковкость
- Способность вытягиваться тонкой проволокой
- Плотность
- Вязкость
- Растворимость
- Масса
- Том
Любое изменение этих физических свойств называется физическим изменением. Для получения дополнительной информации обратитесь к разделу «Свойства вещества».
С другой стороны, химические изменения совершенно разные. Химическое изменение происходит при изменении состава вещества. Когда связи разрываются и образуются новые, происходит химическое изменение. Следующие индикаторы химических изменений:
- Изменение температуры
- Изменение цвета
- Заметный запах (после начала реакции)
- Образование осадка
- Образование пузырей
Примечание: при смешивании двух или более реагентов и изменении температуры, цвета и т. Д.замечено, вероятно, происходит химическая реакция. Это не определенные индикаторы; химическая реакция может происходить , а не . Изменение цвета не всегда является химическим изменением. Если бы кто-то изменил цвет вещества в сценарии нехимической реакции, такой как покраска автомобиля, изменение было бы физическим, а не химическим. Это потому, что состав машины не изменился. Действовать с осторожностью.
Д.замечено, вероятно, происходит химическая реакция. Это не определенные индикаторы; химическая реакция может происходить , а не . Изменение цвета не всегда является химическим изменением. Если бы кто-то изменил цвет вещества в сценарии нехимической реакции, такой как покраска автомобиля, изменение было бы физическим, а не химическим. Это потому, что состав машины не изменился. Действовать с осторожностью.
Общие физические изменения
Текстура
Текстура вещества может отличаться в зависимости от физических изменений.Например, если кусок дерева отшлифовать, отполировать и отполировать, он будет иметь совершенно другую текстуру, чем изначально был грубый кусок дерева.
(слева) Грубый дощатый настил, Квебек, Канада (справа) Готовый пол из рябины. (CC BY-SA 4.0; WikiPedant и CC BY-SA 2.5; MarkAnthonyBoyle соответственно).
Как видите, текстура готовой древесины намного более гладкая, чем у исходной зернистой древесины.
Цвет
Изменение цвета вещества не обязательно является показателем химического изменения.Например, изменение цвета металла не меняет его физических свойств. Однако в химической реакции изменение цвета обычно является индикатором того, что реакция происходит. Покраска металлического автомобиля не приводит к изменению состава металлического вещества .
Роботизированная рука для нанесения краски на детали автомобилей. Использование изображения с разрешения (CC BY-SA 4.0l RoboGuru).
Температура
Хотя мы не можем видеть изменение температуры , если только не происходит изменение состояния, это физическое изменение.
Горячие металлоконструкции. (CC BY-SA-NC 2.0; flagstaffotos.com.au)
Невозможно увидеть, как сковорода физически меняет форму, цвет, текстуру или какие-либо другие физические свойства. Однако, если прикоснуться к сковороде, она станет невероятно горячей и может вызвать ожог. Если бездействовать в шкафу, то эта сковорода будет холодной. Невозможно оценить это изменение только с помощью визуального воздействия; необходимо использование термометра или другого инструмента.
Если бездействовать в шкафу, то эта сковорода будет холодной. Невозможно оценить это изменение только с помощью визуального воздействия; необходимо использование термометра или другого инструмента.
Форма
Форма объекта может быть изменена, и объект останется верным своему химическому составу.Например, если скинуть деньги, как показано на рисунке ниже, химический состав денег останется прежним.
Деньги оригами
Изменение состояния
Изменение состояния также является физическим изменением. В этом сценарии можно наблюдать изменение ряда физических свойств, таких как вязкость и форма. Когда лед превращается в воду, он не сохраняет твердую форму и становится вязкой жидкостью. Физическая «реакция» превращения льда в жидкую воду:
\ [H_2O _ {(s)} \ rightarrow H_2O _ {(l)} \]
Рис.: Таяние льда.используется с разрешения ВикипедииСледующие изменения состояния:
| Твердое → Жидкое | Плавка |
| Жидкость → Газ | Испарение |
| Жидкость → Твердое тело | Замораживание |
| Газ → Жидкость | Конденсация |
| твердое тело → газ | Сублимация |
- Если к веществу добавляется тепло, например, при плавлении, испарении или сублимации, процесс будет эндотермическим .
 В этом случае тепло увеличивает скорость молекул, заставляя их двигаться быстрее.
В этом случае тепло увеличивает скорость молекул, заставляя их двигаться быстрее. - Если от вещества отводится тепло, например, при замораживании или конденсации, то процесс экзотермический . В этом случае тепло снижает скорость молекул, заставляя их двигаться медленнее.
Физические свойства
Люстра
Блеск элемента определяется как его реакция на свет. Глянец — это качество металла.Почти все металлы, переходные металлы и металлоиды блестящие. Неметаллы и газы не блестят. Например, кислород и бром не блестят. Ниже показаны блестящие канцелярские скрепки.
Блестящие скрепки
Ковкость
Ковкость — тоже качество металлов. Считается, что металлы пластичны. Это означает, что металлы могут деформироваться под действием определенного напряжения. Например, если вы можете ударить по металлу молотком, и он деформируется, он станет ковким. Также скрепке можно придать форму голыми руками.
Также скрепке можно придать форму голыми руками.
Скрепка изогнутая
На изображении показана пластичность определенного металла при приложении к нему напряжения.
Способность вытягиваться тонкой проволокой
В материаловедении это свойство называется пластичностью . Например, можно получить необработанную медь, очистить ее и обернуть шнуром. Повторюсь, это свойство характерно в основном для металлов, неметаллы этим качеством не обладают.
Медный провод
Плотность
Плотность объекта — это его масса, деленная на его объем (d = m / v). Вещество будет иметь более высокую плотность, если оно имеет большую массу в фиксированном объеме. Например, возьмем металлический шар размером примерно с бейсбольный мяч, спрессованный из сырого металла. Сравните это с бейсбольным мячом из бумаги. Бейсбольный мяч из металла имеет гораздо больший вес при том же объеме.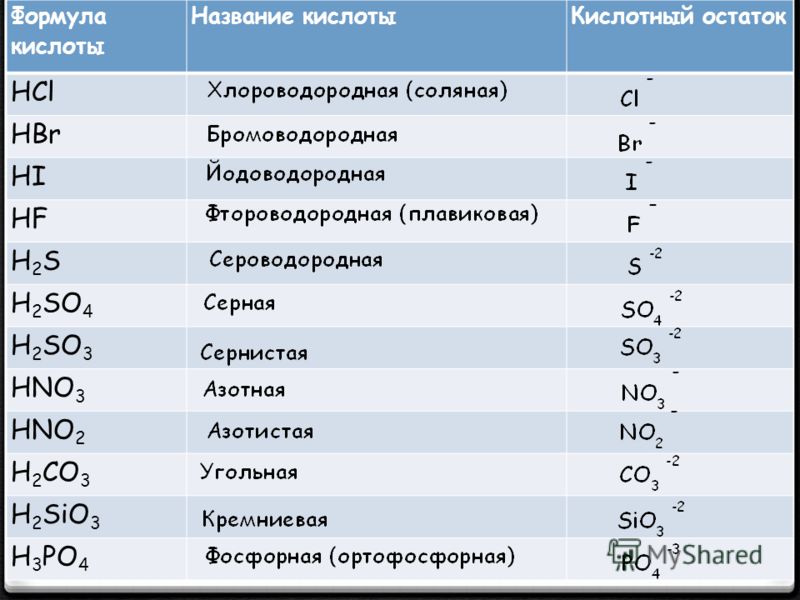 Поэтому металлический бейсбольный мяч имеет гораздо более высокую плотность.Плотность объекта также будет определять, будет ли он тонуть или плавать в определенном химическом веществе. Например, вода имеет плотность 1 г / см 3 . Любое вещество с плотностью ниже указанной будет плавать, а любое вещество с плотностью выше — тонуть.
Поэтому металлический бейсбольный мяч имеет гораздо более высокую плотность.Плотность объекта также будет определять, будет ли он тонуть или плавать в определенном химическом веществе. Например, вода имеет плотность 1 г / см 3 . Любое вещество с плотностью ниже указанной будет плавать, а любое вещество с плотностью выше — тонуть.
Погружение масла в стакан с водой
Вязкость
Вязкость определяется как сопротивление деформации определенного химического вещества при приложении к нему силы.В приведенном ниже примере два кубика падают в две разные пробирки. Верхнее вещество демонстрирует бурную реакцию на падение куба. Низшее вещество просто медленно поглощает его без особой реакции. Верхнее вещество имеет более низкую вязкость по сравнению с нижним веществом, которое имеет очень высокую вязкость. Можно даже думать о вязкости с точки зрения толщины. Вещество с большей толщиной имеет более высокую вязкость, чем вещество, которое считается «тонким». Вода имеет более низкую вязкость, чем мед или магма, которые имеют относительно высокую вязкость.
Вода имеет более низкую вязкость, чем мед или магма, которые имеют относительно высокую вязкость.
Вязкость жидкостей
Рисунок 1.6.21.6.2: Демонстрация вязкости . Жидкость слева имеет более низкую вязкость, чем жидкость справа. (CC SA-BY 4.0; Synapticrelay).Общие химические изменения
Ниже приведены все индикаторы химических реакций. Дополнительную информацию о химических реакциях см. В разделе «Химические реакции».
Изменение температуры
Изменение температуры характеризует химическое изменение.Во время эксперимента можно было окунуть термометр в химический стакан или колбу Эрленмейера, чтобы проверить изменение температуры. Если температура повышается, как это происходит в большинстве реакций, вероятно, происходят химические изменения. Это отличается от физического изменения температуры. Во время физического изменения температуры нагревается одно вещество, например вода. Однако в этом случае одно соединение смешивается с другим, и эти реагенты производят продукт. Когда реагенты смешиваются, изменение температуры, вызванное реакцией, является индикатором химического изменения.
Когда реагенты смешиваются, изменение температуры, вызванное реакцией, является индикатором химического изменения.
В качестве примера экзотермической реакции, если \ (Fe_2O_3 \) смешан с Al и воспламеняется (часто с горящим Mg), то начинается термитная реакция.
\ [Fe_2O_3 + 2Al \ rightarrow 2Fe + Al_2O_3 + \ text {Heat} \]
Эта реакция выделяет тепло как продукт и является (очень) экзотермической.
Однако физические изменения могут быть экзотермическими или эндотермическими. Эндотермическое таяние кубика льда — это изменение физических свойств, а не состава.Таким образом, это физическое изменение.
Изменение цвета
Изменение цвета также является еще одной характеристикой протекающей химической реакции. Например, если бы кто-то наблюдал за ржавчиной металла с течением времени, можно было бы понять, что металл изменил цвет и стал оранжевым. Это изменение цвета свидетельствует о химической реакции. Однако нужно быть осторожным; иногда изменение цвета — это просто смешение двух цветов, но без реального изменения состава рассматриваемых веществ.
Однако нужно быть осторожным; иногда изменение цвета — это просто смешение двух цветов, но без реального изменения состава рассматриваемых веществ.
Металлическая ржавчина
Вышеупомянутая реакция — это реакция ржавления железа.
\ [4Fe + 3O_2 + 6H_2O \ rightarrow 4Fe (OH) _3 \]
Заметный запах
Когда два или более соединения или элемента смешиваются и присутствует запах или запах , произошла химическая реакция. Например, когда начинает пахнуть яйцо (тухлое яйцо), происходит химическая реакция. Это результат химического разложения.
Испорченное яйцо
Образование осадка
Образование осадка может быть одним из наиболее распространенных признаков протекающей химической реакции. Осадок определяется как твердое вещество, которое образуется внутри раствора или другого твердого вещества. Осадки не следует путать с суспензиями, которые представляют собой растворы, представляющие собой однородные жидкости с плавающими в них частицами. Например, когда растворимый карбонат реагирует с барием, может наблюдаться осадок карбоната бария.{2 -} _ {3 \; (aq)} \ rightarrow BaCO) {3 \; (s)} \]
Например, когда растворимый карбонат реагирует с барием, может наблюдаться осадок карбоната бария.{2 -} _ {3 \; (aq)} \ rightarrow BaCO) {3 \; (s)} \]
Дополнительную информацию см. В Классификации материалов.
Образование пузырей
Образование пузырьков , или, скорее, газа , является еще одним индикатором протекающей химической реакции. Когда образуются пузырьки, может происходить изменение температуры. Изменение температуры и образование пузырьков часто происходят одновременно. Например, на следующем изображении видно извергание газа.Это образование газа.
Газообразование
Однако большинство реакций гораздо более тонкие. Например, если происходит следующая реакция, можно заметить образование пузырьков углекислого газа. Если соляной кислоты достаточно, видны пузырьки. Если нет, изменение не сразу заметить:
\ [Na_2CO_3 + 2HCl \ стрелка вправо 2NaCl + H_2O + CO_2 \]
Список литературы
- Чанг, Раймонд.
 Общая химия: основные понятия .Бостон, Массачусетс: Высшее образование Макгроу-Хилла, 2006. Печать.
Общая химия: основные понятия .Бостон, Массачусетс: Высшее образование Макгроу-Хилла, 2006. Печать. - Химия для чайников. Для чайников, 2008. Распечатать.
- Петруччи, Ральф Х. Общие принципы химии и современные приложения. Верхняя Сэдл Ривер, Нью-Джерси: Пирсон / Прентис Холл, 2007. Печать.
Внешние ссылки
Все изображения любезно предоставлены сайтом http://www.sxc.hu, который предоставляет бесплатные изображения, которые можно копировать без ограничений. Изображение вязкости также можно дублировать с разрешения автора в Википедии.com.
Проблемы
1. Что из перечисленного является химической реакцией?
- Замораживающая жидкость Ртуть
- Добавление желтого к синему для получения зеленого
- Разрезание листа бумаги на две части
- Бросить нарезанный апельсин в чан с гидроксидом натрия
- Наполнение воздушного шара естественным воздухом
2. Что из перечисленного является физической реакцией?
Что из перечисленного является физической реакцией?
- Разбивающееся стекло с бейсбольным мячом
- Корродирующий металл
- Взрыв фейерверка
- Зажигание спички
- Выпечка торта
3.Что из перечисленного является химической реакцией?
- Покраска стены синяя
- Велосипед ржавый
- Таяние мороженого
- Царапина ключом по столу
- Создание замка из песка
4. Что из перечисленного является физической реакцией?
- Жарка яйца
- Переваривание моркови
- Macbook, выпадающий из окна
- Создание АТФ в организме человека
- Шипучая таблетка опускается в стакан с водой
5.Напишите C для химической реакции или P для физической реакции.
- Горящие листья
- Огранка бриллиантов
- Раздавливание карандаша
- Фермент амилаза слюны, расщепляющий пищу во рту
- Смешивание соли с водой
ответы
1. D
D
2. А
3. В
4. C
5. а) С
б) П
в)
п.г) С
д) Ни то, ни другое.Это одна из серых областей химических и физических изменений. Хотя соль диссоциировала на ионы натрия и хлорида, она все еще остается солью в воде. Соль изначально на самом деле представляет собой просто конгломерат ионов натрия и хлорида, и в результате их диссоциации изменилось просто расположение ионов. Щелкните здесь, чтобы получить дополнительную информацию.
Авторы и авторство
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Грегори В. Хартланд // Люди // Кафедра химии и биохимии // University of Notre Dame
Биография
- 2004-настоящее время
- Профессор Университета Нотр-Дам
- 2020-настоящее время
- Директор по последипломным исследованиям, Университет Нотр-Дам
- 2013-2015
- Заместитель директора Центра устойчивой энергетики в Нотр-Даме
- 2000-2004
- Доцент, Университет Нотр-Дам,
- 1994-2000
- Доцент, Университет Нотр-Дам
- 1991–1994
- Постдокторант, Пенсильванский университет
- 1991
- Ph.
 Доктор химических наук, Калифорнийский университет, Лос-Анджелес, .
Доктор химических наук, Калифорнийский университет, Лос-Анджелес, . - 1985
- B.Sc. Магистр химии, Мельбурнский университет, Австралия,
Избранные награды
- 2021
- Премия ACS в области экспериментальной физической химии
- 2014
- Член Королевского химического общества
- 2011
- Член Американского химического общества (ACS)
- 2009
- Член Американской ассоциации развития науки
- 2004
- Премия Канеба за преподавание, Университет Нотр-Дам,
Область научных интересов
Исследования в группе Hartland сосредоточены на использовании оптики для изучения свойств наноматериалов и того, как эти материалы взаимодействуют с окружающей средой.Почти все проекты в группе включают исследования отдельных частиц, и разработка новых методов для проведения экспериментов по спектроскопии с временным разрешением и в установившемся режиме над отдельными частицами является важным компонентом исследования.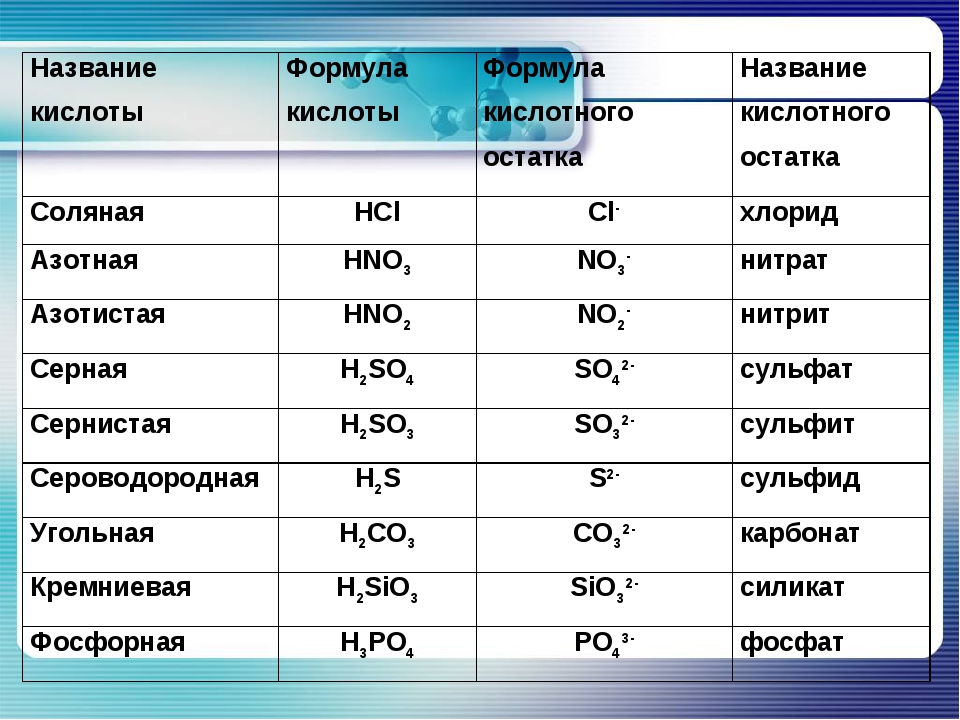 Примерами процессов, которые изучаются, являются распространение поверхностных плазмон-поляритонов в металлических наноструктурах, захват и диффузия носителей заряда в полупроводниковых нанопроводах, химические реакции в наноматериалах и эффекты вязкости на наноуровне.
Примерами процессов, которые изучаются, являются распространение поверхностных плазмон-поляритонов в металлических наноструктурах, захват и диффузия носителей заряда в полупроводниковых нанопроводах, химические реакции в наноматериалах и эффекты вязкости на наноуровне.
Последние публикации
- Ю., К., Янг, Ю., Ван, Дж., Хартленд, Г. В., Ван, Г. П. «Взаимодействие наночастиц и жидкости при сверхвысоких частотах акустических колебаний, изученное с помощью фемтосекундной микроскопии с временным разрешением» 2021 ACS Nano , 15 ( 1), с. 1833-1840. DOI: 10.1021 / acsnano.0c09840.
- Павловец, И.М., Подшивайлов, Е.А., Чаттерджи, Р., Хартленд, Г.В., Французов, П.А., Куно, М. «Инфракрасная фототермическая гетеродинная визуализация: механизм контраста и пределы обнаружения» 2020 Journal of Applied Physics , 127 (16) , DOI: 10.1063 / 1,5142277.
- Aleshire, K., Pavlovetc, IM, Collette, R., Kong, X.-., Rack, PD, Zhang, S.
 , Masiello, DJ, Camden, JP, Hartland, GV, Kuno, M. «Far- полевая визуализация сверхвысокого разрешения в среднем инфракрасном диапазоне и спектроскопия одиночных золотых нанопроволок с высоким соотношением сторон «2020 Proceedings of the National Academy of Sciences of the United States of America , 117 (5), pp. 2288-2293. DOI: 10.1073 / pnas.1916433117.
, Masiello, DJ, Camden, JP, Hartland, GV, Kuno, M. «Far- полевая визуализация сверхвысокого разрешения в среднем инфракрасном диапазоне и спектроскопия одиночных золотых нанопроволок с высоким соотношением сторон «2020 Proceedings of the National Academy of Sciences of the United States of America , 117 (5), pp. 2288-2293. DOI: 10.1073 / pnas.1916433117. - Браун Б. С., Хартланд Г. В. «Демпфирование на границе раздела химических элементов для распространения поверхностных плазмонных поляритонов в золотых нанополосках» 2020 Журнал химической физики , 152 (2), 024707.DOI: 10.1063 / 1.5133958.
- Павловец, И.М., Алешир, К., Хартленд, Г.В., Куно, М. «Подходы к среднему инфракрасному свету, визуализация сверхвысокого разрешения и спектроскопия» 2020 Physical Chemistry Chemical Physics , 22 (8), стр. 4313-4325 . DOI: 10.1039 / c9cp05815j.
- Павловец, И. М .; Подшивайлов, Э. А .; Французов, П. А .; Hartland, G. V .; Куно, М. «Количественная инфракрасная фототермическая микроскопия» 2020 Прогресс в биомедицинской оптике и визуализации — Труды SPIE , 11246, 1124613.
 DOI: 10.1117 / 12.2545159.
DOI: 10.1117 / 12.2545159.
Галерея
Майкл В. Ли, доктор философии | Химия и биохимия
Майкл В. Ли
Доцент кафедры аналитической химии Телефон: 928-523-7072
Эл. Почта: [email protected]
Офис: Корпус 36, Кабинет 341
Академическое образование
BS ECE (Chem minor) 2003
Университет штата Юта
Кандидат аналитической химии 2007
Университет Бригама Янга
Публикации
Щелкните здесь, чтобы увидеть наши публикации
Д-р Ли в Google Scholar
Инструментальная и аналитическая химия для солнечных элементов и органической электроники
Наше исследование сосредоточено на реакциях, которые происходят на интерфейсах, будь то внешняя поверхность или интерфейс, скрытый внутри материала или устройства.Мы сосредоточены на поиске подходящего инструмента для анализа проблемы, будь то внутри компании, в другом отделении НАУ, либо с привлечением внешних сотрудников или компаний.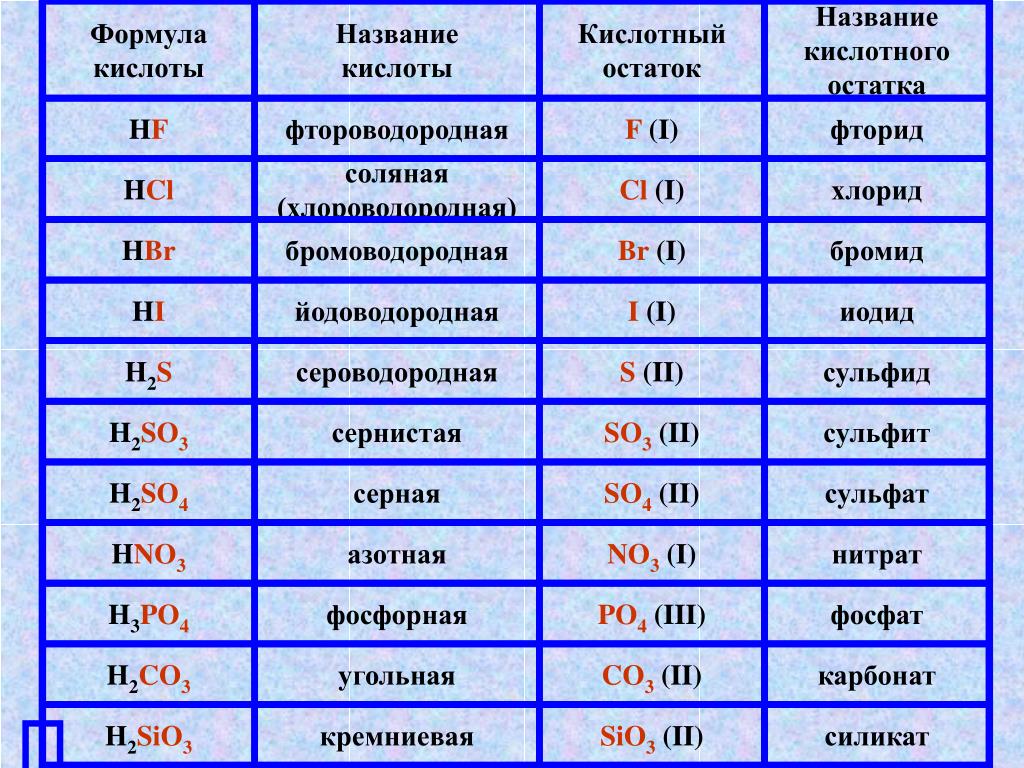 Некоторые примеры областей исследований, которые нас интересуют: органическая электроника, перовскит солнечных элементов, очистка воды и дизайн приборов.
Некоторые примеры областей исследований, которые нас интересуют: органическая электроника, перовскит солнечных элементов, очистка воды и дизайн приборов.
Наша лаборатория расположена на 3 -м этаже в новом здании науки и здравоохранения на северной стороне кампуса НАУ в Флагстаффе, штат Аризона.
Наша группа состоит из 4-12 студентов и до 2 студентов магистратуры.Студенты бакалавриата проводят в лаборатории от 3 до 15 часов в неделю в зависимости от своего графика. Обычно над проектом работают 2-5 студентов. Состав меняется от года к году.
Заинтересованным студентам предлагается написать д-ру Ли по электронной почте и договориться о времени для обсуждения интересов и возможностей. Студенты, которые могут посвятить себя более 1 году, извлекут наибольшую пользу из этого опыта. Будь то здесь или в другой лаборатории, примите участие в исследованиях в самом начале обучения.
Текущие и бывшие студенты
Рамон Мендоса
Патрисия Де Перальта
Роман Родригес
Чаз Шобер
Николас Роуленд
Кайлин Эспарса,
Александр Мюллер
Карен Уинтерс
Коннор Хилл Кралик
Бенджамин Кунцлер
Дженнара Сеффенан
Дэвид Сефферэн Зайя
Дэвид Нейла Анайя
Кэмерон Нил
Виктория Винсент


 Д.
Д.






 Д. ) переменная или непостоянная
Д. ) переменная или непостоянная
 )
) В этом случае тепло увеличивает скорость молекул, заставляя их двигаться быстрее.
В этом случае тепло увеличивает скорость молекул, заставляя их двигаться быстрее. Общая химия: основные понятия .Бостон, Массачусетс: Высшее образование Макгроу-Хилла, 2006. Печать.
Общая химия: основные понятия .Бостон, Массачусетс: Высшее образование Макгроу-Хилла, 2006. Печать. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie. Доктор химических наук, Калифорнийский университет, Лос-Анджелес,
Доктор химических наук, Калифорнийский университет, Лос-Анджелес, , Masiello, DJ, Camden, JP, Hartland, GV, Kuno, M. «Far- полевая визуализация сверхвысокого разрешения в среднем инфракрасном диапазоне и спектроскопия одиночных золотых нанопроволок с высоким соотношением сторон «2020 Proceedings of the National Academy of Sciences of the United States of America , 117 (5), pp. 2288-2293. DOI: 10.1073 / pnas.1916433117.
, Masiello, DJ, Camden, JP, Hartland, GV, Kuno, M. «Far- полевая визуализация сверхвысокого разрешения в среднем инфракрасном диапазоне и спектроскопия одиночных золотых нанопроволок с высоким соотношением сторон «2020 Proceedings of the National Academy of Sciences of the United States of America , 117 (5), pp. 2288-2293. DOI: 10.1073 / pnas.1916433117. DOI: 10.1117 / 12.2545159.
DOI: 10.1117 / 12.2545159.