Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Как вы работаете?
Вам нужно написать сообщение в WhatsApp . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Whatsapp или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/FTtp-vAv3lI» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/7LD4euDcivY» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/ZfNUaigadEY» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
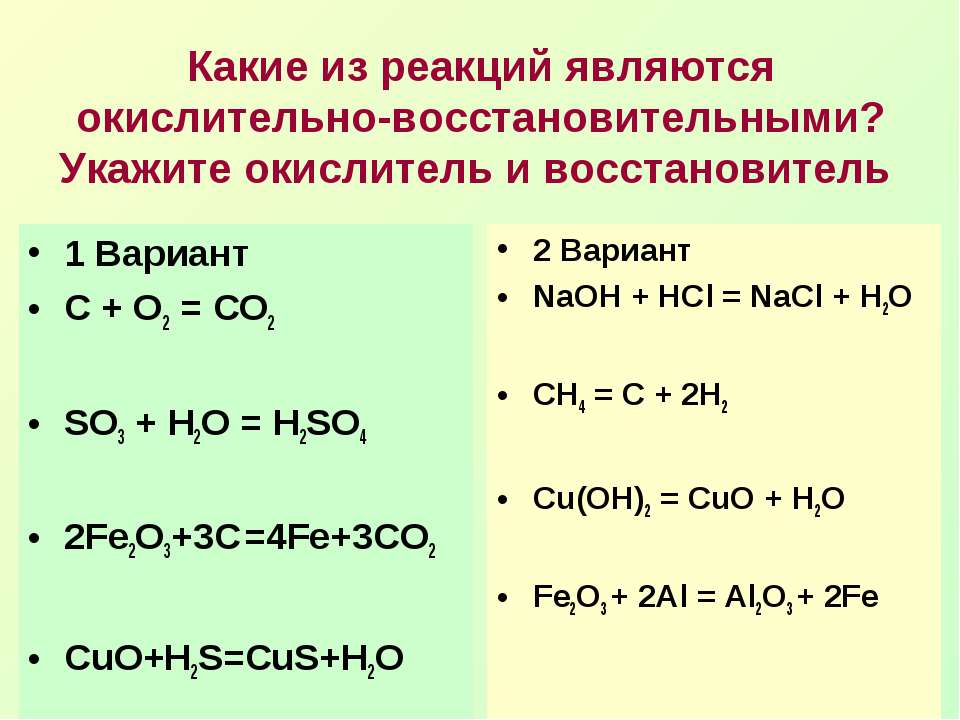
Тест 20. Окислительно-восстановительные реакции
Используя метод электронного баланса, расставьте коэффициенты в уравнениях реакций. Определите окислитель и восстановитель
1. HI + H
2SO4 → I2 + H2S + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
8HI + H2SO4 → 4I2 + H2S + 4H2O
3) Указать, что сера в степени окисления +6 является окислителем, а иод в степени окисления −1 — восстановителем.
2. H
2SO4 + Cu2O → CuSO4 + SO2 + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3H2SO4 + Cu2O → 2CuSO4 + SO2 + 3H2O
3) Указать окислитель и восстановитель:
H2SO4 (S+6) — окислитель
Cu2O (Cu+) — восстановитель
3. HNO
3 + FeO → Fe(NO3)3 + NO + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
10HNO3 + 3FeO → 3Fe(NO3)3 + NO + 5H2O
3) Указать окислитель и восстановитель:
HNO3 (N+5) — окислитель
FeO (Fe+2) — восстановитель
4.
 H2S + KClO3 → S + KCl + H2O
H2S + KClO3 → S + KCl + H2OПоказать решение »
Решение.
1) Составть электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
3H2S + KClO3 → 3S + KCl + 3H2O
3) Указать окислитель и восстановитель:
KClO3 (Cl+5) — окислитель
H2S (S-2) — восстановитель
5. KNO
3 + Al + KOH + H2O → NH3 + K[Al(OH)4]Показать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
3KNO3 + 8Al + 5KOH + 18H2O → 3NH3 + 8K[Al(OH)4]
3) Указать окислитель и восстановитель:
KNO3 (N+5) — окислитель
Al (Al0) — восстановитель
6. SO
2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4Показать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
5SO2 + 2KMnO4 + 2H2O → K2SO4 +2 MnSO4 + 2H2SO4
3) Указать окислитель и восстановитель:
KMnO4 (Mn+7) — окислитель
SO2 (S+4) — восстановитель
7. SO
2 + K2Cr2O7 + H2SO4 → K2SO4 +Cr2(SO4)3 +H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты, составить уравнение реакции:
3SO2 + K2Cr2O7 + H2SO4 → K2SO4 +Cr2(SO4)3 +H2O
3) Указать окислитель и восстановитель:
K2Cr2O7 (Сr+6) — окислитель
SO2 (S+4) — восстановитель
8.
 NaBr + H2SO4 → Br2 + SO2 +Na2SO4 +H2O
NaBr + H2SO4 → Br2 + SO2 +Na2SO4 +H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты, составить уравнение реакции:
2NaBr + 2H2SO4 → Br2 + SO2 + Na2SO4 + 2H2O
3) Указать окислитель и восстановитель:
H2SO4 (S+6) — окислитель
NaBr (Br-1) — восстановитель
9. KI + … + H
2SO4 → I2 + … + MnSO4 + H2OПоказать решение »
Решение.
1) Определить недостающие вещества и записать полное уравнение реакции:
10KI + 2KMnO4 + 8H2SO4 → 5I2 + 6K2SO4 + 2MnSO4 + 8H2O
2) Коэффициенты расставить с помощью метода электронного баланса:
3) Йод в степени окисления −1 является восстановителем, а марганец — окислителем.
10. Fe(OH)
2 + KClO + …→ … + Fe2(SO4)3 + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Определить недостающие вещества и расставить коэффициенты в уравнении реакции:
2Fe(OH)2 + KClO + 3H2SO4 → KCl + Fe2(SO4)3 + 5H2O
3) Железо в степени окисления +2 является восстановителем, а хлор в степени окисления +1 — окислителем.
11. P + HNO
3 + H2O → H3PO4 + NOПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO
3) Указать окислитель и восстановитьель
HNO3 (N+5) — окислитель
P0 — восстановитель
12.
 Si + NaOH + H2O → Na2SiO3 + H2
Si + NaOH + H2O → Na2SiO3 + H2Показать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
Si + 2NaOH + H2O → Na2SiO3 + 2H2
3) Указать окислитель и восстановитель
H+1 — окислитель
Si0 — восстановитель
13. H
2S + Cl2 + H2O → H2SO4 + HClПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
H2S + 4Cl2 + 4H2O → H2SO4 +8 HCl
3) Указать окислитель и восстановитель
S-2 — восстановитель
Cl0 — окислитель
14. S + HNO
2 → H2SO4 + NO + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
S + 6HNO2 → H2SO4 + 6NO + 2H2O
3) Указать окислитель и восстановитель
S0 — восстановитель
N+3 — окислитель
15. FeCl
3 + H2S → HCl + S + FeCl2Показать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
2FeCl3 + H2S → 2HCl + S + 2FeCl2
3) Указать, что S-2 — восстановитель, а Fe+3 — окислитель
16. Zn + HNO
3 → Zn(NO3)2 + NO + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO + 4H2O
3) Указать, что Zn0 — восстановитель, а N+5 — окислитель
17.
 Zn + H2SO4 (конц.) → ZnSO4 + H2S + H2O
Zn + H2SO4 (конц.) → ZnSO4 + H2S + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
4Zn + 5H2SO4 (конц.) → 4ZnSO4 + H2S + 4H2O
3) Указать, что Zn (Zn0) — восстановитель, а H2SO4 (S+6) — окислитель
18. Cu + HNO
3 (разб.) → Cu(NO3)2 + NO + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
3Cu + 8HNO3 (разб.) → 3Cu(NO3)2 + 2NO + 4H2O
3) Указать, что Сu0 — восстановитель, а N+5 — окислитель
19. Ca
3(PO4)2 + SiO2 + C → СaSiO3 + P + COПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
Ca3(PO4)2 + 3SiO2 + 5C → 3СaSiO3 + 2P + 5CO
3) Указать, что С0 — восстановитель, а P+5 — окислитель
20. HCl + CrO
3 → Cl2 + CrCl3 + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Расставить коэффициенты в уравнении реакции:
12HCl + 2CrO3 → 3Cl2 + 2CrCl3 + 6H2O
3) Указать, что Cr+6 — окислитель, а Cl-1 — восстановитель;
21. HCl + KClO
3 → Cl2 + KCl + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
6HCl + KClO3 → 3Cl2 + KCl + 3H2O
3) Указать окислитель и восстановитель:
окислитель — KClO3 (Cl+5) восстановитель — HCl (Cl-1)
22.
 KI + KIO3 + H2SO4 → I2 + K2SO4 + H2O
KI + KIO3 + H2SO4 → I2 + K2SO4 + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
10KI + 2KIO3 + 6H2SO4 → 6I2 + 6K2SO4 + 6H2O
или
5KI + KIO3 + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O
3) Указать окислитель и восстановитель:
окислитель — KIO3 (I+5) восстановитель — KI (I-1)
23. NO + KOH → KNO
2 + N2 + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Составить уравнение реакции:
6NO + 4KOH → 4KNO2 + N2 + 2H2O
3) Указать, что NO ( за счёт азота в степени окисления +2) является и восстановителем, и окислителем;
24.
 Ba(OH)2 + Cl2 → BaCl2 + Ba(ClO3)2 + H2O
Ba(OH)2 + Cl2 → BaCl2 + Ba(ClO3)2 + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Составить уравнение реакции:
6Ba(OH)2 + 6Cl2 → 5BaCl2 + Ba(ClO3)2 + 6H2O
3) Указать, что хлор в степени окисления 0 (Сl20) является и восстановителем, и окислителем
25. Ag + HClO
3 → AgCl + AgClO3 + H2OПоказать решение »
Решение.
1) Составить электронный баланс:
2) Определить коэффициенты и составить уравнение реакции:
6Ag + 6HClO3 → AgCl + 5AgClO3 + 3H2O
3) Указать окислитель и восстановитель:
окислитель — HClO3 (Cl+5)
восстановитель — Ag (Ag0)
Окислительно-восстановительные реакции — презентация онлайн
1.
 « Кто-то теряет, а кто-то находит.»
« Кто-то теряет, а кто-то находит.»2. Тема урока : «Окислительно-восстановительные реакции»
Ca0 +20 ) ) ) )Ca 2+
2 8 8 2
атом
S0 +16 ) ) )
S22 8 6
атом
Ca2+ +20 ) ) )
Ca0 — 2 e =>
2 8 8
ион
S2- +16 ) ) )
2 8 8
ион
Ca0 + S0 => Ca+2S-2
S0 + 2e =
Расставьте степени окисления элементов в реакциях.
Сравните, как ведут себя степени окисления в
процессе реакции.
+1 -1
+1 -2 +1
+1
-1
+1 -2
HCl + NaOH = NaCl + h3O
+1
-1
0
+2
-1
0
Окислительновосстановительная
2
реакция
2 HCl + Zn = ZnCl2 + H
Реакции, в которых происходит изменение степеней
окисления, называются
окислительно-восстановительными
2 H++1Cl-1 + Zn0 = Zn+2Cl2-1 + h3200
H+
Zn0
— 2 е-
окисление
+ 2 е-
восстановление
— окислитель
— восстановитель
Окисление – процесс отдачи электронов.
Восстановление – процесс присоединения
электронов.
Окислитель – элемент, принимающий
электроны.
Восстановитель – элемент, отдающий
электроны.
Отдает или принимает?
Изначально атом не
заряжен, т.к. число
протонов равно числу
электронов
—
—
—
+5
—
—
-2
-1
+1
+2
0
Э
—
-4
-3
-2
-1
0
+1
+2
+3
+4
+6
Отдает электроны (- е-)
Принимает электроны (+ е-)
Какая польза от теории ОВР?
Например, расстановка коэффициентов в
сложных уравнениях – метод электронного
баланса
+1 -1
+1
+7 -2
+2
-1
+1 -1
0
+1 -2
16 HCl +2 KMnO4 =2 MnCl2 +2 KCl +5 Cl2+ 8 h3O
Mn+7
2Cl-1
+5 e- 2 e-
Mn+2
Cl20
Mn+7 – окислитель
Сl -1 – восстановитель
2
Восст-ие
5
окисление
10
Расставьте коэффициенты
методом электронного баланса.
Al + MnO2 = Al2O3 + Mn
Fe2O3 + Zn = ZnO + Fe
10.
 Покажите электронные переходы в следующих схемах ОВР Назовите окислитель и восстановитель • Li0 + O20 => Li2O
Покажите электронные переходы в следующих схемах ОВР Назовите окислитель и восстановитель • Li0 + O20 => Li2O• C0 + O20 => CO2
• H02 + O20 => h3O
11. Из приведенных схем уравнений реакций выпишите те, которые можно отнести к ОВР
• СаСО3 => СаО + СО2• KMnO4 => K2 MnО4 + MnО2 + О2
• CuS + О2 => СuО + SО2
12. Расставьте коэффициенты методом электронного баланса в следующих схемах ОВР Определите окислитель, восстановитель
• 1)С-4Н4+1 + 2О20 => C+4О2-2 + 2h3+1О-2-8e
• С-4 C+4 — восстановитель -(окисляется )
+4e
• О20 2О-2 — окислитель -(восстанавливается )
4|1
8 |2
13. Домашнее задание:
Параграф 44 , упр 1 с.268.
Дидактическая разработка урока по теме «Окислительно-восстановительные реакции с углеводородами». 10–11-е классы
Тип урока: овладение новыми знаниями и приобретение новых умений.
Методы обучения: частично-поисковый, исследовательский, создание проблемной ситуации.
Формы организации учебной деятельности: групповая и индивидуальная работа.
Цель урока: ученики должны научиться предсказывать продукты окислительно-восстановительных реакций, в зависимости от условий их проведения, и расставлять коэффициенты в данных реакциях, используя ионно-электронный метод.
Задачи урока:
- Обучающие:
- закрепить следующие понятия: степень окисления, восстановитель, окислитель, процесс окисления, процесс восстановления, окислительно-восстановительные реакции, электронный баланс;
- развивать умения пользоваться опорными знаниями;
- закрепить умение определять степени окисления, окислитель и восстановитель, расставлять коэффициенты методом ионно-электронного баланса;
- закрепить умения и навыки работы с периодической системой химических элементов;
- закрепить умение составлять окислительно-восстановительные реакции и уравнивать их, используя разные методы;
- развивать познавательный интерес при выполнении теоретических и практических заданий;
- сформировать понимание зависимости продуктов окисления и восстановления органических и неорганических веществ в зависимости от среды раствора;
- сформировать понимание практического значения окислительно-восстановительных реакций в жизни человека.

- Мировоззренческие:
- подчеркнуть взаимосвязь строения веществ и особенностями их превращений, как пример проявления одного из признаков метода диалектического познания явлений.
- Развивающие:
- формировать умение и навыки самостоятельной работы с тестом, навыки выполнения практической работы, умение рационального распределения времени на выполнение заданий;
- развивать умение работать с инструкциями, работать в команде;
- переносить свои знания в новые ситуации;
- развивать умение уравнивать химические реакции разными способами и предсказывать продукты окислительно-восстановительных реакций;
- совершенствовать умение определять окислительно-восстановительные свойства веществ, прогнозировать продукты реакций в зависимости от реакции среды раствора.
- совершенствовать умение находить главное в новом материале и систематизировать полученные знания;
- выработать умение составлять уравнения химических реакций с органическими веществами, протекающих в различных средах.

- продолжить работу по формированию умений делать выводы, а также общие выводы из единичных явлений;
- продолжить подготовку к ЕГЭ по химии;
- формировать элементы творческого поиска на основе приема обобщения.
- Воспитательные:
- формировать навык самостоятельной работы;
- формировать умение аргументировано высказывать своё мнение и выслушивать одноклассников;
- создавать условия для развития коммуникативных навыков, воспитывать интерес к предмету
Ожидаемые результаты:
- учащиеся будут знать методику составления окислительно-восстановительных реакций с органическими веществами;
- на основе анализа и синтеза фактов будут самостоятельно уравнивать окислительно-восстановительные реакции, и формулировать зависимость образования продуктов реакции от среды раствора;
- будут использовать приобретенные знания и умения в практической деятельности.

Продолжительность: 2 часа.
Оборудование и реактивы урока:
- Периодическая система химических элементов Д.И. Менделеева.
- Папка с дидактическими материалами и инструкциями для проведения лабораторной работы.
- Дополнительная литература (пособия для подготовки к ЕГЭ), тетрадь.
- ПК с медиапроектором, экран.
- Правила ТБ.
- Лоток с реактивами: 4 пробирки с раствором перманганата калия, раствор серной кислоты, раствор гидроксида калия, вода, раствор сульфита натрия.
Структура урока
I. Организационный момент (2 мин.)
II. Актуализация опорных знаний и умений. Формулировка темы, целей и задач урока. Определение границы знания и незнания (15 мин.).
III. Работа над новым материалом (практическая деятельность учащихся) – (40 мин.).
IV. Проверка усвоения – (10 мин.).
V. Подведение итога урока и оценка знаний – (5 мин. ).
).
VI. Рефлексия (3-4 мин.).
VII. Инструктаж по домашнему заданию – (5 мин.).
VIII. Резервное время – (6-8 мин.)
ХОД УРОКА
I. Организационный момент (приветствие учителя, проверка готовности класса к уроку).
II. Актуализация опорных знаний (беседа, фронтальный опрос, работа с раздаточным материалом).
Учитель: Большинство наиболее «дорогих» в бальном отношении заданий, единого государственного экзамена, связаны с окислительно-восстановительными процессами.
Перед вами химическая реакция, часть которой утеряна (Презентация, слайд 1):
СН3С≡СН + КMnO4 + H2SO4 →
– Что нам необходимо знать, чтобы составить данную реакцию?
– Можем ли мы уравнять данную реакцию обычным способом?
– Почему?
– К какому типу реакций она относится?
– Какие реакции называются окислительно-восстановительными?
Учитель: Исходя, из всего изложенного, сформулируйте задачи нашего урока. (Задачи нашего урока научиться (слайд 2): определять продукты реакции, которые образуются в результате окислительно-восстановительных реакций; уравнивать окислительно-восстановительные реакции с органическими веществами).
(Задачи нашего урока научиться (слайд 2): определять продукты реакции, которые образуются в результате окислительно-восстановительных реакций; уравнивать окислительно-восстановительные реакции с органическими веществами).
Учитель: Какие понятия нам необходимы на уроке для составления окислительно-восстановительных реакций?
Задания 1 (работа в группах) (Приложение 1) (слайд 3)
Учитель: Какие степени окисления проявляют марганец, хром и сера в своих соединениях? Какие из данных соединений будут проявлять только окислительные свойства? Ответ обоснуйте.
III. Изучение нового материала
1. Определение продуктов окислителя в разных средах
Учитель: В ОВР органических веществ с неорганическими, органические вещества чаще всего являются восстановителями, а в качестве окислителей органических соединений используется ограниченный круг веществ, чаще всего перманганат калия (KMnO4) или дихромат калия (K2Cr2O7). Окислительная способность этих веществ зависит от концентрации раствора, температуры и среды. В зависимости от среды раствора, продуктами окислительно-восстановительных реакций, могут быть разные вещества. Среда влияет на изменение степеней окисления атомов.
Окислительная способность этих веществ зависит от концентрации раствора, температуры и среды. В зависимости от среды раствора, продуктами окислительно-восстановительных реакций, могут быть разные вещества. Среда влияет на изменение степеней окисления атомов.
Обычно для создания кислотной среды добавляют серную кислоту, соляную и азотную кислоты применяют реже, т.к. первая способна окисляться, а вторая сама является сильным окислителем и может вызвать побочные процессы. Для создания щелочной среды применяют гидроксид калия или натрия, нейтральной – воду.
Учитель: (создание проблемной ситуации). Получая к уроку раствор перманганата калия («марганцовка»), я случайно пролила раствор на блузку. Ваша задача найти вещество, с помощью которого, можно избавиться от пятна. Для этого вы проведете несколько лабораторных опытов.
Задание 2. Работа в группах (Приложение 2 – инструкция для учащихся, правила ТБ). Лабораторные опыты с перманганатом калия в разных средах.
Учитель: Используя результаты лабораторных опытов (слайд 4) продолжите, предложенную вначале урока реакцию –
СН3С≡СН + КMnO4 + H2SO4 → … + MnSO4 + К2SO4 + Н2О (слайд 5).
Вы проделали лабораторный опыт, предложите вещество, с помощью которого можно очистить блузку. После выведения пятен кусок ткани необходимо промыть водой.
2. Определение продуктов восстановителя в разных средах
Учитель: Диапазон окислительно-восстановительных реакций в органической химии достаточно высок и охватывает различные классы органических соединений. Мы сегодня рассмотрим ОВР углеводородов.
– Какие классы углеводородов вы знаете?
– Чем отличаются по строению предельные и непредельные углеводороды?
– Какие связи легче подвергаются окислении.?
Учитель: В ОВР органических веществ с неорганическими, органические вещества чаще всего являются восстановителями. Следующая наша задача определить, какие продукты образуются при окислении разных классов углеводородов (задание 3).
Следующая наша задача определить, какие продукты образуются при окислении разных классов углеводородов (задание 3).
Задание 3. Работа в группах (Приложение 3 – групповая работа с дидактическим материалом по изучению продуктов окисления разных групп углеводородов) 1 группа – алкены, 2-я группа – алкины, 3-я группа – алкадиены, 4-я группа – бензол и его гомологи.
Учитель: Сравните продукты реакции, которые образуются в результате окисления углеводородов разных классов из органических и неорганических веществ (Работа у доски – обсуждение итогов работы с дидактическим материалом).
№ п/п | Уравнение реакции | Условия реакции | Продукты реакции (органических веществ) | Продукты реакции (неорганических веществ) окислителя |
1-я группа | R–С≡С–R + КMnO4 + H2SO4 → R–COOH + (СО2↑) + MnSO4 + K2SO4 + H2O | Р-р КMnO4 в кислой среде (H2SO4) | Карбоновые кислоты (углекислвый газ) | MnSO4; K2SO4; H2O |
2-я группа |
|
|
|
|
3-я группа |
|
|
|
|
4-я группа |
|
|
|
|
Какие закономерности вы заметили? Допишите исходное уравнение, предложенное вначале урока (слайд 6):
СН3С≡СН + КMnO4 + H2SO4 → …
Задание 4. (слайд 7) (Приложение 4) Определите продукты реакции в следующих уравнениях:
(слайд 7) (Приложение 4) Определите продукты реакции в следующих уравнениях:
А) СН2=СНСН2СН3 + КMnO4 + H2SO4 →
Б) СН3С≡ССН2СН3 + КMnO4 + H2SO4 →
В) СН3СН=С=СН2СН3 + КMnO4 + H2SO4 →
Г) СН3СН=СНСН2СН3 + КMnO4 + H2SO4 →
Учитель: Таким образом, при составлении окислительно-восстановительных реакций с углеводородами достаточно знать, во что превращается окислитель и восстановитель в разных средах.
3. Расстановка коэффициентов в уравнениях ОВР с органическими веществами
Учитель: Какие существуют методы для уравнивания окислительно-восстановительных реакций?
Для подбора коэффициентов в уравнениях ОВР для органических веществ, протекающих в водных растворах, наиболее приемлемым является метод полуреакций или ионно-электронный метод. Это обусловлено тем, что определение степени окисления для атома углерода, требующееся для составления электронного баланса, весьма непростой процесс. Атом углерода в органических веществах может изменять степень окисления в очень широких пределах.
Это обусловлено тем, что определение степени окисления для атома углерода, требующееся для составления электронного баланса, весьма непростой процесс. Атом углерода в органических веществах может изменять степень окисления в очень широких пределах.
Метод полуреакций имеет ряд преимуществ:
- Нет необходимости определения степени окисления отдельных элементов.
- Можно не указывать все продукты в правой части уравнения. Достаточно знать, во что превращается окислитель и восстановитель в разных средах.
- Вода, кислота или щелочь только указывают среду и даются для правильного определения продуктов реакции.
- В полуреакциях реагенты и продукты записываются виде реальных ионов или молекул (слайд 8).
Пример 1. Окисление алкенов перманганатом калия в кислой среде:
СН3СН=СНСН2СН3 + КMnO4 + H2SO4 → CH3COOH + С2Н5СООН + MnSO4 + K2SO4 + H2O (нагревание)
IV. Закрепление (Работа в группах) (Приложение 5)
Закрепление (Работа в группах) (Приложение 5)
Задание 5. Уравнять ионно-электронным методом предложенные уравнения реакций:
СН2=СНСН2СН3 + КMnO4 + H2SO4 →
СН3С≡ССН2СН3 + КMnO4 + h3SO4 →
СН3СН=С=СН2СН3 + КMnO4 + H2SO4 →
СН3СН=СНСН2СН3 + КMnO4 + H2SO4 →
Учитель: А теперь проверим, как вы усвоили материал урока. Возьмите листочки с номерами ответов, подпишите их. Внимательно, прослушайте вопрос, который я задам и поставьте знак «плюс», если вы согласны с этим утверждением и знак «минус», если ответ отрицательный.
Задание 6. Блеф-игра «Верите ли вы, что…?»
- Окислительно-восстановительными называются все реакции с органическими веществами (–)?
- Восстановитель – это частица, которая принимает электроны (–).

- При окислении степень окисления элемента повышается (+).
- Продуктами реакции перманганата калия в кислой среде с органическими веществами являются: вода, сульфат марганца и сульфат калия (+)?
- Чаще всего при окислении углеводородов в жестких условиях продуктом реакции является карбоновая кислота? (+).
- При окислении гомологов бензола в жестких условиях, продуктами реакции являются разные ароматические альдегиды (–).
- Реакция среды влияет на продукты окислительно–восстановительных реакций (+).
Поменяйтесь листочками, проверяем работу:
1 | 2 | 3 | 4 | 5 | 6 | 7 |
– | – | + | + | + | – | + |
Результаты:
7 правильных ответов оценка – «5»
6-5 правильных ответов оценка – «4»
4 правильных ответов оценка – «3»
V. Подведение итогов урока
Подведение итогов урока
Учитель: Давайте вспомним задачи нашего урока (слайд 9), и этапы урока (слайд 10), которые помогли нам их решить.
В рамках одного урока невозможно рассмотреть все многообразие окислительно-восстановительных реакций. Но их значение в химии, технологии, повседневной жизни человека трудно переоценить. Процессы горения обеспечивают человечество энергией. Технологические процессы – органические и неорганические синтезы, получение металлов, электролиз – также связаны с ОВР. И в биологических процессах таких, как дыхание и фотосинтез, окислительно-восстановительные реакции играют существенную роль.
VI. Рефлексия (Приложение 6 – листок самоанализа)
Учитель: Дорогие ребята. Наш урок подходит к концу. Можно ли считать, что вы успешно справились с поставленными перед вами задачами и расширили свои знания об окислительно–восстановительных реакциях. Возьмите листочки с вопросами, которые мы сегодня разбирали на уроке, и поставьте знак «–» если вы не узнали ничего нового сегодня по этому вопросу и знак «+», если вам удалось расширить свои знания по данной теме.
Поднимите руку, у кого знаков плюсов больше.
А теперь проведем самоанализ своей работы, поставив цифру
«2» – я был на уроке;
«3» – я слушал и смотрел, как работают другие;
«4» – я изучал дидактический материал, помогал составлять уравнения, вносил предложения;
«5» – я изучал дидактический материал, активно участвовал в работе группы, был генератором идей.
VII. Домашнее задание
Учитель: Ознакомьтесь с заданиями, предложенными на дом, и выберите себе задания, с которыми вы успешно можете справиться самостоятельно. (Задание разноуровневое: сильные учащиеся записывают продукты реакции самостоятельно)
1-я группа (для компенсирующих детей). Используя ионно-электронный метод, расставить коэффициенты и определить окислитель и восстановитель в следующих реакциях:
СН2=СН2 + КMnO4 + H2SO4 → СО2 + MnSO4 + K2SO4 + H2O
СН≡СН + КMnO4 + H2SO4 → CO2 + MnSO4 + K2SO4 + H2O
С6Н5–СН3 + КMnO4 + H2SO4 → C6H5COOH + MnSO4 + K2SO4 + H2O
2-я группа (для репродуктивных детей) Используя ионно-электронный метод, расставить коэффициенты и определить окислитель и восстановитель в следующих реакциях:
СН3СН=СНСН2СН3 + КMnO4 + H2SO4 → CH3COOH + С2Н5СООН + MnSO4 + K2SO4 + …
СН3С≡ССН2СН3 + КMnO4 + H2SO4 → CH3COOH + С2Н5СООН + … + K2SO4 + H2O
С6Н5– СН2СН2СН3 СН3СН= + КMnO4 + H2SO4 → CH3COOH + С6Н5СООН + MnSO4 + … + H2O
3-я группа (для творческих детей). На основании полученных знаний, определите продукты предложенных реакций. Используя ионно-электронный метод, расставить коэффициенты и определить окислитель и восстановитель в следующих реакциях:
На основании полученных знаний, определите продукты предложенных реакций. Используя ионно-электронный метод, расставить коэффициенты и определить окислитель и восстановитель в следующих реакциях:
СН3СН=ССН2СН3 + КMnO4 + H2SO4 →
|
С2Н5
СН3СН=СНСН2СН3 + КMnO4 + H2SO4 → Ch4COOH + С2Н5СООН + MnSO4 + K2SO4 + H2OС6Н5–СН2СН=СНСН2СН3 + КMnO4 + H2SO4
расставьте коэффициенты используя метод электронного баланса в следующих схемах
▶▷▶ расставьте коэффициенты используя метод электронного баланса в следующих схемах| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 25-12-2018 |
расставьте коэффициенты используя метод электронного баланса в следующих схемах — Yahoo Search Results Yahoo Web Search Sign in Mail Go to Mail» data-nosubject=»[No Subject]» data-timestamp=’short’ Help Account Info Yahoo Home Settings Home News Mail Finance Tumblr Weather Sports Messenger Settings Want more to discover? Make Yahoo Your Home Page See breaking news more every time you open your browser Add it now No Thanks Yahoo Search query Web Images Video News Local Answers Shopping Recipes Sports Finance Dictionary More Anytime Past day Past week Past month Anytime Get beautiful photos on every new browser window Download 7 Расставьте коэффициенты методом электронного баланса в 5terkacom/node/10321 Cached 7 Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: Источник: Решебник по химии за 8 класс (ОСГабриелян, 2011 год), Используя метод электронного баланса ,расставьте коэффициенты znanijacom/task/6883572 Cached Перед Fe с лев и прав стор ставим 2, перед Сl ставим 3 в лев ч уравн, в правой остаётся 2, тк 3 уже есть в индексе FeCl(3) и 2 как коэфф подходит по уравнению Сl(2) +2e = 2Cl Сумма ат Расставьте коэффициенты методом электронного chemerru/reshebniki/11-klass/rudzitis-i-feldman/11/ Cached Расставьте коэффициенты методом электронного баланса в уравнении окислительно Метод электронного баланса в доступном изложении profmetercomua/communication/learning/course/ Cached в ) be + hno 3 → be(no 3) 2 + no + h 2 o Решение Для решения данной задачи воспользуемся правилами определения степени окисления Применение метода электронного баланса по шагам Пример «а» Задание 2 Дана окислительно-восстановительная реакция studfilesnet/preview/2570709/page:4 Cached Используя метод ионно- электронного баланса , расставьте коэффициенты в следующих схемах реакций Cr 2 (SO 4 ) 3 + H 2 O 2 + NaOH Na 2 CrO 4 + Na 2 SO 4 + H 2 O используя метод электронного баланса расставьте коэффициенты znanijacom/task/1104469 Cached используя метод электронного баланса расставьте коэффициенты в схемах окислительно Задания для самостоятельной работы по химии на тему infourokru/zadaniya-dlya-samostoyatelnoy-raboti Cached Используя метод электронного баланса , расставьте коэффициенты в схемах следующих Методом Электронного Баланса Расставить Коэффициенты Nh4 O2 turbabitsoleweeblycom/blog/metodom-elektronnogo Cached Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: а) nh4 + o2 = no + h3o б) al Методом электронного баланса подберите коэффициенты в схемах h3o2 + kmno4 + h3so4 → o2 + k2so4 + mnso4 + h3o Составьте уравнения полуреакции окисления и восстановления funnychemistryru/p_3703html Cached Составьте уравнения полуреакции окисления и восстановления, назовите атом-окислитель и атом-восстановитель Используя метод электронного баланса , найдите коэффициенты в схемах след ХимикПРО — Расставить коэффициенты методом электронного himikpro/okislitelno-vosstanovitelnyie-reaktsii-2/ Cached Расставить коэффициенты методом электронного баланса в уравнении реакции: KMnO4 + HCl = Решение задачи Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 12,000 results Settings Help Suggestions Privacy (Updated) Terms (Updated) Advertise About ads About this page Powered by Bing™
- расставьте коэффициенты в уравнении реакции
- пользуясь методом электронного баланса
- чтобы не смотреть ролики Узнай больше Больше никакой рекламы Никаких ограничений Хочешь пользоваться сайтом без рекламы? Подключи Знания Плюс
чтобы не смотреть ролики Узнай больше Больше никакой рекламы Никаких ограничений Хочешь пользоваться сайтом без рекламы? Подключи Знания Плюс
используя метод электронного баланса Alim Merdenov Ученик (205)
- найдите коэффициенты в схемах след ХимикПРО — Расставить коэффициенты методом электронного himikpro/okislitelno-vosstanovitelnyie-reaktsii-2/ Cached Расставить коэффициенты методом электронного баланса в уравнении реакции: KMnO4 + HCl = Решение задачи Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster
- найдите коэффициенты в схемах след ХимикПРО — Расставить коэффициенты методом электронного himikpro/okislitelno-vosstanovitelnyie-reaktsii-2/ Cached Расставить коэффициенты методом электронного баланса в уравнении реакции: KMnO4 + HCl = Решение задачи Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster
- Используя метод электронного баланса
расставьте коэффициенты используя метод электронного баланса в следующих схемах — Поиск в Google Специальные ссылки Перейти к основному контенту Справка по использованию специальных возможностей Оставить отзыв о специальных возможностях Нажмите здесь , если переадресация не будет выполнена в течение нескольких секунд Войти Удалить Пожаловаться на неприемлемые подсказки Режимы поиска Все Картинки Новости Видео Покупки Ещё Карты Книги Авиабилеты Финансы Настройки Настройки поиска Языки (Languages) Включить Безопасный поиск Расширенный поиск Ваши данные в Поиске История Поиск в справке Инструменты Результатов: примерно 9 420 (0,56 сек) Looking for results in English? Change to English Оставить русский Изменить язык Результаты поиска Все результаты Расставьте коэффициенты методом электронного баланса в › 5 — 9 классы › Химия Сохраненная копия Похожие 20 окт 2013 г — Расставьте коэффициенты методом электронного баланса в следующих схемах : 1) Nh4 + SOa -+N2 + S + h30 2) h3S + h302~h3S04 + Расставьте коэффициент методом электронного баланса в › 5 — 9 классы › Химия Сохраненная копия Похожие 26 апр 2015 г — Расставьте коэффициент методом электронного баланса в следующих схемах реакций: а) Nh4 + O2 —— NO + h30; б) Al + I2 —— AlI3; Расставьте коэффициенты, используя метод электронного › 5 — 9 классы › Химия Сохраненная копия Похожие Найди ответ на свой вопрос: Расставьте коэффициенты , используя метод электронного баланса, в следующих схемах реакций и укажите степени Ответы@MailRu: Химия 11 класс Расставьте коэффициенты, используя › Домашние задания › Другие предметы Сохраненная копия Похожие 1 ответ 25 февр 2015 г — Расставьте коэффициенты , используя метод электронного баланса, в следующих схемах реакций: а) Nh4 + SO2 — N2 + S + h3O; Ответы MailRu: помогите по химии:расставить 3 июл 2015 г Ответы@MailRu: используя метод электронного баланса 24 дек 2013 г Ответы@MailRu: методом электронного баланса расставьте 22 дек 2011 г Ответы@MailRu: Помогите по химий, раставить 24 дек 2010 г Другие результаты с сайта otvetmailru 7 Расставьте коэффициенты методом электронного баланса в Сохраненная копия ГДЗ к 7 Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: (решение и ответ) Расставьте коэффициенты, используя метод электронного — химия Сохраненная копия 26 февр 2014 г — Расставьте коэффициенты , используя метод электронного баланса, в следующих схемах реакций и укажите степени окисления Картинки по запросу расставьте коэффициенты используя метод электронного баланса в «id»:»-G9V9tMmimz10M:»,»ml»:»600″:»bh»:90,»bw»:117,»oh»:3120,»ou»:» «,»ow»:4160,»pt»:»ru-staticz-dnnet/files/d99/232903fd5ca3397b91a7b»,»rh»:»znanijacom»,»rid»:»pMdjxkdlbQ_saM»,»rt»:0,»ru»:» «,»st»:»Школьные Знанияcom»,»th»:90,»tu»:» \u003dtbn:ANd9GcRfLcFab_u1D9OtFN2Fo8RObeZsyls3cf677VxKEMOQ2UVm4pGOyj2glw»,»tw»:120 «id»:»bXIXd0oeMUEAWM:»,»ml»:»600″:»bh»:90,»bw»:117,»oh»:583,»ou»:» «,»ow»:1046,»pt»:»5terkacom/images/him8gabrielan/him8gabrielan-368″,»rh»:»5terkacom»,»rid»:»nVZYMSPrpXJC_M»,»rt»:0,»ru»:» «,»sc»:1,»th»:90,»tu»:» \u003dtbn:ANd9GcTiJsaEA7oaFxp8HrB6kRyAmUSWSVZQvKKlyjAcZX4w0ZqBoyMTr2bDc8w»,»tw»:161 «id»:»Zu031M8EI6C8nM:»,»ml»:»600″:»bh»:90,»bw»:117,»oh»:520,»ou»:» «,»ow»:924,»pt»:»5terkacom/images/him8gabrielan/him8gabrielan-366″,»rh»:»5terkacom»,»rid»:»nVZYMSPrpXJC_M»,»rt»:0,»ru»:» «,»sc»:1,»th»:90,»tu»:» \u003dtbn:ANd9GcQmW0_WQlFi8Q_brRhfZK-Ydhy13d0Cd3vDZdreDt-xDToPgYNHqNYdZKop»,»tw»:160 «id»:»MYr-NvVHG8ogMM:»,»ml»:»600″:»bh»:90,»bw»:117,»oh»:692,»ou»:» «,»ow»:1169,»pt»:»5terkacom/images/him8gabrielan/him8gabrielan-369″,»rh»:»5terkacom»,»rid»:»nVZYMSPrpXJC_M»,»rt»:0,»ru»:» «,»sc»:1,»th»:90,»tu»:» \u003dtbn:ANd9GcR7I0t—zfyt-q0kYdmkPDTfYpzyN6XUVuGInLRJNcwSNI3KTMm0FB0kZU»,»tw»:152 «id»:»N-g2l-op4qUI8M:»,»ml»:»600″:»bh»:90,»bw»:116,»oh»:228,»ou»:» «,»ow»:963,»pt»:»5terkacom/images/him8gabrielan/him8gabrielanuch-2″,»rh»:»5terkacom»,»rid»:»nVZYMSPrpXJC_M»,»rt»:0,»ru»:» «,»sc»:1,»th»:90,»tu»:» \u003dtbn:ANd9GcSEuTx94vCSbquS7zIwN9lD8I3nbtIRPsXuv2bzHxUdLFjhFCBYUIKoeHok»,»tw»:380 Другие картинки по запросу «расставьте коэффициенты используя метод электронного баланса в следующих схемах» Жалоба отправлена Пожаловаться на картинки Благодарим за замечания Пожаловаться на другую картинку Пожаловаться на содержание картинки Отмена Пожаловаться Все результаты Методом электронного баланса расставьте коэффициенты в wwwsolobyru//методом-электронного-расставьте-коэффициенты-следующих Сохраненная копия Методом электронного баланса расставьте коэффициенты в следующих схемах реакций: a) BaSO4 + С—— BaS + СО; S + КОН—— K2SO3 + K2S + Расставьте коэффициенты методом электронного баланса в wwwsolobyru//расставьте-коэффициенты-методом-электронного-следующих Сохраненная копия Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: а) Nh4 + O2 = NO + h3O б) Al + KMnO4 = Cl2 + KCl + MnCl2 Не найдено: используя [PPT] Алгоритм расстановки коэффициентов методом электронного Сохраненная копия В следующих схемах укажите со каждого элемента и расставьте Расставьте коэффициенты , используя метод электронного баланса : Nh4 + O2 N2 + Химия 9 класс — Страница 83 — Результат из Google Книги Андрей Дроздов , Вадим Ерёмин , Николай Кузьменко — 2018 — Science Расставьте в них коэффициенты , пользуясь методом электронного баланса Используя метод электронного баланса , найдите коэффициенты в схемах следующих реакций: a) Na + Cl P + O2 2 Напишите уравнения реакций горения в кислороде следующих веществ: железа, да(II), метана водорода, Презентация по химии на тему «Упражнение в расстановке › Химия Сохраненная копия Похожие 12 мая 2015 г — Напишите схемы процессов окисления и восстановления C⁰−4e Расставьте коэффициенты методом электронного баланса 1) 7 Расставьте коэффициенты методом электронного баланса в Сохраненная копия 7 Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: Решение задачи: 7 Расставьте коэффициенты методом Не найдено: используя Расстановка коэффициентов методом электронного баланса с Похожие ▶ 18:12 11 окт 2015 г — Добавлено пользователем Your system education Ещё примеры расстановки: Видео-подготовка к ЦТ и ЕГЭ по химии В урок химии в 11 классе «ОВР» — Социальная сеть работников Сохраненная копия 25 нояб 2013 г — Расставьте коэффициенты с помощью метода электронного баланса используя метод электронного баланса в следующих схемах : Метод электронного баланса — Справочник химика 21 — chem21info chem21info/info/6870/ Сохраненная копия Похожие В следующих схемах реакций укажите степень окисления каждого элемента и расставьте коэффициенты , используя метод электронного баланса [c49] Урок химии в 8-м классе по теме «Кто-то теряет, а кто-то находит открытыйурокрф/статьи/532859/ Сохраненная копия 21 апр 2009 г — Покажите электронные переходы в следующих ОВР Из приведенных схем выпишите уравнения реакций, которые можно отнести к ОВР 2 Расставьте коэффициенты методом электронного баланса в следующих схемах углерода и воды), используя для этого молекулярный кислород [PDF] Контрольно-измерительные материалы по общеобразовательной Сохраненная копия (3 балла) Расставьте коэффициенты методом электронного баланса S + HNO3 = используя метод электронного баланса в следующих схемах : методом электронного баланса расставьте коэффициенты в Сохраненная копия 10 янв 2016 г — методом электронного баланса расставьте коэффициенты в следующих схемах уравнений реакций: KMnO4+h3O2=MnO2+KOH+O2+h3O В ответе введите его символ ( используя только латиницу) 1 ответ Реакции простых веществ с сложными веществами стр 7 — стр 7 uchebana5ru/cont/2582611-p7html Сохраненная копия Проставьте степени окисления каждого элемента и расставьте коэффициенты , используя метод электронного баланса в следующих схемах : 1) Fe + Урок по теме овр | Образовательный портал EduContestNet Сохраненная копия 21 июл 2017 г — Метод электронного баланса как способ составления уравнений ОВР В следующих схемах реакций укажите степень окисления каждого и расставьте коэффициенты , используя метод электронного баланса в Метод электронного баланса — Profmeter Сохраненная копия Похожие Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов: Урок №8-9 Окислительно – восстановительные реакции Похожие Рассмотрите приведённые ниже схемы уравнений реакций В чём их Здесь мы рассмотрим метод электронного баланса Определите, что происходит со степенью окисления серы при следующих переходах: А) h3S Расставьте коэффициенты в реакциях используя метод электронного баланса [PDF] Окислительно-восстановительные реакции ksmaru/cms/files/metodicheskie%20ukazaniya%20po%20teme%20ovrpdf Сохраненная копия Пример 2: Используя метод электронного баланса , составьте уравнения следующих Переносим полученные коэффициенты в уравнение реакции: Задание 2 Дана окислительно-восстановительная реакция :4/ 27 мар 2015 г — Используя метод ионно- электронного баланса , расставьте коэффициенты в следующих схемах реакций Cr2(SO4)3 + h3O2 + NaOH Составьте уравнения полуреакции окисления и восстановления funnychemistryru/p_3703html Сохраненная копия Используя метод электронного баланса , найдите коэффициенты в схемах след электронный баланс и расставьте коэффициенты в следующих Расставьте коэффициенты, используя метод электронного zadachkinoru › Форум › Предметы › Химия Сохраненная копия Расставьте коэффициенты , используя метод электронного баланса, в следующих схемах реакций и укажите степени окисления металла и азота до [PDF] Окислительно-восстановительные реакции — Краснодарский ktyisru/wp-content/uploads/2016/04/br_doc1pdf Сохраненная копия Методом электронного баланса подберите коэффициенты в схемах Расставьте коэффициенты в следующих схемах реакций и укажите окислитель Задачи к разделу Окислительно-восстановительные реакции zadachi-po-khimiiru › › Окислительно-восстановительные реакции Сохраненная копия Похожие Составьте уравнение электронного баланса , расставьте коэффициенты в всех компонентов, входящих в состав следующих соединений: HСl, Cl2, HClO 2 и подберите коэффициенты ионно- электронным методом в реакции Уравнения гидролиза | Контент-платформа Pandiaru Расставьте коэффициенты , используя метод электронного баланса, в следующих схемах реакций: а) Nh4 + SO2 — N2 + S + h3O; б) NaClO — NaClO3 + [PDF] Капустина ОВР доп — СГУ elibrarysguru/uch_lit/1637pdf Похожие автор: ЛФ Кожина — Цитируется: 1 — Похожие статьи расставьте коэффициенты методом электронного баланса Решение 2 окислитель — запишем в левую и правую часть схемы формулы окислителя и продукта процесса, используя справочные стандартные полуреакции? Пример 8 Сравните значения стандартных потенциалов следующих Окислительно-восстановительные реакции (ОВР) | ЗНАТОКИ Сохраненная копия Похожие 11 дек 2013 г — Методом электронного баланса расставьте коэффициенты , укажите окислитель и Составьте электронно-ионные схемы и закончите уравнения следующих реакции, используя метод электронного баланса азотная кислота является сильным окислителем azotnayakislotaru/item/azotnaya-kislota-yavlyaetsya-silnym-okislitelem Сохраненная копия 26 февр 2016 г — Расставьте коэффициенты , используя метод электронного баланса, в следующих схемах реакций и укажите степени окисления Метод электронного баланса — ПОМОЩЬ — Форум химиков на XuMuKru forumxumukru › Школьникам и студентам — решение задач › ПОМОЩЬ Сохраненная копия 10 янв 2012 г — Используя метод электронного баланса , расставьте коэффициенты в уравнениях окислительно-восстановительных реакций Укажите Урок «Окислительно — восстановительные реакции» — Урокрф Сохраненная копия 30 нояб 2017 г — Для вычисления степени окисления элемента в соединении следует исходить из следующих положений: Расставьте коэффициенты в реакции, схема которой Al+C→Al4C3, Составляют схемы окисления и восстановления Упражнения Используя метод электронного баланса , [PDF] окислительно–восстановительные реакции — кгасу Сохраненная копия Определите степени окисления центрального атома в следующих Ниже представлены схемы проявления окислительно-восстановительной рические коэффициенты, используя метод электронного баланса : 1) Сu2O Составьте уравнения соответствующих ОВР и расставьте коэффициенты по ме- С Т Жуков Химия 8-9 класс Глава 9 Химические реакции wwwchemmsusu/rus/school/zhukov1/09html Сохраненная копия Похожие С ОВР вы познакомитесь в § 2, а с КОР – в следующих главах Составьте уравнения реакций, соответствующих следующим схемам : Введя коэффициенты 2 и 3 в схему реакции, получаем уравнение реакции: Используя метод электронного баланса , составьте уравнения реакций, соответствующие Методическая разработка практического занятия по химии по теме Сохраненная копия Методом электронного баланса подберите коэффициенты в схемах Расставьте коэффициенты в следующих схемах реакций и укажите окислитель Расставить коэффициенты методом электронного баланса himikpro/okislitelnoreaktsii/rasstavit-koeffitsientyi-metodom-elektronnogo-balans Сохраненная копия Похожие 20 мар 2013 г — электронного баланса · Расставьте коэффициенты в методом электронного баланса · Используя метод электронного баланса · Расставить коэффициенты · Азотная кислота концентрированная Категории: Метод электронного баланса, Окислительно-восстановительные реакции Окислительно-восстановительные реакции — СтудопедияОрг Сохраненная копия Расставьте коэффициенты в следующих уравнениях реакций и укажите окислитель и восстановитель: а) h3S + НСЮ Определите степень окисления, используя метод электронного баланса , уравняйте эти схемы : а) I 2 + Cl + [DOC] Муниципальное общеобразовательное учреждение mou45chel-eduru//metodicheskierekomendaciidlyauchashaixsyakizucheniyuximii Сохраненная копия Похожие Алгоритм составления схемы образования ионной связи Правила расстановки коэффициентов методом электронного баланса Составить молекулярные, полные и краткие ионные уравнения для следующих реакций : Расставьте в уравнении реакции коэффициенты , используя полученные ЕН07 «Химия радиоматериалов — Образовательный портал АГТУ portalastuorg//МУ%20по%20СРС%20ЕН07%20Химия%20радиоматериаловpdf? 11 февр 2011 г — метод электронного баланса в следующих схемах : Расставьте коэффициенты методом электронного баланса в следующих схемах : 4) Затем, используя уравнение закона эквивалентов (5), рассчитываем Студопедия — ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ Сохраненная копия 19 сент 2015 г — Расставьте коэффициенты в уравнении реакции: Используя метод электронного баланса , окисление или восстановление – происходит при следующих превращениях: Реакции выражаются схемами : ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Сохраненная копия 20 мар 2015 г — Расставьте коэффициенты в уравнении реакции: Используя метод электронного баланса , окисление или восстановление – происходит при следующих превращениях: Реакции выражаются схемами : Форум Химиков — Энтузиастов Химия и Химики • Просмотр темы chemistry-chemistscom/forum/viewtopicphp?f=27t=1523start=320 Сохраненная копия Похожие 22 дек 2011 г — 20 сообщений — 10 авторов Используя некоторые из указанных ионов и молекул, составьте — соли с Составьте электронные уравнения и на основании их расставьте коэффициенты в уравнениях реакций Расставьте коэфф методом электронного баланса в следующих схемах реакции и укажите, какой элемент [PDF] Проверочная работа минимального уровня maratakmnarodru/sharafutdinovapdf Сохраненная копия Похожие Составьте схемы образования химической связи для веществ, формулы которых: Впишите пропущенные слова в следующих предложениях: Расставьте коэффициенты методом электронного баланса в следующих схемах : гидроксида алюминия AL(OH)3, используя таблицу растворимости кислот, 1) В следующих схемах реакций укажите степени окисления к Сохраненная копия 1) В следующих схемах реакций укажите степени окисления каждого элемента и расставьте коэффициенты , используя метод электронного баланса : Задание С1 на ЕГЭ по химии Особенности, советы — ЕГЭ-Студия Сохраненная копия Используя метод электронного баланса , составьте уравнение реакции Определите Задание 1: Расставьте степени окисления в веществах: Задание 4: Какой коэффициент в уравнении реакции будет стоять перед магнием? Если ответ на этот вопрос не дают выученные нами схемы , то нужно Вяземский А | Рабочая тетрадь по химии 8 класс | Журнал «Химия him1septemberru/articlephp?ID=200702106 Сохраненная копия Похожие Допишите правую часть в схемах реакций основных оксидов с кислотами и и кислотными оксидами, используя перечисленные вещества: СаО, СО2, SiO 2, ВаО Методом электронного баланса расставьте коэффициенты только в Напишите уравнения реакций получения следующих азотсодержащих [DOC] Окислительно-восстановительные реакции 34stavru/file/urok3_chimdoc Сохраненная копия Закрепить умение расставлять коэффициенты методом электронного баланса Определите степень окисления элементов в следующих соединениях: КСIO3, Расставьте степени окисления всех элементов в формулах веществ, составьте уравнения реакций, используя метод электронного баланса : Вместе с расставьте коэффициенты используя метод электронного баланса в следующих схемах часто ищут расставьте коэффициенты методом электронного баланса в схеме окислительно-восстановительной реакции расставьте коэффициенты методом электронного баланса укажите окислитель и восстановитель расставьте коэффициенты методом электронного баланса c+hno3 расставьте коэффициенты методом электронного баланса nh4+o2=no+h3o расставьте коэффициенты в следующих схемах реакций nh4+so2 расставьте коэффициенты методом электронного баланса fe2o3+h3 расставьте коэффициенты методом электронного баланса no+h3 Навигация по страницам 1 2 3 4 5 6 Следующая Ссылки в нижнем колонтитуле Россия — Подробнее… Справка Отправить отзыв Конфиденциальность Условия Аккаунт Поиск Карты YouTube Play Новости Почта Контакты Диск Календарь Google+ Переводчик Фото Ещё Покупки Документы Blogger Hangouts Google Keep Jamboard Подборки Другие сервисы Google
Яндекс Яндекс Найти Поиск Поиск Картинки Видео Карты Маркет Новости ТВ онлайн Знатоки Коллекции Музыка Переводчик Диск Почта Все Ещё Дополнительная информация о запросе Показаны результаты для Нижнего Новгорода Москва 1 Расставьте коэффициенты , пользуясь методом znanijacom › task/18997085 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Подробнее о сайте Расставьте коэффициенты , пользуясь методом электронного баланса , в следующих схемах , определите степень окисления азота и хлора 1)HNO2=HNO3+NO+h3O 2)NaClO=NaClO3+NaCl Попроси больше объяснений Читать ещё Расставьте коэффициенты , пользуясь методом электронного баланса , в следующих схемах , определите степень окисления азота и хлора 1)HNO2=HNO3+NO+h3O 2)NaClO=NaClO3+NaCl Попроси больше объяснений Следить Хочешь пользоваться сайтом без рекламы? Подключи Знания Плюс, чтобы не смотреть ролики Узнай больше Больше никакой рекламы Никаких ограничений Хочешь пользоваться сайтом без рекламы? Подключи Знания Плюс, чтобы не смотреть ролики Узнай больше Скрыть 2 7 Расставьте коэффициенты методом электронного 5terkacom › node/10321 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте 7 Расставьте коэффициенты методом электронного баланса в следующих схемах реакций Читать ещё 7 Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: Источник: Решебник по химии за 8 класс (ОСГабриелян, 2011 год), задача №7 к главе «Глава 6 Растворение Скрыть 3 Методом электронного баланса расставьте solobyru › 896606/методом…расставьте-коэффициенты… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Методом электронного баланса расставьте коэффициенты в следующих схемах реакций: a) BaSO4 + С—— BaS + СО Используя метод электронного баланса , расставьте коэффициенты в схемах электролиза расплавов: а) А12О3—— А1 + О2; спросил31 Авгот лисенокв категории ЕГЭ (школьный) 1 ответ Читать ещё Методом электронного баланса расставьте коэффициенты в следующих схемах реакций: a) BaSO4 + С—— BaS + СО; б) КСЮ3—— КСЮ4 + КС1; А1 4- h3SO4—— A1Z(SO4)3 + h3; Na2CO3 + С—— Na + CO; КС1О3 + Р—— КС1 + Р2О5; S + КОН—— K2SO3 + K2S + Н2О спросил31 Авгот лисенокв категории ЕГЭ (школьный) Используя метод электронного баланса , расставьте коэффициенты в схемах электролиза расплавов: а) А12О3—— А1 + О2; спросил31 Авгот лисенокв категории ЕГЭ (школьный) 1 ответ Расставьте коэффициенты методом электронного баланса Скрыть 4 Расставьте коэффициенты , используя метод znanijacom › task/2430336 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Подробнее о сайте Расставьте коэффициенты , используя метод электронного баланса , в следующих схемах реакций и укажите степени окисления металла и азота до реакций и после них: 1) Zn+HNO3 (конц) — Zn(NO3)2 + NO2 + h3O 2) Hg + HNO3 (разб) — — Hg(NO3)2 + NO2 + h3O 3) Mg + HNO3 (оч разб) — Читать ещё Расставьте коэффициенты , используя метод электронного баланса , в следующих схемах реакций и укажите степени окисления металла и азота до реакций и после них: 1) Zn+HNO3 (конц) — Zn(NO3)2 + NO2 + h3O 2) Hg + HNO3 (разб) — — Hg(NO3)2 + NO2 + h3O 3) Mg + HNO3 (оч разб) — — Mg(NO3)2 + Nh5NO3 + h3O Скрыть 5 Расставьте коэффициенты методом электронного solobyru › 468525/расставьте-коэффициенты-методом… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: а) Nh4 + O2 = NO + h3O Конфиденциальность: Ваш электронный адрес будет использоваться только для отправки уведомлений Читать ещё Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: а) Nh4 + O2 = NO + h3O Расставьте коэффициенты методом электронного баланса в следующих схемах реакций: а) Nh4 + O2 = NO + h3O б) Al + I2 = AlI3 в) HNO3 + P + h3O= h4PO4 + NO г) HCl + KMnO4 = Cl2 + KCl + MnCl2 + h3O спросил 22 Май, 17 от tutsy в категории ЕГЭ (школьный) добавить свой ответ Конфиденциальность: Ваш электронный адрес будет использоваться только для отправки уведомлений Анти-спам проверка: Чтобы избежать проверки в будущем, пожалуйста войдите или зарегистрируйтесь Ответить Отмена решение вопроса +4 Скрыть 6 «РЕШУ ОГЭ»: химия ОГЭ — 2019: задания, ответы chem-ogesdamgiaru › Задания Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Подробнее о сайте Используя метод электронного баланса , расставьте коэффициенты в уравнении реакции, схема которой: Определите окислитель и восстановитель Пояснение 1) Составлен электронный баланс : 2) Расставлены коэффициенты в Читать ещё Используя метод электронного баланса , расставьте коэффициенты в уравнении реакции, схема которой: Определите окислитель и восстановитель Пояснение 1) Составлен электронный баланс : 2) Расставлены коэффициенты в уравнении реакции: 3) Указано, что сера в степени окисления +6 является окислителем, а иод в степени окисления −1 — восстановителем Источник: Демонстрационная версия ГИА—2014 по химии Скрыть 7 Ответы@MailRu: Химия 11 класс Расставьте коэффициенты , используя метод электронного otvetmailru › question/175492098 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Расставьте коэффициенты , используя метод электронного баланса Alim Merdenov Ученик (205), на голосовании 3 года назад Расставьте коэффициенты , используя метод электронного баланса , в следующих схемах реакций: а) Nh4 + SO2 — N2 + S + h3O; б) NaClO — NaClO3 + NaCl; в) h3SO3 + I2 + h3O Читать ещё Расставьте коэффициенты , используя метод электронного баланса Alim Merdenov Ученик (205), на голосовании 3 года назад Расставьте коэффициенты , используя метод электронного баланса , в следующих схемах реакций: а) Nh4 + SO2 — N2 + S + h3O; б) NaClO — NaClO3 + NaCl; в) h3SO3 + I2 + h3O — h3SO4 + HI; г) Zn + HNO3(конц) — Zn(NO3)2 + NO + h3O; д) Mg + HNO3(очень разбавл) — Mg(NO3)2 + Nh5NO3 +h3O; е) Nh5NO3 — N2O + h3O; ж) KClO3 — KClO4 + KCl Скрыть 8 Метод электронного баланса profmetercomua › communication/learning/course/… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Метод электронного баланса в доступном изложении Суть метода электронного баланса заключается в Задача Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов: а) Ag + HNO3 → AgNO3 + NO + h3O б) Ca +h3SO4 Читать ещё Метод электронного баланса в доступном изложении Суть метода электронного баланса заключается в: Подсчете изменения степени окисления для каждого из элементов, входящих в уравнение химической реакции Элементы, степень окисления которых в результате произошедшей реакции не изменяется — не принимаются во внимание Задача Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов: а) Ag + HNO3 → AgNO3 + NO + h3O б) Ca +h3SO4 → CaSO4 + h3S + h3O в) Be + HNO3 → Be(NO3)2 + NO + h3O Решение Для решения данной задачи воспользуемся правилами определения степени окисления Скрыть 9 Расставить коэффициенты методом электронного himikpro › …reaktsii…koeffitsientyi-metodom…balansa Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Решить уравнение, расставить коэффициенты методом электронного баланса Расставить коэффициенты методом электронного баланса в уравнении реакции: KMnO4 + HCl = Решение задачи Читать ещё Решить уравнение, расставить коэффициенты методом электронного баланса Расставить коэффициенты методом электронного баланса в уравнении реакции: KMnO4 + HCl = Решение задачи 1 Определим атомы, каких элементов изменяют степень окисления: Следовательно, в процессе реакции степень окисления меняют хлор (Cl) и марганец (Mn) 2 Составим электронные уравнения процессов окисления и восстановления: 2Cl -1 – 2e — = Cl 2 0 2 5 (окисление) Mn +7 + 5e — = Mn +2 5 2 (восстановление) 3 Умножают полученные электронные уравнения на наименьшие множители для установления баланса по электронам: 2Cl -1 – 2e — = Cl 2 0 2 5 → 10Cl -1 – 10e — = 5Cl 2 0 Скрыть 10 Составьте уравнения полуреакции окисления funnychemistryru › p_3703html Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Используя метод электронного баланса , найдите коэффициенты в схемах след Составьте электронный баланс и расставьте коэффициенты в следующих окислительно-восстановительных реакциях: h3S + K2Cr2O7 + h3SO4 → S + Cr2 (SO4)3 + K2SO4 + h3OK2SO3 + KmnO4 Тема: Реакции Читать ещё Используя метод электронного баланса , найдите коэффициенты в схемах след Реакций: Na+Cl2=NaCl, P+O2=P2O5, HgO=Hg+O2, h3S +O2=SO2+h3O, Nh4+O2=N2+h3O Составьте электронный баланс и расставьте коэффициенты в следующих окислительно-восстановительных реакциях: h3S + K2Cr2O7 + h3SO4 → S + Cr2 (SO4)3 + K2SO4 + h3OK2SO3 + KmnO4 Тема: Реакции разложения Осуществить следующие превращения: P→Ca3P2→Ph4→P2O5→K3PO4→Ag3PO4, 1,2,3-разобрать как окислительно-восстановительные 5-Расписать на ионы Тема: Осуществите превращение Выписать окислительно- восстановительные реакции и уравнять методом электронного баланса Указать окислитель и восстановитель Скрыть Вместе с « расставьте коэффициенты используя метод электронного баланса в следующих схемах » ищут: как расставлять коэффициенты в химических уравнениях na2o h3o naoh расставить коэффициенты hgo hg o2 naoh 1 2 3 4 5 дальше Браузер Все новые вкладки с анимированным фоном 0+ Установить
8.
 2: Окислители и восстановители
2: Окислители и восстановителиЦель обучения
- Определите окислители и восстановители.
Жизнь на планете Земля представляет собой сложный и хорошо организованный комплекс процессов. Животные созданы для дыхания кислородом, а растения созданы для его производства. Фотосинтез — это средство, с помощью которого мы получаем кислород, необходимый для жизни. Свет, падающий на растительный пигмент, известный как хлорофилл, инициирует сложную серию реакций, многие из которых включают окислительно-восстановительные процессы с движением электронов.{2-}} \end{align}\]
В приведенной выше реакции цинк окисляется, теряя электроны. Однако должно присутствовать другое вещество, которое получает эти электроны, и в данном случае это сера. Другими словами, сера вызывает окисление цинка. Серу называют окислителем. Цинк заставляет серу приобретать электроны и восстанавливаться, поэтому цинк называют восстановителем. Окислитель представляет собой вещество, вызывающее окисление путем принятия электронов; следовательно, его степень окисления снижается. Восстановитель представляет собой вещество, вызывающее восстановление за счет потери электронов; поэтому его степень окисления увеличивается. Простейший способ представить это так: окислитель — это вещество, которое восстанавливается, а восстановитель — это вещество, которое окисляется, как показано на рисунке \(\PageIndex{1}\) и суммировано в таблице \(\PageIndex{1}\).
Восстановитель представляет собой вещество, вызывающее восстановление за счет потери электронов; поэтому его степень окисления увеличивается. Простейший способ представить это так: окислитель — это вещество, которое восстанавливается, а восстановитель — это вещество, которое окисляется, как показано на рисунке \(\PageIndex{1}\) и суммировано в таблице \(\PageIndex{1}\).
Примечание
И окислитель, и восстановитель являются реагентами и, следовательно, появляются в левой -сторонней части уравнения.
| Окислители | Восстановители | |
| Степень окисления | Уменьшается | Увеличивает |
| Количество электронов | Получено | Потерян |
Вещество. .. .. | Уменьшенный | Окисленный |
В приведенных ниже примерах показано, как анализировать окислительно-восстановительную реакцию и определять окислители и восстановители.
Пример \(\PageIndex{1}\) Полууравнения
Когда газообразный хлор пропускают через раствор бромида натрия, происходит реакция, в результате которой образуется водный раствор хлорида натрия и бром. Определите, что окисляется, а что восстанавливается. Назовите окислители и восстановители.
\[\ce{Cl_2} \left( g \right) + 2 \ce{NaBr} \left( aq \right) \rightarrow 2 \ce{NaCl} \left( aq \right) + \ce{Br_2} \влево( л \вправо)\]
Решение:
Шаг 1: Спланируйте проблему.
Разбейте реакцию на суммарное ионное уравнение, а затем на полуреакции. Вещество, потерявшее электроны, окисляется и является восстановителем. Вещество, которое получает электроны, восстанавливается и является окислителем. {2-}\]
{2-}\]
Раствор
\(S\) является восстановителем, а \(Mn\) является окислителем.
Резюме
- Окислитель – это вещество, вызывающее окисление путем принятия электронов; следовательно, он уменьшается.
- Восстановитель – это вещество, вызывающее восстановление за счет потери электронов; поэтому он окисляется.
- Показаны примеры определения окислителей и восстановителей.
Авторы и авторство
Фонд CK-12, созданный Шэрон Бьюик, Ричардом Парсонсом, Терезой Форсайт, Шонной Робинсон и Джин Дюпон.
Эд Витц (Университет Куцтауна), Джон В. Мур (UW-Мэдисон), Джастин Шорб (Колледж Хоуп), Ксавьер Прат-Ресина (Университет Миннесоты в Рочестере), Тим Вендорф и Адам Хан.
- Дайана Пирсон, Конни Сюй, Лавлин Брар (UCD)
Мариса Альвиар-Агню (Городской колледж Сакраменто)
Окисление и восстановление
Если один реагент в реакции удаляет кислород, вносит водород или вносит электроны, говорят, что он является восстановителем. Конечно, он окисляется в процессе. Поскольку окисление и восстановление являются симметричными процессами, всегда протекающими вместе, в реакции всегда присутствуют окислитель и восстановитель. Поскольку оба всегда присутствуют, зачем возиться с этой терминологией?
Конечно, он окисляется в процессе. Поскольку окисление и восстановление являются симметричными процессами, всегда протекающими вместе, в реакции всегда присутствуют окислитель и восстановитель. Поскольку оба всегда присутствуют, зачем возиться с этой терминологией?
Если желаемой целью является восстановление какого-либо вещества, то полезно найти агент, который легко приведет к восстановлению. Газообразный водород является очень полезным восстановителем, широко используемым для выделения чистых металлов путем восстановления.Например, металлическую медь можно получить восстановлением по реакции
CuO + H 2 -> Cu + H 2 OТот факт, что водород окисляется в процессе, является случайным — водород выполнил очень ценную задачу в качестве восстановителя.
Важные задачи решаются восстановителями, такими как фотопроявители и антиоксиданты. И в фотосинтезе восстановители выполняют задачу, которая необходима для нашего выживания.
Относительная сила восстановителей может быть определена по их стандартным электродным потенциалам. Наиболее сильные восстановители показаны в таблице стандартных электродов.
Наиболее сильные восстановители показаны в таблице стандартных электродов.
| катод (уменьшение) 4 Полуакция | Стандартный потенциал | стандартный потенциал E ° (вольт) |
| LI + (AQ) + E — -> Li (S) | -3.04 | |
| K + (AQ) + E — -> K (S) | -2.92 | -2.92 |
| CA 2+ (AQ) + 2E — -> CA (S) | -2.76 | |
| Na + (AQ) + E — -> Na (ы) | -2.71 | -2.71 |
| мг | ||
| мг 2+ (AQ) + 2E — -> Mg (ы) | -2,38 |
Литий, имеющий наибольшее отрицательное значение электродного потенциала, является сильнейшим восстановителем. По соглашению, стандартные электродные потенциалы представляют собой потенциалы восстановления или тенденцию к снижению. Согласно этому соглашению, самые сильные восстановители будут иметь большие отрицательные потенциалы.
Согласно этому соглашению, самые сильные восстановители будут иметь большие отрицательные потенциалы.
Окислительно-восстановительные реакции: второй способ классификации реакций
Другой способ классификации реакций разделяет их только на две группы: (1) те, которые не связаны с изменением степени окисления, но приводят к уменьшению числа ионов в растворе, и (2) те, которые включают перенос электронов и изменение степени окисления.
Те, которые приводят к уменьшению числа ионов в растворе, обычно
реакции двойного смещения (раздел 8.2Д).
В реакции нейтрализации ион водорода соединяется с гидроксид-ионом с образованием
ковалентная, неионизированная составная вода, что уменьшает количество ионов
в растворе. В реакции осаждения нерастворимый продукт удаляет ионы
из раствора. Другими реакциями в этой категории являются те, которые образуют слабые
электролиты (раздел 7.5C), такие как
уксусная кислота или водный раствор аммиака (гидроксид аммония). Примеры — реакция
между ацетатом натрия и соляной кислотой
Примеры — реакция
между ацетатом натрия и соляной кислотой
NaC 2 H 3 O 2 (водн.) + HCl (водн.) NaCl (водн.) + HC 2 H 3 O 2 (водный)
и реакция между гидроксидом натрия и хлоридом аммония
NaOH (водн.) + NH 4 Cl (водн.) NaCl(водн.) + NH 3 (водн.) + H 2 O(л)
Те реакции, которые включают перенос электронов, включают реакции соединения, замещения и разложения.Реакции, в которых происходит перенос электронов, называются Снижение окисления или окислительно-восстановительный реакции. Реакция натрия с хлором является окислительно-восстановительной реакцией:
2 Na + Cl 2 2 NaCl
Каждый атом хлора получает электрон, образуя ион хлора:
Каждый атом натрия теряет электрон, образуя ион натрия:
Элемент, потерявший электроны,
окисленный. При реакции натрия с хлором происходит окисление натрия. Элемент, который получает электроны, восстанавливается. В этой реакции хлор восстанавливается.
При реакции натрия с хлором происходит окисление натрия. Элемент, который получает электроны, восстанавливается. В этой реакции хлор восстанавливается.
Реакции замещения обычно представляют собой окислительно-восстановительные реакции. Типичной реакцией замещения является реакция меди с нитратом серебра:
Cu(т) + 2 AgNO 3 (водн.) 2 Ag + Cu(NO 3 ) 2 (водн.)
В этой реакции медь теряет электроны (окисляется):
Медь 0 Cu 2+ + 2 e —
а ион серебра приобретает электроны (восстанавливается):
Ag + + e — Аг 0
Окисление без восстановления невозможно.Если элемент в реакции теряет электроны, другой элемент в реакции должен получить электроны.
A. Идентификация окислительно-восстановительных реакций
Идентификация окислительно-восстановительных реакций
Цифры окисления (раздел 6.2A) имеют
много применений, но нас здесь интересует их роль в определении того,
или не конкретная реакция включает окисление-восстановление. В окислительно-восстановительной
реакции меняются не менее двух степеней окисления.Элемент, который окисляется
увеличивает степень окисления, а восстанавливаемый элемент уменьшает
степень окисления. В реакции натрия с хлором атомы натрия
окисляется до ионов натрия; степень окисления натрия увеличивается от 0 до
+1. При этом хлор восстанавливается до ионов хлора; степень окисления
хлора уменьшается от 0 до -1. Присвоив степени окисления всем
элементы в реагентах и продуктах реакции, мы можем определить,
реакция приводит к изменению степени окисления.Если изменение произойдет,
реакция представляет собой окислительно-восстановительную реакцию. Например, рассмотрим реакцию
между магнием и кислородом:
Под каждым элементом в каждом веществе в уравнении мы написали его степень окисления. Степень окисления магния увеличивается от 0 до +2; магний окисляется. Степень окисления кислорода уменьшается от 0 до -2; кислорода снижается. Таким образом, реакция магния с кислородом является окислительно-восстановительной реакцией.
Степень окисления магния увеличивается от 0 до +2; магний окисляется. Степень окисления кислорода уменьшается от 0 до -2; кислорода снижается. Таким образом, реакция магния с кислородом является окислительно-восстановительной реакцией.
Реакция, не являющаяся реакцией окисления-восстановления, не вызовет изменения степени окисления. Рассмотрим реакцию гидроксида натрия с соляной кислотой:
Под каждым элементом в уравнении мы написали его степень окисления. Поскольку каждый элемент имеет ту же степень окисления в продуктах, что и в реагентах, мы знаем, что эта реакция нейтрализации не является реакцией окисления-восстановления.
Пример Для следующих реакций определите: (1) Является ли это окислительно-восстановительной? (2) Если да, то какой элемент окисляется, а какой восстанавливается? а. б. Если дунуть через соломинку в известковую воду, раствор станет молочный.С химической точки зрения, если углекислый газ пропускают через раствор гидроксида кальция в воде молочно-белый осадок кальция карбонатные формы: Решение Реакция а 1. Запишите степень окисления под каждым элементом в уравнении: 2. Изменяют ли элементы число окисления? Да, и хлор, и бром делаю.Следовательно, эта реакция является окислительно-восстановительной. 3. Степень окисления хлора изменяется от 0 до -1: хлор уменьшен. Степень окисления брома изменяется от -1 до 0: бром окисляется. Реакция б Под каждым элементом мы
записали его степень окисления. |
В окислительно-восстановительной реакции вещество, которое приобретает электроны, является
окислитель. Вещество, которое теряет электроны, является восстановителем. В
реакция магния с кислородом,
| 2 Mg(s) 0 теряет электроны окисляется до Mg 2+ является восстановителем | + | O 2 (g) 0 приобретает электроны восстанавливается до 2 O 2- является окислителем | 2 | Мг +2, | О -2 |
Пример При реакции натрия с хлором образуется хлорид натрия, который вещество является окислителем? Какой восстановитель? Решение Напишите уравнение реакции и присвойте степени окисления: Поскольку хлор меняет степень окисления с 0 на -1, он восстанавливается:
это окислитель. |
Характеристики окисления и восстановления приведены в таблице 8.4. Глава 14 более глубоко охватывает окислительно-восстановительные процессы. Наше обсуждение здесь является лишь введением.
| Вещество окисленное | Вещество восстановлено |
|---|---|
| теряет электроны | получает электроны |
| достигает более положительной степени окисления | достигает более отрицательной степени окисления |
| восстановитель | является окислителем |
Б. Реакции горения
Реакции горения
Реакции горения представляют собой особый тип окислительно-восстановительных реакций. Мы
правильно связывать реакции горения с горением. При обычном горении
реакция, элементы в реагирующем соединении соединяются с кислородом с образованием
оксиды, как при сгорании пропана с образованием углекислого газа и воды:
2 C 3 H 8 (л) + 10 O 2 (г) 6 CO 2 (г) + 8 H 2 O(л)
Рисунок 8.6 показано горение бензина в кислороде.
Вышеуказанные реакции происходят при наличии достаточного количества кислорода. При отсутствии достаточного снабжения кислородом вместо углекислого газа может образоваться монооксид углерода.
2 C 3 H 8 (л) + 7 O 2 (ж) 6 CO 2 (г) + 8 H 2 O(л)
РИСУНОК 8.6 Сжигание, как показано на примере сжигания резервуаров для хранения бензина. Горение бензина или других нефтепродуктов обычно сопровождается желтым пламенем и густым черным дымом. Горение бензина или других нефтепродуктов обычно сопровождается желтым пламенем и густым черным дымом. |
Пример Напишите сбалансированные уравнения полного сгорания в кислороде из:
Решение Обратите внимание, что физическое состояние этих веществ не указано. Они поэтому исключаются из уравнений. а. Напишите формулы реагентов серы и кислорода, а также продукт, SO 2 . б.Бутан содержит только углерод и водород и сгорание полное,
так продукты двуокись углерода, и вода. Четыре атома углерода слева дают четыре молекулы углекислого газа справа. Десять атомов водорода слева дают 5 молекул воды справа, для которого требуется тринадцать атомов кислорода (6 1/2 молекул) слева. Чтобы написать уравнение, используя только целые числа молекул, мы должны умножьте на 2, чтобы получить: в. Этиловый спирт содержит углерод, водород и кислород. Продукция полного сгорания будет углекислый газ и вода. Первоначальная балансировка дает два атома углерода слева, две молекулы углекислого газа справа; шесть атомов кислорода справа, 3 1/2 молекулы кислорода слева: Умножаем на 2, чтобы очистить дробь и получить сбалансированное уравнение.  |
Идентификация окислителей и восстановителей
НЕФТЯНАЯ ВЫШКА
Окисление можно определить (с точки зрения переноса электронов) как потерю электронов частицами
Редукция может быть определена как приобретение электронов видом
Окислитель (или акцептор электронов) сам должен восстанавливаться
Восстановитель (или донор электронов) сам должен окисляться
Действие как окислителя, так и восстановителя можно представить в виде полууравнения
Слайд 11
Идентификация окислителей и восстановителей
Пример
Образование оксида кальция (CaO)
2Ca(т) + O2(г) 2CaO(т)
Ca и O2 (реагенты): нейтральные атомы
Оксид кальция (продукт): ионное соединение
Ca2+ O2- ионы
Можно записать реакцию как две полуреакции:
2Са 2Са2+
О2 2О2-
Здесь кальций окисляется; я. е. он теряет электроны на кислород
е. он теряет электроны на кислород
Восстанавливает кислород
действует как восстановитель
Кислород снижен; то есть он получает электроны от кальция
Окисляет кальций
действует как окислитель
+ 4е-
+ 4е-
МАСЛО
буровая установка
Слайд 12
Пример
PbO(т) + CO(г) → Pb(т) + CO2(г)
Определите окислители и восстановители в следующей реакции:
+2
-2
+2
-2
0
+4
-2
Pb увеличивает O.Н. от +2 до 0
PbO восстанавливается; действует как окислитель
C уменьшает О.Н. от +2 до +4
CO окисляется; действует как восстановитель
Шаг 1: Присвоение степеней окисления:
PbO(т) + CO(г) → Pb(т) + CO2(г)
Шаг 2: Напишите половинные уравнения:
Этап 3: Определение окислителей и восстановителей:
Слайд 13
Вопросы
Определите окислители и восстановители и запишите полуреакции в
.
следующее:
(в) 4Fe +3O2 2Fe2O3
Ответ: Fe Fe3+ + 3e-
О2 + 4е- 2О2-
O2 : окислитель Fe: восстановитель
(б) Si + 2F2 SiF4
Ответ: Si Si4+ + 4e-
F2 + 2e- 2F-
F2 : окислитель Si : восстановитель
(а) Cl2 + 2NaBr 2NaCl + Br2
Ответ: 2Br— Br2 + 2e-
Cl2 + 2e- → 2Cl-
Cl2 : окислитель Br- : восстановитель
Слайд 14
Балансировка окислительно-восстановительных уравнений
Пример
Сбалансируйте уравнение, показывающее окисление ионов Fe2+ до ионов Fe3+ ионами дихромата (Cr2O72-) в кислой среде
Fe2+ + Cr2O72- Fe3+ + Cr3+
Шаг 1: Определите окислители и восстановители и запишите полуреакции
Fe2+ : +2
Cr2O72- : 2Cr + 7(-2) = -2
2Cr = 12
Кр = +6
Fe3+ : +3
Кр3+ : +3
Fe2+ → Fe3+
Железо теряет один электрон, т. е.е. он окисляется. Он отдает один электрон дихромату, т. е. является восстановителем.
е.е. он окисляется. Он отдает один электрон дихромату, т. е. является восстановителем.
1 2 3 4 5 6 7 8
Вопрос о химическом окислении | Wyzant Спросите эксперта
Итак, прежде чем решать эту задачу, мы должны понять используемые термины:
- Окисленное химическое вещество: или окисление – это процесс, при котором вещество теряет один или несколько электронов, даже если элемент, соединение или ион имеют статус
- Восстановленное химическое вещество: или восстановление — это процесс, при котором вещество приобретает один или несколько электронов.
- Окислительно-восстановительная реакция (окислительно-восстановительная реакция) — это любой процесс, при котором электроны передаются от одного вещества к другому.
- Окислитель: это вещество, которое вызывает окисление, получает один или несколько электронов, подвергается восстановлению, при этом степень окисления атомов уменьшается
- Восстановитель: это вещество, которое вызывает восстановление, теряет один или несколько электронов, подвергается окислению, и его степень окисления атома увеличивается.

Итак, глядя на это уравнение, мы сначала должны убедиться, что оно уравновешено (предполагая, что мы сбалансированы), в противном случае нам пришлось бы уравновешивать его, добавляя электроны по обе стороны уравнения и т. д.Далее мы должны пройти окислительно-восстановительные правила:
- Атом в своем элементарном состоянии имеет степень окисления 0.
- Атом в одноатомном ионе имеет степень окисления, идентичную его заряду
- Атом в многоатомном ионе или в молекулярном соединении обычно имеет такую же степень окисления, как если бы он был одноатомным ионом
- Водород может быть отрицательным или положительным
- Кислород обычно имеет степень окисления -2
- Галогены обычно имеют степень окисления -1
- Сумма степеней окисления равна 0 для нейтрального соединения и равна суммарному заряду многоатомного иона.

Теперь давайте разобьем наше основное уравнение на два отдельных уравнения:
Na (s) —> NA+ (aq) это похоже на A—> A+ (окисление) O заряд —-> +1 заряд
Ag+ (водн.) —> Ag (s) аналогично A+—>A (восстановление) +1 заряд ——> O заряд
Применение правил, указанных выше, к первому уравнению ; я вижу, что мой Na находится в своем природном элементе (твердом) и, таким образом, имеет степень окисления, равную нулю, но теряет электрон и становится более положительным в водном растворе и, таким образом, подвергается окислению и вызывает восстановление.В моем втором уравнении я начинаю с более положительного и заканчиваю с нулевым зарядом, таким образом, я получаю электроны и становлюсь «более отрицательным», что вызывает окисление и восстанавливается.
Таким образом, Na подвергается окислению и, следовательно, является моим восстановителем, поскольку в целом вызывает восстановление.
Это означает, что мой Ag подвергается восстановлению и, следовательно, является моим окислителем, потому что в целом вызывает окисление.
Другой способ взглянуть на эту проблему — использовать стандартные восстановительные потенциалы, в которых используются те же концепции для окислительно-восстановительных реакций.В связи с этим два составленных нами уравнения будут иметь вид:
Ag+ (водн.) + e- —> Ag (тв)
Na+ (водн.) + e- —-> Na (тв)
Таким образом, моим окислителем является Ag, потому что это чрезвычайно сильный окислитель, потому что мы идем в предисловии (благоприятном) направлении. Однако во втором уравнении мы идем в обратном направлении, поэтому Na является более сильным восстановителем (слабым окислителем). При взгляде на стандартную таблицу потенциалов восстановления, поскольку Ag находится выше Na, Ag может окислять только те, которые ниже его, и в этом случае Na находится ниже, и, поскольку Na находится внизу диаграммы, он может восстанавливать только те, которые выше него, которые дело обстоит именно так (эту таблицу можно увидеть в любом учебнике химии для справки).
Уравновешивание окислительно-восстановительных реакций методом изменения степени окисления
У вас есть окислительно-восстановительное уравнение, которое вы не знаете, как сбалансировать? Помимо простой балансировки рассматриваемого уравнения, эти программы также дадут вам подробный обзор всего процесса балансировки с выбранным вами методом. 2+
2+
Почему химические уравнения должны быть сбалансированы?
Сбалансированное химическое уравнение точно описывает количества реагентов и продуктов химических реакций. Закон сохранения массы гласит, что масса не создается и не разрушается в ходе обычной химической реакции.Это означает, что химическое уравнение должно иметь одинаковое количество атомов каждого элемента в обеих частях уравнения. Также сумма зарядов на одной стороне уравнения должна быть равна сумме зарядов на другой стороне. Когда эти два условия выполняются, говорят, что уравнение уравновешено.
Руководство по балансировке окислительно-восстановительных уравнений
- Шаг 1. Напишите несбалансированное уравнение
- Шаг 2.
 Разделить процесс на полуреакции
Разделить процесс на полуреакции- а) Присвойте степени окисления каждому атому
- b) Определите и запишите все окислительно-восстановительные пары в реакции .
- c) Объединить эти окислительно-восстановительные пары в две полуреакции
- Шаг 3.Сбалансируйте атомы в каждой полуреакции
- а) Сбалансируйте все остальные атомы, кроме Н и О
- b) Сбалансировать заряд с H + или OH —
- c) Сбалансируйте атомы кислорода с H 2 O
- Шаг 4: Сделать прирост электронов равным потере электронов в полуреакциях
- Шаг 5: Сложите полуреакции вместе
- Шаг 6: Упростите уравнение
- Наконец, проверьте баланс элементов и зарядов
Примеры окислительно-восстановительных уравнений
Форма ионного и молекулярного уравнений
Когда уравнение записывается в молекулярной форме, программа будет иметь проблемы с балансировкой атомов в парциальных уравнениях окисления и восстановления (Шаг 3.




 Бром можно получить, пропуская через раствор газообразный хлор.
бромида натрия. Уравнение этой реакции:
Бром можно получить, пропуская через раствор газообразный хлор.
бромида натрия. Уравнение этой реакции: Ни один из этих номеров не изменился в течение
реакция: реакция не является окислительно-восстановительной.
Ни один из этих номеров не изменился в течение
реакция: реакция не является окислительно-восстановительной. Потому что натрий меняет степень окисления
от 0 до +1 окисляется; это восстановитель.
Потому что натрий меняет степень окисления
от 0 до +1 окисляется; это восстановитель. Несбалансированное уравнение
это:
Несбалансированное уравнение
это:

 Разделить процесс на полуреакции
Разделить процесс на полуреакции