Основания (гидроксиды) — Справочник химика 21
Нейтрализация слабой кислоты (уксусной) с и л ь ным основанием (гидроксидом натрия) [c.248]Нейтрализация сильной кислоты (азотной) слабым основанием (гидроксидом аммония) [c.248]
Гидроксиды щелочных металлов МеОН — кристаллические вещества, растворимые в воде и спиртах. Их водные растворы — едкие щелочи — самые сильные основания. Гидроксиды получают электролизом водных растворов хлоридов . При этом в катодном пространстве выделяется водород и образуется гидроксид щелочного металла. Побочными продуктами производства являются водород и хлор (на аноде). При нейтрализации растворов гидроксидов щелоч- [c.116]
В качестве титрантов для определения кислот применяют неорганические и органические основания, ацетаты и алкоголя-ты щелочных металлов, амины и т. д. Наиболее сильными основными титрантами в неводных растворах являются четвертичные аммониевые основания — гидроксиды тетраметил-, тетраэтил- и тетрабутиламмония и их производные.

Примеры сильных оснований гидроксиды щелочных металлов (LiOH, NaOH, КОН и др.). Их называют также щелочами. Гидроксиды щелочноземельных металлов (Са(ОН) , Ba(OH) и др.) тоже можно считать сильными основаниями. Их растворимость меньше, чем растворимость гидроксидов щелочных металлов, но намного больше растворимости гидроксидов остальных металлов. [c.126]
Оксид магния MgO — тоже основной оксид. Он малорастворим в воде, но ему соответствует основание — гидроксид магния Mg(0H)2, который можно получить из MgO косвенным путем. [c.30]
При нейтрализации слабого основания — гидроксида аммония— сильной кислотой в растворе тоже устанавливаются два равновесия [c.255]
Раствор хлорида натрия нейтрален и имеет pH = 7,0. Это понятно, поскольку хлорид натрия-соль сильного основания (гидроксида натрия) и сильной (хлористоводородной) кислоты, а когда такие вещества взяты в равных количествах, они должны полностью нейтрализовать друг друга.
Название оснований (гидроксидов металлов) состоит из слова «гидроксид» — названия гидроксильного остатка и названия металла, из которого образован ион металла, в родительном падеже. [c.139]
Как основание гидроксид натрия сильнее, чем гидроксид кальция. Однако равновесие реакции сдвинуто вправо из-за образования нерастворимого карбоната кальция. Щелочи идут на приготовление электролитов щелочных аккумуляторов, на производство мыла, красок, целлюлозы.
Выделение связанного аммиака осуществимо только при химической обработке воды растворами сильных оснований гидроксида кальция или натрия. [c.190]
[c.190]
Основания Гидроксид аммония С/С С/С С/С С/С с/с с/с СИ О-Н/0 со С/С [c.214]
Значительное изменение кислотности или основности раствора оказывает влияние на растворимость почти всех солей. Однако это влияние заметно только в тех случаях, когда один или оба иона, из которых состоит соль, обладают достаточно сильными кислотными или основными свойствами. Как мы только что убедились, гидроксиды металлов являются наглядным примером соединений, в состав которых входит сильное основание, гидроксид-ион. В качестве другого примера рассмотрим СаРз, куда [c.128]
Примеры слабых оснований гидроксиды остальных металлов (Fe(OH)j, u(OH) , Al(OH),, и др), а также вода. [c.126]
Большинство основных оксидов с водой не взаимодействуют, 0 им также соответствуют основания (гидроксиды), которые можно получить косвенным путем. Например, не взаимодействующим с водой оксиду марганца (И) и оксиду марганца (П1) соответствуют гидроксиды Мп(0Н)2 и Мп(0Н)з. [c.28]
[c.28]
Названия оснований (гидроксидов) образуются так же, как и оксидов. Например, Са(0Н)2 — гидроксид кальция, Ре(0Н)2 — гидроксид железа (И), Ре (ОН) з — гидроксид железа (1И). [c.29]
Основания (гидроксиды) наиболее активных металлов можно получить либо путем непосредственного взаимодействия металла с водой
Если данный атом проявляет различную положительную валентность, то указанные выше свойства гидроксидов сохраняются. Так, гидроксид двухвалентного марганца есть основание гидроксид четырехвалентного марганца амфотерен гидроксиды шести- и семивалентного марганца — кислоты. [c.98]
Выделяющийся водород воспламеняется. В результате реакции получаются сильные основания — гидроксид натрия или гидроксид калия. Загоревшиеся натрий и калий нельзя тушить водой [c.145]
Следовательно, в водных растворах самая сильная кислота — ионы гидроксония и самое сильное основание — гидроксид-ионы. [c.50]
[c.50]
Составим уравнение электролитической диссоциации однокислотного основания гидроксида калия КОН [c.188]
Составим уравнения электролитической диссоциации слабого двухкислотного основания — гидроксида железа (II) Ре(ОН)а. [c.188]
Подобно другим основаниям, гидроксид кальция является щелочным и едким веществом. [c.282]
Оснбены.чи называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами. Основным оксидам отвечают основания. Например, оксиду кальция СаО отвечает основание гидроксид кальция Са(0Н)2 оксиду кадмия dO — гидроксид кадмия d(0H)2- [c.31]
Ионные основа ния, такие, как гидроксид натрия NaOH и гидроксид калия КОН, — сильные основания, т. е. их растворы содержат только катионы и ионы ОН. Однако концентрация ионов ОН в растворе иногда ограничена низкой растворимостью основания. Пример такого основания — гидроксид магния Mg(0H)2- [c. 427]
427]
Основными оксидами называются такие, которые прн взаимодействии с кислотами образуют соль и воду. Соединения этих оксидов с водой относятся к классу оснований (гидроксидов). Примерами основных оксидов могут служить NasO, СаО, ВаО, которым соответствуют основания (гидроксиды) NaOH, Са(0И)2 и Ва(0Н)2. [c.27]
При взаимодействии оксида натрия ЫагО с водой образуется сильное основание — гидроксид натрия NaOH. Проставим в химической формуле гидроксида натрия над [c.131]
Положения протолитической теории приложимы к кислотноосновным равновесиям в растворах комплексных соединений. Под влиянием координации могут существенно изменяться свойства центральных атомов и лигандов. Это отчетливо проявляется при координации водородсодержащих веществ, например воды, аммиака, метиламина Nh3—СНз, этиламина Nh3—С2Н5. В водном растворе аммиак образует основание — гидроксид аммония [c.389]
Различаются между собой и гидроксиды этой группы гидроксид бериллия Ве(ОН)г — амфотерное основание, гидроксид магния Mg (ОН) 2 — слабое основание [хотя диссоциирует сильнее, чем такие слабые основания, как, например, 2п(0Н)г, А1(0Н)з], гидроксиды кальция, стронция, бария и радия — сильные основания.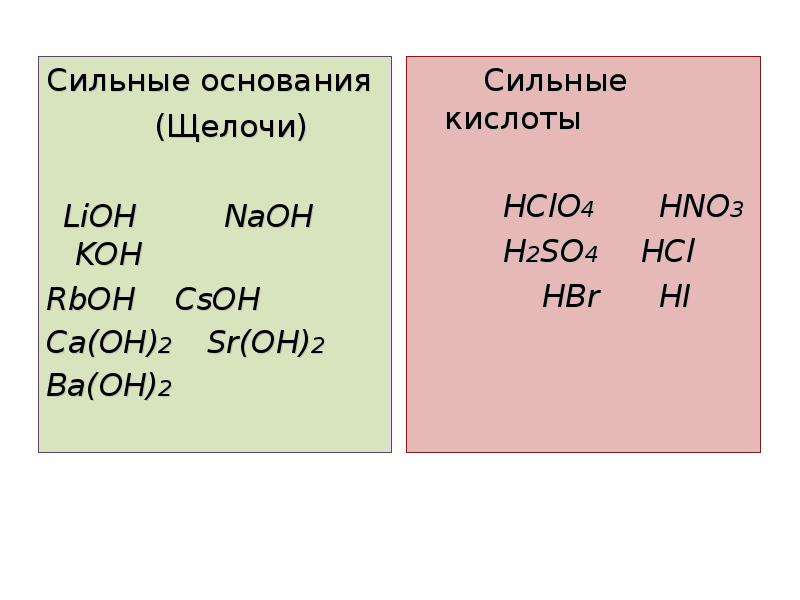
Решение. 1. Соль NaHSOg образована сильным основанием (гидроксидом натрия) и слабой (сернистой) кислотой. В этом случае гидролизу подвергается аиион слабой кислоты [c.65]
Пример 4. Требуется вычислить pH сантимолярного раствора гидроксида натрия. Гидратированные ионы натрия представляют собой очень слабую катионную кислоту (см. табл. 3) и практически на pH раствора не влияют. Последний зависит от присутствующего сильного основания — гидроксид-ионов
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (И) и сильная хлороводородная кислота H I. Однако степень гидролиза по второй ступени намного меньше, чем по первой стушзни. [c.212]
Водородные соединения неметаллов характеризуются различным отношением к воде.
 Метан и силан в воде плохо растворимы. Аммиак и фосфин при растворении в воде образуют слабые основания — гидроксид аммоиия Nh5OH и гидроксид фосфония РН4ОН. [c.330]
Метан и силан в воде плохо растворимы. Аммиак и фосфин при растворении в воде образуют слабые основания — гидроксид аммоиия Nh5OH и гидроксид фосфония РН4ОН. [c.330]Необратимый гидролиз солей
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.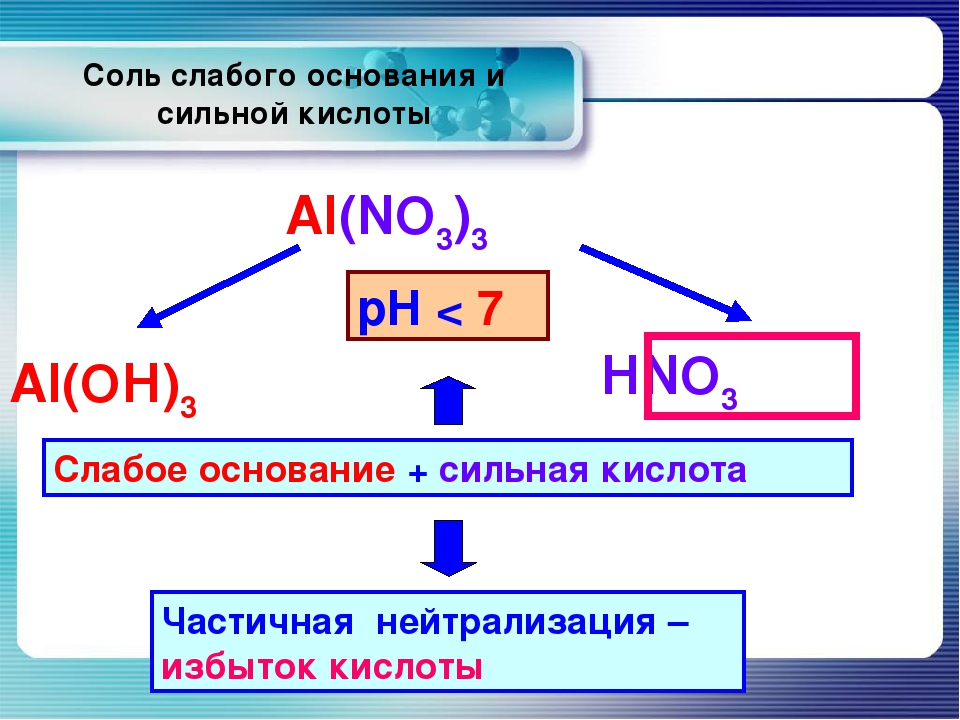
Чтобы получить подробное описание элемента, кликните по его названию.
Что такое буферный раствор? Использование буферного раствора
Один буферный раствор это смесь, используемая для предотвращения изменения pH или pOH среды при добавлении сильных кислот или сильных оснований.
Есть два типа буферного раствора:
1. Смесь слабой кислоты с ее сопряженным основанием;
2. Смесь слабого основания с его конъюгированной кислотой.
Давайте посмотрим на примеры каждого из них и на то, как они работают при добавлении небольшого количества сильной кислоты или основания в среду:
1. Смесь слабой кислоты с сопряженным с ней основанием:
Для образования такого раствора слабую кислоту смешивают с солью того же аниона, что и кислота.
Например, рассмотрим буферный раствор, состоящий из уксусной кислоты (H3CCOOH(здесь)) и ацетат натрия (H3CCOONa(s)). Обратите внимание, что оба имеют ацетат-анион: (H3CCOO—(здесь)). Концентрация этих ионов практически обусловлена большой диссоциацией соли. Кислотная ионизация мала.
Обратите внимание, что оба имеют ацетат-анион: (H3CCOO—(здесь)). Концентрация этих ионов практически обусловлена большой диссоциацией соли. Кислотная ионизация мала.
Теперь обратите внимание, что происходит при следующих возможностях добавления:
- Добавление небольшого количества сильной кислоты:
Добавление сильной кислоты увеличивает концентрацию иона гидроксония H
3О+1, а поскольку уксусная кислота является слабой кислотой, ацетат-анион имеет высокое сродство к протону (H+) гидроксоний. Таким образом они вступают в реакцию и образуется больше уксусной кислоты:В результате pH среды практически не меняется. Однако, если добавляется все больше и больше сильной кислоты, наступит время, когда весь ацетат-анион будет израсходован, и эффект буферизации прекратится.
- Добавление небольшого количества прочного основания:
Добавление сильного основания увеличивает концентрацию ионов ОН. —. Но эти ионы нейтрализуются ионами H3О+1 выделяется при ионизации уксусной кислоты:
—. Но эти ионы нейтрализуются ионами H3О+1 выделяется при ионизации уксусной кислоты:
При этой реакции концентрация ионов H3О+1(здесь) будет уменьшаться, и произойдет сдвиг в равновесии в смысле увеличения кислотной ионизации, и, следовательно, изменение pH раствора будет очень небольшим. Концентрация ионов H3О+1(здесь) он будет практически постоянным.
В этом случае также есть ограничение по емкости. Следовательно, если мы будем добавлять все больше и больше основания, баланс ионизации кислоты будет все больше и больше сдвигаться в сторону ее ионизации, пока не будет израсходована вся кислота.
2. Смесь слабого основания с его конъюгированной кислотой:
Этот тип буферного раствора состоит из слабого основания и раствора соли, которые содержат тот же катион, что и основание.
Например, рассмотрим буферный раствор, образованный гидроксидом магния, MgOH. 2 (водн.) (слабое основание) и хлорид магния, MgCl2 (с) (соль). Оба содержат катион магния (Mg2+(здесь)). Практически все ионы магния, присутствующие в среде, образуются в результате диссоциации соли, поскольку диссоциация основания слабая:
2 (водн.) (слабое основание) и хлорид магния, MgCl2 (с) (соль). Оба содержат катион магния (Mg2+(здесь)). Практически все ионы магния, присутствующие в среде, образуются в результате диссоциации соли, поскольку диссоциация основания слабая:
- Добавление небольшого количества сильной кислоты:
В этом случае ионы H3О+1 поступающие из-за добавления сильной кислоты будут нейтрализованы ионами ОН—, происходящие из-за слабой диссоциации оснований. Это сместит базовый баланс диссоциации вправо.
Таким образом, изменение pH (если оно есть) будет очень небольшим, потому что концентрация ионов OH— остается постоянным. Эффект буферизации прекратится, когда вся основа будет диссоциирована.
- Добавление небольшого количества прочного основания:
Добавленное сильное основание подвергается диссоциации, высвобождая ионы OH.—. Поскольку гидроксид магния является слабым основанием, магний, высвобождающийся при диссоциации из соли, будет иметь большую тенденцию реагировать с ОН.—:
Поскольку гидроксид магния является слабым основанием, магний, высвобождающийся при диссоциации из соли, будет иметь большую тенденцию реагировать с ОН.—:
Следовательно, увеличение количества ионов ОН— компенсируется пропорциональным увеличением Mg (OH)2 (водн.). В результате pH не претерпевает серьезных изменений.
Этот эффект заканчивается, когда весь катион магния израсходован.
Дженнифер Фогача
Окончила химический факультет
Источник: Бразильская школа — https://brasilescola.uol.com.br/quimica/o-que-uma-solucao-tampao.htm
Гидроксиды металлов главных подгрупп. Задачи 1006
Гидроксиды металлов главной подгруппы 2-й группы
Задача 1006.
Как и почему изменяются основные свойства гидроксидов металлов главной подгруппы II группы в ряду Ве(ОН)2 — Ва(ОН)2?
Решение:
Подобная закономерность обусловлена увеличением в группе радиусов ионов при постоянном их заряде за счёт прибавления электронных слоев следует увеличение радиуса атома и иона. Ве(ОН)2 — амфотерный гидроксид, Mg(OH)2 — слабое нерастворимое основание, Ca(OH)2 — основание (щелочь), Sr(OH)2 — сильное основание (щелочь), Ва(ОН)2 – сильное основание (щелочь).
Ве(ОН)2 — амфотерный гидроксид, Mg(OH)2 — слабое нерастворимое основание, Ca(OH)2 — основание (щелочь), Sr(OH)2 — сильное основание (щелочь), Ва(ОН)2 – сильное основание (щелочь).
Это можно объяснить с использованием схем Косселя. Схема Косселя описывает кислотно-основные свойства соединений, содержащих связи Э—Н и Э—О—Н, в зависимости от заряда ядра и радиуса образующего их элемента. Рассмотрим схему для Ве(ОН)2 и Ва(ОН)2:
Рис. 1. Схема Косселя для Mg(ОН)2 и Ва(ОН)2
Как видно из представленной схемы, радиус иона Mg2+ меньше радиуса иона Ba2+ и ОН− – группа связана прочнее с катионом бария, чем с катионом магния. В результате Ва(ОН)2 будет легче диссоциировать в растворе и основные свойства гидроксида бария будут выражены сильнее, чем гидроксида магния.
Диагональное сходство бериллия и алюминия
Задача 1007.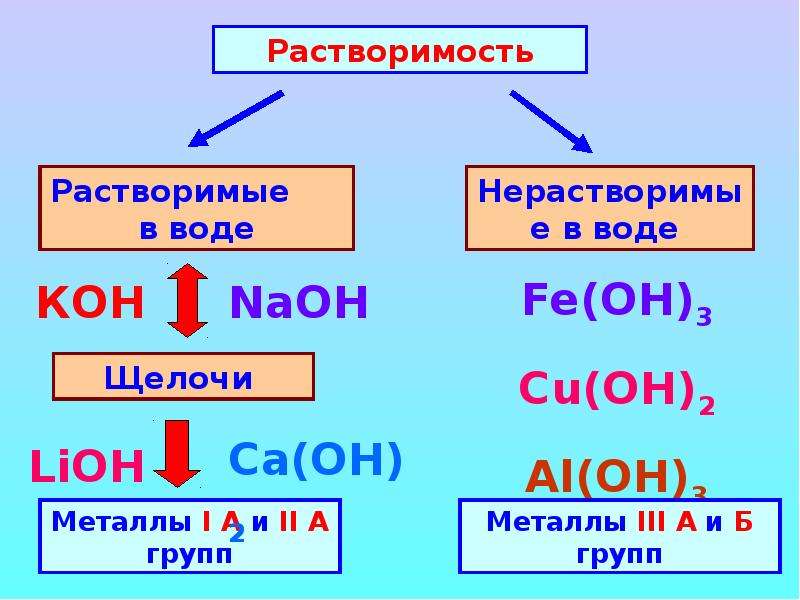
В чем проявляется сходство химических свойств бериллия и алюминия? Чем объясняется это сходство?
Решение:
По своим химическим свойствам бериллий в значительной степени сходен с алюминием (бериллий и алюминий являются амфотерными элементами), находящимся в третьем периоде и в третьей группе периодической системы, т. е. правее и ниже бериллия. Это явление, носящее название диагонального сходства, наблюдается не только у бериллия и алюминия, но так же у лития и магния, натрия и кальция. У бериллия и у алюминия ионные потенциалы Z/R, где Z – заряд иона, R – радиус иона, следует ожидать близкие значения. Действительно, ионные потенциалы для ионов бериллия и алюминия, будут равны 2/0,34 = 5,88 и 3/0,51 = 5,88. Близость ионных потенциалов приводит к близким свойствам самих соединений. При близких значениях ионных потенциалов следует ожидать примерно одинакового поляризующего действия катионов на однотипные анионы.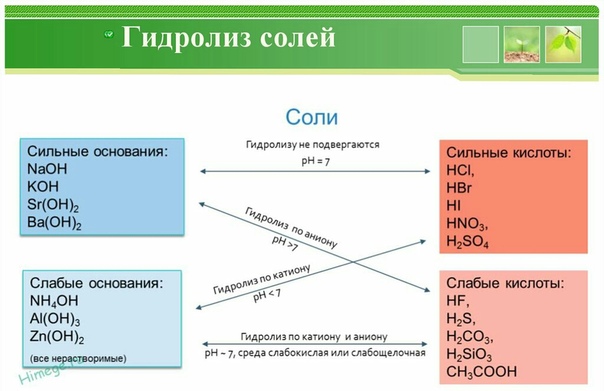 В этом случае физико-химические характеристики разных соединений могут оказаться близкими. Энтальпии образования характеристических оксидов ВеО -598 кДж/моль и Al2O3 -1676,8 кДж/моль, металлические свойства обеих элементов близки (бериллий и алюминий при хранении на воздухе покрываются плотной оксидной плёнкой и др.).
В этом случае физико-химические характеристики разных соединений могут оказаться близкими. Энтальпии образования характеристических оксидов ВеО -598 кДж/моль и Al2O3 -1676,8 кДж/моль, металлические свойства обеих элементов близки (бериллий и алюминий при хранении на воздухе покрываются плотной оксидной плёнкой и др.).
Щелочами называют сложные соединения. Гидроксиды. Термическая устойчивость оснований
Основания (гидроксиды) – сложные вещества, молекулы которых в своём составе имеют одну или несколько гидрокси-групп OH. Чаще всего основания состоят из атома металла и группы OH. Например, NaOH – гидроксид натрия, Ca(OH) 2 – гидроксид кальция и др.
Существует основание – гидроксид аммония, в котором гидрокси-группа присоединена не к металлу, а к иону NH 4 + (катиону аммония). Гидроксид аммония образуется при растворении аммиака в воде (реакции присоединения воды к аммиаку):
NH 3 + H 2 O = NH 4 OH (гидроксид аммония).
Валентность гирокси-группы – 1. Число гидроксильных групп в молекуле основания зависит от валентности металла и равно ей. Например, NaOH, LiOH, Al (OH) 3 , Ca(OH) 2 , Fe(OH) 3 и т.д.
Все основания – твёрдые вещества, которые имеют различную окраску. Некоторые основания хорошо растворимы в воде (NaOH, KOH и др.). Однако большинство из них в воде не растворяются.
Растворимые в воде основания называются щелочами. Растворы щелочей «мыльные», скользкие на ощупь и довольно едкие. К щелочам относят гидроксиды щелочных и щелочноземельных металлов (KOH, LiOH, RbOH, NaOH, CsOH, Ca(OH) 2 , Sr(OH) 2 , Ba(OH) 2 и др.). Остальные являются нерастворимыми.
Нерастворимые основания – это амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью ведут себя, как кислоты.
Разные основания отличаются разной способностью отщеплять гидрокси-группы, поэтому признаку они делятся на сильные и слабые основания.
Сильные основания в водных растворах легко отдают свои гидрокси-группы, а слабые – нет.
Химические свойства оснований
Химические свойства оснований характеризуются отношением их к кислотам, ангидридам кислот и солям.
1. Действуют на индикаторы . Индикаторы меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. В нейтральных растворах – они имеют одну окраску, в растворах кислот – другую. При взаимодействии с основаниями они меняют свою окраску: индикатор метиловый оранжевый окрашивается в жёлтый цвет, индикатор лакмус – в синий цвет, а фенолфталеин становится цвета фуксии.
2. Взаимодействуют с кислотными оксидами с образованием соли и воды:
2NaOH + SiO 2 → Na 2 SiO 3 + H 2 O.
3. Вступают в реакцию с кислотами, образуя соль и воду. Реакция взаимодействия основания с кислотой называется реакцией нейтрализации, так как после её окончания среда становится нейтральной:
2KOH + H 2 SO 4 → K 2 SO 4 + 2H 2 O.
4. Реагируют с солями, образуя новые соль и основание:
2NaOH + CuSO 4 → Cu(OH) 2 + Na 2 SO 4.
5. Способны при нагревании разлагаться на воду и основной оксид:
Cu(OH) 2 = CuO + H 2 O.
Остались вопросы? Хотите знать больше об основаниях?
Чтобы получить помощь репетитора – .
Первый урок – бесплатно!
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Гидроксиды щелочных металлов – при обычных условиях представляют собой твердые белые кристаллические вещества, гигроскопичные, мылкие на ощупь, очень хорошо растворимы в воде (их растворение – экзотермический процесс), легкоплавки. Гидроксиды щелочноземельных металлов Са(ОН) 2 , Sr(OH) 2 , Ва(ОН) 2) – белые порошкообразные вещества, гораздо менее растворимы в воде по сравнению с гидроксидами щелочных металлов. Нерастворимые в воде основания обычно образуются в виде гелеобразных осадков, разлагающихся при хранении. Например, Сu(ОН) 2 – синий студенистый осадок.
3.1.4 Химические свойства оснований.
Свойства
оснований обусловлены наличием ионов
ОН – . В свойствах щелочей и нерастворимых в
воде оснований имеются отличия, однако
общим свойством является реакция
взаимодействия с кислотами. Химические
свойства оснований представлены в
таблице 6.
В свойствах щелочей и нерастворимых в
воде оснований имеются отличия, однако
общим свойством является реакция
взаимодействия с кислотами. Химические
свойства оснований представлены в
таблице 6.
Таблица 6 – Химические свойства оснований
Щелочи | Нерастворимые основания |
Все основания реагируют с кислотами (реакция нейтрализации ) | |
2NaOH + H 2 SО 4 = Na 2 SО 4 + 2H 2 О | Сr(ОН) 2 + 2НС1 = СrС1 2 + 2Н 2 O |
Основания реагируют с кислотными оксидами с образованием соли и воды: 6КОН + Р 2 O 5 = 2К 3 РO 4 + 3Н 2 O | |
Щелочи реагируют с растворами солей , если один из продуктов реакции выпадает в осадок (т. е. если образуется нерастворимое соединение): CuSO 4 + 2KOH = Cu(OH) 2 + K 2 SO 4 Na 2 SO 4 + Ba(OH) 2 = 2NaOH + BaSO 4 | Нерастворимые в воде основания и амфотерные гидроксиды разлагаются при нагревании на соответствующий оксид и воду: Мn(ОН) 2 МnО + Н 2 O Сu(ОН) 2 СuО + Н 2 O |
Щелочи
можно обнаружить индикатором. | |
3.1.5 Важнейшие основания.
NaOH – едкий натр, каустическая сода. Легкоплавкие (t пл = 320 °С) белые гигроскопичные кристаллы, хорошо растворимы в воде. Раствор мылкий на ощупь и является опасной едкой жидкостью. NaOH – один из важнейших продуктов химической промышленности. В больших количествах требуется для очистки нефтепродуктов, широко применяется в мыловаренной, бумажной, текстильной и других отраслях промышленности, а также для производства искусственного волокна.
КОН – едкое кали. Белые гигроскопичные кристаллы, хорошо растворимы в воде. Раствор мылкий на ощупь и является опасной едкой жидкостью. СвойстваКОН аналогичны свойствам NaOH, но применяется гидроксид калия гораздо реже ввиду его более высокой стоимости.
Са(ОН) 2 – гашеная
известь. Белые кристаллы, мало растворимы
в воде. Раствор называется «известковой
водой», суспензия – «известковым
молоком». Известковая вода применяется
для распознавания углекислого газа,
она мутнеет при пропускании СO 2 .
Гашеная известь широко используется в
строительном деле в качестве основы
для изготовления вяжущих веществ.
Известковая вода применяется
для распознавания углекислого газа,
она мутнеет при пропускании СO 2 .
Гашеная известь широко используется в
строительном деле в качестве основы
для изготовления вяжущих веществ.
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое pH раствора, какими общими свойствами обладают кислоты и основания.
Как металлы и неметаллы, кислоты и основания — это разделение веществ по схожим свойствам. Первая теория кислот
и оснований принадлежала швецкому учёному Аррениусу. Кислота по Аррениусу — это класс веществ, которые
в реакции с водой диссоциируют (распадаются), образовывая катион водорода H + . Основания Аррениуса в водном растворе образуют
анионы OH — . Следующая теория в 1923 году была предложена учёными Бренстедом и Лоури. Теория Бренстеда-Лоури
определяет кислотами вещества, способные в реакции отдавать протон (протоном в реакциях называют катион водорода). Основания,
соответственно, — это вещества, способные принять протон в реакции. Актуальная на данный момент теория — теория Льюиса.
Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя
аддукты Льюиса (аддукт — это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
Актуальная на данный момент теория — теория Льюиса.
Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя
аддукты Льюиса (аддукт — это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила справедливы для кислот и оснований.
Диссоциация
Диссоциация – это процесс распада вещества на ионы в растворах или расплавах. Например, диссоциация соляной кислоты — это распад HCl на H + и Cl — .
Свойства кислот и оснований
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется
газ.
Часто используемые кислоты:
H 2 O, H 3 O + , CH 3 CO 2 H, H 2 SO 4 , HSO 4 − , HCl, CH 3 OH, NH 3
Часто используемые основания:
OH − , H 2 O, CH 3 CO 2 − , HSO 4 − , SO 4 2− , Cl −
Сильные и слабые кислоты и основания
Сильные кислоты
Такие кислоты, которые полностью диссоциируют в воде, производя катионы водорода H + и анионы. Пример сильной кислоты — соляная кислота HCl:
HCl (р-р) + H 2 O (ж) → H 3 O + (р-р) + Cl — (р-р)
Примеры сильных кислот: HCl, HBr, HF, HNO 3 , H 2 SO 4 , HClO 4
Список сильных кислот
Слабые кислоты
Растворяются в воде только частично, например, HF:
HF (р-р) + h3O (ж) → h4O + (р-р) + F — (р-р) — в такой реакции более 90% кислоты не диссоциирует:
=Сильную и слабую кислоту можно различить измеряя проводимость растворов: проводимость зависит от количества ионов, чем сильнее кислота тем она более диссоциирована, поэтому чем сильнее кислота тем выше проводимость.
Список слабых кислот
- HF фтороводородная
- H 3 PO 4 фосфорная
- H 2 SO 3 сернистая
- H 2 S сероводородная
- H 2 CO 3 угольная
- H 2 SiO 3 кремниевая
Сильные основания
Сильные основания полностью диссоциируют в воде:
NaOH (р-р) + H 2 O ↔ NH 4К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены, щёлочноземельные металлы) группы.
Список сильных оснований
- NaOH гидроксид натрия (едкий натр)
- KOH гидроксид калия (едкое кали)
- LiOH гидроксид лития
- Ba(OH) 2 гидроксид бария
- Ca(OH) 2 гидроксид кальция (гашеная известь)
Слабые основания
В обратимой реакции в присутствии воды образует ионы OH — :
NH 3 (р-р) + H 2 O ↔ NH + 4 (р-р) + OH — (р-р)Большинство слабых оснований — это анионы:
F — (р-р) + H 2 O ↔ HF (р-р) + OH — (р-р)Список слабых оснований
- Mg(OH) 2 гидроксид магния
- Fe(OH) 2 гидроксид железа (II)
- Zn(OH) 2 гидроксид цинка
- NH 4 OH гидроксид аммония
- Fe(OH) 3 гидроксид железа (III)
Реакции кислот и оснований
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и основания, результирующий раствор будет нейтральным.
Пример:
H 3 O + + OH — ↔ 2H 2 OСлабое основание и слабая кислота
Общий вид реакции:
Слабое основание (р-р) + H 2 O ↔ Слабая кислота (р-р) + OH — (р-р)Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства основания:
HX (р-р) + OH — (р-р) ↔ H 2 O + X — (р-р)Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
Диссоциация воды
Диссоциация — это распад вещества на составляющие молекулы. Свойства кислоты или основания зависят от равновесия, которое присутствует в воде:
H 2 O + H 2 O ↔ H 3 O + (р-р) + OH — (р-р)
K c = / 2
Константа равновесия воды при t=25°: K c = 1.83⋅10 -6 , также имеет место следующее равенство: = 10 -14 , что называется константой диссоциации воды.Для чистой воды = = 10 -7 , откуда -lg = 7.0.
Данная величина (-lg) называется pH — потенциал водорода. Если pH кислотные свойства, если pH > 7, то вещество имеет основные свойства.
Способы определения pH
Инструментальный метод
Специальный прибор pH-метр — устройство, трансформирующее концентрацию протонов в растворе в электрический сигнал.
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора, используя несколько индикаторов можно добиться достаточно точного результата.
Соль
Соль — это ионное соединение образованное катионом отличным от H + и анионом отличным от O 2- . В слабом водном растворе соли полностью диссоциируют.
Что бы определить кислотно-щелочные свойства раствора соли , необходимо определить, какие ионы присутствуют в растворе и рассмотреть их свойства: нейтральные ионы, образованные из сильных кислот и оснований не влияют на pH: не отдают ионы ни H + , ни OH — в воде.
Например, Cl — , NO — 3 , SO 2- 4 , Li + , Na + , K + .
Анионы, образованные из слабых кислот, проявляют щелочные свойства (F — , CH 3 COO — , CO 2- 3), катионов с щелочными свойствами не существует.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного основания, в основном состоят из:
- Смесь слабой кислоты, соответствующей соли и слабого основания
- Слабое основание, соответствующая соль и сильная кислота
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание с соответствующей солью, при этом необходимо учесть:
- Интервал pH в котором буфферный раствор будет эффективен
- Ёмкость раствора — количество сильной кислоты или сильного основания, которые можно добавить не повлияв на pH раствора
- Не должно происходить нежелаемых реакций, которые могут изменить состав раствор
Тест:
Ещё со школы нам известно, что основаниями называют соединения, где атомы металла связаны с одной или несколькими гидроксогруппами — KOH, Ca(OH) 2 и т.
п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса). мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания (гидроксиды) — это вещества или частицы, способные принимать (отщеплять) протон от кислоты. Согласно такому определению, свойства основания зависят от свойств — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
H 2 SO 4 + H 2 O ⇄ HSO 4 — + H 3 O + (катион гидроксония)
H 2 SO 4 + CH 3 COOH ⇄ HSO 4 — + CH 3 COOH 2 +
Номенклатура оснований
Названия оснований образуются весьма просто — сначала идёт слово «гидроксид», а затем название металла, который входит в данное основание. Если металл имеет переменную валентность, это отражают в названии.
KOH — гидроксид калия
Ca(OH) 2 — гидроксид кальция
Fe(OH) 2 — гидроксид железа (II)
Fe(OH) 3 — гидроксид железа (III)Существует также основание NH 4 OH (гидроксид аммония), где гидроксогруппа связана не с металлом, а катионом аммония NH 4 + .
Классификация оснований
Основания можно классифицировать по следующим признакам:
- По растворимости основания делят на растворимые — щёлочи (NaOH, KOH) и нерастворимые основания (Ca(OH) 2 , Al(OH) 3).
- По кислотности (количеству гидроксогрупп) основания делят на однокислотные (KOH, LiOH) и многокислотные (Mg(OH 2), Al(OH) 3).
- По химическим свойствам их делят на оснóвные (Ca(OH) 2 , NaOH) и амфотерные , то есть проявляющие как основные свойства, так и кислотные (Al(OH) 3 , Zn(OH) 2).
- По силе (по степени диссоциации) различают:
а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH) 2 , малорастворимый Ca(OH) 2 .
б) слабые (αСила оснований
Для оснований можно количественно выразить их силу, то есть способность отщеплять протон от кислоты. Для этого используют константу основности K b — константу равновесия для реакции между основанием и кислотой, причём в качестве кислоты выступает вода.
ПолучениеЧем выше значение константы основности, тем выше сила основания и тем сильнее его способность отщеплять протон. Также вместо самой константы часто используют показатель константы основности pK b . Например, для аммиака NH 3 имеем:
Взаимодействие активного металла с водой:
2Na + 2H 2 O → 2NaOH + H 2
Ca + 2H 2 O → Ca(OH) 2 + H 2
Mg + 2H 2 O Mg(OH) 2 + H 2
Взаимодействие основных с водой (только для щелочных и щелочноземельных металлов):
Na 2 O + H 2 O → 2NaOH,
CaO + H 2 O → Ca(OH) 2 .
Промышленным способом получения щелочей является электролиз растворов солей:
2NaCI + 4H 2 O 2NaOH + 2H 2 + CI 2
Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения:
Na 2 SO 4 + Ba(OH) 2 → 2NaOH + BaSO 4
MgSO 4 + 2NaOH → Mg(OH) 2 + Na 2 SO 4.
Физические свойства
Все основания являются твердыми веществами, имеющими различную окраску.
В воде нерастворимы, кроме щелочей.
Внимание! Щёлочи являются очень едкими веществами. При попадании на кожу растворы щелочей вызывают сильные долгозаживающие ожоги, при попадании в глаза могут вызвать слепоту. При работе с ними следует соблюдать технику безопасности и пользоваться индивидуальными средствами защиты.
Внешний вид оснований. Слева направо: гидроксид натрия, гидроксид кальция, метагидроксид железа
Химические свойства
Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид – ионов ОН — .
Изменение цвета индикаторов:
фенолфталеин – малиновый
лакмус – синий
метиловый оранжевый – желтый
Фенолфталеин придаёт раствору щёлочи малиновую окраску
Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
2KOH + H 2 SO 4 → K 2 SO 4 + 2H 2 O,
растворимое
Mg(OH) 2 + 2HCI → MgCI 2 + 2H 2 O.
нерастворимое
Взаимодействие с кислотными :
2KOH + SO 3 → K 2 SO 4 + H 2 O
Взаимодействие с амфотерными и гидроксидами:
а) при плавлении:
2NaOH + AI 2 O 3 → 2NaAIO 2 + H 2 O,
NaOH + AI(OH) 3 → NaAIO 2 + 2H 2 O.
б) в растворе:
2NaOH + AI 2 O 3 +3H 2 O → 2Na,
NaOH + AI(OH) 3 → Na.
Взаимодействие с некоторыми простыми веществами (амфотерными металлами, кремнием и другими):
2NaOH + Zn + 2H 2 O → Na 2 + H 2
2NaOH + Si + H 2 O → Na 2 SiO 3 + 2H 2
Взаимодействие с растворимыми солями с образованием осадков:
2NaOH + CuSO 4 → Cu(OH) 2 + Na 2 SO 4 ,
Ba(OH) 2 + K 2 SO 4 → BaSO 4 + 2KOH.
Малорастворимые и нерастворимые основания разлагаются при нагревании:
Ca(OH) 2 → CaO + H 2 O,
Cu(OH) 2 → CuO + H 2 O.
Знаете ли вы?
Органические молекулы, которые разлагаются в течение миллионов лет в отсутствие света и кислорода, сохраняют только свой углеводородный скелет.
Сырая нефть, например, представляет собой смесь молекул, содержащих только углерод и водород, в то время как уголь включает некоторое количество других элементов. Хотя молекулы, присутствующие в угле и нефти, заметно отличаются по своей химической структуре, у них есть общая особенность: они не содержат функциональных групп!
Нерастворимое основание: гидроксид медиОснования — называют электролиты, в растворах которых отсутствуют анионы, кроме гидроксид-ионов (анионы — это ионы, которые имеют отрицательный заряд, в данном случае — это ионы OH -). Названия оснований состоят из трёх частей: слова гидроксид , к которому добавляют название металла (в родительном падеже). Например, гидроксид меди (Cu(OH) 2). Для некоторых оснований могут используются старые названия, например гидроксид натрия (NaOH) — натриевая щелочь .
Едкий натр , гидроксид натрия , натриевая щелочь , каустическая сода — всё это одно и тоже вещество, химическая формула которого NaOH.
Безводный гидроксид натрия — это белое кристаллическое вещество. Раствор — прозрачная жидкость, на вид ничем не отличимая от воды. При использовании будьте осторожны! Едкий натр сильно обжигает кожу!
В основу классификации оснований положена их способность растворяться в воде. От растворимости в воде зависят некоторые свойства оснований. Так, основания , растворимые в воде, называют щелочью . К ним относятся гидроксиды натрия (NaOH), гидроксид калия (KOH), лития (LiOH), иногда к их числу прибавляют и гидроксид кальция (Ca(OH) 2)), хотя на самом деле — это малорастворимое вещество белого цвета (гашенная известь).
Получение оснований
Получение оснований и щелочей может производиться различными способами. Для получения щелочи можно использовать химическое взаимодействие металла с водой. Такие реакции протекают с очень большим выделением тепла, вплоть до воспламенения (воспламенение происходит по причине выделения водорода в процессе реакции).

2Na + 2H 2 O → 2NaOH + H 2
Негашенная известь — CaOCaO + H 2 O → Ca(OH) 2
Но в промышленности эти методы не нашли практического значения, конечно кроме получения гидроксида кальция Ca(OH) 2 . Получение гидроксида натрия и гидроксида калия связано с использованием электрического тока. При электролизе водного раствора хлорида натрия или калия на катоде выделяются водород, а на аноде — хлор , при этом в растворе, где происходит электролиз, накапливается щелочь !
KCl + 2H 2 O →2KOH + H 2 + Cl 2 (эта реакция проходит при пропускании электрического тока через раствор).
Нерастворимые основания осаждают щелочами из растворов соответствующих солей.
CuSO 4 + 2NaOH → Cu(OH) 2 + Na 2 SO 4
Свойства оснований
Щелочи устойчивы к нагреванию. Гидроксид натрия можно расплавить и расплав довести до кипения, при этом он разлагаться не будет. Щелочи легко вступают в реакцию с кислотами, в результате которого образуется соль и вода.
Эта реакция ещё носит название — реакция нейтрализации
KOH + HCl → KCl + H 2 O
Щёлочи взаимодействуют с кислотными оксидами, в результате которой образуется соль и вода.
2NaOH + CO 2 → Na 2 CO 3 + H 2 O
Нерастворимые основания , в отличии от щелочей, термически не стойкие вещества. Некоторые из них, например, гидроксид меди , разлагаются при нагревании,
Cu(OH) 2 + CuO → H 2 O
другие — даже при комнатной температуре (например, гидроксид серебра — AgOH).Нерастворимые основания взаимодействуют с кислотами, реакция происходит лишь в том случае, если соль, которая образуется при реакции, растворяется в воде.
Cu(OH) 2 + 2HCl → CuCl 2 + 2H 2 O
Растворение щелочного металла в воде с изменение цвета индикатора на ярко-красныйЩелочные металлы — такие металлы, которые при взаимодействии с водой образуют щелочь . К типичному представителю щелочных металлов относится натрий Na. Натрий легче воды, поэтому его химическая реакция с водой происходит на её поверхности.
Активно растворяясь в воде, натрий вытесняет из неё водород, при этом образуя натриевую щелочь (или гидроксид натрия) — едкий натр NaOH. Реакция протекает следующим образом:
2Na + 2H 2 O → 2NaOH + H 2
Подобным образом ведут себя все щелочные металлы. Если перед началом реакцией в воду добавить индикатор фенолфталеин, а затем опустить в воду кусочек натрия, то натрий будет скользить по воде, оставляя за собой ярко розовый след образовавшейся щелочи (щелочь окрашивает фенолфталеин в розовый цвет)
Гидроксид железа
Гидроксид железа является основанием. Железо, в зависимости от степени его окисления, образует два разных основания: гидроксид железа, где железо может иметь валентности (II) — Fe(OH) 2 и (III) — Fe(OH) 3 . Как и основания, образованные большинством металлов, оба основания железа не растворимы в воде.
Гидроксид железа (II) — белое студенистое вещество (осадок в растворе), которое обладает сильными восстановительными свойствами.
К тому же, гидроксид железа (II) очень не стойкий. Если к раствору гидроксида железа (II) добавить немного щёлочи, то выпадет зелёный осадок, который достаточно быстро темнеет о превращается в бурый осадок железа (III).
Гидроксид железа (III) имеет амфотерные свойства, но кислотные свойства у него выражены значительно слабее. Получить гидроксид железа (III) можно в результате химической реакции обмена между солью железа и щёлочью. Например
Fe 2 (SO 4) 3 + 6 NaOH → 3 Na 2 SO 4 +2 Fe(OH) 3
I Гидроксид магния является сильным основанием II Химический класс гидроксидов 11 CBSE
Подсказка: Ответ на этот вопрос в основном основан на понятии растворимости, где, как правило, более щелочное соединение будет более растворимым, но в случае щелочных и щелочноземельных металлов прочность гидроксидов возрастает, и в этом кроется ответ. Полное решение:
Мы изучили основные понятия в главах химии, посвященных растворимости, а также тому, как измерять силу и основность соединений.
Теперь мы увидим изменение данного утверждения в вопросе и выведем требуемый ответ.
— Щелочи являются основной, ионной солью щелочного металла и также могут быть названы основаниями, растворяющимися в воде.
— Основания — это соединения, способные принимать протоны или соединения, способные отдавать электроны.
— Здесь гидроксид магния представляет собой щелочь, но очень слабую щелочь и не растворяется полностью в воде, хотя растворенная часть считается сильным основанием из-за полной диссоциации его ионов..
— Полностью диссоциирует, но не полностью растворяется в воде, поэтому считается слабой щелочью.
— Щелочные металлы, такие как натрий, калий и т. д., и щелочноземельные металлы, такие как кальций, магний и т. д., являются сильными основаниями из-за их способности отдавать электроны гидроксильным группам и легко ионизироваться.
— Таким образом, гидроксид магния является сильным основанием, а гидроксиды большинства щелочных металлов и щелочноземельных металлов являются сильными основаниями.
Итак, правильный ответ — «Вариант А».
Примечание: Обратите внимание, что гидроксид магния производится в больших количествах из морской воды путем добавления гидроксида кальция, также называемого известковым молоком, и является основным сырьем, используемым в производстве металлического магния, а также в качестве огнезащитной добавки. . Этот пункт может помочь вам узнать о натуральном препарате, сделанном для гидроксида магния.
Вопрос #11c1a + пример
Если вы спрашиваете то, о чем, как мне кажется, вы спрашиваете, то вы имеете дело с реакцией нейтрализации .
Говорят, что реакция нейтрализации происходит, когда основание реагирует с кислотой с образованием соли и воды.
В вашем случае серная кислота , #»H»_2″SO»_4#, сильная кислота , будет реагировать с гидроксидом магния , #»Mg»(«OH»)_2#, слабая основания с образованием водного сульфата магния , #»MgSO»_4# и воды.
# «Mg» («OH»)_ (2(s)) + «H»_ 2″SO»_ (4(водн.)) -> «MgSO»_ (4(водн.)) + 2″H» _ 2″О»_((л))#
Теперь вы можете понять, почему это реакция нейтрализации , взглянув на результирующее ионное уравнение .(2-)#
Эти ионы водорода будут реагировать с анионами гидроксида и по существу нейтрализуют друг друга , поэтому это реакция нейтрализации.
В свою очередь, это сместит равновесие диссоциации гидроксида магния дальше к правильному , что, в свою очередь, приведет к образованию большего количества анионов гидроксида и растворению твердого вещества.
Катионы магния и сульфат-анионы являются ионами-спектаторами , потому что они существуют в виде ионов по обе стороны уравнения.(+) -> 2″H»_ 2″O»_((l)))цвет(белый)(a/a)|)))#
Теперь стоит отметить, что реакция нейтрализации на самом деле является частным случаем реакции двойного замещения .
Как известно, реакции двойного замещения включают обмен ионами между двумя соединениями. В этом случае катионы магния меняются местами с катионами водорода.
Антациды — IFFGD
Изжога, возникающая время от времени, является обычным явлением.Это вызвано обратным током (рефлюксом) часто кислого содержимого желудка в пищевод и обычно ощущается как жжение за грудиной.Антацидные препараты служат для нейтрализации желудочной кислоты после ее выделения. Эти все еще полезные агенты играют постоянную роль в лечении легкой, эпизодической изжоги и в качестве дополнения к рецептурным препаратам при более тяжелых заболеваниях. Они традиционны, дешевы, удобны и относительно безопасны, хотя и не лишены рисков, и могут возникать побочные эффекты.
Изжога при ГЭРБ
Изжога также является частым симптомом ГЭРБ или гастроэзофагеальной рефлюксной болезни. ГЭРБ является длительным состоянием. При ГЭРБ изжога или другие симптомы часты и постоянны.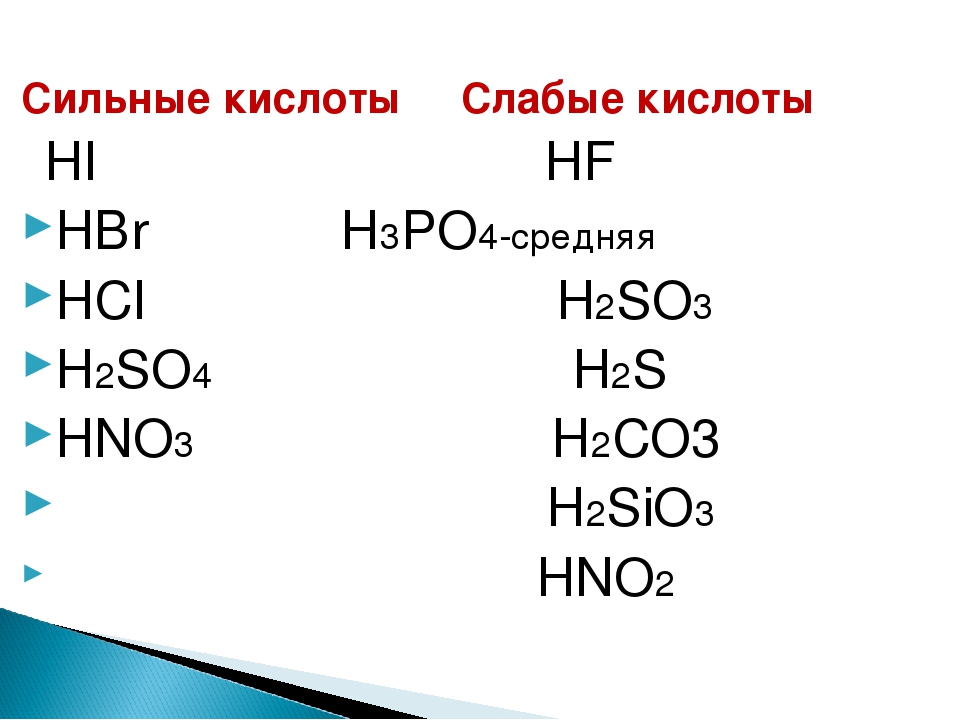 Основным подходом к лечению ГЭРБ является снижение кислотности желудка. Существуют мощные препараты, используемые для снижения секреции кислоты, в том числе антагонисты рецепторов гистамина2 (h3) и ингибиторы протонной помпы или ИПП.
Основным подходом к лечению ГЭРБ является снижение кислотности желудка. Существуют мощные препараты, используемые для снижения секреции кислоты, в том числе антагонисты рецепторов гистамина2 (h3) и ингибиторы протонной помпы или ИПП.
Узнайте больше о ГЭРБ
Что такое антациды?
Антациды — самые старые эффективные лекарства от изжоги.Мел (карбонат кальция) веками жевали, чтобы облегчить боль, и он до сих пор популярен.
Большинство коммерчески доступных антацидов представляют собой комбинации гидроксида алюминия и магния. Некоторые шипучие антациды содержат бикарбонат натрия, это старое домашнее средство от болей в животе, известное как «пищевая сода».
Некоторые антациды комбинируются с альгинатом [нерастворимым веществом, которое увеличивает поверхностное натяжение в жидкости] с образованием соединения, которое всплывает в желудочном соке для защиты пищевода от воздействия кислоты.
Таблетки антацида действуют медленно и обладают меньшей нейтрализующей способностью, чем жидкая форма антацида. Таблетки необходимо жевать, и они могут плохо взаимодействовать с желудочной кислотой. Для большинства удобство планшетов намного перевешивает эти небольшие недостатки.
Таблетки необходимо жевать, и они могут плохо взаимодействовать с желудочной кислотой. Для большинства удобство планшетов намного перевешивает эти небольшие недостатки.
На полках фармацевтов находится такое разнообразие коммерческих антацидов, что данное обсуждение будет сосредоточено на их основных ингредиентах (см. сопроводительную таблицу). Обратите внимание, что в качестве примеров приведены только несколько коммерческих препаратов.
Таблица: Основные антациды
| Антацид | Формула (1) | Нейтрализация Мощность | Нежелательные эффекты |
| Бикарбонат натрия | NaHCO 3 | низкий | Задержка жидкости, алкалоз |
| Гидроксид магния | Мг(ОН) 2 | высокий | Диарея, отравление магнием |
| Гидроксид алюминия | Ал(ОН) 3 | скромный | Запор, связывание лекарств или фосфатов (препятствует всасыванию) |
| Карбонат кальция | CaCO 3 | очень высокий | Отскок кислоты |
(1) Al= алюминий; Mg = магний; Са = кальций; Na = натрий
Компоненты антацида
Бикарбонат натрия [NaHCO3] – Бикарбонат натрия является слабым антацидом короткого действия. Хотя в целом это безопасное домашнее средство, его недостатком является высокое содержание натрия.
Хотя в целом это безопасное домашнее средство, его недостатком является высокое содержание натрия.
Вряд ли врачи рекомендуют «бикарбонат» или «пищевую соду», но они по-прежнему являются распространенным компонентом многих запатентованных лекарств. Бикарбонат обладает шипучим свойством, что объясняет коммерческую выживаемость комбинаций антацидов и обезболивающих, таких как Alka-Seltzer™ и Bromo-Seltzer™. Бикарбонат реагирует с соляной кислотой желудка с выделением углекислого газа (CO2), который быстро абсорбируется, но иногда вызывает удовлетворительную отрыжку.
Дисбаланс нормального уровня рН организма (системный алкалоз) может возникнуть в результате чрезмерного использования бикарбоната. Тем, кому требуется ограничение натрия из-за высокого кровяного давления или сердечных заболеваний, следует избегать бикарбоната.
Гидроксид магния [Mg(OH)2] – Гидроксид магния наиболее известен как магнезиальное молоко. Подобно цитрату магния или сульфату магния, он является эффективным слабительным.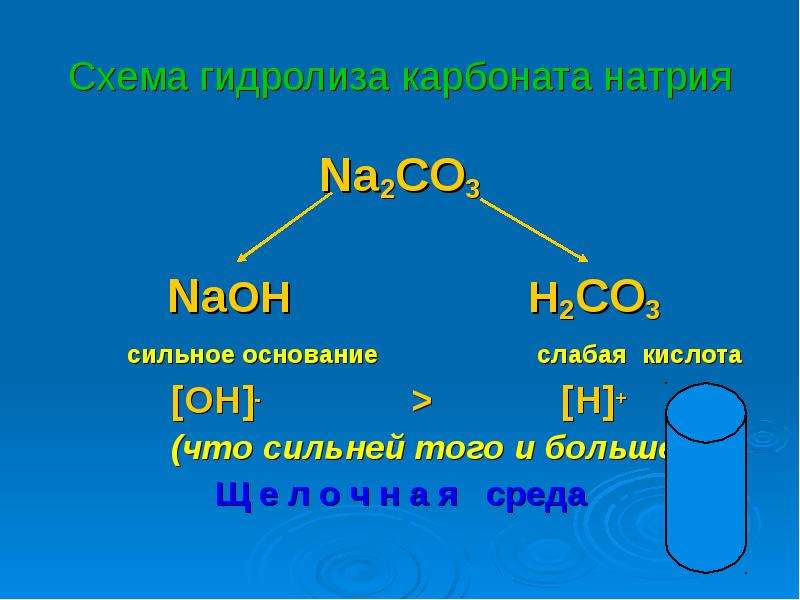 Если бы не склонность вызывать диарею, гидроксид магния был бы самым идеальным антацидом.Чтобы противостоять эффекту диареи, большинство производителей добавляют гидроксид алюминия, вызывающий запор. Комбинация существенно повышает цену, а добавление менее эффективного гидроксида алюминия снижает эффективность антацида.
Если бы не склонность вызывать диарею, гидроксид магния был бы самым идеальным антацидом.Чтобы противостоять эффекту диареи, большинство производителей добавляют гидроксид алюминия, вызывающий запор. Комбинация существенно повышает цену, а добавление менее эффективного гидроксида алюминия снижает эффективность антацида.
Гидроксид магния не всасывается в кишечнике. Однако его взаимодействие с желудочной кислотой приводит к образованию хлорида магния, который может усваиваться. Магний выполняет множество функций в клетках человека, в том числе в сердце, и может оказывать вредное воздействие, если его уровень в крови повышается.Это не проблема для человека со здоровыми почками, но следует избегать приема магния при наличии почечной недостаточности. Изжога, возникающая время от времени, является обычным явлением. Это вызвано обратным током (рефлюксом) часто кислого содержимого желудка в пищевод и обычно ощущается как жжение за грудиной.
Гидроксид алюминия [Al(OH)3] – По сравнению с гидроксидом магния гидроксид алюминия является слабым медленно действующим антацидом, и его кислотонейтрализующий эффект варьируется в зависимости от коммерческих продуктов.
Алюминий может защитить слизистую оболочку желудка от вредного воздействия алкоголя и других раздражителей. Гидроксид алюминия инактивирует пищеварительный фермент желудка пепсин. Однако основной причиной включения его в коммерческие антацидные препараты является противодействие диарейному эффекту магния.
Гидроксид алюминия имеет и другие применения. Он связывает фосфат в просвете кишечника с образованием нерастворимого фосфата алюминия, что полезно при почечной недостаточности, когда уровень фосфата в сыворотке аномально высок.Он также полезен для пациентов, склонных к образованию фосфатсодержащих камней в почках. Всасывается очень небольшое количество алюминия, и при его длительном применении для лечения почечной недостаточности может произойти повреждение головного мозга.
Хроническое чрезмерное употребление гидроксида алюминия может истощать запасы фосфатов в организме, вызывая метаболические заболевания костей (например, остеопороз, остеомаляцию) и риск спонтанных переломов, особенно у истощенных. Гидроксид алюминия может изменить всасывание некоторых лекарств [включая те, которые используются для лечения сердечных заболеваний или высокого кровяного давления], поэтому их не следует принимать одновременно.
Гидроксид алюминия может изменить всасывание некоторых лекарств [включая те, которые используются для лечения сердечных заболеваний или высокого кровяного давления], поэтому их не следует принимать одновременно.
Карбонат кальция [CaCO3] – Карбонат кальция (мел) является наиболее сильнодействующим антацидом. Он может полностью нейтрализовать желудочную кислоту. Тем не менее, это не всегда лучший выбор для регулярного использования.
- Около одной трети введенного кальция всасывается, а высокий уровень кальция в крови или кальцийсодержащие камни в почках представляют небольшой риск.
- Фосфаты, связанные с кальцием в кишечнике или костях, могут снижать содержание фосфора в сыворотке крови у некоторых пациентов с почечной недостаточностью.
- Системный алкалоз в результате длительного и агрессивного употребления редко вызывает метаболические последствия. [Алкалоз — это избыток основания (щелочи) в жидкостях организма. Это противоположно избытку кислоты (ацидозу).
 ]
]
Другим недостатком карбоната кальция может быть тенденция к восстановлению секреции желудочного сока после введения кальция.
Популярные антациды кальция в таблетках включают Tums™ и Titralac™. Доза не должна превышать 3 г в сутки.
Поговорите со своим врачом
Рекомендуется рассматривать любое вещество, которое вы принимаете для терапевтического воздействия , как лекарство.Расскажите об этом своему врачу.
Это применимо независимо от того, принимаете ли вы рецептурные или безрецептурные лекарства, травы или добавки. Помните, что даже «натуральные» добавки и травы могут взаимодействовать с другими веществами или иметь неожиданные и нежелательные побочные эффекты.
Мы рекомендуем проконсультироваться с квалифицированным медицинским работником, знакомым с вашими конкретными обстоятельствами, когда вы пытаетесь самостоятельно лечить хроническое или стойкое заболевание.
Как поговорить с врачом
Дополнительные компоненты
Мятный ароматизатор – Мятный ароматизатор является наиболее распространенным антацидным ароматизатором. Расслабляя нижний пищеводный сфинктер для выпуска газов, мята перечная способствует освобождению отрыжки после еды, отсюда и популярность послеобеденных мятных конфет.
Расслабляя нижний пищеводный сфинктер для выпуска газов, мята перечная способствует освобождению отрыжки после еды, отсюда и популярность послеобеденных мятных конфет.
Противометорологическое средство – Симетикон представляет собой поверхностно-активное вещество, которое, предположительно, разрушая пузырьки в кишечнике, делает газ доступным для всасывания. Несмотря на отсутствие доказательств эффективности, симетикон входит в состав некоторых популярных антацидных препаратов, что увеличивает их стоимость.
Альгиновая кислота – Изготовленный из ламинарии (морских водорослей), альгинат действует как физический кислотный барьер для пищевода при гастроэзофагеальном рефлюксе.Это не антацид. При приеме внутрь это безвкусное и, по-видимому, безвредное вещество плавает в желудочном соке, чтобы предотвратить рефлюкс кислоты и пепсина в пищевод. Такие препараты, как Gaviscon™ или Algicon™, сочетают альгинат с антацидами и являются популярными средствами от изжоги. Удовлетворительных клинических испытаний не проводилось, но эти препараты обладают малой нейтрализующей способностью и, вероятно, малоэффективны у пациентов с рефлюксом, у которых есть осложняющий эзофагит.
Удовлетворительных клинических испытаний не проводилось, но эти препараты обладают малой нейтрализующей способностью и, вероятно, малоэффективны у пациентов с рефлюксом, у которых есть осложняющий эзофагит.
Коммерческие антациды
Большинство коммерческих антацидов содержат два или более компонентов.Наиболее распространенными комбинациями являются различные концентрации гидроксида натрия и гидроксида алюминия. Некоторые широко разрекламированные бренды с дополнительными компонентами и с большей концентрацией эффективных ингредиентов, как правило, стоят дороже. Существуют и другие антациды, которые жертвуют эффективностью в угоду вкусу и приемлемости.
Пробел не позволяет подробно перечислить все продукты. Однако маркировка необходима, и, вооружившись вышеуказанной информацией, потребители должны иметь возможность выбрать продукт, наиболее соответствующий их потребностям.
Как принимать антациды
Большинство коммерческих антацидов поставляются с некоторыми инструкциями. Важно учитывать противопоказания и не превышать рекомендуемую суточную дозу.
Важно учитывать противопоказания и не превышать рекомендуемую суточную дозу.
Потребность в этих антацидах очень индивидуальна, и их регулярное использование должно осуществляться только по назначению врача. Общей рекомендацией является прием антацидов после еды и перед сном. На практике большинство пользователей учатся принимать антацид, когда у них появляются симптомы, например, изжога. Полезный метод заключается в том, чтобы предвидеть время появления симптомов, например, после острой пищи или перед сном, и принимать антацид перед этим.
Резюме и заключение
Антациды полезны для быстрого облегчения перемежающейся изжоги, особенно если она вызвана приемом пищи или различными видами деятельности. Антациды также помогают многим людям с вздутием живота или функциональной (неязвенной) диспепсией. Снижая кислотность желудка (повышая внутрижелудочный рН), антациды инактивируют пепсин и облегчают симптомы.
Безрецептурные препараты обеспечивают лишь временное облегчение симптомов. Они , а не предотвращают рецидив симптомов или позволяют заживлению поврежденного пищевода.Их следует , а не принимать регулярно в качестве заменителя рецептурных лекарств — они могут скрывать более серьезное заболевание.
Они , а не предотвращают рецидив симптомов или позволяют заживлению поврежденного пищевода.Их следует , а не принимать регулярно в качестве заменителя рецептурных лекарств — они могут скрывать более серьезное заболевание.
Если требуется регулярно в течение более двух недель, обратитесь к врачу для диагностики и соответствующего лечения.
Адаптировано из публикации IFFGD № 520 В. Гранта Томпсона, доктора медицины, FRCPC, почетного профессора медицины Университета Оттавы, Онтарио, Канада.
CHEMTUTOR КИСЛОТЫ И ОСНОВЫ
CHEMTUTOR КИСЛОТЫ И ОСНОВЫКИСЛОТЫ И ОСНОВАНИЯ
ЧТО ТАКОЕ КИСЛОТА ИЛИ ОСНОВАНИЕ?
По определению Сванте Аррениуса (Швеция) 1884 г., кислота – это материал
которые могут высвобождать протон или ион водорода (H + ). Хлористый водород в водном растворе ионизирует
и превращается в ионы водорода и ионы хлора. Если это так, то база,
или щелочь, представляет собой материал, который может отдавать гидроксид-ион (OH —).
Гидроксид натрия в водном растворе превращается в ионы натрия и гидроксид-ионы. Определение Аррениуса хорошо подходит для ограниченного использования. В большинстве случаев мы будем использовать определения Аррениуса.
Хлористый водород в водном растворе ионизирует
и превращается в ионы водорода и ионы хлора. Если это так, то база,
или щелочь, представляет собой материал, который может отдавать гидроксид-ион (OH —).
Гидроксид натрия в водном растворе превращается в ионы натрия и гидроксид-ионы. Определение Аррениуса хорошо подходит для ограниченного использования. В большинстве случаев мы будем использовать определения Аррениуса.
СВОЙСТВА КИСЛОТ
Для свойств кислот и оснований мы будем использовать определения Аррениуса.
Кислоты выделяют ион водорода в водный (водный) раствор .
Кислоты нейтрализуют основания в реакции нейтрализации . Кислота и основание соединяются, образуя соль и вода. Соль – это любое ионное соединение, которое может быть
образован анионом кислоты и катионом основания. Ион водорода кислоты и
гидроксид-ион основания объединяются с образованием воды.
Кислоты разъедают активные металлы .Даже золото, наименее активный металл, подвергается воздействию кислоты. смесь кислот, называемая «царской водкой» или «королевской жидкостью». Когда кислота реагирует с металлом он образует соединение с катионом металла и анионом кислоты и водорода газ.
Кислоты окрашивают синий лакмус в красный цвет . Лакмус является одним из многих органических соединения, меняющие окраску при изменении кислотности раствора при определенной температуре. точка. Лакмус – старейший из известных индикаторов pH.Он красный в кислоте и синий в база. Фраза «лакмусовая бумажка» указывает на то, что лакмусовая бумажка существует уже давно. время на английском языке. Лакмус не меняет цвет точно в нейтральная точка между кислотой и основанием, но очень близкая к ней. Лакмус часто пропитывают бумагу, чтобы сделать «лакмусовую бумагу».
Кислоты на вкус кислые . ДЕГУСТАЦИЯ ЛАБОРАТОРНЫХ КИСЛОТ НЕ РАЗРЕШЕНА НИ ОДНОЙ ШКОЛОЙ. Слово «зауэр» в
Немецкий означает «кислота» и произносится почти так же, как «кислый» в английском языке.(Квашеная капуста — это кислая капуста, капуста, консервированная в собственной ферментированной молочной кислоте.
Желудочная кислота – это соляная кислота. Хотя на вкус желудочная кислота неприятна, она имеет кислый привкус
кислота. Уксусная кислота является кислотным компонентом уксуса. Цитрусовые, такие как лимоны,
грейпфруты, апельсины и лаймы содержат в соке лимонную кислоту. Кислое молоко, сметана,
йогурт и творог содержат молочную кислоту в результате ферментации сахарной лактозы.
Слово «зауэр» в
Немецкий означает «кислота» и произносится почти так же, как «кислый» в английском языке.(Квашеная капуста — это кислая капуста, капуста, консервированная в собственной ферментированной молочной кислоте.
Желудочная кислота – это соляная кислота. Хотя на вкус желудочная кислота неприятна, она имеет кислый привкус
кислота. Уксусная кислота является кислотным компонентом уксуса. Цитрусовые, такие как лимоны,
грейпфруты, апельсины и лаймы содержат в соке лимонную кислоту. Кислое молоко, сметана,
йогурт и творог содержат молочную кислоту в результате ферментации сахарной лактозы.
СВОЙСТВА ОСНОВ
Основания выделяют ион гидроксида в водный раствор .
Основания нейтрализуют кислоты в реакции нейтрализации . Слово реакция:
Кислота плюс основание дают воду плюс соль.
Основания для денатурации белка . Это объясняет ощущение «скользкости» на руках. при воздействии на базу. Сильные основания, хорошо растворяющиеся в воде, такие как натрий или
калиевый щелок очень опасен, потому что большое количество структурного материала
человек состоит из белка. Серьезного повреждения плоти можно избежать, осторожно используя
сильные основания.
при воздействии на базу. Сильные основания, хорошо растворяющиеся в воде, такие как натрий или
калиевый щелок очень опасен, потому что большое количество структурного материала
человек состоит из белка. Серьезного повреждения плоти можно избежать, осторожно используя
сильные основания.
Основания превращают красный лакмус в синий . Это не означает, что лакмус является только кислотно-щелочной индикатор, но, вероятно, самый старый из них.
Основы имеют горький вкус . Существует очень мало пищевых материалов, которые являются щелочными, но те, которые имеют горький вкус. Еще более важно соблюдать осторожность при дегустации. Опять НЕТ ШКОЛА РАЗРЕШАЕТ ПОПРОБОВАТЬ ЛАБОРАТОРНЫЕ ХИМИКАТЫ. Дегустация основ более опасна, чем дегустация кислоты из-за свойства более сильных оснований денатурировать белок.
СИЛЬНЫЕ КИСЛОТЫ И СИЛЬНЫЕ ОСНОВАНИЯ
Обычные кислоты, которые почти на сто процентов ионизированы:
HNO 3 — азотная кислота
HCl — соляная кислота
H 2 SO 4 — серная кислота
HClO 4 — хлорная кислота
HClO 3 — хлористоводородная кислота бр. HBr — бромистоводородная кислота
HBr — бромистоводородная кислота
HI-йодистоводородная кислота
Кислоты в этом коротком списке называются сильными кислотами , потому что
количество кислоты качество раствора зависит от концентрации ионизированного
водороды.Вы вряд ли увидите много HBr или HI в лаборатории, потому что они
дорогой. Вы вряд ли увидите хлорную кислоту, потому что она может взорваться, если ее не обработать.
внимательно. Другие кислоты не полностью ионизированы и существуют в основном в неионизированной форме.
Неполностью ионизированные кислоты называются слабыми кислотами , потому что существует меньшая
концентрация ионизированного водорода в растворе. Не путайте это
терминология с концентрацией кислот.Различия в концентрации
вся кислота будет называться разбавленной или концентрированной .
Соляная кислота — это название промышленной соляной кислоты, которая часто
используется при отделке бетона.
В списке сильных кислот только серная кислота является двухосновной , потому что он имеет два ионизируемых водорода на формулу (или два моля ионизируемого водорода на моль кислоты).(Серная кислота ионизируется в два этапа. В первый раз ион водорода отщепляется от серной кислоты, действует как сильная кислота. Второй раз водород отщепляется от сульфат-иона, действует как слабая кислота.) другие кислоты в списке: моноосновная , имеющие только один ионизируемый протон на формулу. Фосфорная кислота, H 3 ПО 4 , является слабой кислотой. Фосфорная кислота имеет три иона водорода, способных ионизировать и теряют протон, поэтому фосфорная кислота трипротонная .Мы называем любую кислоту с двумя или более ионизируемыми атомами водорода полипротонной .
Точно так же есть краткий список сильных оснований, которые полностью ионизируются в
ионы гидроксида. Все основания металлов группы I и группы II
кроме бериллия и магния являются сильными основаниями. Гидроксиды лития, рубидия и цезия и франция не
часто используются в лаборатории, потому что они дороги. Основания металлов II группы,
кальций, барий и стронций являются сильными, но все эти основания имеют несколько ограниченное действие.
растворимость.Гидроксиды калия и натрия имеют общее название lye . Содовый щелок
(NaOH) и калийный щелок (KOH) являются общими названиями для различения этих двух соединений.
Все основания металлов группы I и группы II
кроме бериллия и магния являются сильными основаниями. Гидроксиды лития, рубидия и цезия и франция не
часто используются в лаборатории, потому что они дороги. Основания металлов II группы,
кальций, барий и стронций являются сильными, но все эти основания имеют несколько ограниченное действие.
растворимость.Гидроксиды калия и натрия имеют общее название lye . Содовый щелок
(NaOH) и калийный щелок (KOH) являются общими названиями для различения этих двух соединений.
LiOH — гидроксид лития
NaOH — гидроксид натрия
КОН — гидроксид калия
RbOH — гидроксид рубидия
CsOH — гидроксид цезия
FrOH — гидроксид франция
Mg(OH) 2 — гидроксид магния
Ca(OH) 2 — гидроксид кальция
Sr(OH) 2 — гидроксид стронция
Ba(OH) 2 — гидроксид бария
Основания металлов I группы все одноосновные . Основы
Все металлы II группы двухосновные . Гидроксид алюминия трехосновный .
Любой материал с двумя или более ионизируемыми гидроксильными группами будет называться многоосновным .
Основы
Все металлы II группы двухосновные . Гидроксид алюминия трехосновный .
Любой материал с двумя или более ионизируемыми гидроксильными группами будет называться многоосновным .
Запомните сильные кислоты и сильные основания. Другие кислоты или основания являются слабыми.
ОБЗОР pH
pH — это просто удобный способ показать, насколько кислой или щелочной является вода. решение есть.pH раствора представляет собой отрицательный логарифм концентрации ионов водорода. Концентрация ионов водорода обратно пропорциональна иону гидроксида. концентрация, и два из них, умноженные вместе, дают число 1 E-14. Таблица ниже показана взаимосвязь между этими измерениями в целых числах.
комментарии | [Н + ] | рН | рОН | [ОН — ] |
| очень низкопробный | Е-14 | 14 | 0 | E-0 |
| Е-13 | 13 | 1 | E-1 | |
| основание | Е-12 | 12 | 2 | E-2 |
| Е-11 | 11 | 3 | E-3 | |
| слегка цокольный | E-10 | 10 | 4 | Е-4 |
| E-9 | 9 | 5 | E-5 | |
| E-8 | 8 | 6 | E-6 | |
| НЕЙТРАЛЬНЫЙ | E-7 | 7 | 7 | E-7 |
| E-6 | 6 | 8 | E-8 | |
| E-5 | 5 | 9 | E-9 | |
| слабокислый | Е-4 | 4 | 10 | E-10 |
| E-3 | 3 | 11 | Е-11 | |
| кислота | E-2 | 2 | 12 | Е-12 |
| E-1 | 1 | 13 | Е-13 | |
| сильнокислотный | E-0 | 0 | 14 | Е-14 |
БЛОК pH
Коробка pH — это устройство для самоистязания, похожее на . Все четыре измерения
разные способы выражения одного и того же состояния. кВт воды,
константа диссоциации — натуральное число, поразительно близкое к 1 E-14. Это,
когда вы умножаете концентрацию ионов водорода [H + ] на концентрацию ионов гидроксида
[(OH) — ] в чистой воде при температуре, близкой к комнатной, число
1 Е-14. Если вы знаете [(OH) — ], вы знаете
[H + ] и наоборот.Эти два измерения не являются одной и той же шкалой, но это два разных измерения.
измерения одного и того же. pH — это просто отрицательный логарифм
[H + ] и pOH
просто отрицательный журнал [(OH) — ].
Последняя часть коробки — это соотношение между pH и pOH, и это
является самым легким. pH + pOH = 14, потому что это экспоненциальная форма
Уравнение кВт.
Все четыре измерения
разные способы выражения одного и того же состояния. кВт воды,
константа диссоциации — натуральное число, поразительно близкое к 1 E-14. Это,
когда вы умножаете концентрацию ионов водорода [H + ] на концентрацию ионов гидроксида
[(OH) — ] в чистой воде при температуре, близкой к комнатной, число
1 Е-14. Если вы знаете [(OH) — ], вы знаете
[H + ] и наоборот.Эти два измерения не являются одной и той же шкалой, но это два разных измерения.
измерения одного и того же. pH — это просто отрицательный логарифм
[H + ] и pOH
просто отрицательный журнал [(OH) — ].
Последняя часть коробки — это соотношение между pH и pOH, и это
является самым легким. pH + pOH = 14, потому что это экспоненциальная форма
Уравнение кВт.
Самая трудная часть работы с ящиком pH — это «перемалывание чисел». «Математика проще на научном
калькулятор. Только мазохист может подумать о том, чтобы пытаться выполнять вычисления вручную с
таблица журнала. Из-за большого количества различий между ручными калькуляторами существует
ограничить объем помощи, которая может быть оказана вам при работе с калькулятором, но есть несколько
советы, которым вы можете следовать.
«Математика проще на научном
калькулятор. Только мазохист может подумать о том, чтобы пытаться выполнять вычисления вручную с
таблица журнала. Из-за большого количества различий между ручными калькуляторами существует
ограничить объем помощи, которая может быть оказана вам при работе с калькулятором, но есть несколько
советы, которым вы можете следовать.
НАУЧНЫЙ КАЛЬКУЛЯТОР ДЛЯ ИСПОЛЬЗОВАНИЯ С ПРИБОРОМ pH
Калькулятор может быть несколько неудобен в математике поля pH.Возьмем пример использования коробки. Таблица pH перед полем pH упрощает вычисление целочисленного pH, но калькулятор лучше всего использовать на нецелые значения рН.
[H + ] = 2,75 E-6
Начните с [H + ] = 2,75 x 10 -6 .
Введите 2 . 7 5 EXP +/- 6 .Получить
рН, перфорация «логарифм» (не , а , натуральный логарифм). Дисплей показывает
-5,5607. pH — это отрицательный логарифм, поэтому он равен 5,5607, округленному до 5,6, но
вы оставляете -5,5607 на дисплее, чтобы продолжать обход коробки.
7 5 EXP +/- 6 .Получить
рН, перфорация «логарифм» (не , а , натуральный логарифм). Дисплей показывает
-5,5607. pH — это отрицательный логарифм, поэтому он равен 5,5607, округленному до 5,6, но
вы оставляете -5,5607 на дисплее, чтобы продолжать обход коробки.
рН = 5,5607
Нажмите + 1 4 = , чтобы добавить 14 к отрицательному pH. Это даст вам pOH 8,4393.
рОН = 8,4393
Нажмите кнопку «изменить знак», +/-. Это изменяет 8.4393 до -8,4393. Нам нужно получить антилог -8.4393, а этой функции нет то же самое на многих калькуляторах. Вы можете найти 2-й или INV или сдвиг или какую другую кнопку нажать перед логом. TI-30 SLR имеет ИНВ на кнопке. Нажмите INV, а затем «зарегистрируйтесь», чтобы получить [OH — ]. Ты может увидеть число вроде: 0,000,000,004 на вашем дисплее. Что ты сделал не так? Правильный ответ: 3,6364 Е-9.
[ОН — ] = 3. 6364 E-9
6364 E-9
Почему дисплей вам лжет? Это не так.
Цифры те же, но ваш калькулятор показал вам длинное
форма (потому что МОЖЕТ), которая представляет собой большое количество замещающих нулей и
одна значащая цифра. Калькулятор на самом деле имеет это число в своем
памяти до восьми, десяти или шестнадцати цифр, но он решил показать вам только одну
значащая цифра. Остальные цифры на дисплее можно увидеть, умножив
на EXP6 (1 EXP6) или EXP9 (1 EXP9), но если вы хотите продолжать обход коробки,
вам нужно разделить на то же число (с таким количеством значащих цифр, сколько вы
can), чтобы вернуть [OH — ].Или вы можете сохранить [OH — ]
номер, прежде чем взглянуть на него. На вашем калькуляторе должна быть кнопка с пометкой
STO или M+ или M1, которые сохранят ваш номер в памяти. Сделай это перед собой
посмотри на номер. Чтобы вернуть этот сохраненный номер, вы нажимаете RCL или M-. К
вернуться к исходному [H + ], перфорировать
в: 1 E +/- 1 4 RCL = . Вы должны увидеть свой старый добрый [H + ] из 2.75 E-6 на
отображать.
Вы должны увидеть свой старый добрый [H + ] из 2.75 E-6 на
отображать.
[H + ] = 2,75 E-6
Теперь для практики обойдите коробку pH в другую сторону.
Правила:
Чтобы получить pH из [H + ] или чтобы получить рОН из [ОН — ], используйте отрицательный лог.
Для перехода от [OH —] к pOH или от [H + ] к pH, используйте антилогарифм отрицательного числа.
Перейти от [H + ] до [OH — ] или обратно, сначала введите Kw, 1E-14 и разделите на единицу ты уходишь.
Чтобы перейти от pH к pOH или обратно, вычтите число у вас от 14.
Владение
Вычисления ящика pH требуют практики. Вы можете сделать свои собственные упражнения и проверить свои ответы, вернувшись к
тот же номер. Вы будете использовать расчеты ящика рН во многих
проблемы в этой кислотно-щелочной части.
ВЕРНУТЬСЯ НА ГЛАВНУЮ СТРАНИЦУ
Является ли гидроксид магния амфотерным? — Нинесс
Является ли гидроксид магния амфотерным? Гидроксид алюминия амфотерен. Подобно гидроксидам натрия или магния, он будет реагировать с кислотами.
Какой гидроксид является амфотерным? Гидроксиды металлов с высокозаряженными центральными атомами металла представляют собой амфотерный оксид или амфотерные гидроксиды. Некоторые металлы, такие как алюминий, цинк, олово, свинец и бериллий, могут образовывать амфотерные оксиды или гидроксиды.Эти гидроксиды будут образовывать амфотерные гидроксиды в зависимости от рН окружающих веществ.
Является ли гидроксид магния основанием или кислотой? Оксид магния на самом деле является кислотой, но гидроксид магния является основанием; так как большинство оксидов являются кислотами, а гидроксиды являются основаниями. Гидроксид магния является распространенным компонентом антацидов, таких как магнезиальное молоко, а также слабительных средств.
Какова природа гидроксида магния? Гидроксид магния представляет собой неорганическое соединение с химической формулой Mg(OH)2.Встречается в природе в виде минерала брусита. Это белое твердое вещество с низкой растворимостью в воде (Ksp = 5,61×10–12). Гидроксид магния является распространенным компонентом антацидов, таких как магнезиальное молоко.
В трендеКак управлять бешеным слоном?Является ли гидроксид магния амфотерным? – Часто задаваемые вопросы
Является ли оксид магния амфотерным оксидом?
Оксид магния представляет собой амфотерный оксид.
Является ли h4PO4 амфотерным?
Например, ваша фосфорная кислота (h4PO4) обычно не является амфотерной в водных растворах.
Что из перечисленного является амфотерным?
Оксид алюминия, оксид бериллия, оксид олова, оксид цинка — все они амфотерны.
Почему гидроксид магния называют основанием?
Гидроксид магния Mg(OH)2 является основанием из-за наличия ионов OH-. Кислоты образуют ионы H+ в воде, но гидроксид магния не будет, он образует ион OH-, так что это щелочь. Основание — это то, что может нейтрализовать кислоты.
Кислоты образуют ионы H+ в воде, но гидроксид магния не будет, он образует ион OH-, так что это щелочь. Основание — это то, что может нейтрализовать кислоты.
Является ли гидроксид магния сильным и слабым основанием?
– полностью диссоциирует, но не полностью растворяется в воде, поэтому считается слабой щелочью.– Следовательно, гидроксид магния является сильным основанием, а гидроксиды большинства щелочных и щелочноземельных металлов являются сильными основаниями.
Является ли гидроксид магния кислотным или основным по своей природе классом 7?
Ответ: Это база. Объяснение: гидроксид магния является основанием не из-за магния, а из-за ионов гидроксида.
Является ли гидроксид магния водным или твердым?
Гидроксид магния представляет собой неорганическое соединение с химической формулой Mg(OH)2. Встречается в природе в виде минерала брусита.Это белое твердое вещество с низкой растворимостью в воде (Ksp = 5,61×10–12).
Сколько атомов в гидроксиде магния?
В формульной единице Mg(OH)2 содержится один ион магния и два гидроксид-иона; или один атом магния, два кислорода и два атома водорода.
Какое основание представляет собой гидроксид магния?
Поскольку диссоциация этого небольшого количества растворенного гидроксида магния завершена, гидроксид магния считается сильным электролитом. Его низкая растворимость делает его слабым основанием.
Является ли гидроксид бериллия амфотерным?
Гидроксид бериллия, Be(OH)2, представляет собой амфотерный гидроксид, растворяющийся как в кислотах, так и в щелочах. В промышленности он производится как побочный продукт при извлечении металлического бериллия из руд берилла и бертрандита.
Какой оксид марганца является амфотерным?
Марганец находится в состоянии +4 в основном в двуокиси марганца, MnO2; степень окисления +4 является амфотерной, т. е. в состоянии +4 марганец может либо отдавать, либо принимать электроны в химических реакциях.
Какой оксид имеет амфотерный характер?
CaO является основным; CO2 кислый; SiO2 слабокислотный. SnO2 амфотерный.
Является ли ch4cooh амфотерным?
Этанол, метиламин и уксусная кислота являются амфотерными и в зависимости от условий реагируют либо как кислоты, либо как основания.
Является ли NaOH амфотерным?
Является ли NaOH амфотерным? Нет. Гидроксиды, оксиды щелочных металлов не проявляют амфотерных свойств. Следовательно, NaOH не является амфотерным соединением.
Является ли so4 амфотерным?
Следовательно, SO42- НЕ является амфотерным.Это просто нейтральный ион.
Сколько из следующих амфотерны?
Есть пять металлов, оксиды которых ведут себя как амфотерные. Это Be, Al, Zn, Sn и Pb. Какой из перечисленных металлов образует амфотерный оксид?
Что из перечисленного не является амфотерным оксидом?
ZnO является амфотерным оксидом, так как он является одновременно кислотой и основанием. Точно так же SnO, Al2O3 являются амфотерными оксидами. Однако Cu2O и CuO являются основными оксидами. Таким образом, Cu не дает амфотерного оксида.
Может ли гидроксид магния быть водным?
Гидроксид магния представляет собой нетоксичное неорганическое основание. Его водная суспензия известна как магнезиальное молоко, распространенный антацид. Формула и структура: Химическая формула гидроксида магния – Mg(OH)2, молярная масса – 58,32 г/моль. Он также доступен в виде водной суспензии в воде.
Формула и структура: Химическая формула гидроксида магния – Mg(OH)2, молярная масса – 58,32 г/моль. Он также доступен в виде водной суспензии в воде.
Будет ли гидроксид магния более или менее растворим в щелочном растворе?
Вопрос о том, является ли гидроксид магния сильным или слабым основанием, является предметом разногласий.Обычно его считают слабым основанием из-за низкой растворимости.
Является ли гидроксид магния кислотным по своей природе?
Гидроксид магния является основанием. Он имеет pH приблизительно 10.
В чем разница между кислотным и щелочным классом 7?
Любое соединение со значением pH от нуля до семи считается кислотным, тогда как значение pH от семи до четырнадцати является основанием. Кислоту называют донором протона, а основание — акцептором протона (Kolb, 1978).
Гидроксид магния в качестве нейтрализующего агента для растворов радиоактивной соляной кислоты
PDF-версия также доступна для скачивания.
ВОЗ
Люди и организации, связанные либо с созданием этого отчета, либо с его содержанием.
Что
Описательная информация, помогающая идентифицировать этот отчет.Перейдите по ссылкам ниже, чтобы найти похожие элементы в электронной библиотеке.
Когда
Даты и периоды времени, связанные с этим отчетом.
Статистика использования
Когда последний раз использовался этот отчет?
Взаимодействие с этим отчетом
Вот несколько советов, что делать дальше.
PDF-версия также доступна для скачивания.
Цитаты, права, повторное использование
Международная структура взаимодействия изображений
Распечатать / поделиться
Печать
Электронная почта
Твиттер
Фейсбук
Тамблер
Реддит
Ссылки для роботов
Полезные ссылки в машиночитаемом формате.
Архивный ресурсный ключ (ARK)
Международная структура совместимости изображений (IIIF)
Форматы метаданных
Картинки
URL-адреса
Статистика
Палмер, М. Дж. и Файф, К.В. Гидроксид магния как нейтрализатор радиоактивных растворов соляной кислоты,
отчет,
1 октября 1995 г.;
Нью-Мексико.
(https://digital.library.unt.edu/ark:/67531/metadc628392/:
по состоянию на 11 января 2022 г.), Библиотеки Университета Северного Техаса, цифровая библиотека ЕНТ, https://digital.library.unt.edu; зачисление отдела государственных документов библиотек ЕНТ.
Дж. и Файф, К.В. Гидроксид магния как нейтрализатор радиоактивных растворов соляной кислоты,
отчет,
1 октября 1995 г.;
Нью-Мексико.
(https://digital.library.unt.edu/ark:/67531/metadc628392/:
по состоянию на 11 января 2022 г.), Библиотеки Университета Северного Техаса, цифровая библиотека ЕНТ, https://digital.library.unt.edu; зачисление отдела государственных документов библиотек ЕНТ.
Является ли гидроксид лития слабой щелочью? – Легче с практикой.ком
Является ли гидроксид лития слабой щелочью?
Точно так же существует всего несколько сильных оснований: гидроксид лития (LiOH), гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид кальция (Ca[OH]2), гидроксид стронция (Sr[OH]2) и гидроксид бария (Ba[OH]2). Эти сильные кислоты и основания ионизируются на 100% в водном растворе.
Является ли LiOH слабым или сильным основанием?
LiOH является слабым основанием, потому что он более ковалентен из-за небольшого размера. Таким образом, они не могут легко выделять гидроксильные ионы в водных растворах, что является основной причиной основности.
Таким образом, они не могут легко выделять гидроксильные ионы в водных растворах, что является основной причиной основности.
Является ли LiOH щелочью?
Гидроксид лития представляет собой гидроксид щелочного металла.
Является ли CsOH щелочью?
Гидроксид цезия или гидроксид цезия (CsOH) представляет собой химическое соединение, состоящее из ионов цезия и ионов гидроксида. Это сильное основание (pKb=-1,76), очень похожее на другие гидроксиды щелочных металлов, такие как гидроксид натрия и гидроксид калия… Гидроксид цезия.
| Имена | |
|---|---|
| показать ИнЧИ | |
| показать УЛЫБКИ | |
| Свойства | |
| Химическая формула | CsOH |
Является ли литий гидроксидом?
Гидроксид лития представляет собой неорганическое соединение с формулой LiOH(h3O)n.И безводная, и гидратированная формы представляют собой белые гигроскопичные твердые вещества. Они растворимы в воде и слабо растворимы в этаноле. Хотя гидроксид лития классифицируется как сильное основание, он является самым слабым из известных гидроксидов щелочных металлов.
Они растворимы в воде и слабо растворимы в этаноле. Хотя гидроксид лития классифицируется как сильное основание, он является самым слабым из известных гидроксидов щелочных металлов.
CsOH сильнее, чем NaOH?
NaOH и CsOH являются полностью ионизированными гидроксидами, поэтому нет никакой разницы. Для получения более сильного основания необходимо нечто более сильное, чем гидроксид, например ион алкоксида.
Какая щелочь самая сильная?
Гидроксид натрия
Почему гидроксид магния является слабым основанием?
Весь растворенный гидроксид магния диссоциирует на ионы.Поскольку диссоциация этого небольшого количества растворенного гидроксида магния завершена, гидроксид магния считается сильным электролитом. Его низкая растворимость делает его слабым основанием.
Является ли гидроксид магния слабой щелочью?
– Здесь гидроксид магния является щелочью, но очень слабой щелочью и не растворяется полностью в воде, хотя растворенная часть считается сильным основанием из-за полной диссоциации его ионов.
Каково общее название гидроксида магния?
Молоко магнезии
Является ли магний слабой кислотой?
1, это сильная кислота.Поскольку Mg(OH)2 указан в таблице 15.6. 1, это сильная база. Азот в C5H5N будет действовать как акцептор протонов и поэтому может считаться основанием, но, поскольку он не содержит соединения ОН, его нельзя считать сильным основанием; это слабая база.
Является ли магний кислотой или основанием?
Оксид магния — еще один простой основной оксид, который также содержит оксидные ионы. Однако он не такой сильно основной, как оксид натрия, потому что ионы оксида не так слабо связаны.
Ощелачивает ли магний организм?
Он богат подщелачивающими соединениями, такими как кальций, магний, калий, кремнезем и бикарбонат.Его щелочность и богатые антиоксидантами свойства являются результатом высокого содержания минералов, которые присутствуют в воде в виде отрицательно заряженных ионов.
.
 В
щелочной среде: лакмус –
синий, фенолфталеин –
малиновый, метиловый оранжевый –
желтый
В
щелочной среде: лакмус –
синий, фенолфталеин –
малиновый, метиловый оранжевый –
желтый

 Для чистой воды = = 10 -7 ,
откуда -lg = 7.0.
Для чистой воды = = 10 -7 ,
откуда -lg = 7.0.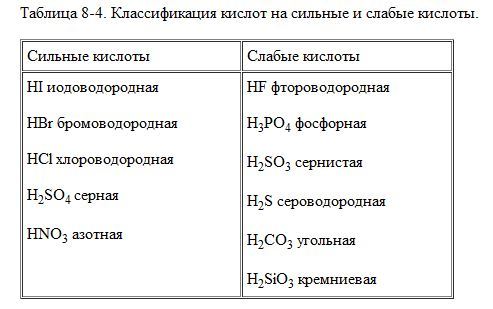 Например, Cl — , NO — 3 ,
SO 2- 4 , Li + , Na + , K + .
Например, Cl — , NO — 3 ,
SO 2- 4 , Li + , Na + , K + . п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса). мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания (гидроксиды) — это вещества или частицы, способные принимать (отщеплять) протон от кислоты. Согласно такому определению, свойства основания зависят от свойств — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса). мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания (гидроксиды) — это вещества или частицы, способные принимать (отщеплять) протон от кислоты. Согласно такому определению, свойства основания зависят от свойств — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
 Чем выше значение константы основности, тем выше сила основания и тем сильнее его способность отщеплять протон. Также вместо самой константы часто используют показатель константы основности pK b . Например, для аммиака NH 3 имеем:
Чем выше значение константы основности, тем выше сила основания и тем сильнее его способность отщеплять протон. Также вместо самой константы часто используют показатель константы основности pK b . Например, для аммиака NH 3 имеем: В воде нерастворимы, кроме щелочей.
В воде нерастворимы, кроме щелочей.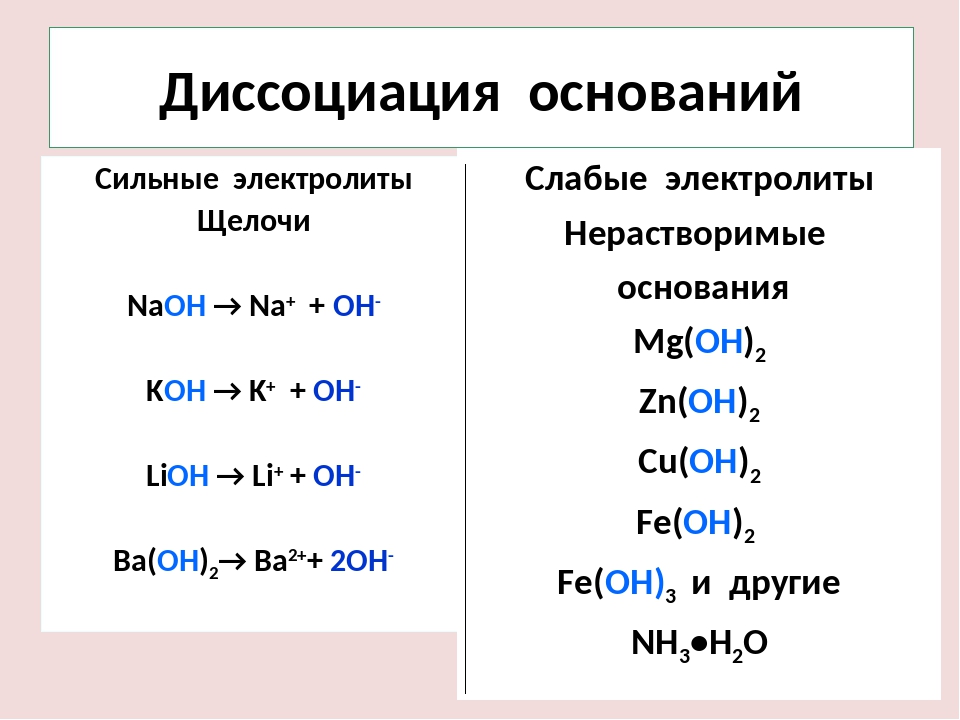
 Сырая нефть, например, представляет собой смесь молекул, содержащих только углерод и водород, в то время как уголь включает некоторое количество других элементов. Хотя молекулы, присутствующие в угле и нефти, заметно отличаются по своей химической структуре, у них есть общая особенность: они не содержат функциональных групп!
Сырая нефть, например, представляет собой смесь молекул, содержащих только углерод и водород, в то время как уголь включает некоторое количество других элементов. Хотя молекулы, присутствующие в угле и нефти, заметно отличаются по своей химической структуре, у них есть общая особенность: они не содержат функциональных групп! Безводный гидроксид натрия — это белое кристаллическое вещество. Раствор — прозрачная жидкость, на вид ничем не отличимая от воды. При использовании будьте осторожны! Едкий натр сильно обжигает кожу!
Безводный гидроксид натрия — это белое кристаллическое вещество. Раствор — прозрачная жидкость, на вид ничем не отличимая от воды. При использовании будьте осторожны! Едкий натр сильно обжигает кожу!
 Эта реакция ещё носит название — реакция нейтрализации
Эта реакция ещё носит название — реакция нейтрализации Активно растворяясь в воде, натрий вытесняет из неё водород, при этом образуя натриевую щелочь (или гидроксид натрия) — едкий натр NaOH.
Реакция протекает следующим образом:
Активно растворяясь в воде, натрий вытесняет из неё водород, при этом образуя натриевую щелочь (или гидроксид натрия) — едкий натр NaOH.
Реакция протекает следующим образом: К тому же, гидроксид железа (II) очень не стойкий. Если к раствору гидроксида железа (II) добавить немного щёлочи, то выпадет зелёный осадок, который достаточно быстро темнеет о превращается в бурый осадок железа (III).
К тому же, гидроксид железа (II) очень не стойкий. Если к раствору гидроксида железа (II) добавить немного щёлочи, то выпадет зелёный осадок, который достаточно быстро темнеет о превращается в бурый осадок железа (III). ]
]