Растворимость оксида азота — Справочник химика 21
Общая характеристика элементов главной подгруппы V группы периодической системы. Азот. Строение атома, строение молекулы, степени окисления. Круговорот азота в природе. Получение, физические и химические свойства азота. Аммиак, строение молекулы, получение, физические и химические свойства. Восстановительные свойства аммиака. Аммиачная вода. Соли аммония, их получение. Термическое разложение солей аммония. Оксиды азота, их получение и основные химические свойства. Азотистая кислота. Окислительно-восстановительные свойства соединений азота со степенью окисления +3. Азотная кислота, ее получение и химические свойства. Окислительные свойства азотной кислоты в реакциях взаимодействия с металлами и неметаллами. Царская водка. Соли азотной кислоты, их термическое разложение. Азотные удобрения. Фосфор, строение атома, степени окисления. Аллотропия. Физические и химические свойства. Фосфин. Фосфиды, их гидролиз.
Получение и изучение свойств оксида азота (1). Приготовьте смесь, состоящую из мелкоизмельченных 2 г нитрата натрия и 1,8 г сульфата аммония, смесь поместите в сухую пробирку, закройте пробирку пробкой с газоотводной трубкой и укрепите ее на штативе в наклонном положении. Конец газоотводной трубки опустите в кристаллизатор С водой, нагретой до 60—80°С, для уменьшения растворимости оксида азота (I). Нагрейте пробирку пламенем горелки для высушивания солей, а затем после расплавления [c.171]
В продуктах гидрогенизации и промывочном масле растворяется также значительное количество водорода — 30-35% от его расхода. При сбросе давления до 2,5-4 МПа выделяются преимущественно газы, обладающие меньшей растворимостью (водород, азот, оксид углерода, метан), бедный газ, а затем при давлении до 0,1-0,3 МПа — газы, обладающие большей растворимостью (этан, пропан, бутаны, сероводород, диоксид углерода), богатый газ.
Растворимость оксида азота в водных растворах серной кислоты незначительна. Так, при нормальном давлении и температуре 20 °С концентрация N0 в растворах составляет [c.272]
При стандартных условиях один объем воды растворяет 0,757 объема оксида углерода и 0,539 объема оксида азота. Растворимость СО в 1,0М растворе Мд(МОз)г 0,559. Рассчитать растворимость оксида азота в этом растворе.
В промышленной практике переработку оксидов азота осуществляют при температурах 20—40 °С. До концентрации азотной кислоты, равной 56%, снижение температуры способствует существенному увеличению скорости и степени переработки оксидов азота в кислоту благодаря увеличению скорости окисления N0 и смещению равновесия реакции (1. 35) в сторону образования НЫОз. При получении азотной кислоты повышенной концентрации наблюдается увеличение физической растворимости оксидов азота в кислоте процесс [c.57]
35) в сторону образования НЫОз. При получении азотной кислоты повышенной концентрации наблюдается увеличение физической растворимости оксидов азота в кислоте процесс [c.57]
Растворимость оксидов азота и воздуха — рис. 196—198. [c.12]
Оксид азота (И) слабо растворим в воде. Растворимость N0 в воде Р-10 при 0,1013 МПа составляет [c.14]
Вода осуществляет постоянный круговорот в природе. Кроме того, существует производственно-бытовой оборот воды. Соли и газы попадают в воду на всех этапах этого оборота. Из атмосферы в воде растворяются кислород, азот, диоксид углерода, а в связи с тем, что атмосфера все более насыщается такими промышленными выбросами, как оксиды азота, серы, фосфора, то в воду попадают и они, образуя минеральные кислоты. Проникая в землю, вода насыщается растворимыми солями натрия, калия, кальция, магния и др. Из горных пород в воду попадают силикаты. [c.12]
Реакция сопровождается выделением тепла в количестве 207,4 кДж/моль.
 Образовавшаяся серная кислота является отходом производства, но может быть использована, если применять более сложную систему обращения потоков. Усложнение УОП позволяет получать серную кислоту с концентрацией 60-65% и не содержащую растворимых оксидов азота.
Образовавшаяся серная кислота является отходом производства, но может быть использована, если применять более сложную систему обращения потоков. Усложнение УОП позволяет получать серную кислоту с концентрацией 60-65% и не содержащую растворимых оксидов азота. Различные каталитические реакции подразделяются на реакции гомогенного и гетерогенного катализа. В тех случаях, когда катализатор и реагирующие вещества образуют однородную систему (т. е. находятся в одной фазе), мы имеем дело с гомогенным катализом. В качестве примеров можно указать на каталитическое окисление СО до СО2 в присутствии паров воды и окисление ЗОг до 50з в присутствии оксида азота N02. К этому типу каталитических реакций относится и реакция гидролиза растворимых углеводов в водном растворе в присутствии кислоты. Как видим, в первых двух случаях катализатор и катализируемые вещества находятся в газообразном состоянии, в третьем — образуют однородный раствор. [c.160]
Оксид азота (II) N0 — бесцветный газ, плохо растворимый в воде (его можно собирать в цилиндре над водой).
Оксид азота (П)ЫО — бесцветный газ, плохо растворимый в воде (его можно собирать в цилиндре над водой). Оксид азота (II) обладает замечательным свойством непосредственно соединяется с кислородом воздуха, образуя бурый газ — оксид азота (IV) [c.194]
Фактором, влияющим на процесс очистки, является давление. Растворимость диоксида серы и оксидов азота в абсорбентах пропорциональна их парциальному давлению, в то время как содержание абсорбентов — 8О3 и Н Ю, — в газовой фазе обратно пропорционально общему давлению. Поэтому при проведении очистки под давлением растет насыщение абсорбентов вредными компонентами, а унос абсорбентов с газами снижается. Одновременно увеличение давления благоприятно влияет и на окисление N0 [c.242]
В фарфоровой чашке на 250 мл смешивают 27 г глюкозы с 160 мл 25%-НОГО раствора азотной кислоты и нагревают на слабо кипяшей водяной бане, непрерывно помешивая жидкость стеклянной палочкой Нагревание ведут до тех пор, пока не закончится реакция окисления (прекрашение выделения оксидов азота) и раствор упарится до консистенции сиропа, окрашенного в желтовато-коричневый цвет.
Оксид азота N0 — малоактивный в химическом отношении бесцветный газ, лишенный запаха и плохо растворимый в воде, быстро окисляемый в диоксид азота скорость окисления зависит от температуры, атмосферного давления и концентрации N0. Оксид азота — кровяной яд, он, как и СО, блокирует гемоглобин, оказывает прямое влияние на центральную нервную систему, обладает наркотическим действием. [c.103]
Оксид азота — кровяной яд, он, как и СО, блокирует гемоглобин, оказывает прямое влияние на центральную нервную систему, обладает наркотическим действием. [c.103]
Вследствие высокой химической инертности и малой растворимости в воде среднее время жизни оксида азота(1) в тропосфере равно 120-150 годам. Поэтому эта малая газовая составляющая равномерно распределена во всей толще тропосферы. Большой вклад тропических районов в глобальный поток N2 в какой-то мере объясняет незначительную величину широтного градиента в обоих полушариях концентрация N36 сейчас близка к 310 млрд
При дисперсном упрочнении молибдена удается достичь значительного повышения жаропрочности и длительной прочности. В качестве упрочнителей используют карбиды, нитриды и оксиды, так как растворимость кислорода, азота и углерода в молибдене очень мала. Степень упрочнения от введения карбидов в. молибден возрастает в ряду Ti , Nb , Zr , Hf . [c.121]
Оксид азота (И) NO — бесцветный газ,. плохо растворимый в воде (его % ожно собирать в цилиндре над водой). [c.140]
плохо растворимый в воде (его % ожно собирать в цилиндре над водой). [c.140]
Оксид азота (I) NjO — бесцветный газ со сладковатым запахом, хорошо растворимый в воде. Его получают разложением нитрата аммония. При 700 °С NjO разлагается с выделением кислорода 2NP = 2N + оД. [c.217]
Оксиды азота N0 . Оксид азота N0 — бесцветный газ без запаха, плохо растворимый в воде, малоактивный в химическом отношении. [c.39]
Нитраты. Нитраты получают растворением металлов, оксидов или гидроксидов в НЫОз. Нитраты в виде кристаллических солей часто являются гидратами и растворимы в воде. Нитраты щелочных металлов при сильном нагревании дают нитриты другие нитраты разлагаются до оксида металла, воды и оксида азота. [c.138]
Ранние работы по определению сульфатов методом пламенной фотометрии были осложнены наличием большого числа помех и относительно низкой чувствительностью определения бария. В работе [166] предложено использовать пламя ацетилена с оксидом азота(I) для определения 0,5—10 ррт сульфатов определению сульфатов мешает только кальций.
Растворимость водорода, азота, оксида углерода, метана и кислорода в растворе этаноламина значительно ниже растворимости диоксида углерода и сероводорода. Этим объясняются ничтожные потери водорода при очистке растворами этаноламина (особенно в случае абсорбции при атмосферном давлении). Однако водород и оксид углерода, попадая в раствор, в дальнейшем загрязняют диоксид углерода. В том случае, если последний применяется в синтезе карбамида, целесообразно предварительно удалять из него горючие примеси. [c.34]
Растворимость оксидов азота в 97%-ной HNOз при —10°С и атмосферном давлении составляет [c.102]
Растворимость NO в водных растворах серной кислоты очень мала в нитрозе она несколько больше, растворимость повышается при увеличении концентрации нитрозилсерной кислоты и исходной серной кислоты и понижается с ростом температуры. Ниже приведены данные о растворимости оксида азота в нитрозе (в %) при давлении, равном 0,1 МПа (760 мм рт. ст.) и температуре 40 °С [c.248]
Ниже приведены данные о растворимости оксида азота в нитрозе (в %) при давлении, равном 0,1 МПа (760 мм рт. ст.) и температуре 40 °С [c.248]
А б с о р б iTiTTIk ндкостями — наиболее распространенный и до сих пор наиболее надежный способ газоочистки. Она используется в промышленности как основной прием извлечения из газов оксидов углерода, оксидов азота, хлора, диоксида серы, сероводорода и других сернистых соединений, паров кислот (НС1, h3SO4, HF), цианистых соединений, разнообразных токсических органических веществ (фенол, формальдегид, фталевый ангидрид и др.) и т. д. Метод абсорбционной очистки основан на избирательной растворимости вредных примесей в жидкости (физическая абсорбция) или избирательном извлечении их прн помощи реакций с активными компонентами поглотителя (хемосорбция). Абсорбцион- [c.229]
Соли азотистой кислоты называются нитритами, или азотистокислыми. Подобно аниону N02, большинство их бесцветно. Почти все нитриты хорошо растворимы в воде (труднее других — АдНОг). Чаще всего встречается на практике NaN02, который получают обычно из оксидов азота по реакции [c.266]
Чаще всего встречается на практике NaN02, который получают обычно из оксидов азота по реакции [c.266]
При взаимодействии с водой оксид азота (IV) образует азотную и азотистую кислоты, со щелочами — смесь нитратов и нитритов. Он хорошо поглощается серной кислотой с образованием нитрозилсерной кислоты HNSOs, обладает высокой растворимостью в концентрированной азотной кислоте, три-бутилфосфате, диметилфталате и других растворителях. [c.15]
Система НМОз—N204—Н2О ограниченно растворима и образует две жидкие фазы. Вода и кислота преимущественно находятся в нижнем слое. Вода, добавляемая к раствору N204 в азотной кислоте, вытесняет ( высаливает ) оксид азота (IV) в верхний слой, содержащий преимущественно N204. [c.32]
Азотная кислота HNO3— бесцветная жидкость с резким запахом, гигроскопична, кипит при 84 °С, хорошо растворима в воде. Разбавленная А. к. проявляет все свойства одноосновных кислот. Концентрированная (96—98 %) HNO3 красно-бурого цвета от присутствия в ней NOa-Ha свету и при нагревании HNO, разлагается на N0-2, О2 и HjO.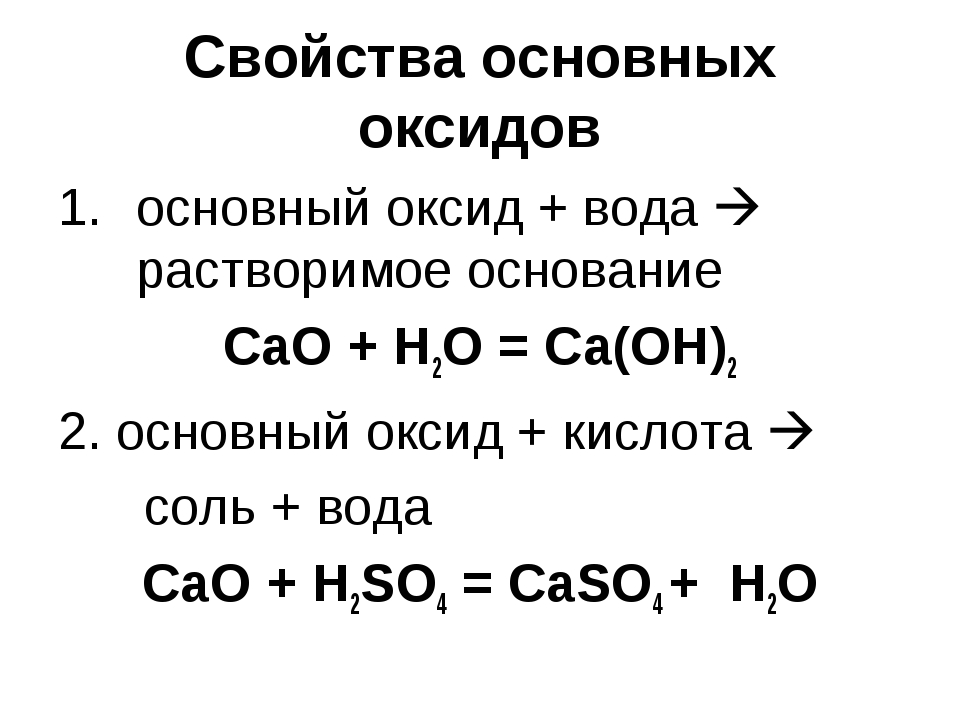 Концентрированная А. к.— один из самых сильных окислителей, реагирует почти со всеми металлами (за исключением золота, платины, иридия, родия) с образованием нитратов, при этом выделяются оксиды азота. Алюминий, железо и хром легко взаимодействуют с разбавленной А. к., но практически не реагируют с концентрированной кислотой вследствие образования на поверхности защитного тонкого слоя оксида металла. А. к. взаимодействуют со многими неметаллами, а также оргащтческими соединениями. В промышленности А. к. получают из аммиака. А. к. применяется в производстве азотных удобрений, взрывчатых веществ, лекарств, красителей, пластических масс, искусственных волокон, как окислитель в реактивных двигателях и др. [c.8]
Концентрированная А. к.— один из самых сильных окислителей, реагирует почти со всеми металлами (за исключением золота, платины, иридия, родия) с образованием нитратов, при этом выделяются оксиды азота. Алюминий, железо и хром легко взаимодействуют с разбавленной А. к., но практически не реагируют с концентрированной кислотой вследствие образования на поверхности защитного тонкого слоя оксида металла. А. к. взаимодействуют со многими неметаллами, а также оргащтческими соединениями. В промышленности А. к. получают из аммиака. А. к. применяется в производстве азотных удобрений, взрывчатых веществ, лекарств, красителей, пластических масс, искусственных волокон, как окислитель в реактивных двигателях и др. [c.8]
Растворяют 5 г пробы в 40 мл HNO3 (1 1) нагревают раствор до прекращения выделения оксидов азота. Переводят раствор в мерную колбу вместимостью 50 мл и разбавляют водой до метки. Отбирают. 5,0 мл раствора в стакан вместимостью 250 мл, добавляют 10 мл раствора хлорида железа (III) (коллектор), 2 г хлорида аммония и разбавляют водой до объема —50 мл. Добавляют концентрированный аммиак до полного переведения Zn (II) в растворимый аммиачный комплекс, а Fe(III) [вместе с As(V)] выпадет в осадок. Нагревают на водяно г бане 30 мин и фильтруют через фильтр белая лента. Осадок промывают водой с каплями аммиака и растворяют на фильтре в НС1 (1 1). собирая раствор в стакан, в котором проводилось осаждение. Повторяют [c.196]
Добавляют концентрированный аммиак до полного переведения Zn (II) в растворимый аммиачный комплекс, а Fe(III) [вместе с As(V)] выпадет в осадок. Нагревают на водяно г бане 30 мин и фильтруют через фильтр белая лента. Осадок промывают водой с каплями аммиака и растворяют на фильтре в НС1 (1 1). собирая раствор в стакан, в котором проводилось осаждение. Повторяют [c.196]
В продуктах гидрогенизации (шлам, гидрюр) и промывочном масле растворяется также значительное количество водорода — 30—35% от его расхода. При двойном сбросе давления вначале (при сбросе до 2,5—4 МПа) выделяются лреимущественно газы, обладающие меньшей растворимостью (водород, азот, оксид углерода, метан), — бедный газ, а затем (до 0,1—0,3 МПа) газы, обладающие большей растворимостью (этан, пропан, бутаны, сероводород, диоксид углерода), — богатый газ. Растворимость газов Б значительной мере зависит от природы растворителя и характеризуется коэффициентом растворимости — числом кубических метров газа, растворенного в 1 м или в 1 т растворителя (м /м или м /т) при повышении парциального давления данного газа на 1 МПа. Средние значения коэффициентов растворимости приведены в табл. 6.15, а составы бед- [c.219]
Средние значения коэффициентов растворимости приведены в табл. 6.15, а составы бед- [c.219]
Поучительно проследить превращения каждого главного компонента по ходу выполнения анализа. Олово окисляется азотной кислотой до четырехвалентного состояния и медленно осаждается в виде малорастворимого гидратированного оксида олова(IV) Sn02-4h30. Этот осадок, склонный образовывать коллоиды, иногда называют метаоловянной кислотой. Осадок способен адсорбировать медь(II) и другие катионы из раствора. Свинец, цинк и медь при растворении в азотной кислоте окисляются до двухвалентного состояния и образуют растворимые соли, а железо переходит в трехвалентное состояние. Выпаривание с серной кислотой для удаления оксидов азота приводит к растворению метаоловянной кислоты, но может вызвать частичное осаждение свинца в виде сульфата медь, цинк и железо изменений не претерпевают. При разбавлении водой сульфат свинца почти полностью осаждается, тогда как другие элементы остаются в растворе. Ни один из них, за исключением меди и железа, не восстанавливается иодидом. Мешающее влияние железа устраняют, связывая в комплекс фосфат-ионами. [c.408]
Ни один из них, за исключением меди и железа, не восстанавливается иодидом. Мешающее влияние железа устраняют, связывая в комплекс фосфат-ионами. [c.408]
Состав и содержание примесей также зависят от метода производства серной кислоты. Например, при получении башенной серной кислоты в нее попадают частицы пыли, остающиеся в обжиговом газе даже после его очистки в сухих электрофильтрах. Кроме того, башенная кислота содержит растворенные оксиды азота. Серная кислота может быть также загрязнена продуктами коррозии аппаратуры, растворимыми в Н2504. Если кислота подвергается концентрированию, в ней могут находиться примеси, присутствовавшие в топочных греющих газах. [c.25]
Оксид алюминия
Оксид алюминия представляет собой белую, очень тугоплавкую (т. пл. 2050 оС) и нерастворимую в воде массу. Природный Al2O3 (минерал корунд), а также полученный искусственно и затем сильно прокаленный отличается большой твердостью и нерастворимостью в кислотах. В растворимое состояние Al2O3 (т. н. глинозем) можно перевести сплавлением со щелочами.
В растворимое состояние Al2O3 (т. н. глинозем) можно перевести сплавлением со щелочами.
Ввиду нерастворимости Al2O3 в воде, отвечающий этому оксиду гидроксид Al(OH)3 может быть получен лишь косвенным путем из солей. Получение гидроксида можно представить в виде следующей схемы. При действии щелочей ионами OH— постепенно замещаются в аквокомплексах [Al(OH2)6]3+ молекулы воды:
[Al(OH2)6]3+ + OH— = [Al(OH)(OH2)5]2+ + H2O
[Al(OH)(OH2)5]2+ + OH— = [Al(OH)2(OH2)4]+ + H2O
[Al(OH)2(OH2)4]+ + OH— = [Al(OH)3(OH2)3]0 + H2O
Al(OH)3 представляет собой объемистый студенистый осадок белого цвета, практически нерастворимый в воде, но легко растворяющийся в кислотах и сильных щелочах. Он имеет, следовательно, амфотерный характер. Однако и основные и особенно кислотные его свойства выражены довольно слабо. В избытке NH4OH гидроксид алюминия нерастворим. Одна из форм дегидратированного гидроксида — алюмогель используется в технике в качестве адсорбента.
Он имеет, следовательно, амфотерный характер. Однако и основные и особенно кислотные его свойства выражены довольно слабо. В избытке NH4OH гидроксид алюминия нерастворим. Одна из форм дегидратированного гидроксида — алюмогель используется в технике в качестве адсорбента.
При взаимодействии с сильными щелочами образуются соответствующие алюминаты:
NaOH + Al(OH)3 = Na[Al(OH)4]
Алюминаты наиболее активных одновалентных металлов в воде хорошо растворимы, но ввиду сильного гидролиза растворы их устойчивы лишь при наличии достаточного избытка щелочи. Алюминаты, производящиеся от более слабых оснований, гидролизованы в растворе практически нацело и поэтому могут быть получены только сухим путем (сплавлением Al2O3 с оксидами соответствующих металлов).
С кислотами Al(OH)3 образует соли. Производные большинства сильных кислот хорошо растворимы в воде, но довольно значительно гидролизованы, и поэтому растворы их показывают кислую реакцию. Еще сильнее гидролизованы растворимые соли алюминия из слабых кислот. Вследствие гидролиза сульфид, карбонат, цианид и некоторые другие соли алюминия из водных растворов получить не удается.
Еще сильнее гидролизованы растворимые соли алюминия из слабых кислот. Вследствие гидролиза сульфид, карбонат, цианид и некоторые другие соли алюминия из водных растворов получить не удается.
Галогениды алюминия в обычных условиях — бесцветные кристаллические вещества. В ряду галогенидов алюминия AlF3 сильно отличается по свойствам от своих аналогов. Он тугоплавок, мало растворяется в воде, химически неактивен. Основной способ получения AlF3 основан на действии безводного HF на Al2O3 или Al:
Al2O3 + 6HF = 2AlF3 + 3H2O
Соединения алюминия с хлором, бромом и иодом легкоплавки, весьма реакционноспособны и хорошо растворимы не только в воде, но и во многих органических растворителях. Взаимодействие галогенидов алюминия с водой сопровождается значительным выделением теплоты. В водном растворе все они сильно гидролизованы, но в отличие от типичных кислотных галогенидов неметаллов их гидролиз неполный и обратимый. Будучи заметно летучими уже при обычных условиях, AlCl3, AlBr3 и AlI3 дымят во влажном воздухе (вследствие гидролиза). Они могут быть получены прямым взаимодействием простых веществ.
Будучи заметно летучими уже при обычных условиях, AlCl3, AlBr3 и AlI3 дымят во влажном воздухе (вследствие гидролиза). Они могут быть получены прямым взаимодействием простых веществ.
Сульфат алюминия Al2(SO4)3.18H2O получается при действии горячей серной кислоты на оксидалюминия или на каолин. Применяется для очистки воды, а также при приготовлении некоторых сортов бумаги.
Алюмокалиевые квасцы KAl(SO4)2.12H2O применяются в больших количествах для дубления кож, а также в красильном деле в качестве протравы для хлопчатобумажных тканей. В последнем случае действие квасцов основано на том, что образующиеся вследствие их гидролиза гидроксид алюминия отлагается в волокнах ткани в мелкодисперсном состоянии и, адсордбируя краситель, прочно удерживает его на волокне.
Из остальных производных алюминия следует упомянуть его ацетат (иначе — уксуснокислуюсоль) Al(CH3COO)3, используемый при крашении тканей (в качестве протравы) и в медицине (примочки и компрессы). Нитрат алюминия легко растворим в воде. Фосфат алюминия нерастворим в воде и уксусной кислоте, но растворим в сильных кислотах и щелочах
Нитрат алюминия легко растворим в воде. Фосфат алюминия нерастворим в воде и уксусной кислоте, но растворим в сильных кислотах и щелочах
ICSC 1653 — ОКСИД НАТРИЯ
ICSC 1653 — ОКСИД НАТРИЯ| ОКСИД НАТРИЯ | ICSC: 1653 (Октябрь 2006) |
| CAS #: 1313-59-3 |
| UN #: 1825 |
| EINECS #: 215-208-9 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее, но способствует возгоранию других веществ. |
НЕ использовать воду. Использовать сухой порошок, сухой песк. |
| ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! ВО ВСЕХ СЛУЧАЯХ ОБРАТИТЬСЯ К ВРАЧУ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Боли в горле. Кашель. Ощущения жжения. Затрудненное дыхание. Сбивчивое дыхание. | Применять местную вытяжку. Применять средства защиты органов дыхания. | Свежий воздух, покой. Полусидячее положение. Может потребоваться искусственное дыхание. Немедленно обратиться за медицинской помощью. |
| Кожа | Покраснение. Боль. Серьезные ожоги кожи. | Защитные перчатки. Защитная одежда. | Снять загрязненную одежду. Промыть кожу большим количеством воды или принять душ. Обратиться за медицинской помощью. Промыть кожу большим количеством воды или принять душ. Обратиться за медицинской помощью. |
| Глаза | Покраснение. Боль. Ожоги. | Использовать маску для лица или средства защиты глаз в комбинации со средствами защиты органов дыхания если вещество в порошкообразном соостоянии. | Промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений). Немедленно обратиться за медицинской помощью. |
| Проглатывание | Боль в горле. Ощущение жжения в горле и груди. Шок или сильная слабость. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. НЕ вызывать рвоту. Обратиться за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: костюм химической защиты, включая автономный дыхательный аппарат. Сухие пластиковыеСмести просыпанное вещество в закрытые контейнеры. Смыть остаток большим количеством воды. Сухие пластиковыеСмести просыпанное вещество в закрытые контейнеры. Смыть остаток большим количеством воды. |
Согласно критериям СГС ООН ОПАСНО Вызывает серьезные ожоги кожи и повреждения глазТранспортировка |
| ХРАНЕНИЕ | |
| Отдельно от сильных кислот и пищевых продуктов и кормов. Хранить сухим. | |
| УПАКОВКА | |
| Не перевозить с продуктами питания и кормами для животных. |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ОКСИД НАТРИЯ | ICSC: 1653 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: Na2O |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
Бурно реагирует с такими средствами пожаротушения, как вода. Симптомы отека легких часто не проявляются, пока не пройдет несколько часов, и они усугубляются физическими усилиями. Поэтому крайне важны отдых и медицинское наблюдение. Следует рассмотреть возможность немедленного проведения соответствующей ингаляционной терапии врачом или уполномоченным на это лицом. См. карту ICSC 0360. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
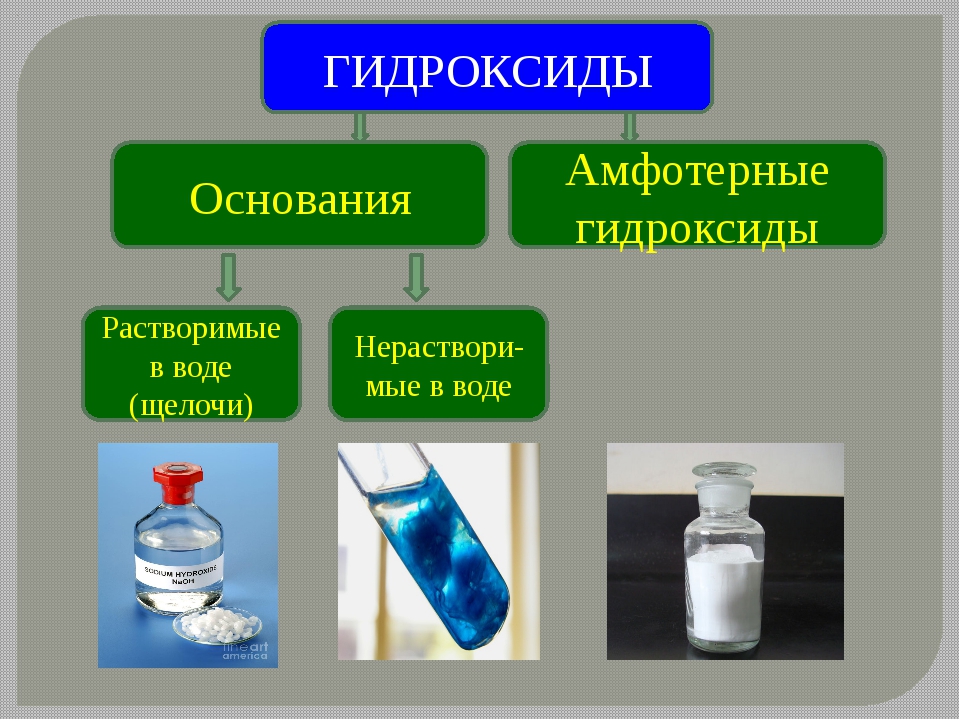
Оксиды
По агрегатному состоянию оксиды делятся на твёрдые, как оксид калия, оксид алюминия, оксид
фосфора пять и другие; на жидкие, как оксид серы шесть, оксид
марганца семь и газообразные, как оксид углерода четыре, оксид
азота четыре, оксид серы четыре и другие.
По растворимости в воде оксиды делятся на растворимые, как оксид серы четыре, оксид углерода четыре, оксид калия и другие; и нерастворимые, как оксид меди два, оксид железа два, оксид кремния четыре, оксид алюминия и другие.
Все кислотные оксиды, кроме оксида кремния четыре, растворимы в воде. Среди основных оксидов растворимыми являются только оксиды щелочных металлов (оксид лития, оксид натрия, оксид калия и так далее) и щелочноземельных металлов (оксид кальция, оксид стронция, оксид бария). Амфотэрные оксиды не растворяются в воде.
Оксиды имеют различный цвет: так, оксид меди два – чёрный, оксид никеля два – зелёный, оксид кальция – белый.
Рассмотрим химические свойства основных оксидов.
Основные оксиды реагируют с кислотами с образованием соли и воды.
Так, в реакции оксида магния с соляной кислотой образуется соль – хлорид магния и вода.
В реакции оксида железа
три с серной кислотой образуется соль – сульфат железа три и вода.
В реакции оксида кальция с серной кислотой образуется соль – сульфат кальция и вода.
Кристаллы этой соль известны под названием «гипс».
Основные оксиды взаимодействуют с кислотными оксидами с образованием солей.
Так, в реакции оксида кальция с оксидом углерода четыре образуется соль – карбонат кальция. Эту соль известная под названием «мел».
В реакции оксида натрия с оксидом фосфора пять образуется соль – фосфат натрия.
Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием растворимых оснований – щелочей.
Так, в реакции оксида калия с водой образуется щёлочь – гидроксид калия; в реакции оксида кальция с водой образуется гидроксид кальция.
Эта реакция – гашение извести, которая сопровождается выделением большого количества тепла.
Оксиды других металлов в
воде не растворяются и с ней не взаимодействуют. Как например, оксид меди два,
или оксид железа три и другие.
Как например, оксид меди два,
или оксид железа три и другие.
Общим свойством всех кислотных оксидов является их способность взаимодействовать с основаниями с образованием соли и воды.
Так, в реакции оксида углерода четыре с гидроксидом натрия образуется соль – карбонат натрия и вода.
В реакции оксида фосфора пять с гидроксидом бария образуется соль – фосфат бария и вода.
Кислотные оксиды взаимодействуют с основными оксидами с образованием солей. Так, в реакции оксида серы шесть с оксидом калия образуется соль – сульфат калия.
Большинство кислотных оксидов взаимодействуют с водой с образованием кислот.
Например, в реакции оксида серы шесть с водой образуется серная кислота.
Амфотэрные оксиды взаимодействуют с кислотами с образованием соли и воды.
Так, в реакции оксида цинка с азотной кислотой образуется соль – нитрат цинка и вода.
В этих реакциях амфотэрные
оксиды играют роль основных оксидов.
Амфотэрные оксиды взаимодействуют со щелочами с образованием солей и воды.
Так, в реакции оксида цинка с гидроксидом калия образуется соль – цинкат калия и вода.
В этих реакциях амфотэрные оксиды играют роль кислотных оксидов.
Амфотэрные оксиды при нагревании взаимодействуют с кислотными оксидами с образованием солей.
Так, в реакции оксида цинка с оксидом углерода четыре образуется соль – карбонат цинка.
Амфотэрные оксиды при нагревании взаимодействуют с основными оксидами с образованием солей.
Например, в реакции оксида цинка с оксидом натрия образуется соль – цинкат натрия.
Некоторые оксиды имеют специфические свойства. У хлора известны такие оксиды, как оксид хлора один, оксид хлора четыре, оксид хора семь и другие.
В реакции с водой оксид
хлора один, образует хлорноватистую кислоту, оксид хлора четыре в реакции с
водой образует хлорноватистую и хлорноватую кислоты; оксид хлора семь в реакции
с водой образует хлорную кислоту.
Оксиды могут быть получены различными способами.
Это взаимодействие простых веществ с кислородом.
Например, в реакции магния с кислородом образуется оксид магния; в реакции углерода с кислородом образуется оксид углерода четыре, в реакции цинка с кислородом образуется оксид цинка.
Оксиды можно получить и при горении сложных веществ. Так, в реакции горения сероводорода образуется оксид серы четыре и вода; в реакции горения метана образуется оксид углерода четыре и вода.
При разложение некоторых оксокислот также образуются оксиды.
Так, в реакции разложения сернистой кислоты образуется оксид серы четыре и вода. В реакции разложения угольной кислоты образуется оксид углерода четыре и вода.
Оксиды можно получить и при разложении нерастворимых оснований.
Например, при разложении
гидроксида меди два образуется оксид меди два и вода. При разложении гидроксида
железа два образуется оксид железа два и вода. При разложении гидроксида
алюминия образуется оксид алюминия и вода.
При разложении гидроксида
алюминия образуется оксид алюминия и вода.
При разложении некоторых солей также образуются оксиды.
Так, при разложении карбоната кальция образуется оксид кальция и оксид углерода четыре.
При разложении нитрата меди два образуется оксид меди два (чёрного цвета), оксид азота четыре (бурого цвета) и кислород.
Ещё одним способом, которым можно осуществить получение оксидов – это окислительно-восстановительные реакции.
Например, в реакции меди с концентрированной азотной кислотой образуется нитрат меди два, оксид азота четыре и вода; в реакции серы с концентрированной азотной кислотой образуется оксид серы четыре и вода.
Таким образом, некоторые
основные оксиды реагируют с водой, с образованием щелочей, основные оксиды
реагируют с кислотными и амфотэрными оксидами, реагируют с кислотами;
большинство кислотных оксидов реагируют с водой, кислотные оксиды реагируют с
основными и амфотэрными оксидами, с основаниям; амфотэрные оксиды реагируют с
основными и кислотными оксидами, реагируют с основаниями и кислотами.
Оксиды можно получить в реакции простых веществ с кислородом, горением сложных веществ, разложением солей, нерастворимых оснований, а также разложением некоторых кислот и в окислительно-восстановительных реакциях.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.
 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie. - Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно.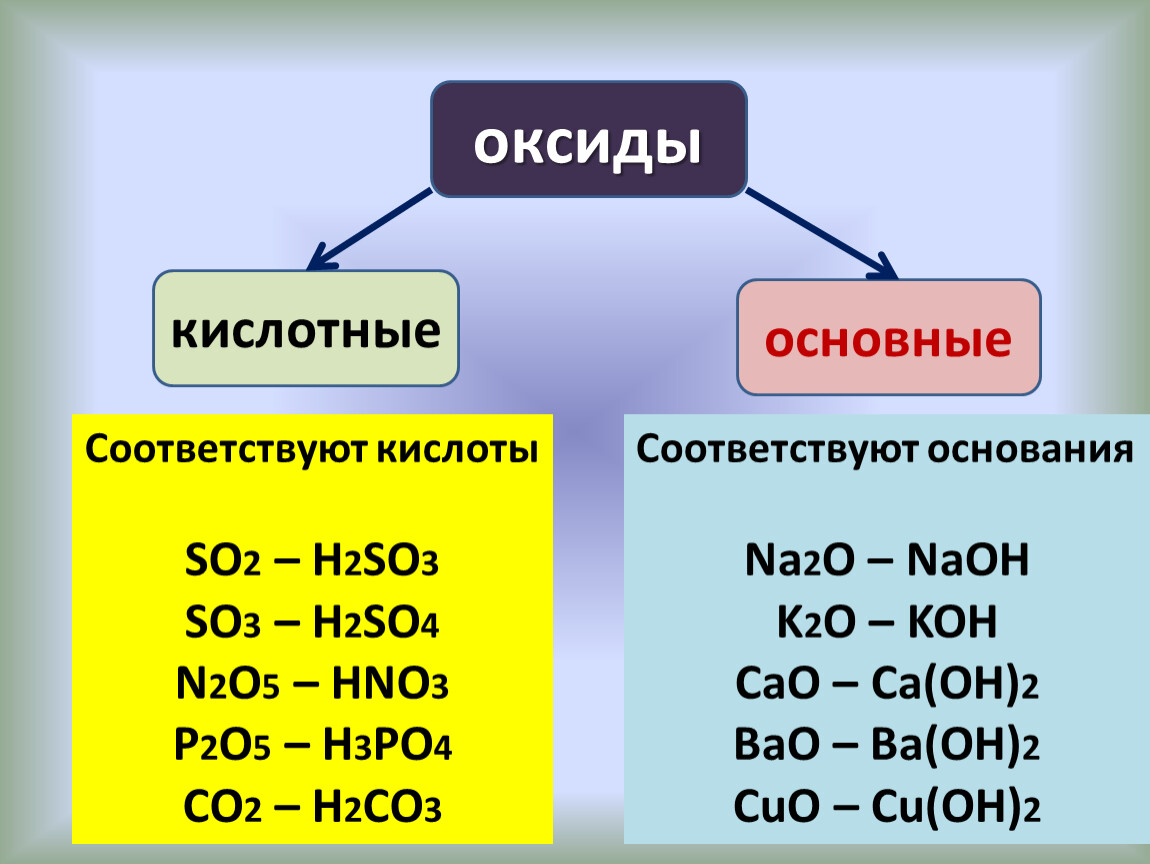 Ниже приведены наиболее распространенные причины:
Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.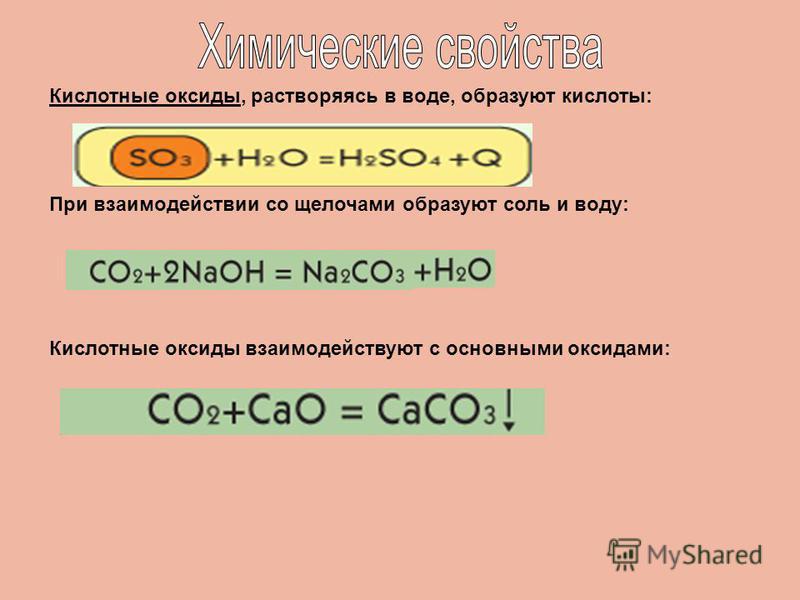
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.
 Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
17.7: Растворимость и рН — Химия LibreTexts
Растворимость многих соединений сильно зависит от рН раствора. Например, анион во многих труднорастворимых солях представляет собой сопряженное основание слабой кислоты, которая может протонироваться в растворе. {-}}]\]
{-}}]\]
Согласно принципу Ле Шателье, большее количество МА будет растворяться до тех пор, пока \(Q = K_{sp}\).{2+} (водн.) + 2HF (водн.) \label{17.20}\]
В примере \(\PageIndex{1}\) показано, как рассчитать эффект растворимости при добавлении сильной кислоты к раствору малорастворимой соли.
Малорастворимые соли, полученные из слабых кислот, имеют тенденцию быть более растворимыми в кислом растворе.
Пример \(\PageIndex{1}\)
Оксалат свинца (PbC 2 O 4 ), йодид свинца (PbI 2 ) и сульфат свинца (PbSO 4 ) довольно нерастворимы, с K sp 9014соответственно Как влияет на их относительную растворимость добавление сильной кислоты, например хлорной кислоты?
Дано: K sp значения для трех соединений
Запрашиваемый вопрос: относительная растворимость в растворе кислоты
Стратегия:
Напишите сбалансированное химическое уравнение растворения каждой соли. Поскольку на самое сильное сопряженное основание больше всего повлияет добавление сильной кислоты, определите относительную растворимость по относительной основности анионов.{2−}_{4(водн.)} \номер\]
Поскольку на самое сильное сопряженное основание больше всего повлияет добавление сильной кислоты, определите относительную растворимость по относительной основности анионов.{2−}_{4(водн.)} \номер\]
Добавление сильной кислоты окажет наибольшее влияние на растворимость соли, которая содержит сопряженное основание слабой кислоты в качестве аниона. Поскольку HI является сильной кислотой, мы предполагаем, что добавление сильной кислоты к насыщенному раствору PbI 2 не сильно повлияет на его растворимость; кислота просто диссоциирует с образованием H + (водн.) и соответствующего аниона. Напротив, оксалат представляет собой полностью депротонированную форму щавелевой кислоты (HO 2 CCO 2 H), которая является слабой дипротонной кислотой (p K a1 = 1.+ (водн.) \rightarrow HO_2CCO_2H (водн.) \номер\]
Эти реакции уменьшатся [C 2 O 4 2− ], вызывая растворение большего количества оксалата свинца, чтобы уменьшить нагрузку на систему. -_{4(водн.)} \номер\]
-_{4(водн.)} \номер\]
Поскольку HSO 4 − имеет pKa 1.99, эта реакция будет лежать в основном влево, как написано. Следовательно, мы прогнозируем, что влияние добавленной сильной кислоты на растворимость PbSO 4 будет значительно меньше, чем для PbC 2 O 4 .
Упражнение \(\PageIndex{1}\)
Какая из следующих нерастворимых солей — AgCl, Ag 2 CO 3 , Ag 3 PO 4 и/или AgBr — будет значительно лучше растворима в 1,0 М HNO 3 , чем в чистой воде?
- Ответить
Ag 2 CO 3 и Ag 3 PO 4
Пещеры и связанные с ними вершины и каменные шпили представляют собой один из наиболее впечатляющих примеров pH-зависимого равновесия растворимости (часть (a) на рисунке \(\PageIndex{1}\):).{2−}3(водн.) \rightleftharpoons CaCO3(s)} \label{17. -_{3(водн.)} \rightleftharpoons CaCO_{3(s)} + CO_{2(g)} + H_2O (l) \label{17.24}\]
-_{3(водн.)} \rightleftharpoons CaCO_{3(s)} + CO_{2(g)} + H_2O (l) \label{17.24}\]
Прямое направление — это та же самая реакция, которая образует твердое вещество, называемое накипью, в чайниках, кофеварках, водонагревателях, бойлерах и других местах, где постоянно нагревается жесткая вода.
Рисунок \(\PageIndex{1}\): Химия образования пещер. (а) Эта пещера в Кампанете, Майорка, Испания, и связанные с ней образования являются примерами равновесия растворимости, зависящего от рН. (b) Пещера образуется, когда подземные воды, содержащие атмосферный CO 2 , образуя кислый раствор, растворяют известняк (CaCO 3 ) в процессе, который может занять десятки тысяч лет.Когда подземные воды просачиваются в пещеру, вода испаряется из раствора CaCO 3 в воде, богатой CO 2 , образуя пересыщенный раствор и сдвиг в равновесии, который вызывает осаждение CaCO 3 . Отложенный известняк в конечном итоге образует сталактиты и сталагмиты.
Когда содержащий подземные воды атмосферный CO 2 (уравнения \(\ref{17.21}\) и \(\ref{17.22}\)) попадает в микроскопические трещины в известняковых отложениях, CaCO 3 растворяется в кислого раствора в обратном направлении уравнения \(\ref{17.24}\). Трещины постепенно увеличиваются от 10–50 мкм до 5–10 мм, и этот процесс может занять до 10 000 лет. В конце концов, примерно через 10 000 лет, образуется пещера. Подземные воды с поверхности просачиваются в пещеру и прилипают к потолку, где вода испаряется и вызывает сдвиг равновесия в уравнении \(\ref{17.24}\) вправо. Круглый слой твердого CaCO 3 откладывается, что в конечном итоге приводит к образованию длинного полого шпиля из известняка, называемого сталактитом, который растет вниз с потолка.Ниже, там, где капли падают с потолка, аналогичный процесс вызывает рост другого шпиля, называемого сталагмитом. Те же самые процессы, которые создают впадины под землей, действуют и над землей, в некоторых случаях создавая фантастически запутанные ландшафты, как в провинции Юньнань в Китае (рис. \(\PageIndex{2}\)).
\(\PageIndex{2}\)).
Кислотные, основные и амфотерные оксиды и гидроксиды
Одна из самых ранних классификаций веществ была основана на их растворимости в кислом и щелочном растворе, что привело к классификации оксидов и гидроксидов как основных или кислых. Основные оксиды и гидроксиды либо реагируют с водой с образованием основного раствора, либо легко растворяются в водной кислоте. Кислотные оксиды или гидроксиды либо реагируют с водой с образованием кислого раствора, либо растворяются в водном основании.− (водный) \метка{17.25}\]
\[SO_{3(g)} + H_2O(l) \rightarrow H_2SO_{4(aq)} \label{17.26}\]
Оксид цезия реагирует с водой с образованием основного раствора гидроксида цезия, тогда как триоксид серы реагирует с водой с образованием раствора серной кислоты — действительно очень разные реакции
Оксиды металлов обычно реагируют с водой с образованием основных растворов, тогда как оксиды неметаллов образуют кислые растворы.
Разница в реакционной способности обусловлена разницей в связывании двух видов оксидов.Из-за низкой электроотрицательности металлов в крайней левой части периодической таблицы их оксиды лучше всего рассматривать как содержащие дискретные катионы M n + и анионы O 2−. На другом конце спектра находятся оксиды неметаллов; из-за их более высокой электроотрицательности неметаллы образуют оксиды с ковалентными связями с кислородом. Однако из-за высокой электроотрицательности кислорода ковалентная связь между кислородом и другим атомом, E, обычно поляризована: E δ + –O δ− .{2−}_{4(водн.)} + H_2O (л) \label{17.27}\]
Рисунок \(\PageIndex{3}\): Классификация оксидов элементов основной группы в зависимости от их кислотного или основного характера. В периодической таблице происходит постепенный переход от основных оксидов к кислотным оксидам из нижнего левого угла в верхний правый. Оксиды металлических элементов обычно представляют собой основные оксиды, которые либо реагируют с водой с образованием основного раствора, либо растворяются в водной кислоте. Напротив, оксиды неметаллических элементов представляют собой кислые оксиды, которые либо реагируют с водой с образованием кислого раствора, либо растворяются в водном основании.Оксиды промежуточного характера, называемые амфотерными оксидами, располагаются вдоль диагональной линии между двумя крайними точками. Амфотерные оксиды либо растворяются в кислоте с образованием воды, либо растворяются в щелочи с образованием растворимого комплексного иона. (Радиоактивные элементы не классифицируются.)
Напротив, оксиды неметаллических элементов представляют собой кислые оксиды, которые либо реагируют с водой с образованием кислого раствора, либо растворяются в водном основании.Оксиды промежуточного характера, называемые амфотерными оксидами, располагаются вдоль диагональной линии между двумя крайними точками. Амфотерные оксиды либо растворяются в кислоте с образованием воды, либо растворяются в щелочи с образованием растворимого комплексного иона. (Радиоактивные элементы не классифицируются.) Как показано на рисунке \(\PageIndex{3}\), происходит постепенный переход от основных оксидов металлов к кислым оксидам неметаллов по мере продвижения от нижнего левого угла к верхнему правому в периодической таблица, с широкой диагональной полосой оксидов промежуточного характера, разделяющей две крайности.Многие оксиды элементов этой диагональной области периодической таблицы растворимы как в кислых, так и в щелочных растворах; следовательно, они называются амфотерными оксидами (от греческого амфо, означающего «оба», как в амфипротном). Амфотерные оксиды либо растворяются в кислоте с образованием воды, либо растворяются в основании с образованием растворимого комплекса. Как показано в видео \(\PageIndex{1}\), например, смешивание амфотерного оксида Cr(OH) 3 (также пишется как Cr 2 O 3 • 3H 2 O) с водой дает мутная пурпурно-коричневая взвесь.-}}\mathrm{(aq)}\label{17.29}\]
Амфотерные оксиды либо растворяются в кислоте с образованием воды, либо растворяются в основании с образованием растворимого комплекса. Как показано в видео \(\PageIndex{1}\), например, смешивание амфотерного оксида Cr(OH) 3 (также пишется как Cr 2 O 3 • 3H 2 O) с водой дает мутная пурпурно-коричневая взвесь.-}}\mathrm{(aq)}\label{17.29}\]
Видео \(\PageIndex{1}\): Гидроксид хрома(III) [Cr(OH) 3 или Cr 2 O 3 • 3H 2 O] является примером амфотерного Окись. Все три стакана изначально содержали суспензию коричневато-фиолетового Cr(OH) 3 (s) (в центре). Когда концентрированную кислоту (6 MH 2 SO 4 ) добавляли в химический стакан слева, Cr(OH) 3 растворялся с образованием фиолетового [Cr(H 2 O) 6 ] 3+ ионов и воды.Добавление концентрированного основания (6 М NaOH) в стакан справа вызвало растворение Cr(OH) 3 с образованием зеленых ионов [Cr(OH) 4 ] — . Более полное описание см. на странице https://www.youtube.com/watch?v=IQNcLH6OZK0
Более полное описание см. на странице https://www.youtube.com/watch?v=IQNcLH6OZK0
Пример \(\PageIndex{2}\)
Гидроксид алюминия, обозначаемый как Al(OH) 3 или Al 2 O 3 •3H 2 O, является амфотерным. Напишите химические уравнения, описывающие растворение гидроксида алюминия в кислоте (а) и щелочи (б).
Дано: амфотерное соединение
Запрашиваемый вопрос: реакции растворения в кислоте и щелочи
Стратегия:
Руководствуясь уравнениями \(\ref{17.28}\) и \(\ref{17.29}\), напишите реакции растворения в растворах кислот и оснований.
Раствор
- Кислота отдает протоны гидроксиду с образованием воды и гидратированного иона металла, поэтому гидроксиду алюминия, который содержит три иона OH − на один Al, требуется три иона H + :
\[Al(OH)_{3(s)} + 3H^+ (водн. {3+} (водн.) + 3H_2O (l) \номер\]
{3+} (водн.) + 3H_2O (l) \номер\]
В водном растворе Al 3 + образует комплексный ион [Al(H 2 O) 6 ] 3+ .2_{−(водн.)} \номер\]
Селективное осаждение с использованием pH
Многие растворенные ионы металлов можно отделить путем селективного осаждения катионов из раствора при определенных условиях. В этом методе pH часто используется для контроля концентрации аниона в растворе, который определяет, какие катионы осаждаются.
Концентрацию анионов в растворе часто можно контролировать, регулируя рН, что позволяет избирательно осаждать катионы.{2−}] \метка{17.33c}\]
Таким образом, концентрации сульфидов от 1,6 × 10 90 151 -21 90 152 М до 8,0 × 10 90 151 -24 90 152 М осаждают CdS из раствора, но не ZnS. Как мы получаем такие низкие концентрации сульфида? Насыщенный водный раствор H 2 S содержит 0,10 М H 2 S при 20°C. Значение p K a1 для H 2 S составляет 6,97, а значение p K a2 , соответствующее образованию [S 2− ], равно 12,90.
− (водн.) \label{17.{−13} \метка{17.34d}\]
Мы можем показать, что концентрация S 2− составляет 1,3 × 10 −13 , сравнивая K a1 и K a2 и учитывая, что вклад в [H + диссоциация HS − пренебрежимо мала по сравнению с [H + ] из диссоциации H 2 S. Таким образом, подставляя 0,10 M в уравнение для K a1 для концентрации H 2 S, которая практически постоянна независимо от pH, дает следующее:
\[K_{\textrm{a1}}=1.{2-}}]\]
Хотя [S 2− ] в растворе H 2 S очень мало (1,3 × 10 -13 М), барботирование H 2 S через раствор до насыщения приведет к осаждению ионов обоих металлов, поскольку тогда концентрация S 2– будет намного больше, чем 1,6 × 10 –21 М. Таким образом, мы должны отрегулировать [S 2– ], чтобы оставаться в желаемом диапазоне.
Самый прямой способ сделать это — отрегулировать [H + ] путем добавления кислоты в раствор H 2 S (вспомним принцип Ле Шателье), тем самым установив равновесие в уравнении \(\ref{17.+}]&=0.94\end{align} \label{17.38}\]
Таким образом, добавление сильной кислоты, такой как HCl, чтобы сделать раствор 0,94 М в H + , предотвратит осаждение более растворимого ZnS, гарантируя, что менее растворимый CdS выпадет в осадок, когда раствор будет насыщен H 2 S.
Пример \(\PageIndex{3}\)
Раствор содержит 0,010 М Ca 2 + и 0,010 М La 3 + . Какая концентрация HCl необходима для осаждения La 2 (C 2 O 4 ) 3 •9H 2 O, но не Ca(C 2 O 4 )•H если концентрация щавелевой кислоты равна 1.0 М? K SP Значения 232 × 10 -9 для CA (C 2 O 4 ) и 2,5 × 10 -27 для La 2 (C 2 O 4 ) 3 ; p K a1 = 1,25 и p K a2 = 3,81 для щавелевой кислоты.
Дано: концентрации катионов, K sp значения, а концентрация и p K a значения для щавелевой кислоты
Запрашиваемый: концентрация HCl, необходимая для селективного осаждения La 2 (C 2 O 4 ) 3
Стратегия:
- Напишите каждое выражение произведения растворимости и рассчитайте концентрацию оксалата, необходимую для образования осадка.Определите диапазон концентраций, необходимый для селективного осаждения La 2 (C 2 O 4 ) 3 • 9H 2 O.
- Сложите уравнения первой и второй диссоциации щавелевой кислоты, чтобы получить общее уравнение диссоциации щавелевой кислоты до оксалата. Подставьте [ox 2− ], необходимое для осаждения La 2 (C 2 O 4 ) 3 • 9H 2 O, в общее уравнение диссоциации щавелевой кислоты, чтобы вычислить требуемое [ Н + ].
{2−}] = (0.+}] &=\textrm{6,1 М}\end{align} \nonumber\]
Таким образом, добавление достаточного количества HCl для получения [H + ] = 6,1 M вызовет осаждение из раствора только La 2 (C 2 O 4 ) 3 • 9H 2 O.
Упражнение \(\PageIndex{3}\)
Раствор содержит 0,015 М Fe 2 + и 0,015 М Pb 2 + . Какая концентрация кислоты необходима, чтобы Pb 2 + осаждался в виде PbS в насыщенном растворе H 2 S, а Fe 2 + не осаждался в виде FeS? K sp значения равны 6.3 · 10 −18 для FeS и 8,0 · 10 −28 для PbS.
- Ответить
0,018 М В +
Растворимость гидроксидов, сульфатов и карбонатов
На этой странице обсуждается растворимость гидроксидов, сульфатов и карбонатов элементов группы 2 — бериллия, магния, кальция, стронция и бария — в воде
Основность оксида металла группы II и растворимость гидроксида в воде увеличиваются по мере продвижения вниз по колонке.
BeO и Be(OH)2 амфотерны и реагируют с кислотами и сильными основаниями, такими как NaOH. MgO является основным, а Mg(OH)2 является слабоосновным и не растворяется в растворе NaOH. Оксиды кальция, стронция и бария являются основными, а гидроксиды — сильноосновными. Растворимость гидроксидов в воде следует в следующем порядке: Be(OH)2 < Mg(OH)2 < Ca(OH)2 < Sr(OH)2 < Ba(OH)2.
Оксид металла Основность
Оксиды металлов группы IIстановятся более щелочными по мере продвижения вниз по колонке. Эту тенденцию легко увидеть, если сравнить электроотрицательность металла II группы с электроотрицательностью кислорода.
Элемент Электроотрицательность ∆Электроотрицательность О 3,44 Бе 1,57 1,87 Мг 1,31 2,13 Ca 1,00 2,44 Старший 0. 95
2,49 Ба 0,89 2,55 Как вы можете видеть, электроотрицательность металлов уменьшается вниз по столбцу, в результате чего изменение электроотрицательности увеличивается вниз по группе. Чем больше разница в электроотрицательности, тем более ионной становится связь металл-кислород. Чем более ионна связь металл-кислород, тем более основным является оксид
.Растворимость гидроксидов
Гидроксиды металлов группы II становятся более растворимыми в воде по мере продвижения вниз по колонке.Эту тенденцию можно объяснить уменьшением энергии решетки гидроксида соли и увеличением координационного числа иона металла по мере спуска по колонке.
Элемент Энергия решетки (кДж/моль) Координационный номер Бе 3620 4 Мг 2998 6 Ca 2637 6 Старший 2474 8 Ба 2330 8 Чем больше энергия решетки, тем больше энергии требуется для ее разрушения на ионы металла и гидроксида.
Поскольку атомные радиусы увеличиваются вниз по группе, имеет смысл, что координационные числа также увеличиваются, потому что чем больше ион металла, тем больше места для координации с ним молекул воды.
Следующие примеры иллюстрируют эту тенденцию:
- Гидроксид магния не растворяется в воде. Однако, если его встряхнуть в воде и профильтровать, раствор будет слегка щелочным. Это свидетельствует о том, что в растворе больше гидроксид-ионов, чем в исходной воде.Это связано с тем, что часть гидроксида магния растворилась.
- Раствор гидроксида кальция называют «известковой водой». В литре чистой воды растворяется около 1 г гидроксида кальция при комнатной температуре.
- Гидроксид бария достаточно растворим для получения раствора с концентрацией около 0,1 моль дм -3 при комнатной температуре.
Растворимость сульфатов
- Сульфаты становятся менее растворимыми по группе.
Эта простая тенденция справедлива при условии, что рассматривается гидратированный сульфат бериллия, а не безводный сульфат бериллия.
В книге данных Наффилда безводный сульфат бериллия BeSO 4 указан как нерастворимый, тогда как гидратированная форма BeSO 4 .4H 2 O является растворимой с растворимостью около 39 г BeSO 4 на 100 г. воды комнатной температуры. Показатели растворимости сульфата магния и сульфата кальция также варьируются в зависимости от того, гидратирована ли соль или нет, но изменения менее значительны.
Два общих примера иллюстрируют эту тенденцию:
- Известная реакция между магнием и разбавленной серной кислотой приводит к образованию газообразного водорода и бесцветного раствора сульфата магния.Обратите внимание, что образуется раствор, а не осадок, что означает растворимость сульфата магния.
- Сульфат бария существует в виде белого осадка в растворе. Быстрое образование осадка указывает на то, что сульфат бария совершенно нерастворим. Фактически, 1 литр воды растворяет около 2 мг сульфата бария при комнатной температуре.
Растворимость карбонатов
Карбонаты становятся менее растворимыми вниз по группе. Все карбонаты группы 2 очень малорастворимы.Карбонат магния, например, имеет растворимость около 0,02 г на 100 г воды при комнатной температуре. Данных по карбонату бериллия мало, но поскольку он реагирует с водой, тенденция неясна. Однако тенденция к снижению растворимости нарушается в нижней части группы: карбонат бария растворяется немного лучше, чем сульфат стронция. Простых примеров этой тенденции нет.
Авторы и авторство
Реакции оксидов периода III с водой
Ионные оксиды Na 2 O и MgO растворимы в воде, хотя MgO лишь незначительно.В воде небольшие высокозаряженные ионы оксида сильно притягивают молекулы воды, и за гидратацией следует гидролиз.
O 2- (водн.) + H 2 O (л) → 2OH — (водн.)
Ионы натрия, имеют низкую плотность заряда и гидролиза не происходит.
Небольшой гидролиз происходит с ионами Mg 2 + (как видно ранее с хлоридами), но этот эффект мал по сравнению с гидролизом оксидных ионов.
Баланс этих реакций гидролиза означает, что эти водные растворы этих оксидов имеют высокие значения pH с Na 2 O (водн.) >MgO (водн.) .
NA 2 O (S) + H (S) + H 2 O (L) → 2NAOOOR (AQ) — PH 14
MGO (S) + H 2 O (L ) → Mg(OH) 2(водн.) — pH 12
Оксид Al 2 O 3 нерастворим в воде из-за высокой энергии решетки.
Реагирует с кислотами и щелочами, проявляя промежуточные свойства между металлическими и неметаллическими оксидами. Al 2 O 3 является амфотерным.
В этих оксидах элемент периода 3 ковалентно связан с кислородом.
В большинстве ковалентных оксидов очень электроотрицательный кислород индуцирует небольшой положительный заряд на атоме, к которому он присоединен.

 0
0
 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
 Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.

 − (водн.) \label{17.{−13} \метка{17.34d}\]
− (водн.) \label{17.{−13} \метка{17.34d}\] Самый прямой способ сделать это — отрегулировать [H + ] путем добавления кислоты в раствор H 2 S (вспомним принцип Ле Шателье), тем самым установив равновесие в уравнении \(\ref{17.+}]&=0.94\end{align} \label{17.38}\]
Самый прямой способ сделать это — отрегулировать [H + ] путем добавления кислоты в раствор H 2 S (вспомним принцип Ле Шателье), тем самым установив равновесие в уравнении \(\ref{17.+}]&=0.94\end{align} \label{17.38}\]
 {2−}] = (0.+}] &=\textrm{6,1 М}\end{align} \nonumber\]
{2−}] = (0.+}] &=\textrm{6,1 М}\end{align} \nonumber\] BeO и Be(OH)2 амфотерны и реагируют с кислотами и сильными основаниями, такими как NaOH. MgO является основным, а Mg(OH)2 является слабоосновным и не растворяется в растворе NaOH. Оксиды кальция, стронция и бария являются основными, а гидроксиды — сильноосновными. Растворимость гидроксидов в воде следует в следующем порядке: Be(OH)2 < Mg(OH)2 < Ca(OH)2 < Sr(OH)2 < Ba(OH)2.
BeO и Be(OH)2 амфотерны и реагируют с кислотами и сильными основаниями, такими как NaOH. MgO является основным, а Mg(OH)2 является слабоосновным и не растворяется в растворе NaOH. Оксиды кальция, стронция и бария являются основными, а гидроксиды — сильноосновными. Растворимость гидроксидов в воде следует в следующем порядке: Be(OH)2 < Mg(OH)2 < Ca(OH)2 < Sr(OH)2 < Ba(OH)2. 95
95 Поскольку атомные радиусы увеличиваются вниз по группе, имеет смысл, что координационные числа также увеличиваются, потому что чем больше ион металла, тем больше места для координации с ним молекул воды.
Поскольку атомные радиусы увеличиваются вниз по группе, имеет смысл, что координационные числа также увеличиваются, потому что чем больше ион металла, тем больше места для координации с ним молекул воды. В книге данных Наффилда безводный сульфат бериллия BeSO 4 указан как нерастворимый, тогда как гидратированная форма BeSO 4 .4H 2 O является растворимой с растворимостью около 39 г BeSO 4 на 100 г. воды комнатной температуры. Показатели растворимости сульфата магния и сульфата кальция также варьируются в зависимости от того, гидратирована ли соль или нет, но изменения менее значительны.
В книге данных Наффилда безводный сульфат бериллия BeSO 4 указан как нерастворимый, тогда как гидратированная форма BeSO 4 .4H 2 O является растворимой с растворимостью около 39 г BeSO 4 на 100 г. воды комнатной температуры. Показатели растворимости сульфата магния и сульфата кальция также варьируются в зависимости от того, гидратирована ли соль или нет, но изменения менее значительны.