УРОК 18. Валентність хімічних елементів
УРОК 18
Валентність хімічних елементів
Мета: — вивчити правильність записування хімічних формул простих і складних речовин;
розвинути вміння використовувати хімічні символи та індекси; визначати якісний та кількісний склад речовин;
виховати значення математичних обчислень під час описування формул.
Тип уроку: поглиблення знань, умінь та навичок.
Форми роботи: хімічний диктант, фронтальна бесіда, виконання вправ.
Обладнання: ПСХЕ, картки із завданнями.
Хід уроку
Організація класу.
Вчитель диктує назви формул простих та складних речовин, а учні по порядку біля дошки записують хімічні формули даних речовин: водень, залізо, вода, азот, метан, золото, мідь, вуглекислий газ, йод, сірка, фтор, срібло, кисень, озон.
Актуальність опорних знань. Фронтальна бесіда
Дані речовини розподіліть у 2 стопчики: 1) прості речовини; 2) складні.
Що спільного між даними речовинами, а що відмінного?
Отже, спільне є те, що всі речовини складаються з певних хімічних елементів – мають свій якісний склад. Відмінним є те, що кількість певних хімічних елементів у кожної хімічної формули своя, тобто кількісний склад.
- Вивчення нового матеріалу.
Хімічна формула – це умовний запис складу речовини за допомогою хімічних символів та індексів. Кожна речовина має лише одну хімічну формулу. Наприклад: вуглекислий газ – СО2.
Якісний склад: вуглекислий газ складається з Карбону та Оксисену.
Кількісний склад: сполука складається з одного атома Карбону та двох атомів Оксисену (Якщо індексу біля хімічного елемента немає, то він дорівнює одиниці).
Для того, щоб показати кількість молекул, або атомів використовують коефіцієнти. Наприклад: запис 3Н2О означає три молекули води, запис 4Н означає чотири атоми Гідрогену.
Спробуйте самостійно прочитати дані записи: 7СО2; 2Н2; 8С; 5СН4; 4N2.
Зверніть увагу, що одні і ті ж атоми досить часто мають різні індекси. Розгляньмо 4 різні сполуки:
НІ – йодидна кислота; Н2S – сульфідна кислота; NН3– амоніак; СН4 – метан.
У даних формулах ми можемо побачити, що різні хімічні елементи мають здатність приєднувати певну кількість атомів Гідрогену.
Отже, валентність – це властивість атомів хімічного елемента з’єднуватися з певним числом атомів того самого або інших хімічних елементів.
Атом Гідрогену завжди має валентність один, спробуймо визначити валентність інших хімічних елементів.
НІ – Гідрогену 1.1 = 1, Йоду 1.1 = 1, звідси видно, що кількість двох хімічних елементів однакова.
Н2S – Гідрогену 1.2 = 2, а Сульфуру х.1 = 2, отже х=2, тобто валентність Сульфуру у даній сполуці 2.NН3 – Гідроген — |, Нітроген — |||; СН4– Карбон — |v.
Валентність записується завжди римськими числами.
Як визначити правильно валентність ?
Закріплення знань, умінь та навичок.Виконання вправ
Учні виконують завдання по порядку на дошці із картки.
Картка ,, Визначення валентностей хімічних елементів у бінарних сполуках”
K2О, СаО, Н2О, N2O5, N2O3, SO3, Cl2O7, XEO4.
Визначте валентності хімічних елементів, знаючи, що:
а) валентність хімічних елементів 1-А групи завжди дорівнює |:
Rb2S, Li3N, KCl, Na2O, Na3P;
б) валентність хімічних елементів другої групи завжди дорівнює ||:
ВаО, МgS, BaI2,Мg3P2, BaCl2;
в) валентність хімічних елементів третьої групи завжди дорівнює |||:
Al2O3, AlCl3,AlN,Al2S3,AlI3;г) для атомів елементів 4, 5, 6, 7 груп валентність у сполуках з Оксигеном становить номеру групи: Аs2O5, I2O7, SiO2;
д) для атомів 4, 5, 6, 7 груп валентність у сполукух з Оксигеном становить 8 відняти номер групи: SiH4, P2O5, SeO3, HF.
Підсумок уроку.Фронтальна бесіда
Домашнє завдання.
Вивчити Ст.57 – 61, виконати № 2 – 3 Ст.63 (письмово).
Валентність хімічних елементів
Розглядаючи формули різних сполук, неважко помітити, що число атомів одного і того ж елемента в молекулах різних речовин не однаково. Наприклад, HCl, Nh5Cl, h3S, h4PO4 і т.д. Число атомів водню в цих сполуках змінюється від 1 до 4. Це характерно не тільки для водню.
Як же вгадати, який індекс поставити поряд з позначенням хімічного елементу? Як складаються формули речовини? Це легко зробити, коли знаєш валентність елементів, що входять до складу молекули даної речовини.
Валентність – це властивість атома даного елемента приєднувати, утримувати або заміщати в хімічних реакціях певну кількість атомів іншого елемента. За одиницю валентності прийнята валентність атома водню. Тому іноді визначення валентності формулюють так: валентність – це властивість атома даного елемента приєднувати або заміщати певну кількість атомів водню.
Якщо до одного атома даного елемента прикріплюється один атом водню, то елемент одновалентен, якщо два – двухвалентен і т.д. Водневі сполуки відомі не для всіх елементів, але майже всі елементи утворюють сполуки з киснем О. Кисень вважається постійно двовалентних.
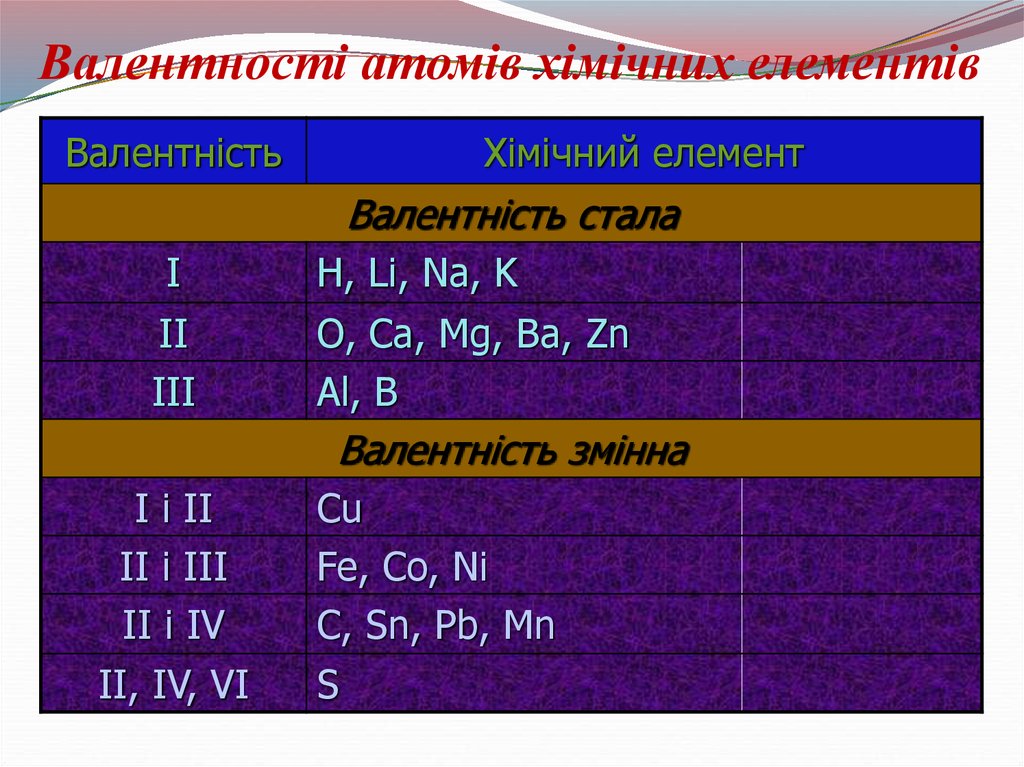
Постійна валентність:
I – H, Na, Li, K, Rb, Cs
II – O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
III – B, Al, Ga, In
Але як вчинити в тому випадку, якщо елементи не з’єднується з воднем? Тоді валентність необхідного елемента визначають за валентності відомого елемента. Найчастіше її знаходять, використовуючи валентність кисню, тому що у з’єднаннях його валентність завжди дорівнює 2. Наприклад, не складе труднощів знайти валентність елементів у таких сполуках: Na2O (валентність Na – 1, O – 2), Al2O3 (валентність Al – 3, O – 2).
Хімічну формулу даної речовини можна скласти, тільки знаючи валентність елементів. Наприклад, скласти формули таких сполук, як CaO, BaO, CO, просто, тому що число атомів в молекулах однаково, оскільки валентності елементів рівні.
А якщо валентності різні? Коли ми діємо в такому випадку? Необхідно запам’ятати наступне правило: у формулі будь-якого хімічної сполуки твір валентності одного елемента на число його атомів в молекулі дорівнює добутку валентності на число атомів іншого елемента. Наприклад, якщо відомо, що валентність Mn в з’єднанні дорівнює 7, а O – 2, тоді формула з’єднання буде виглядати так Mn2O7.
ВалентностьКак ж ми отримали формулу?
Розглянемо алгоритм складання формул по валентності для складаються з двох хімічних елементів.
Існує правило, що число валентностей у одного хімічного елемента дорівнює числу валентностей в іншого. Розглянемо на прикладі утворення молекули, що складається з марганцю і кисню.
Будемо складати відповідно до алгоритму:
1. Записуємо поруч символи хімічних елементів:
Mn O
2. Ставимо над хімічними елементами цифрами їх валентності (валентність хімічного елемента можна знайти в таблиці періодичної системи Менделева, у марганцю – 7, у кисню – 2.Valentnost 1
3. Знаходимо найменше спільне кратне (найменше число, яке ділиться без залишку на 7 і на 2). Це число 14. Ділимо його на валентності елементів 14: 7 = 2, 14: 2 = 7, 2 і 7 будуть індексами, відповідно у фосфору і кисню. Підставляємо індекси.
Valentnost 2Зная валентність одного хімічного елемента, слідуючи правилу: валентність одного елемента × число його атомів в молекулі = валентність іншого елемента × число атомів цього (іншого) елемента, можна визначити валентність іншого.
Mn2O7 (7 · 2 = 2 · 7).
2х = 14,
х = 7.
Поняття про валентності було введено в хімію до того, як стало відомо будова атома. Зараз встановлено, що ця властивість елемента пов’язане з числом зовнішніх електронів. Для багатьох елементів максимальна валентність випливає з положення цих елементів у періодичній системі.
« Кристалічні решітки Ліквідація гетьманства і знищення Запорізької Січі »Як визначити валентність хімічного елемента по таблиці Менделєєва
Поняття «валентність» формувалася в хімії з початку 19-го століття. Англійський вчений Е. Франкленд звернув увагу, що всі елементи можуть утворювати з атомами інших елементів тільки певну кількість зв’язків.
Він назвав це «сполучної силою». Пізніше німецький вчений Ф. А. Кекуле вивчав метан і прийшов до висновку, що один атом вуглецю може приєднати, в нормальних умовах, тільки чотири атома водню.
Він назвав це основністю.
Основність вуглецю дорівнює чотирьом.
Тобто вуглець може утворити чотири зв’язку з іншими елементами.
Подальший розвиток це поняття отримало в роботах Д. І. Менделєєва. Дмитро Іванович розвивав вчення про періодичну зміну властивостей простих речовин. Сполучну силу він визначав як здатність елемента приєднувати певну кількість атомів іншого елемента.
Визначення по таблиці Менделєєва
Таблиця Менделєєва дозволяє з легкістю визначати основність елементів. Для цього потрібно вміти читати періодичну таблицю. Таблиця по вертикалі має вісім груп, а по горизонталі розташовуються періоди. Якщо період складається з двох рядів, то його називають великим, а якщо з одного ряду – малим. Елементи по вертикалі в шпальтах, в групах розподілені нерівномірно.
Валентність завжди позначається римськими цифрами.
Щоб визначити валентність, потрібно знати, яка вона буває.
- У металів головних підгруп валентність завжди постійна.
- У неметалів і металів побічних підгруп може бути змінною.
Також:
- Постійна валентність дорівнює номеру групи.
- Змінна валентність може бути вищою і нижчою.
Вища змінна дорівнює номеру групи, а нижча вираховується за формулою: вісім мінус номер групи. При визначенні потрібно пам’ятати:
- у водню валентність дорівнює I;
- у кисню – II.
Якщо з’єднання має атом водню або кисню, то визначити його валентність не складає труднощів, особливо якщо перед нами гідрид або оксид.
Формула і алгоритм
Найменша валентність у тих елементів, які розташовані правіше і вище в таблиці. І, навпаки, якщо елемент нижче і лівіше, то вона буде вище. Щоб визначити її, необхідно слідувати універсального алгоритму:
- Записуємо формулу сполуки.
- Проставляємо валентність того компонента сполуки, якого знаємо.
- Множимо відому величину на кількість атомів елементу в з’єднанні.
- Знаходимо найменше кратне.
- Проводимо перевірку: множимо значення на індекс. Повинна виходити однакова цифра по кожному компоненту з’єднання.
Приклад: візьмемо з’єднання аміаку – NH3. Нам відомо, що у атома водню валентність постійна і дорівнює I. Множимо I на 3 (кількість атомів) – найменше кратне – 3. У азоту в цій формулі індекс дорівнює одиниці. Звідси висновок: 3 ділимо на 1 і отримуємо, що у азоту валентність дорівнює III.
Валентність за воднем і киснем завжди визначати легко.
Складніше, коли її необхідно визначати без них. Наприклад, з’єднання SiCl4. Як визначити валентність елементів в цьому випадку? Хлор знаходиться в 7 групі. Значить, його валентність або 7, або 1 (вісім мінус номер групи). Кремній знаходиться в четвертій групі, значить, його потенціал для утворення зв’язків дорівнює чотирьом. Стає логічно, що хлор проявляє в цій ситуації найменшу валентність і вона дорівнює I.
У сучасних підручниках хімії завжди є таблиця валентності хімічних елементів. Це істотно полегшує завдання учням. Тему вивчають у восьмому класі – в курсі неорганічної хімії.
Сучасні уявлення
Сучасні уявлення про валентність базуються на будову атомів. Атом складається з ядра і електронів, які обертаються навколо нього по орбіталям.
Саме ядро складається з протонів і нейтронів, які визначають атомну вагу. Для того, щоб речовина була стабільною, її енергетичні рівні повинні бути заповнені і мати вісім електронів.
При взаємодії елементи прагнуть до стабільності і або віддають свої неспарені електрони, або приймають їх.
Взаємодія відбувається за принципом «що легше» – віддати або прийняти електрони. Від цього також залежить те, як змінюється валентність в таблиці Менделєєва.
Кількість неспарених електронів на зовнішній енергетичній орбіталі дорівнює номеру групи.
В якості прикладу
Лужний метал натрій знаходиться в першій групі періодичної системи Менделєєва. Це означає, що у нього один неспарений електрон на зовнішньому енергетичному рівні.
Хлор знаходиться в сьомій групі. Це означає, що у хлору є сім неспарених електронів.
Для завершення енергетичного рівня, хлору не вистачає рівно одного електрона. Натрій віддає йому свій електрон і стає стабільним в з’єднанні. Хлор отримує додатковий електрон і теж стає стабільним. В результаті з’являється зв’язок і міцне з’єднання – NaCl – знаменита кухонна сіль. Валентність хлору і натрію в цьому випадку дорівнює 1.
« Механізм утворення водневого зв’язку Катіони і аніони в хімії »Валентність хімічних елементів
Стр 1 из 3Следующая ⇒Словник термінів і понять
Алотропія —явище існування декількох простих речовин, утворених одним хімічним елементом.
Атом – найменша хімічно неподільна частинка.
Атом — це хімічно неподільна електронейтральна частинка речовини, що складається з позитивно зарядженого ядра й негативно заряджених електронів.
Валентність – це число (ціле), яке показує, скільки атомів (Н) може приєднати даний атом.Валентність характеризує здатність атома утворювати певну кількість хімічних зв’язків, яка може бути пов’язаною із здатністю атомів віддавати або приєднувати певне число
Відносна атомна маса — фізична величина, яка показує, у скільки разів маси атомів хімічних елементів більші від атомної одиниці маси. Ця величина становить 1/12 маси атома нукліда Карбону 12С. Маса атома цього нукліда, яка дорівнює 19,93 ∙ 10-27 кг, прийнята за 12 а. о. м. Із цього випливає, що 1 а. о. м. = 1,66 ∙ 10-27 кг. Відносна молекулярна маса— це фізична величина, що визначається відношенням маси молекули до маси однієї дванадцятої частини маси атома нукліда Карбону 12С. Електронні формулисхематично відображають механізм утворення хімічних зв’язків у молекулах. їх записують за допомогою символів хімічних елементів і крапок, які позначають електрони зовнішнього електронного рівня.
Індекс – це число атомів даного елемента у формулі.
Кількість речовини— це фізична величина, що визначається числом часток у даній порції речовини (структурних елементів речовини: молекул, атомів, іонів).
Кислота– складна речовина, утворена кислотним залишком і такою кількістю атомів гідрогену, як його валентність.
Коефіцієнт – число перед формулою, яке вказує на число структурних частинок (атомів, молекул).
Луг – розчинна у воді основа.
Моль — це така кількість речовини, що містить стільки ж структурних елементів речовини (молекул, атомів, іонів), скільки міститься атомів у нукліді Карбону 12С масою 0,012кг.
Молярна маса— це фізична величина, що дорівнює масі речовини кількістю 1 моль.
Молярний об’єм— це фізична величина, яка дорівнює об’єму речовини кількістю речовини 1 моль.
Оксиди– складні речовини, утворені двома елементами, один з яких – Оксиген з валентністю ІІ.
Оксид кислотний– оксид, якому відповідає кислота.
Оксид основний– оксид, якому відповідає основа.
Основа – складна речовина, утворена одним атомом металу і такою кількістю гідроксильних (ОН) груп, як валентність даного металу.
Молекула – найдрібніша частина речовини, що зберігає її властивості.
Проста речовина – це речовина, утворена атомами одного елемента.
Складна речовина – це речовина, яка утворена кількома видами атомів.
Солі –складні речовини, утворені атомами металу та кислотним залишком.
Структурні формуливідображають порядок з’єднання атомів або груп атомів у молекулах.
Реакція заміщення – це реакція між простою і складною речовиною, коли атоми простої заміщують один з видів атомів складної речовини.
Реакція обміну – реакція між складними речовинами, які обмінюються своїми складовими частинами.
Реакція сполучення – це реакція, під час якої з кількох речовин утворюється одна нова речовина.
Реакція розкладу — це реакція, під час якої з однієї складної речовини утворюється кілька нових речовин.
Рівняння хімічної реакції– це умовне зображення реакцій за допомогою формул і коефіцієнтів.
Хімія – це наука про речовини та їх перетворення.
Хімічне рівняння — це умовний запис хімічної реакції за допомогою хімічних формул і коефіцієнтів.
Хімічна реакція– це хімічне явище, при якому проходять хімічні перетворення одних речовин в інші. Речовини, що вступають в реакцію, називаються реагентами (вихідними речовинами), а ті, що утворюються – продуктами реакції.
Хімічна рівновага– стан системи, при якому швидкість прямої реакції дорівнює швидкості зворотної реакції.
Хімічні явища– це такі явища, під час перебігу яких одні речовини перетворюються в інші, що відрізняються від вихідних за складом і властивостями.
Хімічний елемент— це різновид атомів з певним (однаковим) зарядом ядра.
Фізичні явища– це такі явища, під час перебігу яких змінюється
форма, агрегатний стан речовини, але нова речовина не утворюється.
Формула (хімічна) — умовний запис якісного та кількісного складу речовин за допомогою знаків та індексів.
Протонне число— число протонів, що входять до складу ядра атома.
Нейтронне число— число нейтронів, що входять до складу ядра атома.
Нуклонне число— число нуклонів (протонів і нейтронів) у ядрі атома.
Атоми з однаковим протонним і нейтронним числом називають нуклідами.
Нукліди з однаковим протонним числом, але різним нейтронним числом називають ізотопами.
Методи розділення сумішей
| Назва методу | Короткий опис | Які суміші можна розділяти |
| Розділення за допомогою магніту | Заснований на здатності деяких речовин притягатися магнітом | Суміші твердих речовин, одна з яких притягається магнітом |
| Відстоювання | Суміш двох рідин поміщають у воду, або розчин, залишають на якийсь час, аж доки вона не розшарується. Далі відокремлюють шари з речовинами. | Неоднорідні суміші двох твердих або двох рідких речовин з різною густиною |
| Фільтрування | Суміш пропускають через тіло, в якому є пори (отвори) відповідного розміру (сито або фільтр) | Неоднорідні суміші рідких і твердих, твердих і газоподібних (пил), рідких і газоподібних речовин |
| Випарювання | Суміш повільно нагрівають до такої температури, при якій рідина випаровується, а тверда речовина залишається у вигляді кристалів | Однорідні суміші рідких і твердих речовин |
| Кристалізація | Із розчину твердої речовини в рідині випаровується частково рідина. При цьому після охолодження тверда речовина випадає в осад у вигляді кристалів | Однорідні суміші розчинних твердих і рідких речовин |
| Дистиляція (перегонка) | Суміш двох рідин поступово нагрівають. При цьому більш легкозакипна речовина випаровується раніше, після чого пару охолоджують у холодильнику й конденсат збирають в окрему посудину (приймачі) | Однорідні суміші двох рідин з різними температурами кипіння |
Валентність хімічних елементів
| Валентність | Хімічний елемент | Приклади хімічних сполук |
| валентність стала | ||
| I | H, Li, Na, K | H2O, Na2O |
| II | O, Ca, Mg, Ba, Zn | CaO, MgO |
| III | Al | Al2O3 |
| валентність змінна | ||
| I i II | Cu | Cu2O, CuO |
| II i III | Fe, Co | FeO, Fe2O3 |
| II i IV | C, Sn, Pb | CO, CO2, SnO, SnO2 |
| III i V | P | PH3, P2O5 |
| II, III, VI | Cr | CrO, Cr2O3, CrO3 |
| II, IV, VI | S | H2S, SO2, SO3 |
| I, II, III, IV, V | N | N2O, NO, NH3, NO2, N2O5 |
Визначення валентності елементів за формулою.
У формулах бінарних сполук сумарна валентність усіх атомів одного елемента завжди дорівнює сумарній валентності всіх атомів іншого елемента.
Наприклад,ІІІ ІІІІ ІІ І ІІ
Сr2O3 CuO Na2O
Послідовність складання хімічних формул за валентністю:
1. Над символами елементів написати валентність.
2. Знайти найменше спільне кратне.
3. Поділити найменше спільне кратне на валентність кожного елемента.
4. Отримані числа записати в хімічній формулі як індекси.
Наприклад:
1. AlІІІОІІ
2. Найменше спільне кратне 6 (3 · 2 = 6).
3. Al – 6 : 3 = 2; O – 6 : 2 = 3.
4. Al2O3.
Основні закони хімії
Закон збереження маси: сума мас речовин, які прореагували, дорівнює сумі мас речовин, що утворилися внаслідок реакції.
У природі ніщо не виникає з нічого і не зникає безслідно.
Закон сталості складу:кожна хімічна сполука має сталий якісний і кількісний склад незалежно від способу її добування.
Закон Гей-Люссака: об’єми газів, що вступають у реакцію, відносяться один до одного і до об’ємів газоподібних продуктів реакції як прості цілі числа (за однакових умов).
Коефіцієнти перед газоподібними речовинами у хімічному рівнянні дорівнюють об’ємам газів.
Об’єднаний газовий закон:
 = const; або
= const; або 
де P0, V0, T0 – тиск, об’єм і температура газу за нормальних умов
(P0 = 101325 Па, Т0 = 273 К).
Рівняння Менделєєва-Клапейронаописує залежність об’єму газу від кількості речовини цього газу, температури і тиску.
PV =  RTабо PV = νRT ,
RTабо PV = νRT ,
де P – тиск газу, Па; V – об’єм газу, л; m – маса газу, г;
M – молярна маса газу, г/моль; ν – кількість речовини газу, моль;
R – універсальна газова стала, R = 8,314 Дж/(моль·К).
Закон Авогадро:в однакових об’ємах різних газів за однакових умов міститься однакове число молекул.
1 моль будь-якої речовини містить 6,02·1023 структурних одиниць (молекул, атомів, йонів, електронів).
Молярний об’єм– це об’єм 1 моль газу. За нормальних умов (P0 = 101,3 кПа,
Т0 = 273 К) він дорівнює 22,4 л/моль.
Кількісні величини в хімії
План характеристики хімічних елементів за положенням
Найважливіші кислоти
| назва | формула | традиційна назва | валентність кислотного залишку | назва кислотного залишку |
| боратна | Н3ВО3 | борна | ІІІ | борат |
| бромідна | НВr | бромоводнева | І | бромід |
| дихроматна | Н2Сr2О7 | дихромова | ІІ | дихромат |
| етанова | СН3СООН | оцтова | І | ацетат |
| йодидна | НІ | йодоводнева | І | йодид |
| карбонатна | Н2СО3 | вугільна | ІІ | карбонат |
| нітратна | НNО3 | азотна | І | нітрат |
| нітритна | НNО2 | азотиста | І | нітрит |
| перманганатна | НМnО4 | марганцева | І | перманганат |
| перхлоратна | НСlО4 | хлорна | І | перхлорат |
| силікатна | Н2SіО3 | кремнієва | ІІ | силікат |
| сульфатна | Н2SО4 | сірчана | ІІ | сульфат |
| сульфітна | Н2SО3 | сірчиста | ІІ | сульфіт |
| сульфідна | Н2S | сірководнева | ІІ | сульфід |
| метафосфатна | НРО3 | метафосфорна | І | метафосфат |
| ортофосфатна | Н3РО4 | фосфорна, ортофосфатна | ІІІ | фосфат |
| фторидна | НF | фтороводнева, плавікова | І | фторид |
| хлоридна | НСl | хлороводневі, соляна | І | хлорид |
| ціанідна | НСN | синільна | І | ціанід |
Ряд активності кислот:
сильні середні слабкі
НІ, HClО4,H2SO4,HF, СН3СООН, H2CO3,
HCl, HNO3H3PO4, H2SO3 H2S, H2SiO3
| Кислотний оксид | Кислота |
| СО2 | Н2СО3 |
| SO2 | H2SO3 |
| SO3 | H2SO4 |
| P2O5 | H3PO4 |
| N2O5 | HNO3 |
| N2O3 | HNO2 |
| SiO2 | H2SiO3 |
| Амфотерні оксиди | |
| ZnO | H2ZnO2 |
| Al2O3 | HAlO2 |
| Класифікація хімічних реакцій | |||
| Склад та кількість вихідних речовин і продуктів реакції | Енергетичний ефект | Зміна ступенів окиснення елементів | Оберненість |
| ® Сполучення ® Розкладу ® Заміщення ® Обміну | ® Екзотермічні ® Ендотермічні | ® Без зміни ступенів окиснення елементів ® Окисно-відновні реакції | ® Обернені, ® Ті, що їдуть до кінця |
| Класифікація хімічних реакцій за складом та кількістю вихідних речовин і продуктів реакції | ||
| Тип реакції | Схема реакції | Приклад |
| Сполучення | А + В = АВ | Zn + S = ZnS |
| Розкладу | АВ = А+В | 2HgO = 2Hg + O2 |
| Заміщення | АВ + С = АС + В | 2NaBr + Cl2 = 2NaCl +Br2 |
| Обміну | АВ + СD = АD + СВ | NaOH + HCl = NaCl + H2O |

Можливі ступеня окиснення
Деяких хімічних елементів
| Хімічний елемент | Значення ступеня окиснення | Хімічний елемент | Значення ступеня окиснення |
| С | -4,-1, 0, +2, +4 | I | -1, 0, +1, +3, +5, +7 |
| Сl | -1, 0, +1, +3, +5, +7 | Mn | 0, +2, +3, +4, +6, +7 |
| Cr | 0, +2, +3, +6 | N | -3, -2, 0, +1, +2, +3, +4, +5 |
| F | -1, 0 | P | -3, 0, +3, +5 |
| Fe | 0, +2, +3, +6 | S | -2, 0, +4, +6 |
| H | -1, 0, +1 | Si | -4, 0, +2, +4 |
Словник термінів і понять
Алотропія —явище існування декількох простих речовин, утворених одним хімічним елементом.
Атом – найменша хімічно неподільна частинка.
Атом — це хімічно неподільна електронейтральна частинка речовини, що складається з позитивно зарядженого ядра й негативно заряджених електронів.
Валентність – це число (ціле), яке показує, скільки атомів (Н) може приєднати даний атом.Валентність характеризує здатність атома утворювати певну кількість хімічних зв’язків, яка може бути пов’язаною із здатністю атомів віддавати або приєднувати певне число
Відносна атомна маса — фізична величина, яка показує, у скільки разів маси атомів хімічних елементів більші від атомної одиниці маси. Ця величина становить 1/12 маси атома нукліда Карбону 12С. Маса атома цього нукліда, яка дорівнює 19,93 ∙ 10-27 кг, прийнята за 12 а. о. м. Із цього випливає, що 1 а. о. м. = 1,66 ∙ 10-27 кг. Відносна молекулярна маса— це фізична величина, що визначається відношенням маси молекули до маси однієї дванадцятої частини маси атома нукліда Карбону 12С. Електронні формулисхематично відображають механізм утворення хімічних зв’язків у молекулах. їх записують за допомогою символів хімічних елементів і крапок, які позначають електрони зовнішнього електронного рівня.
Індекс – це число атомів даного елемента у формулі.
Кількість речовини— це фізична величина, що визначається числом часток у даній порції речовини (структурних елементів речовини: молекул, атомів, іонів).
Кислота– складна речовина, утворена кислотним залишком і такою кількістю атомів гідрогену, як його валентність.
Коефіцієнт – число перед формулою, яке вказує на число структурних частинок (атомів, молекул).
Луг – розчинна у воді основа.
Моль — це така кількість речовини, що містить стільки ж структурних елементів речовини (молекул, атомів, іонів), скільки міститься атомів у нукліді Карбону 12С масою 0,012кг.
Молярна маса— це фізична величина, що дорівнює масі речовини кількістю 1 моль.
Молярний об’єм— це фізична величина, яка дорівнює об’єму речовини кількістю речовини 1 моль.
Оксиди– складні речовини, утворені двома елементами, один з яких – Оксиген з валентністю ІІ.
Оксид кислотний– оксид, якому відповідає кислота.
Оксид основний– оксид, якому відповідає основа.
Основа – складна речовина, утворена одним атомом металу і такою кількістю гідроксильних (ОН) груп, як валентність даного металу.
Молекула – найдрібніша частина речовини, що зберігає її властивості.
Проста речовина – це речовина, утворена атомами одного елемента.
Складна речовина – це речовина, яка утворена кількома видами атомів.
Солі –складні речовини, утворені атомами металу та кислотним залишком.
Структурні формуливідображають порядок з’єднання атомів або груп атомів у молекулах.
Реакція заміщення – це реакція між простою і складною речовиною, коли атоми простої заміщують один з видів атомів складної речовини.
Реакція обміну – реакція між складними речовинами, які обмінюються своїми складовими частинами.
Реакція сполучення – це реакція, під час якої з кількох речовин утворюється одна нова речовина.
Реакція розкладу — це реакція, під час якої з однієї складної речовини утворюється кілька нових речовин.
Рівняння хімічної реакції– це умовне зображення реакцій за допомогою формул і коефіцієнтів.
Хімія – це наука про речовини та їх перетворення.
Хімічне рівняння — це умовний запис хімічної реакції за допомогою хімічних формул і коефіцієнтів.
Хімічна реакція– це хімічне явище, при якому проходять хімічні перетворення одних речовин в інші. Речовини, що вступають в реакцію, називаються реагентами (вихідними речовинами), а ті, що утворюються – продуктами реакції.
Хімічна рівновага– стан системи, при якому швидкість прямої реакції дорівнює швидкості зворотної реакції.
Хімічні явища– це такі явища, під час перебігу яких одні речовини перетворюються в інші, що відрізняються від вихідних за складом і властивостями.
Хімічний елемент— це різновид атомів з певним (однаковим) зарядом ядра.
Фізичні явища– це такі явища, під час перебігу яких змінюється
форма, агрегатний стан речовини, але нова речовина не утворюється.
Формула (хімічна) — умовний запис якісного та кількісного складу речовин за допомогою знаків та індексів.
Протонне число— число протонів, що входять до складу ядра атома.
Нейтронне число— число нейтронів, що входять до складу ядра атома.
Нуклонне число— число нуклонів (протонів і нейтронів) у ядрі атома.
Атоми з однаковим протонним і нейтронним числом називають нуклідами.
Нукліди з однаковим протонним числом, але різним нейтронним числом називають ізотопами.
Методи розділення сумішей
| Назва методу | Короткий опис | Які суміші можна розділяти |
| Розділення за допомогою магніту | Заснований на здатності деяких речовин притягатися магнітом | Суміші твердих речовин, одна з яких притягається магнітом |
| Відстоювання | Суміш двох рідин поміщають у воду, або розчин, залишають на якийсь час, аж доки вона не розшарується. Далі відокремлюють шари з речовинами. | Неоднорідні суміші двох твердих або двох рідких речовин з різною густиною |
| Фільтрування | Суміш пропускають через тіло, в якому є пори (отвори) відповідного розміру (сито або фільтр) | Неоднорідні суміші рідких і твердих, твердих і газоподібних (пил), рідких і газоподібних речовин |
| Випарювання | Суміш повільно нагрівають до такої температури, при якій рідина випаровується, а тверда речовина залишається у вигляді кристалів | Однорідні суміші рідких і твердих речовин |
| Кристалізація | Із розчину твердої речовини в рідині випаровується частково рідина. При цьому після охолодження тверда речовина випадає в осад у вигляді кристалів | Однорідні суміші розчинних твердих і рідких речовин |
| Дистиляція (перегонка) | Суміш двох рідин поступово нагрівають. При цьому більш легкозакипна речовина випаровується раніше, після чого пару охолоджують у холодильнику й конденсат збирають в окрему посудину (приймачі) | Однорідні суміші двох рідин з різними температурами кипіння |
Валентність хімічних елементів
Самостійна робота. «Валентність хімічних елементів»
Самостійна робота № 7 Валентність хімічних елементів 7 клас
Варіант 1
1. Визнач валентність хімічних елементів за періодичною системою.
|
Символ |
Назва х. ел. |
№ х. ел. |
№ групи |
№ періоду |
Валентність |
|
Р |
Фосфор |
15 |
V гр., головна підгрупа |
3 період |
III, V |
|
|
|
16 |
|
|
|
|
Na |
|
|
|
|
|
|
|
Алюміній |
|
|
|
|
|
|
|
|
VIІ гр., головна підгрупа |
4 період |
|
2. Валентність – це __________________________________________________
3. Визнач валентність хімічних елементів за формулами сполук.
N2O, Fe2O3, CaO, HCl, NO2.
4. Склади формули речовин за їх валентністю і запиши назви речовин:
а) сполука Магнію з Оксигеном ________________________________________;
б) 2 сполуки Карбону з Оксигеном___________________________________;
в) сполука Калію з Іодом _____________________________________________.
Варіант 2
1. Визнач валентність хімічних елементів за періодичною системою.
|
Символ |
Назва х. ел. |
№ х. ел. |
№ групи |
№ періоду |
Валентність |
|
Р |
Фосфор |
15 |
V гр., головна підгрупа |
3 період |
III, V |
|
|
|
13 |
|
|
|
|
|
Кальцій |
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
І гр., головна підгрупа |
4 період |
|
2. Одиниця валентності – це ________________________________________
3. Визнач валентність хімічних елементів за формулами сполук. P2O5, Cu2O, H2S, I2O7, BaO.
4. Склади формули речовин за їх валентністю і запиши назви речовин:
а) сполука Бору з Оксигеном _________________________________________;
б) 2 сполуки Сульфуру з Оксигеном ____________________________________;
в) сполука Натрію з Форфором _________________________________________
Варіант 3
1. Визнач валентність хімічних елементів за періодичною системою.
|
Символ |
Назва х. ел. |
№ х. ел. |
№ групи |
№ періоду |
Валентність |
|
Р |
Фосфор |
15 |
V гр., головна підгрупа |
3 період |
III, V |
|
|
|
12 |
|
|
|
|
|
Сульфур |
|
|
|
|
|
Іод |
|
|
|
|
|
|
|
|
|
ІV гр., головна підгрупа |
2 період |
|
2. Для яких елементів характерна стала валентність? _____________________
3. Визнач валентність хімічних елементів за формулами сполук.
Cl2O5, Na2O, HBr, N2O3, FeO.
4. Склади формули речовин за їх валентністю і запиши назви речовин:
а) сполука Кальцію з Оксигеном______________________________________;
б) 2 сполуки Купруму з Оксигеном ___________________________________;
в) сполука Магнію з Нітрогеном ______________________________________
Варіант 4
1. Визнач валентність хімічних елементів за періодичною системою.
|
Символ |
Назва х. ел. |
№ х. ел. |
№ групи |
№ періоду |
Валентність |
|
Р |
Фосфор |
15 |
V гр., головна підгрупа |
3 період |
III, V |
|
|
|
56 |
|
|
|
|
|
Нітроген |
|
|
|
|
|
Si |
|
|
|
|
|
|
|
|
|
IІ гр., головна підгрупа |
4 період |
|
2. Для яких елементів характерна змінна валентність? _____________________
3. Визнач валентність хімічних елементів за формулами сполук.
B2O3, K2O, NH3, SO3, CuO.
4. Склади формули речовин за їх валентністю і запиши назви речовин:
а) сполука Цинку з Оксигеном _______________________________________;
б) 2 сполуки Феруму з Оксигеном ____________________________________;
в) сполука Натрію з Хлором _________________________________________
Варіант 5
1. Визнач валентність хімічних елементів за періодичною системою.
|
Символ |
Назва х. ел. |
№ х. ел. |
№ групи |
№ періоду |
Валентність |
|
Р |
Фосфор |
15 |
V гр., головна підгрупа |
3 період |
III, V |
|
|
|
19 |
|
|
|
|
|
Карбон |
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
III гр., головна підгрупа |
3 період |
|
2. Як визначити вищу валентність неметалічних елементів? ________________
3. Визнач валентність хімічних елементів за формулами сполук.
Br2O5, HI, CrO3, SO2, SnO.
4. Склади формули речовин за їх валентністю і запиши назви речовин:
а) сполука Натрію з Оксигеном ______________________________________;
б) 4 сполуки Хлору з Оксигеном _____________________________________;
в) сполука Алюмінію з Флуором ______________________________________
Варіант 6
1. Визнач валентність хімічних елементів за періодичною системою.
|
Символ |
Назва х. ел. |
№ х. ел. |
№ групи |
№ періоду |
Валентність |
|
Р |
Фосфор |
15 |
V гр., головна підгрупа |
3 період |
III, V |
|
|
Калій |
|
|
|
|
|
|
|
13 |
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
ІІ гр., головна підгрупа |
3 період |
|
2. Як визначити нижчу валентність неметалічних елементів? ________________
3. Визнач валентність хімічних елементів за формулами сполук.
I2O5, SiH4, Cl2O, MnO2, PbO.
4. Склади формули речовин за їх валентністю і запиши назви речовин:
а) сполука Барію з Оксигеном _______________________________________;
б) 4 сполуки Нітрогену з Оксигеном _________________________________;
в) сполука Калію з Бромом ________________________________________
Вчитель хімії Черкаської гімназії № 31
Білорус А.В.
ГДЗ (відповіді) Хімія 7 клас Лашевська Г.А., Лашевська А.А. §13 Валентність хімічних елементів НОВА ПРОГРАМА 2015 РОКУ » Допомога учням
Інші завдання дивись тут…
Вправа 1 Що таке валентність? Валентність (від лат. valentia — сила) — властивість атомів, яка характеризує їхню здатність сполучатися з певним числом інших атомів
Вправа 2 Що є одиницею валентності? Валентність атома Гідрогену
Вправа 3 Яке найвище значення валентності хімічних елементів? VIII
Вправа 4 Як визначити валентність хімічного елемента за його положенням у періодичній системі? Максимальне значення валентності більшості елементів збігається з номером його групи в короткій формі періодичної системи
Вправа 5 Чому дорівнює значення валентності неметалічного елемента у сполуці з Гідрогеном або металічним елементом? Дорівнює різниці між числом 8 і номером групи, до якої елемент належить.
Вправа 6 У якій послідовності записують символи хімічних елементів у формулах бінарних сполук? Символ металічного елемента записують першим
Вправа 7 Чому дорівнює сумарна валентність усіх атомів одного елемента в бінарній сполуці. Сумарній валентності всіх атомів іншого елемента
Вправа 8 Визначте й порівняйте валентність Феруму в сполуках, хімічні формули яких FeО і Fе2О3.
У сполуці FeО валентність Феруму ІІ
У сполуці Fе2О3 валентність Феруму ІІІ
Вправа 9 З переліку МnО, МnО2, FеО, Fe2О3, СrО3, СаН2 випишіть хімічні формули сполук, у яких атоми металічних елементів двовалентні.
Відповідь: МnО, FеО, СаН2
Вправа 10 Класифікуйте речовини, хімічні формули яких СО, СО2, Р2О3, АlСl3, МgS, Са3N2, SО3, SF6, NaI, N2О, за валентністю першого елемента. Відповідь оформіть як таблицю.
|
Валентність першого елемента |
Хімічна формула |
| I | NaI, N2О |
| II | СО, МgS, Са3N2 |
| III | Р2О3, АlСl3 |
| IV | СО2 |
| VI | SО3, SF6 |
Вправа 11 Складіть формули бінарних сполук Кальцію з Нітрогеном, Оксигеном, Флуором. Ca3N2, CaO, CaF2
Вправа 12 Складіть формули бінарних сполук з Оксигеном, у яких значення валентності Літію, Магнію, Бору, Карбону максимальні. Li2O, MgO, B2O3, CO2
Максимальне значення валентності елементів збігається з номером групи, в якій елемент міститься
Вправа 13 Складіть формули бінарних сполук одно-, дво- і тривалентних металічних елементів із Флуором.
Відповідь: KF, MgF2, AlF3
Вправа 15 Визначте валентність атомів хімічних елементів за формулами сполук: РIIIН3I, Аu2IIIО3II, SіIVН4I, Аg2IОII
Вправа 16 Знайдіть закономірності в послідовностях формул:
а) N2О, NО, N2О3, NО2; Валентність Нітрогену І, II, III, IV
б) SiН4, РН3, Н2Sе, НF. Валентність елементів Si, P, Se, F відповідно IV, III, II, I
Інші завдання дивись тут…
УРОК 19. Визначення валентності хімічних елементів
УРОК 19
Визначення валентності хімічних елементів
Мета: — продовжити складати бінарні сполуки, знаючи валентність хімічних елементів; систематизувати знання про хімічну формулу;
продовжити розвивати вміння роботу із періодичної системи;
виховати згуртованість на уроках хімії.
Тип уроку: поглиблення і систематизація знань.
Форми роботи: гра ,, Так чи ні”, ланцюжок завдань, фронтальна бесіда, виконання вправ.
Обладнання:ПСХЕ, картка ,,Систематизація знань 1”.
Хід уроку
Організація класу.
Гасло уроку ,, Швидко, вміло та цікаво”
Перевірка домашнього завдання. Гра ,,Так чи ні”
Вчитель називає хімічний елемент і валентність. Якщо правильно, то учні хлопають в долоні, якщо ні, то не хлопають (користуватись дозволено лише періодичною системою):
Натрій — |, Оксисен — ||, Гідроген — |||, Кальцій — ||, Нітроген — |, Літій — |, Барій — |||, Цинк — ||, Фосфор – v, Хлор — |.
Актуалізація опорних знань. Ланцюжок завдань
На дошці ланцюжок формул, учні по порядку визначають валентності хімічних елементів: Mn207, H2S, Cu20, HF, MgO, NH3, Cr203, MgH2, Si02, KH, NaH , CaO, H2S, PH3, МnО, Мn02, Мn203, Мn2О7, СО2, СО.
Поглиблення знань.Фронтальна бесіда і виконання вправ
Як ви гадаєте, чи можна скласти формулу сполуки, знаючи валентність?
Давайте спробуєм це зробити. Запам’ятаєм правило: сума одиниць валентності атомів одного елемента дорівнює сумі одиниць валентності іншого елемента в бінарній сполуці.
Спробуймо скласти сполуку Силіцію із Оксигеном. Ми вже знаєм, що валентність Оксисену становить ||, а Силіцію — |v.
|v||
Si1O2
Перевірка: Силіцій – 4.1=4, Оксиген – 2.2=4.
Складіть формули бінарних сполук знаючи валентності:
|| | || || ||| || v || | | | || | |||
СаІ2, ВаО, РО, РО, КІ, КО, КР.
Систематизація знань, умінь та навичок.Виконання завдань
Учні повторюють вивчений матеріал виконуючи вправи із картки, користуючись лише періодичною системою.
Картка,,Систематизація знань 1. Метали і неметали. Прості та складні речовини. Хімічні Формули речовин. Валентність”
Випишіть із даного переліку прості речовини:
Н2, Н2О,Сu, ZnCl2, O2, HI, N2, Ag, CO2.
Випишіть з даного переліку неметали: золото, сірка, цинк, кисень, ртуть, силіцій, хлор, фосфор, алюміній, залізо, мідь, азот.
Що означає позначення 3СО2 ?
Напишіть формулу речовини, що складається із двох атомів Калію, одного атома Силіцію та трьох атомів Оксигену.
Опишіть якісний та кількісний склад сполуки Na3PO4.
Які валентності виявляють:
а) Оксиген; б) Натрій; в) Алюміній; г) Гідроген; д) Бром; е) Силіцій.
Вкажіть валентність Хлору в сполуках: а) Сl2O;Cl2O7.
Вкажіть валентність у сполуках: а) N2O; N2O5;N2O3;NO2.
Вкажіть дві неправильні сполуки:
а) NaO; б) MgO;в) Ca2O;г) Al2O3.
10. Складіть формули бінарних сполук: а) Цезію з Оксигеном; б) Силіцію з Гідрогеном; в) Брому з Оксисеном.
Домашнє завдання.
Навчитись користуватись таблицями.

