Валентность алюминия (Al), формулы и примеры
Общие сведения о валентности алюминия
Алюминий – серебристо-белый легкий металл. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводимостью и теплопроводностью. Температуры плавления и кипения равны 660oС и -2500oС, соответственно.
При комнатной температуре алюминий не изменяется на воздухе, но лишь потому, что его поверхность покрыта тонкой пленкой оксида, обладающей очень сильным защитным действием.
Валентность алюминия в соединениях
Алюминий — тринадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в третьем периоде в IIIA группе. В ядре атома алюминия содержится 13 протонов и 14 нейтронов (массовое число равно 27). В атоме алюминия есть три энергетических уровня, на которых находятся 13 электронов (рис. 1).
Рис. 1. Строения атома алюминия.
1. Строения атома алюминия.
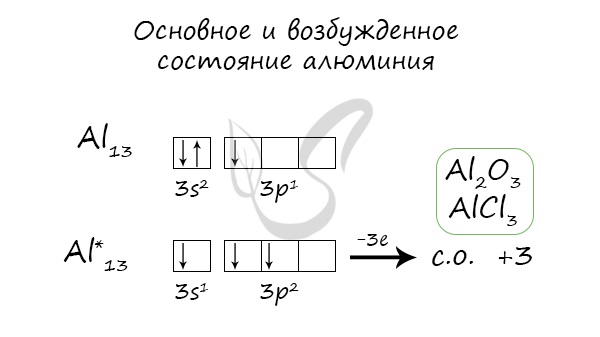
Электронная формула атома алюминия в основном состоянии имеет следующий вид:
1s22s22p63s23p1.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Так как на третьем энергетическом слое помимо 3s-подуровня есть еще и 3p-подуровень, две орбитали которого не заняты электронами, то пара электронов 3s-подуровня распаривается и один из них занимает вакантную орбиталь 3p-подуровня. Это означает, что для атома алюминия характерно наличие возбужденного состояния:
Наличие трех неспаренных электронов свидетельствует о том, что алюминий проявляет валентность III в своих соединения (AlIII2O3, AlIII(OH)3, AlIIICl3и др.). Валентность алюминия постоянная.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Составьте электронные формулы алюминия и представьте графически размещение электронов по квантовым.
 .
.Составьте электронные формулы алюминия и представьте графически размещение электронов по квантовым ячейкам. Проанализируйте возможности разъединения спаренных электронов при возбуждении атомов с образованием валентных электронов в соответствии с теорией спин-валентности.
Решение.
| ?? | ?? | ?? | ?| | | | |||||||||||||||||||||
| Al | 13 | ?? | ?? | 2p6 | ?? | 3p1 | ||||||||||||||||||
| 1s2 | 2s2 | 3s2 | ||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
| ? | ? | | | | ||||||||||||||||||||||
| Al* | 13 | ? | 3p2 | |||||||||||||||||||||
| 3s1 | ||||||||||||||||||||||||
Атом алюминия, имеет 3 валентных электрона, 2 из которых находятся на 3s-подуровне, в возбужденном состоянии * , спаренные электроны 3s-подуровня разъединяются и один из них переходит на свободную орбиталь 3p-подуровня.
Классный урок на «Радио России – Тамбов», эфир 15 мая 2020 года
Автор ГТРК «ТАМБОВ» На чтение 11 мин. Просмотров 213 Опубликовано
В уроке химии для девятиклассников кандидат технических наук, учитель химии из 29-го тамбовского лицея Елена Эдуардовна Дегтерева рассказывает о способах получения, физических и химических свойствах алюминия.
Алюминий. Получение алюминия. Физические и химические свойства. Применение. Сегодня я хочу рассказать о самом распространённом металле в земной коре, о алюминии. Алюминий по распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Элемент алюминий расположен в III группе, главной подгруппе, 3 периоде периодической системы, порядковый номер 13, относительная атомная масса Ar(Al) → 27. Название элемента образовано от латинского алюмен, так в древности называли квасцы, которые использовали для крашения тканей. Данный элемент носил несколько названий. Так, английский химик и физик Гемфри Дэви, предполагая присутствие его в глиноземе, называл алюминумом. В русской химической литературе 19 века встречаются следующие названия алюминия: глинозем, алумий, алюминий и глиний. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера, т. е. он является переходным элементом и его соединения являются амфотерными. Давайте вспомним, что такое амфотерность.
Элемент алюминий расположен в III группе, главной подгруппе, 3 периоде периодической системы, порядковый номер 13, относительная атомная масса Ar(Al) → 27. Название элемента образовано от латинского алюмен, так в древности называли квасцы, которые использовали для крашения тканей. Данный элемент носил несколько названий. Так, английский химик и физик Гемфри Дэви, предполагая присутствие его в глиноземе, называл алюминумом. В русской химической литературе 19 века встречаются следующие названия алюминия: глинозем, алумий, алюминий и глиний. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера, т. е. он является переходным элементом и его соединения являются амфотерными. Давайте вспомним, что такое амфотерность.  Аl является р-элементом на внешнем уровне его электронной оболочки три электрона. В основном состоянии 2 эл. на 3s-подуровне и 1 эл. на 3р. В возбужденном состоянии на внешнем уровне алюминия находится три неспаренных электрона. Поэтому в соединениях с ковалентной связью алюминий проявляет валентность равную III. Нахождение в природе В природе алюминий в связи с высокой химической активностью встречается почти исключительно в виде соединений. Процент содержания алюминия в земной коре составляет 8,13% массы земной коры. Совместно с кремнием он образует такие известные вам породы и минералы, как алюмосиликаты, слюду, глину. Особое место среди минералов занимает криолит Na 3[AlF6] (гексафторалюминат натрия), без которого алюминий вряд ли был вторым после железа по значению металлом. Почему? Об этом мы узнаем чуть позже. Целая группа природных веществ в качестве основного компонента содержит оксид алюминия: это бокситы – основное сырьё для производства алюминия; корунд – одно из самых твёрдых природных веществ.
Аl является р-элементом на внешнем уровне его электронной оболочки три электрона. В основном состоянии 2 эл. на 3s-подуровне и 1 эл. на 3р. В возбужденном состоянии на внешнем уровне алюминия находится три неспаренных электрона. Поэтому в соединениях с ковалентной связью алюминий проявляет валентность равную III. Нахождение в природе В природе алюминий в связи с высокой химической активностью встречается почти исключительно в виде соединений. Процент содержания алюминия в земной коре составляет 8,13% массы земной коры. Совместно с кремнием он образует такие известные вам породы и минералы, как алюмосиликаты, слюду, глину. Особое место среди минералов занимает криолит Na 3[AlF6] (гексафторалюминат натрия), без которого алюминий вряд ли был вторым после железа по значению металлом. Почему? Об этом мы узнаем чуть позже. Целая группа природных веществ в качестве основного компонента содержит оксид алюминия: это бокситы – основное сырьё для производства алюминия; корунд – одно из самых твёрдых природных веществ. Его мелкокристаллические непрозрачные разновидности серовато-чёрного цвета называют наждаком и применяют в качестве абразивного материала. Эту же формулу имеет и другое природное соединение — глинозём. Наиболее драгоценными корундами являются рубины и сапфиры. Их окраска обусловлена различными примесями. Так, ион Сr
Его мелкокристаллические непрозрачные разновидности серовато-чёрного цвета называют наждаком и применяют в качестве абразивного материала. Эту же формулу имеет и другое природное соединение — глинозём. Наиболее драгоценными корундами являются рубины и сапфиры. Их окраска обусловлена различными примесями. Так, ион Сr Такую распространённость в наше время алюминий получил благодаря своей лёгкости, прочности и высокой устойчивости к коррозии (к окислению на воздухе). Однако так было не всегда. С начала открытия алюминия датским физиком Хансом Эрстедом в 1825 году и до конца 19 века ещё не было известно о простом получении его из руды и поэтому алюминий получали восстановлением из его хлорида щелочными металлами калием или натрием. Такой способ был очень дорог, а полученный металл стоял дороже золота. В 18-19 веках алюминий был главным ювелирным металлом. Так в 1889 г. британцы, желая почтить богатым подарком великого русского химика Д.И. Менделеева, подарили ему весы из золота и алюминия. С конца 19 века и по сей день Al получают методом электрометаллургии из оксида алюминия, содержащегося в глинозёме и бокситах. Кристаллическая решётка оксида алюминия состоит из сильно поляризованных атомов алюминия и кислорода, силы притяжения между которыми весьма велики. Это обуславливает высокую температуру плавления оксида алюминия – около 2050 оС.
Такую распространённость в наше время алюминий получил благодаря своей лёгкости, прочности и высокой устойчивости к коррозии (к окислению на воздухе). Однако так было не всегда. С начала открытия алюминия датским физиком Хансом Эрстедом в 1825 году и до конца 19 века ещё не было известно о простом получении его из руды и поэтому алюминий получали восстановлением из его хлорида щелочными металлами калием или натрием. Такой способ был очень дорог, а полученный металл стоял дороже золота. В 18-19 веках алюминий был главным ювелирным металлом. Так в 1889 г. британцы, желая почтить богатым подарком великого русского химика Д.И. Менделеева, подарили ему весы из золота и алюминия. С конца 19 века и по сей день Al получают методом электрометаллургии из оксида алюминия, содержащегося в глинозёме и бокситах. Кристаллическая решётка оксида алюминия состоит из сильно поляризованных атомов алюминия и кислорода, силы притяжения между которыми весьма велики. Это обуславливает высокую температуру плавления оксида алюминия – около 2050 оС. Сложность достижения такой высокой температуры и энергоемкость процесса долгое время относили алюминий к числу труднодоступных металлов. В конце XIX века американский студент –химик Чарльз Мартин Холл обнаружил, что глинозём можно растворить при 950 оС в расплавленном минерале криолите (вот почему он важен для получения алюминия) и электролизом выделить из полученного раствора алюминий. Независимо от Мартина Холла в том же году это открытие сделал французский металлург Поль Луи Туссен Эру. Для того, чтобы иметь более точное представление об электролизе Al2O3 в криолите Na3AlF6 , необходимо уточнить схему электролитической диссоциации Al2O3. Как же он диссоциирует ? Мы знаем, что гидроксид алюминия Al(ОН)3 обладает амфотерными свойствами и его кислотную форму можно представить в виде ортоалюминиемой кислоты Н3AlO3. Этой кислоте соответствует алюминат анион AlO33-.
Сложность достижения такой высокой температуры и энергоемкость процесса долгое время относили алюминий к числу труднодоступных металлов. В конце XIX века американский студент –химик Чарльз Мартин Холл обнаружил, что глинозём можно растворить при 950 оС в расплавленном минерале криолите (вот почему он важен для получения алюминия) и электролизом выделить из полученного раствора алюминий. Независимо от Мартина Холла в том же году это открытие сделал французский металлург Поль Луи Туссен Эру. Для того, чтобы иметь более точное представление об электролизе Al2O3 в криолите Na3AlF6 , необходимо уточнить схему электролитической диссоциации Al2O3. Как же он диссоциирует ? Мы знаем, что гидроксид алюминия Al(ОН)3 обладает амфотерными свойствами и его кислотную форму можно представить в виде ортоалюминиемой кислоты Н3AlO3. Этой кислоте соответствует алюминат анион AlO33-. Формулу алюминиемой соли этой кислоты можно записать AlAlO3. Так ведь это и есть оксид алюминия. Таким образом, в расплаве криолита он диссоциирует, на катион металла и анион кислотного остатка. Поэтому на катоде (отрицательно заряженном электроде) идёт восстановление катиона Al3+ до свободного металла. Катод (-): Al3+ +3е = Al На графитовом аноде (положительно заряженном электроде) окисляется алюминат анион AlO33-. При этом происходит следующий электродный процесс: Анод(+): 4AlO33- -12 е = 2Al2O3 + 3O2 При суммировании левых и правых частей электродных процессов получается молекулярное уравнение электролиза: Процесс проводят в специальных электролитических ваннах, которые одновременно являются катодом. Анодом служат угольные брикеты. Температуру плавления криолита в электролизёре поддерживают благодаря очень большой силе тока, которая достигает 250 кА при напряжении около 4 В.
Формулу алюминиемой соли этой кислоты можно записать AlAlO3. Так ведь это и есть оксид алюминия. Таким образом, в расплаве криолита он диссоциирует, на катион металла и анион кислотного остатка. Поэтому на катоде (отрицательно заряженном электроде) идёт восстановление катиона Al3+ до свободного металла. Катод (-): Al3+ +3е = Al На графитовом аноде (положительно заряженном электроде) окисляется алюминат анион AlO33-. При этом происходит следующий электродный процесс: Анод(+): 4AlO33- -12 е = 2Al2O3 + 3O2 При суммировании левых и правых частей электродных процессов получается молекулярное уравнение электролиза: Процесс проводят в специальных электролитических ваннах, которые одновременно являются катодом. Анодом служат угольные брикеты. Температуру плавления криолита в электролизёре поддерживают благодаря очень большой силе тока, которая достигает 250 кА при напряжении около 4 В. Очевидно, что получение алюминия – очень энергоемкий процесс. Кислород, выделяющийся на аноде, реагирует с углеродом, превращаясь в СО2. При этом угольный анод постепенно «сгорает». Физические свойства алюминия Алюминий как простое вещество представляет собой серебристо-белый металл, достаточно лёгкий (плотность 2,7 г/см3) и относительно легкоплавкий (на бытовой газовой плите с температурой пламени 850оС алюминиевый чайник расплавится, так как температура плавления его 660 оС). На воздухе поверхность металла покрыта тонкой, но очень прочной оксидной плёнкой, предохраняющей его от дальнейшего окисления. Алюминий очень пластичен, его можно прокатывать в фольгу толщиной 0,001 мм. По электро- и теплопроводности он уступает лишь серебру и меди. По сравнению с перечисленными металлами алюминий дешевле. Казалось бы, вот замечательный материал для изготовления высоковольтных линий электропередач! Но мягкость и пластичность алюминия привели бы к тому, что через год под собственной тяжестью провода провисли бы до земли.
Очевидно, что получение алюминия – очень энергоемкий процесс. Кислород, выделяющийся на аноде, реагирует с углеродом, превращаясь в СО2. При этом угольный анод постепенно «сгорает». Физические свойства алюминия Алюминий как простое вещество представляет собой серебристо-белый металл, достаточно лёгкий (плотность 2,7 г/см3) и относительно легкоплавкий (на бытовой газовой плите с температурой пламени 850оС алюминиевый чайник расплавится, так как температура плавления его 660 оС). На воздухе поверхность металла покрыта тонкой, но очень прочной оксидной плёнкой, предохраняющей его от дальнейшего окисления. Алюминий очень пластичен, его можно прокатывать в фольгу толщиной 0,001 мм. По электро- и теплопроводности он уступает лишь серебру и меди. По сравнению с перечисленными металлами алюминий дешевле. Казалось бы, вот замечательный материал для изготовления высоковольтных линий электропередач! Но мягкость и пластичность алюминия привели бы к тому, что через год под собственной тяжестью провода провисли бы до земли. Поэтому в технике, где требуется и прочность конструкции, наряду с лёгкостью и высокой электропроводностью, используют не чистый алюминий, а его сплавы (например с магнием, марганцем, медью и никелем — дюралюминий или с кремнием – силумин). Рассмотрим химические свойства алюминия. В электрохимическом ряду напряжений металлов алюминий близок к щелочным и щелочноземельным металлам и проявляет себя как химически активный металл. В некоторых случаях от протекания возможных при нормальных условиях реакций (например с водой) его спасает оксидная плёнка. В химических реакциях он проявляет восстановительные свойства. Для алюминия во всех соединениях характерна единственно возможная степень окисления +3. Порошкообразный алюминий легко взаимодействует с простыми веществами (неметаллами).
Поэтому в технике, где требуется и прочность конструкции, наряду с лёгкостью и высокой электропроводностью, используют не чистый алюминий, а его сплавы (например с магнием, марганцем, медью и никелем — дюралюминий или с кремнием – силумин). Рассмотрим химические свойства алюминия. В электрохимическом ряду напряжений металлов алюминий близок к щелочным и щелочноземельным металлам и проявляет себя как химически активный металл. В некоторых случаях от протекания возможных при нормальных условиях реакций (например с водой) его спасает оксидная плёнка. В химических реакциях он проявляет восстановительные свойства. Для алюминия во всех соединениях характерна единственно возможная степень окисления +3. Порошкообразный алюминий легко взаимодействует с простыми веществами (неметаллами).- С галогенами (с такими как Cl2 и Вr2). Реакция протекает бурно при комнатной температуре:
 Если смешать порошок алюминия и йода то реакция не начнётся, для инициации реакции в смесь добавляют каплю воды, от которой происходит смачивание компонентов и смесь загорается сама собой с выделением фиолетового дыма из паров йода, таким образом вода в этой реакции является катализатором.
Если смешать порошок алюминия и йода то реакция не начнётся, для инициации реакции в смесь добавляют каплю воды, от которой происходит смачивание компонентов и смесь загорается сама собой с выделением фиолетового дыма из паров йода, таким образом вода в этой реакции является катализатором.- Для начала реакции с другими неметаллами (с S, C, N2, Р), требуется нагревание, зато дальнейшее взаимодействие, сопровождается выделением большого количества теплоты.
- С водородом Al непосредственно не реагирует.

 В результате реакции с водой образуется гидроксид алюминия и водород. 2Al + 6H2O = 2Al(OH)3 + 3H2
В результате реакции с водой образуется гидроксид алюминия и водород. 2Al + 6H2O = 2Al(OH)3 + 3H2- Одно из важнейших химических свойств алюминия – способность вытеснять металлы из их оксидов – используют в металлургии. Этим способом получают хром, железо, марганец, ванадий, титан, цирконий. Этот метод получения простых веществ металлов называется алюмотермией:
 ) = Al2(SO4)3 + 3H2А вот концентрированные серная и азотная кислоты пассивируют алюминий при обычной температуре, образуя на поверхности металла, прочную оксидную плёнку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах. С разбавленной азотной кислотой алюминий реагирует с образованием оксида азота (II): Al + 4HNO3(разб.) = Al(NO3)3 + NO↑ + 2H2O При нагревании Al растворяется в кислотах — окислителях, образующих растворимые соли алюминия: 2Al + 6H2SO4(конц) = 4Al2(SO4)3 + 3SО2↑ + 6H2O Al + 6HNO3(конц) = Al(NO3)3 + 3NO2↑ + 3H2O
) = Al2(SO4)3 + 3H2А вот концентрированные серная и азотная кислоты пассивируют алюминий при обычной температуре, образуя на поверхности металла, прочную оксидную плёнку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах. С разбавленной азотной кислотой алюминий реагирует с образованием оксида азота (II): Al + 4HNO3(разб.) = Al(NO3)3 + NO↑ + 2H2O При нагревании Al растворяется в кислотах — окислителях, образующих растворимые соли алюминия: 2Al + 6H2SO4(конц) = 4Al2(SO4)3 + 3SО2↑ + 6H2O Al + 6HNO3(конц) = Al(NO3)3 + 3NO2↑ + 3H2O- Алюминий – амфотерныйметалл, поэтому он взаимодействует со щелочами.

 Она не только придает красивый внешний вид изделиям и сооружениям, но и защищает их от химического разрушения. Для защиты от солнечных лучей алюминиевой краской покрывают цистерны, предназначенные для перевозки нефтепродуктов и других горючих веществ. Исследуя влияние алюминия на различные пищевые продукты, ученые установили, что при контакте пищи с алюминием не разрушаются витамины. Это открытие послужило причиной широкого применения алюминия в пищевой промышленности, в виде посуды из алюминия, а также в косметике и бытовой химии. Из алюминия изготавливают разнообразную аппаратуру, предназначенную для переработки пищевых продуктов в сахарной, кондитерской, маслобойной и других отраслях промышленности. Сегодня на уроке мы узнали об алюминии: положение этого элемента в Периодической системе, строение его атома, нахождение в природе, физические и химические свойства металла алюминия, получение и применение алюминия.
Она не только придает красивый внешний вид изделиям и сооружениям, но и защищает их от химического разрушения. Для защиты от солнечных лучей алюминиевой краской покрывают цистерны, предназначенные для перевозки нефтепродуктов и других горючих веществ. Исследуя влияние алюминия на различные пищевые продукты, ученые установили, что при контакте пищи с алюминием не разрушаются витамины. Это открытие послужило причиной широкого применения алюминия в пищевой промышленности, в виде посуды из алюминия, а также в косметике и бытовой химии. Из алюминия изготавливают разнообразную аппаратуру, предназначенную для переработки пищевых продуктов в сахарной, кондитерской, маслобойной и других отраслях промышленности. Сегодня на уроке мы узнали об алюминии: положение этого элемента в Периодической системе, строение его атома, нахождение в природе, физические и химические свойства металла алюминия, получение и применение алюминия.Алюминийорганические соединения — презентация онлайн
1.
 Алюминийорганические соединения МАКЕЕВА В.С.
Алюминийорганические соединения МАКЕЕВА В.С.ПОМФА Г.А.
ВЕЛИКОРОДНАЯ В.В.
ШЕВАЛЁВА Е.А.
КУРЯКОВА И.П.
ХЕМО-01-18
Алюминий
По распространенности в земной коре алюминий занимает
первое место среди металлов и третье место среди всех
элементов (после кислорода и кремния), на его долю приходится
около 8, 8% массы земной коры.
В природе алюминий встречается только в соединениях
(минералах):
Корунд
Боксит
Берилл
Нефелин
Алунит
Строение атома Al
Алюминий – тринадцатый элемент Периодической таблицы.
Обозначение – Al от латинского «aluminium».
Расположен в третьем периоде, IIIА группе.
Относится к металлам.
Атом элемента состоит из положительно заряженного ядра +13 (13 протонов и
14 нейронов) и трёх электронных оболочек с 13 электронами.
На внешнем энергетическом уровне атома алюминия имеется три электрона,
которые являются валентными:
1s22s22p63s23р 1
В результате химического взаимодействия алюминий отдает свои валентные
электроны, т.
 е. является их донором, и превращается в положительно заряженный ион:
е. является их донором, и превращается в положительно заряженный ион:Al0-3e → Al3+
В возбужденном состоянии на внешнем уровне алюминия находится три
неспаренных электрона. Поэтому в соединениях с ковалентной связью алюминий
проявляет валентность III. Во всех соединениях алюминий проявляет постоянную
степень окисления +3.
Применение алюминия и его соединений
Алюминий — легкий, но прочный материал.
Алюминий хорошо поддается механической обработке.
Алюминий устойчив к коррозии.
Алюминий прекрасный проводник электрического тока и обладает высокой
теплопроводностью.
Поверхность алюминия обладает высокой отражательной способностью.
Алюминий-немагнитный материал, и это позволяет использовать его для
изготовления навигационного оборудования.
Наличие у алюминия хороших восстановительных свойств позволяет
использовать его в качестве восстановителя в химической и сталелитейной
промышленности.
Отсутствие у алюминия токсичных свойств позволяет использовать его для
изготовления оборудования пищевой и пивоваренной промышленности, а также
материалов для упаковки пищевых продуктов.

Изделия из алюминия
Алюминийорганические соединения
Алюминийорганические соединения –соединения,
содержащие связь Al – C . Общая формула RnAlX3-n, где R –
органический радикал, Х – Hal, H, OR, SR, NR2, RCOO, CN и
другие, n = 1-3.
Основные классы:
Алюминийтриалкилы(арилы) (R3Al)
Алюминийтриалкилы представляют собой вязкие
бесцветные жидкости. Соединения с низшими
радикалами (С1— С4) легко самовоспламеняются на
воздухе даже в условиях разреженной атмосферы.
Алюминийтриарилы — как правило, твердые
кристаллические вещества, на воздухе не
самовоспламеняются, растворяются в углеводородных
растворителях.
Алкил(арил)алюминийгалогениды (RnAlHal3-n)
Алкил(арил)алюминийгалогениды представляют
собой вязкие бесцветные жидкости или кристаллические
вещества. Легко окисляются, причем соединения с
низшими алкильными радикалами самовоспламеняются
на воздухе.
Алкил(арил)алюминийгидриды (RnAlh4-n)
Алкил(арил)алюминийгидриды–жидкие или
твердые кристаллические вещества.
 Как и другие
Как и другиеалюминийорганические соединения, они склонны к
ассоциации с образованием мостиковых связей
через атом водорода, причем
диорганоалюминийгидриды образуют циклические
тримеры:
Алкоксиды алюминия (Al(OR)3)
Алкоксиды алюминия — бесцветные прозрачные
жидкости или твердые кристаллические вещества.
Соединения ассоциированы с образованием
мостиковых связей через кислород. Весьма
реакционноспособны.
Понятие о трехцентровых мостиковых связях
Длины связей и валентные углы в молекуле
триметилалюминия
Схема образования трехцентровых орбиталей в Al(Ch4)6 (a) и
перекрывание sp3 – орбитали углерода с двумя sp3 – орбиталями атомов
алюминия (б)
Свойства алюминийорганических соединений
Алюминийтриалкилы(арилы)
Алюминийтриалкилы (арилы) R3AI — один из
наиболее важных в практическом плане и
доступных типов алюминийорганических
соединений.
Металлический алюминий взаимодействует с алкил(арил)галогенидами с
образованием
смеси
алкил(арил)алюминийгалогенидов
и
алюминийтриалкилов(арилов) (реакция была открыта в 1859 г.
 ):
):Технологическая схема получения триэтилалюминия
1-смеситель; 2-реакторы; 3-обратные конденсаторы; 4-холодильник; 5-центрифуга; 6паровой подогреватель; 7-пленочный испаритель; 8-конденсатор; 9-насос.
Алюминийорганические соединения могут быть также
получены при алкилировании (арилировании) с помощью
металлорганических соединений галогенидов алюминия или
металлического алюминия. Органические производные лития,
натрия и других металлов взаимодействуют с АlСl3 по
следующей схеме:
AICI3 +3RM — AIR3 + 3МСl,
Где М= Li, Na; R -органический радикал.
В качестве алкилирующего агента могут быть
использованы и комплексные соединениялитийалюминийтетраалкилы:
3LIAIR4+AICl3→4R3Al + 3LiCl
Другие способы получения:
Ртутьорганические соединения в среде эфира реагируют с
металлическим алюминием, давая эфираты триалкил(арил)алюминия:
2AI + 3HgR2→2R3AI + 3Нg,
где R=Alk, Аг.
Реакция гидридного присоединения АlН3 к олефинам протекает
исключительно легко, она была использована для синтеза самых
различных алюминийтриалкилов:
AIh4 + 3Ch3=CRR’→AI(CН2CHRR’)3
В 1955 г.
 немецким ученым Циглером был осуществлен
немецким ученым Циглером был осуществленпростой и технологичный синтез алюминийтриалкилов из
дешевого и доступного сырья – металлического
алюминия, водорода и олефинов:
Al + 1,5h3 +3Ch3=CHR→Al(Ch3Ch3R)3.
Это открытие сделало алюминийорганические
соединения вполне доступными и способствовало
развитию химии этого типа соединений. Прямой синтез из
алюминия, водорода и олефинов осуществляется в весьма
широком интервале температур (30-300°C) и давлений
(5—300 атм, или 0,5-30 МПа).
Свойства алюминийтриалкил(арил)ов
Термическая устойчивость алюминийтриалкилов невысока.
Даже низшие алюминийтриалкилы, перегоняемые в вакууме при
температуре не выше 100 °C, содержат несколько процентов
диалкилалюминийгидрида. При 200 С имеет место практически
полное разложение. Особенно неустойчивы соединения с
радикалами изостроения. Основным направлением термического
разложения алюминийтриалкилов является отщепление
органического радикала в виде олефина согласно следующей
схеме:
R2AIR→ R2AIН + Ch3=CH-R’;
R2AIH →RAIh3 + Ch3=CH-R’
3RAIh3 →2AIh4 + 3Сh3=СH-R’ + Al;
АIh4→Al + 1,5h3
Возможны и некоторые другие побочные процессы.

• При повышенном давлении и температуре алюминийтриалкилы реагируют с
водородом с разрывом связи Аl—С:
R3AI+ h3→R2AIH+RH (p,t)
• Алюминийорганические соединения являются хорошими алкилирующими
средствами и подобно другим металлоорганическим соединениям (лития, магния,
ртути и др.) способны взаимоействовать с галогенпроизводными других элементов
или их эфирами, обменивая органический радикал на галоид или алкоксигруппу:
R3AI+BCI3→R3B+AlCl3
4R3AL+3SiCl4→3SiR4+4AICI3
R3Al+AICl3→R2AICI+ RAICI2
R3Al+B(OR’)3→R3B+Al(OR’)3
R3Al+PCl3→RPCI2 + R2PCI + R3P и т. д.
• Реакции алюминийтриалкилов с галогенами протекают очень бурно:
R3AI + Cl2→R2AICI + RСI и т. д.
• Алюминийтриалкилы легко взаимодействуют с соединениями, содержащими подвижный водород, –
с водой, спиртами, тиоспиртами, органическими кислотами, фенолами и подобными соединениями:
R3AL+3h3O→ Al(OH)3 + 3RH;
R3Al + 3R’OH→Al(OR)3 +3RH;
R3AL +3R’SH→Al(SR’)3 + 3RH;
R3AI + 3R’COОН→ (R’COO)3Al +3RH;
R3AI + 3ArОН→Al(OAr)3 +3RH.

• Органоаминосиланы и силазаны реагируют с алюминийтриалкилами достаточно легко с
образованием соединений со связью Si-N-Al:
• Алюминийорганические соединения легко окисляются кислородом.
• Связь A1—С в алюминийтриалкилах способна участвовать в реакции присоединения к двойной связи
олефинов. Этот процесс может быть выражен следующей схемой:
R3Al + 3Ch3=Сh3→(R-Ch3-Ch3)3Al.
Алкил(арил)алюминийгалогениды RnAlHal3-n
• Взаимодействие
галогеналкилов(арилов)
с
металлическим
алюминием
приводит
к
преимущественному образованию алкил- (арил)алюминийгалогенидов:
Al + RX→RAIX2 + R2AIX + R3Al
• Алкилирование (арилирование) тригалогенида алюминия алюминийтриалкилами (арилами)
приводит к образованию алкил(арил)алюминийгалогенидов. В зависимости от мольного
соотношения
исходных
компонентов
могут
быть
получены
смесь
алкил
(арил)алюминийгалогенидов:
R3AI+AIX3→R2AIX+RAIX2+R3AI2Х3
либо индивидуальные соединения:
R3AI+ 2AIX3→3RAIX2
2R3Al+AlX3→3R2AlX
• Осуществляя дегалогенирование сесквигалогенидов алюминия металлическим натрием или
магнием,
можно
повысить
«степень
алкилирования»
алюминия
и
получить
диалкил(арил)алюминийгалогенид:
2R3A12X3+3Na→3R2AIX+3NaX+Al.

Алкил(арил)алюминийгидриды
Одним из способов получения алкил(арил)алюминийгидридов
RnAIh4-n является взаимодействие алюминийтриалкилов с
водородом при повышенном давлении и температуре:
R3Al+h3→R2AIH+RH
Для этой же цели может быть использована реакция
восстановления алюминийтриалкилов,
диалкилалюминийгалогенидов гилридами щелочных металлов:
(С2Н5)3Al + NaН →Na[(С2H5)ЗAІН];
(С2Н5)2AICI + LiH → (С2Н5)2AIН + LiCl
В первом случае образуется комплексное соединение,
содержащее связи =AI-С≡ и =А-Н, во втором случае на водород
замещается только связь =А-CI.
Соединения очень реакционноспособны. Связь =Аl-Н проявляет высокую реакционную
способность в реакциях присоединения к алкенам и алкинам:
Алкил(арил)алюминийгидриды являются хорошими восстановителями и могут
использоваться для этой цели в органической химии. При восстановлении
диалкилалюминийгидридом связей ≡Si-O- в эфирах ортокремниевой кислоты или
силоксанах образуются силаны:
R2AIH + R3’SIОСН=Сh3→R2AIOCH=Ch3 + R3’SiH.

Связь ≡A1-Н способна замещаться на органический радикал при действии
металлоорганических соединений:
2(С2Н5)2АlН + Mg(С2H5)2→2(С2Н5)3Al + MgН2
Алкоксиды алюминия
Реакция регулируемого окисления алюминийтриалкилов, протекающая ступенчато:
Взаимодействие алюминийтриалкилов, алкилалюминийгалогенидов, алкилалюминийгидридов
со спиртами также приводит к получению алкоксидов алюминия:
R3AL+3R’OH→ Al(OR’)3+3RH;
R2AIX + 3R’OН→ Al(OR’)3 + 2RH+ HX;
R2AIH + 3R’OН→ Al(OR’)3 + 2RH + h3
Для алюминия, который является весьма активным металлом, Возможна и прямая реакция со
спиртом с выделением водорода, подобно тому, как реагируют со спиртами щелочные металлы и
магний:
Al + 3ROH→ Al(OR)3+1,5h3
Реакция ускоряется каталитической системой НgCl2 + I2. Поверхность металлического алюминия
должна быть очищена от оксидной пленки.
Алкоксигрупшы у алюминия чувствительны к гидролизу. Реакция протекает
по схеме гидролитической поликонденсации с образованием алюмооксановой
связи:
Al(OR)3 (+h3O)→ (RO)2AIOH + ROH;
2(RO)2AIOH (-h3O)→(RO)2AIOAI(OR)2
Образующиеся соединения с гидроксильной группой у атома алюминия
претерпевают конденсацию с выделением воды.
 Реакции переэтерификации и
Реакции переэтерификации игетерофункциональной конденcации также характерны для алкоголятов
алюминия:
Al(OR)3 + 3R’ОН ⇌ Аl(ОR’)3 + 3ROH;
Al(OR)3 + ЗНOSIR3’⇌Al(OSiR3’)3 + 3ROH.
Практическое использование органических
производных алюминия
Широкое применение нашли элементорганические соединения алюминия благодаря
возможности их промышленного синтеза.
• Алюминийорганические соединения компоненты катализаторов Циглера — Натта,
используемых в синтезе полиолефинов и стереорегулярныхи диеновых каучуков,
катализаторы стереоспецифической полимеризации полярных мономеров, напр.
ацетальдегида, окисей олефинов, капролактама, а также синтеза олефинов
нормального строения и др.
• На основе алюминийорганических соединений разработаны методы получения
высших жирных спиртов нормального строения высших жирных к-т,
тетраэтилсвинца, а также металлич. Аl высокой чистоты.
• Алюминийалкилы — восстановители при получении карбонилов Мn, Сг, Мо и др.
 ,
,диалкилалюминийгидриды и комплексы типа M[R2A1h3]-мягкие восстановители
в орг. синтезе.
Учитывая специфические свойства алюминийорганических
соединений, а также использование в их производстве
водорода, этилена, изобутилена, хлористого этила, натрия,
алюминия (мелкодисперсного и активного, который может
самовоспламеняться на воздухе), следует считать производство
алюминийорганических соединений одним из наиболее
пожаро- и взрывоопасных в химической промышленности, и
поэтому техника безопасности и противопожарная техника при
получении этих веществ играют особую роль.
В НИИМСК была разработана новая каталитическая система
для производства бутилкаучука, состоящая из комплексного
катализатора на основе алюминийорганического соединения в
качестве растворителя применяется изопентан. Аппаратурное
оформление процесса производства бутилкаучука в растворе
изопентана аналогично получению бутилкаучука в среде
метилхлорида (за исключением полимеризатора).
 Однако
Однакоимеются различия в режиме полимеризации: реакцию
полимеризации проводят при более высоких температурах (от
—78 до —85°С), что облегчает регулирование процесса
полимеризации.
Составьте электронные формулы алюминия и представьте графически размещение электронов по квантовым.. на Сёзнайке.ру
Составьте электронные формулы алюминия и представьте графически размещение электронов по квантовым ячейкам. Проанализируйте возможности разъединения спаренных электронов при возбуждении атомов с образованием валентных электронов в соответствии с теорией спин-валентности.
Решение.
| ?? | ?? | ?? | ?| | | | |||||||||||||||||||||
| Al | 13 | ?? | ?? | 2p6 | ?? | 3p1 | ||||||||||||||||||
| 1s2 | 2s2 | 3s2 | ||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
| ? | ? | | | | ||||||||||||||||||||||
| Al* | 13 | ? | 3p2 | |||||||||||||||||||||
| 3s1 | ||||||||||||||||||||||||
Атом алюминия, имеет 3 валентных электрона, 2 из которых находятся на 3s-подуровне, в возбужденном состоянии * , спаренные электроны 3s-подуровня разъединяются и один из них переходит на свободную орбиталь 3p-подуровня. Таким образом атом алюминия имеет три неспаренных электрона и проявляет валентность 3 в соединениях. Например Al2O3 , AlCl3.
Таким образом атом алюминия имеет три неспаренных электрона и проявляет валентность 3 в соединениях. Например Al2O3 , AlCl3.
Цвет пигментов | Всё о красках
Цвет пигментов определяется совокупностью явлений рассеяния и поглощения света их частицами. В случае селективного поглощения света частицами пигмента на каком-либо участке видимой области спектра электромагнитных колебаний рассеянный свет, попадающий в органы зрения человека, вызывает ощущения цвета. Видимая область спектра приходится на интервал частот электромагнитных колебаний от 4,0*1014 до 7,9*1014с-1 (длины волн 760—380 нм). Объект, равномерно рассеивающий либо полностью или частично поглощающий свет во всей видимой области спектра, является бесцветным (белым, черным или серым). Если вещество поглощает какую-то часть спектра, то оно будет окрашено в цвет, дополнительный к поглощенному. Дополнительными называют цвета, способные при сложении давать белый цвет. Ниже показана зависимость цвета вещества от цвета и длины волны поглощенного света:
| Цвет поглощенного света | Длина волны погло щенного света, нм | Цвет вещества |
| Фиолетовый | 400—435 | Желто-зеленый |
| Синий | 435—490 | Желтый |
| Голубовато-зеленый | 490—510 | Красный |
| Зеленый | 510—560 | Пурпурный |
| Желто-зеленый | 560—580 | Фиолетовый |
| Желтый | 580—595 | Синий |
| Оранжевый | 595—610 | Зеленовато-голубой |
| Красный | 610—750 | Сине-зеленый |
Как известно, свет определенной длины волны (определенной частоты или, следовательно, определенной энергии) поглощается в том случае, если его энергия соответствует энергии перехода электрона в более высокое энергетическое состояние. Частота электромагнитных колебаний, которые могут вызвать переход электрона с более низкого энергетического уровня на более высокий, определяется вторым квантовым уравнением Бора, так называемым частотным уравнением:
Частота электромагнитных колебаний, которые могут вызвать переход электрона с более низкого энергетического уровня на более высокий, определяется вторым квантовым уравнением Бора, так называемым частотным уравнением:
где Е1— энергия атома в исходном состоянии; Е2 — энергия атома в возбужденном состоянии; h — постоянная Планка; n — частота.
В любом случае, для того чтобы соединение было окрашенным, необходимо наличие электронов в атоме, которые могут быть подняты на более высокий уровень таким образом, чтобы частота n из второго квантового уравнения Бора соответствовала области видимого света. Электронные переходы, удовлетворяющие этому условию, могут иметь различный характер.
ПЗ-Переход. Цвет многих кристаллических соединений обусловлен электронными переходами с молекулярных орбиталей, локализованных преимущественно на лигандах, на орбитали, локализованные на атоме металла. Такой переход носит название перехода с переносом заряда от лиганда на металл (ПЗ-переход). Этот переход наиболее энергетически возможен, если кристаллическая решетка состоит из сильно поляризующих катионов и сильно поляризующихся анионов. Для этого нужно, чтобы катионы имели небольшой ионный радиус и высокую валентность, а анионы — большой ионный радиус и низкую валентность. Увеличение поляризуемости аниона и поляризующей способности катиона приводит к снижению энергии, необходимой для осуществления перехода, т. е. сдвигает максимум поглощения света в длинноволновую область (батохромный эффект). Так, например, происходит углубление окраски при переходе от РbО к РbO2, вызванное уменьшением ионного радиуса свинца от 1,26 до 0,76 и возрастанием степени окисления свинца. Такое же явление наблюдается при переходе от Fе(ОН)2 к Fе(ОН)3 (ионные радиусы железа 0,8 и 0,67 соответственно). ПЗ-Переходом обусловлена окраска таких важнейших групп хроматических пигментов, как крона (пигменты, в состав которых входит ион CrO42 — ) и железооксидные пигменты.
Этот переход наиболее энергетически возможен, если кристаллическая решетка состоит из сильно поляризующих катионов и сильно поляризующихся анионов. Для этого нужно, чтобы катионы имели небольшой ионный радиус и высокую валентность, а анионы — большой ионный радиус и низкую валентность. Увеличение поляризуемости аниона и поляризующей способности катиона приводит к снижению энергии, необходимой для осуществления перехода, т. е. сдвигает максимум поглощения света в длинноволновую область (батохромный эффект). Так, например, происходит углубление окраски при переходе от РbО к РbO2, вызванное уменьшением ионного радиуса свинца от 1,26 до 0,76 и возрастанием степени окисления свинца. Такое же явление наблюдается при переходе от Fе(ОН)2 к Fе(ОН)3 (ионные радиусы железа 0,8 и 0,67 соответственно). ПЗ-Переходом обусловлена окраска таких важнейших групп хроматических пигментов, как крона (пигменты, в состав которых входит ион CrO42 — ) и железооксидные пигменты.
d‑d — Переход. Поскольку энергия видимого света сравнительно невелика, то, следовательно, необходимым условием окрашенности соединения является наличие так называемых рыхлосвязанных электронов. Как правило, легче возбуждаются электроны в ионах с незавершенной электронной оболочкой. Так, почти все соединения элементов побочных подгрупп периодической системы являются окрашенными. Иными словами, окрашенными обычно являются соединения элементов с незавершенными d-орбиталями.
Поскольку энергия видимого света сравнительно невелика, то, следовательно, необходимым условием окрашенности соединения является наличие так называемых рыхлосвязанных электронов. Как правило, легче возбуждаются электроны в ионах с незавершенной электронной оболочкой. Так, почти все соединения элементов побочных подгрупп периодической системы являются окрашенными. Иными словами, окрашенными обычно являются соединения элементов с незавершенными d-орбиталями.
Каждый электронный слой с главным квантовым числом 3 имеет набор из пяти d-орбиталей, отличающихся пространственным расположением. Если катион d-элемента не находится в окружении заряженных групп, то все пять орбиталей энергетически эквиваленты. Таким образом, d-электрон может с одинаковой вероятностью находиться на любой из пяти орбиталей. Однако, если катион находится под влиянием электростатического поля отрицательных зарядов, окружающих его и расположенных в вершинах октаэдра, тетраэдра или занимающих в пространстве другие фиксированные положения, d-орбитали энергетически не эквиваленты. Наиболее энергетически выгодными будут орбитали, максимально удаленные от отрицательных зарядов, т. е. будет иметь место так называемое расщепление d-орбиталей в электростатическом кристаллическом поле на уровни разной энергии. Переход электрона с одного уровня на другой вследствие расщепления d-орбиталей в электростатическом кристаллическом поле носит название d‑d — перехода.
Наиболее энергетически выгодными будут орбитали, максимально удаленные от отрицательных зарядов, т. е. будет иметь место так называемое расщепление d-орбиталей в электростатическом кристаллическом поле на уровни разной энергии. Переход электрона с одного уровня на другой вследствие расщепления d-орбиталей в электростатическом кристаллическом поле носит название d‑d — перехода.
d‑d — Переходом обусловлена зеленая окраска оксида хрома (III) и изумрудной зелени, где ион Сг3+ имеет строение внешнего электронного слоя 3S23р63d3 и его основное состояние расщепляется в поле лигандов на три уровня.
Переход электрона с катиона более низкой валентности на катион более высокой валентности. Пигменты, в состав которых входят металлы в разных валентных состояниях, всегда интенсивно окрашены. К таким пигментам относятся свинцовый сурик Рb3О4, являющийся свинцовой солью ортосвинцовой кислоты, черный железооксидный пигмент Fе3О4, кристаллическая решетка которого представляет собой кубическую плотную упаковку ионов кислорода, в пустотах которой распределены ионы Fе2+ и Fе3+. Окраска этих соединений обусловлена переходом электрона с иона более низкой валентности на ион более высокой валентности.
Окраска этих соединений обусловлена переходом электрона с иона более низкой валентности на ион более высокой валентности.
Электронные переходы, вызванные дефектами кристаллической структуры. Цвет кристаллического вещества может определяться наличием в нем точечных дефектов, которые служат причиной появления добавочных энергетических уровней; соответствующие им электронные переходы могут происходить под действием электромагнитного излучения видимой части спектра. Центром окраски может быть анионная вакансия, которая, действуя как положительный заряд, захватывает свободный электрон, поставляемый каким-либо примесным атомом; такой центр окраски называют F-центром. Центром окраски может являться совокупность катионной вакансии и дырки; такой центр называется V-центром. Могут быть и более сложные центры, состоящие из двух анионных вакансий и электрона или совокупности F-центра, катионной и анионной вакансий.
Наличием центров окраски определяется цвет ультрамарина, кристаллическая решетка которого представляет собой решетку алюмосиликата. Эта решетка состоит из общих для двух тетраэдров атомов кислорода и чередующихся атомов кремния и алюминия. Вследствие меньшей валентности алюминия алюмосиликатный каркас заряжен отрицательно, катионы натрия, уравновешивающие отрицательный заряд каркаса, равномерно распределены внутри него. Кроме катионов внутри каркаса содержатся ионы или радикалы серы. Наличие серы в пустотах кристаллической решетки ультрамарина приводит к появлению широкой полосы поглощения в длинноволновой области видимой части спектра.
Эта решетка состоит из общих для двух тетраэдров атомов кислорода и чередующихся атомов кремния и алюминия. Вследствие меньшей валентности алюминия алюмосиликатный каркас заряжен отрицательно, катионы натрия, уравновешивающие отрицательный заряд каркаса, равномерно распределены внутри него. Кроме катионов внутри каркаса содержатся ионы или радикалы серы. Наличие серы в пустотах кристаллической решетки ультрамарина приводит к появлению широкой полосы поглощения в длинноволновой области видимой части спектра.
Электронные переходы, обусловливающие цвет органических соединений. В соответствии с теорией молекулярных орбиталей, образование s — и p-связей в молекуле в общем случае приводит к реализации набора молекулярных орбиталей, характеризующихся различным распределением электронных плотностей между ядрами атомов. Орбитали с максимальной электронной плотностью между атомами обладают меньшей энергией, нежели орбитали с минимальной электронной плотностью. Орбитали с меньшей энергией называют связывающими, орбиталм с большей энергией — разрыхляющими. Если в молекуле имеются атомы со свободными электронными нарами, не принимающими участия в образовании связей, то они находятся на несвязывающей орбитали (n). Энергетические уровни соответствующих орбиталей возрастают в следующем порядке:
Если в молекуле имеются атомы со свободными электронными нарами, не принимающими участия в образовании связей, то они находятся на несвязывающей орбитали (n). Энергетические уровни соответствующих орбиталей возрастают в следующем порядке:
s<p<n<p*<s*
Поглощение света молекулой вызывает переход электронов в ней на более высокий энергетический уровень. Вещество будет поглощать свет в видимой части спектра, если возможны переходы электрона под действием электромагнитного излучения соответствующей энергии. Переход s ‑ s*, наиболее характерный для насыщенных углеводородов, совершается с поглощением энергии, соответствующей дальней УФ-области спектра. p— p*-переходы, характерные для ненасыщенных органических соединений, требуют меньших энергий. Однако в случае изолированных двойных связей поглощение света происходит в УФ-области, и лишь при наличии сопряжения повышение энергии p-уровня может привести к такому снижению энергии этого перехода, что он будет происходить под действием света видимой части спектра. Удлинение системы сопряжения вызывает батохромный эффект.
Удлинение системы сопряжения вызывает батохромный эффект.
В гетероорганических соединениях неподеленные электроны азота, кислорода, серы способны к n — p* и n — s* переходам, требующим сравнительно малых энергий. По этой причине большинство гетероорганических соединений поглощают свет в видимой и ближней УФ-области.
Присоединение к системе сопряжения поляризующих заместителей, смещающих p-электроны в невозбужденном состоянии по цепи сопряжения, приводит к снижению энергии p— p* перехода и вызывает батохромный эффект. Введение в молекулу таких заместителей кроме смещения полосы поглощения в длинноволновую область вызывает также и повышение максимума абсорбции света (гиперхромный эффект).
На цвет органических соединений оказывают влияние и пространственные факторы. Так, искажение формы молекулы (углов между направлениями связей) повышает энергетический уровень молекулы в основном состоянии, снижает энергию перехода в возбужденное состояние и вызывает тем самым батохромный эффект. Однако, если возможен поворот одной части молекулы относительно другой, и введение какого-либо заместителя нарушает плоскостную структуру молекулы красителя, то это приводит к гипохромному эффекту из-за разобщения отдельных участков цепи сопряжения.
Однако, если возможен поворот одной части молекулы относительно другой, и введение какого-либо заместителя нарушает плоскостную структуру молекулы красителя, то это приводит к гипохромному эффекту из-за разобщения отдельных участков цепи сопряжения.
Итак, цвет вещества зависит от положения полосы поглощения в видимой части спектра. Однако на цвет пигмента в большой степени влияют форма и размер частиц, так как суммарное цветовое ощущение определяется не только спектром поглощения, но и характером рассеяния света частицами пигмента. Так, увеличение размера частиц свинцового оранжевого и красного свинцово-молибдатного кронов приводит к смещению максимума отражательной способности пигмента в длинноволновую область, т. е. к усилению красного оттенка. Рост кристаллов при синтезе желтого железооксидного пигмента ведет к сильному потемнению продукта. Варьируя размеры частиц красного железооксидного пигмента, можно получить целую гамму оттенков.
Большое влияние на цвет пигмента оказывает кристаллическая структура.
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Как вы работаете?
Вам нужно написать сообщение в WhatsApp . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Whatsapp или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения.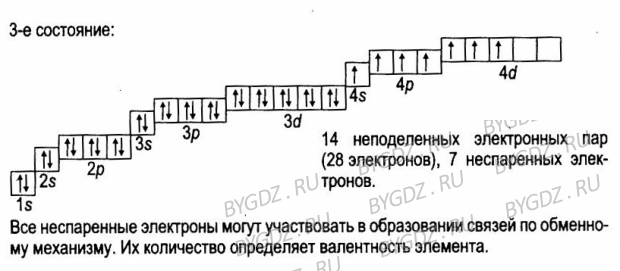 Я и моя команда изучим внимательно задание и сообщим цену.
Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/FTtp-vAv3lI» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/7LD4euDcivY» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/ZfNUaigadEY» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
1#. Это представлено как (игнорируя #3s#):
#ul(color(white)(uarr darr))» «ul(color(white)(uarr darr))» «ul(color(white)(uarr darr))» «ul(color(white)(uarr darr) ))» «ul(color(white)(uarr darr))#
#underbrace(«»»»»»»»»»»»»»»»»»»»»»»»»»»» «)#
#» «» «» «» «» «» «3d##ul(uarr color(white)(darr))#
#4s#
#»»##ul(cancel(uarr) color(white)(darr))» «ul(color(white)(uarr darr))» «ul(color(white)(uarr darr))#
#underbrace(» «» «»»»»»»»»»»»»)#
#»»»»»»3p#
Нормальная электронная конфигурация алюминия имеет вид #[Ne]3s^2 3p^1#. Атомные возбуждения подчиняются следующим правилам отбора :
Атомные возбуждения подчиняются следующим правилам отбора :
- изменение полного углового момента, #DeltaL#, должно быть #bb(pm1)#, где #L = |sum_k m_(l,k)|#, #k# указывает #k#-й электрон, а #m_l# — магнитное квантовое число орбитали.
- Должно быть без изменений в общем спине, #S = |sum_i m_(s,i)|#, где #k# указывает #k#-й электрон, а #m_s# — спиновое квантовое число электрона.
Чтобы общий спин #S# не изменился, т.е.е. #DeltaS = 0#, наш единственный вариант для алюминия — это переход от , наполовину заполненной -орбитали, к пустой -орбитали .
Изначально, поскольку у нас есть только один электрон #3p#, суммы нет, и мы имеем:
#S_i = |m_(s,1)|#
#= 1/2#
для:
#ul(color(white)(uarr darr))» «ul(color(white)(uarr darr))» «ul(color(white)(uarr darr))» «ul(color(white)(uarr darr) ))» «ul(color(white)(uarr darr))#
#underbrace(«»»»»»»»»»»»»»»»»»»»»»»»»»»» «)#
#» «» «» «» «» «» «3d##ul(color(white)(uarr darr))#
#4s#
#»»##ul(uarr color(white)(darr))» «ul(color(white)(uarr darr))» «ul(color(white)(uarr darr))#
#underbrace(» «»»» » «»»»»»»»»»)#
#»»»»»»3р#
Теперь, так как для перехода вверх допускается только #DeltaL = pm1#, мы должны учитывать, что прямо сейчас, для одного электрона #3p#,
#L_i = m_(l,1) = |-1| = 1#.
1)#
из-за перехода #3p -> 4s#, с #DeltaL = 0 — 1 = -1# и #DeltaS = 1/2 — 1/2 = 0#. У нас получилось:
#ul(color(white)(uarr darr))» «ul(color(white)(uarr darr))» «ul(color(white)(uarr darr))» «ul(color(white)(uarr darr) ))» «ul(color(white)(uarr darr))#
#underbrace(«»»»»»»»»»»»»»»»»»»»»»»»»»»» «)#
#» «» «» «» «» «» «3d##ul(uarr color(white)(darr))#
#4s#
#»»##ul(color(white)(uarr darr))» «ul(color(white)(uarr darr))» «ul(color(white)(uarr darr))#
#underbrace(» «»»» » «»»»»»»»»»)#
#»»»»»»3р#
Сколько валентных электронов имеет алюминий(Al)?
13-й элемент периодической таблицы — алюминий.Элемент 13-й группы — алюминий, его обозначение — Al. Алюминий образует связи через свои валентные электроны. В этой статье подробно рассматриваются валентных электронов алюминия. Надеюсь, прочитав эту статью, вы узнаете об этом подробно.
Сколько электронов, протонов и нейтронов имеет алюминий (Al)?
Ядро расположено в центре атома. Протоны и нейтроны находятся в ядре. Атомный номер алюминия — 13. Атомный номер — это число протонов.То есть количество протонов в алюминии (Al) равно тринадцати. Электроны, равные протонам, расположены в круглой оболочке вне ядра. То есть атом алюминия имеет всего тринадцать электронов.
Протоны и нейтроны находятся в ядре. Атомный номер алюминия — 13. Атомный номер — это число протонов.То есть количество протонов в алюминии (Al) равно тринадцати. Электроны, равные протонам, расположены в круглой оболочке вне ядра. То есть атом алюминия имеет всего тринадцать электронов.
Число нейтронов в элементе получается из разницы между числом атомных масс и числом атомов. То есть число нейтронов (n) = атомное массовое число (A) – атомный номер (Z)
Мы знаем, что атомный номер алюминия равен 13, а атомное массовое число составляет около 27(26.981). Нейтрон (n) = 27 – 13 = 14. Следовательно, число нейтронов в алюминии (Al) равно 14.
Каковы валентные электроны алюминия (Al)?
Второй элемент в группе 13 – алюминий. Валентный электрон — это общее количество электронов на последней орбите. Общее количество электронов на последней оболочке после электронной конфигурации алюминия называется валентными электронами алюминия (Al). Валентные электроны определяют свойства элемента и участвуют в образовании связей. Тринадцатым элементом периодической таблицы является алюминий (Al). То есть атом элемента алюминия имеет всего тринадцать электронов. На этом сайте есть статья, в которой подробно описывается электронная конфигурация алюминия (Al) , вы можете прочитать ее, если хотите.
Тринадцатым элементом периодической таблицы является алюминий (Al). То есть атом элемента алюминия имеет всего тринадцать электронов. На этом сайте есть статья, в которой подробно описывается электронная конфигурация алюминия (Al) , вы можете прочитать ее, если хотите.
Как рассчитать количество валентных электронов в атоме алюминия(Al)?
Валентный электрон необходимо определить, выполнив несколько шагов. Электронная конфигурация является одной из них.Невозможно определить валентный электрон без электронной конфигурации. Зная правильно электронную конфигурацию, очень легко определить валентные электроны всех элементов. На этом сайте опубликована статья с подробным описанием электронной конфигурации , вы можете прочитать ее, если хотите. Однако в этой статье кратко обсуждается электронная конфигурация.
Однако валентные электроны можно легко идентифицировать, расположив электроны в соответствии с атомарным принципом Бора. Теперь мы научимся определять валентный электрон алюминия (Al).
Теперь мы научимся определять валентный электрон алюминия (Al).
Шаг-1: Определение общего количества электронов в алюминии(Al)
1 st Нам нужно знать общее количество электронов в атоме алюминия(Al). Чтобы узнать количество электронов, нужно знать количество протонов в алюминии. А чтобы узнать количество протонов, нужно знать атомный номер элемента алюминия.
Положение алюминия (Al) в периодической таблицеЧтобы узнать атомный номер, нам нужно воспользоваться помощью периодической таблицы.Необходимо знать атомный номер элементов алюминия (Al) из периодической таблицы. Атомный номер — это количество протонов. А электроны, равные протонам, находятся вне ядра.
То есть, можно окончательно сказать, что в атоме алюминия есть электроны, равные атомному номеру. Из периодической таблицы мы видим, что атомный номер алюминия равен 13. То есть атом алюминия (Al) имеет в общей сложности тринадцать электронов.
Шаг 2: Необходимо определить электронную конфигурацию алюминия (Al)
Шаг 2 очень важен. На этом этапе электроны алюминия (Al) должны быть организованы. Мы знаем, что атомы алюминия имеют в общей сложности тринадцать электронов. Электронная конфигурация алюминия показывает, что два электрона находятся на K-оболочке, восемь — на L-оболочке и три — на M-оболочке (орбите).
На этом этапе электроны алюминия (Al) должны быть организованы. Мы знаем, что атомы алюминия имеют в общей сложности тринадцать электронов. Электронная конфигурация алюминия показывает, что два электрона находятся на K-оболочке, восемь — на L-оболочке и три — на M-оболочке (орбите).
То есть первая оболочка алюминия имеет два электрона, вторая оболочка имеет восемь электронов и 3-я оболочка имеет три электрона. Электронная конфигурация алюминия (Al) через подорбиту: 1s 2 2s 2 2p 6 3s 2 3p 1 .
Этап-3: Определение валентной оболочки и расчет общего количества электронов
Третий шаг — диагностика валентной оболочки. Последняя оболочка после электронной конфигурации называется валентной оболочкой. Общее число электронов в валентной оболочке называется валентным электроном. Электронная конфигурация алюминия (Al) показывает, что последняя оболочка алюминия имеет три электрона (3s 2 3p 1 ).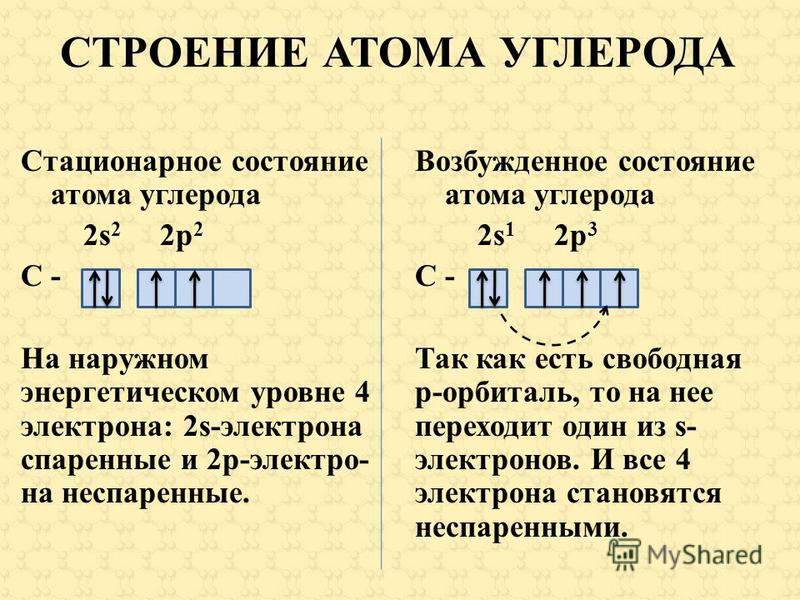 Следовательно, валентных электронов алюминия три.
Следовательно, валентных электронов алюминия три.
Электроны валентности для алюминия (Al)
Какова валентность алюминия (Al)?
Способность одного атома элемента присоединяться к другому атому при образовании молекулы называется валентностью (валентностью).Существуют некоторые правила диагностики валентности. Число электронов в неспаренном состоянии на последней оболочке после электронной конфигурации атома называется валентностью этого элемента.
Валентность и валентные электроны алюминия(Al) Валентность определяется по электронной конфигурации элемента в возбужденном состоянии. Электронная конфигурация алюминия (Al) в возбужденном состоянии Al * (13) = 1S 2 2S 2 2P 6 3S 1 3P 1 3P x 1 3P y 1 . Электронная конфигурация алюминия показывает, что он имеет три неспаренных электрона на последней оболочке (3s 1 3p x 1 3p y 1 ). Следовательно, валентность алюминия (Al) равна 3.
Электронная конфигурация алюминия показывает, что он имеет три неспаренных электрона на последней оболочке (3s 1 3p x 1 3p y 1 ). Следовательно, валентность алюминия (Al) равна 3.
Сколько валентных электронов имеет ион алюминия (Al
3+ )?После электронной конфигурации последняя оболочка атома алюминия имеет три электрона. В данном случае валентность алюминия равна 3. Мы знаем об этом подробности. Элементы, имеющие 1, 2 или 3 электрона на последней оболочке, отдают электроны на последней оболочке при образовании связи.
Элементы, которые образуют связи, отдавая электроны, называются катионами. Алюминий отдает электрон последней оболочки для образования связей и превращается в ионы алюминия. То есть алюминий является катионным элементом.
Al – 3e – → Al 3+
Электронная конфигурация иона алюминия (Al 3+ ) 1s 2 2s 2 12p 691 Электронная конфигурация иона алюминия показывает, что ионы алюминия имеют только две оболочки, а последняя оболочка имеет восемь электронов. Электронная конфигурация показывает, что ион алюминия (Al 3+ ) приобрел электронную конфигурацию неона .
Электронная конфигурация показывает, что ион алюминия (Al 3+ ) приобрел электронную конфигурацию неона .
То есть в данном случае валентность иона алюминия +3. Поскольку последняя оболочка иона алюминия имеет восемь электронов, валентных электронов иона алюминия (Al 3+ ) восемь.
Соединение алюминия
Алюминий участвует в образовании связей через свои валентные электроны. Мы знаем, что валентных электронов в алюминии три.Этот валентный электрон участвует в образовании связей с атомами других элементов. Конфигурация электронов кислорода показывает, что валентных электрона кислорода равны шести. Атом алюминия отдает свои валентные электроны атому кислорода, а атом кислорода получает эти электроны.
В результате кислород приобретает электронную конфигурацию неона, а атомы алюминия также приобретают электронную конфигурацию неона. Оксид алюминия (Al 2 O 3 ) образуется в результате обмена электронами между двумя атомами алюминия и тремя атомами кислорода. Оксид алюминия (Al 2 O 3 ) представляет собой ионную связь.
Оксид алюминия (Al 2 O 3 ) представляет собой ионную связь.
Al Информация об алюминиевом элементе: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементов
История алюминия
Элемент Алюминий был открыт Никто в год 1825 г. в Дании . Алюминий получил свое название от глинозема, соединения (первоначально алюминий)
Присутствие алюминия: изобилие в природе и вокруг нас
В таблице ниже показано содержание алюминия во Вселенной, на Солнце, в метеоритах, Земная кора, океаны и тело человека.
Кристаллическая структура алюминия
Твердотельная структура алюминия представляет собой гранецентрированный куб .
Кристаллическую структуру можно описать с точки зрения ее элементарной ячейки. Единичные клетки повторяются в
три
объемное пространство для формирования конструкции.
Единичные клетки повторяются в
три
объемное пространство для формирования конструкции.
Параметры ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| и | б | в |
|---|---|---|
| 404.95 | 404,95 | 404,95 вечера |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π/2 | №/2 | №/2 |
Положения атомов внутри элементарной ячейки описываются набором положений атомов (
x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются понятием пространственных групп. Все возможное симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются различными.
Атомные и орбитальные свойства алюминия
Атомы алюминия имеют 13 электронов и структура электронной оболочки [2, 8, 3] с атомным символом (квантовыми числами) 2 P 1/2 .
Оболочечная структура алюминия – количество электронов на единицу энергии уровень
| нет | с | р | д | ф | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | л | 2 | 6 | ||
| 3 | М | 2 | 1 |
Электронная конфигурация основного состояния алюминия — нейтральная Атом алюминия
Электронная конфигурация основного состояния нейтрального атома алюминия
[нэ] 3с2 3п1. Часть конфигурации алюминия, которая эквивалентна благородному газу
предшествующий период обозначается аббревиатурой [Ne]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используется сокращенная нотация. Это важно, поскольку это
валентные электроны 3s2 3p1, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации алюминия, которая эквивалентна благородному газу
предшествующий период обозначается аббревиатурой [Ne]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используется сокращенная нотация. Это важно, поскольку это
валентные электроны 3s2 3p1, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Расшифрованная электронная конфигурация из нейтрального алюминия
Полная электронная конфигурация атома алюминия в основном состоянии, Полная электронная конфигурация
1с2 2с2 2п6 3с2 3п1
Атомная структура алюминия
Атомный радиус алюминиясоставляет 118 пм, а его ковалентный радиус — 118 пм.
Атомный спектр алюминия
Химические свойства алюминия: Энергии ионизации алюминия и сродство к электрону
Электронное сродство алюминия 42,5 кДж/моль.
Энергия ионизации алюминия
Энергии ионизации алюминия
см. в таблице ниже.| Номер энергии ионизации | Энтальпия — кДж/моль |
|---|---|
| 1 | 577.5 |
| 2 | 1816.7 |
| 3 | 2744,8 |
| 4 | 11577 |
| 5 | 14842 |
| 6 | 18379 |
| 7 | 23326 |
| 8 | 27465 |
| 9 | 31853 |
| 10 | 38473 |
Физические свойства алюминия
Физические свойства алюминия см. в таблице ниже
в таблице ниже
| Плотность | 2.7 г/см3 |
| Молярный объем | 9,99316222222 см3 |
Упругие свойства
Твердость алюминия. Испытания для измерения твердости элемента
Электрические свойства алюминия
Алюминий является проводником электричества. Ссылаться на Таблица ниже для электрических свойств алюминия
Свойства тепла и проводимости алюминия
Магнитные свойства алюминия
Оптические свойства алюминия
Акустические свойства алюминия
Тепловые свойства алюминия — энтальпии и термодинамика
Тепловые свойства алюминия
см. в таблице ниже.
в таблице ниже.Энтальпии алюминия
Изотопы алюминия — ядерные свойства алюминия
Изотопы родия.Встречающийся в природе алюминий имеет 1 стабильный изотоп — 27Ал.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим затухания |
|---|---|---|---|---|
| 21Ал | ||||
| 22алюминий | ||||
| 23алюминий | ||||
| 24алюминий | ||||
| 25Al | ||||
| 26Al | ||||
| 27алюминий | 100% | Стабильный | Н/Д | |
| 28алюминий | ||||
| 29алюминий | ||||
| 30алюминий | ||||
| 31Al | ||||
| 32Al | ||||
| 33Al | ||||
| 34Al | ||||
| 35Al | ||||
| 36Al | ||||
| 37Al | ||||
| 38Al | ||||
| 39Al | ||||
| 40Ал | ||||
| 41Ал | ||||
| 42Ал |
Нормативно-правовое регулирование и здоровье – Параметры и рекомендации по охране здоровья и безопасности
Поиск по базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химических реестров
Изучите нашу интерактивную периодическую таблицу
Сравнение элементов периодической таблицы
Химия алюминия (Z=13) — Chemistry LibreTexts
Алюминий (также называемый алюминием) является третьим наиболее распространенным элементом в земной коре. Он обычно используется в домашнем хозяйстве в качестве алюминиевой фольги, в таких ремеслах, как крашение и гончарное дело, а также в строительстве для изготовления сплавов. В чистом виде металл голубовато-белого цвета и очень пластичен. Он является отличным проводником тепла и электричества и находит применение в проводке. В чистом виде он слишком мягкий для строительных целей, но добавление небольшого количества кремния и железа значительно его упрочняет.
Он обычно используется в домашнем хозяйстве в качестве алюминиевой фольги, в таких ремеслах, как крашение и гончарное дело, а также в строительстве для изготовления сплавов. В чистом виде металл голубовато-белого цвета и очень пластичен. Он является отличным проводником тепла и электричества и находит применение в проводке. В чистом виде он слишком мягкий для строительных целей, но добавление небольшого количества кремния и железа значительно его упрочняет.
Факты
- Обозначение: Al
- Атомный номер: 13
- Атомный вес: 26.98154 а.е.м.
- Цвет: серебристый
- Температура плавления: 933,4 К
- Температура кипения: 2792 К
- Плотность: 2,70 г/см 3
- Количество степеней окисления: 3
- Отличный восстановитель
- Имеет 13 электронов, 13 протонов и 14 нейтронов
- Металл
- Хороший проводник
- Устойчив к коррозии
- Немагнитный
- Стабильный ион
- Образует димеры
- Номер группы: 13
История алюминия
Алюминий занимает третье место в списке десяти самых распространенных элементов в земной коре, а его оксид — четвертое место среди десяти самых распространенных соединений в земной коре. Это самый распространенный металл на планете. Его название взято от латинского alumen для квасцов. Мягкий, легкий и серебристый, его существование было предложено Лавуазье в 1787 году, названо Дэви в 1807 году и окончательно выделено Эрстедом в 1825 году. установите краску на ткань. В то время он был известен как очень дорогой металл. В конце 1800-х годов два ученых, Чарльз Мартин Холл и Пол Л. Т. Эрулт, обнаружили, что они могут производить алюминий из оксида алюминия посредством электролиза и криолита (расплавленного минерального растворителя).Это позволило снизить цену и сделать алюминий доступным для коммерческого использования.
Это самый распространенный металл на планете. Его название взято от латинского alumen для квасцов. Мягкий, легкий и серебристый, его существование было предложено Лавуазье в 1787 году, названо Дэви в 1807 году и окончательно выделено Эрстедом в 1825 году. установите краску на ткань. В то время он был известен как очень дорогой металл. В конце 1800-х годов два ученых, Чарльз Мартин Холл и Пол Л. Т. Эрулт, обнаружили, что они могут производить алюминий из оксида алюминия посредством электролиза и криолита (расплавленного минерального растворителя).Это позволило снизить цену и сделать алюминий доступным для коммерческого использования.
Алюминий на Земле
Алюминий — третий по распространенности элемент на Земле и самый распространенный металл. Он составляет 8,1% земной коры по массе, после кислорода и кремния. Естественно, он встречается в химических соединениях с другими элементами, такими как бокситы. Его нелегко удалить из природных руд, поскольку его необходимо сначала восстановить. Чтобы увидеть, как глинозем, который используется для производства алюминия, извлекается из бокситов, прочитайте процесс Байера в разделе «Очистка алюминия».
Чтобы увидеть, как глинозем, который используется для производства алюминия, извлекается из бокситов, прочитайте процесс Байера в разделе «Очистка алюминия».
Электронная конфигурация алюминия
Чтобы найти электронную конфигурацию атома, сначала нужно узнать количество электронов, которые у него есть. Поскольку атомный номер алюминия равен тринадцати, у него тринадцать электронов. Затем вы разделяете электроны между разными орбиталями. Первые два электрона алюминия попадают на 1s-орбиталь, а следующие два электрона идут на 2s-орбиталь. Следующие шесть электронов заполняют 2p-орбиталь во второй оболочке (это пока десять электронов, осталось еще три).Затем электроны 11 и 12 заполняют 3s-орбиталь. Наконец, последний электрон занимает 3р-орбиталь.
Электронная конфигурация алюминия: 1s 2 2s 2 2p 6 3s 2 3p 1 . Электронная конфигурация основного состояния: [Ne]3s 2 3p 1 .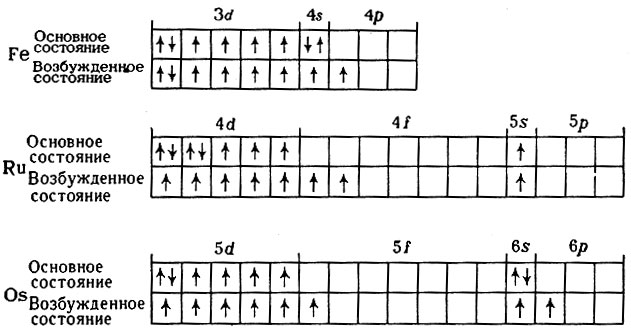
Степени окисления
Алюминий имеет три степени окисления. Чаще всего это +3. Два других +1 и +2. Одна степень окисления +3 для алюминия может быть найдена в составном оксиде алюминия, Al 2 O 3 .В AlO, монооксиде алюминия, он имеет степень окисления +2, а AlH имеет степень окисления +1.
Алюминиевые соединения
Хотя алюминий не кажется особенно реактивным, он считается активным металлом. Его поведение обманчиво, потому что он быстро реагирует с кислородом воздуха с образованием оксида алюминия (\(Al_2O_3\)), или оксида алюминия, который прочно связан с металлом и существует в виде плотного покрытия (в отличие от оксидов железа). Это покрытие защищает его от дальнейшей реакции.Однако очевидно, что это покрытие не является полностью надежным, поскольку алюминий не существует в самородном виде.
Глинозем — это тугоплавкий оксид алюминия, который содержится в бокситах и корундах (сапфирах и рубинах). Он имеет очень высокую температуру плавления. Одним из применений этого соединения является получение света разного цвета, который можно использовать в качестве лазерного луча. Он также используется в гончарном деле, крашении, антацидных лекарствах и в производстве химикатов.
Одним из применений этого соединения является получение света разного цвета, который можно использовать в качестве лазерного луча. Он также используется в гончарном деле, крашении, антацидных лекарствах и в производстве химикатов.
Другим соединением, содержащим алюминий, является Al(OH) 3 , которое обычно образуется в виде желеобразного осадка при гидролизе соединений алюминия в воде.{3+} +3H_{2(г)}\]
При сварке крупных объектов применяют термитную реакцию:
\[2Al_{(s)} + Fe_2O_{3(s)} \rightarrow Al_2O_{3(s)} + Fe_{(s)}\]
Реакции с галогенами
Галогениды алюминия, как и галогениды бора, являются реактивными кислотами Льюиса, что означает, что они легко принимают пару электронов. Например, важным галогенидным комплексом для производства алюминия является криолит NaAlF 6.
\[6 HF +Al(OH)_3 + 3NaOH \rightarrow Na_3AlF_6 +6 H_2O\]
Оксид и гидроксид алюминия
Оксид алюминия часто называют глиноземом, а в кристаллическом виде – корундом. -_{ (водн.)}\]
-_{ (водн.)}\]
Очистка алюминия
Сегодня большая часть алюминия производится методом Холла, в котором для электролиза металлического алюминия из смеси расплавленных солей используется значительное количество энергии в виде электричества. Большие первоначальные затраты энергии являются одной из важных причин, по которой переработка алюминия является такой хорошей и рентабельной идеей.
Поскольку алюминий встречается в соединениях с другими элементами, его необходимо восстанавливать. Процесс Байера был изобретен Карлом Байером в 1887 году.В основном это относится к переработке бокситов, самой важной алюминиевой руды, для производства глинозема . Отсюда промежуточный оксид алюминия должен быть переплавлен в металлический алюминий с помощью процесса Холла-Эру.
Каталожные номера
- Гарнизон Спозито. Экологическая химия алюминия. стр 57-72. 1 декабря 2008 г.
- Химия окружающей среды и токсикология химии. 2 декабря 2008 г.

- Петруччи, Общая химия, принципы и современные приложения, издательства Macmillan Publishing Company, девятое издание, стр. 891-893.
- «Алюминий». Колумбийская энциклопедия . 6-е изд. Нью-Йорк: Columbia UP, 2009. .
- «Глинозем». Колумбийская энциклопедия . 6-е изд. Нью-Йорк: Columbia UP, 2009. .
Проблемы
- Напишите конфигурацию алюминия, предполагая, что он потерял свои валентные электроны.
- Что происходит с алюминием при взаимодействии с хлором?
- Сбалансируйте эти уравнения: a) 2Al(s) → Al 3 + (водн.) + e —
b) Al(s) + Pb + (водн.)→ Al 3 + (водн.)+ Pb(т) - Какова электронная конфигурация алюминия?
- Каков процесс извлечения глинозема из бокситов?
- Завершите и сбалансируйте следующие реакции.
- Al(OH) 3 (т) + OH — (водн.
 ) →
) → - Al(OH) 3 (т) + H + (водн.) →
- Al(OH) 3 (т) + OH — (водн.
Решения
1. 1s 2 2s 2 2p 6 или [Ne]
2. Образует димер.
3. a) 2Al(s) → Al 3 + (водн.) + 3 e —
б) 2 Al(т) + 3 Pb + (водн.) → 2 Al 3 + (водн.) + 3 Pb0(тв)
4.1s 2 2s 2 2p 6 3s 2 3p 1
5. Процесс Байера
6.1 Al(OH) 3 (т) +OH — (водн.) → [Al(OH) 4 ] — (водн.)
6,2 Al(OH) 3( с) + 3 H + (водн.) → Al(H 2 O) 3 ] 3+ (водн.)
Авторы и авторство
- Лия Д’Анджело, Ханна Тауэрс, Даниэль Аренс
Стивен Р. Марсден
Марсден
Молекулярно-орбитальная диаграмма основного и валентно-возбужденного состояний…
Контекст 1
… переноса, что способствует уменьшению порядка связи СС и, следовательно, увеличению длины связи. Другим существенным изменением в структуре этилена является изгиб метиленовых групп на 17,6° в базисе aug-cc-pVTZ ͒ относительно плоскости свободной молекулы. Это отражает изменения в гибридизации атомов С от sp 2 в свободном этилене до промежуточного соединения между sp 2 и sp 3 в комплексе и, таким образом, согласуется с приведенным порядком связи.Эти структурные изменения отражают ослабление связи СС при комплексообразовании. В контексте катализа взаимодействие между алюминием и этиленом в β-связанном комплексе приводит к активации связи CC. Другая интересующая величина, теплота образования состояния ̃ X 2 B 2 при 0 К, с поправкой на энергию нулевых колебаний ͑ ZPE ͒ , составляет 15,71 ккал моль Ϫ 1 ͑ поправка ZPE дает 0,39 ккал моль Ϫ 1 к общему значению ͒ . Это значение было вычислено в базисном наборе aug-cc-pwCVTZ, 34 который обеспечивает адекватную обработку корреляции ядро-ядро и ядро-валентность.Значение, рассчитанное в базисе aug-cc-pVTZ с замороженными остовными электронами, находится в пределах 0,6 ккал моль Ϫ 1 от aug-cc-pwCVTZ, однако результат aug-cc-pVTZ, полученный с коррелированными остовными электронами, ниже на 3,88. ккал моль Ϫ 1 из-за несбалансированной обработки активной зоны. Расчеты с основаниями d-aug-cc-pVTZ и aug-cc-pVQZ и замороженным ядром находятся в пределах 0,5 ккал моль Ϫ 1 от результата aug-cc-pVTZ/замороженного ядра ͑ и полных расчетов aug-cc-pwCVTZ ͒ . Это показывает, что добавление второго набора диффузных функций или улучшение качества n Ϫ за пределами тройной дзета не является необходимым.Величина ⌬ E ° 0 характеризует связь в этом комплексе как промежуточную между ван-дер-ваальсовым взаимодействием и обычной ковалентной связью. Взаимодействие между фрагментами в этой системе довольно слабое, так как оно обусловлено перекрыванием однократно занятой p-орбитали Al и разрыхляющей (*) орбитали этилена, а также между вакантным sp-гибридом Al и дважды занятой -орбиталью этилена.
Это значение было вычислено в базисном наборе aug-cc-pwCVTZ, 34 который обеспечивает адекватную обработку корреляции ядро-ядро и ядро-валентность.Значение, рассчитанное в базисе aug-cc-pVTZ с замороженными остовными электронами, находится в пределах 0,6 ккал моль Ϫ 1 от aug-cc-pwCVTZ, однако результат aug-cc-pVTZ, полученный с коррелированными остовными электронами, ниже на 3,88. ккал моль Ϫ 1 из-за несбалансированной обработки активной зоны. Расчеты с основаниями d-aug-cc-pVTZ и aug-cc-pVQZ и замороженным ядром находятся в пределах 0,5 ккал моль Ϫ 1 от результата aug-cc-pVTZ/замороженного ядра ͑ и полных расчетов aug-cc-pwCVTZ ͒ . Это показывает, что добавление второго набора диффузных функций или улучшение качества n Ϫ за пределами тройной дзета не является необходимым.Величина ⌬ E ° 0 характеризует связь в этом комплексе как промежуточную между ван-дер-ваальсовым взаимодействием и обычной ковалентной связью. Взаимодействие между фрагментами в этой системе довольно слабое, так как оно обусловлено перекрыванием однократно занятой p-орбитали Al и разрыхляющей (*) орбитали этилена, а также между вакантным sp-гибридом Al и дважды занятой -орбиталью этилена. Более сильное межфрагментное взаимодействие потребовало бы большего перекрытия и, следовательно, большего переноса заряда p → * и → sp, что дестабилизировало бы этиленовый фрагмент.Следовательно, прирост энергии за счет более прочной межфрагментной связи будет превышать потери энергии за счет дестабилизации этилена. Это похоже на (NO) 2 ͑ Ref. 18 ͒ и (O 2 ) Ϫ 2 ͑ Ссыл. 19 ͒ димеры, в которых разрыхляющие орбитали также участвуют в межфрагментарном связывании. Энергии вертикального возбуждения и силы осцилляторов для всех исследованных в данной работе состояний ͑ с энергиями вертикального возбуждения до 5,18 эВ ͒ приведены в таблице I и проиллюстрированы на рис. 3. Был использован метод EOM–CCSD 35, 36 для характеристики возбужденных состояний.Известно, что эта модель хорошо работает — точность 0,1–0,3 эВ для расчетных энергий возбуждения, сбалансированное рассмотрение валентных и ридберговских состояний — применительно к состояниям, в которых преобладает возбуждение одного электрона из основного состояния.
Более сильное межфрагментное взаимодействие потребовало бы большего перекрытия и, следовательно, большего переноса заряда p → * и → sp, что дестабилизировало бы этиленовый фрагмент.Следовательно, прирост энергии за счет более прочной межфрагментной связи будет превышать потери энергии за счет дестабилизации этилена. Это похоже на (NO) 2 ͑ Ref. 18 ͒ и (O 2 ) Ϫ 2 ͑ Ссыл. 19 ͒ димеры, в которых разрыхляющие орбитали также участвуют в межфрагментарном связывании. Энергии вертикального возбуждения и силы осцилляторов для всех исследованных в данной работе состояний ͑ с энергиями вертикального возбуждения до 5,18 эВ ͒ приведены в таблице I и проиллюстрированы на рис. 3. Был использован метод EOM–CCSD 35, 36 для характеристики возбужденных состояний.Известно, что эта модель хорошо работает — точность 0,1–0,3 эВ для расчетных энергий возбуждения, сбалансированное рассмотрение валентных и ридберговских состояний — применительно к состояниям, в которых преобладает возбуждение одного электрона из основного состояния. 47 Однако возбужденные состояния, являющиеся двухэлектронными промоушенами, гораздо менее точно обрабатываются методом EOM-CCSD из-за дисбаланса в обработке корреляции для двух электронов в основном и возбужденном состояниях. 48 Вот почему вес дважды возбужденных конфигураций обеспечивает естественную диагностику метода EOM–CCSD.Мы обнаружили, что их вес в волновой функции достаточно мал (р 11 % для всех рассмотренных состояний, чтобы обеспечить точную трактовку. Помимо количественной характеристики электронно-возбужденных состояний Al–C 2 H 4 , важная цель Настоящая работа состоит в качественном анализе природы возбужденных состояний по молекулярным орбиталям, участвующим в переходе, который обязательно включает в себя приписывание возбужденным состояниям валентности или ридберговского характера.Как и во многих радикалах, неспаренный электрон в комплексе Al–C 2 H 4 связан относительно слабо: т. е. наименьший вертикальный потенциал ионизации ͑IP ͒ β-связанного комплекса оценивается в 6,83 эВ.
47 Однако возбужденные состояния, являющиеся двухэлектронными промоушенами, гораздо менее точно обрабатываются методом EOM-CCSD из-за дисбаланса в обработке корреляции для двух электронов в основном и возбужденном состояниях. 48 Вот почему вес дважды возбужденных конфигураций обеспечивает естественную диагностику метода EOM–CCSD.Мы обнаружили, что их вес в волновой функции достаточно мал (р 11 % для всех рассмотренных состояний, чтобы обеспечить точную трактовку. Помимо количественной характеристики электронно-возбужденных состояний Al–C 2 H 4 , важная цель Настоящая работа состоит в качественном анализе природы возбужденных состояний по молекулярным орбиталям, участвующим в переходе, который обязательно включает в себя приписывание возбужденным состояниям валентности или ридберговского характера.Как и во многих радикалах, неспаренный электрон в комплексе Al–C 2 H 4 связан относительно слабо: т. е. наименьший вертикальный потенциал ионизации ͑IP ͒ β-связанного комплекса оценивается в 6,83 эВ. 49 Следовательно, эти виды имеют низменные ридберговские состояния. Действительно, в исследованном в данной работе диапазоне энергий ͑ 0–5,18 эВ ͒ обнаружено несколько состояний с ридберговским характером. Поскольку комплекс также имеет валентные состояния с низкой энергией, они могут сильно взаимодействовать с ридберговскими состояниями той же симметрии и кратности.На самом деле ридберговские состояния всегда имеют вклады валентных возбуждений и наоборот. Более того, ридберговский или валентный характер состояния может измениться при искажении геометрии основного состояния. 50,51 Подробное обсуждение критериев, используемых для отнесения возбужденных состояний к валентным, ридберговским или состояниям со смешанным ридберговско-валентным характером, представлено в Приложении. Молекулярные орбитали, участвующие в переходах из основного состояния в низколежащие возбужденные состояния валентного характера, показаны на рис.4. Низшее возбужденное состояние 1 2 A 1 ͑ структуры I-c на рис. 1 ͒ возникает в результате возбуждения  электрона с c на c-орбиталь ͑, которая однократно занята в основном состоянии ͒ .
49 Следовательно, эти виды имеют низменные ридберговские состояния. Действительно, в исследованном в данной работе диапазоне энергий ͑ 0–5,18 эВ ͒ обнаружено несколько состояний с ридберговским характером. Поскольку комплекс также имеет валентные состояния с низкой энергией, они могут сильно взаимодействовать с ридберговскими состояниями той же симметрии и кратности.На самом деле ридберговские состояния всегда имеют вклады валентных возбуждений и наоборот. Более того, ридберговский или валентный характер состояния может измениться при искажении геометрии основного состояния. 50,51 Подробное обсуждение критериев, используемых для отнесения возбужденных состояний к валентным, ридберговским или состояниям со смешанным ридберговско-валентным характером, представлено в Приложении. Молекулярные орбитали, участвующие в переходах из основного состояния в низколежащие возбужденные состояния валентного характера, показаны на рис.4. Низшее возбужденное состояние 1 2 A 1 ͑ структуры I-c на рис. 1 ͒ возникает в результате возбуждения  электрона с c на c-орбиталь ͑, которая однократно занята в основном состоянии ͒ . Учитывая природу этих орбиталей, т. е. вклад β-орбитали этилена в βc и β-орбитали этилена в βc, можно ожидать, что состояние 1 2 A 1 будет иметь связь CC, которая длиннее, чем в состоянии 1 2 A 1 . основное ( ̃ X 2 B 2 ) состояние. Следующим по энергии является состояние 1 2 B 1 ͑ структура I-b на рис. 1 ͒ , позиция 2.02 эВ, который возникает в результате продвижения неспаренного электрона с орбитали c на несвязывающую ͒ 3 p x орбиталь Al. Следовательно, можно ожидать, что это состояние будет слабосвязанным, что согласуется с его характеристикой Xie. Состояние 1 A 2 при 2,28 эВ и его дублетный аналог 1 2 A 2 при 3,79 эВ возникают в результате возбуждения электрона со связывающей орбитали комплекса, , до 3 p (Al). В конечном состоянии s на каждой орбитали с, с и 3рх находится по одному неспаренному электрону. Следовательно, ожидается, что два состояния будут связаны с еще более длинной связью CC, чем в основном состоянии.При возбуждении в состояние 2 2 B 2 преобладает валентный переход, а именно c → * c .
Учитывая природу этих орбиталей, т. е. вклад β-орбитали этилена в βc и β-орбитали этилена в βc, можно ожидать, что состояние 1 2 A 1 будет иметь связь CC, которая длиннее, чем в состоянии 1 2 A 1 . основное ( ̃ X 2 B 2 ) состояние. Следующим по энергии является состояние 1 2 B 1 ͑ структура I-b на рис. 1 ͒ , позиция 2.02 эВ, который возникает в результате продвижения неспаренного электрона с орбитали c на несвязывающую ͒ 3 p x орбиталь Al. Следовательно, можно ожидать, что это состояние будет слабосвязанным, что согласуется с его характеристикой Xie. Состояние 1 A 2 при 2,28 эВ и его дублетный аналог 1 2 A 2 при 3,79 эВ возникают в результате возбуждения электрона со связывающей орбитали комплекса, , до 3 p (Al). В конечном состоянии s на каждой орбитали с, с и 3рх находится по одному неспаренному электрону. Следовательно, ожидается, что два состояния будут связаны с еще более длинной связью CC, чем в основном состоянии.При возбуждении в состояние 2 2 B 2 преобладает валентный переход, а именно c → * c . Следовательно, это состояние все еще может быть связано ͑ из-за двойного заполнения связывающей орбитали ͒ , но связь слабее, чем в основном состоянии. Состояние 1 4 A 1 при 4,03 эВ возникает в результате возбуждения электрона с дважды занятой c-орбитали на разрыхляющую * c-орбиталь ͑ соответствующее дублетное состояние находится около 6,49 эВ ͒ . В рассматриваемом диапазоне энергий имеются два очень интенсивных перехода, которые можно использовать для экспериментального исследования комплекса Al–C 2 H 4 -связанного.Для состояния 2 2 B 2 при 3,50 эВ большую интенсивность перехода можно объяснить его связывающе-разрыхляющим ( c → * c ) характером, как показал Малликен. 52 В случае состояния 1 2 A 2 при 3,79 эВ ненулевое значение дипольного момента перехода обусловлено s-характером начальной орбитали ( c ). Однако объяснения большой интенсивности перехода найдено не было. В настоящей работе охарактеризовано основное состояние XB 2 и 11 низших вертикальных возбужденных состояний комплекса Al–C 2 H 4 -связанного комплекса на CCSD ͑ T ͒ /aug-cc-pVTZ и EOM-CCSD/6-311.
Следовательно, это состояние все еще может быть связано ͑ из-за двойного заполнения связывающей орбитали ͒ , но связь слабее, чем в основном состоянии. Состояние 1 4 A 1 при 4,03 эВ возникает в результате возбуждения электрона с дважды занятой c-орбитали на разрыхляющую * c-орбиталь ͑ соответствующее дублетное состояние находится около 6,49 эВ ͒ . В рассматриваемом диапазоне энергий имеются два очень интенсивных перехода, которые можно использовать для экспериментального исследования комплекса Al–C 2 H 4 -связанного.Для состояния 2 2 B 2 при 3,50 эВ большую интенсивность перехода можно объяснить его связывающе-разрыхляющим ( c → * c ) характером, как показал Малликен. 52 В случае состояния 1 2 A 2 при 3,79 эВ ненулевое значение дипольного момента перехода обусловлено s-характером начальной орбитали ( c ). Однако объяснения большой интенсивности перехода найдено не было. В настоящей работе охарактеризовано основное состояние XB 2 и 11 низших вертикальных возбужденных состояний комплекса Al–C 2 H 4 -связанного комплекса на CCSD ͑ T ͒ /aug-cc-pVTZ и EOM-CCSD/6-311. (2 ϩ ,2 ϩ )G(3 df ,3 pd ) уровней теории соответственно.Существенные изменения этиленового фрагмента при комплексообразовании (удлинение связи СС на 0,076 Å, обратный изгиб групп СН 2 на 17,6°) являются структурными признаками химического взаимодействия фрагментов Al и С 2 Н 4 в комплекс. Взаимодействие между двумя фрагментами включает две дательные связи: одна возникает в результате перекрывания однократно занятой орбитали Al p с орбиталью * этилена ( p → * с переносом заряда ͒ , другая — в результате перекрывания вакантного гибрида Al sp. с -орбиталью C 2 H 4 ( → sp перенос заряда ͒ .Общее взаимодействие Al–C 2 H 4 довольно слабое, так как межфрагментарная связь дестабилизирует этилен. Это согласуется с расчетным значением теплоты образования при 0 К (15,71 ккал моль Ϫ 1 ), которое характеризует связь в комплексе как промежуточную между ван-дер-ваальсовой и ковалентной. Среди 11 нижних вертикальных возбужденных состояний ͑ в диапазоне энергий 0–5,18 эВ обнаружены как валентные, так и ридберговские состояния.
(2 ϩ ,2 ϩ )G(3 df ,3 pd ) уровней теории соответственно.Существенные изменения этиленового фрагмента при комплексообразовании (удлинение связи СС на 0,076 Å, обратный изгиб групп СН 2 на 17,6°) являются структурными признаками химического взаимодействия фрагментов Al и С 2 Н 4 в комплекс. Взаимодействие между двумя фрагментами включает две дательные связи: одна возникает в результате перекрывания однократно занятой орбитали Al p с орбиталью * этилена ( p → * с переносом заряда ͒ , другая — в результате перекрывания вакантного гибрида Al sp. с -орбиталью C 2 H 4 ( → sp перенос заряда ͒ .Общее взаимодействие Al–C 2 H 4 довольно слабое, так как межфрагментарная связь дестабилизирует этилен. Это согласуется с расчетным значением теплоты образования при 0 К (15,71 ккал моль Ϫ 1 ), которое характеризует связь в комплексе как промежуточную между ван-дер-ваальсовой и ковалентной. Среди 11 нижних вертикальных возбужденных состояний ͑ в диапазоне энергий 0–5,18 эВ обнаружены как валентные, так и ридберговские состояния. Делокализованный характер валентных состояний согласуется с химическим (слабым ковалентным) взаимодействием между фрагментами в комплексе.Учитывая их большую интенсивность, два перехода при 3,50 и 3,79 эВ можно использовать для экспериментального исследования образования комплекса Al-C 2 H 4 . Поддержка со стороны Национального научного фонда CAREER Award ͑ Грант № CHE-0094116 ͒, Программы премирования новых преподавателей Камиллы и Генри Дрейфус, исследовательского фонда WISE Research Fund ͑ USC ͒ и спонсоров Фонда нефтяных исследований, находящегося в ведении Американского химического общества ͒ Грант PRF-AC ͒ выражает благодарность. Мы благодарим профессора Андрея Вилесова за стимулирующие обсуждения и Михаила Слипченко за предварительные расчеты и внимательное прочтение рукописи.Чтобы охарактеризовать возбужденные состояния как имеющие валентный или ридберговский характер, были рассчитаны вертикальные энергии возбуждения и вторые моменты распределения заряда в нескольких базисных наборах.
Делокализованный характер валентных состояний согласуется с химическим (слабым ковалентным) взаимодействием между фрагментами в комплексе.Учитывая их большую интенсивность, два перехода при 3,50 и 3,79 эВ можно использовать для экспериментального исследования образования комплекса Al-C 2 H 4 . Поддержка со стороны Национального научного фонда CAREER Award ͑ Грант № CHE-0094116 ͒, Программы премирования новых преподавателей Камиллы и Генри Дрейфус, исследовательского фонда WISE Research Fund ͑ USC ͒ и спонсоров Фонда нефтяных исследований, находящегося в ведении Американского химического общества ͒ Грант PRF-AC ͒ выражает благодарность. Мы благодарим профессора Андрея Вилесова за стимулирующие обсуждения и Михаила Слипченко за предварительные расчеты и внимательное прочтение рукописи.Чтобы охарактеризовать возбужденные состояния как имеющие валентный или ридберговский характер, были рассчитаны вертикальные энергии возбуждения и вторые моменты распределения заряда в нескольких базисных наборах. Зависимость энергий возбуждения и сферически средних вторых моментов распределения заряда ( 3 1 ͗ R 2 ͘ значений ͒ от базиса показана на рис. 5. При расширении базиса добавлением диффузных функций энергия возбуждения равна ожидается уменьшение, а эффективный размер электронного распределения ( 3 1 ͗ R 2 ͘ ) — существенное увеличение для ридберговских состояний.Для валентных состояний оба параметра практически не изменяются. По этим критериям состояния 1 2 B 1 , 1 2 A 1 , 1 4 A 2 и 1 2 A являются валентными состояниями, а состояния 2 2 A , 2 2 B и 3 B 2 имеют ридберговский характер. Состояние 2 B 2 имеет смешанный ридберговско-валентный характер. 3 2 …
Зависимость энергий возбуждения и сферически средних вторых моментов распределения заряда ( 3 1 ͗ R 2 ͘ значений ͒ от базиса показана на рис. 5. При расширении базиса добавлением диффузных функций энергия возбуждения равна ожидается уменьшение, а эффективный размер электронного распределения ( 3 1 ͗ R 2 ͘ ) — существенное увеличение для ридберговских состояний.Для валентных состояний оба параметра практически не изменяются. По этим критериям состояния 1 2 B 1 , 1 2 A 1 , 1 4 A 2 и 1 2 A являются валентными состояниями, а состояния 2 2 A , 2 2 B и 3 B 2 имеют ридберговский характер. Состояние 2 B 2 имеет смешанный ридберговско-валентный характер. 3 2 …
Почему валентность алюминия равна 3? – Easyrwithpractice.com
Почему валентность алюминия равна 3?
Атомный номер алюминия 13, поэтому его электронная конфигурация 2, 8, 3.Поскольку в его валентной оболочке 3 электрона, он потеряет 3 электрона, чтобы завершить свой октет, поэтому его валентность равна +3.
Какова степень окисления алюминия?
+3
Почему алюминий имеет степень окисления +3?
Поскольку атомный номер алюминия равен 13 (13 электронов = 13 протонов), он может потерять три валентных электрона, чтобы удовлетворить правилу октетов. Потеряв три электрона, он имеет 13 протонов и 10 электронов. Из-за избытка трех протонов его кажущийся заряд или степень окисления становится +3 как Al+3..
Почему алюминий чаще всего имеет степень окисления 3?
Алюминий чаще всего имеет степень окисления +3, потому что он имеет три валентных электрона, которые относительно легко удаляются. Чтобы получить полный октет, он должен либо потерять три электрона, либо приобрести пять.
Какова степень окисления алюминия в alcl3?
Следовательно, степени окисления +3 и -1. Поскольку его нет в вариантах, мы можем рассмотреть вариант D как ответ, предполагая, что…. 3 электрона теряются атомом Al и 3 электрона принимаются атомами Cl.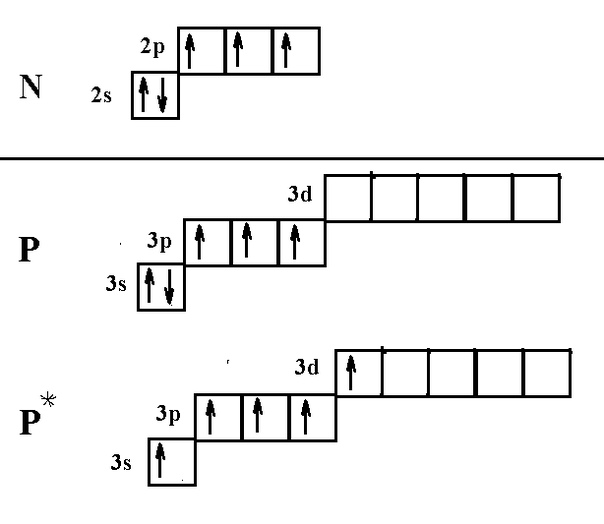 Таким образом, вариант D +3, -3 является нашим ответом.
Таким образом, вариант D +3, -3 является нашим ответом.
Какова степень окисления Cl в alcl4?
Следовательно, степень окисления Cl в этом ионе равна +5.
Какова степень окисления серы?
-2
Каковы три наиболее распространенных степени окисления серы?
Наиболее примечательно, однако, что сера образует ковалентные связи с атомами-партнерами в степенях окисления -2, +2, +4 и +6.
Почему сера имеет степень окисления 6?
Таким образом, есть в основном две причины для +6: из-за 6 валентных электронов и из-за высоких возбужденных состояний.Отдельный атом серы с равным количеством протонов и электронов имеет электронную конфигурацию 3s2, 3p4.
Какая степень окисления S в h3so4?
+6
Какова степень окисления S в HSO?
+4
Какова степень окисления серы в пероксимоносерной кислоте?
Оксокислота серы
| Кислота | Формула | Формальная степень окисления |
|---|---|---|
| Пероксимоносерная кислота | h3SO5 | +6 |
| Пероксидисерная кислота | h3S2O8 | +6 |
| Дитионовая кислота | h3S2O6 | +5 |
| Тиосерная кислота | h3S2O3 | 0 (для конечной серы), +4 (для центрального атома) |
Что такое олеум Какова степень окисления серы в нем?
Какова степень окисления серы в Hypo?
Следовательно, степень окисления атомов серы в Na2S2O3 равна −2 и +6…. Спасибо.
Спасибо.
| Связанные вопросы и ответы | |
|---|---|
| Метамерная сегментация является характеристикой | Смог является комбинацией |
Какая степень окисления у KMnO4?
+7
Какова степень окисления Cl в каждом ионе?
-1
Какова степень окисления Cl в ClO4 -?
Степень окисления кислорода равна -2 в ионе ClO4-, а хлора +7.
Сокращается ли ClO до CL?
Cl в ClO- восстанавливается. Напишите два отдельных уравнения, одно из которых использует только вещества, участвующие в восстановлении, а другое — только вещества, участвующие в окислении. (Когда они уравновешены, они называются уравнениями полуреакции.) Сбалансируйте каждый вид атомов, кроме H и O, с помощью коэффициентов.
Какова степень окисления Cl в тесте ClO?
Однако в ионе ClO-1 атом Cl имеет степень окисления +1 (а O имеет степень окисления -2).
Какова степень окисления CL в Cacl₂?
Какова степень окисления O в o₂?
0
Какова степень окисления Na в Na+?
+1
Сколько валентных электронов содержится в атоме алюминия?
Сколько валентных электронов у атома азота?
Химия
Азот имеет 5 валентных электронов в атоме. Если вы хотите получить подтверждение, пожалуйста, посетите следующий…
Если вы хотите получить подтверждение, пожалуйста, посетите следующий…
Сколько электронов в первой оболочке атома?
Физика
Два электрона находятся на первом энергетическом уровне или оболочке, а остальные пять — на втором…
Сколько валентных электронов во фторе?
Химия
Фтор — это химический элемент, который является наиболее химически активным и электроотрицательным элементом из всех….
Сколько валентных (внешней оболочки) электронов в атоме? Например, литий, бериллий и железо?
Химия
Худсоа9184, Вы видимо не умеете читать свою Периодическую таблицу элементов….
Сколько валентных электронов в железе?
Наука
Железо является химическим элементом и имеет атомный номер 26.Электронная конфигурация атома железа включает: 1s22s22p63s23p63d64s2In…
Сколько валентных электронов в неоне?
Химия
Неон — благородный газ. Он инертен. Это означает, что в нормальных условиях он не будет реагировать ни на…
Он инертен. Это означает, что в нормальных условиях он не будет реагировать ни на…
Сколько валентных электронов передается от атома кальция к йоду при образовании соединения йодида кальция?
Химия
Кальций — это щелочной металл, его символ Ca.Йод — это галоген, его символ I. Существует…
Электронная конфигурация атома кислорода 1s22s22p4. Сколько валентных электронов у атома кислорода?
Химия
Валентные электроны — это те, которые находятся на самом высоком основном энергетическом уровне. Это 2-й директор…
Сколько электронов должен получить атом серы, чтобы достичь октета в своей валентной оболочке?
Химия
Сера имеет 6 валентных электронов, поэтому ей нужно еще 2 для октета, и тогда она будет иметь отрицательный заряд…
Атом в основном состоянии имеет семь валентных электронов. Этот атом может быть атомом какого элемента?
Химия
Этот атом может быть атомом элемента хлора.


 1)#
1)#
 ) →
) →