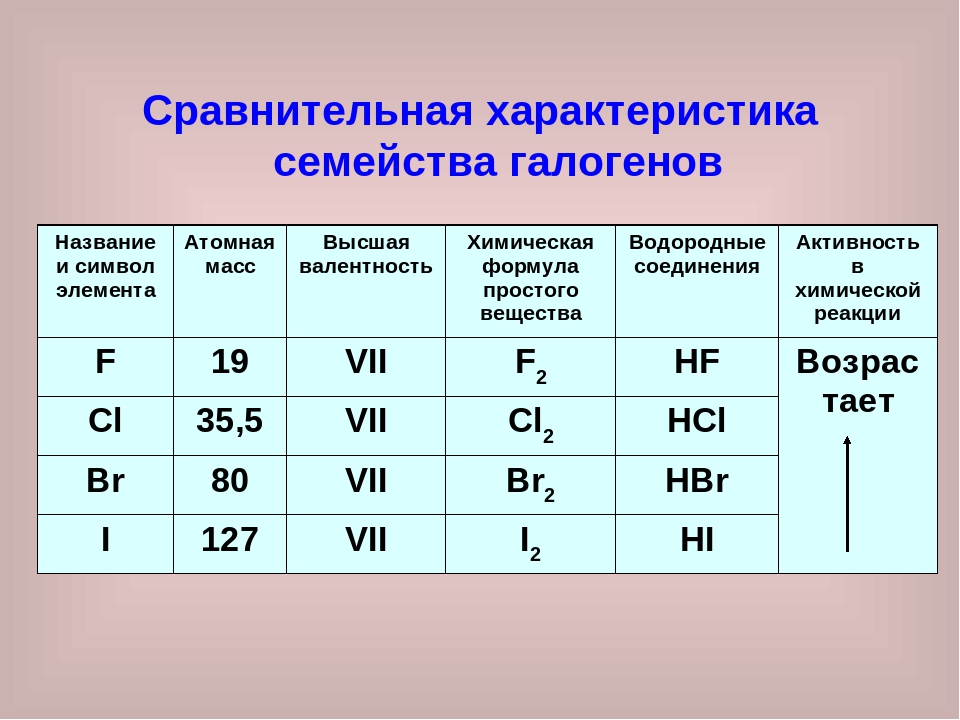
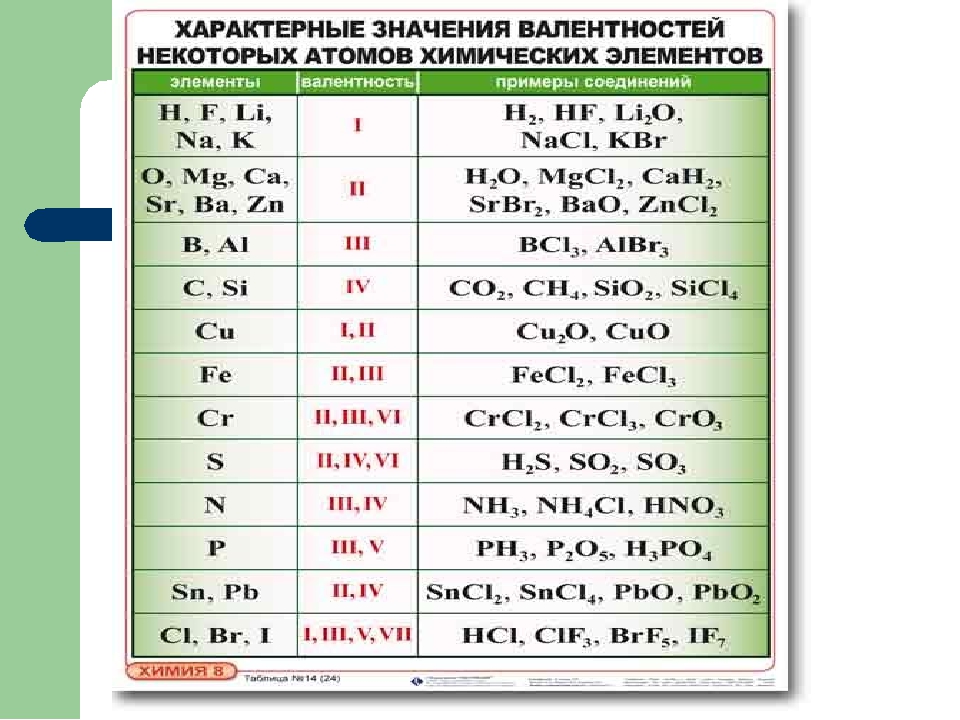
Периодическая система химических элементов
Дидактический материал
Тренировочные тесты ЕГЭ по химии
Закономерности изменения свойств химических элементов и их соединений по периодам и группам. Общая характеристика металлов IA-IIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов: меди, цинка, хрома, железа — по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Общая характеристика неметаллов VIA-VIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1. В ряду Na —>Mg —>Al —>Si
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
2. У элементов подгруппы углерода с увеличением атомного номера уменьшается
У элементов подгруппы углерода с увеличением атомного номера уменьшается
1) атомный радиус
2) заряд ядра атома
3) число валентных электронов в атомах
4) электроотрицательность
3. В ряду элементов азот — кислород — фтор возрастает
1) валентность по водороду
2) число энергетических уровней
3) число внешних электронов
4) число неспаренных электронов
4. В ряду химических элементов бор — углерод — азот возрастает
1) способность атома отдавать электроны
2) высшая степень окисления
3) низшая степень окисления
4) радиус атома
5. Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
1) углерод 2) германий 3) алюминий 4) бор
6. С ростом заряда ядра атомов кислотные свойства оксидов в ряду
N2O5 —> P2O5 —> As2O5 —> Sb2O5
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
7. В порядке возрастания неметаллических свойств элементы расположены в ряду:
В порядке возрастания неметаллических свойств элементы расположены в ряду:
1) O,N,C,B
2) Cl,S,P,Si
3) C,Si,Ge,Sn
4) B,C,O,F
8. В порядке усиления металлических свойств элементы расположены в ряду:
1) А1,Са,К 2) Ca.Ga.Fe 3) K,Al,Mg 4) Li,Be,Mg
9. В каком ряду элементы расположены в порядке возрастания их атомного радиуса?
1) Si,P, S.C1
2) O,S,Se,Te
3) At,I,Br,Cl
4) Mg,Al,Si, P
10. Какой элемент образует газообразное водородное соединен соответствующее общей формуле RH
1) бор 2) калий 3) сера 4) хром
11. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
12. В какой группе периодической системы находится элемент Э, входящий в состав кислоты НЭО4?
В какой группе периодической системы находится элемент Э, входящий в состав кислоты НЭО4?
1) IV 2) V 3) VI 4) VII
13. В ряду оксидов SiO2 — Р2О5 — SO2 — Cl2O7 кислотные свойства
1) возрастают
2) убывают
3) не изменяются
4) сначала уменьшаются, потом увеличиваются
14. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
1) Mg, Ca, Ва
2) Na, Mg, A1
3) K,Ca,Fe
4) Sc, Ca, Mg
15. По периоду слева направо уменьшается(-ются)
1) атомный радиус элементов
2) число валентных электронов в атомах
3) электроотрицательность элементов
4) кислотные свойства гидроксидов
16. В порядке увеличения электроотрицательности химические элементы расположены в раду:
1) С, N, О 2) Si.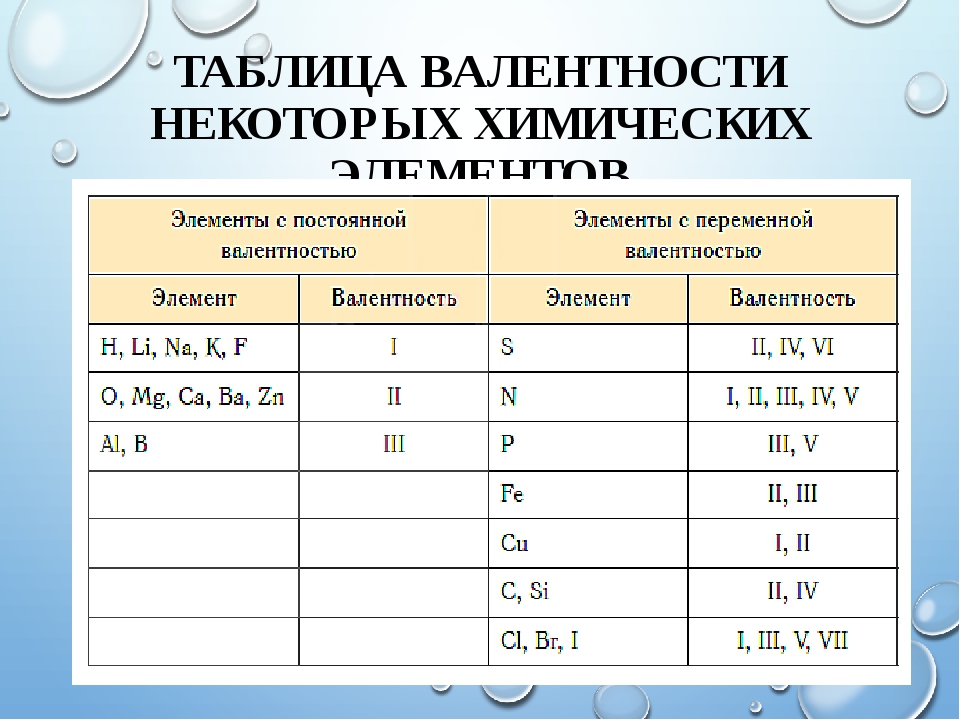 Al.Mg 3) Mg,Ca, Ва 4) Р, S, Si
Al.Mg 3) Mg,Ca, Ва 4) Р, S, Si
17. Химический элемент расположен в IV периоде, IA группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2,8,8,2
2) 2, 8, 18, 1
3) 2, 8, 8, 1
4) 2,8, 18,2
18. Электроотрицательность химических элементов с возрастанием заряда ядра атома
1) увеличивается и в периодах, и в группах
2) уменьшается и в периодах, и в группах
3) увеличивается в периодах, а в группах уменьшается
4) уменьшается в периодах, а в группах увеличивается
19. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1) Rb,K,Na,Li
2) Na,Mg,Al, S
3) F, Cl, Br, I
4) C,N, О, F
20. Среди элементов третьего периода наименьший атомный радиус имеет
1) натрий
2) алюминий
3) фосфор
4) сера
21. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
22. По периоду слева направо уменьшается
1) число валентных электронов в атомах
2) атомный радиус элементов
3) электроотрицательность элементов
4) кислотность гидроксидов элементов
23. Наиболее сильное основание образует
1) цезий 2) натрий 3} литий 4) цинк
24. Оксид с наиболее выраженными кислотными свойствами образует
1) кремний 2) фосфор 3) сера 4) хлор
25. Наиболее сильное основание образует
1) магний 2) стронций 3) барий 4) кадмий
26.
1) Sn 2) А1 3) С 4) S
27. Кислотный характер наиболее выражен у высшего оксида, образованного
1) бериллием 2) бором 3) фосфором 4) кремнием
28. Сила бескислородных кислот неметаллов VIIА группы соответственно возрастанию заряда ядра атомов элементов
1) | увеличивается |
2) | уменьшается |
3) | не изменяется |
4) | изменяется периодически
|
29. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
1) | хлор |
2) | германий |
3) | мышьяк |
4) | селен |
30. Кислотные свойства оксидов в ряду SiO2 —> P2O5 —>SО3
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
31. Газообразные водородные соединения состава ЭН3 образуют
1) Be, Ca, Sr 2) P, As, Sb 3) Ga, Al, B 4) Te, S, Sc
32. В ряду элементов
В ряду элементов
Cl ® S ® P ® Si
1) уменьшается число электронных слоев в атомах
2) увеличивается число внешних электронов в а томах
3) возрастают радиусы атомов
4) усиливаются неметаллические свойства
33. Неметаллические свойства наиболее выражены у
1) серы 2) кислорода 3) кремния 4) фосфора
34. Наибольший радиус имеет атом
1) олова 2} кремния 3) свинца 4) углерода
35. В ряду химических элементов
Li —>Be —> B —> C
1) увеличивается число валентных электронов в атомах
2) уменьшается число электронных слоев а атомах
3) уменьшается число протонов в ядрах атомов
4) увеличиваются радиусы атомов
36.Наибольший радиус имеет атом
1) брома 2) мышьяка 3) бария 4) олова
37. Электронную конфигурацию 1s22s22р63.s2Зр63d1 имеет ион
Электронную конфигурацию 1s22s22р63.s2Зр63d1 имеет ион
1) Са2+ 2) А13+ 3) K+ 4) Sc2+
38. Какую электронную конфигурацию имеет атом наиболее активного металла?
1) | 1s22s22p1 |
2) | 1s22s22p63s1 |
3) | 1s22s2 |
4) | 1s22s22p63s23p1 |
39. В порядке увеличения восстановительной способности металлы расположены в ряду:
В порядке увеличения восстановительной способности металлы расположены в ряду:
1) K,Al,Cr,Sn
2) Sn,Cr,Al,Zn
3) Sn,Ca,Al,K
4) Au,Al,Ca,Li
40. В ряду элементов: натрий —>магний —>алюминий
возрастает их
1) атомный радиус
2) восстановительная способность
3) химическая активность
4) электроотрицательность
41. У магния металлические свойства выражены
1) слабее, чем у бериллия
2) сильнее, чем у алюминия
3) сильнее, чем у кальция
4) сильнее, чем у натрия
42. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
1) Al,Zn,Fe
2) Al,Na,K
3) Fе,Zn,Mg
4) Fe,Zn,Al
43. Наибольший радиус имеет атом
1) лития 2) натрия 3) кальция 4) калия
44. У элементов II А группы сверху вниз
1) уменьшаются радиусы атомов,
2) увеличивается число валентных электронов в атоме
3) увеличиваются радиусы атомов
4) уменьшается число валентных электронов в атоме
45. Сила оснований возрастает в ряду:
Сила оснований возрастает в ряду:
1) Ве(ОН)2, Mg(OH)2, Ca(OH)2
2) Ва(ОН)2, Са(ОН)2, Ве(ОН)2
3) Са(ОН)2, Mg(OH)2, Ве(ОН)2
4) Sr(OH)2, Ca(OH)2, Mg(OH)2
46. У элементов I А группы сверху вниз
1) усиливаются окислительные свойства
2) ослабевают восстановительные свойства
3) увеличиваются радиусы атомов
4) уменьшаются радиусы атомов
47. Валентные электроны наиболее легко отдают атомы
1) алюминия 2) натрия 3) бериллия 4) магния
48. Восстановительные свойства наиболее выражены у
1) алюминия 2) магния 3) натрия 4) калия
49. Основные свойства веществ ослабевают в ряду:
1) NaОН —> КОН —>RbOH
2) А1(ОН)3 —>Mg(OH)2 —> NaOH
3) Са(ОН)2 —> Mg(OH)2 —>Be(OH)2
4) В(ОН)3 —>Ве(ОН)2 —> LiOH
50. Верны ли следующие суждения?
Верны ли следующие суждения?
А. И хром, и железо образуют устойчивые оксиды в степени окисления +3.
Б. Оксид хрома (III) является амфотерным.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
51. Верны ли следующие суждения?
А. Только s-элементы содержит IA группа.
Б. Все элементы IA группы взаимодействуют с водой при комнатной температуре.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
52. Оксид хрома (VI) является
1) основным
2) кислотным
3) амфотерным
4) несолеобразующим
53. Только основные свойства проявляет
1) Сr2O3 2) Сr(ОН)2 3) СrO3 4) Сr(ОН)3
54. Сильные окислительные свойства характерны для
1) оксида меди (I)
2) оксида железа (II)
3) оксида хрома (III)
4) оксида хрома (VI)
55. Верны ли следующие суждения об оксидах железа?
Верны ли следующие суждения об оксидах железа?
А. Степень окисления железа в высшем оксиде равна + 3.
Б. Высший оксид железа относится к основным оксидам.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
56. В ряду оксидов
CrO — Сr2О3 — СrОз
происходит
1) уменьшение степени окисления хрома
2) усиление восстановительных свойств
3) увеличение массовой доли хрома
4) усиление кислотных свойств
57. Оцените справедливость суждений о металлах:
А. Чем сильнее атом удерживает валентные электроны, тем ярче
выражены металлические свойства элемента.
Б. Чем сильнее выражены металлические свойства элемента, тем
более основный характер имеет его гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
58. Оцените справедливость суждений о металлах:
Оцените справедливость суждений о металлах:
А. Для атомов металлов характерно малое число валентных
электронов и слабое их притяжение к ядру.
Б. Чем выше степень окисления металла в его гидроксиде, тем
более основными свойствами обладает гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
59. Оцените справедливость суждений о металлах:
А. Атомы металла могут образовывать только ионные связи.
Б. Оксиды и гидроксиды металлов всегда имеют основный
характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
60. Верны ли следующие суждения о неметаллах?
А. В периодической системе химических элементов Д.И. Менделеева все неметаллы располагаются в главных подгруппах.
Б. Все неметаллы являются р-элементами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
61. У атомов химических элементов, расположенных в ряду: P-S-C1, увеличивается
1) радиус
2) окислительная способность
3) восстановительная способность
4) число неспаренных электронов
62. Соединения состава NaHЭO3 и NaHЭO4 может образовать
1) углерод 2) сера 3) хлор 4) фосфор
63. Наиболее сильными кислотными свойствами обладает
1) НС1О4 2) H2SO3 3) Н3РО4 4) H2SiО3
64 Соединения состава КЭО2 и КЭО3 образует элемент
1) азот 2) фосфор 3) сера 4) марганец
65. Способность атомов химических элементов принимать электроны усиливается в ряду:
1)F —>O —>N
2) N —>F —>О
3) N —>O —>F
4) O —>N —>F
66. Степени окисления хлора, брома и йода в высших оксидах и водородных соединениях соответственно равны:
Степени окисления хлора, брома и йода в высших оксидах и водородных соединениях соответственно равны:
1)+1и-1 2)+7и-1 3)+7и-7 4)+5и-1
67. Сера проявляет как окислительные, так и восстановительные свойства при взаимодействии с
1) водородом и железом
2) углеродом и цинком
3) хлором и фтором
4) натрием и кислородом
68. В ряду: Si —>Р —> S —> С1
электроотрицательность элементов
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала уменьшается, потом увеличивается
69. В ряду элементов мышьяк —>селен —> бром возрастает
1) атомный радиус
2) число неспаренных электронов в атоме
3) число электронных слоев в атоме
4) электроотрицательность
70. Водородное соединение состава Н2Э2 образует
1) углерод
2) кремний
3) бор
4) азот
71. Высшему гидроксиду элемента VIIA группы соответствует формула
Высшему гидроксиду элемента VIIA группы соответствует формула
1) Н2ЭО3 2) Н2ЭО4 3) НЭО3 4) НЭО4
72. Фосфор проявляет окислительные свойства при реакции с
1) кальцием 2) серой 3) хлором 4) кислородом
73. При взаимодействии высшего оксида хлора с водой образуется кислота
1) НС1O 2) НС1O2 3) НСlO3 4) HClO4
74. Характерными степенями окисления хлора в его соединениях являются:
1) -1, +1, +3, +5, +7
2) — 2, +4, +6, +8
3) -3, +3, +5
4) -1, +2, +5
75. Кислотные свойства наиболее выражены у высшего гидроксида
1) азота
2) фосфора
3) мышьяка
4) сурьмы
76. Только восстановительные свойства азот проявляет в соединении
Только восстановительные свойства азот проявляет в соединении
1) N2
2) NНз
3) NО2
4) НNОз
77. Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22p6 3s2 Зр1 ?
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Б. Степень окисления этого элемента в высшем гидроксиде равна (+ 4).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
78. Верны ли следующие суждения о соединениях натрия и бериллия?
А. Оксид натрия проявляет основные свойства
Б. Гидроксид бериллия проявляет амфотерные свойства
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответы 1-4, 2-4, 3-3, 4-2, 5-1, 6-1, 7-4, 8-1, 9-2, 10-3, 11-2, 12-4, 13-1, 14-1, 15-1, 16-1, 17-3, 18-3, 19-3, 20-4, 21-2, 22-2, 23-1, 24-4, 25-3, 26-4, 27-3, 28-1, 29-2, 30-2, 31-2, 32-3, 33-2, 34-3, 35-1, 36-3, 37-4, 38-2, 39-4, 40-4, 41-2, 42-1, 43-4, 44-3, 45-1, 46-3, 47-2, 48-4, 49-3, 50-3, 51-1, 52-2, 53-2, 54-4, 55-1, 56-4, 57-2, 58-1, 59-4, 60-1, 61-2, 62-2, 63-1,64-1, 65-3, 66-2, 67-4, 68-1, 69-4, 70-1, 71-4, 72-1, 73-4, 74-1, 74-3, 76-2, 77-4, 78-3
1. В ряду химических элементов О → S → Sе: 1) уменьшается радиус атомов 2) уменьшается электроотрицательность 3) усиливаются неметаллические свойства 4) увеличиваются заряды ядер атомов 5) уменьшается число заполненных электронных слоев в атомах
2. В ряду химических элементов Na → Al → P происходит увеличение (усиление): 1) числа нейронов в ядрах атомов 2) восстановительных свойств 3) степени окисления в высших оксидах 4) радиуса атома 5) металлических свойств
3. В ряду химических элементов Cl → Si → Al: 1) уменьшаются заряды ядер атомов 2) возрастают кислотные свойства летучих водородных соединений 3) высшая степень окисления уменьшается 4) уменьшается радиус атомов 5) усиливаются металлические свойства
4. 1) уменьшается валентность в высших оксидах 2) возрастают радиусы атомов хим. элементов 3) усиливаются неметаллические свойства 4) увеличивается электроотрицательность 5) увеличивается число электронных слоев в атомах
5. 5.В ряду химических элементов Si → Р → S: 1) уменьшается число протонов в ядре 2) уменьшается электроотрицательность 3) увеличивается радиус атомов 4) увеличивается число электронов во внешнем электронном слое 5) усиливаются неметаллические свойства
6. 6.В ряду химических элементов Ве → Мg → Са: 1) уменьшается радиус атомов 2) возрастает способность атомов отдавать электроны 3) увеличиваются заряды ядер атомов 4) уменьшается относительная атомная масса 5) увеличивается степень окисления в высших гидроксидах
7. 1) уменьшается электроотрицательность 2) уменьшаются радиусы атомов 3) ослабевают неметаллические свойства 4) увеличивается валентность в высших оксидах 5) уменьшается число заполненных электронных слоев в атомах
8. 8.В порядке ослабевания металлических свойств расположены элементы в рядах: 1) 1, Be → Mg → Ca 4, B → Be → Li 2) 2, Na → Mg → Al 5, Mg → Ca → Sr 3) 3, Rb → K → Na
9. Способность отдавать электроны возрастает у элементов следующих рядов: 1) Na → Al → P 2) Sr → Ca → Mg 3) C → N → O 4) Si → Al → Mg 5) B → Be → Li
10. В ряду химических элементов Al → Mg →Na: 1) усиливается электроотрицательность 2) усиливаются металлические свойства 3) усиливается основный характер их высших оксидов 4) уменьшается радиус атомов 5) усиливается кислотный характер их высших оксидов
| 11. 1) увеличивается число протонов в ядре 2) увеличивается электроотрицательность 3) уменьшается радиус атомов 4) уменьшается число электронов во внешнем электронном слое 5) ослабевают неметаллические свойства
12. В порядке уменьшения числа электронов во внешнем слое расположены элементы следующих рядов: 1) N → O → F 2) С → Si → Ge 3) P → Si → Al 4) C → N → O 5) Br → Se → As
13. В ряду химических элементов Si → Ge → Sn: 1) увеличивается радиус атома 2) ослабевают металлические свойства соответствующих им простых веществ 3) ослабевает основный характер их высших оксидов 4) возрастает значение валентности в их высших оксидах 5) увеличивается число электронных слоёв в их атомах
14. В ряду химических элементов Cl → S → P → Si: 1) увеличиваются неметаллические свойства 2) уменьшается радиус атома 3) увеличивается число электронов во внешнем электронном слое 4) уменьшается низшая степень окисления 5) ослабевают неметаллические свойства
15. 1) уменьшается электроотрицательность 2) увеличиваются заряды ядер атомов 3) ослабевают неметаллические свойства 4) уменьшаются радиусы атомов 5) увеличивается число заполненных электронных слоев атомов
16. В ряду химических элементов Cl → P → Si: 1) уменьшаются заряды ядер атомов 2) уменьшается число электронных слоев 3) увеличивается атомный радиус 4) уменьшается низшая степень окисления 5) усиливаются неметаллические свойства
17. В ряду химических элементов I → Вr → Сl: 1) увеличивается степень окисления в высших оксидах 2) уменьшается число валентных электронов в атомах 3) увеличиваются заряды ядер атомов 4) усиливаются неметаллические свойства 5) уменьшается радиус атомов
18. 1) увеличивается число электронных слоев в атомах 2) уменьшаются заряды ядер атомов 3) усиливаются неметаллические свойства 4) уменьшается радиус атомов 5) уменьшается число электронов во внешнем электронном слое
19. В ряду химических элементов Аl → Р → Сl: 1) увеличивается электроотрицательность 2) уменьшаются заряды ядер атомов 3) возрастают металлические свойства 4) уменьшаются радиусы атомов 5) уменьшается число электронов во внешнем электронном слое
20. В ряду химических элементов Li → Ве → В: 1) увеличивается электроотрицательность 2) уменьшаются металлические свойства 3) уменьшаются заряды ядер атомов 4) уменьшается число электронов во внешнем электронном слое 5) увеличивается число заполненных электронных слоев
|
Химия 8 класс, муниципальный этап (2 этап), г.
 Москва, 2017-2018 учебный год
Москва, 2017-2018 учебный годЗадания, ответы, критерии оценивания
Общие указания: если в задаче требуются расчёты, они обязательно должныбыть приведены в решении. Ответ, приведённый без расчётов или иногообоснования, не засчитывается.
Решения и система оценивания. В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не учитывается.
Содержание
- Задание 1. «Хорошо растворимый газ»
- Задание 2. «Неполные уравнения»
- Задание 3. «Горение во фторе»
- Задание 4. «Хлористый этил»
- Задание 5. «Гидразин – формулы и свойства»
- Задание 6. «Простой эксперимент»
Задание 1. «Хорошо растворимый газ»
Содержание ↑
В воде растворили неизвестный газ и получили раствор с массовой долей вещества 40 %. В этом растворе на две молекулы газа приходится 5 молекул воды. Установите относительную молекулярную массу газа и определите его формулу, если известно, что он состоит из атомов водорода, кислорода и ещё одного элемента.
Установите относительную молекулярную массу газа и определите его формулу, если известно, что он состоит из атомов водорода, кислорода и ещё одного элемента.
Решение
Обозначим молекулярную массу газа Mr и составим пропорцию:
5 молекул H2O – 90 а. е. м – 60 %
2 молекулы газа – 2Mr а. е. м. – 40 %.
Mr = 40⋅90 / (2⋅60) = 30.
В состав молекулы газа входит не более одного атома кислорода (16 а. е. м.), тогда на водород и другой элемент приходится 14 а. е. м., это может быть только CH2.
Формула газа – CH2O.
Критерии оценивания
- Молекулярная масса газа – 6 баллов.
- Молекулярная формула – 4 балла.
Засчитывать только те ответы, в которых приведены расчеты молекулярноймассы газа.
За ответ, в котором написана только формула CH2O и не приведены расчеты, ставить 0 (ноль).
Итого 10 баллов.
Задание 2. «Неполные уравнения»
Содержание ↑
Восстановите пропуски в уравнениях реакций, не изменяя коэффициентов:
а) SiH4 + 2… = SiO2 + 2H2O
б) 4H2O2 + … = PbSO4 + 4H2O
в) 2Pb3O4 = 6PbO + …
г) P4 + 10… = 4PCl5
д) Ca(HCO3)2 = CaCO3 + CO2 + …
Решение
а) SiH4 + 2O2 = SiO2 + 2H2O
б) 4H2O2 + PbS = PbSO4 + 4H2O
в) 2Pb3O4 = 6PbO + O2
г) P4 + 10Cl2 = 4PCl5
д) Ca(HCO3)2 = CaCO3 + CO2 + H2O
Критерии оценивания
Каждое уравнение – по 2 балла.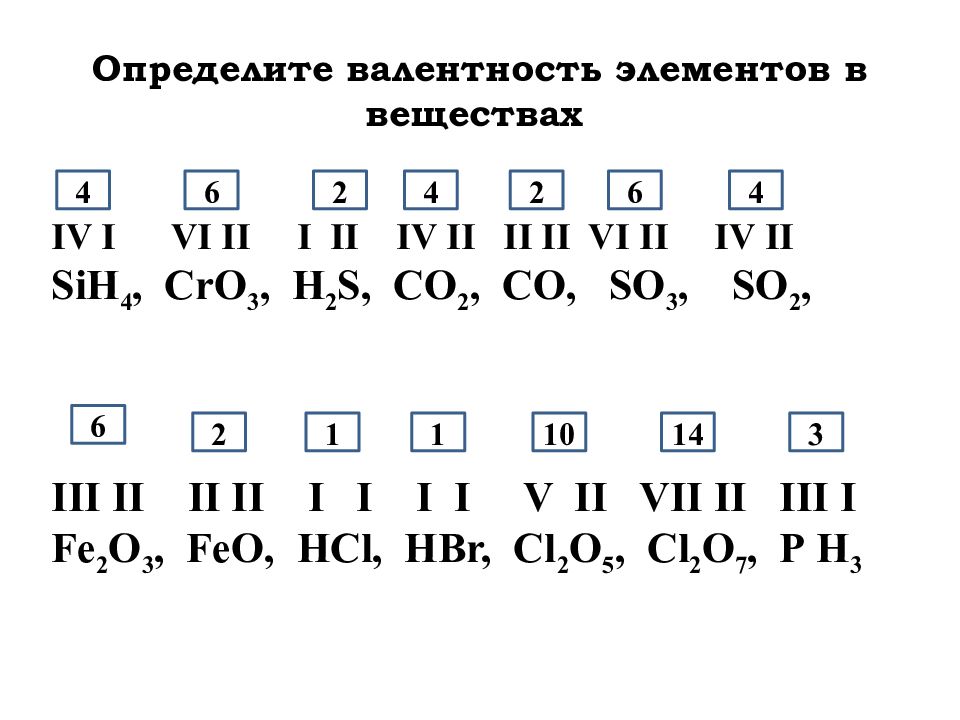
Итого 10 баллов.
Задание 3. «Горение во фторе»
Содержание ↑
Одно из самых активных химических веществ – газообразный фтор, F2. В нём горит даже вода, а многие другие простые и сложные вещества сгорают уже при комнатной температуре. При этом в большинстве реакций продуктами являются только фториды – соединения, в которых фтор имеет валентность I,а остальные элементы проявляют типичные для них валентности. Составьте уравнения сгорания во фторе следующих веществ:
- а) водорода,
- б) углерода,
- в) воды,
- г) метана CH4,
- д) аммиака NH3.
Решение
а) H2 + F2 = 2HF
б) C + 2F2 = CF4
в) H2O + 2F2 = 2HF + OF2
г) CH4 + 4F2 = CF4 + 4HF
д) NH3 + 3F2 = NF3 + 3HF
Критерии оценивания
Каждое уравнение – по 2 балла (1 балл, если правильные продукты, но не уравнено).
Итого 10 баллов.
Задание 4. «Хлористый этил»
Содержание ↑
В состав некоторых органических веществ, помимо углерода, входят хлор иводород.
- Изобразите структурную формулу вещества состава С2H5Cl (хлористый этил), зная, что углерод имеет валентность IV, а водород и хлор – валентность I.Обозначьте связи между атомами черточками.
- Хлористый этил горит красивым жёлтым пламенем. Запишите уравнение реакции горения, если известно, что при этом образуются углекислый газ, вода и хлороводород.
- Изобразите структурные формулы всех продуктов реакции горения.
Решение
1.
2. C2H5Cl + 3O2 = 2CO2 + HCl + 2H2O
3.
Критерии оценивания
- За правильную формулу – 3 балла.
- За уравнение реакции – 4 балла.

- По 1 баллу за каждую структурную формулу, всего – 3 балла.
Итого 10 баллов.
Задание 5. «Гидразин – формулы и свойства»
Содержание ↑
Сложное вещество гидразин, в молекуле которого на один атом азота приходится два атома водорода, представляет собой горючую жидкость,неограниченно смешивающуюся с водой.
- Составьте молекулярную и структурную формулы этого вещества, зная,что азот в нём имеет такую же валентность, как и в аммиаке.
- Запишите уравнение реакции горения гидразина на воздухе, зная, чтов продуктах реакции есть одно простое вещество.
- При горении гидразина в оксиде азота(IV) образуются те же продукты,что и при горении на воздухе. Запишите уравнение реакции.
- С хлороводородом гидразин вступает в реакцию соединения. Составьте уравнение реакции, если известно, что её продукт содержит равное число атомов азота и хлора.
Решение и критерии оценивания
- Вещество, о котором идёт речь, имеет молекулярную формулу N2H4 (2 балла).
 Чтобы её составить, достаточно знать, что атом азота трёхвалентен.
Чтобы её составить, достаточно знать, что атом азота трёхвалентен.
Структурная формула:
2 балла
Уравнения реакций:
- N2H4 + O2 = N2 + 2H2O 2 балла
- 2N2H4 + 2NO2 = 3N2 + 4H2O 2 балла
- N2H4 + 2HCl = N2H6Cl22 балла
Итого 10 баллов.
Задание 6. «Простой эксперимент»
Содержание ↑
В пробирку поместили порошкообразное вещество М зелёного цвета (см. рис. 1), состав которого можно выразить формулой Cu2(OH)2CO3, и нагрели. В результате реакции получили твёрдое вещество X чёрного цвета. На стенках пробирки сконденсировались капли бесцветной прозрачной жидкости Y. Выделился бесцветный газ Z, который пропустили в стакан с известковой водой, при этом наблюдали её помутнение.
Выделился бесцветный газ Z, который пропустили в стакан с известковой водой, при этом наблюдали её помутнение.
Затем порошок вещества X перенесли в трубку и нагрели в токе водорода (см. рис. 2). В результате реакции вещество X превратилось в металл красного цвета. На стенках трубки снова сконденсировались капли бесцветной прозрачной жидкости Y.
- Рисунок 1
- Рисунок 2
Определите вещества X, Y и Z, которые образовались при разложении Cu2(OH)2CO3. Приведите соответствующее уравнение реакции.
Проводя данную реакцию, пробирку с исходным веществом закрепляют с небольшим наклоном в сторону отверстия (см. рис. 1). С какой целью это делают?
Какая реакция протекала при пропускании водорода над нагретым порошком X? Составьте уравнение данной реакции.
Как можно металлический порошок красного цвета, полученный во втором опыте, снова превратить в вещество X? Напишите соответствующее уравнение реакции.
Решение и критерии оценивания
- X — CuO; Y — H2O; Z — CO2. По 1 баллу за каждое вещество
Cu2(OH)2CO3 2CuO + H2O + CO2↑ 2 балла
- Одним из продуктов разложения М является вода, пары которой конденсируются на внутренних стенках пробирки. Из-за небольшого наклона в сторону отверстия капли конденсата оттекают от зоны реакции, где стекло сильно нагрето. В противном случае капли воды попадут на нагретое стекло и пробирка лопнет. 2 балла
- H2 + CuO Cu + H2O 2 балла
- Порошок красного цвета – металлическая медь. Для её превращения в оксидследует провести реакцию с кислородом:
2Cu + O2 = 2CuO 1 балл
Итого 10 баллов.
Содержание ↑
Метод молекулярных орбиталей (МО). Молекулярно-орбитальные диаграммы
Мы уже знаем, что в атомах электроны находятся на разрешенных энергетических состояниях – атомных орбиталях (АО). Аналогичным образом, электроны в молекулах существуют в разрешенных энергетических состояниях – молекулярных орбиталях (МО).
Молекулярная орбиталь
Молекулярная орбиталь устроена намного сложнее атомной орбитали. Приведем несколько правил, которыми мы будем руководствоваться при построении МО из АО:
- При составлении МО из набора атомных орбиталей, получается такое же число МО, сколько АО в данном наборе.
- Средняя энергия МО, полученных из нескольких АО, примерно равна (но может быть больше или меньшее) средней энергии взятых АО.
- МО подчиняются принципу запрета Паули: на каждой МО не может находиться более двух электронов, которые должны иметь противоположные спины.
- АО, которые обладают сопоставимой энергией, комбинируются наиболее эффективно.

- Эффективность, с которой комбинируют две атомные орбитали, пропорциональна их перекрыванию друг с другом.
- При образовании МО при перекрывании двух неэквивалентных АО связывающая МО содержит больший вклад АО с наиболее низкой энергией, а разрыхляющая орбиталь – вклад АО с более высокой энергией.
Введем понятие порядок связи. В двухатомных молекулах, порядок связи показывает насколько число связывающих электронных пар превышает число разрыхляющих электронных пар:
Теперь на примерах рассмотрим как строить молекулярные орбитали с применением этих правил.
Молекулярно-орбитальные диаграммы элементов первого периода
Диаграмма МО молекулы Н
2Пример образования молекулы водорода из двух атомов водорода.
В результате взаимодействия 1s-орбиталей каждого из атомов водорода, образуются две молекулярные орбитали.
При взаимодействии, когда электронная плотность концентрируется в пространстве между ядрами, образуется связывающая сигма – орбиталь (σ). Эта комбинация имеет более низкую энергию, чем исходные атомы. При взаимодействии, когда электронная плотность концентрируется за пределами межъядерной области, образуется разрыхляющая сигма – орбиталь (σ*). Эта комбинация имеет более высокую энергию, чем исходные атомы.
Эта комбинация имеет более низкую энергию, чем исходные атомы. При взаимодействии, когда электронная плотность концентрируется за пределами межъядерной области, образуется разрыхляющая сигма – орбиталь (σ*). Эта комбинация имеет более высокую энергию, чем исходные атомы.
Электроны, в соответствии с принципом Паули, занимают сначала орбиталь с самой низкой энергией σ-орбиталь.
Диаграмма МО молекулы Не
2Теперь рассмотрим пример образования молекулы гелия He2, при сближении двух атомов гелия. В этом случае тоже происходит взаимодействие 1s-орбиталей и образование и σ*-орбиталей, при этом два электрона занимают связывающую орбиталь, а другие два электрона – разрыхляющую.
σ *— орбиталь дестабилизирована в такой же мере, насколько стабилизирована σ –орбиталь, поэтому два электрона, занимающие σ*— орбиталь, дестабилизируют молекулу He2. Действительно, экспериментально доказано, что молекула He2 очень неустойчива.
Действительно, экспериментально доказано, что молекула He2 очень неустойчива.
Как узнать несколько велика прочность молекулы? Чем больше разница в заполненности связывающей и разрыхляющей орбиталей, тем молекула более прочная. Как видно из диаграммы разница в заполненности орбиталей молекулы водорода больше, чем молекулы гелия, поэтому молекула водорода намного более прочная, чем молекула гелия.
Молекулярно-орбитальные диаграммы элементов второго периода
Рассмотрим, как взаимодействуют два одинаковых атома второго периода между собой, имеющие набор из s- и p-орбиталей. Следует ожидать, что 2s-орбитали будут соединяться только друг с другом, а 2p-орбитали – только с а 2p-орбиталями.
Т.к. 2p-орбитали могут взаимодействовать друг с другом двумя различными способами, то образуют σ- и π-молекулярные орбитали. Пользуясь обобщенной диаграммой, показанной ниже, можно установить электронные конфигурации двухатомных молекул второго периода, которые приведены в таблице.
Так, образование молекулы, например, фтора F2 из атомов в системе обозначений теории молекулярных орбиталей может быть записано следующим образом:
2F [1s22s22p5] =F2[(σ1s)2(σ*1s)2(σ2s)2(σ*2s)2(σ2px)2(π2py)2(π2pz)2(π*2py)2(π*2pz)2].
Т.к. перекрывание 1s-облаков незначительно, то участием электронов на этих орбиталях можно пренебречь. Тогда электронная конфигурация молекулы фтора будет такой:
F2[KK(σs)2(σ*s)2(σx)2(πy)2(πz)2(π*y)2(π*z)2],
где К — электронная конфигурация К-слоя.
В таблице приведены молекулярные орбитали двухатомных молекул элементов второго периода бора (B2), углерода (C2), азота (N2), кислорода (O2), фтора (F2)
Рассмотрим подробнее пример образования молекулы лития Li2, принимая во внимание, что 1s- и 2s-орбитали слишком сильно отличаются по энергии и поэтому между ними не возникает сильного взаимодействия.
Диаграмма энергетических уровней молекулы Li2 показана ниже, где электроны, находящиеся на 1s-связывающих и 1s-разрыхляющих орбиталях не вносят значительного вклада в связывание. Поэтому за образование химической связи в молекуле Li2 отвечают 2s-электроны.
диаграмма МО молекулы литияЭто действие распространяется и на образование других молекул, в которых заполненные атомные подоболочки (s, p, d) не дают вклада в химическую связь. Таким образом, рассматриваются только валентные электроны.
В итоге, для щелочных металлов, молекулярно-орбитальная диаграмма будет иметь вид подобный рассмотренной нами диаграмме молекулы Li2.
Порядок связи n в молекуле Li2 равен 1
Молекулярные орбитали полярных двухатомных молекул
Учение о МО позволяет объяснить и образование двухатомных гетероядерных молекул. Если атомы в молекуле не слишком отличаются друг от друга (например, NO, CO, CN), то можно воспользоваться диаграммой, приведенной выше для элементов 2 периода.
При значительных различиях между атомами, входящих в состав молекулы, диаграмма видоизменяется.
Чем больше электроотрицательность атома, тем более низко на диаграмме обозначают атомные орбитали.
Диаграмма МО молекулы HF
Рассмотрим молекулу HF, в которой атомы сильно отличаются по электроотрицательности.
Энергия 1s-орбитали атома водорода выше энергии самой высокой из валентных орбиталей фтора – 2p — орбитали. Взаимодействие 1s-орбитали атома водорода и 2p — орбитали фтора приводит к образованию связывающей и разрыхляющей орбиталей, как показано на рисунке. Пара электронов, находящиеся на связывающей орбитали молекулы HF, образуют полярную ковалентную связь.
Взаимодействие 1s-орбитали атома водорода и 2p — орбитали фтора приводит к образованию связывающей и разрыхляющей орбиталей, как показано на рисунке. Пара электронов, находящиеся на связывающей орбитали молекулы HF, образуют полярную ковалентную связь.
Для связывающей орбитали молекулы HF 2p — орбиталь атома фтора играет более важную роль, чем 1s — орбиталь атома водорода.
Для разрыхляющей орбитали молекулы HF наоборот: 1s — орбиталь атома водорода играет более важную роль, чем 2p — орбиталь атома фтора
Диаграмма МО молекулы HFТ.к. электроотрицательность фтора больше, чем электроотрицательность водорода, то на диаграмме, атомные орбитали фтора расположени ниже, чем атомная орбиталь водорода.
Определим порядок связи, т.е. кратность связи:
Т.о. в молекуле H-F связь одинарная.
Диаграмма МО молекулы СО
Электронная конфигурация внешнего слоя атомов углерода и кислорода:
С+6 1s2 2s2 2p2
O+8 1s2 2s2 2p4
Кислород более электроотрицательный элемент, поэтому его атомная орбиталь на диаграмме расположена ниже орбитали углерода.
Диаграмма МО молекулы СО имеет вид:
СO[KK(σs)2(σ*s)2(σx)2(πy)2(πz)2(π*y)]
Кратность связи равна:
n=(8-2)/2 = 3
Диаграмма молекулы NO приведена в разделе Задачи к разделу Химическая связь и строение молекул
Метод молекулярных орбиталей (МО) | Задачи 241
Задача 241.
Описать электронное строение молекул СО и СN с позиций методов ВС и МО. Какая из молекул характеризуется большей кратностью связи?
Решение:
а) Электронное строение молекул CO и CN с позиции метода ВС.
Электронная конфигурация атома углерода 1s22s22p2, атома кислорода 1s22s22p4, атома азота 1s22s22p3. Электронное строение их валентных орбиталей в невозбуждённом состоянии может быть представлено следующими графическими схемами:
а) атом углерода:
б) атом азота:
При возбуждении атом углерода переходит в состояние 1s22s12p3, а электронное строение его валентных орбиталей соответствует схеме:
Два неспаренных электрона невозбуждённого атома углерода могут участвовать в образовании двух ковалентных связей по обычному механизму с атомом кислорода, имеющем два неспаренных электрона, с образованием молекулы СО. При образовании молекулы CN образуются две ковалентные связи по обычному механизму за счёт двух неспаренных электрона атома углерода и двух неспаренных электронов атома азота. Электронные схемы CO и CN:
При образовании молекулы CN образуются две ковалентные связи по обычному механизму за счёт двух неспаренных электрона атома углерода и двух неспаренных электронов атома азота. Электронные схемы CO и CN:
б) Электронное строение молекул CO и CN с позиции метода МО.
Энергетические схемы образования молекул а) CO и б) CN:
Из приведённых схем следует, что кратность связи в молекуле СО равна 3 [(6 — 0)/2 = 3], а в молекуле NO – 2,5[(5 – 0)/2 = 2,5]. Следовательно, молекула СО по отношению к молекуле NO характеризуется большей устойчивостью, чем больше кратность связи, тем короче связь. Молекула СN имеет один неспаренный электрон на связывающей орбитали, следовательно, она парамагнитна. Молекула СО не имеет неспаренных электронов на связывающих и разрыхляющих орбиталях, значит, она диамагнитна.
Задача 242.
Рассмотреть с позиций метода МО возможность образования молекул В2, F2, BF. Какая из этих молекул наиболее устойчива?
Какая из этих молекул наиболее устойчива?
Решение:
Энергетические схемы образования молекул а)В2, б) F2, в) BF:
Из составленных энергетических схем В2, F2, BF вытекает, что разность между числом связывающих и разрыхляющих электронов соответственно равны 2, 2 и 6, что отвечает кратности связи соответственно 1, 1 и 3. Следовательно, молекула BF характеризуется большей кратностью связи между атомами, она должна быть более прочной, чем у В2 и F2.
Ошибка разрыва связи
ХИМ IA-Dillman-3 (A-E)
Перейти к содержанию Приборная доскаАвторизоваться
Панель приборов
Календарь
Входящие
История
Помощь
- Мой Dashboard
- CHEM IA-Dillman-3 (A-E)
- Home
- Задания
- Pages
- Syllabus
- Викторины
- Модули
- Сотрудничество
- Office 365
- Google Drive
- StudyMate
- Записная книжка для занятий
- Newsela
- Discovery
- Newsela
К сожалению, вы обнаружили неработающую ссылку!
Сколько валентных электронов у F2? — AnswersToAll
Сколько валентных электронов у F2?
14
Каков порядок облигаций F2 -?
1
Что такое точечная диаграмма Льюиса для F2?
Точечная структура Льюиса определяется как структура, которая представляет количество валентных электронов вокруг атомов. Электроны представлены точками. Фтору требуется 1 электрон для завершения своего октета. Когда соединяется другой фтор, они разделяют по 1 электрону каждый, образуя одинарную связь.
Электроны представлены точками. Фтору требуется 1 электрон для завершения своего октета. Когда соединяется другой фтор, они разделяют по 1 электрону каждый, образуя одинарную связь.
Сколько валентных электронов в группе 18?
Число валентных электронов
| Группа периодической таблицы | Валентные электроны |
|---|---|
| Группа 15 (V) (пниктогены) | 5 |
| Группа 16 (VI) (халькогены) | 6 |
| Группа 17 (VII) (галогены) | 7 |
| Группа 18 (VIII или 0) (благородные газы) | 8 ** |
Почему элементы в группах 1 и 7 имеют одинаковую валентность?
(1) Валентность элемента определяется количеством валентных электронов во внешней оболочке атома элемента.(2) Все элементы в группе имеют одинаковое количество валентных электронов. Следовательно, элементы в одной группе должны иметь одинаковую валентность.
Что такое пример атомарности?
Атомность определяется как общее количество атомов, присутствующих в молекуле. Например, каждая молекула кислорода (O2) состоит из двух атомов кислорода.
Что обозначают N2 2N и 2n2?
Ответ. n2 представляет собой 1 молекулу азота. 2n представляет 2 атома азота. 2n2 представляет собой 2 молекулы азота.2. электронная конфигурация на разном энергетическом уровне. количество электронов в хлоридной d-оболочке. почему 2n2 — это формула электронной конфигурации. конфигурация электронной оболочки.
Что такое правило 2nsquare?
В электронной конфигурации используется линейка 2n. есть оболочки K, L, M и N. сначала принимая n = 1, мы получаем, что в оболочке K могут быть размещены только два электрона. Принимая n = 2, мы получаем, что в оболочке L может быть заполнено 8 электронов и так далее. 1Спасибо. Акрити Верма 3 года, 3 месяца назад.
Что такое N в 2-м квадрате?
максимальное количество электронов, присутствующих в оболочке, определяется формулой 2n в квадрате, где n — номер орбиты или индекс энергетического уровня.
1.6 Теория валентных связей и гибридизация — Органическая химия I
1.6.1 Теория валентной связи
Мы говорили о том, как ковалентные связи образуются в результате совместного использования пары электронов; здесь мы применим теорию валентной связи , чтобы более подробно объяснить, как происходит разделение. Теория валентной связи описывает ковалентную связь, образованную перекрытием двух наполовину заполненных атомных орбиталей на разных атомах.
Начнем с простой молекулы H 2 .Атомная электронная конфигурация атома водорода — 1s 1 , что означает, что есть один электрон (который также является валентным электроном) на сферической 1s-орбитали.
Когда два атома водорода приближаются друг к другу, две 1s-орбитали перекрываются, позволяя двум электронам (каждый H отдает 1 электрон) образовывать пары для связывания с перекрывающимися орбиталями. Общая пара электронов находится под притяжением обоих ядер водорода одновременно, в результате чего они служат «клеем», удерживающим два ядра вместе.
. Общие изменения энергии системы по сравнению с расстоянием между двумя ядрами водорода можно резюмировать на приведенной ниже энергетической диаграмме.
Рис. 1.6b. Потенциальная энергия молекулы водорода как функция межъядерного расстояния Когда два атома разделены, перекрытия и взаимодействия отсутствуют. По мере приближения орбитали начинают перекрываться, и возникает притяжение между ядром одного атома и электроном другого атома, поэтому общая энергия системы снижается.Энергия снижается до минимального уровня, когда два атома приближаются к оптимальному расстоянию. Оптимальное расстояние также определяется как длина скрепления . Молекулы H 2 имеют длину связи 74 пм (часто обозначаемую как 0,74 Å, 1Å = 10 -10 м). Разница в энергии между наиболее стабильным состоянием (состояние с наименьшей энергией с оптимальным расстоянием) и состоянием, в котором два атома полностью разделены, называется энергией связи (диссоциации) . Энергия связи 7.22 × 10 -19 Дж для одной связи Н-Н, или 435 кДж / моль.
Энергия связи 7.22 × 10 -19 Дж для одной связи Н-Н, или 435 кДж / моль.
Когда два атома становятся ближе, чем оптимальное расстояние, отталкивание между двумя ядрами становится преобладающим, и энергия системы становится еще выше.
Еще одним важным признаком ковалентной связи в H 2 является то, что две 1s-орбитали перекрываются таким образом, что называется «голова к голове». Связь, образованная прямым перекрытием, называется σ (сигма) связкой .Связи σ имеют цилиндрическую симметрию, что означает, что если взять плоскость поперечного сечения связи в любой точке, она образует круг.
Рисунок 1.6c Свойство цилиндрической симметрии σ-связиТеория валентной связи также хорошо работает для объяснения связи в HF, причем 2p-орбиталь атома фтора участвует в перекрытии.
Атом фтора имеет конфигурацию валентных электронов 2s 2 2p 5 , как показано на орбитальной диаграмме.
Для трех 2p-орбиталей две из них заполнены, а другая наполовину заполнена одним единственным электроном. Заполненная орбиталь не может образовывать связи, поэтому для перекрытия доступны только наполовину заполненные 2p. Следовательно, 1s-орбиталь атома водорода перекрывается лицом к лицу с наполовину заполненной 2p-орбиталью атома фтора с образованием σ-связи H-F, как показано ниже.
Рис. 1.6e H-F σ-связьσ-связь также может быть образована посредством перекрытия двух орбиталей p .Ковалентная связь в молекулярном фторе, F 2 , представляет собой σ-связь, образованную перекрытием двух наполовину заполненных 2 p орбиталей, по одной от каждого атома фтора, как показано здесь.
Рис. 1.6f F2 σ-связь Однако, когда теория валентной связи применяется к органическим молекулам, например, CH 4 , она работает с , а не с . Конфигурация валентных электронов атома углерода 2s 2 2p 2 , как показано на орбитальной диаграмме.
Конфигурация валентных электронов атома углерода 2s 2 2p 2 , как показано на орбитальной диаграмме.
Основываясь на теории валентных связей, при наличии двух наполовину заполненных орбиталей атом углерода должен иметь возможность образовывать две связи. Однако углерод всегда имеет четыре связи в любом стабильном органическом соединении. Чтобы объяснить связь углерода и других атомов, которая не может вписаться в теорию простой валентной связи, новая теория, называемая орбитальной гибридизацией , будет введена в качестве дополнения к теории валентной связи.
1.6.2 Гибридизация и структура CH 4
Проще говоря, гибридизация означает математическую комбинацию нескольких орбиталей для создания набора новых гибридных орбиталей.
В гибридизации для CH 4 , 2s и три 2p-орбитали объединены, чтобы дать новый набор из четырех идентичных орбиталей, которые называются sp 3 гибридными орбиталями. Символ sp 3 здесь обозначает количество и типы орбиталей, участвующих в гибридизации: одна s и три p орбиталей.Для процесса гибридизации
Символ sp 3 здесь обозначает количество и типы орбиталей, участвующих в гибридизации: одна s и три p орбиталей.Для процесса гибридизации
количество гибридных орбиталей = общее количество объединенных атомных орбиталей
Это означает, что из четырех объединенных орбиталей генерируются четыре новых гибридных орбитали, и все они названы как sp 3 гибридных орбиталей . Эти новые гибридные орбитали все находятся на одном уровне энергии, который находится между уровнями 2s и 2p орбиталей, и в целом имеют тетраэдрическую форму с углом между любыми двумя орбиталями, равным 109.5 °. Каждая гибридная орбиталь sp 3 имеет две доли очень разных по размеру. Лепесток большего размера находится в положительной фазе и отвечает за связывание.
Рис. 1.6h Четыре гибридных sp3-орбитали, ориентированные в тетраэдрической форме Поскольку доступны четыре гибридных орбитали sp 3 , каждый из четырех валентных электронов занимает одну из них, поэтому в углероде имеется четыре наполовину заполненных sp 3 орбиталей. атом, способный образовывать четыре связи.Следовательно, связь C-H в CH 4 образована перекрытием между 1s-орбиталью в атоме водорода и sp 3 -орбиталью в атоме углерода.
атом, способный образовывать четыре связи.Следовательно, связь C-H в CH 4 образована перекрытием между 1s-орбиталью в атоме водорода и sp 3 -орбиталью в атоме углерода.
. ВСЕПР. Тетраэдрическую форму углерода sp 3 обычно можно нарисовать, используя сплошные и пунктирные клинья.Из четырех связей две связи, которые лежат внутри бумажной плоскости, показаны обычными линиями, сплошной клин представляет связь, которая указывает на плоскость бумаги, а пунктирный клин представляет связь, которая находится за бумажной плоскостью. Эти перспективные рисунки, которые показывают трехмерную форму тетраэдра, особенно важны при обсуждении стереохимии в Chapter 5 .
Рисунок 1.6j Тетраэдрическая форма метана со сплошными и пунктирными клиньями Рисунок1.6.3 Гибридизация и VSEPR
Помимо гибридизации sp 3 , существуют также другие типы гибридизации, которые включают sp, sp 2 , sp 3 d и sp 3 d 2 . Обычно гибридизацию на определенном атоме можно просто определить, подсчитав общее количество электронных групп (связывающих пар и неподеленных пар). Общее количество электронных групп просто равно общему количеству орбиталей, участвующих в определенной гибридизации. Например, в молекуле CH 4 центральный атом углерода имеет четыре 4 пары связей, поэтому гибридизация углерода имеет вид sp 3 (одна s и три p орбитали, 1 + 3 = 4) . Если у центрального атома всего пять 5 электронных групп (связывающие пары и неподеленные пары вместе), то гибридизация будет sp 3 d (одна s , три p и одна d орбиталей, 1 + 3 + 1 = 5).
Обычно гибридизацию на определенном атоме можно просто определить, подсчитав общее количество электронных групп (связывающих пар и неподеленных пар). Общее количество электронных групп просто равно общему количеству орбиталей, участвующих в определенной гибридизации. Например, в молекуле CH 4 центральный атом углерода имеет четыре 4 пары связей, поэтому гибридизация углерода имеет вид sp 3 (одна s и три p орбитали, 1 + 3 = 4) . Если у центрального атома всего пять 5 электронных групп (связывающие пары и неподеленные пары вместе), то гибридизация будет sp 3 d (одна s , три p и одна d орбиталей, 1 + 3 + 1 = 5).
Это соотношение может напоминать вам VSEPR.Гибридизация и VSEPR — это две разные концепции, однако они могут быть соотнесены друг с другом через количество общих электронных групп. Следующая таблица очень полезна для корреляции гибридизации и формы VSEPR / валентных углов вокруг центрального атома и общего количества электронных групп вместе.
Гибридизация на центральном атоме
| Общее количество электронных пар (BP и LP) вокруг центрального атома | Геометрия (форма) электронных групп (электронных пар) |
sp | 2 | линейный |
| SP 2 | 3 | тригонально планарный |
| sp 3 | 4 | четырехгранный |
| sp 3 d | 5 | тригонально-бипирамидальный |
| sp 3 d 2 | 6 | восьмигранный |
Таблица 1.3 Корреляция между гибридизацией и VSEPR
- Какова гибридизация атома кислорода в молекуле H 2 O?
- Что такое гибридизация атома ксенона в молекуле XeF 4 и какова форма всей молекулы?
Ответы на практические вопросы Глава 1
1. 6.4 Гибридизация и VSEPR в органических молекулах
6.4 Гибридизация и VSEPR в органических молекулах
Органические молекулы обычно содержат более одного центрального атома, поэтому называть форму всей молекулы нецелесообразно; вместо этого мы можем говорить о форме / угле связи для каждого центрального атома в отдельности.Для таких целей не забудьте включить неподеленные пары, которые обычно не учитываются в органических структурах (см. Раздел 1.2.4 ). Различные структурные формулы молекул этанола, уксусной кислоты и этаннитрила показаны в таблице ниже. Также показана трехмерная молекулярная модель для каждого соединения, чтобы помочь вам визуализировать пространственное расположение. Мы видим, что формы гибридизации и VSEPR необходимо указывать для каждого внутреннего атома отдельно. Если взять в качестве примера атом кислорода в группе ОН этанола, поскольку на атоме кислорода также есть две пары неподеленных парных электронов (однако они не показаны в структурах в таблице), кислород имеет sp 3 гибридизацию и находится в четырехгранная форма.
1.6.5 Множественные связи в органической структуре
Этен (C 2 H 4 )
Мы возьмем Этен (C 2 H 4 ) в качестве примера для понимания структуры двойной связи.
Рис. 1.6k Гибридизация этена Согласно структурной формуле C 2 H 4 , вокруг каждого углерода есть три группы электронов.Обращаясь к Таблице 1.3 , было определено , что оба атома углерода находятся в гибридизации sp 2 , с тригональной плоской формой и валентным углом 120 °. Что означает гибридизация sp 2 для атома углерода в этом соединении? Это означает, что в гибридизации участвуют только три орбитали (одна 2 орбитали s и две из 2 орбиталей p ) из всех четырех, и одна 2p-орбиталь не учтена или не включена в гибридизацию, т. е. назвал негибридизированный 2р.
е. назвал негибридизированный 2р.
Три новых гибридных орбитали sp 2 и негибридизованный 2p направлены следующим образом: три гибридных орбитали sp 2 имеют тригональную плоскую форму, а негибридизированные 2р находится в положении, перпендикулярном плоскости. Каждая орбиталь имеет один единственный электрон, поэтому все орбитали заполнены наполовину и доступны для связывания. Оба атома углерода имеют одинаковый набор орбиталей (три гибридных орбитали sp 2 и одна негибридизированная 2p), как показано ниже.
Рисунок 1.6m Набор орбиталей: sp2 + 2p Рисунок 1.6n Набор орбиталей sp2 + 2p Когда два атома углерода приближаются друг к другу, sp 2 на оси x накладывается друг на друга, образуя сигму CC σ. связь, и «негибридизированный» 2p перекрывается бок о бок, образуя еще одну новую связь. Поперечное перекрытие орбиты образует связь π (пи).
Итак, теперь мы понимаем, что двойная связь C = C содержит две разные связи: связь σ (сигма) из sp 2 –sp 2 перекрытие орбиталей и связь π (pi) из перекрытия 2p – 2p.Из-за π-связи общая форма всей молекулы C 2 H 4 копланарна.
Другие sp 2 гибридные орбитали на каждом атоме углерода перекрываются с 1s-орбиталью атомов H и дают всего четыре C-H σ (сигма) связи.
Рисунок 1.6p Каркас сигма (σ) связи C2h5Этин (C 2 H 2 )
Рисунок 1.6q Гибридизация этина Ethyne C 2 H 2 (обычное название — ацетилен) имеет тройную связь C≡C.Обычно тройные связи включают одну сигма-связь и две π (пи) связи. Оба атома углерода находятся в sp-гибридизации и имеют линейную форму. При sp гибридизации каждый углерод имеет две гибридные sp-орбитали и две негибридизированные 2p-орбитали. Каждый углерод использует одну sp-гибридную орбиталь для перекрытия «голова к голове» и дает C-C сигма-связь, в то время как 2p-орбитали перекрываются бок о бок, образуя две π-связи, как показано на диаграмме ниже. Другие sp-орбитали используются для перекрытия с единицами атомов водорода с образованием связей C-H σ.
Каждый углерод использует одну sp-гибридную орбиталь для перекрытия «голова к голове» и дает C-C сигма-связь, в то время как 2p-орбитали перекрываются бок о бок, образуя две π-связи, как показано на диаграмме ниже. Другие sp-орбитали используются для перекрытия с единицами атомов водорода с образованием связей C-H σ.
Таблица 1.4. Описание изображения: CH 3 , CH 2 и OH этанола имеют тетраэдрическую форму sp 3 . CH 3 и ОН уксусной кислоты имеют тетраэдрическую форму sp 3 , а CO имеет трехугольную плоскую форму sp 2 . Наконец, этаннитрил (ацетонитрил) CH 3 имеет тетраэдрическую форму sp 3 , а CN имеет sp линейную форму.[Вернуться к таблице 1.4]
Валентных электронов
Ковалент Облигация
Валентные электроны
Электроны во внешней оболочке имеют валентность электроны электроны на атоме, которые могут быть получены или
теряется в химической реакции. Так как залито d или f подоболочки редко нарушаются в химической реакции, мы можем
определить валентные электроны следующим образом: Электроны на атоме
которые не присутствовали в предыдущем инертном газе, игнорируя заполненные d
или f подоболочки.
Так как залито d или f подоболочки редко нарушаются в химической реакции, мы можем
определить валентные электроны следующим образом: Электроны на атоме
которые не присутствовали в предыдущем инертном газе, игнорируя заполненные d
или f подоболочки.
Галлий имеет следующий электрон конфигурация.
Ga: [Ar] 4 s 2 3 d 10 4 p 1
4 s и 4 p электронов могут быть потеряны в химическая реакция, но не электроны в заполненном 3 d подоболочка. Таким образом, галлий имеет три валентных электрона.
Ковалентная связь
Атомы могут объединяться для получения октета валентных электронов за счет
обмен электронами. Например, два атома фтора могут образовывать
стабильная молекула F 2 , в которой каждый атом имеет октет
валентные электроны, разделяя пару электронов.
Например, два атома фтора могут образовывать
стабильная молекула F 2 , в которой каждый атом имеет октет
валентные электроны, разделяя пару электронов.
Пара атомов кислорода может образовывать молекулу O 2 в который каждый атом имеет в общей сложности восемь валентных электронов, разделяя две пары электронов.
Термин ковалентная связь используется для описания связей в соединения, которые являются результатом совместного использования одной или нескольких пар электроны.
Как совместное использование Электроны Связи Атомы
Чтобы понять, как пара электронов может удерживать атомы вместе давайте рассмотрим простейшую ковалентную связь, которая образует когда два изолированных атома водорода объединяются, чтобы сформировать H 2 молекула.
H + H H-H
Изолированный атом водорода содержит один протон и один электрон. удерживаются вместе силой притяжения между противоположными
заряженные частицы. Величина этой силы равна
произведение заряда электрона ( q e )
умноженное на заряд протона ( q p )
деленное на квадрат расстояния между этими частицами ( r 2 ).
удерживаются вместе силой притяжения между противоположными
заряженные частицы. Величина этой силы равна
произведение заряда электрона ( q e )
умноженное на заряд протона ( q p )
деленное на квадрат расстояния между этими частицами ( r 2 ).
Когда пара изолированных атомов водорода сводится вместе, две новые силы притяжения появляются из-за притяжения между электроном одного атома и протоном другого.
Но две силы отталкивания также создаются, потому что две отрицательно заряженные электроны отталкиваются друг от друга, как и два положительно заряженные протоны.
Может показаться, что две новые силы отталкивания уравновесят
две новые силы притяжения.Если это произошло, H 2 молекула была бы не более стабильной, чем пара изолированных водородных
атомы. Но есть способы, которыми силы отталкивания могут быть
сведены к минимуму. Как мы видели, электроны ведут себя так, как если бы они были волчками.
крутится на оси. Так же, как есть два способа, которыми верх
может вращаться, есть два возможных состояния для спина
электрон: с = + 1 / 2 и с = — 1 / 2 .Когда электроны спарены так, что имеют противоположные спины,
сила отталкивания между этими электронами сведена к минимуму.
Как мы видели, электроны ведут себя так, как если бы они были волчками.
крутится на оси. Так же, как есть два способа, которыми верх
может вращаться, есть два возможных состояния для спина
электрон: с = + 1 / 2 и с = — 1 / 2 .Когда электроны спарены так, что имеют противоположные спины,
сила отталкивания между этими электронами сведена к минимуму.
Сила отталкивания между протонами может быть минимизирована размещение пары электронов между двумя ядрами. В расстояние между электроном на одном атоме и ядром другое теперь меньше, чем расстояние между двумя ядрами. В виде в результате сила притяжения между каждым электроном и ядро другого атома больше, чем сила отталкивания между двумя ядрами, пока ядра не переносятся слишком Близко к друг другу.
Чистый результат спаривания электронов и их размещения
между двумя ядрами есть система, которая более устойчива, чем
пара изолированных атомов, если ядра расположены достаточно близко друг к другу, чтобы
разделяют пару электронов, но не так близко, что отталкивание
между ядрами становится слишком большим. Атомы водорода в H 2 молекулы, следовательно, удерживаются вместе (или связаны) за счет общего
пары электронов, и эта связь является наиболее прочной, когда
расстояние между двумя ядрами около 0.074 нм.
Атомы водорода в H 2 молекулы, следовательно, удерживаются вместе (или связаны) за счет общего
пары электронов, и эта связь является наиболее прочной, когда
расстояние между двумя ядрами около 0.074 нм.
Сходства и Различия между ионными и ковалентными соединениями
Существует значительная разница между физическими свойства NaCl и Cl 2 , как показано в таблице ниже, что является следствием разницы между ионными связями в NaCl и ковалентными связями в Cl 2 .
Некоторые физические свойства NaCl и Cl 2
| N AC | Класс 2 | |||
| Фаза при комнатной температуре | цельный | Газ | ||
| Плотность | 2. 165 г / см 3 165 г / см 3 | 0,003214 г / см 3 | ||
| Температура плавления | 801C | -100,98C | ||
| Точка кипения | 1413C | -34,6C | ||
| Способность к водному раствор для проведения электричества | Поведение | Не проводит |
Каждый ион Na + в NaCl окружен шестью Cl — ионы, и наоборот, как показано на рисунке ниже.Удаление
ион из этого соединения, следовательно, включает разрушение по крайней мере шести
облигации. Некоторые из этих связей должны быть разорваны, чтобы расплавить NaCl,
и все они должны быть разбиты, чтобы сварить это соединение. Как
в результате ионные соединения, такие как NaCl, имеют тенденцию к плавлению.
точки и температуры кипения. Таким образом, ионные соединения являются твердыми телами.
при комнатной температуре.
Как
в результате ионные соединения, такие как NaCl, имеют тенденцию к плавлению.
точки и температуры кипения. Таким образом, ионные соединения являются твердыми телами.
при комнатной температуре.
Cl 2 состоит из молекул, в которых один атом плотно привязан к другому, как показано на рисунке выше.В ковалентные связи внутри этих молекул по крайней мере так же прочны, как ионная связь, но нам не нужно разрывать эти ковалентные связи, чтобы отделить одну молекулу Cl 2 от другой. Как результат, Cl 2 гораздо легче расплавить до жидкости или закипеть он образует газ, а Cl 2 — газ в помещении температура.
Разница между ионными и ковалентными связями также объясняет почему водные растворы ионных соединений проводят электричество, в то время как водные растворы ковалентных соединений — нет.Когда соль растворяется в воде, ионы переходят в раствор.
| H 2 O | ||
| NaCl ( с ) | Na + ( водн. ) + Cl — ( водн. ) ) + Cl — ( водн. ) |
Эти ионы могут проходить через раствор, производя электрический ток, замыкающий цепь.Когда ковалентный соединение растворяется в воде, нейтральные молекулы выделяются в раствор, который не может проводить электрический ток.
| H 2 O | ||
| C 12 H 22 O 11 ( с ) | C 12 H 22 O 11 ( водн. ) |
Когда два атома хлора соединяются, образуя ковалентную связь,
каждый атом вносит один электрон, чтобы сформировать пару электронов
разделены поровну между двумя атомами, как показано на рисунке ниже.Когда атом натрия соединяется с атомом хлора с образованием ионного
связи, каждый атом по-прежнему вносит один электрон, чтобы сформировать пару
электронов, но эта пара электронов не является общей для двух
атомы. Электроны проводят большую часть своего времени на хлоре.
атом.
Электроны проводят большую часть своего времени на хлоре.
атом.
Ионные и ковалентные связи различаются по степени, в которой пара электронов разделяют атомы, образующие связь. Когда один атомов гораздо лучше притягивает электроны к себе чем другой, связь ионная .Когда атомы примерно равны по своей способности притягивать электроны к сами атомы разделяют пару электронов более или менее равно, и связь ковалентная . Как правило большого пальца, металлы часто реагируют с неметаллами с образованием ионных соединений или соли и неметаллы соединяются с другими неметаллами с образованием ковалентные соединения. Это практическое правило полезно, но оно также наивно по двум причинам.
- Единственный способ узнать, является ли соединение ионным или ковалентный — это измерение относительной способности атомов притягивать связанные электроны к себе.
- Любая попытка разделить соединения всего на два класса
(ионные и ковалентные) обречены на провал, потому что
связь во многих соединениях находится между этими двумя
крайности.

Первое ограничение лежит в основе концепции электроотрицательность. Второй служит основой концепции полярности.
Электроотрицательность
Относительная способность атома притягивать электроны в связь. по отношению к себе называется электроотрицательностью атома.Атомы с большой электроотрицательностью (например, F и O) привлекают электроны в связи лучше, чем те, у которых есть небольшие электроотрицательности (такие как Na и Mg). Электроотрицательности элементов основной группы приведены на рисунке ниже.
Когда величина электроотрицательностей основных группа элементов добавляется в периодическую таблицу в качестве третьей оси, мы получите результаты, показанные на рисунке ниже.
В данных двух вышеупомянутых цифры.
- Электроотрицательность регулярно увеличивается от
слева направо по строке периодической таблицы.

- Электроотрицательность уменьшается вниз по столбцу периодической Таблица.
Использование Электроотрицательность для идентификации ионной, ковалентной и полярной ковалентной Соединения
Когда разница между электроотрицательностями элементы в соединении относительно большие, соединение лучше всего классифицируется как ионный .
Пример: NaCl, LiF и SrBr 2 являются хорошими примерами ионные соединения. В каждом случае электроотрицательность неметалл по крайней мере на две единицы больше, чем металл.
| NaCl | LiF | SrBr 2 | ||||||
| Класс | EN = 3. 16 16 | F | EN = 3,98 | Br | EN = 2,96 | |||
| Na | EN = 0,93 | Li | EN = 0,98 | Sr | EN = 0.95 | |||
| EN = 2,23 | EN = 3,00 | EN = 2.01 |
Таким образом, мы можем предположить чистый перенос электронов из
металл к неметаллу с образованием положительных и отрицательных ионов и
запишите структуры Льюиса этих соединений, как показано в
рисунок ниже.
Все эти соединения имеют высокие температуры плавления и кипения. баллов, как и следовало ожидать для ионных соединений.
| NaCl | LiF | SrBr 2 | ||||
| MP | 801 или С | 846 или С | 657 или С | |||
| БП | 1413 или С | 1717 или С | 2146 или С |
Они также растворяются в воде с образованием водных растворов, которые
провести электричество, как и следовало ожидать.
Когда электроотрицательности элементов в соединении равны примерно одинаково, атомы разделяют электроны, а вещество ковалентно .
Пример: Примеры ковалентных соединений включают метан (CH 4 ), диоксид азота (NO 2 ) и диоксид серы (SO 2 ).
| CH 4 | НЕТ 2 | СО 2 | |||||||
| С | EN = 2. 55 55 | O | EN = 3,44 | O | EN = 3,44 | ||||
| H | EN = 2,20 | N | EN = 3,04 | S | EN = 2.58 | ||||
| EN = 0,35 | EN = 0.40 | EN = 0,86 |
Эти соединения имеют относительно низкие температуры плавления и кипения. точек, как и следовало ожидать для ковалентных соединений, и они
все газы комнатной температуры.
точек, как и следовало ожидать для ковалентных соединений, и они
все газы комнатной температуры.
| CH 4 | НЕТ 2 | СО 2 | |||
| MP | -182.5 o С | -163,6 o С | -75,5 o С | ||
| БП | -161,5 o С | -151,8 или С | -10 o С |
Неизбежно должны быть соединения, которые попадают между этими
крайности.Для этих соединений разница между
электроотрицательности элементов достаточно велики, чтобы их можно было
значительный, но недостаточно большой, чтобы классифицировать соединение как
ионный. Возьмем, к примеру, воду.
Возьмем, к примеру, воду.
| H 2 O | ||
| O | EN = 3,44 | |
| H | EN = 2.20 | |
| EN = 1,24 |
Вода не является ни чисто ионной, ни чисто ковалентной. Это не содержат положительные и отрицательные ионы, как указывает Льюис структура слева на рисунке ниже. Но электроны не делятся поровну, как указывает структура Льюиса на прямо на этом рисунке.Воду лучше всего описать как полярных соединение . Один конец или полюс молекулы имеет частичный положительный заряд (+), а другой конец имеет частичный отрицательный заряд (-).
Как правило, при разнице между
электроотрицательности двух элементов меньше 1,2, предполагаем
что связь между атомами этих элементов ковалентная . Если разница больше 1,8, предполагается, что облигация ионный .Соединения, для которых электроотрицательность
разница между 1,2 и 1,8 лучше всего описывается как полярный ,
или полярный ковалентный .
Если разница больше 1,8, предполагается, что облигация ионный .Соединения, для которых электроотрицательность
разница между 1,2 и 1,8 лучше всего описывается как полярный ,
или полярный ковалентный .
| Ковалент: | EN | <1,2 | ||
| Полярный: | 1,2 < | EN | <1.8 | |
| Ионный: | EN | > 1,8 |
| Практическая задача 2: Использование
электроотрицательности, чтобы решить, будут ли следующие
соединения лучше всего описывать как ковалентные, ионные,
или полярный. (а) Цианид натрия (NaCN) (б) Декасульфид тетрафосфора (P 4 S 10 ) (c) Окись углерода (CO) (d) Тетрахлорид кремния (SiCl 4 ) Нажмите здесь, чтобы проверить свой ответ на практическую задачу 2 |
Ограничения Концепция электроотрицательности
Электроотрицательность суммирует тенденцию элемента к
приобретать, терять или делиться электронами, когда он объединяется с другим
элемент.Но есть пределы успеха, с которым это может быть
применяемый. BF 3 ( EN = 1,94) и SiF 4 ( EN = 2,08),
например, имеют разность электроотрицательности, которая приводит нас к
ожидают, что эти соединения будут вести себя так, как если бы они были ионными, но оба
соединения ковалентны. Оба они газы при комнатной температуре,
и их точки кипения составляют -99,9 o C и -86 o C,
соответственно.
Оба они газы при комнатной температуре,
и их точки кипения составляют -99,9 o C и -86 o C,
соответственно.
Источником этой проблемы является то, что каждому элементу присваивается только одно значение электроотрицательности, которое используется для всех его соединения.Но фтор менее электроотрицателен, когда связывается с полуметаллы (например, B или Si) или неметаллы (например, C), чем когда он связывается с металлами (такими как Na или Mg).
Эта проблема снова возникает, когда мы смотрим на элементы, которые образуют соединения в более чем одной степени окисления. TiCl 2 и MnO, например, обладают многими свойствами ионного соединения. Они оба твердые при комнатной температуре, и они имеют очень высокие температуры плавления, как и ожидалось для ионных соединений.
| TiCl 2 | MnO | ||||
| MP = 1035 o C | MP = 1785 o C |
TiCl 4 и Mn 2 O 7 , с другой стороны
стороны, обе жидкости при комнатной температуре, с точками плавления
ниже 0 o C и относительно низких температур кипения, возможно
следует ожидать для ковалентных соединений.
| TiCl 4 | Mn 2 O 7 | ||
| MP = -24.1 o C | MP = -20 o C | ||
| BP = 136.4 o С | BP = 25 o C |
Принципиальное различие между этими соединениями —
степень окисления металла. Как степень окисления атома
становится больше, так же как и его способность притягивать электроны в связь
к себе. Другими словами, атомы титана в окислении +4
состояние и атомы марганца в степени окисления +7 больше
электроотрицательна, чем атомы титана и марганца при окислении
состояние +2.
По мере увеличения степени окисления металла разница между электроотрицательностями металла и неметалл, с которым он сочетается, уменьшается. Облигации в соединения, которые образуют эти элементы, поэтому становятся менее ионными (или более ковалентный).
T he Разница между полярными связями и полярными молекулами
Разница между электроотрицательностями хлора ( EN = 3.16) и водорода ( EN = 2,20) достаточно велики, чтобы что связь в HCl полярная.
Поскольку она содержит только эту одну связь, молекула HCl может также можно охарактеризовать как полярный.
Полярность молекулы может быть определена путем измерения
величина известная как дипольный момент , который зависит от двух
факторы: (1) величина разделения заряда и (2)
расстояние между отрицательным и положительным полюсами
молекула.Дипольные моменты представлены в единицах дебай ( d ). Дипольный момент для HCl невелик: = 1.08 d . Это может
следует понимать, отметив, что разделение заряда в HCl
связь относительно мала ( EN = 0,96) и что связь H-Cl
относительно короткий.
Дипольный момент для HCl невелик: = 1.08 d . Это может
следует понимать, отметив, что разделение заряда в HCl
связь относительно мала ( EN = 0,96) и что связь H-Cl
относительно короткий.
C-Cl ( EN = 0,61) не так полярны, как связи H-Cl ( EN = 0,96), но они значительно длиннее. В результате дипольный момент для CH 3 Cl примерно такое же, как HCl: = 1.01 д . На первый взгляд можно было ожидать подобного дипольного момента для четыреххлористый углерод (CCl 4 ), содержащий четыре полярных Связи C-Cl. Однако дипольный момент CCl 4 равен 0. Это можно понять, рассмотрев структуру CCl 4 . показано на рисунке ниже. Отдельные связи C-Cl в этом молекулы полярны, но четыре диполя C-Cl нейтрализуют друг друга. Таким образом, четыреххлористый углерод иллюстрирует важный момент: Не все молекулы, содержащие полярные связи, обладают дипольным моментом.
Фтор F или F2? — MVOrganizing
Фтор F или F2?
Фтор — химический элемент в периодической таблице, который имеет символ F и атомный номер 9. Атомарный фтор одновалентен и является наиболее химически реактивным и электроотрицательным из всех элементов. В чистом виде это ядовитый бледный желто-зеленый газ с химической формулой F2.
Атомарный фтор одновалентен и является наиболее химически реактивным и электроотрицательным из всех элементов. В чистом виде это ядовитый бледный желто-зеленый газ с химической формулой F2.
Фтор плотнее воздуха?
Фтор имеет нулевой ПГП; Наряду с эффективностью очистки, сокращение выбросов глобального потепления может быть движущей силой использования.Бледно-желтый газ с резким запахом. Плотность газа тяжелее воздуха.
Какое массовое число фтора?
18.998403 u
Что такое фторид в таблице Менделеева?
Фторид — отрицательный ион элемента фтора. Символ элемента фтора — F. Фторид часто обозначается как F-, что означает анион фтора, имеющий электрический заряд -1. Любое соединение, органическое или неорганическое, содержащее фторид-ион, также известно как фторид.
Что такое символ фтора Льюисом?
Примечание: фтор находится в группе 7 (иногда называемой группой VII или группой 17). Поскольку он находится в группе 7, он будет иметь 7 валентных электронов. Когда вы рисуете структуру Льюиса для фтора, вы помещаете семь «точек» или электронов-валансных электронов вокруг символа элемента (F).
Когда вы рисуете структуру Льюиса для фтора, вы помещаете семь «точек» или электронов-валансных электронов вокруг символа элемента (F).
Что такое правило октетов Льюиса?
Льюис сформулировал «правило октетов» в своей теории кубического атома. Правило октетов относится к тенденции атомов предпочитать иметь восемь электронов в валентной оболочке.Когда у атомов меньше восьми электронов, они склонны реагировать и образовывать более стабильные соединения. Атомы отреагируют, чтобы перейти в максимально стабильное состояние.
Что такое диаграмма Льюиса для фтора f2?
Рисование структуры Льюиса для F. 2 F2 представляет собой красноватый газ при комнатной температуре. Структура F2 Льюиса подобна Br2, Cl2 и I2, поскольку F, Br, Cl и I находятся в Группе 7 и имеют 7 валентных электронов. Для структуры F2 Льюиса доступно всего 14 валентных электронов.
Что такое углеродный символ Льюиса?
Например, символ углерода Льюиса изображает «C’, окруженный 4 валентными электронами, потому что углерод имеет электронную конфигурацию 1s22s22p2. Символ Льюиса для углерода: каждый из четырех валентных электронов представлен точкой.
Символ Льюиса для углерода: каждый из четырех валентных электронов представлен точкой.
Каковы правила рисования точечных структур Льюиса?
Правила построения точечных структур Льюиса
- Подсчитайте количество валентностей е — каждый атом привносит в молекулу.
- Поместите электронные пары вокруг каждого атома так, чтобы вокруг каждого атома было 8 электронов (правило октетов), за исключением H, который окружен только 2 электронами.
Что такое угольные светодиоды?
Исследователи сделали белые светодиоды с частицами углерода, используя стандартную конструкцию. Они нанесли покрытие из точек поверх светодиодного чипа, излучающего ультрафиолетовый свет; точки светятся белым при возбуждении этими длинами волн. Команда сообщает, что свет был сопоставим с цветом, излучаемым коммерческими белыми светодиодами.
Что такое CO2-гибридизация?
Гибридизация CO2 (двуокиси углерода) Двуокись углерода в основном имеет sp-тип гибридизации. Этот тип гибридизации происходит в результате связывания углерода с двумя другими атомами. Облигации могут быть либо двумя двойными связями, либо одной одинарной + одной тройной связью. Мы можем определить это, внимательно наблюдая за каждым атомом CO2.
Этот тип гибридизации происходит в результате связывания углерода с двумя другими атомами. Облигации могут быть либо двумя двойными связями, либо одной одинарной + одной тройной связью. Мы можем определить это, внимательно наблюдая за каждым атомом CO2.
Сколько неподеленных пар в СО2?
2 отдельные пары
Сколько неподеленных пар в углероде?
Углерод имеет тенденцию образовывать 4 связи и не имеет неподеленных пар.Азот имеет тенденцию образовывать три связи и иметь одну единственную пару. Кислород имеет тенденцию образовывать две связи и иметь две неподеленные пары. Фтор (и все галогены) имеет тенденцию образовывать одну связь и иметь 3 неподеленные пары.
Почему у кислорода две неподеленные пары?
Этот метод работает, потому что каждая ковалентная связь, которую образует атом, добавляет еще один электрон к валентной оболочке атома без изменения его заряда. Кислород обычно имеет 4 несвязывающих электрона (или 2 неподеленные пары). Полная валентная оболочка для кислорода равна 8, а количество электронов в связях равно 4.Следовательно, разница составляет 4.
Полная валентная оболочка для кислорода равна 8, а количество электронов в связях равно 4.Следовательно, разница составляет 4.
Сколько несвязывающих доменов находится в CO2?
CO2 имеет 2 электронных домена, что приводит к линейной геометрии электронного домена. Оба электронных домена являются связующими парами, поэтому CO2 имеет линейную молекулярную геометрию с валентным углом 180 °.
Неподеленные пары — электронные домены?
В химии электронный домен относится к количеству неподеленных пар или мест связи вокруг конкретного атома в молекуле. Электронные домены также можно назвать электронными группами.Расположение связи не зависит от того, является ли связь одинарной, двойной или тройной.
Является ли СО2 кислотой или основанием Льюиса?
Углекислый газ — это полярная молекула, положительный центр которой находится на атоме углерода: этот положительный центр способен притягивать (и принимать) неподеленные электронные пары, присутствующие на ионе оксида (O2-). Таким образом, диоксид углерода действует как кислота Льюиса, а ион оксида действует как основание Льюиса.
Таким образом, диоксид углерода действует как кислота Льюиса, а ион оксида действует как основание Льюиса.
Без названия работы
% PDF-1.4 % 1 0 объект > эндобдж 7 0 объект /Заголовок /Предмет / Автор /Режиссер / CreationDate (D: 20211205054144-00’00 ‘) / ModDate (D: 201711009 + 01’00 ‘) / rgid (PB: 51367083_AS: 103998803677186 @ 1401806655438) >> эндобдж 2 0 obj > эндобдж 3 0 obj > эндобдж 4 0 объект > эндобдж 5 0 объект > эндобдж 6 0 объект > ручей 2004-11-05T12: 32: 38 Партнерское издательство 5.0 / (Xyvision Postscript Formatter) 3.0 32017-11-09T15: 37: 09 + 01: 002017-11-09T15: 37: 09 + 01: 00 Acrobat Distiller Command 3.01 для приложения Solaris 2.3 и более поздних версий (SPARC) / pdf
 u? dXrk? O? ŇCN? Ӛ}] Nѥ59 | v_ri & xNӅD? ћBs.W «8u и IïˏoXš! P,] R’lOVĢiU4FеGGr (ݦ N71AVͧ | Ż% t́n
ө & \ wyn6
@ f # ZMlRFGˆ
Vj «} *, + [Wm% G = @ 4oNDen # 9Fhrr qXr
gfEbO-CqPtV; IdE8Y
u? dXrk? O? ŇCN? Ӛ}] Nѥ59 | v_ri & xNӅD? ћBs.W «8u и IïˏoXš! P,] R’lOVĢiU4FеGGr (ݦ N71AVͧ | Ż% t́n
ө & \ wyn6
@ f # ZMlRFGˆ
Vj «} *, + [Wm% G = @ 4oNDen # 9Fhrr qXr
gfEbO-CqPtV; IdE8YТеория молекулярных орбиталей | Grandinetti Group
Подход со структурой Льюиса обеспечивает чрезвычайно простой метод определения электронной структуры многих молекул. Однако это немного упрощенно, и у него действительно есть проблемы с предсказанием структуры для нескольких молекул. Тем не менее, он дает разумную структуру для многих молекул, а его простота в использовании делает его очень полезным инструментом для химиков.
Более общий, но немного более сложный подход — это Теория молекулярных орбиталей . Эта теория строится на электронных волновых функциях квантовой механики для описания химической связи. Чтобы понять теорию МО, давайте сначала рассмотрим конструктивную и деструктивную интерференцию стоячих волн, начиная с полной конструктивной и деструктивной интерференции, которая возникает при полном перекрытии стоячих волн.
При частичном перекрытии стоячих волн мы получаем частичную конструктивную и деструктивную интерференцию.
Чтобы увидеть, как мы используем эти концепции в теории молекулярных орбиталей, давайте начнем с H 2 , простейшей из всех молекул. 1s-орбитали атома водорода представляют собой стоячие волны волновой функции электрона. В теории молекулярных орбиталей мы рассматриваем связывание двух H-атомов как частичную конструктивную интерференцию между функциями стоячей волны 1s-орбиталей.
У нас также может быть частичное деструктивное вмешательство.
Энергия молекулы H 2 с двумя электронами на связывающей орбитали на 435 кДж / моль ниже суммарной энергии двух отдельных H-атомов.С другой стороны, энергия молекулы H 2 с двумя электронами на разрыхляющей орбитали выше, чем у двух отдельных атомов H. Чтобы показать относительные энергии, мы используем диаграммы, подобные этой:
В молекуле H 2 связывающие и анти-связывающие орбитали называются орбиталями сигма (σ).
- Sigma Orbital : связывающая молекулярная орбиталь с цилиндрической симметрией относительно межъядерной оси.
Когда атомные орбитали объединяются для получения молекулярных орбиталей, количество образованных молекулярных орбиталей равно количеству используемых атомных орбиталей .Таким образом, две 1s-орбитали H объединяются, чтобы дать σ-орбитали молекулы H 2 . Молекулярная орбиталь (например, атомная орбиталь) может содержать не более двух электронов (принцип исключения Паули) и заполняется, начиная с орбитали с наименьшей энергией. В общем, разница в энергии между связывающей и антисвязывающей орбитальной парой становится больше по мере увеличения перекрытия атомных орбиталей. Теперь давайте посмотрим на несколько примеров:
Молекула H 2 + имеет только один валентный электрон.
Молекула H 2 имеет два валентных электрона.
Молекула He 2 + имеет три валентных электрона.
Молекула He 2 имеет четыре валентных электрона.
В теории структуры Льюиса у нас были одинарные, двойные и тройные связи, в теории молекулярных орбиталей мы аналогичным образом определяем порядок связей.
Порядок связи = 1/2 (количество электронов на связывающих орбиталях — количество электронов на антисвязывающих орбиталях).
Порядок облигаций в четырех приведенных выше примерах приведен в таблице ниже.
| Связь | Заказ облигации |
|---|---|
| H 2 + | 1/2 |
| H 2 | 1 | 1/2 |
| He 2 | 0 |
Порядок связи должен быть положительным, отличным от нуля, чтобы связь была стабильной. He 2 имеет нулевой порядок связи, поэтому молекула He 2 не наблюдается.
He 2 имеет нулевой порядок связи, поэтому молекула He 2 не наблюдается.
Мы также можем формировать связывающие орбитали, используя другие атомные орбитали. В первом приближении могут объединяться только орбитали с близкими энергиями. Например, мы можем объединить две p-орбитали, чтобы образовать сигма-связь:
Используя p-орбитали, можно также сформировать второй тип орбитали, называемый π-орбиталью.
Давайте рассмотрим несколько примеров, когда у нас есть связи, образующиеся между s- и p-орбиталями двух связанных вместе атомов.
Например, например, O 2 имеет 6 + 6 = 12 валентных электронов, которые могут быть размещены на связывающих и антисвязывающих орбиталях.
Обратите внимание, что молекулярная теория орбиталей предсказывает, что O 2 имеет неспаренные электроны, поэтому он будет парамагнитным.
Демо:- Покажите, что металлическое железо парамагнитно — притягивается к магниту.

- Шоу мел не парамагнитен — не притягивается к магниту.
- Покажите, что жидкий азот не парамагнитен — проходит через грани полюса магнита — показано на диапроекторе.
- Показать, что жидкий кислород парамагнитен — прилипает к полюсным граням магнита — показано на диапроекторе.
Другой пример — F 2 . Он имеет 14 электронов, которые размещаются на связывающих и антисвязывающих орбиталях, начиная с орбитали с наименьшей энергией.
В случае B 2 , C 2 и N 2 существует немного другой порядок орбитальных энергий.
Например, B 2 имеет 3 + 3 = 6 валентных электронов.
Чтобы получить более качественную трехмерную визуализацию всех связывающих орбиталей, посетите сайт Mark Winter’s Orbitron.
Домашнее задание от
Chemisty, The Central Science, 10-е изд.
9,49, 9,53, 9,57, 9,59, 9,61, 9,63, 9,65, 9,67, 9,69, 9,71
.
 Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Периодический закон и Периодическая система химических элементов Д.И. Менделеева 4.В ряду химических элементов Sе → S → О:
4.В ряду химических элементов Sе → S → О: 7.В ряду химических элементов N → Р → Аs:
7.В ряду химических элементов N → Р → Аs: В ряду химических элементов N → С → В:
В ряду химических элементов N → С → В: В ряду химических элементов Si → Аl → Мg:
В ряду химических элементов Si → Аl → Мg: В ряду химических элементов F → О → N:
В ряду химических элементов F → О → N:
 Чтобы её составить, достаточно знать, что атом азота трёхвалентен.
Чтобы её составить, достаточно знать, что атом азота трёхвалентен.



