Урок 2. валентность и валентные возможности атомов — Химия — 11 класс
Химия, 11 класс
Урок № 2. Валентность и валентные возможности атомов
Перечень вопросов, рассматриваемых в теме: всё в нашем мире состоит из атомов. Каждый атом — это очень упорядоченная система, имеющая определенную электронную конфигурацию, свои значения валентностей и степеней окисления. Валентность определяется числом химических связей, которые образует атом химического элемента в соединении. Степень окисления, в отличие от валентности, может быть нулевой и характеризуется знаком. Валентные возможности зависят от количества неспаренных электронов, неподелённых электронных пар и вакантных орбиталей внешнего электронного уровня. Благодаря такому понятию как «электроотрицательность» можно определять тип химической связи в соединениях, которая может быть ионной, а также ковалентной полярной и неполярной.
Ключевые слова: валентность; валентные возможности; электроотрицательность; степень окисления; графическая электронная формула; периодическая таблица.
Глоссарий
Валентность – это способность атома химического элемента образовывать определенное число химических связей с другими атомами.
Ионная связь — сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов.
Ковалентная связь — химическая связь, в которой у двух атомов имеется общая пара электронов.
Орбиталь – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
Периодический закон: Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Степень окисления – это условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, то есть все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Электрон — стабильная отрицательно заряженная элементарная частица.
Электронно-графическая формула для отдельных атомов химических элементов – это расположение всех его электронов на орбиталях.
Электроотрицательность – это суммарная характеристика способности атома данного элемента отдавать или присоединять электроны атомов других элементов.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс].
 М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
Теоретический материал для самостоятельного изучения
Формулировка периодического закона: «свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Четыре основные периодические закономерности:
- Правило октета: все элементы стремятся потерять, либо приобрести электрон, для того, чтобы иметь конфигурацию ближайшего по периодической таблице благородного газа, то есть восьмиэлектронную конфигурацию. Благородные газы являются самыми стабильными элементами, в следствие заполненности их внешних s- и p-орбиталей.
- Энергия ионизации – количество энергии, которое необходимо затратить для отрыва электрона атома. Элементы с левой стороны таблицы стремятся потерять электрон, а с правой стороны – его приобрести. По правилу октета чем правее элемент расположен в таблице Менделеева, тем больше нужно затратить энергии на отрыв его электрона, это же справедливо и для энергии ионизации: она увеличивается слева направо.
 Энергия ионизации уменьшается в группе при движении вниз, потому что на низких энергетических уровнях электроны способны отталкивать электроны высоких энергетических уровней. Это явление названо эффектом экранирования.
Энергия ионизации уменьшается в группе при движении вниз, потому что на низких энергетических уровнях электроны способны отталкивать электроны высоких энергетических уровней. Это явление названо эффектом экранирования. - Сродство к электрону – если вещество находится в газообразном состоянии, то при приобретении его атомом дополнительного электрона, его энергия изменяется. При движении по группе вниз сродство к электрону становится менее отрицательным.
- Электроотрицательность — мера того, как сильно атом притягивает к себе электроны другого атома, который связан с ним. Электроотрицательность увеличивается при движении в таблице снизу вверх и слева направо. Благородные газы не имеют электроотрицательности.
Водородная связь – специфическая химическая связь между электроотрицательным атомом (например, кислородом, азотом или фтором) и атомом водорода. Данный вид связи может быть как межмолекулярным, так и внутримолекулярным. Возникновение водородной связи связано с тем, что у атома водорода очень маленький радиус. Благодаря этому при смещении или отдаче единственного электрона водород приобретает положительный заряд, который в свою очередь, действует на те атомы в молекуле, которые обладают высокой электроотрицательностью.
Благодаря этому при смещении или отдаче единственного электрона водород приобретает положительный заряд, который в свою очередь, действует на те атомы в молекуле, которые обладают высокой электроотрицательностью.
Особенностью данного вида связи является ее высокая прочность, а также широкая распространённость, главным образом в органических соединениях, например в спиртах, фенолах, альдегидах и карбоновых кислотах. Именно за счет нее образуется вторичная структура белков. В качестве неорганических веществ, молекулы которых образуют водородную связь, можно отметить следующие: вода, фтороводород, синильная кислота. В настоящее время водородную связь рассматривают как частный случай ковалентной.
Металлическая связь — связь между положительными ионами металлов в металлической решетке, осуществляемая за счет притяжения электронов, которые расположены относительно свободно в кристалле металла. Атомы металлов имеют небольшое число валентных электронов, что объясняется их положением в таблице Менделеева.
Ван-дер-Ваальсова связь — силы межмолекулярного и межатомного взаимодействий, энергия которых составляет 10—20 кДж/моль. Такие связи названы в честь голландского физика Яна Дидерика Ван-дер-Ваальса. Экспериментально было определено, что молекулы, в которых внешние оболочки всех атомов заполнены (молекулы азота N2, хлора Cl2, аммиака NH3 , атомы инертных газов — He, Ne и т.д) также связываются друг с другом и образуют слабые межмолекулярные связи. Вандерваальсово взаимодействие состоит из трёх слабых электромагнитных взаимодействий:
- Ориентационные силы, диполь-дипольное притяжение – связь между молекулами, которые являются постоянными диполями.

- Дисперсионное притяжение, обусловлено взаимодействием между мгновенным и наведённым диполем.
- Индукционное притяжение (поляризационное притяжение). Взаимодействие между постоянным диполем и наведённым (индуцированным).
В основе данного типа связи также лежат кулоновские силы, которые заключаются во взаимодействии между электронами и ядрами двух молекул: на определенном расстоянии между молекулами силы отталкивания/притяжения уравновешивают друг друга, в результате чего образуется устойчивая система.
Возбужденное состояние атома — энергетически нестабильное состояние, в которое атом переходит при получении энергии. Возбужденные состояния атомов образуются при переходе электронов (одного или нескольких) с занятых орбиталей на свободные. Меньше энергии затрачивается при переходе электрона между внешними оболочками, а больше – при переходе с внутренней оболочки на внешнюю.
Возбужденным атом пребывает недолго: при отдаче полученной энергии атом возвращается в основное состояние. Переходы между различными состояниями атомов и молекул могут происходить с испусканием электромагнитного излучения, либо с обменом энергией между молекулами и атомами. Вероятности переходов атомов между возбужденным/основным состоянием и расчет энергии при этом изучает спектроскопия.
Переходы между различными состояниями атомов и молекул могут происходить с испусканием электромагнитного излучения, либо с обменом энергией между молекулами и атомами. Вероятности переходов атомов между возбужденным/основным состоянием и расчет энергии при этом изучает спектроскопия.
Эффективный заряд атома, характеризуется разностью между числом электронов свободного атома и числом электронов принадлежащих данному атому в химическом соединении. Для оценки эффективного заряда атома применяют модель, где величины представляют как функции точечных неполяризуемых зарядов, которые локализованы на атомах. У двухатомной молекулы рассматривают дипольный момент как произведение эффективного заряда атома на межатомное расстояние.
Диполь — совокупность двух равных по величине разноименных точечных зарядов q, расположенных на некотором расстоянии друг от друга, которое мало по сравнению с расстоянием до рассматриваемой точки поля.
Постоянный диполь – совокупность периодически быстро меняющихся по направлению и величине мгновенных микродиполей.
Наведенный диполь – диполь, который возникает под действием внешнего электрического поля.
Примеры и разбор решения задач тренировочного модуля
- Пример задачи. Определите валентность S в соединении H2SO4; определите валентность N в соединении HNO2; определите валентность F в соединении C2
Решение. Валентность кислорода всегда равна 2. Валентность водорода равна 1. Для нахождения валентности серы, необходимо валентность кислорода умножить на ее индекс: 2*4=8, затем валентность водорода умножить на его индекс: 1*2 = 2. Теперь нужно вычесть полученные значения: 8-2 = 6 и разделить его на индекс серы: 6/1 = 6. Валентность серы в соединении 6.
Аналогично в варианте: валентность N в соединении HNO2 : (2*2-1*1)/1=3.
Валентность F в C2H2F2: валентность фтора всегда = 1, поэтому ответ 1.
- Пример задачи.
 Используя шкалу ЭО, соотнесите соединение и тип его химической связи.
Используя шкалу ЭО, соотнесите соединение и тип его химической связи.
Соединения: BeF2, O2, PCl5.
Типы химической связи: ионная, ковалентная неполярная, ковалентная полярная.
Решение. С помощью шкалы электроотрицательности найдем разность значений (∆х) для элементов:
BeF2 : 4,0 – 1,5 = 2,5
O2 : 3,5 – 3,5 = 0
PCl5 : 3,0 – 2,1 = 0,9
По правилам если ∆х < 2,0, то связь ковалентная полярная, если ∆х > 2,0, то связь ионная, если
∆х = 0, то связь ковалентная неполярная, таким образом, верный ответ:
BeF2 – ионная связь, O2 – ковалентная неполярная связь, PCl5 – ковалентная полярная связь.
Валентность. Определение валентности. — Основы химии на Ида Тен
Содержание статьи
Валентность элементовДо сих пор вы пользовались химическими формулами веществ, приведенными в учебнике, или теми, которые вам называл учитель.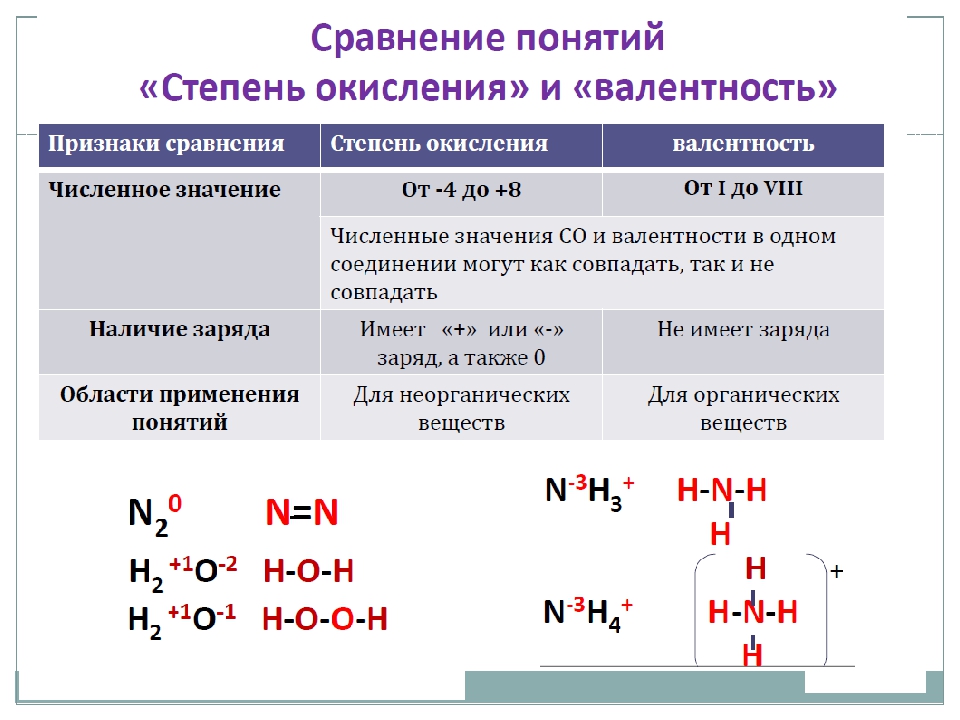 Как же правильно составлять химические формулы?
Как же правильно составлять химические формулы?
Химические формулы веществ составляются на основе знания качественного и количественного состава вещества. Веществ существует гигантское количество, естественно запомнить все формулы невозможно. Это и не нужно! Важно знать определенную закономерность, согласно которой атомы способны соединяться друг с другом с образованием новых химических соединений. Такая способность называется валентностью.
Валентность – свойство атомов элементов присоединять определенное число атомов других элементов Рассмотрим модели молекул некоторых веществ, таких, как вода, метан и углекислый газ.
Видно, что в молекуле воды атом кислорода присоединяет два атома водорода. Следовательно, его валентность равна двум. В молекуле метана атом углерода присоединяет четыре атома водорода, его валентность в данном веществе равна четырем. Валентность водорода в обоих случаях равна одному.
Валентность водорода в обоих случаях равна одному.
Такую же валентность углерод проявляет и в углекислом газе, но в отличие от метана, атом углерода присоединяет два атома кислорода, так как валентность кислорода равна двум. Существуют элементы, валентность которых не меняется в соединениях. О таких элементах говорят, что они обладают постоянной валентностью. Если же валентность элемента может быть различной – это элементы с переменной валентностью. Валентность некоторых химических элементов приведена в таблице 2. Валентность принято обозначать римскими числами. Таблица 2. Валентность некоторых химических элементов
| Символ элемента | Валентность | Символ элемента | Валентность |
| H, Li, Na, K, F, Ag | I | C, Si, Sn, Pb | II, IV |
| Be, Mg, Ca, Ba, Zn, O | II | N | I, II, III, IV |
| Al, B | III | P, As, Sb | III, V |
| S | II, IV, VI | Cl | I, II,III, IV,V, VII |
| Br, I | I, III, V | Ti | II, III, IV |
Стоит отметить, что высшая валентность элемента численно совпадает с порядковым номером группы Периодической Системы, в которой он находится. Например, углерод находиться в IV группе, его высшая валентность равна IV. Исключение составляют три элемента:
Например, углерод находиться в IV группе, его высшая валентность равна IV. Исключение составляют три элемента:
- азот – находится в V группе, но его высшая валентность IV;
- кислород – находится в VI группе, но его высшая валентность II;
- фтор – находится в VII группе, но его высшая валентность – I.
Исходя из того, что все элементы расположены в восьми группах Периодической Системы, валентность может принимать значения от I до VIII.
Составление формул веществ при помощи валентностиДля составления формул веществ при помощи валентности воспользуемся определенным алгоритмом:
| Алгоритм | Пример |
| Записать химические формулы элементов | |
| Вверху, над символами элементов записать значение их валентности. Для элементов с переменной валентностью конкретная валентность указана в условии | |
| Найти наименьшее общее кратное (НОК) значений валентности, записать его вверху | |
| Поделить НОК на значения валентностей элементов – это индексы, выражающие число атомов | 10:V=2(P) 10:II=5(O) P2O5 |
Определение валентности по формуле вещества
Чтобы определить валентность элементов по формуле вещества, необходим обратный порядок действий.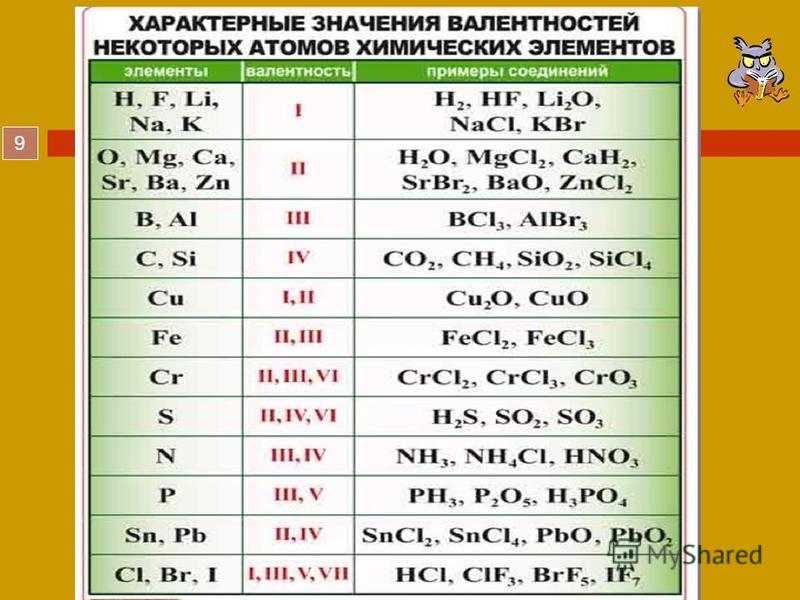 Рассмотрим его также при помощи алгоритма:
Рассмотрим его также при помощи алгоритма:
| Алгоритм | Пример |
| Записать формулу вещества | |
| Указать известную валентность элемента (для элементов с постоянной валентностью) | |
| Найти наименьшее общее кратное (НОК) валентности и индекса элемента | |
| Поделить значение НОК на индекс элемента, валентность которого неизвестна |
При изучении данного параграфа были рассмотрены сложные вещества, в состав которых входят только два вида атомов химических элементов. Формулы более сложных веществ составляются иначе.
Бинарные соединения – соединения, в состав которых входит два вида атомов элементов
Для определения порядка последовательности соединения атомов используют структурные (графические) формулы веществ. В таких формулах валентности элементов обозначают валентными штрихами (черточками). Например, молекулу воды можно изобразить как
Например, молекулу воды можно изобразить как
Н─О─Н
Графическая формула изображает только порядок соединения атомов, но не структуру молекул. В пространстве такие молекулы могут выглядеть иначе. Так, молекула воды имеет угловую структурную формулу:
- Валентность – способность атомов элементов присоединять определенное число атомов других химических элементов
- Существуют элементы с постоянной и переменной валентностью
- Высшая валентность химического элемента совпадает с его номером группы в Периодической Системе химических элементов Д.И. Менделеева. Исключения: азот, кислород, фтор
- Бинарные соединения – соединения, в состав которых входит два вида атомов химических элементов
- Графические формулы отражают порядок связей атомов в молекуле при помощи валентных штрихов
- Структурная формула отражает реальную форму молекулы в пространстве
| | Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Химический справочник / / Таблица валентностей химических элементов.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Валентность и степень окисления
☰
Валентность химического элемента определяет сколько одинарных химических связей способны образовывать атомы этого элемента с другими атомами. Атомы многих химических элементов могут проявлять разную валентность.
Атомы многих химических элементов могут проявлять разную валентность.
Химическую связь образует общая электронная пара двух атомов, которая образуется в ковалентной связи. Таким образом, валентность атомов определяется только в ковалентных соединениях. В ионной и металлической связи нет общих электронных пар, поэтому для веществ с такой связью понятие валентности не уместно.
Поскольку на внешнем энергетическом уровне атома не может быть больше 8 электронов, то валентность атомов разных химических элементов изменяется от I до VIII.
В структурных формулах молекул валентность изображают черточками между атомами. Сколько черточек отходит от одного атома, такова и его валентность.
Высшая валентность атома химического элемента в оксиде, равна номеру группы, в которой он находится. Так, углерод находится в IV группе и его высший оксид — CO2. Для натрия — Na2O, для хлора — Cl2O7.
Однако обычно атом проявляет валентность, равную количеству его неспаренных электронов. Так у галогенов — это один электрон, у кислорода — два, у водорода и щелочных металлов — по одному.
Так у галогенов — это один электрон, у кислорода — два, у водорода и щелочных металлов — по одному.
Степень окисления, по сравнению с валентностью, более универсальное понятие. Оно не зависит от вида химической связи и является характеристикой для соединений как с ковалентной, так и ионной и металлической связью. Степень окисления — это условный заряд на атоме в веществе. При определении степени окисления делают предположение, что все связи в соединении ионные. Степень окисления может быть положительной, отрицательной, нулевой.
В простых случаях степень окисления совпадает с зарядами ионов. Однако в отличие от заряда ионов степень окисления записывают после знака «+» или «-». Например:
Na+Cl—, Ca+2O-2, C+4O2-2
Поскольку металлы обычно образуют ионные связи неметаллами, то под их валентность понимают именно степень окисления.
В простых веществах степень окисления атомов считают равной нулю. Однако валентность не равна нулю, она равна числу общих электронных пар между атомами. Например, в молекуле h3 валентность атомов равна I, а степень окисления 0.
Однако валентность не равна нулю, она равна числу общих электронных пар между атомами. Например, в молекуле h3 валентность атомов равна I, а степень окисления 0.
Отрицательную степень окисления имеют атомы с большей электроотрицательностью. Так в хлориде калия K+1Cl-1 электронная пара смещена к хлору.
При определении степеней окисления атомов в молекуле следует иметь в виду, что сумма степеней окисления должна быть равна нулю, так как молекула электронейтральна.
Определение валентности в химии ✎ pangenes.ru
Валентность — это, как правило, число электронов, необходимое для заполнения внешней оболочки атома. Поскольку существуют исключения, более общее определение валентности — это число электронов, с которыми данный атом обычно связан, или число связей, которые образует атом. (Представьте себе железо, которое может иметь валентность 2 или 3).
Формальное определение валентности IUPAC — это максимальное количество одновалентных атомов, которые могут соединяться с атомом. Обычно определение основывается на максимальном количестве атомов водорода или хлора.
Обычно определение основывается на максимальном количестве атомов водорода или хлора.
Обратите внимание, что IUPAC определяет только одно значение валентности (максимум), в то время как известно, что атомы способны отображать более одной валентности (например, медь обычно имеет валентность 1 или 2).
Пример: Нейтральный атом углерода имеет 6 электронов с конфигурацией электронной оболочки 1S2 2S2 2P2. Углерод имеет валентность 4, поскольку для заполнения 2p-орбиты могут быть приняты 4 электрона.
Общие валентности
Атомы элементов в основной группе периодической таблицы могут отображать валентность между 1 и 7 (так как 8 — полный октет).
- Группа 1 (I) — обычно показывает валентность 1. Пример: Na в NaCl
- Группа 2 (II). Типичная валентность равна 2. Пример: Mg в MgCl2.
- Группа 13 (III). Обычная валентность равна 3.
 Пример: Al в AlCl3
Пример: Al в AlCl3
- Группа 4 (IV). Обычная валентность равна 4. Пример: C в CO (двойная связь) или CH4 (одинарные связи)
- Группа 5 (V) — обычные валентности 3 и 5. Примерами являются N в NH3 и P в PH5
- Группа 6 (VI). Типичные валентности 2 и 6. Пример: O в H2O
- Группа 7 (VII). Обычные валентности 1 и 7. Примеры: Cl в HCl
Валентность против состояния окисления
Есть две проблемы с «валентностью».
- Во-первых, определение неоднозначно. Во-вторых, это просто целое число без знака, указывающее на то, получит ли атом электрон или потеряет его наиболее удаленный элемент. Например, валентность как водорода, так и хлора равна 1, но водород обычно теряет свой электрон, чтобы стать H+, в то время как хлор обычно получает дополнительный электрон, чтобы стать Cl—
- Состояние окисления (степень окисления) является лучшим индикатором электронного состояния атома, поскольку оно имеет величину и знак.
 Также понятно, что атомы элемента могут отображать различные степени окисления в зависимости от условий.
Также понятно, что атомы элемента могут отображать различные степени окисления в зависимости от условий.
- Знак положителен для электроположительных атомов и отрицателен для электроотрицательных атомов. Наиболее распространенная степень окисления водорода +8. Наиболее распространенная степень окисления для хлора -1.
Краткая история
Слово «валентность» было описано в 1425 году от латинского слова valēns, что означает силу или способность.
Понятие валентности было разработано во второй половине 19-го века для объяснения химической связи и молекулярной структуры. Теория химических валентностей была предложена в 1852 году Эдвардом Франклендом.
Валентность и степень окисления, подготовка к ЕГЭ по химии
Валентность
Валентность (лат. valere — иметь значение) — мера «соединительной способности» химического элемента, равная числу индивидуальных
химических связей, которые может образовать один атом.
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди,
железа, фосфора, хрома, серы.
Ниже вы увидите элементы с переменной валентностью и их соединения. Заметьте, определить их непостоянную валентность нам помогают другие элементы — с постоянной валентностью.
Запомните, что у некоторых простых веществ валентность принимает значения: III — у азота, II — кислорода. Подведем итог полученным знаниям, написав графические формулы азота, кислорода, углекислого и угарного газов, карбоната натрия, фосфата лития, сульфата железа (II) и ацетата калия.
Как вы заметили, валентности обозначаются римскими цифрами: I, II, III и т.д. На представленных формулах валентности веществ равны:
- N — III
- O — II
- H, Na, K, Li — I
- S — VI
- C — II (в угарном газе CO), IV (в углекислом газе CO2 и карбонате натрия Na2CO3
- Fe — II
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной
реакции). В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд «+», а другим «-«. Это связано с электроотрицательностью — способностью атома притягивать к себе электроны. Знак «+» означает недостаток электронов, а «-» — их избыток. Повторюсь, СО — условное понятие.
Сумма всех степеней окисления в молекуле равна нулю — это важно помнить для самопроверки.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент
принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Помогают в этом вопросе и элементы с постоянной степенью окисления.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и «уходит в минус». Кто отдает свои электроны и испытывает их недостаток - получает знак «+».
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию ;-)
Особо хочу выделить тему ионов. Ион — атом, или группа атомов, которые за счет потери или приобретения одного или нескольких
электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к «0», как в молекуле. Ионы даны в таблице растворимости, они имеют разные заряды — к такому заряду и нужно в сумме привести ион. Объясню на примере.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химики нашли пропавшие при изменении валентности электроны
Два возможных состояния электронов у атома иттербия: локализованное состояние («пузырь» вокруг ядра), которое при понижении температуры переходит в подвижное состояние со скачками между атомами
Cornell University
Изменение валентности редкоземельных элементов в сплавах со смешанной валентностью при повышении температуры сопровождается электронным топологическим переходом, при котором электроны меняют локализованное состояние на подвижное. К такому выводу пришли американские ученые, изучив с помощью рентгеновской фотоэлектронной спектроскопии сплав иттербия и алюминия. Работа опубликована в Nature Communications.
К такому выводу пришли американские ученые, изучив с помощью рентгеновской фотоэлектронной спектроскопии сплав иттербия и алюминия. Работа опубликована в Nature Communications.
Понятие валентности — количества связей, которое может образовывать тот или иной элемент, — является одним из базовых в химии. И если в простых отдельных молекулах валентность определяется однозначно, то в химических комплексах и в кристаллических веществах определить валентность бывает несколько сложнее, потому что не всегда можно точно определить количество и направленность образованных связей.
Сейчас из-за неоднозначности определения валентности чаще используются термины «степень окисления» (описывает электронное состояние атома) и «координационное число» (описывает количество ближайших атомов-соседей). Наиболее актуальна проблема определения валентности и связи ее с электронным состоянием стоит для материалов, в которых один из элементов проявляет смешанную степень окисления, которая может при этом изменяться при понижении или повышении температуры. Однако до настоящего дня было не очень понятно, что при изменении степени окисления происходит в сплаве с теми электронами, которые освободились и не участвуют больше в образовании химических связей.
Однако до настоящего дня было не очень понятно, что при изменении степени окисления происходит в сплаве с теми электронами, которые освободились и не участвуют больше в образовании химических связей.
В своей работе химики из США изучали модельную систему — сплав алюминия и иттербия состава YbAl3, в котором атом иттербия находится в состоянии со смешанной валентностью. В таком сплаве из-за наличия упорядоченных систем магнитных примесей происходит снижение сопротивления, и иттербий проявляет две степени окисления: +2 и +3, — в которых на внешнем электронном уровне 4f находится 14 и 13 электронов, соответственно. Известно, что при снижении температуры от комнатной до 30 кельвинов (-243 градуса Цельсия) происходит уменьшение средней валентности примерно на 0,05. Но что при этом происходит с электронной структурой внутри кристалла, измерить не удавалось из-за сложностей при получении монокристалла с поверхностью достаточного качества. В новой работе для решения этой проблемы химики использовали тонкую пленку сплава, нанесенного на подложку с помощью молекулярно-лучевой эпитаксии, и исследовали ее с помощью рентгеновской фотоэлектронной спектроскопии с угловым разрешением.
Оказалось, что в таком материале часть электронов локализована и находится вблизи атомов иттербия, а часть электронов — подвижная и может находиться в нелокальном состоянии, перескакивая между атомами. Изменение силы взаимодействия между электронами разных типов при изменении температуры и давления может приводить к флуктуациям валентности иттербия. Электронная структура атома иттербия представляет из себя облако электронов вокруг ядра, размер которого увеличивается при понижении температуры. В обратном пространстве это выглядит как постепенное уменьшение заселенности соответствующего маленького электронного кармана.
Изменение электронной структуры иттербия в прямом (слева) и обратном (справа) пространствах при понижении температуры
S. Chatterjee et al./ Nature Communications, 2017
Это приводит к тому, что постепенно увеличивается подвижность электронов на низкоэнергетических уровнях 4f, при этом увеличивается время жизни этих электронов и площадь соответствующего пика в спектре. Это означает, что смена валентности при изменении температуры (или давления) сопровождается сильным перестроением электронной структуры иттербия и электронным топологическим переходом.
Это означает, что смена валентности при изменении температуры (или давления) сопровождается сильным перестроением электронной структуры иттербия и электронным топологическим переходом.По словам авторов работы, полученные результаты свидетельствуют о сильном влиянии изменения валентности на электронную структуру внутри металлических сплавов с подобными свойствами. Ученые ожидают, что в будущем эти данные смогут использоваться и для управления электронными свойствами металлических сплавов с повышенным сопротивлением.
В органических молекулах определить валентность атомов углерода значительно проще, но при этом она очень редко изменяется и практически для всех соединений равна четырем. Сейчас известно только несколько соединений, в которых углерод проявляет валентность пять, а совсем недавно ученым впервые удалось получить органическое соединение, в котором углерод связан сразу с шестью другими атомами.
Александр Дубов
| валентность | |
Что такое валентность? | |
Чтобы писать химические формулы, нам нужно понимать, как элементы сочетаются друг с другом, образуя молекулы или ионные соединения. Ионные соединения — это вещества, состоящие из комбинации заряженных (положительных и отрицательных) частиц. Ионные соединения — это вещества, состоящие из комбинации заряженных (положительных и отрицательных) частиц. | |
Валентность относится к способности атома или группы химически связанных атомов образовывать химические связи с другими атомами или группами атомов. Давайте не будем усложнять это и сразу перейдем к таблице Менделеева и тому, как мы можем определить валентность элемента. | |
Таблица Менделеева, показанная слева, может многое рассказать нам о валентности элементов. Элементы помещены в группы (столбцы) в периодической таблице в соответствии с количеством валентных электронов, поэтому, естественно, положение элемента в периодической таблице должно дать нам представление о его валентности. Все элементы в группе 1 имеют 1 валентный электрон, поэтому они имеют валентность +1, поскольку они будут иметь тенденцию отдавать 1 электрон. То же самое для группы 2, которая отдаст два электрона, и группы 3, которая отдаст 3 электрона. Однако элементы группы 5 имеют 5 валентных электронов и, как правило, принимают 3 электрона и поэтому имеют валентность -3.Элементы группы 6 имеют 6 валентных электронов и будут иметь тенденцию принимать 2 электрона и иметь валентность -2. Элементы группы 7 имеют 7 валентных электронов и будут иметь тенденцию принимать 1 электрон и иметь валентность -1. Элементы группы 8 не реагируют и поэтому имеют валентность 0 . | |
Валентности очень полезны, когда мы хотим написать формулы соединений, образованных из атомов металлов и неметаллов.Например, возьмем реакцию между атомами натрия и хлора. Литий имеет валентность +1, а азот — -3 Следуйте этому очень простому методу. | |
| Шаг 1 Запишите два атома и их валентность, всегда помещая атом с положительной валентностью слева. | |
| Шаг 2 Запишите валентность (без знака) для каждого атома в виде нижнего индекса. | |
| Шаг 3 Поменяйте местами нижние индексы и разделите на наименьшее число, только если большее число делится на меньшее число. | |
| Шаг 4 Удалите любой нижний индекс, равный «1» | |
| Давайте посмотрим на другой пример, запишем формулу соединения, образованного между кислородом и алюминием (оксид алюминия) | |
Шаг 1 Запишите два атома и их валентность, всегда помещая атом с положительной валентностью слева. | |
| Шаг 2 Запишите валентность (без знака) для каждого атома в виде нижнего индекса. | |
| Шаг 3 Поменяйте местами нижние индексы и разделите на наименьшее число, только если большее число делится на меньшее число. | |
| Шаг 4 Удалите любой нижний индекс, равный «1» | |
Напишите формулу соединения, образующегося между кальцием и углеродом, называемого карбидом кальция. Шаг 1 Запишите два атома и их валентность, всегда помещая атом с положительной валентностью слева. | |
| Шаг 2 Запишите валентность (без знака) для каждого атома в виде нижнего индекса. | |
| Шаг 3 Поменяйте местами нижние индексы и разделите на наименьшее число, только если большее число делится на меньшее число. | |
| Шаг 4 Удалите любой нижний индекс, равный «1» | |
Попробуйте сами. а) кальций и азот (нитрид кальция), | |
б) бор и кислород (оксид бора) | |
г) олово и азот (нитрид олова) | |
д) кислород и литий (оксид лития) | |
| е) фосфор и кальций (фосфид кальция) Растворы | |
Стивена попросили написать формулу соединения, образующегося при соединении атомов бора и кислорода.Он написал формулу как «O 3 B 2 ». Это правильно? Объяснить | |
Как рассчитать валентность | Наука
Обновлено 10 февраля 2020 г.
Трейси МакКоннелл
Обзор: Лана Бандойм, B.S.
Валентность — это мера способности атома связываться с другими атомами. Чем выше количество валентных электронов, тем более реакционноспособен атом или молекула.
Чем выше количество валентных электронов, тем более реакционноспособен атом или молекула.
Сколько электронов на каждой орбитали?
Электроны первыми займут наиболее устойчивое положение. Внутренняя орбиталь (K) вмещает до 2 электронов. Следующая орбиталь (L) содержит до 8 электронов. Следующая орбиталь (M) также содержит до 8 электронов.
Есть суборбиталей s, p, d и f , которые находятся в пределах орбиталей K, L, M, N.
Присутствие 8 электронов на L-орбитали обеспечивает стабильность, исходя из того, что орбиталь заполнена на . Имея 2 на суборбитали s и 2 на каждой из 3 подорбиталей p , это делает L-орбиталь полной.Это относится и к орбитали М. Это называется правилом октетов .
Найдите число валентности
Воспользуйтесь периодической таблицей, чтобы найти атомный номер. Для первого примера возьмем углерод. Атомный номер 6, что означает 6 протонов и 6 электронов.
На внутренней орбитали электронов 2 электрона, поэтому на следующей орбитали 4 (6 — 2 = 4).
Внешняя орбиталь с 4 электронами, движущимися по-разному, вращая ядро, может создать 4 одинарные связи.
Вы бы сказали, что валентность углерода равна 4.
Группы периодической таблицы
Периодическая таблица выстраивает элементы в определенном порядке в зависимости от их поведения. Элементы с одинаковым количеством валентных электронов обладают одинаковыми свойствами. Группы названы по элементу в верхней части столбца периодической таблицы.
Литиевое семейство Group 1A имеет 1 валентный электрон. Атомы в этом столбце периодической таблицы стремятся к потере 1 электрона, и это связывает его с атомом, который предпочитает принимать 1 электрон.
Элементы в группе Бериллий имеют 2 валентных электрона, а элементы в группе кислорода имеют 6. В соответствии с структурой элементов, желающих иметь полную оболочку из электронов, элементы кислородной группы любят получать 2 электрона.
Семейство гелия, также называемое благородными газами, нереактивно, потому что у них нет отверстий во внешней электронной оболочке.
Валентность таких элементов, как железо, принадлежащих к семейству металлов, более сложна и может иметь разные валентности, в зависимости от сил со стороны других атомов вокруг него.Некоторые могут иметь валентность +2 при одних обстоятельствах и +3 при других. Одна из причин этой разницы в том, что в более крупных молекулах орбитали дальше от ядра, а это означает, что сила, удерживающая электрон с атомом, слабее. Другая причина в том, что орбитали иногда близки друг к другу или перекрываются.
Валентность бора (B)
Внутренняя орбиталь является ближайшей к центру атома бора и содержит 2 электрона.
Следующая орбиталь содержит 3 электрона, разделенных на подоболочки s и p. Есть 2 электрона в s и 1 электрон в p. Это крайние 3, так что это реактивные электроны. Каждый будет связываться с другими атомами, разделяя электрон.
Валентность бора равна 3.
Предсказание поведения электронов
Электроны заполняют атомные орбитали по определенной схеме. Принцип aufbau гласит, что электроны присутствуют на атомных орбиталях, начиная с электронов с самой низкой энергией, за которыми следуют электроны с последовательно большей энергией.
Орбитальная 1_s_ заполняется перед 2_s, заполняется перед 2_p, и так далее. Каждая орбиталь s, p и d имеет емкость для 2 электронов, которые вращаются в противоположных направлениях.
Валентность важно знать, потому что она позволяет предсказать, будет ли атом с большей вероятностью отдать электрон или принять их, и это позволяет узнать, как атом будет взаимодействовать с другими атомами.
Валентные и валентные электроны | www.entelki.in
Понятие о валентности и валентных электронах
Атомы элементов имеют естественную тенденцию соединяться с атомами других элементов. Когда два или более атомов одного и того же или разных элементов объединяются вместе и образуют стабильную систему, это называется «молекулой». Например, атом натрия и хлора объединяются с образованием молекулы хлорида натрия, атома водорода и фтора. соединяются с образованием молекулы фтороводорода. Каждый атом обладает некоторой объединяющей способностью или способностью с другими атомами.Эта объединяющая способность атома элемента называется валентностью. Предполагается, что валентность водорода и хлора равна единице. Валентность других элементов выясняется относительно валентности водорода или хлора.
Количество атомов водорода или хлора, которые объединяются с одним атомом элемента, называется валентностью элемента.
На современном языке валентность элемента также определяется следующим образом: :
Количество электронов, которые разделяются, теряются или приобретаются атомом во время химической реакции, называется валентностью элемента.
Самая внешняя оболочка атома называется «валентной оболочкой», а электроны, находящиеся в этой оболочке, называются «валентными электронами». Они определяют валентность элемента.
Типы валентности
Есть два типа валентности — электровалентность и ковалентность.
Электровалентность — количество электронов, потерянных или приобретенных элементом для получения ближайшей конфигурации инертного газа, то есть стабильной конфигурации, называется электровалентностью этого атома.Например, атомы Li, Na, K теряют один электрон, поэтому их электровалентность равна 1, атомы Mg, Ca, Ba теряют два электрона, поэтому их электровалентность равна 2. Атомы O, S получают два электрона, поэтому их электровалентность равна 2. а атомы Cl, Br, I получают один электрон, поэтому их электровалентность равна 1.
Атомы инертных газов полностью заполнили крайнюю орбиту. Таким образом, они не теряют, не приобретают и не делятся электронами. Итак, их валентность равна нулю.
Ковалентность — количество электронов, которые разделяет атом одного элемента с атомом того же или другого элемента, называется ковалентностью атома.
Например, атом кислорода делит два электрона с двумя атомами H, образуя h3O. Таким образом, ковалентность кислорода равна 2.
Атом кремния делит четыре электрона с четырьмя атомами Cl, образуя SiCl4. Таким образом, ковалентность кремния равна 4.
При образовании стабильной молекулы или во время химической реакции атом пытается завершить свой октет или дуплет. Таким образом, количество электронов, потерянных, полученных или разделенных атомом для завершения своей валентной оболочки или октета, также считается валентностью атома.
Валентность — в химии — точка присвоения
Валентность — это мера реакционной способности атома или молекулы. В химии валентность (иногда называемая валентностью) — это количество химических связей, которые могут образовывать атомы определенного элемента. Это мера объединяющей способности атомов или молекул. Это количество электронов, которые атом приобретает, теряет или даже разделяет во время химической реакции. Это дает нам представление о заряде атома. Самую внешнюю оболочку также называют валентной оболочкой атома.
Долгое время люди думали, что это число является фиксированным свойством рассматриваемого элемента. Они думали, что у углерода всегда четыре связи, у кислорода всегда две, а у водорода всегда одна. Проблема возникла позже. Например, фосфор иногда ведет себя так, как если бы он имел три связи с валентностью три. В других случаях кажется, что у него пять облигаций. Прежде чем перейти к выяснению валентности элементов, вы должны знать атомный номер. элементов это поможет вам определить валентность.Сочетание натрия и кислорода. Натрий имеет валентность 1, а кислород имеет валентность 2. Меняя их валентности, чтобы получить соотношение их соединяющихся атомов, мы получили Na 2 O.
ИЮПАК увидел эту проблему и предложил степени окисления. Это означает, что на каждый химический элемент приходится одно число. Проблема этого подхода в том, что он не учитывает большинство химических свойств рассматриваемых элементов. Это относится к способности атома или группы химически связанных атомов образовывать химические связи с другими атомами или группами атомов.Количество электронов во внешней оболочке элемента определяет его валентность. Пример хлора у. нет. это 17 электронная конфигурация 2, 8, 7, поэтому внешняя оболочка имеет 7 электронов, мы узнаем валентность, используя формулу. Валентность определяется количеством электронов во внешней оболочке каждого атома элемента.
Валентная зона — это самая высокая занятая молекулярная орбиталь, обычно занятая валентными электронами для данного твердого тела при абсолютной нулевой температуре.
Разница между радикалом и валентностью
Автор: Мадху
Ключевое различие между радикалом и валентностью заключается в том, что радикал — это химическая разновидность, которая имеет неспаренный электрон, тогда как валентность — это химическое понятие, которое описывает способность химического элемента к соединить с другим химическим элементом .
Радикал является очень реактивным химическим веществом, потому что у него есть неспаренный электрон. Валентность — это объединяющая способность элемента, особенно если она измеряется количеством атомов водорода, с которыми он может вытеснить или объединиться.
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое радикал
3. Что такое валентность
4. Сравнение бок о бок — радикал и валентность в табличной форме
5. Резюме
Что такое радикальный?
Радикал — это химическое соединение, имеющее неспаренный электрон.Непарный электрон — валентный электрон. Это означает; он находится в самой внешней оболочке атома. Радикал может быть атомом, молекулой или ионом. Поскольку наличие неспаренного электрона нестабильно, радикалы являются очень реактивными химическими соединениями. Следовательно, эти химические соединения имеют очень короткое время жизни.
Рисунок 01: Гидроксильный радикал
Далее, радикалы могут образовываться по-разному. Типичный метод — окислительно-восстановительные реакции. Другие важные методы включают ионизирующее излучение, тепло, электрические разряды, электролиз и т. Д.Эти радикалы являются промежуточными продуктами многих химических реакций.
Что такое валентность?
Валентность — это объединяющая способность элемента, особенно если она измеряется количеством атомов водорода, с которыми он может вытеснить или объединиться. Это химическая концепция, которая измеряет реакционную способность химического элемента. Однако он может описывать только связь атомов, но не описывает геометрию соединения.
Мы можем определить валентность химического элемента, наблюдая за положением этого элемента в периодической таблице.В периодической таблице есть все химические элементы в соответствии с числом электронов во внешней оболочке атома. Количество электронов во внешней оболочке также определяет валентность атома. Например, элементы группы 1 в периодической таблице имеют один крайний электрон. Следовательно, у них есть один электрон для смещения или комбинации с атомом водорода; таким образом, валентность 1.
Рисунок 02: Периодическая таблица
Кроме того, мы можем определить валентность, используя химическую формулу соединения.Здесь в основе этого метода лежит правило октетов. Согласно правилу октетов, атом стремится заполнить свою внешнюю оболочку, либо заполняя оболочку электронами, либо удаляя лишние электроны. Например, если мы рассматриваем соединение NaCl, валентность Na равна 1, потому что он может удалить один электрон, который находится в самой внешней оболочке. Точно так же валентность Cl также равна 1, потому что он стремится получить один электрон для завершения своего октета.
Однако нас не следует путать с терминами степень окисления и валентность, потому что степень окисления описывает заряд, который атом может нести с собой.Например, валентность азота равна 3, но степень окисления может варьироваться от -3 до +5.
В чем разница между радикалом и валентностью?
Ключевое различие между радикалом и валентностью заключается в том, что радикал — это химическая разновидность, которая имеет неспаренный электрон, тогда как валентность — это химическое понятие, которое описывает способность химического элемента соединяться с другим химическим элементом. Что касается электронов, разница между радикалом и валентностью заключается в том, что радикал имеет один неспаренный электрон, в то время как валентность химического элемента описывает электроны во внешней оболочке.
Резюме — радикал против валентности
Ключевое различие между радикалом и валентностью заключается в том, что радикал — это химическая разновидность, которая имеет неспаренный электрон, тогда как валентность — это химическое понятие, которое описывает способность химического элемента соединяться с другим химическим элементом.
Артикул:
1. «Радикал (химия)». Википедия , Фонд Викимедиа, 25 июня 2019 г., доступно здесь.
Изображение предоставлено:
1.«Гидроксильный радикал» Автор SmokeyJoe — Собственная работа (CC BY-SA 4.0) через Commons Wikimedia
2. «Векторная периодическая таблица» Рубен Вера Костер — Собственная работа (CC BY-SA 4.0) через Commons Wikimedia
Как рассчитать количество валентных электронов по химическому классу 11 CBSE
Подсказка Валентность определяется как объединяющая способность элементов, а валентность атома определяется количеством валентных электронов, присутствующих во внешней оболочке атома.{\ text {6}}} $. Следовательно, количество валентных электронов равно $ 2e + 6e = 8e $.Число электронов валентной оболочки в неоне составляет 8 $.
Дополнительная информация —
Валентность представляет собой количество электронов, полученных или потерянных или совместно используемых с другими атомами при образовании соединений. Валентность элементов в таблице Менделеева колеблется от 1-8 $. Валентность элементов основана на электронной конфигурации. Валентность элементов в группах $ 1 $ и $ 2 $ равна количеству валентных электронов, а для групп $ 13 $ и $ 14 $ — номеру группы минус $ 10 $.В группе $ 15-18 $ валентность равна $ \ text {(8 -} \, \ text {no} \, \ text {of} \, \ text {valence} \, \ text {electrons)} $.
Примечание — Все элементы группы имеют одинаковые валентности, потому что у них одинаковое количество валентных электронов. Орбитали, содержащие валентные электроны, называются орбиталями валентной оболочки, и для образования ковалентной связи происходит перекрытие между наполовину заполненными орбиталями валентной оболочки двух атомов.
Вы в одном шаге от ответа!
Подпишитесь бесплатно!
Регистрируясь, вы также получаете БЕСПЛАТНЫЙ доступ к тысячам решенных вопросов, викторин
и загружаемым PDF-файлам!
Разница между валентностью и валентностью
Главное отличие — валентность против валентности
Валентность и валентность описываются по отношению к электронам, присутствующим в атоме.Известно, что электроны расположены в оболочках или орбиталях вокруг ядра. Следовательно, электроны могут быть потеряны из атома в зависимости от силы притяжения между этими электронами и ядром атома. Валентность и валентность связаны с электронами на внешней орбитали атома. Основное различие между валентностью и валентностью заключается в том, что валентность относится к способности атома объединяться с другим атомом , тогда как валентность относится к максимальному количеству электронов, которые атом может потерять или получить, чтобы стабилизироваться.
Основные зоны покрытия
1. Что такое валентность
— Определение, объяснение с примерами
2. Что такое валентность
— Определение, объяснение с примерами
3. Каковы сходства между валентностью и валентностью
— Обзор общих характеристик
4. В чем разница между валентностью и валентностью
— Сравнение основных различий
Ключевые термины: атом, атом углерода, электроны, атом водорода, азот, правило октета, орбитальная диаграмма, валентность, валентные электроны, валентность
Что такое валентность
Валентность относится к способности одного атома соединяться с другим атомом.Другими словами, это степень объединяющей силы конкретного атома. Валентность атома связана с количеством электронов, находящихся на внешней орбитали атома. Эти электроны называются валентными электронами. Чтобы объединиться с другим атомом, конкретный атом должен иметь валентные электроны, которые могут быть потеряны, приобретены или могут быть спарены. Это связано с тем, что комбинация двух атомов может происходить как через ионную связь, так и через ковалентную связь, и в обоих этих типах атомы теряют электроны, приобретают электроны или делятся электронами.
Валентность атома может быть задана как количество одновалентных атомов, которые могут быть присоединены к этому атому, или как количество одинарных связей, которые может иметь атом. Это также можно определить как количество атомов водорода (H), которые могут быть присоединены к атому. Это потому, что атомы водорода одновалентны и могут легко связываться с другими атомами. Некоторые атомы могут быть связаны с другими атомами в разных соотношениях. Следовательно, атом может иметь несколько валентностей.
Валентность = Степень объединяющей силы
= Количество одновалентных атомов, которые могут быть присоединены
= Количество атомов H, которые могут быть присоединены.
Например, атом водорода может быть присоединен только к одному атому водорода или любому другому одновалентному атому. Следовательно, валентность водорода равна 1.
Рисунок 01: Атомная структура водорода
Электронная конфигурация водорода: 1с 1
Орбитальная диаграмма водорода :
Следовательно, у водорода есть только одно пространство для входящих электронов; в противном случае водород может потерять только один электрон. Таким образом, он может соединяться только с одним одновалентным атомом.Следовательно, валентность водорода равна 1.
Рассмотрим азот. Атомный номер азота 7.
Электронная конфигурация азота: 1s 2 2s 2 2p 3
Орбитальная диаграмма азота:
Согласно орбитальной диаграмме Азота, у него есть три пространства для входящих электронов. Это потому, что у него есть три неспаренных электрона, и они могут быть спарены, разделяя электроны от другого атома. Другими словами, азот может быть связан с одним, двумя или тремя атомами водорода.Или же азот может потерять один, два или три электрона. Следовательно, атом может иметь несколько валентностей.
Кроме того, валентность атома представлена положительным (+) или отрицательным (-) знаком. Это нужно для того, чтобы показать потерю или усиление этих электронов. Для приведенных выше примеров валентность водорода может быть +1 или -1. Валентности азота: -3, -2, -1, +2, +3.
Что такое валентность
Валентность — это максимальное количество электронов, которое атом может потерять или получить, чтобы стабилизироваться.Этот термин в основном относится к валентным электронам, поскольку количество валентных электронов определяет валентность конкретного атома.
В качестве примера рассмотрим атом углерода.
Рисунок 02: Атомная структура углерода
Электронная конфигурация углерода 1s 2 2s 2 2p 2
Орбитальная диаграмма углерода :
Согласно орбитальной диаграмме углерода, он должен получить 4 электрона, чтобы подчиняться правилу октетов.( Правило октета указывает, что восемь электронов на внешней орбитали атомов являются наиболее стабильной формой этих атомов). После получения 4 электронов общее количество электронов на орбитали n = 2 (2s и 2p) становится 8. Следовательно, валентность углерода равна 4.
Сходства между валентностью и валентностью
Валентность атома равна одной из валентностей этого атома. Это связано с тем, что максимальное количество электронов, которые могут быть потеряны, получены или разделены атомом, определяет комбинационную силу этого атома.Следовательно, хотя определения разные, значения валентности и валентности могут быть одинаковыми.
Разница между валентностью и валентностью
Определение
Валентность: Валентность — это способность одного атома соединяться с другим атомом.
Валентность: Валентность — это максимальное количество электронов, которое атом может потерять или получить, чтобы стабилизироваться.
Представительство
Валентность: Валентность задается целым числом, представленным знаком + или — перед числом.
Валентность: Валентность указывается только в виде числа без знаков + или -.
Значения
Валентность: Валентность атома может иметь несколько значений.
Валентность: Валентность атома имеет только одно значение.
Заключение
Существует небольшая разница между валентностью и валентностью, основанная на их определениях и представлении, хотя валентность и валентность атома относятся к одному и тому же понятию. Валентность дает количество связей, которое может иметь атом, тогда как валентность дает максимальное количество связей, которое может иметь атом.
Изображение предоставлено:
1. «Электронная оболочка 001 Водород — без ярлыка». Автор: Пользователь: Pumbaa (оригинальная работа: Пользователь: Грег Робсон) (соответствующая версия с пометкой), (CC BY-SA 2.
 М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018). Энергия ионизации уменьшается в группе при движении вниз, потому что на низких энергетических уровнях электроны способны отталкивать электроны высоких энергетических уровней. Это явление названо эффектом экранирования.
Энергия ионизации уменьшается в группе при движении вниз, потому что на низких энергетических уровнях электроны способны отталкивать электроны высоких энергетических уровней. Это явление названо эффектом экранирования.
 Используя шкалу ЭО, соотнесите соединение и тип его химической связи.
Используя шкалу ЭО, соотнесите соединение и тип его химической связи. — таблицы Tehtab.ru
— таблицы Tehtab.ru
 +3
+3
 Растворимость. Смеси.
Растворимость. Смеси.:format(png):watermark(177f2936fcd4422.s.siteapi.org/watermark/hghzznn66bk04sggg0s8w0484gw0gs,-1,-1,0,15,none)/177f2936fcd4422.s.siteapi.org/img/bnismc2lvtskwcwo8k8kw08k4ksskg) Пример: Al в AlCl3
Пример: Al в AlCl3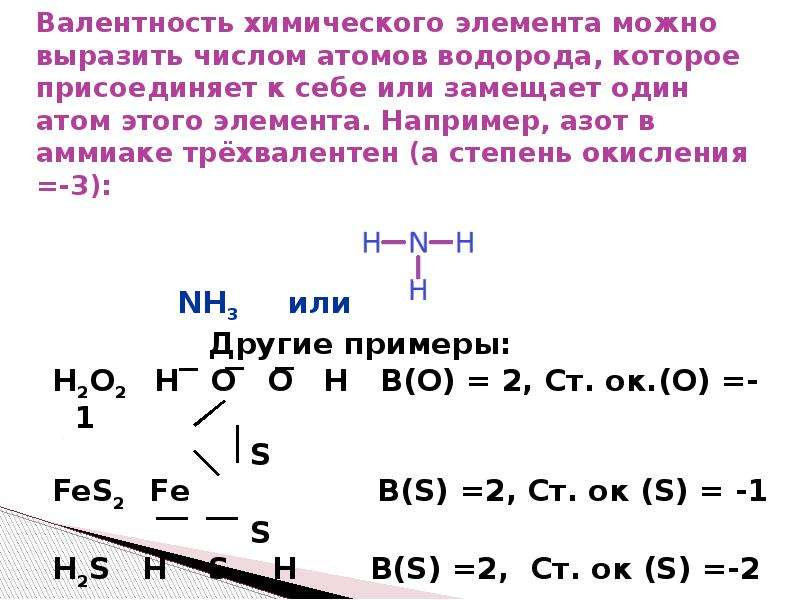 Также понятно, что атомы элемента могут отображать различные степени окисления в зависимости от условий.
Также понятно, что атомы элемента могут отображать различные степени окисления в зависимости от условий.
 Сначала мы рассмотрим взаимодействие металлов и неметаллов.
Сначала мы рассмотрим взаимодействие металлов и неметаллов. Напишите формулу соединения, образованного между:
Напишите формулу соединения, образованного между: