Валентность — это… Что такое Валентность?
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
История возникновения понятия «валентность»
Этимологию термина валентность возможно отследить начиная с 1425 года, когда его начали использовать в научных текстах в значении «экстракт», «препарат». Использование в рамках современного определения зафиксировано в 1884 году (нем. Valenz).[1] В 1789 году Уильям Хиггинс опубликовал работу, в которой высказал предположение о существовании связей между мельчайшими частицами вещества.[2]
Однако точное и позже полностью подтверждённое понимание феномена валентности было предложено в 1852 году химиком Эдуардом Франклендом в работе, в которой он собрал и переосмыслил все существовавшие на тот момент теории и предположения на этот счёт.[3]. Наблюдая способность к насыщению разных металлов и сравнивая состав органических производных металлов с составом неорганических соединений, Франкленд ввёл понятие о «
Решающую роль в создании теории валентности сыграл Фридрих Август Кекуле. В 1857 г. он показал, что углерод является четырёхосновным (четырёхатомным) элементом, и его простейшим соединением является метан СН4. Уверенный в истинности своих представлений о валентности атомов, Кекуле ввёл их в свой учебник органической химии: основность, по мнению автора — фундаментальное свойство атома, свойство такое же постоянное и неизменяемое, как и атомный вес. В 1858 г. взгляды, почти совпадающие с идеями Кекуле, высказал в статье «О новой химической теории» Арчибальд Скотт Купер.
Уже три года спустя, в сентябре 1861 г. А. М. Бутлеров внёс в теорию валентности важнейшие дополнения. Он провёл чёткое различие между свободным атомом и атомом, вступившим в соединение с другим, когда его сродство « связывается и переходит в новую форму». Бутлеров ввёл представление о полноте использования сил сродства и о «напряжении сродства», то есть энергетической неэквивалентности связей, которая обусловлена взаимным влиянием атомов в молекуле. В результате этого взаимного влияния атомы в зависимости от их структурного окружения приобретают различное «химическое значение». Теория Бутлерова позволила дать объяснение многим экспериментальным фактам, касавшимся изомерии органических соединений и их реакционной способности.
Огромным достоинством теории валентности явилась возможность наглядного изображения молекулы. В 1860-х гг. появились первые молекулярные модели. Уже в 1864 г. А. Браун предложил использовать структурные формулы в виде окружностей с помещёнными в них символами элементов, соединённых линиями, обозначающими химическую связь между атомами; количество линий соответствовало валентности атома. В 1865 г. А. фон Гофман продемонстрировал первые шаростержневые модели, в которых роль атомов играли крокетные шары. В 1866 г. в учебнике Кекуле появились рисунки стереохимических моделей, в которых атом углерода имел тетраэдрическую конфигурацию.
Современные представления о валентности
С момента возникновения теории химической связи понятие «валентность» претерпело существенную эволюцию. В настоящее время оно не имеет строгого научного толкования, поэтому практически полностью вытеснено из научной лексики и используется, преимущественно, в методических целях.
Резонансная модель образования ковалентных связей в молекуле HNO3В основном, под валентностью химических элементов понимается способность свободных его атомов к образованию определённого числа ковалентных связей. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей. Именно такой подход принят в теории локализованных валентных связей, предложенной в 1927 году В. Гайтлером и Ф. Лондоном в 1927 г. Очевидно, что если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами[4]. При оценке максимальной валентности следует исходить из электронной конфигурации гипотетического, т. н. «возбуждённого» (валентного) состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH)42-, BF4— и NH4+), фосфора — 5 (PCl5), серы — 6 (H2SO4), хлора — 7 (Cl2O7).
 Структурная формула молекулы этана
Структурная формула молекулы этанаВ ряде случаев, с валентностью отождествляются такие характеристики молекулярной системы как степень окисления элемента, эффективный заряд на атоме, координационное число атома и т. д. Эти характеристики могут быть близки и даже совпадать количественно, но ни коим образом не тождественны друг другу
Особенно это справедливо для молекул с делокализованными химическими связями, например в азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4. Известное из многих школьных учебников правило — «Максимальная валентность элемента численно равна номеру группы в Периодической таблице» — относится исключительно к степени окисления. Понятия «постоянной валентности» и «переменной валентности» также преимущественно относятся к степени окисления.
Семиполярные и донорно-акцепторные (дативные) связи по своей сути являются «двойными» связями, поскольку при их образовании происходят оба процесса: перенос электрона (образование ионной связи) и обобществление электронов (образование ковалентной связи).
Понятие валентности нельзя использовать и в очень многих случаях, когда невозможно применить модель двухэлектронных двухцентровых связей[6]. Представления о валентности не применимы к описанию кластерным соединениям, бороводородам, карборанам, π-комплексам, соединениям благородных газов и многим другим. Например, катионы щелочных металлов в комплексах с краун-эфирами проявляют валентность, намного превышающую их степень окисления.
Некорректным будет использование валентности для описания соединений ионной, кристаллической природы. Так в кристалле хлорида натрия NaCl у каждого иона Na+ или Cl— — центра элементарной ячейки — реальное число соседних ионов координационное число равно 6, а степень окисления — +1 и −1 соответственно. Локализованных же электронных пар вовсе нет.
В современной химии активно используется метод молекулярных орбиталей, в котором отсутствуют какие-либо аналоги понятия валентности атома. Между тем, понятие кратности химической связи наиболее близко к характеристике числа образуемых связей. Отождествление единичной связи с двухэлектронной молекулярной орбиталью возможно лишь в предельном, локализованном случае[5]. В квантовой химии аналога понятия валентности как характеристики атома в молекуле не существует, а используемое понятие спин-валентности относится к изолированному атому[7].
См. также
Примечания
- ↑ Valence — Online Etymology Dictionary.
- ↑ Partington J.R. A Short History of Chemistry. — Dover Publications, Inc, 1989. — ISBN 0-486-65977-1
- ↑ Frankland E. On a New Series of Organic Bodies Containing Metals. // Phil. Trans. 1852. Vol. 142. P. 417—444.
- ↑ Неорганическая химия / Б. Д. Степин, А. А. Цветков ; Под ред. Б. Д. Степина. — М.: Высш. шк., 1994. — С. 71—72
- ↑ 1 2 Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — С. 126
- ↑ Развитие учения о валентности. Под ред. Кузнецова В. И. М.: Химия, 1977. стр.19.
- ↑ Татевский В. М. Квантовая механика и теория строения молекул. М.: Изд-во МГУ, 1965. Глава 3.
Ссылки
Литература
- Л. Паулинг Природа химической связи. М., Л.: Гос. НТИ хим. литературы, 1947.
- Картмелл, Фоулс. Валентность и строение молекул. М.: Химия, 1979. 360 с.]
- Коулсон Ч. Валентность. М.: Мир, 1965.
- Маррел Дж., Кеттл С., Теддер Дж. Теория валентности. Пер. с англ. М.: Мир. 1968.
- Развитие учения о валентности. Под ред.
- Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — С. 126.
Валентность — это… Что такое Валентность?
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
История возникновения понятия «валентность»
Этимологию термина валентность возможно отследить начиная с 1425 года, когда его начали использовать в научных текстах в значении «экстракт», «препарат». Использование в рамках современного определения зафиксировано в 1884 году (нем. Valenz).[1] В 1789 году Уильям Хиггинс опубликовал работу, в которой высказал предположение о существовании связей между мельчайшими частицами вещества.[2]
Однако точное и позже полностью подтверждённое понимание феномена валентности было предложено в 1852 году химиком Эдуардом Франклендом в работе, в которой он собрал и переосмыслил все существовавшие на тот момент теории и предположения на этот счёт. [3]. Наблюдая способность к насыщению разных металлов и сравнивая состав органических производных металлов с составом неорганических соединений, Франкленд ввёл понятие о «соединительной силе», положив этим основание учению о валентности. Хотя Франкленд и установил некоторые частные закономерности, его идеи не получили развития.
Решающую роль в создании теории валентности сыграл Фридрих Август Кекуле. В 1857 г. он показал, что углерод является четырёхосновным (четырёхатомным) элементом, и его простейшим соединением является метан СН4. Уверенный в истинности своих представлений о валентности атомов, Кекуле ввёл их в свой учебник органической химии: основность, по мнению автора — фундаментальное свойство атома, свойство такое же постоянное и неизменяемое, как и атомный вес. В 1858 г. взгляды, почти совпадающие с идеями Кекуле, высказал в статье «
Уже три года спустя, в сентябре 1861 г. А. М. Бутлеров внёс в теорию валентности важнейшие дополнения. Он провёл чёткое различие между свободным атомом и атомом, вступившим в соединение с другим, когда его сродство «связывается и переходит в новую форму». Бутлеров ввёл представление о полноте использования сил сродства и о «напряжении сродства», то есть энергетической неэквивалентности связей, которая обусловлена взаимным влиянием атомов в молекуле. В результате этого взаимного влияния атомы в зависимости от их структурного окружения приобретают различное «химическое значение». Теория Бутлерова позволила дать объяснение многим экспериментальным фактам, касавшимся изомерии органических соединений и их реакционной способности.
Огромным достоинством теории валентности явилась возможность наглядного изображения молекулы. В 1860-х гг. появились первые молекулярные модели. Уже в 1864 г. А. Браун предложил использовать структурные формулы в виде окружностей с помещёнными в них символами элементов, соединённых линиями, обозначающими химическую связь между атомами; количество линий соответствовало валентности атома. В 1865 г. А. фон Гофман продемонстрировал первые шаростержневые модели, в которых роль атомов играли крокетные шары. В 1866 г. в учебнике Кекуле появились рисунки стереохимических моделей, в которых атом углерода имел тетраэдрическую конфигурацию.
Современные представления о валентности
С момента возникновения теории химической связи понятие «валентность» претерпело существенную эволюцию. В настоящее время оно не имеет строгого научного толкования, поэтому практически полностью вытеснено из научной лексики и используется, преимущественно, в методических целях.
Резонансная модель образования ковалентных связей в молекуле HNO3В основном, под валентностью химических элементов понимается способность свободных его атомов к образованию определённого числа ковалентных связей. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей. Именно такой подход принят в теории локализованных валентных связей, предложенной в 1927 году В. Гайтлером и Ф. Лондоном в 1927 г. Очевидно, что если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами[4]. При оценке максимальной валентности следует исходить из электронной конфигурации гипотетического, т. н. «возбуждённого» (валентного) состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH)42-, BF4— и NH4+), фосфора — 5 (PCl5), серы — 6 (H2SO4), хлора — 7 (Cl2O7).
 Структурная формула молекулы этана
Структурная формула молекулы этанаВ ряде случаев, с валентностью отождествляются такие характеристики молекулярной системы как степень окисления элемента, эффективный заряд на атоме, координационное число атома и т. д. Эти характеристики могут быть близки и даже совпадать количественно, но ни коим образом не тождественны друг другу[5]. Например, в изоэлектронных молекулах азота N2, монооксида углерода CO и цианид-ионе CN— реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления элементов равна, соответственно, 0, +2, −2, +2 и −3. В молекуле этана (см. рис.) углерод четырёхвалентен, как и в большинстве органических соединений, тогда как степень окисления формально равна −3.
Особенно это справедливо для молекул с делокализованными химическими связями, например в азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4. Известное из многих школьных учебников правило — «Максимальная валентность элемента численно равна номеру группы в Периодической таблице» — относится исключительно к степени окисления. Понятия «постоянной валентности» и «переменной валентности» также преимущественно относятся к степени окисления.
Семиполярные и донорно-акцепторные (дативные) связи по своей сути являются «двойными» связями, поскольку при их образовании происходят оба процесса: перенос электрона (образование ионной связи) и обобществление электронов (образование ковалентной связи).
Понятие валентности нельзя использовать и в очень многих случаях, когда невозможно применить модель двухэлектронных двухцентровых связей[6]. Представления о валентности не применимы к описанию кластерным соединениям, бороводородам, карборанам, π-комплексам, соединениям благородных газов и многим другим. Например, катионы щелочных металлов в комплексах с краун-эфирами проявляют валентность, намного превышающую их степень окисления.
Некорректным будет использование валентности для описания соединений ионной, кристаллической природы. Так в кристалле хлорида натрия NaCl у каждого иона Na+ или Cl— — центра элементарной ячейки — реальное число соседних ионов координационное число равно 6, а степень окисления — +1 и −1 соответственно. Локализованных же электронных пар вовсе нет.
В современной химии активно используется метод молекулярных орбиталей, в котором отсутствуют какие-либо аналоги понятия валентности атома. Между тем, понятие кратности химической связи наиболее близко к характеристике числа образуемых связей. Отождествление единичной связи с двухэлектронной молекулярной орбиталью возможно лишь в предельном, локализованном случае[5]. В квантовой химии аналога понятия валентности как характеристики атома в молекуле не существует, а используемое понятие спин-валентности относится к изолированному атому[7].
См. также
Примечания
- ↑ Valence — Online Etymology Dictionary.
- ↑ Partington J.R. A Short History of Chemistry. — Dover Publications, Inc, 1989. — ISBN 0-486-65977-1
- ↑ Frankland E. On a New Series of Organic Bodies Containing Metals. // Phil. Trans. 1852. Vol. 142. P. 417—444.
- ↑ Неорганическая химия / Б. Д. Степин, А. А. Цветков ; Под ред. Б. Д. Степина. — М.: Высш. шк., 1994. — С. 71—72
- ↑ 1 2 Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — С. 126
- ↑ Развитие учения о валентности. Под ред. Кузнецова В. И. М.: Химия, 1977. стр.19.
- ↑ Татевский В. М. Квантовая механика и теория строения молекул. М.: Изд-во МГУ, 1965. Глава 3.
Ссылки
Литература
- Л. Паулинг Природа химической связи. М., Л.: Гос. НТИ хим. литературы, 1947.
- Картмелл, Фоулс. Валентность и строение молекул. М.: Химия, 1979. 360 с.]
- Коулсон Ч. Валентность. М.: Мир, 1965.
- Маррел Дж., Кеттл С., Теддер Дж. Теория валентности. Пер. с англ. М.: Мир. 1968.
- Развитие учения о валентности. Под ред. Кузнецова В. И. М.: Химия, 1977. 248с.
- Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — С. 126.
Валентность никеля (Ni), формулы и примеры
Общие сведения о валентности никеля
В виде простого вещества никель – блестящий белый метал с серебристым оттенком. Плотность 8,91г/см3. Температура плавления 1455oС, кипения 2900oС.
Никель имеет две аллотропные модификации. Ниже 250oС устойчив α-никель с гексагональной решеткой, выше 2500oС — β-никель с гранецентрированной кубической решеткой.
Валентность никеля в соединениях
Никель – двадцать восьмой по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в четвертом периоде в VIIIВ группе. В ядре атома никеля содержится 28 протонов и 31 нейтрон (массовое число равно 59). В атоме никеля есть четыре энергетических уровня, на которых находятся 28 электронов (рис. 1).
Рис. 1. Строение атома никеля.
Электронная формула атома никеля в основном состоянии имеет следующий вид:
1s22s22p63s23p63d84s2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие двух неспаренных электронов свидетельствует о том, что никель проявляет в своих соединениях валентность II (NiO, Ni(OH)2, NiCl2, NiBr2). Известно, что для никеля также характерна валентность III (Ni2O3, NiOOH).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Валентность — Википедия. Что такое Валентность
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей.
История возникновения понятия «валентность»
Этимологию термина валентность возможно отследить начиная с 1425 года, когда его начали использовать в научных текстах в значении «экстракт», «препарат». Использование в рамках современного определения зафиксировано в 1884 году (нем. Valenz)[1]. В 1789 году Уильям Хиггинс опубликовал работу, в которой высказал предположение о существовании связей между мельчайшими частицами вещества[2].

Однако точное и позже полностью подтверждённое понимание феномена валентности было предложено в 1852 году химиком Эдуардом Франклендом в работе, в которой он собрал и переосмыслил все существовавшие на тот момент теории и предположения на этот счёт[3]. Наблюдая способность к насыщению разных металлов и сравнивая состав органических производных металлов с составом неорганических соединений, Франкленд ввёл понятие о «соединительной силе» (соединительном весе), положив этим основание учению о валентности. Хотя Франкленд и установил некоторые частные закономерности, его идеи не получили развития.
Решающую роль в создании теории валентности сыграл Фридрих Август Кекуле. В 1857 году он показал, что углерод является четырёхосновным (четырёхатомным) элементом, и его простейшим соединением является метан СН4. Уверенный в истинности своих представлений о валентности атомов, Кекуле ввёл их в свой учебник органической химии: основность, по мнению автора — фундаментальное свойство атома, свойство такое же постоянное и неизменяемое, как и атомный вес. В 1858 году взгляды, почти совпадающие с идеями Кекуле, высказал в статье «О новой химической теории» Арчибальд Скотт Купер.
Уже три года спустя, в сентябре 1861-го, А. М. Бутлеров внёс в теорию валентности важнейшие дополнения. Он провёл чёткое различие между свободным атомом и атомом, вступившим в соединение с другим, когда его сродство «связывается и переходит в новую форму». Бутлеров ввёл представление о полноте использования сил сродства и о «напряжении сродства», то есть энергетической неэквивалентности связей, которая обусловлена взаимным влиянием атомов в молекуле. В результате этого взаимного влияния атомы в зависимости от их структурного окружения приобретают различное «химическое значение». Теория Бутлерова позволила дать объяснение многим экспериментальным фактам, касавшимся изомерии органических соединений и их реакционной способности.
Молекулярные модели ГофманаОгромным достоинством теории валентности явилась возможность наглядного изображения молекулы. В 1860-х годах появились первые молекулярные модели. Уже в 1864 году А. Браун предложил использовать структурные формулы в виде окружностей с помещёнными в них символами элементов, соединённых линиями, обозначающими химическую связь между атомами; количество линий соответствовало валентности атома. В 1865 году А. фон Гофман продемонстрировал первые шаростержневые модели, в которых роль атомов играли крокетные шары. В 1866 году в учебнике Кекуле появились рисунки стереохимических моделей, в которых атом углерода имел тетраэдрическую конфигурацию.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода — двум, азота — трём, углерода — четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода — двум, азота — трём, кремния — четырём, серы — шести.
У большинства элементов значения валентности в водородных и в кислородных соединениях различны: например, валентность серы по водороду равна двум (H2S), а по кислороду шести (SO3). Кроме того, большинство элементов проявляют в разных своих соединениях различную валентность [некоторые элементы могут не иметь ни гидридов, ни оксидов]. Наприм., углерод образует с кислородом два оксида: монооксид углерода CO и диоксид углерода CO2. В монооксиде углерода валентность углерода равна двум, а в диоксиде — четырём (некоторые элементы способны образовывать также пероксиды). Из рассмотренных примеров следует, что охарактеризовать валентность элемента каким-нибудь одним числом и/или методом, как правило, нельзя.
Современные представления о валентности
С момента возникновения теории химической связи понятие «валентность» претерпело существенную эволюцию. В настоящее время оно не имеет строгого научного толкования, поэтому практически полностью вытеснено из научной лексики и используется, преимущественно, в методических целях.
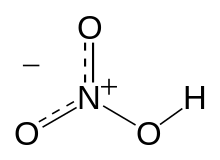 Резонансная модель образования ковалентных связей в молекуле HNO3
Резонансная модель образования ковалентных связей в молекуле HNO3В основном, под валентностью химических элементов обычно понимается способность свободных его атомов (в более узком смысле — мера его способности) к образованию определённого числа ковалентных связей. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей. Именно такой подход принят в теории локализованных валентных связей, предложенной в 1927 году В. Гайтлером и Ф. Лондоном. Очевидно, что если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами[4]. При оценке максимальной валентности следует исходить из электронной конфигурации гипотетического, т. н. «возбуждённого» (валентного) состояния. Например, максимальная валентность атома бора, углерода и азота равна 4 (например, в
[BF4]−, CH4 и [NH4]+), фосфора — 5 (PCl5), серы — 6 (H2SO4), хлора — 7 (Cl2O7).
Число связей, которые может образовывать атом, равно числу его неспаренных электронов, идущих на образование общих электронных пар (молекулярных двухэлектронных облаков). Ковалентная связь может образовываться также по донорно-акцепторному механизму. При этом в обоих случаях не учитывается полярность образовавшихся связей, а потому валентность не имеет знака — она не может быть ни положительной, ни отрицательной, в отличие от степени окисления (N2, NO2, NH3 и [NH4]+).
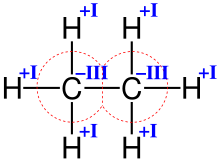 Структурная формула молекулы этана
Структурная формула молекулы этанаКроме валентности по водороду и по кислороду, способность атомов данного элемента соединяться друг с другом или с атомами других элементов в ряде случаев можно выразить [часто и отождествить] иными способами: как, например, степень окисления элемента (условный заряд атома в предположении, что вещество состоит из ионов), ковалентность (число химических связей, образуемых атомом данного элемента, в том числе и с одноимённым элементом; см. ниже), координационное число атома (число атомов, непосредственно окружающих данный атом) и т. п. Эти характеристики могут быть близки и даже совпадать количественно, но ни коим образом не тождественны друг другу[5]. Например, в изоэлектронных молекулах азота N2, монооксида углерода CO и цианид-ионе CN− реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления элементов равна, соответственно, 0, +2, −2, +2 и −3. В молекуле этана (см. рис.) углерод четырёхвалентен, как и в большинстве органических соединений, тогда как степень окисления равна −3.
Особенно это справедливо для молекул с делокализованными химическими связями, например в азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4. Известное из многих школьных учебников правило — «Максимальная валентность элемента численно равна номеру группы в Периодической таблице» — относится исключительно к степени окисления. Понятия «постоянной валентности» и «переменной валентности» также преимущественно относятся к степени окисления.
Семиполярные и донорно-акцепторные (дативные) связи по своей сути являются «двойными» связями, поскольку при их образовании происходят оба процесса: перенос электрона (образование ионной связи) и обобществление электронов (образование ковалентной связи).
Понятие валентности нельзя использовать и в очень многих случаях, когда невозможно применить модель двухэлектронных двухцентровых связей[6] — нельзя говорить о валентности элементов в соединениях, где отсутствуют ковалентные связи (чаще в таких случаях корректнее говорить о степени окисления). Представления о валентности не применимы для описания кластерных соединений, бороводородов, карборанов, π-комплексов, соединений благородных газов и многих других. Например, катионы щелочных металлов в комплексах с краун-эфирами проявляют валентность, намного превышающую их степень окисления.
Некорректным будет использование валентности для описания соединений с ионной кристаллической структурой. Так в кристалле хлорида натрия NaCl у каждого иона Na+ или Cl− — центра элементарной ячейки — реальное число соседних ионов — координационное число — равно 6, а степень окисления — +1 и −1 соответственно. Локализованных же электронных пар вовсе нет.
В современной химии активно используется метод молекулярных орбиталей, в котором отсутствуют какие-либо аналоги понятия валентности атома. Между тем, понятие кратности химической связи наиболее близко к характеристике числа образуемых связей. Отождествление единичной связи с двухэлектронной молекулярной орбиталью возможно лишь в предельном, локализованном случае[5]. В квантовой химии аналога понятия валентности как характеристики атома в молекуле не существует, а используемое понятие спин-валентности относится к изолированному атому[7].
Ковалентность элемента (мера валентных возможностей элементов; ёмкость насыщения) определяется общим числом неспаренных электронов [валентных электронных пар[8]] как в нормальном, так и в возбуждённом состоянии атома, или, иначе говоря, число образуемых атомом ковалентных связей (углерод 2s22p2 II-ковалентен, а в возбуждённом состоянии C* 2s12p3 — IV-ковалентный; таким образом в CO и CO2 валентность составляет II или IV, а ковалентность — II и/или IV). Так, ковалентность азота в молекулах N2, NH3, Al≡N и цианамиде Ca=N-C≡N равна трём, ковалентность кислорода в молекулах H2O и CO2 — двум, ковалентность углерода в молекулах CH4, CO2 и кристалле C (алмаза) — четырём.
В классическом и/или пост-квантовохимическом представлении по электронным спектрам поглощения двухатомных молекул можно определять число оптических (валентных) электронов при данной энергии возбуждения[9]. Согласно этому методу, обратная величина тангенса угла наклона корреляционной прямой/прямых (при релевантных значениях молекулярных электронных термов, которые образованы относительными суммами атомных) соответствует числу пар валентных электронов, то есть валентности в её классическом понимании[10].
Между валентностью [стехиометрической] в данном соединении, мольной массой его атомов и его эквивалентной массой существует простое соотношение, непосредственно вытекающее из атомной теории и определения понятия «эквивалентная масса».
Стехиометрическая валентность [расчётная] элемента в данном соединении[11] равна молекулярной массе его атомов (в г/моль), делённой на эквивалентную массу элемента (в г/моль):
- V=ME{\displaystyle V={\frac {M}{E}}}
V — Стехиометрическая валентность
M — Молекулярная масса (г/моль)
E — Эквивалентная масса (г/моль)
Так, стехиометрическая валентность углерода в CO 12 (г/моль) /6 (г/моль) = 2, а в CO2 12 /3 = 4.
В неорганической химии во многих случаях понятие валентности элемента теряет определённость: эта величина зависит от знания химического строения соединения, во многих случаях она может быть больше номера группы (таблицы ПСХЭ). В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как большинство неорганических веществ имеет немолекулярное строение, а органических — молекулярное. Нельзя отождествлять эти два понятия, даже если они численно совпадают. Широко применяется также термин «валентные электроны», то есть наиболее слабо связанные с ядром атома, чаще всего внешние электроны.
По валентности элементов можно составлять истинные формулы соединений, и, наоборот, исходя из истинных формул можно определять валентности элементов в данных соединениях. При этом необходимо придерживаться принципа, согласно которому произведение валентности одного элемента на число его атомов равно произведению валентности второго элемента на число его атомов. Так, чтобы составить формулу оксида азота (III), следует записать сверху над символом валентности элементов NIII{\displaystyle {\stackrel {III}{\mbox{N}}}} OII{\displaystyle {\stackrel {II}{\mbox{O}}}}. Определив наименьший общий знаменатель и разделив его на соответствующие валентности, получим атомное соотношение азота к кислороду, а именно 2 : 3. Следовательно, формула оксида азота (III) соответствует N+32O−23{\displaystyle {\stackrel {+3}{\mbox{N}}}_{2}{\stackrel {-2}{\mbox{O}}}_{3}}. Для определения валентности поступают таким же образом наоборот.
Примечания
- ↑ Valence — Online Etymology Dictionary.
- ↑ Partington, J.R. A Short History of Chemistry. — Dover Publications, Inc, 1989. — ISBN 0-486-65977-1.
- ↑ Frankland E. On a New Series of Organic Bodies Containing Metals. // Phil. Trans. 1852. Vol. 142. P. 417—444.
- ↑ Неорганическая химия / Б. Д. Степин, А. А. Цветков ; Под ред. Б. Д. Степина. — М.: Высш. шк., 1994. — С. 71—72
- ↑ 1 2 Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — С. 126
- ↑ Развитие учения о валентности. Под ред. Кузнецова В. И. М.: Химия, 1977. стр.19.
- ↑ Татевский В. М. Квантовая механика и теория строения молекул. М.: Изд-во МГУ, 1965. Глава 3.
- ↑ в том числе в донорно-акцепторной связи
- ↑ Серов Н. В. Электронные термы простых молекул // Оптика и спектроскопия, 1984, Т.56, вып.3, с. 390—406.
- ↑ Ionov S.P. and Kuznetsov N.T. Excited and Ionized and States of h3 in Terms of the Structural Thermodynamic Model// Russian Journal of Inorganic Chemistry Vol. 50, No. 2, February 2005, pp. 233—237
- ↑ В предположении что Валентность неизвестна, но известны молекулярная масса и эквивалентная масса соединения.
См. также
Ссылки
Литература
- Л. Паулинг Природа химической связи. М., Л.: Гос. НТИ хим. литературы, 1947.
- Картмелл, Фоулс. Валентность и строение молекул. М.: Химия, 1979. 360 с.]
- Коулсон Ч. Валентность. М.: Мир, 1965.
- Маррел Дж., Кеттл С., Теддер Дж. Теория валентности. Пер. с англ. М.: Мир. 1968. (недоступная ссылка)
- Развитие учения о валентности. Под ред. Кузнецова В. И. М.: Химия, 1977. 248с.
- Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — С. 126.