Химический элемент фтор: валентность, свойства, характеристика
Фтор (F) – наиболее реактивный химический элемент и самый легкий галоген группы 17 (VIIa) периодической таблицы. Данная характеристика фтора объясняется его способностью привлекать электроны (это самый электроотрицательный элемент) и небольшим размером его атомов.
История открытия
Фторсодержащий минерал плавиковый шпат был описан в 1529 году немецким врачом и минералогом Георгием Агриколой. Вероятно, что плавиковая кислота была впервые получена неизвестным английским стеклодувом в 1720 г. А в 1771 г. шведский химик Карл Вильгельм Шееле получил неочищенную плавиковую кислоту при нагревании плавикового шпата с концентрированной серной кислотой в стеклянной реторте, которая в значительной степени корродировала под действием полученного продукта. Поэтому в дальнейших экспериментах использовались сосуды из металла. Почти безводная кислота была получена в 1809 году, а спустя два года французский физик Андре-Мари Ампер предположил, что это соединение водорода с неизвестным элементом, аналогичным хлору, для которого он предложил название фтор из греческого φθόριος, «разрушающий». Плавиковый шпат оказался фторидом кальция.
Выделение фтора оставалось одной из главных нерешенных проблем неорганической химии до 1886 года, когда французский химик Анри Муассан получил элемент электролизом раствора гидрофторида калия во фтороводороде. За это в 1906 году он получил Нобелевскую премию. Трудность в обращении с этим элементом и токсические свойства фтора способствовали медленному прогрессу в области химии этого элемента. Вплоть до Второй мировой войны он был лабораторной диковинкой. Затем, однако, использование гексафторида урана при разделении изотопов урана наряду с ростом промышленного значения органических соединений данного элемента, сделало его химикатом, который приносит значительную пользу.

Распространенность
Фторсодержащий плавиковый шпат (флюорит, CaF2) в течение многих столетий использовался в качестве флюса (очищающего средства) в металлургических процессах. Минерал впоследствии оказался источником элемента, который был также назван флуором. Бесцветные прозрачные кристаллы флюорита при освещении имеют синеватый оттенок. Это свойство известно под названием флуоресценции.
Фтор – элемент, который встречается в природе только в виде его химических соединений, за исключением чрезвычайно небольших количеств свободного элемента в плавиковом шпате, подвергшегося воздействию излучения радия. Содержание элемента в земной коре составляет около 0,065 %. Основными фторсодержащими минералами являются плавиковый шпат, криолит (Na3AlF6), фторапатит (Са5[PO4]3 [F, Cl]), топаз (Al2SiO4[F, OH]2) и лепидолит.

Физические и химические свойства фтора
При комнатной температуре фтор является газом бледно-желтого цвета с раздражающим запахом. Вдыхание его опасно. При охлаждении он становится желтой жидкостью. Существует только один стабильный изотоп этого химического элемента – фтор-19.
Первая энергия ионизации данного галогена очень высока (402 ккал/моль), что составляет стандартную теплоту образования катиона F+420 ккал/моль.
Небольшой размер атома элемента позволяет разместить их относительно большое количество вокруг центрального атома с образованием множества устойчивых комплексов, например, гексафторсиликата (SiF6)2- и гексафторалюмината (AlF6)3-. Фтор – элемент, который обладает наиболее сильными окисляющими свойствами. Ни одно другое вещество не способно окислить фторид-анион, чтобы он превратился в свободный элемент, и по этой причине элемент не находится в свободном состоянии в природе. Данная характеристика фтора на протяжении более 150 лет не позволяла получить его ни одним химическим методом. Это удалось только за счет использования электролиза. Тем не менее в 1986 г. американский химик Карл Крайст сообщил о первом «химическом» получении фтора. Он использовал K2MnF6 и пентафторид сурьмы (SbF5), которые могут быть получены из растворов HF.

Фтор: валентность и степень окисления
Внешняя оболочка галогенов содержит неспаренный электрон. Вот почему валентность фтора в соединениях равна единице. Однако атомы элементов группы VIIa могут увеличивать количество таких электронов до 7. Максимальная валентность фтора и его степень окисления равны -1. Элемент не способен расширить свою валентную оболочку, так как у его атома отсутствует d-орбиталь. Другие галогены благодаря ее наличию способны проявлять валентность вплоть до 7.
Высокая окислительная способность элемента позволяет достигать максимально возможной степени окисления в других элементах. Фтор (валентность I) может образовывать соединения, которых не существует ни у каких других галогенидов: дифторид серебра (AgF2), трифторид кобальта (CoF3), гептафторид рения (ReF7), пентафторид брома (BrF5) и гептафторид йода (IF7).

Соединения
Формула фтора (F2) составлена из двух атомов элемента. Он может вступать в соединения со всеми другими элементами, кроме гелия и неона, образуя ионные или ковалентные фториды. Некоторые металлы, такие как никель, быстро покрываются слоем этого галогена, что предотвращает дальнейшую связь металла с элементом. Некоторые сухие металлы, такие как мягкая сталь, медь, алюминий или монель (66 % никеля и 31,5 % сплава меди) при обычных температурах с фтором не реагируют. Для работы с элементом при температурах до 600 °C подходит монель; спеченный глинозем устойчив до 700 °C.
Фторуглеродные масла являются наиболее подходящими смазочными материалами. Элемент бурно реагирует с органическими веществами (например, резиной, деревом и тканями), поэтому контролируемое фторирование органических соединений элементарным фтором возможно только при принятии специальных мер предосторожности.
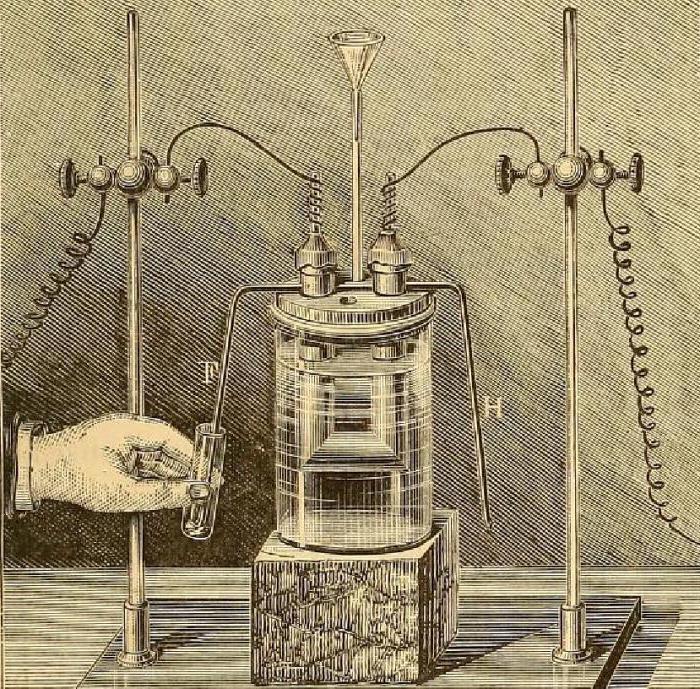
Производство
Плавиковый шпат является главным источником фтора. В производстве фтористого водорода (HF) порошкообразный флюорит перегоняют с концентрированной серной кислотой в свинцовом или чугунном аппарате. В ходе перегонки образуется сульфат кальция (CaSO4), нерастворимый в HF. Фтористый водород получают в достаточно безводном состоянии путем фракционной перегонки в медных или стальных сосудах и хранят в стальных баллонах. Обычными примесями в промышленном фтороводороде являются сернистая и серная кислоты, а также кремнефтористоводородная кислота (H2SiF6), образующиеся из-за наличия в плавиковом шпате кремнезема. Следы влаги могут быть удалены путем электролиза с использованием платиновых электродов, обработкой элементарным фтором или хранением над более сильной кислотой Льюиса (MF5, где М – металл), которая может образовывать соли (Н3О)+ (MF6)—: Н2О + SbF5 + HF → (Н3О)+ (SbF6)—.
Фтористый водород используют в приготовлении множества промышленных неорганических и органических соединениях фтора, например, натрийфторидалюминия (Na3AlF6), используемого в качестве электролита при выплавке металлического алюминия. Раствор газообразного фтористого водорода в воде называется плавиковой кислотой, большое количество которой применяется при очистке металлов и для полировки, придания матовости стеклу или для его травления.
Получение свободного элемента осуществляется с помощью электролитических процедур в отсутствие воды. Как правило, они имеют форму электролиза расплава фторида калия фторидом водорода (в соотношении 1 к 2,5-5) при температурах 30–70, 80–120 или 250 °C. Во время процесса содержание фтороводорода в электролите уменьшается, и температура плавления повышается. Поэтому необходимо, чтобы его добавление происходило непрерывно. В высокотемпературной камере электролит заменяется, когда температура превысит 300 °C. Фтор можно безопасно хранить под давлением в баллонах из нержавеющей стали, если клапаны цилиндров свободны от следов органических веществ.

Использование
Элемент используется для производства различных фторидов, таких как трифторид хлора (ClF3), гексафторид серы (SF6) или трифторид кобальта (CoF3). Соединения хлора и кобальта являются важными фторирующими агентами органических соединений. (При наличии соответствующих мер предосторожности для этого может быть использован непосредственно фтор). Гексафторид серы используется в качестве газообразного диэлектрика.
Элементарный фтор, часто разбавленный азотом, вступает в реакцию с углеводородами с образованием соответствующих фторуглеродов, в которых часть или весь водород замещается галогеном. Полученные соединения, как правило, характеризуются высокой стабильностью, химической инертностью, высоким электрическим сопротивлением, а также другими ценными физико-химическими свойствами.
Фторирование можно произвести также путем обработки органических соединений трифторидом кобальта (CoF3) или электролизом их растворов в безводном фтористом водороде. Полезные пластики с антипригарными свойствами, такие как политетрафторэтилен [(CF2CF2)х], известные под коммерческим названием тефлон, получают из ненасыщенных фторированных углеводородов.
Органические соединения, содержащие хлор, бром или йод, фторируют для получения таких веществ, как дихлордифторметан (Cl2CF2), хладагент, который широко применялся в бытовых холодильниках и кондиционерах. Так как хлорфторуглероды, такие как дихлордифторметан, играют активную роль в истощении озонового слоя, их производство и применение было ограничено, и теперь предпочтение отдается хладагентам, содержащим гидрофторуглероды.
Элемент также используется для получения гексафторида урана (UF6), используемого в газовом диффузионном процессе отделения урана-235 от урана-238 при производстве ядерного топлива. Фтороводород и трифторид бора (BF3) производятся в промышленных масштабах, так как они являются хорошими катализаторами для реакций алкилирования, применяемых для получения многих органических соединений. Фторид натрия обычно добавляют в питьевую воду для того, чтобы снизить заболеваемость кариесом зубов у детей. В последние годы наиболее важное значение приобрело применение соединений фтора в фармацевтической и сельскохозяйственной областях. Селективное замещение фтора резко изменяет биологические свойства веществ.

Анализ
Сложно точно определить количество данного галогена в соединениях. Свободный фтор, валентность которого равна 1, можно выявить по его окислению ртути Hg + F2 → HgF2, а также измеряя увеличения веса ртути и изменение объема газа. Основными качественными тестами на присутствие ионов элемента являются:
- выделение фтористого водорода под действием серной кислоты,
- образование осадка фторида кальция при добавлении раствора хлорида кальция,
- обесцвечивание желтого раствора тетраоксида титана (TiO4) и пероксида водорода в серной кислоте.
Количественные методы анализа:
- осаждение фторида кальция в присутствии карбоната натрия и обработка осадка с помощью уксусной кислоты,
- осаждение хлорфторида свинца путем добавления хлорида натрия и нитрата свинца,
- титрование (определение концентрации растворенного вещества) с раствором нитрата тория (Th [NO3]4) с использованием ализаринсульфоната натрия в качестве индикатора: Th(NO3)4 + 4KF ↔ ThF4 + 4KNO3.
Ковалентно связанный фтор (валентность I), как, например, в фторуглеродах, анализировать сложнее. Это требует соединения с металлическим натрием с последующим анализом ионов F—, как описано выше.
Свойства элемента
Напоследок приведем некоторые свойства фтора:
- Атомный номер: 9.
- Атомный вес: 18,9984.
- Возможные валентности фтора: 1.
- Температура плавления: -219,62 °C.
- Точка кипения: -188 °C.
- Плотность (1 атм, 0 °C): 1,696 г/л.
- Электронная формула фтора: 1s22s22p5.
fb.ru
валентность, химические свойства, характеристики :: SYL.ru
Где располагается в таблице Менделеева фтор? Валентность данного элемента равна одному, следовательно, он является типичным представителем седьмой группы главной подгруппы. Дадим краткую характеристику этому неметаллу, выявим его основные физические и химические свойства.
Страницы истории
Рассмотрим строение атома фтора, но сначала остановимся на истории его открытия. В начале шестнадцатого века немецкий врач и минералог Григорий Агрикола описал минерал, в составе которого содержался фтор. Валентность элемента тогда еще не была известна, поэтому сложно было предсказать его основные свойства.
В конце восемнадцатого века шведскому химику Карлу Шееле удалось синтезировать при нагревании в стеклянном сосуде концентрированной серной кислоты и плавикового шпата фтороводородное соединение. Полученное ученым вещество не вступало во взаимодействие с металлами, поэтому Шееле сделал вывод о незначительной химической активности плавиковой кислоты.
В безводном виде она была получена только в начале девятнадцатого века, но никому не удавалось выделить из соединения чистый фтор. Валентность данного неметалла долгое время оставалась для химиков настоящей загадкой.
Только в 1886 году Муассану удалось путем электролиза водного раствора гидрофторида кальция выделить чистый фтор. Валентность неметалла он так и не определил, но за свое исследование был удостоен Нобелевской премии в области химии (1906 год).
Из-за токсических свойств, выявленных у данного химического элемента, его изучение было достаточно продолжительным. Только после Второй мировой войны фтор стали получать путем промышленной переработки фторидов.
Нахождение в природе
Молекула фтора не встречается в природе в чистом виде. Среди самых распространенных соединений фтора отметим плавиковый шпат. Именно флюорит на протяжении нескольких столетий применяли в качестве очищающего компонента в металлургическом производстве. Исследователям удалось определить, что минерал, используемый для выделения фтора, обладает свойством флуоресценции, то есть способностью давать синеватый цвет при дополнительном освещении.
Формула фтора была определена значительно позже, причиной стала его незначительная распространенность в земной коре (не больше 0,065 процента). В качестве основных соединений можно рассмотреть топаз, криолит, а также лепидолит.

Особенности свойств
Данный неметалл при обычных условиях является бледно-желтым газом, имеющим раздражающий запах. Вдыхание фтора опасно для человека, поэтому так долго не было достоверной информации о физических характеристиках этого галогена. В ходе исследований был выявлен один стабильный изотоп этого элемента, имеющий вид – фтор-19. Специфическое строение атома фтора объясняет его способность размещать вокруг атома устойчивые комплексы. Например, выявлены гексафторсиликаты и гексафтоалюминаты, причем фтор проявляет свои сильные окислительные свойства.
Ни у какого другого неметалла, располагающегося в таблице Менделеева, нет такой способности к образованию анионов. Именно по этой причине фтор не встречается в природе в чистом виде. Только в конце двадцатого века американскому химику Карлу Крайсту удалось осуществить получение фтора. Для этого он провел электролиз раствора пентафторида сурьмы.
Химические свойства фтора основываются на его способности к присоединению электрона от других элементов. Имея на внешнем уровне семь валентных электронов, он проявляет степень окисления -1.
Основные химические свойства фтора можно объяснить особенностями строения его атома. У данного элемента нет свободной d-орбитали, как у хлора, поэтому для него не характерны положительные значения степеней окисления.
Благодаря высокой окислительной способности данного элемента, он образует соединения, нехарактерные для иных галогенидов: трифторид кобальта, дифторид серебра, гептафторид рения, гептафторид йода.

Типичные соединения
Основная масса фтора находится в виде различных соединений, имеющих практическое значение. Например, фторуглеродные масла считают оптимальными смазочными материалами. Фтор легко вступает во взаимодействие с деревом, резиной, тканями, что нашло применение во фторировании органических веществ. При этом важно соблюдать предосторожность, чтобы не ощутить на себе токсического действия данного элемента.
Производство
Получение фтора основывается на переработке плавикового шпата. Изготовление фтороводорода сопровождается перегонкой порошкообразного флюорита с концентрированной серной кислотой. Данный процесс осуществляется в чугунном или свинцовом аппарате. После перегонки образуется сульфат кальция, не способный растворяться во фтороводороде. Для получения HF используют фракционную перегонку в стальных или медных сосудах. Фтороводород хранят в стальных емкостях.
В качестве основных примесей, содержащихся в данном соединении, отметим серную, сернистую и кремнефтористоводородную кислоту. Они образуются из-за наличия кремнезема в плавиковом шпате. Для удаления из реакционной смеси следов влаги, проводят электролиз на платиновых электродах. Готовая формула фтора хранится над сильной кислотой Льюиса, способной образовывать соли.

Востребованность HF
Фтористый водород востребован в производстве разных органических и неорганических соединений фтора. К примеру, с его помощью образуется Na3AlF6, применяемый в качестве электролита в процессе выплавки алюминия. Плавиковая кислота, являющаяся раствором HF, в больших количествах нужна для очистки металлов и полировки. Она придает стеклу матовый цвет, необходима для травления.
Чистый фтор можно размещать в стальных баллонах под давлением только в том случае, если на клапанах нет органических веществ.

Фториды
Рассматриваемый химический элемент применяют при производстве разных фторидов, например, трифторида кобальта, гексафторида серы. Именно эти соединения являются востребованными фторирующими агентами органических веществ. Гексафторид серы нашел применение в качестве газообразного диэлектрика.
Элементарный фтор в смеси с азотом способен реагировать с углеводородами. В качестве продукта реакции образуется определенный фтороуглерод, где водород в полной мере или частично замещен галогеном. Образующиеся соединения отличаются высокой стабильностью, отличным электрическим сопротивлением, а также химической инертностью.

Особенности фторирования
Осуществить это процесс можно с помощью обработки органического соединения трифторидом кобальта, а также путем электролиза его водного раствора. Тефлон, хорошо знакомый российским хозяйкам, известен в химии в качестве политетрафторэтилена, получаемого при галогенировании непредельных углеводородов.
В кондиционерах и холодильниках используют специальный хладагент (дихлордифтометан). В связи с тем, что подобные реагенты оказывали негативное воздействие на атмосферу, способствовали истощению озонового слоя, постепенно их производство было ограничено. В настоящее время их заменили хладагенты, которые в своем составе имеют гидрофторуглероды.

Заключение
Фтор проявляет самые сильные окислительные свойства из всех представителей подгруппы галогенов. Он имеет небольшой радиус атома, а значит, ему гораздо проще принимать один электрон, поэтому фтор используют для получения фторидов.
Например, гексафторид урана применяют при газовом диффузионном процессе выделения урана-235 из 238, что характерно для производства ядерного топлива. Трифторид бора и фтороводород производят в больших объемах, поскольку эти компоненты являются отличными катализаторами для алкилирования, они востребованы в производстве органических соединений. Например, при добавлении в питьевую воду фторида натрия, можно снизить заболеваемость кариесом.
В настоящее время особое значение получило применение фтора в сельскохозяйственной и фармацевтической промышленности. Например, при количественном осаждении фторида кальция, его последующей обработке уксусной кислотой можно вычислить содержание данного элемента и использовать полученные результаты для количественного анализа.
Благодаря современным методам качественного и количественного анализа, широко применяемым в аналитической химии, стало возможным использование разнообразных соединений фтора. Именно этот представитель подгруппы галогенов является одним из самых востребованных элементов в органической и в неорганической химии.
www.syl.ru
Химический элемент фтор: валентность, свойства, характеристика
Фтор (F) – наиболее реактивный химический элемент и самый легкий галоген группы 17 (VIIa) периодической таблицы. Данная характеристика фтора объясняется его способностью привлекать электроны (это самый электроотрицательный элемент) и небольшим размером его атомов.
История открытия
Фторсодержащий минерал плавиковый шпат был описан в 1529 году немецким врачом и минералогом Георгием Агриколой. Вероятно, что плавиковая кислота была впервые получена неизвестным английским стеклодувом в 1720 г. А в 1771 г. шведский химик Карл Вильгельм Шееле получил неочищенную плавиковую кислоту при нагревании плавикового шпата с концентрированной серной кислотой в стеклянной реторте, которая в значительной степени корродировала под действием полученного продукта. Поэтому в дальнейших экспериментах использовались сосуды из металла. Почти безводная кислота была получена в 1809 году, а спустя два года французский физик Андре-Мари Ампер предположил, что это соединение водорода с неизвестным элементом, аналогичным хлору, для которого он предложил название фтор из греческого φθόριος, «разрушающий». Плавиковый шпат оказался фторидом кальция.
Выделение фтора оставалось одной из главных нерешенных проблем неорганической химии до 1886 года, когда французский химик Анри Муассан получил элемент электролизом раствора гидрофторида калия во фтороводороде. За это в 1906 году он получил Нобелевскую премию. Трудность в обращении с этим элементом и токсические свойства фтора способствовали медленному прогрессу в области химии этого элемента. Вплоть до Второй мировой войны он был лабораторной диковинкой. Затем, однако, использование гексафторида урана при разделении изотопов урана наряду с ростом промышленного значения органических соединений данного элемента, сделало его химикатом, который приносит значительную пользу.

Распространенность
Фторсодержащий плавиковый шпат (флюорит, CaF2) в течение многих столетий использовался в качестве флюса (очищающего средства) в металлургических процессах. Минерал впоследствии оказался источником элемента, который был также назван флуором. Бесцветные прозрачные кристаллы флюорита при освещении имеют синеватый оттенок. Это свойство известно под названием флуоресценции.
Фтор – элемент, который встречается в природе только в виде его химических соединений, за исключением чрезвычайно небольших количеств свободного элемента в плавиковом шпате, подвергшегося воздействию излучения радия. Содержание элемента в земной коре составляет около 0,065 %. Основными фторсодержащими минералами являются плавиковый шпат, криолит (Na3AlF6), фторапатит (Са5[PO4]3 [F, Cl]), топаз (Al2SiO4[F, OH]2) и лепидолит.

Физические и химические свойства фтора
При комнатной температуре фтор является газом бледно-желтого цвета с раздражающим запахом. Вдыхание его опасно. При охлаждении он становится желтой жидкостью. Существует только один стабильный изотоп этого химического элемента – фтор-19.
Первая энергия ионизации данного галогена очень высока (402 ккал/моль), что составляет стандартную теплоту образования катиона F+420 ккал/моль.
Небольшой размер атома элемента позволяет разместить их относительно большое количество вокруг центрального атома с образованием множества устойчивых комплексов, например, гексафторсиликата (SiF6)2- и гексафторалюмината (AlF6)3-. Фтор – элемент, который обладает наиболее сильными окисляющими свойствами. Ни одно другое вещество не способно окислить фторид-анион, чтобы он превратился в свободный элемент, и по этой причине элемент не находится в свободном состоянии в природе. Данная характеристика фтора на протяжении более 150 лет не позволяла получить его ни одним химическим методом. Это удалось только за счет использования электролиза. Тем не менее в 1986 г. американский химик Карл Крайст сообщил о первом «химическом» получении фтора. Он использовал K2MnF6 и пентафторид сурьмы (SbF5), которые могут быть получены из растворов HF.

Фтор: валентность и степень окисления
Внешняя оболочка галогенов содержит неспаренный электрон. Вот почему валентность фтора в соединениях равна единице. Однако атомы элементов группы VIIa могут увеличивать количество таких электронов до 7. Максимальная валентность фтора и его степень окисления равны -1. Элемент не способен расширить свою валентную оболочку, так как у его атома отсутствует d-орбиталь. Другие галогены благодаря ее наличию способны проявлять валентность вплоть до 7.
Высокая окислительная способность элемента позволяет достигать максимально возможной степени окисления в других элементах. Фтор (валентность I) может образовывать соединения, которых не существует ни у каких других галогенидов: дифторид серебра (AgF2), трифторид кобальта (CoF3), гептафторид рения (ReF7), пентафторид брома (BrF5) и гептафторид йода (IF7).

Соединения
Формула фтора (F2) составлена из двух атомов элемента. Он может вступать в соединения со всеми другими элементами, кроме гелия и неона, образуя ионные или ковалентные фториды. Некоторые металлы, такие как никель, быстро покрываются слоем этого галогена, что предотвращает дальнейшую связь металла с элементом. Некоторые сухие металлы, такие как мягкая сталь, медь, алюминий или монель (66 % никеля и 31,5 % сплава меди) при обычных температурах с фтором не реагируют. Для работы с элементом при температурах до 600 °C подходит монель; спеченный глинозем устойчив до 700 °C.
Фторуглеродные масла являются наиболее подходящими смазочными материалами. Элемент бурно реагирует с органическими веществами (например, резиной, деревом и тканями), поэтому контролируемое фторирование органических соединений элементарным фтором возможно только при принятии специальных мер предосторожности.

Производство
Плавиковый шпат является главным источником фтора. В производстве фтористого водорода (HF) порошкообразный флюорит перегоняют с концентрированной серной кислотой в свинцовом или чугунном аппарате. В ходе перегонки образуется сульфат кальция (CaSO4), нерастворимый в HF. Фтористый водород получают в достаточно безводном состоянии путем фракционной перегонки в медных или стальных сосудах и хранят в стальных баллонах. Обычными примесями в промышленном фтороводороде являются сернистая и серная кислоты, а также кремнефтористоводородная кислота (H2SiF6), образующиеся из-за наличия в плавиковом шпате кремнезема. Следы влаги могут быть удалены путем электролиза с использованием платиновых электродов, обработкой элементарным фтором или хранением над более сильной кислотой Льюиса (MF5, где М – металл), которая может образовывать соли (Н3О)+ (MF6)—: Н2О + SbF5 + HF → (Н3О)+ (SbF6)—.
Фтористый водород используют в приготовлении множества промышленных неорганических и органических соединениях фтора, например, натрийфторидалюминия (Na3AlF6), используемого в качестве электролита при выплавке металлического алюминия. Раствор газообразного фтористого водорода в воде называется плавиковой кислотой, большое количество которой применяется при очистке металлов и для полировки, придания матовости стеклу или для его травления.
Получение свободного элемента осуществляется с помощью электролитических процедур в отсутствие воды. Как правило, они имеют форму электролиза расплава фторида калия фторидом водорода (в соотношении 1 к 2,5-5) при температурах 30–70, 80–120 или 250 °C. Во время процесса содержание фтороводорода в электролите уменьшается, и температура плавления повышается. Поэтому необходимо, чтобы его добавление происходило непрерывно. В высокотемпературной камере электролит заменяется, когда температура превысит 300 °C. Фтор можно безопасно хранить под давлением в баллонах из нержавеющей стали, если клапаны цилиндров свободны от следов органических веществ.

Использование
Элемент используется для производства различных фторидов, таких как трифторид хлора (ClF3), гексафторид серы (SF6) или трифторид кобальта (CoF3). Соединения хлора и кобальта являются важными фторирующими агентами органических соединений. (При наличии соответствующих мер предосторожности для этого может быть использован непосредственно фтор). Гексафторид серы используется в качестве газообразного диэлектрика.
Элементарный фтор, часто разбавленный азотом, вступает в реакцию с углеводородами с образованием соответствующих фторуглеродов, в которых часть или весь водород замещается галогеном. Полученные соединения, как правило, характеризуются высокой стабильностью, химической инертностью, высоким электрическим сопротивлением, а также другими ценными физико-химическими свойствами.
Фторирование можно произвести также путем обработки органических соединений трифторидом кобальта (CoF3) или электролизом их растворов в безводном фтористом водороде. Полезные пластики с антипригарными свойствами, такие как политетрафторэтилен [(CF2CF2)х], известные под коммерческим названием тефлон, получают из ненасыщенных фторированных углеводородов.
Органические соединения, содержащие хлор, бром или йод, фторируют для получения таких веществ, как дихлордифторметан (Cl2CF2), хладагент, который широко применялся в бытовых холодильниках и кондиционерах. Так как хлорфторуглероды, такие как дихлордифторметан, играют активную роль в истощении озонового слоя, их производство и применение было ограничено, и теперь предпочтение отдается хладагентам, содержащим гидрофторуглероды.
Элемент также используется для получения гексафторида урана (UF6), используемого в газовом диффузионном процессе отделения урана-235 от урана-238 при производстве ядерного топлива. Фтороводород и трифторид бора (BF3) производятся в промышленных масштабах, так как они являются хорошими катализаторами для реакций алкилирования, применяемых для получения многих органических соединений. Фторид натрия обычно добавляют в питьевую воду для того, чтобы снизить заболеваемость кариесом зубов у детей. В последние годы наиболее важное значение приобрело применение соединений фтора в фармацевтической и сельскохозяйственной областях. Селективное замещение фтора резко изменяет биологические свойства веществ.

Анализ
Сложно точно определить количество данного галогена в соединениях. Свободный фтор, валентность которого равна 1, можно выявить по его окислению ртути Hg + F2 → HgF2, а также измеряя увеличения веса ртути и изменение объема газа. Основными качественными тестами на присутствие ионов элемента являются:
- выделение фтористого водорода под действием серной кислоты,
- образование осадка фторида кальция при добавлении раствора хлорида кальция,
- обесцвечивание желтого раствора тетраоксида титана (TiO4) и пероксида водорода в серной кислоте.
Количественные методы анализа:
- осаждение фторида кальция в присутствии карбоната натрия и обработка осадка с помощью уксусной кислоты,
- осаждение хлорфторида свинца путем добавления хлорида натрия и нитрата свинца,
- титрование (определение концентрации растворенного вещества) с раствором нитрата тория (Th [NO3]4) с использованием ализаринсульфоната натрия в качестве индикатора: Th(NO3)4 + 4KF ↔ ThF4 + 4KNO3.
Ковалентно связанный фтор (валентность I), как, например, в фторуглеродах, анализировать сложнее. Это требует соединения с металлическим натрием с последующим анализом ионов F—, как описано выше.
Свойства элемента
Напоследок приведем некоторые свойства фтора:
- Атомный номер: 9.
- Атомный вес: 18,9984.
- Возможные валентности фтора: 1.
- Температура плавления: -219,62 °C.
- Точка кипения: -188 °C.
- Плотность (1 атм, 0 °C): 1,696 г/л.
- Электронная формула фтора: 1s22s22p5.
autogear.ru
Химический элемент фтор: валентность, свойства, характеристика
Образование 8 июля 2016Фтор (F) – наиболее реактивный химический элемент и самый легкий галоген группы 17 (VIIa) периодической таблицы. Данная характеристика фтора объясняется его способностью привлекать электроны (это самый электроотрицательный элемент) и небольшим размером его атомов.
История открытия
Фторсодержащий минерал плавиковый шпат был описан в 1529 году немецким врачом и минералогом Георгием Агриколой. Вероятно, что плавиковая кислота была впервые получена неизвестным английским стеклодувом в 1720 г. А в 1771 г. шведский химик Карл Вильгельм Шееле получил неочищенную плавиковую кислоту при нагревании плавикового шпата с концентрированной серной кислотой в стеклянной реторте, которая в значительной степени корродировала под действием полученного продукта. Поэтому в дальнейших экспериментах использовались сосуды из металла. Почти безводная кислота была получена в 1809 году, а спустя два года французский физик Андре-Мари Ампер предположил, что это соединение водорода с неизвестным элементом, аналогичным хлору, для которого он предложил название фтор из греческого φθόριος, «разрушающий». Плавиковый шпат оказался фторидом кальция.
Выделение фтора оставалось одной из главных нерешенных проблем неорганической химии до 1886 года, когда французский химик Анри Муассан получил элемент электролизом раствора гидрофторида калия во фтороводороде. За это в 1906 году он получил Нобелевскую премию. Трудность в обращении с этим элементом и токсические свойства фтора способствовали медленному прогрессу в области химии этого элемента. Вплоть до Второй мировой войны он был лабораторной диковинкой. Затем, однако, использование гексафторида урана при разделении изотопов урана наряду с ростом промышленного значения органических соединений данного элемента, сделало его химикатом, который приносит значительную пользу.
Распространенность
Фторсодержащий плавиковый шпат (флюорит, CaF 2) в течение многих столетий использовался в качестве флюса (очищающего средства) в металлургических процессах. Минерал впоследствии оказался источником элемента, который был также назван флуором. Бесцветные прозрачные кристаллы флюорита при освещении имеют синеватый оттенок. Это свойство известно под названием флуоресценции.
Фтор – элемент, который встречается в природе только в виде его химических соединений, за исключением чрезвычайно небольших количеств свободного элемента в плавиковом шпате, подвергшегося воздействию излучения радия. Содержание элемента в земной коре составляет около 0,065 %. Основными фторсодержащими минералами являются плавиковый шпат, криолит (Na3AlF6), фторапатит (Са5[PO4]3 [F, Cl]), топаз (Al2SiO4[F, OH]2) и лепидолит.
Физические и химические свойства фтора
При комнатной температуре фтор является газом бледно-желтого цвета с раздражающим запахом. Вдыхание его опасно. При охлаждении он становится желтой жидкостью. Существует только один стабильный изотоп этого химического элемента – фтор-19.
Первая энергия ионизации данного галогена очень высока (402 ккал/моль), что составляет стандартную теплоту образования катиона F+420 ккал/моль.
Небольшой размер атома элемента позволяет разместить их относительно большое количество вокруг центрального атома с образованием множества устойчивых комплексов, например, гексафторсиликата (SiF6)2- и гексафторалюмината (AlF6)3-. Фтор – элемент, который обладает наиболее сильными окисляющими свойствами. Ни одно другое вещество не способно окислить фторид-анион, чтобы он превратился в свободный элемент, и по этой причине элемент не находится в свободном состоянии в природе. Данная характеристика фтора на протяжении более 150 лет не позволяла получить его ни одним химическим методом. Это удалось только за счет использования электролиза. Тем не менее в 1986 г. американский химик Карл Крайст сообщил о первом «химическом» получении фтора. Он использовал K 2MnF6 и пентафторид сурьмы (SbF5), которые могут быть получены из растворов HF.
Фтор: валентность и степень окисления
Внешняя оболочка галогенов содержит неспаренный электрон. Вот почему валентность фтора в соединениях равна единице. Однако атомы элементов группы VIIa могут увеличивать количество таких электронов до 7. Максимальная валентность фтора и его степень окисления равны -1. Элемент не способен расширить свою валентную оболочку, так как у его атома отсутствует d-орбиталь. Другие галогены благодаря ее наличию способны проявлять валентность вплоть до 7.
Высокая окислительная способность элемента позволяет достигать максимально возможной степени окисления в других элементах. Фтор (валентность I) может образовывать соединения, которых не существует ни у каких других галогенидов: дифторид серебра (AgF
Соединения
Формула фтора (F2) составлена из двух атомов элемента. Он может вступать в соединения со всеми другими элементами, кроме гелия и неона, образуя ионные или ковалентные фториды. Некоторые металлы, такие как никель, быстро покрываются слоем этого галогена, что предотвращает дальнейшую связь металла с элементом. Некоторые сухие металлы, такие как мягкая сталь, медь, алюминий или монель (66 % никеля и 31,5 % сплава меди) при обычных температурах с фтором не реагируют. Для работы с элементом при температурах до 600 °C подходит монель; спеченный глинозем устойчив до 700 °C.
Фторуглеродные масла являются наиболее подходящими смазочными материалами. Элемент бурно реагирует с органическими веществами (например, резиной, деревом и тканями), поэтому контролируемое фторирование органических соединений элементарным фтором возможно только при принятии специальных мер предосторожности.
Производство
Плавиковый шпат является главным источником фтора. В производстве фтористого водорода (HF) порошкообразный флюорит перегоняют с концентрированной серной кислотой в свинцовом или чугунном аппарате. В ходе перегонки образуется сульфат кальция (CaSO4), нерастворимый в HF. Фтористый водород получают в достаточно безводном состоянии путем фракционной перегонки в медных или стальных сосудах и хранят в стальных баллонах. Обычными примесями в промышленном фтороводороде являются сернистая и серная кислоты, а также кремнефтористоводородная кислота (H2SiF6), образующиеся из-за наличия в плавиковом шпате кремнезема. Следы влаги могут быть удалены путем электролиза с использованием платиновых электродов, обработкой элементарным фтором или хранением над более сильной кислотой Льюиса (MF5
Фтористый водород используют в приготовлении множества промышленных неорганических и органических соединениях фтора, например, натрийфторидалюминия (Na3AlF6), используемого в качестве электролита при выплавке металлического алюминия. Раствор газообразного фтористого водорода в воде называется плавиковой кислотой, большое количество которой применяется при очистке металлов и для полировки, придания матовости стеклу или для его травления.
Получение свободного элемента осуществляется с помощью электролитических процедур в отсутствие воды. Как правило, они имеют форму электролиза расплава фторида калия фторидом водорода (в соотношении 1 к 2,5-5) при температурах 30–70, 80–120 или 250 °C. Во время процесса содержание фтороводорода в электролите уменьшается, и температура плавления повышается. Поэтому необходимо, чтобы его добавление происходило непрерывно. В высокотемпературной камере электролит заменяется, когда температура превысит 300 °C. Фтор можно безопасно хранить под давлением в баллонах из нержавеющей стали, если клапаны цилиндров свободны от следов органических веществ.
Использование
Элемент используется для производства различных фторидов, таких как трифторид хлора (ClF3), гексафторид серы (SF6) или трифторид кобальта (CoF3). Соединения хлора и кобальта являются важными фторирующими агентами органических соединений. (При наличии соответствующих мер предосторожности для этого может быть использован непосредственно фтор). Гексафторид серы используется в качестве газообразного диэлектрика.
Элементарный фтор, часто разбавленный азотом, вступает в реакцию с углеводородами с образованием соответствующих фторуглеродов, в которых часть или весь водород замещается галогеном. Полученные соединения, как правило, характеризуются высокой стабильностью, химической инертностью, высоким электрическим сопротивлением, а также другими ценными физико-химическими свойствами.
Фторирование можно произвести также путем обработки органических соединений трифторидом кобальта (CoF3) или электролизом их растворов в безводном фтористом водороде. Полезные пластики с антипригарными свойствами, такие как политетрафторэтилен [(CF2CF2)х], известные под коммерческим названием тефлон, получают из ненасыщенных фторированных углеводородов.
Органические соединения, содержащие хлор, бром или йод, фторируют для получения таких веществ, как дихлордифторметан (Cl2CF2), хладагент, который широко применялся в бытовых холодильниках и кондиционерах. Так как хлорфторуглероды, такие как дихлордифторметан, играют активную роль в истощении озонового слоя, их производство и применение было ограничено, и теперь предпочтение отдается хладагентам, содержащим гидрофторуглероды.
Элемент также используется для получения гексафторида урана (UF6), используемого в газовом диффузионном процессе отделения урана-235 от урана-238 при производстве ядерного топлива. Фтороводород и трифторид бора (BF3) производятся в промышленных масштабах, так как они являются хорошими катализаторами для реакций алкилирования, применяемых для получения многих органических соединений. Фторид натрия обычно добавляют в питьевую воду для того, чтобы снизить заболеваемость кариесом зубов у детей. В последние годы наиболее важное значение приобрело применение соединений фтора в фармацевтической и сельскохозяйственной областях. Селективное замещение фтора резко изменяет биологические свойства веществ.
Анализ
Сложно точно определить количество данного галогена в соединениях. Свободный фтор, валентность которого равна 1, можно выявить по его окислению ртути Hg + F2 → HgF
- выделение фтористого водорода под действием серной кислоты,
- образование осадка фторида кальция при добавлении раствора хлорида кальция,
- обесцвечивание желтого раствора тетраоксида титана (TiO4) и пероксида водорода в серной кислоте.
Количественные методы анализа:
- осаждение фторида кальция в присутствии карбоната натрия и обработка осадка с помощью уксусной кислоты,
- осаждение хлорфторида свинца путем добавления хлорида натрия и нитрата свинца,
- титрование (определение концентрации растворенного вещества) с раствором нитрата тория (Th [NO3]4) с использованием ализаринсульфоната натрия в качестве индикатора: Th(NO3)4 + 4KF ↔ ThF4 + 4KNO3.
Ковалентно связанный фтор (валентность I), как, например, в фторуглеродах, анализировать сложнее. Это требует соединения с металлическим натрием с последующим анализом ионов F—, как описано выше.
Свойства элемента
Напоследок приведем некоторые свойства фтора:
- Атомный номер: 9.
- Атомный вес: 18,9984.
- Возможные валентности фтора: 1.
- Температура плавления: -219,62 °C.
- Точка кипения: -188 °C.
- Плотность (1 атм, 0 °C): 1,696 г/л.
- Электронная формула фтора: 1s22s22p5.
Источник: fb.ru
monateka.com
Валентные возможности фтора
Фтор — химический элемент, расположенный во втором периоде в VIIA группе Периодической таблицы Д.И. Менделеева. Обозначение – F. Неметалл (входит в группу галогенов), относится к элементам р-семейства. Порядковый номер – 9, значит заряд ядра атома равен (+169 В ядре атома фтора содержится 9 протонов и 10 нейтронов (массовое число равно 19). В атоме фтора есть два энергетических уровня, на которых находятся 9 электронов. Электронная конфигурация основного состояния фтора имеет вид:
.
На внешнем энергетическом уровне фтора находится 7 электронов (валентные, т.е. участвуют в образовании химических связей), из которых всего один неспаренный. Этим обусловлены валентные возможности фтора: до завершения внешнего энергетического уровня этому элементу не хватает всего одного электрона, поэтому он способен в химических реакциях выступать только в качестве акцептора электронов, т.е. принимать электрон от других атомов
.
Валентность фтора постоянна и равна I, степень окисления фтора равна (1). Возбужденных состояний в атоме фтора не наблюдается.
В свободном состоянии фтор представляет собой газ бледно-зеленоватого цвета или жидкость светло-желтого цвета. Явление аллотропии для него не свойственно. Температура плавления равна (), кипения – ().
Ядовит. В малых концентрациях запах фтора напоминает запах озона и хлора одновременно.
Молекула фтора двухатомна . Обладает самой низкой поляризуемостью среди галогенов.
Фтор неограниченно растворяется в воде; 40%-й раствор фтора в воде называют плавиковой кислотой (слабая кислота), а более разбавленные растворы — фтороводородной кислотой. Нейтрализуется щелочами.
ru.solverbook.com
Иод, Фтор, Хлор валентность — Справочник химика 21
Какие валентные состояния характерны для фтора, хлора, брома, йода и астатина Дайте развернутое объяснение с учетом особенностей строения их атомов. [c.9]При образовании связей с менее электроотрицательными атомами (для фтора это — все элементы, для хлора — все, кроме фтора и кислорода) валентность всех галогенов равна . Степень окисления -1 и заряд иона 1-. Положительные степени окисления невозможны для фтора. Хлор же проявляет различные положительные степени окисления вплоть до +7 (номер группы). Примеры соединений приведены в Справочной части. [c.75]
Если сравнить расположение электронов по орбиталям в атомах фтора, хлора и других галогенов, то можно судить и об их отличительных свойствах. У атома фтора свободных орбиталей нет. Поэтому атомы фтора могут проявить только валентность I и степень окисления — 1. В атомах других галогенов, например в атоме хлора, на том же энергетическом уровне имеются свободные d-орбитали [c.125]
В то же время сера — аналог кислорода — проявляет переменную валентность 2, 4, 6 хлор — налог фтора проявляет валентность 1, 3, 5, 7. Это объясняется наличием свободных ( -ячеек в третьем энергетическом уровне [c.45]
Изучение фтора, хлора, брома и йода показывает, что эти элементы по химическим свойствам сходны между собой. Все четыре элемента — типичные неметаллы, очень активные, поэтому в природе в свободном состоянии не встречаются. В химических соединениях они проявляют одинаковую валентность и их соединения с одним и тем же элементом проявляют сходные свойства. [c.94]
Как пользоваться таблицами 22, 23, 24 и 25 Помеш,ен-ный в них учебный материал не предназначен для простого заучивания. Руководствуясь им, вы должны повторить и обобщить самое важное, самое существенное об элементах, расположенных в группах периодической системы, о их соединениях, свойствах и применении. Например, следует только взглянуть на схемы распределения электронов по орбиталям фтора F и хлора С1 (табл. 25) — и вы вспомните их общие и отличительные химические свойства. Из этих схем видно, что в атомах фтора и хлора в нормальном состоянии имеется по одному неспаренному электрону. Этим и объясняются общие свойства этих элементов фтор, хлор и другие галогены в свободном состоянии образуют двухатомные молекулы — Рз, I2, Вг2, Ь — и проявляют валентность I в соединениях же с металлами и водородом — [c.125]
Исходя из строения атомов галогенов, указать, какие валентные состояния характерны для фтора, хлора, брома и иода. Какие степени окисленности проявляют галогены в своих соединениях [c.221]
Особенности химии фтора. Как и в других группах системы, химия типических элементов — фтора и хлора — имеет целый ряд особенностей. Наиболее ярко это проявляется у фтора. Специфика поведения фтора по сравнению с другими галогенами связана не только с наименьшим радиусом, наибольшими потенциалом ионизации и ОЭО атомов фтора. Главное, что определяет особенности химии фтора,— ограниченные валентные возможности и степени окисления фтора. Атом фтора не располагает -орбиталями, а промотирование электронов на орбитали с главным квантовым числом 3 для него энергетически невыгодно. В результате в химии фтора представлены только две степени окисления Ои — 1. Отсюда следует, что фтор только окислитель, а восстановителем быть не может. Поэтому для фтора неизвестны соединения с положительной сте- [c.350]
Общие сведения. Элементы главной подгруппы V группы — азот, фосфор, мышьяк, сурьма и висмут — в своих кислородных соединениях максимально пятивалентны, по отношению же к водороду они бывают исключи, тельно трехвалентными. Большинство этих элементов пятивалентны также и в отношении других электроотрицательных элементов, прежде всего фтора, хлора, брома и серы. Однако наряду с валентностью пять они всегда проявляют но отношению к ним и валентность три. [c.560]
Электронные конфигурации внешнего валентного слоя галогенов относятся к типу ns np (л = 2, 3, 4 и 5 соответственно у фтора, хлора, брома и иода). Такие электронные конфигурации обусловливают типичные окислительные свойства галогенов — способностью присоединять электроны обладают все галогены, хотя при переходе к иоду окислительная способность галогенов ослабляется. [c.179]
При этом валентная группа каждого атома включает более восьми электронов. В случае фтора расширение валентной группы невозможно, так как фтор в отличие от хлора и др. не имеет незанятых орбит с достаточно низкой энергией. Другой фактор может быть обусловлен тем, что в маленькой молекуле Fa отталкивание неподеленных электронных пар гораздо больше, чем в больших молекулах I2, Вга, 12- [c.141]
В первом разделе данной главы описаны некоторые свойства водорода, углерода, азота, фосфора, мышьяка, сурьмы, (висмута, кислорода, серы, селена, теллура, фтора, хлора, брома и иода. Последующие разделы посвящены их. соединениям между собой, в частности соединениям, в которых они проявляют нормальную валентность и связаны одинарными связями. Соединения неметаллических элементов с кислородом рассмотрены в следующей главе. [c.172]
VII группа. Галогены. К ней относятся элементы главной подгруппы — фтор, хлор, бром, иод, а также нестабильный элемент астат. Все галогены реакционно способны, поскольку во внешней электронной оболочке у них находится семь валентных электронов, и для получения устойчивого одноотрицательного иона достаточно присоединить один электрон. Это обстоятельство характеризует галогены как типичные неметаллы со степенью окисленности —1. [c.38]
Водородные соединения галогенов. Галогены, соединяясь с водородом, образуют вещества однотипного состава HF, НС1, НВг, HI. Состав этих веществ может быть выражен общей формулой НаШ, где под Hai подразумевается один из галогенов — фтор, хлор, бром, иод, астат. Соединения галогенов с водородом— газы, обладающие резким запахом, дымящие на воздухе. Они отличаются большой растворимостью в воде, при этом образуются кислоты с общей формулой НаШ, сходные по свойствам. По мере повышения зарядов ядер атомов галогенов растет количество промежуточных электронных слоев между ядром атома и его внешним электронным слоем. При этом уменьшается сила связи валентных электронов с ядром атома (уменьшается электроотрицательность с 4,1 у фтора к 2,2 у иода). [c.274]
Известно, что атом водорода, теряя свой единственный электрон, превращается в протон Н , лишенный электронной оболочки. Поэтому он легко притягивается электронными слоями других атомов или ионов, внедряется в электронные оболочки
www.chem21.info
Одинаковы ли валентные возможности фтора и хлора
Фтор — химический элемент, расположенный во втором периоде в VIIA группе Периодической таблицы Д.И. Менделеева. Обозначение – F. Неметалл (входит в группу галогенов), относится к элементам р-семейства. Порядковый номер – 9, значит заряд ядра атома равен (+169 В ядре атома фтора содержится 9 протонов и 10 нейтронов (массовое число равно 19). В атоме фтора есть два энергетических уровня, на которых находятся 9 электронов. Электронная конфигурация основного состояния фтора имеет вид:
.
На внешнем энергетическом уровне фтора находится 7 электронов (валентные, т.е. участвуют в образовании химических связей), из которых всего один неспаренный. Возбужденных состояний в атоме фтора не наблюдается.
Валентность фтора постоянна и равна I.
Хлор — химический элемент, расположенный в третьем периоде в VIIA группе Периодической таблицы Д.И. Менделеева. Обозначение – Cl. Неметалл (входит в группу галогенов), относится к элементам р-семейства. Порядковый номер – 17, значит заряд ядра атома равен (+17). В ядре атома хлора содержится 17 протонов и 18 нейтронов (массовое число равно 35). В атоме хлора есть три энергетических уровня, на которых находятся 17 электронов. Электронная конфигурация основного состояния фхора имеет вид:
.
На внешнем энергетическом уровне хлора находится 7 электронов (валентные, т.е. участвуют в образовании химических связей), из которых всего один неспаренный. При возбуждении атома хлора за счет вакантных орбиталей 3d-подуровня пары электронов 3s — , а затем и 3p-подуровней способны распариваться и занимать более энергетически выгодное положение. Наличие трех, пяти и семи неспаренных электронов в возбужденном состоянии свидетельствует о том, что хлор проявляет в своих соединениях валентности III, V и VI. Формально хлор может проявлять валентности IV и VI.
ru.solverbook.com