Валентность хлора fecl2, felc3 | То что Интересно!
Валентностью называется способность элементов присоединять к себе другие элементы.
Т. е. валентность – это число, демонстрирующее количество элементов, которое может притянуть к себе конкретный атом. Определяется числом неспаренных электронов невозбуждённого и возбуждённого атома.
Хлор, является элементом седьмой группы главной подругппы, третьего периода периодической системы химических элементов Менделеева. Атомный номер хлора – 17. Записывается он как Cl от Chlorum. Хлор является активным неметаллом и входит в группу галогенов.
Валентность и степень окисления атомов хлора в его молекуле
Если сравнивать степень окисления с валентностью, то степень окисления является более универсальным понятием. Степень окисления характеризует ряд соединений, таких как ионная связь, химическая или металлическая, однако не зависит от вида химической связи. Степень окисления — это условный заряд на атоме в веществе. Определяют степень окисления исходя из допущения, о том, что соединение состоит исключительно из ионных связей. Степень окисления, в отличии от валентности, встречается не только положительной, но также нулевой, а порой и отрицательной.
Степень окисления численно обозначается тем, в каком состоянии находится атом в соединении. Также её именуют окислительным числом. Определяя которое условно полагают, что в простых ковалентных соединениях значение положительной степени окисления элемента равняется количеству оттянутых от атома связывающих электронных пар, а значение отрицательной степени окисления — числом притянутых электронных пар. Поэтому, определяя степень окисления принято считать, что, соединения состоят только из положительно и отрицательно заряженных ионов.
Степень окисления — это условный заряд атома в соединении, который возник бы, если бы связи в этом соединении были бы ионными, а электроны смещены к наиболее электроотрицательному элементу.
Говоря о хлоре, его валентности и степени окисления в его молекуле, получаются следующие значения:
- Валентность – 1.
- Степень окисления — 0
Какова валентность азота фосфора кремния
Какова же валентность других веществ, нередко взаимодействующих с хлором?
- Валентность азота. Азот в таблице Менделеева обозначен буквой N. Он может существ овать в самом разном валентном виде завися от соединения. Встречается даже дробная валентность. Это можно прекрасно посмотреть на примере окисления азота: N2O — одновалентный азот (веселящий газ) NO — двухвалентный. NO2 (диоксид азота, бурый газ). Соединения азота в степени окисления +5 — оксид азота (V) N2O5, азотная кислота и её соли — нитраты, и др.
Тем не менее, валентность самого азота = 3.
- Фосфор (Р) стоит в 3-м периоде, V группы, основной подгруппы периодической системы Менделеева. Валентность фосфора также может быть разной, всё, как и с любым другим веществом, упирается в то, с каким веществом случиться химическая связь фосфора. Тем не менее валентность самог фосфора бывает III, V.
- Кремний (Si) – стоит в 3 периоде, IV группе главной подгруппы периодической системы. Валентность – 2, 4.
Валентность хлора в органических соединениях, в возбужденном состоянии, в хлороводороде, в высшем оксиде
Валентность хлора в органических соединениях может быть различной, в зависимости, собственно, от соединения.
Основные реакции хлора с органическими веществами:
- С насыщенными соединениями:
Ch4-Ch4 + Cl2 → C2H5Cl + HCl
- Присоединяется к ненасыщенным соединениям по кратным связям:
Ch3=Ch3 + Cl2 → Cl-Ch3-Ch3-Cl
- Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (например, AlCl3 или FeCl3):
C6H6 + Cl2 → C6H5Cl + HCl
В невозбужденном состоянии у атома хлора на 3 энергетическом уровне находится 1 неспаренный электрон, таким образом невозбужденный атом хлора может показывать валентность 1.
В возбужденном состоянии — валентность 3.
Зная валентность 1 химического элемента, всегда можно узнать валентность остальных атомов в соединении. Если атомы водорода в любое время одновалентные, то в молекуле хлороводорода HCl валентность атомов хлора также будет равняться одному, ведь атом хлора связан только с атомом водорода и не может образовывать с ним больше 1 связи.
Высшим оксидом является оксид, где элемент проявляет высшую степень окисления.
Cl2O7 — оксид хлора (VII) — ст. окисл. Cl (+7) — высший оксид.
Валентность хлора с металлами, с фосфором, с серебром, с натрием, с водородом, с кислородом, с кальцием, с алюминием, с неметаллами, с железом
Вообще валентность – одна из самых сложных тем в химии, чтобы в этом разобраться, придётся проштудировать немало материала. Не зная элементарных законов и правил химии, никто не сможет понять, что же такое валентность, а уж тем более научиться определять её.
Вообще, чтобы знать валентность того или иного вещества, достаточно просто уметь читать таблицу Менделеева, т. к. там схематически написано в сё и обо всех химических веществах. Это необходимо, чтобы решать задачи по химии и ставить опыты. Валентность всех веществ, в том числе и хлора, подчиняется строгим правилам, выучив которые, можно с лёгкостью определять валентность любого интересующего вещества.
Взаимодействие с металлами:
Хлор непосредственно вступает в реакцию фактически со всеми металлами, однако для реакции с некоторыми необходима влага или нагревание.
Взаимодействие с неметаллами:
C неметаллами (кроме углерода, азота, фтора, кислорода и инертных газов), образует соответствующие хлориды.
В различных соединениях валентность хлора также различается, с металлами (серебро, натрий, железо, алюминий) валентность хлора = 1, с неметаллами имеет различную валентность, но, чаще всего, также 1. В соединениях с водородом валентность хлора = 1.
Вообще CL всегда имеет валентность 1, соединяясь с веществами, исключения составляют вещества с валентностью VII.
viplu.ru
валентность, химические свойства :: SYL.ru
Валентность определяет способность хлора присоединять к себе атомы других химических элементов.
Хлор, валентность которого имеет различные значения, располагается в седьмой группе, в главной подгруппе таблицы элементов. Выясним особенности строения атома этого галогена.
Хлор в нормальном состоянии
Валентность атомов хлора определяется особенностями строения его внешнего уровня. Данный элемент находится в 7(А) группе, имеет семнадцатый порядковый номер. Учитывая, что элемент является представителем четвертого периода, он имеет не только s-, p-, но и d-орбитали.
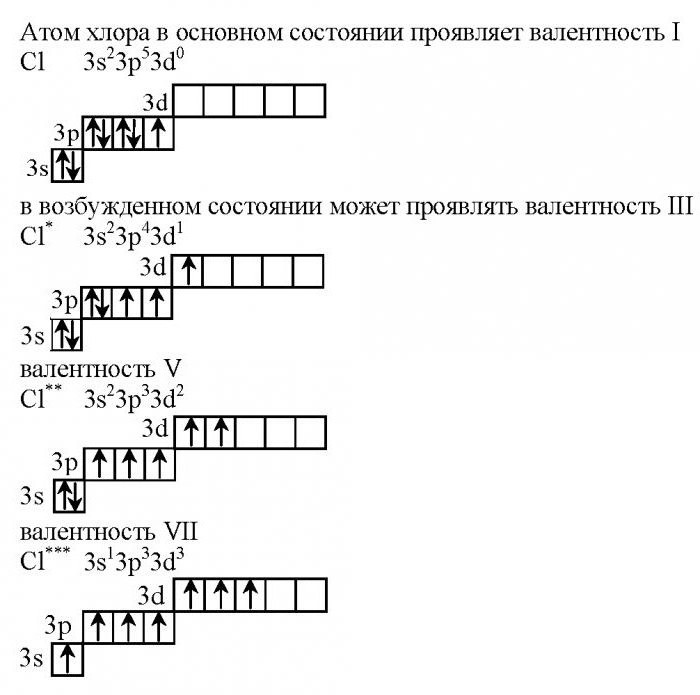
Электронная конфигурация атома
Какую электронную формулу имеет хлор? Валентность связана с особенностями внешнего энергетического уровня, поэтому запишем конфигурацию данного элемента.
В невозбужденном состоянии на первом уровне у хлора располагаются всего два электрона, второй занимают восемь, на третьем уровне их 10 штук. Отметим, что на последнем уровне есть незаполненная d-орбиталь, которая и характеризует валентные возможности данного галогена.
В данном случае валентность хлора равна I. Это характерно при взаимодействии с металлами (образуются хлориды). Высшую валентность VII хлор имеет в соединениях с неметаллами, например, в оксиде хлора (7), а также в хлорной кислоте.
Приведем в качестве примеров формулы соединений хлора, в которых он проявляет такую валентность: HClO4, Cl2O7.
Последний электронный уровень называют в неорганической химии валентным, так как именно он объясняет способность элемента вступать в химические взаимодействия с другими атомами.

Возбужденное состояние
Как ведет себя при нагревании хлор? Валентность его будет меняться в том случае, если атом будет находиться в возбужденном состоянии.
Учитывая тот факт, что у каждого энергетического уровня есть определенный запас энергии, электроны двух первых уровней не изменяют своего первоначального положения. Наблюдается переход одного p-электрона с 3p энергетического уровня на 3d-подуровень. Как будет при этом менять свое участие в химических реакциях хлор? Валентность его изменится, она будет равна трем.
Рассмотрим электронную конфигурацию, которую приобретет в этом случае хлор.
Такая конфигурация не является устойчивой, поэтому соединения хлора, в которых он проявляет степень окисления +3, быстро разлагаются.
Так как на 3d-орбитали есть еще четыре свободные квантовые ячейки, возможен последующий переход электрона с 3p-подуровня, который приводит к образованию еще одной конфигурации атома хлора.
В этом случае существует пять неспаренных электронов, поэтому хлор способен проявлять валентность V, степень окисления +5.
При максимальном разогревании атома хлора происходит переход электрона с 3s-подуровня на 3d-орбиталь. В этом случае хлор имеет максимальную валентность, равную семи.
На внешнем энергетическом уровне у него располагается семь неспаренных электронов, поэтому валентность хлора в соединениях равна 7.
Распределение электронов по уровням, подуровням, их переход осуществляются в соответствии с правилом Хунда и принципом Паули.
Как в этом случае обозначается хлор? Валентность элемента принято указывать римскими цифрами, а возбужденное состояние атома отмечают звездочкой.
Заключение
Все затраты внутренней энергии, которые идут на процесс возбуждения атома хлора, полностью компенсируются той энергией, которая выделяется при образовании ковалентных связей. Это объясняет повышенную химическую активность хлора, находящегося в возбужденном состоянии. В своей максимальной степени окисления (+7) он проявляет свойства сильного окислителя.
Валентные возможности атома химического элемента не ограничиваются только количеством неспаренных электронов в стационарном и возбужденном виде. Например, при образовании связей в молекулах посредством донорно-акцепторного механизма, предполагают использование и свободных орбиталей.
Какие факторы влияют на валентные возможности атома хлора? Подводя итог, скажем, что в первую очередь необходимо отметить количество неспаренных электронов (незаполненные орбитали). Кроме того, в атоме должна быть свободная орбиталь, на которую будут при нагревании переходить электроны.
www.syl.ru
Какая валентность у хлора?
Прежде, чем отвечать на вопрос «какая валентность у хлора» следует дать четкое определение понятию «валентности».
Понятие валентность было введено в химию в середине XIX века. А связь между атомом химического элемента и его валентностью обнаружил Д.И. Менделеев и так же ввел понятие переменной валентности для элементов, которые способны проявлять не одно значение этой величины (марганец, хлор, кобальт, медь и др.).
Существует несколько определений понятия валентность, но наиболее общее имеет следующую формулировку: валентность – это способность атомов соединяться с другими атомами в определенных соотношениях.
Хлор – элемент третьего периода VIIA группы (главная подгруппа). Поскольку высшая валентность элемента определяется по номеру группы Периодической таблицы Д.И. Менделеева, в которой он расположен, то для хлора она равна VII (, ). Также, при помощи Периодической таблицы можно найти низшую валентность хлора. Она определяется как разность между числом 8 и номером группы, т.е. равна I (, ). Помимо этих валентностей у хлора есть промежуточные – III () и V ().
ru.solverbook.com
Контрольная работа по химии Теория химического строения органических соединений 10 класс
Контрольная работа по химии Теория химического строения органических соединений с ответами для учащихся 10 класса. Контрольная работа состоит из 3 вариантов в каждом по 4 задания.
1 вариант
1. Число разных веществ, изображённых структурными формулами

равно:
1) одному
2) двум
3) трем
4) четырем
2. Число изомеров, соответствующих веществу с молекулярной формулой С 5Н12 равно:
1) одному
2) двум
3) трем
4) четырем
3. Количество вещества, содержащееся в 33,6 л (н. у.) пропана С3Н8 , составляет _____ моль. (Впишите ответ с точностью до десятых.)
4. Составьте три структурные формулы гомологов вещества, структурная формула которого

2 вариант
1. Молекулярной формулой углеводорода является:

2. Изомерами являются вещества, формулы которых:

3. Количество вещества, содержащееся в 43 г гексана С6Н14, составляет _____ моль. (Впишите ответ с точностью до десятых.)
4. Запишите три варианта возможных структурных формул вещества состава С5Н12 , имеющих неразветвлённую углеродную цепочку.
3 вариант
1.Валентность углерода, хлора, кислорода в органических соединениях равна соответственно:
1) IV, VII, II
2) II, I, II
3) IV, I, II
4) II, VII, II
2. В перечне формул веществ

гомологами являются:
1) АБВ
2) АВЕ
3) АВД
4) БВД
3. Пропан С3Н8, количеством вещества 0,3 моль, занимает объём (н. у.), равный _____ л. (Впишите ответ с точностью до сотых.)
4. Составьте три структурные формулы изомеров углеводорода, формула которого С6Н14.
Ответы на контрольную работу по химии Теория химического строения органических соединений1 вариант
1. 4
2. 3
3. 1,5
4.

2 вариант
1. 3
2. 4
3. 0,5
4.

3 вариант
1. 3
2. 2
3. 6,72
4.

testschool.ru