Валентность железа. Какая валентность у железа?
Трудно переоценить роль железа для человеческого организма, ведь именно оно способствует «творению» крови, его содержание влияет на уровень гемоглобина и миоглобина, железо нормализует работу ферментной системы. Но что это за элемент с точки зрения химии? Какая валентность железа? Об этом будет рассказано в данной статье.

Немного истории
Человечество знало об этом химическом элементе и даже владело изделиями из него еще в IV веке до нашей эры. Это были народы Древнего Египта и Шумеры. Именно они первые начали изготавливать украшения, оружие из сплава железа и никеля, которые были найдены при археологических раскопках и тщательно исследованы химиками.
Немного позже, племена арийцев, переселившиеся в Азию, научилось добывать твердое железо из руды. Оно было настолько ценным для людей того времени, что изделия покрывали золотом!
Характеристика железа
Железо (Fe) стоит на четвертом месте по содержанию его в недрах земной коры. Оно занимает место в 7 группе 4 периода и имеет номер 26 в химической таблице элементов Менделеева. Валентность железа имеет прямую зависимость от своего положения в таблице. Но об этом позже.

Данный металл наиболее всего распространен в природе в виде руды, встречается в воде как минерал, а также в различных соединениях.
Наибольшее количество запасов железа в виде руды, находится в России, Австралии, Украине, Бразилии, США, Индии, Канаде.
Физические свойства
Прежде чем переходить к валентности железа, необходимо подробнее рассмотреть его физические свойства, так сказать, приглядеться к нему поближе.
Этот металл имеет серебристый цвет, достаточно пластичный, но способен к увеличению твердости путем его взаимодействия с другими элементами (например, с углеродом). Также он обладает магнитными свойствами.
Во влажной среде железо может корродировать, то есть ржаветь. Хотя абсолютно чистый металл устойчивее к влаге, но если в нем есть примеси, именно они провоцируют коррозию.

Железо хорошо взаимодействует с кислотной средой, даже может образовывать соли железной кислоты (при условии сильного окислителя).
В воздушной среде быстро покрывается оксидной пленкой, которая защищает его от взаимодействий.
Химические свойства
Также этот элемент обладает рядом химических свойств. Железо, как и остальные элементы таблицы Менделеева, имеет заряд атомного ядра, который соответствует порядковому номеру +26. А возле ядра вращается 26 электронов.
А вообще, если рассматривать свойства железа – химического элемента, то он является металлом с невысокой активной способностью.
Взаимодействуя с окислителями более слабыми, железо образует соединения, где оно двухвалентно (то есть его степень окисления +2). А если с сильными окислителями, то степень окисления железа достигает +3 (то есть валентность его становится равной 3).
При взаимодействии с химическими элементами, которые не являются металлами, Fe выступает по отношению к ним восстановителем, при этом степень окисления его становиться, кроме +2 и +3, даже +4, +5, +6. Такие соединения имеют очень сильные окислительные свойства.
Как уже отмечалось выше, железо в воздушной среде покрывается оксидной пленкой. А при нагревании скорость реакции повышается и может образоваться оксид железа с валентностью 2 (температура менее 570 градусов по Цельсию) или оксид с валентностью 3 (температурный показатель более 570 градусов).

Взаимодействие Fe с галогенами, приводит к образованию солей. Элементы фтор и хлор окисляют его до +3. Бром же – до +2 или +3 (все зависит от того, какие условия осуществления химического превращения при взаимодействии с железом).
Вступая во взаимодействия с йодом, элемент окисляется до +2.
Нагревая железо и серу, получается сульфид железа с валентностью 2.
Если феррум расплавить и соединить его с углеродом, фосфором, кремнием, бором, азотом, то получатся соединения называемые сплавами.
Железо является металлом, поэтому оно вступает во взаимодействие и с кислотами (об этом кратко также говорилось чуть выше). Например, кислоты серная и азотная, имеющие высокую концентрацию, в среде с пониженной температурой, на железо не оказывают воздействия. Но стоит ей повысится, как происходит реакция, в результате которой железо окисляется до +3.
Чем выше концентрация кислоты, тем большую температуру необходимо дать.
Нагревая 2-х валентное железо в воде, получим его оксид и водород.
Также Fe обладает способностью вытеснять из водных растворов солей металлы, которые имеют пониженную активность. При этом он окисляется до +2.
При повышении температуры, железо восстанавливает металлы из оксидов.

Что такое валентность
Уже в предыдущем разделе немного встречалось понятие валентности, а также степени окисления. Пришло время рассмотреть валентность железа.
Но для начала необходимо понять, что это вообще за такое свойство химических элементов.
Химические вещества почти всегда постоянны в своем составе. Например, в формуле воды Н2О – 1 атом кислорода и 2 атома водорода. То же самое и с другими соединениями, в которых задействованы два химических элемента, один из которых водород: к 1 атому химического элемента может добавиться 1-4 атома водорода. Но никак не наоборот! А потому, видно, что водород присоединяет к себе всего 1 атом другого вещества. И именно это явление называют валентностью – способностью атомов химического элемента присоединять конкретное количество атомов других элементов.
Значение валентности и графическая формула
Есть элементы таблицы Менделеева, которые обладают постоянной валентностью – это кислород и водород.
А есть такие химические элементы, у которых она изменяется. Например, железо чаще 2-х и 3-х валентно, сера 2, 4, 6-ти, углерод 2 и 4-х. Это элементы с переменной валентностью.
Далее, понимая, что такое валентность, можно правильно написать графическую формулу соединений. Она отображает последовательность соединения атомов в молекуле.
Также, зная валентность одного из элементов в соединении, можно определить валентность другого.
Валентность железа
Как было отмечено, железо относится к элементам с переменной валентностью. И она может колебаться не только между показателями 2 и 3, но и достигать 4, 5 и даже 6.
Конечно, более подробно изучает валентность железа неорганическая химия. Рассмотрим этот механизм кратко на уровне простейших частиц.
Железо является д-элементом, к которому причисляется еще 31 элемент таблицы Менделеева (это 4-7 периоды). С возрастанием порядкового номера, свойства д-элементов приобретают небольшие изменения. Атомный радиус у этих веществ также медленно возрастает. Они обладают переменной валентностью, которая зависит от того, что предвнешний д-электронный подуровень является незавершенным.
Потому для железа валентными есть не только с-электроны, находящиеся во внешнем слое, но и неспаренные 3д-электроны предвнешнего слоя. И, как следствие, валентность Fe в химических соединениях может равнятся 2, 3, 4, 5, 6. В основном, она равна 2 и 3 – это более устойчивые соединения железа с другими веществами. В менее устойчивых — он проявляет валентность 4, 5, 6. Но, такие соединения встречаются реже.

Двухвалентный феррум
При взаимодействии 2 валентного железа с водой получается оксид железа (2). Такое соединение обладает черным цветом. Достаточно легко взаимодействует с соляной (малой концентрации) и азотной (высокой концентрации) кислотами.
Если такому оксиду 2-х валентного железа провзаимодействовать или с водородом (температура 350 градусов по Цельсию), или с углеродом (коксом) при 1000 градусов, то оно восстанавливается до чистого состояния.
Добывают оксид железа 2-х валентного такими способами:
- через соединение оксида 3-х валентного железа с угарным газом;
- при нагревании чистого Fe, при этом низкое давление кислорода;
- при раскладывании оксалата 2-х валентного железа в вакуумной среде;
- при взаимодействии чистого железа с его оксидами, температура при этом 900-1000 градусов по Цельсию.
Что касается природной среды, то оксид железа 2-х валентного, присутствует в виде минерала вюстита.
Есть еще способ, как в растворе определить валентность железа – в данном случае, имеющего ее показатель 2. Необходимо провести реакции с красной солью (гексацианоферрат калия) и с щелочью. В первом случае наблюдается получение осадка темно-синего цвета – комплексной соли железа 2-х валентного. Во втором – получение темного серо-зеленого осадка – гидроксида железа также 2-х валентного, в то время, как гидроксид железа 3-х валентного имеет цвет в растворе темно-бурый.

Трехвалентное железо
Оксид 3-х валентного феррума имеет порошкообразную структуру, цвет которой красно-коричневый. Имеет также наименования: окись железа, железный сурик, красный пигмент, пищевой краситель, крокус.
В природе это вещество встречается в виде минерала – гематита.
Оксид такого железа с водой уже не взаимодействует. Но соединяется с кислотами и щелочами.
Применяется оксид железа (3) для окрашивания материалов, применяемых в строительстве:
- кирпичей;
- цемента;
- керамических изделий;
- бетона;
- тротуарной плитки;
- напольных покрытий (линолеум).
Железо в организме человека
Как отмечалось в начале статьи, вещество железо является важной составляющей человеческого организма.
Когда этого элемента является недостаточно, то могут возникнуть следующие последствия:
- повышенная усталость и чувствительность к холоду;
- сухость кожи;
- снижение мозговой деятельности;
- ухудшение прочности ногтевой пластины;
- головокружение;
- проблемы с пищеварением;
- седина и выпадение волос.
Накапливается железо, как правило, в селезенке и печени, а также почках и поджелудочной железе.
В рационе человека должны быть продукты, содержащие железо:
- говяжья печень;
- гречневая каша;
- арахис;
- фисташки;
- зеленый горошек консервированный;
- сушенные белые грибы;
- куриные яйца;
- шпинат;
- кизил;
- яблоки;
- груши;
- персики;
- свекла;
- морепродукты.
Недостаток железа в крови, приводит к снижению гемоглобина и развитию такого заболевания, как железодефицитная анемия.
Валентность железа (Fe), формулы и примеры
Общие сведения о валентности железа
В виде простого вещества железо – серебристо-белый металл. Плотность равна 7,87 г/см3. Температура плавления 1539oС, кипения 3200oС. Железо имеет несколько модификаций. До 769oС устойчиво α-железо с объемно центрированной кубической решеткой и ферромагнитными свойствами. При 769oС осуществляется переход в β-железо (кристаллическая структура та же, парамагнетик). При 910oС образуется γ-железо с гранецентрированной кристаллической решеткой. Парамагнитные свойства. При 1400oС и до температуры плавления – δ- железо с объемно центрированной кубической решеткой.
Валентность железа в соединениях
Железо – двадцать шестой по счету элемент Периодической таблицы Д.И. Менделеева. Оно находится в четвертом периоде в VIIIВ группе. В ядре атома железа содержится 26 протонов и 30 нейтронов (массовое число равно 56). В атоме железа есть четыре энергетических уровня, на которых находятся 26 электронов (рис. 1).
Рис. 1. Строение атома железа.
Электронная формула атома железа в основном состоянии имеет следующий вид:
1s22s22p63s23p63d64s2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Железо проявляет в своих соединениях валентности II (FeO, Fe(OH)2, FeCl2, FeBr2) и III (Fe2O3, Fe(OH)3, FeCl3, Fe2S3).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Какая валентность у железа с кислородом. Валентность железа. Какая валентность у железа
Валентность – способность элементов присоединять к себе другие элементы.
Говоря простым языком, это число, показывающее, сколько элементов может присоединить к себе определённый атом.
Ключевым моментом в химии является правильная запись формул соединений.
Существуют несколько правил, которые облегчают нам правильное составление формул.
- Валентность всех металлов главных подгрупп равна номеру группы:
 На рисунке представлен пример главной и побочной подгруппы I группы.
На рисунке представлен пример главной и побочной подгруппы I группы.

2. Валентность кислорода равна двум
3. Валентность водорода равна одному
4. Неметаллы проявляют два типа валентности:
- Низшую (8-№ группы)
- Высшую (равна № группы)
А) В соединениях с металлами, неметаллы проявляют низшую валентность!
Б) В бинарных соединениях сумма валентности одного вида атомов равна сумме валентности другого вида атомов!

Валентность алюминия равна трём (алюминий -металл III группы). Валентность кислорода равна двум. Сумма валентности для двух атомов алюминия равна 6. Сумма валентности для трёх атомов кислорода равна тоже 6.
1) Определите валентности элементов в соединениях:
Валентность алюминия равна III. В формуле 1 атом => суммарная валентность тоже равна 3. Следовательно, для всех атомов хлора валентность тоже будет равна 3 (правило бинарных соединений). 3:3=1. Валентность хлора равна 1.
Валентность кислорода равна 2. В соединении 3 атома кислорода => суммарная валентность равна 6. Для двух атомов суммарная валентность равна 6 => для одного атома железа — 3 (6:2=3)
2) Составьте формулы соединения, состоящего из:
натрия и кислорода
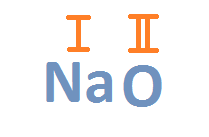
Валентность кислорода равна II.
Натрий-металл первой группы главной подгруппы => его валентность равна I.
Железо (Ferrum, Fe) — химический элемент VIII группы периодической системы Д.И. Менделеева, входит в состав дыхательных пигментов, в т.ч. гемоглобина, участвует в связывании и переносе кислорода к тканям в организме животных и человека.
Атомный номер железа 26, атомная масса 55,847. В природе обнаружены 4 стабильных изотопа железа; известны 6 радиоактивных изотопов железа с массовыми числами от 52 до 61, из которых в медицине для исследования эритропоэза, обмена и всасывания железа применяют 59 Fe.
Чистое
В организме взрослого человека содержится 4-5 г железа, изкоторых около 70% входит в состав гемоглобина (см. Кровь ), около 5-10% — в состав миоглобина, около 20-25% приходится на так называемое резервное железо и не более 0,1% железа находится в плазме крови; в клетках и тканях Ж. присутствует в составе дыхательных ферментов (его относительное содержание — около 1% железа организма). В плазме крови определяется так называемое геминовое железо , железо ферритина, внутрисосудистого гемоглобина и трансферрина. Геминовое железо входит в состав гемина (производного гема, в отличие от гемоглобина, содержащего только одну порфириновую группу). Ферритин представляет собой самый богатый железом сывороточный белок (в его составе имеется мицелла, содержащая до 4300 атомов окисленного железа), состоящий из белка апоферритина и гидрооксидфосфата железа.
Основная часть железа плазмы крови связана с белком трансферрином (сидерофиллином) — главным компонентом фракции b 1 -глобулинов. Трансферрин находится в крови в концентрации около 0,4 г /100 мл и при нормальном содержании Ж. в плазме крови (около 100 мкг /100 мл ) насыщен железом в среднем на 30%. Так называемая ненасыщенная железосвязывающая способность крови (НЖСС) определяется дополнительным количеством железа, которое может быть связано трансферрином, а общая железосвязывающая способность крови (ОЖСС) — общим количеством железа, которое способен связать трансферрин. В норме ОЖСС крови у мужчин составляет 45-75
Гиперсидеремия (повышение концентрации негеминового Ж. в плазме крови) с одновременным снижением НЖСС наблюдается при гемосидерозе , гемохроматозе ,
некоторых анемиях , острых и хронических инфекциях, циррозе печени , уремии (см. Почечная недостаточность ), злокачественных новообразованиях, гемолитической и паренхиматозной желтухах . Гипосидеремия (снижение концентрации негеминового железа в плазме крови), сопровождающаяся одновременным повышением НЖСС, наблюдается при истощений резервов Ж. , недостаточном его поступлении с пищей и при состояниях, сопровождающихся повышенной потребностью в железе (беременности, кровопотере, гипохромных анемиях, острых инфекционных болезнях и др.). Ж. может откладываться в тканях организма (сидероз). У шахтеров, занятых на разработках красного железняка, наблюдается экзогенный сидероз, при этом в легких откладывается железо в виде оксида Fe(III). В результате избыточного разрушения гемоглобина образуется пигмент гемосидерин — агрегат гидрооксида Fe(lll) с белками, гликозами-ногликанами и липидами, накопление гранул которого (эндогенный сидероз) происходит, например, в местах кровоизлияний. Поскольку обмен железа в организме в значительной степени определяется состоянием печени, определение содержания Ж. в плазме крови может быть использовано в качестве дополнительного функционального теста, свидетельствующего о состоянии печени.Установлено, что ионы свободного Fe(ll), а также комплексные соединения железа могут инициировать свободнорадикальное перекисное окисление липидов (универсальный механизм повреждения биологических мембран, белков и нуклеиновых кислот) в организме. В связи с этим определение свободного ионизи
Валентность железа. Какая валентность у железа?
Трудно переоценить роль железа для человеческого организма, ведь именно оно способствует «творению» крови, его содержание влияет на уровень гемоглобина и миоглобина, железо нормализует работу ферментной системы. Но что это за элемент с точки зрения химии? Какая валентность железа? Об этом будет рассказано в данной статье.

Немного истории
Человечество знало об этом химическом элементе и даже владело изделиями из него еще в IV веке до нашей эры. Это были народы Древнего Египта и Шумеры. Именно они первые начали изготавливать украшения, оружие из сплава железа и никеля, которые были найдены при археологических раскопках и тщательно исследованы химиками.
Немного позже, племена арийцев, переселившиеся в Азию, научилось добывать твердое железо из руды. Оно было настолько ценным для людей того времени, что изделия покрывали золотом!
Характеристика железа
Железо (Fe) стоит на четвертом месте по содержанию его в недрах земной коры. Оно занимает место в 7 группе 4 периода и имеет номер 26 в химической таблице элементов Менделеева. Валентность железа имеет прямую зависимость от своего положения в таблице. Но об этом позже.

Данный металл наиболее всего распространен в природе в виде руды, встречается в воде как минерал, а также в различных соединениях.
Наибольшее количество запасов железа в виде руды, находится в России, Австралии, Украине, Бразилии, США, Индии, Канаде.
Физические свойства
Прежде чем переходить к валентности железа, необходимо подробнее рассмотреть его физические свойства, так сказать, приглядеться к нему поближе.
Этот металл имеет серебристый цвет, достаточно пластичный, но способен к увеличению твердости путем его взаимодействия с другими элементами (например, с углеродом). Также он обладает магнитными свойствами.
Во влажной среде железо может корродировать, то есть ржаветь. Хотя абсолютно чистый металл устойчивее к влаге, но если в нем есть примеси, именно они провоцируют коррозию.

Железо хорошо взаимодействует с кислотной средой, даже может образовывать соли железной кислоты (при условии сильного окислителя).
В воздушной среде быстро покрывается оксидной пленкой, которая защищает его от взаимодействий.
Химические свойства
Также этот элемент обладает рядом химических свойств. Железо, как и остальные элементы таблицы Менделеева, имеет заряд атомного ядра, который соответствует порядковому номеру +26. А возле ядра вращается 26 электронов.
А вообще, если рассматривать свойства железа – химического элемента, то он является металлом с невысокой активной способностью.
Взаимодействуя с окислителями более слабыми, железо образует соединения, где оно двухвалентно (то есть его степень окисления +2). А если с сильными окислителями, то степень окисления железа достигает +3 (то есть валентность его становится равной 3).
При взаимодействии с химическими элементами, которые не являются металлами, Fe выступает по отношению к ним восстановителем, при этом степень окисления его становиться, кроме +2 и +3, даже +4, +5, +6. Такие соединения имеют очень сильные окислительные свойства.
Как уже отмечалось выше, железо в воздушной среде покрывается оксидной пленкой. А при нагревании скорость реакции повышается и может образоваться оксид железа с валентностью 2 (температура менее 570 градусов по Цельсию) или оксид с валентностью 3 (температурный показатель более 570 градусов).

Взаимодействие Fe с галогенами, приводит к образованию солей. Элементы фтор и хлор окисляют его до +3. Бром же – до +2 или +3 (все зависит от того, какие условия осуществления химического превращения при взаимодействии с железом).
Вступая во взаимодействия с йодом, элемент окисляется до +2.
Нагревая железо и серу, получается сульфид железа с валентностью 2.
Если феррум расплавить и соединить его с углеродом, фосфором, кремнием, бором, азотом, то получатся соединения называемые сплавами.
Железо является металлом, поэтому оно вступает во взаимодействие и с кислотами (об этом кратко также говорилось чуть выше). Например, кислоты серная и азотная, имеющие высокую концентрацию, в среде с пониженной температурой, на железо не оказывают воздействия. Но стоит ей повысится, как происходит реакция, в результате которой железо окисляется до +3.
Чем выше концентрация кислоты, тем большую температуру необходимо дать.
Нагревая 2-х валентное железо в воде, получим его оксид и водород.
Также Fe обладает способностью вытеснять из водных растворов солей металлы, которые имеют пониженную активность. При этом он окисляется до +2.
При повышении температуры, железо восстанавливает металлы из оксидов.

Что такое валентность
Уже в предыдущем разделе немного встречалось понятие валентности, а также степени окисления. Пришло время рассмотреть валентность железа.
Но для начала необходимо понять, что это вообще за такое свойство химических элементов.
Химические вещества почти всегда постоянны в своем составе. Например, в формуле воды Н2О – 1 атом кислорода и 2 атома водорода. То же самое и с другими соединениями, в которых задействованы два химических элемента, один из которых водород: к 1 атому химического элемента может добавиться 1-4 атома водорода. Но никак не наоборот! А потому, видно, что водород присоединяет к себе всего 1 атом другого вещества. И именно это явление называют валентностью – способностью атомов химического элемента присоединять конкретное количество атомов других элементов.
Значение валентности и графическая формула
Есть элементы таблицы Менделеева, которые обладают постоянной валентностью – это кислород и водород.
А есть такие химические элементы, у которых она изменяется. Например, железо чаще 2-х и 3-х валентно, сера 2, 4, 6-ти, углерод 2 и 4-х. Это элементы с переменной валентностью.
Далее, понимая, что такое валентность, можно правильно написать графическую формулу соединений. Она отображает последовательность соединения атомов в молекуле.
Также, зная валентность одного из элементов в соединении, можно определить валентность другого.
Валентность железа
Как было отмечено, железо относится к элементам с переменной валентностью. И она может колебаться не только между показателями 2 и 3, но и достигать 4, 5 и даже 6.
Конечно, более подробно изучает валентность железа неорганическая химия. Рассмотрим этот механизм кратко на уровне простейших частиц.
Железо является д-элементом, к которому причисляется еще 31 элемент таблицы Менделеева (это 4-7 периоды). С возрастанием порядкового номера, свойства д-элементов приобретают небольшие изменения. Атомный радиус у этих веществ также медленно возрастает. Они обладают переменной валентностью, которая зависит от того, что предвнешний д-электронный подуровень является незавершенным.
Потому для железа валентными есть не только с-электроны, находящиеся во внешнем слое, но и неспаренные 3д-электроны предвнешнего слоя. И, как следствие, валентность Fe в химических соединениях может равнятся 2, 3, 4, 5, 6. В основном, она равна 2 и 3 – это более устойчивые соединения железа с другими веществами. В менее устойчивых — он проявляет валентность 4, 5, 6. Но, такие соединения встречаются реже.

Двухвалентный феррум
При взаимодействии 2 валентного железа с водой получается оксид железа (2). Такое соединение обладает черным цветом. Достаточно легко взаимодействует с соляной (малой концентрации) и азотной (высокой концентрации) кислотами.
Если такому оксиду 2-х валентного железа провзаимодействовать или с водородом (температура 350 градусов по Цельсию), или с углеродом (коксом) при 1000 градусов, то оно восстанавливается до чистого состояния.
Добывают оксид железа 2-х валентного такими способами:
- через соединение оксида 3-х валентного железа с угарным газом;
- при нагревании чистого Fe, при этом низкое давление кислорода;
- при раскладывании оксалата 2-х валентного железа в вакуумной среде;
- при взаимодействии чистого железа с его оксидами, температура при этом 900-1000 градусов по Цельсию.
Что касается природной среды, то оксид железа 2-х валентного, присутствует в виде минерала вюстита.
Есть еще способ, как в растворе определить валентность железа – в данном случае, имеющего ее показатель 2. Необходимо провести реакции с красной солью (гексацианоферрат калия) и с щелочью. В первом случае наблюдается получение осадка темно-синего цвета – комплексной соли железа 2-х валентного. Во втором – получение темного серо-зеленого осадка – гидроксида железа также 2-х валентного, в то время, как гидроксид железа 3-х валентного имеет цвет в растворе темно-бурый.

Трехвалентное железо
Оксид 3-х валентного феррума имеет порошкообразную структуру, цвет которой красно-коричневый. Имеет также наименования: окись железа, железный сурик, красный пигмент, пищевой краситель, крокус.
В природе это вещество встречается в виде минерала – гематита.
Оксид такого железа с водой уже не взаимодействует. Но соединяется с кислотами и щелочами.
Применяется оксид железа (3) для окрашивания материалов, применяемых в строительстве:
- кирпичей;
- цемента;
- керамических изделий;
- бетона;
- тротуарной плитки;
- напольных покрытий (линолеум).
Железо в организме человека
Как отмечалось в начале статьи, вещество железо является важной составляющей человеческого организма.
Когда этого элемента является недостаточно, то могут возникнуть следующие последствия:
- повышенная усталость и чувствительность к холоду;
- сухость кожи;
- снижение мозговой деятельности;
- ухудшение прочности ногтевой пластины;
- головокружение;
- проблемы с пищеварением;
- седина и выпадение волос.
Накапливается железо, как правило, в селезенке и печени, а также почках и поджелудочной железе.
В рационе человека должны быть продукты, содержащие железо:
- говяжья печень;
- гречневая каша;
- арахис;
- фисташки;
- зеленый горошек консервированный;
- сушенные белые грибы;
- куриные яйца;
- шпинат;
- кизил;
- яблоки;
- груши;
- персики;
- свекла;
- морепродукты.
Недостаток железа в крови, приводит к снижению гемоглобина и развитию такого заболевания, как железодефицитная анемия.
Железо валентность — Справочник химика 21
Рассматриваемые элементы образуют химические связи за счет орбиталей внешнего и предвнешнего электронных слоев (табл. 40). У атома железа валентные электроны заполняют орбитали следующим образом [c.484]Для железа валентности 2 и 3 характерны примерно в равной степени. Поэтому в зависимости от условий соединения двухвалентного железа могут выступать в качестве восстановителей, а трехвалентного — в роли окислителей. Соединения шестивалентного железа неустойчивы и являются окислителями. [c.278]
Химические свойства железа уже рассматривались понемногу в предьщущих программах. Например, вам должно быть кое-что известно о проявляемых железом валентностях. [c.399]
Домашняя подготовка. Распространение железа в природе. Важнейшие руды железа. Строение атома железа. Валентность железа в соединениях. Положение железа в ряду напряжений и его отношение к различным окислителям. Окислы и гидроокиси железа. Соли двухвалентного и трехвалентного железа. Их окислительно-восстановительные свойства. Комплексные соединения железа. Основные реакции доменного процесса. Чугун и сталь. Применение железа и его соединений. [c.229]
Вопросы и задачи. I. Что называют валентностью элемента 2. Какая зависимость существует между атомной массой, эквивалентом и валентностью элемента в химическом соединении 3. Привести примеры элементов, имеющих валентность а) постоянную, б) переменную. 4. Найти валентность хрома в соединениях СгО, СГ2О3, СгОз- 5. Найти валентность серы в соединениях HaS, 50г, SO3. 6. Определить валентность магния в окиси магния, если эквивалент его в этом соединении равен 12 (атомная масса магния 24). 7. Найти величину эквивалента железа в соединении, называемом а) закисью железа (валентность железа 2), б) окисью железа (валентность железа 3). Атомная масса железа 56. 8. Составить формулы химических соединений, образованных следующими элементами (в скобках указана проявляемая ими валентность) а) натрия (1) и серы (2), б) кальция (2) и хлора (1), в) фосфора (5) и кислорода (2), г) алюминия (3) и серы (2), д) углерода (4) и водорода (1),
Однако подобные допущения противоречат структурной теории Бутлерова, так как, например, атом железа валентности, равной 10, проявлять не может. Свойства полученных соединений также не согласуются с подобными структурами, противоречащими к тому же нормальному чередова- [c.262]
Рассматриваемые металлы в соединениях чаш,е всего двухвалентны. Но они образуют и соединения, в которых проявляется более высокая положительная валентность 3- -, 4 + и 6+. Устойчивость соединений высшей валентности уменьшается от железа к никелю. Так, у железа валентность 3-4- устойчива ион Со существует, но является сильным окислителем, способным окислять воду ион неустойчив. [c.308]
Невозможностью возбуждения электрона объясняется отсутствие у железа валентности 8, тогда как у его аналогов — рутения и осмия — эта валентность возможна. Кислород проявляет валентность 2, а его аналоги — сера, селен, теллур — могут быть четырех- и шестивалентны. По тем же соображениям гелий и неон обладают нулевой валентностью, а их аналоги — аргон, криптон, ксенон и радон — вследствие возможности возбуждения электронов могут давать соединения, в которых проявляют валентность 2, 4, 6 и 8 (подобные соединения последних трех элементов получены в 1962—1970 гг. в виде оксидов, фторидов, оксфторидов и солей кислот криптона и ксенона). [c.102]
Железо низшие валентности — Справочник химика 21
Как уже было показано (стр. 631), максимальная валентность (УИ1) группы проявляется лишь у рутения и осмия. Элементы этой группы в более низких валентных состояниях, особенно элементы семейства железа, дают окрашенные ионные соединения. Сродство к кислороду в каждом из трех рядов снижается слева направо, будучи самым большим у Ре, Ки, Оз и самым малым у N1, Рс1 и Р1 таким образом, последние три элемента по своим свойствам приближаются к элементам побочной подгруппы соседней I группы (Си, Ag, Ли). Все они обладают более или менее резко выраженным характером благородных металлов. Одновременно с понижением сродства элементов к кислороду возрастает их сродство к сере. Почти все элементы УП1 группы дают устойчивые сульфиды, что приближает их к элементам I и П групп. Склонность к образованию кислородных кислот, определяющая химические свойства элементов побочных подгрупп V, VI и УП групп периодической системы, здесь менее резко выражена она наблюдается лишь у элементов первого столбца УП1 группы (Ре, Ки, Оз), в то время как у остальных элементов отсутствует. Зато у всех элементов УП1 группы сильно выражено стремление к образованию большого числа устойчивых комплексных соединений. [c.658]Мартынов и Муллер [23] показали, что коагуляция за счет дальнего взаимодействия частиц может иметь место при достаточно высоком значении фв-потенциала и низкой валентности противоионов. Для дисперсий с относительно крупными частицами характерно наличие глубокого вторичного минимума и, следовательно, дальняя коагуляция наиболее вероятна. Экспериментальные данные, которые мы приведем в следующих главах, убеждают в том, что фиксация сильно гидратированных частиц продуктов гидролиза алюминия и железа происходит преимущественно во вторичном энергетическом минимуме Рассмотрим силы взаимного притяжения и отталкивания частиц. [c.33]
Разработаны условия восстановления следующих металлов до указанной валентности Ре , Мо , Мо , и Си . Вполне вероятно, что и другие элементы, как, например, восстанавливаются до более низкой валентности, а и 8е — до элементарного состояния. К числу металлов, не восстанавливающихся серебром, относятся несколько таких,, которые восстанавливаются цинком, например Ке , Сг и При анализе материалов, содержащих эти металлы, как, например, для определения железа в присутствии титана, применение серебряного редуктора весьма целесообразно. [c.140]
Полученные результаты показывают, что наименьшее количество абсорбированного водорода содержится в образцах, находившихся в растворах НЫОз, несмотря на то, что сталь в растворах НЫОз корродирует с максимальной скоростью по сравнению с другими кислотами. Среднее содержание водорода в стали в этом случае не превышало 1,7 см /100 г, а обычно было менее 1 см /ЮО г. Такое поведение стали в азотной кислоте следует отнести за счет ее высокой окислительной способности. По-видимому, выделяющийся при взаимодействии металла с кислотой водород, почти полностью расходуется на восстановление иона ЫОз до соединений, содержащих азот с более низкой валентностью. Известно, что при растворении железа в азотной кислоте газообразные продукты реакции состоят главным образом из N02, N0, N2 и NHз, соотношение между которыми зависит от концентрации кислоты и степени нагартовки металла. [c.111]
Слабые окислители (например, под) переводят его пз валентного состояния +3 в валентное состояние +4 желто-зеленого цвета это же валентное состояние может быть получено из более высоких. валентных состояний с помощью сравнительно сильных восстановительных агентов, таких, как ионы железа, иода или урана (IV). Слабое восстановление нептуния (VI) или сравнительно сильное окисление более низких валентных состояний дает КрО+ зеленого цвета. Это же валентное состояние получается в результате продолжительного воздействия воздуха или кислорода иа нептуний более низких валентных состояний. При отсутствии других окислительных и восстановительных агентов НКОз и окислы азота превращают другие валентные состояния нептуния в валентное состояние +5. Сильные окислители, такие, как Се (IV), озон, бромат ВгО или перманганат, переводят другие валентные состояния нептуния в шестивалентное состояние розового цвета. [c.153]
В воде протекают не только сложные химические, фотохимические и биохимические превращения. Следует учитывать дыхание живых организмов, которое сопровождается поглощением кислорода. Фотохимические реакции протекают в поверхностной пленке и в поверхностных слоях воды, куда проникает солнечный свет. Недостаток кислорода ведет не только к нарушению дыхания водных обитателей животного и растительного происхождения, но и к изменению химического состава содержащихся в воде веществ. Так, при недостатке кислорода нарушаются окислительно-восстановительные процессы, резко повышаются концентрации НгЗ, ЫНз, СОг- Снижается окисляемость металлов, отмечается переход в состояние с более низкой валентно-1>Л стью, что уменьшает их растворимость в воде, например, желе-г зо(П1) переходит в железо(П). Многие металлы, в нормальных условиях склонные к образованию соединений, выпадающих в осадок, теряют это свойство. Например, растворимость гидро-ксида железа(1И) составляет примерно 1,6-10 моль/л, а же- 4 леза(И)—5,8-моль/л. Растворимость гидроксида кобаль-та(П1)—5-10 2 моль/л, а кобальта(П)—8-10 моль/л [11, с. 312—315]. [c.17]
М . Применяя извлечение эфиром, галлий отделяют от алюминия и цинка (хотя и сообщают, что экстрагируются следы цинка), а также от многих других металлов. К металлам, хлориды которых извлекаются эфиром, относятся железо(П1), золото, таллий(П1), германий, молибден, рений, мышьяк, сурьма и олово (ср. табл. 9). Медь(П) экстрагируется в небольшом количестве. Если железо восстановить до двухвалентного состояния при помощи хлорида титана(П), то оно экстрагироваться не будет. В то же время некоторые из упомянутых выше элементов (особенно золото и таллий) восстанавливаются до металла или до состояния более низкой валентности, вследствие чего не экстрагируются. Молибден до некоторой степени извлекается в этих условиях. [c.423]
После хрома такого повышения прочности связи не наблюдается. Вместо этого прочность, твердость и другие свойства переходных металлов остаются по существу постоянными для