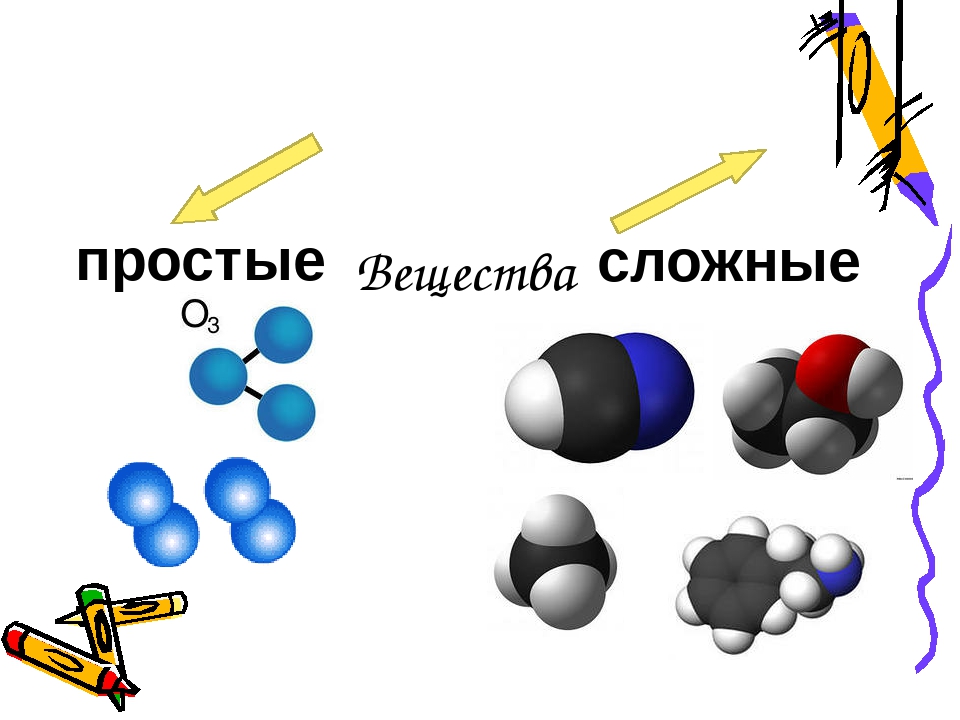
Отличия простых и сложных веществ. Химия, 8–9 класс: уроки, тесты, задания.
| 1. |
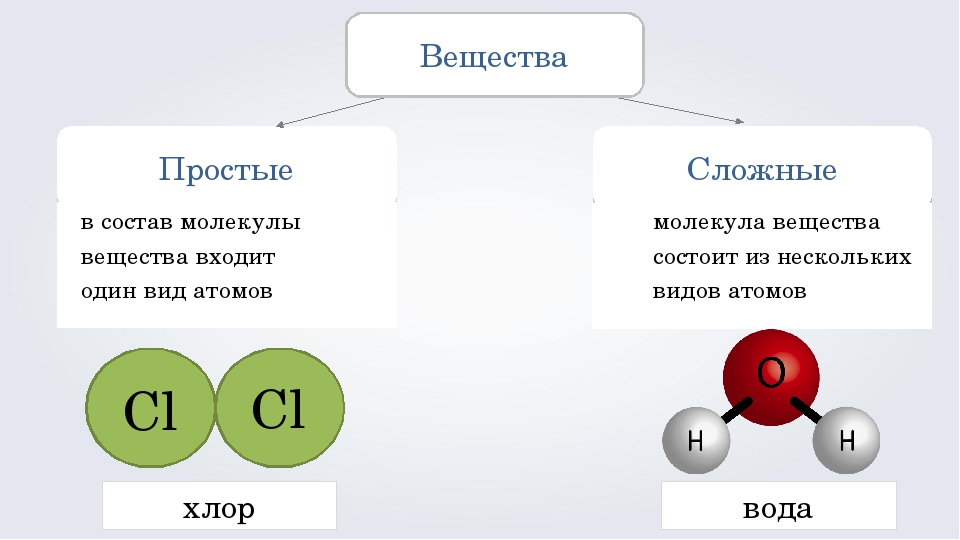
Названия простых веществ
Сложность: лёгкое |
1 |
| 2. |
Названия сложных веществ
Сложность: лёгкое |
1 |
3.
|
Формулы простых веществ
Сложность: лёгкое |
1 |
| 4. |
Простое вещество и химический элемент
Сложность: среднее |
2 |
5.
|
Сложность: среднее |
2 |
| 6. |
Отличия металлов от неметаллов
Сложность: среднее |
2 |
7.
|
Формулы простых и сложных веществ
Сложность: сложное |
3 |
| 8. |
Аллотропия кислорода
Сложность: сложное |
4 |
9.
|
Установи формулу сложного вещества Сложность: сложное | 4 |
Металлы и неметаллы — урок. Химия, 8–9 класс.
Простые вещества по их свойствам делят на металлы и неметаллы.
Металлы имеют немолекулярное строение и сходные физические свойства. Все металлы (кроме ртути) при обычных условиях представляют собой твёрдые вещества. Их легко узнать по характерному металлическому блеску. Металлы хорошо проводят тепло и электрический ток.
Их легко узнать по характерному металлическому блеску. Металлы хорошо проводят тепло и электрический ток.
Рис. \(1\). Ртуть
Рис. \(2\). Железо
При ударе металлы не разрушаются, а меняют свою форму, т. е. им характерна пластичность. Металлы можно ковать, прокатывать в листы, вытягивать в проволоку.
Неметаллы не имеют общих физических свойств и не похожи на металлы. У них отсутствует металлический блеск. У большинства неметаллов низкие электропроводность и теплопроводность.
Большинство неметаллов имеет молекулярное строение. Такие вещества при обычных условиях являются газами (водород, кислород, азот, озон, фтор, хлор, инертные газы), жидкостями (бром) или хрупкими легкоплавкими твёрдыми веществами (сера, иод, белый фосфор).
Рис. \(3\). Хлор
Рис. \(4\). Бром
Рис.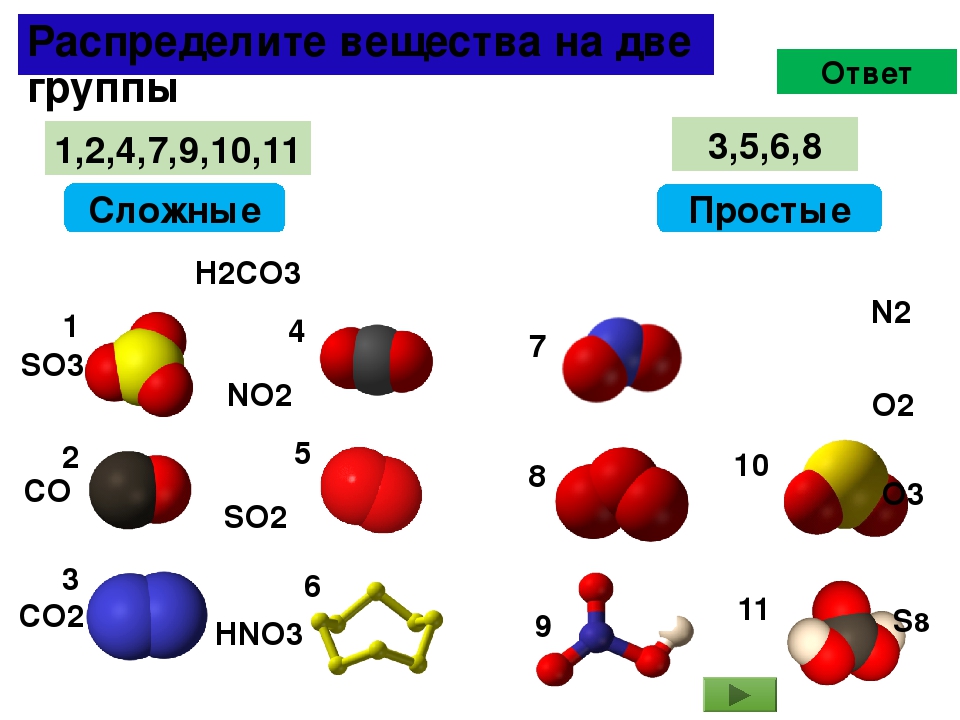 \(5\). Сера
\(5\). Сера
Некоторые неметаллы имеют немолекулярное строение, например, красный фосфор, кремний, алмаз и графит. Такие вещества твёрдые, тугоплавкие, нелетучие.
Рис. \(6\). Уголь
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы. Химические элементы металлы, образующие простые вещества с металлическими свойствами, располагаются в периодической таблице слева ниже диагонали «водород — бор — кремний — мышьяк — теллур — астат — № \(118\)». Вверху справа располагаются химические элементы неметаллы, которые образуют простые вещества с неметаллическими свойствами.
Рис. \(7\). Периодическая таблица
Элементов металлов больше, чем элементов неметаллов. Значит, и простых веществ с металлическими свойствами существует больше, чем с неметаллическими.
Источники:
Рис. 1. Ртуть https://www.shutterstock.com/ru/image-illustration/shiny-mercury-hg-metal-drops-droplets-373508821
1. Ртуть https://www.shutterstock.com/ru/image-illustration/shiny-mercury-hg-metal-drops-droplets-373508821
Рис. 2. Железо https://www.shutterstock.com/ru/image-photo/99-fine-electrolytic-iron-isolated-on-1687925125
Рис. 3. Хлор https://image.shutterstock.com/image-photo/chlorine-gaz-glass-round-bottom-600w-713676862.jpg
Рис. 4. Бром https://image.shutterstock.com/image-photo/macroview-on-ampoule-element-no-600w-1739647871.jpg
Рис. 5. Сера https://www.shutterstock.com/ru/image-photo/yellow-natural-native-sulfur-crystal-isolated-729259936
Рис. 6. Уголь https://www.shutterstock.com/ru/image-photo/activated-charcoal-isolated-on-white-background-1446133922
Рис. 7. Периодическая таблица © ЯКласс
Простые и сложные вещества. Элементы
Простые и сложные вещества. Элементы. Итак, ны знаем, что окись ртути можно разложить на ртуть и кислород, что сернистое железо можно получить из серы и железа. Следовательно, окись ртути и сернистое железо — сложные вещества. Что же касается ртути, кислорода, серы и железа, то они никакими химическими способами не [c.21]
Что же касается ртути, кислорода, серы и железа, то они никакими химическими способами не [c.21]Закон кратных отношений состоит в том, что при образовании какого-либо простого или сложного вещества элементы в его молекулу входят в количествах, равных или кратных их атомной массе. Если же отнести этот закон к объемам вступающих в реакцию веществ, то он примет следующую формулировку если вещества вступают в химическую реакцию в газообразном состоянии, то они при одинаковых условиях (Р и i) могут соединяться только в объемах, которые относятся между собой как целые числа.
Простые и сложные вещества. Элементы. Химические обозначения и формулы [c.44]
Изучая влияние электрического тока на химические вещества, ученые смогли выделить ряд новых элементов. Вообще за полтора века, прошедшие с того времени, когда Бойль ввел понятие элемент (см. гл. 3), было открыто поразительно много веществ, отвечающих этому определению.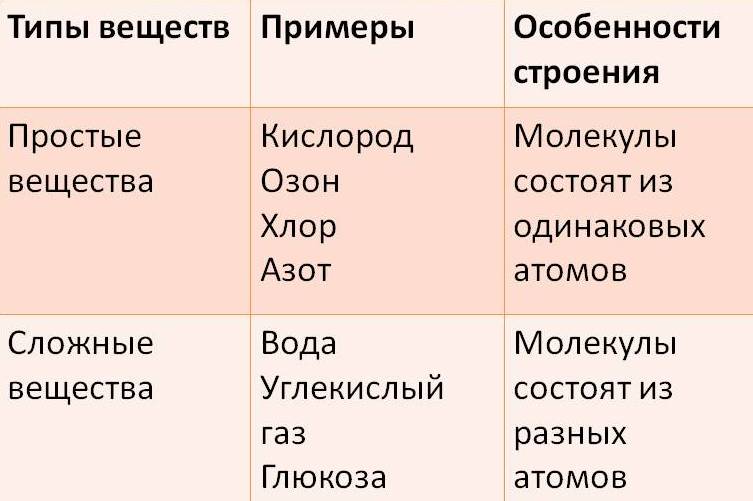 Более того, было установлено, что некоторые простые и сложные вещества содержат неоткрытые элементы, которые химики не могли пока ни выделить, ни изучить.
Более того, было установлено, что некоторые простые и сложные вещества содержат неоткрытые элементы, которые химики не могли пока ни выделить, ни изучить.
Одна из универсальных констант в физике и химии — число молекул в моле простого или сложного вещества и число атомов в моле атомов элемента — называется постоянной Авогадро и составляет 6,02 10 . [c.21]
Всякое изложение какого-либо материала строится на последовательности определений. Сначала формулируются определения наиболее общих понятий, затем с их помощью определяются менее общие понятия, далее — более частные и т. п. Таким способом строится иерархия (подчиненность) определений в изложении. Распределите нижеперечисленные термины в иерархическом порядке кислотный оксид, смесь, простое вещество, оксид, сложное вещество, основной оксид, элемент, молекула, атом, материя, вещество. [c.16]
Согласно формулировке закона Д. И. Менделеева периодичность изменения свойств касается не только химических элементов, но и образуемых ими простых и сложных веществ.
Получение простых веществ из сложных основано на окислительно-восстановительных реакциях. Окисление применяется для получения простых веществ элементов, степени окисления которых в соответствующих соединениях отрицательны, а восстановление для получения простых веществ элементов, проявляющих в соответствующих соединениях положительные степени окисления. [c.192]
Базируясь на своих представлениях о строении материи, Ломоносов разработал так называемую «корпускулярную теорию строения вещества», в которой впервые разграничил понятия атома, элемента, молекулы, простого вещества. С этого времени под «элементом» стали понимать элемент химический, а не абстрактный элемент материи. Правильнее было бы говорить «элемент химии», а не «химический элемент».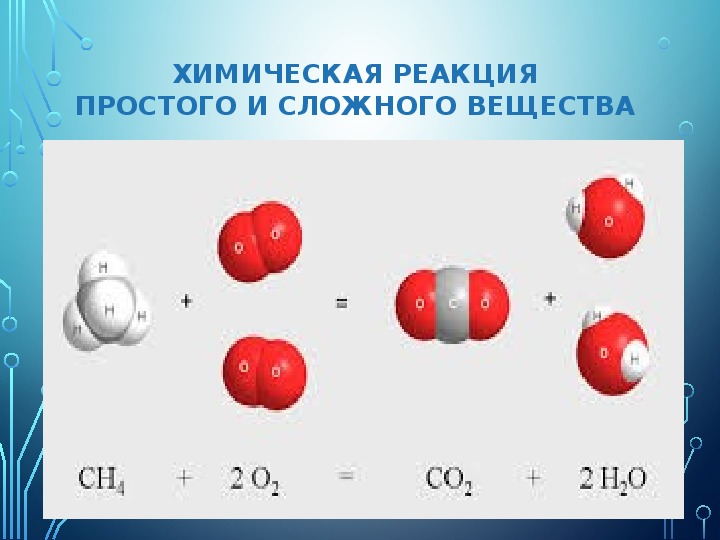
 22]
22]
Что называется эквивалентом вещества (элемента, простого вещества, сложного вещества) [c.7]
Атом есть наименьшая частица элемента в молекулах простых и сложных веществ. [c.6]
Природа не приготовила для людей ни простых, ни сложных веществ в особо чистом состоянии. Хотя ряд веществ, таких, как алмаз, кварц, самородное золото и т. д., и встречается в природе на первый взгляд в чистом виде, но и эти вещества содержат разнообразные примеси — одних больше, других меньше. Если мы, например, имеем дело с серой самородной, то уже визуально заметно, что она загрязнена примесями в ней кроме атомов серы, составляющих основную массу вещества, находятся атомы селена, мышьяка, железа, углерода и других элементов. Любое простое или сложное вещество —это смесь многих веществ, и задача получения индивидуального вещества состоит в выделении из этой смеси основного вещества. При получении того или иного вещества с помощью химической реакции примеси, содержащиеся в реагентах, частично переходят в продукты реакции. Кроме того, при этом всегда образуются побочные соединения, загрязняющие получаемое вещество. Таким образом, получение простых и сложных веществ в высокочистом состоянии заключается в глубокой их очистке и освобождении от примесей. Отличие от обычного разделения здесь состоит в том, что при получении вещества высокой чистоты глубина разделения должна быть значительно большей, а материал стенок аппаратуры не должен в сколько-нибудь заметной степени загрязнять очищаемое вещество. [c.9]
При получении того или иного вещества с помощью химической реакции примеси, содержащиеся в реагентах, частично переходят в продукты реакции. Кроме того, при этом всегда образуются побочные соединения, загрязняющие получаемое вещество. Таким образом, получение простых и сложных веществ в высокочистом состоянии заключается в глубокой их очистке и освобождении от примесей. Отличие от обычного разделения здесь состоит в том, что при получении вещества высокой чистоты глубина разделения должна быть значительно большей, а материал стенок аппаратуры не должен в сколько-нибудь заметной степени загрязнять очищаемое вещество. [c.9]
Используется также термин полиморфизм ( много форм ). Под этим термином часто понимают разные кристаллические структурные формы простого и сложного вещества говорят, например, о полиморфных модификациях металлов и сложных вещ,еств (Т 02, 8102 и др.). Необходимо эти два понятия — аллотропия и полиморфизм —разграничивать. Понятие аллотропия относят к модификациям простых веществ, которые образует один и тот же элемент, тогда как термин полиморфизм целесообразно применять при рассмотрении модификаций одного и того же сложного вещества (АиОз, ТЮг и др. ) таким образом три понятия — аллотропия, полиморфизм и изоморфизм — получат свою логическую качественную дифференциацию. [c.33]
) таким образом три понятия — аллотропия, полиморфизм и изоморфизм — получат свою логическую качественную дифференциацию. [c.33]
Для объяснения свойств химических элементов, а также свойств образуемых ими простых н сложных веществ максимально используются представления о строении атомов и молекул. [c.3]
При взаимодействии молекул простых веществ образуются молекулы сложных веществ. В этих молекулах нельзя обнаружить свойств, характерных для исходных простых веществ, так как молекулы сложных веществ состоят из атомов химических элементов [c.8]
В результате проявления такого свойства, как валентность, атомы химических элементов взаимодействуют друг с другом, образуя молекулы простых или сложных веществ. Таким образом, молекула рассматривается как наименьшая частица простого или сложного вещества, сохраняющая его состав и свойства. [c.95]
Большинство простых и сложных веществ энергично взаимодействуют с кислородом при повышенной температуре. Взаимодействие многих простых и сложных веществ с кислородом сопровождается выделением большого количества тепла. Таким образом, кислород по химическим свойствам относится к весьма активным элементам (атомарный кислород значительно активнее молекулярного). Он непосредствен- [c.163]
Взаимодействие многих простых и сложных веществ с кислородом сопровождается выделением большого количества тепла. Таким образом, кислород по химическим свойствам относится к весьма активным элементам (атомарный кислород значительно активнее молекулярного). Он непосредствен- [c.163]
Широкое применение полупроводников привело к созданию новых сложных полупроводниковых систем на основе химических соединений. Поиск таких соединений базировался, в первую очередь, на аналогии их структуры со структурой элементарных полупроводников. Так, согласно правилу октета следует ожидать, что полупроводниковыми свойствами будут обладать не только простые вещества типа AIV Д1У но и сложные соединения типа В», А В , А >В и А В , в кристаллической решетке которых на каждый атом приходится такое же количество электронов, как и в кристаллах простых веществ элементов IV группы. Действительно, полупроводниковыми свойствами обладают кристаллы следующих соединений, которые имеют тетраэдрическую структуру [c. 313]
313]
Важной особенностью атомной массы как характеристики химического элемента является то, что она не зависит от его состояния в природе находится он в свободном (в виде изолированных атомов) или в связанном состоянии (в составе простых или сложных веществ, конденсированном состоянии, во внешнем поле и т.д.). [c.13]
Закон соединительных весов или кратных отношений состоит в том, что при образованин какого-либо простого или сложного вещества элементы в молекулу последнего входят в количествах, равных или кратных их атомному весу. Если же отнести этот закон к объемам вступающих в реакцию веществ, то он примет следующую формулировку если вещества вступают в химическую реакцию в газообразном состоянии, то они при одинаковых условиях (Р и t) могут соединяться только в объемах, которые относятся между собой, как целые числа. Так, например, при образовании воды (2Н2- -02 = = 2Н2О) 2 г-мол (т. е. 4,0 г) водорода соединяются с 1 г-мол (32,0 г) кислорода, или, что то же, на 2 объема (например 2 м ) водорода при образовании воды необходим 1 объем (1 м ) кислорода. Если мы возьмем для этой реакции 10 г водорода и 20 г кислорода, то по окончании реакции найдем, что 7,5 г Hg останутся свободными, [c.46]
Если мы возьмем для этой реакции 10 г водорода и 20 г кислорода, то по окончании реакции найдем, что 7,5 г Hg останутся свободными, [c.46]
Свойстна элементов а образуемых ими простых и сложных веществ ниходятсп в периодической зависимости от заряда ядра атомов элементов. [c.61]
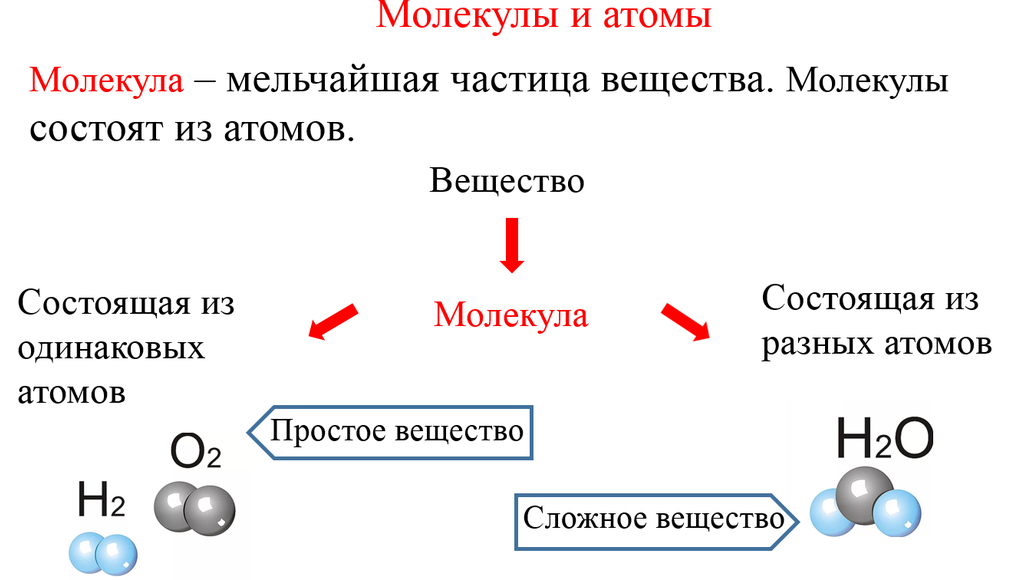
Отсюда просты вещестсс. — — это вещества, состоящие из атомов одного того же химического элемента, а сложные вещества (химические соединения) образуются при химтпеском взаи .юдействии атомов разных химических элементов. [c.10]
Химическая формула сложного вещества отражает, помимо его элементного состава, количественные соотношения между числом атомов различных элементов в молекуле, например вода — Н2О, оксид фосфора (V) — Р2О5, сахароза — С,2Н220,, и т. д. Для твердых веществ, представляющих собой молекулярные ассоциаты или агрегаты, в химических формулах учитывается простейшее сочетание их атомов, например ЫаС1. [c.11]
[c.11]
Название сложного вещества согласно его формуле читается справа налево ЫаНСОз — гидрокарбонат натрия, Ы1 — иодид лития. Простые вещества называют, как правило, по названию соответствующего элемента натрий, сера, ртуть, золото. Аллотропные модификации указываются дополнительно, например белый фосфор, а-олово, или имеют специальное название озон Оз. [c.96]
Простые вещества. Зависимость строения и свойств просты.х веществ от иоложения алементов в периодической системе. Получение простых веществ. Сложные вещества. Бинарные соединения. Двухэлементные соединения. Зависимость устойчивости и свойств двухэлементных соединений от атомного номера элемента с положительной степенью окисления. Неорганические полимеры с тетраэдрическими связями. Трехэлементные соединения. Их строение, свойства. Смешанные соединепия. Твердые расгвор1л. Эвтектические смеси. Оксосоединения /i-элементов. Силикат(.1, Алюмосиликаты. [c.181]
Химические элементы на Земле обычно находятся в составе сложных веществ. В земной коре преобладают кислородные соединения, из которых нанболее распространены силикаты, слагающие все главнейшие горные породы. Заметно менее распространены карбонаты, еще меньше — сульфидные и сульфатные минералы. Некоторые элементы нстречаются в природе в виде простых ве]цеств в самородном состоянии В таблице 5 показаны наиболее часто встречающиеся формы существования элементов на Земле. [c.192]
В земной коре преобладают кислородные соединения, из которых нанболее распространены силикаты, слагающие все главнейшие горные породы. Заметно менее распространены карбонаты, еще меньше — сульфидные и сульфатные минералы. Некоторые элементы нстречаются в природе в виде простых ве]цеств в самородном состоянии В таблице 5 показаны наиболее часто встречающиеся формы существования элементов на Земле. [c.192]
Все сложные биосинтетические вещества образуются из простейших химических соединений вроде СО2, Н2О, КНз и др. Жизненный процесс переводит эти соединения в сложнейшие вещества, характеризующие живое вещество, например, в клетчатку, белки, жиры, лигнин, порфирины и другие вещества, существующие и развивающиеся в результате однажды направленного биосинтеза. Гибель живого вещества прежде всего разрушает те связи между элементами, которые, собственно говоря, и являются признаком жизни, и тогда начинается рертоградная эволюция в исходные простые химические соединения. Если нефть происходит из живого вещества, то ее углеводородный характер является лишь одним из начальных этапов превращения сложных гетерогенных соединений в более простые и относительно устойчивые соединения углеводородного типа. [c.202]
Если нефть происходит из живого вещества, то ее углеводородный характер является лишь одним из начальных этапов превращения сложных гетерогенных соединений в более простые и относительно устойчивые соединения углеводородного типа. [c.202]
В то же время теория процессов горения до настоящего времени развита недостаточно полно, отсутствуют методы расчета должной точности. В результате возникает необходимость длительной кропотливой опытной доводки почти всех устройств и агрегатов, в которых протекает процесс горения. Можно назвать причины существующего положения. Во-первых, главный участник процесса горения — топливо — является комплексом природных органических веществ очень сложного химического строения. Правда, при нагреве и взаимодействии с окислителем происходит распад этих комплексов на простые соединения и элементы, но при анализе процесса горения невозможно обойтись без учета поведения горючего в его исходной форме и промежуточных состояниях. А это крайне, затрудняет изучение процесса.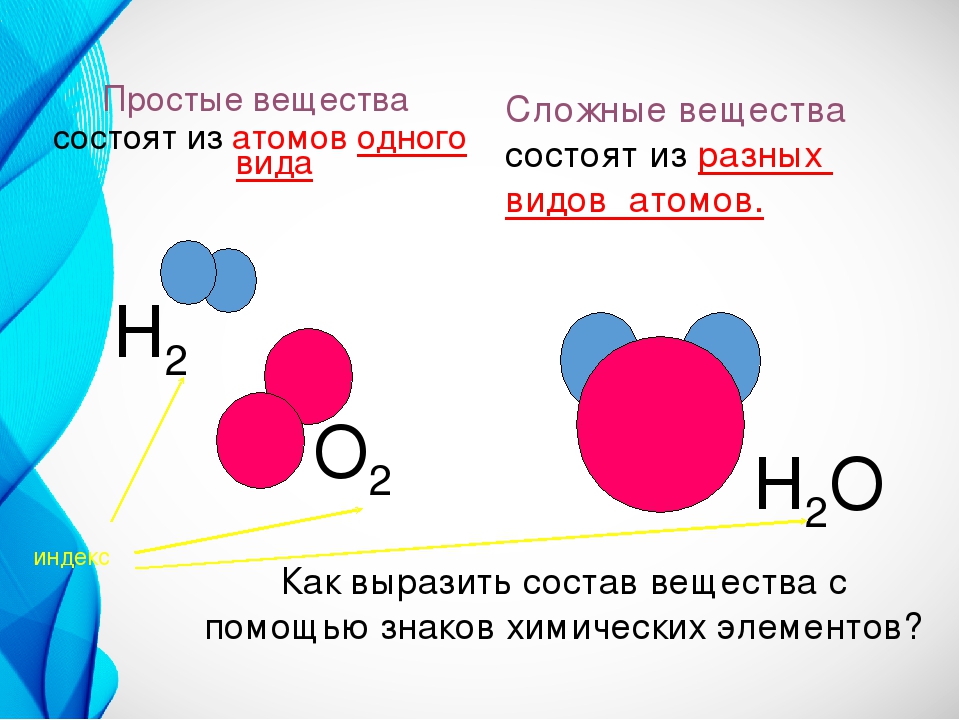 Во-вторых, в процессе горения, так же, как и в других химических пронессах, обязательны два этапа создание молекулярного контакта между горючим и окислителем (физический этап) и само взаимодействие молекул с образованием продуктов реакции (химический этап). При этом второй этап протекает только у молекул, находящихся в особом энергетически или кинетически возбужденном состоянии. Возбуждаются же молекулы в результате начавшегося процесса. Поэтому при изучении процесса горения нельзя рассматривать участвующие в нем вещества как однородную массу одинаковых средних молекул. Даже при рассмотрении простейших реакций горения необходимо учитывать различия между отдельными молекулами, составляющими сложную полисистему. В-третьих, горение принципиально не является равновесным процессом. При горении обязательно возникают неоднородности состояния молекул, их концентраций, неравномерности полей температур и скоростей потоков. Из этого вытекает необходимость одновременного решения нестационарных задач массо- и тепло-переноса и химической кинетики в движущихся потоках, причем наиболее часто при турбулентности, вызванной самим процессом горения.
Во-вторых, в процессе горения, так же, как и в других химических пронессах, обязательны два этапа создание молекулярного контакта между горючим и окислителем (физический этап) и само взаимодействие молекул с образованием продуктов реакции (химический этап). При этом второй этап протекает только у молекул, находящихся в особом энергетически или кинетически возбужденном состоянии. Возбуждаются же молекулы в результате начавшегося процесса. Поэтому при изучении процесса горения нельзя рассматривать участвующие в нем вещества как однородную массу одинаковых средних молекул. Даже при рассмотрении простейших реакций горения необходимо учитывать различия между отдельными молекулами, составляющими сложную полисистему. В-третьих, горение принципиально не является равновесным процессом. При горении обязательно возникают неоднородности состояния молекул, их концентраций, неравномерности полей температур и скоростей потоков. Из этого вытекает необходимость одновременного решения нестационарных задач массо- и тепло-переноса и химической кинетики в движущихся потоках, причем наиболее часто при турбулентности, вызванной самим процессом горения. [c.4]
[c.4]
Со времени Лавуазье все вещества разделяют на простые вещества, сложные вещества (соединения) и смеси. Простое вещество состоит из атомов какого-нибудь одного элемента, соединения— из химически связанных атомов двух или более элементов. Простые вещества и соединения представляют собой химические иудивиды или индивидуальные вещества. Каждое из них обладает определенным составом, строением и только ему одному присущим набором свойств, обусловленных этим составом и строением. Химические индивиды отличаются от механических смесей однородностью, т. е. в их массе нет включений иного состава н строения. [c.12]
Давно известно, что настойчивое выщелачивание кислотой некоторых силикатов, алюмосиликатов и боросиликатов приводит к почти полному удалению из их состава щелочных и щелочноземельных оксидов и выделению твердого кремнеземного или алюмокремнеземного остатка обработка алюминиево-никелевого сплава щелочью позволяет получать пористый никель Ренея. Обугливание различных углеродистых веществ, активирование угля водяным паром позволяет другим путем достигать аналогичного результата — выделения из состава сложного твердого вещества более простого твердого вещества, состоящего из атомов элементов, связанных особо прочными ковалентными связями. [c.61]
Обугливание различных углеродистых веществ, активирование угля водяным паром позволяет другим путем достигать аналогичного результата — выделения из состава сложного твердого вещества более простого твердого вещества, состоящего из атомов элементов, связанных особо прочными ковалентными связями. [c.61]
Химические формулы. Химическими формулами пользуются для обозначения состава простых и сложных веществ. Химическая формула вещества показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента входит в состав его молекулы. Например, формула N2 показывает, что молекула азота состоит из двух атомов азота aS04 — в молекуле сульфата кальция содержится один атом кальция, один атом серы и четыре атома кислорода. [c.27]
Кислород образует соединения со всеми химическими элементами, кроме гелия, неона и аргона. С большинством элементов он взаимодействует непосредственно (кроме галогенов, золота и платины). Скорость взаимодействия кислорода как с простыми, так и со сложными веществами зависит от природы вещества и от температуры. Некоторые вещества, например оксид азота (II), гемоглобин крови, уже при комнатной температуре соединяются с кислородом воздуха со значительной скоростью. Многие реакщ1и окисления ускоряются катализаторами. Например, в присутствии дисперсной платины смесь водорода с кислородом воспламеняется при комнатной температуре. Характерной особенностью многих реакций соединения с кислородом является выделение теплоты и света. Такой процесс называется горением. [c.455]
Некоторые вещества, например оксид азота (II), гемоглобин крови, уже при комнатной температуре соединяются с кислородом воздуха со значительной скоростью. Многие реакщ1и окисления ускоряются катализаторами. Например, в присутствии дисперсной платины смесь водорода с кислородом воспламеняется при комнатной температуре. Характерной особенностью многих реакций соединения с кислородом является выделение теплоты и света. Такой процесс называется горением. [c.455]
Сложными веществами или химическими соединениями называются такие, молекулы которых состоят из атомов двух и более элементов. Например Н2О, СО2, СаСОз и т. д. Атомы, вступившие в химическое соединение друг с другом, не остаются неизменными. Они оказывают друг на друга взаимное влияние. Вот почему молекулы сложного вещества обладают только присущими им свойствами и их нельзя рассматривать как простую сумму атомов. [c.8]
Реакции замеи ения, когда атомы одного элемента замещают атомы другого элемента в молекулах сложных веществ.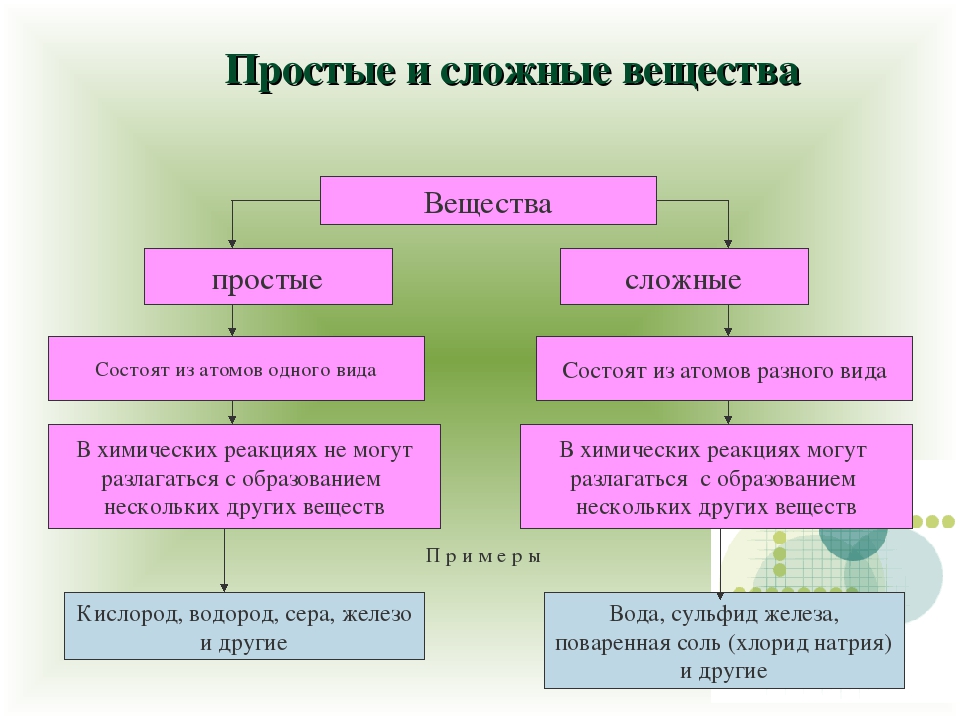 В результате образуются новые (простое и сложное) вещества [c.12]
В результате образуются новые (простое и сложное) вещества [c.12]
Понятие о химическом элементе. Необходимость четко различать понятия элемент и простое вещество впервые отметил Д. И. Менделеев. Полезно сделать ясное различие между понятием о простом теле как об отдельном однородном веществе ио нем же как о вещественной части или элементе сложных вещестЕ . Можно дать первоначальное определение понятия элемента химический элемент есть вид атомов, входящих в состав простых и сложных веществ, характеризующийся определенной совокупностью свойств. [c.6]
В эмиссионном спектральном анализе исследуемого вещества пробу (анализируемый объект) испаряют и возбуждают свечение паров посредством пламени электрической дуги, высоковольтной искры или другим источииком возбуждения. Атомы каждого элемента в возбужденном состоянии испускают волны только определенной длины, так называемое характеристическое излучение. Благодаря этому оказывается возможным проводить качественный эмиссионный спектральный анализ не только простых, но и сложных веществ и их смесей. [c.224]
[c.224]
В зависимости от того, нз атомов каких элементов построены вещества, их делят иа простыв и сложныг (сложные вещества называют химическими соединениями). [c.119]
Все вещества делятся на простые, — состоящие из одного элемента, — и сложные, в состав которых входит два или более элементов. Сложные вещества, в свою очередь, принято делить, на органические, к которым относят почти все соединения углерода (кроме простейших его соединений, таких, например, как СО, СОа, Н2СО3, НСМ), и неорганические. [c.8]
При решении задач необходимо помнить, что вещества состоят из молекул, которые, в свою очередь, состоят из атомов. Для обозначения состава молекул как простых, так и сложных веществ пользуются химическими формулами. Последние показывают, из каких элементов состоит вещество и сколько атомов каждого элемента входит в состав молекулы. Химическая формула отображает качественный и количественный состав молекулы.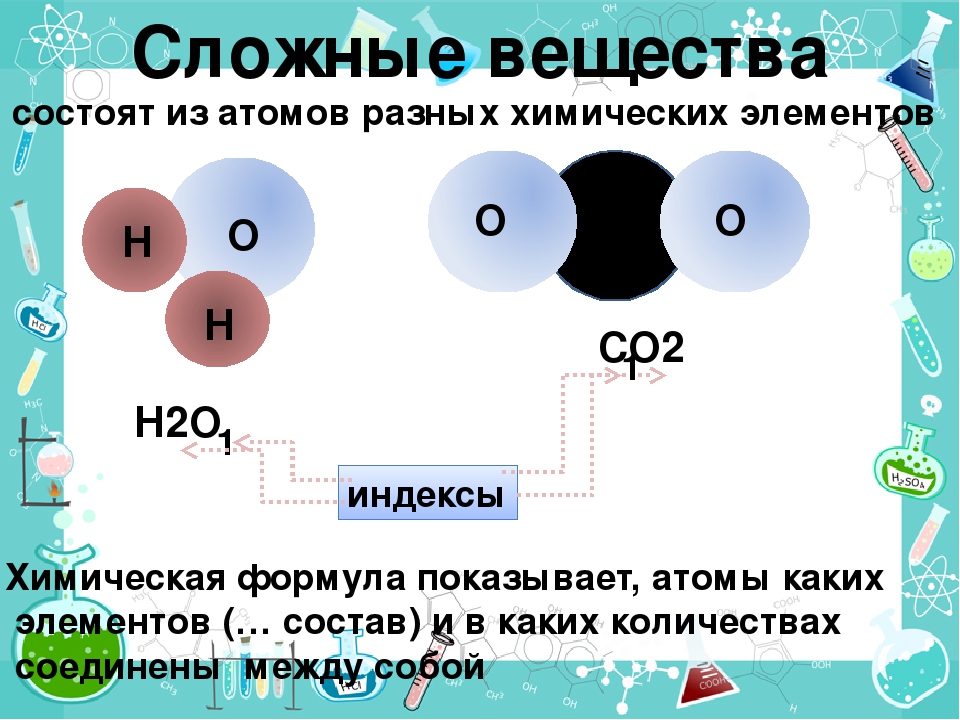 Например, оксид алюминия AI2O3 состоит из атомов алюминия и кислорода. Индексы 2 и 3 указывают на количественный состав соединения. [c.16]
Например, оксид алюминия AI2O3 состоит из атомов алюминия и кислорода. Индексы 2 и 3 указывают на количественный состав соединения. [c.16]
Простые вещества
В природе существуют простые и сложные вещества. Главное отличие между ними — в их составе. Так, простые вещества включают атомы одного элемента. Их (простых веществ) кристаллы можно синтезировать в лабораторных, а иногда и в домашних условиях. Однако часто для хранения полученных кристаллов необходимо создавать определенные условия.
Существует пять классов, на которые разделены простые вещества: металлы, полуметаллы, неметаллы, интерметаллиды и галогены (не встречающиеся в природе). Они могут быть представлены атомарными (Ar, Не) или молекулярными (О2, Н2, О3) газами.
В качестве примера можно взять простое вещество кислород. Оно включает молекулы, состоящие из двух атомов элемента Кислород. Или, например, вещество железо состоит из кристаллов, включающих только атомы элемента Железо. Исторически принято называть простое вещество по названию элемента, атомы которого входят в его состав. Строение этих соединений может быть молекулярным и немолекулярным.
Исторически принято называть простое вещество по названию элемента, атомы которого входят в его состав. Строение этих соединений может быть молекулярным и немолекулярным.
Сложные вещества включают атомы различного вида и при разложении могут образовывать два (или больше) соединения. Например, вода при расщеплении формирует кислород и водород. При этом не каждое соединение можно разложить на простые вещества. Например, сульфид железа, сформированный атомами серы и железа, не поддается расщеплению. В этом случае, для того чтобы доказать, что соединение является сложным и включает разнородные атомы, применяют принцип обратной реакции. Другими словами, при помощи исходных компонентов получают сульфид железа.
Простые вещества являются формами химических элементов, существующих в свободном виде. Сегодня науке известно более четырехсот видов этих элементов.
В отличие от сложных веществ, простые нельзя получить из других простых веществ. Их также нельзя разложить на другие соединения.
Один химический элемент может сформировать разные типы простых веществ. (Например, элемент Кислород формирует трехатомный озон и двухатомный кислород, а Углерод способен образовать алмаз и графит). Это свойство называется аллотропией. Аллотропные модификации различаются по строению и способу размещения молекул в кристаллах или по составу самих молекул (атомов) элемента. Способность к формированию нескольких типов простых веществ обусловлена атомным строением, которое определяет вид химической связи, а также особенностями строения молекул и кристаллов.
Все аллотропные модификации обладают свойством переходить друг в друга. Разные типы простых веществ, сформированные одним химическим элементом, могут иметь разные физические свойства и разный уровень химической активности. Так, например, кислород проявляет меньшую, чем озон, активность, а температура плавления фуллерена, например, меньше, чем у алмаза.
В нормальных условиях для одиннадцати элементов простые вещества будут представлять собой газы (Ar, Xe, Rn, N, H, Ne, O, F, Kr, Cl, He,), для двух жидкости (Br, Hg), а для прочих элементов – твердые тела.
При температуре, приближенной к комнатной, пять металлов будут принимать жидкое или полужидкое состояние. Это связано с тем, что температура их плавления почти равна комнатной температуре. Так, ртуть и рубидий плавятся при 39 градусах, франций – при 27, цезий – при 28, а галлий при 30 градусах.
Следует отметить, что понятия «химический элемент», «атом», «простое вещество» смешивать не следует. Так, например, атом имеет определенное, конкретное значение и существует реально. Определение «химический элемент» является в целом абстрактным, собирательным. В природе элементы присутствуют в форме атомов свободных или химически связанных. При этом характеристики простых веществ (совокупности частиц) и химических элементов (изолированных атомов конкретного вида) имеют свои особенности.
ГДЗ (ответы) Химия 7 класс Григорович А.В. §12 Простые и сложные вещества » Допомога учням
Другие задания смотри здесь…
Контрольные вопросы
Вопрос 1 Дайте определения простым и сложным веществам. Вещество, образованное одним химическим элементом, является простым. Сложные вещества состоят из нескольких химических элементов, их также называют химическими соединениями.
Вещество, образованное одним химическим элементом, является простым. Сложные вещества состоят из нескольких химических элементов, их также называют химическими соединениями.
Вопрос 2 На какие группы веществ разделяют простые и сложные вещества? Простые вещества делятся на металлы и неметаллы, а сложные — на органические и неорганические вещества.
По каким физическим свойствам они отличаются? Металлы — в обычных условиях твердые (кроме ртути), имеют металлический блеск, пластичные (ковкие), серебристо-белого цвета или серого (кроме меди и золота), хорошо проводят электрический ток и теплоту. Неметаллы — в обычных условиях газообразные и твердые вещества (только бром — жидкость), не имеют металлического блеска (кроме графита и йода), хрупкие, имеют разный цвет (например, сера — желтый, графит — черный), не проводят или плохо проводят электрический ток (кроме графита) и теплоту.
Вопрос 3 Какими элементами образованы металлы, а какими — неметаллы? Металлические элементы образуют металлы, а неметаллические — неметаллы.
Вопрос 4 В чем заключается различие между понятиями:
а) «химический элемент» и «простое вещество»;
Химический элемент — это определенный вид атомов, то есть понятие применяют для классификации атомов, а простое вещество — металл или неметалл — образованное определенным видом атомов, то есть химическим элементом, поэтому простое вещество является формой существования химического элемента в свободном состоянии. Химический элемент может образовывать не одно, а несколько простых веществ — аллотропных модификаций, которые отличаются друг от друга строением или составом молекул. Например, атомы Карбона образуют несколько простых веществ: алмаз, графит, карбин, фуллерен, которые отличаются расположением атомов друг относительно друга, а атомы Оксигена образуют две аллотропные модификации: кислород (O2) и озон (O3), которые отличаются составом молекул.
б) «простое вещество» и «сложное вещество»;
Простое вещество образованное одним химических элементом, а сложное — несколькими.
в) «сложное вещество» и «смесь веществ»?
Сложное вещество (химическое соединение) описывается химической формулой, имеет постоянный состав, а простые вещества, из которых образованное химическое соединение, не хранят свои свойства, физически неделимы. Смесь веществ нельзя описать химической формулой, имеет переменный состав, компоненты смеси сохраняют свои свойства, можно разделить физическими методами.
Вопрос 5 Какие вещества относят к органическим, а какие — к неорганическим? Неорганические вещества могут состоять из атомов любых элементов, а в состав органических соединений обязательно входят атомы Карбона.
Приведите примеры.
Органические вещества: метан CH4, сахароза C12H22O11, глюкоза C6H12O6, этиловый спирт C2H5OH, уксусная кислота СH3COOH.
Неорганические вещества: поваренная соль NaCl, мел CaCO3, водород H2, углекислый газ СО2, кислород O2, хлор Cl2.
Задания для усвоения материала
Упражнение 1 Какие физические свойства характерны для алюминия:
а) твердый;
б) газообразный;
в) блестящий;
г) хрупкий;
д) пластичный;
е) хорошо проводит электрический ток;
ж) не проводит электрический ток;
з) быстро нагревается?
Ответ: а),в),д),е),з)
Упражнение 2 Из приведенного перечня выпишите названия неметаллических элементов: Гидроген, Аурум, Йод, Плюмбум, Аргентум, Сульфур, Меркурий.
Ответ: Гидроген, Йод, Сульфур.
Упражнение 3 Выпишите отдельно формулы простых и сложных веществ: Fe2O3, Mg, H2, NaHCO3, Au, Cl2, Na, Cu(OH)2, He, Cu, NaCl, S8. Подчеркните символы, которые обозначают простые вещества — металлы.
| Формулы простих веществ | формулы сложных веществ |
Mg, H2, Au, Cl2, Na, He, Cu, S8. |
Fe2O3, NaHCO3, Cu(OH)2, NaCl |
Упражнение 4 Приведите по пять примеров металлических и неметаллических элементов.
|
Металлические элементы |
Неметалические элементы |
|
Кальций Ca, Феррум Fe, Алюминий Al, Аурум Au, Купрум Cu |
Гидроген H, Оксиген O, Нитроген N, Фосфор P, Силиций Si |
Упражнение 5 Вычислите массовую долю Натрия в поваренной соли (NaCl) и пищевой соде (NaНCO3). В каком из этих сложных веществ содержание Натрия больше?
Mr(NaCl)=Ar(Na)+Ar(Cl)=23+35,5=58,5
Mr(NaHCO3)=Ar(Na)+Ar(Н)+Ar(C)+3•Ar(O)=23+1+12+3•16=84
w1(Na)=Ar(Na)/Mr(NaCl)=23:58,5=0,393, или 39,3%
w2(Na)=Ar(Na)/Mr(NaHCО3)=23:84=0,274, или 27,4%
27,4% <39,3%
Ответ: массовая доля Натрия больше в поваренной соле (NaCl).
Упражнение 6 Как можно доказать, что целлюлоза (основное вещество, из которого состоит древесина) и сахароза являются органическими веществами? Целлюлоза и сахароза обугливаются при нагревании, поэтому являются органическими веществами.
Упражнение 7 На рисунке 68 изображены модели простых и сложных веществ, а также их смесей. Для каждого случая a) — e) определите, модели каких веществ (простых или сложных) изображены, запишите химические формулы этих веществ. Определите, в каком случае изображена смесь веществ, составьте химические формулы веществ в смеси.
а) простое вещество — кислород О2;
б) смесь простых веществ: кислорода О2 и водорода Н2;
в) простое вещество — углерод С;
г) сложное вещество — углекислий газ СО2;
д) сложное вещество — метан СН4;
є) смесь простого и сложного веществ: кислорода О2 и воды Н2О
Упражнение 8 Малахит (вещество зеленого цвета) при нагревании разлагается на купрум (II) оксид CuO (порошок черного цвета), воду H2O и углекислый газ CO2. Является ли малахит смесью купрум (II) оксида, воды и углекислого газа? Смеси сохраняют свойства компонентов, поэтому малахит должен быть черным, а он зеленого цвета. Следовательно малахит — это химическое соединение, которое разложилось в результате нагрева на различные сложные вещества.
Является ли малахит смесью купрум (II) оксида, воды и углекислого газа? Смеси сохраняют свойства компонентов, поэтому малахит должен быть черным, а он зеленого цвета. Следовательно малахит — это химическое соединение, которое разложилось в результате нагрева на различные сложные вещества.
Из каких химических элементов состоит малахит? Купрум Сu, Оксиген О, Гидроген H, Карбон C.
Упражнение 9 Вещество хлор Cl2 является очень ядовитым газом, но вместе с тем атомы Хлора входят в состав поваренной соли NaCl, которую мы употребляем каждый день. Нет ли в этом противоречия? Нет
Ответ обоснуйте. Химические соединения не хранят свойств простых веществ, из которых они образованы. Если же хлор и натрий прореагируют друг с другом, образуется новое соединение поваренная соль с формулой NaCl. Это соединение уже не проявляет свойств ни хлора, ни натрия, оно имеет свои свойства.
Упражнение 10* В природе встречается 89 химических элементов, однако простых веществ насчитывается около 600. Как можно объяснить этот факт? Аллотропией, то есть способностью некоторых химических элементов существовать в виде нескольких простых веществ с различным строением, физическими и химическими свойствами.
Как можно объяснить этот факт? Аллотропией, то есть способностью некоторых химических элементов существовать в виде нескольких простых веществ с различным строением, физическими и химическими свойствами.
Ответ подтвердите примерами. Атомы Оксигена образуют две аллотропные модификации: кислород О2 и озон О3. Атомы Карбона образуют несколько простых веществ: алмаз, графит, сажа, карбин, фуллерен.
Чем можно объяснить существование значительно большего количества сложных веществ по сравнению с количеством простых веществ? Вещества образуются за счет комбинаций из атомов химических элементов. Очевидно, что таких комбинаций образуется значительно больше из атомов различных химических элементов сложного вещества, чем из атомов одного химического элемента простого вещества.
Другие задания смотри здесь…
Простые и сложные вещества » Народна Освіта
Вспомните: смеси состоят из молекул разных веществ; в смеси вещества сохраняют свои химические и физические свойства; смеси можно разделить на чистые вещества определенными методами.
Простые вещества
В природе существует огромное многообразие веществ, и все они отличаются по составу и строению. Вещества могут состоять как из одинаковых, так и из разных атомов. Соответственно, все чистые вещества по составу разделяют на простые и сложные.
Вещество, образованное одним химическим элементом, является простым.
Например, вещество железо состоит только из атомов Феррума, его формула Fe (рис. 59, с. 71). Газ кислород состоит из молекул, образованных только атомами Оксигена (рис. 63), его формула O2. Часто название простого вещества отличается от названия химического элемента, который его образует, однако нередко названия простых веществ и химических элементов совпадают. По правилам современной украинской химической номенклатуры названия элементов пишутся с прописной буквы, а названия веществ — со строчной. Например: «вещество алюминий состоит из атомов Алюминия», «вещество бром состоит из молекул, образованных двумя атомами Брома».
В таблице 2 (с. 82) приведены названия простых веществ, которые образованы известными вам химическими элементами.
Следует различать понятия «простое вещество» и «химический элемент».
Вещества и элементы характеризуются разными свойствами. Для веществ характерны агрегатное состояние, цвет, плотность и т. п. А свойства химических элементов — это свойства их атомов: строение (размеры), способность отдавать или присоединять электроны и др.
Таблица 2. Химические элементы и образованные ими простые вещества
Когда мы говорим о материале или компоненте смеси — например, банка наполнена газообразным хлором, приготовим раствор брома, возьмем небольшой кусочек фосфора,— то в данном случае речь идет о простом веществе. Если же мы говорим, что заряд ядра атома Хлора равен +17, вещество содержит Фосфор, молекула состоит из двух атомов Брома, то имеем в виду химический элемент.
Многие химические элементы могут образовывать не одно, а несколько простых веществ. Это явление называют аллотропия, а простые вещества, образованные данным химическим элементом,— аллотропными модификациями. Аллотропные модификации отличаются друг от друга строением или составом молекул. Например, атомы Карбона образуют несколько простых веществ: алмаз, графит, карбин, фулерен. Они отличаются расположением атомов относительно друг друга. Атомы Оксигена образуют две аллотропные модификации: кислород (02) и озон (03). Эти два вещества отличаются составом молекул. Аллотропные модификации — это разные простые вещества со своими собственными физическими и химическими свойствами.
Это явление называют аллотропия, а простые вещества, образованные данным химическим элементом,— аллотропными модификациями. Аллотропные модификации отличаются друг от друга строением или составом молекул. Например, атомы Карбона образуют несколько простых веществ: алмаз, графит, карбин, фулерен. Они отличаются расположением атомов относительно друг друга. Атомы Оксигена образуют две аллотропные модификации: кислород (02) и озон (03). Эти два вещества отличаются составом молекул. Аллотропные модификации — это разные простые вещества со своими собственными физическими и химическими свойствами.
Металлы и неметаллы
Металлы — железо, хром, цинк, магний, золото, свинец и другие — отличаются от неметаллов характерным металлическим блеском и ковкостью, они хорошо проводят электрический ток и теплоту (рис. 64). В обычных условиях все металлы (за исключением ртути) находятся в твердом агрегатном состоянии. Свойства металлов
обусловлены их внутренней структурой. Металлы являются веществами атомного строения.
Металлы являются веществами атомного строения.
Неметаллы, в отличие от металлов, не имеют металлического блеска (кроме йода и графита) (рис. 65). Они хрупкие и разрушаются от удара, плохо проводят электрический ток и теплоту. Неметаллы могут быть твердыми, жидкими и газообразными (см. табл. 2, с. 82).
Четкой границы между металлами и неметаллами не существует. Например, йод и графит являются неметаллами, но оба имеют металлический блеск, а графит хоть слабо, но проводит электрический ток. Для отнесения веществ к металлам или неметаллам следует принимать во внимание все их физические свойства в совокупности, а также их внутреннее строение и химические свойства.
Как и простые вещества, химические элементы разделяют на металлические и неметаллические. Металлы образованы металлическими элементами, а неметаллы — неметаллическими.
Если провести условную линию от Бора до Астата, то в длинном варианте Периодической системы над этой линией будут расположены неметаллические элементы, а под ней — металлические (рис. 66, см. также последний форзац). В коротком варианте Периодической системы под линией также будут расположены металлические элементы, а над нею — как металлические, так и неметаллические элементы (см. первый форзац). Таким образом, определять, является ли элемент металлическим или неметаллическим, удобнее по длинному варианту Периодической системы. Это разделение условно, так как все элементы в той или иной степени проявляют как металлические, так и неметаллические свойства, но в большинстве случаев такое распределение соответствует действительности.
66, см. также последний форзац). В коротком варианте Периодической системы под линией также будут расположены металлические элементы, а над нею — как металлические, так и неметаллические элементы (см. первый форзац). Таким образом, определять, является ли элемент металлическим или неметаллическим, удобнее по длинному варианту Периодической системы. Это разделение условно, так как все элементы в той или иной степени проявляют как металлические, так и неметаллические свойства, но в большинстве случаев такое распределение соответствует действительности.
Классификация элементов на металлические и неметаллические основана на способности атомов отдавать или принимать электроны в химических реакциях. Атомы металлических элементов преимущественно отдают электроны и превращаются в положительно заряженные ионы. Атомы неметаллических элементов преимущественно присоединяют электроны и превращаются в отрицательно заряженные ионы.
Сложные вещества
Вещество, образованное несколькими химическими элементами, является сложным.
Сложные вещества также называют химическими соединениями. К ним относятся поваренная соль, сода, глюкоза, вода, уксусная кислота и множество других. Сложных веществ в природе значительно больше, чем простых.
Сложные вещества могут быть образованы разным числом элементов:
Сложные вещества необходимо отличать от смесей простых веществ (рис. 67, с. 86), которые также состоят из атомов разных элементов. Для этого необходимо вспомнить отличительные особенности смесей и чистых веществ (см. § 5). Количественное соотношение компонентов смеси может быть разным, а химические соединения
имеют постоянный состав. Например, можно приготовить смесь 100 г воды с одной ложкой сахара, а можно и с двумя или полуторами ложками. А в соединении FeS на каждый атом Феррума приходится только один атом Сульфура, а не полтора или три.
Это значит, что состав соединений можно описать одной химической формулой, а состав смесей — нет.
Кроме того, компоненты смеси сохраняют свои физические и химические свойства. Например, если смешать железный порошок с серой, то образуется смесь двух веществ. И сера, и железо в ее составе сохраняют свои свойства: железо притягивается магнитом, а сера не тонет в воде. Из этой смеси с помощью магнита можно выделить железо. Если же железо и сера прореагируют друг с другом, то образуется новое соединение с формулой FeS. Это соединение уже не проявляет свойств ни железа, ни серы, оно обладает своими свойствами. Никаким методом разделения смесей мы не сможем выделить атомы Феррума из соединения FeS.
Например, если смешать железный порошок с серой, то образуется смесь двух веществ. И сера, и железо в ее составе сохраняют свои свойства: железо притягивается магнитом, а сера не тонет в воде. Из этой смеси с помощью магнита можно выделить железо. Если же железо и сера прореагируют друг с другом, то образуется новое соединение с формулой FeS. Это соединение уже не проявляет свойств ни железа, ни серы, оно обладает своими свойствами. Никаким методом разделения смесей мы не сможем выделить атомы Феррума из соединения FeS.
Классификация сложных веществ
Сложные вещества разделяют на две большие группы: неорганические и органические. Неорганические вещества могут состоять из атомов любых элементов. В состав органических соединений обязательно входят атомы Карбона, поэтому большинство из них при нагревании обугливаются. В подавляющее большинство органических веществ входят также атомы Гидрогена. Примерами органических веществ являются: метан СН4, сахароза C12H22O11, этиловый спирт
C2H5OH, уксусная кислота СH3COOH. Органических веществ существует значительно больше, чем неорганических.
Органических веществ существует значительно больше, чем неорганических.
Неорганические и органические вещества, в свою очередь, делятся еще на ряд групп. Но в седьмом классе вы подробно ознакомитесь лишь с некоторыми неорганическими веществами, а другие будете изучать в дальнейшем.
Распределение веществ на разные группы по их признакам и свойствам называется классификацией. В этом параграфе мы рассмотрели основную классификацию веществ, которую можно изобразить такой схемой:
Иранский ученый-энциклопедист, врач, алхимик и философ. Получил разностороннее образование — изучал медицину, философию, метафизику, поэзию, магию и алхимию. Прославился как искусный врач. Именно он сформулировал основную задачу алхимии как превращение металлов с помощью «эликсира» в золото, а также получение из обычных камней (кварца и стекла) драгоценных. Ар-Рази первым предложил классификацию всех известных веществ на землистые (минеральные), растительные и животные. Минеральные вещества, в свою очередь, он распределял на шесть групп: «духи» (спирты), «тела» (металлы), «камни», купоросы, «бораки» и соли.
Ознакомление с образцами простых и сложных вещестЕ
Оборудование: штатив с пробирками, пробиркодержатель, нагревательный прибор.
Реактивы: медный купорос, железо, цинк, алюминий, медь, сера, сахар, мел, графит, пищевая сода, поваренная соль.
| Правила безопасности:
• при выполнении опытов используйте небольшие количества реактивов;
• остерегайтесь попадания реактивов на одежду, кожу, в глаза.
1. Внимательно рассмотрите выданные вам образцы веществ.
2. Для каждого образца отметьте наличие металлического блеска, цвет, твердость.
3. По формулам веществ распределите их на простые и сложные. Среди простых веществ найдите металлы и неметаллы.
4. На основании каких признаков можно отличить металлы?
5. Можно ли по каким-либо признакам отличить простые вещества от сложных?
6. Свои наблюдения запишите в тетради и сделайте выводы.
Выводы:
1. Простые вещества состоят из одного химического элемента. Простые вещества разделяют на металлы и неметаллы. Для металлов характерны металлический блеск, ковкость, электро- и теплопроводность. Металлы образованы преимущественно металлическими элементами, а неметаллы — неметаллическими.
Простые вещества разделяют на металлы и неметаллы. Для металлов характерны металлический блеск, ковкость, электро- и теплопроводность. Металлы образованы преимущественно металлическими элементами, а неметаллы — неметаллическими.
2. Сложные вещества состоят из нескольких химических элементов, их также называют химическими соединениями. Сложные вещества разделяют на органические и неорганические. В составе неорганических могут содержаться любые химические элементы, а в органические соединения обязательно входят атомы Карбона и Гидрогена.
Контрольные вопросы
1. Дайте определения простым и сложным веществам.
2. На какие группы веществ разделяют простые и сложные вещества? По каким физическим свойствам они отличаются?
3. Какими элементами образованы металлы, а какими — неметаллы?
4. В чем заключается различие между понятиями: а) «химический элемент» и «простое вещество»; б) «простое вещество» и «сложное вещество»; в) «сложное вещество» и «смесь веществ»?
5. , №НС03, Аи, С12, №, Си(ОН)2, Не, Си, №С1, S8. Подчеркните символы, которые обозначают простые вещества — металлы.
, №НС03, Аи, С12, №, Си(ОН)2, Не, Си, №С1, S8. Подчеркните символы, которые обозначают простые вещества — металлы.
4. Приведите по пять примеров металлических и неметаллических элементов.
5. Вычислите массовую долю Натрия в поваренной соли (№й) и пищевой соде (№НС03). В каком из этих сложных веществ содержание Натрия больше?
6. Как можно доказать, что целлюлоза (основное вещество, из которого состоит древесина) и сахароза являются органическими веществами?
7. На рисунке 68 изображены модели простых и сложных веществ, а также их смесей. Для каждого случая а) — е) определите, модели каких веществ (простых или сложных) изображены, запишите химические формулы этих веществ. Определите, в каком случае изображена смесь веществ, составьте химические формулы веществ в смеси.
8. Малахит (вещество зеленого цвета) при нагревании разлагается на купрум(М) оксид СиО (порошок черного цвета), воду Н20 и углекислый газ СО2. Является ли малахит смесью купрум(11) оксида, воды и углекислого газа? Из каких химических элементов состоит малахит?
Является ли малахит смесью купрум(11) оксида, воды и углекислого газа? Из каких химических элементов состоит малахит?
9. Вещество хлор 02 является очень ядовитым газом, но вместе с тем атомы Хлора входят в состав поваренной соли №0, которую мы употребляем каждый день. Нет ли в этом противоречия? Ответ обоснуйте.
10*. В природе встречается 89 химических элементов, однако простых веществ насчитывается около 600. Как можно объяснить этот факт? Ответ подтвердите примерами. Чем можно объяснить существование значительно большего количества сложных веществ по сравнению с количеством простых веществ?
Существование аллотропных модификаций Станума объясняет так называемую «оловянную чуму». Обычное белое олово на сильном морозе превращается в другую аллотропную модификацию — очень хрупкое серое олово. Из-за этого оловянные изделия на морозе рассыпаются в порошок.
Это материал учебника Химия 7 класс Григорович
Простые и сложные вещества.
 6 класс
6 классРаздел: 6.2А. Вещества и материалы | Школа: КГУ СШ №23 им.М.Шаяхметова | ||||||||
Дата: | ФИО учителя: Тесленко Н.В. | ||||||||
Класс: 6 | Количество присутствующих: |
| |||||||
Тема урока | Простые и сложные вещества | ||||||||
Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу) | 6.3.1.1 различать атомы и молекулы, простые и сложные вещества | ||||||||
Цели урока | Учащиеся могут: Распознавать атомы и молекулы; Классифицирует вещества на простые и сложные. | ||||||||
Критерии оценивания | 1.Понимает сходства и различия атомов и молекул, простых и сложных веществ; 2.Усваивает основные термины при обсуждении в паре и группах; 3. Исследует, что молекулы состоят из атомов и различия простых и сложных веществ. | ||||||||
Языковые цели
| Учащиеся могут: Устно объяснить, что атом является наименьшей химически неделимой частицей вещества; Устно объясняет отличие молекул и атомов, простых и сложных веществ. Лексика и терминология, специфичная для предмета: атом, молекула, простые вещества, сложные вещества. Полезные выражения для диалогов и письма: Атом – это …. частица Молекулы состоят из …. Два или более атомов могут соединиться с образованием … Это вещество …, так как состоит из … | ||||||||
Привитие ценностей
| Данный урок направлен на развитие ценностей академической честности, сплоченности и умения работать в команде. Привитие ценностей осуществляется через организацию групповой и самостоятельной работы. | ||||||||
Межпредметные связи | У учащихся формируются знания о химическом элементе, простых и сложных веществах. При изучении состава атома имеет место межпредметная связь с физикой. | ||||||||
Предварительные знания
| 3 класс 3.1.1.2 Давать характеристику веществу согласно его агрегатному состоянию 4 класс 4. 4.3.1.1 Определять сферы применения веществ согласно их свойствам 5 класс Объяснять структуру твердых, жидких и газообразных веществ согласно теории частиц. | ||||||||
План | |||||||||
Запланированные этапы урока | Запланированная деятельность на уроке | Ресурсы | |||||||
Начало урока
0-5
5-10 | 1. Эмоциональный настрой урока Проверка усвоения изученного ранее матриала. 1. Организация взаимопроверки в парах (5 баллов)
2. Целеполагание. Совместно с учащимися определяются цели урока: Различать простые и сложные вещества
| Слайд №1-13
| |||||||
Середина урока
10-20
20-32
32-36
| 3. Сравнение: — атомов и молекул -молекул 4. Работа с текстом (стр78) Простое вещество – молекулы состоят из атомов одного вещества. Сложное вещество – молекулы образованы атомами разных элементов.
5. Закрепление – работа в группах Распределите вещества на простые и сложные: SO2, K, Cu, N2, O2 , Cl2 , Al2O3 , H 2, NaCl, MgSO4 6. Комментирование . . | Слайд 14-18
Слайд 19-21
Приложение 1
| |||||||
Конец урока: 37-40 | 8. Возвращение к целям урока, обсуждая уровень их достижения. Учащиеся проводят рефлексию устно дополняя предложения: Я узнал ……… Я научился……….. Мне понравилось……….. Я затруднялся…….. | Слайд 22
| |||||||
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися? | Оценивание – как Вы планируете проверить уровень усвоения материала учащимися? | Здоровье и соблюдение техники безопасности | |||||||
На этапе повторения материала, учащиеся имеют возможности продемонстрировать свои знания, что создает ситуацию успеха. | Имеет место формативное оценивание в ходе усвоения новых знаний и закреплении материала. | Соблюдение техники безопасности при передвижении учащихся по классу во время групповой работы. | |||||||
Проблемы с классификацией твердых тел, жидкостей и газов
Эта основная идея исследуется через:
Противопоставление студенческих и научных взглядов
Студенческий повседневный опыт
Понимание учащимися твердых тел, жидкостей и газов было хорошо изучено и подтверждает, что их раннее представление об этих терминах сформировано их повседневным использованием этих слов. Студенты часто используют слово «твердый» как прилагательное, а не для описания класса веществ.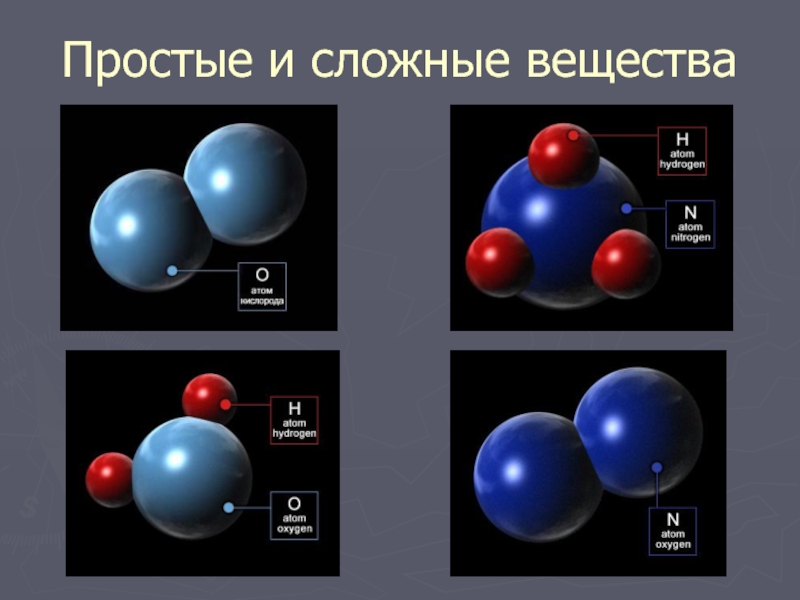 Как правило, когда студентов просят привести примеры каждого состояния, они могут привести многочисленные примеры твердых тел, меньше жидкостей и лишь несколько примеров газов, что отражает их общий опыт. Твердые вещества обычно определяются как объекты, которые можно удерживать, жидкости — как «жидкости для мытья посуды», которые являются «жидкими» или «смачивающими», а газы — как сжиженный нефтяной газ или пропан, которые являются горючими. Повседневный язык, по-видимому, сильно влияет на раннюю идентификацию учащихся. Например, твердая сталь, жидкое моющее средство и газ для кемпинга часто предоставляются, когда учащихся просят привести примеры веществ в каждом состоянии.
Как правило, когда студентов просят привести примеры каждого состояния, они могут привести многочисленные примеры твердых тел, меньше жидкостей и лишь несколько примеров газов, что отражает их общий опыт. Твердые вещества обычно определяются как объекты, которые можно удерживать, жидкости — как «жидкости для мытья посуды», которые являются «жидкими» или «смачивающими», а газы — как сжиженный нефтяной газ или пропан, которые являются горючими. Повседневный язык, по-видимому, сильно влияет на раннюю идентификацию учащихся. Например, твердая сталь, жидкое моющее средство и газ для кемпинга часто предоставляются, когда учащихся просят привести примеры веществ в каждом состоянии.
Исследования: Джонс (1984), Krnel, Watson & Glazar (1998)
Представления студентов о газах более подробно изучаются в основной идее. Газ это материя.
Некоторые студенты твердо убеждены в том, что для того, чтобы быть твердым, вещество должно быть очень твердым и отчетливо слипшимся в нерушимые комки. Вещества, которые выглядят как порошки или мелкие гранулы, такие как песок или тальк, часто идентифицируются как жидкости, потому что учащиеся считают, что они легко формуются или свободно переливаются. Другим учащимся удобно рассматривать порошок как твердое тело, потому что он не «смачивает» погруженные в воду предметы.Вода и жидкости на водной основе (например, молоко, морская вода, ликеры и лимонад) являются повторяющимися примерами жидкостей, идентифицированных учащимися. Жидкости не на водной основе, такие как кулинарные масла, керосин, минеральный скипидар, парафиновое масло и краски на масляной основе, выявляются реже. Имеющиеся данные свидетельствуют о том, что учащиеся свободно ассоциируют жидкости с водой или предполагают, что все они содержат некоторое количество воды, потому что они являются жидкостью.
Вещества, которые выглядят как порошки или мелкие гранулы, такие как песок или тальк, часто идентифицируются как жидкости, потому что учащиеся считают, что они легко формуются или свободно переливаются. Другим учащимся удобно рассматривать порошок как твердое тело, потому что он не «смачивает» погруженные в воду предметы.Вода и жидкости на водной основе (например, молоко, морская вода, ликеры и лимонад) являются повторяющимися примерами жидкостей, идентифицированных учащимися. Жидкости не на водной основе, такие как кулинарные масла, керосин, минеральный скипидар, парафиновое масло и краски на масляной основе, выявляются реже. Имеющиеся данные свидетельствуют о том, что учащиеся свободно ассоциируют жидкости с водой или предполагают, что все они содержат некоторое количество воды, потому что они являются жидкостью.
Исследования: Макгиган, Квалтер и Шиллинг (1993), Krnel, Watson & Glazar (1998)
Научный взгляд
Классификация материи по одному из трех состояний (твердое, жидкое или газообразное) является удобным способом на более низких уровнях определить, когда вещества изменяют свое состояние (т.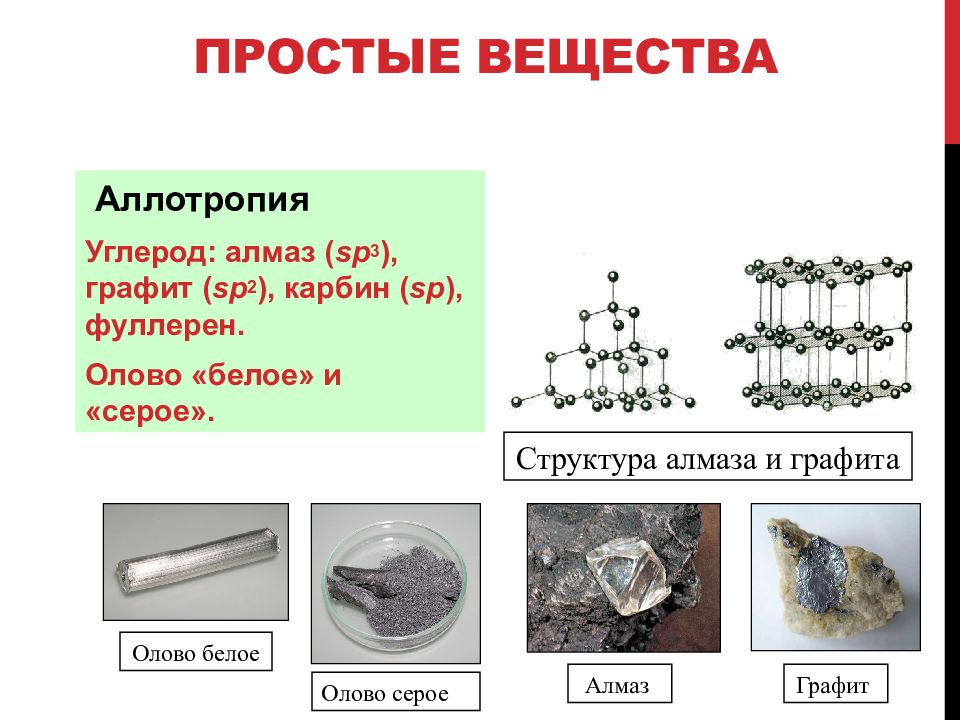 е. плавиться, кипеть, испаряться или замерзать). Однако, поскольку это простая система классификации, а структура материи сложна, она не лишена трудностей. Многие вещества не поддаются простой классификации, а многие вообще не поддаются классификации. Например, гель для волос, зубная паста, майонез, тесто для лепки и т.
Oobleck (созданный из смеси кукурузного крахмала и воды) представляет собой «нечеткие» примеры, которые трудно классифицировать. Учитывая ограничения этой системы классификации, некоторые приемлемые идеи для определения твердых тел, жидкостей и газов:
е. плавиться, кипеть, испаряться или замерзать). Однако, поскольку это простая система классификации, а структура материи сложна, она не лишена трудностей. Многие вещества не поддаются простой классификации, а многие вообще не поддаются классификации. Например, гель для волос, зубная паста, майонез, тесто для лепки и т.
Oobleck (созданный из смеси кукурузного крахмала и воды) представляет собой «нечеткие» примеры, которые трудно классифицировать. Учитывая ограничения этой системы классификации, некоторые приемлемые идеи для определения твердых тел, жидкостей и газов:
Изменение температуры может вызвать изменение состояния вещества; однако это также может быть достигнуто изменением давления. Некоторые вещества, такие как масло и шоколад, описать гораздо труднее, потому что они размягчаются в диапазоне температур по сравнению с плавлением при одной температуре плавления.
Гели,
коллоиды, иммерсии и многие другие вещества не поддаются простой классификации, поскольку содержат смеси веществ в различных состояниях в диапазоне температур.
Некоторые вещества, такие как масло и шоколад, описать гораздо труднее, потому что они размягчаются в диапазоне температур по сравнению с плавлением при одной температуре плавления.
Гели,
коллоиды, иммерсии и многие другие вещества не поддаются простой классификации, поскольку содержат смеси веществ в различных состояниях в диапазоне температур.
Критические обучающие идеи
- Целью классификации является выявление объектов с общими или сходными свойствами.
- Твердые вещества, жидкости и газы обеспечивают простые средства классификации состояния материи, но это не единственные группы, используемые учеными.
- Некоторые вещества очень трудно «классифицировать».
- Классификация состояний материи имеет ограничения, но все же может быть полезной.
- Изменение температуры может вызвать изменение состояния вещества.
Исследуйте взаимосвязь между представлениями о состояниях материи в Карты развития концепции: состояния материи
При обучении изменениям состояния важно подчеркнуть, что хотя вещество перешло из одного состояния в другое (например, из твердого в жидкое расплавилось), оно все равно остается тем же самым веществом. .Студенты часто считают, что изменение состояния создает новое вещество с совершенно новыми свойствами. Это понятно, учитывая очевидные различия между свойствами различных состояний. Выбор языка преподавателя во время обсуждения важен для того, чтобы убедить учащихся в том, что содержание остается прежним, хотя кажется, что оно ведет себя по-другому.
.Студенты часто считают, что изменение состояния создает новое вещество с совершенно новыми свойствами. Это понятно, учитывая очевидные различия между свойствами различных состояний. Выбор языка преподавателя во время обсуждения важен для того, чтобы убедить учащихся в том, что содержание остается прежним, хотя кажется, что оно ведет себя по-другому.
Некоторые наблюдательные студенты могут задаться вопросом, почему мы не наблюдаем замороженный углекислый газ (сухой лед) в жидком состоянии. Углекислый газ превращается из замороженного твердого состояния (сухой лед остается твердым при температуре ниже -79°C) в газ (процесс, называемый
сублимации) без образования лужиц жидкости.Это связано с тем, что для сохранения жидкого состояния требуется давление, примерно в 60 раз превышающее нормальное атмосферное давление. Учащиеся могут предположить, что при плавлении из твердого состояния в жидкое оно мгновенно закипает, образуя газ.
Нафталин (используемый для изготовления шариков от моли) — еще одно вещество, которое также возгоняется при комнатной температуре.
Преподавательская деятельность
Практика использования и создания воспринимаемой полезности научной модели или идеи
Предоставьте небольшим группам учащихся ряд общих предметов (например, смешанные пуговицы), состоящих из разных веществ, и поставьте перед ними задачу разработать систему их классификации таким образом, чтобы помочь определить общие черты или свойства.Их системы могут основываться на цвете, твердости, естественности, ощущениях и полезности. Может быть достаточно, если учащихся попросят определить всего три общих признака для всех предметов в группе. Студенты могли составлять таблицы или вырезать и вставлять изображения на листы, чтобы сгруппировать их.
Особое внимание следует уделить выбору элементов с очевидными общими свойствами для этой задачи. В ходе обсуждения в классе стремитесь продвигать мнение о том, что все признаки, используемые для группировки элементов, являются правильными, однако некоторые группировки (системы классификации) могут быть более полезными, чем другие, для выявления полезных общих признаков.
Открытое обсуждение посредством обмена опытом
Во время обсуждения в классе поощряйте учащихся рассматривать широкий спектр подходящих контекстов, тесно связанных с их повседневным опытом. Рассмотрим сценарии изменения состояния материи, такие как сушка одежды, таяние масла и капание ледяных столбов. Стремитесь расширить мышление учащихся за пределы общих примеров воды, ледяной воды и водяного пара. Обсудите таяние шоколада, воск для свечей, сахар и опыт, который некоторые дети испытали с замороженным углекислым газом (сухой лед).
Используйте примеры сухого льда и нафталина в демонстрации Predict-Observe-Explain (POE), показывающей, что некоторые вещества могут переходить из твердого состояния в газообразное, не превращаясь в жидкость. Исследуйте, как учащиеся могут обнаружить, что газ выделяется из обоих этих твердых веществ. Учащиеся могут обнаружить газ нафталин по запаху. Насыпьте несколько гранул сухого льда в пустой воздушный шар и завяжите его, завязав узел на горлышке. Воздушный шар будет надуваться, когда твердое тело превратится в газ.Или бросьте гранулы сухого льда в стакан с водой, чтобы увидеть образование пузырьков газа. (Обратите внимание, что образующийся туман представляет собой не углекислый газ, а крошечные жидкие капельки воды, видимые при смешивании холодного газа с влажным воздухом. Это второе изменение состояния, связанное с этим явлением).
Воздушный шар будет надуваться, когда твердое тело превратится в газ.Или бросьте гранулы сухого льда в стакан с водой, чтобы увидеть образование пузырьков газа. (Обратите внимание, что образующийся туман представляет собой не углекислый газ, а крошечные жидкие капельки воды, видимые при смешивании холодного газа с влажным воздухом. Это второе изменение состояния, связанное с этим явлением).
Бросьте вызов учащимся существующим идеям
Предоставить учащимся трудно поддающиеся классификации вещества, которые бросают вызов их определениям и заставляют их подвергать сомнению их текущее понимание системы классификации.На этом уровне учащиеся должны увидеть, что с некоторыми веществами легче обращаться и что для их передачи не требуются контейнеры (твердые вещества). Некоторые вещества являются «жидкими» и требуют для работы с ними открытые контейнеры (жидкости), а с некоторыми вообще нельзя обращаться и для них требуются закрытые контейнеры (газы). Как только учащиеся разовьют четкое представление об этой системе очевидной классификации, им можно будет предложить вещества, представляющие более сложные задачи, такие как зубная паста, песок, гель для волос и т.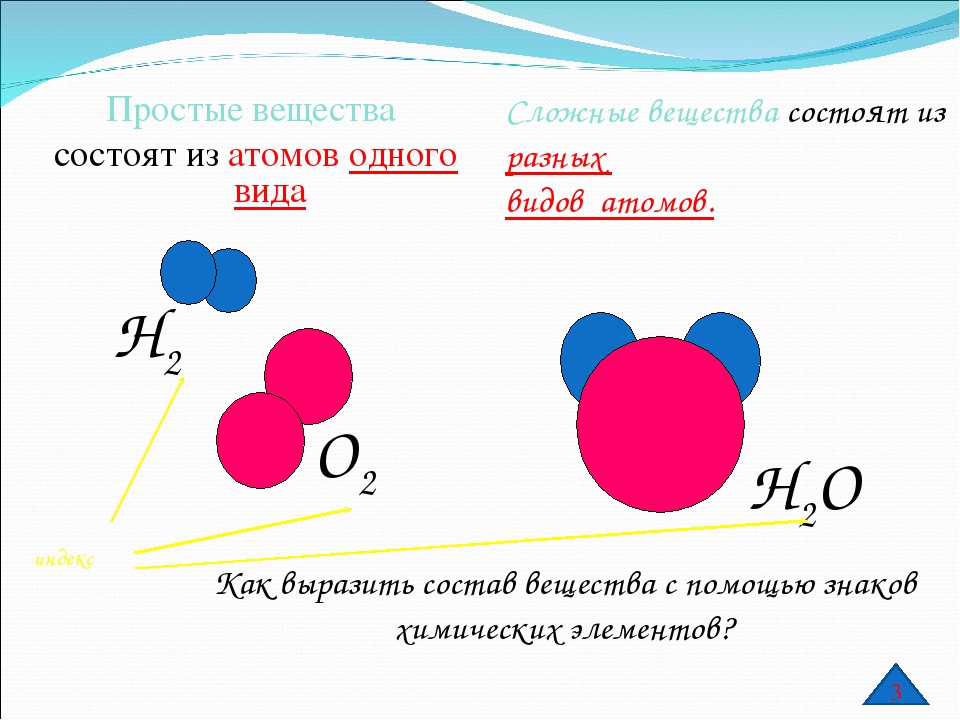 Ooblek или сахарный песок.Классификация этих предметов поможет опровергнуть мнение, что все вещества можно легко классифицировать.
Ooblek или сахарный песок.Классификация этих предметов поможет опровергнуть мнение, что все вещества можно легко классифицировать.
Чем отличаются лекарства и биологические препараты?
Лекарства против биопрепаратов
- Биологический препарат производится в живой системе, такой как микроорганизм, клетки растений или животных. Большинство биологических препаратов представляют собой очень большие сложные молекулы или смеси молекул. Многие биологические препараты производятся с использованием технологии рекомбинантной ДНК.
- Лекарство обычно производится путем химического синтеза, что означает, что оно производится путем объединения определенных химических ингредиентов в упорядоченном процессе.
- Лекарства обычно имеют четко определенную химическую структуру, и готовое лекарство обычно можно проанализировать, чтобы определить все его различные компоненты. Напротив, сложно, а иногда и невозможно охарактеризовать сложный биологический препарат методами тестирования, доступными в лаборатории, и некоторые компоненты готового биологического препарата могут быть неизвестны.

- Следовательно, для биопрепаратов «продукт — это процесс». Поскольку конечный продукт не может быть полностью охарактеризован в лаборатории, производители должны обеспечить постоянство, качество и чистоту продукта, следя за тем, чтобы производственный процесс оставался практически неизменным с течением времени.Напротив, производитель лекарств может значительно изменить производственный процесс и проанализировать готовый продукт, чтобы установить, что он такой же, как до изменения производства.
- Живые системы, используемые для производства биопрепаратов, могут быть чувствительны к очень незначительным изменениям в производственном процессе. Небольшие технологические различия могут существенно повлиять на природу готового биологического препарата и, что наиболее важно, на то, как он функционирует в организме. Чтобы производственный процесс оставался неизменным с течением времени, производители биологических препаратов должны строго контролировать источник и природу исходных материалов и последовательно использовать сотни средств контроля процесса, которые гарантируют предсказуемые результаты производства.

- Контроль процессов для биологических препаратов устанавливается отдельно для каждого уникального производственного процесса/продукта и не применяется к производственному процессу/продукту, созданному другим производителем. Эти средства контроля процесса также могут быть конфиденциальными для первоначального производителя. Следовательно, второму производителю было бы трудно или невозможно производить «тот же самый» биопрепарат без глубоких знаний и опыта работы с инновационным процессом.
Непатентованные препараты в сравнении с последующими биологическими препаратами
- Чтобы быть одобренным в качестве дженерика, препарат должен иметь тот же активный ингредиент, силу действия, лекарственную форму и способ введения, что и референтный препарат, а также должен быть «биоэквивалентным».» Это означает, что непатентованные препараты имеют такой же химический состав, что и оригинальные аналоги, и действуют в организме таким же образом. Биоэквивалентность непатентованного препарата демонстрируется с помощью относительно простых анализов, таких как определение уровня в крови, без необходимости проведения клинических испытаний на людях.
 , Утверждая дженерик в соответствии со статьей 505(j) FDCA, FDA определяет, что дженерик «терапевтически эквивалентен» оригинальному лекарству и взаимозаменяем с ним.
, Утверждая дженерик в соответствии со статьей 505(j) FDCA, FDA определяет, что дженерик «терапевтически эквивалентен» оригинальному лекарству и взаимозаменяем с ним. - FDA заявило, что не определило, как можно установить взаимозаменяемость для сложных белков (http://www.fda.gov/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/ApprovalApprovalApplications/TherapeuticBiologicApplications/Biosimilars/default.htm, ноябрь 2010 г.). Исторически сложилось так, что FDA допускало взаимозаменяемость только тогда, когда два продукта являются «терапевтическими эквивалентами». Однако, когда последующий производитель устанавливает новый производственный процесс, начиная с новых исходных материалов, он будет производить продукт, который отличается от продукта новатора и не будет терапевтически эквивалентен ему.Из-за сложности биологических препаратов единственный способ установить, существуют ли различия, влияющие на безопасность и эффективность последующего продукта, — это провести клинические испытания.

Перфторалкильные и полифторалкильные вещества (ПФАС)
Введение
Что такое ПФАС?
PFAS — это большая, сложная и постоянно расширяющаяся группа промышленных химикатов, которые широко используются для производства различных видов повседневных продуктов.Например, они предотвращают прилипание пищи к посуде, делают одежду и ковры устойчивыми к пятнам и создают более эффективную пену для пожаротушения. PFAS используются в таких отраслях, как аэрокосмическая, автомобильная, строительная, электронная и военная.
МолекулыПФАС состоят из цепочки связанных атомов углерода и фтора. Поскольку связь углерод-фтор является одной из самых прочных, эти химические вещества не разлагаются в окружающей среде. На самом деле, ученые не могут оценить период полураспада ПФАС в окружающей среде, который представляет собой время, необходимое для исчезновения 50% химического вещества.
Исследования двух видов PFAS составляют основу нашего научного понимания этой группы химических веществ. Перфтороктановая кислота (ПФОК) и перфтороктановый сульфонат (ПФОС) производились дольше всех, они наиболее распространены в окружающей среде и наиболее хорошо изучены. Хотя эти два соединения больше не производятся в Соединенных Штатах, производители химических веществ заменили их альтернативными ПФАС, такими как GenX.
Перфтороктановая кислота (ПФОК) и перфтороктановый сульфонат (ПФОС) производились дольше всех, они наиболее распространены в окружающей среде и наиболее хорошо изучены. Хотя эти два соединения больше не производятся в Соединенных Штатах, производители химических веществ заменили их альтернативными ПФАС, такими как GenX.
PFOA, также известная как C8, имеет 8 атомов углерода.
Как люди подвергаются воздействию PFAS?
Эти широко распространенные искусственные химикаты попали в нашу почву, воздух и воду. Люди, скорее всего, подвергаются воздействию этих химических веществ при употреблении загрязненной PFAS воды или продуктов питания, при использовании продуктов, изготовленных с PFAS, или при вдыхании воздуха, содержащего PFAS. Необходимы дополнительные исследования, чтобы полностью понять все источники воздействия, а также если и как они вызывают проблемы со здоровьем.
В одном отчете Центров по контролю и профилактике заболеваний Национального обследования состояния здоровья и питания (NHANES) PFAS обнаружен в крови 97% американцев.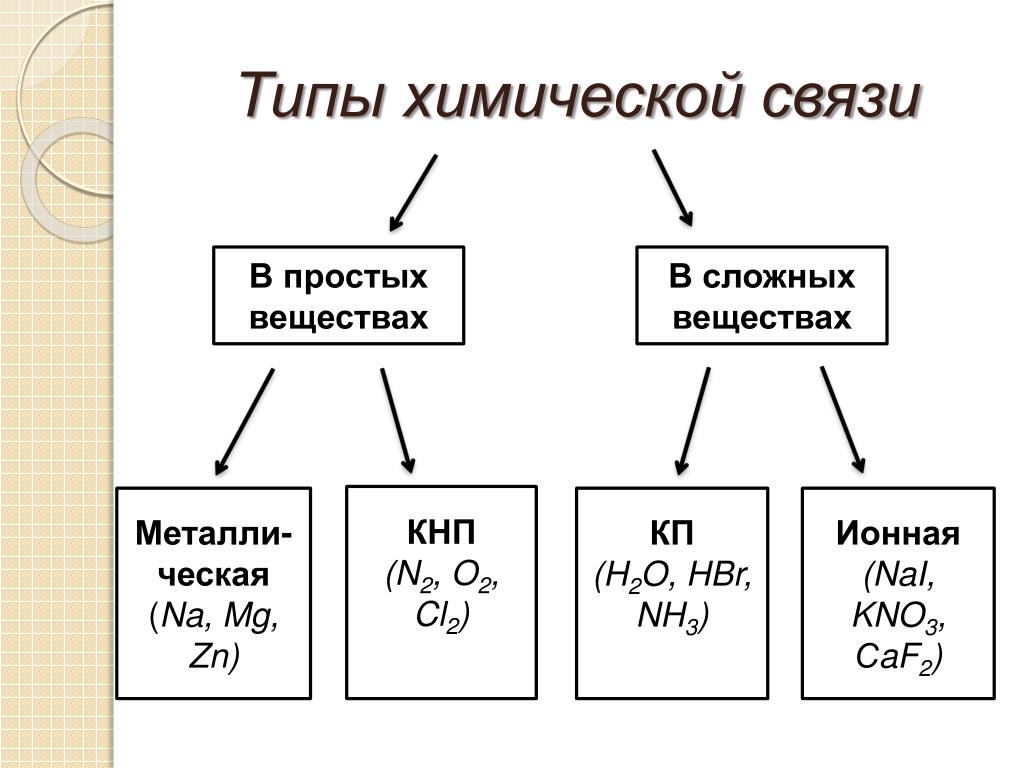 1 В более позднем отчете NHANES говорится о снижении уровня ПФОС и ПФОК в крови после их удаления из потребительских товаров в начале 2000-х годов. Однако количество новых химических веществ PFAS, по-видимому, увеличивается, и воздействие трудно оценить.
1 В более позднем отчете NHANES говорится о снижении уровня ПФОС и ПФОК в крови после их удаления из потребительских товаров в начале 2000-х годов. Однако количество новых химических веществ PFAS, по-видимому, увеличивается, и воздействие трудно оценить.
Зачем беспокоиться о PFAS?
Опасения по поводу воздействия PFAS на здоровье населения возникли по следующим причинам:
- Широко распространенное явление. Исследования обнаруживают ПФАС в крови и моче людей, и ученые хотят знать, вызывают ли они проблемы со здоровьем.
- Многочисленные экспозиции. PFAS используются в сотнях продуктов по всему миру, что может привести к воздействию на человека.
- Растущее число. Существует более 4700 ПФАС, и их число увеличивается по мере того, как промышленность изобретает новые формы этого типа химического вещества. 2
- Постоянный. PFAS остаются в окружающей среде в течение неизвестного времени, и могут пройти годы, прежде чем они покинут организм.

- Биоаккумуляция. Различные химические вещества ПФАВ могут попадать в пищевую цепь различными путями, постепенно накапливаясь и оставаясь в организме с течением времени — процесс, связанный с большим потреблением, чем выделением химических веществ.
Чем занимается NIEHS?
Национальный институт экологических наук и Национальная токсикологическая программа поддерживают исследования, чтобы лучше понять потенциальные последствия для здоровья от воздействия PFAS.
Что мы уже узнали
При поиске возможного воздействия химических соединений на здоровье человека важно понимать, что их трудно изучать, особенно с тысячами вариаций химических веществ PFAS.Многие исследования PFAS поддерживались или возглавлялись NIEHS.
Исследования, проведенные на сегодняшний день, выявили возможную связь между воздействием ПФАС на человека и неблагоприятными последствиями для здоровья. Эти последствия для здоровья включают изменение обмена веществ, 3 фертильность, 4 замедление роста плода и повышенный риск избыточного веса или ожирения, 5 и снижение способности иммунной системы бороться с инфекциями. 6
6
В то время как знания о потенциальном воздействии PFAS на здоровье выросли, многие вопросы остаются без ответа.Поэтому NIEHS продолжает финансировать или проводить исследования, чтобы лучше понять последствия воздействия PFAS.
Национальная программа токсикологии
Национальная токсикологическая программа (NTP) — это межведомственная программа тестирования со штаб-квартирой в NIEHS. В 2016 году, основываясь на данных предыдущих исследований, NTP пришла к выводу, что ПФОК и ПФОС представляют опасность для функции иммунной системы человека. 7
NTP возглавляет многогранные токсикологические исследования для оценки и выявления побочных эффектов химических веществ PFAS, таких как:
- Систематический литературный обзор шести химических веществ PFAS — PFNA, PFHxS, PFHxA, PFDA, PFOS, PFBS — для определения того, ослабляют ли они реакцию организма на прививки.
- Исследования на животных, включая двухлетнее исследование ПФОК и 28-дневные исследования этих семи химических веществ ПФАС: ПФБС, ПФГСК, ПФОС, ПФГНК, ПФОК, ПФНА, ПФДА.

Исследование, финансируемое NIEHS
NIEHS также предоставляет множество грантов внешним организациям, в частности исследовательским университетам, в США для проведения исследований PFAS, в том числе:
- Ограниченные по времени исследования, такие как воздействие ПФАВ на жителей вблизи Колорадо-Спрингс, вода которых была загрязнена ПФАВ, известным как перфторгексансульфонат (ПФГСК), и загрязнение реки Кейп-Фир в Северной Каролине GenX.
- Долгосрочные эпидемиологические исследования последствий воздействия ПФАВ на здоровье, некоторые из которых были начаты до рождения, включая исследование более 300 детей на Фарерских островах. 8
- В исследовании здоровья окружающей среды у детей изучалась связь между пренатальным и детским воздействием ПФАВ и результатами когнитивных тестов у детей. Полученные результаты были противоречивыми, подчеркивая необходимость дальнейших исследований того, как PFAS может действовать на развивающийся мозг.
 9
9 - Другое долгосрочное исследование показало связь между воздействием ПФАС и повышенным риском диабета 2 типа у женщин. 10
Исследовательская программа NIEHS Superfund (SRP)
SRP финансирует поиск практических приложений для защиты населения от воздействия опасных веществ. Примеры включают:
- Проект «Источники, перенос, воздействие и воздействие ПФАВ» (STEEP) в Университете Род-Айленда направлен на выявление источников загрязнения ПФАВ, оценку воздействия на здоровье человека и обучение населения способам снижения воздействия. 11
- Исследовательский центр Суперфонда штата Мичиган разрабатывает энергоэффективные нанореакторы, способные разрушать связь углерод-фтор, которая препятствует разложению ПФАС.
- Ученые Калифорнийского университета в Беркли работают над вариантами содержания пленкообразующих пен на водной основе, используемых для пожаротушения, основного источника загрязнения PFAS.

- Исследовательский центр Суперфонда Университета Брауна разработал базы данных, которые используют данные о землепользовании для выявления городов с высоким риском воздействия ПФАС. 12
- Компания CycloPure, Inc., получающая грант от исследования инноваций в малом бизнесе (SBIR), разрабатывает новые способы удаления опасного PFAS из воды.
- Другой проект SBIR EnChem Engineering, Inc. разрабатывает инновационную технологию для ускорения удаления PFAS на объектах Superfund.
Почему важно сотрудничество в области исследований
ЗагрязнениеPFAS представляет собой сложную проблему, которую ни одна организация не может решить в одиночку. NIEHS и NTP активно координируют усилия с другими государственными учреждениями для понимания того, как PFAS может влиять на здоровье человека.
- NIEHS принял участие в федеральном совещании по обмену информацией, организованном NIH в феврале 2018 г. 13 , и на саммите национального руководства PFAS, организованном EPA в мае 2018 г.
 14
14 - NTP сотрудничает с EPA в рамках программы оперативной оценки и оценки химической токсичности (REACT), в рамках которой разрабатывается новый подход к проверке более 100 PFAS для выявления общих и перекрывающихся моделей токсичности.
- NIEHS тесно сотрудничает с Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в области безопасности пищевых продуктов, связанных с ПФАВ, а также с Центрами по контролю и профилактике заболеваний в области мониторинга уровней воздействия ПФАВ.
- Агентство по регистрации токсичных веществ и заболеваний консультируется с NIEHS по разработке и проведению оценок воздействия и исследований состояния здоровья, санкционированных Законом о национальной обороне на 2018 финансовый год.
Влияние исследований на общественное здравоохранение
В совокупности работа получателей грантов NIEHS, NTP и их сотрудников поможет определить токсичность химических веществ PFAS и потенциальное неблагоприятное воздействие на здоровье человека. Такие данные ценятся регулирующими органами и политиками для принятия обоснованных решений, помогающих защитить здоровье человека.
Такие данные ценятся регулирующими органами и политиками для принятия обоснованных решений, помогающих защитить здоровье человека.
- Оценка альтернатив помогает гарантировать, что вредные химические вещества не будут заменены столь же вредными, но менее изученными родственными соединениями.
- Известный как Цюрихское заявление, NIEHS стал соавтором комментария к PFAS 15 , призывающего к более тесному сотрудничеству между организациями, исследующими, регулирующими и использующими PFAS. Он был разработан на семинаре в ноябре 2017 года в Цюрихе, Швейцария.
- Некоторые государственные учреждения анализируют результаты коллективных исследований PFAS для оценки воздействия этих химических веществ на здоровье человека в своих сообществах.
Дополнительная литература
Истории из
Фактор окружающей среды (информационный бюллетень NIEHS)Дополнительные ресурсы
Связанные темы здравоохранения
Определение различий: что делает биологические препараты уникальными
Biotechnol Healthc. 2004 сен; 1(4): 24-26,28-29.
2004 сен; 1(4): 24-26,28-29.
Томас Морроу, доктор медицинских наук, президент Национальной ассоциации врачей управляемой медицинской помощи, а также вице-президент и медицинский директор Matria Healthcare. Он имеет 20-летний опыт работы в сфере управляемого медицинского обслуживания на уровне плательщика или плана медицинского обслуживания.
Эта статья была процитирована другими статьями в PMC.Abstract
Биопрепараты отличаются от препаратов, полученных химическим путем, в том, что касается их стоимости, производства, введения и клинической эффективности. Вот взгляд на наиболее важные различия и их последствия.
«Разница между почти правильным словом и правильным словом действительно велика — это разница между светлячком и молнией». Замечание Марка Твена о важности трех маленьких букв применимо к различиям между лекарствами, полученными биологическим и химическим путем. На этот раз, однако, три буквы ДНК .
Биопрепараты и устройства на основе белка используются для лечения всего, от морщин до укусов гремучей змеи, и варьируются от натуральных белковых швов до факторов коагуляции фибриногена. Биотехнологические приложения в здравоохранении охватывают профилактические средства, средства диагностики in vivo и терапевтические продукты. Биотехнология предоставляет визуализирующие агенты и молекулярные диагностические тесты для выявления широкого спектра проблем со здоровьем, от избыточного уровня ЛПНП до лекарственно-устойчивых штаммов ВИЧ.
Биотехнологические приложения в здравоохранении охватывают профилактические средства, средства диагностики in vivo и терапевтические продукты. Биотехнология предоставляет визуализирующие агенты и молекулярные диагностические тесты для выявления широкого спектра проблем со здоровьем, от избыточного уровня ЛПНП до лекарственно-устойчивых штаммов ВИЧ.
Достижения в этой области быстро выворачивают западную медицину наизнанку. Вместо того, чтобы начинать с болезни и искать ее происхождение, биотехнологическая медицина начинает с обнаружения генетической вариации и полагается на методы лечения, которые манипулируют ею.Развивая эту концепцию дальше, она обещает прогнозировать состояние здоровья и действовать соответственно — само понятие профилактики, на котором была основана управляемая помощь.
Однако все это не является недорогим, что создает серьезные проблемы с использованием ресурсов и надлежащим отбором пациентов. Таким образом, для эффективного приобретения и использования биологических агентов необходимо понимать их загадочную активность и структуру, специфичность их действия и то, чем они отличаются от традиционных терапевтических агентов.
СТАРАЯ ИДЕЯ, НОВАЯ АДАПТАЦИЯ
Биопрепараты не новы; Разработка человеческого гормона роста, инсулина и агентов, стимулирующих эритроциты, началась несколько десятилетий назад, но количество мишеней увеличилось в геометрической прогрессии благодаря новой генетической информации и новому пониманию субклеточных каскадов и болезненных процессов. Научные области, используемые при разработке биологических препаратов, включают геномику и протеомику, а также технологии микрочипов, клеточных культур и моноклональных антител.
Расширение знаний о генетике и клеточных процессах приводит к потенциальным новым биологическим (и лекарственным) мишеням на каждом этапе процесса производства белка.Это приводит к новым методам лечения, которые, в свою очередь, ведут к новому пониманию болезней.
Биопрепараты определили новые мишени для лечения анемии, кистозного фиброза, дефицита роста, диабета, гемофилии, гепатита, остроконечных кондилом, отторжения трансплантата и рака. Биологи предсказывают генетическую предрасположенность к таким заболеваниям, как болезнь Паркинсона. К немедикаментозным биологическим препаратам относятся культивированные ткани и средства, подавляющие иммунную систему, для трансплантации и факторы роста для восстановления тканей при лечении таких состояний, как диабетические язвы стопы.
Биологи предсказывают генетическую предрасположенность к таким заболеваниям, как болезнь Паркинсона. К немедикаментозным биологическим препаратам относятся культивированные ткани и средства, подавляющие иммунную систему, для трансплантации и факторы роста для восстановления тканей при лечении таких состояний, как диабетические язвы стопы.
Как и в случае низкомолекулярных препаратов, исследования и разработки биологических препаратов являются дорогостоящими и рискованными и часто заканчиваются неудачей. В то время как фармацевтические компании нацелены на наиболее распространенные заболевания и состояния, биотехнологии, как правило, нацелены на более трудно поддающиеся лечению группы населения, которые были бы слишком малы для того, чтобы фармацевтические компании могли окупить затраты на разработку лекарств. Тем не менее, более новые биологические препараты также нацелены на широко распространенные заболевания, что имеет серьезные последствия: лекарство, которое стоит 20 000 долларов в год и полезно для 1 человека из 100 000, оказывает гораздо меньшее влияние на структуру затрат плана медицинского страхования, чем полезное лекарство стоимостью 5 000 долларов в год. на 1 из 100 человек.
на 1 из 100 человек.
Многие из следующих блокбастеров вполне могут быть биопрепаратами. Два противодиабетических препарата, Симлин (ацетат прамлинтида) и Эксенатид (синтетический эксендин-4), соответствуют определению биологических препаратов. Как и моноклональные антитела и ингибиторы ФНО, а также ингибиторы ангиогенеза, такие как недавно выпущенный Авастин (бевацизумаб) и Эрбитукс (цетуксимаб).
ОРГАНИЧЕСКОГО ПРОИСХОЖДЕНИЯ
В настоящее время не существует простого способа определить все препараты, которые, как сообщается, являются биологическими. Есть несколько фракций, которые хотят по-разному определять биопрепараты.Некоторые применяют строгое определение биопрепаратов, диктующее, что эти продукты имеют две важные черты, которые отличают их физический состав от лекарств, полученных химическим путем: только живые системы могут производить их, а биопрепараты представляют собой относительно большие молекулы с гетерогенной структурой, которая может содержать сотни молекул. аминокислоты.
аминокислоты.
Некоторые группы расширили определение биологических препаратов, включив в него любое вещество, состоящее из органических молекул, независимо от их размера. Третьи считают, что любой продукт, полученный биологическим путем, можно назвать биологическим, и еще больше думают, что любая сложная молекула — независимо от того, как она произведена — должна принадлежать к этому классу.Другие могут включать вещества, которые образуются в других организмах, но не являются очень сложными, например, гормоны эстрогены, извлеченные из мочи жеребых кобыл (премарин).
Хотя большинство сегодняшних блокбастеров получают химическим путем, следующим поколением блокбастеров могут быть биологические препараты, говорит автор Томас Морроу, доктор медицины.
ФОТОГРАФИЯ СТЭНА КАДИ
Независимо от того, какое определение используется, оно, скорее всего, будет нуждаться в модификации по мере появления на рынке новых продуктов.За некоторыми исключениями, в этой статье будет использоваться определение, согласно которому биологические препараты создаются либо микроорганизмом, либо клеткой млекопитающего и представляют собой большие сложные молекулы, большинство из которых представляют собой белки или полипептиды.
Химические препараты часто более чистые и лучше охарактеризованы современными аналитическими технологиями, чем биологические препараты. На активность биологического агента может влиять клеточная система, в которой он производится, ферментационная среда или условия эксплуатации.
Использование живых организмов для производства лечебных экстрактов не ново.Новым является манипулирование генетикой этих организмов для производства конкретных терапевтических средств.
Процесс производства химических препаратов относительно хорошо определен, что позволяет производить эти препараты в однородных больших количествах. Биопрепараты, однако, имеют сложный производственный процесс, который, как правило, дает небольшие количества. Трудно масштабировать биологические препараты от лабораторных количеств, используемых для раннего анализа и доклинических испытаний, до крупномасштабных партий и поддерживать чистоту продукта и эквивалентность между партиями.
Биопрепараты часто чрезвычайно чувствительны к физическим условиям (температура, силы сдвига, химическая фаза и свет) и действию ферментов. Обычно они требуют сложных биоанализов для выпуска партии и оценки стабильности, а не химических тестов на идентичность и чистоту.
КАК ОНИ РАБОТАЮТ
Терапевтической мишенью биологического препарата всегда является ген или белок. Тот факт, что генетическая информация расшифровывается одинаково во всех клетках, независимо от вида, позволяет людям изучать функцию генов у червей или рыбок данио.
Рекомбинантная ДНК, важный процесс производства биологических препаратов, требует выделения ДНК из клеток человека и возможной модификации этого сегмента ДНК, введения его в бактерию или клетку млекопитающего и получения этого организма или клетки для его экспрессии. Процесс разработки включает в себя несколько этапов: поиск генов, кодирующих белки, клонирование генов, воспроизведение белков, связанных с генами, определение роли белков в патологическом процессе, а затем разработка потенциальной терапии.
Все идентифицированные новые белки проходят серию клеточных анализов, позволяющих получить информацию о том, как конкретный белок изменяет биологический процесс. Биоанализы для определения потенции используют биологические индикаторы живых организмов или тканей. Они могут включать культуры тканей на основе клеток, технологию экспрессии микрочипов, нокаутные модели животных, модели трансгенных животных и технологию антисмысловых или антител (например, диагностическую характеристику антител).
Вероятность иммунных реакций на биологические препараты выше, чем на химические препараты.Молекулы в химических препаратах слишком малы, чтобы считаться иммуногенными, и, как правило, иммунная система не распознает их как «захватчиков». С биологическими препаратами, в зависимости от препарата, иммунная система человека может быстро идентифицировать молекулу, а затем вызвать иммунный ответ, чтобы удалить большую молекулу, которую она считает чужеродным веществом. Это может разрушить или, в редких случаях, усилить активность биофармацевтического препарата.
Почти все биологические препараты могут индуцировать выработку антител, хотя большинство антител имеют доброкачественные клинические последствия.Антитела могут быть вызваны крошечными фрагментами загрязнения, контактом с сывороткой пациента или ферментативными каскадами после введения дозы.
КОМПЛЕКСНОЕ ПРОИЗВОДСТВО
Хрупкость биологических макромолекул и чувствительность живых клеток, производящих биопрепараты, обусловливают сложные производственные требования к ферментации, асептической обработке, хранению и тестированию. Хотя активный ингредиент химического фармацевтического препарата обычно представляет собой уникальную молекулу, подлежащую хорошо зарекомендовавшим себя аналитическим тестам, для биологических препаратов активный компонент часто представляет собой часть большой макромолекулы.Эта макромолекула, в свою очередь, является модификацией исходного белка или полипептида и других биологических веществ, которые не могут быть четко охарактеризованы. Белковые и полипептидные продукты могут содержать различные комплексы, а это означает, что они имеют различное количество идентичных компонентов в молекулах. Кроме того, биологические препараты могут иметь различия в поверхностных сахарах (гликозилирование) или схемах укладки в зависимости от способа их производства. При использовании биопрепаратов также существует вероятность микробиологического загрязнения исходных материалов.
Кроме того, биологические препараты могут иметь различия в поверхностных сахарах (гликозилирование) или схемах укладки в зависимости от способа их производства. При использовании биопрепаратов также существует вероятность микробиологического загрязнения исходных материалов.
Поскольку биологические препараты часто гетерогенны по молекулам и/или присутствующим полипептидам, они имеют профиль примесей, который зависит и может меняться в зависимости от процессов, используемых для изготовления и тестирования каждой партии. Для биологических препаратов необходимо определить белковую смесь, а также охарактеризовать активный агент и поддерживающие агенты. Другими словами, продукт не обязательно должен быть гомогенным, если биологический препарат действует через молекулярную группу. Кровь, например, является биопрепаратом (согласно классификации Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США), который не состоит из единой однородной молекулы.
Это не означает отсутствия мер контроля качества при производстве биологических препаратов; на самом деле верно как раз обратное. Типичный производственный процесс химического препарата может включать от 40 до 50 критических тестов. Процесс для биологического может содержать 250 или более. Биологическое производство использует специализированные процессы, которые не всегда напоминают объекты, машины или оборудование, используемые для производства химических лекарств. Строительство и аттестация новых объектов несоразмерно дороги, а также отнимают много времени.Это помогает объяснить глобальную нехватку биопроизводственных мощностей и разницу в стоимости между биологическими и химическими препаратами.
Типичный производственный процесс химического препарата может включать от 40 до 50 критических тестов. Процесс для биологического может содержать 250 или более. Биологическое производство использует специализированные процессы, которые не всегда напоминают объекты, машины или оборудование, используемые для производства химических лекарств. Строительство и аттестация новых объектов несоразмерно дороги, а также отнимают много времени.Это помогает объяснить глобальную нехватку биопроизводственных мощностей и разницу в стоимости между биологическими и химическими препаратами.
Отдельные категории структуры биологического агента
Гормон (гормон роста, паратиреоидный гормон, инсулин): Вещество, обычно пептид или стероид, вырабатываемое одной тканью и переносимое кровотоком в другую для осуществления физиологической активности например, рост или обмен веществ. |
| Интерфероны: Белки, которые обычно вырабатываются клетками в ответ на вирусную инфекцию и другие раздражители. |
| Интерлейкины: Большая группа цитокиновых белков. Большинство из них участвуют в управлении делением и дифференцировкой других иммунных клеток. |
| Фактор роста: Вещество, такое как витамин B12 или интерлейкин, которое способствует росту, особенно росту клеток. |
Моноклональные антитела (МАт): Один вид молекул иммуноглобулина, полученный путем культивирования одного клона клетки гибридомы.MAb распознают только одну химическую структуру, т. е. они направлены против одного эпитопа антигенного вещества, используемого для образования антител. |
| Полипептиды: Пептиды, содержащие десять или более аминокислот. Как правило, пептид состоит менее чем из 50 аминокислот, а белок состоит из более чем 50 аминокислот. |
| Белки: Встречающиеся в природе и синтетические полипептиды с молекулярной массой более 10 000 (предел не является точным). |
| Вакцина: Агент, содержащий антигены, полученные из убитых, аттенуированных или живых патогенных микроорганизмов, синтетических пептидов или рекомбинантных организмов. Используется для стимуляции иммунной системы реципиента к выработке специфических антител, обеспечивающих активный иммунитет и/или пассивный иммунитет у потомства. |
Изменение производственного процесса обычно вызывает меньше проблем с химическими препаратами, чем с биологическими препаратами. Партии химических препаратов выпускаются в соответствии со спецификациями на лекарственное вещество и конечный продукт без обширной характеристики и критических испытаний, необходимых для биологических препаратов.
Партии химических препаратов выпускаются в соответствии со спецификациями на лекарственное вещество и конечный продукт без обширной характеристики и критических испытаний, необходимых для биологических препаратов.
ДОЗИРОВКА И РАСПРЕДЕЛЕНИЕ
Биопрепараты могут стоить тысячи долларов в месяц и требуют особого обращения, поскольку они часто менее стабильны, чем лекарства химического происхождения, и требуют контролируемой температуры и освещения, а также защиты от толчков в жидкой форме. Например, многие крупные белки нельзя встряхивать для восстановления, так как встряхивание может разрушить структуру белка.
Биопрепараты — это препараты, нацеленные на определенные генотипы или белковые рецепторы. Чаще всего они хранятся, обрабатываются и доставляются специализированными аптеками, дистрибьюторами, которые специализируются на введении продуктов со сложными молекулами для небольших групп населения и имеют специальные процессы обработки, обработки и отправки по почте для размещения этих сложных лекарств. Во многих отношениях биологические препараты считаются дизайнерскими препаратами, предназначенными для пациентов с необычными заболеваниями или для генетических подклассов пациентов с широко распространенными заболеваниями.
Во многих отношениях биологические препараты считаются дизайнерскими препаратами, предназначенными для пациентов с необычными заболеваниями или для генетических подклассов пациентов с широко распространенными заболеваниями.
Для некоторых очень редких заболеваний, таких как болезнь Гоше, число пациентов в США может не превышать 1000. Высокая стоимость разработки и маркетинга продукта в сочетании с небольшой целевой аудиторией приводит к значительным затратам на одного пациента. Часто специализированные клиники лечат пациентов и/или назначают эти препараты.
Лекарственные формы химических препаратов сильно различаются, и концентрации обычно легко определить. Тем не менее, поскольку биологические молекулы слишком велики, чтобы их можно было принимать перорально, не разрушаясь перед тем, как пройти через кишечник в кровоток, их обычно вводят путем инъекций или инфузий.Кроме того, эффективность биологических агентов труднее определить количественно, а мониторинг является ключевым компонентом ранней терапии.
Изучаются новые способы введения, например, через пищу, которая является прямо или косвенно трансгенной. Примером последнего является козье молоко, которое производит противомалярийное соединение. Трансдермальные вакцины также находятся в стадии изучения.
НОРМАТИВНЫЕ ВОПРОСЫ
FDA точно определяет биологические методы лечения и устройства для целей регулирования.Предполагаемое использование продукта может диктовать его классификацию — например, диагностический набор in vitro может соответствовать классическому определению медицинского устройства, но все же может быть определен как биологический, поскольку он используется для тестирования и выпуска лицензированного биологического продукта, такого как кровь. Аналогичный набор, используемый для тестирования образцов крови для диагностики таких заболеваний, как краснуха, или для мониторинга прогрессирования заболевания, может подпадать под действие правил медицинского оборудования из-за его использования для диагностики заболеваний человека.
Производственный процесс биологических продуктов является частью патента и подлежит утверждению регулирующими органами.Изменения процесса вызывают необходимость в новых клинических испытаниях, что приводит к увеличению затрат на разработку. Частично для того, чтобы исправить это, Центр оценки и исследований биологических препаратов (CBER) FDA разработал проект руководства по протоколу сопоставимости после утверждения, позволяющему компаниям объединять несколько производственных изменений в одну сокращенную заявку на получение после утверждения, когда они изменяют свой процесс. Компании не обязаны дублировать клинические исследования после изменения производства лекарственного средства, если они могут показать, что оно является биоэквивалентным и не вызывает новых побочных реакций.
Многие биологические продукты — некоторые вакцины, генная терапия, антитоксины, кровь и некоторые средства диагностики in vitro и многие другие — одобрены CBER. Остальные категории, включая моноклональные антитела, факторы роста, ферменты, иммуномодуляторы и тромболитики, находятся в ведении Центра оценки и исследований лекарственных средств (CDER). Генерические (точнее, последующие) биологические препараты незаконны в Соединенных Штатах, и для их одобрения не существует регулирующих органов.
Генерические (точнее, последующие) биологические препараты незаконны в Соединенных Штатах, и для их одобрения не существует регулирующих органов.
При генетическом тестировании перед лечением крупные клинические исследования могут стать устаревшими.Обычные клинические испытания включают экстраполяцию на более крупные популяции для прогнозирования медицинских результатов в гораздо более крупных популяциях; однако на сегодняшний день биологические препараты не были нацелены на большие гетерогенные популяции, поэтому проведение крупных испытаний расточительно. Кроме того, соотношение риск/польза лекарства для смертельного заболевания смещено в сторону эффективности по сравнению с безопасностью. Это не относится к обычному лекарству от хронического состояния, такого как гипертония, для которого существует множество относительно безопасных вариантов лечения.
СТОИМОСТЬ ВЗВЕШИВАНИЯ, СТОИМОСТЬ
Биопрепараты, хотя и намного более дорогие, чем химические вещества, поставщики медицинских услуг и плательщики обычно считают, что они стоят своих затрат — до тех пор, пока соответствующие пациенты получают их и достигают желаемых клинических результатов. Пациенты, для которых биопрепараты представляют ценность, включают тех, у кого традиционные методы лечения оказались неэффективными или для которых не существует других вариантов. Для некоторых лекарств анализы помогают в отборе пациентов. Стоимость тестов на основе ДНК и расходы на обучение клиницистов их использованию должны быть учтены в чистой стоимости.
Пациенты, для которых биопрепараты представляют ценность, включают тех, у кого традиционные методы лечения оказались неэффективными или для которых не существует других вариантов. Для некоторых лекарств анализы помогают в отборе пациентов. Стоимость тестов на основе ДНК и расходы на обучение клиницистов их использованию должны быть учтены в чистой стоимости.
ЗАХВАТЫВАЮЩЕЕ БУДУЩЕЕ
Заглядывая вперед, несколько многообещающих технологических достижений находятся на разных стадиях готовности, каждое из которых имеет серьезные последствия.
РНК-интерференция позволяет лучше охарактеризовать функцию конкретного гена или фрагмента ДНК. Антисмысловые молекулы (небольшие фрагменты ДНК или РНК) предотвращают выработку белка, закодированного в этой заблокированной ДНК или РНК, эффективно «выбивая» ген. Процедура нокаута также используется для определения функции определенного гена у лабораторных животных.Затем эти знания можно экстраполировать на соответствующие человеческие гены. Физическое проявление признака или заболевания обычно является кульминацией многих стадий, включающих цепную реакцию белок-белок, начиная с экспрессии гена и заканчивая каскадом небольших событий, в которых молекула изменяется ферментами, а затем передается другие ферменты для дальнейших изменений.
Физическое проявление признака или заболевания обычно является кульминацией многих стадий, включающих цепную реакцию белок-белок, начиная с экспрессии гена и заканчивая каскадом небольших событий, в которых молекула изменяется ферментами, а затем передается другие ферменты для дальнейших изменений.
Ученые изучают взаимосвязь между генами, признаками и белками, блокируя экспрессию генов и характеризуя полученные биологические или видимые изменения.Полученные знания помогут в выборе будущих методов лечения. Заместительная генная терапия, направленная на такие заболевания, как гемофилия, вызванная недостатком белка, является одним из направлений исследований.
Наука быстро раскрывает секреты человеческой ДНК. Здравоохранение догоняет его.
Простые молекулы — Ковалентные вещества — GCSE Chemistry (Single Science) Revision — Other
Ковалентно связанные вещества делятся на два основных типа:
- 212br8u896y.0.0.0.1:0.1.0.$0.$1.$1″>
- простые молекулы
- гигантские ковалентные структуры
Простые молекулы содержат всего несколько атомов, удерживаемых вместе ковалентными связями.Примером может служить двуокись углерода (CO 2 ), молекулы которой содержат один атом углерода, связанный с двумя атомами кислорода.
Однако, хотя ковалентные связи , удерживающие атомы вместе в простой молекуле, прочны , межмолекулярные силы между простыми молекулами 212br8u896y.0.0.0.1:0.1.0.$0.$1.$4.$7″> слабы .
Свойства простых молекулярных веществ
- Низкие температуры плавления и кипения — это связано с тем, что для разрушения слабых межмолекулярных сил требуется мало энергии.
- Не проводят электричество — это потому, что у них нет ни свободных электронов, ни общего электрического заряда.
Водород, аммиак, метан и чистая вода также являются простыми молекулами. Все они имеют сильные ковалентные связи 212br8u896y.0.0.0.1:0.1.0.$0.$2.$2.$1″> между своими атомами , но гораздо более слабые межмолекулярные связи между молекулами .
Когда одно из этих веществ плавится или кипит, разрываются именно эти слабые межмолекулярные силы, а не прочные ковалентные связи.При комнатной температуре простые молекулярные вещества представляют собой газы, жидкости или твердые тела с низкими температурами плавления и кипения.
Слайд-шоу показывает, как при кипении или плавлении разрушаются слабые межмолекулярные силы между молекулами воды:
Локк, вещество — это всего лишь идея
[В разделе 33 Локк развивает это последнее замечание, утверждая, что мы можем построить наше представление о Боге как о бесконечно могущественном, мудром и т. д. с помощью общей процедуры, которую он иллюстрирует примером в разделе 34. ]
]
34. Если я обнаружу, что знаю несколько вещей, некоторые или все из них несовершенно, я могу составить представление о том, что знаю вдвое больше; которое я могу снова удвоить, ·и так далее до бесконечности·, точно так же, как я могу генерировать бесконечный ряд чисел путем многократного удвоения. Таким образом, я могу расширить свое представление о знании, распространив его охват на все существующие или возможные вещи. И я могу сделать то же самое в отношении более совершенного познания их, образуя таким образом идею бесконечного или безграничного знания. То же самое можно сделать и с властью.. . .а также на время существования. . . . Мы формируем наилучшее представление о Боге, на которое способны наши умы, • беря простые идеи из операций нашего собственного разума (через размышление) или из внешних вещей (через наши чувства) и • расширяя их до той необъятности, до которой может дойти бесконечность. расширить их.
35. Именно бесконечность, соединенная с существованием, силой, знанием и т. д., составляет нашу сложную идею Бога. Хотя в своей сущности (которой мы не знаем, как не знаем истинной сущности камешка, или мухи, или нас самих) Бог может быть простым и несложным, все же наше единственное представление о Нем есть сложное. тот, частью которого являются идеи существования, знания, силы, счастья и т. д.— все это бесконечно и вечно. . . .
д., составляет нашу сложную идею Бога. Хотя в своей сущности (которой мы не знаем, как не знаем истинной сущности камешка, или мухи, или нас самих) Бог может быть простым и несложным, все же наше единственное представление о Нем есть сложное. тот, частью которого являются идеи существования, знания, силы, счастья и т. д.— все это бесконечно и вечно. . . .
36. Помимо бесконечности, нет никакой идеи, которую мы приписываем Богу, которая не была бы также частью нашей сложной идеи о других Духах [здесь = что-то вроде «ангелов»]. Мы можем отнести к Духам только те идеи, которые получаем от размышления; и мы можем отличить их «от Бога, с одной стороны, и от нас, с другой», только благодаря различиям в объеме и степени знания, силы, длительности, счастья и т. д., которые каждый из них имеет. Вот еще одно доказательство того, что мы ограничены идеями, которые мы получаем из ощущения и размышления: даже если мы мыслим о невоплощенных духах как о чем-то гораздо, даже бесконечно более продвинутом, чем тела, мы все же не можем иметь какое-либо представление о том, как они раскрывают свои мысли друг другу. Мы должны использовать физические знаки и определенные звуки; они самые лучшие и самые быстрые, на которые мы способны, что делает их самыми полезными, которые мы можем найти. Конечно, невоплощенные Духи должны также иметь более совершенный способ сообщения своих мыслей, чем у нас; но о таком непосредственном общении мы не имеем никакого опыта в себе и, следовательно, никакого понятия.
Мы должны использовать физические знаки и определенные звуки; они самые лучшие и самые быстрые, на которые мы способны, что делает их самыми полезными, которые мы можем найти. Конечно, невоплощенные Духи должны также иметь более совершенный способ сообщения своих мыслей, чем у нас; но о таком непосредственном общении мы не имеем никакого опыта в себе и, следовательно, никакого понятия.
37. Теперь мы увидели, какие идеи мы имеем о субстанциях всех видов, из чего они состоят и как мы к ним пришли.Все это, я думаю, делает три вещи очень очевидными. 1. Все наши идеи о различных видах субстанций суть не что иное, как совокупность простых идей вместе с предположением о чем-то, чему они принадлежат и в чем существуют, хотя у нас вообще нет ясной отчетливой идеи об этом предполагаемом чем-то.
2. Все простые идеи, которые, будучи соединены таким образом в одном общем субстрате, составляют наши сложные идеи различных родов субстанций, получены из ощущения или размышления. Даже «те чрезвычайно знакомые идеи, которые применимы почти ко всему, — такие, как идеи времени, движения, тела, мысли, чувства, — имеют такие простые идеи ощущения и отражения как свои единственные ингредиенты. Так же обстоит дело и с идеями, которые, по-видимому, наиболее далеки от того, чтобы иметь с нами какое-либо отношение, и которые бесконечно превосходят все, что мы можем воспринять в себе путем размышления или обнаружить посредством ощущения в других вещах. Даже эти идеи должны быть построены из простых идей, которые мы первоначально получили от ощущения или размышления. Это явно относится к сложным представлениям, которые у нас есть об ангелах, и особенно к нашему представлению о Боге.
Так же обстоит дело и с идеями, которые, по-видимому, наиболее далеки от того, чтобы иметь с нами какое-либо отношение, и которые бесконечно превосходят все, что мы можем воспринять в себе путем размышления или обнаружить посредством ощущения в других вещах. Даже эти идеи должны быть построены из простых идей, которые мы первоначально получили от ощущения или размышления. Это явно относится к сложным представлениям, которые у нас есть об ангелах, и особенно к нашему представлению о Боге.
3. Большинство простых идей, из которых состоят наши сложные идеи о субстанциях, на самом деле являются лишь «идеями» сил, как бы мы ни склонны думать о них как «идеях» положительных качеств.[Здесь опять «положительные» противопоставляются «относительным».] Например, большинство идей, составляющих наше сложное представление о золоте, — это желтизна, большой вес, пластичность, плавкость и растворимость в царской водке и т. д., объединенные вместе в неизвестное. субстрат; и все это идеи об отношении золота к другим веществам.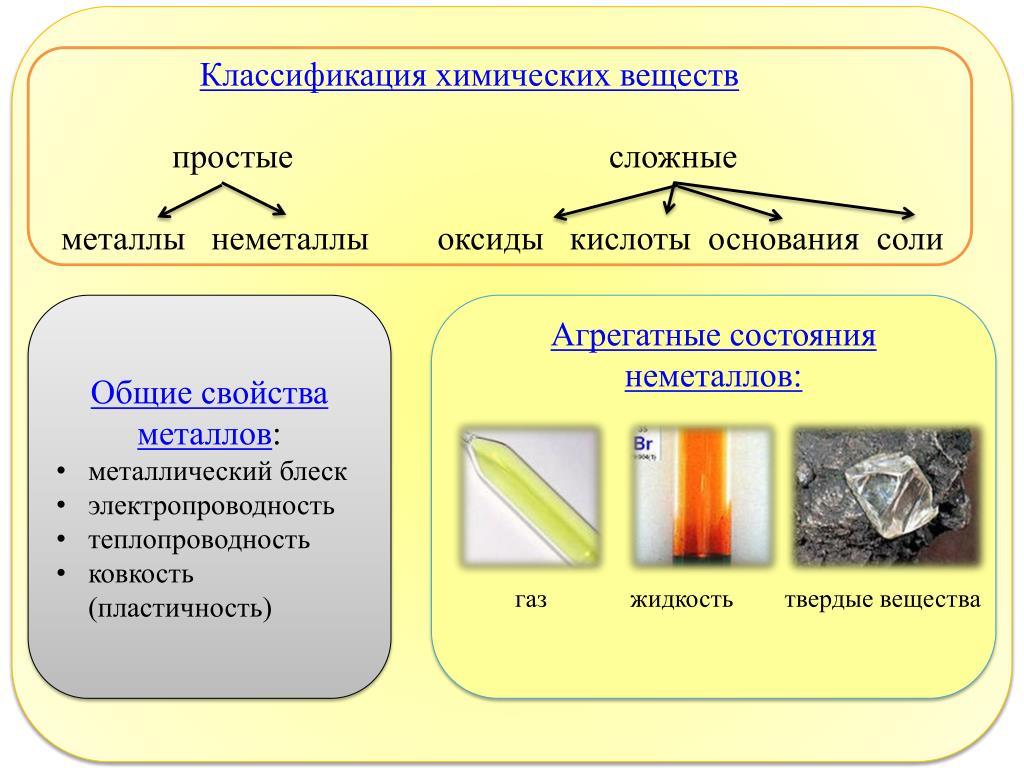 · Быть тяжелым значит иметь силу перевешивать другие вещи; быть желтым означает обладать способностью вызывать определенные зрительные ощущения у людей-наблюдателей. [Пластичность — это способность вытягиваться в тонкую проволоку, а плавкость — это способность плавиться в горячем состоянии; ни одно из которых не является отношением к другим субстанциям.Может быть, у Локка здесь работает иная мысль, не совсем правильно выраженная: он может противопоставлять «положительные» качества не только относительным качествам, но и условным. Приписывать чему-то силу — значит утверждать об этом условное: если что-то нагреть, оно растает. Положительное качество, такое как прямоугольность, не таково: вещь справедлива квадратна, и «если» в нее не входит.] Эти силы зависят от реальных и первичных качеств внутреннего строения золота; именно они придают ему способность воздействовать на другие субстанции и управляться ими; но силы на самом деле не в золоте, если рассматривать его чисто само по себе.
· Быть тяжелым значит иметь силу перевешивать другие вещи; быть желтым означает обладать способностью вызывать определенные зрительные ощущения у людей-наблюдателей. [Пластичность — это способность вытягиваться в тонкую проволоку, а плавкость — это способность плавиться в горячем состоянии; ни одно из которых не является отношением к другим субстанциям.Может быть, у Локка здесь работает иная мысль, не совсем правильно выраженная: он может противопоставлять «положительные» качества не только относительным качествам, но и условным. Приписывать чему-то силу — значит утверждать об этом условное: если что-то нагреть, оно растает. Положительное качество, такое как прямоугольность, не таково: вещь справедлива квадратна, и «если» в нее не входит.] Эти силы зависят от реальных и первичных качеств внутреннего строения золота; именно они придают ему способность воздействовать на другие субстанции и управляться ими; но силы на самом деле не в золоте, если рассматривать его чисто само по себе.
10.
 5 Твердое состояние вещества – Химия
5 Твердое состояние вещества – ХимияЦели обучения
К концу этого раздела вы сможете:
- Дайте определение и опишите связь и свойства ионных, молекулярных, металлических и ковалентно-сетчатых кристаллических твердых тел
- Описать основные типы кристаллических твердых тел: ионные твердые тела, металлические твердые тела, твердые тела с ковалентной сеткой и молекулярные твердые тела
- Объясните, каким образом дефекты кристаллов могут возникать в твердом теле
Когда большинство жидкостей охлаждаются, они в конце концов замерзают и образуют кристаллические твердые тела , твердые тела, в которых атомы, ионы или молекулы располагаются в определенном повторяющемся порядке.Жидкость также может замерзнуть до того, как ее молекулы выстроятся в упорядоченную структуру. Полученные материалы называются аморфными твердыми телами или некристаллическими твердыми телами (или, иногда, стеклами).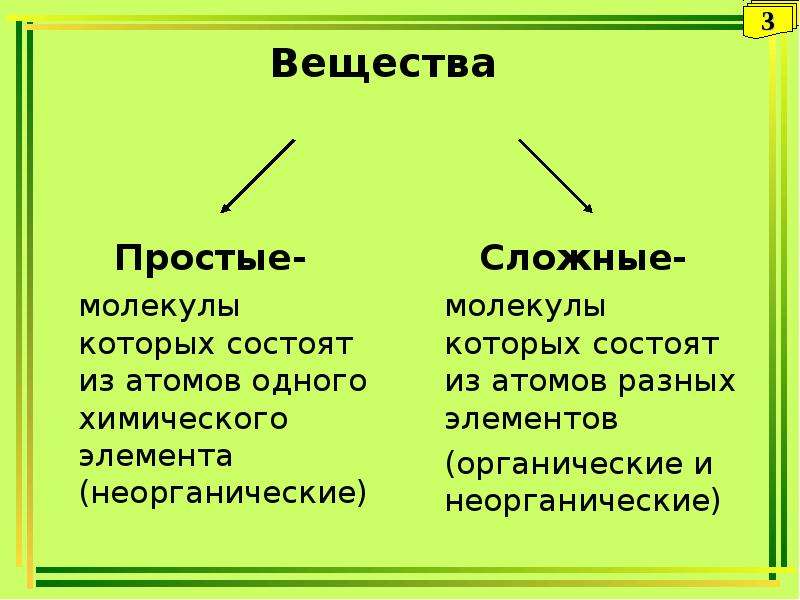 Частицы таких твердых тел лишены упорядоченной внутренней структуры и расположены беспорядочно (рис. 1).
Частицы таких твердых тел лишены упорядоченной внутренней структуры и расположены беспорядочно (рис. 1).
Металлы и ионные соединения обычно образуют упорядоченные кристаллические твердые тела.Вещества, состоящие из больших молекул или смеси молекул, движения которых более ограничены, часто образуют аморфные твердые тела. Например, свечной воск представляет собой аморфные твердые вещества, состоящие из больших молекул углеводородов. Некоторые вещества, такие как оксид бора (показан на рис. 2), могут образовывать либо кристаллические, либо аморфные твердые вещества, в зависимости от условий, в которых они производятся. Кроме того, аморфные твердые тела могут переходить в кристаллическое состояние при соответствующих условиях.
Рис. 2. (a) Триоксид дибора, B 2 O 3 , обычно встречается в виде белого аморфного твердого вещества (стекло), которое имеет высокую степень беспорядка в своей структуре. (b) При осторожном продолжительном нагревании он может быть преобразован в кристаллическую форму B 2 O 3 , которая имеет очень упорядоченное расположение.
(b) При осторожном продолжительном нагревании он может быть преобразован в кристаллическую форму B 2 O 3 , которая имеет очень упорядоченное расположение.Кристаллические твердые тела обычно классифицируют в соответствии с природой сил, удерживающих их частицы вместе. Эти силы в первую очередь ответственны за физические свойства сыпучих материалов.В следующих разделах дается описание основных типов кристаллических твердых тел: ионных, металлических, ковалентно-сетчатых и молекулярных.
Ионные твердые вещества , такие как хлорид натрия и оксид никеля, состоят из положительных и отрицательных ионов, которые удерживаются вместе за счет электростатического притяжения, которое может быть довольно сильным (рис. 3). Многие ионные кристаллы также имеют высокие температуры плавления. Это происходит из-за очень сильного притяжения между ионами — в ионных соединениях притяжение между полными зарядами (намного) больше, чем между частичными зарядами в полярных молекулярных соединениях. Это будет рассмотрено более подробно при более позднем обсуждении энергий решетки. Хотя они твердые, они также имеют тенденцию быть хрупкими и скорее ломаются, чем гнутся. Ионные твердые вещества не проводят электричество; однако они проводят в расплавленном или растворенном состоянии, потому что их ионы могут свободно двигаться. Многие простые соединения, образованные реакцией металлического элемента с неметаллическим элементом, являются ионными.
Это будет рассмотрено более подробно при более позднем обсуждении энергий решетки. Хотя они твердые, они также имеют тенденцию быть хрупкими и скорее ломаются, чем гнутся. Ионные твердые вещества не проводят электричество; однако они проводят в расплавленном или растворенном состоянии, потому что их ионы могут свободно двигаться. Многие простые соединения, образованные реакцией металлического элемента с неметаллическим элементом, являются ионными.
Металлические твердые тела , такие как кристаллы меди, алюминия и железа, образованы атомами металла. Рисунок 4.Структуру металлических кристаллов часто описывают как равномерное распределение атомных ядер в «море» делокализованных электронов. Атомы в таком металлическом твердом теле удерживаются вместе уникальной силой, известной как металлическая связь , которая обеспечивает множество полезных и разнообразных объемных свойств.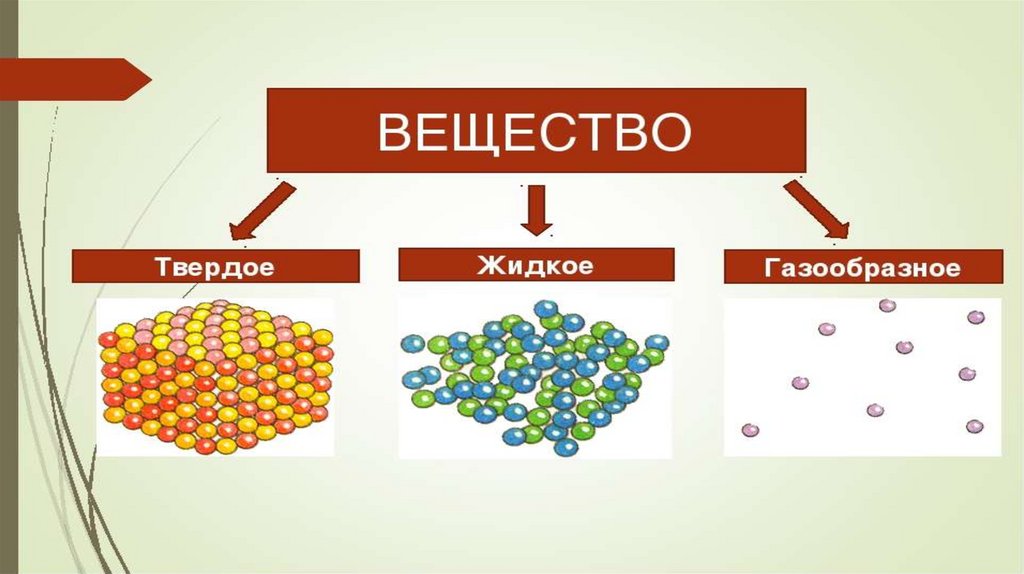 Все они обладают высокой тепло- и электропроводностью, металлическим блеском и пластичностью. Многие очень жесткие и достаточно сильные. Из-за своей пластичности (способность деформироваться под давлением или ударом молотка) они не рассыпаются и, следовательно, являются полезными строительными материалами.Температуры плавления металлов сильно различаются. Ртуть при комнатной температуре находится в жидком состоянии, а щелочные металлы плавятся при температуре ниже 200 °C. Некоторые постпереходные металлы также имеют низкие температуры плавления, тогда как переходные металлы плавятся при температурах выше 1000 °C. Эти различия отражают различия в силе металлической связи между металлами.
Все они обладают высокой тепло- и электропроводностью, металлическим блеском и пластичностью. Многие очень жесткие и достаточно сильные. Из-за своей пластичности (способность деформироваться под давлением или ударом молотка) они не рассыпаются и, следовательно, являются полезными строительными материалами.Температуры плавления металлов сильно различаются. Ртуть при комнатной температуре находится в жидком состоянии, а щелочные металлы плавятся при температуре ниже 200 °C. Некоторые постпереходные металлы также имеют низкие температуры плавления, тогда как переходные металлы плавятся при температурах выше 1000 °C. Эти различия отражают различия в силе металлической связи между металлами.
Твердые вещества с ковалентной сеткой включают кристаллы алмаза, кремния, некоторых других неметаллов и некоторых ковалентных соединений, таких как диоксид кремния (песок) и карбид кремния (карборунд, абразив на наждачной бумаге).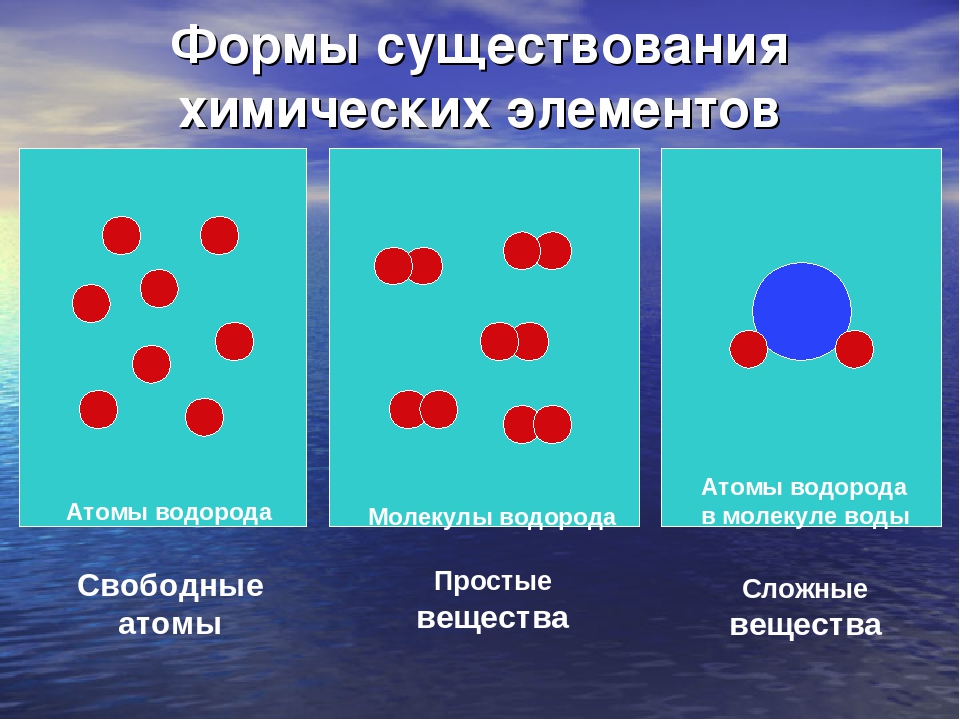 Многие минералы имеют сети ковалентных связей. Атомы в этих твердых телах удерживаются вместе сетью ковалентных связей, как показано на рисунке 5. Чтобы разорвать или расплавить твердое тело с ковалентной сетью, ковалентные связи должны быть разрушены. Поскольку ковалентные связи относительно прочны, твердые вещества с ковалентной сеткой обычно характеризуются твердостью, прочностью и высокими температурами плавления. Например, алмаз является одним из самых твердых известных веществ и плавится при температуре выше 3500 °C.
Многие минералы имеют сети ковалентных связей. Атомы в этих твердых телах удерживаются вместе сетью ковалентных связей, как показано на рисунке 5. Чтобы разорвать или расплавить твердое тело с ковалентной сетью, ковалентные связи должны быть разрушены. Поскольку ковалентные связи относительно прочны, твердые вещества с ковалентной сеткой обычно характеризуются твердостью, прочностью и высокими температурами плавления. Например, алмаз является одним из самых твердых известных веществ и плавится при температуре выше 3500 °C.
Молекулярные твердые вещества , такие как лед, сахароза (столовый сахар) и йод, как показано на рисунке 6, состоят из нейтральных молекул. Величина сил притяжения между единицами, присутствующими в разных кристаллах, сильно различается, на что указывают температуры плавления кристаллов.Небольшие симметричные молекулы (неполярные молекулы), такие как H 2 , N 2 , O 2 и F 2 , обладают слабыми силами притяжения и образуют молекулярные твердые вещества с очень низкими температурами плавления (ниже -200 ° C). ). Вещества, состоящие из более крупных неполярных молекул, обладают большей силой притяжения и плавятся при более высоких температурах. Молекулярные твердые тела, состоящие из молекул с постоянными дипольными моментами (полярные молекулы), плавятся при еще более высоких температурах. Примеры включают лед (точка плавления, 0 ° C) и столовый сахар (точка плавления, 185 ° C).
Величина сил притяжения между единицами, присутствующими в разных кристаллах, сильно различается, на что указывают температуры плавления кристаллов.Небольшие симметричные молекулы (неполярные молекулы), такие как H 2 , N 2 , O 2 и F 2 , обладают слабыми силами притяжения и образуют молекулярные твердые вещества с очень низкими температурами плавления (ниже -200 ° C). ). Вещества, состоящие из более крупных неполярных молекул, обладают большей силой притяжения и плавятся при более высоких температурах. Молекулярные твердые тела, состоящие из молекул с постоянными дипольными моментами (полярные молекулы), плавятся при еще более высоких температурах. Примеры включают лед (точка плавления, 0 ° C) и столовый сахар (точка плавления, 185 ° C).

Кристаллическое твердое вещество, подобное перечисленным в таблице 7, имеет точную температуру плавления, потому что каждый атом или молекула одного и того же типа удерживается на месте с одинаковыми силами или энергией. Таким образом, притяжение между единицами, составляющими кристалл, имеет одинаковую силу и требует одинакового количества энергии для разрушения.Постепенное размягчение аморфного материала резко отличается от отчетливого плавления кристаллического твердого тела. Это является следствием структурной неэквивалентности молекул в аморфном твердом теле. Одни силы слабее других, и при нагревании аморфного материала первыми разрушаются самые слабые межмолекулярные силы притяжения. При дальнейшем повышении температуры более сильные притяжения разрушаются. Таким образом, аморфные материалы размягчаются в диапазоне температур.
” Under the “Type of Solid” column are the following: ionic, metallic, covalent network, and molecular. Under the “Type of Particles” column are the following: ions, atoms of electropositive elements, atoms of electronegative elements, and molecules ( or atoms ). Under the “Type of Attractions” column are the following: ionic bonds, metallic bonds, covalent bonds, I M F s. Under the “Properties column” are the following: hard, brittle, conducts electricity as a liquid but not as a solid, high to very high melting points; shiny, malleable, ductile, conducts heat and electricity well, variable hardness and melting temperature; very hard, not conductive, very high melting points; variable hardness, variable brittleness, not conductive, low melting points. Under the “Examples” column are the following: N a C l, A l subscript 2 O subscript 3; C u, F e, T I, P b, U; C (diamond), S I O subscript 2, S i C; H subscript 2 O, C O subscript 2, I subscript 2, C subscript 12 H subscript 22 O subscript 11. «>
«>| Тип твердого тела | Тип частиц | Тип аттракционов | Свойства | Примеры |
|---|---|---|---|---|
| ионная | ионов | ионные связи | твердый, хрупкий, проводит электричество в жидком, но не в твердом состоянии, температура плавления от высокой до очень высокой | NaCl, Al 2 O 3 |
| металлический | атомов электроположительных элементов | металлические связки | блестящий, ковкий, пластичный, хорошо проводит тепло и электричество, переменная твердость и температура плавления | Cu, Fe, Ti, Pb, U |
| ковалентная сеть | атомов электроотрицательных элементов | ковалентные связи | очень твердый, непроводящий, очень высокая температура плавления | C (алмаз), SiO 2 , SiC |
| молекулярный | молекул (или атомов) | МВФ | переменная твердость, переменная хрупкость, непроводящий, низкая температура плавления | H 2 O, CO 2 , I 2 , C 12 H 22 O 11 |
Таблица 7. Типы кристаллических твердых тел и их свойства Типы кристаллических твердых тел и их свойства | ||||
Графен: материал будущего
Углерод является важным элементом в нашем мире. Уникальные свойства атомов углерода позволяют существовать основанным на углероде формам жизни, таким как мы. Углерод образует огромное количество разнообразных веществ, которые мы используем ежедневно, в том числе те, что показаны на рис. 7. Возможно, вы знакомы с алмазом и графитом, двумя наиболее распространенными аллотропными аллотропами углерода. (Аллотропы — это разные структурные формы одного и того же элемента.) Алмаз — одно из самых твердых известных веществ, тогда как графит достаточно мягкий, чтобы его можно было использовать в качестве грифеля карандаша. Эти очень разные свойства проистекают из различного расположения атомов углерода в разных аллотропах.
Рисунок 7. Алмаз чрезвычайно твердый из-за сильной связи между атомами углерода во всех направлениях. Графит (в карандашном грифеле) стирается с бумаги из-за слабого притяжения между углеродными слоями. Изображение поверхности графита показывает расстояние между центрами соседних атомов углерода.(фото слева: модификация работы Стива Джурветсона; фото в центре: модификация работы Геологической службы США)
Изображение поверхности графита показывает расстояние между центрами соседних атомов углерода.(фото слева: модификация работы Стива Джурветсона; фото в центре: модификация работы Геологической службы США)Возможно, вы менее знакомы с недавно открытой формой углерода: графеном. Графен был впервые выделен в 2004 году, когда с помощью ленты снимали с графита все более тонкие слои. По сути, это один лист (толщиной в один атом) графита. Графен, показанный на рисунке 8, не только прочен и легок, но также является отличным проводником электричества и тепла.Эти свойства могут оказаться очень полезными в широком диапазоне приложений, таких как значительно улучшенные компьютерные микросхемы и схемы, более совершенные батареи и солнечные элементы, а также более прочные и легкие конструкционные материалы. Нобелевская премия по физике 2010 года была присуждена Андре Гейму и Константину Новоселову за их новаторскую работу с графеном.
Рисунок 8.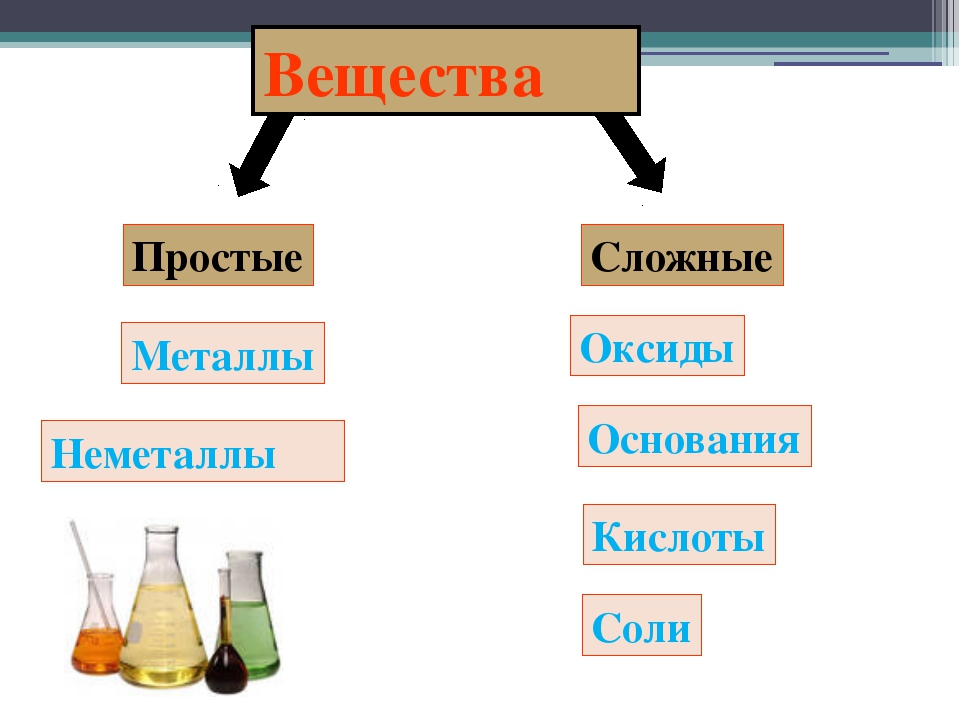 Листы графена могут быть сформированы в виде фуллеренов, нанотрубок и многослойных слоев.
Листы графена могут быть сформированы в виде фуллеренов, нанотрубок и многослойных слоев. В кристаллическом твердом теле атомы, ионы или молекулы располагаются в определенном повторяющемся порядке, но в этом образце могут возникать случайные дефекты.Известно несколько типов дефектов, как показано на рисунке 9. Вакансии — это дефекты, возникающие, когда позиции, которые должны содержать атомы или ионы, являются вакантными. Реже некоторые атомы или ионы в кристалле могут занимать позиции, называемые междоузлиями , расположенные между обычными позициями для атомов. В нечистых кристаллах встречаются и другие искажения, например, когда катионы, анионы или молекулы примеси слишком велики, чтобы вписаться в правильные положения без искажения структуры.Иногда к кристаллу добавляют следовые количества примесей (процесс, известный как легирование ) , чтобы создать дефекты в структуре, которые приводят к желаемым изменениям ее свойств. Например, кристаллы кремния легируют различным количеством различных элементов, чтобы получить подходящие электрические свойства для их использования в производстве полупроводников и компьютерных микросхем.
Например, кристаллы кремния легируют различным количеством различных элементов, чтобы получить подходящие электрические свойства для их использования в производстве полупроводников и компьютерных микросхем.
Некоторые вещества образуют твердые кристаллические вещества, состоящие из частиц очень организованной структуры; другие образуют аморфные (некристаллические) твердые тела с неупорядоченной внутренней структурой. Основными типами кристаллических твердых тел являются ионные твердые тела, металлические твердые тела, твердые тела с ковалентной сеткой и молекулярные твердые тела. Свойства различных видов кристаллических твердых тел обусловлены типами частиц, из которых они состоят, расположением частиц и силой притяжения между ними.Поскольку их частицы испытывают одинаковое притяжение, кристаллические твердые тела имеют разные температуры плавления; частицы в аморфных твердых телах испытывают ряд взаимодействий, поэтому они постепенно размягчаются и плавятся в диапазоне температур. Некоторые кристаллические твердые тела имеют дефекты в определенном повторяющемся узоре их частиц. Эти дефекты (которые включают вакансии, атомы или ионы, не находящиеся в правильном положении, а также примеси) изменяют физические свойства, такие как электропроводность, которая используется в кристаллах кремния, используемых для производства компьютерных микросхем.
Некоторые кристаллические твердые тела имеют дефекты в определенном повторяющемся узоре их частиц. Эти дефекты (которые включают вакансии, атомы или ионы, не находящиеся в правильном положении, а также примеси) изменяют физические свойства, такие как электропроводность, которая используется в кристаллах кремния, используемых для производства компьютерных микросхем.
Химия Упражнения в конце главы
- Какие типы жидкостей обычно образуют аморфные твердые тела?
- При очень низких температурах кислород O 2 замерзает и образует кристаллическое твердое вещество. Что лучше всего описывает эти кристаллы?
(а) ионная
(б) ковалентная сеть
(в) металлик
(г) аморфный
(e) молекулярные кристаллы
- При охлаждении оливковое масло медленно затвердевает и образует твердое вещество при различных температурах.Что лучше всего описывает твердое тело?
(а) ионная
(б) ковалентная сеть
(в) металлик
(г) аморфный
(e) молекулярные кристаллы
- Объясните, почему лед, представляющий собой кристаллическое твердое вещество, имеет температуру плавления 0 °C, тогда как масло, представляющее собой аморфное твердое вещество, размягчается в диапазоне температур.

- Определите тип твердого кристаллического вещества (металлическое, сетчатое, ковалентное, ионное или молекулярное), образованное каждым из следующих веществ:
(а) SiO 2
(б) KCl
(в) Cu
(г) СО 2
(д) С (алмаз)
(е) BaSO 4
(ж) NH 3
(з) NH 4 F
(и) С 2 Н 5 ОН
- Определите тип твердого кристаллического вещества (металлическое, сетчатое, ковалентное, ионное или молекулярное), образованное каждым из следующих веществ:
(а) CaCl 2
(б) карбид кремния
(в) № 2
(г) Fe
(д) С (графит)
(f) CH 3 CH 2 CH 2 CH 3
(г) HCl
(ч) NH 4 НЕТ 3
(и) К 3 ПО 4
- Классифицируйте каждое вещество в таблице как металлическое, ионное, молекулярное или ковалентное сетчатое твердое вещество:
The first row is a header row, and it labels each column: “Substance,” “Appearance,” “Melting Point,” “Electrical Conductivity,” and “Solubility in Water.” Under the “Substance” column are the following: X, Y, and Z. Under the “Appearance” column are the following: lustrous, malleable; soft, yellow; hard, white. Under the “Melting Point,” column are the following: 1500 degrees C, 113 degrees C, and 800 degrees C. Under the “Electrical Conductivity” column are the following: high; none; only if melted / dissolved. Under the “Solubility in Water” column are the following: insoluble, insoluble, and soluble.»>Вещество Внешний вид Точка плавления Электропроводность Растворимость в воде Х блестящий, пластичный 1500 °С высокий нерастворимый Д мягкий, желтый 113 °С нет нерастворимый З жесткий, белый 800 °С только в расплавленном/растворенном состоянии растворимый Таблица 8. 
- Классифицируйте каждое вещество в таблице как металлическое, ионное, молекулярное или ковалентное сетчатое твердое вещество:
Вещество Внешний вид Точка плавления Электропроводность Растворимость в воде Х хрупкий, белый 800 °С только в расплавленном/растворенном состоянии растворимый Д блестящий, пластичный 1100 °С высокий нерастворимый З твердый, бесцветный 3550 °С нет нерастворимый Таблица 9. 
- Идентифицируйте следующие вещества как ионные, металлические, ковалентно-сетчатые или молекулярные твердые вещества:
Вещество А ковкое, пластичное, хорошо проводит электричество и имеет температуру плавления 1135 °C. Вещество B является хрупким, не проводит электричество в твердом состоянии, но проводит электричество в расплавленном состоянии, и имеет температуру плавления 2072 °C. Вещество С очень твердое, не проводит электричество и имеет температуру плавления 3440 °С. Вещество D мягкое, не проводит электричество и имеет температуру плавления 185°С.
- Вещество А блестит, хорошо проводит электричество и плавится при 975 °C. Вещество A, вероятно, a(n):
(а) ионное твердое вещество
(b) металлический твердый
(c) молекулярное твердое вещество
(d) сплошная ковалентная сеть
- Вещество B твердое, не проводит электричество и плавится при 1200 °C. Вещество B, вероятно, a(n):
(а) ионное твердое вещество
(b) металлический твердый
(c) молекулярное твердое вещество
(d) сплошная ковалентная сеть
Глоссарий
- аморфное твердое вещество
- (также некристаллическое твердое вещество) твердое вещество, в котором частицы не имеют упорядоченной внутренней структуры
- сплошная ковалентная сеть
- твердое тело, частицы которого удерживаются вместе ковалентными связями
- кристаллическое твердое вещество
- твердое тело, в котором частицы расположены в определенном повторяющемся порядке
- промежуточные сайты
- промежутков между регулярными положениями частиц в любом массиве атомов или ионов
- ионное твердое вещество
- твердое тело, состоящее из положительных и отрицательных ионов, удерживаемых вместе сильным электростатическим притяжением
- сплошной металлический
- твердое тело, состоящее из атомов металла
- молекулярное твердое вещество
- твердое тело, состоящее из нейтральных молекул, удерживаемых вместе силами межмолекулярного притяжения
- вакансия
- дефект, возникающий, когда позиция, которая должна содержать атом или ион, является вакантной
Решения
Ответы на упражнения по химии в конце главы
2. (e) молекулярные кристаллы
(e) молекулярные кристаллы
4. Лед имеет кристаллическую структуру, стабилизированную водородными связями. Эти межмолекулярные силы сопоставимы по силе и поэтому требуют одинакового количества энергии для преодоления. В результате лед тает при одной температуре, а не в диапазоне температур. Различные, очень большие молекулы, из которых состоит масло, испытывают различное ван-дер-ваальсово притяжение различной силы, которое преодолевается при различных температурах, поэтому процесс плавления происходит в широком диапазоне температур.
6. (а) ионный; (б) ковалентная сеть; (в) молекулярный; (г) металлический; (д) ковалентная сеть; (е) молекулярный; (ж) молекулярный; (з) ионный; (i) ионный
8. X = ионная; Y = металлический; Z = ковалентная сеть
10. (b) металлический твердый
.
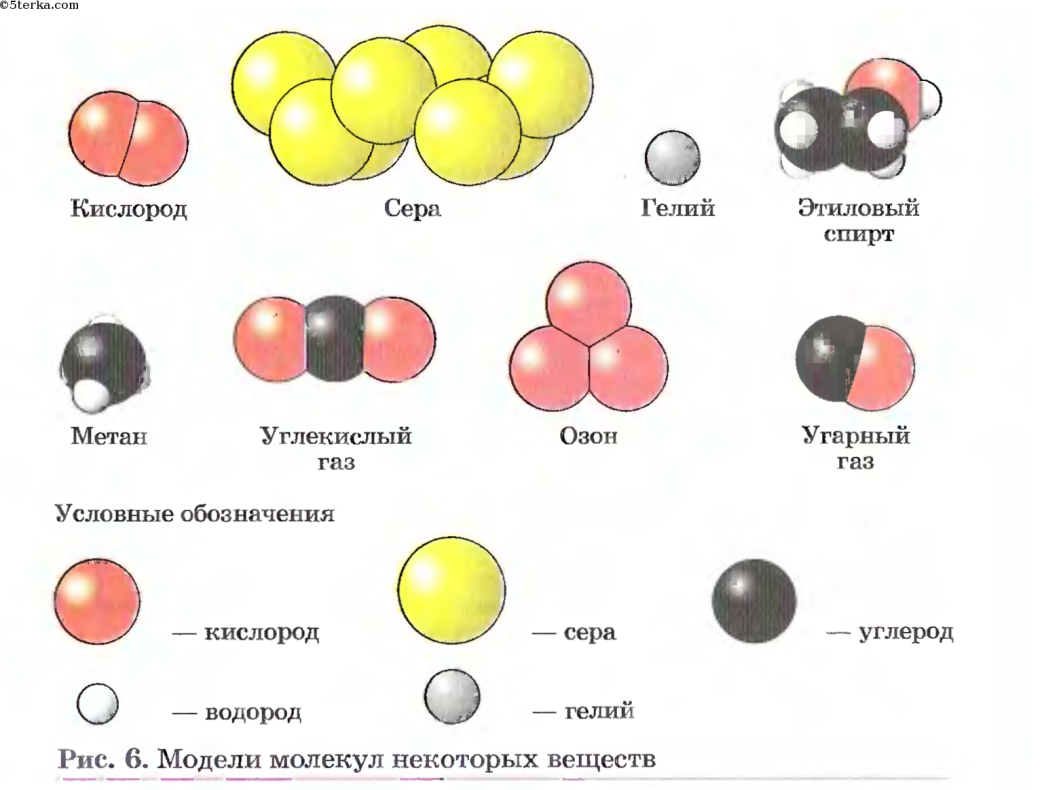

 3.1.2 Получать новое вещество согласно составленному плану эксперимента
3.1.2 Получать новое вещество согласно составленному плану эксперимента  Строение атома 2. Количесвто электронов
Строение атома 2. Количесвто электронов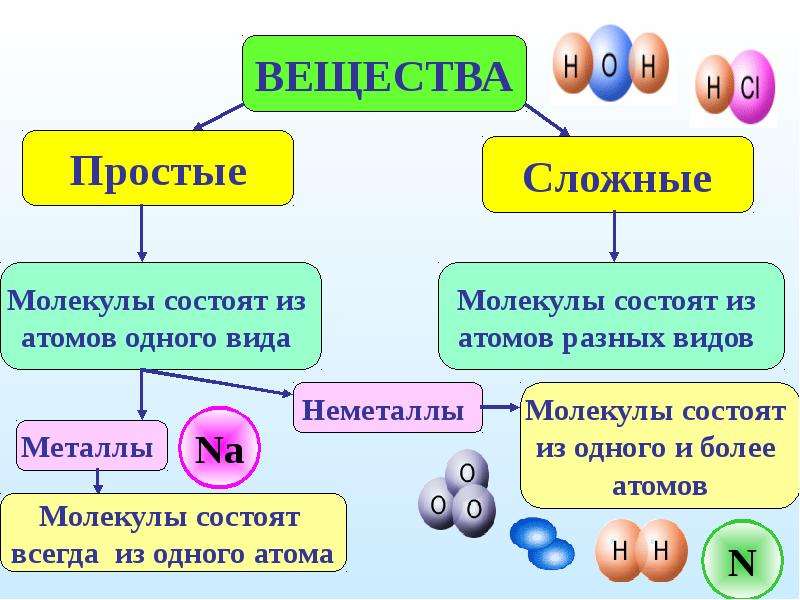 Коммулятивная беседа.
Коммулятивная беседа. Взаимопроверка работ в группах
Взаимопроверка работ в группах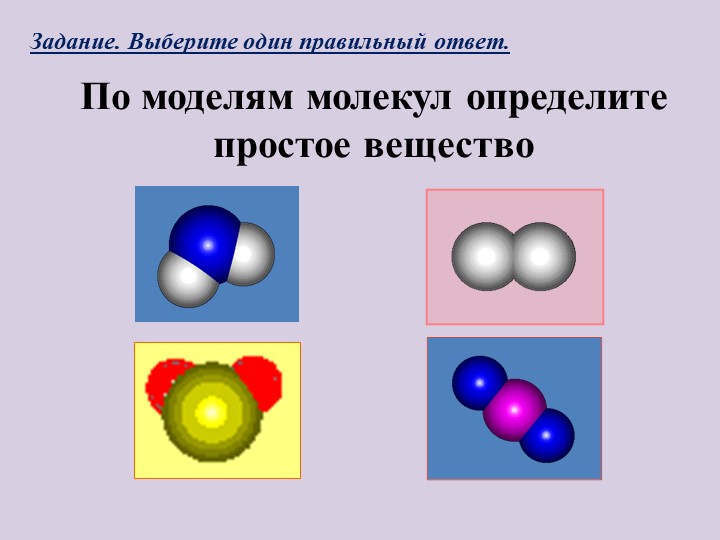 Рефлексия
Рефлексия . На уроке используется учебная информация с учетом различных типов восприятия информации. На этапе закрепления менее способным учащимся предлагаются различные подмостки.
. На уроке используется учебная информация с учетом различных типов восприятия информации. На этапе закрепления менее способным учащимся предлагаются различные подмостки.

 , Утверждая дженерик в соответствии со статьей 505(j) FDCA, FDA определяет, что дженерик «терапевтически эквивалентен» оригинальному лекарству и взаимозаменяем с ним.
, Утверждая дженерик в соответствии со статьей 505(j) FDCA, FDA определяет, что дженерик «терапевтически эквивалентен» оригинальному лекарству и взаимозаменяем с ним.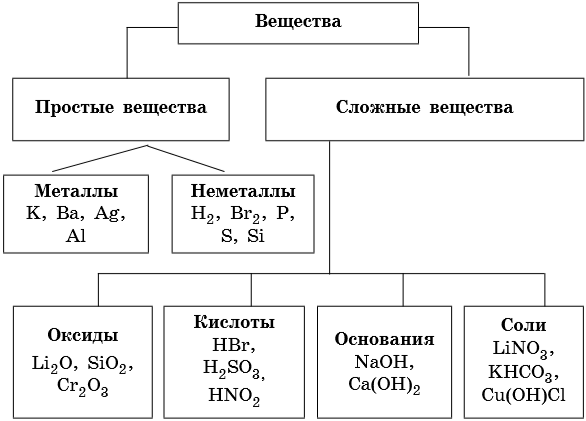
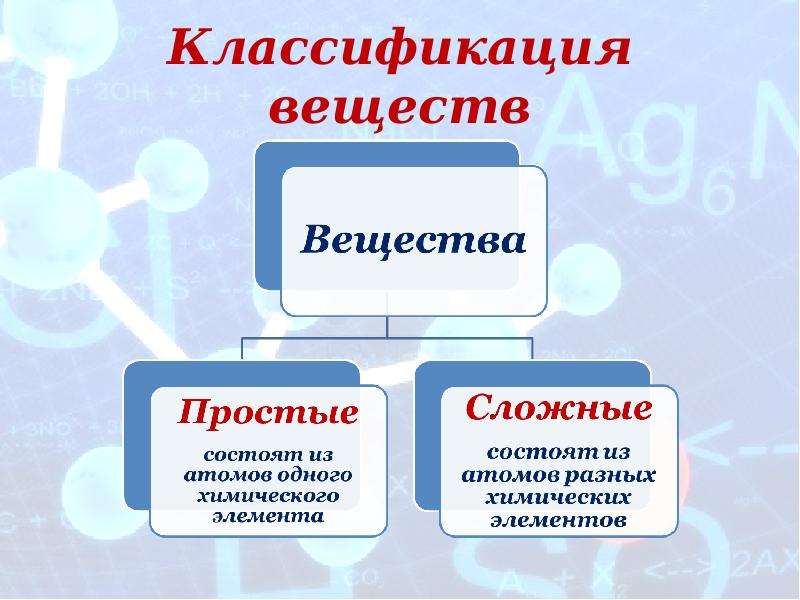

 9
9 
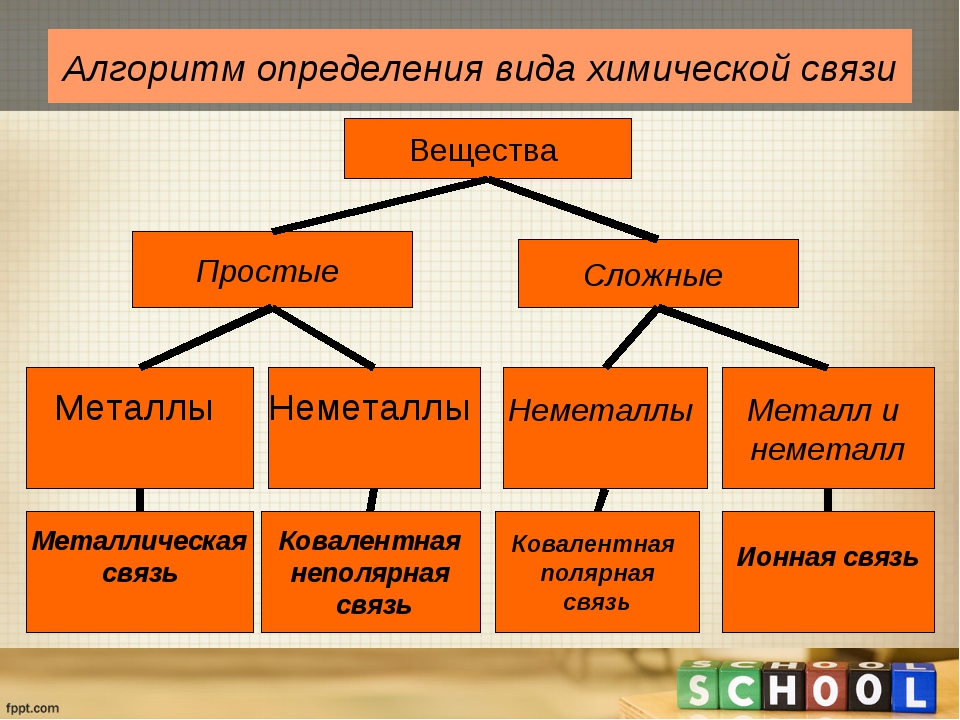 14
14