Виды соли, используемые при приготовлении пищи
Соль можно классифицировать, например, по способу производства и/или добычи, степени измельчения и очистки, содержанию натрия и примесей.
Хотя некоторые соли могут содержать больше разных минералов, чем обычная поваренная соль, их все же никак нельзя считать источниками соответствующих минералов (за искл. йодированной соли). При умеренном потреблении, независимо от вида соли, сопутствующие натрию минералы поступают в крайне малых количествах.
Никакая соль не может стать полноценным источником минеральных веществ. Это означает, что не нужно есть соль с целью получения минеральных веществ.
МОРСКАЯ СОЛЬ
Морскую соль получают путем выпаривания морской воды в специальных ваннах или прудах под действием солнца. Чистота морской соли зависит от состава и чистоты морской воды, из которой она производится. Кристаллы этой соли крупные, неровные. Помимо хлорида натрия, морская соль может содержать некоторое количество йода, кальция, магния и калия.
СОЛЬ ГРУБОГО ПОМОЛА, ИЛИ КАМЕННАЯ СОЛЬ
Грубую, или каменную соль по преимуществу добывают из подземных залежей. Каменная соль имеет грязно-серый цвет. В залежах каждого конкретного месторождения содержатся различные примеси, поэтому стабильной и/или равномерной чистоты каменной соли добиться почти невозможно.
ПОВАРЕННАЯ, ИЛИ СТОЛОВАЯ СОЛЬ
В случае поваренной соли основная часть воды удаляется из соляного раствора кипячением или выпариванием, после чего при помощи мощных центрифуг отделяется оставшаяся вода, чтобы в конце процесса влажность соли составляла около 3%. После дополнительной сушки получается равномерно чистая, мелкозернистая качественная поваренная соль.
ЙОДИРОВАННАЯ СОЛЬ
Йодированная соль обычно представляет собой столовую или минеральную соль с добавлением йода. Добавление йода не меняет вкуса соли. Йодированная соль – хороший способ получить недостающее количество необходимого организму йода.
ПАН-СОЛЬ
Пан-соль получают путем уменьшения содержания натрия в обычной столовой соли и добавлением 25–40% хлорида калия и 10% сульфата магния. Кроме того, в пан-соли есть аминокислота лизин, которая устраняет металлический привкус йода. В двух чайных ложках пан-соли содержится столько же натрия, сколько в одной чайной ложке поваренной соли. В действительности при употреблении пан-соли потребление натрия нередко не сокращается, поскольку ее добавляют в пищу в больших количествах, чтобы добиться привычного вкуса пищи.
Источниками значимого количества минеральных веществ являются зерновые (особенно цельнозерновые продукты), картофель, фрукты и овощи, а также ягоды, молоко и молочные продукты, рыба, птица, яйца, мясо, добавляемые пищевые жиры, орехи, семена, плоды масличных культур, но не соль. Только йодированную соль можно считать полноценным источником йода.
Помимо обычной соли, в продаже можно найти разноцветные соли с разными названиями (например, Rose, Himaalaja, Hawai, Pärsia), состав и цвет которых зависят от места производства. Несмотря на то, что в их составе зачастую приведен целый список минералов, ни одна из этих солей не содержит ни один из минералов в таком количестве, чтобы оно покрыло значимую часть суточной потребности.
Кроме того, выпускается соль с различными вкусовыми нюансами. Это, например, ароматизированная, чесночная, копченая соль. Соль добавляется и во многие смеси пряностей (например, в перцовую смесь). Так что в случае смесей пряностей нужно обязательно читать маркировку, чтобы узнать, сколько соли они содержат.
В производстве мяса часто используется соль с добавлением нитрита. Нитритная соль – соль высокой степени очистки, специально предназначенная для мясной промышленности. Эта соль придает мясу розовато-красный цвет и сдерживает развитие нежелательных микроорганизмов, продлевая тем самым срок годности продукта.
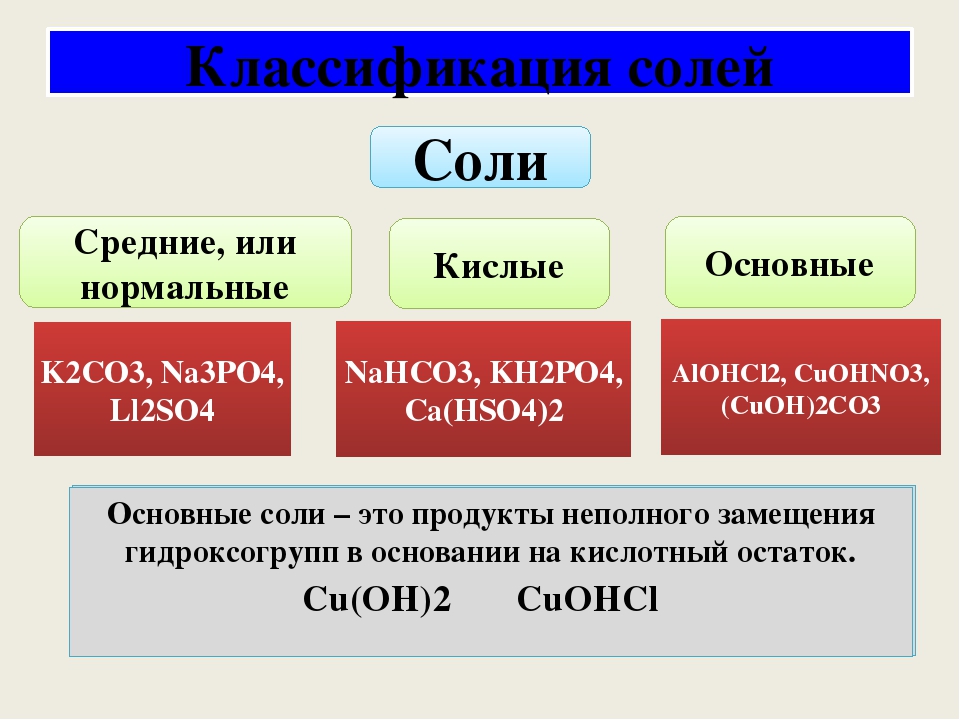
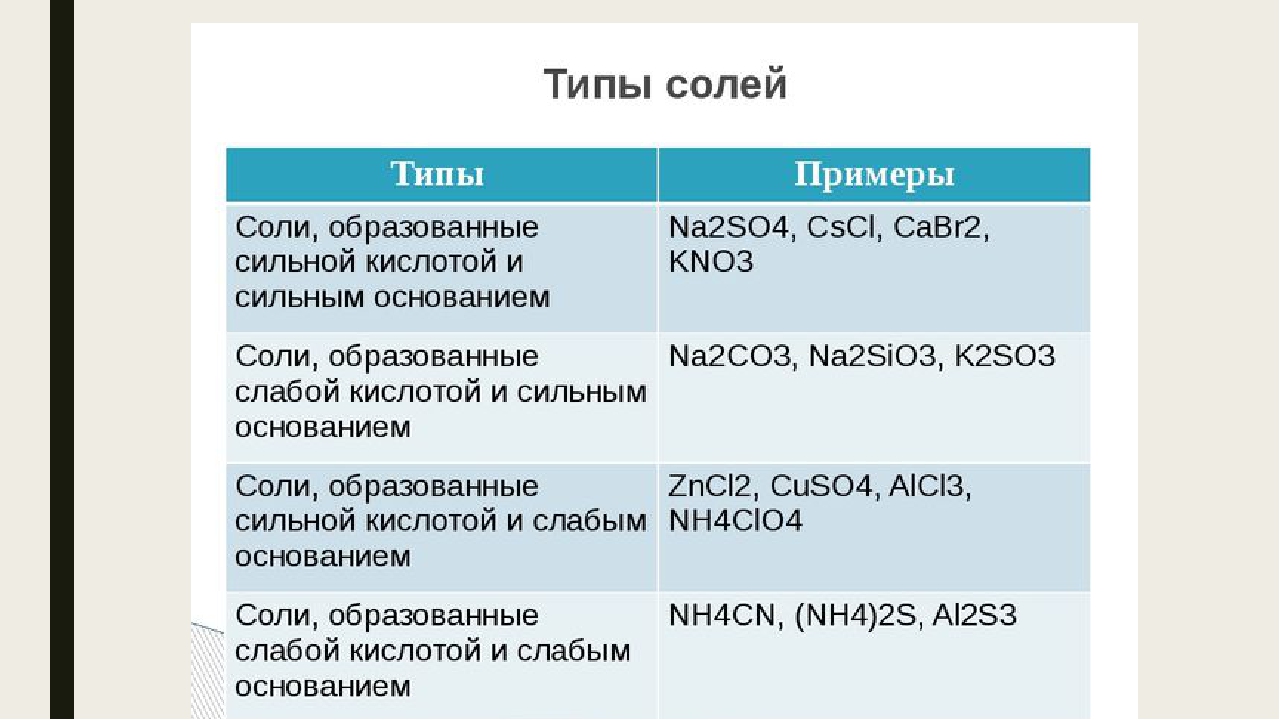
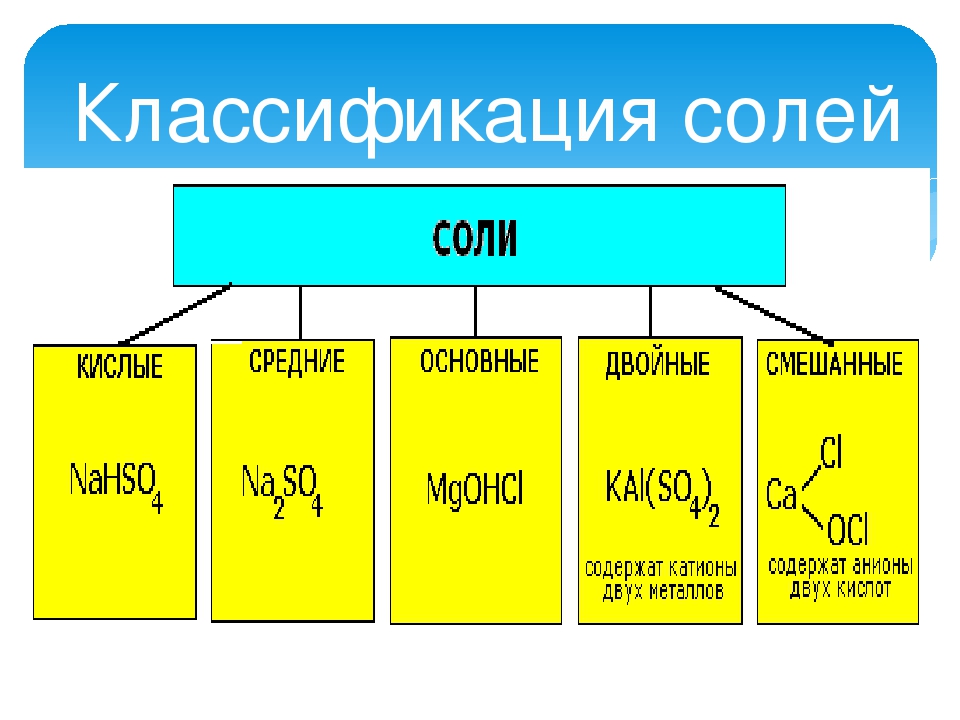
Соли средние, кислые, основные | Решаем химию: вопросы и ответы
Соли встречаются в химии очень часто. Состоят они из металла и кислотного остатка, образуются чаще всего в реакции нейтрализации, то есть реакции между основанием и кислотой, хотя получить соли можно и другими способами. Изучение химии в школе предполагает знакомство со средними солями, но иногда в школьной химии встречаются кислые и основные соли. О них и пойдёт речь.
Состоят они из металла и кислотного остатка, образуются чаще всего в реакции нейтрализации, то есть реакции между основанием и кислотой, хотя получить соли можно и другими способами. Изучение химии в школе предполагает знакомство со средними солями, но иногда в школьной химии встречаются кислые и основные соли. О них и пойдёт речь.
Классификация солей
Средние соли
Итак, средние соли образуются, когда в кислоте все атомы водорода замещены металлом. Примеры средних солей: КCl, Li2SO4, Na3PO4.
Из примеров как раз видно, что в кислотах, использованных для получения солей, все атомы водорода заместились на металл. Посмотрите, например, на фосфат натрия Na3PO4. Эта соль фосфорной кислоты h4PO4. Видно, что все три атома водорода заместились на атомы натрия.
Средние соли. Номенклатура
Здесь нет никакой сложности:
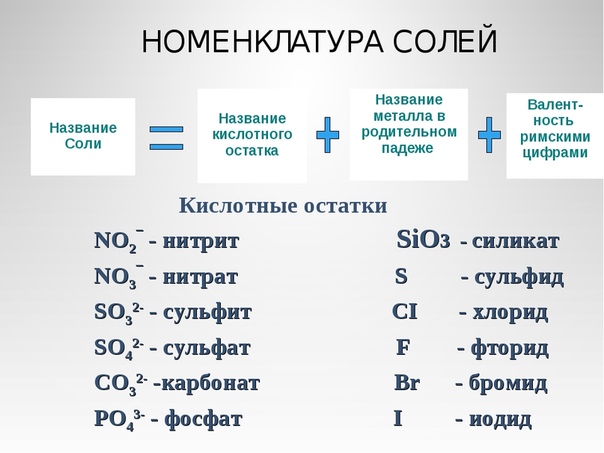
в названии используется название кислотного остатка и металл.
Примеры:
Ca(NO3)2 – нитрат кальция (нитрат – соль азотной кислоты),
MgSO4 – сульфат магния (сульфат – соль серной кислоты),
К3PO4 – фосфат калия (фосфат – соль фосфорной кислоты).
Кислые соли
Кислые соли – продукт неполного замещения атомов водорода в кислоте атомами металла. Примеры кислых солей: NaHCO3, KHSO3.
При составлении формул кислых солей важно понимать, как они образуются, иначе будет путаница с индексами. Давайте разберём это на примере гидрокарбоната натрия NaHCO3. Для начала вспомним о карбонате натрия Na2CO3. Это соль угольной кислоты Н2СО3. При образовании карбоната натрия заместились оба атома водорода на два атома натрия, то есть вместо двух атомов водорода в кислоте h3CO3 встали два атома натрия, образовав карбонат натрия Na2CO3:
в h3CO3 заместились 2 атома водорода на 2 атома натрия с образованием Na2CO3
А вот если атомов натрия не хватило, то атом натрия заместит лишь один атом водорода, второй при этом останется, то есть:
в h3CO3 заместился 1 атом водорода на 1 атом натрия с образованием NaHCO3
Обратите внимание, что все валентности учтены! Это важно! Вы знаете, что валентность кислотного остатка угольной кислоты СО3 равна II (потому что угольная кислота двухосновная, в ней два атома водорода).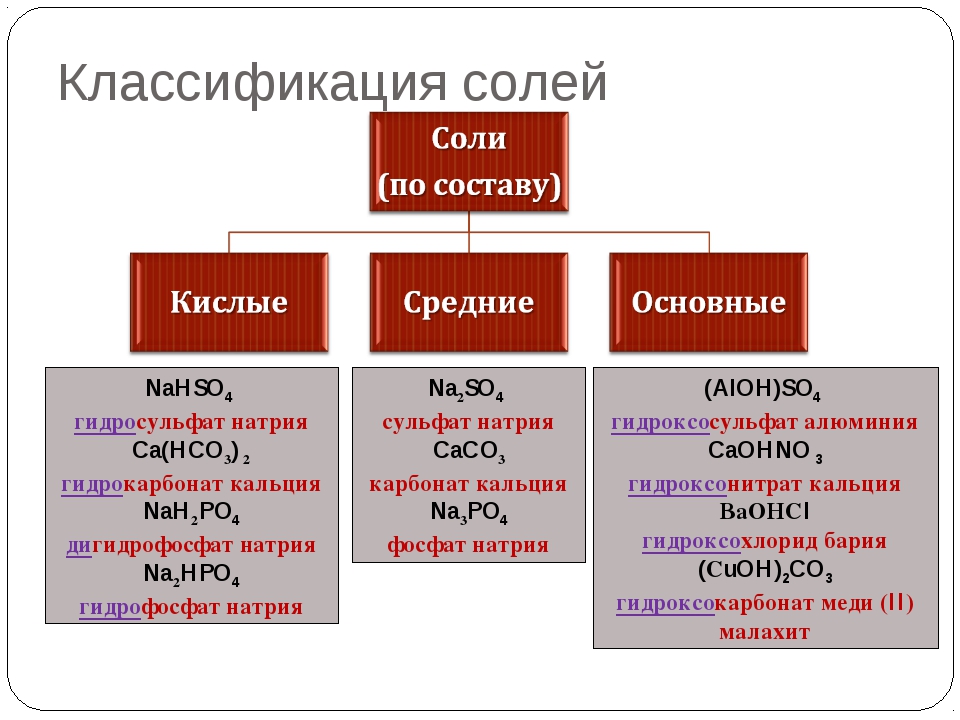 Валентность атома натрия I, валентность атома водорода I, поэтому и формула гидрокарбоната выглядят так: NaHCO3.
Валентность атома натрия I, валентность атома водорода I, поэтому и формула гидрокарбоната выглядят так: NaHCO3.
Чтобы назвать кислую соль правильно,
нужно к кислотному остатку добавить часть «гидро» (если в соли два атома водорода, то нужно добавить «дигидро»).
Примеры:
NaHSO3 – гидросульфит натрия (сульфит – соль сернистой кислоты h3SO3, но у нас соль кислая, поэтому добавляем «гидро»),
Na2HPO4 – гидрофосфат натрия (фосфат – соль фосфорной кислоты h4PO4, но у нас соль кислая, поэтому добавляем «гидро»),
Nah3PO4 – дигидрофосфат натрия (фосфат – соль фосфорной кислоты h4PO4, но у нас соль кислая, причём в ней два атома водорода, поэтому добавляем «дигидро»).
Запомните, что одноосновные кислоты не образуют кислых солей. Это довольно очевидно, ведь в одноосновных кислотах всего один атом водорода, и если он не заместится, то кислота так и останется кислотой, не превратившись в соль. Например, в соляной кислоте (одноосновной) HCl атом водорода в любом случае должен заместиться на атом металла, иначе соли не получится.
Основные соли
Основные соли получаются, когда не все гидроксильные группы в основании заместились кислотным остатком. Примеры основных солей: Zn(OH)Cl, Al(OH)SO4, Fe(OH)(NO3)2.
Здесь ситуация обратна той, что имеется при образовании кислых солей. Но если в кислых солях частично замещаются атомы водорода, то в основных — частично замещаются гидроксогруппы. Давайте рассмотрим это на примере гидроксохлорида цинка Zn(OH)Cl.
В гидроксиде цинка Zn(OH)2 заместились две группы ОН на два кислотных остатка соляной кислоты Cl с получением хлорида цинка ZnCl2 (средней соли).
Но бывает, что в гидроксиде цинка Zn(OH)2 заместилась одна группа ОН на один кислотный остаток соляной кислоты Cl с получением гидроксохлорида цинка Zn(ОН)Cl (средней соли).
Составление формул основных солей тоже требует внимательности. Здесь нужно учитывать число гидроксильных групп ОН и валентность кислотного остатка. Например, в Zn(OH)Cl валентность цинка II, валентность гидроксогруппы I, валентность кислотного остатка Cl – I.
Здесь нужно учитывать число гидроксильных групп ОН и валентность кислотного остатка. Например, в Zn(OH)Cl валентность цинка II, валентность гидроксогруппы I, валентность кислотного остатка Cl – I.
Чтобы правильно назвать основную соль,
нужно к кислотному остатку прибавить «гидроксо» (если в соли две гидроксильные группы, то добавляют «дигидроксо»).
Al(OH)SO4 – гидроксосульфат алюминия (сульфат – соль серной кислоты h3SO4, но у нас соль основная, поэтому добавляем «гидроксо»),
Fe(OH)2(NO3) – дигидроксонитрат железа (III) (нитрат – соль азотной кислоты HNO3, но у нас соль основная, причём в ней две гидроксильные группы ОН, поэтому добавляем «дигидроксо»),
Mg(ОН)Cl – гидроксохлорид магния (хлорид – соль соляной кислоты HCl, но у нас основная соль, поэтому добавляем «гидроксо»).
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Разделение смеси соли и речного песка. Химия. 8 класс. Разработка урока
УМК по химии для 8 класса О. С. Габриеляна.
Тип урока: Комбинированный (теория, практическая часть)
Цели урока:
- Образовательные – ознакомиться с методами получения чистых веществ и способами разделения смесей. Продолжить формирование умений и навыков учащихся по использованию лабораторного оборудования для проведения химического эксперимента.
- Развивающие – формировать умение наблюдать за явлениями, описывать их и делать умозаключения-выводы. Научить простейшим способам разделения смесей – отстаиванию, фильтрованию, выпариванию.

- Воспитательные – развивать умения работать индивидуально и в группах, делать практические выводы из произведенного опыта и знаний.
Задачи урока:
- Обобщить знания по теме «Виды смесей», полученные на предыдущем уроке, путем проведения фронтального опроса в виде беседы.
- Рассказать о способах разделения смесей, используя ЭОРы.
- Актуализировать полученную информацию.
- Объяснить методику выполнения практической части работы.
Оборудование урока: Мультимедийная установка, химические стаканы, воронка, бумажный фильтр, стеклянная палочка, спиртовка, спички, держатель, предметное стекло, смесь соли и речного песка.
Используемые источники: Габриелян О.С. Химия. 8 класс :учеб. Для общеобразоват. учреждений / О.С.Габриелян. – М.: Дрофа, 2012.- 286 с.: ил. Электронное приложение к данному учебнику.
Ход урока
1. Организация класса — 2 минуты.
2. Теоретическая часть урока – 5 минут (беседа)
Учитель: На прошлом уроке мы познакомились с понятием «смеси». Выяснили, что они бывают
- Природными.
- Искусственными.
Дети:
- Морская вода, воздух, гранит.
- Бронза, стекло, пластик, различные растворы.
Учитель: На какие две группы смеси делятся по составу?
Дети:
- Однородные – визуально не наблюдается граница раздела компонентов (истинные растворы).
- Неоднородные – визуально наблюдается граница раздела компонентов смеси (масло и вода).
Учитель: На какие группы делятся смеси по агрегатному состоянию?
Дети:
- Газообразные (воздух, пропан-бутановая смесь).

- Жидкие (молоко, речная вода, нефть).
- Твердые (гранит, бронза, стекло).
Учитель: Для чего человеку нужны чистые вещества?
Дети: Чтобы создавать необходимые смеси нужного состава.
Учитель: Подводя итог моим вопросам и вашим ответам, предположите тему сегодняшнего урока.
Дети сами формулируют тему урока и записывают в тетрадь.
3. Новый материал: «Способы разделения смесей». — 10 минут.
Дистилляция, перегонка, кристаллизация – методы, основанные на разных температурах кипения компонентов смеси. Применяется для однородных смесей (вода, нефть, воздух, растворы) ЭОР №1 (приложение).
Фильтрование – основано на разной пропускной способности фильтров.
Отстаивание – основано на разной плотности веществ.
Фильтрование и отстаивание предназначены для разделения неоднородных смесей (соль и песок, масло и вода) ЭОР №2 (приложение) .
Возгонка – это переход твердого вещества в газообразное минуя жидкое. Применяется для получения чистого йода. Встречается в быту, когда мокрое белье высыхает на морозе.
Постановка проблемы.
Учитель: Вы пошли в лес на пикник, запас соли рассыпался на землю. Что вы будете делать?
Дети: Звучат разные варианты ответов.
4. Практическая часть урока «Разделение смеси соли и речного песка». — 20 минут.
Дети получают методички, оборудование. Перед началом выполнения работы изучают алгоритм своих практических действий. ЭОР №3 (приложение).
Цель работы: практически провести разделение смеси.
Оборудование: химический стакан (2 шт.), воронка, фильтр, спиртовка, спички, держатель, стекло для выпаривания, смесь речного песка с солью.
Ход работы
Задание №1: выделить поваренную соль из смеси с песком.
- Растворить смесь песка и соли в воде.
- Приготовьте фильтр и вложите его в воронку.
- Отфильтруйте смесь.
- Поместите несколько капель фильтрата на стекло для выпаривания, закрепите стекло в держателе и нагрейте над пламенем спиртовки до появления кристаллов поваренной соли.
Задание №2
Сделайте рисунки ваших действий.
Задание №3: Ответить на вопросы.
- Каков характер разделяемой смеси (однородная или неоднородная)
- На чем основаны методы разделения смеси.
- Учебник стр.155. Вопросы № 3, 4, 5, 6.
5. Заключительная часть урока — 8 минут.
Отвечают устно на вопросы (учебник стр.155. №3,5,6).
Смотрят ЭОР №4 (приложение) «Как профильтровать воду в походных условиях»
Наркотическая зависимость — знать, чтобы предотвратить
Дата публикации : 10/01/2020 11:26
Большинство из тех, кто никогда не сталкивался с миром наркотиков, считает, что самые опасные из них вводятся в вену, а наиболее страшный – героин. Реальность намного более жестока: современное поколение синтетических наркотиков по простоте приобретения и употребления, по силе зависимости и тяжести эффекта уже потеснили опиаты и прочно вошли в жизнь молодежи.
Под синтетическими наркотиками понимают искусственно созданные психоактивные вещества, которые обладают наркотическими свойствами, способны провоцировать физическую и/или психологическую зависимость. Все синтетические наркотики или их отдельные компоненты производятся в условиях химических лабораторий из разнообразных веществ, отличаются низкой стоимостью. Часть из них копирует фармакологические свойства растительных наркотиков, является их искусственным аналогом.
Все синтетические наркотики или их отдельные компоненты производятся в условиях химических лабораторий из разнообразных веществ, отличаются низкой стоимостью. Часть из них копирует фармакологические свойства растительных наркотиков, является их искусственным аналогом.
Многие наркотики синтетического происхождения были созданы на основе уже существующих путем внесения изменений в их химическую формулу. Реже, но все-таки выпускаются наркотические средства принципиально новые, часто – основывающиеся на побочном действии какого-либо лекарственного препарата. Все синтетические наркотики запрещены для реализации, преследуются законом, хотя законодательство в последние годы не справляется с созданием документально подтвержденных ограничительных мер из-за появления огромного количества таких психоактивных веществ.
Виды
По форме и типу употребления все синтетические наркотики можно условно поделать на применяемую внутривенно, перорально, для курения, для проникновения через слизистые оболочки.
По фармакологическому воздействию большинство наркотиков являются психостимуляторами или галлюциногенами, кроме опиатов и некоторых других средств, которые тормозят работу ЦНС. Видов и групп «синтетики» много, и в мире каждый год появляется до 25-30 новых наименований. Вещества, из которых синтезируются такие наркотики, называются прекурсорами, их великое множество, и в зависимости от комбинаций они могут образовывать различные препараты.
Примерная классификация:
Опиоиды – метадон, героин.
Амфетамины – «скорость», «экстази», метамфетамин.
Курительные смеси — разнообразные спайсы.
Эмпатогены и психоделики – ЛСД, «соль».
Снотворные, транквилизаторы – барбитураты.
Ингалянты – растворители, краски.
Несмотря на весьма обширную классификацию под синтетическими наркотиками в России и большинстве других стран понимают именно современные препараты – наркотики амфетаминового ряда, соли, а также курительные смеси.
Самые известные современные наркотики: скорость, или speed, ЛСД (кислота), экстази, соли (или синтетические катиноны), спайсы.
Воздействие на организм
Усугубляет быстроту развития зависимости тот факт, что при потреблении наркотиков наркоману не нужен шприц. Выявить в организме человека присутствие спайсов и солей порой невозможно из-за отсутствия нужных тест-систем. Но воздействие «синтетики» на организм еще более серьезное, нежели употребление опиатов.
Синтетические наркотики очень медленно разлагаются и выводятся из организма. Некоторые, возможно, не выведутся никогда, продолжая оказывать свое разрушительное действие. Эффект их держится от 3 часов до 2-3 суток в зависимости от вида. Что же касается того, сколько держатся синтетические наркотики в крови и моче, то здесь все зависит от вида наркотика:1-2 суток — амфетамины; до недели и больше — соли, спайсы при регулярном употреблении.
Вещества дают такие ощущения: сила, энергичность, эйфория, бессонница (стойкая), повышение активности, галлюцинации и т.д.
По окончанию воздействия наблюдается сильная тревога, страх смерти, беспокойство, появляются фобии. Человек вновь начинает искать наркотик, порой даже толком не выспавшись, у него наступает «марафон». У некоторых даже спустя 2-3 недели трезвости появлялись галлюцинации: так современные «соли» разрушают нервную систему. Наркотики связываются с несколькими видами рецепторов головного мозга, встраиваясь в нормальные процессы и делая так, что организм уже не может без них существовать. Эмоции без «синтетики» тусклые, удовольствие от жизни отсутствует – человек почти мгновенно попадает в зависимость.
Вред и последствия
Тот, кто «подсел» на синтетический наркотик, редко может вернуться в нормальное человеческое общество без последствий. Химические препараты быстро разрушают клетки ЦНС, пагубно влияя на интеллект, расстраивают мышление, внимание, память.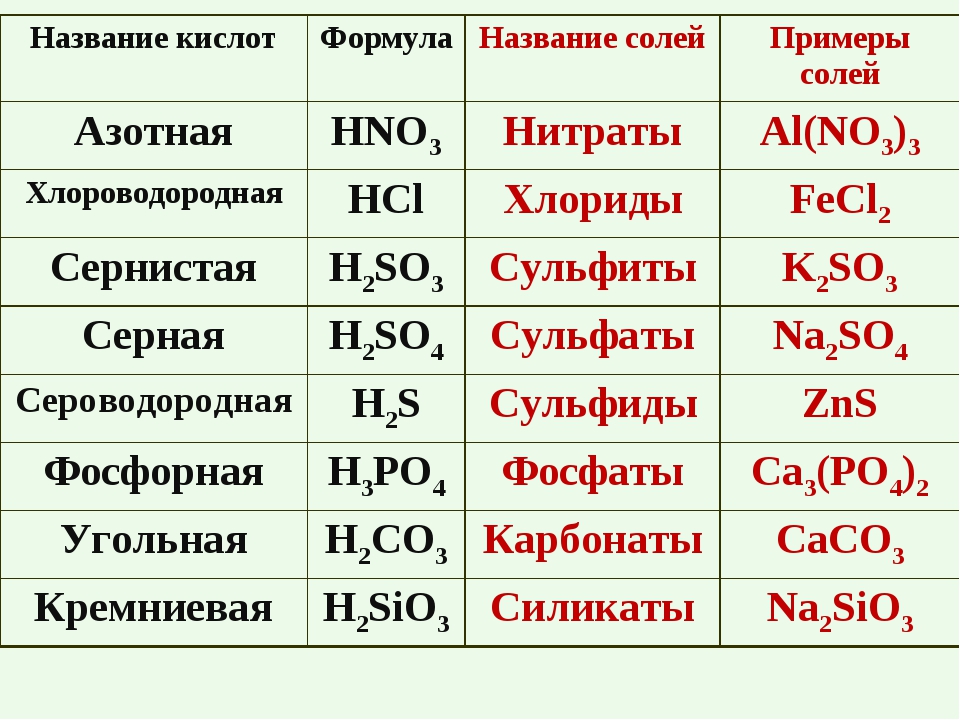
Больной при стаже всего в пару месяцев становится раздражительным и рассеянным, его не волнуют проблемы близких, да и адекватная оценка ситуаций затруднена. Возникают параноидные синдромы и фобии, прочие психические расстройства.
У наркоманов, подсевших на синтетические наркотики, сильно страдает и физическое здоровье.
Иммунитет и гормональный баланс серьезно нарушаются после длительного приема, что приводит к:
Частым простудам.
Грибковым болезням.
Гнойникам на коже.
Смене менструального цикла.
Бесплодию и импотенции.
Болезням сердца.
Опасность синтетических наркотиков в их непредсказуемости, ведь порой даже сами их создатели точно не знают формулу, которая получилась в результате комбинирования ингредиентов. Употребление грозит шизофренией и прочими тяжелыми последствиями и никогда не проходит даром.
Симптомы употребления «химии»
Обнаружить некоторые наркотики в крови и моче невозможно, что усугубляет сложности диагностики зависимости. Но по внешним признакам не заметить развитие наркомании у близкого человека сложно – они всегда яркие, на лицо.
Выраженные изменения психики наступят позже, через несколько месяцев, а в начале симптомы употребления могут быть такими:
Снижение концентрации внимания, нарушение мышления, потеря смысла в разговорах.
Неряшливость, отсутствие самокритики.
Частое появление приподнятого настроения, аномальная энергичность.
Бессонница.
Различные нарушения поведения.
Слишком эмоциональная речь.
Излишняя смелость, хвастовство, бравада.
Усиление сексуального влечения (под действием препарата).
Перепады настроения – от веселого до агрессивного состояния у зависимого не далеко.
Истерики, капризы (при абстинентном синдроме), депрессия вплоть до попыток суицида.
Сухость, бледность кожи, либо, напротив, покраснение щек.
Потеря веса.
При употреблении солей у человека взгляд становится безумным, наблюдаются разные речевые дефекты, мания слежки, тревога. Он постоянно ощущает жажду. Бессонница становится выраженной, аппетит пропадает. Появляются бредовые идеи, подкрепляемые высокомерием.
Почти у всех людей, длительно потребляющих соль, внешний вид неопрятный, отекшее лицо, руки, сильно упавший интеллект.
Возможна ли передозировка?
Заполучить передозировку при употреблении «химии» несколько сложнее, чем при опиоидной наркомании. И все-таки эти случаи – не редкость, и любой наркоман, подсевший на синтетические наркотики, хотя бы раз ощущал малоприятные симптомы передозировки. Токсический порог у «синтетики» выше, поэтому летальный исход наступает реже, но в таком состоянии наркоманы нередко сводят счеты с жизнью из-за возникших галлюцинаций.
При передозировке возможны такие симптомы:
Тахикардия;
Спутанность сознания;
Паранойя;
Повышение и скачки давления и пульса;
Расширение зрачков;
Нарушение работы печени и почек;
Повышение температуры;
Психические расстройства;
Изредка – отек мозга, кома.
Обычно при излишнем употреблении солей развивается состояние острого психоза, снять которое очень сложно. Часто такие пациенты надолго попадают в психиатрические клиники. В 3-5% случаев тяжелых передозировок наступает смерть из-за отказа жизненно важных органов.
Как вывести из организма?
Отказ от синтетических наркотиков – шанс на сохранение собственной жизни. После прекращения употребления «химии» важно провести детоксикацию организма и полноценное лечение. Лучше для очищения от наркотиков обратиться к опытному наркологу, ведь синтетические вещества очень прочно закрепляются в тканях.
В домашних условиях частично вывести наркотик из организма помогут такие методы:
Потребление большого объема жидкости.
Прием мочегонных препаратов.
Промывание желудка (при недавнем употреблении наркотика).
Прием сорбентов.
Питье молока.
Питье кофе, крепкого чая при синтетической наркомании воспрещено, так как они будоражат нервную систему и могут усугубить состояние зависимого. В стационаре больному предложат намного более качественное очищение крови и всего организма при помощи методик плазмафареза, гемосорбции. Если решение отказаться от вредной привычки твердое, лучше довериться профессионалам, а затем обратиться в реабилитационный центр.
Лечение зависимости
По мнению врачей, исцелить солевого наркомана, а также пациента, злоупотребляющего спайсами, очень сложно. Наркотик в отдельных тканях организма держится годами, а зависимость очень крепка из-за прочной связи действующих веществ препарата с рецепторами мозга.
Во время терапии у всех наркоманов обостряются хронические болезни, а ряд (до 30%) в качестве последствия привычки обретает шизофрению. Поэтому лечение от синтетических наркотиков может помочь не всем больным.
Таким людям делают детоксикацию и отпускают, либо помещают их в стационар психиатрической клиники. Поэтому важно отказаться от наркотика как можно раньше, обратиться за помощью и профессиональной реабилитацией. Чаще диагноз снимается после полноценного и раннего лечения, а это означает благополучный исход!
По информации ГО и ЧС
#Профилактика употребления табака, алкоголя, наркотиков и ПАВ
| 1. |
Химические формулы солей
Сложность: лёгкое |
1 |
2.
|
Номенклатура средних солей
Сложность: среднее |
2 |
| 3. |
Составление названий средних солей
Сложность: среднее |
3 |
| 4. |
Классификация солей
Сложность: лёгкое |
1 |
5.
|
Составление химических формул средних солей
Сложность: сложное |
4 |
| 6. |
Составление названия кислых, основных и комплексных солей
Сложность: среднее |
2 |
| 7. |
Составление названия кристаллогидрата соли
Сложность: сложное |
1 |
8.
|
Составление химических формул кислых, основных и комплексных солей
Сложность: среднее |
3 |
| 9. |
Распознавание соли по её внешнему виду
Сложность: среднее |
3 |
| 10. |
Растворимость солей
Сложность: лёгкое |
1 |
11.
|
Составление уравнений реакций по химическим свойствам солей
Сложность: среднее |
4 |
| 12. |
Уравнения реакций по химическим свойствам солей
Сложность: среднее |
4 |
| 13. |
С чем может реагировать соль?
Сложность: среднее |
4 |
14.
|
Применение солей
Сложность: лёгкое |
1 |
| 15. |
Способы получения средних солей
Сложность: среднее |
2 |
| 16. |
Образование солей в реакциях обмена
Сложность: среднее |
5 |
17.
|
Способы получения кислых, основных и комплексных солей
Сложность: сложное |
5 |
| 18. |
Расчёт по уравнению реакции, если исходное вещество содержит примеси
Сложность: среднее |
5 |
| 19. |
Расчёт формулы кристаллогидрата и составление его названия
Сложность: сложное |
5 |
20.
|
Соли в природе. Названия минералов и горных пород
Сложность: среднее |
2 |
| 21. |
Названия солей, встречающихся в природе
Сложность: среднее |
2 |
| 22. |
Распространение солей в природе
Сложность: лёгкое |
3 |
«сумасшествие» и «шугняк» в Карагандинской области
«ЕСЛИ БЫ НЕ МАМА»
25-летняя карагандинка Екатерина, просившая не указывать ее фамилию, несколько раз употребляла «скорость», один из наиболее распространенных синтетических наркотиков, но, по ее словам, сумела избавиться от зависимости. Не сама — с помощью матери и изоляции. Екатерина — бывшая наркозависимая с двухлетним стажем, сидевшая на героине. Когда доставать его стало сложно, перешла на «скорость». Этот «синтетик» как раз только появился в городе.
Не сама — с помощью матери и изоляции. Екатерина — бывшая наркозависимая с двухлетним стажем, сидевшая на героине. Когда доставать его стало сложно, перешла на «скорость». Этот «синтетик» как раз только появился в городе.
— Сначала я ее один раз нюхала. Потом мне показалось этого мало, и я укололась. Результатом стали страх, сумасшествие, я хотела спрыгнуть с четвертого этажа. Если бы не мама, которая поймала меня в тот момент, меня бы уже не было. Состояние сумасшедшее: можешь перекладывать одну и ту же вещь по десять раз, или ковырять целые сутки пол, или прятаться от [вымышленной] полиции, — рассказывает Екатерина.
Ей также известны истории других людей, употребляющих «синтетики». Эти наркотики, говорит она, в частности, вызывают быструю психологическую зависимость, а «выход» сопряжен с сильной депрессией.
Побочные эффекты при приеме у всех разные: кто-то начинает представлять себе, что может летать, и сигает с крыш, говорит Игорь Скурихин, бывший наркозависимый, сейчас помогающий другим людям со схожими проблемами. А у кого-то, по его словам, начинается, как они сами говорят, «шугняк»: они боятся преследований, например, мнимых людей или насекомых.
Он накурится, наколется этой «синтетики», потом сидит на кухне с ножом и обороняется от воображаемых преследователей, а мама сидит рядом с ним и его охраняет.
— К нам женщина привозила своего сына, просила помочь, потому что сама не может ничего с ним сделать. Он накурится, наколется этой «синтетики», потом сидит на кухне с ножом и обороняется от воображаемых преследователей, а мама сидит рядом с ним и его охраняет. Когда к нам таких людей привозят — их очень сложно сдержать. Вот он приезжает и несколько суток просто спит, потому что под этими смесями у них со сном проблема, они всё время двигаются. И как только они курить или колоться перестают, то вырубаются. Когда он отоспится, возникает сложный момент: начинается депрессия, хочется опять. И вот в этот период их очень сложно сдержать. С ним разговариваешь, но он тебя плохо понимает, у него в голове крутится только одно — доза, — рассказывает Скурихин.
С ним разговариваешь, но он тебя плохо понимает, у него в голове крутится только одно — доза, — рассказывает Скурихин.
«СИНТЕТИКИ» – В ЛИДЕРАХ В ЭКСПЕРТНОЙ ЛАБОРАТОРИИ
Экспертизу наркотических, психотропных веществ, их аналогов и прекурсоров проводят в Институте судебной экспертизы в Караганде. Здесь, в частности, проверяют состав изъятых веществ с тем, чтобы классифицировать их как наркотические и незаконные… или нет.
Похоже, журналиста в лаборатории видят впервые. Смотрят настороженно, просят, чтобы лица экспертов не попадали в объектив. Якобы это может быть небезопасно для них.
— Это — прибор для качественного определения наркотиков. Здесь определяют его наименование, имеется ли наркотическое средство в предоставленном веществе или нет. Другой прибор определяет, сколько процентов наркотиков содержится в смеси. Есть прибор экспресс-анализа, который может минут за 10–15 определить предположительно, содержится ли в предоставленном веществе наркотическое вещество или нет, — рассказывает Тимур Ермагамбетов, директор Института судебных экспертиз по Карагандинской области.
Если раньше на экспертизу чаще сдавали героин, то теперь лидируют синтетические наркотики, говорят специалисты. По их словам, если количество экспертиз по исследованию растений конопли и продуктов ее переработки остается практически неизменным, то количество экспертиз «синтетиков» постоянно увеличивается, но с трудом поспевает за стремительно растущим разнообразием этого вида наркотиков.
Тимур Ермагамбетов, директор Института судебных экспертиз по Карагандинской области, Караганда, 25 февраля 2019 года.— Изобретатели синтетических наркотиков постоянно добавляют что-то новое. Если по формуле был один состав, то через время его меняют, и [как следствие] это вещество может отсутствовать в таблице запрещенных [в Казахстане] прекурсоров и синтетических наркотиков. «Производители» создают аналоги, которые по своему влиянию на организм могут быть еще хуже, — говорит Ермагамбетов.
Эксперты ведут активную работу по внесению синтетических веществ в список незаконных препаратов. Сейчас, рассказывает Ермагамбетов, на республиканском уровне решается вопрос об упрощении процедуры причисления новых видов наркотических средств и прекурсоров к запрещенным веществам.
Между тем беспрерывное «новаторство» характерно не только для подпольных лабораторий, где производят «синтетики», но и для тех, кто занимается их реализацией.
В полиции сообщают, что постоянно выявляют новые виды продаж. Азаттык уже писал, что сделки зачастую происходят без какого-либо контакта между продавцом и покупателем, например через веб-сайты и чаты в мессенджерах. Их рекламу наносят с помощью пульверизаторов и трафаретов на стены и другие поверхности, где им легко попасться на глаза. Кроме того, торговля может вестись и в социальных сетях. Сами наркотики закладывают в общедоступных местах: подъездах, дуплах деревьев, в урны, или закапывают.
Еще более сложная задача, чем поимка сбытчиков, — это арест поставщиков. Управление по борьбе с наркобизнесом сообщает о задержании первых, но вопрос об аресте вторых по большей части обходит стороной. В полиции сообщают, что в последнее время наметилась активная тенденция распространения синтетических наркотиков через «международные почтовые отправления и логистические организации, оказывающие курьерские услуги из стран Евросоюза, России и Китая».
АНОНИМНОЕ ОБСЛЕДОВАНИЕ И ЛЕЧЕНИЕ
Как говорят сотрудники областного наркодиспансера, само понятие «синтетические наркотики» появилось в Казахстане шесть-семь лет назад. Тогда в крупные регионы начали сначала поставлять «спайсы» — курительные смеси, — в которых не сразу выявили содержание синтетических каннабиноидов. Затем появились вещества синтетического происхождения — так называемые «кристаллы», «скорость», «соли для ванн».
Коридор областного наркологического диспансера, Караганда, 25 февраля 2019 года.— Это те же самые наркотические и психоактивные вещества, путем химического добавления разных химикатов получаются разные виды быстродействующих наркотических средств.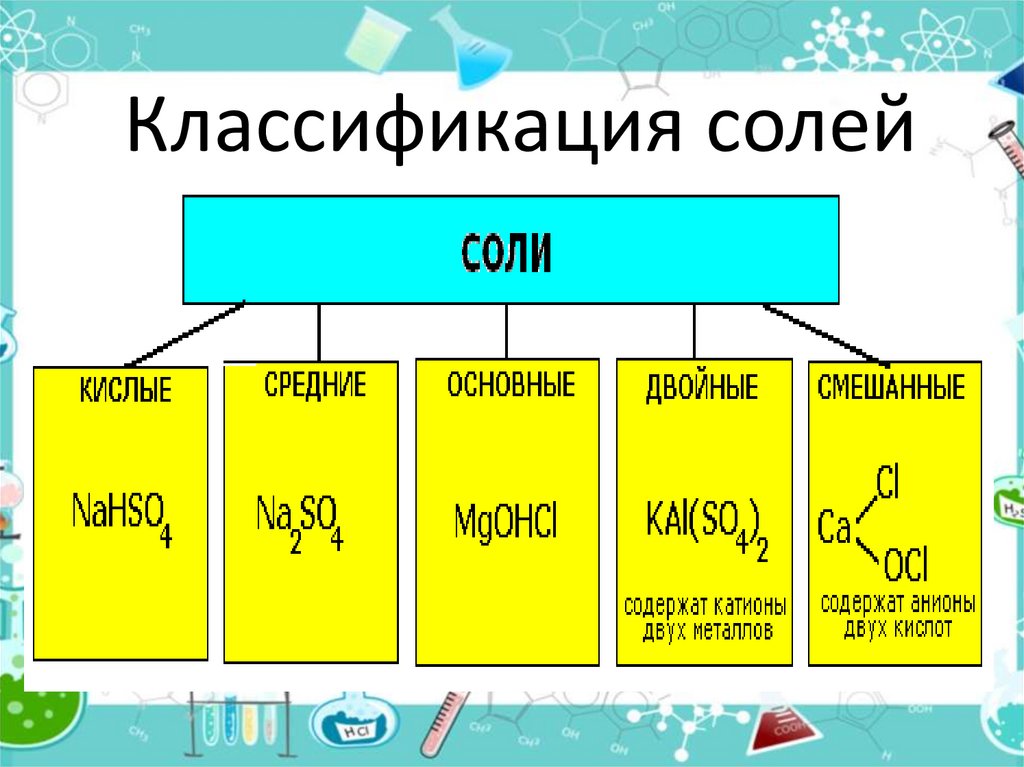 Раньше у нас отсутствовали возможности своевременно выявить эти вещества. Сейчас мы можем определить их наличие в моче, — рассказывает заместитель директора по медицинской работе областного наркологического диспансера Алпыс Аманжолов.
Раньше у нас отсутствовали возможности своевременно выявить эти вещества. Сейчас мы можем определить их наличие в моче, — рассказывает заместитель директора по медицинской работе областного наркологического диспансера Алпыс Аманжолов.
В наркодиспансере говорят, что употребление «синтетики» вызывает сильное психомоторное возбуждение, психическое расстройство, которое может спровоцировать суицидальные наклонности. В особой группе риска как потенциальные потребители зачастую оказываются подростки. Специалисты сообщают, что пока за медицинской помощью в наркодиспансер никто не обращался, но люди консультируются.
Заместитель директора по медицинской работе областного наркологического диспансера Алпыс Аманжолов, Караганда, 25 февраля 2019 года.— При подозрении — чтобы эта проблема далеко не зашла — родители могут привести ребенка в наркодиспансер анонимно, обследовать его. Бывает, что люди звонят и консультируются, но мы не можем заставить их сюда прийти, пока сам человек, родитель не осознает свою беду. Часто бывает, что мы получаем негативную реакцию от родителей, когда они спрашивают о первых признаках при употреблении синтетических веществ. В первую очередь происходит изменение в поведении, которое зачастую родители списывают на трудный переходный возраст. После применения сразу появляется дискомфорт, и человек начинает искать дозу. И вот эта бесконтактная продажа — самое страшное, — отмечает Аманжолов.
Телефон доверия наркологического диспансера — 8 (7212) 34-70-43. Там также есть работающий круглосуточно кабинет медицинского освидетельствования, где можно анонимно сдать анализы. Специалисты убедительно просят родителей внимательно наблюдать за переменами в поведении их детей и без страха обращаться в кабинет подросткового нарколога, обещая полную конфиденциальность.
Разновидности жесткости воды – смягчение воды | О воде
Жесткость воды можно определить как содержание растворенных в ней солей магния, кальция, а также ряда других элементов из периодической таблицы Д.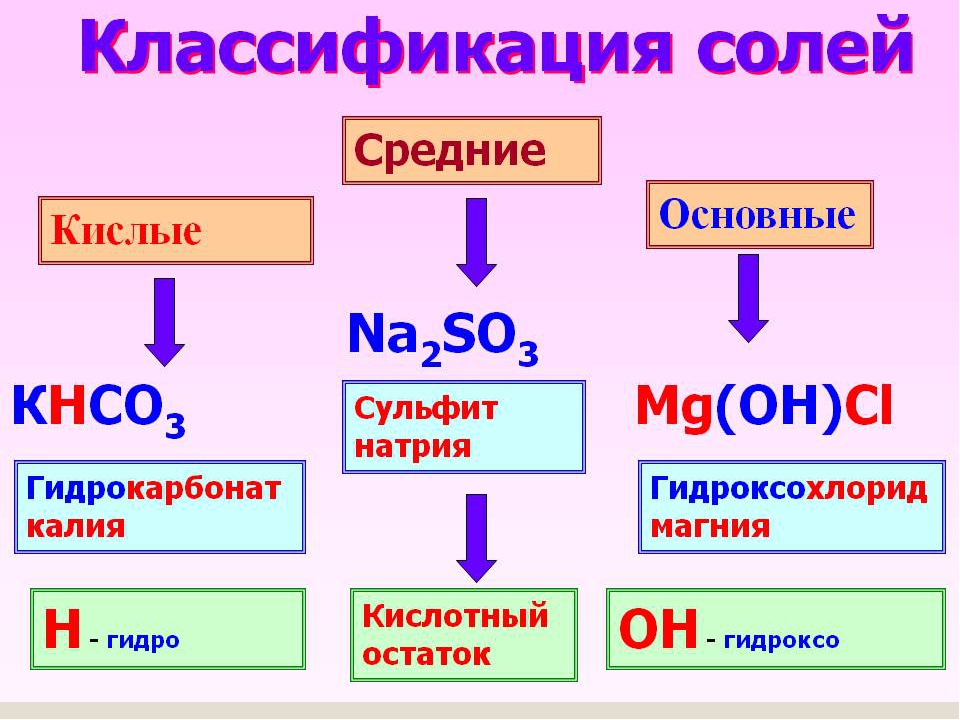 И. Менделеева. К примеру, это могут быть соли железа и марганца, однако, содержание последних в воде, как правило, на порядок ниже в сравнении с содержанием солей кальция и магния, поэтому, говоря об общей жесткости воды, подразумевают именно содержание в воде растворенных солей кальция и магния. Общая жесткость включает в себя временную и постоянную жесткость, которые также иногда называют карбонатной и некарбонатной, соответственно.
И. Менделеева. К примеру, это могут быть соли железа и марганца, однако, содержание последних в воде, как правило, на порядок ниже в сравнении с содержанием солей кальция и магния, поэтому, говоря об общей жесткости воды, подразумевают именно содержание в воде растворенных солей кальция и магния. Общая жесткость включает в себя временную и постоянную жесткость, которые также иногда называют карбонатной и некарбонатной, соответственно.
Временная (карбонатная жесткость): Имеет обозначение KH. Она напрямую зависит содержания в воде гидрокарбонатов и карбонатов магния и кальция. Карбонатная жесткость называется временной, поскольку она может быть устранена путем кипячения воды. При кипячении данные соли выпадают в осадок и образуют накипь. Карбонатная жесткость определяет буферные свойства воды, в связи с чем, препятствует резким колебаниям уровня pH воды. Этот тип жесткости определяет ее пригодность для использования в быту, поскольку образование накипи на сантехнике и водонагревательных элементах бытовых приборов может легко вывести их из строя.
Постоянная жесткость (некарбонатная жесткость): Имеет обозначение GH. Она обусловлена количественным содержанием в воде хлоридов, сульфатов и ряда других солей магния и кальция. При кипячении воды, такие соли в осадок выпадать не будут. Именно эта разновидность жесткости определяет степень пригодности воды для целей питья и приготовления пищи, т.к. ввиду невозможности ее удаления посредством кипячения, все соли кальция и магния, определяющие данные тип жесткости, попадут в организм человека. Кальций и магний – важнейшие макроэлементы, необходимые для нормального функционирования человеческого организма, однако, все хорошо в меру, и потребление воды с избыточным содержанием солей кальция и магния на протяжении длительного периода времени может привести к развитию мочекаменной болезни. Данный показатель может быть снижен путем применения технологии – смягчение.
Успешно справиться с избыточной жесткостью поможет фильтр, в котором реализована технология смягчения воды, которая позволит привести качество воды по данному показателю к приемлемому уровню.
Пять примеров солей для научного класса
Крошечное белое кристаллическое вещество, которое вы посыпаете картофелем фри, — всего лишь один пример того, что химики называют солями. Фактически, любая ионная молекула, состоящая из кислоты и основания, которая растворяется в воде с образованием ионов, является солью. Хотя соли обычно нейтральны, когда они растворяются в воде, они могут образовывать кислый или щелочной раствор, в зависимости от того, какой из составляющих ионов сильнее. Если ионы одинаковой силы, раствор нейтрален.
TL; DR (слишком долго; не читал)
Соли всегда называются, перечисляя сначала кислотный ион или катион. Ион основания или анион указан вторым. Поваренная соль, например, называется хлоридом натрия (NaCl).
Хлорид натрия
••• brian Wilcox / iStock / Getty Images
Хлорид натрия (NaCl) — самый распространенный вид соли в нашей жизни. Известная как поваренная соль, в твердой форме она образует кубическую решетку. Это один из самых безопасных материалов, который вы можете использовать на уроке химии или на кухне.
Катион Na + является кислотой, потому что он акцептор электронной пары. Однако это чрезвычайно слабая кислота из-за большого радиуса действия и низкого заряда. Вы можете распознать анион Cl- как часть соляной кислоты (HCl). Заряд Cl- иона настолько слаб, что он практически нейтрален. При растворении в воде хлорид натрия образует нейтральный раствор.
Дихромат калия
••• Marika- / iStock / Getty Images
Дихромат калия (K 2 Cr 2 O 7 ) представляет собой соль оранжевого цвета, состоящую из калия, хрома и кислорода.Он не только токсичен для людей, но и является окислителем, опасным для возгорания. Никогда не выбрасывайте дихромат калия. Вместо этого его следует смыть в канализацию большим количеством воды. Всегда используйте резиновые перчатки при работе с этим составом.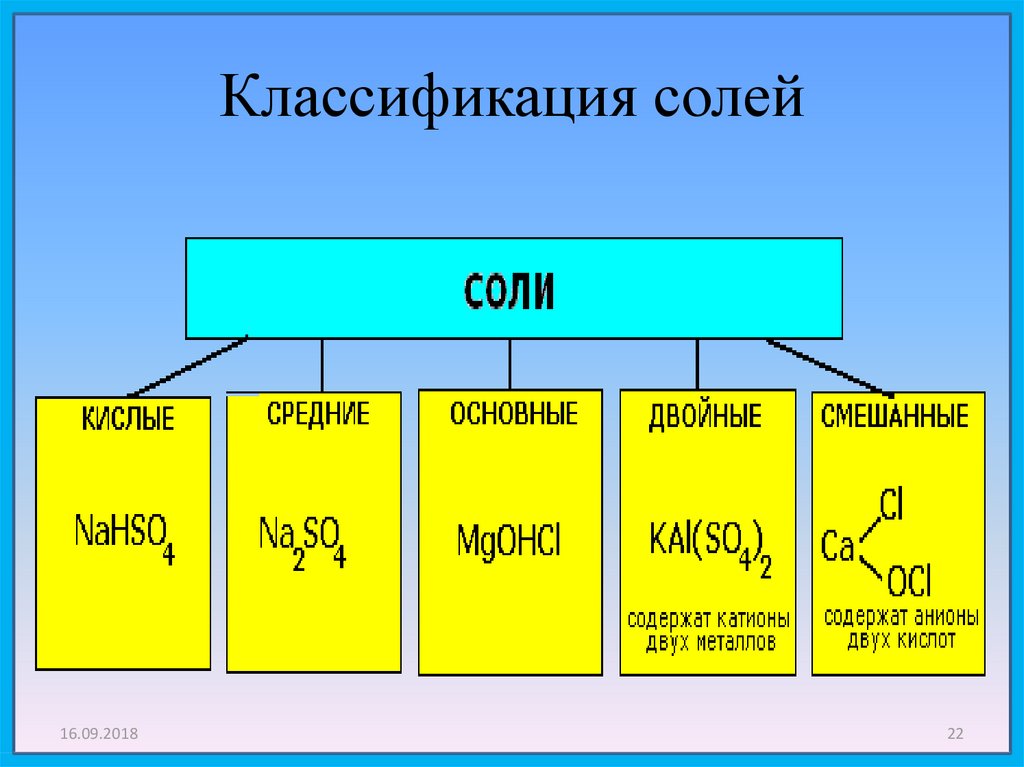 Если вы пролите раствор дихромата калия на кожу, это вызовет химический ожог. Имейте в виду, что любое соединение, содержащее хром, является потенциальным канцерогеном.
Если вы пролите раствор дихромата калия на кожу, это вызовет химический ожог. Имейте в виду, что любое соединение, содержащее хром, является потенциальным канцерогеном.
Хлорид кальция
••• Carme Balcells / iStock / Getty Images
Хлорид кальция (CaCl 2 ) своим белым цветом напоминает поваренную соль.Он широко используется для удаления льда с дорог. Он более эффективен, чем хлорид натрия в качестве антиобледенителя, потому что хлорид кальция производит три иона, а хлорид кальция — только два. Хлорид кальция может растопить лед до минус 25 F, что на 10 градусов ниже, чем у хлорида натрия. Хлорид кальция настолько гигроскопичен, что означает способность поглощать воду, что, если вы оставите его в комнате непокрытым, он может поглотить достаточно воды из воздуха, чтобы раствориться в растворе самостоятельно.
Бисульфат натрия
••• Эдвард Лам / iStock / Getty Images
Бисульфат натрия (NaHSO 4 ) образуется из натрия, водорода, серы и кислорода.Он создан из серной кислоты и удерживает один из ионов водорода кислоты, что придает этой соли кислотные свойства. Бисульфат натрия, известный как сухая кислота, используется в коммерческих целях, например, для снижения уровня pH в спа-салонах и плавательных бассейнах, для мытья бетона и очистки металлов. В твердой форме бисульфат натрия образует белые шарики. Эта соль ядовита и может повредить кожу, поэтому при обращении с ней используйте резиновые перчатки. В случае проглатывания немедленно обратитесь в токсикологический центр и не вызывайте рвоту.
Сульфат меди
••• Svetl / iStock / Getty Images
Сульфат меди (CuSO 4 ) представляет собой синюю соль, состоящую из меди, серы и кислорода. При растворении в воде становится бесцветным. Если вы окунете железный предмет в раствор сульфата меди и воды, железо вскоре приобретет красный цвет. Это пленка из меди, образовавшаяся в результате химической реакции между раствором и железом. Та же реакция заставляет железо заменять медь в растворе, образуя сульфат железа.
Та же реакция заставляет железо заменять медь в растворе, образуя сульфат железа.
От чего зависит сила кислоты?
Кислота получает свои характеристики от атомов водорода в ее молекулах. Сильные кислоты имеют слабосвязанные атомы водорода, и молекулы легко отделяются от них в растворе. Сколько из этих атомов водорода диссоциируют и образуют ионы водорода, определяет силу кислоты. Сильные кислоты теряют большую часть или все свои атомы водорода в водном растворе и образуют ионы H 3 O с положительным зарядом. Остальная часть молекулы кислоты образует отдельный ион с отрицательным зарядом.
TL; DR (слишком долго; не читал)
Для сильных кислот большинство или все слабосвязанные атомы водорода в их молекулах образуют ионы водорода в водном растворе. Слабые кислоты остаются в основном вместе в виде молекул, и только некоторые из их атомов водорода образуют ионы. Положительные ионы водорода и соответствующие отрицательные ионы остальной части молекулы кислоты придают кислотам их основные характеристики.
Сильные кислоты и как они диссоциируют
К наиболее сильным общедоступным кислотам относятся соляная кислота, HCl и серная кислота, H 2 SO 4 .Связь между атомами водорода и хлора соляной кислоты достаточно слабая, чтобы все атомы водорода отделялись от атомов хлора, когда кислота растворяется в воде. Атомы водорода в молекулах соляной кислоты потеряли свои одиночные электроны на атомы хлора в химической реакции, в результате которой образовалось соединение соляной кислоты. В результате атомы водорода образуют ионы с зарядом плюс один, а атомы хлора образуют ионы с зарядом минус один.
Точно так же атомы водорода молекулы серной кислоты потеряли свои электроны в химической реакции, в результате которой образовалась серная кислота.Они также слабо удерживаются и диссоциируют от атомов SO 4 , образуя два иона водорода с зарядом плюс один. Атомы SO 4 образуют отрицательный сульфат-ион с зарядом минус два.
Атомы SO 4 образуют отрицательный сульфат-ион с зарядом минус два.
Как диссоциируют сильные основания
Там, где ионы водорода сильных кислот диссоциируют в воде и придают раствору характеристики кислоты, гидроксид-ион играет ту же роль для сильных оснований. Гидроксид натрия, NaOH, и гидроксид кальция, Ca (OH) 2 , являются примерами сильных оснований, которые полностью диссоциируют в воде.Слабо удерживаемый ион ОН с зарядом минус один диссоциирует от иона натрия с зарядом плюс один или от иона кальция с зарядом плюс два. Большое количество ионов ОН в воде придает раствору характеристики сильного основания.
Когда сильные кислоты и сильные основания вступают в реакцию
Поскольку сильные кислоты и основания полностью диссоциируют в воде, они могут нейтрализовать друг друга и образовать стабильную соль. Если правильные пропорции кислоты и основания медленно смешиваются, ионы водорода H с положительным зарядом объединяются с отрицательно заряженными ионами гидроксида OH с образованием воды.Остальные части молекул, растворенные в воде, объединяются в соль.
Например, если гидроксид натрия медленно добавляют к соляной кислоте, ионы ОН гидроксида натрия соединяются с ионами Н соляной кислоты с образованием воды. Ионы натрия соединяются с ионами хлора с образованием хлорида натрия или поваренной соли. Из-за силы кислоты и основания все их ионы растворились и все вместе образовали воду. Сильные кислоты и сильные основания могут полностью нейтрализовать друг друга.
7 видов соли в химии
Определение солей Соли — это химические соединения (ионные), состоящие из положительных и отрицательных ионов. Соль — это результат реакции кислоты и основания. Положительный ион происходит от основания, а отрицательный ион — от кислоты. Например, в нашей поваренной соли NaCl ион Na + происходит от NaOH (основания), а отрицательный ион (Cl-) происходит от HCl (кислоты). Соли могут быть получены из морской воды или из горных пород.В этой статье мы обсудим 7 типов солей на основе различных классификаций с некоторыми примерами.
Соли могут быть получены из морской воды или из горных пород.В этой статье мы обсудим 7 типов солей на основе различных классификаций с некоторыми примерами.
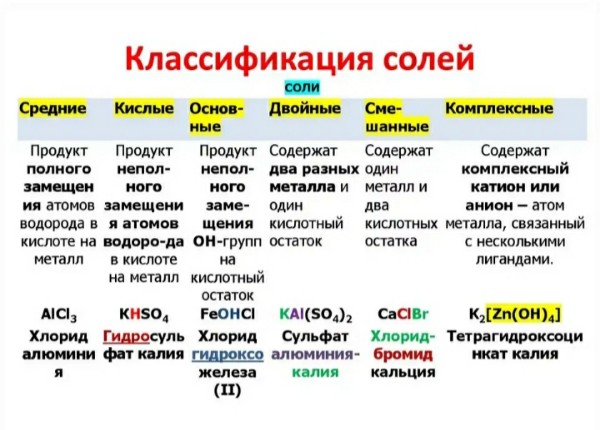
- Простые соли
- Кислые соли
- Основные соли
- Нейтральные соли
- Двойные соли
- Комплексные соли
- Смешанные соли
Соли можно разделить на следующие типы:
Простые солиПростые соли образуются в результате простого взаимодействия кислоты и основания.Наиболее распространенным примером простой соли является NaCl, который является производным HCl (кислота) и NaOH (основание). В зависимости от предшественника солей простые соли можно дополнительно разделить на три типа солей: кислые соли, основные соли и нейтральные / нормальные соли.
Нейтральные солиОбразующиеся нейтральные соли не содержат замещаемых протонов (атомов водорода) или гидроксильных ионов. Они имеют pH около 7 и не обладают кислотным или щелочным характером.
Примеры нейтральных солей- Хлорид натрия (NaCl)
- Нитрат натрия (NaNO3)
- Сульфат калия (K2SO4)
- Хлорид калия (KCl)
- Хлорат калия (KClO3)
- Ортофосфат кальция (Ca3 9010 (PO4) 2) (Na3BO3)
- Nah3PO2 (Ион h3PO2- является производным от кислоты h4PO2, которая является одноосновной, поэтому оба атома H не подлежат замене)
- Перхлорат калия (KClO 4 )
09 Кислотные соли
Кислотные соли являются результатом реакции между сильной кислотой и слабым основанием.Таким образом, происходит неполная нейтрализация кислот, в результате чего соли имеют pH ниже 7 и проявляют кислотные свойства. Эти соли содержат один или несколько замещаемых атомов водорода из-за неполной нейтрализации. Вы можете узнать больше о кислотных солях здесь.
- Карбонат натрия (NaHCO3)
- Бисульфат натрия (NaHSO4)
- Дигидрофосфат натрия (Nah3PO4)
- Гидрофосфат двунатрия (Na2HPO4)
- Бисульфат калия (Nah3Cl2
- ) сульфат аммония (KHSCl
- )
- Амия хлорид (KHSCl
- )
- Nh5) 2SO4)
Основные соли являются результатом реакции между сильным основанием и слабой кислотой.Таким образом, происходит неполная нейтрализация оснований, в результате чего соли имеют pH выше 7 и проявляют щелочные свойства. Эти соли обычно содержат один или несколько гидроксильных ионов. Вы можете узнать больше об основных солях здесь.
Примеры основных солей- гидроксид цинка хлорида (Zn (OH) Cl)
- цианид калия (KCN)
- гидроксид натрия (NaOH)
- оксихлорид магния (Mg (OH) Cl)
- гидроксид железа (II) (Fe (OH) 2Cl )
- Ацетат натрия (NaOOCCH 3 )
- Оксихлорид висмута (Bi (OH) 2Cl)
Двойные соли содержат более одного катиона или аниона в составе.Это происходит из-за реакции между двумя простыми солями, и получающаяся формула обычно очень сложна. Такие соли обычно наиболее стабильны в твердой форме.
Примеры двойной соли- Калий фторид церия (KCeF4)
- Соль Мора ((Nh5) 2Fe (SO4) 2,6h3O)
- Калийные квасцы, (K2SO4Al2 (SO4) 3,24h3O)
- Калий иттербий йодид
906 [K157] Смешанные соли
Смешанные соли состоят из двух анионов с общим катионом или двух катионов с общим анионом.Эти соли являются результатом реакции между более чем одной кислотой или основанием, которая приводит к дисбалансу количества катионов или анионов.
Примеры смешанных солей- Обесцвечивающий порошок (Ca (ClO) 2)
- ЭДТА динатрия кальция
- Сульфат натрия-калия (NaKSO4)
Комплексные соли представляют собой комбинацию ионов и молекулярных соединений.
Примеры комплексных солей Обычно он имеет центральный атом металла, окруженный нейтральными молекулами и заряженными ионами.
Обычно он имеет центральный атом металла, окруженный нейтральными молекулами и заряженными ионами.- Тетрааминсульфат меди ([Cu (NH 3 ) 4 ] SO 4 )
- Ферроцианид калия (K 4 [Fe (CN) 6 ])
- Гексамин хром (III) хлорид [Cr (Nh4) 6] Cl3]
- Карбонил никеля [Ni (CO) 4]
Соли, которые мы используем на кухне, можно разделить на множество различных видов солей в зависимости от незначительных различий в составе и происхождения соли.
- Поваренная соль
- Кошерная соль
- Копченая соль
- Маринованная соль
- Гималайская розовая соль
- Морская соль
- Черная соль
Изображение monicore с сайта Pixabay Что такое очищающая соль?Чистящие соли — это соли, которые обычно используются для обработки жесткой воды и чистых металлических поверхностей посредством реакций ионного обмена. Жесткая вода обычно содержит соли, такие как магний и кальций.Очищающие соли подвергаются катионообменной реакции, чтобы избавиться от этих катионов в воде. Эти соли непригодны для употребления и должны использоваться только для очистки.
Стиральная сода, используемая для мытья поверхностей
Изображение Monfocus с сайта PixabayРаствор поваренной соли также можно использовать для простых целей очистки. Обычно стиральная сода (карбонат натрия) используется в наших домах для уборки.
См. ТакжеКислотно-основные свойства солей | Безграничная химия
Соли, производящие базовые растворы
При растворении в воде основной соли образуется раствор с pH более 7.0.
Цели обучения
Отличить основные соли от неосновных солей
Основные выводы
Ключевые моменты
- В кислотно-основной химии соли — это ионные соединения, образующиеся в результате реакции нейтрализации кислоты и основания.

- Основные соли содержат сопряженное основание слабой кислоты, поэтому, когда они растворяются в воде, они реагируют с водой с образованием раствора с pH более 7,0.
Ключевые термины
- основная соль : продукт нейтрализации сильного основания и слабой кислоты; его анион является сопряженным основанием слабой кислоты
В кислотно-основной химии соль определяется как ионное соединение, которое образуется в результате реакции нейтрализации между кислотой и основанием.Таким образом, соли состоят из катионов (положительно заряженных ионов) и анионов (отрицательных ионов), и в их несольватированных твердых формах они электрически нейтральны (без чистого заряда). Ионы, входящие в состав соли, могут быть неорганическими; примеры включают хлорид (Cl —), органический ацетат (CH 3 COO —) и одноатомный фторид (F —), а также многоатомные ионы, такие как сульфат (SO 4 2− ).
Реакция основной соли в воде
Существует несколько разновидностей солей, и в этом разделе мы рассмотрим основные соли.- (\ text {aq}) [/ latex]
Поскольку он способен депротонировать воду и давать щелочной раствор, бикарбонат натрия является основной солью.
Другие примеры основных солей включают:
- Карбонат кальция (CaCO 3 )
- Ацетат натрия (NaOOCCH 3 )
- Цианид калия (KCN)
- Сульфид натрия (Na 2 S)
Обратите внимание, что для всех этих примеров анион является сопряженным основанием слабой кислоты (угольная кислота, бисульфат (вторая стадия диссоциации серной кислоты), уксусная кислота, синильная кислота, сероводород).
Конъюгированные основы слабых и сильных кислот
Имейте в виду, что соль будет основной, только если она содержит сопряженное основание слабой кислоты . Например, хлорид натрия содержит хлорид (Cl — ), который является сопряженным основанием HCl.
 Но поскольку HCl — сильная кислота, ион Cl — не является основным в растворе и не способен депротонировать воду.
Но поскольку HCl — сильная кислота, ион Cl — не является основным в растворе и не способен депротонировать воду.Бикарбонат натрия : Поскольку ион бикарбоната является сопряженным основанием угольной кислоты, слабая кислота, бикарбонат натрия дает щелочной раствор в воде.
Соли, образующие кислотные растворы
При растворении в воде кислые соли образуют растворы с pH менее 7,0.
Цели обучения
Объясните образование кислотных солей и их влияние на pH раствора.
Основные выводы
Ключевые моменты
- Кислотные соли содержат гидролизуемый протон в катионе, анионе или обоих; например, соль бисульфата аммония (NH 4 HSO 4 ) содержит кислый протон как в катионе, так и в анионе.
- Чтобы определить кислотность / щелочность гидролизуемого аниона, сравните значения K a и K b для иона; если K a > K b , ион кислый; если K b > K a , ион является основным.
Ключевые термины
- кислотная соль : соль, дающая раствор с pH менее 7,0
- гидролизуемый : способный диссоциировать в воде
Соли с гидролизуемым катионом
При растворении в воде кислые соли образуют растворы с pH менее 7.0. Это происходит либо из-за присутствия катиона металла, который действует как кислота Льюиса (что будет обсуждаться позже), либо, что довольно часто, из-за гидролизуемого протона в катионе или анионе. Соли с кислотными протонами в катионе чаще всего представляют собой соли аммония или органические соединения, содержащие протонированную аминогруппу. Примеры включают:
- аммоний (NH 4 + )
- метиламмоний (CH 3 NH 3 + )
- этиламмоний (CH 3 CH 2 NH 3 + )
- анилиний (C 6 H 6 NH 2 + )
Примером кислой соли является соль, содержащая любой из этих катионов с нейтральным основанием, например хлорид аммония (NH 4 Cl).

Соли с гидролизуемыми протонами в анионе
Кислотные соли также могут содержать кислотный протон в анионе. Примеры анионов с кислотным протоном включают:
- бисульфат (HSO 4 —)
- дигидроцитрат (H 2 C 6 H 5 O 7 —)
- биоксалат (HO 2 C 2 O —)
Каждый из этих анионов содержит протон, который слабо диссоциирует в воде.Следовательно, соли, содержащие эти анионы, такие как бисульфат калия, будут давать слабокислые растворы в воде.
Определение кислотности или щелочности гидролизуемого иона
Из предыдущей концепции мы знаем, что соли, содержащие ион бикарбоната (HCO 3 –), являются основными, тогда как соли, содержащие ион бисульфата (HSO 4 –), являются кислотными. Мы определяем, является ли гидролизуемый ион кислотным или основным, сравнивая значения K a и K b для иона; если K a > K b , ион будет кислым, тогда как если K b > K a , ион будет основным.
Хлорид анилиния : Хлорид анилиния является примером кислой соли. Группа NH 3+ содержит кислотный протон, способный диссоциировать в растворе; следовательно, раствор хлорида анилиния в чистой воде будет иметь pH менее 7.
Обзор кислотно-основных свойств соли
Некоторые соли, такие как бикарбонат аммония (NH 4 HCO 3 ), содержат катионы и анионы, которые могут подвергаться гидролизу.
Цели обучения
Предскажите pH раствора соли, содержащей катионы и анионы, оба из которых участвуют в гидролизе.
Основные выводы
Ключевые моменты
- Основные соли образуются в результате нейтрализации сильного основания слабой кислотой.
- Кислотные соли образуются в результате нейтрализации сильной кислоты слабым основанием.
 — ( \ text {aq}) [/ latex]
— ( \ text {aq}) [/ latex]Однако, как мы уже обсуждали, ион аммония действует в растворе как слабая кислота, а ион бикарбоната действует как слабое основание.{-8} [/ латекс]
Поскольку оба иона могут гидролизоваться, будет ли раствор бикарбоната аммония кислотным или основным? Мы можем определить ответ, сравнив значения K a и K b для каждого иона. В этом случае значение K b для бикарбоната больше, чем значение K a для аммония. Следовательно, бикарбонат немного более щелочной, чем аммоний кислый, а раствор бикарбоната аммония в чистой воде будет слабощелочным (pH> 7.0). Таким образом, если соль содержит два гидролизующихся иона, сравните их значения K a и K b :
- Если K a > K b , раствор будет слабокислым.
- Если K b > K a , решение будет немного простым.
Гидролиз солей : В этом видео рассматривается гидролиз кислой соли, основной соли и соли, в которой оба иона гидролизуются.
Химия соли на кухне
Соль кажется достаточно распространенной, но у нее есть поразительные свойства. Предоставлено: Shutterstock.Когда мы говорим «соль», мы обычно имеем в виду то, что мы посыпаем чипсами, а именно хлорид натрия (NaCl). Но, технически говоря, это всего лишь один из примеров соли.
В химии соль — это ионное соединение, которое образуется в результате реакции нейтрализации кислоты и основания.Позвольте мне объяснить это вам.
Молекулы, обладающие электрическим зарядом, называются ионами. Те, у кого положительный заряд — это катионы, а те, у кого отрицательный заряд — анионы. Они похожи на противоположные концы магнита, поэтому анионы притягивают катионы.

Кислоты — это вещества, которые выделяют положительно заряженные ионы водорода (H +), когда находятся в воде, в то время как основания выделяют отрицательно заряженные ионы гидроксида (OH-) в воде. При смешивании они нейтрализуют друг друга и образуют соль.
Итак, соли состоят только из положительно заряженных катионов, связанных с отрицательно заряженными анионами.Хлорид натрия — это положительный ион натрия (Na +), связанный с отрицательным ионом хлорида (Cl-). Свойства солей различаются в зависимости от того, какие ионы сочетаются.
Соленый
Не все соли безопасны для употребления, и не все они соленые на вкус. Катион определяет, имеет ли соль соленый вкус, а анион определяет интенсивность этого аромата.
Чтобы взаимодействовать с нашими вкусовыми рецепторами, соли сначала должны расщепиться — или диссоциировать — на свои ионы. Для этого нужен раствор, например, слюна или вода.Так что, если вы высунете язык, пока он не высохнет, и посолите его, вы не почувствуете солености.
Хотя добавление солей в воду — довольно безопасная химическая реакция, в элементарном состоянии каждый компонент может быть очень реактивным. И натрий, и хлор бурно реагируют с водой, но стабильны, когда их ионы находятся вместе в соли.
Люди добавляли соль в пищу на протяжении тысячелетий по двум простым причинам: это дешевый и естественный консервант; и это улучшает вкус еды.
Добавление соли продлевает срок хранения пищи за счет снижения «водной активности» продуктов. Соль по существу впитывает воду, создавая «сухую» среду, в которой затрудняется рост бактерий, портящих пищу. Соль также вытягивает воду из влажных внутренностей бактерий в более сухую среду, убивая их.
При правильном уровне соль приятна на вкус.
 Вполне вероятно, что соленый превратился в приятный вкус, побуждающий нас потреблять необходимое количество.Соли важны во многих биологических процессах, таких как передача нервных сигналов, поэтому нам нужно немного соли в нашем рационе.
Вполне вероятно, что соленый превратился в приятный вкус, побуждающий нас потреблять необходимое количество.Соли важны во многих биологических процессах, таких как передача нервных сигналов, поэтому нам нужно немного соли в нашем рационе.Соль также усиливает вкус. Добавьте немного соли, и почти все станет вкуснее. Например, добавление соли в куриный суп не только делает его более соленым, но и делает его вкус более густым, сбалансированным и более «куриным». Соль делает это разными способами.
Соль подавляет неприятный привкус пищи, позволяя преобладать более приятным.Когда исследователи смешали горький и сладкий растворы во вкусовом тесте, добавление соли сделало вкус смеси более сладким. Но в сладком растворе добавление соли не так сильно улучшило вкус.
Многие витамины и антиоксиданты горькие на вкус. Добавление соли в продукты, которые содержат или обогащены этими горькими соединениями, улучшает их вкус. Вот почему мы часто добавляем соль в наши зеленые овощи.
Соль также снижает количество несвязанной воды, известное как «активность воды».Это приводит к относительному увеличению концентрации других ароматических компонентов, улучшая аромат, вкус и «густоту» пищевых продуктов.
Это может улучшить вкус продуктов с низким содержанием жира или сахара. Так что проверьте свои пищевые панели; вы можете обменивать лишние килоджоули на избыток соли, которая не обязательно полезнее для здоровья.
Когда образуется, соль образует кристаллы. Предоставлено: Тим Симпсон / Flickr, CC BY.Защитное питание
Привычное употребление слишком большого количества соли связано с такими заболеваниями, как сердечно-сосудистые и почечные заболевания.Избыток соли в разовой дозе тоже не годится. При отсутствии достаточного количества воды избыток соли нарушает процессы, зависящие от конкретной концентрации соли.

Избыток соли также стимулирует рецепторы горького и кислого вкуса, как часть «защитного приема пищи». Вот почему добавление соли в пищу улучшает вкус, а слишком много соли портит ее.
Уровень соли, приятный или неприятный на вкус, варьируется от человека к человеку. Частично это связано с нашими генами, но акклиматизация также происходит в зависимости от наших обычных диетических привычек.
Люди с диетой, обычно богатой солью, адаптируются к большему количеству соли. Те, кто придерживается низкосолевой диеты в молодом возрасте, едят меньше соли и имеют более низкое кровяное давление в более позднем возрасте. Однако мы можем использовать эту акклиматизацию в обратном порядке как стратегию для уменьшения потребления соли.
Это может быть постепенное добавление меньшего количества в вашу собственную пищу, а также то, что производители продуктов питания постепенно снижают уровни в своих продуктах, позволяя потребителям адаптироваться.
Хлорид калия — еще одна соль, которую иногда используют для замены хлорида натрия.Однако, поскольку он также имеет горький вкус, он может действовать только в качестве частичной замены. Используя еще более сложные смеси солей, мы можем усилить солевой вкус и, таким образом, использовать меньше.
Другой подход — заставить соль растворяться более эффективно, чтобы вкус ощущался быстрее. Если вы добавляете соль на поверхность продуктов, а не смешиваете ее, соль быстрее впадает в слюну. Уменьшение размера частиц соли, что увеличивает площадь поверхности, также позволяет соли быстрее растворяться в слюне, увеличивая «соленость».
Другое интересное решение было недавно предложено группой японских исследователей: вилка, которая слегка поражает ваш язык электрическим током во время еды. Электрический импульс имитирует соленый вкус и снижает потребность в добавлении соли в пищу.
Большая часть соли, которую мы едим, скрыта в пище, которую многие люди даже не назовут «соленой». А австралийцы едят больше, чем рекомендовано.
 Итак, теперь, когда вы знакомы с наукой, вы можете использовать ее, чтобы делать осознанный выбор соленой пищи.
Итак, теперь, когда вы знакомы с наукой, вы можете использовать ее, чтобы делать осознанный выбор соленой пищи.
Жир и соль вместе — токсичная смесь для нашего здоровья и талии.Эта история любезно опубликована The Conversation (по лицензии Creative Commons-Attribution / Без производных).
Ссылка : Химия соли на кухне (2016, 6 мая) получено 11 апреля 2021 г. из https: // medicalxpress.ru / news / 2016-05-chemistry-salt-kitchen.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Что такое соль? — Соляная ассоциация
Когда вы думаете о соли, скорее всего, это поваренная соль, которую вы себе представляете — та соль, которую вы найдете в кухонном шкафу дома, та, которую вы смешиваете со своими чипсами.И хотя это соль — поваренная соль — NaCl, — это еще не все.
«Соль» — это общее название, которое мы используем для описания любого вещества, образующегося в результате реакции кислоты с основанием — процесса, известного как реакция нейтрализации.
 Все эти соли имеют некоторые общие характеристики: их ионные связи, их относительно высокие температуры плавления, их электропроводность в расплавленном состоянии или в растворе и их кристаллическая структура в твердом состоянии.
Все эти соли имеют некоторые общие характеристики: их ионные связи, их относительно высокие температуры плавления, их электропроводность в расплавленном состоянии или в растворе и их кристаллическая структура в твердом состоянии.Соли, как природные, так и полученные путем нейтрализации, являются чрезвычайно важными веществами.По оценкам, соль имеет более 14000 применений — вы можете быть удивлены, узнав, что она играет важную роль в создании тысяч предметов, которые мы используем ежедневно, — включая компьютер, который вы используете для просмотра этого веб-сайта, тренажеры. на ваших ногах и одежде, которую вы носите!
Вот два словарных определения соли:
- кристаллическое соединение, хлорид натрия, NaCl, встречающееся в виде минерала, составляющая морской воды и т. Д. И используемое для приправы пищи, в качестве консерванта и т. Д.
- поваренная соль, смешанная с определенной травой или приправой, в честь которых она названа: чесночная соль; сельдерея соль.
- Химия: Любой из класса соединений, образованных заменой одного или нескольких атомов водорода кислоты элементами или группами, которые состоят из анионов и катионов и обычно ионизируются в растворе; продукт, образованный нейтрализацией кислоты основанием.
- соли, любые из различных солей, используемых в качестве слабительных, таких как соли Эпсома.
- элемент, придающий живость, пикантность или остроту: анекдоты — изюминка его повествования.
(Источник: http://dictionary.reference.com/browse/salt?s=t)
- (также поваренная соль) [массовое существительное] Белое кристаллическое вещество, придающее морской воде ее характерный вкус и используемое для приправы или консервирования пищи: приправить солью и перцем
- Химия: Любое химическое соединение, образованное в результате реакции кислоты с основанием, при котором весь или часть водорода кислоты заменена на металл или другой катион ».

(Источник: http: // www.oxforddictionaries.com/)
5.1: Сахар и соль — Chemistry LibreTexts
Хлорид натрия, также известный как поваренная соль, представляет собой ионное соединение с химической формулой \ (\ ce {NaCl} \), представляющей соотношение 1: 1 ионов натрия и хлорида. Он обычно используется в качестве приправы и пищевого консерванта. Соль можно создать, сложив вместе два очень реактивных элемента: металлический натрий (\ (\ ce {Na (s)} \) и газообразный хлор (\ (\ ce {Cl2 (g)} \).
)\ [\ ce {2Na (s) + Cl2 (g) \ rightarrow 2NaCl (s)} \ label {eq1} \]
Элемент натрий (рисунок \ (\ PageIndex {1a} \)) является очень химически активным металлом; Если у вас есть возможность, он вступит в реакцию с потом на ваших руках и образует гидроксид натрия, который является очень едким веществом.Элемент хлор (рис. \ (\ PageIndex {1b} \)) — это бледно-желтый едкий газ, который нельзя вдыхать из-за его ядовитости. Однако объедините эти два опасных вещества вместе, и они вступят в реакцию с образованием ионного соединения хлорида натрия (рис. \ (\ PageIndex {1c} \)), известного просто как соль.
Рисунок \ (\ PageIndex {1} \): Натрий + Хлор = Хлорид натрия (a) Натрий — очень реактивный металл. (b) Хлор — это бледно-желтый ядовитый газ. (c) Вместе натрий и хлор образуют хлорид натрия — соль, которая необходима для нашего выживания.{-}} \) ионы необходимы для нормальной работы нервов и дыхания. Оба эти иона поставляются солью. Вкус соли — один из основных вкусов; соль, вероятно, самый древний из известных ароматизаторов и один из немногих камней, которые мы едим. Очевидно, что когда элементарный натрий и хлор объединяются (уравнение \ ref {eq1}), образующийся солевой продукт имеет радикально разные свойства (как физические, так и химические). Наблюдать за этой реакцией очень интересно (Видео \ (\ PageIndex {1} \)).Видео \ (\ PageIndex {1} \): Приготовление столовой соли с использованием металлического натрия и газообразного хлора
Еще одно соединение — сахар, общее название сладких растворимых углеводов, многие из которых используются в пище.



 Обычно он имеет центральный атом металла, окруженный нейтральными молекулами и заряженными ионами.
Обычно он имеет центральный атом металла, окруженный нейтральными молекулами и заряженными ионами.
 Но поскольку HCl — сильная кислота, ион Cl — не является основным в растворе и не способен депротонировать воду.
Но поскольку HCl — сильная кислота, ион Cl — не является основным в растворе и не способен депротонировать воду.
 — ( \ text {aq}) [/ latex]
— ( \ text {aq}) [/ latex]
 Вполне вероятно, что соленый превратился в приятный вкус, побуждающий нас потреблять необходимое количество.Соли важны во многих биологических процессах, таких как передача нервных сигналов, поэтому нам нужно немного соли в нашем рационе.
Вполне вероятно, что соленый превратился в приятный вкус, побуждающий нас потреблять необходимое количество.Соли важны во многих биологических процессах, таких как передача нервных сигналов, поэтому нам нужно немного соли в нашем рационе.
 Итак, теперь, когда вы знакомы с наукой, вы можете использовать ее, чтобы делать осознанный выбор соленой пищи.
Итак, теперь, когда вы знакомы с наукой, вы можете использовать ее, чтобы делать осознанный выбор соленой пищи. Все эти соли имеют некоторые общие характеристики: их ионные связи, их относительно высокие температуры плавления, их электропроводность в расплавленном состоянии или в растворе и их кристаллическая структура в твердом состоянии.
Все эти соли имеют некоторые общие характеристики: их ионные связи, их относительно высокие температуры плавления, их электропроводность в расплавленном состоянии или в растворе и их кристаллическая структура в твердом состоянии.
