Поверхностные явления — Википедия
Пове́рхностные явле́ния — совокупность явлений, обусловленных особыми свойствами тонких слоёв вещества на границе соприкосновения фаз. К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействия сопряжённых фаз.
Поверхностные явления обусловлены тем, что в поверхностных слоях на межфазных границах вследствие различного состава и строения соприкасающихся фаз и соответственно из-за различия в связях поверхностных атомов и молекул со стороны разных фаз существует ненасыщенное поле межатомных, межмолекулярных сил. Вследствие этого атомы и молекулы в поверхностных слоях образуют особую структуру, а вещество принимает особое состояние, отличающееся от его состояния в объеме фаз различными свойствами[1]. Поверхностные явления изучаются коллоидной химией.
Классификация поверхностных явлений[править | править код]
Поверхностные явления принято классифицировать в соответствии с объединенным уравнением первого и второго начал термодинамики, в которое входят основные виды энергии. Для любой гетерогенной системы его можно записать в следующем виде:
Это уравнение показывает приращение энергии Гиббса через алгебраическую сумму приращений других видов энергии. Очевидно, что поверхностная энергия способна переходить в следующие виды энергии:
- Энергия Гиббса
- Теплота
- Химическая энергия
- Механическая энергия
- Электрическая энергия
Превращение поверхностной энергии в один из перечисленных видов энергии соответствует определенным поверхностным явления, таким как изменение реакционной способности при изменении дисперсности, адгезия и смачивание, капиллярность, адсорбция, электрические явления.
Поверхностные явления широко распространены в химической технологии. Практически любое химическое производство осуществляется с применением дисперсных систем и поверхностных явлений. Как правило, все гетерогенные процессы в химической технологии проводят при максимальной поверхности контакта фаз. Для этого системы вещества переводят в состояние суспензий, порошков, эмульсий, туманов, пылей. Процессы измельчения сырья и промежуточных продуктов, обогащение протекают в дисперсных системах, значительную роль в них играют такие явления как смачивание, капиллярность, адсорбция, седиментация, коагуляция. Широко распространены в химической технологии пористые адсорбенты и катализаторы, представляющие собой дисперсную систему с твердой дисперсионной средой.
Закономерности протекания поверхностных явлений, в частности структурообразования, служат теоретической основой получения материалов с заданными свойствами: керамики, цементов, ситаллов, сорбентов, катализаторов, полимеров, порохов, лекарственных средств и т. п.
Существует отчётливый контраст между простотой раздела поверхностей «масло-вода» при визуальном осмотре и его сложностью на уровне микроскопического масштаба
Поверхностные явления на границе «масло-вода» лежат в основе ряда важных химических, физическихruen и биологических процессов, включая образование мицелл и мембран, сворачивание белка, химическое разделение, нефтедобычу, формирование наночастиц и полимеризацию на границе фазruen.[4]
Структура воды, контактирующей с «расширенными» гидрофобными поверхностями, которые возникают на границе раздела, например, в эмульсии гексана, сильно отличается от структуры гидратационной оболочки
ruen простых растворённых веществ, таких как метан. В гомогенном растворе метана молекулы водной оболочки ориентированы по касательной к сфере молекулы метана; в то время как в эмульсии гексана около 25 % поверхностных молекул воды теряют одну водородную связь, а возникающие при этом свободные группы OH проникают в мицеллу гексана. Согласно гипотезе химиков Ю. Чона и Р. А. Маркуса, наличие свободных групп OH является причиной, по которой некоторые органические реакции на водных поверхностяхruenускоряются в сотни раз.[5]Водная поверхность в коллоидах может иметь кластерную структуру, состоящую из нескольких водных слоёвru
- ↑ Biletskyi, V.,Shendrik,T.,Sergeev,P.Derivatography as the method of water structure studying on solid mineral surface.//London-2012.Geomechanical Processes During Underground Mining — Proceedings of the School of Underground Mining , pp. 181.
- ↑ McFearin, Beaman, Moore et al., 2009.
- ↑ Vogler, 1998.
- ↑ Moore, Richmond, 2008.
- ↑ Jung, Marcus, 2007.
- ↑ Chaplin, 2006.
- Фролов Ю. Г. Курс коллоидной химии. — ООО ТИД «Альянс», 2004. — 464 с. — ISBN 5-98535-003-7.
- Киселев В. Ф. Поверхностные явления в полупроводниках и диэлектриках. — Наука, 1970. — 399 с.
- Chaplin, M. Water structuring at colloidal surfaces // Surface Chemistry in Biomedical and Environmental Science : [англ.] / J. P. Blitz, V. M. Gun’ko (Eds.). — Springer Netherlands, 2006. — P. 1-10. — DOI:10.1007/1-4020-4741-X_1.
- Jung, Y. On the theory of organic catalysis “on water” : [англ.] / Y. Jung, R. A. Marcus // Journal of the American Chemical Societyruen. — 2007. — Vol. 129, no. 17. — P. 5492-5502. — DOI:10.1021/ja068120f.
- McFearin, C. L. From Franklin to today: Toward a molecular level understanding of bonding and adsorption at the oil-water interface : [англ.] / C. L. McFearin, D. K. Beaman, F. G. Moore [et al.] // Journal of Physical Chemistry Cruen. — 2009. — Vol. 113, no. 4. — P. 1171-1188. — DOI:10.1021/jp808212m.
- Moore, F. G. Integration or segregation: How do molecules behave at oil/water interfaces? : [англ.] / F. G. Moore, G. L. Richmondruen // Accounts of Chemical Researchru
- Vogler, E. A. A brief history of water structure and reactivity at surfaces. — In: Structure and reactivity of water at biomaterial surfaces : [англ.] // Advances in Colloid and Interface Scienceruen. — 1998. — Vol. 74, no. 1-3. — P. 74-77. — DOI:10.1016/S0001-8686(97)00040-7.
Взрыв — Википедия

Взрыв — быстропротекающий физический или физико-химический процесс, проходящий со значительным выделением энергии в небольшом объёме за короткий промежуток времени и приводящий к ударным, вибрационным и тепловым воздействиям на окружающую среду вследствие высокоскоростного расширения продуктов взрыва. Взрыв в твёрдой среде вызывает разрушение и дробление.[1]
Взрывное превращение — быстрый самостоятельно распространяющийся процесс с выделением энергии и образованием сильно сжатых газов, способных производить работу, возникает из-за химических и ядерных реакций. В результате взрывного превращения в окружающей среде возникает волна сжатия.
[2] Такие волны также сопровождают взрывы, не сопровождающиеся взрывным превращением, — физические взрывы сосудов под давлением, наполненных негорючими газами, паром или многофазными сжимаемыми системами (пыль, пена). Физико-химический взрыв паров вскипающей жидкости (BLEVE) происходит в результате внешнего подогрева сосуда, наполненного горючей легкокипящей жидкостью. При разрыве емкости и последующем воспламенении паров кипящей жидкости происходит образование огненного шара.[3]:35 В зависимости от источников энергии существуют также электрические, вулканические взрывы, взрывы при столкновении космических тел (например, при падении метеоритов на поверхность планеты), взрывы, вызванные гравитационным коллапсом (взрывы сверхновых звёзд и др.).Точечными взрывами являются взрывы вещества, занимающего малый объем относительно зоны воздействия, например — заряд взрывчатого вещества. Объемным взрывом является взрыв газо-, паро-, пылевоздушного облака, занимающего значительный объем зоны воздействия. При взрыве облака возникает огненный шар.[4]:168
Последствия взрыва паровоза, 1911 годВ физике и технике термин «взрыв» используется в разных смыслах: в физике взрыва необходимым условием является наличие ударной волны, в технике для отнесения процесса к взрыву наличие ударной волны не обязательно при наличии угрозы разрушения оборудования и зданий. В технике в значительной части термин «взрыв» связан с процессами, происходящими внутри замкнутых сосудов и помещений, которые при чрезмерном повышении давления могут разрушится и при отсутствии ударных волн.[5] В технике для внешних взрывов без образования ударных волн рассматриваются волны сжатия и воздействие огненного шара.
[6]:9 При отсутствии ударных волн признаком определяющим взрыв является звуковой эффект волны давления.[7]:104 В технике дополнительно к взрывам и детонации также выделяют хлопки.[8]:5В технике для химических взрывов не сопровождающихся возникновением ударных волн используется термин «взрывное горение». От нормального послойного горения этот процесс отличается нестационарностью и на несколько порядков большой скоростью распространения пламени. В замкнутом объеме взрывное горение вызывает волны сжатия. Такое горение характерно при взрывах дымного пороха, пиротехнических составов, промышленной пыли. Взрывное горение при определенных условиях может перейти в детонацию.[9]
При взрывах с использованием химических взрывчатых веществ в грунтах и горных породах ударные волны практически никогда не возникают. Мощные ударные волны образуются только при подземных ядерных взрывах на не очень больших расстояниях от заряда.
При медленном горении возникающем в закрытой трубе впереди зоны горения всегда возникает ударная волна. При больших скоростях горения ударная волна существенно влияет на состояние газовой смеси подходящей к зоне горения. Медленное горение в трубе может перейти в детонацию при самопроизвольном ускорении пламени с возникновением детонационной волны впереди пламени.[11]:686
В юридической литературе широко используется термин «криминальный взрыв» — взрыв, причиняющий материальный ущерб, вред здоровью и жизни людей, интересам общества, а также взрыв, который может вызвать смерть человека.[12] К криминальным взрывам относятся как взрывы в целях совершения умышленного преступления, так и нарушения специальных правил безопасности, которые привели к взрывам.[12] Для определения необходимости выполнения специальных правил в области взрывобезопасности в промышленности выделяются взрывоопасные зоны и взрывоопасные объекты.
Взрыв горной массы в карьереМеханическое воздействие взрыва связано с работой, которая совершается при расширении газов. Воздействие условно делится на бризантные (местные) и фугасные (общие) формы. Бризантное действие проявляется непосредственно в окрестностях заряда (в твердой среде) или вблизи поверхности твердого тела, фугасное — на расстояниях намного больше размера заряда. Для бризантного действия характерно сильное деформирование и дробление среды, а его общий фугасный эффект определяется импульсом, т.е. начальным давлением в полости взрыва и её размерами. Фугасное действие зависит только от энергии заряда. Форма заряда взрывчатого вещества и его детонационные характеристики существенно влияют лишь на бризантное действие взрыва.[10] Бризантное действие взрыва может быть усилено кумулятивными эффектами.
Действие ударной волны на предметы зависит от их характеристик. Разрушение капитальных строений зависит от импульса взрыва. Например, при действии ударной волны на кирпичную стену она начнет наклоняться. За время действия ударной волны наклон будет незначительным. Однако, если и после действия ударной волны стена будет наклоняться по инерции, то она рухнет. Если предмет жесткий, прочно укреплен и имеет небольшую массу, то он успеет изменить свою форму под действием импульса взрыва и будет сопротивляться действию ударной волны, как силе, приложенной постоянно. В этом случае разрушение будет зависеть не от импульса, а от давления, вызываемого ударной волной.[13]:37
Единого мнения о том, какие именно химические процессы следует считать взрывом, не существует. Это связано с тем, что высокоскоростные процессы могут протекать в виде детонации или дефлаграции (медленного горения). Детонация отличается от горения тем, что химические реакции и процесс выделения энергии идут с образованием ударной волны в реагирующем веществе, и вовлечение новых порций взрывчатого вещества в химическую реакцию происходит на фронте ударной волны, а не путём теплопроводности и диффузии, как при медленном горении. Различие механизмов передачи энергии и вещества влияют на скорость протекания процессов и на результаты их действия на окружающую среду, однако на практике наблюдаются самые различные сочетания этих процессов и переходы горения в детонацию и обратно. В связи с этим обычно к химическим взрывам относят различные быстропротекающие процессы без уточнения их характера.
Химический взрыв неконденсированных веществ от горения отличается тем, что горение происходит, когда горючая смесь образуется в процессе самого горения.[6]:36
Существует более жёсткий подход к определению химического взрыва как исключительно детонационному. Из этого условия с необходимостью следует, что при химическом взрыве, сопровождаемом окислительно-восстановительной реакцией (сгоранием), сгорающее вещество и окислитель должны быть перемешаны, иначе скорость реакции будет ограничена скоростью процесса доставки окислителя, а этот процесс, как правило, имеет диффузионный характер. Например, природный газ медленно горит в горелках домашних кухонных плит, поскольку кислород медленно попадает в область горения путём диффузии. Однако, если перемешать газ с воздухом, он взорвётся от небольшой искры — объёмный взрыв. Существуют очень немногие примеры химических взрывов, не имеющих своей причиной окисление/восстановление, например реакция мелкодисперсного оксида фосфора(V) с водой, но её можно рассматривать и как паровой взрыв.
Индивидуальные взрывчатые вещества, как правило, содержат кислород в составе своих собственных молекул. Это метастабильные вещества, которые способны храниться более или менее долгое время при нормальных условиях. Однако при инициировании взрыва веществу передаётся достаточная энергия для самопроизвольного распространения волны горения или детонации, захватывающей всю массу вещества. Подобными свойствами обладают нитроглицерин, тринитротолуол и другие вещества. Бездымные пороха и чёрный порох, который состоит из механической смеси угля, серы и селитры, в обычных условиях не способны к детонации, но их традиционно также относят к взрывчатым веществам.
Ядерные взрывы[править | править код]
Ядерный взрыв — это неуправляемый процесс высвобождения большого количества тепловой и лучевой энергии в результате цепной ядерной реакции расщепления атома или реакции термоядерного синтеза. Искусственные ядерные взрывы в основном используются в качестве мощнейшего оружия, предназначенного для уничтожения крупных объектов и скоплений.
 Анимация взрыва той же дымовой трубы
Анимация взрыва той же дымовой трубыТехнологии на основе взрывных процессов применяются в военном деле, на взрыве основано действие боеприпасов.
Мирные технологии включают в себя разрушение конструкций направленным взрывом, сварку взрывом, взрывной синтез материалов и др.
- ↑ Взрыв//Большая Советская Энциклопедия
- ↑ Взрывное превращение//Горная энциклопедия. Том 1. Аа-лава-геосистема —М.: Советская энциклопедия, 1984
- ↑ Гельфанд Б.Е., Сильннков М.В. Взрывобезопасность: учебник —СПб.:Астерион, 2006
- ↑ Девисилов В.А., Дроздова Т.И., Тимофеева С.С. Теория горения и взрыва : практикум : учебное пособие — М.:Форум, 2012
- ↑ Водяник В.И. Горение и взрыв газов//Безопасность труда в промышленности N 1, 2005
- ↑ 1 2 Д. З. Хуснутдинов, А. В. Мишуев, В. В. Казеннов и др. Аварийные взрывы газовоздушных смесей в атмосфере : монография —М.:МГСУ, 2014
- ↑ Бейкер У. и др. Взрывные явления. Оценка и последствия т.1 —М.: «Мир», 1986
- ↑ Овчаренко Н.Л. Предупреждение взрывов в доменных и сталеплавильных цехах —М., 1963
- ↑ Взрывное горение//Горная энциклопедия. Том 1. Аа-лава-геосистема —М.: Советская энциклопедия, 1984
- ↑ 1 2 Взрыв//Горная энциклопедия. Том 1. Аа-лава-геосистема —М.: Советская энциклопедия, 1984
- ↑ Ландау Л.Д., Лифшиц Е. М. Теоретическая физика: Учеб. пособ.: Для вузов. В 10 т. Т. VI. Гидродинамика. — 5-е изд., стереот.-М.: ФИЗМАТЛИТ, 2001.-
- ↑ 1 2 Таубкин И.С. О терминологии в уголовно-правовой классификации взрывов//Теория и практика судебной экспертизы №1 (29) 2013
- ↑ Покровский Г.И. Взрыв и его действие —М., 1954
- Андреев С. Г., Бабкин А. В., Баум Ф. А. и др. Физика взрыва / Под редакцией Л. П. Орленко. — издание 3-е, переработанное и дополненное. — М.: Физматлит, 2004. — 656 с. — ISBN 5-9221-0220-6.
Изомерия — Википедия
Изомерия (от др.-греч. ἴσος — равный + μέρος — доля, часть) — явление, заключающееся в существовании химических соединений — изомеров, — одинаковых по атомному составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
В итоге дискуссии Ю. Либиха и Ф. Вёлера в 1823 году было установлено, что существуют два резко различных по свойствам вещества состава AgCNO — циановокислое (AgNCO (англ.)русск.) и гремучее (AgONC) серебро. Ещё одним примером послужили винная и виноградная кислоты, после исследования которых Й. Берцелиус в 1830 году ввёл термин «изомерия» и высказал предположение, что различия возникают из-за «различного распределения простых атомов в сложном атоме» (то есть, в современных терминах, молекуле).
Подлинное объяснение изомерия получила лишь во 2-й половине XIX века на основе теории химического строения А. М. Бутлерова (структурная изомерия) и стереохимического учения Я. Г. Вант-Гоффа (пространственная изомерия).
Структурная изомерия — результат различий в химическом строении. К этому типу относят:
Изомерия углеродной цепи (углеродного скелета)[править | править код]
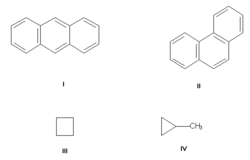
Изомерия углеродного скелета, обусловленная различным порядком связи атомов углерода. Простейший пример — бутан СН3—СН2—СН2—СН3 и изобутан (СН3)3СН. Другие примеры: антрацен и фенантрен (формулы I и II, соответственно), циклобутан и метилциклопропан (III и IV).
Валентная изомерия[править | править код]
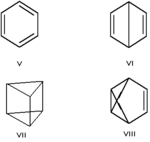
Валентная изомерия — особый вид структурной изомерии, при которой изомеры можно перевести друг в друга лишь за счёт перераспределения связей. Например, валентными изомерами бензола (V) являются бицикло[2.2.0]гекса-2,5-диен (VI, «бензол Дьюара»), призман (VII, «бензол Ладенбурга»), бензвален (VIII).
Изомерия функциональной группы (межклассовая изомерия)[править | править код]
Различается характером функциональной группы; например, этанол (CH3—CH2—OH) и диметиловый эфир (CH3—O—CH3).
Изомерия положения[править | править код]
Тип структурной изомерии, характеризующийся различием положения одинаковых функциональных групп или кратных связей при одинаковом углеродном скелете. Пример: 2-хлорбутановая кислота и 4-хлорбутановая кислота.
Метамерия[править | править код]
Метамерия — вид структурной изомерии, для которого характерно различное распределение углеродных атомов между несколькими углеводородными радикалами, разделёнными в молекуле гетероатомом. Метамерия известна в рядах алифатических простых эфиров, сложных эфиров, тиоспиртов и аминов. В настоящее время термин используется редко.
На данный вид изомерии ещё указывал А. М. Бутлеров, называя его «изомерия нецельных структур».
Пример: CH3CH2OCH2CH3 — диэтиловый эфир и CH3OCH2CH2CH3 — метилпропиловый эфир
Пространственная изомерия (стереоизомерия)[править | править код]
Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение. Для обозначения пространственных изомеров разных типов разработана стереохимическая номенклатура, собранная в разделе E номенклатурных правил ИЮПАК по химии[источник не указан 3283 дня].
Этот тип изомерии подразделяют на энантиомерию (оптическую изомерию) и диастереомерию.
Энантиомерия (оптическая изомерия)[править | править код]
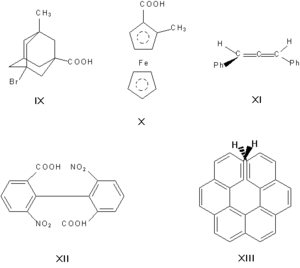
Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с другими оптически активными веществами и физических свойств в хиральной среде). Необходимая и достаточная причина возникновения оптических антиподов — принадлежность молекулы к одной из следующих точечных групп симметрии: Cn, Dn, T, O или I (хиральность). Чаще всего речь идёт об асимметрическом атоме углерода, то есть об атоме, связанном с четырьмя разными заместителями.
Асимметрическими могут быть и другие атомы, например атомы кремния, азота, фосфора, серы. Наличие асимметрического атома — не единственная причина энантиомерии. Так, имеют оптические антиподы производные адамантана (IX), ферроцена (X), 1,3-дифенилаллена (XI), 6,6′-динитро-2,2′-дифеновой кислоты (XII). Причина оптической активности последнего соединения — атропоизомерия, то есть пространственная изомерия, вызванная отсутствием вращения вокруг простой связи. Энантиомерия также проявляется в спиральных конформациях белков, нуклеиновых кислот, в гексагелицене (XIII).
Диастереомерия[править | править код]
Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ- и π-диастереомеры.
σ—диастереомерия[править | править код]
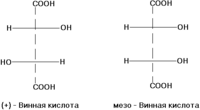
σ-диастереомеры отличаются друг от друга конфигурацией части имеющихся в них элементов хиральности. Так, диастереомерами являются (+)-винная кислота и мезо-винная кислота, D-глюкоза и D-манноза, например:
π—диастереомерия (геометрическая изомерия)[править | править код]
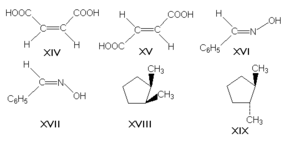
π-диастереомеры, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).
Химические превращения, в результате которых структурные изомеры превращаются друг в друга, называется изомеризацией. Такие процессы имеют важное значение в промышленности. Так, например, проводят изомеризацию нормальных алканов в изоалканы для повышения октанового числа моторных топлив; изомеризуют пентан в изопентан для последующего дегидрирования в изопрен. Изомеризацией являются и внутримолекулярные перегруппировки, из которых большое значение имеет, например, перегруппировка Бекмана — превращение циклогексаноноксима в капролактам (сырьё для производства капрона).
Процесс взаимопревращения энантиомеров называется рацемизацией: она приводит к исчезновению оптической активности в результате образования эквимолярной смеси (−)- и (+)-форм, то есть рацемата. Взаимопревращение диастереомеров приводит к образованию смеси, в которой преобладает термодинамически более устойчивая форма. В случае π-диастереомеров это обычно транс-форма. Взаимопревращение конформационных изомеров называется конформационным равновесием.
Явление изомерии в огромной степени способствует росту числа известных (и ещё в большей степени — числа потенциально возможных) соединений. Так, возможное число структурно-изомерных дециловых спиртов — более 500 (известно из них около 70), пространственных изомеров здесь более 1500.
При теоретическом рассмотрении проблем изомерии все большее распространение получают топологические методы; для подсчёта числа изомеров выведены математические формулы.
- Физер Л., Физер М. Органическая химия. Углубленный курс. т. 1. пер. с англ., Под ред. д. х. н. Н. С. Вульфсона. Изд. «Химия». М., 1969.
- Пальм В. А. Введение в теоретическую органическую химию, М., 1974;
- Соколов В. И. Введение в теоретическую стереохимию, М., 1979;
- Сланина 3. Теоретические аспекты явления изомерии в химии, пер. с чешского, М., 1984;
- Потапов В. М. Стереохимия М., 1988.
- Большой энциклопедический словарь. Химия. Изд.: Большая Российская энциклопедия, 2003, ISBN 5-85270-253-6
химические явления — это… Что такое химические явления?
- химические явления
Astronautics: chemical phenomena
Универсальный русско-английский словарь. Академик.ру. 2011.
- химические эффекты
- химические, биологические и радиологические средства
Смотреть что такое «химические явления» в других словарях:
химические явления пищеварения — Они являются результатом последовательного действия различных желудочных соков на пищу. слюна, желудочный сок, пепсин, лабфермент, слизистая оболочка желудка … Универсальный дополнительный практический толковый словарь И. Мостицкого
Явления — коллективные явления все свойства плазмы, которые проявляются за счёт коллективного движения всех частиц плазмы; характерны для бесстолкновительной плазмы. поверхностные явления явления, вызываемые избытком свободной энергии в поверхностных слоях … Термины атомной энергетики
Химические равновесия — Явления химического равновесия охватывают область неполных превращений, т. е. таких случаев, когда химическое превращение материальной системы совершается не до конца, но прекращается после того, как изменению подвергнется часть вещества. В… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Химические реакции — Этим термином называется тот процесс, во время которого взятые тела превращаются в новые, ранее не существовавшие. В русском языке мы имеем два слова для выражения этого понятия: X. взаимодействие и X. превращение. Из них нужно отдать… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
поверхностные явления — – физико химические явления, обусловленные неравномерным распределением молекул растворителя и растворенного вещества вблизи поверхности раздела фаз. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Поверхностные явления — выражение особых свойств поверхностных слоев, т. е. тонких слоев вещества на границе соприкосновения тел (сред, фаз). Эти свойства обусловлены избытком свободной энергии (См. Свободная энергия) поверхностного слоя, особенностями его… … Большая советская энциклопедия
Трупные явления — Трупные явления изменения, которым подвергаются органы и ткани трупа после наступления биологической смерти. Трупные явления подразделяются на ранние и поздние. К ранним относятся охлаждение трупа, трупные пятна, трупное окоченение,… … Википедия
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ — явления, вызываемые избытком свободной энергии в пограничном слое поверхностной энергии, повышенной активностью и ориентацией молекул поверхностного слоя, особенностями его структуры и состава. П. я. определяются также тем, что хим. и физ. вз… … Физическая энциклопедия
Элементы химические* — Громадное разнообразие явлений и веществ природы, при её изучении, мысль человеческая всегда стремилась упростить при помощи допущения если не полного единства основных Э. (Демокрит, Эпикур), то, по крайней мере, при помощи небольшого числа Э.,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Элементы (химические) — Громадное разнообразие явлений и веществ природы, при её изучении, мысль человеческая всегда стремилась упростить при помощи допущения если не полного единства основных Э. (Демокрит, Эпикур), то, по крайней мере, при помощи небольшого числа Э.,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Контактные явления — (хим.). В 1823 г. Доберейнер нашел, что губчатая платина обладает способностью вызывать соединение водорода с кислородом при обычной температуре [При обыкновенных условиях смесь кислорода с водородом может сохраняться неопределенно долго… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
химический — Викисловарь
Морфологические и синтаксические свойства[править]
| падеж | ед. ч. | мн. ч. | |||
|---|---|---|---|---|---|
| муж. р. | ср. р. | жен. р. | |||
| Им. | хими́ческий | хими́ческое | хими́ческая | хими́ческие | |
| Рд. | хими́ческого | хими́ческого | хими́ческой | хими́ческих | |
| Дт. | хими́ческому | хими́ческому | хими́ческой | хими́ческим | |
| Вн. | одуш. | хими́ческого | хими́ческое | хими́ческую | хими́ческих |
| неод. | хими́ческий | хими́ческие | |||
| Тв. | хими́ческим | хими́ческим | хими́ческой хими́ческою | хими́ческими | |
| Пр. | хими́ческом | хими́ческом | хими́ческой | хими́ческих | |
хи-ми́-чес-кий
Прилагательное, относительное, тип склонения по классификации А. Зализняка — 3a✕~.
Корень: -хим-; суффикс: -ическ; окончание: -ий [Тихонов, 1996].
Произношение[править]
- МФА: [xʲɪˈmʲit͡ɕɪskʲɪɪ̯]
Семантические свойства[править]
Значение[править]
- связанный с химией, относящийся к процессам, явлениям и закономерностям, изучаемым этой наукой ◆ Химические элементы делятся на металлы, неметаллы и переходные элементы.
- перен. неестественный (о цвете, вкусе, запахе, часто — с негативным оттенком) ◆ Лапша быстрого приготовления зачастую имеет неприятный химический привкус.
Синонимы[править]
Антонимы[править]
- нехимический
Гиперонимы[править]
Гипонимы[править]
- биохимический, газохимический, геохимический, гидрохимический, гистохимический, петрохимический, фотохимический, цитохимический
Родственные слова[править]
Этимология[править]
Происходит от существительного химия, далее от лат. chymia «химия», далее из χυμεία «химия», далее из χυμός «сок», далее из χέω «лить», далее из праиндоевр. *ghew- «лить». Русск. химия — начиная с Петра I; возможно, заимств. через польск. chimia, chimik или стар. нов.-в.-нем. Chymie (так ещё в 1800 г.). Использованы данные словаря М. Фасмера. См. Список литературы.
Фразеологизмы и устойчивые сочетания[править]
Перевод[править]
Библиография[править]
- Новые слова и значения. Словарь-справочник по материалам прессы и литературы 80-х годов / Под ред. Е. А. Левашова. — СПб. : Дмитрий Буланин, 1997.
 | Для улучшения этой статьи желательно:
|
ХИМИЧЕСКИЙ — это… Что такое ХИМИЧЕСКИЙ?
химический — химическая, химическое. 1. Прил. к химия. Химический факультет. Химическая лаборатория. Химическая специальность. Химические дисциплины. Химическая формула. 2. Прил., по знач. связанное с процессами и явлениями, присущими области химии.… … Толковый словарь Ушакова
ХИМИЧЕСКИЙ — ХИМИЧЕСКИЙ, ая, ое. 1. см. химия. 2. Относящийся к явлениям и процессам, изучаемым химией. Х. элемент. Химическая реакция. Химическое разложение. 3. Относящийся к применению методов химии и к изготовлению продуктов этими методами. Х. анализ.… … Толковый словарь Ожегова
химический — синтетический, ненатуральный Словарь русских синонимов. химический прил., кол во синонимов: 4 • микрохимический (2) • … Словарь синонимов
химический — ХИМИЧЕСКИЙ, ая, ое. Ненатуральный, вредный для здоровья, содержащий пестициды и т. п. (о продуктах). Химические помидорчики. От химия, 3 … Словарь русского арго
химический — прил., употр. сравн. часто Морфология: нар. химически 1. Химическим анализом какого либо вещества называется исследование этого вещества на предмет содержания в нём продуктов химии. Химический анализ воды, воздуха, почвы. | Химический метод… … Толковый словарь Дмитриева
химический — ▲ связанный (с) ↑ химия химический … Идеографический словарь русского языка
Химический — прил. 1. соотн. с сущ. химия I, связанный с ним 2. Свойственный химии [химия I 1., 2.], характерный для неё. 3. Относящийся к явлениям, изучаемым химией [химия I 1.]. 4. Содержащий в себе химические вещества. 5. Связанный с применением методов… … Современный толковый словарь русского языка Ефремовой
химический — химический, химическая, химическое, химические, химического, химической, химического, химических, химическому, химической, химическому, химическим, химический, химическую, химическое, химические, химического, химическую, химическое, химических,… … Формы слов
химический — хим ический … Русский орфографический словарь
химический — … Орфографический словарь русского языка
Ответы@Mail.Ru: что такое химическое явление?
ХИМИЧЕСКИЕ ЯВЛЕНИЯ — -явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества — с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит. Химические явления называют иначе химическими реакциями. например: Газовую камфорку зажигаешь — это горение (окисление с большим количеством выделяемой теплоты) . Химическое явление от других явлений отличается тем, что при этом явлении происходит превращание одних веществ в другие. ещё примеры химических явлений: 1) Производство самогона. Дрожжи и сахар бродят. В растворе образуется спирт. (Это химическое явление. ) Потом этот раствор нагревают, спирт испаряется, проходит через трубочку в бочке с водой, охлаждается и конденсируется (это физическое явление, потому что нету превращения одного вещества в другое) 2) Отбеливание. В некоторых отбеливателях присутсвует хлор, специально потому что соединения хлора, как правило имеют белый цвет. Посторонние вещества (грязь) окисляются хлором и становятся белыми. 3) Нейтрализация. В тесто, замешанное на прокисшем молоке или кифире, добавляют соду. Она вступает в реакцию с молочной кислотой. Выделяет газ, который пузырит тесто, и выпечка получается более пышная.
ХИМИЧЕСКИЕ ЯВЛЕНИЯ — -явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества — с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит. Химические явления называют иначе химическими реакциями.